Гетероциклічні сполуки
Номер патенту: 79309
Опубліковано: 11.06.2007
Автори: Каррутерс Ніколас Л., Шах Чандравадан Р., Венейбл Дженніфер Д., Едвардс Джеймс П., Джаблоновскі Джилл А., Лай Кієв С., Дворак Курт А., Грайс Черіл А., Піо Барбара А.
Формула / Реферат
1. Сполука формули (І):
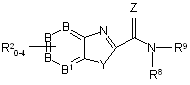 , (І)
, (І)
в якій
В та В1 являють собою С, або не більше ніж один з В та В1 може бути N;
Y являє собою О, S або NRz, де Rz являє собою Н або С1-4алкіл;
Z являє собою О або S;
R8 являє собою Н та R9 являє собою 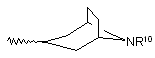 , де R10 являє собою Н або С1-4алкіл, або
, де R10 являє собою Н або С1-4алкіл, або
R8 та R9 взяті разом з N, до якого вони приєднані, утворюють радикал
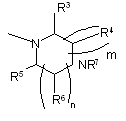 ;
;
n означає 1 або 2;
m означає 1 або 2;
n+m означає 2 або 3;
R2 являє собою, незалежно, Н, F, Сl, Вr, І, С1-4алкіл, С1-4алкокси, -С3-6циклоалкіл, -ОС3-6циклоалкіл, -ОСН2Рh, -СF3, -ОСF3, -SCF3, -ОН, -(C=O)Rk (де Rk являє собою Н, С1-4алкіл, -ОН, феніл, бензил, фенетил або С1-6алкокси), -(N-Rt)(C=O)Rk (де Rt являє собою Н або С1-4алкіл), -(N-Rt)SO2С1-4aлкiл, -(S=(O)p)-С1-4алкіл (де р означає 0, 1 або 2), нітро, -NRlRm (де Rl та Rm незалежно вибрані з Н, С1-4алкілу, фенілу, бензилу або фенетилу, або Rl та Rm взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-4алкілу), -SO2NRlRm, -(C=O)NRlRm, ціано або феніл, де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
R3 і R4 являють собою, незалежно, Н, С1-4алкіл, С3-6циклоалкіл, С1-4алкіл(С3-6циклоалкіл), ціано, -СF3, -(CO)NRpRq, -(CO)ORr, -CH2NRpRq або -CH2ORr; де Rp, Rq і Rr незалежно вибрані з Н, С1-4алкілу, С3-6циклоалкілу, фенілу, -С1-2алкіл(С3-6циклоалкілу), бензилу або фенетилу, або Rp і Rq, взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NC1-6алкілу, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
R5 і R6 являють собою, незалежно, Н або С1-6алкіл;
R7 являє собою -Ra, -RbRa, -Re-O-Ra або -Re-N(Rc)(Rd), де Ra являє собою Н, ціано, -(C=O)N(Rc)(Rd), -C(=NH)(NH2), С1-10алкіл, С2-8алкеніл, С3-8циклоалкіл, С4-7гетероциклічний радикал або феніл, де С4-7гетероциклічний радикал приєднаний до атома вуглецю і містить один з О, S, NH або NС1-4алкілу, і необов'язково додатковий NH або NC1-6алкіл в 5- або 6-, або 7-членних кільцях, де Rb являє собою С1-8алкілен або С2-8алкенілен, де Re являє собою С2-8алкілен або С2-8алкенілен, де Rc і Rd являють собою кожний незалежно Н, С1-4алкіл, С2-4алкеніл, С3-6циклоалкіл або феніл, або Rc і Rd взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NC1-6алкілу, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
альтернативно, R7 може бути взятий разом з суміжним R4, а також з атомами вуглецю та азоту, до яких вони приєднані, утворюючи 5-, 6- або 7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-6алкілу, та необов'язково і незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
та її енантіомери, діастереомери та фармацевтично прийнятні солі та ефіри,
за наступних умов:
що R6 ,суміжній з N, повинен бути Н, в тих випадках, коли R4, суміжній з N, є відмінним від Н, та
що R2 не може бути бензоїлом, коли один з R4 та R6 являє собою метил та інший являє собою водень.
2. Сполука за пунктом 1, в якій В та В1 являють собою С, або В1 може бути N.
3. Сполука за пунктом 1, в якій В та В1 являють собою С.
4. Сполука за пунктом 1, в якій Y являє собою NH.
5. Сполука за пунктом 1, в якій Z являє собою О.
6. Сполука за пунктом 1, в якій R10 являє собою Н або метил.
7. Сполука за пунктом 1, в якій n означає 1 та m означає 1.
8. Сполука за пунктом 1, в якій R2 є , незалежно, вибраним з групи, яка містить Н, -F, -Сl, -Вr, -І, -СН3, -СН2СН3, -ОСН3, -ОСН2СН3, -ОСН(СН3)2, циклопропіл, циклобутил, циклопентил, циклогексил, -Оциклопентил, -Оциклогексил, -СF3, -ОСF3, -SCFs, -С(O)СН3, -С(O)СН2СН3, -ОН, -СООН, -С(O)феніл, -С(O)бензил, -СООСН3, -СООСН2СН3, -NHСОСН3, -NCН3СОСН3, -NHSO2CH3, -NCH3SO2CH3, -SOСН3, -SО2СН3, -NO2, -NH2, -NHCH3, -N(CH3)2, -N(CH2CH3)2, -піролідин-1-іл, -імідазолідин-1-іл, -піразолідин-1-іл, -піперидин-1-іл, -піперазин-1-іл, -морфолін-4-іл, -тіоморфолін-4-іл, -SO2NH2, -SO2NHCH3, -SO2N(СН3)2, -SO2N(CH2CH3)2, -SO2піролідин-1-іл, -SO2імідазолідин-1-іл, -SO2піразолідин-1-іл, -SO2піперидин-1-іл, -SО2піперазин-1-іл, -SO2морфолін-4-іл, -SO2тіоморфолін-4-іл, -C(О)NH2, -C(О)N(CH3)2, -C(О)NH(CH3), -C(О)N(CH2CH3)2, -С(О)піролідин-1-іл, -С(О)імідазолідин-1-іл, С(О)піразолідин-1-іл, -С(О)піперидин-1-іл, -С(О)піперазин-1-іл, С(О)морфолін-4-іл, -С(О)тіоморфолін-4-іл, -CN та феніл.
9. Сполука за пунктом 1, в якій R2 є, незалежно, вибраний з групи, яка містить водень, метил, трифторметил, метокси, трифторметокси, нітро, хлоро, фторо та бензоїл.
10. Сполука за пунктом 1, в якій один або два R2 не є воднем.
11. Сполука за пунктом 1, в якій R3 та R4 є, незалежно, вибраними з групи, яка містить
a) Н,
b) -СН3, -СН2СН3, -СН2СН3СН3, -СН(СН3)2, н-бутил, ізо-бутил, трет-бутил,
c) циклопропіл, циклопентил, циклогексил, -СН2циклопропіл, -СН2циклопентил, -СН2циклогексил, -СН2Оциклопропіл, -СН2Оциклопентил, -СН2Оциклогексил,
d) ціано,
e) трифторметил,
f) -(C=О)NH2, -(С=О)NHС1-4алкіл, -(С=О)N(С1-4алкіл)2, -(С=О)NНфеніл, -(С=О)піролідин-1-іл, -(С=О)імідазолідин-1-іл, -(С=O)піразолідин-1-іл, (С=О)піперидин-1-іл, -(С=О)піперазин-1-іл, -(C=O)морфолін-4-іл, (С=О)тіоморфолін-4-іл,
g) -COOH, -СООСН3, -СООСН2СН3, -СООфеніл, -СООбензил,
h) -CH2NH2, -CH2NHС1-4алкіл, -СН2N(С1-4алкіл)2, -СН2NНфеніл, -CH2NHбензил, -СН2піролідин-1-іл, -СН2імідазолідин-1-іл, -СН2піразолідин-1-іл, -СН2піперидин-1-іл, -СН2піперазин-1-іл, -СН2морфолін-4-іл, СН2тіоморфолін-4-іл,
і) -СН2OН, -СН2СН2OН, -СН2СН2СН2OН, -СН2OСН3, -СН2OСН2СН3, -СН2OСН2СН2СН3, -СН2OСН(СН3)2, -СН2O-н-бутил, -СН2О-ізо-бутил, -СН2O-трет-бутил, -СН2Офеніл, -СН2Oбензил та -СН2OСН2циклопропіл.
12. Сполука за пунктом 1, в якій R3 та R4 являють собою, незалежно, Н або -СН3.
13. Сполука за пунктом 1, в якій R5 та R6 є, незалежно, вибраними з групи, що складається з Н та метилу.
14. Сполука за пунктом 1, в якій R5 та R6 являють собою Н.
15. Сполука за пунктом 1, в якій R7 вибраний з групи, що складається з
a) Н, -СН2СН2OН, -СН2СН2СН2ОН,
b) ціано,
c) -(C=O)NH2, -(С=О)NHС1-4алкіл, -(C=O)N(С1-4алкіл)2, -(С=O)NНфеніл, -(С=О)піролідин-1-іл, -(С=О)імідазолідин-1-іл, -(С=О)піразолідин-1-іл, -(С=О)піперидин-1-іл, -(С=О)піперазин-1-іл, -(С=О)морфолін-4-іл, -(С=О)тіоморфолін-4-іл, -CH2(C=O)NH2, -СН2(С=О)NНС1-4алкіл, -СН2(С=О)N(С1-4алкіл)2, -СН2(СО)NНфеніл, -СН2(С=О)піролідин-1-іл), -СН2(С=О)імідазолідин-1-іл, -СН2(С=О)піразолідин-1-іл, -СН2(С=О)піперидин-1-іл, -СН2(С=О)піперазин-1-іл, -СН2(С=О)морфолін-4-іл,
-СН2(С=О)тіоморфолін-4-іл, -СН2СН2O(С=О)NН2,
-СН2СН2O(С=О)NНС1-4алкіл, -СН2СН2O(С=О)N(С1-4алкіл)2,
-CH2CH2O(C=О)NHфeнiл, -СН2CH2O(С=О)піролідин-1-іл,
-СH2CH2O(С=О)імідазолідин-1-іл, -СН2CH2O(С=O)піразолідин-1-іл,
-СН2CH2O(С=O)піперидин-1-іл, -СН2CH2O(С=О)піперазин-1-іл,
-СН2CH2O(С=О)морфолін-4-іл, -СН2CH2O(С=О)тіоморфолін-4-іл,
d) -C(=NH)(NH2), -CH2C(=NH)(NH2),
e) -СН3, -СН2СН3, -СН2СН2СН3, -СН(СН3)2, н-бутил, ізо-бутил, трет-бутил, -СН2CH2OСН3, -СН2CH2OСН2СН3, -СН2CH2OСН2СН2СН3, -СН2CH2OСН(СН3)2, -СН2CH2OН-бутил, -СН2CH2O-ізо-бутил, -СН2CH2O-трет-бутил,
f) -СН-СН2, -СН2СН=СН2,
g) циклопропіл, циклопентил, циклогексил, -СН2циклопропіл, -СН2циклопентил, -СН2циклогексил, -СН2CH2Oциклопропіл,
-СН2CH2Oциклопентил, -СН2CH2Oциклогексил,
h) піролідиніл, імідазолідиніл, піразолідиніл, піперидиніл, піперазиніл, морфолініл, тіоморфолініл, -СН2піролідиніл, -СН2імідазолідиніл, -СН2піразолідиніл, -СН2піперидиніл, -СН2піперазиніл, -СН2морфолініл, -СН2тіоморфолініл,
і) -CH2CH2NH2, -CH2CH2NHС1-4алкіл, -СH2СH2N(С1-4алкіл)2, -CH2CH2NHфeнiл, -СН2СН2піролідин-1-іл, -СН2СН2імідазолідин-1-іл, -СН2СН2піразолідин-1-іл, -СН2СН2піперидин-1-іл, -СН2СН2піперазин-1-іл, -СН2СН2морфолін-4-іл, -СН2СН2тіоморфолін-4-іл,
j) феніл, бензил, фенетил та бензилоксиметил.
16. Сполука за пунктом 1, в якій R7 вибраний з групи, що складається з Н, -СН3 та -СН2СН3.
17. Сполука за пунктом 1, в якій R7, взятий разом з суміжним R4, а також з атомами вуглецю та азоту, до яких вони приєднані, являє собою піролідин-1,2-іл, імідазолідин-1,2-іл, імідазолідин-1,5-іл, піразолідин-1,5-іл, піперидин-1,2-іл, піперазин-1,2-іл, морфолін-4,5-іл та тіоморфолін-4,5-іл.
18. Сполука за пунктом 1, в якій R7, взятий разом з сусіднім R4, а також з атомами вуглецю та азоту, до яких вони приєднані, являє собою піролідин-1,2-іл та піперидин-1,2-іл.
19. Сполука за пунктом 1, вибрана з групи, яка містить:
1)
(1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
2)
(1Н-бензоімідазол-2-іл)-(4-етилпіперазин-1-іл)-метанон;
3)
(1Н-бензоімідазол-2-іл)-(3-метилпіперазин-1-іл)-метанон;
4)
(1Н-бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон;
5)
(8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 1Н-бензоімідазол-2-карбонової кислоти;
6)
(5-хлоро-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
7)
(5-хлоро-1Н-бензоімідазол-2-іл)-піперазин-1-ілметанон;
8)
(5-хлоро-1Н-бензоімідазол-2-іл)-(3-метилпіперазин-1-іл)-метанон;
9)
(5,6-дифтор-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
10)
(5,6-дифтор-1Н-бензоімідазол-2-іл)-(4-етилпіперазин-1-іл)-метанон;
11)
(5,6-дифтор-1Н-бензоімідазол-2-іл)-(3-метилпіперазин-1-іл)-метанон;
12)
(5,6-дифтор-1H-бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон;
13)
(8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5,6-дифтор-1H-бензоімідазол-2-карбонової кислоти;
14)
(6-хлоро-5-фтор-1H-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
15)
(6-хлоро-5-фтор-1H-бензоімідазол-2-іл)-піперазин-1-ілметанон;
16)
(6-хлоро-5-фтор-1H-бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон;
17)
(8-метил-8-азабіцикло[3.2.1]окт-3-ил)-амід 6-хлоро-5-фтор-1Н-бензоімідазол-2-карбонової кислоти;
18)
(5-хлоро-6-метил-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
19)
(5-хлоро-6-метил-1Н-бензоімідазол-2-іл)-піперазин-1-ілметанон;
20)
(4-метил-1Н-бензоімідазол-2-іл)-(3-метилпіперазин-1-іл)-метанон;
21)
(4-етилпіперазин-1-іл)-(4-метил-1Н-бензоімідазол-2-іл)-метанон;
22)
(4-метил-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
23)
(4-метил-1Н-бензоімідазол-2-іл)-піперазин-1-ілметанон;
24)
(8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 4-метил-1Н-бензоімідазол-2-карбонової кислоти;
25)
(8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5-метил-1Н-бензоімідазол-2-карбонової кислоти;
26)
(5-метил-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
27)
(4-метилпіперазин-1-іл)-(5-трифторметил-1H-бензоімідазол-2-іл)-метанон;
28)
піперазин-1-іл-(5-трифторметил-1Н-бензоімідазол-2-іл)-метанон;
29)
(5-фтор-1H-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
30)
(4-етилпіперазин-1-іл)-(5-фтор-1Н-бензоімідазол-2-іл)-метанон;
31)
(5-фтор-1Н-бензоімідазол-2-іл)-піперазин-1-ілметанон;
32)
(5-фтор-1Н-бензоімідазол-2-іл)-(3-метилпіперазин-1-іл)-метанон;
33)
(8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5-фтор-1H-бензоімідазол-2-карбонової кислоти;
34)
(3H-імідазо[4,5-b]піридин-2-іл)-(4-метилпіперазин-1-іл)-метанон;
35)
бензооксазол-2-іл-(4-метилпіперазин-1-іл)-метанон;
36)
(7-метилбензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
37)
(5-метилбензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
38)
(4-метилбензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
39)
бензотіазол-2-іл-(4-метилпіперазин-1-іл)-метанон;
40)
(5-бензоїл-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
41)
(4-хлоро-1H-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
42)
(4-метилпіперазин-1-іл)-(4-нітро-1H-бензоімідазол-2-іл)-метанон;
43)
(4-аміно-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
44)
(4-ізопропіламіно-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон та
45)
С-(5-хлоро-1Н-бензоімідазол-2-іл)-С-(4-метилпіперазин-1-іл)-метиленамін.
20. Сполука за пунктом 1, вибрана з групи, яка містить:
46)
(4,6-дифтор-1H-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
47)
(4-метилпіперазин-1-іл)-(5-нітро-1Н-бензоімідазол-2-іл)-метанон;
48)
(5-фтор-4-метил-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон та
49)
(5-бром-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон.
21. Сполука за пунктом 1, вибрана з групи, яка містить:
50)
(5,6-дихлоро-1H-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
51)
(4,5-диметил-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
52)
(5,6-диметил-1H-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
53)
(5-метокси-1Н-бензоімідазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
54)
(5-хлоробензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
55)
(5-фторбензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
56)
(6-фторбензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
57)
(5,7-дифторбензооксазол-2-іл)-(4-метилпіперазин-1-іл)-метанон;
58)
(4-метилпіперазин-1-іл)-(5-трифторметокси-бензооксазол-2-іл)-метанон;
59)
(5-хлоробензотіазол-2-іл)-(4-метилпіперазин-1-іл)-метанон та
60)
(4-метилпіперазин-1-іл)-(5-трифторметил-бензотіазол-2-іл)-метанон.
22. Фармацевтична композиція, що містить сполуку формули (І):
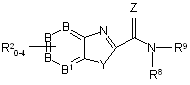 , (I)
, (I)
в якій В та В1 являють собою С, або не більше ніж один з В та В1 може бути N;
Y являє собою О, S або NRz, де Rz являє собою Н або С1-4алкіл;
Z являє собою О або S;
R8 являє собою Н та R9 являє собою  , де R10 являє собою Н або С1-4алкіл, або
, де R10 являє собою Н або С1-4алкіл, або
R8 та R9 взяті разом з N, до якого вони приєднані, утворюють радикал
 ;
;
n означає 1 або 2;
m означає 1 або 2;
n+m означає 2 або 3;
R2 являє собою, незалежно, Н, F, Сl, Вr, І, С1-4алкіл, С1-4алкокси, -С3-6циклоалкіл, -C3-6циклоалкіл, -OCH2Ph, -СF3, -ОСF3, -SСF3, -ОН, -(C=O)Rk (де Rk являє собою Н, С1-4алкіл, -ОН, феніл, бензил, фенетил або С1-6алкокси), -(N-Rt)(С=О)Rk (де Rt являє собою Н або С1-4алкіл), -(N-Rt)SO2С1-4aлкiл, -(S=(O)p)-С1-4алкіл (де р означає 0, 1 або 2), нітро, -NRlRm (де Rl та Rm незалежно вибрані з Н, С1-4алкілу, фенілу, бензилу або фенетилу, або Rl та Rm взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-4алкілу), -SO2NRlRm, -(C=O)NRlRm, ціано або феніл, де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
R3 і R4 являють собою, незалежно, Н, С1-4алкіл, С3-6циклоалкіл, С1-4алкіл(С3-6циклоалкіл), ціано, -СF3, -(CO)NRpRq, -(CO)ORr, -CH2NRpRq або -CH2ORr; де Rp, Rq і Rr незалежно вибрані з Н, С1-4алкілу, С3-6циклоалкілу, фенілу, -С1-2алкіл(С3-6циклоалкілу), бензилу або фенетилу, або Rp і Rq, взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NC1-6алкілу, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
R5 і R6 являють собою, незалежно, Н або С1-6алкіл;
R7 являє собою -Ra, -RbRa, -Re-O-Ra або -Re-N(Rc)(Rd), де Ra являє собою Н, ціано, -(C=O)N(Rc)(Rd), -C(=NH)(NH2), С1-10алкіл, С2-8алкеніл, С3-8циклоалкіл, С4-7гетероциклічний радикал або феніл, де С4-7гетероциклічний радикал приєднаний до атома вуглецю і містить один з О, S, NH або NС1-4алкілу, і необов'язково додатковий NH або NC1-6алкіл в 5- або 6-, або 7-членних кільцях, де Rb являє собою С1-8алкілен або С2-8алкенілен, де Re являє собою С2-8алкілен або С2-8алкенілен, де Rc і Rd являють собою кожний незалежно Н, С1-4алкіл, С2-4алкеніл, С3-6циклоалкіл або феніл, або Rc і Rd взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NC1-6алкілу, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
альтернативно, R7 може бути взятий разом з суміжнім R4, а також з атомами вуглецю та азоту, до яких вони приєднані, утворюючи 5-, 6- або 7-членне гетероциклічне кільце з 0 або 1 додатковими гетероатомами, вибраними з О, S, NH або NС1-6алкілу, та необов'язково і незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
та її енантіомери, діастереомери та фармацевтично прийнятні солі та ефіри,
за наступних умов:
що R6, суміжний з N, повинен бути Н, в тих випадках, коли R4, суміжній з N, є іншим ніж Н, та
що R2 не може бути бензоїлом, коли один з R4 та R6 являє собою метил та інший являє собою водень.
23. Спосіб лікування або попередження Н4-опосередкованих розладів та станів, в якому пацієнту, який потребує такого лікування або попередження, вводять фармацевтичну композицію, яка містить ефективну кількість сполуки формули (І):
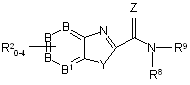 , (І)
, (І)
в якій В та В1 являють собою С, або один з В та В1 може бути N;
Y являє собою О, S або NR2, де R2 являє собою Н або С1-4алкіл;
Z являє собою О або S;
R8 являє собою Н та R9 являє собою  , де R10 являє собою Н або С1-4алкіл, або
, де R10 являє собою Н або С1-4алкіл, або
R8 та R9 ,взяті разом з N, до якого вони приєднані, утворюють радикал
 ;
;
n означає 1 або 2;
m означає 1 або 2;
n+m означає 2 або 3;
R2 являє собою, незалежно, Н, F, Сl, Вr, І, С1-4алкіл, С1-4алкокси, -С3-6циклоалкіл, -ОС3-6циклоалкіл, -ОСН2Рh, -СF3, -ОСF3, -SCF3, -ОН, -(C=O)Rk (де Rk являє собою Н, С1-4алкіл, -ОН, феніл, бензил, фенетил або С1-6алкокси), -(N-Rt)(C=O)Rk (де Rt являє собою Н або С1-4алкіл), -(N-Rt)SO2С1-4aлкiл, -(S=(O)p)-С1-4алкіл (де р означає 0, 1 або 2), нітро, -NRlRm (де Rl та Rm незалежно вибрані з Н, С1-4алкілу, фенілу, бензилу або фенетилу, або Rl та Rm взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7 членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-4алкілу), -SO2NRlRm, -(C=O)NRlRm, ціано або феніл, де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
R3 і R4 являють собою, незалежно, Н, С1-4алкіл, С3-6циклоалкіл, С1-4алкіл(С3-6циклоалкіл), ціано, -СF3, -(CO)NRpRq, -(CO)ORr, -CH2NRpRq або -CH2ORr; де Rp, Rq і Rr незалежно вибрані з Н, С1-4алкілу, С3-6циклоалкілу, фенілу, -С1-2алкіл(С3-6циклоалкілу), бензилу або фенетилу, або Rp і Rq, взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7 членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NC1-6алкілу, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
R5 і R6 являють собою, незалежно, Н або С1-6алкіл;
R7 являє собою -Ra, -RbRa, -Re-O-Ra або -Re-N(Rc)(Rd), де Ra являє собою Н, ціано, -(C=O)N(Rc)(Rd), -C(=NH)(NH2), С1-10алкіл, С2-8алкеніл, С3-8циклоалкіл, С4-7гетероциклічний радикал або феніл, де С4-7гетероциклічний радикал приєднаний до атома вуглецю і містить один з О, S, NH або NС1-4алкілу, і необов'язково додатковий NH або NC1-6алкіл в 5- або 6-, або 7-членних кільцях, де Rb являє собою С1-8алкілен або С2-8алкенілен, де Re являє собою С2-8алкілен або С2-8алкенілен, де Rc і Rd являють собою кожний незалежно Н, С1-4алкіл, С2-4алкеніл, С3-6циклоалкіл або феніл, або Rc і Rd взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NC1-6алкілу, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
альтернативно, R7 може бути взятий разом з суміжним R4, а також з атомами вуглецю та азоту, до яких вони приєднані, утворюючи 5-, 6- або 7-членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-6алкілу, та необов'язково і незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси;
та її енантіомери, діастереомери та фармацевтично прийнятні солі та ефіри,
за наступних умов:
що R6, сусідній з N, повинен бути Н, в тих випадках, коли R4, сусідній з N, є іншим ніж Н, та
що R2 не може бути бензоїлом, коли один з R4 та R6 являє собою метил та інший являє собою водень.
24. Спосіб за пунктом 23, в якому Н4-опосередкований розлад або стан, вибраний з групи, що містить запальні розлади, астму, псоріаз, ревматоїдний артрит, виразковий коліт, хворобу Крона, запальну кишкову хворобу, розсіяний склероз, алергічні розлади, алергічний риніт, дерматологічні розлади, аутоімунну хворобу, лімфатичні розлади, атеросклероз та імунодефіцитні розлади.
25. Спосіб за пунктом 23, в якому Н4-опосередкований розлад або стан, вибраний з групи, що містить рак або сверблячку шкіри, і в якому сполуку вводять як ліки та як засіб, що підсилює дію препарату.
Текст
Винахід відноситься до нових, фармацевтично активних, конденсованих гетероциклічних сполук та способів їх використання для лікування або попередження розладів та станів, опосередкованих Н4 рецептором гістаміну. Вперше гістамін ідентифікували як гормон [G. Barger та Н.Н. Dale, J. Physiol. (London) 1910, 41:19-59], та з того часу було продемонстровано, що він відіграє головну роль в різноманітних фізіологічних процесах, включаючи запальну "потрійну реакцію" за допомогою Н1 рецепторів [A.S.F. Ash та Н.О. Schild, Br. J. Pharmac. Chemother. 1966, 27:427-439], секрецію шлункової кислоти за допомогою Н2 рецепторів [J.W. Black та інші, Nature 1972, 236:385-390] та нейротрансмітерне вивільнення в центральній нервовій системі за допомогою Н3 рецепторів [J.-M. Arrang та інші, Nature 1983, 302:832-837] [для огляду див. S.J. Hill та інші, Pharmacol. Rev. 1997, 49(3):253-278]. Було продемонстровано, що всі три підтипи рецептора гістаміну є членами надсімейства G протеїн-зв'язуючих рецепторів [І. Gantz та інші, Proc. Natl. Acad. Sci. U.S.A. 1991, 88:429-433; T.W. Lovenberg та інші, МоI. Pharmacol. 1999, 55(6): 1101-1107; Μ. Yamashita та інші, Proc. Natl. Acad. Sci. U.S.A. 1991, 88:11515-11519]. Проте, існують додаткові функції гістаміну, що були описані, для яких не було визначено рецептор. Наприклад, в 1994 Raible та інші продемонстрували, що гістамін та R-aметилгістамін міг би активувати мобілізацію кальцію в людських еозинофілах [D.G. Raible та інші, Am. J. Respir. Crit. Care Med. 1994,149:1506-1511]. Ці реакції були блоковані за допомогою антагоніста тіопераміду Н3-рецептора. Проте, R-a-метилгістамін був значно менш ефективним, ніж гістамін, який був несумісний з залученням відомих підтипів Н3 рецептора. Таким чином, Raible та інші припустили існування нового рецептора гістаміну на еозинофілах, що був не-Н1, не-Н2 та не-Н3. Зовсім недавно декількома групами [Т. Oda та інші, J. Вiol. Chem. 2000, 275(47):36781-36786; С. Liu та інші, Моl. Pharmacol. 2001, 59(3):420-426; Т. Nguyen та інші, Моl. Pharmacol. 2001, 59(3):427-433; Y. Zhu та інші, Моl. Pharmacol. 2001, 59(3):434-441; K.L. Morse та інші, J. Pharmacol. Exp. Ther. 2001, 296(3): 1058-1066] було визначено та охарактеризовано четвертий підтип рецептора гістаміну, Н4 рецептор. Цей рецептор є 390 амінокислотним, семимембранним, G протеїн-зв'язуючим рецептором з приблизно 40% гомологією до Н3 рецептора гістаміну. На відміну від Н3 рецептора, який в основному розташований в мозку, Н4 рецептор виражений на більших рівнях в нейрофілах та мастоцитах, серед інших клітин, як описано Morse та інші. [див. вище]. Події, які викликають запальну реакцію, включають фізичне подразнення (включаючи травму), хімічне подразнення, інфекцію та вторгнення інородного тіла. Запальна реакція характеризується болем, підвищеною температурою, почервонінням, опуханням, зниженням діяльності або їх комбінацією. Багато станів, таких як алергії, астма, хронічна обструктивна легенева хвороба (COPD), атеросклероз, та аутоімунні хвороби, включаючи ревматоїдний артрит та вовчак, характеризуються надмірним або тривалим запаленням. Інгібування поповнення лейкоцитів може забезпечити істотне терапевтичне значення. Запальні розлади або розлади чи стани, опосередковані запаленням, включають, але не обмежуються, гостре запалення, алергічне запалення, та хронічне запалення. Дегрануляція мастоцитів (екзоцитоз) приводить до запальної реакції, яка спочатку може бути охарактеризована за допомогою гістамін-модульованого пухиря та запальної реакції. Широка різноманітність імунологічних (наприклад, алергени або антитіла) та неімунологічних (наприклад, хімічні) стимулів може викликати активацію, поповнення та дегрануляцію мастоцитів. Активація мастоцитів ініціює алергічні (Н]) запальні реакції, які, в свою чергу, викликають поповнення інших клітин-ефекторів, які надалі сприяють запальній реакції. Н2 рецептори гістаміну модулюють секрецію шлункової кислоти, та Н3 рецептори гістаміну уражають вивільнення нейротрансмітеру в центральній нервовій системі. Приклади посібників на тему запалення включають [J.I. Gallin та R. Snyderman, Inflammation: Basic Principles та Clinical Correlates, 3-я редакція, (Lippincott Williams & Wilkins, Philadelphia, 1999); V. Stvrtinova, J. Jakubovsky та I. Hulmi "Inflammation та Fever", Pathophysiology Principles of Diseases (Textbook for Medical Students, Academic Press, 1995); Cecil та інші, Textbook Of Medicine. 18-а редакція (W.B. Saunders Company, 1988); та Steadmans Medical Dictionary]. Винахід відноситься до сполук формули (І): в якій В та В1 являють собою С, або один з В та В1 може бути N; Υ являє собою О, S або ΝΗ; Ζ являє собою О, S або NRz, де Rz являє собою Η або С1-4алкіл; R8 являє собою Η та R9 являє собою , де R10 являє собою Η або С1-4алкіл, або 8 9 R та R взяті разом з Ν, до якого вони приєднані, утворюють радикал n означає 1 або 2; m означає 1 або 2; n+m означає 2 або 3; R2 являє собою, незалежно, Н, F, СІ, Вr, І, С1-4алкіл, С1-4алкокси, -С3-6циклоалкіл, -ОС3-6циклоалкіл, OCH2Ph, -CF3, -OCF3, -SCF3, -OH, -(C=O)Rk (де Rk являє собою Η, С1-4алкіл, -ОН, феніл, бензил, фенетил або С1-6алкокси), -(Ν-Rt)(C=O)Rk (де Rt являє собою Η або С1-4алкіл), -(N-Rt)SO2 С1-4алкіл, -(S=(O)p)-С1-4алкіл (де p означає 0, 1 або 2), нітро, -NRlRm (де Rl та Rm незалежно вибрані з Н, С1-4алкілу, фенілу, бензилу або фенетилу, або Rl та Rm взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7 членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-4алкіл), -SO2NRRm, -(C=O)NRIRm, ціано або феніл, де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-3алкокси; R3 і R4 являють собою, незалежно, Н, С1-4алкіл, С3-6циклоалкіл, С1-4алкіл(С3-6циклоалкіл), ціано, -CF3, (CO)NRpRq, -(CO)ORr, -CH2NRpRq або -CH2ORr; де Rp, Rq і Rr незалежно вибрані з Н, С1-4алкілу, С3p q 6циклоалкілу, фенілу, -С1-2алкіл(С3-6циклоалкіл), бензилу або фенетилу, або R і R взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7 членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-6алкіл, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С1Залкілу, галогену, гідрокси, аміно та С1-Залкокси; R5 і R являють собою, незалежно, Η або С1-6алкіл; R7 являє собою -Ra, -RbRa, -Re-O-Ra або -Re-N(Rc)(Rd), де Ra являє собою Η, ціано, -(C=O)N(Rc)(Rd), C(=NH)(NH2 ), С1-10алкіл, С2-8алкеніл, С3-8циклоалкіл, С4-7гетероциклічний радикал або феніл, де С47гетероциклічний радикал приєднаний до атому вуглецю і містить один з О, S, NH або NС1-4алкіл, і необов'язково додатковий NH або NС1-6алкіл в 5- або 6-, або 7-членних кільцях, де R являє собою С1e c d 8алкілен або С2-8алкенілен, де R являє собою С2-8алкілен або С2-8алкенілен, де R і R являють собою кожний незалежно Н, С1-4алкіл, С2-4алкеніл, С3-6циклоалкіл або феніл, або Rc і Rd взяті разом з атомом азоту, до якого вони приєднані, утворюють 4-7 членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-6алкіл, і де будь-який вищезгаданий фенільний або алкільний, або циклоалкільний компонент необов'язково та незалежно заміщений 1-3 замісниками, вибраними з С13алкілу, галогену, гідрокси, аміно та С1-3алкокси; альтернативно, R7 може бути взятий разом з сусіднім R4, а також з атомами вуглецю та азоту, до яких вони приєднані, утворюючи 5, 6 або 7 членне гетероциклічне кільце з 0 або 1 додатковим гетероатомом, вибраним з О, S, NH або NС1-6алкіл, та необов'язково і незалежно заміщений 1-3 замісниками, вибраними з С1-3алкілу, галогену, гідрокси, аміно та С1-Залкокси; та їх енантіомери, діастереомери та фармацевтично прийнятні солі та ефіри, за наступних умов: що R6 ,сусідній з N, повинен бути Н, в тих випадках, коли R4 ,сусідній з N ,є іншим, ніж Н, та що R2 не може бути бензоїлом, коли один з R4 та R6 являє собою метил та інший являє собою водень. Винахід також відноситься до фармацевтичних композицій, що містять такі сполуки, та до способів використання таких композицій для лікування або попередження Н4-осередкованих розладів та станів, особливо тих, де бажано протидіяти Н4 рецептору. Переважно, В та В1 являють собою С, або В1 може бути N. Більш переважно, В та В1 являють собою С. Переважно, Υ являє собою ΝΗ. Переважно, Ζ являє собою О. Переважно, R1 являє собою Η або метил. Переважно, n означає 1 та m означає 1. Переважно, R2 є незалежно, вибраним з групи, яка містить Н, -F, -СІ, -Вr, -І, -СН3, -СН2СН3, -ОСН3, ОСН2СН3, -ОСН(СН3)2, циклопропіл, циклобутил, циклопентил, циклогексил, -Оциклопентил, -Оциклогексил, -CF3, -OCF3, -SCF3, -С(О)СН3, -С(О)СН2СН3, -ОН, -СООН, -С(О)феніл, -С(О)бензил, -СООСН3, -СООСН2СН3, -NHCOCH3, -NCH3COCH3, -NHSO2CH3, -NCH3SO2CH3, -SOCH3, -SO2CH3, -NO2, -NH2, -NHCH3, -N(CH3 )2, N(CH2CH3)2, -піролідин-1-іл, -імідазолідин-1-іл, -піразолідин-1-іл, -піперидин-1-іл, -піперазин-1-іл, -морфолін4-іл, -тіоморфолін-4-іл, -SO2NH2, -SO2NHCH3, -SO2N(CH3)2, -SO2N(CH2CH3 )2, -SО2піролідин-1-іл, SО2імідазолідин-1-іл, -SО2 піразолідин-1-іл, -SО2піперидин-1-іл, -SО2піперазин-1-іл, -SО2морфолін-4-іл, SО2тіоморфолін-4-іл, -C(O)NH2, -C(O)N(CH3)2, -C(O)NH(CH3), -C(O)N(CH2CH3)2 , -С(О)піролідин-1-іл, С(О)імідазолідин-1-іл, -С(О)піразолідин-1-іл, -С(О)піперидин-1-іл, -С(О)піперазин-1-іл, -С(О)морфолін-4-іл, С(О)тіоморфолін-4-іл, -CN та феніл. Більш переважно, R2 є, незалежно, вибраний з групи, яка містить водень, метил, трифторметил, метокси, трифторметокси, нітро, хлоро, фторо та бензоїл. Надалі, найбільш переважно вважають, що один або два R2 не є воднем. Переважно, R3 та R4 є незалежно вибраними з групи, яка містить а) Н, b) -СН3, -СН2СН3, -СН2СН2СН3, -СН(СН3)2, н-бутил, ізо-бутил, трет-бутил, c) циклопропіл, циклопентил, циклогексил, -СН2циклопропіл, СН2циклопентил, -СН2циклогексил, СН2Оциклопропіл, -СН2Оциклопентил, -СН2Оциклогексил d) ціано, e) трифторметил, f) -(C=O)NH2, -(С )NНС1-4 алкіл, -(С N(С1-4алкіл)2, -(С )NHфеніл, -(С=O)піролідин-1-іл, = О = О = О (С=О)імідазолідин-1-іл, -(С=О)піразолідин-1-іл, -(С=O)піперидин-1-іл, -(С=O)піперазин-1-іл, -(С=О)морфолін4-іл, (С=O)тіоморфолін-4-іл g) -СООН, -СООСН3, -СООСН2СН3, -СООфеніл, -СООбензил, h) -CH2 NH2 , -СН2 NНС1-4алкіл, -СН2 N(С1-4алкіл)2, -СН2 NНфеніл, -СН2NНбензил, -СН2 піролідин-1-іл, СН2імідазолідин-1-іл, -СН2 піразолідин-1-іл, -СН2 піперидин-1-іл, -СН2 піперазин-1-іл, -СН2морфолін-4-іл, СН2тіоморфолін-4-іл, і) -СН2ОН, -СН2СН2ОН, -СН2СН2СН2ОН, -СН2ОСН3, -СН2ОСН2СН3, -СН2ОСН2СН2СН3, -СН2ОСН(СН3)2, СН2О-н-бутил, -СН2О-ізо-бутил, -СН2О-трет-бутил, -СН2Офеніл, -СН2Обензил та -СН2ОСН2циклопропіл. Переважно, R3 та R4 являють собою, незалежно, Η або -СН3. Переважно, R5 та R6 є, незалежно, вибраними з групи, що складається з Η та метилу. Більш переважно, R5 та R6 являють собою Н. Переважно, R7 вибраний з групи, що складається з a) Н, -СН2СН2ОН, -СН2СН2СН2ОН, b) ціано, c) -(C=O)NH2, -(С )NHС1-4алкіл, -(С )N(С1-4алкіл)2, -(С )NНфеніл, -(С )піролідин -1-іл, = О = О = О = О (С=О)імідазолідин -1-іл, -(С=О)піразолідин -1-іл, (С=О)піперидин -1-іл, -(С=О)піперазин -1-іл, -(С=О)морфолін 4-іл, (С)тіоморфолін = О -4-іл, -CH2(C=O)NH2 , -СН2(С О)NНС1-4алкіл, = СН2= О)N(С1-4алкіл)2 , (С СН2(С=О )NНфеніл, -СН2(С=О)піролідин -1-іл), -СН2 (С=О)імідазолідин -1-іл, -СН2(С=О)піразолідин -1-іл, СН2(С=О)піперидин -1-іл, -СН2(С=О)піперазин -1-іл, -СН2(С=О)морфолін -4-іл, СН2(С=О)тіоморфолін -4-іл, CH2CH2O(C=O)NH2, -CH2CH2O(C=O)NHС1-4алкіл, -СН2СН2О(С= О)N(С1-4алкіл)2, -СН2СН2О(С=О )NНфеніл, СН2СН2О(С = О)піролідин -1-іл, -СН2СН2О(С = О)імідазолідин -1-іл, -СН2СН2О(С = О)піразолідин -1-іл, СН2СН2О(С О)піперидин-1-іл, = -СН2СН2О(С О)піперазин-1-іл, = -СН2СН2О(С О)морфолін-4-іл, = СН2СН2О(С О)тіоморфолін-4-іл, = d) -C(=NH)(NH2), -CH2C(=NH)(NH2), e) -CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, н-бутил, ізо-бутил, трет-бутил, -СН2СН2ОСН3, СН2СН2ОСН2СН3, -СН2СН2ОСН2СН2СН3, -СН2СН2ОСН(СН3)2, -СН2СН2О-н-бутил, -СН2СН2О-ізо-бутил, СН2СН2О-трет-бутил, f) -СН=СН2, -СН2СН=СН2, g) циклопропіл, циклопентил, циклогексил, -СН2циклопропіл, -СН2циклопентил, -СН2циклогексил, СН2СН2Оциклопропіл, СН2СН2Оциклопентил, -СН2СН2Оциклогексил, h) піролідиніл, імідазолідиніл, піразолідиніл, піперидиніл, піперазиніл, морфолініл, тіоморфолініл, СН2піролідиніл, -СН2імідазолідиніл, СН2 піразолідиніл, -СН2 піперидиніл, -СН2 піперазиніл, -СН2морфолініл, СН2тіоморфолініл, і) -CH2CH2 NH2, -СН2СН2 NНС1-4алкіл, -СН2СН2N(С1-4алкіл)2, -СН2СН2NНфеніл, -СН2СН2 піролідин-1-іл, СН2СН2імідазолідин-1-іл, СН2СН2 піразолідин-1-іл, -СН2СН2 піперидин-1-іл, -СН2СН2 піперазин-1-іл, СН2СН2морфолін-4-іл, -СН2СН2 тіоморфолін-4-іл, j) феніл, бензил, фенетил та бензилоксиметил. Більш переважно, R7 вибраний з групи, що складається з Н, -СН3 та -СН2СН3. Переважно R7 взятий разом з сусіднім R4, а також з атомами вуглецю та азоту, до яких вони приєднані, являє собою піролідин-1,2-іл, імідазолідин-1,2-іл, імідазолідин-1,5-іл, піразолідин-1,5-іл, піперидин-1,2-іл, піперазин-1,2-іл, морфолін-4,5-іл та тіоморфолін-4,5-іл. Переважно R7 взятий разом з сусіднім R4, а також з атомами вуглецю та азоту, до яких вони приєднані, являє собою піролідин-1,2-іл та піперидин-1,2-іл. Термін "їх фармацевтично прийнятні солі та ефіри" відноситься до тих форм солі та ефіру сполук за даним винаходом, які були б очевидними хіміку-фармацевту, тобто, ті, які є нетоксичними та які сприятливо впливали б на фармакокінетичні властивості згаданих сполук за даним винаходом. Ті сполуки, які мають позитивні фармакокінетичні властивості, були б очевидними хіміку-фармацевту, тобто, ті, які є нетоксичними та які мають такі фармакокінетичні властивості, щоб забезпечити достатню смакову привабливість, абсорбцію, розповсюдження, метаболізм та виділення. Інші чинники, більш практичні по природі, які також важливі при виборі, являють собою витрати сировини, простоту кристалізації, вихід, стабільність, гігроскопічність та плинність одержаних масових ліків. Крім того, прийнятні солі карбоксилатів включають натрій, калій, кальцій та магній. Приклади прийнятних катіонних солей включають солі бромистоводневої кислоти, йодистоводневої кислоти, соляної кислоти, перхлорної кислоти, сірчаної кислоти, малеїнової кислоти, фумарової кислоти, яблуневої кислоти, винної кислоти, лимонної кислоти, бензойної кислоти, мигдалевої кислоти, метансульфонової кислоти, гідроетансульфонової кислоти, бензолсульфонової кислоти, щавлевої кислоти, памоїнової кислоти, 2-нафталінсульфонової кислоти, ртолуолсульфонової кислоти, циклогексансульфамінової кислоти та сахарної кислоти. Приклади прийнятних ефірів включають такі ефіри, де один або більше карбоксильних замісників замінені на рметоксибензилоксикарбоніл, 2,4,6-триметилбензилоксикарбоніл, 9-антрилоксикарбоніл, CH3SCH2COO-, тетрагідрофур-2-илоксикарбоніл, тетрагідропіран-2-ілоксикарбоніл, фур-2-илоксикарбоніл, бензоїлметоксикарбоніл, р-нітробензилоксикарбоніл, 4-піридилметоксикарбоніл, 2,2,2трихлоретоксикарбоніл, 2,2,2-трибромоетоксикарбоніл, трет-бутилоксикарбоніл, трет-амілоксикарбоніл, дифенілметоксикарбоніл, трифенілметоксикарбоніл, адамантилоксикарбоніл, 2бензилоксифенілоксикарбоніл, 4-метилтіофенілоксикарбоніл, або тетрагідропіран-2-ілоксикарбоніл. Умови базуються на нездатності знайти активність, принаймні, однієї сполуки, відповідаючи специфікаціям кожної умови. Переважні сполуки Формули І, були одержані, як описано в Прикладах 1-45 та Схемах 1-4, та вибрані з групи, яка містить: Прикл. 1 2 3 4 5 6 7 8 Сполука (1Н-Бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (1Н-Бензоімідазол-2-іл)-(4-етил-піперазин-1-іл)-метанон; (1Н-Бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон; (1Н-Бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон; (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 1Н-бензоімідазол-2-карбонової кислоти; (5-Хлоро-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5-Хлоро-1Н-бензоімідазол-2-іл)-піперазин-1-іл-метанон; (5-Хлоро-1Н-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон; 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 (5,6-Дифтор-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5,6-Дифтор- 1Н-бензоімідазол-2-іл)-(4-еthуі-піперазин-1-іл)-метанон; (5,6-Дифтор-1Н-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон; (5,6-Дифтор-1Н-бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон; (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5,6-дифтор-1Н-бензоімідазол-2-карбонової кислоти; (6-Хлоро-5-фтор-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (6-Хлоро-5-фтор-1Н-бензоімідазол-2-іл)-піперазин-1-іл-метанон; (6-Хлоро-5-фтор-1Н-бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон; (8-метил-8-азабіцикло[3.2.1]окт-3-ил)-амід 6-хлоро-5-фтор-1Н-бензоімідазол-2-карбонової кислоти; (5-Хлоро-6-метил-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5-Хлоро-6-метил-1Н-бензоімідазол-2-іл)-піперазин-1-іл-метанон; (4-Метил-1Н-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон; (4-Етил-піперазин-1-іл)-(4-метил-1Н-бензоімідазол-2-іл)-метанон; (4-Метил-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Метил-1Н-бензоімідазол-2-іл)-піперазин-1-іл-метанон; (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 4-метил-1Н-бензоімідазол-2-карбонової кислоти; (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5-метил-1Н-бензоімідазол-2-карбонової кислоти; (5-Метил-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Метил-піперазин-1-іл)-(5-трифторметил-1Н-бензоімідазол-2-іл)-метанон; Піперазин-1-іл-(5-трифторметил-1Н-бензоімідазол-2-іл)-метанон; (5-Фтор-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Етил-піперазин-1-іл)-(5-фтор-1Н-бензоімідазол-2-іл)-метанон; (5-Фтор-1Н-бензоімідазол-2-іл)-піперазин-1-іл-метанон; (5-Фтор-1Н-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон; (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5-фтор-1Н-бензоімідазол-2-карбонової кислоти; (3Н-Імідазо[4,5-b]піридин-2-іл)-(4-метил-піперазин-1-іл)-метанон; Бензооксазол-2-іл-(4-метил-піперазин-1-іл)-метанон; (7-Метил-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5-Метил-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Метил-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; Бензотіазол-2-іл-(4-метил-піперазин-1-іл)-метанон; (5-Бензоїл-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Хлоро-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Метил-піперазин-1-іл)-(4-нітро-1Н-бензоімідазол-2-іл)-метанон; (4-Аміно-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Ізопропіламіно-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; та С-(5-Хлоро-1H-бензоімідазол-2-іл)-С-(4-метил-піперазин-1-іл)-метиленамін Додаткові переважні сполуки Формули І були одержані відповідно до способів синтезу, які наведені на Схемах 1-3, та вибрані з групи, яка містить: Прикл. 46 47 48 49 Сполука (4,6-Дифтор-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Метил-піперазин-1-іл)-(5-нітро-1Н-бензоімідазол-2-іл)-метанон; (5-Фтор-4-метил-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; та (5-Бром-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон Інші переважні сполуки Формули І були одержані відповідно до способів синтезу, які наведені на Схемах 1-3, та вибрані з групи, яка містить: Прикл. 50 51 52 53 54 55 56 57 58 59 60 Сполука (5,6-Дихлоро-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4,5-Диметил-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5,6-Диметил-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5-Метокси-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5-Хлоро-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5-Фтор-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (6-Фтор-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (5,7-Дифтор-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; (4-Метил-піперазин-1-іл)-(5-трифторметокси-бензооксазол-2-іл)-метанон; (5-Хлоро-бензотіазол-2-іл)-(4-метил-піперазин-1-іл)-метанон; та (4-Метил-піперазин-1-іл)-(5-трифторметил-бензотіазол-2-іл)-метанон Наступні терміни визначено нижче та при їх використанні в описі винаходу. Термін "алкіл" включає вуглеводні з лінійним або розгалуженим ланцюгом з, принаймні, одним видаленим воднем для утворення радикальної групи. Алкільні групи включають метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, 1-метилпропіл, пентил, ізопентил, втор-пентил, гексил, гептил, октил і так далі. Алкіл не включає циклоалкіл. Термін "алкеніл" включає вуглеводневі радикали з лінійним або розгалуженим ланцюгом, як вказано вище, з, принаймні, одним вуглець-вуглець подвійним зв'язком (sp2). Алкеніли включають етеніл (або вініл), проп-1-еніл, проп-2-еніл (аліл), ізопропеніл (або 1-метилвініл), бут-1-еніл, бут-2-еніл, бутадієніли, пентеніли, гекса-2,4-дієніл і так далі. Алкеніл не включає циклоалкеніл. Термін "алкокси" включає алкільну групу з лінійним або розгалуженим ланцюгом з кінцевим киснем, що зв'язує алкільну групу з залишком молекули. Алкокси включає метокси, етокси, пропокси, ізопропокси, бутокси, трет-бутокси, пентокси і так далі. Терміни "аміноалкіл", "тіоалкіл" та "сульфонілалкіл" є аналогічними алкокси,в яких кінцевий атом кисню алкокси замінено на, відповідно, NH (або NR), S, та SO2. Термін "циклоалкіл" включає циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил і так далі. Термін "галоген" включає фтор, хлор, бром та йод, та, переважно, фтор або хлор. Терміни "пацієнт" або "суб'єкт" включають ссавців, таких як людина та тварини (собаки, коти, коні, щури, кролики, миші, нелюдиноподібні примати), які потребують обстеження, експерименту, лікування або попередження у зв'язку з релевантними хворобою або станом. Переважно, пацієнтом є людина. Термін "композиція" включає продукт, який містить визначені інгредієнти у визначених кількостях, а також і будь-який продукт, що одержують безпосередньо або опосередковано з комбінації визначених інгредієнтів у визначених кількостях. Сполуки, описані вище, може бути одержані відповідно до способів, які відомі з рівня техніки та/або які описані в схемах та прикладах, які наведено далі. Щоб отримати різні сполуки за даним винаходом, як вихідні речовини можуть бути використані ті, які мають в основі бажані замісники, хоча схема реакції з або без захисту є прийнятною. Альтернативно, може бути необхідно використання, в місці основи бажаного замісника, прийнятної групи, яка може бути збережена до кінця схеми реакції та замінена, як прийнятна, бажаним замісником. Посилаючись на Схему 1, описано наступні посилання та доповнення. Вихідні речовини та HNR8R9 комерційно доступні або їх синтези є відомими з рівня техніки. Посилаючись на Схему 2, описано наступні посилання та доповнення. Вихідні речовини та HNR8R9 комерційно доступні або їх синтези є відомими з рівня техніки. Вихідні речовини конденсують, щоб одержати бензимідазол А2. Атоми хлору бензимідазолу А2 заміняють конденсацією з вторинним аміном з супутнім гідролізом, що приводить до утворення сполуки В2. Високі виходи сполуки В2 можуть бути одержані в тих випадках, коли використовують слабку водну основу в реакціях конденсації та гідролізу. Прийнятними слабкими водними основами є 2N K2СО3, 2N NaHCO3, 0,1N NaOH, тощо. Посилаючись на Схему 3, описано наступні посилання та доповнення. Вихідні речовини та HNR8R9 комерційно доступні або їх синтези є відомими з рівня техніки. Посилаючись на Схему 4, описано наступні посилання та доповнення. Вихідні речовини конденсують, щоб одержати бензимідазол А2. Атоми хлору бензимідазолу А2 заміняють конденсацією з вторинним аміном з супутнім амінолізом з первинним аміном, щоб одержати сполуку В2. Для високих виходів сполуки В2 вторинний амін необхідно додаватися перед первинним аміном. Експресія Н4 рецептора в імунних клітинах, включаючи деякі лейкоцити та мастоцити, визначає його, як важливий об'єкт для терапевтичного втручання в ряді імунологічних та запальних розладів (таких як алергічне, хронічне або гостре запалення). Особливо очікують, що ліганди Н4 рецептора будуть корисними для лікування або запобігання різним хворобливим станам ссавців. Таким чином, відповідно до даного винаходу розкриті сполуки, які є антагоністами Н4 рецептора, та композиції є корисними для поліпшення симптомів, пов'язаних з лікуванням та запобіганням наступним станам та хворобам: запальні розлади, астма, псоріаз, ревматоїдний артрит, виразковий коліт, хвороба Крона, запальна кишкова хвороба, розсіяний склероз, алергічні розлади, алергічний риніт, дерматологічні розлади, аутоімунна хвороба, лімфатичні розлади, атеросклероз та імонодефіцитні розлади. Описані сполуки можуть бути також корисними як допоміжні засоби в хіміотерапії або при лікуванні сверблячки шкіри. Аспекти винаходу включають (а) фармацевтичну композицію, що містить сполуку формули (І) або одну або більше переважних сполук, як описано в даній заявці, та фармацевтично прийнятний носій; (b) упаковані ліки, що включають (1) фармацевтичну композицію, що містить сполуку формули (І) та фармацевтично прийнятний носій, та (2) інструкцію для введення згаданої композиції для лікування або запобігання Н4 -опосередкованої хвороби або стану. Винахід також включає спосіб лікування Н4-опосередкованого стану у пацієнта, згаданим способом, який включає введення пацієнту фармацевтично ефективної кількості композиції, яка містить сполуку формули (І) та інші описані або переважні сполуки. Наприклад, винахід включає спосіб лікування Н4опосередкованого стану у пацієнта, згаданим способом, який включає введення пацієнту фармацевтично ефективної H4-протидіючої кількості композиції, яка містить сполуку формули (І). Вплив антагоніста може також бути викликаний зворотним агоністом. Зворотний агонізм описує властивість сполуки активно закривати рецептор, що проявляє конститутивну активність. Конститутивна активність може бути визначена в клітинах, які були примушені до над-експресії людського Н4-рецептора. Конститутивна активність може бути виміряна за допомогою дослідження сАМР рівнів або за допомогою вимірювання репортерного гену, чутливого до сАМР рівнів, після обробки сАМР-стимулюючим агентом, таким як форсколін. Клітини, що над-експресують Н4 рецептори, будуть проявляти більш низькі сАМР рівні після обробки форсколіном, ніж не-експресуючі клітини. Сполуки, які поводяться, як Н4 агоністи, будуть, залежно від дози, знижувати форсколін-стимулюючі сАМР рівні в Н4 -експресуючих клітинах. Сполуки, які поводяться, як зворотні Н4 агоністи, будуть, залежно від дози, стимулювати сАМР рівні в Н4-експресуючих клітинах. Сполуки, які поводяться, як Н4 антагоністи, будуть блокувати або Н4 агоніст-викликане інгібування сАМР, або зворотне Н4 агоніст-викликане зростання в сАМР. Подальші втілення винаходу включають описані сполуки, що є інгібіторами функції Н4 рецептора гістаміну у ссавців, інгібіторами запалення або запальної реакції in vivo або in vitro, модуляторами експресії протеїну Н4 рецептора гістаміну у ссавців, інгібіторами активації поліморфно-ядерних лейкоцитів in vivo або in vitro, або комбінації вище згаданого, та відповідні способи лікування, профілактики та діагностики, що включають використання описаних сполук. Кваліфікований фахівець в даній області техніки зможе визначити, відповідно до відомих способів, прийнятне дозування для пацієнта, беручи до уваги чинники, такі як вік, вага, загальний стан здоров'я, тип симптомів, що потребують лікування, та наявність інших медикаментозних лікувань. Загалом, ефективна кількість буде між 0,01 та 1000мг/кг на день, переважно між 0,5 та 300мг/кг ваги тіла, та щоденні дозування будуть між 10 та 5000мг для дорослого суб'єкта нормальної ваги. Капсули, таблетки або інші склади (такі як рідини та таблетки з плівковим покриттям) можуть бути між 0,5 та 200мг, як наприклад 1, 3, 5, 10, 15, 25, 35, 50мг, 60мг та 100мг та можуть бути введені відповідно до розкритих способів. Форми одиничного дозування включають таблетки, капсули, пілюлі, порошки, грануляти, водні та неводні оральні розчини і суспензії та парентеральні розчини, упаковані в контейнери, що пристосовані для послідовного розділення на індивідуальні дози. Форми одиничного дозування можуть також бути адаптовані для різних способів введення, включаючи композиції контрольованого вивільнення, такі як підшкірні імплантанти. Способи введення включають оральні, ректальні, парентеральні (внутрішньовенні, внутрішньом'язові, підшкірні), внутрішньопорожнинні, внутрішньовагінальні, внутрішньочеревні, внутрішньоміхурні, місцеві (краплі, порошки, мазі, гелі або крем) та шляхом інгаляції (букальні або назальні спреї). Парентеральні склади включають фармацевтично прийнятні водні або неводні розчини, дисперсії, суспензії, емульсії та стерильні порошки для їх приготування. Приклади носіїв включають воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь), рослинні масла та органічні ефіри, прийнятні для ін'єкцій, такі як етил олеат. Текучість може бути підтримана за допомогою використання покриття, такого як лецитин, поверхнево-активна речовина, або підтримуючи відповідний розмір частинок. Носії для твердих форм дозування включають (а) заповнювачі або наповнювачі, (b) зв'язуючі речовини, (с) зволожувачі, (d) агенти дезинтеграції, (e) уповільнювачі розчинення, (f) каталізатори абсорбції, (g) адсорбенти, (h) змащуючі речовини, (і) буферизуючі агенти та о) пропеленти. Композиції можуть також містити допоміжні засоби, такі як консервуючі, зволожуючі, емульгуючі та диспергуючі агенти; антимікробні агенти, такі як парабени, хлорбутанол, фенол та сорбінова кислота; ізотонічні агенти, такі як цукор або хлорид натрію; абсорбуючі агенти тривалої дії, такі як моностеарат алюмінію та желатин; та агенти, що покращують абсорбцію. Приклади Загальний Експеримент: Спектри ЯМР були отримані або на Bruker модель DPX400 (400МГц), або на DPX500 (500МГц) спектрометрі. Дані 1H ЯМР наведено у такому форматі: хімічний зсув в м.ч. відносно області тетраметилсилану (мультиплетність, коефіцієнт зв'язку J в Гц, інтеграція). Масові спектри були отримані на Agilent серій 1100 MSD, використовуючи електророзпилювальну іонізацію (ESI) або в позитивному, або в негативному стані, як вказано. "Розрахована маса" для молекулярної формули - це моноізотопічна маса сполуки. Обернено-фазова ВЕРХ Час утримання обернено-фазовою ВЕРХ визначений в хвилинах, використовуючи спосіб, описаний нижче. Прилад: Gilson215 Мобільна Фаза: Ацетонітрил (0,05% трифтороцтової кислоти, ТРА)/вода (0,05% TFA) Швидкість потоку: 25мл/хв Градієнт: 1) 0,0хв 2% Ацетонітрил, 0,05% TFA 2) 18,0хв 98% Ацетонітрил, 0,05% TFA Колонка: YMC ODS-A (5мкл, 30´150mm) Температура: 25°С Довжина хвилі: Подвійне виявлення при 254 та 220нм. Нормально-фазова силікагелева колоночна хроматографія Нормально-фазову колоночну хроматографію виконували, використовуючи ISCO Foxy 200 або ISCO ОРТІХ 10Х системи, що використовують одну з наступних комерційно доступних попередньо укомплектованих колонок: Biotage 40S (SiO2 40г), Biotage або ISCO Redisep (SiO2, 10г, 12г, 35г, 40г або 120г). Приклад 1 (1H-Бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Загальна методика 1: А. 2-Трихлорметил-1H-бензоімідазол. Метил 2,2,2-трихлороацетимідат (1,63мл, 9,22ммоль) додавали до розчину фенілендіаміну (1,0г, 9,2ммоль) в оцтовій кислоті (30мл), який потім перемішували при кімнатній температурі протягом 1 години. До суміші додавали воду (20мл), та збирали отриманий в результаті осад. Тверду фазу промивали водою (2´30мл) та сушили під вакуумом, одержуючи 1,90г (88%) 2-трихлорометил-1H-бензоімідазолу, який використовували без подальшого очищення. MS (ESI): маса, розрахована для C8H5CI 3N2, 233,95; m/z знайдено, 235,0 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 13,45 (ушир, s, 1Н), 7,73-7,65 (m, 2H), 7,39-7,30 (m, 2H). Загальна методика 2: В. (1H-Бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. До суспензії 2-трихлорометил-1H-бензоімідазолу (100мг, 0,42ммоль) в 3:1 ацетонітрил/вода (4,0мл) додавали N-метилпіперазин (0,93мл, 0,84ммоль), потім додавали 4Μ K2СО3 (0,30мл). Реакційну суміш перемішували протягом 24 годин та потім розбавляли насиченим водн. NaHCO3 (3мл) і екстрагували дихлорметаном (3´5мл). Об'єднані екстракти сушили (Na2SO4) та потім концентрували при зниженому тиску. Неочищений продукт очищали на силікагелі (10г; 4 % метанол/дихлорметан), одержуючи 54мг (52%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H16N4O, 244,13; m/z знайдено 245,2 [М+Н]+. 1H ЯМР (400МГц, DMSO-d6): 13,2 (s, 1Н), 7,74 (d, J=7,3Гц, 2H), 7,53 (d, J=8,3Гц, 2H), 7,34-7,24 (m, 2H), 4,45-4,42 (m, 2H), 3,71 (t, J=5,2Гц, 2H), 2,42-2,40 (m, 4H), 2,22 (s, 3H). 13C ЯМР (400МГц, DMSO-d6): 158,1, 145,5, 142,3, 133,2, 124,1, 122,4, 120,1, 112,2, 55,0, 54,4, 46,0, 45,5, 42,3. Альтернативне одержання прикладу 1 (схема 1) А. Бензимідазол-2-карбонова кислота. 2-Гідроксиметилбензимідазол (6,75ммоль) додавали до колби, що містить гарячу воду (25мл). Розчин 2N Na2CO3 (5мл) додавали до реакційної суміші, поки не досягали рН 10-12, потім додавали KМnО4 (~10ммоль). Потім реакційній суміші дозволяли кипіти зі зворотним холодильником протягом 0,5 годин. Гарячий розчин відфільтровували та фільтрат охолоджували до кімнатної температури та додавали 3N оцтову кислоту, поки не досягали рН 3-4. Одержаний білий осад збирали фільтруванням та промивали водою і ефіром, одержуючи зазначену у заголовку проміжну сполуку. MS (ESI): маса, розрахована для C8H6N2O2, 162,04; m/z знайдено, 163,10 [М+Н]+. 1H ЯМР (400МГц, CD3OD): 7,61-7,55 (m, 2H), 7,44-7,38 (m, 2H). В. (1H-Бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Діізопропілетиламін (2,2ммоль) додавали до розчину бензимідазол-2-карбонової кислоти (3,59ммоль), О-(7-азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронід гексафторофосфату (HATU, 3,00ммоль), 1-гідрокси7-азабензотриазолу (HOAT, 3,00ммоль) та 1-метилпіперазину (2,00ммоль) в DMF (0,5m). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Видаляли розчинник та залишок розчиняли в EtOAc. Розчин промивали 1N НСl, насиченим водн. NaHCO3 та сольовим розчином. Потім сушили (Na2SO4), відфільтровували та концентрували, отримуючи неочищений продукт у вигляді в'язкого масла, яке очищали на силікагелі (40г; 3-10% метанол (2Μ NH3)/дихлорметан), одержуючи зазначену у заголовку сполуку (1,68ммоль, 47%). Елементний аналіз: розраховано для C13H16N4O, С 63,91, Η 6,60, Ν 22,93; знайдено С 63,76, Η 6,79, Ν 22,87. Дані MS та 1H ЯМР відповідають зразку, отриманому вище. Приклад 2 (1H-Бензоімідазол-2-іл)-(4-етил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-1Hбензоімідазол (Приклад 1, 100мг, 0,42ммоль) та Ν-етилпіперазин (0,10мл, 0,84ммоль). Очищенням одержували 16мг (15%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H18N4O, 258,15; m/z знайдено, 259,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,60 (ушир, s, 1Н), 7,82 (d, J=8,0Гц, 1H), 7,54 (d, J=8,0Гц, 1H), 7,35-7,30 (m, 2H), 4,82-4,80 (m, 2H), 3,97-3,95 (m, 2H), 2,63-2,59 (m, 4H), 2,48 (q, J=7,2Гц, 2Н), 1,14 (t, J=7,2Гц, 3Н). Приклад 3 (1H-Бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-1Hбензоімідазол (Приклад 1, 100мг, 0,42ммоль) та 2-метилпіперазин (84мг, 0,84ммоль). Очищенням одержували 55мг (54%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H16N4O, 244,13; m/z знайдено, 245,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3) суміш ротамерів: 12,1 (ушир, s, 1Н), 7,80-7,52 (m, 2Н), 7,33-7,31 (m, 2Н), 6,02 (d, J=12,9Гц, 0,5 Η), 5,93 (d, J=12,9Гц, 0,5 Η), 4,78-4,73 (m, 1Η), 3,44-3,37 (m, 0,5H), 3,21-2,88 (m, 4H), 2,67-2,62 (m, 0,5H), 1,18 (t, J=6,8Гц, 3Н). Приклад 4 (1H-Бензоімідазол-2-іл)-(4-метил-[1,4] діазепан-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-1Hбензоімідазол (Приклад 1, 100мг, 0,42ммоль) та N-метилгомопіперазин (96мг, 0,84ммоль). Очищенням одержували 25мг (23%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H18N4O, 258,15; m/z знайдено, 259,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,66-7,64 (m, 2Н), 7,32-7,30 (m, 2Н), 4,72-4,69 (m, 1Н), 4,63 (t, J=6,3Гц, 1Н), 3,99-3,97 (m, 1Н), 3,94 (t, J=6,3Гц, 1H), 2,90-2,87 (m, 1H), 2,83-2,81 (m, 1H), 2,67-2,63 (m, 2H), 2,41 (d, J=3,5Гц, 3H), 2,13-2,10 (m, 2H). Приклад 5 (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 1H-бензоімідазол-2-карбонової кислоти. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-1Hбензоімідазол (Приклад 1, 100мг, 0,42ммоль) та 8-метил-8-азабіцикло[3.2.1]окт-3-иламін дигідрохлорид (172мг, 0,84ммоль) в тетрагідрофурані (ТГФ, 3мл). Очищенням одержували 10мг (10%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C16H20N4O, 284,16; m/z знайдено, 285,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,70 (ушир, s, 1Н), 8,10 (d, J=8,0Гц, 1H), 7,76 (ушир, s, 1H), 7,43 (ушир, s, 1H), 7,35-7,33 (m, 2H), 4,37 (q, J=7,1Гц, 1H), 3,25-3,23 (m, 2H), 2,49 (s, 3H), 2,39-2,33 (m, 2H), 2,23 (s, 3H), 2,23-2,18 (m, 2H), 2,02-1,96 (m, 2H), 1,97 (d, J=14,4Гц, 2Н). Приклад 6 (5-Хлоро-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи комерційно доступні 5-хлоро-2трихлорометил-1H-бензоімідазол (100мг, 0,37ммоль) та N-метилпіперазин (0,08мл, 0,75ммоль). Очищенням одержували 65мг (63%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15CIN4O, 278,09; m/z знайдено, 279,2 [М+Н]+. 1H ЯМР (400МГц, DMSO-d6): 13,29 (s, 1Н), 7,67 (ушир, s, 2H), 7,33 (d, J=8,6Гц, 2H), 4,51-4,48 (m, 2H), 3,71 (t, J=4,6Гц, 2H), 2,41-2,39 (m, 4H), 2,22 (s, 3H). Альтернативне одержання прикладу 6 (схема 1) A. (5-Хлоро-1H-бензоімідазол-2-іл)-метанол. Суміш 3-хлоро-бензол-1,2-діаміну (5,68г) в 4N НСI (40мл) обробляли гліколевою кислотою (7мл, 70% розчин у воді) та кип'ятили зі зворотним холодильником протягом 2 годин. Суміш охолоджували та відфільтровували. Потім фільтрат нейтралізували концентрованим ΝΗ4ΟΗ, та одержану тверду фазу збирали фільтруванням та сушили під вакуумом, одержуючи зазначену у заголовку проміжну сполуку (6,59г). Цю речовину використовували на стадії В без подальшого очищення. B. 5-Хлоро-1H-бензоімідазол-2-карбонова кислота. Суміш (5-хлоро-1H-бензоімідазол-2-іл)-метанол (3,8г), суспендований в 2N карбонаті натрію (110мл) обробляли розчином KМnО4 (4,935г в 310мл води). Одержану суміш нагрівали до 100°С протягом 2 годин та потім відфільтровували. Фільтрат охолоджували до кімнатної температури та розчин скоректовували до кислого рН додаванням 3N оцтової кислоти, одержуючи осад. Тверду фазу відокремлювали фільтруванням, промивали водою та сушили під вакуумом, одержуючи зазначену у заголовку проміжну сполуку (2,910г). Цю речовину використовували на стадії С без подальшого очищення. C. (5-Хлоро-1Н-бензоімідазол-2-vО-(4-метил-піперазин-1-іл)-метанон. 5-хлоро-1H-бензоімідазол-2-карбонову кислоту (0,197г) в DMF (3мл) обробляли 1,1'-карбонілдіімідазол (GDI; 0,163г) при кімнатній температурі та суміш перемішували протягом 1 години. Одержану суміш обробляли N-метилпіперазином (0,111мл) та перемішували при кімнатній температурі протягом 16 годин. Потім цю суміш розбавляли водою (50мл) та екстрагували дихлорметаном (3´20мл). Об'єднані екстракти промивали сольовим розчином і сушили (Na2SO4), та потім концентрували при зниженому тиску. Залишок очищали на силікагелі (10г; 0-5% метанол (2Μ МН3)/дихлорметан), одержуючи зазначену у заголовку сполуку у вигляді білої твердої фази (0,160г). Дані MS та 1H ЯМР відповідають одержаній вище сполуці. Приклад 7 (5-Хлоро-1H-бензоімідазол-2-іл)-піперазин-1-іл-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи комерційно доступні 5-хлоро-2трихлорометил-1H-бензоімідазол (100мг, 0,37ммоль) та піперазин (64мг, 0,75ммоль) в ТГФ (3мл). Очищенням одержували 10мг (10%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для С12Н13СIN4А 264,08; m/z знайдено, 265,2 [М+Н]+. 1 H ЯМР (400МГц, DMSO-d6): 13,29 (s, 1Н), 7,67 (ушир, s, 2H), 7,33 (d, J=8,6Гц, 2H), 4,50-4,47 (m, 2H), 3,71 (t, J=4,6Гц, 2H), 2,41-2,39 (m, 4H), 2,22 (s, 3Н). Приклад 8 (5-Хлоро-1H-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи комерційно доступні 5-хлоро-2трихлорометил-1H-бензоімідазол (100мг, 0,37ммоль) та 2-метилпіперазин (74мг, 0,74ммоль). Очищенням одержували 41мг (40%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15CIN4O, 278,09; m/z знайдено, 279,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3) суміш ротамерів: 7,61-7,52 (ушир, m, 2Н), 7,27 (d, J=8,8Гц, 2Н), 6,00 (d, J=12,6Гц, 0,5 Η), 5,89 (d, J=12,6Гц, 0.5 Η), 4,75-4,71 (m, 1Н), 3,19-3,16 (m, 0,5H), 3,21-2,88 (m, 4H), 2,68-2,65 (m, 0,5H), 1,21-1,17 (m, 3H). Приклад 9 (5,6-Дифтор-1Н-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. A. 5,6-Дифтор-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 4,5-дифтор-1,2-фенілендіамін (1,00г, 6,94ммоль). Висушений осад розтирали в порошок з дихлорметаном (3´10мл) з подальшим використанням гексану (3´10мл), одержуючи 890мг (48%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для С8Н3СI 3F2N2 269,93; m/z знайдено, 271,0 [М+Н]+. 1 H ЯМР (400МГц, CDCI 3): 10,0 (s, 1Н), 7,65 (dd, J=10,0, 7,3, 1H), 7,32 (dd,J=9,8, 6,3, 1H). B. (5,6-Дифтор-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5,6-дифтор-2-трихлорометил1Н-бензоімідазол (100мг, 0,37ммоль) та N-метилпіперазин (0,08мл, 0,75ммоль). Очищенням одержували 42мг (40%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H14F2N4O, 280,11; m/z знайдено, 281,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,9 (ушир, s, 1Н), 7,56-7,31 (ушир, m, 2Н), 4,78-4,75 (m, 2Н), 3,95 (t, J=5,1Гц, 2Н), 2,58 (t, J=5,1Гц, 4Н), 2,37 (s, 3Н). Приклад 10 (5,6-Дифтор-1H-бензоімідазол-2-іл)-(4-етил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5,6-дифтор-2-трихлорометил1H-бензоімідазол (Приклад 9, Стадія А, 100мг, 0,39ммоль) та N-етилпіперазин (0,10мл, 0,79ммоль). Очищенням одержували 31мг (28%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H16F2N4O, 294,13; m/z знайдено, 295,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,70 (ушир, s, 1H), 7,61 (ушир, s, 1Н), 7,31 (ушир, s, 1H), 4,78-4,76 (m, 2H), 3,96-3,92 (m, 2Н), 2,64-2,62 (m, 4Н), 2,49 (q, J=7,2Гц, 2Н), 1,15 (t, J=7,2Гц, 3Н). Приклад 11 (5,6-Дифтор-1H-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5,6-дифтор-2-трихлорометил1H-бензоімідазол (Приклад 9, Стадія А, 100мг, 0,37ммоль) та 2-метилпіперазин (74мг, 0,37ммоль). Очищенням одержували 30мг (28%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H14F2N4O, 280,11; m/z знайдено, 281,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3) суміш ротамерів: 11,6 (ушир, s, 1Η), 7,35-7,27 (ушир, m, 2H), 5,99 (d, J=12,6Гц, 0,5Η), 5,88 (d, J=12,6Гц, 0,5Н), 4,69-4,66 (m, 1Н), 3,19-3,16 (m, 0,5H), 3,04-2,67 (m, 4H), 2,67-2,63 (m, 0,5H), 1,20-1,18 (m, 3H). Приклад 12 (5,6-Дифтор-1H-бензоімідазол-2-іл)-(4-метил-[1,4]діазепан-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5,6-дифтор-2-трихлорометил1H-бензоімідазол (Приклад 9, Стадія А, 100мг, 0,37ммоль), та N-метилгомопіперазин (84мг, 0,74ммоль). Очищенням одержували 29мг (27%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H16F2N4O, 294,13; m/z знайдено, 295,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,12 (ушир, s, 1Н), 7,47-7,40 (ушир, m, 2H), 3,92-3,89 (m, 1Н), 3,87 (t, J=6,0Гц, 1H), 3,99-3,97 (m, 1H), 3,94 (t, J=6,3Гц, 1Н), 2,90-2,87 (m, 1H), 2,83-2,81 (m, 1H), 2,67-2,63 (m, 2H), 2,41 (d, J=3,5Гц, 3Н), 2,13-2,10 (m, 2H). Приклад 13 (8-метил-8-аза-біцикло[3.2.1]окт-3-ил)-амід 5,6-дифтор-1H-бензоімідазол-2-карбонової кислоти. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5,6-дифтор-2-трихлорометил1H-бензоімідазол (Приклад 9, Стадія А, 100мг, 0,37ммоль) та 8-метил-8-аза-біцикло[3.2.1]окт-3-иламін дигідрохлорид (157мг, 0,74ммоль). Очищенням одержували 25мг (21%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C16H18F2N4O 320,14; m/z знайдено, 321,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 8,04 (d, J=8Гц, 1Н), 7,41 (ушир, s, 2H), 4,37-4,32 (m, 1H), 3,25 (s, 2H), 2,40-2,34 (m, 5H), 2,26-2,22 (m, 2H), 1,97-1,95 (m, 2H), 1,88-1,85 (d, J=12,0Гц, 2Н). Приклад 14 (6-Хлоро-5-фтор-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. A. 6-Хлоро-5-фтор-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 4-фтор-5-хлоро-1,2фенілендіамін (1,00г, 6,25ммоль). Висушений осад розтирали в порошок з дихлорметаном (3´10мл) з подальшим використанням гексану (3´10мл), одержуючи 1,09г (59%) 6-хлоро-5-фтор-2-трихлорометил-1Нбензоімідазолу. MS (ESI): маса, розрахована для C8H3CI 4FN2, 285,90; m/z знайдено, 287,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 10,2 (ушир, s, 1Н), 7,57 (d, J=5,6, 1Н), 7,31 (d, J=9,0, 1H). B. (6-Хлоро-5-фтор-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл) метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 6-хлоро-5-фтор-2трихлорометил-1H-бензоімідазол (100мг, 0,35ммоль) та N-метилпіперазин (0,08мл, 0,70ммоль). Очищенням одержували 58мг (56%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H14CIFN4O, 296,08; m/z знайдено, 297,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,71-7,69 (ушир, s, 1H), 7,39-7,37 (ушир, s, 2H), 4,65-4,63 (m, 2H), 3,87 (t, J=4,5Гц, 2Н), 2,59-2,57 (m, 4Н), 2,37 (s, 3Н). Приклад 15 (6-Хлоро-5-фтор-1H-бензоімідазол-2-іл)-піперазин-1-іл-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 6-хлоро-5-фтортрихлорометил-1H-бензоімідазол (Приклад 14, Стадія А, 100мг, 0,35ммоль) та піперазин (59мг, 0,70ммоль). Очищенням одержували 10мг (10%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C12H12CIFN4O, 282,07; m/z знайдено, 283,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,77-7,67 (m, 2H), 7,46-7,37 (m, 2H), 4,72-4,68 (m, 2H), 3,91-3,85 (m, 2H), 3,07-3,02 (m, 4H). Приклад 16 (6-Хлоро-5-фтор-1H-бензоімідазол-2-іл)-(4-метил-[1,4] діазепан-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 6-хлоро-5-фтор-2трихлорометил-1H-бензоімідазол (Приклад 14, Стадія А, 100мг, 0,35ммоль) та N-метилгомопіперазин (79мг, 0,70ммоль). Очищенням одержували 29мг (27%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H16ClFN4O, 310,10; m/z знайдено, 311,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,2 (ушир, s, 1Н), 7,72 (ушир, s, 1Н), 7,41 (ушир, s, 1Н), 4,64-4,61 (m, 1H), 3,88 (t, J=6,1Гц, 1H), 3,93-3,91 (m, 1H), 3,88 (t, J=6,1Гц, 1H), 2,87-2,84 (m, 1H), 2,80-2,78 (m, 1H), 2,66-2,62 (m, 2H), 2,41 (d, J=5,1Гц, 3H), 2,17-2,11 (m,2H). Приклад 17 (8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-амід 6-хлоро-5-фтор-1Н-бензоімідазол-2-карбонової кислоти. Реакцію, проводили, як описано в Загальній методиці 2, використовуючи 6-хлоро-5-фтор-2трихлорометил-1H-бензоімідазол (Приклад 14, Стадія А, 100мг, 0,35ммоль) та 8-метил-8-азабіцикло[3,2,1]окт-3-иламін дигідрохлорид (149мг, 0,70ммоль). Очищенням одержували 35мг (30%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C16H18ClFN4O, 336,12; m/z знайдено, 337,2 [M+H]+. 1H ЯМР (400МГц, CDCI 3): 8,01 (d, J=8Гц, 1Н), 7,71 (ушир, s, 1H), 7,52-7,38 (m, 1H), 4,37-4,31 (m, 1H), 3,24 (s, 2H), 2,39-2,32 (m, 5H), 2,26-2,22 (m, 2H), 1,96-1,95 (m, 2H), 1,86 (d, J=12,0Гц, 2Н). Приклад 18 (5-Хлоро-6-метил-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. A. 5-Хлоро-6-метил-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 5-хлоро-6-метил-1,2фенілендіамін (1,00г, 6,41ммоль). Висушений осад розтирали в порошок з дихлорметаном (3´10мл) з подальшим використанням гексану (3´10мл), одержуючи 950мг (53%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C9H6CI 4N2, 281,93; m/z знайдено, 283,0 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,70 (s, 1Н), 7,52 (s, 1H). B. (5-Хлоро-6-метил-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-хлоро-6-метил-2трихлорометил-1H-бензоімідазол (100мг, 0,35ммоль) та Ν-метилпіперазин (0,08мл, 0,71ммоль). Очищенням одержували 36мг (35%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H17CIN4O, 292,11; m/z знайдено, 293,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,5 (ушир, s, 1Н), 7,71-7,32 (ушир, m, 2H), 4,74-4,72 (m, 2H), 3,97-3,94 (m, 2H), 2,58 (t, J=5,1Гц, 4H), 2,48 (s, 3Н), 2,38 (s, 3Н). Приклад 19 (5-Хлоро-6-метил-1H-бензоімідазол-2-іл)-піперазин-1-іл-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-хлоро-6-метилтрихлорометил-1H-бензоімідазол (Приклад 18, Стадія А, 100мг, 0,35ммоль) та піперазин (60мг, 0,71ммоль). Очищенням одержували 8мг (8%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15CIN4O, 278,09; m/z знайдено, 279,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,75-7,28 (m, 2Н), 4,72-4,69 (m, 2Н), 3,85-3,82 (m, 2Н), 3,03-3,00 (m, 4Н), 2,49 (s, 3Н). Приклад 20 (4-Метил-1H-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон. A. 4-Метил-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 2,3-діамінотолуол (1,19г 9,74ммоль) та метил-2,2,2-трихлороацетимідат (1,20мл, 9,74ммоль). Очищенням на силікагелі (40г; 40% EtOAc/гексан) одержували 830мг (34%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C9H7CI 3N2, 247,97; m/z знайдено, 249,0 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 9,78 (s, 1Н), 7,52 (ушир, s, 1H) 7,27 (d, J=7,4, 8,1Гц, 1H), 7,17 (d, J=7,4Гц, 1H), 2,64 (s, 3H). B. (4-Метил-1H-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-метил-2-трихлорометил-1Hбензоімідазол (100мг, 0,40ммоль) та 2-метилпіперазин (80мг, 0,80ммоль) в ТГФ (3мл). Очищенням одержували 27мг (26%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H18 N4O 258,15; m/z знайдено, 259,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): суміш ротамерів: 11,61-11,58 (m, 1Н), 7,68-7,57 (m, 0,5Н), 7,24-7,18 (m, 1Н), 7,10 (d, J=7,1Гц, 1Н), 6,18-5,84 (m, 1H), 4,73-4,67 (m, 1H), 3,40 (ddd, J=3,03, 12,6, 14,15Гц, 0,5H), 3,18-3,13 (m, 1H), 3,10-2,86 (m, 3,5 H), 2,70-2,45 (m 4H), 1,80 (ушир, s, 1 Η), 1,17 (d, J= 6,32Гц, 3Н). Приклад 21 (4-Етил-піперазин-1-іл)-(4-метил-1H-бензоімідазол-2-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-метил-2-трихлорометил-1Hбензоімідазол (Приклад 20, Стадія А, 100мг, 0,40ммоль) та N-етилпіперазин (0,10мл, 0,80ммоль) в ТГФ (3мл). Очищенням одержували 67мг (62%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C15H20N4O, 272,16; m/z знайдено, 273,2 [М+Н]+. 1H ЯМР (400МГц, CDCI3): 10,89 (s, 1Н), 7,64 (d, J=8,6Гц, 0,5H), 7,33 (d, J=8,6Гц, 0,5Н), 7,22-7,18 (m, 1H), 7,13 (d, J=7,4Гц, 0,5Н), 7,10 (d, J=7,4Гц, 0,5Н), 4,86-4,84 (m, 1H), 4,80-4,78 (m, 1H), 3,93-3,90 (m, 2H), 2,66 (s, 1,5H), 2,63-2,56 (m, 4H), 2,52 (s, 1,5H), 2,48 (q, J=7,3Гц, 2Н), 1,14 (t, J=7,1Гц, 3Н). Приклад 22 (4-Метил-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-метил-2-трихлорометил-1Нбензоімідазол (Приклад 20, Стадія А, 100мг, 0,40ммоль) та N-метилпіперазин (0,09мл, 0,80ммоль). Очищенням одержували 51мг (50%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H18N4O, 258,15; m/z знайдено, 259,2 [М+Н]+. 1H ЯМР (400МГц, CDCI3): 11,53 (ушир, s, 1Н), 7,64 (d, J=8,3Гц, 0,5Н), 7,32 (d, J=8,3Гц, 0,5Н), 7,25-7,18 (m, 1H), 7,10 (t, J=7,3Гц, 1H), 4,87-4,82 (m, 1H), 4,79-4,75 (m, 1H), 3,95-3,92 (m, 2H), 2,66 (s, 1,5H), 2,59-2,54 (m, 4H), 2,50 (s, 1,5H), 2,36 (s, 3H). Альтернативне одержання прикладу 22 (схема 1) A. (4-Метил-1H-бензоімідазол-2-іл-метанол. Суміш 3-метил-бензол-1,2-діаміну (3,77g, 30,8ммоль) та гліколевої кислоти (5мл, 70% розчин у воді) в 4N НСI (30мл) нагрівали до 100°С протягом 2 годин. Теплу суміш охолоджували та відфільтровували. Нейтралізація фільтрату концентрованим NН4ОН призводила до утворення твердої фази, яку збирали фільтруванням, промивали водою та сушили під вакуумом, одержуючи 0,95г (19%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C9H10N2O, 162,08; m/z знайдено, 163,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,35 (d, J=8,1Гц, 1Н) 7,10 (dd, J=7,3, 8,1Гц, 1H), 7,00 (d, J=7,3Гц, 1H), 4,88 (ушир., 3H), 2,55 (s, 3H). B. (4-Метил-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. До суспензії (4-метил-1H-бензоімідазол-2-іл)-метанолу (0,84г, 5,18ммоль) у воді (10мл) додавали 2Μ Na2CO3 (10мл). До суміші додавали по краплинам розчин 0,1Μ KМnО4 (1,4г, 8,8ммоль). Цю суміш нагрівали до 100°С протягом 2 годин та потім відфільтровували гарячою, та охолоджений фільтрат підкислювали 3N оцтовою кислотою. Одержану тверду фазу збирали фільтруванням, промивали водою та сушили під вакуумом. Неочищену кислоту (0,56г, 62%) використовували в амідному сполученні без подальшого очищення. До суспензії кислоти (111,6мг, 0,63ммоль) в DMF (3мл) додавали GDI (108,9мг, 0,67ммоль) та цю суміш перемішували протягом 1 години. Потім додавали метилпіперазин (80мкл) та реакційну суміш перемішували 16 годин при кімнатній температурі. Суміш виливали у воду (50мл) та екстрагували дихлорметаном. Об'єднані екстракти концентрували при зниженому тиску, та залишок очищали на силікагелі (10г; 1-8% метанол (2Μ NН3)/дихлорметан), одержуючи 124,3мг (76%) білого твердого осаду. Дані MS та 1H ЯМР відповідають отриманому вище продукту. Приклад 23 (4-Метил-1H-бензоімідазол-2-іл)-піперазин-1-іл-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-метил-2-трихлорометил-1Hбензоімідазол (Приклад 20, Стадія А, 100мг, 0,40ммоль) та піперазин (69мг, 0,80ммоль). Очищенням одержували 4мг (4%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H16N4O, 244,13; m/z знайдено, 245,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 10,36 (s, 1Н), 7,65 (d, J=8,3Гц, 0,5Н), 7,34 (d, J=8,3Гц, 0,5Н), 7,24-7,20 (m, 1H), 7,15 (d, J=7,3Гц, 0,5H), 7,11 (d, J=7,3Гц, 0,5H), 4,80-4,78 (m, 1H), 4,75-4,73 (m, 1H), 3,03-2,99 (m, 2H), 2,67 (s, 1,5H), 2,54 (s, 1,5H). Приклад 24 (8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-амід 4-метил-1H-бензоімідазол-2-карбонової кислоти. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-метил-2-трихлорометил-1Hбензоімідазол (Приклад 20, Стадія А, 100мг, 0,40ммоль) та 8-метил-8-азабіцикло[3,2,1]октан-3-амін дигідрохлорид (170мг, 0,80ммоль). Очищенням одержували 16мг (13%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C17H22N4O, 298,18; m/z знайдено, 299,3 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): суміш ротамерів: 11,65-11,46 (m, 1Н), 8,12-8,07 (m, 1H), 7,64 (d, J=8,1Гц, 0,6Н), 7,36 (d, J=8,1Гц, 0,4Н), 7,24 (t, J=8,1Гц, 1Н), 7,14 (d, J=7,3Гц, 0,6H), 7,11 (d, J=7,3 Гц, 0,4H), 4,34 (quin, J=6,8Гц, 1H), 3,23 (ушир, s, 2H), 2,68 (s, 1,4H), 2,60 (s, 1,6H), 2,34 (mm, 5H), 2,24-2,20 (m,2H), 2,02-1,96 (m, 2H), 1,87 (d, J=14,4Гц, 2Н). Приклад 25 (8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-амід 5-метил-1H-бензоімідазол-2-карбонової кислоти. А. 5-Метил-2-трихлорометил-1Н-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 3,4-діамінотолуол (1,33г, 10,88ммоль) та метил-2,2,2-трихлороацетимідат (1,33мл, 10,88ммоль). Очищенням на силікагелі (40г; 40% EtOAc/гексан) одержували 980мг (36%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C9H7CI 3N2, 247,97; m/z знайдено, 249,0 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 9,77 (ушир, s, 1Н), 7,60 (ушир, s, 1Н), 7,43 (ушир, s, 1H), 7,19 (dd, J=1,3, 8,6Гц, 1H), 2,50 (s, 3H). B. (8-метил-8-аза-біцикло[3,2Л]окт-3-ил)-амід 5-метил-1H-бензоімідазол-2-карбонової кислоти. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-метил-2-трихлорометил-1Hбензоімідазол (100мг, 0,40ммоль) та 8-метил-8-азабіцикло[3,2,1]окт-3-иламін дигідрохлорид (170мг, 0,80ммоль) в ТГФ (3мл). Очищенням одержували 12мг (10%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C17H22N4O, 298,18; m/z знайдено, 299,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,55 (ушир, s, 1H), 8,02-7,96 (m, 1H), 7,67 (d, J=8,4Гц, 0,55H), 7,58 (ушир, s, 0,45H), 7,42 (d, J=8,6Гц, 0,45H), 7,33 (ушир, s, 0,55H), 7,18-7,13 (m, 1H), 4,34 (q, J=7,07Гц, 1H), 3,24-3,22 (m, 2H), 2,49 (s, 3H), 2,39-2,33 (m, 2H), 2,23 (s, 3H), 2,23-2,18 (m, 2H), 2,01-1,95 (m, 2H), 1,88 (d, J=14,4Гц, 2Н). Приклад 26 (5-Метил-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-метил-2-трихлорометил-1Нбензоімідазол (Приклад 25, Стадія А, 100мг, 0,40ммоль) та N-метилпіперазин (0,09мл, 0,80ммоль). Очищенням одержували 36мг (35%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H18N4O, 258,15; m/z знайдено, 259,2 [М+Н]+. 1H ЯМР (400МГц, CDCI3): 11,24 (ушир, s, 1Η), 7,69 (d, J=8,3Гц, 0,6Н), 7,60 (ушир, s, 0,4Н), 7,39 (d, J=8,3Гц, 0,4Н), 7,29 (ушир, s, 0,6Н), 7,18 (d, J=8,3Гц, 0,4Н) 7,13 (d, J=8,3Гц, 0,6Н), 4,81-4,77 (m, 2H), 3,95-3,93 (m, 2H), 2,59-2,55 (m, 4H), 2,49 (s, 3Н), 2,36 (s, 3Н). Приклад 27 (4-Метил-піперазин-1-іл)-(5-трифторметил-1H-бензоімідазол-2-іл)-метанон. А. 2-Трихлорометил-5-трифторметил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 4-(трифторметил)-1,2фенілендіамін (1,0г, 5,68ммоль) та метил-2,2,2-трихлороацетимідат (0,70мл, 5,68ммоль). Очищенням на силікагелі (40г; 40% ЕtOАс/гексан) одержували 930мг (54%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C9H4Cl3F3N2, 301,94; m/z знайдено, 303,0 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 10,16 (ушир, s, 1Н), 8,18 (ушир, s, 0,55Н), 7,98 (ушир, d, J=8,08Гц, 0,5Н), 7,83 (ушир, s, 0,45Н), 7,71-7,63 (m, 1,5Н). В. (4-Метил-піперазин-1-іл)-(5 -трифторметил-1H-бензоімідазол-2-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-5трифторметил-1H-бензоімідазол (100мг, 0,33ммоль) та Ν-метилпіперазин (0,07мл, 0,66ммоль). Очищенням одержували 42мг (41%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H15F3N4O, 312,12; m/z знайдено, 313,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 8,01 (ушир, s, 1Н), 7,74-7,70 (m, 1H), 7,58 (dd, J=1,3, 8,6Гц, 1H), 4,78-4,76 (m, 2H), 3,96-3,94 (m, 2H), 2,60-2,56 (m, 4H), 2,37 (s, 3H). Приклад 28 Піперазин-1-іл-(5-трифторметил-1H-бензоімідазол-2-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-5трифторметил-1H-бензоімідазол (Приклад 27, Стадія А, 100мг, 0,33ммоль) та піперазин (57мг, 0,66ммоль). Очищенням одержували 6мг (6%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H13F3N4O, 298,10; m/z знайдено, 299,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,01 (ушир, s, 1Н), 8,12 (ушир, s, 0,5Н), 7,87 (ушир., 1Н), 7,58-7,60 (m, 1,5Н), 4,74-4,72 (m, 2Н), 3,89-3,86 (m, 2Н), 3,06-3,03 (m, 4Н). Приклад 29 (5-Фтор-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. A. 5-Фтор-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 4-фтор-1,2-фенілендіамін (1,0г, 8,12ммоль) та метил-2,2,2-трихлороацетимідат (1,0мл, 8,12ммоль). Розтиранням в порошок отриманого осаду одержували 1,20г (60%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C8H4CI 3FN2, 251,94; m/z знайдено 253,0 [М+Н]+. 1H ЯМР (400МГц, CDCI3): 7,64 (ушир, s, 1Н), 7,31 (ушир, s, 1Н), 7,07 (dt, J=2,27, 9,09Гц, 1Н). B. (5-Фтор-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-фтор-2-трихлорометил-1Hбензоімідазол (100мг, 0,39ммоль) та N-метилпіперазин (0,09мл, 0,79ммоль). Очищенням одержували 28мг (27%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15FN4O, 262,12; m/z знайдено, 236,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,55 (ушир, s, 1Н), 7,74 (ушир, s 0,5Н), 7,46 (ушир, s, 1Н), 7,19-7,17 (m, 0,5Н), 7,09-7,07 (m, 1H), 4,79-4,77 (m, 2H), 3,95-3,92 (m, 2H), 2,59-2,57 (m, 4H), 2,37 (s, 3H). Приклад 30 (4-Етил-піперазин-1-іл)-(5-фтор-1H-бензоімідазол-2-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-фтор-2-трихлорометил-1Hбензоімідазол (Приклад 29, Стадія А, 100мг, 0,39ммоль) та N-етилпіперазин (0,10мл, 0,79ммоль). Очищенням одержували 30мг (28%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H17FN4O, 276,14; m/z знайдено, 277,2 [М+Н]+. 1 H ЯМР (400МГц, CDCI 3): 11,62 (ушир, s, 1Н), 7,74 (ушир, s, 0,5Н), 7,46 (ушир, s, 1Н), 7,1-9 (ушир, s, 0,5Н), 7,08 (ушир, s, 1Н), 4,80-4,76 (m, 2H), 3,96-3,93 (m, 2H), 2,632,60 (m, 4H), 2,50 (q, J=7,3Гц, 2Н), 1,14 (t, J=7,3Гц, 3Н). Приклад 31 (5-Фтор-1H-бензоімідазол-2-іл)-піперазин-1-іл-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-фтор-2-трихлорометил-1Hбензоімідазол (Приклад 29, Стадія А, 100мг, 0,39ммоль) та піперазин (68мг, 0,79ммоль). Очищенням одержували 7мг (7%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C12H13FN4O, 248,11; m/z знайдено, 249,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,26 (ушир, s, 1 Η), 7,72 (ушир, s, 0,5Н), 7,46 (ушир, s, 1Н), 7,19 (ушир, s, 0,5Н), 7,09 (ушир, s, 1Н), 4,74-4,71 (m, 2H), 3,89-3,86 (m, 2H), 3,05-3,02 (m, 4H). Приклад 32 (5-Фтор-1H-бензоімідазол-2-іл)-(3-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-фтор-2-трихлорометил-1Hбензоімідазол (Приклад 29, Стадія А, 100мг, 0,39ммоль) та 2-метилпіперазин (79мг, 0,79ммоль). Очищенням одержували 17мг (17%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15FN4O, 262,12; m/z знайдено, 263,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,45 (ушир, s, 1 Η), 7,74 (ушир, s, 0,5Н), 7,46 (ушир, s, 1Н), 7,19 (ушир, s, 0,5Н), 7,08 (ушир, s, 1Н), 6,57-6,03 (m, 0,5H), 5,94-5,89 (m, 0,5H), 4,72-4,65 (m, 1H), 3,42-3,35 (m, 0,5H), 3,20-3,14 (m, 1H), 3,08-2,87 (m, 3H), 2,66-2,59 (m, 0,5H), 1,19 (d, J=6,3Гц, 1,5H), 1,18(d, J=6,3Hz, 1,5H). Приклад 33 (8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-амід 5-фтор-1H-бензоімідазол-2-карбонової кислоти. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 5-фтор-2-трихлорометил-1Hбензоімідазол (Приклад 29, Стадія А, 100мг, 0,39ммоль) та 8-метил-8-азабіцикло[3,2,1]октан-3-амін дигідрохлорид (168мг, 0,79ммоль). Очищенням одержували 17мг (15%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C16H19FN4O, 302,15; m/z знайдено, 303,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 12,01 (ушир, s, 1Н), 8,06 (d, J=7,8Гц, 1H), 7,73 (ушир, s, 0,6Н), 7,47 (ушир, s, 1Н), 7,22 (ушир, s, 0,4Н), 7,10 (m, 1H), 4,35 (q, J=7,1Гц, 1H), 3,28-3,25 (m, 2H), 2,41-2,35 (m, 2H), 2,34 (s, 3H), 2,28-2,21 (m, 2H), 2,02-1,97 (m, 2H), 1,88 (d, J=14,4Гц, 2Н). Приклад 34 (3Н-Імідазо[4,5-b]піридин-2-іл)-(4-метил-піперазин-1-іл)-метанон. А. 2-Трихлорометил-3H-імідазо[4,5-b]піридин. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2,3-діамінопіридин (1,0г, 9,16ммоль) та метил-2,2,2-трихлороацетимідат (1,13мл, 9,16ммоль). Очищенням на силікагелі (40г; 60% EtOAc/гексан) одержували 600мг (28%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C7H4CI 3N3, 234,95; m/z знайдено, 236,0 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 8,65 (dd, J=1,5, 8,1Гц, 1Н), 8,32 (dd, J=1,3, 8,1Гц, 1 Η), 7,45 (dd, J=4,8, 8,1Гц, 1Н). В. (3H-Імідазо[4,5-b]піридин-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 2-трихлорометил-3Hімідазо[4,5-b]піридин (100мг, 0,43ммоль) та N-метилпіперазин (0,09мл, 0,86ммоль) в ТГФ (3мл). Очищенням одержували 29мг (28%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C12H15N5O, 245,13; m/z знайдено, 246,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 13,63 (s, 1Н), 8,71 (d, J=4,3Гц, 1Н), 8,15 (s, 1H), 7,34 (dd, J=4,8, 8,3Гц, 1Н), 4,77 (ушир, s, 2H), 3,96-3,93 (m, 2H), 2,58 (m, 4H), 2,36 (s, 3H). Приклад 35 Бензооксазол-2-іл-(4-метил-піперазин-1-іл)-метанон. Загальна методика 3: Перемішаний розчин 2-амінофенолу (300мг, 2,75ммоль), метил 2,2,2-триметоксіацетату (902мг, 5,50ммоль) та трифлат ітербію (170мг, 0,28ммоль) в толуолі (10мл) нагрівали до кипіння зі зворотним холодильником. Через 5 годин суміш охолоджували та осад збирали і сушили. Неочищену тверду фазу суспендували в толуолі (5мл), та додавали N-метилпіперазин (1,5мл, 13,7ммоль) з подальшим використанням 2-гідроксипіридину (26мг, 0,28ммоль). Суміш нагрівали до 125°С в ампулі протягом 4 годин. Одержаний жовтий розчин концентрували при зниженому тиску та залишок очищали на силікагелі (12г; 2% метанол/дихлорметан), одержуючи 320мг (48%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15 N3O2, 245,12; m/z знайдено, 246,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,83-7,79 (m, 1Н), 7,66-7,65 (m, 2H), 7,47-7,41 (m, 2H), 4,19 (t, J=5,1Гц, 4Н), 3,88 (t, J=5,1Гц, 4H), 2,55-2,52 (m, 4H), 2,35 (s, 3H). 13C ЯМР (400МГц, CDCI3): 156,1, 154,6, 149,9, 140,1, 127,1, 125,3, 121,3, 111,5, 55,3, 54,6, 46,9, 45,9, 42,8. Приклад 36 (7-Метил-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Послідовність реакцій проводили, як описано в Загальній методиці 3, починаючи з 2-аміно-6-метилфенол (300мг, 2,43ммоль). Очищенням одержували 410мг (65%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H17N3O2, 259,13; m/z знайдено, 260,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,66 (d, J=8,1Гц, 1Н), 7,43 (s, 1H), 7,23 (dd, J=8,1, 1,0Гц, 1Н), 4,22 (t, J=5,1Гц, 4H), 3,88 (t, J=5,1Гц, 4H), 2,54-2,52 (m, 7H), 2,35 (s, 3H). 13C ЯМР (400МГц, CDCI 3): 156,2, 154,4, 150,2, 138,0, 137,9, 126,7, 120,6, 111,5, 55,4, 54,6, 46,9, 46,0, 42,8, 21,9. Приклад 37 (5-Метил-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Послідовність реакцій проводили, як описано в Загальній методиці 3, починаючи з 2-аміно-4-метилфенол (300мг, 2,43ммоль). Очищенням одержували 212мг (34%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для С14Н17 N3О2, 259,13; m/z знайдено, 260,2 [М+Н]+. 1 H ЯМР (400МГц, CDCI 3): 7,47 (s, 1Η), 7,40 (d, J=8,3Гц, 1 Η), 7,16 (dd, J=8,3, 1,7Гц, 1Н), 4,08 (t, J=5,1Гц, 4H), 3,76 (t, J=5,1Гц, 4H), 2,43-2,40 (m, 4H), 2,38 (s, 3H), 2,24 (s, 3H). 13C ЯМР (400МГц, CDCI 3): 156,5, 155,3, 158,5, 140,7, 135,5, 128,7, 121,3, 111,2, 55,7, 54,69, 47,2, 46,3, 43,2, 21,8. Приклад 38 (4-Метил-бензооксазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Послідовність реакцій проводили, як описано в Загальній методиці 3, починаючи з 2-аміно-3-метилфенолу (300мг, 2,43ммоль). Очищенням одержували 230мг (37%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C14H17N3O2, 259,13; m/z знайдено, 260,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,37 (d, J=8,1Гц, 1H), 7,27(t, J=8,1Гц, 1Н), 7,13 (d, J=8,1Гц, 1H), 4,12 (t, J=5,1Гц, 4H), 3,81 (t, J=5,1Гц, 4H), 2,56 (s, 3H), 2,48-2,44 (m, 4H), 2,28 (s, 3H). 13C ЯМР (400МГц, CDCI 3): 156,7, 154,6, 150,1, 139,9, 132,3, 127,2, 126,0, 109,1, 55,7, 54,9, 47,3, 46,3, 43,2, 16,8. Приклад 39 Бензотіазол-(4-метил-піперазин-1-іл)-метанон. А. Метиловий ефір бензотіазол-2-карбонової кислоти. Перемішаний розчин 2-амінотіофенолу (1,70мл, 15,9ммоль), метил 2,2,2-триметоксіацетату (3,93г, 23,9ммоль), та трифлат ітербію (620мг, 1,59ммоль) в толуолі (10мл) нагрівали до кипіння зі зворотним холодильником. Після 1,5 годин суміш охолоджували та розчинник видаляли при зниженому тиску. Неочищене масло очищали на силікагелі (40г; 20-100% етилацетат/гескан) одержуючи 2,00г (66%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C9H7 NO2S, 193,02; m/z знайдено, 194,1 [М+Н]+, 216,0 [M+Na]+. 1H ЯМР (400МГц, CDCI 3): 7,58-7,54 (m, 1H), 7,37-7,35 (m, 2H), 6,956,87 (m, 2H), 3,37 (s, 3H). 13C ЯМР (400МГц, CDCI 3): 164,82, 162,5, 156,9, 140,7, 131,9, 131,4, 128,6, 126,5, 57,0. В. Бензотіазол-2-іл-(4-метил-піперазин-1-іл)-метанон. Суміш метилового ефіру бензотіазол-2-карбонової кислоти (100мг, 0,52ммоль), N-метилпіперазину (0,29мл, 2,59ммоль), та 2-гідроксипіридину (5мг, 0,05ммоль) в толуолі (1,5мл) нагрівали мікрохвилями до 170°С протягом 10 хвилин. Одержаний жовтий розчин концентрували при зниженому тиску, та залишок очищали обернено-фазовою ВЕРХ, одержуючи 50мг (19%) зазначеної у заголовку сполуки у вигляді трифторацетатної солі. [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 8,11-8,08 (m, 1Н), 7,97-7,96 (m, 2H), 7,55-7,45 (m, 2H), 4,45 (t, J=5,1Гц, 4H), 3,88 (t, J=5,1Гц, 4H), 2,55-2,52 (m, 4H), 2,35 (s, 3H). 13C ЯМР (400МГц, CDCI 3): 164,7, 159,7, 153,0, 136,1, 126,6, 126,5, 124,6, 121,8, 55,5, 54,7, 46,4, 46,0, 43,5. Приклад 40 (5-Бензоїл-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. А. (2-Гідроксиметил-1H-бензоімідазол-5-іл)-феніл-метанон. Суміш (3,4-діаміно-феніл)-феніл-метанону (4,28г, 20,16ммоль) та гліколевої кислоти (5мл, 70% розчин у воді) в 4N НСI (40мл) нагрівали до 100°С протягом 2 годин. Теплу суміш виливали у воду (350мл) та охолоджували. Нейтралізація концентрованим NH4OH призводила до утворення твердої фази, яку збирали фільтруванням, промивали водою та сушили під вакуумом, одержуючи 4,99г (98%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C15H12N2O2, 252,09; m/z знайдено, 253,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 8,02-7,99 (m, 1Н), 7,79-773 (m, 3H), 7,66-7,62 (m, 2H), 7,56-7,51 (m, 2H) 4,90 (ушир., 4Н). В. (5-Бензоїл-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. До суспензії (2-гідроксиметил-1H-бензоімідазол-5-іл)-феніл-метанону (2,0г, 7,9ммоль) у воді (250мл) додавали 2Μ Na2CO3 (10мл). До суміші додавали по краплинам розчин 0,1Μ KМnО4 (1,9г, 12,0ммоль). Цю суміш нагрівали до 100°С протягом 2 годин та потім відфільтровували гарячою, та охолоджений фільтрат підкислювали 3N оцтовою кислотою. Одержану тверду фазу збирали фільтруванням, промивали водою та сушили під вакуумом. Неочищену кислоту (0,63г, 30%) використовували в амідному сполученні без подальшого очищення. До суспензії кислоти (120,7мг, 0,45ммоль) в DMF (3мл) додавали GDI (82,3мг, 0,51ммоль) та цю суміш перемішували протягом 1 години. Потім додавали N-метил піперазин (55мл) та реакційну суміш перемішували при кімнатній температурі протягом 16 годин. Суміш виливали у воду (50мл) та екстрагували дихлорметаном. Об'єднані екстракти концентрували при зниженому тиску та залишок очищали на силікагелі (10г; 1-8% метанол (2Μ NН3)/дихлорметан), одержуючи 71,8мг (45%) не зовсім білого осаду. MS (ESI): маса, розрахована для C20H20N4O2, 348,16; m/z знайдено, 349,1 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 12,21 (ушир, s, 1Н), 8,25-8,22 (m, 0,5Н), 7,93-7,91 (m, 1,5Н), 7,83-7,79 (m, 2H), 7,62-7,56 (m, 1Н), 7,517,46 (m, 2H), 4,83-4,73 (m, 2H), 3,96-3,93 (m, 2H), 2,61-2,59 (m, 2H), 2,56-2,53 (m, 2H), 2,36 (s, 3H). Приклад 41 (4-Хлоро-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. A. 4-Хлоро-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 3-хлоро-1,2-фенілендіамін (647мг, 4,52ммоль). Через 1,5 години додавали воду (10мл) та осад збирали фільтруванням, одержуючи 1,04мг (86%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C8H4CI 4N2, 269,9; m/z знайдено, 271,0 [М+Н]+. B. (4-Хлоро-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-хлоро-2-трихлорометил-1Hбензоімідазол (1,04г, 3,86ммоль) та N-метилпіперазин (0,39мл, 4,25ммоль). Очищенням одержували 594мг (56%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15CIN4O, 278,74; m/z знайдено, 279,5 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 12,3-11,19 (s, 1Н), 7,71-7,40 (m, 1H), 7,32 (d, J=7,8Гц, 1Н), 7,23 (d, J=7,8Гц, 1Н), 4,82-4,72 (m, 2H), 3,96-3,93 (m, 2H), 2,60-2,55 (m, 4H), 2,37 (s, 3H). Приклад 42 (4-Метил-піперазин-1-іл)-(4-нітро-1H-бензоімідазол-2-іл)-метанон. А. 4-Нітро-2-трихлорометил-1H-бензоімідазол. Реакцію проводили, як описано в Загальній методиці 1, використовуючи 3-нітро-1,2-фенілендіамін (1г, 6,54ммоль). Через 1,5 години додавали воду (10мл) та осад збирали фільтруванням, одержуючи 1,18мг (64%) зазначеної у заголовку проміжної сполуки. MS (ESI): маса, розрахована для C8H4CI 3N3O2, 280,49; m/z знайдено, 281,2 [М+Н]+. В. (4-Метил-піперазин-1-іл)-(4-нітро-1H-бензоімідазол-2-іл-метанон. Реакцію проводили, як описано в Загальній методиці 2, використовуючи 4-нітро-2-трихлорометил-1Hбензоімідазол (1,18г, 4,20ммоль) та N-метилпіперазин (0,70мл, 6,30ммоль). Очищенням одержували 801мг (66%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H15N5O3, 289,29; m/z знайдено, 290,3 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 11,36-11,24 (s, 1 Η), 8,29 (d, J=7,8Гц, 1Н), 8,17 (d, J=7,8Гц, 1Н), 7,45 (t, J=7,8Гц, 1Н), 4,71-4,68 (m, 2H), 3,92-3,89 (m, 2H), 2,58-2,54 (m, 4H), 2,37 (s, 3H). Приклад 43 (4-Аміно-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. До розчину (4-метил-піперазин-1-іл)-(4-нітро-1H-бензоімідазол-2-іл)-метанону (640мг, 2,21ммоль) в 1:1 ТГФ/етанол (10мл з декількома краплями етилацетату) додавали 10% паладію на вуглеці (640мг). Реакційну суміш розміщали під 1атм. водню протягом 72 годин. Утворену суміш відфільтровували через діатомову землю та фільтрат концентрували при зниженому тиску. Неочищений продукт очищали на силікагелі (40г; 0-10% метанол/СН2СI 2), одержуючи 519мг (91%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H17N5O, 259,31; m/z знайдено, 260,3 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 12,21-11,36 (s, 1Н), 7,12 (t, J=7,8Гц, 1Н), 6,94-6,83 (m, 1H), 6,53 (d, J=7,8Гц, 1H), 4,82-4,78 (m, 2H), 4,43-4,40 (m, 2H), 3,943,92 (m, 2H), 2,56-2,54 (m, 4H), 2,35 (s, 3H). Приклад 44 (4-Ізопропіламіно-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанон. До розчину (4-аміно-1H-бензоімідазол-2-іл)-(4-метил-піперазин-1-іл)-метанону (Приклад 43; 50мг, 0,19ммоль) в дихлороетані (10мл) додавали ацетон (0,07мл, 0,96ммоль) та оцтову кислоту (10 крапель), потім додавали NaBH(OAc)3 (203мг, 0,96ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 16 годин та потім гасили насиченим водн. NaHCO3 (5мл). Водний шар екстрагували CDCI 3 (10мл) та об'єднані органічні шари сушили (Na2SO4) та потім концентрували при зниженому тиску. Неочищений продукт очищали на силікагелі (10г; 0-10% метанол (2Μ NH3 )/CH2CI 2), одержуючи 35мг зазначеної у заголовку сполуки (60%). MS (ESI): маса, розрахована для C16H23N5O, 301,39; m/z знайдено, 302,3 [М+Н]+. 1 H ЯМР (400МГц, CDCI 3): 11,11-11,07 (s, 1Н), 7,18 (t, J=7,8 Гц, 1Н), 6,76 (d, J=7,8Гц, 1H), 6,37 (d, J=7,8Гц, 1H), 4,80-4,65 (m, 2H), 3,92-3,78 (m, 2H), 2,56-2,53 (m, 4H), 2,36 (s, 3H), 1,85-1,81, (m, 1H), 1,32 (d, J=6,3Гц, 6Н). Приклад 45 С-(5-Хлоро-1Н-бензоімідазол-2-іл)-С-(4-метил-піперазин-1-іл)-метиленамін. До суспензії 5-хлоро-2-трихлорометил-1H-бензоімідазолу (100мг, 0,37ммоль) в ацетонітрилі (4мл) додавали N-метилпіперазин (0,04мл, 0,4ммоль). Суміш перемішували протягом 10 хвилин, потім додавали ацетат амонію (29мг, 0,38ммоль). Через 18 годин реакційну суміш розбавляли насиченим водн. NaHCO3 (10мл) та потім екстрагували дихлорметаном (3´10мл). Об'єднані екстракти сушили (Na2SO4) та потім концентрували при зниженому тиску. Неочищений продукт очищали на силікагелі (10г; 0-10% метанол (2Μ NH3)/дихлорметан), одержуючи 23мг (22%) зазначеної у заголовку сполуки. MS (ESI): маса, розрахована для C13H16N4O, 277,11; m/z знайдено, 278,2 [М+Н]+. 1H ЯМР (400МГц, CDCI 3): 7,79-7,74 (m, 2H), 7,45 (dd, J=8,6, 2,0Гц, 1Н), 4,23-4,17 (m, 4H), 3,63-3,58 (m, 4H), 3,01 (s, 3H). Біологічні Приклади Аналіз зв'язування на рекомбінантному людському H4 рецепторі гістаміну. SK-N-MC клітини або COS7 клітини тимчасово заражали pH4R та вирощували в 150см тканинних чашках для культивування. Клітини промивали розчином солі, зскрібали клітинним скальпелем та збирали центрифугуванням (1000об/хв, 5 хвилин). Клітинні мембрани готували гомогенізацією клітинного осаду після центрифугування в 20мМ Трис-НСІ з політрон-тканинним гомогенізатором протягом 10с при високій швидкості. Гомогенат центрифугували при 1000об/хв протягом 5 хвилин при 4°С. Потім збирали надосадову рідину та центрифугували при 20,000 x г протягом 25 хвилин при 4°С. Кінцевий осад ресуспендували в 50мМ Трис-НСІ. Клітинні мембрани інкубували 3Н-гістаміном (5-70нМ) в присутності або відсутності надлишку гістаміну (10000нМ). Інкубація відбувалася при кімнатній температурі протягом 45 хвилин. Мембрани одержували швидким фільтруванням через фільтри Whatman GF/C та промивали 4 рази крижаним 50мМ Трис НСl. Потім фільтри сушили, змішували зі сцинтиллятором та розраховували радіоактивність. SK-N-MC або COS7 клітини, експресуючі Н4 рецептор людського гістаміну, використовували, щоб виміряти спорідненість до зв'язування інших сполук та їх здатність витісняти 3Нліганд зв'язування за допомогою інкубації вище-описаної реакції в присутності різних концентрацій інгібітора або тестованих сполук. Для конкуренції зв'язуючих досліджень, використовуючи 3Н-гістамін, значення Ki розраховували, базуючись на експериментально визначеному значенні Ki 5нМ та концентрації ліганду 5нМ, відповідно до [Y.-C. Cheng та W.H. Prusoff (Biochem. Pharmacol. 1973, 22(23):3099-3108)]: Ki=(IC50)/(1+([L]/(KD)). Результати аналізу зв'язування ПР 1 2 3 4 5 6 7 8 9 10 11 12 Ki(нМ) 32 490 331 1400 89 25 87 300 28 620 355 807 ПР 16 17 18 19 20 21 22 23 24 25 26 27 Ki(нМ) 1300 535 226 1000 156 468 31 135 270 613 528 11 ПР 31 32 34 35 36 37 38 39 40 41 45 46 Ki(нМ) 42 460 833 620 1200 1300 1600 810 8000 57 110 64 13 14 15 380 53 216 28 29 30 420 26 370 47 48 49 158 23 51 Аналіз хемотаксису мастоцитів Нагромадження мастоцитів в епітелію слизової оболонки є відомою ознакою алергічних ринітів та астми. Переносні лунки (Costar, Cambridge, MA) з розміром пор 8мкм покривали 100мкл 100нг/мл людського фібронектину (Sigma) протягом 2 годин при кімнатній температурі. Після видалення фібронектину 600мкл RPMI з 5% BSA в присутності 10мкМ гістаміну додавали до нижньої камери. Щоб дослідити різні антагоністи рецептора гістаміну (HR), 10мкМ та/або 1мкМ розчини тестових сполук додавали до верхньої та нижньої камер. Мастоїдити (2´105/лунка) додавали до верхньої камери. Планшети інкубували протягом 3 годин при 37°С. Переносні лунки видаляли та клітини в нижній камері рахували протягом шістдесяти секунд, використовуючи проточний цитометр. 10мкМ HR Антагоніст (мкМ) Аналіз Гістамін зв'язування 10 1 ПР % Інг. Stdev % Інг. Stdev Ki (нМ) 9 97 72 11 28 6 97 1 84 5 25 7 101 1 8 15 87 25 27 75 66 12 613 Розподілення клітинного типу Н4 експресії RNA готували з різних клітин, використовуючи комплект RNeasy (Qiagen, Valencia, СА) згідно інструкцій виробника. RNA зразки (5мкг) проявляли на RNA гелі та потім переміщали на ніч до нейлонового блоту (Hybond, Amersham Pharmacia Biotech, Piscataway, NJ). Блот попередньо гібридизували ExpressHyb розчином (CLONTECH) протягом 30 хвилин при 68°С. Н4 Рецептор DNA помічали, використовуючи комплект Rediprime II (Amersham Pharmacia Biotech). Блот гібридизували протягом 2 годин при 68°С, з наступною однією стадією промивки (23 SSC та 0,05% SDS) 40 хвилин при кімнатній температурі та другою стадією промивки (0,13 SSC та 0,1% SDS) 40 хвилин при 50°С. Блот піддавали дії рентгенівських променів при -70°С з двома підсилюючими екранами протягом ночі. Результати Результати Northern Blot вказують, що Н4 рецептор виражений на кістково-мозгових вторинних мастоцитах (ВММС), перитонеальних мастоцитах та еозинофілах. Ці позитивні результати узгоджуються з опублікованою літературою [наприклад Oda та інші, Nguyen та інші, та Morse та інші в розділі „Передумови створення винаходу"]. Проте, негативні результати Northern Blot-експерименту, такі як виявлення можливо невиміряних рівнів Н4 рецептора, вираженого нейтрофілами, відрізняється дещо від згаданих вище отриманих даних літератури. Це може пояснюватися використанням різних методик. Нагромадження мастоцитів та еозинофілів в уражених тканинах є однією з основних ознак алергічних ринітів та астми. Оскільки експресія Н4 рецептора є обмежена цими типами клітин; сигналізація Н4 рецептора, ймовірно, опосередковує інфільтрацію мастоцитів та еозинофілів у відповідь на гістамін. Додаткове дослідження може також прояснити ці проблеми. Наступна таблиця показує розподілення клітинного типу Н4 експресії за допомогою Northern Blot. Вид Людина Тип клітини Еозинофіли Незрілі дендроподібні клітини Зрілі дендроподібні клітини CD14+ моноцити CD4+ T клітини CD8+ T клітини В клітини Нейтрофіли Миша/(Щур) Еозинофіли Перитоніальні мастоцити (щур) ВММС ВМ вторинні макрофаги Перитоніальні макрофаги CD4+ T В клітини Н4 + + + + Інгібування зміни форми еозинофілів за допомогою антагоністів Н4 рецептора гістаміну Нагромадження еозинофілів на ділянках алергічної реакції є відомою ознакою алергічних ринітів та астми. Цей приклад демонструє, що антагоністи рецептора Н4 гістаміну можуть блокувати реакцію змін форми в людських еозинофілах у відповідь на гістамін. Зміна форми є клітинною властивістю, яка передує хемотаксису еозинофілів. Способи Людські зернисті лейкоцити відокремлювали з людської крові за допомогою Ficoll градієнта. Червоні кров'яні клітини розчиняли в 5-10Х Qiagen буфері лізису при кімнатній температурі протягом 5-7 хвилин. Зернисті лейкоцити збирали та промивали один раз FACS буфером. Клітини ресуспендували з густиною 2´106клітин/мл в реакційному буфері. Щоб дослідити інгібування за допомогою особливих антагоністів рецепторів гістаміну, 90мкл суспензії клітин (~2´105 клітин) інкубували 10мкМ однієї з багатьох тестованих сполук. Після 30 хвилин додавали 11мкл однієї з різних концентрацій гістаміну. Через десять хвилин клітини переміщали в лід та фіксували 250мкл крижаного фіксуючого буферу (2% формальдегіду) протягом 1 хвилини. Зміну форми кількісно визначали, використовуючи керовану автофлуоресценцію перед аналізом розсіювання (GAPS) [Byran та інші, Am. J. Crit. Care Med. 2002, 165:1602-1609]. Результати - гістамін опосередковує зміну форми еозинофілів за допомогою Н4 рецептора Зміна у формі еозинофілів є результатом змін цитоскелету, що передує хемотаксису, і, таким чином, є мірою хемотаксису. Дані в наступній таблиці показують, що гістамін індукує дозо-залежну зміну форми в еозинофілах. Антагоністи рецептора гістаміну (HR) використовують, щоб відсортувати, який рецептор гістаміну відповідальний за зміну форми. Антагоністи, видові для Н1 рецептора гістаміну (дифенгідрамін) або для Н2 рецептора (ранатидин), не змінювали гістамін-викликану зміну форми. Проте, подвійний Н3/Н4 антагоніст (тіоперамід) та специфічний антагоніст Н4 рецептора гістаміну ((5-Хлоро-1H-індол-2-іл)-(4-метилпіперазин-1-іл)-метанон, K i=5нМ) інгібували гістамін-викликану зміну форми еозинофілів з ІС50 1,5 та 0,27мкМ, відповідно. Гістамін (мкМ): Не HR антагоніст 10мкМН4 антагоніст 10мкМ Тhіор 10мкМ Diphen 10мкМ Ranat 10 Зміна складки 1 0,1 0,01 0 1,34 1,31 1,21 0,01 1,00 1,09 1,05 1,05 1,01 1,00 1,08 1,63 1,64 1,05 1,50 1,49 1,01 1,18 1,21 1,04 1,03 1,04 1,00 1,00 1,00 Інгібування хемотаксису еозинофілів за допомогою антагоністів Н4 рецептора гістаміну Нагромадження еозинофілів на ділянках алергічної реакції є відомою ознакою алергічних ринітів та астми. Еозинофіли очищають від людської крові стандартними способами. Аналіз хемотаксису проводять, використовуючи переносні лунки (Costar, Cambridge, MA) з розміром пор 5мкм, вкриті 100мкл 100нг/мл людського фібронектину (Sigma) протягом 2 годин при кімнатній температурі. Після видалення фібронектину 600мкл RPMI з 5% BSA в присутності гістаміну (діапазон 1,25-20мкМ) додають до нижньої камери. Щоб дослідити різні антагоністи рецептора гістаміну, 10мкМ тестових сполук можуть бути додані до верхньої та нижньої камер. Еозинофіли будуть додавати до верхньої камери, тоді як гістамін або чинники, які викликають хемотаксис, будуть розміщені в нижній камері. Планшети інкубують протягом 3 годин при 37°С. Переносні лунки видаляють та кількість клітин в нижній камері може бути визначена протягом шістдесяти секунд, використовуючи проточний цитометр, або може бути кількісно визначена, використовуючи метод забарвлювання по Гімза. Інгібування зимозан-викликаного перитоніту в мишах за допомогою антагоністів Н4 рецептора гістаміну Було продемонстровано, що антагоністи Н4 рецептора гістаміну можуть блокувати перитоніт, викликаний зимозаном, який є нерозчинним полісахаридним компонентом на стінці клітин Saccharomyces cerevisiae. Він звичайно використовується, щоб викликати перитоніт в мишах та, проявляє дію в мастоцитзалежному способі. Сполуки за даним винаходом можуть бути досліджені в такій моделі, щоб продемонструвати їх використання як анти-запальних агентів. Мишам дають сполуку або PBS, або s.c. або р.о. (час приймався за 0). Через п'ятнадцять хвилин кожна миша одержує 1мг зимозану (Sigma) i.p. Мишей вбивають через 4 години, та черевні порожнини промивають 3мл PBS, що містить 3мМ EDTA. Кількість мігрованих лейкоцитів визначають, беручи аліквотну пробу (100мкл) рідини промивання та розбавляючи її 1:10 розчином Тюрка (0,01% кристалічного фіолетового в 3% оцтовій кислоті). Потім зразки струшують, та 10мкл забарвленого розчину клітин поміщають в лічильну камеру Нойбаєра. Диференціальні підрахунки клітин виконують, використовуючи оптичний мікроскоп (Olympus B061). Зважаючи на їх колірні характеристики та зовнішній вигляд ядра і цитоплазми, поліморфно-ядерні лейкоцити (PMN; >95% нейтрофілів) можуть бути легко ідентифіковані. Обробка зимозаном збільшує кількість нейтрофілів, що є характерним для запальної реакції. Обробка антагоністом Н4 рецептора блокує це збільшення. Інгібування хемотаксису мастоцитів за допомогою антагоніста Н4 рецептора в тваринній моделі астми та алергічного риніту Тваринна модель буде використана, щоб спостерігати за ходом досліджень, що мастоцити нагромаджуються у відповідь на алергічне запалення, та що це може бути блоковане за допомогою антагоністів Н4 рецептора. Сполуки за даним винаходом можуть бути досліджені в цій моделі, щоб продемонструвати їх використання при лікуванні алергічного риніту або астми. В мишах збільшують чутливість за допомогою інтраперитонеальної ін'єкції яєчного альбуміну/квасци (10нг в 0,2мл Аl(ОН)3; 2%) на День 0 та День 14. На День 21 23 мишам зроблять ін'єкцію PBS або яєчного альбуміну, та вб'ють через 24 години після введення на День 24. Ділянка трахеї буде видалена та зафіксована у формаліні. Введення тканини у парафін та продольний розтин трахеї, буде виконаний з подальшим забарвленням мастоцитів толуїдиновим синім. Альтернативно, трахея буде заморожена в ОСТ для кріостатного зрізу, та мастоцити будуть ідентифіковані за допомогою IgE забарвлювання. Мастоцити будуть кількісно визначені як підслизова або під-епітеліальна залежність від їх розташування в межах кожної секції трахеї. Піддавання впливу алергену повинне збільшити кількість під-епітеліальних мастоцитів, та цей ефект буде блокований антагоністами Н4 рецептора. Особливості та переваги винаходу очевидні фахівцю в даній області техніки. Базуючись на цьому описі, включаючи короткий опис, детальний опис, передумови створення винаходу, приклади та формулу, фахівець в даній області техніки буде здатний здійснити модифікації та адаптації до різних умов та використань. Публікації, описані тут, включені за допомогою посилань в повному обсязі. Ці інші втілення винаходу також включені в межі даного винаходу.
ДивитисяДодаткова інформація
Автори англійськоюCarruthers Nicholas I., Dvorak Curt A., Edwards, James, P., Edwards James P., Grice Cheryl A., Grice, Cheryl, A., Jablonowski Jill А., Ly Kiev S., Shan Chandravadan R., Venable Jennifer D.
Назва патенту російськоюГетероциклические соединения
Автори російськоюКаррутерс Николас Л., Дворак Курт А., Эдвардс Джеймс П., Грайс Черил А., Джаблоновски Джилл А., Лай Киев С., Шах Чандравадан Р., Венейбл Дженнифер Д.
МПК / Мітки
МПК: C07D 403/06, C07D 277/68, C07D 451/04, C07D 263/58, C07D 235/24, C07D 471/04
Мітки: сполуки, гетероциклічні
Код посилання
<a href="https://ua.patents.su/21-79309-geterociklichni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні сполуки</a>
Попередній патент: Спосіб дослідження механічних властивостей грунтів на різних глибинах залягання
Наступний патент: Способи одержання сплавів або кераміки з використанням методу армстронга та пристрій для їх здійснення
Випадковий патент: Спосіб визначення параметрів грунту пенетрацією