Гетероциклічні сполуки
Формула / Реферат
1. Профілактичний чи лікувальний засіб при гіперліпідемії, що включає як активний інгредієнт гетероциклічну сполуку формули [1] або її фармацевтично прийнятну сіль:
![]() [1],
[1],
у якій:
R1 є арилом, ароматичною гетероциклічною групою чи циклоалкілом, причому вказаний арил чи ароматична гетероциклічна група є необов'язково заміщеною однаковими чи різними однією-трьома групами, вибраними з алкілу, галоїдалкілу, тригалоїдалкілу, алкоксигрупи, галогену та нітрогрупи,
Het означає двовалентну ароматичну гетероциклічну групу, причому вказана ароматична гетероциклічна група є необов'язково заміщеною алкілом чи тригалоїдалкілом,
D означає алкілен, алкенілен, алкінілен чи групу формули [2]:
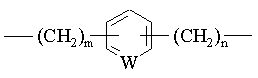 [2],
[2],
де W означає СН чи нітроген, m означає ціле число 1-10 і n означає ціле число 0-9, за умови, що m+n дорівнює цілому числу 1-10, і
Е означає групу формули [3] чи [4]:
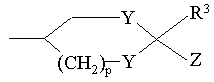 [3],
[3],
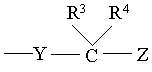 [4],
[4],
де Y означає оксиген чи сульфур, R3 та R4 є однаковими чи різними і означають кожен гідроген чи алкіл, р означає ціле число 0-2, Z означає карбоксигрупу, алкоксикарбоніл, гідроксиметил, карбамоїл, N-гідроксикарбамоїл, N-алкілкарбамоїл, N,N-діалкілкарбамоїл, ціаногрупу, 1Н-5-тетразоліл, 1-алкіл-5-тетразоліл чи 2-алкіл-5-тетразоліл, за умови, що коли D означає групу формули [2], Е не може бути групою формули [4].
2. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 1, у якому D означає алкілен, алкенілен чи алкінілен, що містить 3-10 атомів карбону.
3. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 1, у якому Het означає двовалентну ароматичну гетероциклічну групу формули [5]:
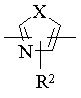 [5],
[5],
де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, і R2 означає гідроген, алкіл чи тригалоїдалкіл.
4. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 1, у якому Het означає двовалентну ароматичну гетероциклічну групу формули [5]:
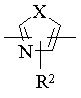 [5],
[5],
де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, і R2 означає гідроген, алкіл чи тригалоїдалкіл,
і D означає алкілен, алкенілен чи алкінілен, що містить 3-10 атомів карбону.
5. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 4, у якому R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену, тригалоїдалкілу та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а]:
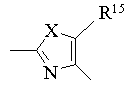 [5a],
[5a],
де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, і R15 означає алкіл чи тригалоїдалкіл,
і D означає алкілен чи алкенілен, що містить 3-7 атомів карбону.
6. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 5, у якому R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену, тригалоїдалкілу та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, R15 означає алкіл чи тригалоїдалкіл, D означає алкілен чи алкенілен, що містить 3-5 атомів карбону, Е означає групу формули [3], у якій р дорівнює 1, Y означає оксиген, R3 означає гідроген чи алкіл і Z означає карбоксигрупу чи алкоксикарбоніл.
7. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 5, у якому R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, R15 означає алкіл чи тригалоїдалкіл, D означає алкілен, алкенілен чи алкінілен, що містить 5-7 атомів карбону, Е означає групу формули [4], у якій Y означає оксиген, R3 та R4 є однаковими чи різними і кожен означає гідроген чи алкіл і Z означає карбоксигрупу чи алкоксикарбоніл.
8. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 6, у якому R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкіл та алкокси, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], у якій Х означає оксиген, R15 означає алкіл, D означає алкілен, що містить 3-5 атомів карбону, Е означає групу формули [3], у якій р дорівнює 1, Y означає оксиген, R3 означає алкіл і Z означає карбоксигрупу.
9. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 7, у якому R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], у якій Х означає оксиген, R15 означає алкіл, D означає алкілен, алкенілен чи алкінілен, що містить 5-7 атомів карбону, Е означає групу формули [4], у якій Y означає оксиген, R3 та R4 є однаковими і означають кожен алкіл, а Z означає карбоксигрупу.
10. Профілактичний чи лікувальний засіб при гіперліпідемії за п. 1, який вибирають з групи, що складається зі сполук:
(1) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексенілокси]пропіонова кислота,
(2) с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота,
(3) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-4-гексинілокси]пропіонова кислота,
(4) 2-ізобутил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота,
(5) 2-етил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота,
(6) 2-метил-с-5-{4-[5-метил-2-(4-трифторметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота,
(7) 2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)-(Е)-3-бутеніл]-1,3-діоксан-r-2-карбонова кислота,
(8) с-5-{4-[2-(4-трет-бутилфеніл)-5-метилоксазол-4-іл]бутил}-2-метил-1,3-діоксан-r-2-карбонова кислота,
(9) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропанол,
(10) 2-метил-2-{6-[5-метил-2-(п-толіл)оксазол-4-іл]гексилокси}пропіонова кислота,
(11) 2-метил-с-5-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота,
(12) 2-метил-с-5-{4-[5-метил-2-(3-фтор-4-метилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота,
(13) 2-метил-с-5-{4-[5-метил-2-(м-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота і
(14) 2-метил-с-5-{4-[5-метил-2-(3,4-диметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-с-2-карбонова кислота.
11. Фармацевтична композиція, що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 2-10, або її фармацевтично прийнятну сіль.
12. Профілактичний чи лікувальний засіб при артеріосклерозі, що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль.
13. Профілактичний чи лікувальний засіб при ішемічній хворобі серця, що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль.
14. Профілактичний чи лікувальний засіб при інфаркті мозку, що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль.
15. Профілактичний чи лікувальний засіб при реоклюзії після черезшкірної транслюмінальної коронарної ангіопластики (РТСА), що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль.
16. Профілактичний чи лікувальний засіб при цукровому діабеті, що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль.
17. Профілактичний чи лікувальний засіб при ожирінні, що містить як активний інгредієнт гетероциклічну сполуку, визначену у будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль.
18. Гетероциклічна сполука формули [1], визначена у п. 1, або її фармацевтично прийнятна сіль, за умови, що сполука формули [1], у якій D означає алкілен, що містить 1-6 атомів карбону, Е означає групу формули [4], у якій Y означає оксиген, є виключеною.
19. Гетероциклічна сполука за п. 18, у якій D означає алкілен, алкенілен чи алкінілен, що містить 3-10 атомів карбону, або її фармацевтично прийнятна сіль.
20. Гетероциклічна сполука за п. 18, у якій Het означає двовалентну ароматичну гетероциклічну групу формули [5]:
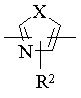 [5],
[5],
де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, і R2 означає гідроген, алкіл чи тригалоїдалкіл, або її фармацевтично прийнятна сіль.
21. Гетероциклічна сполука за п. 18, у якій Нet означає двовалентну ароматичну гетероциклічну групу формули [5]:
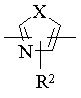 [5],
[5],
де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, і R2 означає гідроген, алкіл чи тригалоїдалкіл, a D означає алкілен, алкенілен чи алкінілен, що містить 3-10 атомів карбону, або її фармацевтично прийнятна сіль.
22. Гетероциклічна сполука за п. 21, у якій Het означає двовалентну ароматичну гетероциклічну групу формули [5а]:
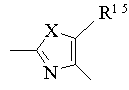 [5а],
[5а],
де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, і R15 означає алкіл чи тригалоїдалкіл, а D означає алкілен чи алкенілен, що містить 3-7 атомів карбону, або її фармацевтично прийнятна сіль.
23. Гетероциклічна сполука за п. 21, у якій R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену, тригалоїдалкілу та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], де Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, R15 означає алкіл чи тригалоїдалкіл, і D означає алкілен чи алкенілен, що містить 3-5 атомів карбону, Е означає групу формули [3], у якій р дорівнює 1, Y означає оксиген, R3 означає гідроген чи алкіл, і Z означає карбокси чи алкоксикарбоніл, або її фармацевтично прийнятна сіль.
24. Гетероциклічна сполука за п. 22, у якій R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], у якій Х означає оксиген, сульфур чи NR6, R6 означає гідроген чи алкіл, R15 означає алкіл чи тригалоїдалкіл, а D означає алкілен, алкенілен чи алкінілен, що містить 7 атомів карбону, Е означає групу формули [4], у якій Y означає оксиген, R3 та R4 є однаковими чи різними і позначають кожен гідроген чи алкіл, і Z означає карбокси чи алкоксикарбоніл, або її фармацевтично прийнятна сіль.
25. Гетероциклічна сполука за п. 23, у якій R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], у якій Х означає оксиген, R15 означає алкіл, a D означає алкілен, що містить 3-5 атомів карбону, Е означає групу формули [3], у якій р дорівнює 1, Y означає оксиген, R3 означає алкіл, і Z означає карбоксигрупу, або її фармацевтично прийнятна сіль.
26. Гетероциклічна сполука за п. 24, у якій R1 означає феніл, необов'язково заміщений однією-двома групами, вибраними з алкілу, галогену та алкоксигрупи, Het означає двовалентну ароматичну гетероциклічну групу формули [5а], у якій Х означає оксиген, R15 означає алкіл, а D означає алкілен, алкенілен чи алкінілен, що містить 7 атомів карбону, Е означає групу формули [4], у якій Y означає оксиген, R3 та R4 є однаковими і означають кожен алкіл, і Z означає карбоксигрупу, або її фармацевтично прийнятна сіль.
27. Гетероциклічна сполука за п. 18, яку вибирають з групи, що складається зі сполук:
(1) с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота,
(2) 2-ізобутил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота,
(3) 2-етил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота,
(4) 2-метил-с-5-{4-[5-метил-2-(4-трифторметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота,
(5) 2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)-(Е)-3-бутеніл]-1,3-діоксан-r-2-карбонова кислота,
(6) с-5-{4-[2-(4-трет-бутилфеніл)-5-метилоксазол-4-іл]бутил}-2-метил-1,3-діоксан-r-2-карбонова кислота,
(7) 2-метил-с-5-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота,
(8) 2-метил-с-5-{4-[5-метил-2-(3-фтор-4-метилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота,
(9) 2-метил-с-5-{4-[5-метил-2-(м-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота і
(10) 2-метил-с-5-{4-[5-метил-2-(3,4-диметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонова кислота, або її фармацевтично прийнятна сіль.
28. Гетероциклічна сполука, вибрана з групи, що складається зі сполук:
(1) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропіонова кислота,
(2) метил-2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропіонат,
(3) 2-метил-2-[6-(5-метил-2-(п-толіл)оксазол-4-іл)гексилокси]пропіонова кислота,
(4) метил-2-метил-2-[6-(5-метил-2-(п-толіл)оксазол-4-іл)гексилокси]пропіонат,
(5) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-4-гексинілокси]пропіонова кислота,
(6) метил-2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-4-гексинілокси]пропіонат,
(7) 2-{6-[2-(4-хлорфеніл)-5-метилоксазол-4-іл]гексилокси}-2-метилпропіонова кислота,
(8) метил-2-{6-[2-(4-хлорфеніл)-5-метилоксазол-4-іл]гексилокси}-2-метилпропіонат,
(9) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексенілокси]пропіонова кислота,
(10) метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексенілокси]-2-метилпропіонат і
(11) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропанол, або її фармацевтично прийнятна сіль.
29. Гетероциклічна сполука за п. 28, яку вибирають з групи, що складається з:
(1) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропіонової кислоти,
(2) 2-метил-2-[6-(5-метил-2-(п-толіл)оксазол-4-іл)гексилокси]пропіонової кислоти,
(3) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-4-гексинілокси]пропіонової кислоти,
(4) 2-{6-[2-(4-хлорфеніл)-5-метилоксазол-4-іл]гексилокси}-2-метилпропіонової кислоти,
(5) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексинілокси]пропіонової кислоти і
(6) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропанолу, або її фармацевтично прийнятна сіль.
Текст
Даний винахід стосується нових гетероциклічних сполук та їхніх фармацевтично прийнятних солей. Сполуки за даним винаходом мають здатність знижувати рівень тригліцеридів у крові, здатність до зниження ліпопротеїду низької густини - холестерину (тут та надалі - "LDL-C"), а також здатність до зниження глюкози крові, здатність до зниження інсуліну крові або здатність до підвищення холестерину ліпопротеїдів високої густини (тат та надалі - "HDL-C"), здатність до зниження атерогенного індексу, який визначається як відношення не-HDL-C до HDL-C і обчислюється за формулою: (загальний холестерин - HDL-C)/(HDL-C). Таким чином, сполуки за даним винаходом є корисними для лікування хвороби коронарної артерії, інфаркту головного мозку, гіперліпідемії, артеріосклерозу чи цукрового діабету. Синдром інсулінорезистентності, ускладнений розладом метаболізму вуглеводів та/або ліпідів та гіпертензією, привертає увагу як мультиризикова група з високою частотою ішемічної хвороби серця. Синдром інсулінорезистентності виявлений у більшості пацієнтів, що страждають на ожиріння та інсуліннезалежний цукровий діабет (NIDDM). Розлад метаболізму ліпідів визначається тут як підвищення три гліцериді о крові, спричинене переважно підвищенням хіломікронів, ліпогротеїдів дуже низької густини та залишкових ліпопротеїдів, що є їхніми проміжними метаболітами, та зниженням HDL-C (Diabetes, 37, 1595-1607 (1988); Arch, intern. Med., 149, 1514-1520 (1989); Diabetes Care, 14, 173-194 (1991)). Хоч часто стверджувалося, що рівень тригліцеридів у крові є, можливо, важливим фактором ризику артеріосклеротичних хвороб, чіткого взаємозв'язку не було встановлено. Повідомлялося, однак, на основі нещодавно одержаних з використанням артеріографії результатів, що вказаний рівень є незалежним фактором ризику ішемічної хвороби серця (Circulation, 90, 2230-2235 (1994)). Добре відомо, що за результатами численних епідеміологічних досліджень рівень HDL-C негативно корелює з поширеністю ішемічних захворювань серця (Circulation, 79, 8-15 (1989)). Вважають, що HDL бере участь у зворотному транспорті холестерину до печінки з позапечінкових тканин і демонструє антиартеріосклеротичний ефект в експериментах з тваринною моделлю (J. СІіn. Invest, 85, 1234-1241 (1990); Nature, 353, 265-267 (1991)). Було підтверджено великомасштабними випробуваннями з втручанням, що рівень загального холестерину крові, особливо рівень LDL-C, позитивно корелює з поширеністю ішемічних захворювань серця, і що вказана частота захворювань може бути знижена шляхом зниження рівня (Lipid Research Clinics Program: JAMA, 251, 351 (1984); Lipid Research Clinics Program: JAMA, 251, 365 (1984)). Отже, сполуки, які знижують рівень тригліцериду у крові та рівень LDL-C, a також підвищують рівень HDLC чи знижують атерогенний індекс, є корисними як ліки для артеріосклерозу, особливо для профілактики чи лікування ішемічних хвороб серця. Крім того, очікується, що сполуки, які поліпшують інсулінорезистентність, знижують рівень глюкози крові та рівень інсуліну крові і поліпшують патологічні стани таких ускладнень, як цукровий діабет, гіперінсулінемія, гіпертензія та ожиріння, що можуть бути факторами ризику артеріосклеротичних захворювань, і тим самим виявляють ефективну профілактичну чи лікувальну дію при артеріосклерозі. Таким чином, було відомо, що 2-арил-5-алкілоксазольні похідні чи 2-арил-5-алкілтіазольні похідні загальної формули (А), які мають певний ступінь подібності до сполук за даним винаходом, виявляють ефект зниження ліпідів крові чи ефект зниження глюкози крові. у якій: кільце Аr1 є арилом; V позначає оксиген чи сульфур; Аk1 позначає гідроген, алкіл чи галоїдалкіл; Аk2 позначає алкілен; Аk3 позначає алкілен, алкенілен чи алкінілен, необов'язково заміщений алкоксигрупою, алкоксикарбонілом, ацилтіогрупою, ациламіногрупою чи арилом; Q позначає карбоксигрупу, 2,4-оксазоліндіон5-іл, 2,4-тіазоліндіон-5-іл чи 1,2,4-оксадіазолідин-3,5-діон-2-іл; кільце Аr2 ε групою формули [В1] чи [В2]. Наприклад, в документах USP 5532256, WO 96/05186, JP H7-188227 A, JP S61-85372 та USP 5401761 повідомляється, що сполуки, які підпадають під загальну формулу (А), а саме похідні 2,4-тіазолідиндіону, виявляють ефект зниження ліпідів крові чи ефект зниження глюкози крові. В документах JP Н9-124623 A, WO 95/18125, JP H7-165735 A, USP 5468762 та JP H8-92228 повідомляється, що сполуки, які підпадають під загальну формулу (А), а саме похідні 2,4-оксазолідиндіону, виявляють ефект зниження ліпідів крові чи ефект зниження глюкози крові. В документах USP 5510360 та USP 5480896 повідомляється, що сполуки, які підпадають під загальну формулу (А), а саме похідні 1,2,4-оксадіазолідин-3,5-діону, виявляють ефект зниження ліпідів крові чи ефект зниження глюкози крові. В документах WO 99/462325, WO 98/00137, WO 97/31907, WO 96/38415, JP Н9-323982 A, JP H8-325264 A, JP H5-507920 A, USP 5510360 та USP 5480896 повідомляється, що сполуки, які підпадають під загальну формулу (А), а саме похідні карбонової кислоти, виявляють ефект зниження ліпідів крові чи ефект зниження глюкози крові. Сполука загальної формули (А) характеризується тим, що вона має: (1) 2-арил-5-алкілоксазольне кільце чи 2-арил-5-алкілтіазольне кільце з одного кінця; (2) карбоксигрупу, 2,4-оксазоліндіон-5-іл, 2,4-тіазоліндіон-5-іл чи 1,2,4-оксадіазолідин-3,5-діон-2-іл з другого кінця; і (3) ароматичне кільце, таке як бензольне, представлене кільцем Аr2, у молекулі. дію. Крім того, ЕР-А-220573 повідомляє, що оксазольні похідні загальної формули (В) виявляють антиартритну у якій: Аr3 позначає заміщений феніл чи тієніл; R23 позначає гідроген чи алкіл; Аk4 позначає алкілен, який містить 1-2 атоми карбону: кожен з R24 та R25 позначає алкіл; Q1 позначає карбоксигрупу, алкоксикарбоніл, карбамоїл, N-алкілкарбамоїл чи Ν,Ν-діалкілкарбамоїл. Однією з цілей даного винаходу є створення чудового профілактичного чи терапевтичного агента для гіперліпідемії, артеріосклерозу, цукрового діабету, гіпертензії, ожиріння і т.п., який виявляє ефект зниження тригліцеридів крові, ефект зниження LDL-C, а також ефект зниження глюкози крові, ефект зниження інсуліну крові чи ефект підвищення HDL-C, ефект зниження атерогенного індексу. Автори даного винаходу провели великий обсяг досліджень для досягнення зазначеної вище мети і знайшли, що гетероциклічні сполуки наведеної нижче формули [1] забезпечують досягнення цієї мети та утворюють даний винахід. Таким чином, даний винахід пропонує гетероциклічну сполуку наведеної нижче формули [1] чи її фармацевтично прийнятні солі та фармацевтичну композицію, що включає її як активний інгредієнт. у якій: R1 позначає арил, ароматичну гетероциклічну групу чи циклоалкіл, причому вказаний арил чи ароматична гетероциклічна група необов'язково заміщені однаковими чи різними однією-трьома групами, обраними з алкілу, галоїдалкілу, тригалоїдалкілу, алкоксигрупи, галогену та нітрогрупи; Het позначає двовалентну ароматичну гетероциклічну групу, причому вказана ароматична гетероциклічна група є необов'язково заміщеною алкілом чи тригалоїдалкілом; D позначає алкілен, алкенілен, алкінілен чи групу формули [2]: де W позначає СН чи нітроген, m позначає ціле число 1-10, і n позначає ціле число 0-9, за умови, що m+n дорівнює цілому числу 1-10; і Ε позначає групу формули [3] чи [4]: де Υ позначає оксиген чи сульфур; R3 та R4 є однаковими чи різними і позначають кожен гідроген чи алкіл; ρ є цілим числом 0-2; Ζ позначає карбоксигрупу, алкоксикарбоніл, гідроксиметил, карбамоїл, Nгідроксикарбамоїл, Ν-алкілкарбамоїл, Ν,Ν-діалкілкарбамоїл, ціаногрупу, 1Н-5-тетразоліл, 1-алкіл-5-тетразоліл чи 2-алкіл-5-тетразоліл, за умови, що коли D позначає групу формули [2], Ε не може бути гр упою формули [4]. Поміж гетероциклічних сполук формули [1] ті, у яких Het позначає групу формули [5z]: де R22 позначає гідроген, алкіл чи тригалоїдалкіл, D позначає алкілен, що містить 1-2 атоми карбону, Ε позначає групу формули [4] і Υ позначає оксиген, включають відомі сполуки. Однак, автори даного винаходу уперше знайшли, що сполуки формули [1] виявляють ефект зниження тригліцеридів крові, ефект зниження LDL-C, а також ефект зниження глюкози крові, ефект зниження інсуліну крові чи ефект підвищення HDL-C, ефект зниження атерогенного індексу. Гетероциклічн сполуки [1], що відрізняються від сполук формули [1], у якій Het позначає групу формули [5z], D позначає алкілен, що містить 1-2 атоми карбону, R22 позначає гідроген, алкіл чи тригалоїдалкіл, Ε позначає групу формули [4] і Υ позначає оксиген, є новими сполуками, що не були досі описані у жодному документі. Поміж сполук [1] за даним винаходом кращими є ті, у яких D позначає алкілен, алкенілен чи алкінілен, що містить 3-10 атомів карбону. Іншими кращими сполуками є ті, у яких Het позначає двовалентну ароматичну гетероциклічну груп у формули [5]: де X позначає оксиген, сульфур чи NR6, R6 позначає гідроген чи алкіл, R2 позначає гідроген, алкіл чи тригалоїдалкіл. Ще кращими сполуками поміж сполук [1] за даним винаходом є ті, у яких Het позначає двовалентну ароматичну гетероциклічну групу формули [5], X позначає оксиген, сульфур чи NR6, R6 позначає гідроген чи алкіл, R2 позначає гідроген, алкіл чи тригалоїдалкіл, і D позначає алкілен, алкенілен чи алкінілен, що містить 310 атомів карбону. Ще кращими сполуками поміж сполук [1] за даним винаходом є ті, у яких R 1 позначає феніл, необов'язково заміщений однією-двома групами, обраними з алкілу, галогену, тригалоїдалкілу та алкоксигрупи; Het позначає двовалентну ароматичну гетероциклічну гр упу формули [5а]: де X має значення, визначені вище, a R15 позначає алкіл чи тригалоїдалкіл; і D позначає алкілен чи алкенілен, що містить 3-7 атомів карбону. Ще більш кращими сполуками поміж сполук [1] за даним винаходом є, по-перше, ті, у яких R 1 позначає феніл, необов'язково заміщений однією-двома групами, обраними з алкілу, галогену, тригалоїдалкілу та алкоксигрупи, Het позначає двовалентну ароматичну гетероциклічну груп у формули [5а], X позначає оксиген, сульфур чи NR6, R6 позначає гідроген чи алкіл, R15 позначає алкіл чи тригалоїдалкіл, D позначає алкілен чи алкенілен, що містить 3-5 атомів карбону, Ε позначає групу формули [3], p дорівнює 1, Υ позначає оксиген, R3 позначає гідроген чи алкіл, і Ζ позначає карбоксигрупу чи алкоксикарбоніл; і по-друге, ті, у яких R1 позначає феніл, необов'язково заміщений однією-двома групами, обраними з алкілу, галогену та алкоксигрупи, Het позначає двовалентну ароматичну гетероциклічну груп у формули [5а], X позначає оксиген, сульфур чи NR6, R6 позначає гідроген чи алкіл, R15 позначає алкіл чи тригалоїдалкіл, D позначає алкілен, алкенілен чи алкінілен, що містить 5-7 атомів карбону, Ε позначає груп у формули [4], Υ позначає оксиген, R3 та R4 є однаковими чи різними і позначають кожен гідроген чи алкіл, a Z позначає карбоксигрупу чи алкоксикарбоніл. Особливо кращими сполуками поміж сполук [1] за даним винаходом є, по-перше, ті, у яких R 1 позначає феніл, необов'язково заміщений однією-двома групами, обраними з алкілу та алкоксигрупи, Het позначає двовалентну ароматичну гетероциклічну групу формули [5а], X позначає оксиген, R15 позначає алкіл, D позначає алкілен, що містить 3-5 атомів карбону, Ε позначає групу формули [3], p дорівнює 1, Υ позначає оксиген, R3 позначає алкіл і Ζ позначає карбокси; та, по-друге, ті, у яких R1 позначає феніл, необов'язково заміщений однією-двома групами, обраними з алкілу, галогену та алкоксигрупи, Het позначає двовалентну ароматичну гетероциклічну групу формули [5а], X позначає оксиген, R15 позначає алкіл, D позначає алкілен, алкенілен чи алкінілен, що містить 5-7 атомів карбону, Ε позначає групу формули [4], Υ позначає оксиген, R3 та R4 є однаковими і позначають кожен алкіл, a Z позначає карбоксигрупу. Конкретні приклади кращих сполук [1] за даним винаходом включають такі гетероциклічні сполуки (1)-(14) чи їхні фармацевтично прийнятні солі: (1) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексенілокси]пропіонову кислоту, (2) с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонову кислоту, (3) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-4-гексинілокси]пропіонову кислоту, (4) 2-ізобутил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонову кислоту, (5) 2-етил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонову кислоту, (6) 2-метил-с-5-{4-[5-метил-2-(4-трифторметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонову кислоту, (7) 2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)-(Е)-3-бутеніл]-1,3-діоксан-r-2-карбонову кислоту, (8) с-5-{4-[2-(4-трет-бутилфеніл)-5-метилоксазол-4-іл]бутил}-2-метил-1,3-діоксан-r-2-карбонову кислоту, (9) 2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропанол, (10) 2-метил-2-{6-[5-метил-2-(п-толіл)оксазол-4-іл]гексилокси]пропіонову кислоту, (11) 2-метил-с-5-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонову кислоту, (12) 2-метил-с-5-{4-[5-метил-2-(3-фтор-4-метилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонову кислоту, (13) 2-метил-с-5-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонову кислоту, (14) 2-метил-с-5-{4-[5-метил-2-(3,4-диметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбонову кислоту. В цілях даного винаходу, термін "алкіл", що використовується тут, позначає алкільну групу з прямим чи розгалуженим ланцюгом, що містить від 1 до 7 атомів карбону, наприклад, метил, етил, н-пропіл, ізопропіл, нбутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, н-гексил, ізогексил, н-гептил та ізогептил. Кращими є алкільні групи з лінійним ланцюгом, які містять від 1 до 3 атомів карбону, наприклад, метил, етил та н-пропіл. Приклади алкільного фрагмента груп "галоїдалкіл", "тригалоїдалкіл", "алкоксигрупа", "алкоксикарбоніл", "N-алкілкарбамоїл", "Ν,Ν-діалкілкарбамоїл", "1-алкіл-5-тетразоліл" та "2-алкіл-5-тетразоліл" включають алкільні групи, як вони були визначені вище. Термін "циклоалкіл" позначає циклоалкільну групц, що містить від 4 до 8 атомів карбону, наприклад, циклобутил, циклопентил, циклогексил, циклогептил та циклооктил. Кращими є циклоалкільні групи, що містять від 5 до 7 атомів карбону. Термін "алкілен" позначає алкіленову гр упу з прямим чи розгалуженим ланцюгом, що містить від 1 до 10 атомів карбону, наприклад, метилен, етилен, 1-метилетилен, 2-метилетилен, триметилен, тетраметилен, пентаметилен, гексаметилен, гептаметилен, октаметилен, нонаметилен та декаметилен. Кращими є алкіленові групи, що містять від 3 до 10 атомів карбону, а ще кращими - ті, що містять від 3 до 7 атомів карбону. Термін "алкенілен" позначає алкеніленову груп у з прямим чи розгалуженим ланцюгом, що містить від 2 до 10 атомів карбону, наприклад, етенілен, 1-пропенілен, 2-пропенілен, 1-бутенілен, 2-бутенілен, 3-бутенілен, 1пентенілен, 2-пентенілен, 3-пентенілен, 4-пентенілен, 4-метил-3-пентенілен, 1-гексенілен, 2-гексенілен, 3гексенілен, 4-гексенілен, 5-гексенілен, 1-гептенілен, 2-гептенілен, 3-гептенілен, 4-гептенілен, 5-гептенілен, 6гептенілен, 1-октенілен, 2-октенілен, 3-октенілен, 4-октенілен, 5-октенілен, 6-октенілен, 7-октенілен, 1ноненілен, 2-ноненілен, 3-ноненілен, 4-ноненілен, 5-ноненілен, 6-ноненілен, 7-ноненілен, 8-ноненілен, 1деценілен, 2-деценілен, 3-деценілен, 4-деценілен, 5-деценілен, 6-деценілен, 7-деценілен, 8-деценілен та 9деценілен. Кращими є алкеніленові групи, що містять від 3 до 10 атомі карбону, а ще кращими - ті, що містять від 3 до 7 атомів карбону. Термін "алкінілен" позначає алкініленову груп у з прямим чи розгалуженим ланцюгом, що містить від 2 до 10 атомів карбону, наприклад, етинілен, 1-пропінілен, 2-пропінілен, 1-бутинілен, 2-бутинілен, 3-бутинілен, 1пентинілен, 2-пентинілен, 3-пентинілен, 4-пентинілен, 2-метил-3-пентинілен, 1-гексинілен, 2-гексинілен, 3гексинілен, 4-гексинілен, 5-гексинілен, 1-гептинілен, 2-гептинілен, 3-гептинілен, 4-гептинілен, 5-гептинілен, 6гептинілен, 1-октинілен, 2-октинілен, 3-октинілен, 4-октинілен, 5-октинілен, 6-октинілен, 7-октинілен, 1нонінілен, 2-нонінілен, 3-нонінілен, 4-нонінілен, 5-нонінілен, 6-нонінілен, 7-нонінілен, 8-нонінілен, 1-децинілен, 2-децинілен, 3-децинілен, 4-децинілен, 5-децинілен, 6-децинілен, 7-децинілен, 8-децинілен та 9-децинілен. Кращими є алкініленові групи, що містять від 3 до 10 атомів карбону, а ще кращими - ті, що містять від 3 до 7 атомів карбону. Термін "арил" позначає арильну групу, що містить від 6 до 10 атомів карбону, наприклад, феніл, 1-нафтил та 2-нафтил, а кращим є феніл. Термін "ароматичне гетероциклічне кільце" позначає 5-6-членне ароматичне кільце, що містить від 1 до 4 гетероатомів, обраних з нітрогену, оксигену та сульфур у, або таке кільце, конденсоване з бензольним кільцем. Приклади включають 1-піроліл, 2-піроліл, 3-піроліл, 3-індоліл, 2-фурил, 3-фурил, 3-бензофураніл, 2-тієніл, 3тієніл, 3-бензотієніл, 2-оксазоліл, 2-тіазоліл, 2-бензотіазоліл, 2-імідазоліл, 4-імідазоліл, 2-бензімідазоліл, 1Н1,2,4-триазол-1-іл, 1Н-тетразол-5-іл, 2-піридил, 3-піридил, 4-піридил, піридин-1-оксид-2-ил, піридин-1-оксид-3ил, піридин-1-оксид-4-ил, 2-піримідиніл, 4-піримідиніл, 2-піразиніл, 1,3,5-триазин-2-іл. Термін "двовалентне ароматичне гетероциклічне кільце" позначає 5-6-членне ароматичне кільце, яке містить від 1 до 4 гетероатомів, обраних з нітрогену, оксигену та сульфур у, або таке кільце, конденсоване з бензольним кільцем. Приклади включають піролілен, індолілен, фуранілен, бензофуранілен, тієнілен, бензотієнілен; оксазолілен, тіазолілен, бензотіазолілен, імідазолілен, бензімідазолілен, 1Н-1,2,4-триазолілен, піридинілен, піримідинілен, піразинілен та 1,3,5-триазинілен. Приклади "галогену" включають фтор, хлор, бром та йод. Приклади галоїдного фрагменту "галоїдалкілу" та "тригалоїдалкілу" включають галоген, як він був визначений вище. Конкретні приклади "тригалоїдалкілу" включають трифторметил, трихлорметил, 2, 2, 2-трифторетил та 2, 2, 2-трихлоретил. Сполуки [1] за даним винаходом можуть бути одержані за методиками, описаними нижче чи у робочих Прикладах. СПОСІБ А Сполука [1а] за даним винаходом, у якій Ε позначає групу формули [3], a Z позначає алкоксикарбоніл, може бути одержана шляхом проведення реакції сполуки [11] та сполуки [22]. де R1, Het, D, Υ, ρ та R3 мають значення, які було визначено вище, a R11 позначає алкіл. Загалом, реакція може бути проведена у відповідному розчиннику (наприклад, полярному розчиннику, такому як ацетонітрил чи Ν,Ν-диметилформамід (ДМФ), е фірному розчиннику, такому як тетрагідрофуран (ТГФ) чи діетиловий ефір, галогенованому вугле водневому розчиннику, такому як хлороформ чи дихлорметан, складноефірному розчиннику, такому як метилацетат чи етилацетат, вуглеводневому розчиннику, такому як бензол, толуол чи н-гексан, чи їхній суміші), у присутності кислоти Льюїса (наприклад, бортрифторефіратний комплекс) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [11] та сполуки [22], або температури реакції, загалом придатними значеннями будуть від 30 хвилин до 24 годин. Сполука [22] краще використовується у кількості від 1 до 5 молей на один моль сполуки [11]. СПОСІБ В Сполука [1b] за даним винаходом, у якій Ε позначає групу формули [4], a Z позначає карбоксигрупу, може бути одержана шляхом проведення реакції сполуки [12] та сполуки [13], з наступною обробкою кислотою. де R1, Het, Y, R 3 та R4 мають значення, які було визначено вище, L позначає відхідну гр упу, таку як галоген, метансульфонілоксигрупу чи толуолсульфонілоксигрупу, Τ позначає галоген, R13 та R14 є однаковими чи різними і позначають кожен алкіл, D1 позначає алкілен, алкенілен чи алкінілен, що має на один атом карбону менше, ніж D (D має таке саме значення, як було визначено вище). Сполука [14] може бути одержана, загалом, шляхом обробки сполуки [13] металевим реагентом, таким як бутиллітій чи -магній, з наступним проведенням реакції зі сполукою [12] у присутності йодиду міді чи броміду міді при температурі від -80 до 150°С, у апротонному розчиннику (наприклад, полярному розчиннику, такому як ацетонітрил чи Ν,Ν-диметилформамід (ДМФ), е фірному розчиннику, такому як тетрагідрофуран (ТГФ) чи діетиловий ефір, галогенованому вуглеводневому розчиннику, такому як хлороформ чи дихлорметан, складноефірному розчиннику, такому як метилацетат чи етилацетат, вуглеводневому розчиннику, такому як бензол, толуол чи н-гексан, чи їхній суміші). Хоч час реакції змінюється у залежності від виду сполуки [12], сполуки [13] та металевого реагенту чи температури реакції, загалом він зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Металевий реагент та сполука [12] краще використовуються у кількості від 1 до 1,2 молей на один моль сполуки [13]. Сполука [1b] може бути, загалом, одержана шляхом обробки сполуки [14] кислотою (наприклад, хлористоводневою кислотою) у спиртовому розчиннику (наприклад, метанол чи етанол) при температурі від 80 до 80°С протягом часу від 5 хвилин до 24 годин. СПОСІБ С Сполука [1с], у якій D позначає алкенілен, приєднаний до Het фрагментом з ненасиченим зв'язком, може бути одержана за реакцією Віттіга з використанням сполуки [15] та сполуки [16]. де R1, Het, Ε та Τ мають значення, визначені вище, Ph позначає феніл, D2 позначає алкенілен, що містить на два атоми карбону менше, ніж D (D має значення, визначене вище), чи груп у формули [2] вище. Реакція може бути проведена, загалом, у розчиннику, подібному до того, що використовується у Способі вище, у присутності основи (наприклад, гідроксиду натрію) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [15] та сполуки [16] чи температури реакції, загалом, придатні значення знаходяться в інтервалі від 30 хвилин до 24 годин. Сполука [16] краще використовується у кількості від 1 до 1,2 молей на один моль сполуки [15]. СПОСІБ D Сполука [1d] за даним винаходом, у якій Het позначає групу формули [5а]; де X та R15 мають значення, визначені вище, Ε позначає групу формули [3] чи [4], a Z позначає алкоксикарбоніл, може бути також одержана шляхом проведення реакції сполуки [17] з оксихлоридом фосфор у, тіонілхлоридом, пентоксидом фосфор у, реагентом Деві-метилом - (2,4-біс(метилтіо)-1,3-дитіа-2,4дифосфетан-2,4-дисульфідом), реагентом Лоусона - (2,4-біс(4-метоксифеніл)-1,3-дитіа-2,4-дифосфетан-2,4дисульфідом), аміаком чи алкіламіном. Якщо використовуються оксихлорид фосфору, тіонілхлорид чи пентоксид фосфору, то можуть бути одержані оксазольні похідні, якщо використовуються реагент Деві-метил чи реагент Лоусона, можуть бути одержані тіазольні похідні, а якщо використовуються аміак чи алкіламін, то можуть бути одержані імідазольні похідні. де R1, D та R15 мають значення, визначені вище, а Е1 позначає групу формули [31] чи [41]: де R3, R4, R11 , Υ та ρ мають значення, визначені вище. Загалом, реакція може бути проведена у відповідному розчиннику (наприклад, вуглеводневому розчиннику, такому як бензол, толуол чи ксилол, галогенованому вуглеводневому розчиннику, такому як хлороформ чи дихлорметан, полярному розчиннику, такому як Ν,Ν-диметилформамід (ДМФ), ефірному розчиннику, такому як, тетрагідрофуран (ТГФ) чи діетиловий ефір, або оцтовій кислоті, чи їхній суміші) при температурі від -10 до 200°С. Хоч час реакції змінюється у залежності від виду реагенту (наприклад, оксихлорид фосфору, реагент Лоусона, алкіламін), виду сполуки [17] чи температури реакції, він загалом придатно знаходиться в інтервалі від 30 хвилин до 24 годин. Оксихлорид фосфору, тіонілхлорид, пентоксид фосфор у, реагент Деві-метил, реагент Лоусона, аміак чи алкіламін краще використовуються у кількості від 1 до 10 молей на один моль сполуки [17]. СПОСІБ Ε Сполука [1е] за даним винаходом, у якій Het позначає групу формули [5а] вище, Ε позначає групу формули [4] і Ζ позначає алкоксикарбоніл, може також бути одержана шляхом проведення реакції сполуки [18] та сполуки [19]. де R1, R3, R4, R 11, R15 , X, Y, L та D1 мають значення, визначені вище. Реакція може бути проведена, загалом, у розчиннику, подібному до того, що використовується у Способі А вище, у присутності основи (наприклад, гідриду натрію чи карбонату натрію) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [18] та сполуки [19] чи температури реакції, він загалом придатно знаходиться в інтервалі від 30 хвилин до 24 годин. Сполука [19] краще використовується у кількості від 1 до 1,2 молей на один моль сполуки [18]. СПОСІБ F Сполука [1d] за даним винаходом, у якій Het позначає групу формули [5а] ви ще, може також бути одержана шляхом проведення реакції сполуки [20] та сполуки [21]. де R1, R15 , D, Ε 1 та X мають значення, визначені вище, a L1 позначає хлор чи бром. Реакція може бути проведена, загалом, без розчинника чи у розчиннику, подібному до того, що використовується у Способі А вище, у присутності основи (наприклад, гідриду натрію чи карбонату натрію) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [20] та сполуки [21] чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Сполука [21] краще використовується у кількості від 1 до 1,2 молей на один моль сполуки [20]. СПОСІБ G Сполука [1h] за даним винаходом, у якій Ζ позначає карбоксигрупу, може бути одержана шляхом гідролізу сполуки [1g] за даним винаходом, у якій Ζ позначає алкоксикарбоніл. Сполука [1g] за даним винаходом може бути одержана шляхом надання змоги сполуці [1h] за даним винаходом конденсуватися зі спиртом [73] чи вступити до реакції з алкілувальним агентом. Крім того, сполука [1і] за даним винаходом, у якій Ζ позначає карбамоїл, Ν-гідроксикарбамоїл, Nалкілкарбамоїл чи Ν,Ν-діалкілкарбамоїл, може бути одержана шляхом проведення реакції сполуки [1h] за даним винаходом зі сполукою [82], тобто, аміаком, гідроксиламіном, алкіламіном чи діалкіламіном. де R1, R11, Het, D та Ε1 мають значення, визначені вище; R7 позначає гідроген і R8 позначає гідроген, гідроксильну групу чи алкіл, або R7 позначає алкіл і R8 позначає алкіл; Е2 позначає групу формули [32] чи [42]; Е3 позначає групу формули [33] чи [43]: де R3, R4, R7, R 8, Υ та ρ мають значення, визначені вище. Гідроліз сполуки [1g] може загалом бути проведений у змішаному розчиннику, що складається зі спиртового розчинника, такого як метанол, етанол, ізопропанол чи трет-бутиловий спирт, та води у присутності кислоти (наприклад, хлористоводневої кислоти, сірчаної кислоти чи п-толуолсульфокислоти) чи основи (наприклад, гідроксид натрію чи гідроксид калію) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [1g] чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Кислота чи основа краще використовуються у кількості від 1 до 20 молей на один моль сполуки [1g]. Конденсація між сполукою [1h] та спиртом [73] може бути, загалом, проведена з використанням спирту як розчиннику у присутності кислоти (наприклад, хлористоводневої кислоти, сірчаної кислоти чи птолуолсульфокислоти) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [1h], виду спирту чи температури реакції, він загалом зручно находиться в інтервалі від 30 хвилин до 24 годин. Кислота краще використовується у кількості від 0,1 до 1,2 молей на 1 моль сполуки [1h]. Зазначена реакція конденсації може також бути проведена у розчиннику, подібному до того, що використовується у Способі А вище, у присутності агента конденсації (наприклад, Ν,Ν'дициклогексилкарбодіімід чи 1,1'-карбонілдіімідазол) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [1h], виду спирту чи агента конденсації, чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Агент конденсації краще використовується у кількості від 1 до 1,2 молей на 1 моль сполуки [1h]. Реакція між сполукою [1h] та алкілувальним агентом (наприклад, триметилсилілдіазометан/метанол, метилйодид) може бути проведена у розчиннику, подібному до того, що використовується у Способі А вище при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [1h], виду алкілувального агента чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Алкілувальний агент краще використовується у кількості від 1 до 2 молей на 1 моль сполуки [1h]. Реакція між сполукою [1h] та сполукою [82] може бути проведена у спосіб, аналогічний до зазначеної реакції конденсації між сполукою [1h] та спиртом [73]. Крім того, сполука [1i] за даним винаходом може бути одержана шляхом проведення реакції реакційноздатного похідного сполуки [1h] та сполуки [82] у спосіб, відомий фахівцям. Приклади реакційноздатних похідних включають реагенти, що загалом використовуються в амідуванні, такі як галоїдангідриди кислот (хлорангідрид кислоти чи бромангідрид кислоти), змішаний ангідрид кислоти, активований амід і т.п. Наприклад, якщо як реакційноздатне похідне використовується галоїдангідрид кислоти, то реакція може бути проведена у апротонному розчиннику (наприклад, полярному розчиннику, такому як ацетонітрил чи Ν,Νдиметилформамід (ДМФ), е фірному розчиннику, такому як тетрагідрофуран (ТГФ) чи діетиловий ефір, галогенованому вуглеводневому розчиннику, такому як хлороформ чи дихлорметан, вуглеводневому розчиннику, такому як бензол, толуол чи н-гексан, або їхній суміші) у присутності основи (наприклад, карбонату калію, карбонату натрію, бікарбонату натрію, бікарбонату калію, піридину, 4-диметиламінопіридину, триетиламіну, гідроксиду натрію) при температурі від -20 до 100°С. Хоч час реакції змінюється у залежності від виду галоїдангідриду кислота та сполуки [82] чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Сполука [82] краще використовується у кількості від 1 до 1,2 молей на один моль галоїдангідриду кислоти. СПОСІБ Η Сполука [1k] за даним винаходом, у якій D позначає алкенілен, приєднаний до Het через фрагмент з ненасиченим зв'язком, може також бути одержана шляхом дегідрогенування сполуки [1j] за даним винаходом, у якій D позначає алкілен. Крім того, сполука [1k] за даним винаходом може також бути одержана шляхом гідрогенування сполуки [1m] за даним винаходом, у якій D позначає алкінілен, приєднаний до Het через фрагмент з ненасиченим зв'язком. Сполука [1j] за даним винаходом може також бути одержана шляхом гідрогенування сполуки [1k] за даним винаходом. де R1, Het, D 2 Ta E1 мають значення, визначені вище. Дегідрогенування сполуки [1j] може бути проведене шляхом проведення реакції сполуки з Nбромсукцинімідом (NBS) чи N-хлорсукцинімідом (NCS) у розчиннику, подібному до того, що використовується у Способі А ви ще, при температурі від -20 до 150°С, а потім проведення реакції з основою (наприклад, гідроксидом натрію чи гідроксидом калію) у спиртовому розчиннику, такому як метанол чи етанол. Хоч час реакції змінюється у залежності від виду сполуки [1j] чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. NBS, NCS чи основи краще використовуються у кількості від 1 до 1,2 молей на 1 моль сполуки [1j]. Гідрогенування сполуки [1m] може бути проведене у спиртовому розчиннику (наприклад, метанолі чи етанолі) у присутності паладієвого каталізатора (наприклад, паладій-карбонат кальцію чи паладій-вугілля) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [1m], паладієвого каталізатора чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Паладієвий каталізатор краще використовується у кількості від 0,05 до 0,5 молей на 1 моль сполуки [1т]. Гідрогенування сполуки [1k] може бути проведене у спиртовому розчиннику (наприклад, метанолі чи етанолі) у присутності паладієвого каталізатора (наприклад, паладій-вугілля) при температурі від -20 до 150°С. Хоч час реакції змінюється у залежності від виду сполуки [1k], паладієвого каталізатора чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Паладієвий каталізатор краще використовується у кількості від 0,05 до 0,2 молей на 1 моль сполуки [1k]. СПОСІБ І Сполука [1n] за даним винаходом, у якій Ζ позначає гідроксиметил, може бути одержана шляхом відновлення сполуки [1g] за даним винаходом, у якій Ζ позначає алкоксикарбоніл. де R1, Het, D, Ε1 мають значення, визначені вище, Е4 позначає групу наведеної нижче формули [34] чи [44]: де R , R , Υ та р мають значення, визначені вище. Реакція може бути проведена у присутності відновлювального агента (наприклад, гідриду літію-алюмінію, борогідриду натрію чи літійдіізобутилалюмінійгідриду) у відповідному розчиннику (наприклад, ефірному розчиннику, такому як тетрагідрофуран (ТГФ) чи діетиловий ефір, полярному розчиннику, такому як Ν,Νдиметилформамід (ДМФ) чи диметил сульфоксид, спиртовому розчиннику, такому як метанол, етанол чи ізопропанол, чи їхній суміші) при температурі від -20 до 100°С. Хоч час реакції змінюється у залежності від виду сполуки [1g] чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Відновлювальний агент краще використовується у кількості від 0,5 до 2 молей на один моль сполуки [1g]. СПОСІБ J Сполука [1q], у якій Ε позначає групу формули [3] чи [4] і Ζ позначає ціаногрупу, може бути одержана зі сполука [1р] за даним винаходом, у якій Ζ позначає карбамоїл чи N-гідроксикарбамоїл. де R1, Het та D мають значення, визначені вище, Е5 позначає групу формули [35] чи [45], і Е6 позначає груп у формули [36] чи [46]: де R3, R4, Y та р мають значення, визначені вище, a R12 позначає гідроген чи гідроксильну груп у. Якщо використовується вихідна сполука, у якій Ζ позначає карбамоїл, тобто, R12 позначає гідроген, вона може бути загалом оброблена дегідратуючим агентом (наприклад, пентоксидом фосфору, тіонілхлоридом, трифтороцтовим ангідридом чи Ν,Ν'-дициклогексилкарбодіімідом) без розчинника чи у розчиннику, подібному до того, що використовується у Способі А ви ще. Хоч час реакції змінюється у залежності від виду сполуки [1р], виду дегідратуючого агента чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 24 годин. Дегідратуючий агент краще використовується у кількості від 1 до 5 молей на 1 моль сполуки [1р]. Якщо використовується вихідна сполука, у якій Ζ позначає N-гідроксикарбамоїл, тобто, R12 позначає гідроксильну груп у, то реакція може бути проведена у відповідності до методу A.Liguori et al., Synthesis, 168 (1987). СПОСІБ K Сполука [1r] за даним винаходом, у якій Ε позначає групу формули [3] чи [4] і Ζ позначає 1Н-5-тетразоліл, може бути одержана шляхом проведення реакції сполуки [1q] за даним винаходом, у якій Ζ позначає ціаногрупу, з азидом. де R1, Het, D та Е6 мають значення, визначені вище, а Е7 позначає групу формули [37] чи [47]: де R3, R4, Υ та ρ мають значення, визначені вище. Реакція може бути загалом проведена у відповідному розчиннику (наприклад, спиртовому розчиннику, такому як метанол, етанол чи метоксіетанол, вуглеводневому розчиннику, такому як бензол чи толуол, галогенованому вугле водневому розчиннику, такому як хлороформ чи дихлорметан, полярному розчиннику, такому як Ν,Ν-диметилформамід (ДМФ) чи диметилсульфоксид, ефірному розчиннику, такому як тетрагідрофуран (ТГФ), чи їхній суміші) у присутності азиду (наприклад, азиду натрію, азидтриметилсилану чи азидтриметилстануму) при температурі від 0 до 200°С. Реакція може бути проведена у присутності добавки, такої як хлорид літію чи хлорид амонію. Хоч час реакції змінюється у залежності від виду сполуки [1q], виду азиду чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 100 годин. СПОСІБ L Сполука [1s] за даним винаходом, у якій Ε позначає групу формули [3] чи [4] і Ζ позначає 1-алкіл-5тетразоліл чи 2-алкіл-5-тетразоліл, може бути одержана шляхом проведення реакції сполуки [1r] за даним винаходом, у якій Ζ позначає 1Н-5-тетразоліл, з алкілувальним агентом. де R1, Het, D, Ε7 та L мають визначені вище значення, R20 позначає алкіл і Е8 позначає групу формули [38] чи [48]: де R3, R4, Υ, ρ та R20 мають значення, визначені вище. Реакція може бути проведена, наприклад, у розчиннику, подібному до того, що використовується у Способі А ви ще, у присутності алкілувального агента (наприклад, галоїдалкілу, алкілмезилату чи алкілтозилату) та основи при температурі від 0 до 150°С. Приклади використовуваної основи включають органічний амін (наприклад, піридин чи триетиламін), гідрид металу (наприклад, гідрид натрію), неорганічну основу (наприклад, карбонат калію, бікарбонат натрію чи гідроксид натрію). Хоч час реакції змінюється у залежності від виду вихідного матеріалу чи температури реакції, він загалом зручно знаходиться в інтервалі від 30 хвилин до 100 годин. Галогенуючий агент та основа використовують обидва у кількості від 1 до 10 молей, краще, від 1 до 5 молей на один моль сполуки [1r]. Сполуки за даним винаходом можуть існувати у формі таутомерів. Даний винахід включає відповідні таутомери до обсягу винаходу. Сполуки за даним винаходом можуть існувати у формі геометричних ізомерів внаслідок присутності подвійного зв'язку. Даний винахід включає відповідні геометричні ізомери та їхні суміші. Сполуки за даним винаходом можуть існувати у формі стереоізомерів внаслідок присутності асиметричного атому карбону. Даний винахід включає відповідні стереоізомери та їхні суміші. Такий стереоізомер може бути одержаний з суміші за допомогою хроматографії на колонці з силікагелем. Крім того, вказаний стереоізомер може бути одержаний з суміші методом рідинної хроматографії з використанням колонці для відокремлення оптично активної речовини (наприклад, CHIRALCEL® OD, CHIRALCEL® OF, D AICEL, Ltd.). Якщо сполука за даним винаходом має карбоксильну гр упу, вона може бути перетворена на фармацевтично прийнятну сіль у відомий спосіб. Приклади фармацевтично прийнятної солі включають сіль лужного металу (наприклад, натрієва сіль, калієва сіль, і т.д.), сіль лужноземельного металу (наприклад, кальцієва сіль, магнієва сіль, і т.д.), сіль амонію, сіль з органічним аміном (наприклад, триетиламіном, лізином, аргініном, і т.д.), і т.п. Наприклад, сіль лужного металу сполуки за даним винаходом може бути одержана шляхом додавання одного еквівалента гідроксиду натрію чи гідроксиду калію до сполуки за даним винаходом, краще, у спиртовому розчиннику. Сіль лужноземельного металу сполуки за даним винаходом може бути одержана шляхом розчинення солі лужного металу, одержаної у згаданий вище спосіб, у воді, метанолі, етанолі чи змішаному розчиннику, що складається з них, та додавання одного еквівалента хлориду кальцію і т.п. Якщо сполука за даним винаходом є основною, вона може бути перетворена на фармацевтично прийнятну сіль у відомий спосіб. Приклади солі включають сіль з неорганічною кислотою, такою як хлористоводневою кислотою, сірчаною кислота, азотною кислотою, фосфорною кислотою і т.п.; чи сіль з органічною кислотою, такою як фумаровою кислотою, малеїновою кислотою, метансульфокислотою, птолуолсульфокислотою і т.п. Наприклад, хлористоводнева сіль сполуки за даним винаходом може бути одержана шляхом додавання одного еквівалента хлористоводневої кислоти до сполуки за даним винаходом, краще, у спиртовому розчиннику. Сполука за даним винаходом чи її сіль може бути виділена та очищена з реакційної суміші описаної вище реакції будь-яким звичайним методом, наприклад, екстракцією, концентруванням, нейтралізацією, фільтрацією, перекристалізацією, хроматографією на колонці, тонкошаровою хроматографією і т.п. Сполуки, що використовуються як вихідний матеріал для одержання сполук за даним винаходом, є відомими сполуками чи можуть бути, наприклад, одержані у відповідності до способів, описаних нижче чи у Типових прикладах. ОДЕРЖАННЯ СПОЛУК [11а] та [11b] Поміж сполук формули [11], що використовуються як вихідний матеріал у Способі А, ті, у яких D позначає СН2-D1 і Υ позначає оксиген (сполука [11а]) чи сульфур (сполука [11b]) можуть бути одержані у відповідності до таких способів. де R1, Het, D 1 , ρ, Τ та L мають значення, визначені вище. Сполука [51] може бути одержана шляхом дегідратаційної конденсації сполуки [50] та ацетону у відповідному розчиннику (наприклад, бензолі) у присутності кислотного каталізатора (наприклад, птолуолсульфокислоти). Сполука [52] може бути одержана шляхом додавання три-н-бутилфосфіну та йодиду купр уму до сполуки [51] у відповідному розчиннику (наприклад, безводному тетрагідрофурані) та проведення реакції зі сполукою [12] при температурі -60°С чи нижче. Замість три-н-бутилфосфіну та йодиду купруму може бути використаний магній. Сполука [11а] може бути одержана шляхом обробки сполуки [52] у відповідному розчиннику (наприклад, етанолі чи метанолі) за кислотних умов (наприклад, у присутності піридиній-п-толуолсульфонату) при температурі від 0 до 100°С. Сполука [11b] може бути одержана шляхом перетворення сполуки [11а] на бромід за реакцією з бромувальним агентом (наприклад, трифенілфосфін/чотирибромистий карбон чи трибромід фосфору) у відповідному розчиннику (наприклад, тетрагідрофуран, бензол), а потім проведення реакції з тіосечовиною при температурі від -20 до 100°С. ОДЕРЖАННЯ СПОЛУКИ [50а] Поміж сполук формули [50], що використовуються як вихідний матеріал для одержання сполуки [11а] вище, сполуки [50а], у яких ρ дорівнює 1, можуть бути одержані у відповідності до таких способів. де D1 та Τ мають значення, визначені вище, і R18 позначає алкіл. Сполука [55] може бути одержана шляхом проведення реакції сполуки [53] та складного діефіру малонової кислоти [54] у відповідному розчиннику (наприклад, безводному тетрагідрофурані) у присутності основного каталізатора (наприклад, гідриду натрію) при температурі від -50 до 100°С. Сполука [50а] може бути одержана шляхом введення сполуки [55] у реакцію у спосіб, аналогічний до описаного у Способі І вище. ОДЕРЖАННЯ СПОЛУКИ [50b] Поміж сполук формули [50], що використовуються як вихідний матеріал для одержання сполуки [11а] вище, сполуки [50b], у яких p дорівнює 0, можуть бути одержані у відповідності до таких способів. де D1 та Τ мають значення, визначені вище. Сполука [50b] може бути одержана шляхом проведення реакції сполуки [56] з окисним агентом (наприклад, тетроксидом осмію) у відповідному розчиннику (наприклад, діетиловому ефірі) при температурі від -20 до 50°С. ОДЕРЖАННЯ СПОЛУКИ [50c] Поміж сполук формули [50], що використовуються як вихідний матеріал для одержання сполуки [11а] вище, сполуки [50с], у яких ρ дорівнює 2, можуть бути одержані у відповідності до таких способів. де D1, Τ та R18 мають значення, визначені вище. Сполука [59] може бути одержана шляхом проведення реакції сполуки [55] та сполуки [58] у відповідному розчиннику (наприклад, тетрагідрофурані чи етанолі) у присутності основи (наприклад, алкоксиду натрію, такому як етоксид натрію чи гідрид натрію) при температурі в інтервалі від -20°С до кімнатної температури. Сполука [60] може бути одержана шляхом проведення гідролізу сполуки [59] у спосіб, аналогічний до описаного у Способі G вище, з наступним проведенням реакції декарбоксилювання шляхом нагрівання при температурі від 50 до 150°С без розчинника чи у відповідному розчиннику (наприклад, ксилол, толуол, етилацетат чи їхні суміші). Сполука [50с] може бути одержана шляхом проведення відновлення сполуки [60] у спосіб, аналогічний до описаного у Способі І вище. Сполука [50с] може також бути одержана шляхом проведення етерифікації сполуки [60] у звичайний спосіб з наступним відновленням у спосіб, аналогічний до описаного вище. ОДЕРЖАННЯ СПОЛУК [11с] та [11d] Поміж сполук формули [11], що використовуються як вихідний матеріал у Способі А, ті, у яких Het позначає групу формули [5а], D позначає D1-CH2, p дорівнює 1 і Υ позначає оксиген (сполука [11с]) чи сульфур (сполука [11d]), можуть бути одержані у відповідності до таких способів. де R1, R15 , R18, D1 , X та L мають значення, визначені вище. Сполука [81] може бути одержана шляхом проведення реакції сполуки [18] та діалкілового ефіру малонової кислоти у відповідному розчиннику (наприклад, тетрагідрофурані чи етанолі) у присутності основи (наприклад, алкоксиду натрію, такому як етоксид натрію, чи гідриду натрію) при температурі в інтервалі від 20°С до кімнатної температури. Сполука [11с] може бути одержана шляхом проведення реакції сполуки [81] у спосіб, аналогічний до описаного у Способі І вище. Сполука [11d] може бути одержана шляхом проведення реакції сполуки [11e] у спосіб, аналогічний до способу одержання сполуки [11b] зі сполуки [11а]. ОДЕРЖАННЯ СПОЛУКИ [13] Сполука [13], що використовується як вихідний матеріал у Способі В, може бути одержана у відповідності до таких способів. де R3, R4, R11 , R13 , R14, D1 , Υ та Τ мають значення, визначені вище. Сполука [61] може бути одержана шляхом проведення реакції сполуки [19] та сполуки [53] у спосіб, аналогічний до описаного у Способі Е. Сполука [62] може бути одержана шляхом обробки сполуки [61] у спосіб, аналогічний до гідролізу, описаного у Способі G вище. Сполука [13] може бути одержана шляхом проведення реакції сполуки [62] та сполуки [63] у відповідному розчиннику (наприклад, толуол) при температурі від 90 до 150°С. ОДЕРЖАННЯ СПОЛУКИ [16] Сполука [16], що використовується як вихідний матеріал у Способі С, може бути одержана у відповідності до таких способів. де Е, D2, Τ та Ph мають значення, визначені вище. Сполука [16] може бути одержана шляхом проведення реакції сполуки [64] та трифенілфосфіну у розчиннику, аналогічно до описаного вище Способу А при температурі від -20 до 150°С. ОДЕРЖАННЯ СПОЛУКИ [17] Сполука [17], що використовується як вихідний матеріал у Способі D, може бути одержана у відповідності до таких способів. де R1, R11 , R15, R18, Е1, Е2, D та Τ мають значення, визначені вище. Сполука [67] може бути одержана шляхом проведення реакції сполуки [65] та сполуки [66] у розчиннику аналогічно описаному вище Способу А у присутності основи (наприклад, триетиламіну чи диметиланіліну) при температурі від -20 до 150°С. Сполука [69] може бути одержана зі сполук [67] та [68] у спосіб, аналогічний до того, що використовувався для одержання сполуки [59] вище. Сполука [70] може бути одержана зі сполуки [69] у спосіб, аналогічний до того, що використовувався для одержання сполуки [60] вище. Сполука [72] може бути одержана шляхом проведення реакції сполуки [70] та сполуки [71] у відповідному розчиннику (наприклад, піридині) при температурі від 50 до 110°С, а потім - від 30 до 100°С після додавання води. Сполука [17] може бути одержана шляхом проведення реакції сполуки [72], аналогічної до описаної у способі G вище, у якій сполуку [1g] одержують зі сполуки [1h]. ОДЕРЖАННЯ СПОЛУКИ [68а] Поміж сполук формул [68], що використовуються як вихідний матеріал для одержання сполуки [17] вище, сполука [68а], у якій Е1 позначає групу формули [31], може бути одержана у відповідності до таких способів. де D, Τ, Υ, р, R 3 та R11 мають значення, визначені вище. Сполука [68а] може бути одержана шляхом проведення реакції сполуки [22] та сполуки [74], яка може бути одержана у такий самий спосіб, як сполука [50], аналогічний до описаного у Способі А ви ще. ОДЕРЖАННЯ СПОЛУКИ [68b] Поміж сполук формули [68], що використовуються як вихідний матеріал для одержання сполуки [17] вище, сполуки [68b], у яких Е1 позначає групу формули [41] можуть бути одержані у відповідності до таких способів. де D, Τ, Υ, R3 , R4 та R11 мають значення, визначені вище. Сполука [68b] може бути одержана шляхом проведення реакції сполуки [19] та сполуки [75] у спосіб, аналогічний до описаного для одержання сполуки [61] вище. ОДЕРЖАННЯ СПОЛУКИ[18] Сполука [18], що використовується як вихідний матеріал у Способі Е, може бути одержана у відповідності до таких способів. де R1, R11 , R15, X, D1 та L мають значення, визначені вище. Сполука [77] може бути одержана зі сполуки [76], яку одержують у спосіб, описаний у Способі D вище, і відповідності до методики, описаної у Способі І вище. Сполука [18] може бути одержана шляхом проведення реакції сполуки [77] та бромувального агента (наприклад, трифенілфосфін/тетрабромід карбону) чи галоїдангідриду сульфокислоти (наприклад, птолуолсульфонілхлорид) у розчиннику за методикою, аналогічною до описаної у Способі А вище, при температурі від -20 до 150°С. ОДЕРЖАННЯ СПОЛУКИ [21] Сполука [21], що використовується як вихідний матеріал у Способі F, може бути одержана у відповідності до таких способів. де R15, D, E1 та L1 мають значення, визначені вище. Сполука [79] може бути одержана шляхом проведення реакції сполуки [78] з окисним агентом (наприклад, м-хлорпербензойною кислотою) у відповідному розчиннику (наприклад, дихлорметан) при температурі в інтервалі від -10°С до кімнатної температури. Сполука [80] може бути одержана шляхом проведення реакції сполуки [79] з хлоридом літію чи бромідом літію у відповідному розчиннику (наприклад, безводному тетрагідрофурані) при кімнатній температурі. Сполука [21] може бути одержана шляхом проведення реакції сполуки [80] з реагентом Джонса (наприклад, конц.сірчаної кислоти та оксиду хрому(\/І)) при кімнатній температурі. Сполука за даним винаходом виявляє ефект зниження тригліцеридів крові ефект та ефект зниження LDLC, і тому є придатною для профілактики та лікування хвороб, таких як гіперліпідемія, спричинених підвищеним рівнем тригліцеридів крові чи рівнем загального холестерину. Сполуки за даним винаходом виявляли різні ефекти у мишей KK-АУ, які є тваринною моделлю NIDDM і у яких розвивається гіпертригліцеридимія, гіперглікемія та гіперінсулінемія, такі як ефект зниження тригліцеридів крові, ефект зниження холестерину ліпопротеїдів дуже низької густини (тут та надалі позначаються як "VLDLC"), ефект зниження LDL-C та ефект зниження глюкози крові, ефект зниження інсуліну крові, чи ефект підвищення HDL-C чи ефект зниження атерогенного індексу і, як очікується, є особливо кращими профілактичними чи лікувальними агентами при артеріосклерозі у порівнянні з відомими сполуками. Крім того, токсичність сполук за даним винаходом є досить низькою порівняно з ефективною дозою. Відповідно до цього, сполуки та фармацевтичні композиції за даним винаходом є не лише придатними для профілактики та лікування артеріосклерозу, спричиненого гіперліпідемією, але також застосовні до профілактики та лікування, наприклад, інфаркту міокарда, захворювань коронарної артерії, включаючи реоклюзію після черезшкірної транслюмінальної коронарної ангіопластики (РТСА), стенокардії та ішемічної хвороби серця, спричиненої захворюваннями коронарної артерії, інфаркту головного мозку, включаючи інфаркт кортикальної гілки та інфаркт проникної гілки, тромб та артеріосклероз, викликаний тими самими причинами і т.п. Крім того, сполуки та фармацевтичні композиції за даним винаходом можуть бути використані у профілактиці та лікуванні ожиріння, гіпертензії, цукрового діабету, особливо інсуліннезалежного цукрового діабету. Якщо сполука за винаходом вводиться як лікарський засіб, вона може бути введена ссавцям, включаючи людину, як така або у формі фармацевтичної композиції, що містить сполуку у фармацевтично прийнятному, нетоксичному та інертному носії в концентрації, наприклад, від 0,1% до 99,5%, краще, від 0,5% до 90%. Приклади застосовного носія включають тверді, напівтверді чи рідкі розріджувачі, наповнювачі та інші допоміжні речовини для композицій, причому використовується принаймні одна з них. Фармацевтичні композиції, краще, вводять у дозованій лікарській формі. Фармацевтичні композиції за даним винаходом можуть бути введені внутрішньовенно, перорально, у тканини, місцево (наприклад, трансдермально) чи ректально. Звичайно, використовується дозована лікарська форма, яка є особливо кращою для кожного зі способів введення. Особливо кращим є пероральне введення. Дозування фармацевтичних композицій для профілактики чи лікування артеріосклерозу треба, краще, регулювати з ура хуванням стану пацієнта, такого як вік, вага тіла, шлях введення, природа та тяжкість захворювання; але добова доза сполуки за даним винаходом як активного інгредієнта для дорослого може загалом складати 0,1-100мг/людину, краще, 0,5-20мг/людину. Вказаний вище діапазон доз є некритичним, і у деяких випадках достатньою може виявитися доза, нижча від вказаного діапазону, а в інших випадках може бути потрібною доза вище вказаного діапазону. Добова доза може бути введена 2 чи 3 кратними дозами. Якщо фармацевтична композиція має бути використана для профілактики чи лікування цукрового діабету чи інших хвороб, доза сполуки за даним винаходом може бути встановлена у відповідності до наведених вище значень. НАЙКРАЩИЙ СПОСІБ ЗДІЙСНЕННЯ ВИНАХОДУ Наведені нижче Приклади, включаючи Типові приклади, Робочі приклади, Тестові приклади та Приклади композицій дані для додаткової більш детальної ілюстрації даного винаходу, і не повинні тлумачитися як такі, що обмежують обсяг даного винаходу. Типовий приклад 1 Діетил-(4-хлорбутил)малонат До 458мл сухого.тетрагідрофурану (ТГФ) додають 13,4г 60% гідриду натрію, і 160,6г діетилмалонату додають по краплях при перемішуванні при охолодженні льодом. Після додавання реагентів продовжують перемішування протягом 15 хвилин і додають 57,3г 1-бром-4-хлорбутану. С уміш перемішують протягом 50 годин при кімнатній температурі. Реакційний розчин виливають у охолоджену льодом воду, нейтралізують розведеною хлористоводневою кислотою та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок дистилюють при зниженому тиску одержуючи 26,8г цільової сполуки у вигляді безбарвної маслянистої рідини. Т.кип. 127-130°С (5мм рт.ст.). За методикою, описаною у Типовому прикладі 1, були одержані такі сполуки: Діетил-(3-хлорпропіл)малонат; і Діетил-(5-хлорпентил)малонат. Типовий приклад 2 Діетил-(5-гексеніл)малонат До 120мл сухого тетрагідрофурану (ТГФ) додають 4,9г 60% гідриду натрію, і 29,5г діетилмалонату додають по краплях при перемішуванні з охолодженням льодом. Після додавання реагентів продовжують перемішування протягом 15 хвилин, а потім додають до суміші 10г 6-бром-1-гексену і нагрівають до кипіння зі зворотним холодильником протягом 21 години. Реакційний розчин охолоджують, виливають у охолоджену льодом воду, нейтралізують розведеною хлористоводневою кислотою та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =20:1), одержуючи 14,5г цільової сполуки у вигляді жовтува тої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,23-1,47 (10Н, м), 1,84-2,11 (4Н, м), 3,28-3,37 (1Н, м), 4,14-4,25 (4Н, м), 4,91-5,05 (2Н, м), 5,69-5,90 (1Н, м). Типовий приклад 3 6-Хлор-2-гідроксиметил-1-гексанол До 214мл сухого ефіру додають 8г гідриду літію-алюмінію , і розчин 26,7г діетил-(4хлорбутил)малонату/53мл сухого ефіру додають по краплях при перемішуванні з охолодженням льодом. Після 1-годинного перемішування при кімнатній температурі суміш о холоджують водою з льодом і додають поступово 173мл тетрагідрофурану/14,7мл води. Потім додають 14,7мл 1Н розчину гідроксиду натрію та 35мл води, перемішують протягом 15 хвилин, фільтрують для видалення нерозчинних речовин. Фільтрат концентрують, одержуючи 18,2г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,22-1,38 (2Н, м), 1,42-1,58 (2Н, м), 1,68-1,88 (3Н, м), 2,36-2,44 (2Н, м), 3,55 (2Н, т), 3,613,72 (2Н, м), 3,77-3,88 (2Н, м). За методикою, описаною у Типовому прикладі 3, були одержані такі сполуки: 5-Хлор-2-гідроксиметил-1-пентанол; 7-Хлор-2-гідроксиметил-1-гептанол; і 2-Гідроксиметил-7-октен-1-ол. Типовий приклад 4 Метил-с-5-(4-хлорбутил)-2-метил-1,3-діоксан-r-2-карбоксилат До 270мл ацетонітрилу додають 18г 6-хлор-2-гідроксиметил-1-гексанолу та 44г метилпіруватуу. До розчинуу суміші додають при перемішуванні 65,2г ефірату трифториду бор у (приблизно 47%) при кімнатній температурі і перемішують протягом 14 годин. Реакційну суміш виливають у розчин бікарбонату натрію в охолодженій льодом воді та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =10:1), одержуючи 14,8г цільової сполуки у вигляді жовтуватої маслянистої рідини. 1 Н-ЯМР (CDCІ3) δ: 0,99-1,11 (2Н, м), 1,37-1,55 (5Н, м), 1,68-1,82 (2Н, м), 1,95-2,09 (1Н, м), 3,41 (2Н, т), 3,483,60 (2Н, м), 3,83 (3Н, с), 3,92-4,00 (2Н, м). За методикою, описаною у Типовому прикладі 4, були одержані такі сполуки: Метил-с-5-(3-хлорпропіл)-2метил-1,3-діоксан-r-2-карбоксилат; і Ме тил-с-5-(5-хлорпентил)-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 5 Діетил-[4-(тетрагідро-2Н-піран-2-ілокси)-(Z)-2-бутеніл]малонат 2-[4-Хлор-(Z)-2-бутенілокси]тетрагідро-2Н-піран (100г) розчиняють у 2000мл сухого тетрагідрофурану/600мл сухого Ν,Ν-диметилформаміду. До розчину додають 100г діетилмалонату, а потім 25г 60% гідриду натрію при перемішуванні з охолодженням льодом, і суміш перемішують при кімнатній температурі протягом 1 години. Реакційну суміш виливають в охолоджену льодом воду і екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, нгексан:етилацетат =9:1), одержуючи 65,5г цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,27 (6Н, т), 1,50-1,90 (6Н, м), 2,67 (2Н, т), 3,39 (1Н, т), 3,45-3,60 (1H, м), 3,80-3,95 (1Н, м), 4,05-4,35 (6Н, м), 4,61 (1Н, дд), 5,45-5,75 (2Н, м). Типовий приклад 6 2-Гідроксиметил-6-(тетрагідро-2Н-піран-2-ілокси)-(Z)-4-гексен-1-ол Діетил-[4-(тетрагідро-2Н-піран-2-ілокси)-(Z)-2-бутеніл]малонат (65,5г) розчиняють у 650мл сухого тетрагідрофурану, і додають до нього 15,1г боргідриду натрію. Розчин 110г метанолу/275мл тетрагідрофурану додають по краплях поступово при перемішуванні при нагріванні до кипіння зі зворотним холодильником. Потім додають 13,18г хлориду літію та 11г боргідриду натрію і кип'ятять зі зворотним холодильником протягом 1,5 години. Реакційний розчин охолоджують та виливають у льодяну воду і екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, хлороформ), одержуючи 22,8г цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,40-1,90 (7Н, м), 2,20 (2Н, шир.), 2,26 (2Н, ддд), 3,46-3,90 (6Н, м), 4,10-4,30 (2Н, м), 4,68 (1Н, дд), 5,50-5,80 (2Н, м). Типовий приклад 7 Метил-с-5-[4-гідрокси-(Z)-2-бутеніл]-2-метил-1,3-діоксан-r-2-карбоксилат Ефірат трифториду бору (приблизно 47%, 26,8г) додають по краплях до розчину 21,79г 2-гідроксиметил-6(тетрагідро-2Н-піран-2-ілокси)-(Z)-4-гексен-1-олу, 430мл ацетонітрилу та 38,57г метилпірувату при охолодженні льодом, і суміш перемішують протягом 15 годин при кімнатній температурі. Реакційний розчин виливають в розчин бікарбонату натрію у воді з льодом та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =7:1), одержуючи 5,36г цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,51 (3Н, с), 1,85 (2Н, дд), 1,95-2,20 (1Н, м), 3,43 (2Н, дд), 3,84 (3Н, с), 3,95 (2Н, ДД), 4,14 (2Н, дд), 5,44 (1Н, ддд), 5,70 (1Н, ддд). Типовий приклад 8 Метил-с-5-[4-хлор-(Z)-2-бутеніл]-2-метил-1,3-діоксан-r-2-карбоксилат Метил-с-5-[4-гідрокси-(Z)-2-бутеніл]-2-метил-1,3-діоксан-r-2-карбоксилат (538мг) розчиняють у 12мл Ν,Νдиметилформаміду, і додають 1,13г 2,4,6-триметилпіридину та 396мг хлориду літію. Потім додають по краплях при охолодженні льодом 1,07г метансульфонілхлориду, суміш перемішують протягом 9 годин при кімнатній температурі. Реакційний розчин виливають у льодяну воду, додають до нього 0,5Н хлористоводневу кислоту і розчин екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =9:1), одержуючи 561мг цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ:1,52 (3Н, с), 1,89 (2Н, дд), 2,00-2,20 (1Н, м), 3,45 (2Н, дд), 3,85 (ЗН, с), 3,95 (2Н, дд), 4,00 (2Н, дд), 5,53 (1Н, ддд), 5,72 (1Н, ддд). Типовий приклад 9 Метил-с-5-[4-йод-(Е)-2-бутеніл]-2-метил-1,3-діоксан-r-2-карбоксилат Meтил-c-5-[4-xлop-(Z)-2-бyтeнiл]-2-мeтил-1,3-дioкcaн-r-2-кapбoкcилaт (300мг) розчиняють у 5мл ацетону та додають до нього йодид натрію. Суміш нагрівають до кипіння зі зворотним холодильником протягом 2 годин. Реакційний розчин охолоджують, додають до нього льодяну воду і суміш екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують, одержуючи 353мг цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,51 (3Н, с), 1,79 (2Н, дд), 2,00-2,20 (1Н, м), 3,41 (2Н, дд), 3,81 (2Н, дд), 3,84 (3Н, т), 3,93 (2Н, дд), 5,48-5,93 (2Н, м). Типовий приклад 10 Метил-с-5-(4-йодбутил)-2-метил-1,3-діоксан-r-2-карбоксилат Метил-с-5-(4-хлорбутил)-2-метил-1,3-діоксан-r-2-карбоксилат (14,8г) розчиняють у 148мл ацетону і додають 44,2г йодиду натрію. Суміш перемішують протягом 22,5 годин при 40°С. Реакційний розчин концентрують, до залишку додають воду і розчин екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують, одержуючи 19,9 г цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 0,99-1,10 (2Н, м), 1,30-1,45 (2Н, м), 1,51 (3Н, с), 1,72-1,86 (2Н, м), 1,97-2,08 (1Н, м), 3,16 (2Н, т), 3,40 (2Н, т), 3,83 (3Н, с), 3,92-4,00 (2Н, м). За методикою, описаною у Типовому прикладі 10, були одержані такі сполуки: Метил-с-5-(3-йодпропіл)-2-метил-1,3-діоксан-r-2-карбоксилат, і Метил-с-5-(5-йодпентил)-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 11 6-Бром-1-(тетрагідро-2Н-піран-2-ілокси)-2-гексин У потоці аргону, 13,46г 3-(тетрагідро-2Н-піран-2-ілокси)-1-протну розчиняють у 135мл безводного тетрагідрофурану, і додають по краплях 60мл розчину 1,6Н н-бутиллітію у гексані протягом 20 хвилин при перемішуванні при внутрішній температурі розчину -10°С. Суміш перемішують протягом 1 години при такій саме температурі. Після перемішування протягом ще 1 години при кімнатній температурі, внутрішню температуру змінюють на -3°С і додають до суміші 16,7мл триаміду гексаметилфосфорної кислоти (НМРА). Потім додають 58,14г 1,3-дибромпропану порціями при внутрішній температурі -10°С і суміш перемішують протягом 12 годин при кімнатній температурі. Реакційний розчин виливають у льодяну воду, екстрагують ефіром, промивають водою, осушають над безводним сульфатом магнію та концентрують. Залишок дистилюють при зниженому тиску, одержуючи 12,0г цільової сполуки у вигляді безбарвної маслянистої рідини. Т.кип. 121-126°С (5мм рт.ст.). Типовий приклад 12 Метил-2-(6-бромгексилокси)-2-метилпропіонат До 120мл сухого Ν,Ν-диметилформаміду додають 4,0г 60% гідриду натрію. До суміші додають по краплях 11,81г метил-2-гідроксиізобутирату при перемішуванні з охолодженням льодом і перемішують протягом 10 хвилин. Потім додають 122г 1,6-дибромгексану та перемішують протягом 15 годин при кімнатній температурі. Реакційний розчин виливають у льодяну воду, екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =20:1), одержуючи 6,25г цільової сполуки у вигляді жовтуватої маслянистої рідини. 1 H-ЯМР (CDCI3) δ: 1,42-1,65 (12Н, м), 1,80-1,94 (2Н, м), 3,32-3,45 (4Н, м), 3,73 (3Н, с). За методикою, описаною у Типовому прикладі 12, були одержані такі сполуки: Метил-2-(5-бромпентилокси)-2-метилпропіонат, Метил-2-(7-бромгептилокси)-2-метилпропіонат, Метил-2-(8-бромоктилокси)-2-метилпропіонат, Етил-2-метил-2-[6-(тетрагідро-2Н-піран-2-ілокси)-4-гексинілокси]пропіонат, Етил-2-(6-бромгексилокси)-2-метилпропіонат, та Метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексенілокси]-2-метилпропіонат. Типовий приклад 13 Етил-2-(6-гідрокси-4-гексинілокси)-2-метилпропіонат Етил-2-метил-2-[6-(тетрагідро-2Н-піран-2-ілокси)-4-гексинілокси]пропіонат (3,72г) розчиняють у 37мл етанолу, додають до нього 15,372мг Amberlyst® і суміш перемішують протягом 1 години при 55-60°С. Після охолодження, суміш фільтрують та фільтрат концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =9:1-3:1), одержуючи 1,98г цільової сполуки у вигляді блідо-жовтої маслянистої рідини. 1Н-ЯМР (СОСІ3) δ: 1,29 (3Н, т), 1,42 (6Н, с), 1,70-1,83 (2Н, м), 2,30-2,39 (2Н, м), 3,44-3,50 (2Н,м), 4,14-4,26 (4Н, м). Типовий приклад 14 Метил-2-метил-2-(8-ноненілокси)пропіонат До 500мл сухого Ν,'Ν-диметилформаміду додають 17г 60% гідриду натрію та 48г метил-2гідроксиізобутирату додають по краплях при перемішуванні з охолодженням льодом і перемішують протягом 10 хвилин. Потім додають 100г 9-бром-1-нонену (чистота: 63,4%) і суміш перемішують протягом 15 годин при кімнатній температурі. Реакційний розчин виливають у льодяну воду, екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок дистилюють при зниженому тиску, одержуючи 29,9г цільової сполуки у вигляді жовтуватої маслянистої рідини. Т.кип. 124-127°С (8мм рт.ст.). За методикою, описаною у Типовому прикладі 14, були одержані такі сполуки: Метил-2-(6-гептенілокси)-2-метилпропіонат, Метил-2-метил-2-(7-октенілокси)пропіонат, та Метил-2-(9-деценілокси)-2-метилпропіонат, Типовий приклад 15 Метил-2-(8,9-епоксинонілокси)-2-метилпропіонат Метил-2-метил-2-(8-ноненілокси)пропіонат (40г) розчиняють у 320мл метиленхлориду та додають при перемішуванні з охолодженням льодом 40,8г 70% 3-хлорпербензойної кислоти, і суміш перемішують протягом 15 годин при кімнатній температурі. Реакційний розчин фільтрують для видалення нерозчинних речовин, та фільтрат концентрують. Залишок розчиняють у н-гексані та промивають 4 рази водним розчином 10% карбонату калію, промивають водою, осушають над безводним сульфатом магнію та концентрують, одержуючи 43,2 г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,25-1,70 (18Н, м), 2,44-2,48 (1Н, м), 2,72-2,77 (1Н, м), 2,85-2,97 (1Н, м), 3,34 (2Н,т), 3,73 (3Н,с). За методикою, описаною у Типовому прикладі 15, були одержані такі сполуки: Метил-2-(6,7-епоксигептилокси)-2-метилпропіонат, Метил-2-(7,8-епоксіоктилокси)-2-метилпропіонат, Метил-2-(9,10-епоксидецилокси)-2-метилпропіонат, і Метил-с-5-(5,6-епоксигексил)-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 16 Метил-2-(9-хлор-8-гідроксинонілокси)-2-метилпропіонат Метил-2-(8,9-епоксинонілокси)-2-метилпропіонат (26г) розчиняють у 260мл сухого те трагідрофурану, додають 6,8г хлориду літію та 7г оцтової кислоти та суміш перемішують протягом 22 годин при кімнатній температурі. Реакційний розчин виливають у льодяну воду, екстрагують етилацетатом, промивають насиченим розчином бікарбонату натрію та розсолом, осушають над безводним сульфатом магнію та концентрують, одержуючи 31,7г цільової сполуки у вигляді маслянистої рідини. За методикою, описаною у Типовому прикладі 16, були одержані такі сполуки: Метил-2-(7-хлор-6-гідроксигептилокси)-2-метилпропіонат, Метил-2-(8-хлор-7-гідроксіоктилокси)-2-метилпропіонат, Метил-2-(10-хлор-9-гідроксидецилокси)-2-метилпропіонат, і Метил-с-5-(6-хлор-5-гідроксигексил)-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 17 Метил-2-(9-хлор-8-оксононілокси)-2-метилпропіонат Метил-2-(9-хлор-8-гідроксинонілокси)-2-метилпропіонат (31г) розчиняють у 465мл ацетону і додають по краплях при перемішуванні з охолодженням льодом 46мл реагенту Джонса, одержаного шляхом додавання 10,2мл конц.сірчаної кислоти та 12г оксиду хрому(VI) до 45мл води при охолодженні льодом. Після 3годинного перемішування при кімнатній температурі, надлишкову кількість реагенту Джонса розкладають шляхом додавання ізопропілового спирту. Реакційну суміш виливають у льодяну воду, екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =7,5:1), одержуючи 18,16г цільової сполуки у вигляді маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,24-1,40 (6Н, м), 1,41 (6Н, с), 1,45-1,75 (4Н, м), 2,58 (2Н, т), 3,34 (2Н, т), 3,73 (3Н, с), 4,07 (2Н, с). За методикою, описаною у Типовому прикладі 17, були одержані такі сполуки: Метил-2-(7-хлор-6-оксогептилокси)-2-метилпропіонат, Метил-2-(8-хлор-7-оксооктилокси)-2-метилпропіонат, Метил-2-(10-хлор-9-оксодецилокси)-2-метилпропіонат, і Метил-с-5-(6-хлор-5-оксогексил)-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 18 Діетил п-толуоїламіномалонат Діетиламіномалонату гідрохлорид (20,5г) суспендують у 180мл метиленхлориду та додають 29,4 гтриетиламіну при охолодженні водою з льодом. Після 30-хвилинного перемішування додають по краплях 15г п-толуоїлхлориду і суміш перемішують протягом 24 годин при кімнатній температурі. Реакційний розчин промивають водою, розведеною хлористоводневою кислотою, та водою, осушають над безводним сульфатом магнію і концентрують. До залишку додають ізопропіловий ефір і кристали, що утворюються, збирають фільтрацією та висушують, одержуючи 25,9г цільової сполуки у вигляді білої кристалічної речовини. Т.пл. 101-102°С. За методикою, описаною у Типовому прикладі 18, були одержані такі сполуки: Діетилбензоїламіномалонат, Діетил-(4-хлорбензоїл)аміномалонат, Діетил-(4-фторбензоїламіно)малонат, Діетил-(4-трифторметилбензоїл)аміномалонат, Діетил-(4-трет-бутилбензоїл)аміномалонат, і Діетил-(4-етилбензоїл)аміномалонат. Типовий приклад 19 Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат До 27мл сухого е танолу додають 6,6г 20% етанольний розчин етоксиду натрію та 5,4г діетил-птолуоїламіномалонату і перемішують протягом 30 хвилин при кімнатній температурі. Потім додають по краплях розчин 6,3г метил-с-5-(4-йодбутил)-2-метил-1,3-діоксан-r-2-карбоксилату/5,4мл сухого етанолу та перемішують протягом 15 годин при 50-60°С. Реакційний розчин виливають у льодяну воду та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogei® C-200, нгексан:етилацетат =5:1), одержуючи 4,34г цільової сполуки у вигляді жовтувати х кристалів. Т.пл. 60-63°С. За методикою, описаною у Типовому прикладі 19, були одержані такі сполуки: Етил-с-5-(4-бензоїламіно-4,4-біс(етоксикарбоніл)бутил)-2-метил-1,3-діоксан-r-2-карбоксилат, Етил-с-5-(5-бензоїламіно-5,5-біс(етоксикарбоніл)пентил)-2-метил-1,3-діоксан-r-2-карбоксилат, Етил-с-5-(6-бензоїламіно-6,6-біс(етоксикарбоніл)гексил)-2-метил-1,3-діоксан-r-2-карбоксилат, Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(4-фторбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(4-трифторметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2карбоксилат, Етил-с-5-[5-(4-трет-бутилбензоїламіно)-5,5-біс-(етоксикарбоніл)пентил]-2-метил-1,3-діоксан-r-2карбоксилат, Етил-с-5-[5-бензоїламіно-5,5-біс(етоксикарбоніл)-(Е)-2-пентеніл]-2-метил-1,3-діоксан-r-2-карбоксилат, 5-(5-Бензоїламіно-5,5-біс(етоксикарбоніл)пентил-2,2-диметил-1,3-діоксан, Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(4-хлорбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Етил-с-5-[6,б-біс(етоксикарбоніл)-6-(п-толуоїламіно)гексил]-2-метил-1,3-діоксан-r-2-карбоксилат, Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(3-фтор-4-метилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2карбоксилат, і Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(4-етилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 20 Етил-2-(7-бензоїламіно-7,7-біс(етоксикарбоніл)гептилокси)-2-метилпропіонат До 5мл сухого етанол додають 675мг 20% етанольного розчину етоксиду натрію та 698мг діетилбензоїламіномалонату і перемішують протягом 30 хвилин при кімнатній температурі. Потім додають по краплях розчин 914мг метил-6-бромгексилокси-2-метилпропіонату/4мл сухого етанолу та перемішують протягом 15 годин при 50-60°С. Реакційний розчин виливають у льодяну воду та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =5:1), одержуючи 642мг цільової сполуки у вигляді жовтува тої маслянистої рідини. 1 Н-ЯМР (CDCl3) δ:·1,10-1,37 (15Н, м), 1,38 (6Н, с), 1,42-1,60 (2Н, м), 2,41-2,49 (2Н, м), 3,30 (2Н, т), 4,11-4,33 (6Н, м), 7,40-7,60 (4Н, м), 7,81-7,86 (2Н, м). За методикою, описаною у Типовому прикладі 20, були одержані такі сполуки: Етил-2-метил-2-[7-(п-толуоїламіно)-7,7-біс(етоксикарбоніл)гептилокси]-пропіонат, Етил-2-[7-бензоїламіно-7,7-біс(етоксикарбоніл)-4-гєптинілокси]-2-метилпропіонат, Етил-2-[7-(4-хлорбензоїламіно)-7,7-біс(етоксикарбоніл)гептилокси]-2-метилпропіонат, Етил-2-[7,7-біс(етоксикарбоніл)-7-(4-фторбензоїламіно)гептилокси]-2-метилпоопіонат. Етил-2-[7-(4-трет-бутилбензоїламіно)-7,7-біс(етоксикарбоніл)гептилокси]-2-метилпропіонат, Етил-2-[6-бензоїламіно-6,6-біс(етоксикарбоніл)гексилокси]-2-метилпропіонат, Етил-2-[8-бензоїламіно-8,8-біс(етоксикарбоніл)октилокси]-2-метилпропіонат, Етил-5-бензоїламіно-5,5-біс(етоксикарбоніл)пентаноат, Етил-6-бензоїламіно-6,6-біс(етоксикарбоніл)гексаноат, Етил-5,5-біс(етоксикарбоніл)-5-(п-толуоїламіно)пентаноат, і 5-(Бензоїламіно)-1-бром-5,5-біс(етоксикарбоніл)-(Е)-2-пентен. Типовий приклад 21 с-5-[5-Карбокси-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота Етил-с-5-[5,5-біс(етоксикарбоніл)-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат (4,2г) розчиняють у 33,6мл етанолу та додають розчин 2,0г гідроксиду натрію/8,4мл води. Суміш нагрівають до кипіння зі зворотним холодильником протягом 5 годин. Реакційний розчин концентрують. До залишку додають воду, суміш підкислюють хлористоводневою кислотою та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують, одержуючи 3,23г жовтуватої маслянистої рідини. Маслянисту рідину, що утворюється, перемішують протягом 30 хвилин при 130°С, одержуючи 3,1г цільової сполуки у вигляді білих кристалів. Т.пл. 152-156°С. За методикою, описаною у Типовому прикладі 21, були одержані такі сполуки: с-5-(4-Бензоїламіно-4-карбоксибутил)-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-(5-Бензоїламіно-5-карбоксипентил)-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-(6-Бензоїламіно-6-карбоксигексил)-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Карбокси-5-(4-фторбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Карбокси-5-(4-трифторметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-(4-трет-Бутилбензоїламіно)-5-карбоксипентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Бензоїламіно-5-карбокси-(Е)-2-пентеніл]-2-метил-1,3-діоксан-r-2-карбонова кислота, 5-(5-Бензоїламіно-5-карбоксипентил)-2,2-диметил-1,3-діоксан, 2-(7-Бензоїламіно-7-карбоксигептилокси)-2-метилпропіонова кислота, 2-[7-Карбокси-7-(п-толуоїламіно)гептилокси]-2-метилпропіонова кислота, 2-(7-Бензоїламіно-7-карбокси-4-гептинілокси)-2-метилпропіонова кислота, 2-[7-Карбокси-7-(4-хлорбензоїламіно)гептилокси]-2-метилпропіонова кислота, 2-[7-Карбокси-7-(4-фторбензоїламіно)гептилокси]-2-метилпропіонова кислота, 2-[7-(4-трет-Бутилбензоїламіно)-7-карбоксигептилокси)-2-метилпропіонова кислота, 2-(8-Бензоїламіно-8-карбоксіоктилокси)-2-метилпропіонова кислота, 2-(6-Бензоїламіно-6-карбоксигексилокси)-2-метилпропіонова кислота, 5-Бензоїламіно-5-карбоксипентанова кислота, 6-Бензоїламіно-6-карбоксигексанова кислота, с-5-[5-Карбокси-5-(4-хлорбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[6-Карбокси-6-(п-толуоїламіно)гексил]-2-метил-1,3-діоксан-r-2-карбонова кислота, 5-Карбокси-5-(п-толуоїламіно)пентанова кислота, с-5-[5-Карбокси-5-(3-фтор-4-метилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, та с-5-[5-Карбокси-5-(4-етилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота. Типовий приклад 22 с-5-[5-Ацетил-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота с-5-[5-Карбокси-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонову кислоту (3,1г) розчиняють у 15,5мл піридину, додають 10,2мл оцтового ангідриду та перемішують протягом 1 години при 90°С. Потім додають по краплях 10,2мл води та перемішують протягом 30 хвилин при 90°С. Реакційний розчин охолоджують, виливають у льодяну воду, екстрагують етилацетатом, промивають розсолом» осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogei® C-200, хлороформ:метанол =100:1), одержуючи 2,2г цільової сполуки у вигляді жовтуватої маслянистої рідини. 1 Н-ЯМР (CDCl3) δ: 0,99-1,10 (2Н, м), 1,15-1,45 (4Н, м), 1,54 (3Н, с), 1,50-1,82 (1Н, м), 1,84-2,15 (2Н, м), 2,27 (3Н, с), 2,40 (3Н, с), 3,47 (2Н, дд), 3,89-4,04 (2Н, м), 4,82-4,92 (1Н, м), 7,01 (1Н, д), 7,22-7,27 (2Н, м), 7,68-7,74 (2Н, м). За методикою, описаною у Типовому прикладі 22, були одержані такі сполуки: с-5-(4-Ацетил-4-бензоїламінобутил)-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-(5-Ацетил-5-бензоїламінопентил)-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-(6-Ацетил-6-бензоїламіногексил)-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Ацетил-5-(4-фторбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Ацетил-5-(4-трифторметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Ацетил-5-(4-трет-бутилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Ацетил-5-бензоїламіно-(Е)-2-пентеніл]-2-метил-1,3-діоксан-r-2-карбонова кислота, 5-(5-Ацетил-5-бензоїламінопентил)-2,2-диметил-1,3-діоксан, 2-(7-Ацетил-7-бензоїламіногептилокси)-2-метилпропіонова кислота, 2-[7-Ацетил-7-(п-толуоїламіно)гептилокси]-2-метилпропіонова кислота, 2-(7-Ацетил-7-бензоїламіно-4-гептинілокси)-2-метилпропіонова кислота, 2-[7-Ацетил-7-(4-хлорбензоїламіно)гептилокси]-2-метилпропіонова кислота, 2-[7-Ацетил-7-(4-фторбензоїламіно)гептилокси]-2-метилпропіонова кислота, 2-[7-Ацетил-7-(4-трет-бутилбензоїламіно)гептилокси)-2-метилпропіонова кислота, 2-(8-Ацетил-8-бензоїламінооктилокси)-2-метилпропіонова кислота, 2-(6-Ацетил-6-бензоїламіногексилокси)-2-метилпропіонова кислота, 5-Ацетил-5-бензоїламінопентанова кислота, 6-Ацетил-б-бензоїламіногексанова кислота, с-5-[5-Ацетил-5-(4-хлорбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[6-Ацетил-6-(п-толуоїламіно)гексил]-2-метил-1,3-діоксан-r-2-карбонова кислота, 5-Ацєтил-5-(п-толуоїламіно)пентанова кислота, с-5-[5-Ацетил-5-(3-фтор-4-метилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, с-5-[5-Ацетил-5-(4-етилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонова кислота, і 7-Ацетил-7-(бензоїламіно)-(Е)-4-гептанова кислота. Типовий приклад 23 Метил-с-5-[5-ацетил-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат с-5[5-Ацетил-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонову кислоту (2,1г) розчиняють у 44мл бензолу та 4,2мл метанолу, та додають по краплях-при перемішуванні з охолодженням льодом 4,2мл 2,0М гексанового розчину триметилсилілдіазометану. Суміш перемішують протягом 1 години та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =2,5:1), одержуючи 0,85г цільової сполуки у вигляді жовтува тої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 0,90-1,08 (2Н, м), 1,10-1,40 (4Н, м), 1,50 (3Н, с), 1,55-1,80 (1Н, м), 1,85-2,16 (2Н, м), 2,27 (3Н, с), 2,40 (3Н, с), 3,36 (2Н, дд), 3,82 (3Н, с), 3,92 (2Н, дд), 4,80-4,89 (1Н, м), 6,89 (1Н, д), 7,25 (2Н, д), 7,70 (2Н, д). За методикою, описаною у Типовому прикладі 23, були одержані такі сполуки: Метил-с-5-(4-ацетил-4-бензоїламінобутил)-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-{5-ацетил-5-бензоїламінопентил)-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-(6-ацетил-6-бензоїламіногексил)-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(4-фторбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(4-трифторметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(4-трет-бутилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, і Метил-с-5-[5-ацетил-5-бензоїламіно-(Е)-2-пентеніл]-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 24 Метил-с-5-[5-ацетил-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат с-5-[5-Ацетил-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбонову кислоту (20г) розчиняють у 140мл ацетонітрилу і додають 14,5г метилйодиду та 14,1г карбонату калію. Суміш нагрівають до кипіння зі зворотним холодильником протягом 3 годин. Реакційний розчин охолоджують, виливають у льодяну воду, екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом, магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, нгексан:етилацетат =2:1), одержуючи 10,3г цільової сполуки у вигляді жовтуватої маслянистої рідини. За методикою, описаною у Типовому прикладі 24, були одержані такі сполуки: Метил-с-5-(5-ацетил-5-бензоїламінопентил)-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(4-хлорбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[6-ацетил-6-(п-толуоїламіно)гексил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(3-фтор-4-метилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, і Метил-с-5-[5-ацетил-5-(4-етилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 25 Метил-6-ацетил-6-бензоїламіногексаноат 6-Ацетил-6-бензоїламіногексанову кислоту (4,35г) розчиняють у 100мл метанолу та додають 0,5мл конц.сірчаної кислоти. Суміш нагрівають до кипіння зі зворотним холодильником протягом 2,5 годин. Реакційний розчин охолоджують, виливають у льодяну воду, екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію та концентрують, одержуючи 4,4г цільової сполуки у вигляді жовтуватих кристалів. Т.пл. 59-60°С. За методикою, описаною у Типовому прикладі 25, були одержані такі сполуки: Метил-2-(7-ацетил-7-бензоїламіногептилокси)-2-метилпропіонат, Метил-2-[7-ацетил-7-(п-толуоїламіно)гептилокси]-2-метилпропіонат, Метил-2-(7-ацетил-7-бензоїламіно-4-гептинілокси)-2-метилпропіонат, Метил-2-[7-ацетил-7-(4-хлорбензоїламіно)гептилокси]-2-метилпропіонат, Метил-2-[7-ацетил-7-(4-фторбензоїламіно)гептилокси]-2-метилпропіонат, Метил-2-[7-ацетил-7-(4-трет-бутилбензоїламіно)гептилокси]-2-метилпропіонат, Метил-2-(8-ацетил-8-бензоїламінооктилокси)-2-метилпропіонат, Метил-2-(6-ацетил-6-бензоїламіногексилокси)-2-метилпропіонат, Метил-5-ацетил-5-бензоїламінопентаноат, Метил-5-ацетил-5-(п-толуоїламіно)пентаноат, і Метил-7-ацетил-7-(бензоїламіно)-(Е)-4-гептеноат. Типовий приклад 26 Діетил-(3-бромбензил)малонат Гідрид натрію (60%, 1,6г) суспендують у 20мл сухого тетрагідрофурану/15мл сухого Ν,Νдиметилформаміду і додають по краплях 7,6мл діетилмалонату при охолодженні льодом. Суміш перемішують протягом 15 хвилин. Потім додають розчин 5г 3-бромбензилброміду/10мл сухого тетрагідрофурану, та перемішують протягом 1 години при охолодженні льодом. До реакційного розчину додають льодяну воду і екстрагують ефіром, промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =10:1), одержуючи 5,41г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (СОСІ 3) δ: 1,22 (6Н, т), 3,81 (2Н, д), 3,61 (1Н, т), 4,17 (4Н, кв), 7,10-7,20 (2Н, м), 7,29-7,40 (2Н, м). За методикою, описаною у Типовому прикладі 26, були одержані такі сполуки: Діетил-(4-бромбензил)малонат. Типовий приклад 27 Діетил-(4-бромфеніл)малонат У потоці аргону, 10,85г діетилкарбонату розчиняють у 60мл бензолу, додають 2,75г 60% гідриду натрію та нагрівають суміш до кипіння зі зворотним холодильником. Розчин 5,58г етил-4-бромфенілацетату/20мл бензолу додають по краплях до розчину протягом 1 години і суміш нагрівають до кипіння зі зворотним холодильником протягом 1 години. Після охолодження до реакційного розчину повільно додають по краплях льодяну воду. Органічний шар відокремлюють, промивають водою, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, нгексан:етилацетат =10:1), одержуючи 6,45г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,26 (6Н, т), 4,21 (4Н, кв), 4,56 (1Н, с), 7,29 (2Н, д), 7,50 (2Н, д). За методикою, описаною у Типовому прикладі 27, були одержані такі сполуки: Діетил-(3-бромфеніл)малонат. Типовий приклад 28 2-(3-Бромбензил)-1,3-пропандіол До 94мл охолодженого льодом 1,0М толуольного розчину діізобутилалюмінійгідриду додають по краплях 5,41г діетил-(3-бромбензил)-малонату при 15°С чи нижче у потоці аргону. Суміш перемішують протягом 30 хвилин при охолодженні льодом, підігрівають до кімнатної температури та перемішують протягом 2 годин. Реакційний розчин охолоджують льодом та повільно додають по краплях 21мл метанолу, а потім додають по краплях 41мл 2Н хлористоводневої кислоти. Суміш перемішують протягом 20 хвилин при кімнатній температурі. Реакційний розчин фільтрують для видалення нерозчинних речовин, екстрагують етилацетатом, промивають насиченим бікарбонату натрію, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, хлороформ:метанол =10:1), одержуючи 1,96г цільової сполуки у вигляді білих кристалів. Т.пл. 61-63°С. За методикою, описаною у Типовому прикладі 28, були одержані такі сполуки: 2-(4-Бромбензил)-1,3-пропандіол, 2-(4-Бромфеніл)-1,3-пропандіол, і 2-(3-Бромфеніл)-1,3-пропандіол. Типовий приклад 29 5-(3-Бромбензил)-2,2-диметил-1,3-діоксан 2-(3-Бромбензил)-1,3-пропандіол (1,85г) розчиняють у суміші 8мл ацетону/18мл бензолу і додають 70мг птолуолсульфокислоти моногідрату. Розчин піддають азеотропному зневодненню в апараті Діна-Старка протягом 1 години. Після додавання насиченого розчину бікарбонату натрію суміш екстрагують етилацетатом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =4:1), одержуючи 1,47г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,43 (6Н, д), 1,90-2,10 (1Н, м), 2,60 (2Н, д), 3,61 (2Н, дд), 3,86 (2Н, дд), 7,05-7,20 (2Н, м), 7,30-7,40 (2Н, м). За методикою, описаною у Типовому прикладі 29, були одержані такі сполуки: 5-(4-Бромбензил)-2,2-диметил-1,3-діоксан, 5-(4-Бромфеніл)-2,2-диметил-1,3-діоксан, та 5-(3-Бромфеніл)-2,2-диметил-1,3-діоксан. Типовий приклад 30 2,2-Диметил-5-{3-[(5-метил-2-фенілоксазол-4-іл)метил]бензил}-1,3-діоксан У потоці аргону, 1,45г 5-(3-бромбензил)-2,2-диметил-1,3-діоксану розчиняють у 7мл сухого тетрагідрофурану і о холоджують на бані з сухим льодом-ацетоном. До суміші додають 0,9мл Ν,Ν,Ν',Ν'тетраметилетилендіаміну, а потім додають по краплях н-бутиллітій (1,6М розчин у гексані) при температурі 60°С чи нижче. Після 10-хвилинного перемішування додають суспензію 1,03г три-н-бутилфосфіну та 0,97г йодиду міді/7мл сухого те трагідрофурану і суміш перемішують протягом 10 хвилин. Розчин 1,52г 4-йодметил5-метил-2-фенілоксазолу/7мл сухого те трагідрофурану додають по краплях при температурі -60°С чи нижче, і суміш перемішують протягом 15 хвилин за таких саме умов. Баню забирають і суміш перемішують протягом 1,5 години. До реакційного розчину додають насичений водний розчин хлориду амонію. Суміш розводять водою, екстрагують ефіром, фільтрують для видалення нерозчинних речовин, промивають водою, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =4:1), одержуючи 0,34г цільової сполуки у вигляді білих кристалів. Т.пл. 85-87°С. За методикою, описаною у Типовому прикладі 30, були одержані такі сполуки: 2,2-Диметил-5{4-[(5-метил-2-фенілоксазол-4-іл)метил]бензил}-1,3-діоксан, 2,2-Диметил-5-{4-[(5-метил-2-фенілоксазол-4-іл)метил]феніл}-1,3-діоксан, і 2,2-Диметил-5-{3-[(5-метил-2-фенілоксазол-4-іл)метил]феніл}-1,3-діоксан. Типовий приклад 31 5-(5-Метил-2-фенілоксазол-4-іл)-1-пентанол До 17мл сухого е фіру додають 550мг гідриду літію-алюмінію, і додають по краплях 3,3г метил-5-(5-метил2-фенілоксазол-4-іл)-1-пентаноату/10мл сухого е фіру. Після 1-годинного перемішування при кімнатній температурі суміш о холоджують льодяною водою та поступово додають по краплях 12мл тетрагідрофурану/0,7мл води. Потім додають 0,7мл 1Н гідроксиду натрію та 2,5мл води і перемішують протягом 15 хвилин. Суміш фільтрують для видалення нерозчинних речовин і фільтрат концентрують, одержуючи 2,9г цільової сполуки у вигляді жовтувати х кристалів. Т.пл. 40-42°С. За методикою, описаною у Типовому прикладі 31, були одержані такі сполуки: 4-(5-Метил-2-фенілоксазол-4-іл)-1-бутанол, 4-[5-Метил-2-(п-толіл)оксазол-4-іл]-1-бутанол, 4-[2-(п-Толіл)-5-трифторметилоксазол-4-іл]-1-бутанол, 6-[5-Метил-2-(п-толіл)оксазол-4-іл]-1-гексанол, та 6-(5-Метил-2-фенілоксазол-4-іл)-(Е)-4-гексен-1-ол. Типовий приклад 32 4-(5-Бромпентил)-5-метил-2-фенілоксазол 5-(5-Метил-2-фенілоксазол-4-іл)-1-пентанол (2,9г) розчиняють у 62мл сухого е фіру і додають 8,4г тетраброміду карбону. До суміші додають поступово 6,6г трифенілфосфіну при охолодженні льодом. Суміш потім перемішують протягом 2,5 годин при кімнатній температурі, фільтрують для видалення нерозчинних речовин та фільтрат концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =10:1), одержуючи 2,61г цільової сполуки у вигляді жовтуватої маслянистої рідини. За методикою, описаною у Типовому прикладі 32, були одержані такі сполуки: 4-(4-Бромбутил)-5-метил-2-фенілоксазол, Етил-2-(6-бром-4-гексинілокси)-2-метилпропіонат, 4-(4-Бромбутил)-5-метил-2-(п-толіл)оксазол, 4-(4-Бромбутил)-2-(п-толіл)-5-трифторметилоксазол, 4-(6-Бромгексил)-5-метил-2-(п-толіл)оксазол, та 4-[6-Бром-(Е)-2-гексеніл]-5-метил-2-фенілоксазол. Типовий приклад 33 Діетил-[5-(5-метил-2-фенілоксазол-4-іл)пентил]малонат До 35мл сухого тетрагідрофурану додають 650мг 60% гідриду натрію і додають по краплях при перемішуванні 3,9г діетилмалонату при охолодженні льодом. Після перемішування протягом 10 хвилин додають 4-(4-бромпентил)-5-метил-2-фенілоксазол (2,5г). Суміш перемішують протягом 10 хвилин при кімнатній температурі, а потім нагрівають до кипіння зі зворотним холодильником протягом 12 годин. Реакційний розчин виливають у льодяну воду, нейтралізують розведеною хлористоводневою кислотою, а потім екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, нгексан:етилацетат =10:1), одержуючи 2,75г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,26 (6Н, т), 1,32-1,43 (4Н, м), 1,55-1,75 (2Н, м), 1,82-2,00 (2Н, м), 2,31 (3Н, с), 2,47 (2Н, т), 3,31 (1Н, т), 4,19 (4Н, кв), 7,37-7,47 (3Н, м), 7,95-8,00 (2Н, м). За методикою, описаною у Типовому прикладі 33, були одержані такі сполуки: Діетил-[4-(5-метил-2-фенілоксазол-4-іл)бутил]малонат, Діетил-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}малонат, Діетил-{4-[2-(п-толіл)-5-трифторметилоксазол-4-іл]бутил}малонат, і Діетил-[5-(бензоїламіно)-5,5-біс(етоксикарбоніл)-(Е)-2-пентеніл]малонат. Типовий приклад 34 4-[6,б-Біс(гідроксиметил)гексил]-5-метил-2-фенілоксазол До 15мл сухого ефір у додають 637мг гідриду літію-алюмінію, та додають по краплях 2,6г діетил-[5-(5метил-2-фенілоксазол-4-іл)пентил]малонату/10мл, сухого ефіру. Після 2-годинного перемішування при кімнатній температурі суміш охолоджують льодяною водою та додають по краплях поступово 14мл тетрагідрофурану/0,8мл води. До суміші додають 0,8мл водного розчину 1Н гідроксиду натрію та 2,3мл води і перемішують протягом 15 хвилин та фільтрують для видалення нерозчинних речовин. Фільтрат концентрують, одержуючи 2,0г цільової сполуки у вигляді білих кристалів. Т.пл. 71-74°С. За методикою, описаною у Типовому прикладі 34, були одержані такі сполуки: 4-[5,5-Біс(гідроксиметил)пєнтил]-5-метил-2-фенілоксазол, 4-[5,5-Біс(гідроксиметил)пентил]-5-метил-2-(п-толіл)оксазол, 4-[5,5-Біс(гідроксиметил)пентил]-2-(п-толіл)-5-трифторметилоксазол, і 4-[5,5-Біс(гідроксиметил)пентил]-5-етил-2-(п-толіл)оксазол. Типовий приклад 35 4-{3-[2,2-Біс(гідроксиметил)етил]бензил}-5-метил-2-фенілоксазол Змішаний розчин 320мг 2,2-диметил-5-{3-[(5-метил-2-фенілоксазол-4-іл)метил]бензил}-1,3-діоксану, 21мл етанолу та 21мг п-толуолсульфонату піридинію (PPTS) перемішують протягом 2 годин при 55-60°С. Реакційний розчин концентрують та залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, хлороформ), одержуючи 305мг цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,90-2,15 (1Н, м), 2,29 (3Н, с), 2,35 (2Н, шир.), 2,60 (2Н, д), 3,64 (2Н, дд), 3,78 (2Н, дд), 3,85 (2Н, с), 6,90-7,50 (7Н, м), 7,85-8,05 (2Н, м). За методикою, описаною у Типовому прикладі 35, були одержані такі сполуки: 4-{4-[2,2-Біс(гідроксиметил)етил]бензил}-5-метил-2-фенілоксазол, 4-{4-[1,1-Біс(гідроксиметил)метил]бензил}-5-метил-2-фенілоксазол, 4-{3-[1,1-Біс(гідроксиметил)метил]бензил}-5-метил-2-фенілоксазол, і 4-[5,5-Біс(гідроксиметил)пентил]-5-метил-2-фенілоксазол. Типовий приклад 36 Метил-5-(5-метил-2-фенілоксазол-4-іл)пентаноат Метил-6-ацетил-6-бензоїламіногексаноат (4,35г) розчиняють у 87мл толуолу, додають 2,9мл оксихлориду фосфор у та нагрівають до кипіння зі зворотним-холодильником протягом 50 хвилин. Реакційний розчин охолоджують; виливають у .льодяну воду, нейтралізують водним розчином бікарбонату натрію, екстрагують етилацетатом та промивають розсолом. Одержаний розчин осушають над безводним сульфатом магнію та концентрують, одержуючи 3,40г цільової сполуки у вигляді жовтуватої маслянистої рідини. За методикою, описаною у Типовому прикладі 36, були одержані такі сполуки: Метил-4-(5-метил-2-фенілоксазол-4-іл)бутаноат, Метил-4-[5-метил-2-(п-толіл)оксазол-4-іл]бутаноат, Етил-6-[5-метил-2-(п-толіл)оксазол-4-іл]гексаноат, та Метил-6-(5-метил-2-фенілоксазол-4-іл)-(Е)-4-гексеноат. Типовий приклад 37 1-бром-3-[2,2-біс(етоксикарбоніл)-2-(п-толуоїламіно)етил]бензол До 100мл сухого етанолу додають 21,45г 20% етанольного розчину етоксиду натрію та 17,61г діетил-птолуоїламіномалонату та перемішують протягом 30 хвилин при кімнатній температурі під атмосферою аргону. Після додання по краплях 15,00г 3-бромбензилброміду, реакційний розчин перемішують протягом 8 годин при 55°С, а потім концентрують. До залишку додають воду та екстрагують етилацетатом. Органічний шар промивають розсолом та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 29,82г цільової сполуки у вигляді жовтої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1.31 (6Н, т), 2,41 (3Н, с), 3,74 (2Н, с), 4,30 (4Н, кв), 6,90-7,40 (7Н, м), 7,60-7,70 (2Н, м). Типовий приклад 38 1-Бром-3-[2-карбокси-2-(п-толуоїламіно)етил]бензол 1-Бром-3-[2,2-біс(етоксикарбоніл)-2-(п-толуоїламіно)етил]бензол (28,93г) розчиняють у 200мл етанолу, додають розчин 9,6г гідроксиду натрію/60мл води та нагрівають до кипіння зі зворотним холодильником протягом 3 годин. Реакційний розчин концентрують. До залишку додають воду та промивають діетиловим ефіром. Водний шар підкислюють хлористоводневою кислотою, екстрагують етилацетатом. Органічний шар осушають над безводним сульфатом магнію та концентрують, одержуючи 24,19г цільової сполуки у вигляді безбарвної маслянистої рідини. Одержану маслянисту рідину розчиняють у 150мл етилацетату і, після додавання 150мл ксилолу, перемішують протягом 15 годин при 130°С. Розчинник відганяють при зниженому тиску і одержані кристали промивають діетиловим ефіром, одержуючи 17,22г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 196-197°С. Типовий приклад 39 1-[2-Ацетил-2-(п-толуоїламіно)етил]-3-бромбензол 1-Бром-3-[2-карбокси-2-(п-толуоїламіно)етил]бензол (16,84г) розчиняють у 85мл піридину, додають 55мл оцтового ангідриду та перемішують протягом 3 годин під атмосферою аргону при 90-95°С. Поступово додають по краплях воду (55мл) таким чином, щоб максимальна температура не перевищувала 100°С, і суміш перемішують протягом 20 хвилин при 60-70°С. Реакційний розчин охолоджують, виливають у льодяну воду та екстрагують етилацетатом. Одержаний розчин промивають по черзі 10% хлористоводневою кислотою, водою та насиченим водним розчином бікарбонату натрію і осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску. Одержані кристали промивають ізопропіловим ефіром, одержуючи 13,31 г цільової сполуки у вигляді коричнюватих кристалів. Т.пл. 106-107°С. Типовий приклад 40 1-Бром-3-{[5-метил-2-(п-толіл)оксазол-4-іл]метил}бензол 1-[2-Ацетил-2-(п-толуоїламіно)етил]-3-бромбензол (13,26г) розчиняють у 260мл толуолу, додають 6,8мл оксихлориду фосфору та нагрівають до кипіння зі зворотним холодильником протягом 3 годин. Реакційний розчин охолоджують, виливають у льодяну воду та екстрагують етилацетатом. Одержаний розчин промивають водним розчином насиченого бікарбонату натрію, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, нгексан:етилацетат =4:1), одержуючи 10,86г цільової сполуки у вигляді жовтуватих кристалів. Т.пл. 74-75°С. Типовий приклад 41 3-{[5-Метил-2-(п-толіл)оксазол-4-іл]метил}бензальдегід Ν,Ν-Диметилформамід (30мл) додають до 9,48г 1-бром-3-{[5-метил-2-(п-толіл)оксазол-4-іл]метил}бензолу, 2,83г форміату натрію та 0,97г ди хлориду біс(трифенілфосфін)паладію(ІІ), і суміш перемішують протягом 9 годин при 110°С, барботуючи монооксид карбону. До реакційного розчину додають воду та екстрагують етилацетатом, фільтрують для видалення нерозчинних речовин, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан: етил ацетат =4:1), одержуючи 3,58г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 98-99 °С. Типовий приклад 42 3-{[5-Метил-2-(п-толіл)оксазол-4-іл]метил}бензиловий спирт 3-{[5-Метил-2-(п-толіл)оксазол-4-іл]метил}бензальдегід (3,54г) суспендують у 35мл метанолу та додають до нього 230мг боргідриду натрію при перемішуванні з охолодженням льодом, і перемішують протягом 1,5 годин при кімнатній температурі. Реакційний розчин виливають у льодяну воду, екстрагують етилацетатом, промивають водою та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 3,54г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 97-99°С. Типовий приклад 43 3-{[5-Метил-2-(п-толіл)оксазол-4-іл]метил}бензилбромід 3-{[5-Метил-2-(п-толіл)оксазол-4-іл]метил}бензиловий спирт (3,52г) розчиняють у 60мл дихлорметану. Після додавання 3,77г трифенілфосфіну та 5,17г тетраброміду карбону, суміш перемішують протягом 30 хвилин при кімнатній температурі. Реакційний розчин концентрують та залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =4:1), одержуючи 3,96г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 101-102°С. Типовий приклад 44 Діетил-3-{[5-метил-2-(п-толіл)оксазол-4-іл]метил}бензилмалонат До 15мл, сухого тетрагідрофурану та 7мл сухого Ν,Ν-диметилформаміду додають 0,88г 60% гідриду натрію. До суміші додають по краплях 4,40г діетилмалонату при перемішуванні з охолодженням льодом. Після 15-хвилинного перемішування додають розчин 3,93г 3-{[5-метил-2-(п-толіл)оксазол-4іл]метил}бензилброміду/5мл сухого тетрагідрофурану та перемішують протягом 1 години при охолодженні льодом. Реакційний розчин виливають у льодяну воду, екстрагують етилацетатом, промивають водою та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску та залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =5:1), одержуючи 3,95г цільової сполуки у ви гляді безбарвних кристалів. 1 Н-ЯМР (CDCI3) δ: 1,17 (6Η, τ), 2,25 (3Н, с), 2,38 (3Н, с), 3,18 (2Н, д), 3,62 (1Н, т), 4,07 (2Н, с), 4,12 (4Н, кв), 7,00-7,30 (6Н, м), 7,80-7,90 (2Н, м). Типовий приклад 45 2-[3-{[5-Метил-2-(п-толіл)оксазол-4-іл]метил}бензил]-1,3-пропандіол До 30мл сухого тетрагідрофурану додають 854мг гідриду літію-алюмінію, і додають по краплях при перемішуванні 3,94г діетил-3-{[5-метил-2-(п-толіл)оксазол-4-іл]метил}бензилмалонату/10мл сухого тетрагідрофурану при охолодженні льодом. Суміш перемішують протягом 1,5 години при кімнатній температурі та охолоджують льодяною водою. До суміші додають по черзі по краплях 0,85мл води, 0,85мл 15% розчину гідроксиду натрію та 2,5мл води, і перемішують протягом 15 хвилин. Суміш фільтрують для видалення нерозчинних речовин і фільтрат концентрують. Залишок розчиняють у етилацетаті та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску та залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, хлороформ:метанол =20:1), одержуючи 2,32г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 114-115°С. Типовий приклад 46 Діетил-(3-фтор-4-метилбензоїл)аміномалонат До розчину 10,1г 3-фтор-4-метилбензойної кислоти та 15,2г діетилмалонату гідрохлориду у 200мл Ν,Νдиметилформаміду додають по черзі 9,7г 1-гідроксибензотриазолу, 23мл триетиламіну та 13,8г 1-(3диметиламінопропіл)-3-етилкарбодііміду гідрохлориду, і перемішують протягом 1 години при кімнатній температурі. Після додавання до реакційного розчину води суміш екстрагують етилацетатом. Екстракт промивають по черзі водою, 10% хлористоводневою кислотою, водою, насиченим водним розчином бікарбонату натрію та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску та залишок кристалізують додаванням ізопропілового ефіру, одержуючи 15,1г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 102-103 °С. Типовий приклад 47 1-(п-Толуолсульфонілокси)-3-[2-(п-толіл)-5-трифторметилоксазол-4-іл]пропан 3-[2-(п-Толіл)-5-трифторметилоксазол-4-іл]-1-пропанол (6,40г), синтезований за методом Kawase et. al. (Chem. Pharrn. Bull., 46, 749-756 (1998)), розчиняють у 35мл дихлорметану. До розчину додають по черзі 293мг 4-(диметиламіно)піридину, 4,7мл триетиламіну та 5,13г п-толуолсульфонілхлориду та перемішують протягом 3 годин при кімнатній температурі. До реакційного розчину додають етилацетат та промивають по черзі водою, 10% хлористоводневою кислотою та насиченим водним розчином бікарбонату натрію, і осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 10,08г цільової сполуки у вигляді блідо-коричневих кристалів. Т.пл. 57-58°С. Типовий приклад 48 4-[2-(п-Толіл)-5-трифторметилоксазол-4-іл]-бутаннітрилу До 40мл диметилсульфоксиду додають 10,08г 1(п-толуолсульфонілокси)-3-[2-(п-толіл)-5трифторметилоксазол-4-іл]пропану, 1,16г ціаніду натрію та перемішують протягом 2 годин при 90°С. До реакційного розчину додають воду і суміш екстрагують діетиловим ефіром, промивають водою та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 6,35г цільової сполуки у вигляді блідо-коричневих кристалів. Т.пл. 41-42,5°С. Типовий приклад 49 Метил-4-[2-(п-толіл)-5-трифторметилоксазол-4-іл]бутаноат 4-[2-(п-Толіл)-5-трифторметилоксазол-4-іл]бутаннітрил (5,28г) розчиняють у 40мл метанолу, та перемішують протягом 10 хвилин при охолодженні льодом, барботуючи газоподібний хлористий водень. Після припинення барботування суміш підігрівають до кімнатної температури та перемішують протягом 30 хвилин. До реакційного розчину додають 5мл води та суміш перемішують протягом 30 хвилин і залишають при кімнатній температурі на ніч. Після додавання води реакційний розчин екстрагують етилацетатом. Екстракт промивають насиченим водним розчином бікарбонату натрію, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogei® С-200, нгексан:етилацетат =4:1), одержуючи 5,63г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 44,5-45°С. Типовий приклад 50 Метил-4-(фторметил)бензоат Сухий ацетонітрил (150мл) додають до 25,00г метил-4-(бромметил)бензоату, 19,02г фториду калію та 9,51г фториду кальцію і суміш нагрівають до кипіння зі зворотним холодильником протягом 3 днів. Реакційний розчин концентрують. Після додавання 200мл ацетонітрилу, нерозчинні речовини видаляють фільтрацією і фільтрат знов концентрують. Залишок очищають хроматографією на колонці з силікагелем (YMC-GEL® SIL60-230/70, н-гексан:етилацетат =10:1-4:1), з наступною дистиляцією при зниженому тиску, одержуючи 14,45г цільової сполуки у вигляді безбарвної маслянистої рідини. Т.кип. 118,5-119°С/18мм рт.ст. 1 Н-ЯМР (CDCI3) δ: 3,93 (3Н, с), 5,44 (2Н, д), 7,40-7,46 (2Н, м), 8,03-8,09 (2Н, м). Типовий приклад 51 4-(Фторметил)бензойна кислота У 200мл метанолу розчиняють 8,68г метил-4-(фторметил)бензоату і додають по краплях при перемішуванні та охолодженні 77мл водного розчину 1Н гідроксиду натрію. Суміш потім перемішують протягом 3,5 годин при кімнатній температурі. Після підкислення суміші 1Н хлористоводневою кислотою кристали, що випалу до осаду, збирають фільтрацією і фільтрат концентрують. Кристали, що випали до осаду, об'єднують із залишком, одержаним шляхом концентрування фільтрату, і додають до них воду. С уміш екстрагують етилацетатом і осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 7,47г цільової сполуки у ви гляді безбарвних кристалів. Т.пл. 192-194°С. Типовий приклад 52 4-(Фторметил)бензоїлхлорид 4-(Фторметил)бензойну кислоту (6,20г) розчиняють у 30мл бензолу, додають 0,3мл Ν,Νдиметилформаміду, а потім додають по краплях 4,4мл тіонілхлориду. С уміш перемішують протягом 1 години при 40°С, а потім нагрівають до кипіння зі зворотним холодильником протягом ще 1 години. Розчинник відганяють при зниженому тиску, одержуючи 6,70г цільової сполуки у вигляді блідо-жовтої маслянистої рідини. Типовий приклад 53 Етил-6-хлор-2-етоксикарбоніл-2-(п-толуоїламіно)гексаноат Натрій (6,42г) розчиняють у 390мл етанолу при кімнатній температурі. До розчину додають 78,0г діетил-птолуоїламіномалонату та додають по краплях при нагріванні до кипіння зі зворотним холодильником 47,9г 1бром-4-хлорбутану. Суміш нагрівають до кипіння зі зворотним холодильником протягом 20 годин. Реакційний розчин концентрують. До залишку додають воду і суміш промивають етилацетатом. Після промивання по черзі 10% хлористоводневою кислотою та водою, розчин осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, нгексан:етилацетат =9:1), одержуючи 55,7г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,26 (6Н, т), 1,26-1,42 (2Н, м), 1,72-1,86 (2Н, м), 2,41 (3Н, с), 2,44-2,52 (2Н, м), 3,51 (2Н, т), 4,28 (4Н, кв), 7,24-7,28 (2Н, м), 7,48 (1Н, с), 7,71-7,75 (2Н, м). Типовий приклад 54 6-Хлор-2-(п-толуоїламіно)гексанова кислота Етил-6-хлор-2-етоксикарбоніл-2-(п-толуоїламіно)-гексаноат (103,2г) розчиняють у 412мл етанолу, додають розчин 24,5г гідроксиду натрію/98мл води та нагрівають до кипіння зі зворотним холодильником протягом 16 годин. Реакційний розчин концентрують. До залишку додають етилацетат. Суміш підкислюють хлористоводневою кислотою та екстрагують етилацетатом. Екстракт промивають водою, осушають над безводним сульфатом магнію та концентрують, одержуючи 80,0 г безбарвної смолистої речовини. До одержаної смоли додають 75мл оцтової кислоти та нагрівають до кипіння зі зворотним холодильником протягом 10 годин. Після перемішування суміші та вистоювання до охолодження кристали, що випали до осаду, промивають етилацетатом та перекристалізовують з оцтової кислоти, одержуючи 26,0г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 177-181°С. Типовий приклад 55 8-Хлор-4-(п-толуоїламіно)-3-октанон 6-Хлор-2-(п-толуоїламіно)гексанову кислоту (10,0г) розчиняють у 15мл сухого піридину, додають 15мл пропіонового ангідриду та перемішують протягом 2,5 годин при 90°С. До суміші додають повільно 15мл води так, щоб максимальна температура не перевищувала 85°С, та перемішують протягом 20 хвилин при 80°С. Реакційний розчин охолоджують, виливають у льодяну воду та екстрагують діетиловим ефіром. Екстракт промивають по черзі 10% хлористоводневою кислотою, насиченим водним розчином бікарбонату натрію та розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =8:1-4:1), одержуючи 6,0г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 85-86°С. Типовий приклад 56 4-(4-Хлорбутил)-5-етил-2-(п-толіл)оксазол У 150мл толуолу розчиняють 6,5г 8-хлор-4-(п-толуоїламіно)-3-октанону, додають 4,1мл дксихлориду фосфор у та нагрівають до кипіння зі зворотним холодильником протягом 1,5 годин. Реакційний розчин охолоджують, виливають у льодяну воду та екстрагують етилацетатом. Екстракт промивають по черзі насиченим водним розчином бікарбонату натрію та розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, нгексан:етилацетат =8:1), одержуючи 5,5г цільової сполуки у вигляді жовтувати х кристалів. 1 Н-ЯМР (CDCI3) δ: 1,27 (3Н, т), 1,78-1,87 (4Н, м), 2,38 (3Н, с), 2,52 (2Н, т), 2,67 (2Н, кв), 3,57 (2Н, т), 7,23 (2Н, д), 7,84-7,89 (2Н, м). Типовий приклад 57 Діетил-4-[5-етил-2-(п-толіл)оксазол-4-іл]бутилмалонат До 32,8мл 21% етанольного розчину етоксиду натрію додають при нагріванні до кипіння зі зворотним холодильником 16,7мл діетилмалонату. Потім додають по краплях 5,0г 4-(4-хлорбутил)-5-етил-2-(птоліл)оксазолу/5мл етанолу та суміш нагрівають до кипіння зі зворотним холодильником протягом 7 годин під атмосферою аргону. Реакційний розчин виливають у льодяну воду та екстрагують етилацетатом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =10:1), одержуючи 2,65 г цільової сполуки у вигляді жовтої маслянистої рідини. 1 Н-ЯМР (CDCІ3) δ: 1,25 (6Н, т), 1,29 (ЗН, т), 1,35-1,46 (2Н, м), 1,65-1,73 (2Н, м), 1,88-1,99 (2Н, м), 2,39 (3Н, с), 2,48 (2Н, т), 2,66 (2Н, кв), 3,32 (1Н, т), 4,13-4,26 (4Н, м), 7,22 (2Н,д), 7,87 (2Н,д). Типовий приклад 58 За методикою, описаною у наведеному далі Прикладі 6, були одержані такі сполуки: 2,2-Диметил-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан, Метил-4-(5-метил-2-фенілоксазол-4-іл)бутират, і Метил-3-(5-метил-2-фенілоксазол-4-іл)пропіонат. Типовий приклад 59 1-(о-Толуоїламіно)-2-пропанол До 100мл розчину 5,83г 1-аміно-2-пропанолу у толуолі додають 18,0мл триетиламіну та повільно додають, по краплях 10мл розчину 10,00г о-толуоїлхлориду у толуолі при перемішуванні з охолодженням льодом. Після 30-хвилинного перемішування льодяну баню забирають та суміш перемішують протягом ще 1 години при кімнатній температурі. До реакційного розчину додають воду та суміш екстрагують етилацетатом. Екстракт промивають по черзі 10% хлористоводневою кислотою, льодяною водою та насиченим водним розчином бікарбонату натрію, осушають над безводним сульфатом магнію та розчинник відганяють при зниженому тиску. Зали шок кристалізують шляхом додавання діетилового ефіру, одержуючи 7,25г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 78-81°С. За методикою, описаною у Типовому прикладі 59, були одержані такі сполуки: 1-(4-Фторметилбензоїламіно)-2-пропанол, 1-(м-Толуоїламіно)-2-пропанол, і 1-(Циклогексилкарбоніламіно)-2-пропанол. Типовий приклад 60 1-(о-Толуоїламіно)-2-пропанон Хлорхромат піридинию (15,91г) додають до 143мл суспензії 7,13г 1-(о-толуоїламіно)-2-пропанолу та 15,91г целіту у ди хлорметані при перемішуванні. Суміш перемішують протягом 4 годин при кімнатній температурі. Реакційний розчин очищають хроматографією на колонці з силікагелем (Wakogel® C-200, хлороформ) та розчинник відганяють при зниженому тиску. Елюат знов очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =1:2), одержуючи 5,73г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 65-66°С. За методикою, описаною у Типовому прикладі 60, були одержані такі сполуки: 1-(2,4-Диметилбензоїламіно)-2-пропанон, 1-(4-Фторметилбензоїламіно)-2-пропанон, 1-(м-Толуоїламіно)-2-пропанон, 1-(3,4-Диметилбензоїламіно)-2-пропанон, 1 -(4-Метоксибензоїламіно)-2-пропанон, та 1-(Циклогексилкарбоніламіно)-2-пропанон. Типовий приклад 61 Метил-с-5-[5-ацетил-5-(о-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат Під атмосферою аргону 40мл суспензії 1,18г 60% гідриду натрію у Ν,Ν-диметилформаміді охолоджують до -25°С на бані з сухим льодом-ацетоном, а потім повільно додають по краплях 15мл розчину 5,65г 1-(отолуоїламіно)-2-пропанону у Ν,Ν-диметилформаміді. Після 1-годинного перемішування повільно додають по краплях 5мл розчину 10,09г метил-с-5-(4-йодбутил)-2-метил-1,3-діоксан-r-2-карбоксилату у Ν,Νдиметилформаміді та суміш перемішують протягом ще 1 години. До реакційного розчину додають 1мл 1Н хлористоводневої кислоти, а потім воду, і суміш екстрагують діетиловим ефіром. Екстракт промивають водним 0,5% розчином гідроксиду натрію, осушають над безводним сульфатом магнію та розчинник відганяють при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем (Wakogei® C-200, нгексан:етилацетат =1:1), одержуючи 6,38г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCl3) δ: 1,01-1,08 (2Н, м), 1,22-1,39 (4Н, м), 1,51 (3Н, с), 1,62-1,71 (2Н, м), 1,97-2.09 (1Н, м), 2,28 (3Н, с), 2,44 (3Н, с), 3,39 (2Н, т), 3,83 (3Н, с), 3,94 (2Н, дд), 4,84 (1Н. кв), 6,49 (1Н, д), 7,22-7,42 (4Н, м). За методикою, описаною у Типовому прикладі 61, були одержані такі сполуки: Метил-с-5-[5-ацетил-5-(2,4-диметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(4-фторметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(м-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(3,4-диметилбензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-[5-ацетил-5-(4-метоксибензоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбсксилат, Метил-с-5-[5-ацетил-5-(2-теноїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат, і Метил-с-5-[5-ацетил-5-(циклогексилкарбоніламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат. Типовий приклад 62 1-3,4-Диметилбензоїламіно)-2-пропанол Де 30мл розчину 5,00г 3,4-диметилбензойної кислоти та 2,75г 1-аміно-2-пропанолу у Ν,Νдиметилформаміді додають по черзі 4,95г 1-гідроксибензотриазолу, 6,96мл триетиламіну та 7,02г 1-(3диметиламінопропіл)-3-етилкарбодііміду гідрохлориду та перемішують протягом 15 годин при кімнатній температурі. Після додавання води, реакційний розчин екстрагують етилацетатом, промивають по черзі 10% хлористоводневою кислотою, льодяною водою та насиченим водним розчином бікарбонату натрію, і осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 6,28г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 77-78°С. За методикою, описаною у Типовому прикладі 62, були одержані такі сполуки: 1-(2,4-Диметилбензоїламіно)-2-пропанол, і 1-(4-Метоксибензоїламіно)-2-пропанол. Типовий приклад 63 Метил-2-(2-теноїламіно)ацетат До 250мл суспензії 12,56г метил-2-аміноацетату гідрохлориду у ди хлорметані додають 20,24г триетиламіну та перемішують протягом 30 хвилин при кімнатній температурі. Після охолодження льодом повільно додають по краплях 20мл розчину 14,66г 2-теноїлхлориду у ди хлорметані. Льодяну баню забирають і суміш перемішують протягом 14 годин при кімнатній температурі. Кристали, що випали до осаду, збирають фільтрацією та промивають дихлорметаном. Розчинник видаляють з фільтрату дистиляцією при зниженому тиску. До залишку додають т-бутилметиловий ефір для осадження. Обидва продукти об'єднують, одержуючи 17,20 г цільової сполуки у вигляді коричнюватих кристалів. 1 Н-ЯМР (CDCI3) δ: 3,80 (3Н, с), 4,23 (2Н, д), 6,62 (1Н, шир.), 7,09 (1Н, дд), 7,50 (1Н, дд), 7,57(1Н, дд). Типовий приклад 64 2-(2-Теноїламіно)ацетат натрію До 200мл розчину 16,70г метил-2-(2-теноїламіно)ацетату у метанолі додають 20мл водного розчину 4,02г гідроксиду натрію та нагрівають до кипіння зі зворотним холодильником протягом 30 хвилин. Розчинник відганяють при зниженому тиску. Залишок кристалізують шляхом додавання ізопропанолу, одержуючи 18,03г цільової сполуки у вигляді блідо-жовтих кристалів. Типовий приклад 65 1-(2-Теноїламіно)-2-пропанон До 44,0мл суспензії 16,70г 2-(2-теноїламіно)ацетату натрію у β-піколіні додають 42,7мл оцтового ангідриду та перемішують протягом 3 годин при кімнатній температурі. Після охолодження льодом повільно додають по краплях по черзі 26,3мл етанолу, 129,7мл води та 45,2мл конц.хлористоводневої кислоти і суміш перемішують протягом 15 хвилин, як вона є. Після забирання льодяної бані суміш перемішують протягом ще 15 хвилин при кімнатній температурі. Додають воду (250мл) і кристали, що випали до осаду, збирають та промивають водою. До кристалів додають 37,0мл води та суміш нагрівають до кипіння зі зворотним холодильником протягом 1 години. Після додавання 14,0г хлориду натрію суміш нагрівають до кипіння зі зворотним холодильником протягом ще 1 години. Реакційний розчин екстрагують етилацетатом та осушають над безводним сульфатом магнію. Після додавання активованого вугілля (Kyoryoku-sirasagi® MOIWY433), суміш перемішують протягом 30 хвилин при кімнатній температурі. Розчинник відганяють при зниженому тиску. Залишок кристалізують шляхом додавання т-бутилметилового ефіру, одержуючи 7,15г цільової сполуки у вигляді блідо-коричневих кристалів. 1 Н-ЯМР (СОСІ 3) δ: 2,27 (ЗН, с), 4,34 (2Н, д), 6,80 (1Н, шир.), 7,09 (1Н, дд), 7,50 (1Н, дд), 7,57(1Н, дд). Типовий приклад 66 4-[5,5-Біс(бромметил)пентил]-5-метил-2-(п-толіл)-оксазол До 15мл розчину 2,25г 4-[5,5-біс(гідроксиметил)пентил]-5-метил-2-(п-толіл)оксазолу у Ν,Νдиметилформаміді додають по черзі 3,92мл g-колідину, 2,57г броміду літію та 2,3мл метансульфонілхлориду, та перемішують при нагріванні протягом 2,5 годин при 80°С. До реакційного розчину додають воду та суміш екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію і розчинник відганяють при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C200, н-гексан.-етилацетат =9:1), одержуючи 1,45г цільової сполуки у вигляді коричневої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,30-1,55 (2Н, м), 1,60-1,85 (4Н, м), 1,95-2,15 (1Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,49 (2Н, т), 2,82-3,05 (4Н, м), 7,38-7,45 (2Н, м), 7,94-8,01 (2Н, м). Типовий приклад 67 4-[5,5-Біс(ацетилтіометил)пентил]-5-метил-2-(п-толіл)оксазол До 4мл розчину 923мг 4-[5,5-біс(бромметил)лентил]-5-метил-2-(п-толіл)оксазолу у поліетиленгліколі-200 додають 1,18г тіолацетату калію та перемішують при нагріванні протягом 1,5 годин при 80°С. До реакційного розчину додають воду та суміш екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію і розчинник відганяють при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =9:1), одержуючи 830мг цільової сполуки у вигляді коричневої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,35-1,50 (4Н, м), 1,55-1,70 (2Н, м), 1,75-1,95 (1Н, м), 2,32 (3Н, с), 2,33 (6Н, с), 2,38 (3Н, с), 2,47 (2Н, т), 2,82-3,05 (4Н, м), 7,20-7,25 (2Н, м), 7,84-7,89 (2Н, м). За методикою, описаною у Типовому прикладі 67, були одержані такі сполуки: 5-Метил-4-(6-ацетилтіогексил)-2-(п-толіл)оксазол. Типовий приклад 68 4-[5,5-Біс(меркаптометил)пентил]-5-метил-2-(л-толіл)оксазол До 8мл розчину 830мг 4-[5,5-біс(ацетилтіометил)пентил]-5-метил-2-(п-толіл)оксазолу у метанолі додають 8мл водного 1Н розчину гідроксиду натрію та нагрівають до кипіння зі зворотним холодильником протягом 1 години. Реакційний розчин підкислюють 1Н хлористоводневою кислотою, екстрагують дихлорметаном та осушають над безводним сульфатом магнію. Розчинник відганяють при зниженому тиску, одержуючи 635мг цільової сполуки у вигляді блідо-жовтої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,25-1,95 (9Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,48 (2Н, т), 2,55-2,85 (4Н, м), 7,16-7,24 (2Н, м), 7,81-7,89 (2Н, дд). Типовий приклад 69 Етил-6-йодгексаноат До 112мл розчину 13,38г етил-6-бромгексаноату у ацетоні додають 26,97г йодиду натрію та нагрівають до кипіння зі зворотним холодильником протягом 18 годин. Реакційний розчин охолоджують, фільтрують для видалення нерозчинних речовин та промивають ацетоном. Фільтрат концентрують і, після додавання води, екстрагують етилацетатом. Органічний шар промивають водою та розсолом по черзі, осушають над безводним сульфатом магнію та концентрують, одержуючи 16,21г цільової сполуки у вигляді червоно-жовтої маслянистої рідини. 1 Н-ЯМР (СОСІ3) δ: 1,26 (3Н, т), 1,39-1,51 (2Н, м), 1,58-1,73 (2Н, м), 1,78-1,92 (2Н, м), 2,31 (2Н, т), 3,19 (2Н, т), 4,13 (2Н, кв). Типовий приклад 70 Етил-7-ацетил-7-(п-толуоїламіно)гептаноат Суспензію (100мл) 60% гідриду натрію (2,64г) у Ν,Ν-диметилформаміді охолоджують до -18°С за допомогою бані з льодом-хлоридом натрію, та повільно додають по краплях 31мл розчину 12,62г 1-(птолуоїламіно)-2-пропанону у Ν,Ν-диметилформаміді. Після 1-годинного перемішування повільно додають по краплях 31мл розчину 16,21г етил-6-йодгексаноату у Ν,Ν-диметилформаміді. Льодяну баню забирають та суміш перемішують протягом 18 годин при кімнатній температурі. Після додавання льодяної води реакційний розчин екстрагують етилацетатом, промивають по черзі водою та розсолом, осушають над безводним сульфатом магнію та розчинник відганяють при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =3:1), одержуючи 13,13г цільової сполуки у вигляді жовтої маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,20-1,45 (4Н, м), 1,24 (3Н, т), 1,54-1,77 (3Н, м), 2,01-2,08 (1Н, м), 2,23-2,31 (2Н, т), 2,40 (3Н, с), 2,78 (3Н, с), 4,11 (2Н, кв), 4,18-4,90 (1Н, м), 6,90 (1Н, д), 7,25 (2Н,д), 7,71 (2Н,д). Типовий приклад 71 Етил-2-(6-йодгексилокси)-2-метилпропіонат До 76мл розчину 12,16г етил-2-(6-бромгексилокси)-2-метилпропіонату у ацетоні додають 18,52г йодиду натрію та нагрівають до кипіння зі зворотним холодильником протягом 18 годин. Реакційний розчин охолоджують, фільтрують для видалення нерозчинних речовин та промивають ацетоном. Фільтрат концентрують і, після додавання води, екстрагують етилацетатом. Органічний шар промивають по черзі водою та розсолом, осушають над безводним сульфатом магнію та концентрують, одержуючи 14,46г цільової сполуки у вигляді червоно-жовтої маслянистої рідини. 1 Н-ЯМР (CDCb) δ: 1,29 (3Н, т), 1,37-1,40 (4Н, м), 1,41 (6Н, с), 1,55-1,62 (2Н, м), 1,80-1,87 (2Н, м), 3,19 (2Н, т), 3,56 (2Н, т), 4,12 (2Н, кв). Типовий приклад 72 Етил-2-[7-ацетил-7-(п-толуоїламіно)гептилокси]-2-метилпропіонат Суспензію (70мл) 1,81г 60% гідриду натрію у Ν,Ν-диметилформаміді охолоджують до -18°С за допомогою бані з льодом-хлоридом натрію та додають повільно 21мл розчину 8,67г 1-(п-толуоїламіно)-2-пропанону у Ν ,Νдиметилформаміді. Після 1-годинного перемішування повільно додають по краплях 21мл розчину 14,10г етил2-(6-йодгексилокси)-2-метилпропіонату у Ν,Ν-диметилформаміді. Баню-забирають і суміш перемішують протягом ще 18 годин при кімнатній температурі. Реакційний розчин після додавання льодяної води екстрагують етилацетатом, промивають по черзі водою та розсолом, осушають над безводним сульфатом магнію, і розчинник відганяють при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =3:1), одержуючи 12,20г цільової сполуки у вигляді жовтих кристалів. 1 Н-ЯМР (CDCI3) δ: 1,23-1,41 (6Н, м), 1,27 (3Н, т), 1,39 (6Н, с), 1,51-1,57 (2Н, м), 1,71-1,74 (1Н, m)-2-,01-2,08 (1Н, м), 2,27 (3Н, с), 2,40 (3Н, с), 3,32 (2Н, т), 4,17 (2Н, кв), 4,80-4,90 (1Н, м), 6,89 (1Н, д), 7,25 (2Н, д), 7,71 (2Н, д). Типовий приклад 73 7-(Бензоїламіно)-7-карбокси-(Е)-4-гептенова кислота До 170мл розчину 8,50г діетил-[5-(бензоїламіно)-5,5-біс(етоксикарбоніл)-(Е)-2-пентеніл]малонату у етанолі додають 34мл водного розчину гідроксиду натрію (5,53г) та нагрівають до кипіння зі зворотним холодильником протягом 20 годин. Реакційний розчин концентрують і залишок, після додавання води, промивають діетиловим ефіром. Водний шар підкислюють хлористоводневою кислотою, екстрагують етилацетатом, осушають над безводним сульфатом магнію та концентрують, одержуючи 6,58г блідо-жовтої маслянистої рідини. Одержану маслянисту рідину розчиняють у 90мл етилацетату. До розчину додають 90мл ксилолу та перемішують протягом 15 годин при 130°С. Розчинник відганяють при зниженому тиску, і кристали, що утворюються, промивають ізопропіловим ефіром, одержуючи 4,52г цільової сполуки у вигляді безбарвних кристалів. Т.пл. 138°С. Приклад 1 Метил-2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат 4-[5,5-Біс(гідроксиметил)пентил]-5-метил-2-фенілоксазол (36г) розчиняють у 432мл ацетонітрилу і додають 25,4г метилпірувату. До суміші додають при перемішуванні при кімнатній температурі 35,3г ефірату трифториду бору (приблизно 47%) та кип'ятять зі зворотним холодильником протягом 2 годин. Реакційний розчин охолоджують, виливають в о холоджений льодом водний розчин гідрогенкарбонату натрію та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н гексан:етилацетат =7,5:1) і фракції, що елююються раніше, концентрують, одержуючи 16,5г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCl3) δ: 1,00-1,12 (2Н, м), 1,22-1,40 (2Н, м), 1,55-1,70 (5Н, м), 1,90-2,20 (1Н, м), 2,30 (3Н, с), 2,45 (2Н, т), 3,39 (2Н, т), 3,82 (3Н, с), 3,95 (2Н, дд), 7,37-7,47 (3Н, м), 7,92-8,03 (2Н, м). Приклад 2 Метил-2-метил4-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат Останні фракції за Прикладом 1 збирають та концентрують, одержуючи 11г залишку, який знов очищають хроматографією на колонці з силікагелем (Wakogel® С-200, н-гексан:етилацетат =7,5:1), одержуючи 0,83г цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,33-1,44 (3Н, м), 1,51 (3Н, с), 1,63-1,78 (4Н, м), 2,33 (3Н, с), 2,51 (2Н, т), 3,75-3,81 (2Н, м), 3,83 (3Н, с), 3,91-3,99 (2Н, м), 7,38-7,45 (3Н, м), 7,96-8,01 (2Н, м). За методикою, описаною у Прикладах 1 та 2, були одержані такі сполуки: Метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-t-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-2-етил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)-бутил]-1,3-діоксан-r-2-карбоксилат, Метил-2-ізобутил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-2,5-диметил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-2,5-диметил-t-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-5-етил-2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-5-етил-2-метил-t-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-[3-(5-метил-2-фенілоксазол-4-іл)пропіл]-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-t-5-[3-(5-метил-2-фенілоксазол-4-іл)пропіл]-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[(5-метил-2-фенілоксазол-4-іл)метил]бензил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[(5-метил-2-фенілоксазол-4-іл)метил]феніл}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{3-[(5-метил-2-фенілоксазол-4-іл)-метил]феніл}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[2-(п-толіл)-5-трифторметил-оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-етил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, і Етил-2-етил-с-5-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат. Приклад 3 Метил-2-метил-с-5-[4-(2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат До 5мл ацетонітрилу, у якому розчиняють 1,25г 4-[5,5-біс(гідроксиметил)пентил]-2-фенілоксазолу, додають 927мг метилпірувату. До суміші додають при перемішуванні при кімнатній температурі 1,3г е фірату трифториду бор у (приблизно 47%) і перемішують протягом 30 годин при кімнатній температурі. Реакційний розчин виливають у льодяний водний розчин бікарбонату натрію та екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:ізопропіловий ефір =1:1) і фракції, що елююються раніше, концентрують, одержуючи 450мг цільової сполуки у вигляді білих кристалів. Т.пл. 71-74°С. 1 Н-ЯМР (CDCI3) δ: 1,01-1,12 (2Н, м), 1,27-1,43 (2Н, м), 1,51 (3Н, с), 1,59-1,74 (2Н, м), 1,90-2,20 (1Н, м), 2,56 (2Н, т), 3,39 (2Н, т), 3,83 (3Н, с), 3,96 (2Н, дд), 7,41-7,47 (4Н, м), 7,99-8,05 (2Н, м). Приклад 4 Метил-2-метил-tІ-5-[4-(2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат Останні фракції за Прикладом 3 збирають та концентрують. Залишок знов . очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексаном:ізопропіловий ефір =1:1), одержуючи 110мг цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР (CDCI3) δ: 1,25-1,48 (2Н, м), 1,51 (3Н, с), 1,63-1,80 (5Н, м), 2,62 (2Н, т), 3,76-3,86 (5Н, м), 3,92-4,00 (2Н, м), 7,41-7,47 (4Н, м), 8,00-8,05 (2Н, м). Приклад 5 Метил-2-метил-5-{3-[(5-метил-2-фенілоксазол-4-іл)метил]бензил}-1,3-діоксан-2-карбоксилат До 5мл ацетонітрилу додають 297мг 4-{3-[2,2-біс-(гідроксиметил)етил]-бензил}-5-метил-2-фенілоксазолу та 369мг метилпірувату. До суміші додають 544мг ефірату трифториду бору (приблизно 47%) при перемішуванні при кімнатній температурі, і перемішують протягом 14 годин при кімнатній температурі. Реакційний розчин виливають у льодяний водний розчин бікарбонату натрію і екстрагують етилацетатом. Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, н-гексан:етилацетат =3:1), одержуючи 185мг суміші (цис:транс =2,5:1, на основі інтегрального значення ЯМР) у вигляді безбарвної маслянистої рідини. Приклад 6 Метил-2-метил-С-5-{4-[5-метил-2-(п-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат Метил-с-5-[5-ацетил-5-(п-толуоїламіно)пентил]-2-метил-1,3-діоксан-r-2-карбоксилат (0,85г) розчиняють у 17мл толуолу. Після додавання 644мг оксихлориду фосфору суміш нагрівають до кипіння зі зворотним холодильником протягом 2,5 годин. Реакційний розчин охолоджують, виливають у льодяну воду, нейтралізують водним розчином бікарбонату натрію, екстрагують етилацетатом, промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, хлороформ:метанол =100:1), одержуючи 0,42г цільової сполуки у вигляді білих кристалів. Т.пл. 92-94°С. Елементний аналіз для C22H29NO5: Розрах. (%): С, 68,20; Н, 7,54; N, 3,61 Знайдено (%): С, 68,07; Н, 7,43; N,3,65. За методикою, описаною у Прикладі 6, були одержані такі сполуки: Метил-2-метил-с-5-[3-(5-метил-2-фенілоксазол-4-іл)пропіл]-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-[5-(5-метил-2-фенілоксазол-4-іл)пентил]-1,3-діоксан-r-2-карбоксилат, Метил-с-5-{4-[2-(4-фтор феніл)-5-метилоксазол-4-іл]бутил}-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-с-5-{4-[2-(4-трет-бутилфеніл)-5-метилоксазол-4-іл]бутил}-2-метил-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(4-трифторметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)-(Е)-2-бутеніл]-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)гексилокси]пропіонат, Метил-2-метил-2-{6-[5-метил-2-(п-толіл)оксазол-4-іл]гексилоксиІпропіонат, Метил-2-метил-2-[6-(5-метил-2-фенілоксазол-4-іл)-4-гексинілокси]пропіонат, Метил-2-{6-[2-(4-хлорфеніл)-5-метилоксазол-4-іл]гексилокси}-2-метилпропіонат, Метил-2-{6-[2-(4-фтор феніл)-5-метилоксазол-4-іл]гексилокси}-2-метилпропіонат, Метил-2-{6-[2-(4-трет-бутилфеніл)-5-метилоксазол-4-іл]-гексилокси}-2-метилпропіонат, Метил-2-метил-2-[7-(5-метил-2-фенілоксазол-4-іл)гептилокси]пропіонат, Метил-2-метил-2-[5-(5-метил-2-фенілоксазол-4-іл)пентилокси]пропіонат, Метил-2-[6-(5-етил-2-фенілоксазол-4-іл)гексилокси]-2-метилпропіонат, Метил-2-метил-2-{6-[5-метил-2-(4-піридил)оксазол-4-іл]гексилокси}-пропіонат, Метил-2-метил-2-{6-[5-метил-2-(3-піридил)оксазол-4-іл]гексилокси}-пропіонат, Метил-2-метил-с-5-{4-[5-метил-2-(4-хлорфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{5-[5-метил-2-(п-толіл)оксазол-4-іл]пентил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(3-фтор-4-метилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(4-етилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(2,4-диметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[2-(4-фторметилфеніл)-5-метилоксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(м-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(о-толіл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(3,4-диметилфеніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(4-метоксифеніл)-оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, Метил-2-метил-с-5-{4-[5-метил-2-(2-тієніл)оксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, метил-2-метил-с-5-{4-[2-циклогексил-5-метилоксазол-4-іл]бутил}-1,3-діоксан-r-2-карбоксилат, і Етил-2-метил-2-{6-[5-метил-2-(п-толіл)оксазол-4-іл]гексилокси}пропіонат. Приклад 7 Метил-2-метил-2-[6--(2-фенілоксазол-4-іл)гексилокси]пропіонат Суміш 956мг бензаміду та 1,1г метил-2-(8-хлор-7-оксооктилокси)-2-метилпропіонату перемішують протягом 2 годин при 120°С. Реакційний розчин охолоджують, розчиняють у етилацетаті, промивають шляхом додавання бікарбонату натрію, промивають водою, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® С-200, нгексан:етилацетат =9:1), одержуючи 658 мг цільової сполуки у вигляді безбарвної маслянистої рідини. 1 Н-ЯМР.-(СDСl3) δ: 1,36-1,50 (10Н, м), 1,55-1,80 (4Н, м), 2,54-2,63 (2Н, м), 3,35 (2Н, т), 3,73 (3Н, с), 7,417,47 (4Н, м), 7,99-8,05 (2Н, м). За методикою, описаною у Прикладі 7, були одержані такі сполуки: Метил-2-метил-2-[7-(2-фенілоксазол-4-іл)гептилокси]пропіонат, Метил-2-{7-[2-(4-хлорфеніл)оксазол-4-іл]гептилокси}-2-метилпропіонат, Метил-2-{7-[2-(4-фтор феніл)оксазол-4-іл]гептилокси}-2-метилпропіонат, Метил-2-{6-[2-(4-фтор феніл)оксазол-4-іл]гексилокси}-2-метилпропіонат, і Метил-2-метил-2-[8-(2-фенілоксазол-4-іл)октилокси]пропіонат. Приклад 8 Метил-2-метил-2-[7-(2-фенілтіазол-4-іл)гептилокси]пропіонат Суміш 783мг тіобензаміду та 1,0г метил-2-(9-хлор-8-оксононілокси)-2-метилпропіонату перемішують протягом 2 годин при 120°С. Реакційний розчин охолоджують та розчиняють у етилацетаті, промивають шляхом додавання бікарбонату натрію, промивають водою, осушають над безводним сульфатом магнію та концентрують. Залишок очищають хроматографією на колонці з силікагелем (Wakogel® C-200, нгексан:етилацетат =9:1), одержуючи 963мг цільової сполуки у вигляді блідо-жовтої маслянистої рідини. 1 Н-ЯМР (СОСІ 3) δ: 1,36-1,39 (6Н, м), 1,42 (6Н, с), 1,54-1,61 (2Н, м), 1,72-1,80 (2Н, м), 2,78-2,86 (2Н, м), 3,313,38 (2Н, м), 3,73 (3Н, с), 6,87 (1Н, с), 7,39-7,46 (3Н, м) 7,91-7,96 (2Н, м). За методикою, описаною у Прикладі 8, були одержані такі сполуки: Метил-2-метил-2-[8-(2-фенілтіазол-4іл)октилокси]пропіонат. Приклад 9 2-Метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбонова кислота Метил-2-метил-с-5-[4-(5-метил-2-фенілоксазол-4-іл)бутил]-1,3-діоксан-r-2-карбоксилат (15,76г) розчиняють у 215мл метанолу, додають розчин 2,53г гідроксиду натрію/28мл води та суміш кип'ятять зі зворотним холодильником протягом 4 годин. Реакційний розчин охолоджують, виливають у льодяну воду, підкислюють розведеною хлористоводневою кислотою та екстрагують етилацетатом. :Органічний шар промивають розсолом, осушають над безводним сульфатом магнію та концентрують. Залишок розчиняють при нагріванні у толуолі/н-гексані і залишають охолонути. Осад збирають фільтрацією, одержуючи 13,52г цільової сполуки. 1 Н-ЯМР (CDCl3) δ: 1,00-1,15 (2Н, м), 1,25-1,45 (2Н, м), 1,50-1,70 (5Н, м), 1,90-2,20 (1Н, м), 2,32 (3Н, с), 2,52 (2Н, т), 3,49 (2Н, дд), 3,99 (2Н, дд), 7,40-7,50 (3Н, м), 7,90-8,05 (2Н,м), 9,70 (1Н, шир.). Елементний аналіз для C20H25NO5 Розрах. (%): С, 66,84; Н, 7,01; N,3,90 Знайдено (%): С, 66,76; Н, 7,09; N,3,82.
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclic compounds
Назва патенту російськоюГетероциклические соединения
МПК / Мітки
МПК: A61K 31/421, A61K 31/4178, A61P 3/04, C07D 405/06, C07D 413/14, A61P 9/12, C07D 413/06, C07D 277/30, C07D 413/12, A61K 31/422, C07D 413/04, A61P 3/10, A61K 31/4439, A61K 31/427, A61P 9/10, C07D 263/32, A61K 31/426, C07D 277/24, A61P 3/06
Мітки: гетероциклічні, сполуки
Код посилання
<a href="https://ua.patents.su/41-72625-geterociklichni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні сполуки</a>
Попередній патент: Спосіб випробування футерувальних матеріалів для магнієвих електролізерів
Наступний патент: Оптичний рівнемір
Випадковий патент: Асфальтова композиція для дорожнього покриття, спосіб її одержання та модифіковане бітумне в'яжуче для неї












