Поліморфні модифікації кислотно-адитивних солей іматинібу з метансульфоновою кислотою
Номер патенту: 84462
Опубліковано: 27.10.2008
Автори: Корчак Катаржина, Шелєєвскі Вєслав, Марушак Віолєта, Качмарек Лукаш, Самсон-Лазінска Дорота, Гліце Магдалєна, Лавецка Марта, Фрачек Уршула, Цмох Пьотр, Загродзкі Богдан, Щепек Войцех, Модзелєвскі Ришард
Формула / Реферат
1. Спосіб одержання a-кристалічної форми метансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, в якому здійснюють:
a) реакцію приєднання з використанням не більш ніж 0,99 еквівалента метансульфонової кислоти на 1 еквівалент 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду в розчиннику, вибраному з групи, що складається з С2-С6 аліфатичних спиртів або їх сумішей, необов'язково з додаванням іншогоС1-С4 аліфатичного спирту;
b) додавання, при необхідності, розчинника, вибраного з групи, що складається з естерів нижчих карбонових кислот і С1-C4 аліфатичних спиртів;
c) необов'язкову затравку реакційної суміші a- кристалічною формою;
d) перемішування реакційної суміші протягом часу, необхідного для кристалізації a-кристалічної форми;
e) відокремлення a-кристалічної форми від реакційної суміші.
2. Спосіб за п. 1, в якому реакцію приєднання здійснюють з використанням від 0,95 до 0,99 еквівалентів метансульфонової кислоти на 1 еквівалент 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду.
3. Спосіб за будь-яким з пунктів 1-2, в якому реакцію приєднання здійснюють у спирті, вибраному з групи, що містить н-пропіловий спирт, ізопропіловий спирт, н-бутиловий спирт, тpeт-бутиловий спирт і їх суміші з етиловим спиртом.
4. Спосіб за будь-яким з пунктів 1-3, в якому реакцію приєднання здійснюють в суміші, що містить від 0 до 50 % етилового спирту і від 50 до 100 % н-пропілового спирту (об'єм/об'єм).
5. Спосіб за будь-яким з пунктів 1-3, в якому реакцію приєднання здійснюють в суміші, що містить від 0 до 50 % етилового спирту і від 50 до 100 % ізопропілового спирту (об'єм/об'єм).
6. Спосіб за будь-яким з пунктів 1-3, в якому реакцію приєднання здійснюють в суміші, що містить від 0 до 50 % етилового спирту і від 50 до 100 % н-бутилового спирту (об'єм/об'єм).
7. Спосіб за будь-яким з пунктів 1-3, в якому реакцію приєднання здійснюють в суміші, що містить від 0 до 50 % етилового спирту і від 50 до 100 % тpeт-бутилового спирту (об'єм/об'єм).
8. Спосіб одержання a-кристалічної форми метансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, в якому здійснюють:
a) реакцію приєднання з використанням 1 еквівалента метансульфонової кислоти на 1 еквівалент 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду в етиловому спирті, необов'язково з додаванням іншого С1-С4 аліфатичного спирту;
b) додавання розчинника, вибраного з групи, що складається з естерів нижчих карбонових кислот і С1-С4 аліфатичних спиртів;
c) затравку реакційної суміші a-кристалічною формою;
d) перемішування реакційної суміші протягом часу, необхідного для кристалізації a-кристалічної форми;
e) відокремлення a-кристалічної форми від реакційної суміші.
9. Спосіб за п. 8, в якому додатковим С1-С4 аліфатичним спиртом є метиловий спирт або ізопропіловий спирт, в якому частка С1-С4 аліфатичного спирту в суміші розчинників не перевищує 55 % (об'єм/об'єм).
10. Спосіб за будь-яким з пунктів 1-8, в якому реакцію приєднання здійснюють при одночасному перемішуванні з одночасним підтриманням внутрішньої температури реакційної суміші в діапазоні від кімнатної температури до температури кипіння.
11. Спосіб за будь-яким з пунктів 1-8, в якому отримана таким чином a-кристалічна форма метансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду по суті вільна від b-кристалічної форми метансульфонової кислої адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду або будь-яких інших кристалічних твердих речовин.
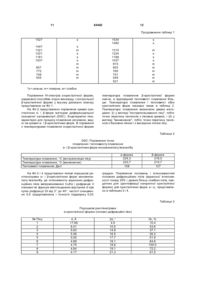
12. Спосіб за будь-яким з пунктів 1-8, в якому отримана таким чином a-кристалічна форма метансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду показує на порошковій рентгенограмі піки при кутах 2q приблизно: 4,9; 18,6; 19,1; 23,2 і 28,6°, отриманій при випромінюванні СuКa і з довжиною хвилі l=1,54056Å.
13. Спосіб за будь-яким з пунктів 1-8, в якому отримана таким чином a-кристалічна форма метансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду показує на порошковій рентгенограмі піки відносної інтенсивності понад 20 % при кутах 2q приблизно: 10,5; 14,9; 16,5; 17,7; 18,1; 18,6; 19,1; 21,3; 21,6; 22,7; 23,2; 23,8; 24,9; 27,4; 28,0 і 28,6°.
14. Диметансульфонова кислотно-адитивна сіль 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду.
15. Диметансульфонова кислотно-адитивна сіль за п. 14 в кристалічній формі.
16. Диметансульфонова кислотно-адитивна сіль за п. 14 в кристалічній формі І, яка показує на порошковій рентгенограмі, отриманій при випромінюванні СuКa з довжиною хвилі l=1,54056Å, піки відносної інтенсивності понад 20 % при кутах 2q приблизно: 16,94; 19,80; 20,08; 20,51; 21,28; 21,65; 21,98; 22,70 і 23,07°.
17. Диметансульфонова кислотно-адитивна сіль за п. 16, яка характеризується тим, що порошкова рентгенограма, отримана при випромінюванні СuКa з довжиною хвилі l=1,54056Å, по суті ідентична діаграмі, представленій на фіг. 8.
18. Диметансульфонова кислотно-адитивна сіль за п. 14 в кристалічній формі II, яка показує на порошковій рентгенограмі, отриманій при випромінюванні СuКa з довжиною хвилі l=1,54056Å, піки відносної інтенсивності понад 20 % при кутах 2q приблизно: 17,23; 17,62; 18,72; 19,90; 20,23; 21,25; 21,59; 22,05; 22,44; 23,38; 23,68; 24,48; 25,41; 26,10 і 28,39°.
19. Диметансульфонова кислотно-адитивна сіль за п. 18, яка характеризується тим, що порошкова рентгенограма, отримана при випромінюванні СuКa з довжиною хвилі l=1,54056Å, по суті ідентична діаграмі, представленій на фіг. 9.
20. Суміш кристалічних форм І і II диметансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]-бензаміду, яка показує на порошковій рентгенограмі, отриманій при випромінюванні СuКa з довжиною хвилі l=1,54056Å, піки відносної інтенсивності понад 20 % при кутах 2q приблизно: 16,91; 17,60; 18,69; 19,78; 20,50; 21,60; 22,00; 22,70; 23,07; 24,49; 26,13 і 27,25°.
21. Суміш кристалічних форм І і II за п. 20, яка характеризується тим, що порошкова рентгенограма, отримана при випромінюванні СuКa з довжиною хвилі l=1,54056Å, по суті ідентична діаграмі, представленій на фіг. 10.
22. Застосування кристалічної форми диметансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, вибраної з групи, що включає кристалічну форму І і кристалічну форму II і їх суміші, для одержання фармацевтичної композиції, що має протипухлинну активність.
23. Фармацевтична композиція диметансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]-бензаміду, вибраної з групи, що включає кристалічну форму І і кристалічну форму II і їх суміші, разом з фармацевтично прийнятними носіями і/або наповнювачами.
Текст
1. Спосіб одержання a-кристалічної форми метансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, в якому здійснюють: a) реакцію приєднання з використанням не більш ніж 0,99 еквівалента метансульфонової кислоти на 1 еквівалент 4-(4-метилпіперазин-1-ілметил)-N-[4метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду в розчиннику, вибраному з групи, що складається з С2-С6 аліфатичних спиртів або їх сумішей, необов'язково з додаванням іншого С1-С4 аліфатичного спирту; b) додавання, при необхідності, розчинника, вибраного з групи, що складається з естерів нижчих карбонових кислот і С1-C4 аліфатични х спиртів; c) необов'язкову затравку реакційної суміші a- кристалічною формою; d) перемішування реакційної суміші протягом часу, необхідного для кристалізації a-кристалічної форми; e) відокремлення a-кристалічної форми від реакційної суміші. 2. Спосіб за п. 1, в якому реакцію приєднання здійснюють з використанням від 0,95 до 0,99 еквівалентів метансульфонової кислоти на 1 еквівалент 4 2 (19) 1 3 84462 4 спирту в суміші розчинників не перевищує 55 % (об'єм/об'єм). 10. Спосіб за будь-яким з пунктів 1-8, в якому реакцію приєднання здійснюють при одночасному перемішуванні з одночасним підтриманням внутрішньої температури реакційної суміші в діапазоні від кімнатної температури до температури кипіння. 11. Спосіб за будь-яким з пунктів 1-8, в якому отримана таким чином a-кристалічна форма метансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду по суті вільна від b-кристалічної форми метансульфонової кислої адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду або будь-яких інших кристалічних твердих речовин. 12. Спосіб за будь-яким з пунктів 1-8, в якому отримана таким чином a-кристалічна форма метансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду показує на порошковій рентгенограмі піки при кутах 2q приблизно: 4,9; 18,6; 19,1; 23,2 і 28,6°, отриманій при випромінюванні СuКa і з довжиною хвилі l=1,54056Å. 13. Спосіб за будь-яким з пунктів 1-8, в якому отримана таким чином a-кристалічна форма метансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду показує на порошковій рентгенограмі піки відносної інтенсивності понад 20% при кутах 2q приблизно: 10,5; 14,9; 16,5; 17,7; 18,1; 18,6; 19,1; 21,3; 21,6; 22,7; 23,2; 23,8; 24,9; 27,4; 28,0 і 28,6°. 14. Диметансульфонова кислотно-адитивна сіль 4(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду. 15. Диметансульфонова кислотно-адитивна сіль за п. 14 в кристалічній формі. 16. Диметансульфонова кислотно-адитивна сіль за п. 14 в кристалічній формі І, яка показує на порошковій рентгенограмі, отриманій при випромінюванні СuКa з довжиною хвилі l=1,54056Å, піки відносної інтенсивності понад 20% при кута х 2q приблизно: 16,94; 19,80; 20,08; 20,51; 21,28; 21,65; 21,98; 22,70 і 23,07°. 17. Диметансульфонова кислотно-адитивна сіль за п. 16, яка характеризується тим, що порошкова рентгенограма, отримана при випромінюванні СuКa з довжиною хвилі l=1,54056Å, по суті ідентична діаграмі, представленій на Фіг.8. 18. Диметансульфонова кислотно-адитивна сіль за п. 14 в кристалічній формі II, яка показує на порошковій рентгенограмі, отриманій при випромінюванні СuКa з довжиною хвилі l=1,54056Å, піки відносної інтенсивності понад 20 % при кута х 2q приблизно: 17,23; 17,62; 18,72; 19,90; 20,23; 21,25; 21,59; 22,05; 22,44; 23,38; 23,68; 24,48; 25,41; 26,10 і 28,39°. 19. Диметансульфонова кислотно-адитивна сіль за п. 18, яка характеризується тим, що порошкова рентгенограма, отримана при випромінюванні СuКa з довжиною хвилі l=1,54056Å, по суті ідентична діаграмі, представленій на Фіг.9. 20. Суміш кристалічних форм І і II диметансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]-бензаміду, яка показує на порошковій рентгенограмі, отриманій при випромінюванні СuКa з довжиною хвилі l=1,54056Å, піки відносної інтенсивності понад 20% при кутах 2q приблизно: 16,91; 17,60; 18,69; 19,78; 20,50; 21,60; 22,00; 22,70; 23,07; 24,49; 26,13 і 27,25°. 21. Суміш кристалічних форм І і II за п. 20, яка характеризується тим, що порошкова рентгенограма, отримана при випромінюванні СuКa з довжиною хвилі l=1,54056Å, по суті ідентична діаграмі, представленій на Фіг.10. 22. Застосування кристалічної форми диметансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, вибраної з групи, що включає кристалічну форму І і кристалічну форму II і їх суміші, для одержання фармацевтичної композиції, що має протипухлинну активність. 23. Фармацевтична композиція диметансульфонової кислотно-адитивної солі 4-(4-метилпіперазин1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин2-іламіно]феніл]-бензаміду, вибраної з групи, що включає кристалічну форму І і кристалічну форму II і їх суміші, разом з фармацевтично прийнятними носіями і/або наповнювачами. Винахід відноситься до поліморфних модифікацій кислих адитивних солей Іматинібу з метансульфоновою кислотою і до способів їх одержання. Зокрема, винахід відноситься до способу приготування α-кристалічної форми метансульфонату Іматинібу. Іматиніб, 4-(4-метилпіперазин-1-ілметил)-N-[4метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл] бензамід, був розкритий [в Європейській патентній заявці EP 0564409 А1] як фармакологічно активна речовина з протипухлинною активністю, яка особливо корисна при лікуванні захворювань, які реагують на інгібування рецептора тирозинкінази. [Міжнародна патентна заявка WO 2004/026930] відноситься до використання Іматинібу або його фармацевтичної прийнятної солі для зменшення запалення. Згадуються багато фармацевтичних прийнятних адитивних солей Іматинібу, 5 84462 хоча детально описані тільки експериментальні дослідження над монометансульфонатною сіллю. Нова кристалічна модифікація метансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, тобто β-кристалічна форма, описана в публікації міжнародної патентної заявки WO 99/03854. Ця βкристалічна форма могла б бути отримана, inter alia, з менш термодинамічно стійкої α-кристалічної форми шляхом розтирання суспензії останньої в порошок в полярному розчиннику, особливо в спирті, наприклад в метанолі, β-кристалічна форма могла б також бути отримана й безпосередньо з вільної основи шляхом обробки суспензії 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду метансульфоновою кислотою в метанолі, концентрації отриманого розчину і його затравки затравковими кристалами β-кристалічної форми. B [WO 99/03854] авторами була зроблена загальна примітка відносно того, що β-кристалічна форма могла б бути отримана, наприклад, шляхом осадження кислотно-адитивної солі метансульфонату з її розчину в розчиннику, відмінним від спирту, наприклад, метанолу, і без додавання будьяких затравкових кристалів β-кристалічної форми. Спосіб приготування β-кристалічної форми, представлений в прикладі 1, полягає в наступному: (1) суспензію вільної основи в етанолі обробляють метансульфоновою кислотою, а розчин отриманої солі піддають дефлегмації протягом 20 хвилин; (2) одержаний згаданим вище способом розчин концентрують до половини його первинного об'єму, а осад, який утворився, фільтрують при 25°С, внаслідок чого отримують продукт фільтрації А; (3) фільтрат випаровують до сухого стан у, потім продукт фільтрації А додають до залишку з подальшим додаванням відповідного об'єму етанолу і води, а одержану суміш піддають дефлегмації до повного розчинення; (4) після повільного охолоджування розчину до 25°C β-кристалічну форму відокремлюють фільтруванням. Проте, спроби відтворити приклад 1 показали, що згадане вище розкриття недостатньо для селективного і неодноразового приготування α-форми. При повторенні процедури відповідно до прикладу 1 із застосуванням безводного етанолу (тобто етанолу, що містить 0,1% (маса/об'єм) води) авторами даної заявки було встановлено, що продукт фільтрації А після його об'єднання із залишком після концентрації фільтрату не повністю розчиняється в заданому об'ємі води і етанолу. Кристали солі осаджували з розчину, отриманого після фільтрації нерозчинених кристалів, і піддавали монотонному охолоджуванню до кімнатної температури. Проте, як про це свідчать результати аналізу методом порошкової рентгенографії, які засновані на даних, представлених в [WO 99/03854], ці кристали відносяться до βкристалічної форми. З другого боку, у разі викори 6 стання етанолу, що містить 4,8% (маса/об'єм) води, розчин, сконцентрований до половини його об'єму, легко не кристалізується, а кінцевий розчин солі не кристалізується без затравки навіть через 36 годин, оскільки він був о холоджений до приблизно 16°С. Крім того, спосіб приготування α-кристалічної форми, представлений в публікації [WO 99/03854], вимагає декількох одиничних операцій, наприклад, відокремлення незрілих кристалів метансульфонату від реакційної суміші, концентрації розчинушляхом випаровування етанолу і повторного суспендування метансульфонатної солі в цьому ж розчиннику. Крім того, авторами даного винаходу було встановлено, що без затравки реакційної суміші кристалізація метансульфонової кислотноадитивної солі 4-(4-метилпіперазин-1-ілметил)-N[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду носить випадковий характер, тобто α-форму, β-форму або їх суміші отримують випадково незалежно від умов реакції. Таким чином, необхідно було знайти селективний і відтворний спосіб приготування αкристалічної форми метансульфонової кислотноадитивної солі 4-(4-метилпіперазин-1-ілметил)-N[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду. Крім того, було б бажано розробити такий спосіб, який був би придатний для його здійснення в одній реакційній судині. Ця проблема була вирішена способом, розкритим [в патентній заявці Польщі №P-366885 від 2 квітня 2004р.], в якій реакцію еквімолярних кількостей метансульфонової кислоти з 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензамідом здійснюють в етиловому спирті або в суміші етилового спирту з іншим аліфатичним спиртом C1C4, потім до реакційної суміші додають складний ефір карбонової кислоти і аліфатичний спирт C 1C4, всю суміш охолоджують до внутрішньої температури А, затравлюють кристалами α-кристалічної форми, а одержану реакційну суміш залишають при одночасному перемішуванні при внутрішній температурі В на час, який необхідний для кристалізації α-кристалічної форми. Хоча даний спосіб дозволяє одержувати чисту α-кристалічну форму, він вимагає використання двох різних розчинників, другий з яких (складний ефір карбонової кислоти і аліфатичний спирт C 1C4) приводить до осадження кислотно-адитивної солі з реакційної суміші. Крім того, даний спосіб вимагає затравки реакційної суміші затравковими кристалами α-кристалічної форми, а вихід кристалізації ледве перевищує 80%. Даний винахід заснований на експериментально отриманих даних, які свідчать про те, що в деяких випадках, коли використовуються певні розчинники або їх суміші, отримані α-кристалічні або β-кристалічні форми метансульфонату Іматинібу або їх суміш додатково містить морфологічно різні, не ідентифіковані кристали. Відмінність цих кристалів і відомих форм метансульфонату була підтверджена рентгенівським структурним аналізом і ІЧ-спектром. 7 84462 Аналіз відокремлених кристалів методом протонного магнітного резонансу (ЯМР) продемонстрував, що вони є кислою адитивною сіллю 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду з двома молекулами метансульфонової кислоти, тобто диметансульфонатом Іматинібу (димесилатом). Відкриття одночасного утворення різних кристалічних форм монометансульфонату і диметансульфонату Іматинібу, залежно від умов кристалізації, дозволило розробити більш селективний спосіб приготування α-кристалічної форми метансульфонової кислотно-адитивної солі 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, званої надалі мономесилатом Іматинібу. Було встановлено, що шля хом використання не більше ніж 0,99 еквіваленту метансульфонової кислоти на 1,00 еквівалент 4-(4-метилпіперазин-1ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду в реакції приєднання дозволяє одержувати α-кристалічну форму мономесилату Іматинібу, яка, по суті, не містить βкристалічну форму мономесилату Іматинібу, а також кристалічні форми димесилату Іматинібу, в кількостях, які виявляються спектроскопічними методами. Несподівано було також встановлено, що шляхом обмеження стехіометричного співвідношення реагентів можна розширити можливість одержання, по суті, чистої α-кристалічної форми мономесилату Іматинібу, зокрема, розширити діапазон придатних для потенційного використання розчинників або їх сумішей визначеного складу. Проте, в деяких випадках, наприклад, у разі використання суміші етанолу і метил-трет-бутилового ефіру, утворення димесилату Іматинібу неможливо уникнути. Вважається, що у разі використання певних розчинників, досягається рівновага між вільною основою Іматинібу, мономесилатом Іматинібу і димесилатом Іматинібу, не зважаючи на використання менше ніж 1,00 еквіваленту метансульфонової кислоти на 1,00 еквівалент Іматинібу: Imatinib Imatinib.MeSO3H Imatinib.(MeSO3H)2 Таким чином, розроблений спосіб, який за певних умов дозволяє виключити необхідність внесення в суміш α-кристалічної форми шляхом використання реагентів при стехіометричному співвідношенні менше ніж 1,00:0,99 разом з відповідними розчинниками. Додавання осаджуючого розчинника, такий як складний ефір, також стає не обов'язковим. Запропонований відповідно до винаходу спосіб приготування метансульфонової кислотноадитивної солі 4-(4-метилпіперазин-1-ілметил)-N[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду в α-кристалічній формі включає: a) здійснення реакції приєднання метансульфонової кислоти і 4-(4-метилпіперазин-1-ілметил)N-[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду в розчиннику, вибраному з групи, що складається з аліфатичних спиртів C2 8 C6 або їх сумішей, необов'язково з додаванням іншого аліфатичного спирту С1-С4; b) додавання, при необхідності, розчинника, вибраного з групи, що складається з складних ефірів нижчих карбонових кислот і аліфатичних спиртів C1-C4; c) необов'язкова затравка реакційної суміші αкристалічною формою; d) перемішування реакційної суміші протягом часу, необхідного для кристалізації α-кристалічної форми; e) відокремлення α-кристалічної форми від реакційної суміші. В переважному варіанті здійснення винаходу кислу реакцію приєднання здійснюють шляхом використання не більше ніж 0,99 еквіваленту, особливо від 0,95 до 0,99 еквівалентів, метансульфонової кислоти на 1,00 еквівалент 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду. Розчинники, придатні для здійснення реакції приєднання і кристалізації, є такими, які вибрані з групи, що містить n-пропіловий спирт, ізопропіловий спирт, n-бутиловий спирт, трет-бутиловий спирт і їх суміші, особливо суміші, що містять етиловий спирт. В одній з модифікацій даного варіанту здійснення винаходу реакцію приєднання здійснюють в суміші розчинників, що містить від 0 до приблизно 50% етилового спирту і від 50% до 100% nпропілового спирту (об'єм/об'єм). В іншій модифікації даного варіанту здійснення винаходу реакцію приєднання здійснюють в суміші розчинників, що містить від 0 до приблизно 50% етилового спирту і від 50% до 100% ізопропілового спирту (об'єм/об'єм). В ще одній модифікації даного варіанту здійснення винаходу реакцію приєднання здійснюють в суміші розчинників, що містить від 0 до приблизно 50% етилового спирту і від 50% до 100% Nбутилового спирту (об'єм/об'єм). В ще одній модифікації даного варіанту здійснення винаходу реакцію приєднання здійснюють в суміші розчинників, що містить від 0 до приблизно 50% етилового спирту і від 50% до 100% третбутилового спирту (об'єм/об'єм). Відповідна селективність кристалізації могла б бути досягнута також шляхом використання тільки одного спирту, переважно n-пропілового спирту, ізопропілового спирту, n-бутилового спирту або трет-бутилового спирту. В реакції приєднання використовують, як правило, від 15 до 50 об'ємних частин спирту або суміші спиртів на 1 масову частин у основи Іматинібу залежно від системи розчинників, що використовується. Розчинник може бути введений у вигляді однієї частини на початку реакції приєднання або по частинах у ході її протікання. В другому варіанті здійснення винаходу використовують еквімолярні кількості реагентів. В даному випадку необхідною умовою селективної кристалізації α-кристалічної форми мономесилату Іматинібу є, після завершення кислої реакції приєднання, додавання до реакційної суміші складного ефіру нижчої карбонової кислоти і аліфатичного 9 84462 спирту C1-C4 (розчинник ефірного типу). Як переважні розчинники ефірного типу можуть бути згадані алкілові ефіри мурашиної кислоти, оцтової кислоти і пропіонової кислоти, особливо етилацетат. Корисний ефект кристалізації досягається також в результаті додавання ізопропілацетату Об'єм ефіру, що додається, щонайменше, рівний об'єму спиртових розчинників, що використовуються. Як було згадано вище, в переважному варіанті здійснення винаходу реакцію приєднання здійснюють шляхом використання від 0,95 до 0,99 еквівалентів метансульфонової кислоти на 1,00 еквівалент 4-(4-метилпіперазин-1-ілметил)-N-[4метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду. Реакційну суміш перемішують, одночасно підтримуючи внутрішню температуру суміші в діапазоні температур від кімнатної температури до температури кипіння розчину. Після додавання розрахованої кількості метансульфонової кислоти до суспензії основи Іматинібу у вибраному розчиннику можна необов'язково додати додаткову кількість цього ж або іншого розчинника. Додавання розчинника ефірного типу в даному варіанті не є обов'язковим, але це збільшує ви хід α-кристалічної форми мономесилату Іматинібу і дозволяє скоротити об'ємрозчинника, що використовується для суспендування основи Іматинібу. Таким чином, спосіб, розкритий [в патентній заявці Польщі №Р-366,885], в даному випадку поліпшений шляхом вживання згаданого вище переважного співвідношення реагентів. Цей ефект підтверджується в прикладах 8-11, включених в дану заявку. Кристалізація може бути ініційована шляхом затравки реакційної суміші затравковими кристалами α-кристалічної форми. Проте, у багатьох випадках затравка не є обов'язковою, оскільки система розчинників і молярне співвідношення реагентів, які були використані, є сприятливим фактором для спонтанної кристалізації кислотноадитивної солі метансульфонової кислоти і 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду в α-кристалічній формі. Суміш охолоджують, а потім залишають при одночасному безперервному перемішуванні на 10 деякий час, який необхідний для кристалізації αкристалічної форми, тобто, як правило, на 3-5 годин. Кристалічну тверду речовину відокремлюють способом, відомим фахівцям, промивають, наприклад, етилацетатом, і висушують спочатку при кімнатній температурі на повітрі, а потім при кімнатній температурі або при підвищених температурах, наприклад, при приблизно 60°С, в умовах зниженого тиску. Спосіб згідно винаходу є селективним і відтворним способом приготування, по суті, чистої αкристалічної форми кислотно-адитивної солі метансульфонової кислоти і 4-(4-метилпіперазин-1ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду. Для цілей даного винаходу термін "по суті, чиста α-кристалічна форма мономесилату Іматинібу" повинен розумітися як α-кристалічна форма метансульфонової кислотно-адитивної солі метансульфонової кислоти і 4-(4-метилпіперазин-1ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду, яка не містить ніяких домішок інших кристалічних форм мономесилату Іматинібу або будь-яких інших кристалічних твердих речовин в кількостях, що виявляються традиційно вживаними аналітичними методами, тобто форма, яка містить менше 2% мас, переважно менше 1% мас, β-кристалічної форми мономесилату Іматинібу або будь-яких інших кристалічних твердих речовин. Кристалічна форма кислотно-адитивної солі метансульфонової кислоти і 4-(4-метилпіперазин1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин2-іламіно]феніл]бензаміду, одержана способом згідно винаходу, була проаналізована методами ІЧ-спектроскопії, порошковій рентгенографії і диференціальній скануючої калориметрії, а отримані результати були порівняні з даними для контрольної β-кристалічної форми, одержаної способом, описаним в [WO 99/03854], приклад 1, і з аналітичними даними для обох форм, представленими в публікації згаданої вище патентної заявки. ІЧ-спектр α-кристалічної форми, зміряний шляхом використання техніки із застосуванням таблеток KBr, істотно відрізняється від спектра βформи у всьому діапазоні спектру (4000-400см -1), як це показано в таблиці 1. Таблиця 1 FT (з перетворенням Фур'є) - ІЧспектри (таблетки KBr): порівняння типових смуг для α- і β-кристалічних форм мономесилату Іматинібу α-кристалічна форма Об'єм, см -1 Інтенсивність* 3257 m 3033-3010 m 2824-2782 m 2706-2492 m-w 1660 s 1572 s β-кристалічна форма Об'єм, см -1 Інтенсивність* 3336 m 3006-2946 m 2801-2758 m 1656 s 1596 s 1574 s 11 84462 12 Продовження таблиці 1 1527 s 1447 1321 1221 1161 1037 s m s s s m m m m m 807 772 749 555 1534 1482 s s 1310 1224 1168 1037 815 803 765 751 549 521 m s s s m m m m m m *s= сильна, m= помірна, w= слабка Порівняння ІЧ-спектрів α-кристалічної форми, одержаної способом згідно винаходу, і контрольної β-кристалічної форми у всьому діапазоні спектру представлено на Фіг.1. На Фіг.2 представлено порівняння кривих кристалічних α- і β-форм методом диференціальної скануючої калориметрії (DSC). Ендотермічні піки, характерні для процесу плавлення речовини, видні на кривих α- і β-кристалічних форм. В порівнянні з температурами плавлення α-кристалічної форми температура плавлення β-кристалічної форми нижче, а відповідний тепловміст плавлення більше. Температури плавлення і тепловміст обох кристалічних форм показані також в таблиці 2. Температури плавлення визначали двома методами: (і) у вигляді "екстрапольованого піку", тобто точки перетину тангенсів з піковою кривою, і (іі) у вигляді "виникнення", тобто точки перетину тангенсів з базовою лінією і з висхідною лінією піку. Таблиця 2 DSC: Порівняння точок плавлення і тепловмісту плавлення α- і β-кристалічних форм мономесилату Іматинібу α-форма 224,3 223,7 108 Температура плавлення, °C {екстраполяція піку) Температура плавлення, °C {виникнення) Тепловміст плавлення, Дж/г На Фіг.3 і 4 представлені типові порошкові рентгенограми α- і β-кристалічних форм мономесилату Іматинібу, де інтенсивність відносних дифракційних піків випромінювання CuKα і рефракція q показані як функція міжплощинних відстаней d при кутах рефракції 2q від 3° до 40°, частоті сканування 0,5 градус/хвилина і точності підрахунку 0,03 β-форма 216,5 214,7 127 градуси. Порівняння положень і інтенсивностей головних дифракційних піків (відносної інтенсивності понад 20% і деяких більш слабких піків, придатних для ідентифікації конкретної кристалічної форми) для кристалічних форм а і р, представлено в таблицях 3 і 4. Таблиця 3 Порошкові рентгенограми α-кристалічної форми (головні дифракційні піки) № Піку 1 2 3 4 5 6 7 8 9 d, Å 17.89 8.41 5.93 5.36 5.00 4.89 4.75 4.64 4.17 2q, ° 4.9 10.5 14.9 16.5 17.7 18.1 18.6 19.1 21.3 І/І0 , % 10.4 53.6 37.1 26.3 51.9 64.6 100.0 72.2 61.5 13 84462 14 Продовження таблиці 3 10 11 12 13 14 15 16 17 4.10 3.92 3.83 3.74 3.57 3.25 3.18 3.12 21.6 22.7 23.2 23.8 24.9 27.4 28.0 28.6 73.8 23.1 32.3 29.2 76.1 22.0 21.7 72.4 Таблиця 4 Порошкові рентгенограми β-кристалічної форми (головні дифракційні піки) № Піку 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 d, (Å) 15.28 10.55 9.12 6.37 5.09 4.89 4.70 4.45 4.32 4.22 4.03 3.92 3.75 3.52 3.33 3.01 2.90 В таблицях 3 і 4 типові піки, які могли б бути придатними для ідентифікації обох форм в їх сумішах і для визначення їх кристалічної чистоти, позначено жирними числами. Піки, характерні для α-кристалічної форми, спостерігаються при кутах 2q приблизно: 4,9; 18,6; 19,1; 23,2 і 28,6°, а для βкристалічної форми при кутах 2q приблизно: 5,8; 8,4; 9,7; 17,4; 19,9 і 20,5°. Аналіз даних, отриманих методами порошкової рентгенографії, ІЧ-спектроскопії і диференціальної скануючої калориметрії, свідчить про те, що спосіб згідно винаходу забезпечує одержання αкристалічної форми мономесилату Іматинібу, яка по суті вільна від будь-яких домішок β-кристалічної форми або будь-яких інших кристалічних форм. Як було згадано вище, кристалізація αкристалічної форми, отриманої в реакції приєднання з використанням еквімолярних кількостей метансульфонової кислоти і 4-(4-метилпіперазин1-ілметил)-N-[4-метил-3-[(4-піридин-3-іл)піримідин2-іламіно]феніл]бензаміду в певних розчинниках, дуже часто супроводжується утворенням кристалічної домішки. Вона була ідентифікована винахідниками як димесилат Іматинібу на основі аналізу методом протонного ядерного магнітного резонансу (1H Я МР (D MSO-d6) із зсувами δ (проміле): 10,28 (1Н, s, NH), 9,38 (1Н, d, J=1,8Гц), 9,07 (1H, s, NH), 8,81 (1Н, dd, J=5,0 і 1,4Гц), 8,73 (1Н, dt, J=8 ,1 і 1,8Гц), 8,57 (1Н, d, J=5,1Гц), 8,14 (1Н, d, J=1,8Гц), 8,05 (2Н, d, J=8,2Гц), 7,74 (1Н, dd, J=8,0 і 5,1Гц), 2q (°) 5.8 8.4 9.7 13.9 17.4 18.1 18.9 19.9 20.5 21.0 22.0 22.7 23.7 25.3 26.8 29.7 30.8 І/І0 (%) 8.2 4.5 19.1 30.8 59.3 66.6 21.2 55.8 100.0 75.3 65.4 34.8 32.8 20.9 25.0 31.9 25.6 7,63 (2Н, d, J=8,1Гц), 7,51 (1Н, dd, J=8,2 і 2,1Гц), 7,50 (1Н, d, J=5,1Гц), 7,24 (1Н, d, J=8,5Гц), 4,17 (2Н, s), 2,9-3,7 (8Н, br m), 2,87 (3Н, s, N-CH 3), 2,45 (6Н, s, 2хCH3, 2 хMeSO3H), 2,25 (3Н, s, Ar-CH 3). Таким чином димесилат Іматинібу утворюється в реакції 4-(4-метилпіперазин-1-ілметил)-N-[4метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду з двома еквівалентами метансульфонової кислоти. 15 84462 Винахідники успішно відокремили диметансульфонову кислу адитивн у сіль 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду (димесилат Іматинібу) в її кристалічній формі у вигляді домішки однієї з кристалічних форм мономесилату Іматинібу, а також визначили її фізикохімічні властивості. Потім сполука була синтезована, що дозволило довести існування двох поліморфних модифікацій цих сполук. Іншим аспектом винаходу є, таким чином, нова метансульфонова кисла адитивна сіль 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, яка містить дві молекули кислоти на одну молекулу Іматинібу, тобто димесилат Іматинібу. Димесилат Іматинібу кристалізується в дво х чітких кристалічних формах, званих далі формою І і формою Il залежно від розчинників, що використовуються для кристалізації, і умов кристалізації (з 16 або без затравкових кристалів). За певних умов він кристалізується у вигляді суміші обох поліморфних модифікацій при масовому співвідношенні приблизно 1:1. Кристалічні форми І і Il димесилату Іматинібу і їх суміш можна легко ідентифікувати і відрізнити одну від іншої або від поліморфних модифікацій мономесилату Іматинібу методами диференціальної скануючої калориметрії (DSC), інфрачервоної абсорбційної спектрометрії з перетворенням Фур'є (FTIR) і порошкової рентгенографії (XRPD). Типові ендотермічні піки, що відповідають плавленню речовин, видні на кривих DSC кристалічних форм І і Il димесилату Іматинібу. Температура плавлення форми І вище, ніж у форми II, тоді як тепловміст плавлення порівняний. Два піки, які відображають плавлення обох форм, видні на кривій DSC кристалічної суміші. Температури плавлення і тепловміст суміші обох форм представлені в Таблиці 5. Таблиця 5 DSC: Порівняння температур плавлення і тепловмісту кристалічних форм І і Il і суміші обох форм димесилату Іматинібу Форма І Форма Il Температура плавлення,°С (екстраполяція піку) 227,2 211,0 Температура плавлення,°С (виникнення) 225,3 205,6 Тепловміст плавлення, Дж/г 100,7 103,5 На Фіг.5 представлена типова рентгенограма форми І димесилату Іматинібу, на Фіг.6 представлена типова рентгенограма форми Il сполук, а на Фіг.7 представлена типова рентгенограма кристалічної суміші цих форм. Суміш форм І і Il 208,8 222,2 202,0 216,6 Положення і інтенсивности дифракційних піків кристалічних форм І і Il димесилату Іматинібу і їх суміші представлені в таблицях 6, 7 і 8 (піки інтенсивності понад 20% позначені з жирними цифрами). Таблиця 6 Порошкова рентгенограма форми І димесилату Іматинібу d, Å 17.71 10.52 9.30 8.89 8.38 8.06 7.04 6.75 6.36 5.92 5.56 5.41 5.22 4.94 4.47 4.41 4.32 4.17 2q, ° 4.98 8.47 9.49 9.93 10.54 10.99 12.56 13.09 13.91 14.94 15.91 16.35 16.94 17.93 19.80 20.08 20.51 21.28 І/І0 , % 2.1 4.2 3.9 17.2 1.6 2.7 3.4 6.3 1.8 8.8 5.2 18.9 27.4 7.7 100.0 41.7 32.2 20.2 17 84462 18 Продовження таблиці 6 4.10 4.04 3.91 3.85 3.62 3.57 3.39 3.26 2.78 21.65 21.98 22.70 23.07 24.50 24.90 26.22 27.28 32.09 27.2 30.0 43.0 29.3 17.8 13.4 17.9 14.7 5.5 Таблиця 7 Порошкова рентгенограма форми І* димесилату Іматинібу d, Å 8.89 6.19 6.02 5.68 5.50 5.14 5.02 4.73 4.45 4.38 4.17 4.11 4.02 3.95 3.80 3.75 3.63 3.50 3.41 3.14 2.79 2.68 2q, ° 9.93 14.28 14.68 15.57 16.08 17.23 17.62 18.72 19.90 20.23 21.25 21.59 22.05 22.44 23.38 23.68 24.48 25.41 26.10 28.39 32.02 33.38 І/І0 , % 13.6 7.7 15.0 15.7 11.3 22.7 81.4 100.0 39.1 28.3 51.0 84.6 48.0 41.3 66.3 40.9 30.0 28.7 44.5 37.5 13.9 12.5 * Помилка в тексті оригіналу. Слід читати форми II (прим, перекл.) Таблиця 8 Порошкова рентгенограма суміші форм І і Il димесилату Іматинібу d, Å 10.41 9.31 8.90 8.39 8.04 5.91 5.68 5.41 5.23 5.03 4.74 4.48 4.32 4.10 2q, ° 8.48 9.48 9.92 10.53 10.99 14.95 15.58 16.34 16.91 17.60 18.69 19.78 20.50 21.60 І/І0 , % 4.0 4.5 17.5 2.2 2.3 9.7 6.0 18.2 27.2 28.5 34.3 100.0 33.8 51.9 19 84462 20 Продовження таблиці 8 4.03 3.91 3.85 3.63 3.50 3.40 3.26 2.78 Як показано в таблиці 9, ІЧ-спектр форми І димесилату Іматинібу, о триманий шляхом використання технології із застосуванням таблеток KBr, помітно відрізняється від спектру форми Il у всьо 22.00 22.70 23.07 24.49 25.39 26.13 27.25 32.09 42.6 50.3 34.9 26.4 17.0 26.2 24.6 9.5 му діапазоні довжин хвиль (4000-400см -1), Смуги, які відповідають формам IiII, чітко видні в ІЧспектрі суміші цих форм. 21 84462 Ще одним аспектом винаходу є кристалічна форма І диметансульфонової кислотно-адитивної солі 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду (форма І димесилату Іматинібу). Кристалічна форма І димесилату Іматинібу характеризується піками інтенсивності понад 20% при кутах 2q на порошковій рентгенограмі приблизно: 16,94, 19,80, 20,08, 20,51, 21,28, 21,65, 21,98, 22,70 і 23,07°. Форма І утворюється в таких системах розчинників як, наприклад, етиловий спирт/третбутил-метиловий ефір, етиловий спирт/етилацетат, ізопропіловий спирт. Іншим аспектом винаходу є кристалічна Форма Il диметансульфонової кислотно-адитивної солі 4(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду (форма Il димесилату Іматинібу). Кристалічна форма Il димесилату Іматинібу характеризується піками інтенсивності понад 20% при кутах 26 на порошковій рентгенограмі приблизно: 17,23, 17,62, 18,72, 19,90, 20,23, 21,25, 21,59, 22,05, 22,44, 23,38, 23,68, 24,48, 25,41, 26,10 і 28,39°. Форма Il утворюється в таких системах розчинників як, наприклад, етиловий спирт/ацетон, метиловий спирт. В деяких випадках димесилат Іматинібу кристалізується у вигляді суміші форм І і Il при масовому співвідношенні приблизно 1:1 в тих же розчинниках, які описані вище, наприклад, в етиловому спирті, в суміші етиловий спирт/етилацетат, але без затравки реакційної суміші затравковими кристалами. Ще одним аспектом винаходу є суміш кристалічних форм І і Il метансульфонової кислотноадитивної солі 4-(4-метилпіперазин-1-ілметил)-N[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду при масовому співвідношенні приблизно 1:1, яка характеризується піками інтенсивності понад 20% при кутах 2q на порошковій рентгенограмі приблизно: 16,91, 17,60, 18,69, 19,78, 20,50, 21,60, 22,00, 22,70, 23,07, 24,49, 26,13 i 27,25°. Димесилат 4-(4-метилпіперазин-1-ілметил)-N[4-метил-3-[(4-піридин-3-іл)піримідин-2іламіно]феніл]бензаміду має корисні фізико-хімічні властивості, він термодинамічно стійкий і нетоксичний, отже як фармацевтично прийнятна сіль [(Handbook of Pharmaceutical Salts (Довідник фармацевтичних солей), P.H. Stahl, CG. Wermuth (eds.), Verlag Helvetica Chimica Acta, 2002)] він міг би бути використаний як активний інгредієнт у фармацевтичних складах, що мають протипухлинну активність. Для терапевтичного застосування димесилат 4-(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду готують у вигляді фармацевтичних композицій, що містять терапевтично ефективну кількість солі в комбінації з, щонайменше, одним фармацевтично прийнятним носієм і/або розріджувачем. 22 Фармацевтичну композицію згідно винаходу вводять пацієнту, який потребує такого лікування, у відповідній фармацевтичній дозованій формі способом, який підходить для такої дозованої форми, наприклад, орально або парентерально (внутрішньовенно, внутрішньом'язово або підшкірно). Вибір дози і режиму дозування залежить від виду захворювання, віку, маси і стану пацієнта, і вони могли б бути визначені фахівцем на основі відомих процедур лікування і попередження таких захворювань. Переважна доза солі згідно винаходу може складати 100 - 500 мг з розрахунку на вільний 4-(4-метилпіперазин-1-ілметил)-N-[4метил-3-[(4-піридин-3-іл)піримідин-2-іламіно]феніл]бензамід. Доза може вводитися пацієнту один раз в день або кілька разів на день окремо або в комбінації з іншими лікарськими речовинами. Такі речовини можуть вводитися паралельно у вигляді єдиної лікарської форми або як різні лікарські форми. В альтернативному варіанті лікарські форми могли б вводитися послідовно в порядку і через проміжки часу, визначувані фа хівцем. Фармацевтичний інгредієнт згідно винаходу може бути приготований в різних комбінаціях, добре відомих фахівцям в даній області техніки, наприклад, в таких, які описані, наприклад, [у Remington's Pharmaceutical Sciences, ХVIth ed., Mack Publ. Co., 1980]. Фармацевтичні форми для орального вживання включають таблетки, драже, порошки, гранули, пілюлі або капсули, тверді речовини, що містять, фармацевтично прийнятні наповнювачі, наприклад, кукурудзяний крохмаль, лактозу, сахарозу, сорбіт, тальк, манітол або дикальційфосфат. Таблетки або гранули можуть бути забезпечені покриттям або оброблені яким-небудь іншим чином з тим, щоб отримати дозовану форму, яка забезпечує корисну, тривалу активність. Численні речовини, які можуть використовуватися для приготування таких захисних шарів, містять різні полімерні кислоти і їх суміші, з такими речовинами як, наприклад, шелак, цетиловий спирт або ацетат целюлози. Доцільно розглянути введення димесилату 4(4-метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду, що містить фармацевтичні форми, у вигляді лікарських форм для ін'єкцій або вливань. Такі форми включають стерильні водні, водні органічні і неводні розчини, суспензії, сухі речовини і таблетки для приготування розчинів або для імплантації. Наповнювачі, які забезпечують рівномірний розподіл лікарської речовини в рідкій формі і які використовуються для приготування суспензій, включають ефіри поліоксіетиленової жирної кислоти, лецетин, співполімери оксиполіетилену з оксиполіпропіленом, пептизатори, наприклад, фосфати, поліфосфати і цитрати, водорозчинні полімери, наприклад, карбоксиметилцелюлозу, метилцелюлозу, полівинилпіролідон, смоли або желатин. Композиції для ін'єкцій можуть містити фармацевтичний прийнятні наповнювачі, наприклад, засоби для регулювання рН і буфери, модифікатори тонусу і консервуючі засоби. Сухі речовини призначені для приготування розчинів або суспензій ex 23 84462 tempore шляхом розбавлення цих речовин з використанням відповідних розчинників. На Фіг.1 представлено порівняння ІЧ-спектрів α- і β-кристалічних форм мономесилату Іматинібу. На Фіг.2 представлено порівняння DSC кривих α- і β-кристалічних форм мономесилату Іматинібу. На Фіг.3 представлена порошкова рентгенограма α-кристалічної форми мономесилату Іматинібу. На Фіг.4 представлена порошкова рентгенограма β-кристалічної форми мономесилату Іматинібу. На Фіг.5 представлена DSC крива кристалічної форми І димесилату Іматинібу. На Фіг.6 представлена DSC крива кристалічної форми Il димесилату Іматинібу. На Фіг.7 представлена DSC крива суміші кристалічних форм І і Il димесилату Іматинібу (одержаної безпосередньо з експерименту кристалізації). На Фіг.8 представлена типова порошкова рентгенограма кристалічної форми І димесилату Іматинібу. На Фіг.9 представлена типова порошкова рентгенограма кристалічної форми Il димесилату Іматинібу. На Фіг.10 представлена типова порошкова рентгенограма суміші кристалічних форм І і Il димесилату Іматинібу. На Фіг.11 представлений ІЧ-спектр кристалічної форми І димесилату Іматинібу. На Фіг.12 представлений ІЧ-спектр кристалічної форми Il димесилату Іматинібу. На Фіг.13 представлений ІЧ-спектр суміші кристалічних форм І і Il димесилату Іматинібу. Аналізи методом DSC проводили з використанням апарату Mettler Toledo DSC 822 в 40-милі літрових алюмінієвих тиглях, які в початковому стані були герметичними а потім розкриті. Аналізи проводили в потоці азоту при швидкості потоку 60мл/хв. в температурному діапазоні 30-260°С при швидкості нагрівання 5°С/хв. в динамічній фазі, якій передувала ізотермічна фаза (30°С протягом 5 хвилин), з тим, щоб стабілізувати температуру печі в значенні початкового вимірювання. Температури плавлення визначали двома методами: (і) у вигляді "екстрапольованого піку", тоб 24 то точки перетину тангенсів з піковою кривою, і (іі) у вигляді "виникнення", тобто точки перетину тангенсів з базовою лінією і з висхідною лінією піку. Порошкові рентгенограми (XRPD) були отримані з використанням порошкового дифрактометра Mini Flex, що поставляється фірмою Rigaku. Параметри вимірювання були наступними: - діапазон кута 2q: 3,0-40,0° - довжина хвилі випромінювання СuKα1 l=1,54056Å - частота сканування: 0,5° в хвилину - точність D2q=0,03°. Інфрачервоні (ІЧ) спектри були отримані від таблеток, спресованих з KBr з використанням FTIR спектрометра Perkin Elmer type BX в діапазоні 4000-400см -1 і з роздільною здатністю 4см -1. Нижче винахід ілюструється прикладами, які не носять обмежувальний характер. Приклади А. Мономесилат Іматинібу Приклад 1 3,802г (0,01моль) суспензії 4-(4метилпіперазин-1-ілметил)-N-[4-метил-3-[(4піридин-3-іл)піримідин-2-іламіно]феніл]бензаміду в безводному етиловому спирті (85мл) нагріли при одночасному перемішуванні до 75°С, після чого повільно по краплях додали метансульфонову кислоту (0,5мл, 0,01моль). Потім суміш витримали в нагрітому стані при 75°С протягом 10 хвилин. Потім по краплях додали етилацетат (85мл), після чого суміш охолодили до 30°C при одночасному перемішуванні. Потім додали затравкові кристали α-кристалічної форми (17мг), після чого суміш охолодили і піддали перемішуванню при 13-20°С протягом 4 годин. Кристали відфільтрували, промили 40мл етилацетату і просушили. Ви хід: 2,954г (65,0%); продукт, який ідентифікували як αкристалічну форму месилату Іматинібу. Приклади 2-7 α-Кристалічну форму месилату Іматинібу приготували відповідно до загальної методики, описаної в прикладі 1, з використанням суміші основа Іматинібу:метансульфонова кислота =1:1 (моль/моль) з різними параметрами кристалізації. Таблиця Параметри кристалізації № 1 2 3 4 5 6 7 Розчинник в реакції приєд- Розчинник ефір- ТемператураТемпература Час кристаліза- Вихід (г, %) нання (мл) ного типу (мл) А (°) В (°) ції (годин) етиловий спирт (85) етилацетат (85) 30 13-20 4 2,954 65.0% етиловий спирт (75) етилацетат (100) 30 15-18 3,40 2,957 65.1% етиловий спирт (85)+ вода етилацетат (85) 25 17-21 3,50 2,733 60.1% (0,5) ізопропіл-ацетат етиловий спирт (85) 25 16-18 4,40 3,790 83.4% (85) етиловий спирт (40)+ метил- ізопропіл-ацетат 25 16-20 4,50 2,229 49.1% овий спирт (45) (85) етиловий спирт (65)+ ізо- етилацетат (85) 24 16-20 4,20 3,951 87.0% пропіловий спирт (20) етиловий спирт (85) етилацетат (85) 21 20-21 5 3,168 69.7% 25 84462 Приклад 8 Метансуль фонову кислоту (0,73г, приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (3,802г, 0,01моль) в етанолі (63мл), заздалегідь нагрітої до 65°С, після чого суміш піддали перемішуванню протягом 10 хвилин. Потім повільно по краплях додали етилацетат (63мл), після чого суміш охолодили до 34°C при одночасному перемішуванні. Потім додали затравкові кристали α-кристалічної форми (50мг), після чого суміш о холодили і піддали перемішуванню при кімнатній температурі протягом 4,5 годин. Кристали відфільтрували, промили 30мл етилацетату і просушили в умовах зниженого тиску при кімнатній температурі. Вихід: 3,699г (81,4%) продукту, який ідентифікували як α-кристалічну форму мономесилату Іматинібу. Приклад 9 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (39,96г, 0,08моль) в суміші етанолу (890мл) і етилацетату (200мл), заздалегідь нагрітої до 65°С. Розчин піддали перемішуванню протягом 10 мін, після чого повільно по краплях додали етилацетат (690мл), потім суміш повільно охолодили до 39°C при одночасному перемішуванні, після чого додали 1,215г затравкових кристалів α-кристалічної форми, а потім суміш повільно охолодили до 22°С. Потім суміш залишили без перемішування при кімнатній температурі (приблизно 19°С) на два дні. Продукт відфільтрували і промили 100мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі. Вихід: 44,43г (93,1%) продукту. Приклад 10 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (10,647г) в етиловому спирті (173мл), заздалегідь нагрітої до 65°C, після чого суміш піддали перемішуванню протягом 5 хвилин. Потім до розчину додали затравкові кристали αкристалічної форми (0,279г) при приблизно 44°С, після чого по краплях додали ізопропанол (65мл) і етилацетат (238мл). Перемішування при кімнатній температурі (приблизно 24-25°С) продовжили протягом 4 годин, а потім суміш залишили без перемішування на 64 години. Продукт відфільтрували і промили 50мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 11,85г (93,1%) α-кристалічної форми мономесилату Іматинібу. Приклад 11 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (37,997г) в етанолі (620мл), заздалегідь нагрітої до 75°С. Отриманий розчин піддали перемішуванню протягом 15 хвилин, а потім по краплях додали ізопропанол (230мл) і етилацетат (750мл). Суміш перемішали і повільно охолодили до 31,5°C, а потім додали 0,994г затравкових кристалів α-кристалічної форми, після чого по краплях додали етилацетат (100мл). Потім суміш охолодили до 22-23°С. Перемішування при цій температурі продовжили протягом 4 годин. Потім 26 суміш залишили без перемішування на ніч при приблизно 20°С. Продукт відфільтрували і промили 100мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 43,814г (96,5%) продукту. Приклад 12 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (3,802г) в етанолі (85мл), заздалегідь нагрітої до 68°C. Через 5 хвилин по краплях додали ізопропанол (85мл). Потім суміш повільно охолодили при одночасному перемішуванні, після чого до неї додали 50мг затравкових кристалів α-кристалічної форми при приблизно 37°С. Потім суміш охолодили до 21°С (у результаті з моменту затравки суміш піддали перемішуванню протягом приблизно 6,5 годин). Потім суміш залишили без перемішування на ніч при приблизно 21°C. Продукт відфільтрували і промили 25мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 4,393г (96,7%) продукту. Приклад 13 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (39,96г) в суміші етанолу (890мл) і ізопропанолу (200мл), заздалегідь нагрітої до 65°С. Розчин піддали перемішуванню протягом 10 хвилин, після чого повільно по краплях додали ізопропанол (690мл), потім суміш повільно охолодили до 39°С при одночасному перемішуванні, після чого додали 1,118г затравкових кристалів α-кристалічної форми, а потім суміш повільно охолодили до приблизно 22°С. Потім суміш залишили без перемішування при кімнатній тем пературі (приблизно 20°С) на два дні. Продукт відфільтрували і промили 100мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 46,88г (98,2%) продукту. Приклад 14 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (78,56г) в етанолі (1100мл), заздалегідь нагрітої до 71°C. Розчин піддали перемішуванню протягом 10 хвилин при 72-75°С, після чого до нагрітого розчину повільно по краплях додали ізопропанол (1100мл). Потім суміш повільно охолодили до 45°C, після чого до неї додали 1,276г затравкових кристалів α-кристалічної форми. Після охолоджування суміші до приблизно 20°С її піддали перемішуванню при цій же температурі протягом 3 годин. Продукт відфільтрували і промили 150мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 91,12г (97,1%) продукту. Приклад 15 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (7,604г) в етанолі (11мл), заздалегідь нагрітої до 69°С. До отриманого розчину повільно по краплях додали ізопропанол 27 84462 (225мл). Суміш повільно охолодили при одночасному перемішуванні, а потім додали 100 мг затравкових кристалів α-кристалічної форми при приблизно 38°С (розчин був злегка каламутним). Потім суміш охолодили до 21°C (у результаті з моменту затравки суміш піддали перемішуванню протягом приблизно 6,5 годин). Потім суміш залишили без перемішування на ніч при приблизно 21°С. Продукт відфільтрували і промили 50мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 8,502г (93,6%) продукту. Приклад 16 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (22,76г) в етанолі (180мл), заздалегідь нагрітої до 75°С. Потім повільно по краплях додали ізопропанол (820мл). Суміш повільно охолодили при одночасному перемішуванні, а потім додали 0,600г затравкових кристалів αкристалічної форми при приблизно 44°С. Потім суміш охолодили до 21°C (у результаті з моменту затравки суміш піддали перемішуванню протягом 6,5 годин). Потім суміш залишили без перемішування на ніч при приблизно 21°C. Продукт відфільтрували і промили 100мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 26,721г (98,3%) продукту. Приклад 17 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (10,00г) в суміші етанолу (79мл) і ізопропанолу (360мл), заздалегідь нагрітої до 45°С, після чого додали 0,282г затравкових кристалів α-кристалічної форми. Потім суміш піддали охолоджуванню до кімнатної температури протягом 5 годин, після чого її залишили без перемішування при кімнатній температурі (приблизно 21°С) на ніч. Продукт відфільтрували і промили 80мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 11,671г (97,7%) продукту. Приклад 18 Метансуль фонову кислоту (приблизно 0,99екв.) додали при кімнатній температурі (2424,5°С) при одночасному перемішуванні до суспензії Іматинібу (10,000г) в суміші етанолу (79мл) і ізопропанолу (360мл). Одержану суміш нагріли до 70°С, причому при цій температурі майже всі кристали розчинилися. Потім суміш піддали природному охолоджуванню до кімнатної температури протягом 3 годин 50 хвилин. Потім суміш залишили без перемішування при кімнатній температурі (22°С) на ніч. Продукт відфільтрували і промили 80мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 11,187г (93,6%) продукту. Приклад 19 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (22,76г) в етанолі (182мл), заздалегідь нагрітої до 76°С. До отриманого роз 28 чину по краплях додали ізопропанол (250мл), після чого всю суміш нагріли до 70°C. Потім суміш повільно охолодили при одночасному перемішуванні, а потім додали 100мг затравкових кристалів α-кристалічної форми при приблизно 44°С. Потім по краплях додали ізопропанол (850мл), після чого суміш о холодили до 22°С Перемішування продовжили при цій же температурі протягом 0,5 годин, після чого суміш залишили без перемішування на ніч при приблизно 22°С. Продукт відфільтрували і промили 100мл ізопропанолу і 75мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 26,306г (96,7%) продукту. Приклад 20 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в ізопропанолі (75мл), заздалегідь нагрітої до 65°С, після чого суміш піддали перемішуванню і ви тримці при приблизно 65-70°С до тих пір, поки не розчинилися тверді речовини. Потім суміш піддали повільному охолоджуванню при одночасному перемішуванні, після чого до неї додали 27мг затравкових кристалів α-кристалічної форми при 34°С. Потім суміш повільно охолодили до кімнатної температури, і перемішування продовжили протягом 4,5 годин. Продукт відфільтрували і промили 15мл ізопропанолу. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 1,761г (96,9%) продукту. Приклад 21 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (10,88г) в ізопропанолі (536мл), заздалегідь нагрітої до 75°C. Отриманий розчин повільно охолодили при одночасному перемішуванні, а потім додали 0,285г затравкових кристалів α-кристалічної форми при приблизно 40°C (невелика каламутність). Потім суміш охолодили до кімнатної температури (загальний час охолоджування 1 година 15 хвилин). Потім суміш залишили без перемішування на ніч при приблизно 22°С. Продукт відфільтрували і промили 100мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 12,521г (96,3%) продукту. Приклад 22 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (10,023г) в ізопропанолі (440мл), заздалегідь нагрітої до 65°С. Потім суміш залишили природно охолоджуватися до 22,5°С (приблизно протягом 7 годин). Продукт відфільтрували і промили 45мл ізопропанолу. Кристали просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 11,784г (98,4%) продукту. Приклад 23 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (5,326г) в n-пропанолі (230мл), заздалегідь нагрітої до 72°С Потім суміш піддали перемішуванню протягом 5 хвилин і охолодили. Потім додали затравкові кристали α 29 84462 кристалічної форми (100мг) при 30°С. Потім суміш охолодили до приблизно 21°С, після чого її піддали перемішуванню при цій же температурі протягом 2,5 годин. Продукт відфільтрували і промили з 40мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі. Приклад 24 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (5,325г) в n-бутанолі (230мл), заздалегідь нагрітої до 70°С. Потім суміш піддали перемішуванню протягом 5 хвилин і охолодили. Потім додали затравкові кристали αкристалічної форми (105мг) при 38°С. Потім суміш повільно охолодили до приблизно 18°С (протягом 3,5 годин). Продукт відфільтрували і промили 25мл ізопропанолу і 30мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі. Приклад 25 Метансуль фонову кислоту (приблизно 0,99екв.) додали при одночасному перемішуванні до суспензії Іматинібу (5,320г) в трет-бутанолі (230мл), заздалегідь нагрітої до 70°C. Отриману жовто-оранжеву суміш витримували при 75-80°C протягом 1 години, а потім повільно охолодили (протягом 1 години 40 хвилин) до 27°С. Продукт відфільтрували і промили з 50мл етилацетату. Кристали просушили в умовах зниженого тиску при кімнатній температурі. В. Димесилат Іматинібу Приклад 26 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 65°С. До нагрітого розчину повільно по краплях додавали трет-бутилметиловий ефір (MTBE) до тих пір, поки він не помутнів (6мл). Після перемішування протягом 1 години при кімнатній температурі додали 5мл безводного етанолу, і перемішування продовжили протягом 4 годин. Осад відфільтрували і промили 2мл безводного етанолу і 5мл MTBE. Продукт просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 0,739г форми І димесилату Іматинібу. Приклад 27 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 65°С. До нагрітого розчину повільно по краплях додавали трет-бутилметиловий ефір (MTBE) до тих пір, поки він злегка не помутнів (4,5мл), після чого до нього додали затравкові кристали кристалічної форми І. Після перемішування протягом 0,5 години при кімнатній температурі додали 5мл безводного етанолу, і перемішування продовжили протягом 1 години. Потім суміш нагріли до приблизно 35°C і піддали перемішуванню при цій же температурі протягом 1 години, а потім при кімнатній температурі протягом 2,5 годин. Осад відфільтрували і промили 10мл безводного етанолу. Продукт просушили в умовах зниженого тиску при кімнатній 30 температурі, внаслідок чого було отримано 1,370г форми І димесилату Іматинібу. Приклад 28 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (70мл), заздалегідь нагрітої до приблизно 65°С. Суміш нагріли до 70°C, а потім повільно охолодили. Потім додали затравкові кристали кристалічної форми І, після чого продовжили охолоджування. Після перемішування протягом 3 годин при кімнатній температурі осад жовтого кольору відфільтрували і промили 10мл ізопропанолу. Продукт просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 1,967г форми І димесилату Іматинібу. Приклад 29 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 65°С. До нагрітого розчину повільно по краплях додали 20мл етилацетату, після чого перемішування продовжили. Потім до нього додали затравкові кристали кристалічної форми І при 40°С. Суміш* (* Помилка в тексті оригіналу: слід читати "перемішування" (Прим, перекл.)) продовжили при кімнатній температурі протягом приблизно 2 годин, після чого продовжили охолоджування. Продукт відфільтрували і промили 10мл етилацетату. Продукт просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого було отримано 1,983г форми І димесилату Іматинібу. Приклад 30 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 65°C. Суміш піддали перемішуванню протягом 10 хвилин. Потім суміш охолодили до кімнатної температури. Через 0,5 години по краплях додали 20мл ацетону, після чого суміш піддали перемішуванню при кімнатній температурі протягом 1 години 50 хвилин. Потім по краплях додали ще 20мл ацетону, а потім додали затравкові кристали кристалічної форми І. Через 50 хвилинпо краплях додали додаткові 10мл ацетону, після чого суміш піддали перемішуванню при кімнатній температурі протягом 1 години 20 хвилин. Продукт відфільтрували і промили 25мл ацетону і 35мл гексану, внаслідок чого були отримані кристали форми Il димесилату Іматинібу. Приклад 31 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 65°С, після чого суміш піддали перемішуванню при цій же температурі протягом 10 хвилин. Потім суміш охолодили до кімнатної температури, після чого до неї повільно по краплях додали 40мл ацетону. Потім до суміші додали затравкові кристали кристалічної форми II, після чого повільно по краплях додали 10мл ацетону. Потім суміш піддали перемішуванню при кімнатній температурі протягом 3 31 84462 годин. Продукт відфільтрували і промили 20мл ацетону. Продукт просушили в умовах зниженого тиску при кімнатній температурі, внаслідок чого були отримані кристали форми Il димесилату Іматинібу. Приклад 32 Суміш продуктів відповідно до прикладів 5 і 6 (1,551г) обробили 25мл метанолу, а отриману суспензію піддали перемішуванню при кімнатній температурі протягом 1 години 50 хвилин. Потім суміш нагріли, а отриманий розчин повільно охолодили до кімнатної температури. Потім додали затравкові кристали кристалічної Форми II, і перемішування продовжили при кімнатній температурі (4 години 40 хвилин, оскільки суміш була нагріта). Продукт відфільтрували і промили мінімальною кількістю метанолу. Потім продукт просушили при кімнатній температурі в умовах зниженого тиску, внаслідок чого були отримані кристали форми Il димесилату Іматинібу. Приклад 33 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 65°C. Потім до нагрітого розчину по краплях додавали етилацетат до тих пір, поки не була відзначена незначна каламутність (27мл). Потім до суміші додали затравкові кристали кристалічної форми II, після чого суміш піддали перемішуванню при кімнатній температурі протягом 4 годин. Продукт відфільтрували і промили 20мл етилацетату. Продукт 32 просушили в умовах зниженого тиску при кімнатній температурі. Була отримана кристалічна суміш форм І і Il димесилату Іматинібу (масове співвідношення приблизно 1:1). Приклад 34 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл) при кімнатній температурі. Потім суміш нагріли до температури кипіння і додали 10мл безводного етанолу, після чого суміш знову нагріли до температури кипіння і піддали перемішуванню при цій же температурі протягом 3 годин 20 хвилин. Продукт відфільтрували і промили 15мл безводного етанолу. Продукт просушили в умовах зниженого тиску при кімнатній температурі. Була отримана кристалічна суміш форм І і Il димесилату Іматинібу (масове співвідношення приблизно 1:1). Приклад 35 Метансуль фонову кислоту (0,4мл) по краплях додали при одночасному перемішуванні до суспензії Іматинібу (1,521г) в безводному етанолі (20мл), заздалегідь нагрітої до приблизно 70°С. Потім до нагрітого розчину повільно по краплях додавали етилацетат (20мл), після чого перемішування продовжили при кімнатній температурі. Через 3,5 годин осідань відфільтрували і промили сумішшю безводного етанолу і етилацетату (1:1, 20мл). Продукт просушили в умовах зниженого тиску при кімнатній температурі. Була отримана кристалічна суміш форм І і Il димесилату Іматинібу (масове співвідношення приблизно 1:1). 33 84462 34 35 84462 36 37 84462 38 39 84462 40 41 84462 42 В описі до патенту на в инахід графічні зображення та текст подаються в редакції заяв ника Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline polymorphs of methanesulfonic acid addition salts of imatinib
Автори англійськоюSzczepek Wojciech, Samson-Lazinska Dorota, Zagrodzki Bogdan, Glice Magdalena, Maruszak Wioleta, Korczak Kataryzna, Modzelewski Ryszard, Lawecka Marta, Kaczmarek Lukasz, Shelieievski Wieslaw, Fraczek Urszula, Cmoch Piotr
Назва патенту російськоюПолиморфные модификации кислотно-аддитивных солей иматиниба с метансульфоновой кислотой
Автори російськоюЩепек Войцех, Самсон-Лазинска Дорота, Загродзки Богдан, Глице Магдалена, Марушак Виолета, Корчак Катаржина, Модзелевски Ришард, Лавецка Марта, Качмарек Лукаш, Шелеевски Веслав, Фрачек Уршула, Цмох Петр
МПК / Мітки
МПК: C07D 401/04
Мітки: модифікації, кислотно-адітивних, кислотою, солей, іматинібу, поліморфні, метансульфоновою
Код посилання
<a href="https://ua.patents.su/21-84462-polimorfni-modifikaci-kislotno-aditivnikh-solejj-imatinibu-z-metansulfonovoyu-kislotoyu.html" target="_blank" rel="follow" title="База патентів України">Поліморфні модифікації кислотно-адитивних солей іматинібу з метансульфоновою кислотою</a>
Попередній патент: Спосіб зчитування інформації з механічної фонограми
Наступний патент: Пристрій для визначення вмісту магнетиту у залізних рудах
Випадковий патент: Спосіб оптимізації робочих параметрів теплового двигуна