Заміщені хіноліни та їх застосування як мікобактеріальних інгібіторів
Номер патенту: 85570
Опубліковано: 10.02.2009
Автори: Жільмон Жером Еміль Жорж, Паск'є Елізабет Тереза Жанна
Формула / Реферат
1. Сполука формули
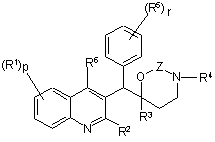 (Ia)
(Ia)
або
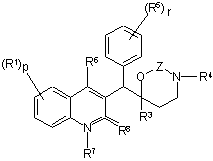 , (Ib)
, (Ib)
та її фармацевтично прийнятні кислотно- або основно-адитивні солі, її четвертинні аміни, її стерохімічно ізомерні форми, її таутомерні форми та її N-оксидні форми, де
R1 являє собою водень, галоген, галогеналкіл, ціано, гідрокси, Аr, Het, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл,
р означає ціле число, рівне 1, 2, 3 або 4;
R2 являє собою водень, гідрокси, тіо, алкілокси, алкілоксіалкілокси, алкілтіо,
моно- або ді(алкіл)аміно або радикал формули  , де Y являє собою СН2, О, S, NH або N-алкіл;
, де Y являє собою СН2, О, S, NH або N-алкіл;
R3 являє собою алкіл, Аr, Аr-алкіл, Het або Het-алкіл;
R4 являє собою водень, алкіл або бензил;
R5 являє собою водень, галоген, галогеналкіл, гідрокси, Аr, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл; або
два сусідні радикали R5 можуть бути взяті разом з фенільним кільцем, до якого вони приєднані, утворюючи нафтил;
r означає ціле число, рівне 1, 2, 3, 4 або 5; та
R6 являє собою водень, алкіл, Аr або Het;
R7 являє собою водень або алкіл;
R8 являє собою оксо; або
R7 та R8 разом утворюють радикал -СН=СН-N=;
Z являє собою СН2 або С(=O);
алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вуглеводневим радикалом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю може бути необов'язково заміщений галогеном, гідрокси, алкілокси або оксо;
Аr являє собою гомоцикл, вибраний із групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний із групи, що включає гідрокси, галоген, ціано, нітро, аміно, моно- або діалкіламіно, алкіл, галогеналкіл, алкілокси, галогеналкілокси, карбоксил, алкілоксикарбоніл, аміно карбоніл, морфолініл та моно- або діалкіламінокарбоніл;
Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає N-феноксипіперидиніл, піроліл, піразоліл, імідазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл та піридазиніл;
або біциклічний гетероцикл, вибраний із групи, що включає хінолініл, хіноксалініл, індоліл, бензимідазоліл, бензоксазоліл, бензізоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл, бензотієніл, 2,3-дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 замісниками, вибраними з групи, що включає галоген, гідрокси, алкіл або алкілокси;
галоген являє собою замісник, вибраний із групи, що включає фтор, хлор, бром та йод, а
галогеналкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, в якому один або більше атомів вуглецю заміщені одним або більше атомами галогену.
2. Сполука за п. 1, в якій Z являє собою СН2.
3. Сполука за будь-яким з попередніх пунктів, в якій R3 являє собою водень, галоген, галогеналкіл, гідрокси, Аr, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл.
4. Сполука за п. 1 або 2, в якій
R1 являє собою водень, галоген, ціано, Аr, Het, алкіл та алкілокси;
р означає ціле число, рівне 1, 2, 3 або 4;
R2 являє собою водень, гідрокси, алкілокси, алкілоксіалкілокси, алкілтіо або
радикал формули  , де Y являє собою О;
, де Y являє собою О;
R3 являє собою алкіл, Аr, Аr -алкіл або Het;
R4 являє собою водень, алкіл або бензил;
R5 являє собою водень, галоген або алкіл; або
два сусідні радикали R5 можуть бути взяті разом з фенільним кільцем, до якого вони приєднані, утворюючи нафтил;
r означає ціле число, рівне 1; та
R6 являє собою водень;
R7 являє собою водень або алкіл;
R8 являє собою оксо; або
R7 та R8 разом утворюють радикал -CH=CH-N=;
алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вуглеводневим радикалом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю може бути необов'язково заміщений галогеном або гідрокси;
Аr являє собою гомоцикл, вибраний із групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний із групи, що включає галоген, галогеналкіл, ціано, алкілокси та морфолініл;
Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає N-феноксипіперидиніл, фураніл, тієніл, піридиніл, піримідиніл; або біциклічний гетероцикл, вибраний із групи, що включає бензотієніл, 2,3-дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 алкільними замісниками; а
галоген являє собою замісник, вибраний із групи, що включає фтор, хлор та бром.
5. Сполука за будь-яким з попередніх пунктів, що являє собою сполуку формули (Іа) та де R1 являє собою водень, галоген, Аr, Het, алкіл або алкілокси; р = 1; R2 являє собою водень, алкілокси або алкілтіо; R3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений 1 або 2 замісниками, вибраними з групи, що включає галоген та галогеналкіл; R4 являє собою водень або алкіл; R5 являє собою водень, алкіл або галоген; r дорівнює 1; а R6 являє собою водень.
6. Сполука за будь-яким з пп. 1, 3, 4 або 5, що являє собою сполуку формули (Іа), де R1 являє собою водень, галоген, алкіл або Het; R2 являє собою алкілокси; R3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений галогеном; R4 являє собою алкіл; R5 являє собою водень або галоген; R6 являє собою водень; Z являє собою СН2 або С(=O).
7. Сполука, визначена в будь-якому з попередніх пунктів, для застосування як лікарський засіб.
8. Фармацевтична композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки, визначеної за будь-яким з пп. 1-6.
9. Застосування сполуки за будь-яким з пп. 1-6 або композиції за п. 8 для одержання лікарського засобу для лікування мікобактеріальних захворювань.
10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що а) проміжну сполуку формули (II-а) та (II-b) вводять у взаємодію з параформом в придатному розчиннику
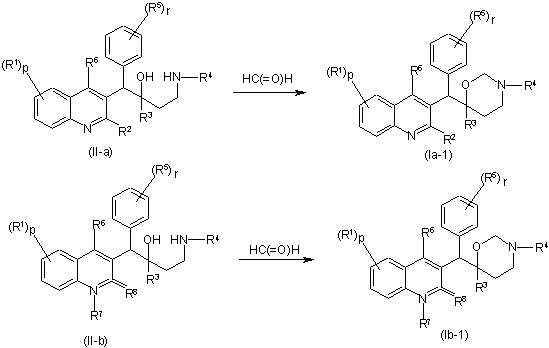 ,
,
при цьому R1-R8, p та r визначені в п. 1;
b) проміжну сполуку формули (III-а) та (ІІІ-b) вводять у взаємодію з придатною основою в придатному розчиннику
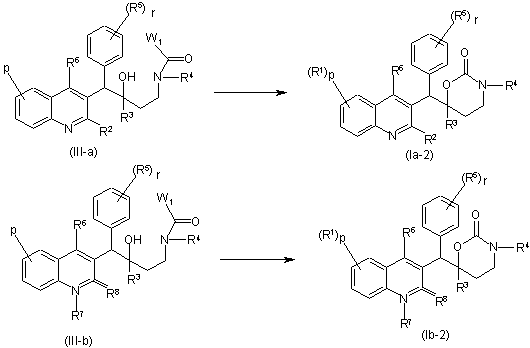 ,
,
при цьому R1-R8, p та r визначені в п. 1, a W1 являє собою придатну групу, що відходить;
або, при бажанні, сполуки формули (Iа) або (Ib) перетворюють одну в одну шляхом відомих у даній галузі реакцій перетворень та потім, при бажанні, переводять сполуки формули (Iа) або (Іb) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або в терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, переводять кислотно-адитивну сольову форму в вільну основу шляхом обробки лугом, або переводять основно-адитивну сіль у вільну кислоту шляхом обробки кислотою, та, при бажанні, одержують їх стереохімічно ізомерні форми, четвертинні аміни, таутомерні форми або N-оксиди.
Текст
1. Сполука формули 3 85570 золіл, ізоксазоліл, тіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл та піридазиніл; або біциклічний гетероцикл, вибраний із групи, що включає хінолініл, хіноксалініл, індоліл, бензимідазоліл, бензоксазоліл, бензізоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл, бензотієніл, 2,3-дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 замісниками, вибраними з групи, що включає галоген, гідрокси, алкіл або алкілокси; галоген являє собою замісник, вибраний із групи, що включає фтор, хлор, бром та йод, а галогеналкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, в якому один або більше атомів вуглецю заміщені одним або більше атомами галогену. 2. Сполука за п. 1, в якій Z являє собою СН 2. 3. Сполука за будь-яким з попередніх пунктів, в якій R3 являє собою водень, галоген, галогеналкіл, гідрокси, Аr, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл. 4. Сполука за п. 1 або 2, в якій R1 являє собою водень, галоген, ціано, Аr, Het, алкіл та алкілокси; р означає ціле число, рівне 1, 2, 3 або 4; R2 являє собою водень, гідрокси, алкілокси, алкілоксіалкілокси, алкілтіо або N Y радикал формули , де Y являє собою О; R3 являє собою алкіл, Аr, Аr -алкіл або Het; R4 являє собою водень, алкіл або бензил; R5 являє собою водень, галоген або алкіл; або два сусідні радикали R5 можуть бути взяті разом з фенільним кільцем, до якого вони приєднані, утворюючи нафтил; r означає ціле число, рівне 1; та R6 являє собою водень; R7 являє собою водень або алкіл; R8 являє собою оксо; або R7 та R8 разом утворюють радикал -CH=CH-N=; алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вуглеводневим радикалом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю може бути необов'язково заміщений галогеном або гідрокси; Аr являє собою гомоцикл, вибраний із групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний із групи, що включає галоген, галогеналкіл, ціано, алкілокси та морфолініл; 4 Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає N-феноксипіперидиніл, фураніл, тієніл, піридиніл, піримідиніл; або біциклічний гетероцикл, вибраний із групи, що включає бензотієніл, 2,3-дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 алкільними замісниками; а галоген являє собою замісник, вибраний із групи, що включає фтор, хлор та бром. 5. Сполука за будь-яким з попередніх пунктів, що являє собою сполуку формули (Іа) та де R1 являє собою водень, галоген, Аr, Het, алкіл або алкілокси; р = 1; R2 являє собою водень, алкілокси або алкілтіо; R3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений 1 або 2 замісниками, вибраними з групи, що включає галоген та галогеналкіл; R4 являє собою водень або алкіл; R5 являє собою водень, алкіл або галоген; r дорівнює 1; а R6 являє собою водень. 6. Сполука за будь-яким з пп. 1, 3, 4 або 5, що являє собою сполуку формули (Іа), де R1 являє собою водень, галоген, алкіл або Het; R2 являє собою алкілокси; R3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений галогеном; R4 являє собою алкіл; R5 являє собою водень або галоген; R6 являє собою водень; Z являє собою СН 2 або С(=O). 7. Сполука, визначена в будь-якому з попередніх пунктів, для застосування як лікарський засіб. 8. Фармацевтична композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки, визначеної за будь-яким з пп. 1-6. 9. Застосування сполуки за будь-яким з пп. 1-6 або композиції за п. 8 для одержання лікарського засобу для лікування мікобактеріальних захворювань. 10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що а) проміжну сполуку формули (IIа) та (II-b) вводять у взаємодію з параформом в придатному розчиннику (R 5) r (R 1)p (R 5) r R6 OH H N N R2 R4 HC(=O)H (R 1) p R6 O R3 N (I I-a) R2 (Ia-1) (R 5) r (R 1) p N R7 R4 HC(=O)H (R1) p R6 O R3 R8 R4 (R5) r R6 OH HN N R3 N R7 R8 R N R4 3 (I I-b) , при цьому R1-R8, p та r визначені в п. 1; b) проміжну сполуку формули (III-а) та (ІІІ-b) вводять у взаємодію з придатною основою в придатному розчиннику (I b-1) 5 (R5) 85570 r (R5) r W1 R6 p OH N O R4 O (R1)p R6 O R3 N R2 N (III-a) R2 (Ia-2) R4 N R3 (R5) r (R5) r W1 p O R6 OH N R7 R8 N R4 O (R1)p R6 O R3 N R7 N R4 R3 R8 (III-b) , при цьому R1-R8, p та r визначені в п. 1, a W1 являє собою придатну гр упу, що відходить; (Ib-2) Даний винахід відноситься до нових заміщених похідних хіноліну, які корисні для лікування мікобактеріальних захворювань, зокрема, захворювань, викликаних такими патогенними мікобактеріями, як Mycobacterium, (Μ.) tuberculosis, M bovis, M. a vium та Μ. marinum. Mycobacterium tuberculosis є збудником туберкульозу (ТБ), серйозної та потенційно смертельної інфекції, що розповсюджена в усьому світі. За оцінках Всесвітньої Організації Охорони здоров'я більше 8 мільйонів чоловік занедужують на ТБ щороку, а 2 мільйони чоловік вмирають від туберкульозу щорічно. Протягом останнього десятиліття кількість випадків захворювання ТБ в усьому світі виросла на 20%, причому особливо важка ситуація спостерігається в країнах з найбільш низьким рівнем життя. Якщо подібна тенденція буде продовжуватися, протягом наступних 20 років число випадків захворювання ТБ виросте на 41%. Через п'ятдесятьох років після введення ефективної хіміотерапії ТБ залишається після СНІДу в числі лідируючих інфекцій, що викликають смертність серед дорослого населення у світі. Ускладнює епідемію ТБ зростаючий потік штамів, стійких до безлічі лікарських препаратів, та смертельний симбіоз із ВІЛ. Люди, що мають позитивну ВІЛ-реакцію, та інфіковані ТБ, поширять активний ТБ з імовірністю в 30 разів більшою, ніж люди, що мають негативну ВІЛ-реакцію, а ТБ є причиною смерті одного з кожних трьох людин-носіїв ВІЛ/СНІД в усьому світі. Усі відомі підходи до лікування туберкульозу включають сполучення численних агентів. Наприклад,, режим, рекомендований системою охорони здоров'я США, включає сполучення ізоніазиду, рифампіцину та піразинаміду протягом двох місяців, потім тільки ізоніазид та рифампіцин ще чотири місяці. Пацієнти, інфіковані ВІЛ, продовжують прийом цих лікарських препаратів ще протягом семи місяців. Для пацієнтів, інфікованих штамами М. tuberculosis, стійкими до численних лікарських препаратів, до комбінаційної терапії додають такі агенти, як етамбутол, стрептоміцин, канаміцин, амікацин, капреоміцин, етіонамід, циклосерин, ципрофлоксацин та офлоксацин. Не існує окремого агента, що був би е фективний для клінічного лікування туберкульозу, а також ніякого сполучен 6 або, при бажанні, сполуки формули (Iа) або (Ib) перетворюють одну в одн у шляхом відомих у даній галузі реакцій перетворень та потім, при бажанні, переводять сполуки формули (Iа) або (Іb) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою або в терапевтично активну нетоксичну основно-адитивну сіль шляхом обробки основою, або навпаки, переводять кислотно-адитивну сольову форму в вільну основу шляхом обробки лугом, або переводять основно-адитивну сіль у вільну кислоту шляхом обробки кислотою, та, при бажанні, одержують їх стереохімічно ізомерні форми, четвертинні аміни, таутомерні форми або N-оксиди. ня агентів, що давали б можливість терапії тривалістю менше шести місяців. Для медицини вкрай необхідні нові лікарські засоби, що поліпшать існуюче лікування, зробивши можливим режими, що сприяють його дотриманню пацієнтом та постачальником. Менш тривалі короткі режими та режими, що вимагають меншого контролю, являють собою найкращий шлях для досягнення цього. Найбільша користь від лікування досягається протягом перших двох місяців під час інтенсивної або бактерицидної фази, коли одночасно дають чотири лікарських препарати; бактеріальне навантаження значно зменшується та пацієнти стають незаразними. Для фази тривалістю від 4 до 6 місяців або стерилізаційної, необхідно вивести з організму мікроби, що залишилися, та звести до мінімуму небезпеку рецидиву. Був б вкрай корисним ефективний стерилізуючий лікарський засіб, що скорочує тривалість лікування до 2 місяців. Крім того, необхідні лікарські препарати, що сприяють дотриманню режиму, вимагаючи менш інтенсивного контролю. Очевидно, найбільшу користь принесла б сполука, що зменшує як загальну тривалість лікування, так і частоту введення лікарських препаратів. Ускладнює епідемію ТБ зростаючий відсоток штамів, стійких до великого числа лікарських препаратів або MDR-ТБ. Аж до чотирьох відсотків від усі х випадків в усьому світі вважаються MDR-ТБ штами, стійкі до найбільш ефективних лікарських засобів чотирьох-препаратного стандарту, ізоніазиду та ри фампіну. За відсутності лікування MDRТБ смертельний та не може бути адекватно вилікуваний за допомогою звичайної терапії, так що для режиму необхідно до 2 років застосування лікарських засобів «другої лінії». Ці лікарські засоби часто токсичні, дорогі та малоефективні. За відсутності ефективної терапії пацієнти, інфіковані MDR-ТБ, продовжують поширювати дане захворювання, приводячи до нових інфекцій зі штамами MDR-ТБ. У медицині існує крайня необхідність у новому лікарському препараті з новим механізмом дії, що, можливо, виявить активність у відношенні MDR штамів. Використаний раніше або надалі термін «лікарська стійкість» є терміном, що зрозумілий фахівцю в мікробіології. Лікарсько стійка Micobacterium являє собою Micobacterium, що більш не є чутли 7 85570 вою, щонайменше, до одного з раніше ефективних лікарських засобів, що знайшла здатність протистояти антибіотичній дії, щонайменше, одного з раніше ефективних лікарських засобів. Лікарсько стійкий штам може передавати цю здатність своєму потомству. Причиною зазначеної стійкості може бути випадкові генетичні мутації в бактеріальній клітині, що змінюють її чутливість до одного лікарського засобу або до різних лікарських засобів. MDR туберкульоз являє собою особливий вид лікарсько стійкого туберкульозу через бактерію, стійку, щонайменше, до ізоніазиду та рифампіцину (при наявності або за відсутності стійкості до інших лікарських засобів), що у даний час є двома найбільш могутніми проти-ТБ лікарськими засобами. Метою даного винаходу є надання нових сполук, зокрема, заміщених похідних хіноліну, що мають здатність інгібувати ріст мікобактерій, включаючи лікарсько стійкі або стійкі до великого числа лікарських засобів мікобактерії, та, таким чином, корисних для лікування мікобактеріальних захворювань, зокрема, мікобактеріальних захворювань, викликаних патогенними мікобактеріями, такими, як Micobacterium tuberculosis, Μ. bovis, Μ. avium, Μ. smegmatis та Μ mannum. Заміщені хіноліни вже були описані в патенті США 5965572 (Сполучені Штати Америки) для лікування інфекцій, стійких до антибіотиків, та в WO 00/34265 для інгібування росту бактеріальних мікроорганізмів. В жодній з цих публікацій заміщені похідні хіноліну не були описані відповідно до даного винаходу. Даний винахід відноситься до нових заміщених похідних хіноліну формули (Іа) та (Іb) їх фармацевтично прийнятних кислотно- або основно-адитивних солей, їх че твертинних амінів, їх стереохімічно ізомерних форм, їх таутомерних форм та їх N-оксидних форм, де: R1 являє собою водень, галоген, галогеналкіл, циано, гідрокси, Аr, Неt, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл; p означає ціле число, рівне 1, 2, 3 або 4; R2 являє собою водень, гідрокси, тіо, алкілокси, алкілоксіалкілокси, алкілтіо, 8 моно або ді(алкіл)аміно або радикал форму ли де Υ являє собою СН 2, О, S, ΝΗ або Nалкіл; R3 являє собою алкіл, Аr, Аr-алкіл, Het або Hetалкіл; R4 являє собою водень, алкіл або бензил; R5 являє собою водень, галоген, галогеналкіл, гідрокси, Аr, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл; або два сусідні радикали R5 можуть бути взяті разом з фенільним кільцем, до якого вони приєднані, утворюючи нафтил; r означає ціле число, рівне 1, 2, 3, 4 або 5; та R являє собою водень, алкіл, Аr або Het; R7 являє собою водень або алкіл; R8 являє собою оксо; або R7 та R8 разом утворюють радикал -CH=CHN=; Ζ являє собою СН 2 або С(=О); алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вуглеводневим радикалом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю може бути необов'язково заміщений галогеном, гідрокси, алкілокси або оксо; Аr являє собою гомоцикл, вибраний з групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, кожен з яких необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з групи, що включає гідрокси, галоген, ціано, нітро, аміно, моно- або діалкіламіно, алкіл, галогеналкіл, алкілокси, галогеналкілокси, карбоксил, алкілоксикарбоніл, амінокарбоніл, морфолініл та моно- або діал кіламінокарбоніл; Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає Nфеноксипіперидиніл, піроліл, піразоліл, імідазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл та піридазиніл; або біциклічний гетероцикл, вибраний із групи, що включає хінолініл, хіноксалініл, індоліл, бензимідазоліл, бензоксазоліл, бензизоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл, бензотієніл, 2,3-дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 замісниками, вибраними з групи, що включає галоген, гідрокси, алкіл або алкілокси; галоген являє собою замісник, вибраний із групи, що включає фтор, хлор, бром та йод, та галогеналкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, в якому один або більше атомів вуглецю заміщені одним або більше атомами галогену. 9 85570 Сполуки відповідно до формули (Іа) та (Іb) є взаємозалежними в тому, що, наприклад, сполука формули (Іb), де R8 являє собою оксо, є таутомерним еквівалентом сполуки формули (Іа), де R являє собою гідрокси (кето-єнольна таутомерія). В рамках даної заявки алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вугле водневим радикалом, що містить від 1 до 6 атомів вуглецю, де кожен атом вуглецю може бути необов'язково заміщений галогеном, гідрокси, алкілокси або оксо. Переважно, алкіл являє собою метил, етил або циклогексилметил. В рамках даної заявки Аr являє собою гомоцикл, вибраний із групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, при цьому кожен замісник незалежно вибраний із групи, що включає гідрокси, галоген, ціано, нітро, аміно, моно- або діалкіламіно, алкіл, галогеналкіл, алкілокси, галогеналкілокси, карбоксил, алкілоксикарбоніл, амінокарбоніл, морфолініл та моно- або діалкіламінокарбоніл. Переважно, арил являє собою нафтил або феніл, кожний з яких необов'язково заміщений 1 або 2 галоїдними замісниками. В рамках даної заявки Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає N-феноксипіперидиніл, піроліл, піразоліл, імідазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл та піридазиніл або біциклічний гетероцикл, вибраний із групи, що включає хінолініл, хіноксалініл, індоліл, бензимідазоліл, бензоксазоліл, бензизоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл, бензотієніл, 2,3дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл, при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 замісниками, вибраними з групи, що включає галоген, гідрокси, алкіл або алкілокси. Переважно, Het являє собою тієніл або фураніл, або пиридил, найбільш переважно, Het являє собою фураніл. В рамках даної заявки галоген є замісником, вибраним із групи, що включає фтор, хлор, бром та йод, а галогеналкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, в якому один або більше атомів вуглецю заміщені одним або більше атомами галогену. Переважно, галоген являє собою бром, фтор або хлор та, переважно, галогеналкіл являє собою трифторметил. Як використовується в даній заявці, мається на увазі, що термін «сполуки формули (Іа) або (Іb)» включає також форми їх N-оксидів, їх солі, їх четвертинні аміни, їх та утомерні форми та їх стереохімічно ізомерні форми. Особливий інтерес представляють ті сполуки формули (Іа) або (Іb), що є стереохімічно чистими. 10 Цікавий варіант здійснення даного винаходу відноситься до тих сполук формули (Іа) або (Іb), їх фармацевтично прийнятних кислотно- або основно-адитивних солей, їх стереохімічно ізомерних форм, їх та утомерних форм та форм їх N-оксидів, де Ζ являє собою СН 2; R1 являє собою водень, галоген, галогеналкіл, ціано, гідрокси, Аr, Неt, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл; p означає ціле число, рівне 1, 2, 3 або 4; R2 являє собою водень, гідрокси, тіо, алкілокси, алкілоксіалкілокси, алкілтіо, моно або ді(алкіл)аміно або радикал формули де Υ являє собою СН2, О, S, ΝΗ або Nалкіл; 3 R являє собою алкіл, Аr, Аr-алкіл, Het або Hetалкіл; R4 являє собою водень, алкіл або бензил; R5 являє собою водень, галоген, галогеналкіл, гідрокси, Аr, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді(Аr)алкіл; або два сусідні радикали R5 можуть бути взяті разом з фенільним кільцем, до якого вони приєднані, утворюючи нафтил; r являє собою ціле число, рівне 1, 2, 3, 4 або 5; та R6 являє собою водень, алкіл, Аr або Het; R7 являє собою водень або алкіл; R8 являє собою оксо; або R7 та R8 разом утворюють радикал -CH=CHN=; алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вуглеводневим радикалом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю може бути необов'язково заміщений галогеном, гідрокси, алкілокси або оксо; Аr являє собою гомоцикл, вибраний із групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з групи, що включає гідрокси, галоген, ціано, нітро, аміно, моно- або діалкіламіно, алкіл, галогеналкіл, алкілокси, галогеналкілокси, карбоксил, алкілоксикарбоніл, амінокарбоніл, морфолініл та моно- або діалкіламінокарбоніл; Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає Nфеноксипіперидиніл, піроліл, піразоліл, імідазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл та піридазиніл; або біциклічний гетероцикл, вибраний із групи, що включає хінолініл, хіноксалініл, індоліл, бензимідазоліл, бензоксазоліл, бензизоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл, бензотієніл, 2,3-дигідробензо[1,4]діоксиніл або 11 85570 бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на атомі вуглецю 1, 2 або 3 замісниками, вибраними з групи, що включає галоген, гідрокси, алкіл або алкілокси; галоген являє собою замісник, вибраний із групи, що включає фтор, хлор, бром та йод, та галогеналкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, в якому один або більше атомів вуглецю заміщені одним або більше атомами галогену. Переважно, R5 являє собою водень, галоген, галогеналкіл, гідрокси, Аr, алкіл, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, Ar-алкіл або ді(Аr)алкіл. Переважно, винахід відноситься до сполук формули (Іа) або (Іb), де: R1 являє собою водень, галоген, ціано, Аr, Неt, алкіл та алкілокси; p означає ціле число, рівне 1, 2, 3 або 4; R2 являє собою водень, гідрокси, алкілокси, алкілоксіалкілокси, алкілтіо або радикал формули де Υ являє собою О; R3 являє собою алкіл, Аr, Аr-алкіл або Het; R4 являє собою водень, алкіл або бензил; R5 являє собою водень, галоген або алкіл; або два сусідні радикали R5 можуть бути взяті разом з фенільним кільцем, до якого вони приєднані, утворюючи нафтил; r означає ціле число, рівне 1; та R6 являє собою водень; R7 являє собою водень або алкіл; R8 являє собою оксо; або R7 та R8 разом утворюють радикал -CH=CHN=; алкіл являє собою лінійний або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, зв'язаний з лінійним або розгалуженим насиченим вуглеводневим радикалом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю може бути необов'язково заміщений галогеном або гідрокси; Аr являє собою гомоцикл, вибраний із групи, що включає феніл, нафтил, аценафтил, тетрагідронафтил, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з групи, що включає галоген, галогеналкіл, ціано, алкілокси та морфолініл; Het являє собою моноциклічний гетероцикл, вибраний із групи, що включає Nфеноксипіперидиніл, фураніл, тієніл, піридиніл, піримідиніл; або біциклічний гетероцикл, вибраний із групи, що включає бензотієніл, 2,3дигідробензо[1,4]діоксиніл або бензо[1,3]діоксоліл; при цьому кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений на 12 атомі вуглецю 1, 2 або 3 алкільними замісниками; та галоген являє собою замісник, вибраний із групи, що включає фтор, хлор та бром. Переважно, для сполук кожної з формул (Іа) або (Ib) R1 являє собою водень, галоген, Аr, Het, алкіл або алкілокси. Більш переважно, R1 являє собою галоген. Найбільш переважно, R1 являє собою бром. Переважно, p дорівнює 1. Переважно, R2 являє собою водень, алкілокси або алкілтіо. Більш переважно, R2 являє собою алкілокси. Найбільш переважно, R2 являє собою метилокси. Переважно, R3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений 1 або 2 замісниками, при цьому даний замісник переважно являє собою галоген або галогеналкіл, найбільш переважно, являє собою галоген. Більш переважно, R3 являє собою нафтил або феніл. Найбільш переважно, R3 являє собою нафтил. Переважно, R4 являє собою водень або алкіл, більш переважно, алкіл, такий, як метил або етил. Найбільш переважно, R4 являє собою метил. Переважно, R5 являє собою водень, алкіл або галоген. Найбільш переважно, R5 являє собою водень. Переважно, r дорівнює 1 або 2. Переважно, R6 являє собою водень або метил. Найбільш переважно, R6 являє собою водень. Переважно, Ζ являє собою СН2. Переважно, Ζ являє собою С(=О). Для сполук тільки формули (Ib) R7 являє собою алкіл, переважно, метил, a R8 являє собою кисень. Цікавою групою сполук є сполуки формули (Іа), їх фармацевтично прийнятні кислотно- або основно-адитивні солі, їх четвертинні аміни, їх стереохімічно ізомерні форми, їх та утомерні форми та форми їх N-оксидів. Цікавою групою сполук є такі сполуки формули (Іа), їх фармацевтично прийнятні кислотно- або основно-адитивні солі, їх четвертинні аміни, їх стереохімічно ізомерні форми, їх та утомерні форми та форми їх N-оксидів, де R1 являє собою водень, галоген, Аr, Неt, алкіл або алкілокси; ρ дорівнює 1; R2 являє собою водень, алкілокси або алкілтіо; R3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений 1 або 2 замісниками, вибраними з групи, що включає галоген та галогеналкіл; R4 являє собою водень або алкіл; R5 являє собою водень, алкіл або галоген; r дорівнює 1, a R 6 являє собою водень. Цікавою групою сполук є такі сполуки формули (Іа), де R1 являє собою водень, галоген, наприклад, бром; алкіл, наприклад, метил; або Het, наприклад, фураніл; R2 являє собою алкілокси, наприклад, метилокси; R 3 являє собою нафтил, феніл або Het, кожний з яких необов'язково заміщений галогеном, наприклад, феніл, необов'язково заміщений галогеном, нафтил або фураніл; R4 являє собою алкіл, наприклад, метил або етил; R5 являє собою водень або галоген, наприклад, хлор; R6 являє собою водень; a Z являє собою СН2 або С(=О). 13 85570 Як визначено, фармацевтично прийнятні солі кислотно-адитивні солі включають терапевтично активні нетоксичні кислотно-адитивні солі, що здатні утворювати сполуки формули або (Іа) або (Іb). Зазначені кислотно-адитивні солі можна одержати обробкою основної форми сполук кожної з формул (Іа) або (Іb) відповідними кислотами, наприклад, неорганічним кислотами, наприклад, галогенводневими кислотами, зокрема, хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, азотною кислотою та фосфорною кислотою; органічними кислотами, наприклад, оцтовою кислотою, гідроксіоцтовою кислотою, пропановою кислотою, молочною кислотою, піровиноградною кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, малеїновою кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, п-толуолсуль фоновою кислотою, цикламовою кислотою, саліциловою кислотою, паміносаліциловою кислотою та памовою кислотою. Сполуки формули або (Іа), або (Іb), що містять кислі протони, можна також перевести у форми їх терапевтично активних нетоксичних основноадитивних солей при обробці відповідними органічними та неорганічними основами. Відповідні основні сольові форми включають, наприклад, амонієві солі, солі лужних та лужноземельних металів, зокрема, солі літію, натрію, калію, магнію та кальцію, солі органічних основ, наприклад, солі бензатину, N-метил-D-глюкаміну, гібраміну, та солі амінокислот, наприклад, аргініну та лізину. Навпаки, зазначені форми кислотно- або основно-адитивних солей можна перевести у вільні форми обробкою відповідною основою або кислотою. Як використовується в рамках даної заявки, термін „адитивна сіль" включає також сольвати, що здатні утворювати сполуки кожної з формул (Іа) або (Іb), а також їх солі. Подібними сольватами є, наприклад, гідрати та алкілоголяти. Використаний раніше термін «четвертинний амін» визначає четвертинні аміни, що здатні утворювати сполуки формули (Іа) або (Іb) при реакції основного атома азоту сполуки формули (Іа) або (Іb) з відповідним кватернізуючим агентом, наприклад, необов'язково заміщеним алкілгалогенідом, арилгалогенідом або арилалкілгалогенідом, наприклад, метилйодидом або бензилйодидом. Можна використовувати інші реагенти з групами, що легко відходять, такі, як алкілтрифторметансульфонати, алкілметансульфонати та алкіл птолуосульфонати. Четвертинний амін має позитивно заряджений атом азоту. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифторацетат та ацетат. Вибраний протиіон можна ввести за допомогою іонообмінних смол. Термін «стереохімічно ізомерні форми», який використовується в даній заявці, визначає всі можливі ізомерні форми, які можуть мати сполуки формули або (Іа), або (Іb). Якщо не згадано або не зазначено інше, хімічне позначення сполук включає суміш всі х можливих стереохімічно ізомерних 14 форм, при цьому зазначені суміші містять всі діастереомери та енантіомери основної молекулярної структури. Більш конкретно, стереогенні центри можуть мати R- або S-конфігурацію; замісники двовалентних циклічних (частково) насичених радикалів можуть мати або цис-, або трансконфігурацію. Зрозуміло, що стереохімічно ізомерні форми сполук формули або (Іа), або (Іb) включені в межі даного винаходу. Відповідно до правил CAS-номенклатури, якщо в молекулі існує два стереогенних центри відомої абсолютної конфігурації, дескриптор R або S (на підставі правила послідовності КанаІнгольда-Прелога) приписують нижчому хіральному центру, центр у відліку. Конфігурацію другого стереогенного центра вказують з використанням відносних дескрипторів [R*,R*] або [R*,S*], де R* завжди визначають як центр відліку, a [R*,R*] позначає центри з однакової хіральністю та [R*,S*] позначає центри з різною хіральністю. Наприклад, якщо нижчий хіральний центр у молекулі має S конфігурацію, а другий центр є R, стереодескриптор буде позначений як S-[R*,S*]. При використанні «а» та «β»: положення найстаршого замісника при асиметричному атомі вуглецю в циклічній системі з найнижчим номером циклу умовно завжди знаходиться в «а» положенні середньої площини, визначеною циклічною системою. Положення при іншому асиметричному атомі вуглецю в циклічній системі щодо положення найстаршого замісника при базовому атомі позначають «а», якщо він знаходиться з того ж боку середньої площини, визначеною циклічною системою або «β», якщо він знаходиться з іншого боку від середньої площини, визначеною циклічною системою. Сполуки формули або (Іа), або (Іb) та деякі проміжні сполуки без виключень мають, щонайменше, два стереогенні центри в своїй стр уктурі, що може приводити, щонайменше, до 4 стереохімічно різних стр уктур. Сполуки формули або (Іа), або (Іb), одержані за допомогою описаних нижче способів, можна синтезувати у вигляді рацемічних сумішей енантіомерів, які можна відокремити друг від др уга за допомогою відомих в даній галузі методів розділення. Рацемічні сполуки формули або (Іа), або (Іb), можна перевести у відповідну діастереомерну сіль реакцією з прийнятною хіральною кислотою. Зазначені форми діастереомерних солей можна потім розділити, наприклад, селективною або фракційною кристалізацією та виділити з них енантіомери при дії лугом. Інший спосіб розділення енантіомерних форм сполук формули або (Іа), або (Іb) включає рідинну хроматографію на хіральній нерухомій фазі. Зазначені чисті стереохімічно ізомерні форми можна також одержати з відповідних чистих стереохімічно ізомерних форм відповідних вихідних речовин, за умови, що реакція відбувається стереоспецифічно. Переважно, якщо бажаним є визначений стереоізомер, зазначену сполуку синтезують стереоспецифічними способами одержання. У подібних способах переважно будуть використовува тися енантіомерно чисті вихідні речовини. 15 85570 Мається на увазі, що таутомерні форми сполук формули або (Іа), або (Іb), включають такі сполуки формули або (Іа), або (Іb), в яких, наприклад, єнольна група перетворюється на кето-групу (кетоєнольна таутомерія). Мається на увазі, що форми N-оксидів сполук формули або (Іа), або (Іb) включають такі сполуки формули або (Іа), або (Іb), в яких один або кілька атомів азоту окиснені до так названого N-оксиду, зокрема, такі N-оксиди, в яких атом азоту амінного радикала окиснений. Винахід також включає похідні сполук (названі звичайно «проліками») фармакологічно активних сполук відповідно до винаходу, що розкладаються in vivo, утворюючи сполуки відповідно до винаходу. Проліки звичайно (але не завжди) менш ефективні відносно цільового рецептора, ніж сполуки, до яких вони розкладаються. Зокрема, проліки застосовують в тих випадках, коли необхідна сполука має хімічні або фізичні властивості, що роблять її введення складним або неефективним. Наприклад, необхідна сполука може бути вкрай малорозчинною, вона може погано переноситися через епітелій слизової оболонки або вона може мати небажано короткий період напівперетворення в плазмі. Подальше обговорення з приводу проліків можна знайти в [Stella, V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112176, та Drugs, 1985, 29, pp. 455-473]. Форми проліків фармакологічно активних сполук відповідно до даного винаходу, як правило, будуть являти собою сполуки формули або (Іа), або (Іb), їх фармацевтично прийнятні кислотноабо основно адитивні солі, їх стерохімічно ізомерні форми, їх та утомерні форми та форми їх Nоксидів, що містять кислотну груп у, яку піддають етерифікації або амідуванню. В число подібних етерифікованих кислотних груп входять групи формули -COOR x, де Rx являє собою С1-6 алкіл, феніл, бензил або одну з наступних гр уп: Амідовані групи включають групи формули CONRyRz, де Ry являє собою Н, С1-6 алкіл, феніл або бензил, a Rz являє собою -ОН, Н, С1-6 алкіл, феніл або бензил. Зі сполук відповідно до даного винаходу, що містять аміногрупу, можна одержати похідні дією кетону або альдегіду, такого, як формальдегід, з утворенням основи Маніха. Ця основа буде гідролізуватися у водному розчині по кінетиці першого порядку. Зненацька, було виявлено, що сполуки відповідно до даного винаходу підходять для лікування мікобактеріальних захворювань, зокрема, мікобактеріальних захворювань, викликаних патогенними мікобактеріями, включаючи лікарсько стійкі та стійкі до дії численних лікарських засобів, такими, як Mycobacterium tuberculosis, Μ, bovis, M. a vium, Μ. smegmatis та М. mаrіnum. Таким чином, даний винахід відноситься також до сполук формули або 16 (Іа), або (Іb), їх фармацевтично прийнятних кислотно- або основно-адитивних солей, їх стерохімічно ізомерних форм, їх таутомерних форм та форм їх N-оксидів, для використання як лікарського засобу. Крім того, винахід відноситься до композиції, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки відповідно до даного винаходу. Зі сполук відповідно до даного винаходу можуть бути отримані різні фармацевтичні препаративні форми з метою введення. Як підходящі композиції можна привести всі композиції, що звичайно використовуються для лікарських препаратів, що вводяться системно. Для одержання фармацевтичних композицій за даним винаходом ефективну кількість конкретної сполуки, необов'язково у формі адитивної солі, як активний інгредієнт, ретельно змішують з фармацевтично прийнятним носієм, при цьому носій може приймати самі різні форми в залежності від форми препарату, бажаного для введення. Подібні фармацевтичні композиції бажані у вигляді дозованої лікарської форми, що підходить, зокрема, для перорального введення або у вигляді парентеральної ін'єкції. Наприклад, при одержанні композиції у вигляді пероральної дозованої форми, можна використовувати будь-які звичайні фармацевтичні середовища, наприклад, такі як вода, гліколі, олії, спирти і так далі у випадку пероральних рідких препаратів, таких, як суспензії, сиропи, еліксири, емульсії та розчини або тверді носії, такі, як крохмалі, цукри, каолін, розріджувачі, змазуючі речовини, зв'язуючі речовини, розпушуючі агенти і так далі, у випадку порошків, пігулок, капсул та таблеток. Завдяки простоті введення, таблетки та капсули являють собою найбільш переважні пероральні разові лікарські форми, в яких звичайно використовують тверді фармацевтичні носії. Для парентеральних композицій носій звичайно включає стерильну воду, принаймні, здебільшого, хоча в нього можуть входити інші інгредієнти, наприклад, для поліпшення розчинності. Наприклад, можна приготувати розчини для ін'єкцій, в яких носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Крім того, можна приготувати розчини для ін'єкцій, в яких можна використовува ти підходящі рідкі носії, суспендуючі агенти і так далі. Мають на увазі, що також включені тверді препарати, призначені для перетворення в рідкі препарати незадовго до використання. В залежності від способу введення фармацевтична композиція переважно буде містити від 0,05 до 99мас. %, більш переважно, від 0,1 до 70мас. % активного інгредієнта формули (Іа) або (Іb) та від 1 до 99,95мас. %, більш переважно, від 30 до 99,9мас. % фармацевтично прийнятного носія, при цьому всі процентні співвідношення надані з розрахунку на загальну композицію. Крім того, фармацевтична композиція може містити різні інші інгредієнти, відомі в даній галузі техніки, наприклад, змазуючий засіб, стабілізуючий агент, буферизуючий агент, емульгатор, регулятор в'язкості, поверхнево-активну речовину, консервант, ароматизатор або барвник. 17 85570 Особливо переважно одержувати препарати із згаданих вище фармацевтичних композицій у вигляді одиничних лікарських форм для простоти введення та рівномірності дозування. Як використовується в даній заявці, одинична лікарська форма відноситься до фізично дискретних одиниць, придатних для одиничних доз, при цьому кожна одиниця містить заздалегідь визначену кількість активного інгредієнта, розраховану таким чином, щоб одержати необхідний терапевтичний ефект, у сполученні з бажаним фармацевтичним носієм. Прикладами подібних одиничних лікарських форм є таблетки (включаючи таблетки з насічкою або з покриттям), капсули, пігулки, пакетики з порошком, пластинки, супозиторії, розчини для ін'єкцій або суспензії і так далі, та їх окремі різновиди. Поза сумнівом, денна доза сполуки відповідно до винаходу буде змінюватися в залежності від сполуки, що використовується, способу введення, необхідного лікування та зазначеного мікобактеріального захворювання. Проте, загалом, задовільні результати будуть отримані в тому випадку, коли сполуку відповідно до винаходу вводять у вигляді денної дози, що не перевищує 1 грам, наприклад, в інтервалі від 10 до 50мг/кг маси тіла. Крім того, даний винахід відноситься до застосування сполуки формули або (Іа), або (Іb), її фармацевтично прийнятної кислотно- або основноадитивної солі, її стерохімічно ізомерних форм, її таутомерних форм та форм її N-оксидів, а також кожної із згаданих вище фармацевтичних композицій для одержання лікарського засобу з метою попередження або лікування мікобактеріальних захворювань. Відповідно, в іншому аспекті, винахід пропонує спосіб лікування пацієнта, що страждає або піддається ризику виникнення мікобактеріального захворювання, що включає введення даному пацієнту фармацевтичної композиції відповідно до винаходу. Сполуки за даним винаходом можуть також бути з'єднані з одним або більше антимікобактеріальними агентами. Отже, даний винахід відноситься також до комбінації (а) сполуки формули (Іа) або (Іb) та (b) одного або більше антимікобактеріальних агентів. Даний винахід відноситься також до комбінації (а) сполуки формули (Іа) або (Іb) та (b) одного або більше антимікобактеріальних агентів для застосування як лікарського засобу. Даний винахід також включає фармацевтичну композицію, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість (а) сполуки формули (Іа) або (Іb) та (b) один або більше антимікобактеріальних агентів. Інші мікобактеріальні агенти, які можна поєднувати із сполуками формули (Іа) або (Іb), являють собою, наприклад, рифампіцин (=рифампін), ізоніазид, піразинамід, амікацин, етіонамід, моксифлоксацин, етамбутол, стрептоміцин, парааміносаліцилову кислоту, циклосерин, капреоміцин, канаміцин, тіоацетазон, РА-824, хінолони/фторхінолони, наприклад, такі як офлоксацин, ципрофлоксацин, спарфлоксацин, макроліди, на 18 приклад, такі як кларитроміцин, клофазимін, амоксицилін із клавулановою кислотою, рифаміцини, рифабутин, ри фапентин. Переважно, дані сполуки формули (Іа) або (Іb) поєднують з рифапентином та моксифлоксацином. Загальні способи одержання В цілому, сполуки відповідно до даного винаходу можуть бути отримані в результаті послідовності стадій, кожна з яких відома фахівцю в даній галузі техніки. Сполуки формули (Іа) та (Іb), в яких Ζ являє собою СН 2, що представлені формулою (Іа-1) та (Іb-1), можна одержати, вводячи у взаємодію проміжну сполуку формули (ll-а) та (ΙΙ-b) з параформом в підходящому розчиннику, наприклад, такому як толуол. Сполуки формули (Іа) та (Іb), в яких Ζ являє собою С(=О), що представлені формулою (Іа-2) та (Іb-2), можна одержати, вводячи у взаємодію проміжну сполуку формули (lll-а) та (Іll-b), де W1 є підходящою гр упою, що відходить, наприклад, такою, як імідазол, алкілокси-групи, наприклад, метилокси, з підходящою основою, наприклад, такою як гідрид натрію, тритіобутилат калію, в підходящому розчиннику, наприклад, такому як тетрагідрофуран, діетиловий ефір, діоксан. В наведених вище реакціях отриману сполуку формули (Іа) або (Іb) можна виділити та, при необхідності, очистити за допомогою загальновідомих у даній галузі методів, наприклад, таких як екстракція, кристалізація, перегонка, розтирання в порошок та хроматографія. В тому випадку, якщо сполука формули (Іа) або (Іb) кристалізується, її можна виділити фільтруванням. В іншому випадку, кристалізацію можна викликати додаванням відповідного розчинника, наприклад, такого як вода, ацетонітрил, будь-який спирт, наприклад, такий як метанол, етанол, та комбінацію зазначених роз 19 85570 чинників. Альтернативно, реакційну суміш можна також випарити насухо, а потім залишок очистити хроматографією (наприклад, ВЕРХ з оберненою фазою, флеш-хроматографією і так далі). Реакційну суміш також можна очистити хроматографією без попереднього випарювання розчинника. Сполуку формули (Іа) або (Іb) можна виділити також випарюванням розчинника з наступною перекристалізацією з відповідного розчинника, наприклад, такого як вода, ацетонітрил, будь-який спирт, наприклад, такий як метанол, та комбінація зазначених розчинників. Фахівець у даній галузі техніки зрозуміє, який спосіб варто вибрати, який розчинник найбільше підійде для використання або ж пошук найбільш підходящого способу виділення відноситься до звичайної експериментальної роботи. Крім того, сполуки формули (Іа) або (Іb) можна одержати, перетворюючи сполуки формули (Іа) або (Іb) одна в одну відповідно до відомих в даній галузі реакцій перетворення груп. Сполуки формули (Іа) або (Іb) можна перевести у форму відповідних N-оксидів за допомогою відомих у даній галузі техніки методик перетворення тривалентного атома азоту у форму його Nоксиду. Загалом, зазначену реакцію N-окиснення можна здійснити при взаємодії вихідної сполуки формули (Іа) або (Іb) з відповідним органічним або неорганічним пероксидом. Відповідні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних або лужноземельних металів, наприклад, пероксид натрію, пероксид калію; відповідні органічні пероксиди можуть включати пероксикислоти, наприклад, такі як надбензойна кислота або галогензаміщена надбензойна кислота, наприклад, 3-хлорнадбензойна кислота, пероксоалканові кислоти, наприклад, пероксооцтова кислота, алкілгідропероксиди, наприклад, гідропероксид третбутилу. Підходящими розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол і так далі, вуглеводні, наприклад, толуол, кетони, наприклад, 2-бутанон, галогензаміщені вуглеводні, наприклад, дихлорметан, та суміші подібних розчинників. Сполуки формули (Іа) або (Іb), в яких R 4 являє собою алкіл, можна перевести в підходящий четвертинний амін реакцією з підходящим кватернізуючим агентом, наприклад, таким, як необов'язково заміщений алкілгалогенід, наприклад, ІСН3, в присутності підходящого розчинника, наприклад, ацетону. Деякі сполуки формули (І) та деякі проміжні сполуки за даним винаходу можуть складатися із суміші стереохімічно ізомерних форм. Чисті стереохімічно ізомерні форми зазначених сполук та зазначених проміжних сполук можна одержати при використанні відомих у даній галузі методів. Наприклад, діастереоізомери можна розділити фізичними методами, такими, як фракційна кристалізація або хроматографічними методами, наприклад, протиточним розподілом, рідинною хроматографією та подібними методами. Енантіомери можна виділити з рацемічних сумішей, перевівши спочатку зазначені рацемічні суміші в суміші діастереомерних солей або сполук, за допомогою 20 підходящих розділяючих агентів, наприклад, таких, як хіральні кислоти, потім фізично розділяючи зазначені суміші діастереомерних солей або сполук, наприклад, за допомогою фракційної кристалізації або хроматографічних методів, наприклад, рідинною хроматографією та подібними методами та, нарешті, переводячи зазначені розділені діастереомерні солі або сполуки у відповідні енантіомери. Чисті стереохімічно ізомерні форм можна також одержати з чистих стереохімічно ізомерних форм відповідних проміжних сполук та вихідних речовин, за умови, що проміжні реакції відбуваються стереоспецифічно. Альтернативний спосіб розділення енантіомерних форм сполук формули (І) та проміжних сполук включає рідинну хроматографію, зокрема, рідинну хроматографію з використанням хіральної нерухомої фази. Необхідно розуміти, що в приведених вище або наступних одержаннях, продукти реакції можуть бути виділені з реакційного середовища та, при необхідності, очищені далі за допомогою загальновідомих у даній галузі те хніки методів, наприклад, таких, як екстракція, кристалізація, перегонка, розтирання в порошок та хроматографія. Деякі проміжні сполуки та вихідні речовини є відомими сполуками та можуть бути комерційно доступними або можуть бути отримані за допомогою відомих у даній галузі методик. Проміжні сполуки формули (ll-а) та (ΙΙ-b) можна одержати, вводячи у взаємодію проміжну сполуку формули (IV-a) та (IV-b) з підходящим агентом для зняття захисту, наприклад, таким, як 1хлоретилхлорформіат, у підходящому розчиннику, наприклад, такому, як 1,2-дихлоретан та підходящим спиртом, наприклад, таким, як метанол і так далі. Проміжні сполуки формули (ll-а) або (ΙΙ-b) можна також одержати, вводячи у взаємодію проміжну сполуку формули (IV-a) або (IV-b) з форміатом амонію в присутності паладію на вугіллі та в присутності підходящого розчинника, наприклад, такого як спирт, наприклад, метанол. Проміжні сполуки формули (IV-a) або (IV-b), в яких R1 є галогеном, можуть втрачати зазначений галоїдний замісник при перетворенні їх у проміжні сполуки формули (ll-а) або (ІІ-b). Проміжні сполуки формули (IV-a) або (IV-b) можна одержати, вводячи у взаємодію проміжну сполуку (V-a) та (V-b) із проміжною сполукою формули (VI) в присутності підходящого відновника, наприклад, такого як n-BuLi, в присутності підхо 21 85570 дящої основи, наприклад, такої як Ν,Νдіізопропіламін, та в присутності підходящого розчинника, наприклад, такого як тетрагідрофуран. Проміжні сполуки формули (IV-a) або (IV-b), в яких R1 є Неt, а р дорівнює 1, при цьому зазначені проміжні сполуки представлені формулою (IV-a-Ι) або (IV-b-1), можна одержати, вводячи у взаємодію проміжну сполуку (IV-a) або (IV-b), в якій R1 є галогеном, при цьому зазначені проміжні сполуки представлені формулою (IV-a-2) або (IV-b-2), із проміжною сполукою формули (VII) в присутності підходящого каталізатора, наприклад, такого як Pd(PPh3)4, підходящої основи, наприклад, такої як К2СО3, та підходящого розчинника, наприклад, такого як діетиловий ефір, та підходящого спирту, наприклад, такого як метанол і так далі. Проміжні сполуки формули (lll-а) або (Іll-b) можна одержати, вводячи у взаємодію проміжну сполуку формули (ll-а) або (ΙΙ-b) із проміжною сполукою формули (VIII), в якій W1-(C=O) являє собою груп у, яку потрібно ввести, a R являє собою залишок проміжної сполуки, наприклад, такої як 1,1¢карбонілбіс-1Н-імідазол, метилхлорформіат або етилхлорформіат, у присутності підходящого розчинника, наприклад, такого як тетрагідрофуран. 22 Проміжні сполуки формули (V-a) або (V-b) являють собою сполуки, що або комерційно доступні, або їх можна одержати за допомогою звичайних методик, загальновідомих у даній галузі те хніки. Наприклад, проміжні сполуки формули (V-a-1) можна одержати за наступною схемою реакції (1): в якій всі перемінні визначені, як для формули (Іа) та (Іb). С хема реакції (1) включає стадію (а), в якій відповідним чином заміщений анілін вводять у взаємодію з відповідним ацилхлоридом, таким, як 3-фенілпропіонілхлорид, 3фторбензолпропіонілхлорид або пхлорбензолпропіонілхлорид, в присутності підходящої основи, такої, як триетиламін, та підходящого нереакційноздатного розчинника, такого, як метилен хлорид або етилен дихлорид. Дану реакцію зручно проводити при температурі в інтервалі від кімнатної температури до температури кипіння зі зворотним холодильником. На наступній стадії (b) адукт, отриманий на стадії (а), вводять у взаємодію з фосфорил хлоридом (РОСl3) в присутності підходящого розчинника, наприклад, такого, як Ν,Ν-диметилформамід (формілювання Вільсмайєра-Хаака з наступною циклізацією). Дану реакцію зручно проводити при температурі в інтервалі від кімнатної температури до температури кипіння зі зворотним холодильником. На наступній стадії (с) вводять визначену R2-групу, де R2 являє собою алкілокси або алкілтіо-радикал, вводячи у взаємодію проміжну сполуку, отриману на стадії (b), та сполуку -X-Alk, в якій X = S або О, а Alk являє собою алкільную групу, визначену у формулі (Іа) та (Іb), наприклад, таку як метанолат натрію, в присутності підходящого розчинника, наприклад, такого як спирт, наприклад, метанол. Проміжні сполуки формули (V-a-2) можна одержати за наступною схемою реакції (2), в якій на першій стадії (а) заміщений індол-2,3-діон вводять у взаємодію з заміщеним 3-фенілпропіоновим альдегідом в присутності підходящої основи, такої, як гідроксид натрію (реакція Пфітцингера), після чого сполуку карбонової кислоти на наступній стадії (b) декарбоксилюють при високій температурі в присутності підходящого нереакційноздатного розчинника, такого, як дифеніловий ефір. 23 85570 24 ція рентгенівських променів. Спосіб виділення докладно описаний нижче. Для деяких проміжних сполук та деяких кінцевих сполук стереохімічні конфігурації зазначені в структурах. Дані конфігурації є відносними конфігураціями, що вказують, що розглянуті гр упи розташовані в одній і тій же або в протилежних площинах Очевидно, що в згаданих ви ще та в наступних реакціях продукти реакції можна виділити з реакційного середовища та, при необхідності, очистити далі відповідно до методів, загальновідомих в даній галузі, наприклад, такими як екстракція, кристалізація та хроматографія. Крім того, мабуть, що продукти реакції, що існ ують більш ніж в одній енантіомерній формі, можна виділити з їх суміші відомими методами, зокрема, препаративною хроматографією, такою, як ВЕРХ. Як правило, сполуки формули (Іа) та (Іb) можна розділити на їх ізомерні форми. Проміжні сполуки формули (VI) являють собою сполуки, що або комерційно доступні, або їх можна одержати за допомогою звичайних методик, загальновідомих в даній галузі. Наприклад, проміжні сполуки формули (VI) можна одержати за наступною схемою реакції (3): Схема реакції (3) включає стадію (а), на якій R3, наприклад, відповідним чином заміщений феніл, нафтил або Het, вводять у взаємодію за реакцією Фріделя-Крафтса з відповідним ацилхлоридом, таким, як 3-хлорпропіонілхлорид або 4хлорбутирилхлорид, в присутності підходящої кислоти Льюїса, такої, як АlСl3, FeCl3, SnCI4, ТiСІ4 або ZnCI2 та, необов'язково, в підходящому нереакційноздатному розчиннику, такому, як метилен хлорид або етилен дихлорид. Реакцію зручно проводити при температурі в інтервалі від кімнатної температури до температури кипіння зі зворотним холодильником. На наступній стадії (b) вводять аміногрупу (-NR4(CH2-C6H5)) при взаємодії проміжної сполуки, отриманої на стадії (а), з первинним або вторинним аміном в присутності підходящого розчинника, наприклад, такого, як ацетонітрил, та, необов'язково, підходящої основи, наприклад, такої, як К2СО3. Наступні приклади ілюструють винахід, не обмежуючи його при цьому. Експериментальна частина Для деяких сполук абсолютну конфігурацію стереогенного атома(атомів) вуглецю експериментально не визначали. В цих випадках стереохімічно ізомерну форму, виділену першої, позначали «А», а другу «В», незалежно від дійсної стереохімічної конфігурації. Однак фахівець у даній галузі може однозначно охарактеризувати зазначені ізомерні форми «А» та «В» за допомогою відомих у даній галузі методів, наприклад, таких, як дифрак молекули *R означає, що хіральний центр має абсолютну конфігурацію R або S. *S означає, що хіральний центр має абсолютну конфігурацію R або S. Експериментальна частина Надалі, термін «т.пл.» («М.Р.») означає температуру плавлення, «ТГФ» означає тетрагідрофуран, "EtOAc" означає етилацетат, «МеОН» означає метанол, «DME» означає диметиловий ефір, "DIPE" означає діізопропіловий ефір, «ДМФА» означає Ν,Ν-диметилформамід, "Et3N" означає триетиламін, "Pd(PPh3)4" означає тетракіс(трифенілфосфин)паладій, "CDI" означає 1,1¢карбонілбіс-1H-імідазол. А. Одержання проміжних сполук Приклад А1 Одержання проміжної сполуки 1 До розчину 4-бромбензоламіну (0,407моль) в Εt3Ν (70мол) та СН 2СІ2 (700мл) додавали по краплям бензолпропаноїлхлорид (0,488моль) при кімнатній температурі та перемішували суміш при кімнатній температурі протягом ночі. Суміш виливали у воду та концентрований ΝΗ 4ΟΗ та екстрагували СН 2Сl2. Органічний шар сушили (MgSO4), фільтрували та випарювали розчинник. Залишок кристалізували з діетилового ефіру. Залишок (119,67г) розчиняли в СН 2Сl2 та промивали НСl IN. Органічний шар сушили (MgSO4), фільтрували та випарювали розчинник. Вихід: 107,67г проміжної сполуки 1. Приклад А2 Одержання проміжної сполуки 2 Реакцію проводили двічі. До ДМФА (0,525моль) по краплям додавали РОСl3 (1,225моль) при 10°С. Потім при кімнатній температурі додавали проміжну сполуку 1 (0,175моль). Суміш перемішували протягом ночі при 80°С, виливали на лід та екстрагували СН 2Сl2. Органічний шар сушили (MgSO 4), фільтрували та випарювали розчинник, одержуючи 77,62г (67%) проміжної сполуки 2. Продукт використовували без додаткового очищення. Приклад A3 Одержання проміжної сполуки 3 25 85570 26 гували СН 2Сl2 та водою. Ви хід: 40г проміжної сполуки 6 (75%). Приклад А5 a) Одержання проміжної сполуки 7 Суміш проміжної сполуки 2 (0,233моль) в CH3ONa (30%) в МеОН (222,32мл) та МеОН (776мл) перемішували та кип'ятили зі зворотним холодильником протягом ночі, потім виливали на лід та екстрагували СН 2Сl2. Органічний шар відокремлювали, сушили (MgSO4), фільтр ували та випарювали розчинник. Залишок очищали за допомогою колоночної хроматографії на силікагелі (елюент: СН2СІ2/циклогексан 20/80, а потім 100/0, 20 - 45мкм). Чисті фракції збирали та випарювали розчинник. Вихід: 25г (33%) проміжної сполуки 3 (т.пл.: 84°С). Приклад А4 a) Одержання проміжних сполук 4 та 5 Суміш хлориду алюмінію (34,3г, 0,257моль) та 3-хлорпропаноїлхлориду (29,7г, 0,234 моль) в 1,2дихлоретані (150мл) перемішували при 0°С. Додавали розчин нафталіну (30г, 0,234моль) в 1,2дихлоретані (50мл). Суміш перемішували при 5°С протягом 2 годин та виливали в крижану воду. Органічний шар відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Залишок (56г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/СН2Сl2: 60/40, 20 - 45 мкм). Збирали дві фракції та випарювали розчинник, одержуючи проміжну сполуку 4 (31г, 61%) у вигляді масла. Другу фракцію (14г) розчиняли в DIPE, одержуючи проміжну сполуку 5 (8,2г, 16%, т.пл.: 68°С) у вигляді блідо-жовтої твердої речовини. За попередньою методикою одержували наступну проміжну сполуку: Суміш проміжної сполуки 4 (3г, 0,0137моль), N-бензиламіну (2мл, 0,0150моль) в ацетонітрилі (100мл) перемішували при 80°С протягом 2 годин. Додавали воду кімнатної температури. Суміш екстрагували СН2СІ2. Органічний шар відокремлювали та сушили (MgSO4), фільтрували та випарювали розчинник. Залишок (6г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/МеOН: 97/3, 20 - 45 мкм), одержуючи масло. Вихід: 4,2г проміжної сполуки 7. За попередньою методикою одержували наступну проміжну сполуку: b) Одержання проміжної сполуки 8 Суміш проміжної сполуки 6 (0,015моль), Nетилбензолметанаміну (0,016моль) та К2СО3 (0,016моль) в ацетонітрилі (30мл) перемішували при 70°С протягом 2 годин, виливали у воду та екстрагували СН 2Сl2. Органічний шар відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Вихід: 4г проміжної сполуки 8 (88%). Приклад А6 а) Одержання проміжної сполуки 9 b) Одержання проміжної сполуки 6 До 1,3-дифторбензолу (0,26моль) обережно додавали хлорид алюмінію (0,3моль) та нагрівали при інтенсивному перемішуванні до 50°С. Протягом 15 хвилин додавали по краплям 3пропаноїлхлорид (0,26моль) при 40°С (охолодження льодом) та перемішували суміш при 50°С. Суміш виливали у воду (250мл), лід (250г) та НСl (25мл) та перемішували протягом 20 хвилин. Осад, що утворився, відфільтровували та екстра До розчину діізопропіламіну (0,0075моль) в ТГФ (50мл) додавали н-бутиллітій (0,0075моль) при -20°С. Суміш охолоджували до -70°С. Додавали проміжну сполуку 3 (0,0062моль). Суміш перемішували при -70°С протягом 1 години та 30 хвилин. Додавали проміжну сполуку 7 (0,0075моль). Суміш перемішували протягом 1 години та 30 хвилин. Додавали воду. Суміш екстрагували СН 2Сl2. Органічний шар відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Залишок (3г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс: 90/10, 15-40мкм). Збирали чисті фракції та випа 27 85570 рювали розчинник. Вихід: 1,5г суміші двох діастереоізомерів (38%), тобто проміжної сполуки 9. За попередньою методикою одержували наступну проміжну сполуку: До розчину діізопропіламіну (0,0075моль) в ТГФ (50мл) додавали н-бутиллітій (0,0075моль) при -20°С. Суміш охолоджували до -70°С. Додавали проміжну сполуку 3 (0,0061моль). Суміш перемішували при -70°С протягом 1 години та 30 хвилин. Додавали 4-[метил(фенілметил)аміно]-1феніл-1-бутанон (0,0073моль). Суміш перемішували протягом 1 години та 30 хвилин. Додавали воду. С уміш екстрагували СН 2СІ2. Органічний шар відокремлювали, сушили (MgSO 4), фільтрували та випарювали розчинник. Залишок (4,9г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: 100% СН2Сl2; 15-40мкм). Збирали чисті фракції та випарювали розчинник, одержуючи 1,43г проміжної сполуки 10 (40%, суміш діастереоізомерів: 60/40). За попередньою методикою одержували наступні проміжні сполуки: 28 29 85570 До розчину діізопропіламіну (0,0075моль) в ТГФ (50мл) додавали н-бутиллітій (0,0075моль) при -20°С. Суміш охолоджували до -70°С. Додавали проміжну сполуку 3 (0,00824моль). Суміш перемішували при -70°С протягом 1 години та 30 хвилин. Додавали проміжну сполуку 8 (0,0099моль). Суміш перемішували протягом 1 години та 30 хвилин. Додавали воду. Суміш екстрагували СН2Сl2. Органічний шар відокремлювали, сушили (MgSO 4), фільтрували та випарювали розчинник. Залишок (5,4г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/циклогексан 60/40; 15-40мкм). Збирали дві фракції та випарювали розчинник. Вихід: 0,95г проміжної сполуки 11 у вигляді діастереоізомера А (15%, т.пл.: 171°С) та 0,83г проміжної сполуки 12 у вигляді діастереоізомера В (13%, МН+: 631). Приклад А7 Одержання проміжної сполуки 17 Проміжну сполуку 9 (1,58ммол), 2фуранборонову кислоту (2,69ммоль), Pd(PPh3)4 (0,158ммоль), DME (30мл), МеОН (10мл) та К2СО3 (1,6мл) нагрівали при мікрохвильовому опроміненні (300 Вт, 68°С) протягом 10 хвилин. Суміш охолоджували, виливали у воду та екстрагували EtOAc. Органічний шар відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Залишок (1,4г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕЮАс 90/10; 15-40мкм). Збирали чисті фракції та випарювали розчинник. Вихід: 0,47г проміжної сполуки 17 у вигляді суміші діастереоізомерів (60/40) (41%). Приклад А8 а-1) Одержання проміжних сполук 13 та 14 До суміші проміжної сполуки 9 (0,0023моль) в 1,2-дихлоретані 30мл) додавали при кімнатній температурі 1-лоретилхлорформіат (15мл). Суміш перемішували при 80°С протягом 1 години. Роз 30 чинник випарювали. Додавали МеОН (15мл). Суміш перемішували та кип'ятили зі зворотним холодильником протягом 30 хвилин. Розчинник випарювали. Залишок (*) (1,49г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: CH2Cl2/MeOH/NH 4OH 97/3/0,1; 15-40мкм). Збирали дві фракції та випарювали розчинник. Перший залишок (0,23г) кристалізували з DIPE. Осад відфільтровували та сушили, одержуючи: 0,168г (13%) проміжної сполуки 13 (діастереоізомер А) (т.пл.: 204°С). Другий залишок (0,32г) кристалізували з DIPE. Осад відфільтровували та сушили. Вихід: 0,298г (23%) проміжної сполуки 14 (діастереоізомер В) (т.пл.: 225°С). За описаною вище методикою одержували наступні проміжні сполуки. Очищення отриманого залишку (*) зазначено для кожної проміжної сполуки окремо. 31 85570 32 Проміжну сполуку 13 (діастереоізомер А) (0,9г) очищали за допомогою хіральної хроматографії на силікагелі (елюент: 100% етанол). Збирали дві фракції та випарювали розчинник. Вихід: 0,420г проміжної сполуки 15 (енантіомер А1) (т.пл.: 161°С, МН+: 541) та 0,397г проміжної сполуки 16 (енантіомер А2) (т.пл.: 158°С, МН+: 541). а-3) Одержання проміжних сполук 44 та 45 Суміш проміжної сполуки 43 (отриманої за прикладом А6.а) (1,5г, 2,62моль), форміату амонію (0,83г, 0,013моль) та паладію на вугіллі (10%, 1,5г) в метанолі (30мл) кип'ятили зі зворотним холодильником протягом 1 години. Суміш охолоджували та фільтрували через невеликий шар целіту. Додавали воду. Органічний шар екстрагували етилацетатом, відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Залишок (1,3г) 33 85570 очищали за допомогою колоночної хроматографії на силікагелі (елюент: MeOH/AcNH 4 60/40, кромасил C18, 5мкм). Збирали чисті фракції та випарювали розчинник, одержуючи дві фракції. Вихід: 0,14г проміжної сполуки 44 у вигляді діастереоізомера А (12%) та 0,26г проміжної сполуки 45 у вигляді діастереоізомера В (22%). Приклад А9 Одержання проміжної сполуки 18 Суміш проміжної сполуки 39 (отримано] за прикладом А8. а-1) (0,0002моль) та CDI (0,0003моль) в ТГФ (7мл) перемішували та кип'ятили зі зворотним холодильником протягом 2 годин, виливали в Н2О та екстрагували СН 2Сl2. Органічний шар відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Вихід: 0,15г проміжної сполуки 18 (діастереоізомер А) (84%). В. Одержання сполук Приклад В1 Одержання сполуки 1 ι Суміш проміжної сполуки 13 (отриманої за прикладом А8.а-1) (0,00009моль) та параформу (0,0001моль) в толуолі (5мл) перемішували при 80°С. Суміш випарювали. Залишок (*) очищали за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/МеOН 99/1; 15-40мкм). Збирали чисті фракції та випарювали розчинник. Вихід: 0,025г сполуки 1 (діастереоізомер А) (49%, т.пл. 112°С). За описаною вище методикою одержували наступні сполуки. Очищення 1 залишку (*) зазначено, якщо воно відрізняється від описаної вище методики. 34 35 85570 36 0,031г сполуки 4 у вигляді гідройодиду (діастереоізомер А) (48%, т.пл.: 211°С). За описаною вище методикою одержували наступну сполуку. Приклад В5 Одержання сполуки 5 Суміш проміжної сполуки 37 (діастереоізомера А, отриманого за прикладом А8.а-1) (0,00009моль) та параформу (0,0001моль) в толуолі (5мл) перемішували при 80°С. Суміш випарювали. Залишок очищали за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/МеOН 99/1; 1540мкм). Збирали чисті фракції та випарювали розчинник. Залишок (0,06г, 92%) кристалізували з DIPE. Осад фільтр ували та сушили. Ви хід: 0,026г сполуки 2 (діастереоізомер В) (40%, т.пл. 201°С). Приклад В3 Одержання сполуки 3 Суміш проміжної сполуки 30 (діастереоізомера В, отриманого за прикладом А8.а-1) (0,00009моль) та параформу (0,0001моль) в толуолі (5мл) перемішували при 80°С. Суміш випарювали. Залишок очищали за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/МеOН 99/1; 1540мкм). Збирали чисті фракції та випарювали розчинник. Залишок (0,11г, 100%) кристалізували з діетилового ефіру. Осад фільтрували та сушили. Вихід: 0,033г сполуки 3 (діастереоізомер В) (33%, т.пл. 189°С). Приклад В4 Одержання сполуки 4 Суміш сполуки 7 (діастереоізомера А, отриманого за прикладом В1) (0,1ммоль) та йодометану (0,1ммоль) в ацетоні (2мл) перемішували при кімнатній температурі протягом 2,5 годин. Осад фільтрували, промивали ацетоном та сушили. Вихід: До суміші проміжної сполуки 18 (отриманої за прикладом А9) (0,0001моль) в ТГФ (10мл) додавали гідрид натрію (0,011г) при 0°С в потоці N2. Суміш перемішували при 0°С протягом 30 хвилин, виливали в Н 2О та екстрагували ЕtOАс. Органічний шар відокремлювали, сушили (MgSO4), фільтрували та випарювали розчинник. Залишок очищали за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ ЕtOАс 80/20; 15 40мкм). Збирали чисті фракції та випарювали розчинник. Залишок (0,09г, 67%) кристалізували з DIPE. Осад фільтр ували та сушили. Ви хід: 0,034г сполуки 5 (діастереоізомер А) (т.пл.: 192°С). За описаною вище методикою одержували наступну сполуку. Суміш проміжної сполуки 44 (діастереоізомера А, отриманого за прикладом А8.а-3) (0,12г, 0,298ммоль) та параформу (0,358моль) в толуолі (5мл) перемішували при 80°С протягом 2 годин. Додавали воду при кімнатній температурі та екстрагували органічний шар етилацетатом, відокремлювали, сушили (MgSO 4), фільтрували та випарювали розчинник. Залишок (0,13г) очищали за допомогою колоночної хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 99/1/0,1; 10мкм). Збирали чисті фракції та випарювали розчинник. Вихід: 0,075г сполуки 20 (діастереоізомер А) (61%, МН+: 415). За описаною вище методикою, але без колоночної хроматографії, одержували наступну сполуку. 37 85570 С. Аналітичні методи Масу сполук визначали за допомогою LCMS (рідинна хроматографія з мас-спектрометрією). Використовували три описаних нижче методи. Дані зазначені в наведеній далі таблиці 1. LCMS-метод І Аналіз методом LCMS (іонізація електророзпиленням в позитивному режимі, режим сканування від 100 до 900 атомних одиниць маси (апш)) виконували на колонці Kromasil С18 (Interchim, Montlucon, FR; 5мкм, 4,6x150мм) при швидкості потоку 1мл/хвилину. Використовували дві р ухливі фази (рухлива фаза А: 30% 6,5мМ ацетату амонію + 40% ацетонітрилу + 30% мурашиної кислоти (2мл/л); рухлива фаза В: 100% ацетонітрилу) для одержання умови градієнта від 100% А протягом 1 хвилини до 100% В протягом 4 хвилин, від 100% В протягом 5 хвилин до 100% А протягом 3 хвилин, та повторного встановлення рівноваги при 100% А протягом 2 хвилин. LCMS-метод 2 Аналіз методом LCMS (іонізація електророзпиленням як в позитивному, так і в негативному (імпульсному) режимі сканування від 100 до 1000 атомних одиниць маси (amu)) виконували на колонці Kromasil С18 (Interchim, Montlucon, FR; 3,5мкм, 4,6x100мм) при швидкості потоку 0,8мл/хвилину. Використовували дві рухливі фази (рухлива фаза А: 35% 6,5мМ ацетату амонію + 30% ацетонітрилу + 35% мурашиної кислоти (2мл/л); рухлива фаза В: 100% ацетонітрилу) для одержання умови градієнта від 100% А протягом 1 хвилини до 100% В протягом 4 хвилин, від 100% В при швидкості потоку 1,2мл/хвилину протягом 4 хвилин до 100% А при 0,8мл/хвилину протягом 3 хвилин, та повторного встановлення рівноваги при 100% А протягом 1,5 хвилин. LCMS-метод 3 Аналіз методом LCMS (іонізація електророзпиленням як в позитивному, так і в негативному (імпульсному) режимі сканування від 100 до 1000 атомних одиниць маси (amu)) виконували на колонці Sunfire СІ8 (Waters, Millford USA; 3,5мкм, 4,6x100мм) при швидкості потоку 0,8мл/хвилину. Використовували дві рухливі фази (рухлива фаза А: 35% 6,5мМ ацетату амонію + 30% ацетонітрилу + 35% мурашиної кислоти (2мл/л); рухлива фаза В: 100% ацетонітрилу) для одержання умови градієнта від 100% А протягом 1 хвилини до 100% В протягом 4 хвилин, від 100% В при швидкості потоку 1,2мл/хвилину протягом 4 хвилин до 100% А при 0,8мл/хвилину протягом 3 хвилин, та повторного встановлення рівноваги при 100% А протягом 1,5 хвилин. LCMS-метод 4 Аналіз методом LCMS (іонізація електророзпилення як в позитивному, так і в негативному (ім 38 пульсному) режимі сканування від 100 до 1000 атомних одиниць маси (amu)) на колонці Sunfire С18 (Waters, Millford USA; 3,5мкм, 4,6(100мм) при швидкості потоку 0,8мл/хвилину. Використовували дві рухливі фази (рухлива фаза А: 25% 6,5мМ ацетату амонію + 50% ацетонітрилу + 25% мурашиної кислоти (2мл/л); рухлива фаза В: 100% ацетонітрилу) для одержання умови градієнта від 100% А протягом 1 хвилини до 100 % В протягом 4 хвилин, від 100% В при швидкості потоку 1,2мл/хвилину протягом 4 хвилин до 100% А при 0,8мл/хвилину протягом 3 хвилин, та повторного встановлення рівноваги при 100% А протягом 1,5 хвилин. D. Фармакологічні приклади 39 85570 D.I. In vitro спосіб тестування сполук проти Μ. tuberculosis. Плоскодонні стерильні 96-лункові пластикові мікротитрувальні планшети заповнювали 100мкл бульйонним середовищем Middlebrook (1х). Після цього додавали основні розчини (10х кінцева тестова концентрація) сполук в об'ємі 25мкл до ряду парних лунок в колонці 2 для того, щоб оцінити їх вплив на бактеріальний ріст. Послідовні п'ятикратні розведення проводили безпосередньо в мікротитрувальних планшетах з колонки 2 по 11 за допомогою виконаного за замовленням робототехнічного комплексу (Zymark Corp,. Hopkinton, MA). Наконечники піпеток змінювали після кожних трьох розведень, щоб звести до мінімуму помилки піпеток з високогідрофобними сполуками. Неопрацьовані контрольні зразки, що містять (колонка 1) та не містять (колонка 12) інокулят, входили в кожен мікротитрувальний планшет. До рядів з А по Н, за винятком колонки 12, додавали приблизно 5000 CFU на лунку Mycobacterium tuberculosis (штам H37RV) в об'ємі 100мкл в бульйонному середовищі Middlebrook (1х). Такий же об'єм бульйонного середовища без інокулята додавали в колонку 12 в ряд з А по Н. Культури інкубували при 37°С протягом 7 днів у зволоженій атмосфері (інкубатор з відкритим повітряним клапаном та безперервною вентиляцією). За день до закінчення інкубації, через 6 днів після інокуляції в усі лунки додавали Resazurin (1:5) в об'ємі 20мкл та інкубували планшети ще протягом 24 годин при 37°С. На 7 день проводили кількісну оцінку бактеріального росту методом флуоресценції. Флуоресценцію вимірювали на керованому комп'ютером флуориметрі (Spectramax Gemini EM, Molecular Devices) при довжині хвилі збудження 530 нм та довжині хвилі емісії 590 нм. Процентний ріст інгібування, досягнутий сполуками, розраховували стандартними методами та розраховували дані МІС (що представляють величини ІС90, виражені в мікрограмах/мл). 40 D.2. Спосіб тестування сполук на антибактеріальну активність проти штаму М. Smegmatis ATCC607 in vitro. Плоскодонні стерильні 96-лункові пластикові мікротитрувальні планшети заповнювали 180мкл стерильної деіонізованої води з добавкою 0,25% BSA. Після цього додавали основні розчини (7,8х кінцева тестова концентрація) сполук в об'ємі 45 мкл до ряду парних лунок в колонці 2 для того, щоб оцінити їх вплив на бактеріальний ріст. Послідовні п'ятикратні розведення (45мкл в 180мкл) проводили безпосередньо в мікротитрувальних планшетах з колонки 2 по 11 за допомогою виконаного за замовленням робототехнічного комплексу (Zymark Corp,. Hopkinton, ΜΑ). Наконечники піпеток змінювали після кожних трьох розведень, щоб звести до мінімуму помилки піпеток з високогідрофобними сполуками. Неопрацьовані контрольні зразки, що містять (колонка 1) та не містять (колонка 12) інокулят, входили в кожен мікротитрувальний планшет. В ряди з А по Н, за винятком колонки 12, додавали приблизно 250 CFU на лунку бактеріального інокулята, в об'ємі 100мкл в 2,8х бульйонного середовища Mueller-Hinton. Той же об'єм бульйонного середовища без прищеплювального матеріалу додавали в колонку 12 в ряд з А по Н. Культури інкубували при 37°С протягом 48 годин в зволоженій атмосфері, що містить 5% СO2 (інкубатор з відкритим повітряним клапаном та безперервною вентиляцією). Наприкінці інкубації, через два дні після інокуляції, проводили кількісну оцінку бактеріального росту методом флуоресценції. Тому в усі лунки додавали Alamar Blue (10х) в об'ємі 20мкл та інкубували планшети ще 2 години при 50°С. Флуоресценцію вимірювали на керованому комп'ютером флуориметрі (Cytofluor, Biosearch) при довжині хвилі збудження 530нм та довжині хвилі емісії 590нм (збільшення 30). Процентний ріст інгібування, досягнутий сполуками, розраховували стандартними методами. рІС50 визначали, як 50% концентрації, що інгібує ріст бактерій. Результати представлені в таблиці 2. 41 Комп’ютерна в ерстка Л. Купенко 85570 Підписне 42 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted quinolines and their use as mycobacterial inhibitors
Автори англійськоюGuillemont Jerome Emile Georges, Pasquier Elisabeth Therese Jeanne
Назва патенту російськоюЗамещенные хинолины и их применение в качестве микобактериальных ингибиторов
Автори російськоюЖильмон Жером Эмиль Жорж, Паскье Элизабет Тереза Жанна
МПК / Мітки
МПК: C07D 413/06, A61P 31/10, A61K 31/5355, C07D 413/14
Мітки: застосування, мікобактеріальних, заміщені, хіноліни, інгібіторів
Код посилання
<a href="https://ua.patents.su/21-85570-zamishheni-khinolini-ta-kh-zastosuvannya-yak-mikobakterialnikh-ingibitoriv.html" target="_blank" rel="follow" title="База патентів України">Заміщені хіноліни та їх застосування як мікобактеріальних інгібіторів</a>
Попередній патент: Заміщені конденсовані гетероциклічні с-глікозиди
Наступний патент: Спосіб мікроклонального розмноження унгернії віктора ungernia victoris vved. ex artjuschenko
Випадковий патент: Спосіб керування головною водовідливною установкою вугільної шахти