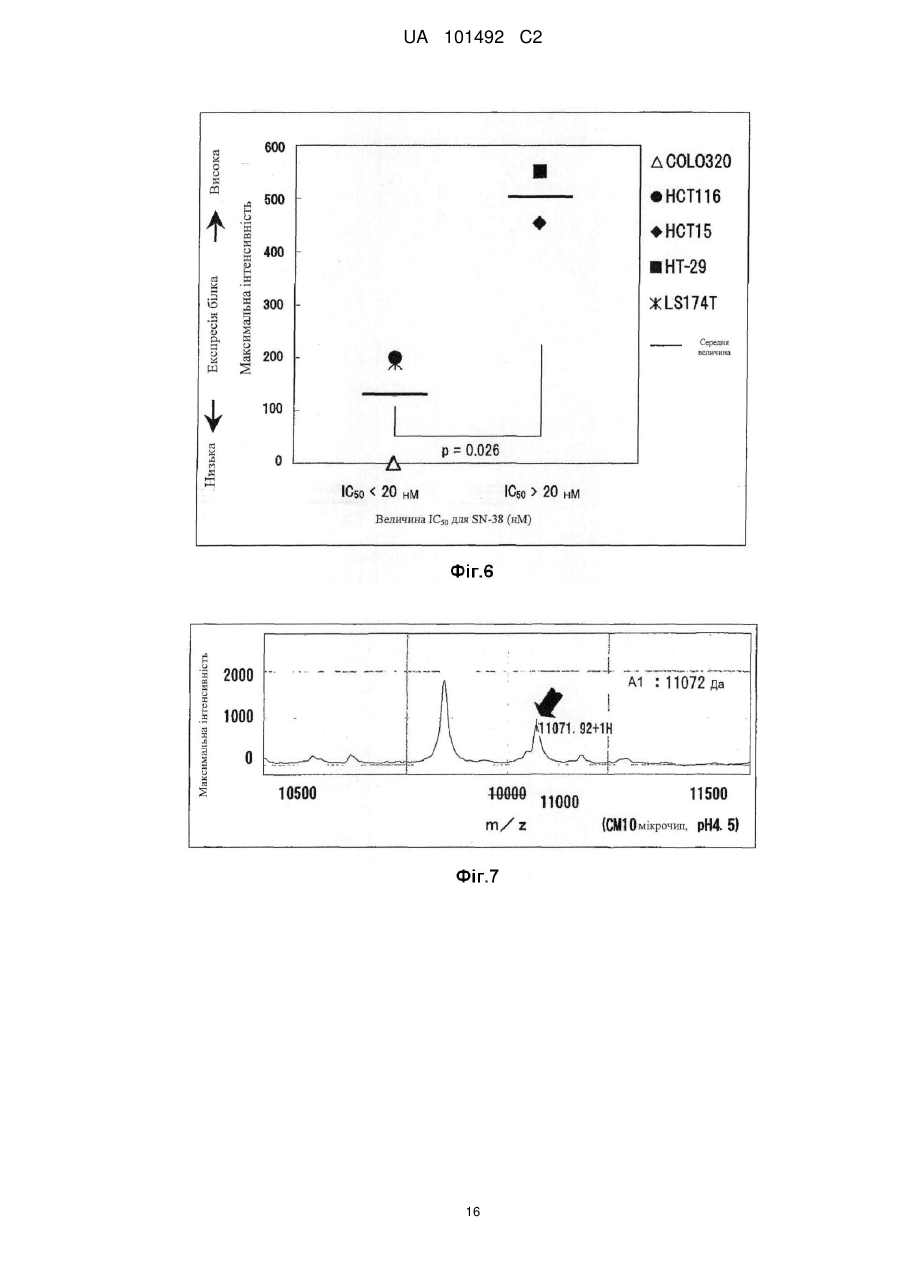
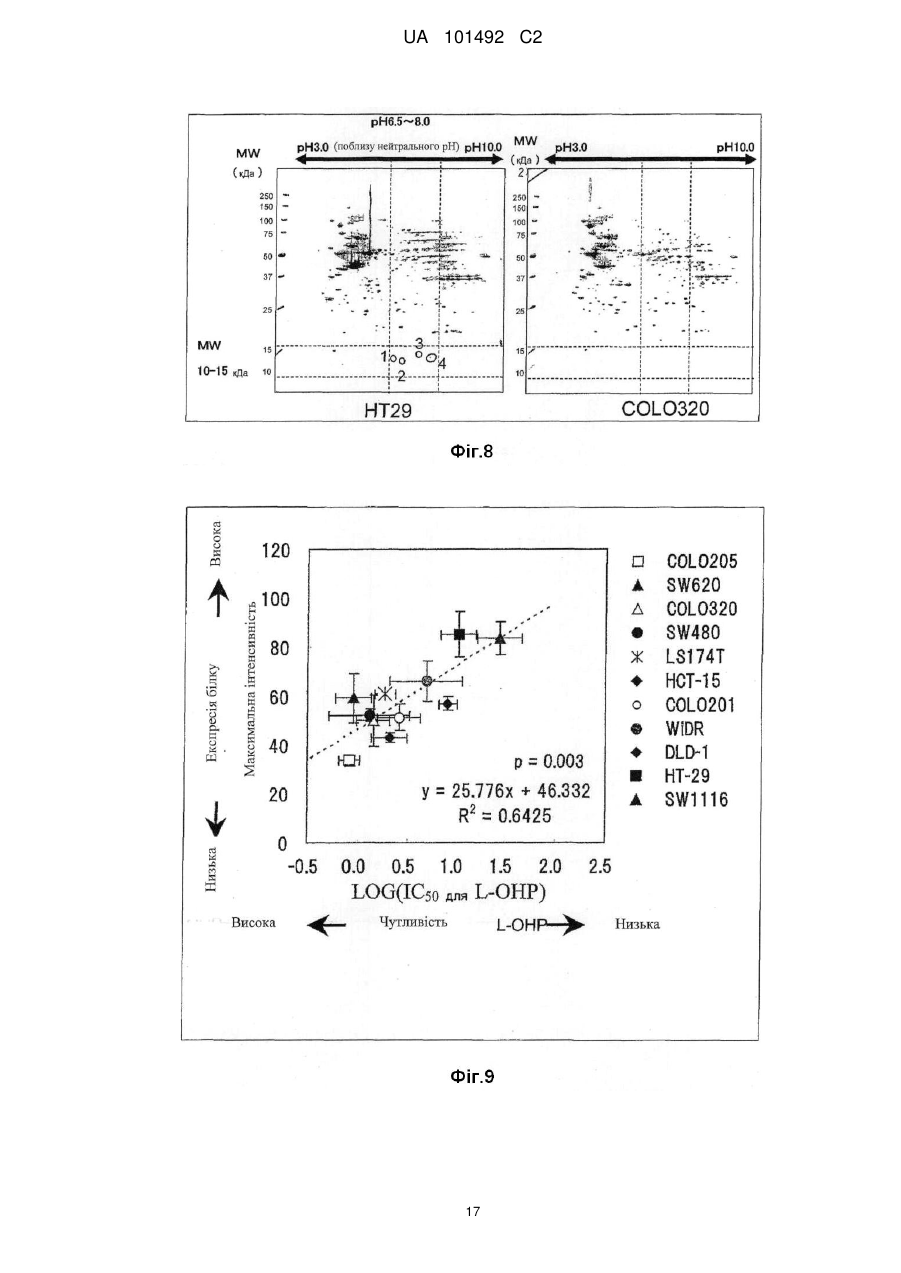
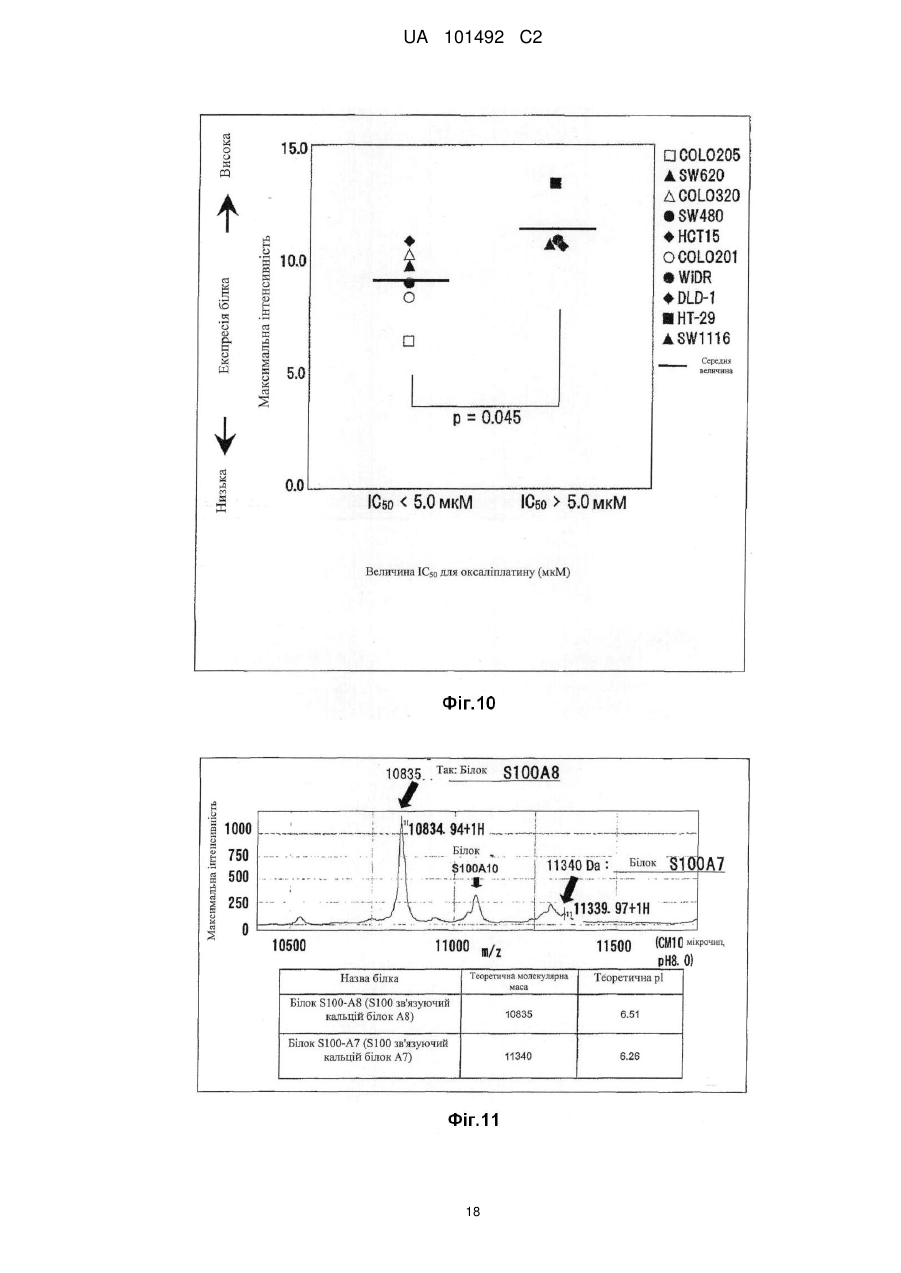
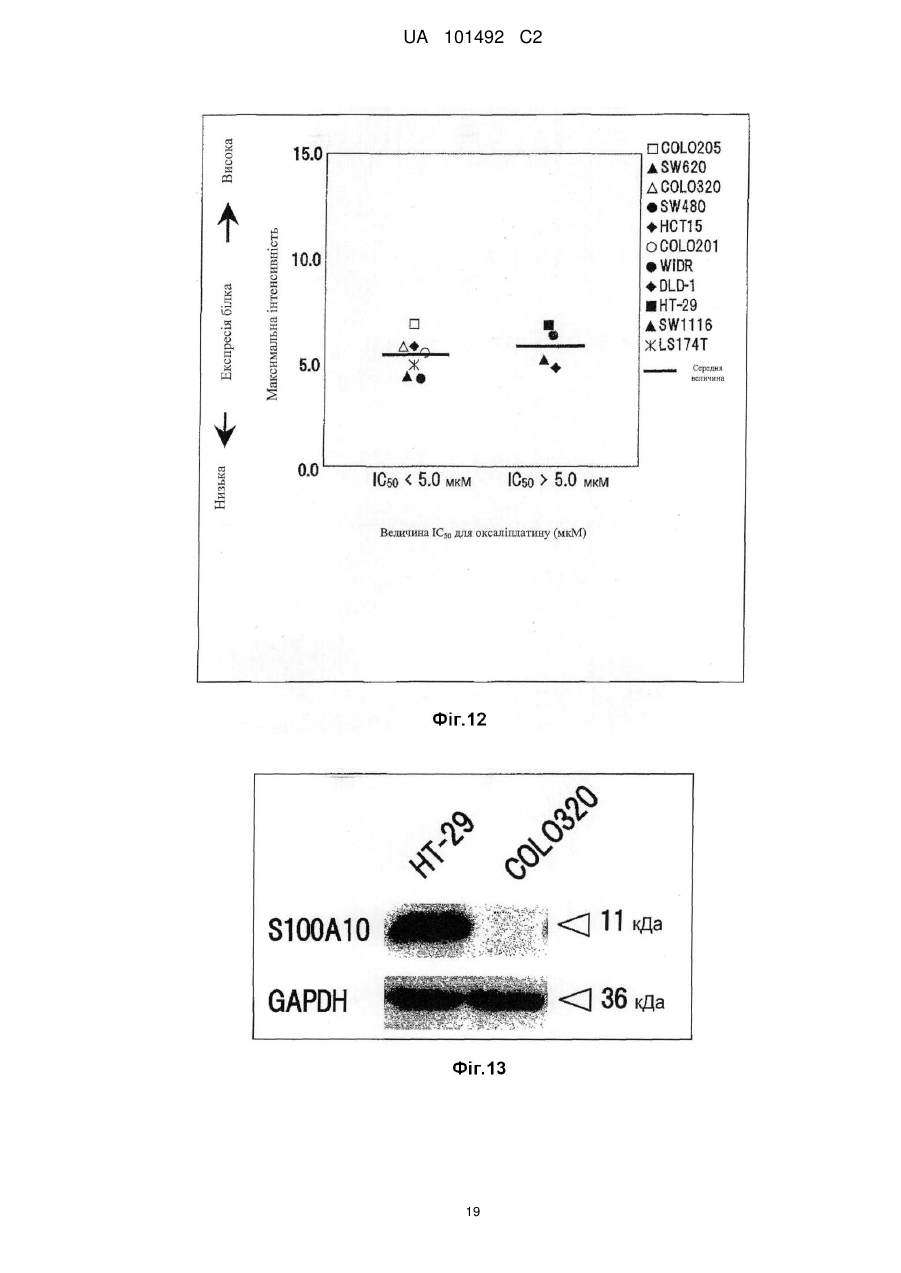
Спосіб визначення чутливості до протиракового засобу
Номер патенту: 101492
Опубліковано: 10.04.2013
Автори: Сузукі Сайо, Танігавара Юсуке, Сугімото Сіндзі
Формула / Реферат
1. Маркер для визначення чутливості індивідуума до протиракового засобу, де вказаний маркер містить зв'язуючий кальцій білок S100A7 або S100A8, де протираковий засіб являє собою оксаліплатин, цисплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки.
2. Маркер для визначення чутливості індивідуума до протиракового засобу, де вказаний маркер містить зв'язуючий кальцій білок S100A10, де протираковий засіб являє собою оксаліплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки.
3. Спосіб визначення чутливості індивідуума до протиракового засобу, де вказаний спосіб включає вимірювання концентрації маркера для визначення чутливості до протиракового засобу за п. 1 в зразку, де протираковий засіб являє собою оксаліплатин, цисплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки.
4. Спосіб визначення чутливості індивідуума до протиракового засобу, де вказаний спосіб включає вимірювання концентрації маркера для визначення чутливості до протиракового засобу за п. 2 в зразку, де протираковий засіб являє собою оксаліплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки.
5. Спосіб визначення чутливості індивідуума до протиракового засобу за п. 3 або п. 4, де зразок являє собою біологічний зразок, одержаний в індивідуума, який страждає на рак ободової та прямої кишки.
6. Спосіб визначення чутливості індивідуума до протиракового засобу за п. 3 або п. 4, де зразок являє собою біологічний зразок, одержаний в індивідуума, який страждає на рак ободової та прямої кишки і який одержував протираковий засіб.
7. Спосіб скринінгу агента, який підвищує чутливість до протиракового засобу, що включає використання як показника інгібування експресії маркера для визначення чутливості до протиракового засобу за п. 1 або 2.
Текст
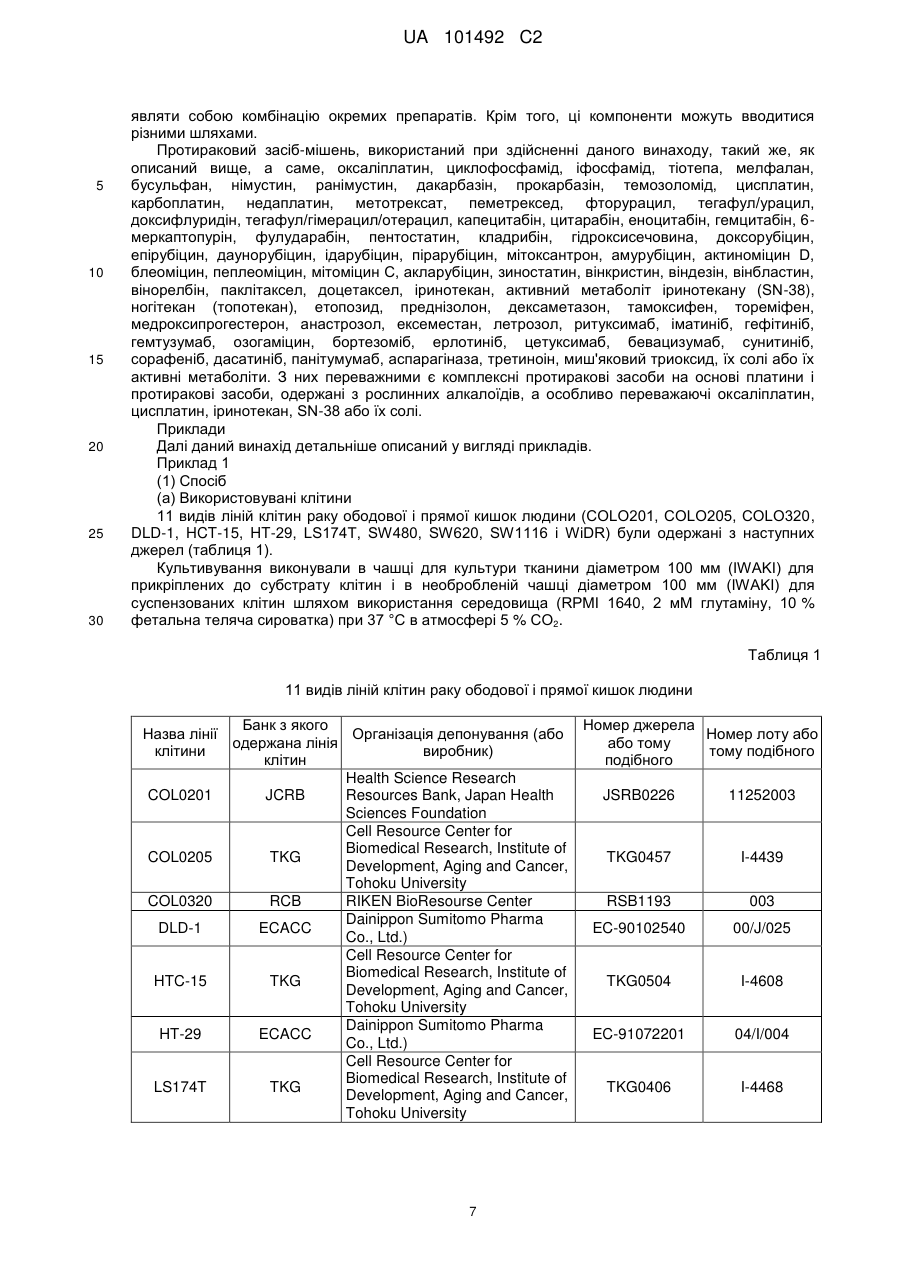
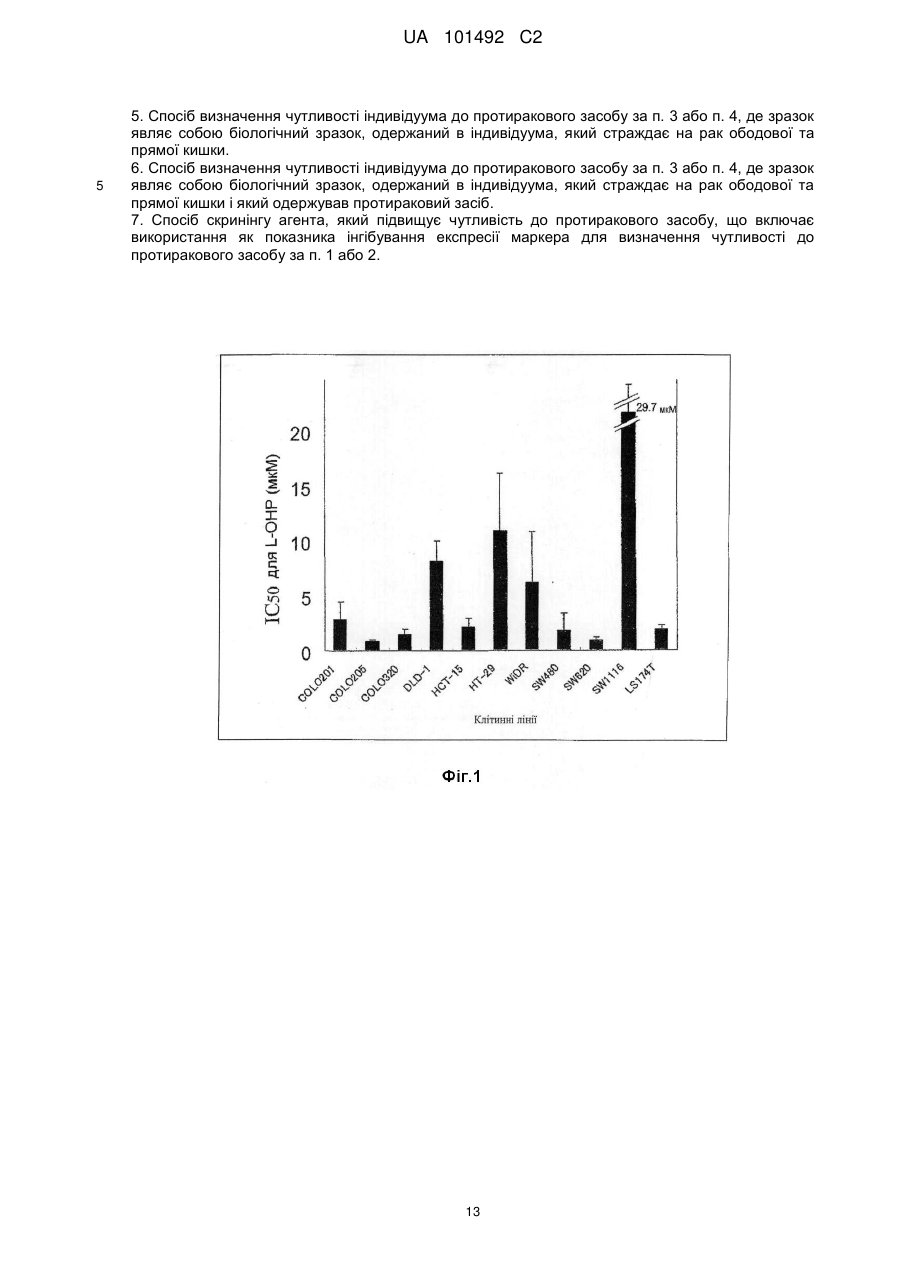
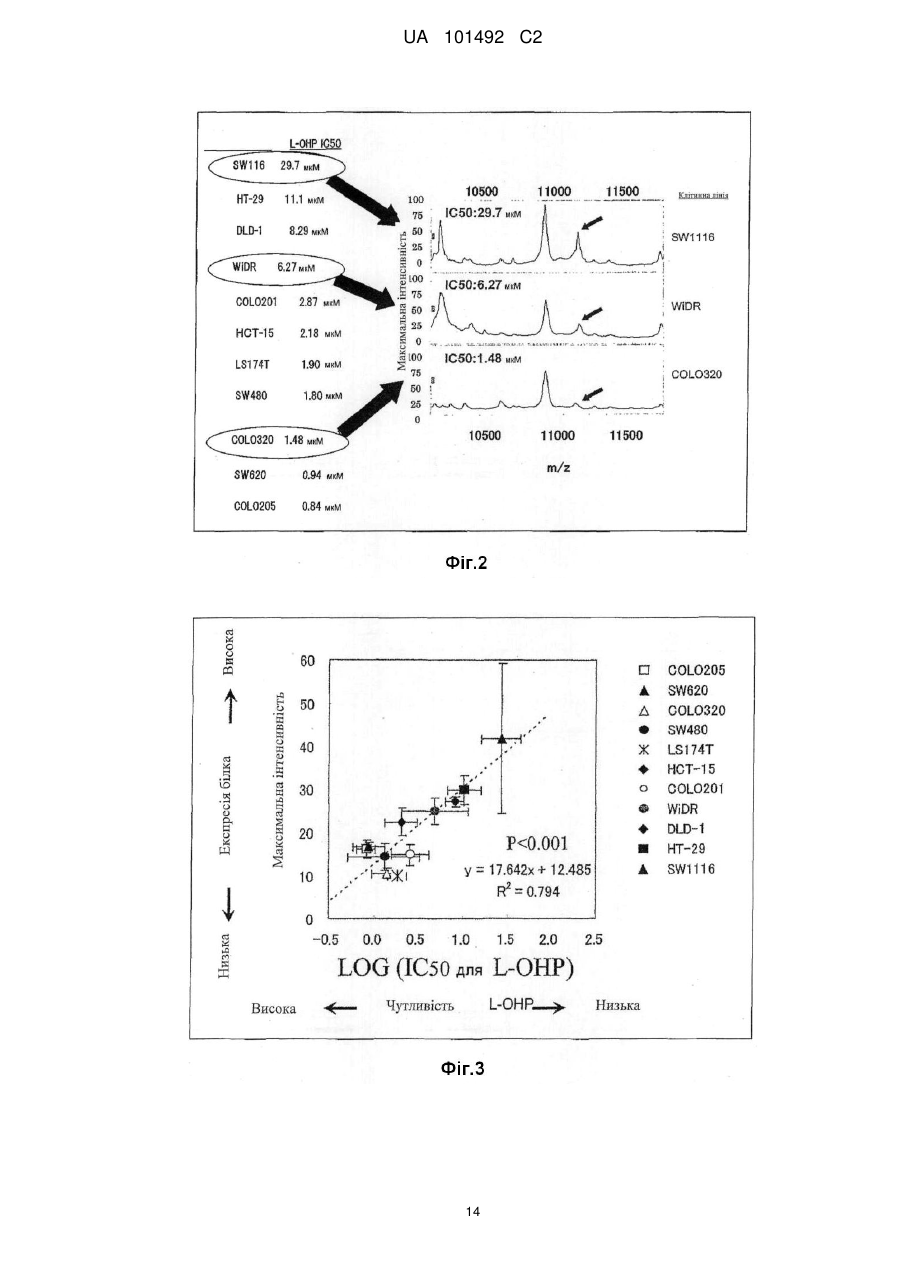
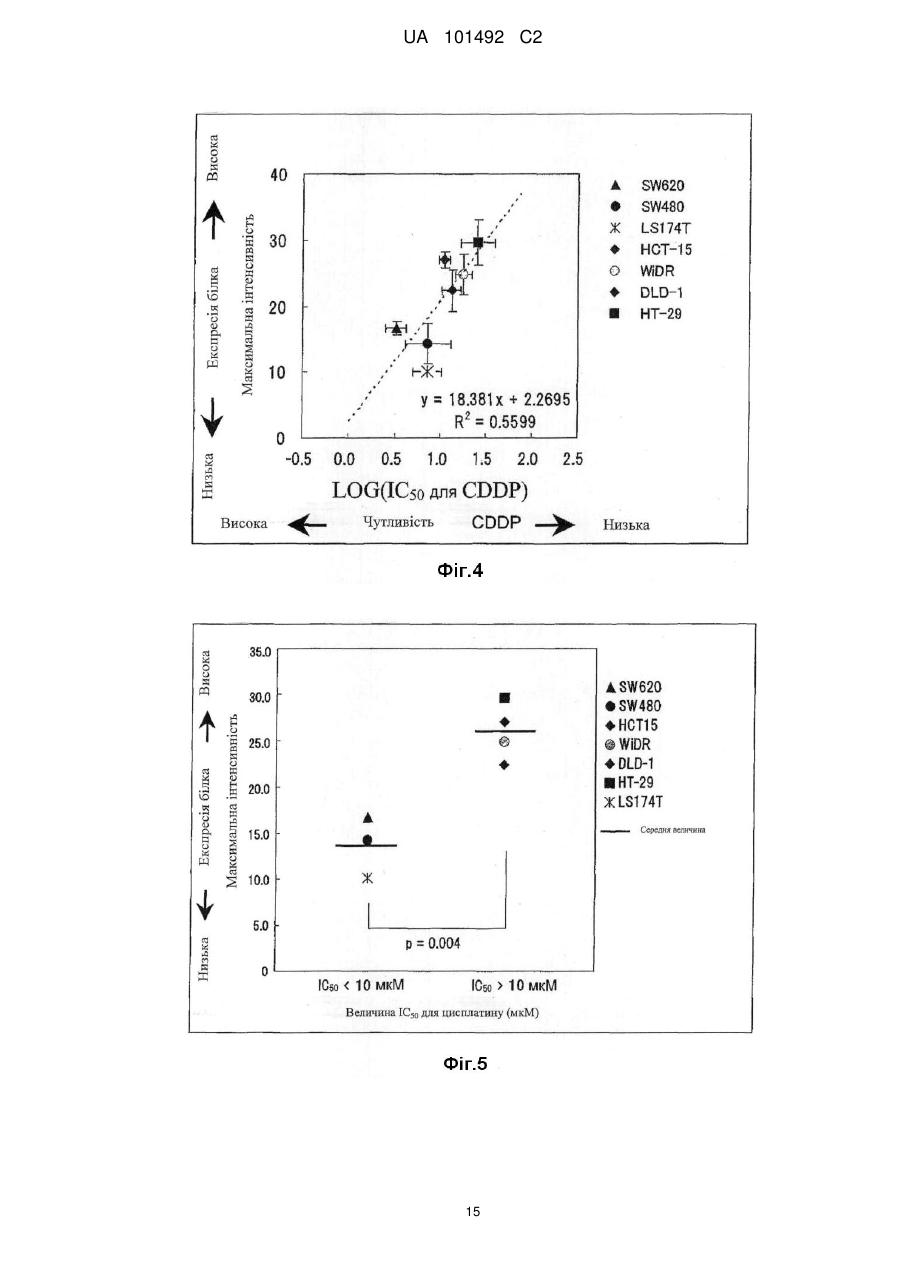
Реферат: Винахід стосується маркера для визначення чутливості до протиракового засобу, здатний розрізнити реакцію на лікування окремого пацієнта. Маркер для визначення чутливості до протиракового засобу містить зв'язуючий кальцій білок S100A7, S100A8 або S100A10. UA 101492 C2 (12) UA 101492 C2 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки Даний винахід належить до маркера, який визначає чутливість до протиракового засобу, який застосовується для визначення того, чи є реакція на лікування протираковим засобом, який підлягає застосуванню, і до його застосування. Попередній рівень техніки Є різні види протиракових засобів, такі як алкілуючий засіб, платиновий засіб, антиметаболіт, протипухлинний антибіотик і протипухлинний рослинний алкалоїд. Крім того, ці протиракові засоби в деяких випадках виявляють ефекти, а в інших випадках виявляють відсутність цього ефекту, що залежить від виду раку. Однак відомо, що якщо навіть рак належить до виду, при якому підтверджено, що протираковий засіб є ефективним, протираковий засіб виявляє ефект в деяких випадках і виявляє відсутність ефекту в інших випадках, призводячи до відмінностей між індивідуумами. Те, виявляє чи ні протираковий засіб ефект у окремого страждаючого на рак пацієнта, означає чутливість до протиракового засобу. 1 Оксаліплатин, тобто (SP-4-2)-[(1R, 2R)-циклогексан-1, 2-діамін-κN, κN'][етандіоато (2-)-κO , 2 κO ]) платина (IUPAC), являє собою протираковий засіб третього покоління у вигляді комплексу на основі платини. Вважається, що його механізм дії, як і платини (CDDP) і карбоплатини (CВCDA), які являють собою проліки, оснований на інгібуванні синтезу ДНК і/або інгібуванні синтезу білка утворенням поперечного зшивання з ДНК основою. Оксаліплатин (L-OHP) виявляє протипухлинний ефект при раку ободової і прямої кишок, при якому CDDP і CВCDA неефективні, і виявляє спектр протипухлинної активності, відмінний від спектра звичайного комплексного засобу на основі платини. В Америці оксаліплатин для застосування в комбінації з фторурацилом (5-FU) і левофолінатом (LV) в січні 2004 р. був затверджений як терапія першої лінії при метастатичному раку ободової і прямої кишок. В Японії в квітні 2005 р. оксаліплатин був включений до списку переліку цін Національного Страхування Здоров'я (NHI) у разі комбінованого його застосування з інфузійним фторурацилом і левофолінатом (схема FOLFOX4) при запущеному/рецидивуючому раку ободової і прямої кишок, який не підлягає радикальній хірургічній резекції. При лікуванні запущеного/рецидивуючого раку ободової і прямої кишок, хоча виживання при схемі 5-FU/LV, яку проводили до початку 1990-х років, знаходилося в діапазоні від 10 до 12 місяців, виживання при схемі FOLFOX в комбінації з оксаліплатином досягає приблизно подвійного періоду (19,5 місяців). Крім того, в дослідженні випадків II/III стадії повідомляється про ефективність схеми FOLFOX в порівнянні зі схемою 5FU/LV при післяопераційній ад'ювантній хіміотерапії. Відповідно, хоча оксаліплатин ще не був затверджений, очікується, що оксаліплатин буде додатково затверджений для застосування при лікуванні пацієнтів, які страждають на рак ободової і прямої кишок, при післяопераційній ад'ювантній хіміотерапії і буде ефективним у цих пацієнтів. Проте, об'єктивна частота реакції на схему FOLFOX проти запущеного/рецидивуючого раку ободової і прямої кишок становить близько 50 %. Іншими словами, передбачається, що половина пацієнтів, які одержували лікування за схемою FOLFOX, не досягла ефекту. Крім того, застосування оксаліплатину з високою частотою викликає периферичну нейропатію, яка не є фатальним побічним ефектом, але являє собою фактор, що викликає складності при продовженні терапії. Тому, якщо можна прогнозувати або діагностувати перед початком терапії, чи є пацієнт таким, у якого очікується досягнення реакції (респондент), або пацієнтом, у якого не очікується досягнення реакції (не респондент), то може бути здійснена високоефективна і безпечна хіміотерапія. Крім того, в цілому, лікувальна схема хіміотерапії раку продовжується протягом тривалого періоду. Тому, моніторинг чутливості до протиракового засобу хронологічно протягом терапії забезпечує можливість визначення того, чи треба продовжувати лікування чи ні, і веде до зниження навантаження пацієнта і побічних явищ, і може також бути ефективним з точки зору медичної економії. Необхідне встановлення біологічного маркера для прогнозування реакції на лікування для "персоналізованої медицини", при якій прогнозується реакція окремих пацієнтів на лікування і вибирається відповіднелікування. Як фактори, пов'язані з реакцією на лікування оксаліплатином, можуть, головним чином, бути залучені наступні: (1) посилення оксаліплатином здатності ексцизійної репарації пошкодженої ДНК; (2) інактивація (детоксикація) оксаліплатину (активованої форми) в клітинах; і (3) зниження кількості накопичення оксаліплатину в клітинах. Проводяться клінічні дослідження реакції на лікування з використанням комбінації оксаліплатину і 5-FU у пацієнтів, які страждають на рак ободової і прямої кишок, і клінічні дослідження, пов'язані з вказаними вище пунктами з (1) по (3), як прогностичними факторами для прогнозу. 1 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відносно пункту (1) повідомляється, що кількісна експресія гена перехресно комплементуючої групи 1 ексцизійної репарації (ERCC1) в пухлині являє собою прогностичний фактор, причому ERCC1 відіграє важливу роль в репарації нуклеотидної ексцизії (NER) (непатентний документ 1). Повідомляється, що у пацієнта, який має гомозиготу С/С C118T, яка являє собою один з видів поліморфізму одиночних нуклеотидів (SNPs) ERCC1, присутня більш сприятлива виживаність, ніж у пацієнта, який має щонайменше один або більше алелів Т (непатентний документ 2). Повідомляється, що генетичний поліморфізм, який спричиняє мутацію амінокислоти Lys751Gln в Xeroderma pigmentosum D (XPD, також відомої як ERCC2), бере участь в зниженні частоти зменшення пухлини або у виживаності (непатентні документи 2 і 3). При основній ексцизійній репарації (BER) повідомляється про зв'язок між ефектом зменшення пухлини і генетичним поліморфізмом, який спричиняє мутацію амінокислотної послідовності Arg399Gln в перехресно комплементуючій групі при репарації після рентгенівського пошкодження 1 (XRCC1) і XRCC1, який кодує білок, який може брати участь в ефективній репарації розриву однієї нитки ДНК, який виник в результаті впливу алкілуючого агента або тому подібного пошкоджуючого агента (непатентний документ 4). Однак повідомляється, що при наступному аналізу прицільної дії у тих же пацієнтів генетичний поліморфізм не впливає на клінічний прогноз (непатентний документ 2). Репарація з помилковим підбором ДНК (MMR) також може бути пов'язана зі зниженням чутливості до цисплатину. Однак повідомляється, що в дослідженні in vitro MMR не бере участь в репарації ДНК, пошкодженої оксаліплатином (непатентний документ 5). Відносно пункту (2) глютатіон-S-трансфераза (GST) являє собою один з ферментів, які відповідальні за другу фазу реакції детоксикації і метаболізму, і інактивує лікарський засіб каталізом утворення спряженого зв'язку платини-аддукту ДНК і глютатіону. Серед підтипів GST GSTP1 має високий рівень експресії при раку ободової і прямої кишок. Крім того, повідомляється, що генетичний поліморфізм GSTP1, який викликає мутацію амінокислотної послідовності Ile105Val, пов'язаний з виживанням (медіана виживаності: Ile/Ile, 7,9 місяці, Ile/Val, 13,3 місяці і Val/Val, 24,9 місяці) (непатентний документ 6). Відносно пункту (3) повідомляється, що в дослідженні з використанням культивованих клітин транспортери органічних катіонів (OCTs) пов'язані з транспортом оксіплатину в клітини і чутливістю до нього (непатентний документ 7). Крім того, повідомляється про зв'язок між транспортером, який бере участь в транспортуванні міді або важкого металу, таким як АТР7А або АТР7В, і чутливістю до оксаліплатину (непатентні документи 8 і 9). Однак немає клінічного дослідження зв'язку між експресією цих транспортерів і терапевтичною реакцією на оксаліплатин. Повідомлялося, що в нещодавно проведеному клінічному дослідженні використання схеми FOLFOX при запущеному раку ободової і прямої кишок було виявлено, що генетичний поліморфізм ERCC1 (Asn118Asn) і генетичний поліморфізм XPD (Lys751Gln) незалежно пов'язані з виживанням без прогресування процесу (PFS). Однак не виявлений зв'язок між генетичним поліморфізмом GSTP1 (Ile105Val) і PFS і визнано, що генетичний поліморфізм має тенденцію мати зв'язок з нейротоксичністю, викликаною оксаліплатином (непатентний документ 10). У дослідженнях in vitro є багато повідомлень про фактор, пов'язаний зі стійкістю до цисплатину, який являє собою комплексний, попередній лікарський препарат на основі платини. Повідомляється також про зв'язок між оксаліплатином і пов'язаними з апоптозом факторами, такими як FAS/FASL і Bcl-xL (непатентні документи 11 і 12). Однак в залежності від виду раку оксаліплатин виявляє терапевтичну реакцію, відмінну від цисплатину. Крім того, важко з'ясувати клітинну реакцію ракової клітини на ДНК-платиновий аддукт, який відповідає за цитотоксичну активність оксаліплатину. Ще не був встановлений біологічний маркер, здатний ясно прогнозувати терапевтичну реакцію на хіміотерапію з використанням оксаліплатину. Документи, які стосуються даної галузі [Непатентний документ 1] J.Clin. Oncol. 19, 4298-4304 (2001) [Непатентний документ 2] Br. J. Cancer 91, 344-354 (2004) [Непатентний документ 3] Cancer Res 61, 8654-8658 (2001) [Непатентний документ 4] Anticancer Res. 21, 3075-3079 (2001) [Непатентний документ 5] Cancer Res. 56, 4881-4886 (1996) [Непатентний документ 6] J.Natl. Cancer Inst. 94, 936-942 (2002) [Непатентний документ 7] Cancer Res. 66, 8847-8857 (2006) [Непатентний документ 8] Mol. Pharmacol. 66, 25-32 (2004) [Непатентний документ 9] Clin. Cancer Res. 10, 4661-4669 (2004) [Непатентний документ 10] J.Clin. Oncol. 25, 1247-1254 (2007) 2 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 60 [Непатентний документ 11] Clin. Cancer Res. 11, 4770-4774 (2005) [Непатентний документ 12] J.Biol. Chem. 279,46113-46121 (2004) Опис винаходу Проблеми, які має вирішити винахід Метою даного винаходу є надання маркера для визначення чутливості до протиракового засобу, здатного визначити терапевтичну реакцію окремих пацієнтів і забезпечити новий засіб для лікування раку з використанням маркера. Способи розв'язання проблем Заявники культивували лінії клітин раку людини і здійснювали пошук маркера для визначення чутливості до протиракового засобу з їх внутрішньоклітинних білків шляхом використання мас-спектрометра з поверхнево посиленою лазерною десорбцією/часом протікання іонізації (SELDI-TOF MS). В результаті, заявники виявили білки, рівні експресії яких збільшуються при зниженні чутливості до протиракового засобу, і було виявлено, що ці білки стосуються трьох видів білків, які виявляються мас-спектрометром у вигляді піків при m/z від 10800 до 11400. Потім, заявники, крім того, досліджували білки і в результаті виявили, що ці білки являють собою білки, які зв'язують кальцій, тобто S100A7, S100A8 і S100A10, які, як було відомо, були ізомерами сімейства білка S100, який має білковий домен EF-рука, який зв'язує кальцій. Заявники провели подальші дослідження на основі цих даних і виявили, що те, чи є ракова пухлина у страждаючого на рак пацієнта чутливою до протиракового засобу чи ні, можна визначити вимірюванням концентрації S100A7, S100A8 або S100A10 в біологічному зразку, одержаного у страждаючого на рак пацієнта; використання інгібування експресії білка як показника забезпечує можливість скринінгу агента для підвищення чутливості до протиракового засобу (який далі називається "агентом, який підвищує чутливість до протиракового засобу"); і терапевтичний ефект протиракового засобу значно поліпшується при використанні агента, який підвищує чутливість до протиракового засобу, і протиракового засобу як мішені підвищення чутливості в комбінації. Таким чином був створений даний винахід. Тобто, даний винахід надає маркер для визначення чутливості до протиракового засобу, який містить білок S100A7, S100A8 або S100A10, який зв'язує кальцій. Даний винахід також надає спосіб визначення чутливості до протиракового засобу, який включає вимірювання концентрації S100A7, S100A8 або S100A10 зразка. Даний винахід також надає набір для здійснення способу визначення чутливості до протиракового засобу, який містить протокол для вимірювання концентрації S100A7, S100A8 або S100A10 в зразку. Даний винахід також надає спосіб скринінгу агента, який підвищує чутливість до протиракового засобу, та включає використання як показника інгібування експресії S100A7, S100A8 або S100A10. Даний винахід також надає агент, який підвищує чутливість до протиракового засобу, який одержаний вказаним вище способом скринінгу. Даний винахід також надає композицію для лікування раку, яка містить комбінацію вказаного вище агента, що підвищує чутливість до протиракового засобу, і протираковий засіб як мішень підвищення чутливості. Даний винахід також дає можливість застосування комбінації вказаного вище агента, який підвищує чутливість до протиракового засобу, і протиракового засобу як мішені підвищення чутливості для одержання терапевтичного лікарського засобу для лікування раку. Даний винахід також надає спосіб лікування раку, який включає введення вказаного вище агента, який підвищує чутливість до протиракового засобу, і протиракового засобу як мішені підвищення чутливості. Ефекти винаходу Якщо використовується маркер для визначення чутливості до протиракового засобу відповідно до даного винаходу, то чутливість до протиракового засобу окремого пацієнта може бути певним чином визначена перед початком лікування, що призведе до вибору протиракового засобу, який має високий терапевтичний ефект. Крім того, можна уникнути застосування протиракового засобу, який не надає ефекту, за допомогою чого можна уникнути непотрібного побічного явища. Крім того, схема лікування з використанням протиракового засобу триває протягом тривалого періоду, і, отже, чутливість ракового ураження до протиракового засобу можна оцінити хронологічно шляхом визначення чутливості до протиракового засобу при кожному циклі лікування навіть під час терапії, і, таким чином, можна визначити, чи необхідно продовжувати лікування чи ні. В результаті можна запобігти прогресуванню раку і посиленню побічних явищ, які супроводжують безперервне введення протиракового засобу, що не виявляє 3 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 терапевтичного ефекту, що призведе до зниження навантаження на пацієнта і скорочення медичних витрат. Крім того, якщо використовується маркер, то можна провести скринінг агента, який підвищує чутливість до протиракового засобу. Ефект лікування раку значно поліпшується застосуванням агенту, який підвищує чутливість до протиракового засобу, і протиракового засобу як мішені в комбінації. Короткий опис креслень Фіг. 1 являє собою графік, який ілюструє чутливість до оксаліплатину (L-OHP) кожної лінії ракових клітин. Фіг. 2 являє собою графік, який ілюструє чутливість до оксаліплатину (L-OHP) і зміну максимальної інтенсивності білка А1 в кожній лінії ракових клітин. Фіг. 3 являє собою діаграму, яка ілюструє кореляцію між максимальною інтенсивністю білка А1 і чутливістю до оксаліплатину (L-OHP) кожної лінії ракових клітин. Фіг. 4 являє собою діаграму, яка ілюструє кореляцію між максимальною інтенсивністю білка А1 і чутливістю до цисплатину (CDDP) кожної лінії ракових клітин. Фіг. 5 являє собою діаграму, яка ілюструє зв'язок між максимальною інтенсивністю білка А1 і чутливістю до цисплатину (CDDP) кожної лінії ракових клітин (лінії клітин класифікуються на 2 групи і порівнюються установкою величини відсічки IC50 відносно 10 мкМ цисплатину). Фіг. 6 являє собою діаграму, яка ілюструє зв'язок між максимальною інтенсивністю білка А1 і чутливістю до SN-38 кожної лінії ракових клітин (лінії клітин класифікуються на 2 групи і порівнюються установкою величини відсічки IC50 відносно 20 нМ SN-38). Фіг. 7 являє собою діаграму, яка ілюструє молекулярну масу білка А1 аналізом SELDI-TOF MS з використанням білкового мікрочипу. Фіг. 8 ілюструє виявлення двовимірного електрофорезу двох видів ліній клітин раку ободової і прямої кишок НТ-29 (яка експресує білок А1 на високому рівні) і COLO320 (яка експресує білок А1 на низькому рівні) і вибраних плям для аналізу LC/MS/MS (рідинною хроматографією/масспектроскопією/мас-спектроскопією). Фіг. 9 являє собою діаграму, яка ілюструє кореляцію між максимальною інтенсивністю білка А2 і чутливістю до оксаліплатину кожної лінії ракових клітин. Фіг. 10 являє собою діаграму, яка ілюструє зв'язок між максимальною інтенсивністю білка А3 і чутливістю до оксаліплатину кожної лінії ракових клітин (лінії клітин класифікуються на 2 групи і порівнюються установкою величини відсічки IC50 відносно 5,0 мкМ оксаліплатину). Фіг. 11 ілюструє білок А2 (білок S100-A8, S100 зв'язуючий кальцій білок А8) і білок А3 (білок S100-A7, S100 зв'язуючий кальцій білок А7) аналізом SELDI-TOF MS з використанням білкового мікрочіпу. Фіг. 12 являє собою діаграму, яка ілюструє зв'язок між максимальною інтенсивністю S100A9 і чутливістю до оксаліплатину кожної лінії ракових клітин (лінії клітин класифікуються на 2 групи і порівнюються установкою величини відсічки IC50 відносно 5,0 мкМ оксаліплатину). Фіг. 13 являє собою креслення, яке ілюструє виявлення S100A10 в НТ-29 (яка експресує S100A10 на високому рівні) і COLO320 (яка експресує S100A10 на низькому рівні) вестернблотингом. Найкращий спосіб здійснення винаходу Маркер для визначення чутливості до протиракового засобу відповідно до даного винаходу містить S100A7, S100A8 або S100A10. Ці білки виявляються у вигляді піків при m/z від 10800 до 10900 (S100A8), від 11000 до 11100 (S100A10) і від 11300 до 11400 (S100A7) масспектрометром з поверхнево посиленою лазерною десорбцією/часом протікання іонізації (SELDI-TOF MS). В результаті дослідження експресії внутрішньоклітинного білка в культивованих ракових клітинах шляхом використання SELDI-TOF MS, як наведено нижче в прикладах, було виявлено, що ці білки S100A7, S100A8 і S100A10 (кожний з яких далі також називається білком А) мають значну кореляцію з чутливістю до оксаліплатину (величина IC50) або чутливістю до іринотекану або SN-38 (величина IC50). Тобто, рівень експресії білка А був низьким в ракових клітинах, які мають високу чутливість до оксаліплатину, цисплатину, іринотекану або SN-38, тоді як рівень експресії білка А був високим в ракових клітинах, які мають низьку чутливість до оксаліплатину, цисплатину, іринотекану або SN-38. Відповідно, білок А ефективний як маркер для визначення чутливості до протиракового засобу, зокрема, як маркер для визначення чутливості до комплексного протиракового засобу на основі платини або протиракового засобу, одержаного з рослинного алкалоїду, конкретніше, як маркер для визначення чутливості до оксаліплатину, цисплатину, іринотекану, SN-38 або їх солей. 4 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 60 У цьому випадку, в зв'язку з тим, що, як відомо, S100A8 і S100A7 можливо зв'язуються з S100A10 (Journal of Proteome Research 2005; 4: 1717-1721), ці білки можуть в деякій мірі взаємодіяти з чутливістю до протиракового засобу. Крім того, ці зв'язані форми можуть також використовуватися як маркер для визначення чутливості до протиракового засобу. Далі, відомо, що димер самого S100A10 і димер анексину А2 (Анексин-2, Анексин II, Ліпокортин II, важкий ланцюг Калпактину I, Хромбіндин-8, р36, Білок I, Плацентарний антикоагулянтний білок IV, PAPIV) утворюють гетеротетрамер, і, отже, анексин А2 може також використовуватися як маркер для визначення чутливості до протиракового засобу, а також S100A10. Протираковий засіб як мішень маркера для визначення чутливості до протиракового засобу відповідно до даного винаходу конкретно не обмежується. Його приклади включають оксаліплатин, циклофосфамід, іфосфамід, тіотепу, мелфалан, бусульфан, німустин, ранімустин, дакарбазін, прокарбазін, темозоломід, цисплатин, карбоплатин, недаплатин, метотрексат, пеметрексед, фторурацил, тегафул/урацил, доксифлуридін, тегафул/гімерацил/отерацил, капецитабін, цитарабін, еноцитабін, гемцитабін, 6-меркаптопурін, фулударабін, пентостатин, кладрибін, гідроксисечовина, доксорубіцин, епірубіцин, даунорубіцин, ідарубіцин, пирарубіцин, мітоксантрон, амурубіцин, актиноміцин D, блеоміцин, пеплеоміцин, мітоміцин С, акларубіцин, зиностатин, вінкристин, віндезін, вінбластин, вінорелбін, паклітаксел, доцетаксел, іринотекан, активний метаболіт іринотекану (SN-38), ногітекан (топотекан), етопозид, преднізолон, дексаметазон, тамоксифен, тореміфен, медроксипрогестерон, анастрозол, ексеместан, летрозол, ритуксимаб, іматиніб, гефітиніб, гемтузумаб, озогаміцин, бортезоміб, ерлотиніб, цетуксимаб, бевацизумаб, сунітиніб, сорафеніб, дасатиніб, панітумумаб, аспарагіназ, третиноін, миш'яковий триоксид, їх солі або їх активні метаболіти. З них переважними є комплексні протиракові засоби на основі платини і протиракові засоби, одержані з рослинних алкалоїдів, а найбільш переважними є оксаліплатин, цисплатин, іринотекан, SN-38 або їх солі. Для визначення чутливості до протиракового засобу шляхом використання маркера для визначення чутливості до протиракового засобу відповідно до даного винаходу можна виміряти концентрацію білка А в зразку. В цьому випадку приклади зразка включають біологічний зразок, одержаний в індивідуума, який страждає на рак (пацієнта, який страждає на рак), такого як кров, сироватка, плазма, зразок біопсії ракової тканини, препарат, одержаний при резекції ракової пухлини, випорожнення, сеча, асцитична рідина, плевральна рідина, спинномозкова рідина або мокрота. Особливо переважна сироватка. Крім того, приклади раку-мішені при здійсненні даного винаходу включають рак губ, ротової порожнини і гортані, типовими представниками якого є рак ураження гортані; рак ураження шлунково-кишкового тракту, типовими представниками яких є рак стравоходу, рак шлунка і рак ободової і прямої кишок; рак ураження дихальних органів і органів грудної порожнини, типовим представником яких є рак легенів; рак ураження кісток і суглобового хряща; злоякісна меланома, плоскоклітинна карцинома шкіри і інший рак шкіри; рак ураження мезотеліальної і м'якої тканини, типовим представником яких є мезотеліома; рак ураження жіночих статевих органів, типовими представниками яких є рак молочних залоз, рак матки і рак яєчників; рак ураження чоловічих статевих органів, типовим представником яких є рак передміхурової залози; рак ураження сечовивідних шляхів, типовим представником яких є рак сечового міхура; рак ураження очей, мозку і центральної нервової системи, типовим представником яких є рак мозку; рак щитовидної залози і інші раки ураження ендокринної системи; рак ураження лімфоїдної тканини, гематопоетичної тканини і суміжної тканини, типовими представниками яких є неходжкінська лімфома, лімфолейкоз; і метастатичні раки ураження, первинними вогнищем яких є вказані вище види раку. Особливо, даний винахід підходить для застосування при раку шлунка і раку ободової і прямої кишок. Концентрація білка А може бути виміряна таким способом вимірювання як SELDI-TOF MS, спосіб імунологічного вимірювання або тому подібне. Вимірювання SELDI-TOF MS може виконуватися способом, описаним нижче в розділі "Приклади". Крім того, як способу імунологічного вимірювання перевагу віддають способу імунологічного вимірювання з використанням антитіла проти білка А. Антитіло, яке підлягає застосуванню проти білка А, може являти собою моноклональне антитіло або поліклональне антитіло. Конкретніше, як приклад можна назвати радіоімуноаналіз, ферментний імуноаналіз, люмінесцентний імуноаналіз, імунопреципітацію, імунофелометрію, вестерн-блотинг, імунне фарбування і імунодифузію. Переважний вестерн-блотинг або ферментний імуноаналіз, а особливо переважний вестерн-блотинг або ферментний імуносорбентний аналіз (ELISA) (наприклад, сандвіч ELISA). Для визначення чутливості до протиракового засобу-мішені вимірюється концентрація білка А в біологічному зразку, одержаного у хворого на рак перед введенням протиракового засобу. У 5 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 60 випадку, коли визначається, що концентрація білка А вища, ніж задана стандартна концентрація, може бути визначено, що ракове ураження нечутливе до протиракового засобумішені. Крім того, концентрація білка А в біологічному зразку, одержаного у пацієнта, хворого на рак, вимірюється і контролюється при кожному циклі лікування, за допомогою чого можна хронологічно оцінити чутливість раку до протиракового засобу-мішені. Таким чином, білок А може використовуватися як маркер для визначення того, варто чи ні продовжувати лікування. У випадку, коли рак нечутливий до протиракового засобу-мішені, ефекту лікарського засобу чекати не можна, і під дією протиракового засобу може лише розвинутися побічний ефект. Тому, маркер для визначення чутливості до протиракового засобу згідно з даним винаходом може використовуватися як маркер для уникнення виявлення небажаного побічного ефекту або для уникнення прогресування раку і посилення побічного ефекту, викликаного неефективним тривалим лікуванням. Крім того, у випадку, коли визначається, що концентрація білка А нижча, ніж задана стандартна концентрація, можна визначити, що ракове ураження чутливе до протиракового засобу-мішені. Відповідно, білок А може також використовуватися як маркер для правильного відбору пацієнтів, в яких може очікуватися терапевтичний ефект. Крім того, коли білок А використовується як показник, можна провести скринінг протиракового засобу. Тобто, якщо in vitro після впливу речовини на різні види ліній ракових клітин, які містять білок А у високій концентрації, речовина виявляє ефект знищення клітин, то речовина являє собою протираковий засіб, ефективний також проти раку, який має низьку чутливість до комплексного протиракового засобу на основі платини, такого як оксаліплатин, одержаного з рослинного алкалоїду протиракового засобу, такого як іринотекан, або вказаним вище звичайним протираковим засобом. Крім того, якщо in vitro після введення речовини ураженій пухлиною тварині, біологічний зразок якої має білок А у високій концентрації, розвивається ефект зменшення пухлини, то речовина являє собою протираковий засіб, ефективний також проти раку, який має низьку чутливість до комплексного протиракового засобу на основі платини, такого як оксаліплатин, одержаного з рослинного алкалоїду протиракового засобу, такого як іринотекан, або вказаним вище звичайним протираковим засобом. За допомогою скринінгу з використанням білка А як показника і використання різних видів ліній ракових клітин, кожна з яких містить білок А у високій концентрації, або ураженої раком тварини, біологічний зразок якої містить білок А у високій концентрації, можна визначити, чи є речовина ефективною як протираковий засіб, який виявляє протипухлинний ефект проти форм раку, які мають низьку чутливість до комплексного протиракового засобу на основі платини, такого як оксаліплатин, одержаного з рослинного алкалоїду протиракового засобу, такого як іринотекан, або вказаним вище звичайним протираковим засобом. Значний ефект може також очікуватися з точки зору зменшення трудових і матеріальних затрат, пов'язаних з розробкою протиракового засобу. Переважне використання набору, який містить протокол для вимірювання концентрації білка А в зразку для здійснення запропонованого в даному винаході способу визначення чутливості до протиракового засобу. Набір містить реагент для вимірювання концентрації білка А, інструкції по застосуванню реагенту для вимірювання, стандарт для визначення наявності або відсутності чутливості до протиракового засобу і тому подібне. Стандарт стосується стандартної концентрації білка А, концентрації, яка визначається як висока або низька, фактор, який впливає на результат вимірювання, ступінь впливу і тому подібне. Ці концентрації можуть бути встановлені для кожного протиракового засобу-мішені. Шляхом використання стандарту можна здійснити визначення, як описано вище. Якщо як показник використовується інігбування експресії білка А, то може проводитись скринінг агента, який підвищує чутливість до протиракового засобу. Тобто, речовина, яка інгібує експресію білка А in vitro або in vivo, підвищує чутливість до протиракового засобу. Наприклад, in vitro речовина, яка знижує концентрацію білка А в різних видах ліній ракових клітин за відсутності або в присутності протиракового засобу, являє собою речовину, яка підвищує чутливість до протиракового засобу (агент, який підвищує чутливість до протиракового засобу). Крім того, in vivo в ураженої раком тварини, речовина, яка посилює зниження концентрації білка А перед або під час введення протиракового засобу, являє собою речовину, яка підвищує чутливість до протиракового засобу (агент, який підвищує чутливість до протиракового засобу). Якщо одержаний таким чином агент, який підвищує чутливість до протиракового засобу, і протираковий засіб як мішень підвищення чутливості використовуються в комбінації, терапевтичний ефект протиракового засобу різко поліпшується. Форма комбінації агента, який підвищує чутливість до протиракового засобу, і протиракового засобу як мішені підвищення чутливості може являти собою композицію, яка містить компоненти обох засобів, або може 6 UA 101492 C2 5 10 15 20 25 30 являти собою комбінацію окремих препаратів. Крім того, ці компоненти можуть вводитися різними шляхами. Протираковий засіб-мішень, використаний при здійсненні даного винаходу, такий же, як описаний вище, а саме, оксаліплатин, циклофосфамід, іфосфамід, тіотепа, мелфалан, бусульфан, німустин, ранімустин, дакарбазін, прокарбазін, темозоломід, цисплатин, карбоплатин, недаплатин, метотрексат, пеметрексед, фторурацил, тегафул/урацил, доксифлуридін, тегафул/гімерацил/отерацил, капецитабін, цитарабін, еноцитабін, гемцитабін, 6меркаптопурін, фулударабін, пентостатин, кладрибін, гідроксисечовина, доксорубіцин, епірубіцин, даунорубіцин, ідарубіцин, пірарубіцин, мітоксантрон, амурубіцин, актиноміцин D, блеоміцин, пеплеоміцин, мітоміцин С, акларубіцин, зиностатин, вінкристин, віндезін, вінбластин, вінорелбін, паклітаксел, доцетаксел, іринотекан, активний метаболіт іринотекану (SN-38), ногітекан (топотекан), етопозид, преднізолон, дексаметазон, тамоксифен, тореміфен, медроксипрогестерон, анастрозол, ексеместан, летрозол, ритуксимаб, іматиніб, гефітиніб, гемтузумаб, озогаміцин, бортезоміб, ерлотиніб, цетуксимаб, бевацизумаб, сунитиніб, сорафеніб, дасатиніб, панітумумаб, аспарагіназа, третиноін, миш'яковий триоксид, їх солі або їх активні метаболіти. З них переважними є комплексні протиракові засоби на основі платини і протиракові засоби, одержані з рослинних алкалоїдів, а особливо переважаючі оксаліплатин, цисплатин, іринотекан, SN-38 або їх солі. Приклади Далі даний винахід детальніше описаний у вигляді прикладів. Приклад 1 (1) Спосіб (а) Використовувані клітини 11 видів ліній клітин раку ободової і прямої кишок людини (COLO201, COLO205, COLO320, DLD-1, HCT-15, HT-29, LS174T, SW480, SW620, SW1116 і WiDR) були одержані з наступних джерел (таблиця 1). Культивування виконували в чашці для культури тканини діаметром 100 мм (IWAKI) для прикріплених до субстрату клітин і в необробленій чашці діаметром 100 мм (IWAKI) для суспензованих клітин шляхом використання середовища (RPMI 1640, 2 мМ глутаміну, 10 % фетальна теляча сироватка) при 37 °C в атмосфері 5 % СО2. Таблиця 1 11 видів ліній клітин раку ободової і прямої кишок людини Банк з якого Номер джерела Назва лінії Організація депонування (або Номер лоту або одержана лінія або тому клітини виробник) тому подібного клітин подібного Health Science Research COL0201 JCRB Resources Bank, Japan Health JSRB0226 11252003 Sciences Foundation Cell Resource Center for Biomedical Research, Institute of COL0205 TKG TKG0457 I-4439 Development, Aging and Cancer, Tohoku University COL0320 RCB RIKEN BioResourse Center RSB1193 003 Dainippon Sumitomo Pharma DLD-1 ECACC EC-90102540 00/J/025 Co., Ltd.) Cell Resource Center for Biomedical Research, Institute of HTC-15 TKG TKG0504 I-4608 Development, Aging and Cancer, Tohoku University Dainippon Sumitomo Pharma HT-29 ECACC EC-91072201 04/I/004 Co., Ltd.) Cell Resource Center for Biomedical Research, Institute of LS174T TKG TKG0406 I-4468 Development, Aging and Cancer, Tohoku University 7 UA 101492 C2 Продовження таблиці 1 SW480 SW620 15 20 25 30 35 40 45 ECACC WiDR 10 ATCC SW1116 5 ECACC ECACC Dainippon Sumitomo Pharma Co., Ltd.) Summit Pharmaceuticals International Corporation) Dainippon Sumitomo Pharma Co., Ltd.) Dainippon Sumitomo Pharma Co., Ltd.) EC-87092801 02/A/030 CCL-227 2324584 EC-87071006 02/A/063 EC-85111501 00/H/001 (b) Лікарський препарат Оксаліплатин (L-OHP) у вигляді насипного порошку був одержаний у компанії Yakult Honsha, Co., Ltd. (с) Оцінка чутливості до оксаліплатину Після впливу на кожну клітинну лінію від 0 до 1000 мкмоль/л оксаліплатину протягом 48 TM годин оцінювали виживаність клітин аналізом MTS (CellTiter96 AQueous One Solution Cell Proliferation Assay, Promega, клітинний титр в одному розчині для аналізу клітинної проліферації). Потім розраховували величину IC50 (концентрацію, при якій число клітин пригнічується до 50 % відносно числа в ямці, не обробленій оксаліплатином) і використовували як показник чутливості кожної клітинної лінії до оксаліплатину. Оцінку чутливості проводили 4 рази з клітинами, які мають різні номери пасажу, і розраховували середню величину і величину її стандартного відхилення. (d) Екстракція внутрішньоклітинного білка Середовище збирали з чашки, прикріплені до підкладки клітини три рази промивали крижаним PBS (соєвим розчином з фосфатним буфером) і потім збирали, зіскрібаючи гумовим шпателем. Суспензійні клітини промивали три рази з повторним центрифугуванням і суспендуванням в PBS. Одержану таким чином клітинну суспензію переносили в мікропробірку ємністю 1,5 мл; клітинну суспензію центрифугували при 4 °C і 1200 × g протягом 10 хвилин для збору клітин; після вилучення супернатанту до них додавали 400 мкл буфера для лізису клітин (9 моль/л сечовини, 2 % CHAPS (3-((3-холамідопропіл)диметиламоніо)-1-пропансульфонової кислоти), 1 мМ DTT (дитіотрейтолу), суміш інгібітору протеази (Sigma)); клітину піддавали обробці ультразвуком в умовах охолодження льодом; суспензію центрифугували при 4 °C і 16000 × g протягом 20 хвилин; супернатант швидко заморожували рідким азотом, і одержаний в результаті заморожений супернатант зберігали при -80 °C до аналізу. Частину супернатанту використовували для виконання кількісного аналізу білка (набір для аналізу білка DC Protein Assay Kit, Bio-Rad). (е) Одержання зразка для аналізу експресії білка чипом ProteinChip і аналізу експресії внутрішньоклітинного білка Концентрацію білка в зразку доводили до 5 мг/мл буфером для лізису клітин (вилучаючи інгібітор протеази) і потім концентрацію білка доводили до 1 мг/мл буфером розбавлення/промивання (буфер, який містить 50 мМ ацетат натрію) (який далі називається буфером), який має рН 4,5. 100 мкл зразка з доведеною концентрацією білка наносили на кожну пляму катіонно-обмінного мікрочипу Proteinchip (CM10 Bio-Rad), який був заздалегідь оброблений таким же буфером з подальшою реакцією інкубацією протягом 1 години. Після цього пляму промивали три рази буфером і двічі споліскували водою високого ступеню очищення milli-Q. Після сушіння повітрям 0,5 мкл поглинаючої енергії молекули (ЕАМ: насичений розчин синапінової кислоти в розчині 50 % ACN (ацетонітрилу)/0,5 % TFA (трифтороцтової кислоти)) наносили двічі окремо на кожну пляму. Після сушіння поверхні плями виконували аналіз мікрочипу Proteinchip. Експресію білка аналізували мас-спектрометром з поверхнево посиленою лазерною десорбцією/час протікання іонізації (SELDI-TOF MS). Як аналізатор використали зчитувальний пристрій чипу ProteinChipTM Reader (Model PBSIIC, Bio-Rad). Аналіз виконували в наступних умовах: діапазон оптимізації відношення маси до заряду (m/z) від 2000 до 30000 дальтон; інтенсивність лазера 220; чутливість детектора 8; і всього 104 дози на зразок. Екстракцію піка, що дорівнює відношенню сигналу до шуму (відношення S/N) 5 або більш, і порівняння експресії білка виконували з використанням програмного забезпечення обробки даних TM CiphergenExpress Data Manager 3.0. 50 8 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 (f) Аналіз кореляції між експресією білка і чутливістю до оксаліплатину Зв'язок між величиною IC50 і максимальною інтенсивністю кожної лінії клітин аналізували для всіх білкових піків, виявлених SELDI-TOF MS. Аналіз лінійної регресії виконували відносно зв'язку між величиною логарифма величини IC50 і максимальної інтенсивності. Білок, який має пік, який відповідає наступним зв'язкам, вибирали як білок, перспективний відносно зв'язку з 2 чутливістю до оксаліплатину: величина Р0,5. Аналіз кореляції і аналіз лінійної регресії виконували з використанням програмного забезпечення SPSS 15.0J для Windows (зареєстрована торгова марка) (версія 15.0.1). (2) Результати (а) Оцінка чутливості до оксаліплатину 11 видів ліній клітин раку ободової і прямої кишок Величина IC50 кожної клітинної лінії склала від 0,84±0,20 до 29,7±13,6 мкМ, і був встановлений широкий діапазон чутливості (фіг. 1). (b) Аналіз експресії білка Усього було виявлено 42 піка аналізом експресії з використанням SELDI-TOF MS в наведених вище умовах. (с) Аналіз кореляції між експресією білка і чутливістю до оксаліплатину За допомогою кореляційного аналізу і аналізу лінійної регресії було виявлено, що пік, виявлений при m/z від 11000 до 11100, має значну кореляцію з чутливістю до оксаліплатину (величина IC50) (фіг. 2 і фіг. 3). Приклад 2 (1) Спосіб Як клітини використовували 7 видів ліній клітин раку ободової кишки людини (DLD-1, HCT15, HT-29, LS174T, SW480, SW620 і WiDR), а як лікарський препарат використовували цисплатин (дихлорид цисдіамінплатини (II), SIGMA). Виживаність клітин після впливу від 0 до 1000 мкмоль/л цисплатину протягом 48 годин оцінювали аналізом MTS таким же чином, як в прикладі 1, і розраховували величину IC50. Екстракцію внутрішньоклітинного білка, аналіз експресії білка і аналіз кореляції між експресією білка і чутливістю до цисплатину (CDDP) виконували таким же чином, як в прикладі 1. (2) Результати (а) Оцінка чутливості до цисплатину в 7 видів ліній клітин раку ободової і прямої кишок людини Величина IC50 кожної лінії клітин становила від 3,33±0,80 до 26,9±11,6 мкМ, і був встановлений широкий діапазон чутливості. (b) Аналіз кореляції між експресією білка і чутливістю до цисплатину За допомогою кореляційного аналізу і аналізу лінійної регресії було встановлено, що пік, виявлений при m/z від 11000 до 11100, виявив тенденцію кореляції з чутливістю до цисплатину (величина IC50) (фіг. 4). Крім того, на основі фармакокінетичних параметрів загальної платини TM під час введення цисплатину (ін'єкція Briplatin , проміжна форма), коли відразу вводилася 2 максимальна доза (100 мг/м ) при клінічному застосуванні цисплатину, його розрахована максимальна концентрація в крові (Cmax) становила близько від 9,5 до 11,0 мкМ (розрахована, 2 коли площа поверхні тіла жителя Японії була встановлена на рівні від 1,50 до 1,73 м ). Тому, величина відсічки була встановлена на 10 мкМ для величини IC50 кожної лінії ракових клітин відносно цисплатину, і лінії ракових клітин класифікували на дві групи: групу з високою чутливістю і групу з низькою чутливістю. В результаті, було значне збільшення максимальної інтенсивності піка, виявленого при m/z від 11000 до 11100 в групі низької чутливості (фіг. 5). Приклад 3 (1) Спосіб Як клітини використовували 5 видів ліній клітин раку ободової і прямої кишок людини (COLO320, HCT-15, HT-29, LS174T, HCT116 (HCT116 одержували з ECACC)), а як лікарський препарат використовували активний метаболіт іринотекану (SN-38, одержаний від компанії Yakult Honsha, Co., Ltd.). Виживаність клітин після впливу від 0 до 1000 нмоль/л SN-38 протягом 72 годин оцінювали аналізом MTS таким же чином, як в прикладі 1, і розраховували величину IC50. Екстракцію внутрішньоклітинного білка і одержання зразка для аналізу за допомогою чипу ProteinChip виконували таким же чином, як в прикладі 1. Для аналізу використали зчитувальний TM пристрій чипу ProteinChip Reader (модель PCS4000, персональний випуск, Bio-Rad) і аналіз виконували в наступних умовах: діапазон маси від 0 до 70000 дальтон; маса фокусу 11000 дальтон; енергія 3000 нДж; і всього 265 доз на зразок. Аналіз експресії білка виконували з TM використанням програмного забезпечення обробки даних CiphergenExpress Data Manager 3.0. 60 9 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 (2) Результати (а) Оцінка чутливості до SN-38 у 5 видів ліній клітин раку ободової і прямої кишок людини Величина IC50 кожної лінії клітин становила від 3,39 до 33,7 нМ, і був встановлений широкий діапазон чутливості. (b) Аналіз кореляції між експресією білка і чутливістю до SN-38 TM На основі фармакокінетичних параметрів SN-38 (Campto , проміжна форма) розрахована площа під кривою концентрації SN-38 в крові (AUCSN-38), одержаної після першого введення 2 іринотекану схеми лікування раку ободової кишки (180 мг/ м / день), становила 1,449 нмольгод./л. По розрахункам концентрація SN-38, необхідна для одержання однакового кількісного впливу протягом всього використаного в даному прикладі 72-часового впливу, становила 20 нМ. Тому, величина відсічки була встановлена на 20 нМ для величини IC50 SN-38 для кожної лінії ракових клітин, і лінії ракових клітин класифікували на дві групи: групу з високою чутливістю і групу з низькою чутливістю. В результаті, було значне збільшення максимальної інтенсивності піка, виявленого при m/z від 11000 до 11100 в групі з низькою чутливістю (фіг. 6). Приклад 4 Для дослідження властивості білка, виявленого у вигляді піка при m/z від 11000 до 11100 (білок А1) в прикладі 1, досліджували зміну максимальної інтенсивності, пов'язаної зі зміною рН, і те, можна було виявити білок А1 чи ні в мікрочипі ProteinChip, поверхня якого була піддана хімічній модифікації, відмінній від модифікації мікрочіпу СМ10. (1) Спосіб (а) Мікрочип ProteinChip і буферні умови, використані для дослідження Наступні 15 видів буферів використовували для катіонно-обмінного мікрочипу Proteinchip (CM10, Bio-Rad) і аніонно-обмінного мікрочипу Proteinchip (Q10 Bio-Rad): рН 3,0 (50 нМ буфера гліцину-HCl); рН 3,5 (50 мМ буфера ацетат натрію): рН 4,0 (50 мМ буфера ацетат натрію); рН 4,5 (50 мМ буфера ацетат натрію); рН 5,0 (50 мМ буфера ацетат натрію); рН 5,5 (50 мМ буфера ацетат натрію); рН 6,0 (50 мМ фосфатного буфера); рН 6,5 (50 мМ фосфатного буфера); рН 7,0 (50 мМ фосфатного буфера); рН 7,5 (50 мМ фосфатного буфера); рН 8,0 (50 мМ буфера TrisHCl); рН 8,5 (50 мМ буфера Tris-HCl); рН 9,0 (50 мМ буфера гліцину-NaOH); рН 9,5 (50 мМ буфера гліцину-NaOH); і рН 10,0 (50 мМ буфера гліцину-NaOH). Для мікрочипу афінного захоплення іммобілізованого металу ProteinChip (IMAC30, Bio-Rad) використали сольовий розчин з фосфатним буфером (PBS). (b) Одержання зразка для аналізу з використанням мікрочипів CM10 і Q10 і умовами аналізу Одержання зразка для аналізу з використанням мікрочипів CM10 і Q10 і продукції білкових мікрочипів проводили з використанням кожного з буферів, вказаних в пункті (а), і відповідно до пункту (е) розділу "(1) Спосіб" в прикладі 1. Слід зазначити, що як аналізатор використовували TM зчитувальні пристрої ProteinChip Reader (модель PCS4000, персональний випуск, Bio-Rad) і аналіз виконували за наступних умов: діапазон маси від 0 до 70000 дальтон; маса фокусу 11000 дальтон; енергія 3000 нДж; і всього 265 доз на зразок. (с) Одержання зразка для аналізу з використанням мікрочипу IMAC30 і умови аналізу Поверхню плями мікрочипу IMAC30 активували 50 мМ NiSO4 і однократно промивали надочищеною водою, пропущеною через міліпоровий фільтр Q. Потім плями заздалегідь обробляли PBS. Підготовку зразка і нанесення зразка на поверхню чипу і подальші процедури проводили з використанням PBS, описаного в пункті (а) як буфер, і відповідно до пункту (е) розділу "(1) Спосіб" в прикладі 1. Слід зазначити, що як аналізатор використовували зчитувальні TM пристрої ProteinChip Reader (модель PCS4000, персональний випуск, Bio-Rad) і аналіз виконували в наступних умовах: діапазон маси від 0 до 70000 дальтон; маса фокусу 11000 дальтон; енергія 6000 нДж; і всього 265 доз на зразок. (2) Результати Було встановлено, що пік перспективного білка, виявленого у вигляді піка при m/z від 11000 до 11100 в прикладі 1, за таких умовах аналізу, де використовувався чіп CM10 і рН становив 4,5, різко знижувався при рН від 7,0 до 7,5 і в мікрочипі CM10 і мікрочипі Q10. За оцінками ізоелектрична точка (pI) перспективного білка становила від 7,0 до 7,5. Крім того, перспективний білок був також виявлений в мікрочипі IMAC30, поверхня чипу якого активувалася NiSO4. Приклад 5 (Ідентифікація перспективного білка А1) (1) Оцінка молекулярної маси перспективного білка А1 Шляхом використання як калібраторів бичачого інсуліну (5733,51 Да) і кінського цитохрому з (12360,96 Да), молекулярна маса яких була відома, зразок екстрагованого внутрішньоклітинного білка піддавали внутрішньому калібруванню використанням SELDI-TOF MS за таких же умов аналізу (мікрочип CM10 і 50 мМ буфера ацетат натрію, рН 4,5), як при аналізу експресії білка. В 10 UA 101492 C2 5 10 15 20 25 30 35 40 45 50 55 60 результаті, за оцінкою, молекулярна маса піка перспективного білка А1 становила 11072 Да (фіг. 7). (2) Очищення і ідентифікація перспективного білка А1 (Очищення) Для очищення і ідентифікації перспективного білка А1 внутрішньоклітинні білки екстрагували з двох ліній клітин, лінії клітин НТ-29, яка експресує високий рівень перспективного білка, і лінії клітин COLO320, яка експресує низький рівень перспективного білка, в той же спосіб, як при аналізу експресії. Обидва зразки в рівній кількості брали на основі результату кількісного визначення білка і осадження TCA. Після цього зібрані осади промивали крижаним розчинником етанолом/простим ефіром і сушили при кімнатній температурі. Лізисний буфер IEF (6 М сечовини, 2 М тіосечовини, 3 % CHAPS, 1 % Triton X-100, реагент DeStreak, GE Healthcare) додавали до осадів і одержану суміш перемішували при кімнатній температурі з подальшою обробкою ультразвуком. Одержаний зразок розчину IEF центрифугували і супернатант наносили на суху смужку гелю Immobiline (рН від 3 до 10, нелінійний, 13 см, GE Healthcare). Гель набухав, і потім виконували ізоелектричне фокусування (5000 В, 15 год.). Після завершення ізоелектричного фокусування суху смужку гелю Immobiline врівноважували в буфері зразка для двовимірного електрофорезу (6 М сечовини, 20 % гліцерин, 2 % DTT, 2 % SDS (додецилсульфат натрію), 100 мМ Tris-HCl, рН 8,8). Врівноважену суху смужку геля Immobiline піддавали електрофорезу при постійному струмі 25 мА. Як гель використовували поліакриламідний градієнтний гель (градієнт від 10 до 18 %, 16×16 см (BIO CRAFT)). Гель після електрофорезу забарвлювали CBB G-250 і знебарвлювали 5 % оцтовою кислотою. Зображення двовимірного електрофорезу одержуваливізуалізуючим денситометром, каліброваним GS-800 (Bio-Rad), і зображення аналізували програмним забезпеченням PDQuest (Bio-Rad). Потім виконували аналіз для порівняння. (Ідентифікація) На основі інформації про перспективний білок А1 (молекулярна маса: 11072, pI: від 7,0 до 7,5), одержаної аналізом SELDI-TOF MS з використанням ProteinChip, мішенню були плями, присутні на гелі, виявленому двовимірним електрофорезом, і в наступному діапазоні: молекулярна маса від 10 до 15 кДа і рI близько від 6,5 до 8,0 (поблизу нейтрального рН). З цих плям були вибрані 4 плями, що виявляють високий рівень експресії в НТ-29, в порівнянні з COLO320 (фіг. 8). Ці плями вирізали, і білки переварювали трипсином в гелі відповідно до відомого способу. Після цього білки аналізували (вимірювання MS/MS) з використанням рідинної хроматографії/мас-спектрометрії часу протікання захоплення іонів (LCMS-IT-TOF, Shimadzu), і одержані результати були піддані пошуку в базі даних MASCOT. З підданих аналізу 4 плям білок А1 (молекулярна маса 11072, pI: 7,3), ідентифікований плямою 4, яка ілюструється на фіг. 8, відповідав результату, одержаному аналізом SELDI-TOF MS (молекулярна маса: 11072, pI: від 7,0 до 7,5). З вище вказаних перспективний білок А1, який виявив кореляцію з чутливістю до оксаліплатину і був виявлений у вигляді піка, який виявляє m/z від 11000 до 11100, був ідентифікований у вигляді S100A10 (S100 зв'язуючий кальцій білок А10, легкий ланцюг Калпактину-1, легкий ланцюг Калпактину I, білок р10, р11, Клітинний ліганд анексину II). Приклад 6 (S100A7 і S100A8) Зразок екстрагованого внутрішньоклітинного білка з лінії ракових клітин аналізували з використанням мікрочипу СМ10 і буфера 50 мМ Tris-HCl (рН 8,0) в таких же умовах, які вказані в пункті (е) розділу "(1) Спосіб" в прикладі 1. В результаті, були виявлені два білкових піка, пов'язані з чутливістю до оксаліплатину, тобто піка білка А2 і білка А3. Інтенсивність піка білка А2 виявила значну кореляцію з чутливістю до оксаліплатину (L-OHP) (величина IC50) кожної лінії ракових клітин (фіг. 9). Крім того, на основі величини IC50 кожної лінії клітин по відношенню до оксаліплатину лінії ракових клітин класифікували на дві групи: групу високої чутливості і групу низької чутливості при величині відсічки 5,0 мкМ, яка грубо відповідала максимальній концентрації в крові під час клінічного застосування оксаліплатину. В результаті, було значне збільшення інтенсивності піка білка А3 в групі низької чутливості (фіг. 10). Потрібно зазначити, що клітинна лінія LS174T була виключена з мішень аналізу, тому що відношення S/N становило менше ніж 5. Піки білка А2 і білка А3 були присутніми поблизу піка S100A10. Калібрування виконували шляхом використання бичачого інсуліну (5733,51 Да) і кінського цитохрому с (12360,96 Да) як калібраторів. В результаті, передбачалося, що білок А2 мав молекулярну масу 10835 Да, і що білок А3 мав молекулярну масу 11340 Да. 11 UA 101492 C2 5 10 15 20 25 30 35 40 Як і в прикладі 2, шляхом використання кожного з 15 видів буферів, які мають рН від 3,0 до 10,0, і кожних з мікрочипу СМ10 і мікрочипу Q10, зміну інтенсивності кожного піка аналізували SELDI-TOF MS. В результаті, пік з молекулярною масою 10835 Да значно зменшився при рН від 6,5 до 7,0, і пік з молекулярною масою 11340 Да різко збільшився при рН від 6,0 до 6,5, за допомогою чого, за оцінками, pI становив відповідно від 6,5 до 7,0 і від 6,0 до 6,5. На основі цих результатів пошук цих білків в базі даних (Expasy TagIdent tool:http://www. expasy. Ch/tools/tagident.html). В результаті було виявлено, що пік, який виявляє молекулярну масу 10835 Да, являє собою S100A8 (S100 зв'язуючий кальцій білок А8, Калгранулін-А, пов'язаний з інгібуючим міграцію фактором білком 8, MRP-8, р8 або тому подібні), і було виявлено, що пік, який виявляє молекулярну масу 11340 Да, являв собою S100A7 (S100 зв'язуючий кальцій білок А7, Псоріазін) (фіг. 11). Порівняльний приклад 1 Як в прикладі 6, пік, який за оцінкою SELDI-TOF MS являв собою S100A9, який має молекулярну масу 13242, досліджували для виявлення зв'язку з чутливістю до оксаліплатину. В результаті, не було значного зв'язку між рівнем експресії S100A9 і чутливістю до оксаліплатину (фіг. 12). Відповідно, було виявлено, що немає зв'язку між S100A9 і чутливістю до протиракового засобу. Приклад 7 1) Спосіб З клітин НТ-29, які експресують високий рівень піка, виявленого при m/z від 11000 до 11100, і клітин COLO320, які експресують низький рівень піка, внутрішньоклітинні білки екстрагували таким же способом, як в прикладі 1. 10 мкг білків наносили на кожну смугу 16,5 % поліакриламідного гелю і SDS-PAGE (електрофорез в поліакриламідному гелі з додецилсульфатом натрію) виконували при постійній напрузі 100 В. Після електрофорезу виконували блотинг білків на мембрані PVDF (полівініліденфториду) з використанням пристрою сухого блотингу (iBlotTM, Invitrogen). Після проведення блокування S100A10 і ендогенний білок взаємодіяли відповідно з первинними антитілами, тобто моноклональним антитілом проти S100A10 (очищене мишаче моноклональне антитіло проти легкого ланцюга анексину II, BD Transduction Laboratories) і з моноклональним антитілом проти GAPDH (гліцеральдегід-3фосфат дегідрогенази) (Ambion) з подальшою взаємодією з вторинним антитілом, міченим лужною фосфатазою антитілом проти мишачого IgG. Потім додавали хемілюмінесцентний TM субстрат CDP-Star як субстрат реакції і люмінесценцію виявляли аналізатором люмінесцентних зображень (LAS-4000mini, FUJIFILM). Як блокуючий реагент використовували вторинне антитіло і субстрат реакції, включені в набір для імунного виявлення Chemiluminescent TM Western Blot Immunodetection Kit (WesternBreeze , Invitrogen). (2) Результат Експресії клітин S100A10 і HT-29, які експресують високий рівень піка, які були виявлені при m/z від 11000 до 11100 при аналізу білкової експресії з використанням мікрочипу ProteinChip (приклад 1), і клітин COLO320, які експресують низький рівень піка, були підтверджені вестернблотингом з використанням моноклонального антитіла проти S100A10 (фіг. 13). ФОРМУЛА ВИНАХОДУ 45 50 55 1. Маркер для визначення чутливості індивідуума до протиракового засобу, де вказаний маркер містить зв'язуючий кальцій білок S100A7 або S100A8, де протираковий засіб являє собою оксаліплатин, цисплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки. 2. Маркер для визначення чутливості індивідуума до протиракового засобу, де вказаний маркер містить зв'язуючий кальцій білок S100A10, де протираковий засіб являє собою оксаліплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки. 3. Спосіб визначення чутливості індивідуума до протиракового засобу, де вказаний спосіб включає вимірювання концентрації маркера для визначення чутливості до протиракового засобу за п. 1 в зразку, де протираковий засіб являє собою оксаліплатин, цисплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки. 4. Спосіб визначення чутливості індивідуума до протиракового засобу, де вказаний спосіб включає вимірювання концентрації маркера для визначення чутливості до протиракового засобу за п. 2 в зразку, де протираковий засіб являє собою оксаліплатин, іринотекан, SN-38 або їх сіль, і де індивідуум страждає на рак ободової та прямої кишки. 12 UA 101492 C2 5 5. Спосіб визначення чутливості індивідуума до протиракового засобу за п. 3 або п. 4, де зразок являє собою біологічний зразок, одержаний в індивідуума, який страждає на рак ободової та прямої кишки. 6. Спосіб визначення чутливості індивідуума до протиракового засобу за п. 3 або п. 4, де зразок являє собою біологічний зразок, одержаний в індивідуума, який страждає на рак ободової та прямої кишки і який одержував протираковий засіб. 7. Спосіб скринінгу агента, який підвищує чутливість до протиракового засобу, що включає використання як показника інгібування експресії маркера для визначення чутливості до протиракового засобу за п. 1 або 2. 13 UA 101492 C2 14 UA 101492 C2 15 UA 101492 C2 16 UA 101492 C2 17 UA 101492 C2 18 UA 101492 C2 19 UA 101492 C2 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determining the sensitivity to an anti-cancer agent
Автори англійськоюTanigawara, Yusuke, Suzuki, Sayo, Sugimoto, Shinji
Назва патенту російськоюСпособ определения чувствительности к противораковому средству
Автори російськоюТанигавара Юсуке, Сузуки Сайо, Сугимото Синдзи
МПК / Мітки
МПК: G01N 33/574, G01N 33/50, A61K 31/282, A61P 35/00
Мітки: чутливості, спосіб, протиракового, засобу, визначення
Код посилання
<a href="https://ua.patents.su/22-101492-sposib-viznachennya-chutlivosti-do-protirakovogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення чутливості до протиракового засобу</a>
Попередній патент: Пачка для виробів тютюнової промисловості
Наступний патент: Похідні азетидину та циклобутану як інгібітори jak
Випадковий патент: Порошковий дріт для електродугового напилення зносостійких покриттів