Похідні варіоліну, спосіб їх одержання (варіанти) та застосування вказаних речовин як протиракового засобу
Номер патенту: 79925
Опубліковано: 10.08.2007
Автори: Мансанарес Ігнасіо, Морріс Джонатан Чарльз, Андерсон Ріган Джеймс, Ремуіньян Модесто
Формула / Реферат
1. Сполука формули (I):
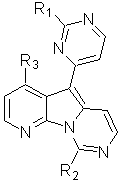 (І),
(І),
де:
кожний з R1 і R2 незалежно вибирають з групи, що включає Н, OН, OR', SH, SR', SOR', SО2R', NО2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSО2R', CN, галоген, С(=О)Н, С(=О)R', CО2H, CО2R', С1-C12 алкіл, С1-С12 галогеналкіл, C2-C12 алкеніл, C2-C12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну групу; і
R3 вибирають з групи, що включає ОН і ОМе;
де групу R' або кожну з груп R' незалежно вибирають з групи, що включає ОН, C1-C12 алкіл, C1-C12 галогеналкіл, C2-C12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну групу;
і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце;
арильна група і арильна частина аралкільної і арилалкенільної групи являють собою карбоциклічну арильну групу, що містить від 6 до 14 атомів вуглецю у карбоциклічному кільці або у двох або більше конденсованих кільцях;
аралкільна група являє собою C1-C6 алкільну групу, заміщену вказаною вище арильною групою;
арилалкенільна група являє собою С2-С6 алкенільну групу, заміщену вказаною вище арильною групою;
гетероароматична група являє собою гетероциклічну ароматичну групу, що містить від 5 до 14 атомів в одному кільці або у двох або більше конденсованих кільцях, в яких принаймні один атом у кільці вибирають з групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну групу, сконденсовану з вказаною вище арильною групою;
замісники в арильних і гетероароматичних групах і в арильній частині аралкільних і арилалкенільних груп вибирають з групи, що включає C1-C12 алкіл, C1-C12 галогеналкіл, C1-C12 алкокси, C1-C12 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)аміно, C1-C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NО2, CN і галоген;
її похідні, в яких атом азоту кватернізований,
і їх солі та складні ефіри,
за винятком сполук, в яких:
R1 і R2 означають аміно і R3 означає гідрокси.
2. Сполука за п.1, в якій R1 вибирають з групи, що включає OН, OR', SH, SR', SOR', SО2R', NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSО2R', С(=О)R', CО2H, CО2R', C1-C12 алкіл, C1-C12 галогеналкіл, де групу R' або кожну з груп R' незалежно вибирають з групи, що включає ОН, C1-C12 алкіл, C1-C12 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси, C1-С6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)аміно, NО2, CN і галогену), аралкіл або арилалкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-C6 алкокси, C1-С6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-C4 алкіл)аміно, NО2, CN і галогену), і в якій, коли група R1 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членне гетероциклічне кільце.
3. Сполука за п.1, в якій R1 вибирають з групи, що включає OR', SR', SOR', NH2, NHR', N(R')2, NHCOR', N(COR')2 і NHSO2R', де групу R' або кожну з груп R' незалежно вибирають з групи, що включає C1-C6 алкіл, C1-C6 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси і галогену), аралкіл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-C6 алкокси і галогену), аралкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-C6 алкокси і галогену), і в якій, коли група R1 являє собою групу формули N(R')2 або N(COR')2, дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-10-членне гетероциклічне кільце.
4. Сполука за п.1, в якій R1 вибирають з групи, що включає C1-C4 алкокси, C1-C4 алкілтіо, С1-С4 алкілсульфініл, аміно, C1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, C1-C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, C1-C4 галогеналканоїламіно, ариламіно (де арильна частина може бути необов'язково заміщена C1-C4 алкоксигрупою), бензиламіно (де фенільна частина бензильної частини може бути необов'язково заміщена C1-C4 алкоксигрупою), цинамоїламіно або дицинамоїламіно (де фенільна частина кожної цинамоїльної частини може бути необов'язково заміщена C1-C4 алкоксигрупою) або 5-7-членне азотвмісне гетероциклічне кільце, приєднане до частини молекули, яка залишилась, через його атом азоту.
5. Сполука за п.1, в якій R1 вибирають з групи, що включає метокси, тіометил, метилсульфініл, аміно, метиламіно, етиламіно, бензиламіно, ацетиламіно, трифторацетиламіно, діацетиламіно, цинамоїламіно, дицинамоїламіно, п-метоксибензиламіно та піперидино.
6. Сполука за п.1, в якій R1 вибирають з групи, що включає аміно, бензиламіно, ацетиламіно, трифторацетиламіно, діацетиламіно, цинамоїламіно, дицинамоїламіно і п-метоксибензиламіно.
7. Сполука за п.1, в якій R2 вибирають з групи, що включає OН, OR', SH, SR', SOR', SO2R', NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', C(=O)R', CO2H, CO2R', C1-C12 алкіл і C1-C12 галогеналкіл, де групу R' або кожну з груп R' незалежно вибирають з групи, що включає OН, C1-C12 алкіл, C1-C12 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси, С1-С6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)аміно, NО2, CN і галогену), аралкіл або арилалкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з С1-С6 алкілу, C1-C6 алкокси, C1-C6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)амiно, NО2, CN і галогену), і в якій, коли група R2 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членне гетероциклічне кільце.
8. Сполука за п.1, в якій R2 вибирають з групи, що включає OR', SR', SOR', NH2, NHR', N(R')2, NHCOR', N(COR')2 і NHSО2R', де групу R' або кожну з груп R' незалежно вибирають з групи, що включає C1-С6 алкіл, C1-C6 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси і галогену), аралкіл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-C6 алкілу, C1-C6 алкокси і галогену), аралкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-С6 алкокси і галогену), і в якій, коли група R2 являє собою групу формули N(R')2 або N(COR')2, дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-10-членне гетероциклічне кільце.
9. Сполука за п.1, в якій R2 вибирають з групи, що включає С1-С4 алкокси, C1-C4 алкілтіо, C1-C4 алкілсульфініл, аміно, C1-C4 алкіламіно, ді(C1-C4 алкіл)аміно, C1-C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, C1-C4 галогеналканоїламіно, ариламіно (де арильна частина може бути необов'язково заміщена C1-С4 алкоксильною групою), бензиламіно (де фенільна частина бензильної частини може бути необов'язково заміщена C1-C4 алкоксильною групою), цинамоїламіно або дицинамоїламіно (де фенільна частина кожної цинамоїльної частини може бути необов'язково заміщена C1-C4 алкоксильною групою) і 5-7-членне азотвмісне гетероциклічне кільце, приєднане до частини молекули, яка залишилась, через його атом азоту.
10. Сполука за п.1, в якій R2 вибирають з групи, що включає тіометил, метилсульфініл, аміно, метиламіно, етиламіно, ацетиламіно, діацетиламіно, цинамоїламіно і п-метоксибензиламіно.
11. Сполука за п.1, в якій R2 вибирають з групи, що включає аміно, ацетиламіно, діацетиламіно і п-метоксибензиламіно.
12. Сполука за п.1, в якій R3 означає ОН.
13. Сполука за п.1, в якій R3 означає ОМе.
14. Сполука за будь-яким з пп.1-13, що має протипухлинну активність, для одержання фармацевтичної композиції.
15. Сполука за будь-яким з пп.1-13, що має протипухлинну активність, яка придатна для лікування або профілактики раку.
16. Сполука за будь-яким з пп.1-13, що має протипухлинну активність, придатна для одержання фармацевтичної композиції для лікування або профілактики раку.
17. Сполука наступної формули:
 ,
,
що являє собою сполуки з номерами, вказаними у наведеній нижче таблиці, в якій R1, R2, R3 мають значення, вказані у таблиці:
№ сполуки
R1
R2
R3
13
SMe
SMe
OMe
14
SOMe
SOMe
OMe
15
NHPMB
NHPMB
OMe
16
NHPMB
NHPMB
OH
19
SMe
SMe
H
20
SOMe
SOMe
H
23a
N(Ac)2
NH2
H
23b
N(Ac)2
NHAc
H
23c
N(Ac)2
N(Ac)2
H
23d
NHAc
NH2
H
23e
NHAc
NHAc
H
24a
N(цинамоїл)2
NH2
H
24b
N(цинамоїл)2
NH-цинамоїл
H
25
NHSO2Me
NH2
H
26
NHCOCF3
NH2
H
27
OMe
NH2
H
28d
NHBn
NH2
H
28b
NHEt
NH2
H
28a
піперидиніл
NH2
H
28c
NMeBu
NH2
H
29
NHPMB
NHPMB
H
де Ме означає метил, Еt – етил, Bu – бутил, Ac – ацетил і NHPMB – п-метоксибензиламіно.
18. Сполука за п.17, що має протипухлинну активність, для одержання фармацевтичної композиції.
19. Сполука за п.17, що має протипухлинну активність, яка придатна для лікування або профілактики раку.
20. Сполука за п.17, що має протипухлинну активність, придатна для одержання фармацевтичної композиції для лікування або профілактики раку.
21. Спосіб одержання сполуки формули (І):
 (І),
(І),
де:
R1 і R2 незалежно вибирають з групи, що включає Н, OН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, C(=O)Н, C(=O)R', СO2Н, CO2R', C1-C12 алкіл, C1-C12 галогеналкіл, C2-C12 алкеніл, C2-C12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну групу, і
R3 вибирають з групи, що включає OН і ОМе;
де групу R' або кожну з груп R' незалежно вибирають з групи, що включає ОН, C1-C12 алкіл, C1-C12 галогеналкіл, C2-C12 алкеніл, C2-C12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну групу;
і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або двi групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце;
арильна група і арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну групу, що має від 6 до 14 атомів вуглецю у карбоциклічному кільці або у двох або більше конденсованих кільцях;
аралкільна група являє собою C1-C6 алкільну групу, заміщену вказаною вище арильною групою;
арилалкенільна група являє собою С2-С6 алкенільну групу, заміщену вказаною вище арильною групою;
гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або у двох або більше конденсованих кільцях, в яких принаймні один атом у кільці вибирають з групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну групу, сконденсовану з вказаною вище арильною групою;
замісники в арильних і гетероароматичних групах і в арильній частині аралкільних і арилалкенільних груп вибирають з групи, що включає C1-C12 алкіл, C1-C12 галогеналкіл, C1-C12 алкокси, C1-C12 алкілтіо, NH2, С1-С4 алкіламіно, ді(C1-C4 алкіл)аміно, С1-C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген;
її похідних, в яких атом азоту кватернізований,
її солей і складних ефірів,
який включає циклізацію проміжної сполуки формули (II):
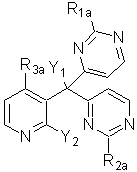 (ІІ),
(ІІ),
де:
R1a, R2a і R3a означають будь-які групи, представлені відповідно позначеннями R1, R2 і R3, і всі такі групи, в яких реакційноздатні функціональні групи захищені; і
Y1 і Y2 означають групи, які можуть бути видалені з утворенням конденсованої трициклічної піридопіролопіримідинової кільцевої структури, з одержанням сполуки формули (ІІІ):
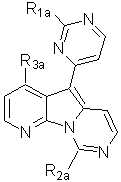 (ІІІ),
(ІІІ),
і, за необхідністю, перетворення будь-якої з груп, що позначені як R1a, R2a і R3a, у будь-яку з груп, позначених як R1, R2 і R3, відповідно.
22. Спосіб за п. 21, де Y1 означає гідроксильну групу.
23. Спосіб за пп. 21 або 22, де Y2 означає атом хлору.
24. Спосіб за будь-яким з пп. 21-23, де R1a=R2a.
25. Спосіб за п. 24, де R1a і R2a означають метилтіогрупи.
26. Спосіб за будь-яким з пп. 21-25, в якому каталізують кислотою.
27. Спосіб за будь-яким з пп. 21-26, який включає взаємодію проміжної сполуки формули (II) з триалкілсиланом формули RaRbRcSiH, де Ra, Rb і Rc можуть мати однакові або різні значення, і кожний з них являє собою С1-С12 алкільну групу.
28. Спосіб за будь-яким з пп. 21-27, в якому проміжну сполуку формули (ІІ) одержують в результаті взаємодії проміжної сполуки формули (ІV):
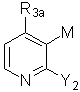 (IV),
(IV),
де R3a і Y2 мають значення, вказані у п. 21, і М означає метал, зі сполукою формули (V):
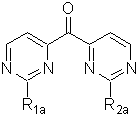 (V),
(V),
де R1a і R2a мають значення, вказані у п. 21.
29. Спосіб за будь-яким з пп. 21-27, в якому проміжну сполуку формули (II) одержують внаслідок взаємодії сполуки формули (VI):
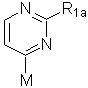 (VI),
(VI),
де R1a має значення, визначені як вказано у п. 21, і М означає метал, з проміжною сполукою формули (VII):
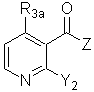 (VII),
(VII),
де R3a і Y2 мають значення, визначені як вказано у п. 21, і Z означає групу, що видаляється.
30. Спосіб за п. 21, де R1 і R2 являють собою аміногрупи і R3 має значення, вказані у п.1, який включає:
a) обробку сполуки формули (III), де R1а і R2a являють собою метилсульфініл, і R3a має значення, вказані у п. 21, сполукою формули NH2Prot, де Prot означає амінозахисну групу, з утворенням сполуки формули (III), де R1a і R2a являють собою захищену аміногрупу і R3a має значення, вказані у п. 21; і
b) видалення амінозахисної групи з утворенням сполуки формули (I), де R1 і R2 являють собою аміногрупи і R3 має значення, вказані у п. 21.
31. Спосіб за п. 21, де R1 означає метилтіо- або аміногрупу, R2 означає аміногрупу і R3 має значення, вказані у п. 21, який включає:
a) необов’язкове окислення сполуки формули (ІІІ), де R1a і R2a означають метилтіо і R3a має значення, вказані у п. 21, у сполуку формули (ІІІ), де R1a і R2a являють собою метилсульфініл; і
b) обробку сполуки формули (III), де R1a і R2a являють собою метилтіо або метилсульфініл, реагентом, вибраним з азиду натрію і аміаку.
32. Спосіб одержання сполуки формули (I):
 (I),
(I),
де:
R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну групу; і
R3 вибирають із групи, що включає ОН і ОМе;
де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну групу;
і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце;
арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну групу, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях;
аралкільна група являє собою С1-С6 алкільну групу, заміщену вищевказаною арильною групою;
арилалкенільна група являє собою С2-С6 алкенільну групу, заміщену вищевказаною арильною групою;
гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну групу, сконденсовану з вищевказаною арильною групою;
замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, С1-С4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген;
її похідних, у яких атом азоту кватернізований,
її солей і складних ефірів,
що включає нижченаведені стадії:
а) перетворення сполуки формули (VIII):
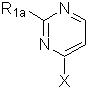 (VIII),
(VIII),
де R1а має вказані вище значення і Х означає атом галогену, у сполуку формули (VI), вказану в п. 29;
b) взаємодію сполуки формули (VI) зі сполукою формули L1-CO-L2, де L1 і L2 мають однакові або різні значення і являють собою групу, що видаляється, з утворенням сполуки формули (V), вказаної в п. 28;
с) взаємодію сполуки формули (V) зі сполукою формули (IV), вказаною в п. 28, з утворенням сполуки формули (II), вказаної в п. 21;
d) циклізацію сполуки формули (II) з утворенням сполуки формули (III), вказаної в п. 21;
е) перетворення, при необхідності, будь-яких груп, позначених як R1а, R2а і R3а, у будь-які групи, позначені як R1, R2 і R3, відповідно.
33. Спосіб одержання сполуки формули (I):
 (I),
(I),
де:
R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну групу; і
R3 вибирають із групи, що включає ОН і ОМе;
де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну групу;
і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце;
арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну групу, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях;
аралкільна група являє собою С1-С6 алкільну групу, заміщену вищевказаною арильною групою;
арилалкенільна група являє собою С2-С6 алкенільну групу, заміщену вищевказаною арильною групою;
гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну групу, сконденсовану з вищевказаною арильною групою;
замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4алкіл)аміно, С1-С4 алканоїламіно, ді(С1-С4алканоїл)аміно, NO2, CN і галоген;
її похідних, у яких атом азоту кватернізований,
її солей і складних ефірів,
що включає нижченаведені стадії:
а) перетворення сполуки формули (VIII), вказаної у п. 32, у сполуку формули (ІV), вказану у п. 29;
b) взаємодію сполуки формули (VI) зі сполукою формули (VII), вказаною у п. 29, з утворенням сполуки формули (ІІ), вказаної у п. 21;
с) циклізацію сполуки формули (II) з утворенням сполуки формули (III), вказаної в п. 21;
d) перетворення, при необхідності, будь-яких груп, позначених як R1а, R2а і R3а, у будь-які групи, позначені як R1, R2 і R3, відповідно.
34. Фармацевтична композиція, що містить ефективну кількість фармакологічно активної сполуки разом з носієм або розріджувачем, у якій вказана фармакологічно активна сполука є сполукою за будь-яким з пп.1-13 або 17.
35. Спосіб лікування або профілактики раку у ссавця, що включає введення ссавцеві, який потребує такого лікування, ефективної кількості сполуки за кожним з пп.1-13 або 17.
36. Сполука формули (I):
 (I),
(I),
де:
R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну групу; і
R3 вибирають із групи, що включає Н, ОН і ОМе;
де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну групу;
і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце;
арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну групу, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях;
аралкільна група являє собою С1-С6 алкільну групу, заміщену вищевказаною арильною групою;
арилалкенільна група являє собою С2-С6 алкенільну групу, заміщену вищевказаною арильною групою;
гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну групу, сконденсовану з вищевказаною арильною групою;
замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, С1-С4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген;
її похідні, у яких атом азоту кватернізований, її солі і складні ефіри, які мають протиракову активність,
призначені для лікування або профілактики ракових захворювань, вибраних з раку яєчника, раку нирки, раку передміхурової залози, раку молочної залози і меланоми.
37. Спосіб лікування або профілактики ракових захворювань у ссавця, вибраних з раку яєчника, раку нирки, раку передміхурової залози, раку молочної залози і меланоми, що включає введення ссавцеві, який потребує такого лікування, ефективної кількості сполуки формули (I):
 (I),
(I),
де:
R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну групу; і
R3 вибирають із групи, що включає Н, ОН і ОМе;
де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну групу;
і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце;
арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну групу, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях;
аралкільна група являє собою С1-С6 алкільну групу, заміщену вищевказаною арильною групою;
арилалкенільна група являє собою С2-С6 алкенільну групу, заміщену вищевказаною арильною групою;
гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну групу, сконденсовану з вищевказаною арильною групою;
замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, С1-С4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген;
її похідних, у яких атом азоту кватернізований, її солей і/або складних ефірів.
38. Сполука формули (II):
 (II),
(II),
де R1а, R2а, R3а, Y1 і Y2 мають значення, вказані в п. 21.
39. Сполука за п. 38, у якому Y1 означає гідроксильну групу.
40. Сполука за пп. 38 або 39, у якому Y2 означає атом хлору.
41. Сполука за будь-яким з пп. 38-40, де R1а=R2а.
42. Сполука за п. 41, у якому R1а і R2а означають метилтіогрупи.
43. Спосіб одержання сполуки формули (I):
 (I),
(I),
де:
R1 і R2 незалежно вибирають з групи, що складається з груп SCH3, SOCH3, SО2CH3, NH2 і NH (4-метоксибензил); і
R3 являє собою Н;
який включає циклізацію проміжної сполуки формули (II)
 (II),
(II),
де:
R1a і R2a являють собою SСН3, R3а являє собою водень; Y1 означає водень або гідроксильну групу; Y2 означає атом хлору;
з одержанням сполуки формули (III):
 (ІІІ),
(ІІІ),
де кожний з R1a і R2a являють собою SСН3, і R3a являє собою водень, і, при необхідності, перетворення будь-якої з груп, позначених як R1a і R2a, в будь-яку з груп, позначених як R1 і R2 в формулі (I), відповідно.
44. Спосіб за п. 43, де Y1 означає гідроксильну групу.
45. Спосіб за п. 43, в якому каталізують кислотою.
46. Спосіб за п. 43, який включає взаємодію проміжної сполуки формули (II) з триетилсиланом.
47. Спосіб за п. 43, в якому проміжну сполуку формули (II) одержують внаслідок взаємодії проміжної сполуки формули (VI):
 (VI),
(VI),
де R1a являють собою SСН3, а М означає літій, з проміжною сполукою формули (VII)
 (VII),
(VII),
де R3a являє собою водень, а Y2 і Z обидва означають атом хлору.
48. Спосіб за п. 43, де кожний з R1 і R2 являє собою 4-метоксибензиламіногрупу, який включає:
a) окислення сполуки формули (III) з одержанням сполуки формули (I), де R1 і R2 незалежно являють собою SОСН3 або SO2CH3; і
b) обробку сполуки формули (I), де R1 і R2 незалежно являють собою SОСН3 або SO2СН3, 4- метоксибензиламіном з одержанням при цьому сполуки формули (I), де кожний з R1 і R2 являє собою 4-метоксибензиламіногрупу.
49. Спосіб за п. 48, що додатково включає видалення групи 4-метоксибензил з одержанням сполуки формули (I), де кожний з R1 і R2 являє собою аміногрупу.
50. Спосіб за п. 48, де на стадії а) одержують сполуку формули (I), в якій кожний з R1 i R2 являє собою групу SОСН3.
51. Спосіб одержання сполуки формули (I):
 (I),
(I),
де R1 і R2 незалежно вибирають з групи, що складається з груп SСН3, SОСН3, SO2CH3, NH2 і NH(4-метоксибензил); і R3 являє собою Н; що включає наступні стадії:
a) перетворення сполуки формули (VIII):
 (VIII)
(VIII)
в сполуку формули (VI):
 (VI),
(VI),
де R1a являє собою SСН3, X означає атом хлору або йоду, і М означає літій;
b) взаємодію сполуки формули (VI) із сполукою формули (VII):
 (VII)
(VII)
з утворенням сполуки формули (II):
 , (II)
, (II)
де:
R1a і R2a являють собою SCH3, R3а являє собою водень; Y1 означає водень або гідроксильну групу; а Y2 і Z обидва означають атом хлору;
c) циклізацію сполуки формули (II) з утворенням сполуки формули (III):
 (ІІІ),
(ІІІ),
де кожний з R1a і R2a являють собою SСН3, і R3a являє собою водень,
d) перетворення, при необхідності, будь-якої з груп, позначених як R1a і R2a, в будь-яку з груп, позначених як R1 і R2 в формулі (I), відповідно.
Текст
1. Сполука формули (I): C2 2 (19) 1 3 79925 і їх солі та складні ефіри, за винятком сполук, в яких: R1 і R2 означають аміно і R3 означає гідрокси. 2. Сполука за п.1, в якій R1 вибирають з групи, що включає OН, OR', SH, SR', SOR', SО2R', NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSО2R', С(=О)R', CО2H, CО2R', C1-C12 алкіл, C1-C12 галогеналкіл, де груп у R' або кожну з груп R' незалежно вибирають з групи, що включає ОН, C1-C12 алкіл, C1-C12 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси, C1-С6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)аміно, NО2, CN і галогену), аралкіл або арилалкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-C6 алкокси, C1-С6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-C4 алкіл)аміно, NО2, CN і галогену), і в якій, коли група R1 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членне гетероциклічне кільце. 3. Сполука за п.1, в якій R1 вибирають з групи, що включає OR', SR', SOR', NH 2, NHR', N(R')2, NHCOR', N(COR')2 і NHSO2R', де груп у R' або кожну з гр уп R' незалежно вибирають з групи, що включає C1-C6 алкіл, C1-C6 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси і галогену), аралкіл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-C6 алкокси і галогену), аралкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-C6 алкокси і галогену), і в якій, коли група R1 являє собою групу формули N(R')2 або N(COR')2, дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-10-членне гетероциклічне кільце. 4. Сполука за п.1, в якій R1 вибирають з групи, що включає C1-C4 алкокси, C1-C4 алкілтіо, С1-С4 алкілсульфініл, аміно, C1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, C1-C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, C1-C4 галогеналканоїламіно, ариламіно (де арильна частина може бути необов'язково заміщена C1-C4 алкоксигрупою), бензиламіно (де фенільна частина бензильної частини може бути необов'язково заміщена C1-C4 алкоксигрупою), цинамоїламіно або дицинамоїламіно (де фенільна частина кожної цинамоїльної частини може бути необов'язково заміщена C1-C4 алкоксигрупою) або 5-7-членне азотвмісне гетероциклічне кільце, приєднане до частини молекули, яка залишилась, через його атом азоту. 5. Сполука за п.1, в якій R1 вибирають з групи, що включає метокси, тіометил, метилсульфініл, аміно, метиламіно, етиламіно, бензиламіно, ацетиламіно, трифторацетиламіно, діацетиламіно, цинамоїламіно, дицинамоїламіно, п-метоксибензиламіно та піперидино. 6. Сполука за п.1, в якій R1 вибирають з групи, що включає аміно, бензиламіно, ацетиламіно, трифторацетиламіно, діацетиламіно, цинамоїламіно, дицинамоїламіно і п-метоксибензиламіно. 7. Сполука за п.1, в якій R2 вибирають з групи, що включає OН, OR', SH, SR', SOR', SO2R', NH2, NHR', 4 N(R')2, NHCOR', N(COR')2, NHSO2R', C(=O)R', CO2H, CO2R', C1-C12 алкіл і C1-C12 галогеналкіл, де груп у R' або кожну з груп R' незалежно вибирають з групи, що включає OН, C1-C12 алкіл, C1-C12 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси, С1-С6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)аміно, NО2, CN і галогену), аралкіл або арилалкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з С1-С6 алкілу, C1-C6 алкокси, C1-C6 алкілтіо, NH2, C1-C4 алкіламіно, ді(С1-С4 алкіл)амiно, NО2, CN і галогену), і в якій, коли група R2 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членне гетероциклічне кільце. 8. Сполука за п.1, в якій R2 вибирають з групи, що включає OR', SR', SOR', NH 2, NHR', N(R')2, NHCOR', N(COR')2 і NHSО2R', де груп у R' або кожну з гр уп R' незалежно вибирають з групи, що включає C1-С6 алкіл, C1-C6 галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-C6 алкілу, C1-C6 алкокси і галогену), аралкіл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-C6 алкілу, C1-C6 алкокси і галогену), аралкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6 алкілу, C1-С6 алкокси і галогену), і в якій, коли група R2 являє собою групу формули N(R')2 або N(COR')2, дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-10-членне гетероциклічне кільце. 9. Сполука за п.1, в якій R2 вибирають з групи, що включає С 1-С4 алкокси, C1-C4 алкілтіо, C1-C4 алкілсульфініл, аміно, C1-C4 алкіламіно, ді(C1-C4 алкіл)аміно, C1-C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, C1-C4 галогеналканоїламіно, ариламіно (де арильна частина може бути необов'язково заміщена C1-С4 алкоксильною групою), бензиламіно (де фенільна частина бензильної частини може бути необов'язково заміщена C1-C4 алкоксильною групою), цинамоїламіно або дицинамоїламіно (де фенільна частина кожної цинамоїльної частини може бути необов'язково заміщена C1-C4 алкоксильною групою) і 5-7-членне азотвмісне гетероциклічне кільце, приєднане до частини молекули, яка залишилась, через його атом азоту. 10. Сполука за п.1, в якій R2 вибирають з групи, що включає тіометил, метилсульфініл, аміно, метиламіно, етиламіно, ацетиламіно, діацетиламіно, цинамоїламіно і п-метоксибензиламіно. 11. Сполука за п.1, в якій R2 вибирають з групи, що включає аміно, ацетиламіно, діацетиламіно і пметоксибензиламіно. 12. Сполука за п.1, в якій R3 означає ОН. 13. Сполука за п.1, в якій R3 означає ОМе. 14. Сполука за будь-яким з пп.1-13, що має протипухлинну активність, для одержання фармацевтичної композиції. 15. Сполука за будь-яким з пп.1-13, що має протипухлинну активність, яка придатна для лікування або профілактики раку. 16. Сполука за будь-яким з пп.1-13, що має протипухлинну активність, придатна для одержання 5 79925 фармацевтичної композиції для лікування або профілактики раку. 17. Сполука наступної формули: 6 R3 N NH2 H 28b N N NHBn NHEt NH2 H 28a R1 28d піперидиніл NH2 H 28c NMeBu NH2 H 29 NHPMB NHPMB H N N R2 , що являє собою сполуки з номерами, вказаними у наведеній нижче таблиці, в якій R1, R2, R3 мають значення, вказані у таблиці: № R2 R3 сполу- R1 ки 13 SMe SMe OMe 14 SOMe SOMe OMe 15 NHPMB NHPMB OMe де Ме означає метил, Еt – етил, Bu – бутил, Ac – ацетил і NHPMB – п-метоксибензиламіно. 18. Сполука за п.17, що має протипухлинну активність, для одержання фармацевтичної композиції. 19. Сполука за п.17, що має протипухлинну активність, яка придатна для лікування або профілактики раку. 20. Сполука за п.17, що має протипухлинну активність, придатна для одержання фармацевтичної композиції для лікування або профілактики раку. 21. Спосіб одержання сполуки формули (І): R1 16 NHPMB NHPMB OH 19 SMe SMe H R3 N N (І), N N N 20 SOMe SOMe H 23a N(Ac)2 NH2 H 23b N(Ac)2 NHAc H 23c N(Ac)2 N(Ac)2 H 23d NHAc NH2 H 23e NHAc NHAc H 24a N(цинамоїл)2 NH2 H 24b N(цинамоїл)2 NHцинамоїл H 25 NHSO2Me NH2 H 26 NHCOCF3 NH2 H 27 OMe NH2 H R2 де: R1 і R2 незалежно вибирають з групи, що включає Н, OН, OR', SH, SR', SOR', SO 2R', NO 2, NH2 , NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, C(=O)Н, C(=O)R', СO2Н, CO2R', C1-C12 алкіл, C1-C12 галогеналкіл, C2-C12 алкеніл, C2-C12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу, і R3 вибирають з групи, що включає OН і ОМе; де групу R' або кожну з груп R' незалежно вибирають з групи, що включає ОН, C1-C12 алкіл, C1-C12 галогеналкіл, C2-C12 алкеніл, C2-C12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або двi групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група і арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю у карбоциклічному кільці або у двох або більше конденсованих кільцях; аралкільна група являє собою C1-C6 алкільну групу, заміщену вказаною вище арильною групою; арилалкенільна група являє собою С 2-С6 алкенільну групу, заміщену вказаною вище арильною групою; 7 79925 гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або у двох або більше конденсованих кільцях, в яких принаймні один атом у кільці вибирають з групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну гр упу, сконденсовану з вказаною вище арильною групою; замісники в арильних і гетероароматичних групах і в арильній частині аралкільних і арилалкенільних груп вибирають з групи, що включає C1-C12 алкіл, C1-C12 галогеналкіл, C1-C12 алкокси, C1-C12 алкілтіо, NH2, С1-С4 алкіламіно, ді(C1-C4 алкіл)аміно, С1C4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген; її похідних, в яких атом азоту кватернізований, її солей і складних ефірів, який включає циклізацію проміжної сполуки формули (II): 8 R3a M N Y2 де R3a і Y2 мають значення, вказані у п. 21, і М означає метал, зі сполукою формули (V): O N N R 1a N (ІІ), Y2 N N R1a (VI), N де R1a має значення, визначені як вказано у п. 21, і М означає метал, з проміжною сполукою формули (VII): O R 2a R 3a N N (ІІІ), N N R2a (V), R 2a N R3a де: R1a, R2a і R3a означають будь-які групи, представлені відповідно позначеннями R1, R2 і R3, і всі такі групи, в яких реакційноздатні функціональні групи захищені; і Y1 і Y2 означають групи, які можуть бути видалені з утворенням конденсованої трициклічної піридопіролопіримідинової кільцевої структури, з одержанням сполуки формули (ІІІ): R1a N M N N N де R1a і R2a мають значення, вказані у п. 21. 29. Спосіб за будь-яким з пп. 21-27, в якому проміжну сполуку формули (II) одержують внаслідок взаємодії сполуки формули (VI): R1a R3a Y 1 (IV), N і, за необхідністю, перетворення будь-якої з груп, що позначені як R1a, R2a і R3a, у будь-яку з груп, позначених як R1, R2 і R3, відповідно. 22. Спосіб за п. 21, де Y1 означає гідроксильну груп у. 23. Спосіб за пп. 21 або 22, де Y2 означає атом хлору. 24. Спосіб за будь-яким з пп. 21-23, де R1a=R2a. 25. Спосіб за п. 24, де R1a і R2a означають метилтіогрупи. 26. Спосіб за будь-яким з пп. 21-25, в якому каталізують кислотою. 27. Спосіб за будь-яким з пп. 21-26, який включає взаємодію проміжної сполуки формули (II) з триалкілсиланом формули RaRbRcSiH, де Ra, Rb і Rc можуть мати однакові або різні значення, і кожний з них являє собою С 1-С12 алкільну груп у. 28. Спосіб за будь-яким з пп. 21-27, в якому проміжну сполуку формули (ІІ) одержують в результаті взаємодії проміжної сполуки формули (ІV): (VII), Z N Y2 де R3a і Y2 мають значення, визначені як вказано у п. 21, і Z означає групу, що видаляється. 30. Спосіб за п. 21, де R1 і R2 являють собою аміногрупи і R3 має значення, вказані у п.1, який включає: a) обробку сполуки формули (III), де R1а і R2a являють собою метилсульфініл, і R3a має значення, вказані у п. 21, сполукою формули NH2Prot, де Prot означає амінозахисну групу, з утворенням сполуки формули (III), де R1a і R2a являють собою захищену аміногрупу і R3a має значення, вказані у п. 21; і b) видалення амінозахисної групи з утворенням сполуки формули (I), де R1 і R2 являють собою аміногрупи і R3 має значення, вказані у п. 21. 31. Спосіб за п. 21, де R1 означає метилтіо- або аміногрупу, R2 означає аміногрупу і R3 має значення, вказані у п. 21, який включає: a) необов’язкове окислення сполуки формули (ІІІ), де R1a і R2a означають метилтіо і R3a має значення, вказані у п. 21, у сполуку формули (ІІІ), де R1a і R2a являють собою метилсульфініл; і b) обробку сполуки формули (III), де R1a і R2a являють собою метилтіо або метилсульфініл, реагентом, вибраним з азиду натрію і аміаку. 32. Спосіб одержання сполуки формули (I): R1 R3 N N (I), N N N R2 де: R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO 2R', NO 2, NH2 , NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, 9 79925 С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу; і R3 вибирають із групи, що включає ОН і ОМе; де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі гр упи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях; аралкільна група являє собою С 1-С6 алкільну групу, заміщену ви щевказаною арильною групою; арилалкенільна група являє собою С 2-С6 алкенільну групу, заміщену вищевказаною арильною групою; гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну гр упу, сконденсовану з вищевказаною арильною групою; замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, С1С4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген; її похідних, у яких атом азоту кватернізований, її солей і складних ефірів, що включає нижченаведені стадії: а) перетворення сполуки формули (VIII): R1a N N (VIII), X де R1а має вказані вище значення і Х означає атом галогену, у сполуку формули (VI), вказану в п. 29; b) взаємодію сполуки формули (VI) зі сполукою формули L1-CO-L2, де L1 і L2 мають однакові або різні значення і являють собою групу, що видаляється, з утворенням сполуки формули (V), вказаної в п. 28; с) взаємодію сполуки формули (V) зі сполукою формули (IV), вказаною в п. 28, з утворенням сполуки формули (II), вказаної в п. 21; d) циклізацію сполуки формули (II) з утворенням сполуки формули (III), вказаної в п. 21; 10 е) перетворення, при необхідності, будь-яких гр уп, позначених як R1а, R2а і R3а , у будь-які групи, позначені як R1, R2 і R3, відповідно. 33. Спосіб одержання сполуки формули (I): R1 R3 N N (I), N N N R2 де: R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO 2R', NO 2, NH2 , NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу; і R3 вибирають із групи, що включає ОН і ОМе; де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі гр упи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях; аралкільна група являє собою С 1-С6 алкільну групу, заміщену ви щевказаною арильною групою; арилалкенільна група являє собою С 2-С6 алкенільну групу, заміщену вищевказаною арильною групою; гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну гр упу, сконденсовану з вищевказаною арильною групою; замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С 1-С4алкіл)аміно, С1С4 алканоїламіно, ді(С1-С4алканоїл)аміно, NO2, CN і галоген; її похідних, у яких атом азоту кватернізований, її солей і складних ефірів, що включає нижченаведені стадії: а) перетворення сполуки формули (VIII), вказаної у п. 32, у сполуку формули (ІV), вказану у п. 29; 11 79925 b) взаємодію сполуки формули (VI) зі сполукою формули (VII), вказаною у п. 29, з утворенням сполуки формули (ІІ), вказаної у п. 21; с) циклізацію сполуки формули (II) з утворенням сполуки формули (III), вказаної в п. 21; d) перетворення, при необхідності, будь-яких гр уп, позначених як R1а, R2а і R3а , у будь-які групи, позначені як R1, R2 і R3, відповідно. 34. Фармацевтична композиція, що містить ефективну кількість фармакологічно активної сполуки разом з носієм або розріджувачем, у якій вказана фармакологічно активна сполука є сполукою за будь-яким з пп.1-13 або 17. 35. Спосіб лікування або профілактики раку у ссавця, що включає введення ссавцеві, який потребує такого лікування, ефективної кількості сполуки за кожним з пп.1-13 або 17. 36. Сполука формули (I): R1 R3 N замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, С1С4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген; її похідні, у яких атом азоту кватернізований, її солі і складні ефіри, які мають протиракову активність, призначені для лікування або профілактики ракових захворювань, вибраних з раку яєчника, раку нирки, раку передміхурової залози, раку молочної залози і меланоми. 37. Спосіб лікування або профілактики ракових захворювань у ссавця, вибраних з раку яєчника, раку нирки, раку передміхурової залози, раку молочної залози і меланоми, що включає введення ссавцеві, який потребує такого лікування, ефективної кількості сполуки формули (I): R1 N (I), N 12 R3 N N (I), N N R2 де: R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO 2R', NO 2, NH2 , NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу; і R3 вибирають із групи, що включає Н, ОН і ОМе; де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі гр упи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях; аралкільна група являє собою С 1-С6 алкільну групу, заміщену ви щевказаною арильною групою; арилалкенільна група являє собою С 2-С6 алкенільну групу, заміщену вищевказаною арильною групою; гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну ароматичну гр упу, сконденсовану з вищевказаною арильною групою; N N N R2 де: R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO 2R', NO 2, NH2 , NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1-C12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу; і R3 вибирають із групи, що включає Н, ОН і ОМе; де групу R' або кожну з груп R' незалежно вибирають із групи, що включає ОН, С1-С12 алкіл, С1-С12 галогеналкіл, С2-С12 алкеніл, С2-С12 алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і коли група R1 або R2 являє собою групу формули N(R')2 або N(COR')2, усі гр упи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група й арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю в карбоциклічному кільці або в двох або більше конденсованих кільцях; аралкільна група являє собою С 1-С6 алкільну групу, заміщену ви щевказаною арильною групою; арилалкенільна група являє собою С 2-С6 алкенільну групу, заміщену вищевказаною арильною групою; гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або в двох або більше конденсованих кільцях, у яких принаймні один атом у кільці вибирають із групи, що включає атоми азоту, кисню і сірки, а також описану гетероциклічну арома 13 79925 тичну гр упу, сконденсовану з вищевказаною арильною групою; замісники в арильних і гетероароматичних групах і в арильній частини аралкільних і арилалкенільних груп вибирають із групи, що включає С1-С12 алкіл, С1-С12 галогеналкіл, С1-С12 алкокси, С1-С12 алкілтіо, NH2, С1-С4 алкіламіно, ді(С1-С4 алкіл)аміно, С1С4 алканоїламіно, ді(С1-С4 алканоїл)аміно, NO2, CN і галоген; її похідних, у яких атом азоту кватернізований, її солей і/або складних ефірів. 38. Сполука формули (II): R1a R3a Y 1 N N де R1a являють собою SСН3, а М означає літій, з проміжною сполукою формули (VII) R2a N N (I), N N N R2 де: R1 і R2 незалежно вибирають з групи, що складається з груп SCH3, SOCH3, SО2CH3, NH2 і NH (4метоксибензил); і R3 являє собою Н; який включає циклізацію проміжної сполуки формули (II) R3a N R3a Y 1 N Y2 N R1 N N де R1 і R2 незалежно вибирають з групи, що складається з груп SСН3, SОСН3, SO 2CH3, NH2 і NH(4метоксибензил); і R3 являє собою Н; що включає наступні стадії: a) перетворення сполуки формули (VIII): R1a N N N N N R 2a N R2 (ІІІ), N N N N N R2a R3a Y2 (I), (II), де: R1a і R2a являють собою SСН3, R3а являє собою водень; Y1 означає водень або гідроксильну групу; Y2 означає атом хлору; з одержанням сполуки формули (III): R 1a (VII), де R3a являє собою водень, а Y2 і Z обидва означають атом хлору. 48. Спосіб за п. 43, де кожний з R1 і R2 являє собою 4-метоксибензиламіногрупу, який включає: a) окислення сполуки формули (III) з одержанням сполуки формули (I), де R1 і R2 незалежно являють собою SОСН3 або SO2CH3; і b) обробку сполуки формули (I), де R1 і R2 незалежно являють собою SОСН3 або SO2СН3, 4- метоксибензиламіном з одержанням при цьому сполуки формули (I), де кожний з R1 і R2 являє собою 4метоксибензиламіногрупу. 49. Спосіб за п. 48, що додатково включає видалення групи 4-метоксибензил з одержанням сполуки формули (I), де кожний з R 1 І R2 являє собою аміногрупу. 50. Спосіб за п. 48, де на стадії а) одержують сполуку формули (I), в якій кожний з R 1 i R2 являє собою групу SОСН3. 51. Спосіб одержання сполуки формули (I): R3 N O Z R1a N (VI), M N де R1а, R2а, R3а, Y1 і Y2 мають значення, вказані в п. 21. 39. Сполука за п. 38, у якому Y1 означає гідроксильну груп у. 40. Сполука за пп. 38 або 39, у якому Y2 означає атом хлору. 41. Сполука за будь-яким з пп. 38-40, де R 1а=R2а. 42. Сполука за п. 41, у якому R 1а і R2а означають метилтіогрупи. 43. Спосіб одержання сполуки формули (I): R1 R1a N (II), Y2 R3 де кожний з R1a і R2a являють собою SСН3, і R3a являє собою водень, і, при необхідності, перетворення будь-якої з груп, позначених як R1a і R2a, в будь-яку з груп, позначених як R1 і R2 в формулі (I), відповідно. 44. Спосіб за п. 43, де Y1 означає гідроксильну груп у. 45. Спосіб за п. 43, в якому каталізують кислотою. 46. Спосіб за п. 43, який включає взаємодію проміжної сполуки формули (II) з триетилсиланом. 47. Спосіб за п. 43, в якому проміжну сполуку формули (II) одержують внаслідок взаємодії проміж ної сполуки формули (VI): N N N 14 X в сполуку формули (VI): (VIII) 15 N 79925 R1a (VI), N M де R1a являє собою SСН3, X означає атом хлору або йоду, і М означає літій; b) взаємодію сполуки формули (VI) із сполукою формули (VII): R3a O Y2 N (II) N N (ІІІ), N R2a N R 2a R1a N R 3a N N з утворенням сполуки формули (II): N R1a N Y2 R3a Y 1 де: R1a і R2a являють собою SCH3, R3а являє собою водень; Y1 означає водень або гідроксильну групу; а Y2 і Z обидва означають атом хлору; c) циклізацію сполуки формули (II) з утворенням сполуки формули (III): (VII) Z N 16 де кожний з R1a і R2a являють собою SСН3, і R3a являє собою водень, d) перетворення, при необхідності, будь-якої з груп, позначених як R1a і R2a , в будь-яку з гр уп, позначених як R1 і R2 в формулі (I), відповідно. , Даний винахід відноситься до протипухлинних сполук, зокрема, до нових протипухлинних аналогів варіоліну В і дезоксиваріоліну В. Даний винахід відноситься також до способів синтезу, зокрема, до способів одержання як нових сполук за даним винаходом, так і відомих сполук варіоліну В і дезоксиваріоліну В, включаючи нові проміжні сполуки, одержання яких є однією зі складових частин таких способів синтезу. Крім того, даний винахід відноситься до нових, раніше не описаних застосувань відомих сполук варіоліну. Варіоліни являють собою новий клас морських алкалоїдів, що виділяють з рідкісного, важкодоступного виду антарктичної губки Kirkpatricka varialosa, типовим прикладом яких є варіолін В (1). Всі варіоліни мають конденсоване тридо[3',2':4,5]піроло[1,2-с]-піримідинове ядро (2), в якому до атома вуглецю С5 приєднане або гетероциклічне ароматичне кільце, або складноефірна група, як це має місце у варіоліні В (1) і варіоліні D (3). Відомо, що варіоліни володіють протипухлинною активністю та іншими корисними властивостями. Повна структура і протипухлинна активність вказаних і споріднених сполук [описані у статтях N.B.Perry et al., Tetrahedron, 1994, 50, 3987-92 і G.Trimurtulu et al., Tetrahedron, 1994, 50, 39934000]. Однак досі було показано, що варіоліни, описані у вказаних стаття х, володіють тільки обмеженим спектром протипухлинної активності. Обмежена доступність природної сировини зробила необхідним пошук альтернативних способів синтезу природних сполук і споріднених аналогів. Спосіб синтезу спорідненого дезоксиваріоліну В (4) [описаний у статті М.Al varez et al., Tetrahedron Lett., 2001, 42, 315-317] (яка була опублікована до дати подачі даної заявки, але після дат пріоритету). Шлях одержання дезоксиваріоліну В, описаний у зазначеній вище статті, приведеній як посилання, включає в цілому не менше чотирнадцяти стадій, у процесі виконання яких з 7-азаіндолу утворюють конденсоване трициклічне піридопіролопіримідинове ядро, потім здійснюють реакцію гетероарильного сполучення для введення четвертого ароматичного кільця і одержують проміжну сполуку (5). Заміщуючи аміногрупу сульфоновою групою (6), одержують дезоксиваріолін В (4). 17 79925 Однак, як вказувалося вище, даний спосіб синтезу є довгим і складним. Крім того, у науковій літературі відсутній опис способу синтезу варіоліну В (або будь-якого природного варіоліну). Тому бажано створити спосіб, що дозволяє синтезувати дезоксиваріолін В і його похідні при виконанні меншого числа стадій у порівнянні з описаним вище способом. Бажано також створити спосіб, що дозволяє синтезувати безпосередньо варіолін В, а також його дезоксипохідне. Крім цього, бажано одержати нові сполуки, що володіють протипухлинною активністю, яка є порівнянною або перевищує аналогічну активність природного варіоліну В. Способи синтезу за даним винаходом включають вперше розроблений спосіб одержання варіоліну В (1), забезпечують коротке і швидке одержання дезоксиваріоліну В (4) і проміжних сполук, таких як (5) і (6). Вказані проміжні сполуки використані для одержання нових протипухлинних сполук, що мають конденсоване трициклічне піридопіролопіримідинове ядро варіолінів. Відповідно до даного винаходу розроблені нові способи синтезу варіоліну В, дезоксиваріоліну В і подібних сполук, в яких використовується перевага прихованого елемента симетрії цих сполук. Новий підхід дозволяє створити стр уктур у ядра варіоліну, що включає конденсоване піридопіролопіримідинове ядро з приєднаним до нього гетероциклічним ароматичним кільцем у положенні С5, внаслідок виконання меншого числа стадій у порівнянні з відомим способом синтезу. Таким чином, прості моногетероароматичні молекули можна перетворити у ряд нових і відомих похідних варіоліну, що володіють потенційною протипухлинною лікувальною дією. Таким чином, першим об'єктом даного винаходу є сполука формули (І): де: 18 R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)Н, C(=O)R', CO2H, CO2R', C1С12алкіл, C1-С12галогеналкіл, С2-С12алкеніл, C2C12алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу; і R3 вибирають з групи, що включає Н, ОН і ОМе; де R' або кожну з гр уп R' незалежно вибирають з групи, що включає ОН, C1-С12алкіл, C1С12галогеналкіл, C2-C12алкеніл, C2-C12алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і група R1, R2 або R3 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група і арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю у карбоциклічному кільці або у двох або більше конденсованих кільцях; аралкільна група являє собою С 1-С6алкільну груп у, заміщену зазначеною вище арильною групою; арилалкенільна група являє собою С 2С6алкенільну груп у, заміщену зазначеною вище арильною групою; гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або у дво х або більше конденсованих кільцях, в яких принаймні один атом у кільці вибирають з групи, що включає атоми азоту, кисню і сірки, причому така гетероциклічна ароматична група конденсована з зазначеною вище арильною групою; замісники в арильних і гетероароматичних групах і в арильній частині аралкільних і арилалкенільних груп вибирають з групи, що включає С1С12алкіл, С1-С12галогеналкіл, С1-С12алкокси, С1С12алкілтіо, NH2, С1-С4алкіламіно, ді(С1С4алкіл)аміно, С1-С4алканоїламіно, ді(С1С4алканоїл)аміно, NO2, CN і галоген; її похідні, в яких атом азоту кватернізований, її солі та складні ефіри, за винятком сполук, в яких: R1 означає аміно, тіометил, метилсульфініл або метилсульфоніл, R2 означає аміно і R3 означає водень; або R1 і R2 означають аміно і R3 означає гідрокси. Даний винахід відноситься також до способу синтезу як нових описаних вище похідних варіоліну формули (І), так і відомих похідних варіоліну, описаних у відомому рівні техніки. Другим об'єктом даного винаходу є спосіб одержання сполуки формули (І): 19 79925 20 який включає одержання проміжної сполуки формули (II) де: R1 і R2 незалежно вибирають з групи, що включає Н, ОН, OR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галоген, С=(О)Н, C(=O)R', CO2H, CO2R', C1С12алкіл, C1-С12галогеналкіл, С2-С12алкеніл, С2С12алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл і заміщену або незаміщену гетероароматичну гр упу; і R3 вибирають з групи, що включає Н, ОН і ОМе; де R' або кожну з гр уп R' незалежно вибирають з групи, що включає ОН, C1-С12алкіл, C1С12галогеналкіл, С2-С12алкеніл, С2-С12алкініл, заміщений або незаміщений арил, заміщений або незаміщений аралкіл, заміщений або незаміщений арилалкеніл і заміщену або незаміщену гетероароматичну груп у; і де група R1, R2 або R3 являє собою групу формули N(R')2 або N(COR')2, де всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-14-членне гетероциклічне кільце; арильна група і арильна частина аралкільної і арилалкенільної групи являє собою карбоциклічну арильну груп у, що має від 6 до 14 атомів вуглецю у карбоциклічному кільці або у двох або більше конденсованих кільцях; аралкільна група являє собою С 1-С6алкільну груп у, заміщену зазначеною вище арильною групою; арилалкенільна група являє собою С 2С6алкенільну груп у, заміщену зазначеною вище арильною групою; гетероароматична група являє собою гетероциклічну ароматичну групу, що має від 5 до 14 атомів в одному кільці або у дво х або більше конденсованих кільцях, в яких принаймні один атом у кільці вибирають з групи, що включає атоми азоту, кисню і сірки, причому така гетероциклічна ароматична група сконденсована з зазначеною вище арильною групою; замісники в арильних і гетероароматичних групах і в арильній частині аралкільних і арилалкенільних груп вибирають з групи, що включає C1С12алкіл, C1-С12галогеналкіл, C1-С12алкокси, C1С12алкілтіо, NH2, С1-C4алкіламіно, ді(С1С4алкіл)аміно, С1-С4алканоїламіно, ді(С1С4алканоїл)аміно, NO2, CN і галоген; її похідних, в яких атом азоту кватернізований, та її солей і складних ефірів, де: R1а, R2а і R3а означають будь-які групи, представлені відповідно R1, R2 і R3, і всі такі групи, в яких реакційноздатні функціональні групи захищені; і Υ1 і Y2 означають групи, які можуть бути видалені з утворенням конденсованої трициклічної піридопіролопіримідинової кільцевої структури. Як буде описано нижче, нові сполуки формули (І) проявляють біологічну активність проти різних ліній ракових клітин ссавців. Протипухлинна активність вказаних сполук направлена проти лейкозу, раку легені, раку ободової кишки, раку нирки, раку передміхурової залози, раку яєчника, раку молочної залози, сарком і меланом. Крім того, відомі сполуки формули (І) проявляють не описану раніше активність проти цілого ряду ракових захворювань. Таким чином, третім об'єктом даного винаходу є спосіб лікування або профілактики раку у ссавця, який включає введення ссавцеві, який потребує такого лікування, ефективної кількості нової сполуки за даним винаходом. Четвертим об'єктом даного винаходу є спосіб лікування або профілактики ракових захворювань, вибираних з раку яєчника, раку нирки, раку передміхурової залози, раку молочної залози і меланоми у ссавця, який включає введення ссавцеві, який потребує такого лікування, ефективної кількості нової сполуки за даним винаходом або відомої сполуки варіоліну. Інші об'єкти даного винаходу відносяться до стадій синтезу деяких переважних сполук, більш детально описаних нижче, і проміжних сполук, зокрема, сполук приведеної вище формули (II). Відповідно до визначень, що використовуються у даній заявці, алкільні групи можуть являти собою групи з прямим або розгалуженим ланцюгом, що переважно мають від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю, ще більш переважно від 1 до близько 6 атомів вуглецю і найбільш переважно 1, 2, 3 або 4 атоми вуглецю. Ме тил, етил і пропіл, включаючи ізопропіл, є особливо переважними алкільними групами у сполуках за даним винаходом. У значенні, що використовується тут, термін «алкіл», за винятком особливо обумовлених випадків, відноситься до циклічних і нециклічних груп, причому циклічні групи містять принаймні три атоми вуглецю у кільці. 21 79925 Галогеналкільні групи являють собою зазначені вище алкільні групи (включаючи циклоалкільні групи), які заміщені одним або декількома атомами галогену (переважно атомами фтору, хлору, брому або йоду) і переважно мають від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю, ще більш переважно від 1 до близько 6 атомів вуглецю і найбільш переважно 1, 2, 3 або 4 атоми вуглецю. Ме тил, етил і пропіл, включаючи ізопропільні групи, заміщені 1, 2 або 3 атомами галогену, які можуть мати однакові або різні значення, зокрема, фторметил, фторхлорметил, трифторметил і трихлорметил, є особливо переважними галогеналкільними групами у сполуках за даним винаходом. Переважні алкенільні та алкінільні групи у сполуках за даним винаходом містять один або декілька ненасичених зв'язків і від 2 до близько 12 атомів вуглецю, більш переважно від 2 до близько 8 атомів вуглецю, ще більш переважно від 2 до близько 6 атомів вуглецю, найбільш переважно 2, 3 або 4 атоми вуглецю. Терміни «алкеніл» та «алкініл» у значенні, що використовується тут, відносяться як до циклічних, так і нециклічних груп, причому нециклічні групи з прямим або розгалуженим ланцюгом звичайно є більш переважними. Переважні алкоксильні групи у сполуках за даним винаходом включають групи, що містять один або декілька (але переважно тільки один) кисневих зв'язків і від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю, ще більш переважно від 1 до близько 6 атомів вуглецю і найбільш переважно 1,2, 3 або 4 атоми вуглецю. Переважні алкілтіогрупи у сполуках за даним винаходом містять один або декілька (але переважно тільки один) простих тіоефірних зв'язків і від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алкілтіогрупи, що містять 1, 2, 3 або 4 атоми вуглецю, є особливо переважними. Переважні алкілсульфінільні групи у сполуках за даним винаходом включають групи, що містять один або декілька сульфоксидних (SO) гр уп і від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алкілсульфінільні групи, що містять 1, 2, 3 або 4 атоми вуглецю, є особливо переважними. Переважні алкілсульфонільні групи у сполуках за даним винаходом включають групи, що містять один або декілька сульфонільних (SO2) гр уп і від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алкілсульфонільні групи, що містять 1, 2, 3 або 4 атоми вуглецю, є особливо переважними. Переважні алканоїльні групи у сполуках за даним винаходом включають групи, що містять один або декілька карбонільних (CO) груп і від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю (включаючи вуглець карбонільної групи). Алканоїльні групи, що 22 містять 1, 2, 3 або 4 атоми вуглецю, зокрема формільні, ацетильні, пропіонільні, бутирильні та ізобутирильні групи, є особливо переважними. Переважні алкіламіногрупи у сполуках за даним винаходом містять один або декілька (але переважно тільки один) NH-зв'язків і від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алкіламіногрупи, що містять 1, 2, 3 або 4 атоми вуглецю, зокрема метиламіно, етиламіно, пропіламіно і бутиламіногрупи, є особливо переважними. Переважні діалкіламіногрупи у сполуках за даним винаходом містять один або декілька (але переважно тільки один) атомів азоту, приєднаних до двох алкільних груп, кожна з яких може містити від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алкільні групи можуть містити однакові або різні значення. Діалкіламіногрупи, в яких кожна алкільна група містить 1, 2, 3 або 4 атоми вуглецю, зокрема диметиламіно, діетиламіно, N-метилетиламіно, Nетилпропіламіно, дипропіламіно, дибутиламіно і Nметилбутиламіногрупи, є особливо переважними. Переважні алканоїламіногрупи у сполуках за даним винаходом містять один NH-CO-зв'язок, приєднаний до алкільної групи, що містить від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алканоїламіногрупи, що містять 1, 2, 3 або 4 атоми вуглецю, зокрема форміламіно, ацетиламіно, пропіоніламіно і бутириламіногрупи, є особливо переважними. Ацетиламіногрупа є найбільш переважною. Переважні діалканоїламіногрупи у сполуках за даним винаходом містять один атом азоту, приєднаний до двох зазначених ви ще алканоїльних груп, які можуть мати однакові або різні значення і містять від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Діалканоїламіногрупи, в яких кожна алканоїльна група містить 1, 2, 3 або 4 атоми вуглецю, зокрема диформіламіно, формілацетиламіно, діацетиламіно, дипропіоніламіно і дибутириламіногрупи, є особливо переважними. Діацетиламіногрупа є особливо переважною. Переважні алкілсульфоніламіногрупи у сполуках за даним винаходом містять один NH-SO2зв'язок, приєднаний до алкільної групи, що містить від 1 до близько 12 атомів вуглецю, більш переважно від 1 до близько 8 атомів вуглецю і ще більш переважно від 1 до близько 6 атомів вуглецю. Алкілсульфоніламіногрупи, що містять 1, 2, 3 або 4 атоми вуглецю, зокрема метансульфоніламіно, етансульфоніламіно, пропансульфоніламіно і бутансульфоніламіно, є особливо переважними. У сполуках формули (І) R1 переважно вибирають з групи, що включає ОН, OR', SH, SR', SOR', SO2R', NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', C(=O)R', СО 2Н, CO 2R', C1-С 12алкіл, C1С12галогеналкіл, де R' або кожну з R' незалежно вибирають з групи, що включає ОН, C1-С12алкіл, C1-С12галогеналкіл, арил (який може бути необо 23 79925 в'язково заміщений групою, вибраною з C1С6алкілу, C1-С6алкокси, C1-С6алкілтіо, NH2, C1С6алкіламіно, ді(C1-С6алкіл)аміно, NO2, CN і галогену), аралкіл або арилалкеніл (арильна частина якого може бути необов'язково заміщена групою, вибираною з C1-С6алкілу, C1-С6алкокси, C1С6алкілтіо, NH2, C1-С6алкіламіно, ді(C1С6алкіл)аміно, NO2, CN і галогену), і, коли група R1 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членне гетероциклічне кільце. Більш переважно R1 вибирають з групи, що включає OR', SR', SOR', NH 2, NHR', N(R')2, NHCOR', N(COR')2 і NHSO2R', де R' або кожну з R' незалежно вибирають з групи, що включає C 1С6алкіл, C1-С6галогеналкіл, арил (який може бути необов'язково заміщений групою, вибираною з C1С6алкілу, C1-С6алкокси і галогену), аралкіл (арильна частина якого може бути необов'язково заміщена групою, вибираною з C1-С6алкілу, C1С6алкокси і галогену), аралкеніл (арильна частина якого може бути необов'язково заміщена групою, вибираною з C1-С6алкілу, C1-С6алкокси і галогену), і, коли група R1 являє собою групу формули N(R')2 або N(COR')2, дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-10членне гетероциклічне кільце. Ще більш переважно R1 вибирають з групи, що включає С 1-С4алкокси, С1-С4алкілтіо, С1С4алкілсульфініл, аміно, С1-С4алкіламіно, ді(С1С4алкіл)аміно, С1-С4алканоїламіно, ді(С1С4алканоїл)аміно, С1-С4галогеналканоїламіно, ариламіно (де арильна частина може бути необов'язково заміщена С 1-С4алкоксильною групою), бензиламіно (де фенільна частина бензильної частини може бути необов'язково заміщена С 1С4алкоксильною групою), цинамоїламіно або дицинамоїламіно (де фенільна частина кожної цинамоїльної частини може бути необов'язково заміщена С1-С4алкоксильною групою) або 5-7-членне азотвмісне гетероциклічне кільце, приєднане до іншої частини молекули через його атом азоту. Найбільш переважно R1 вибирають з групи, що включає метокси, тіометил, метилсульфініл, аміно, метиламіно, етиламіно, бензиламіно, ацетиламіно, трифторацетиламіно, діацетиламіно, цинамоїламіно, дицинамоїламіно, пметоксибензиламіно та піперидино. Найбільш переважно R1 вибирають з групи, що включає аміно, бензиламіно, ацетиламіно, трифторацетиламіно, діацетиламіно, цинамоїламіно, дицинамоїламіно і п-метоксибензиламіно. R2 переважно вибирають з групи, що включає ОН, OR', SH, SR', SOR', SO 2R', NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', C(=O)R', CO2H, CO2R', C1-С12алкіл і C1-С12галогеналкіл, де R' або кожну з R' незалежно вибирають з групи, що включає ОН, C1-С12алкіл, C1-С12галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1-С6алкілу, C1-С6алкокси, C1С6алкілтіо, NH2, C1-С6алкіламіно, ді(C1С6алкіл)аміно, NO2, CN і галогену), аралкіл або арилалкеніл (арильна частина якого може бути 24 необов'язково заміщена групою, вибраною з C1С6алкілу, C1-С6алкокси, C1-С6алкілтіо, NH2, C1С6алкіламіно, ді(C1-С6алкіл)аміно, NO2, CN і галогену), і, коли група R2 являє собою групу формули N(R')2 або N(COR')2, всі групи R' можуть мати однакові або різні значення або дві групи R' разом з атомом азоту, до якого вони приєднані, утворюють 5-12-членне гетероциклічне кільце. Більш переважно R2 вибирають з групи, що включає OR', SR', SOR', NH 2, NHR', N(R')2, NHCOR', N(COR')2 і NHSO2R', де R' або кожну з R' незалежно вибирають з групи, що включає C 1С6алкіл, C1-С6галогеналкіл, арил (який може бути необов'язково заміщений групою, вибраною з C1С6алкілу, C1-С6алкокси і галогену), аралкіл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6алкілу, C1С6алкокси і галогену), аралкеніл (арильна частина якого може бути необов'язково заміщена групою, вибраною з C1-С6алкілу, C1-С6алкокси і галогену), і, коли група R2 являє собою групу формули N(R')2 або N(COR')2, дві групи R' разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-10членне гетероциклічне кільце. Ще більш переважно R2 вибирають з групи, що включає C1-С4алкокси, C1-С4алкілтіо, C1С4алкілсульфініл, аміно, C1-С4алкіламіно, ді(C1С4алкіл)аміно, C1-С4алканоїламіно, ді(C1С4алканоїл)аміно, C1-С4галогеналканоїламіно, ариламіно (де арильна частина може бути необов'язково заміщена C1-С4алкоксильною групою), бензиламіно (де фенільна частина бензильної частини може бути необов'язково заміщена C1С4алкоксильною групою), цинамоїламіно або дицинамоїламіно (де фенільна частина цинамоїльної частини може бути необов'язково заміщена C1С4алкоксильною групою) і 5-7-членне азотвмісне гетероциклічне кільце, приєднане до іншої частини молекули через його атом азоту. Набагато переважніше R2 вибирають з групи, що включає тіометил, метилсульфініл, аміно, метиламіно, етиламіно, ацетиламіно, діацетиламіно, цинамоїламіно і п-метоксибензиламіно. Найбільш переважно R2 вибирають з групи, що включає аміно, ацетиламіно, діацетиламіно і пметоксибензиламіно. R3 переважно означає Н. Як повинно бути очевидно фахівцеві у даній області, приведені вище переважні визначення R1, R2 і R3 можуть бути об'єднані з утворенням різних комбінацій, і всі сполуки, що включають такі комбінації зазначених вище переважних визначень, входять в об'єм даного винаходу. Переважною є комбінація, що складається з двох зазначених вище визначень, і особливо переважною є комбінація, що включає всі три переважних визначення. Приведені нижче сполуки є найбільш переважними: N'-бісацетилдезоксиваріолін; N'-бісацетил-N-ацетилдезоксиваріолін; N'-бісацетил-N-бісацетилдезоксиваріолін; N'-ацетилдезоксиваріолін; N'-ацетил-N-ацетилдезоксиваріолін; N'-бісцинамоїлдезоксиваріолін; N'-бісцинамоїл-N-цинамоїлдезоксиваріолін; 25 79925 N'-метансульфонілдезоксиваріолін; N'-трифторацетилдезоксиваріолін; 2'-метоксидезоксиваріолін; 2'-піперидинілдезоксиваріолін; N'-етилдезоксиваріолін; N'-бутил-N'-метилдезоксиваріолін; N'-бензилдезоксиваріолін. Сполуки формули (І) містять основну груп у і тому можуть утворювати сіль. Тип таких солей не має принципового значення для даного винаходу за умови, що у випадку використання даної сполуки для лікувальних цілей такі солі повинні бути фармацевтично прийнятними, тобто більш біологічно активними, приблизно такими ж біологічно активними або не менш біологічно активними, ніж вільні основи, і менш токсичними, приблизно такими ж токсичними або не більш токсичними, ніж вільні основи. Вказані властивості можна легко оцінити, виконуючи прості випробування, відомі фа хівцям у даній області. Однак, коли сполуку використовують для інши х цілей (наприклад, як проміжний продукт у процесі одержання іншої сполуки), зазначене вище обмеження є необов'язковим. Приклади прийнятних солей включають солі неорганічних кислот, такі як гідрохлорид, гідробромід, сульфат і фосфат; солі органічних кислот, такі як ацетат, бензоат, оксалат, малеат, фумарат, тартрат, цитрат і сукцинат; і солі сульфонової кислоти, такі як метансульфонат, бензолсульфонат і п-толуолсуль фонат. Переважними солями є гідрохлорид, гідробромід, тартрат і сукцинат. Деякі сполуки формули (І) містять карбоксильну гр упу і тому можуть утворювати складний ефір. Тип таких складних ефірів не має принципового значення для даного винаходу за умови, що у випадку використання даної сполуки для лікувальних цілей складні ефіри повинні бути фармацевтично прийнятними, тобто більш біологічно активними, приблизно такими ж біологічно активними або не менш біологічно активними, ніж вільні кислоти, і менш токсичними, приблизно такими ж токсичними або не більш токсичними, ніж вільні кислоти. Бажано, щоб складноефірна група була такою, що фізіологічно видаляється, тобто щоб складний ефір легко перетворювався in vi vo у вільну кислоту. Вказані властивості можна легко оцінити, виконуючи прості випробування, відомі фахівцям у даній області. Сполуки за даним винаходом містять принаймні чотири третинні аміногрупи, з яких одна або декілька груп (але переважно тільки одна група) можуть бути кватернізовані з утворенням солі четвертинного амонію. У цьому випадку також присутній протиіон; приклади прийнятних протиіонів приведені вище з посиланням на солі. Спосіб кватернізації одного або декількох атомів азоту добре відомий фахівцям у даній області. Бажано, щоб група, приєднана до третинної аміногрупи з утворенням четвертинних амонієвих сполук, представляла С 1-C6алкільну груп у, найбільш переважно метальну груп у. Різні похідні варіоліну формули (І), у тому числі відомі сполуки варіоліну, одержують новим способом, який входить в об'єм даного винаходу. 26 Складовою частиною способу за даним винаходом є одержання проміжної сполуки приведеної нижче формули (II): У проміжній сполуці формули (II) R 1a, R2a і R3a означають будь-які групи, представлені відповідно R1, R2 і R3, і всі такі групи, в яких реакційноздатні функціональні групи захищені; і Υ1 і Y2 означають групи, які можуть бути видалені з утворенням конденсованої трициклічної піридопіролопіримідинової кільцевої структури. Проміжні сполуки формули (II) є новими сполуками і також входять в об'єм даного винаходу. Для одержання груп R1a, R2a і R3a з захи щеними реакційноздатними функціональними групами можна використовувати будь-які захисні групи, відомі у даній області. У зв'язку з цим можна послатися на [видання T.W. Greene et al., "Protecti ve Groups in Organic Synthesis", John Wiley & Sons, 1991]. Будь-які групи, які можуть бути видалені з утворенням конденсованої трициклічної піридопіролопіримідинової кільцевої структури, можна використовувати як групи Y1 і Y2. Група Υ1 переважно є гідроксильною групою або нестійкою складноефірною групою, такою як ацетат, метансульфонат, п-толуолсуль фонат або трифторметансульфонат, більш переважно гідроксильною групою. Група Υ2 переважно являє собою атом галогену, більш переважно атом хлору. Бажано, щоб проміжна сполука формули (II) була симетричною, тобто R1a і R2a повинні мати однакові значення; як описано нижче, це дозволяє одержати дану проміжну сполуку внаслідок додавання двох еквівалентів реагенту до речовинипопередника, що в свою чергу зменшує число стадій синтезу. Більш переважно R1a і R2a є метилтіогрупами. Проміжну сполуку формули (II) можна одержати декількома способами. Один переважний спосіб включає взаємодію проміжної сполуки формули (IV): де R3a і Y2 мають вказані вище значення і Μ означає метал, зі сполукою формули (V): 27 79925 де R1a і R2a мають вказані вище значення. У сполуці формули (IV) тип атома металу Μ не має принципового значення за умови, що дана сполука є досить реакційноздатною для приєднання до сполуки формули (V). Приклади прийнятних металованих сполук включають такі сполуки, в яких Μ означає Li, Na, K, Mg або Zn; у металованих сполуках, що містять іони двовалентних металів, може також бути присутнім ще один протиіон, такий як галоген, або така сполука може представляти диметалорганічну сполуку. Μ переважно означає Li. Сполуку формули (IV) звичайно одержують in situ металуванням відповідної галогеновмісної сполуки. Прийнятні реагенти добре відомі у даній області, і такі приклади включають сам метал або іншу більш активну сполуку, що металує, наприклад, похідне алкілметалу. Переважними є похідні алкіллітію і особливо переважним є бутиллітій. Сполуку формули (V) переважно одержують шляхом взаємодії проміжної сполуки формули (VI); де R1a має вказані значення і Μ означає метал, зі сполукою формули L1-CO-L2, де L1 і L2 мають однакові або різні значення і являють собою груп у, що видаляється. У сполуці формули (VI) тип атома металу Μ не має принципового значення за умови, що дана сполука є досить реакційноздатною для приєднання до сполуки формули L1-CO-L2. Приклади прийнятних металованих сполук включають сполуки, приведені як приклади для сполуки формули (IV). Μ переважно означає Li. Сполуку формули (VI) звичайно одержують in situ металуванням відповідної сполуки, що містить галоген, тобто сполуки формули (VIII): де R1a має вказані вище значення і X означає атом галогену, переважно бром або йод. Сполуку формули (VIII), в якій R1a означає метилтіо і X означає хлор, можна придбати комерційним шляхом. Відповідні сполуки, в яких X являє собою атом іншого галогену, можна одержати з відповідної хлоровмісної сполуки, [як це описано у 28 науковій літературі, див. Majeed, AJ; Antonsen, P.; Benneche, Т.; Undheim, К., Tetrahedron, 1989, 45, 993, і у приведеному нижче довідковому прикладі 1]. Прийнятні реагенти і способи металування сполуки формули (VIII) з одержанням сполуки формули (VI) добре відомі у даній області. Такі приклади включають сам метал або іншу більш активну сполук у, що металує, наприклад, похідне алкілметалу. Переважними є похідні алкіллітію і особливо переважним є бутиллітій. У сполуці формули L1-СО-L2 гр упи L1 і L2 можуть мати однакові або різні значення і являють собою групу, що видаляється, конкретний тип якої не має принципового значення. Необмежуючими прикладами прийнятних груп, що видаляються, є галоген, С1-С6алкокси, ді(С1-C6алкіл)аміно, азотвмісна гетероциклічна група (особливо імідазол) або нестійка складноефірна група, приведена вище у визначенні Υ1. Діетилкарбонат є особливо переважним прикладом сполуки формули L1-СОL2. В альтернативному переважному варіанті втілення винаходу сполуку формули (II) одержують шляхом взаємодії описаної вище проміжної сполуки формули (VI) з проміжною сполукою формули (VII): де R3a і Y2 мають вказані вище значення і Ζ означає групу, що видаляється. У сполуці формули (VII) гр упа Ζ є групою, що видаляється, приклади якої приведені вище з посиланням на Y1, L1 і L 2. Особливо переважно, якщо Ζ являє собою атом галогену, зокрема хлору, оскільки два еквіваленти металованої сполуки формули (VI) можна у чистому вигляді додавати до сполуки формули (VII). Після видалення груп Y1 і Y2 проміжну сполуку формули (II) переважно циклізують з одержанням проміжної сполуки формули (III): де R1a, R2a і R3a мають вказані вище значення. Групи Υ1 і Y2 переважно видаляють шляхом взаємодії проміжної сполуки формули (II) з триалкілсиланом формули RaRbRcSiH, де Ra, Rb і Rc можуть мати однакові або різні значення, і кожний з них являє собою С 1-C12алкільну груп у. Як вказаний реагент переважно використовують триетилсилан. 29 79925 Зазначену реакцію переважно здійснюють у присутності кислоти, конкретний тип якої не має принципового значення. Переважною є сильна органічна кислота, така як п-толуолсульфонова кислота або трифтороцтова кислота, і особливо переважною є трифтороцтова кислота. Проміжну сполуку формули (III) потім можна перетворити у сполуку формули (І) внаслідок взаємоперетворення функціональних гр уп, спосіб виконання якого відомий фахівцям у даній області. Як приклад можна зазначити, що аміногрупи відомої сполуки дезоксиваріоліну В (4), одержаного способом за даним винаходом, можна легко перетворити у різні функціональні похідні, як це показано на схемі І та проілюстровано прикладами нижче. Відповідно до альтернативного підходу можна одержати іншу груп у аналогів, вводячи функціональну групу у положенні С5 гетероароматичного кільця варіолінів. Це можна легко здійснити, окиснюючи проміжну сполуку (5) у сульфон (6) або сульфоксид (22), з подальшим виконанням реакцій нуклеофільного заміщення, як це показано на схемі II. Два особливо важливих взаємоперетворення не були раніше описані для варіолінів. 30 Тому ще одним об'єктом даного винаходу є спосіб одержання сполуки формули (І), де R 1 і R2 являють собою аміногрупи і R3 має вказані вище значення, який включає: a) обробку сполуки формули (III), де R1a і R2a являють собою метилсульфініл і R3a має вказані вище значення, сполукою формули NH2Prot, де Prot означає амінозахисну групу, з одержанням сполуки формули (II), де R1a і R2a являють собою захищені аміногрупи і R3a має вказані вище значення; і b) видалення амінозахисної групи з одержанням сполуки формули (І), де R1 і R2 являють собою аміногрупи і R3 має вказані вище значення. Тип амінозахисної групи не має принципового значення. Приклади прийнятних захисних гр уп, способи їх приєднання і видалення [описані у виданні T.W. Greene et al., «Protective Groups in Organic Synthesis», John Wiley & Sons, 1991], яке приведене як посилання. Захисна група переважно є заміщеною або незаміщеною бензильною групою або фталімідною групою, зокрема, п-метоксибензильною (РМВ) групою. Вказану груп у можна видалити будь-яким відомим способом, наприклад, у кислотних умовах (особливо у присутності сильної органічної кислоти, наприклад, трифторметансульфонової кислоти або трифтороцтової кислоти), в окисних умовах, наприклад, у присутності дихлордиціанобензохінону (DDQ), або у відновних умовах, наприклад, у присутності водню і паладієвого каталізатора. Переважний варіант такого способу проілюстрований на приведеній нижче схемі III, де перетворення дисульфоксиду (20) у дезоксиваріолін В (4) досягають за допомогою виконання двох стадій через біс-амін (29). Ще одним об'єктом даного винаходу є спосіб одержання сполуки формули (І), де R1 являє собою метилтіо- або аміногрупу, R2 являє собою аміногрупу і R3 має значення, вказані у п ункті 1, зі сполуки формули (III), де R1a і R2a являють собою метилтіо і R3a має значення, вказані у пункті 19, який включає: a) необов'язкове окиснення сполуки формули (III), де R1a і R2a означають метилтіо, у сполуку формули (III), де R1a і R2a являють собою метилсульфініл; і b) обробку сполуки формули (III), де R1a і R2a являють собою метилтіо або метилсульфініл, реагентом, вибираним з азиду натрію і аміаку. На стадії необов'язкового окиснення а) описаного вище способу можна використовувати будьякий окисник, здатний окиснювати прості тіоефіри у сульфоксиди. Необмежуючі приклади прийнятних окисників включають перекис водню, періодат 31 79925 32 натрію, трет-BuOCl, перборат натрію і перкислоти, такі як пероцтова кислота, м-хлорпербензойна кислота (mСРВА) або монопероксифталат магнію (ММРР), з яких переважними є перкислоти і особливо переважна м-хлорпербензойна кислота (mСРВА). Переважний варіант такого способу проілюстрований на приведеній нижче схемі IV, де проміжну сполуку (19) перетворюють у дезоксиваріолін В (4) в одну стадію через проміжний сульфоксид (20): Безпосереднє маніпулювання функціональною групою дозволяє перетворити проміжну сполуку (13) у відому сполук у варіоліну В (1) внаслідок виконання ще чотирьох стадій, як це проілюстровано на приведеній нижче схемі VII: Нова методика, що використовується для створення структури ядра варіоліну, дозволяє виконувати синтез дезоксиваріоліну В (4) з простої моногетероароматичної вихідної речовини (7) внаслідок виконання всього п'яти стадій. Вказаний синтез є набагато коротшим послідовності синтезу дезоксиваріоліну В, описаної у відомому рівні техніки. В альтернативному варіанті такого способу, проілюстрованому на приведеній нижче схемі V, проміжний простий дитіоефір (19) перетворюють у тіодезоксиваріолін (5) в одну стадію за допомогою обробки розчином аміаку: Особливо переважний варіант способу за даним винаходом проілюстрований на приведеній нижче схемі VI. Конкретні умови виконання даного способу детально описані у прикладах сполук, прикладах способів одержання і довідкових прикладах. Новий спосіб синтезу за даним винаходом дозволяє створити структур у ядра варіоліну, що включає конденсоване піридопіролопіримідинове ядро, яке несе гетероциклічне ароматичне кільце у положенні С5, як показано у формулі (13), з простої моногетероароматичної вихідної речовини (7) внаслідок виконання всього чотирьох стадій. Вказана коротка послідовність синтезу з восьми стадій з використанням комерційно доступної вихідної речовини (7) являє собою вперше описаний спосіб синтезу варіоліну В. Подібна методика забезпечує швидке одержання головної проміжної сполуки (19), що використовується для синтезу дезоксиваріоліну В і споріднених аналогів, як це проілюстровано на приведеній нижче схемі VIII і більш детально описано у прикладах сполук, прикладах способів одержання та довідкових прикладах. Описані вище способи одержання варіоліну В або дезоксиваріоліну В можна легко модифікувати для одержання інших похідних. Зокрема, даний винахід відноситься до нових сполук, які можна одержати з проміжних сполук, одержаних новим способом, який входить в об'єм даного винаходу. 33 79925 Таким чином, даний винахід відноситься до способів синтезу варіоліну В (1), дезоксиваріоліну В (4) і споріднених проміжних сполук, таких як сполука формули (5), і до способів одержання аналогів варіоліну. Шляхи синтезу відповідно до даного винаходу включають декілька стадій перетворення, які забезпечують одержання необхідного продукту. Кожна стадія сама по собі являє собою спосіб, що входить в об'єм даного винаходу. Даний винахід не обмежений описаними способами і може включати альтернативні способи, наприклад, відповідну зміну порядку стадій перетворення у випадку необхідності. У більш докладному викладі синтез варіоліну В відповідно до особливо переважного варіанту втілення даного винаходу включає вісім наведених нижче стадій: (a) перетворення комерційно доступного 4хлор-2-тіометилпіримідину (7) у йодозаміщену сполуку (8); (b) взаємодію сполуки (8) з діетилкарбонатом з одержанням симетричного кетону (9); (c) додавання сполуки (9) до розчину літійованої форми похідного піридину (11) з одержанням триарилового спирту (12); (d) послідовні дезоксигенування і циклізацію триарилового спирту (12) з використанням триетилсилану у поєднанні з трифтороцтовою кислотою; (e) окиснення проміжної сполуки (13) мхлорпербензойною кислотою (mСРВА) у дисульфоксид (14); (f) обробку сполуки (14) пметоксибензиламіном з одержанням біс-аміну (15); (g) перетворення метоксигрупи сполуки (15) у спирт (16) з використанням етантіолату натрію; (h) видалення п-метоксибензильних захисних груп сполуки (16) за допомогою трифторметансульфонової кислоти з одержанням варіоліну В (1). Такий синтез проілюстрований на приведеній нижче схемі IX. Вказані способи більш детально розглянуті у прикладах сполук, прикладах способів одержання та довідкових прикладах. В іншій переважній модифікації вихідну речовину (7) перетворюють у дезоксиваріолін В за до 34 помогою виконання інших приведених нижче п'яти стадій, які включають: (a) перетворення комерційно доступного 4хлор-2-тіометилпіримідину (7) у йодозаміщену сполуку (8); (b) взаємодію сполуки (8) з похідним піридину (17) з одержанням триарилового спирту (18); (c) дезоксигенування і циклізацію триарилового спирту (18), що здійснюють послідовно, з використанням триетилсилану у поєднанні з трифтороцтовою кислотою; (d) окиснення простого дитіоефіру (19) мхлорпербензойною кислотою (mСРВА) у дисульфоксид (20); (e) обробку сполуки (20) розчином аміаку з одержанням дезоксиваріоліну В (4). Такий синтез проілюстрований на приведеній нижче схемі X. Вказані способи більш детально розглянуті у прикладах сполук, прикладах способів одержання та довідкових прикладах. Як повинно бути очевидно фахівцеві у даній області, описані схеми реакцій можуть бути модифіковані і/або об'єднані різним чином і сполуки, одержані внаслідок таких змін, входять в об'єм даного винаходу. Зокрема, вихідна речовина і/або реагенти і реакції можуть бути змінені для відповідності іншим комбінаціям груп, що заміщують, у формулах з (І) по (VIII). Фармацевтичні композиції Приклади фармацевтичних композицій включають будь-які тверді (таблетки, пілюлі, капсули, гранули і т.д.) або рідкі (розчини, суспензії або емульсії) форми, призначені для перорального, місцевого або парентерального введення, які можуть містити чисту сполуку або у поєднанні з будьяким носієм або іншими фармакологічно активними сполуками. При парентеральному введенні вказані композиції повинні бути стерильними. Необхідні дози сполук можуть змінюватися в залежності від конкретного препарату, способу введення і, особливо, локалізації, хазяїна і виду пухлини, яка потребує лікування. При цьому необхідно враховувати інші фактори, такі як вік, маса тіла, стать, режим харчування, час введення, швидкість виведення з організму, стан суб'єкта, який потребує цього, комбінації лікарських засобів, що вводяться, чутливість до лікарських засобів і тяжкість захворювання. Введення можна здійсню 35 79925 вати безперервно або періодично з врахуванням максимально допустимої дози. Сполуки або композиції за даним винаходом можна вводити будь-яким прийнятним способом, таким як внутрішньовенне вливання, пероральне, внутрішньочеревне і внутрішньовенне введення. Цитотоксична активність Сполуки за даним винаходом перевірені відповідно до описаної нижче методики випробування. Колориметричний аналіз з використанням сульфородаміну В (SRB) був адаптований для кількісного вимірювання росту і життєздатності клітин: [див. Skehan, P.A. et al., J. Natl. Cancer Inst, 1990, 82, 1107-1112]. Вказаний аналіз виконують з використанням 96-ямкових мікропланшетів для культури клітин діаметром 9мм [Faircloth, G.T.; Stewart, D. and Clement, J.J., Journal of Tissue and Culture Methods, 1983, 11, 201-205; Mosmann, T. Journal of Immunological Methods, 1983, 65, 55-63]. Більшість ліній клітин, одержаних з Американської колекції типових культур (АТСС), відносяться до різних типів злоякісних пухлин людини. Клітини витримують у середовищі RPMI 1640 з 10% FBS, що містить 0,1г/л пеніциліну і 0,1г/л сульфату стрептоміцину, і потім інкубують при 37°С, 5% СО2 і 98% вологості. Для виконання експериментів клітини збирають з субконфлюентних культур, використовуючи трипсин, і повторно суспендують у свіжому середовищі до посіву. Клітини висівають на 96-ямкові титраційні мікропланшети у кількості 5´103клітин/ямку в 195мкл аліквотах середовища і залишають для прикріплення до поверхні планшету, вирощуючи клітини у середовищі, що не містить лікарського засобу, протягом 18 годин. Потім зразки піддають впливу 5мкл аліквот лікарських засобів у концентрації від 10 до 10-8мкг/мл, розчинених у ДМСО/EtOH (0,2% 36 у фізіологічному розчині з фосфатним буфером). Після впливу протягом 48 годин вимірюють протипухлинну дію SRB-методом: клітини фіксують, додаючи 50мкл холодної 50% (мас/об.) трихлороцтової кислоти (ТСА), та інкубують протягом 60 хвилин при 4°С. Планшети промивають деіонізованою водою і сушать. У кожну ямку титраційного мікропланшету додають 100мкл розчину SRB (0,4% мас/об, в 1% оцтовій кислоті) та інкубують протягом 10 хвилин при кімнатній температурі. Незв'язаний SRB видаляють, проводячи промивання 1% оцтовою кислотою. Планшети піддають повітряному сушінню і зв'язаний барвник солюбілізують трис-буфером. Оптичну щільність вимірюють за допомогою автоматичного спектрофотометру для зчитування планшетів при одній довжині хвилі, що дорівнює 490нм. Обчислюють середні значення ± стандартне відхилення для даних, одержаних з використанням зразків з трьох ямок. Вказаним способом можна обчислити деякі параметри реакції клітин: GI= гальмування росту, TGI= повне гальмування росту (цитостатичний ефект) і LC - лізис клітин (цитотоксичний ефект). Результати приведені у наведених нижче таблицях 1 і 2. Хоча сполуки (1), (4), (5) і (6) самі по собі не входять в об'єм даного винаходу, результати, приведені у таблицях, свідчать про протипухлинну активність, яка раніше не була виявлена у вказаних сполуках. Дана заявка претендує на пріоритет [заявок на патент Великобританії №0017055.5, поданої 11 липня 2000р., і №0030689.4, поданої 15 грудня 2000р.]. Обидва документи включені у даний опис винаходу як посилання у тій частині опису винаходу, яка повністю не відображається в описі винаходу даної заявки. Таблиця 1 Дані дослідження протипухлинної активності in vitro GI50 50% гальмування росту TGI Повне гальмування росту (цитостатичний ефект) LC50 50% чистий лізис клітин (цитотоксичний ефект) Тип пухлини: Сполука Лінія клітин: 1GI50 (М): Варіолін В (природTGI (M): ний) LC50 (М): GI50 (М): Дезоксиваріолін 4 TGI (M): LC50 (М): GI50 (М): Тіодезоксиваріолін 5 TGI (M): LC50 (М): NSCL кишки А-549 7,Е-07 1,Е-06 3,Е-06 1,Е-07 2,Е-07 4,Е-07 1,Ε-06 3,Е-06 1,Ε-05 ободової НТ-29 7,Е-07 1,Е-06 3,Е-06 7,Е-08 2,Е-07 1,Ε-05 6,Е-07 2,Е-06 1,Ε-05 меланома SW-620 1,Ε-07 3,Е-07 2,Е-06 7,Е-08 3,Е-07 1,Ε-05 3,Е-06 1,Ε-05 3,Е-05 MEL-28 7,Е-07 1,Е-06 2,Е-06 7,Е-08 1,Е-07 3,Е-07 6,Е-08 3,Е-07 6,Е-06 37 79925 38 Продовження Таблиці 1 Тип пухлини: Сполука Яєчника Лінія клітин: GI50 (М): Варіолін В 1 (природTGI (M): ний) LC50 (М): GI50 (М): Дезоксиваріолін 4 TGI (M): LC50 (М): GI50 (М): Тіодезоксиваріолін5 TGI (M): LC50 (М): Нирки OVC AR-3 А498 1,Ε-07 3,Е-07 2,Е-06 7,Е-08 2,Е-07 7,Е-07 6,Е-07 2,Е-06 3,Е-06 1,Ε-07 3,Ε-07 4,Е-07 1,Ε-06 2,Е-06 3,Е-06 Передміхурової залози DU-145 1,Ε-07 3,Е-07 1,Ε-06 1,Ε-07 3,Ε-07 7,Ε-06 3,Ε-07 1,Ε-06 3,Ε-06 Молочної залози MCF-7 7,Ε-07 2,Ε-06 2,Ε-06 1,Ε-07 3,Ε-07 4,Ε-06 2,Ε-06 6,Ε-06 3,Ε-05 МВ-231 3,Ε-07 1,Ε-06 3,Ε-06 7,Ε-08 3,Ε-07 3,Ε-05 2,Ε-06 6,Ε-07 1,Ε-05 Таблиця 2 Дані дослідження протинухлинної активності in vitro (M) Сполука № 19 20 22 23а 23b 23с 23d 23e 24a 24b 26 27 28d 28b 28a 28c 29 1 6 Молекулярна маса 339,4 371,4 324,4 361,4 403,4 445,4 319,3 361,4 407,4 667,7 373,3 292,3 367,4 305,3 345,4 347,42 517,6 293,3 340,4 R1 SMe SOMe SOMe N(Ac)2 N(Ac)2 N(Ac)2 NHAc NHAc N(цинаміл)2 N(цинаміл)2 NHCOCF3 OMe NHBn NHEt піперидиніл NMeBu NHPMB NH2 SO2 Me R2 SMe SOMe NH2 NH2 NHAc N(Ac)2 NH2 NHAc NH2 NНцинаміл NH2 NH2 NH2 NH2 NH2 NH2 NHPMB NH2 NH2 R3 Η Η Η Η Η Η Η Η Η Η Η Η Η Η Η Η Η ОН Η 39 79925 40 Продовження Таблиці 2 Сполука № 19 20 22 23а 23b 23с 23d 23е 24а 24b 26 27 28d 28b 28а 28с 29 1 6 GI50 5,9 10-6 5,4 10-5 1,2 10-6 2,8 10-7 7,4 10-7 2,2 10-6 6,3 10-7 2,2 10-6 1,2 10-7 3,0 10-6 2,7 10-7 6,8 10-8 1,4 10-6 >3,3 10-5 8,7 10-6 2,9 10-6 >9,7 10-5 1,7 10-7 4,4 10-6 А-549 TGІ 1,2 10-5 >1,3 10-4 6,2 10-6 1,4 10-6 2,0 10-6 1,3 10-5 1,6 10-6 5,5 10-6 1,2 10-6 7,5 10-6 1,3 10-6 3,4 102,7 10-6 >3,3 10-5 2,3 10-5 8,7 10-6 >9,7 10-5 6,8 10-7 1,5 10-4 LC50 2,9 10-5 >1,3 10-5 9,2 10-5 2,8 10-6 7,4 10-6 2,2 10-5 3,2 10-6 2,8 10-5 1,2 10-5 7,5 10-5 2,7 10-5 2,7 10-6 2,7 10-5 >3,3 10-5 >2,9 10-5 2,3 10-5 >9,7 10-5 1,7 10-4 >1,5 10-4 Приклади У приведених нижче прикладах описані способи одержання цільових і проміжних сполук за даним винаходом. У прикладах способів одержання описані способи одержання відомих сполук, що входять в об'єм даного винаходу. Одержання проміжних сполук, що не входять в об'єм даного винаходу, описане у довідкових прикладах. За винятком особливо обумовлених випадків всі реакції виконують в інертній атмосфері у заздалегідь висушеному скляному посуді. Всі органічні екстракти промивають водою та насиченим розчином солі і сушать над MgSO4 до концентрування у вакуумі. Температури плавлення визначені в апараті з нагрівом Кофлера і не скореговані. Приклад 1. Сполука 13 Суміш триарилового спирту 12 (100мг, 0,237моль) (одержаного у приведеному нижче прикладі 16) і трифтороцтової кислоти (37мкл, 0,48моль) розчиняють у 1,2-дихлоретані (0,5мл). Оранжевий розчин, що утворився, переносять у пробірку Янга з гумовою мембраною, яка містить триетилсилан (0,30мл, 1,9моль). У сильному потоці аргону мембрану замінюють тефлоновою® кришкою, що загвинчується, і герметично закриту реакційну посудину нагрівають при 100°С протягом 43 годин. Посудину охолоджують, відкривають і вміст розводять СН 2Сl2 (12мл). Розчин нейтралі GI50 5,9 10-6 1,1 10-4 9,2 10-7 1,4 10-7 1,0 10-7 1,1 10-7 6,3 10-7 5,5 10-6 4,9 10-6 1,5 10-6 8,0 10-7 1,7 10-7 1,4 10-6 >3,3 10-5 5,8 10-6 2,9 10-6 >9,7 10-5 1,0 10-6 2,9 10-5 НТ-29 TGI 1,5 10-5 >1,3 10-4 1,5 10-5 2,8 10-7 1,7 10-6 2,0 10-6 1,6 10-6 >2,8 10-5 1,2 10-5 1,5 10-5 1,3 10-5 3,4 10-7 2,4 10-6 >3,3 10-5 2,0 10-5 8,7 10-6 >9,7 10-5 1,7 10-5 1,5 10-4 LC50 2,9 10-5 >1,3 10-4 >1,5 10-4 2,8 102,5 10-6 1,8 10-5 3,2 10-6 >2,8 10-5 >1,2 10-4 7,5 10-5 1,1 10-4 3,4 10-5 2,2 10-5 >3,3 10-5 >2,9 10-5 2,3 10-5 >9,7 10-5 >1,7 10-4 >1,5 10-4 зують 5% розчином NaHCO3 (8мл) і розділяють фази. Водний шар повторно екстрагують СН 2Сl2 і органічні екстракти обробляють стандартним способом. Сиру речовину очищають флешхроматографією на силікагелі, проводячи градієнтне елюювання (48-75% EtOАс/гексани), і одержують у порядку елюювання: (1) структур у ядра варіоліну 13 у вигляді жовтої твердої речовини (41мг, 47%): Т.п.: 192-194°С; 1H ЯМР (500МГц, CDCI3): δ 2,65 (с, 3Н), 2,70 (с, 3Н), 4,03 (с, 3Н), 6,92 (д, J=5,4Гц, 1Н), 7,40 (д, J=5,4Гц, 1Н), 7,71 (д, J=6,8Гц, 1Н), 7,98 (д, J=6,8Гц, 1Н), 8,48 (м, 2Н); 13С ЯМР (75МГц, CDCI3): δ 14,1, 14,9, 55,6, 101,9, 102,5, 108,5, 110,8, 117,7, 135,9, 138,6, 143,5, 144,3, 154,2, 155,6, 159,6, 161,1, 171,2; HRMS: обчислено для C17H15N5O32S2 (M+) 369,0718, знайдено 369,0720. і (2) нециклізований простий ефір 13а у вигляді в'язкої смоли (28мг, 28%) 1 Н ЯМР (500МГц, CDCI3): δ 2,36 (с, 3Н), 2,44 (с, 3Н), 3,84 (с, 3Н) 6,57 (д, 1=5,9Гц, 1Н), 6,80 (д, J=5,9Гц, 1Н), 7,17 (д, J=4,9Гц, 1Н), 7,79 (с, 1Н), 8,27 (д, J=5,9Гц, 1Н), 8,30 (д, J=5,9Гц, 1Н), 8,49 (д, J=4,9Гц, 1Н); 13С ЯМР (75МГц, CDCI3): δ 14,0 (х2), 56,2, 71,8, 103,5, 106,4, 112,9, 120,8, 150,7, 152,5, 157,1, 158,0, 166,0, 167,1, 167,3, 172,1, 172,4; HRMS: обчислено для C17H1635ClN5O232S2 (M+) 421,0434, знайдено 421,0444. 41 79925 Приклад 2. Сполуки 14 і 15 Біс-сульфід 13 (37мг, 0,10моль) розчиняють у СНСI3 (5мл) в атмосферних умовах і охолоджують на бані з температурою -40°С. Попередньо охолоджений (-40°С) розчин м-хлорпербензойної кислоти у СНСI3 (10мг/мл) по краплях додають до розчину до повного зникнення вихідної речовини (використано приблизно 2екв. m-СРВА) за результатами аналізу ТШХ. Розчин нагрівають до кімнатної температури і нейтралізують насиченим розчином NaHCO3. Одержаний розчин повторно екстрагують СН 2Сl2 і після стандартної обробки одержують жовту тверду речовину, яка в основному являє собою суміш діастереомерних біссульфоксидів. Сиру суміш використовують без очищення, однак біс-сульфоксиди 14 мають наведені нижче спектроскопічні характеристики: 1 H ЯМР (500МГц, CDCI3) (більшість сигналів для діастереоізомерів співпадають, однак, оскільки вони являють собою декілька сполук, всі вказані сигнали кваліфікуються як мультиплети) δ 3,02 (м, 3Н), 3,19 (м, 3Н), 4,12 (м, 3Н), 7,00-7,01 (м, 1Н), 7,98-7,99 (м, 1Н), 8,12-8,14 (м, 1Н), 8,48-8,49 (м, 1Н), 8,64-8,67 (м, 1Н), 8,79-8,81 (м, 1Н). Сиру окиснену речовину нагрівають з надлишком п-метоксибензиламіну (0,15мл, 1,1моль) при 85°С протягом 15 годин. Сиру червону пасту очищають флеш-хроматографією на силікагелі, проводячи градієнтне елюювання (2,5-4% МеОН/СН2Сl2). Жовті фракції повторно хроматографують, проводячи градієнтне елюювання (від 50% ЕtOАс/СН2Сl2 до 100% ЕtOАс), і одержують біс-амін 15 у вигляді жовтої твердої речовини (43мг, 78% протягом двох стадій). Т.п. 74-77°С; 1Н ЯМР (500МГц, CDCI3): δ 3,81 (с, 6Н), 3,99 (с, 3Н), 4,66 (д, J=5,6Гц, 2Н), 4,85 (д, J=5,5Гц, 2Н), 5,51 (м, 1Н), 6,82 (д, J=5,6Гц, 1Н), 6,89 -6,91 (м, 4Н), 7,00 (д, J=5,2Гц, 1Н), 7,29 (м, 1Н), 7,34 (д, J=8,5Гц, 2Н), 7,39 (д, J=8,5Гц, 2Н), 7,43 (м, 1Н), 8,16 (д, J=5,6Гц, 1Н), 8,26 (д, J=5,lГц, 1Н), 10,39 (м, 1Н); 13С ЯМР (75МГц, CDCI3): δ 44,3, 44,9, 55,3 (2хСН3), 55,5, 101,3, 101,6, 101,8, 111,4, 112,2, 114,0 (х2), 128,5, 128,8, 130,5, 131,4, 137,5, 141,5, 141,9, 144,7, 148,7, 154,6 (шир.), 158,7, 158,9, 159,4, 160,9, 162,6; HRMS: обчислено для C31H29N7 O3 (M+) 547,2332, знайдено 547,2334. Приклад 3. Сполука 16 42 NaH (60%, 60мг, 1,5моль) тричі промивають петролейним ефіром і суспендують у сухому ДМФА (1/5мл). С успензію, що перемішується, охолоджують на льоді і по краплях додають етантіол (0,14мл, 1,9моль). Після припинення виділення газу прозорий розчин перемішують при кімнатній температурі протягом 10 хвилин. Порцію розчину NaS в Et (1,1мл) додають до розчину біс-аміну 15 (40мг, 0,073моль) у сухому ДМФ (1,5мл) і суміш перемішують при 50°С протягом 7 годин. Одержаний розчин охолоджують, додають водний розчин NH4CI і суміш екстрагують ЕtOАс (3 рази). Органічні екстракти тричі промивають водою, щоб видалити ДМФА, і виконують звичайну обробку. Жовту тверду речовину, що утворилася, очищають флеш-хроматографією на силікагелі, використовуючи як елюент 3% МеОН/СН2Сl2, і одержують спирт 16 у ви гляді жовтої твердої речовини (34мг, 87%). 1 Н ЯМР (500МГц, CDCI3): δ 3,80 (с, 3Н), 3,81 (с, 3Н), 4,61 (д, J=5,5Гц, 2Н), 4,85 (д, J=5,4Гц, 2Н), 5,35 (м, 1Н), 6,76 (д, J=5,5Гц, 1Н), 6,88-6,92 (м, 4Н), 7,03 (д, J=6,8Гц, 1Н), 7,06 (д, J=5,7Гц, 1Н), 7,32 (д, J=8,4Гц, 2Н), 7,40 (д, J=8,4Гц, 2Н), 7,68 (д, J=6,8Гц, 1Н), 8,05 (д, J=5,5Гц, 1Н), 8,29 (д, J=5,7Гц, 1Н), 10,94 (м, 1Н), 15,75 (шир. с, 1Н); 13С ЯМР (75МГц, CDCI3): δ 44,3, 45,2, 55,3 (2хСН3), 100,3, 100,5, 106,9, 107,5, 111,4, 114,1 (2хС), 128,8, 129,2, 130,2 (2хС), 137,5, 142,8, 143,8, 145,4, 149,7, 158,6, 158,9, 159,0, 159,5, 159,8, 160,0; HRMS: обчислено для C30H27N7O 3 (Μ") 533,2175, знайдено 533,2185. Приклад 4. Сполука 19 Суміш спирту 18 (одержаного у приведеному нижче прикладі 17) (1,04г, 2,65моль), триетилсилану (3,4мл, 21,5моль) і трифтороцтової кислоти (0,81мл, 10,6моль) нагрівають зі зворотним холодильником протягом 3 годин. Одержану суміш охолоджують, червоний залишок розчиняють у СН2Сl2 (40мл) і додають насичений розчин NaHCO3. Коричневу суміш перемішують протягом 1 години при кімнатній температурі і шари розділяють. Водний шар екстрагують СН 2Сl2 (3´50мл), об'єднані органічні шари сушать, фільтр ують і концентрують при зниженому тиску. Червоний залишок очищають флеш-хроматографією, використовуючи як елюент етилацетат:гексан (1:4) етилацетат:гексан (1:3), і одержують піридопіролопіримідин 19 (0,3г, 33%) у вигляді блідо-жовтої твердої речовини. 1 Н ЯМР (300МГц, CDCI3): 8,64 (дд, J=8,l і 1,7Гц, 1Н), 8,60 (дд, J=4,6 і 1,7Гц, 1Н), 8,51 (д, J=5,4Гц, 1Н), 8,06 (д, J=6,4Гц, 1Н), 7,82 (д, J=6,6Гц, 1Н), 7,51 (дд, J=8,5 і 4,6Гц, 1Н), 7,34 (д, J=5,4Гц, 1Н), 2,73 (с, 3Н), 2,68 (с, 3Н). Приклад 5. Сполуки 20 і 29 43 79925 Окиснення біс-сульфіду 19 у біс-сульфоксид 20 здійснюють способом за прикладом 2. Суміш п-метоксибензиламіну (2мл) і біссульфінілдезоксиваріоліну 20 (30мг, 8,1´10-5моль) перемішують при 95°С протягом 2 годин та упарюють при зниженому тиску. Червоний залишок очищають флеш-хроматографією, використовуючи як елюент дихлорметан (DCM)/MeOH (0,2%) DCM/MeOH (2%), і одержують N',N-біс(пметоксибензил)дезоксиваріолін 29 (21мг, 49%) у вигляді жовтої олії. 1 Н ЯМР (300МГц, CDCI3): 10,4 (шир.с, 1Н), 8,56 (д, J=7,8Гц, 1Н), 8,31 (д, J=5,4Гц, 1Н), 8,27 (дд, J=5,2 і 1,1Гц, 1Н), 7,63 (д, J=6,8Гц, 1Н), 7,42-7,33 (м, 12Н), 6,98 (д, J=5,4Гц, 1 Н), 6,93-6,89 (м, 4Н), 5,52 (шир.с, 1Н), 4,89 (д, J=5,4Гц, 2Н), 4,69 (д, J=5,9Гц, 2Н), 3,81 (с, 3Н), 3,80 (с, 3Н). Приклад 6. Сполука 28а Піперидин (0,04мл, 0,4моль) додають до розчину сульфінілдезоксиваріоліну 22 (7мг, 2,1´105 моль) (одержаного у приведеному нижче прикладі способу одержання 5) у ТГФ (2мл). Жовтий розчин перемішують при 70°С протягом ночі та упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (3%), і одержують піперидинілдезоксиваріолін 28а (5,6мг, 78%) у вигляді жовтої олії. 1 Н ЯМР (300МГц, CDCI3): 8,63 (дд, J=8,4 і 1,5Гц, 1Н), 8,38 (дд, J=4,8 і 1,7Гц, 1Н), 8,35 (д, J=5,4Гц, 1H), 7,60 (д, J=6,6Гц, 1Н), 7,50 (д, J=6,6Гц, 1Н), 7,46 (дд, J=8,0 і 4,6Гц, 1Н), 6,84 (д, J=5,4Гц, 1Н), 3,92 (шир.с, 4Н), 1,73 (шир.с, 6Н). MS (електророзпилювальна іонізація, ESI) 346 (M+1). Приклад 7. Сполука 28b Етиламін (0,34мл, 2Μ розчин у МеОН) додають до розчину сульфініл-дезоксиваріоліну 22 (одержаного у приведеному нижче прикладі способу одержання 5) (11мг, 3,4´10-5моль) у ТГФ (2мл). Жовтий розчин перемішують при 70°С про 44 тягом ночі та упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) DCM/MeOH (4%), і одержують N'етилдезоксиваріолін 28b (5,5мг, 53%) у вигляді жовтої олії. 1 Н ЯМР (300МГц, CDCI3): 8,67 (дд, J=7,9 і 1,4Гц, 1Н), 8,36 (д, J=4,4Гц, 1Н), 8,22 (д, J=4,8Гц, 1Н), 7,52 (шир.с, 2Н), 7,45 (дд, J=7,8 і 4,1Гц, 1Н), 6,93 (д, J=5,lГц, 1Н), 3,54 (д, J=6,8Гц, 2Н), 1,29 (т, J=7,0Гц, 3Н). (ESI) 306 (М+1). Приклад 8. Сполука 28с Бутилметиламін (0,029мл, 0,24моль) додають до розчину сульфініл-дезоксиваріоліну 22 (одержаного у приведеному нижче прикладі способу одержання 5) (8мг, 2,4´10-5моль) у ТГФ (2мл). Жовтий розчин перемішують при 70°С протягом ночі та упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) -DCM/MeOH (4%), і одержують N'-бутилметилдезоксиваріолін 28с (2мг, 62% з врахуванням виділеної вихідної речовини) у вигляді жовтої олії. 1 H ЯМР (300МГц, CDCI3): 8,75 (д, 1Н), 8,41 (дд, 1Н), 8,39 (д, J=5,5Гц, 1Н), 7,78 (д, J=6,5Гц, 1Н), 7,68 (д, 1=6,5Гц, 1Н), 7,42 (дд, J=8,0 і 4,5Гц, 1Н), 6,89 (д, J=5,6Гц, 1Н), 3,60 (шир.с, 2Н), 3,41 (с, 3Н), 1,62 (шир.с, 4Н), 1,05 (шир.с, 3Н). (ESI) 348 (М+1). Приклад 9. Сполука 28d Бензиламін (0,050мл, 0,45моль) додають до розчину сульфінілдезокси-варіоліну 22 (4мг, 1,2´10-5моль) у ТГФ (1,5мл). Жовтий розчин перемішують при 70°С протягом ночі та упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) -DCM/MeOH (4%), і одержують N'-бензилдезоксиваріолін 28d (2,1мг, 47%) у вигляді жовтої олії. 1 Н ЯМР (300МГц, CDCI3): 8,81 (шир.с, 1Н), 8,75 (д, J=7,lГц, 1Н), 8,64 (д, J=6,0Гц, 1Н), 7,49-7,31 (м, 8Н), 6,99 (д, J=6,2Гц, 1Н), 4,78 (д, J=5,8Гц, 2Н). (ESI) 368 (М+1). Приклад 10. Сполука 27 45 79925 Розчин сульфонілдезоксиваріоліну 6 (одержаного у приведеному нижче прикладі способу одержання 5) (5,8мг, 1,7´10-5моль) в МеОН (2мл) додають до розчину метоксиду натрію в МеОН (2мл) при 0°С. Жовтий розчин перемішують при 24°С протягом 4 годин, гасять насиченим розчином NH4Cl і екстрагують етилацетатом (3´10мл). Об'єднані органічні шари сушать, фільтрують і упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (1%) - DCM/MeOH (3%), і одержують метоксидезоксиваріолін 27 (2,6мг, 53%) у вигляді жовтої твердої речовини. 1 Н ЯМР (300МГц, CDCI3): 8,78 (dd, J=8,1 і 1,5Гц, 1Н), 8,51 (д, J=5,43Гц, 1Н), 8,41 (дд, J=4,6 і 1,5Гц, 1Н), 7,69 (д, J=6,6Гц, 1Н), 7,63 (д, J=6,6Гц, 1Н), 7,50 (дд, J=8,1 і 4,6Гц, 1Н), 7,34 (д, J=5,4Гц, 1Н), 4,14 (с, 3Н). (ESI) 293 (M+1). Приклад 11. Сполука 26 Трифтороцтовий ангідрид (6мкл, 4,3´10-5моль) додають до розчину дезоксиваріоліну 4 (4мг, 1,4´10-5моль) у ТГФ (1,5мл). Жовтий розчин перемішують при 24°С протягом ночі та упарюють при зниженому тиску. Жо втий залишок розчиняють у DCM (5мл) і промивають насиченим розчином NaHCO3 (4мл). Органічний шар сушать, фільтрують і упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (4%), і одержують N'-трифторацетилдезоксиваріолін 26 (0,9мг, 43% з врахуванням виділеної вихідної речовини) у ви гляді жовтої олії. 1 Н ЯМР (300МГц, CDCI3): 8,99 (дд, J=8,4 і 1,1Гц, 1Н), 8,57 (д, J=5,6Гц, 1Н), 8,42 (дд, J-4,6 і 1,3Гц, 1Н), 7,91 (д, J=6,7Гц, 1Н), 7,79 (д, J=6,6Гц, 1Н), 7,58 (дд, J=8,3 і 4,3Гц, 1Н), 7,52 (д, J=5,6Гц, 1H). (ESI) 374 (М+1). Приклад 12. Сполука 25 46 Метансуль фонілхлорид (5,5мкл, 5´10-5моль) додають до розчину дезоксиваріоліну 4 (одержаного у приведеному нижче прикладі способу одержання 2 або 4) (5мг, 1,8´10-5моль) і Et3N (5мкл, 3,6´10-5моль) у ТГФ (1,5мл). Жовтий розчин перемішують при 24°С протягом ночі та упарюють при зниженому тиску. Жо втий залишок розчиняють у DCM (5мл) і промивають насиченим розчином NaHCO3 (4мл). Органічний шар сушать, фільтрують і упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (4%), і одержують N'-метансульфонілдезоксиваріолін 25 (1,5мг, 46% з врахуванням виділеної вихідної речовини) у вигляді жовтої олії. 1 Н ЯМР (300МГц, CDCI3):8,89 (дд, J=7,9 і 1,1Гц, 1Н), 8,76 (д, J=5,7Гц, 1Н), 8,42 (дд, J=4,2 і 1,2Гц, 1Н), 7,78 (д, J=6,4Гц, 1Н), 7,72 (д, J=6,5Гц, 1Н), 7,64 (д, J=5,6Гц, 1Н), 7,57 (дд, J=8,3 і 4,3Гц, 1Н), 3,15 (с, 3Н). Приклад 13. Сполуки 24а і 24b Цинамоїлхлорид (9мкл, 5,4´10-5моль) додають до розчину дезоксиваріоліну 4 (5мг, 1,8´10-5моль) (одержаного у приведеному нижче прикладі способу одержання 2 або 4) і Et3N (12мкл, 5,4´105 моль) у ТГФ (2мл). Відразу ж однією порцією додають диметиламінопіридин (DMAP) (1мг, 0,9´105 моль), жовтий розчин перемішують при 24°С протягом ночі та упарюють при зниженому тиску. Жовтий залишок розчиняють у DCM (5мл) і промивають насиченим розчином NaHCO3 (4мл). Органічний шар сушать, фільтрують і упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (1%) - DCM/MeOH (4%), і одержують N'-бісцинамоїл-дезоксиваріолін 24а (1,1мг, 21% з розрахунку на виділену вихідн у речовину) і N'бісцинамоїл-N-цинамоїлдезоксиваріолін 24b (0,6мг, 9% з врахуванням виділеної вихідної речовини) у ви гляді жовтих олій. 1 Н ЯМР (300МГц, CDCI3): 8,78 (д, J=6,4Гц, 1Н), 8,69 (дд, J=7,4 і 1,1Гц, 1Н), 8,38 (дд, J=4,6 і 1,2Гц, 1Н), 7,91 (д, J=15,3Гц, 2H), 7,64-7,32 (м, 14Н), 6,90 (д, J=15,6Гц, 2Н). (ESI) 560 (M+Na), 538 (М+1). 47 79925 1 Н ЯМР (300МГц, CDCI3): 8,82 (д, J=6,4Гц, 1Н), 8,79 (дд, J=7,4 і 1,1Гц, 1Н), 8,58 (дд, J=4,6 і 1,3Гц, 1Н), 8,01-7,82 (м, 4Н), 7,71 (д, J=15,3Гц, 2Н), 7,64 (дд, J=8,3 і 4,2Гц, 1Н), 7,58-7,31 (м, 16Н), 6,90 (д, J=15,6Гц, 3Н). (ESI) 668 (М+1), 690 (M+Na). Приклад 14. Сполуки 23а, 23b і 23с Ацетилхлорид (3,5мкл, 4,8´10-5моль) додають до розчину дезоксиваріоліну 4 (9мг, 3,2´10-5моль) (одержаного у приведеному нижче прикладі способу одержання 2 або 4) і Et3N (9мкг, 6,5´10-5моль) у ТГФ (2мл). Оранжеву суспензію перемішують при 24°С протягом ночі та упарюють при зниженому тиску. Жовтий залишок розчиняють у DCM (5мл) і промивають насиченим розчином NaHCO3 (4мл). Органічний шар сушать, фільтрують і упарюють при зниженому тиску. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (5%), і одержують N'-бісацетилдезоксиваріолін 23а (1мг, 26% з врахуванням виділеної вихідної речовини), N'-бісацетил-N-ацетилдезоксиваріолін 23b (1мг, 23% з врахуванням виділеної вихідної речовини) і N'-бісацетил-N-бісацетилдезоксиваріолін 23с (0,5мг, 10% з врахуванням виділеної вихідної речовини) у вигляді жовтих олій. 1 H ЯМР (300МГц, CDCI3): 8,76 (д, J=5,6Гц, 1Н), 8,68 (дд, J=6,9 і 1,1Гц, 1Н), 8,42 (дд, J=4,l і 1,2Гц, 1Н), 7,73 (д, J=6,6Гц, 1Н), 7,66 (д, J=6,6Гц, 1Н), 7,54-7,42 (м, 2Н), 2,41 (с, 6Н). (ESI) 384 (M+Na). 48 1 Н ЯМР (300МГц, CDCI3): 8,82 (д, J=5,6Гц, 1Н), 8,72 (дд, J=7,8 і 1,2Гц, 1Н), 8,53 (дд, J=4,4 і 1,2Гц, 1Н), 7,90 (д, J=6,4Гц, 1Н), 7,87 (д, J=6,5Гц, 1Н), 7,70 (д, J=5,4Гц, 1Н), 7,60 (дд, J=8,3 і 4,9Гц, 1Н), 2,68 (с, 3Н), 2,40 (с, 6Н). (ESI) 426 (M+Na), 404 (М+1). 1 Н ЯМР (300МГц, CDCI3): 8,88 (д, J=5,4Гц, 1Н), 8,63 (дд, J=8,3 і 1,7Гц, 1Н), 8,56 (дд, J=4,6 і 1,3Гц, 1Н), 8,36 (д, J=6,7Гц, 1Н), 7,99 (д, J=6,6Гц, 1Н), 7,75 (д, J=5,5Гц, 1Н), 7,58 (дд, J=8,3 і 4,6Гц, 1Н), 2,43 (с, 12Н). (ESI) 468 (M+Na). Приклад 15. Сполуки 23d і 23e Ацетилхлорид (1,5мкл, 1,8´10-5моль) додають до розчину дезоксиваріоліну 4 (одержаного у приведеному нижче прикладі способу одержання 2 або 4) (5мг, 1,8´10-5моль) і Et3N (4мкл, 2,7´105 моль) у ТГФ (1,5мл) при -78°С. Оранжеву суспензію перемішують протягом ночі, дуже повільно підвищуючи температур у до кімнатної температури, і потім упарюють при зниженому тиску. Жовтий залишок розчиняють у DCM (5мл) і промивають насиченим розчином NaHCO3 (4мл). Органічний шар сушать, фільтрують і упарюють при зниженому тиску. Жовтий залишок очищають флешхроматографією, використовуючи як елюент DCM/MeOH (1%) - DCM/MeOH (4%), і одержують N'-ацетил-N-ацетилдезокси варіолін 23d (1мг, 26%) і N'-ацетилдезоксиваріолін 23е (0,5мг, 10%) у вигляді жовтих олій. 49 79925 1 H ЯМP (300МГц, CDCI3):8,83 (дд, J=7,4 і 1,4Гц, 1Н), 8,52 (д, J=6,2Гц, 1Н), 8,41 (дд, J=4,2 і 1,4Гц, 1Н), 7,75-7,71 (м, 2Н), 7,56-7,48 (м, 1Н), 7,39 (д, J=6,3Гц, 1Н), 2,43 (с, 3Н). (ESI) 342 (M+Na). 1 H ЯМP (300МГц, CDCI3): 8,91 (дд, J=7,4 і 1,4Гц, 1Н), 8,58 (д, J=6,2Гц, 1Н), 8,52 (дд, J=4,2 і 1,4Гц, 1Н), 8,19 (д, J=6,4Гц, 1Н), 8,03 (шир.с, 1Н), 7,85 (д, J=6,5Гц, 1Н), 7,61 (дд, J=8,3 і 4,9Гц, 1Н), 7,39 (д, J=6,lГц, 1Н), 2,65 (с, 3Н), 2,43 (с, 3Н). (ESI) 384 (M+Na). Приклад 16. Сполука 12 2-хлор-4-метоксипіридин (11) (довідковий приклад 3) (0,633г, 4,41моль) розчиняють у щойно перегнаному ТГФ (18мл) і реакційну суміш охолоджують до температури нижче -90°С. н-BuLi у гексанах (1,6Μ розчин, 2,9мл, 4,5моль) додають до розчину, що перемішується, протягом 17 хвилин, підтримуючи температур у нижче -97°С. Оранжевий розчин перемішують при -78°С протягом 1 години, внаслідок чого він набуває темночервоного забарвлення. Реакційну суміш знову охолоджують до температури нижче -90°С і протягом 11 хвилин додають розчин кетону (9) (1,14г, 4,09моль) у ТГФ (10мл), підтримуючи температуру нижче -90°С. Темну суміш перемішують при -78°С протягом 3,5 годин, гасять метанолом і залишають нагріватися до кімнатної температури. Потім реакційну суміш струшують з водним розчином NH4Cl, екстрагують етилацетатом (3 рази) і піддають стандартній обробці. Сиру суміш очищають флешхроматографією на силікагелі, проводячи градієн 50 тне елюювання (70-75% ЕtOАс/гексани), і одержують триариловий спирт 12 у вигляді кремової твердої речовини (1/32г, 76%). 1 Н ЯМР (500МГц, CDCI3): δ 2,49 (с, 6Н), 3,43 (с, 3Н), 6,55 (с, 1Н), 6,76 (д, J=5,4Гц, 1Н), 7,39 (д, J=5,4Гц, 2Н), 8,25 (д, J=5,4Гц, 1Н), 8,46 (д, J=5,4Гц, 2Н); 13С ЯМР (75МГц, CDCI3): δ 14,1, 55,8, 78,0, 107,1, 113,7, 124,8, 149,8, 152,3, 157,2, 165,9, 171,0, 171,1; IR (розчин CDCI3): 3344см -1; HRMS: обчислено для C17H1635ClN5O2 32S2 (M+) 421,0434, знайдено 421,0448. Приклад 17. Сполука 18 BuLi (6,9мл, 2,5Μ розчин у гексані) додають по краплях до розчину йодпіримідину 8 (довідковий приклад 1) (4,3г, 17моль) у ТГФ (50мл) при -100°С. Чорний розчин перемішують протягом 30 хвилин при тій же температурі. За допомогою канюлі додають розчин 2-хлорнікотиноїлхлориду 17 (1г, 5,7моль) у ТГФ (7мл), заздалегідь охолоджений при -78°С. Інтенсивно забарвлену червону суміш перемішують протягом 3 годин при -95°С і додають насичений розчин NH 4Cl (50мл). Шари розділяють і водний шар екстрагують діетиловим ефіром (3´100мл). Об'єднані органічні шари сушать, фільтрують і концентрують при зниженому тиску. Червоний залишок очищають флешхроматографією, використовуючи як елюент етилацетат:гексан (1:3,5) - етилацетат:гексан (1:1,5), і одержують спирт 18 (1,3г, 58%) у вигляді блідооранжевої твердої речовини. 1 Н ЯМР (300МГц, CDCI3): 8,56 (д, J=5,1Гц, 2Н), 8,37 (дд, J=4,7 і 1,5Гц, 1Н), 7,39 (д, J=5,1Гц, 2Н), 7,22 (дд, J=7,8 і 1,9Гц, 1Н), 7,17 (дд, J=7,8 і 4,4Гц, 1Н), 2,48 (с, 6Н). Приклад способу одержання 1. Сполука 1 (варіолін) (Дана сполука не входить в об'єм даного винаходу) Спирт 16 (одержаний у приведеному вище прикладі 3) (33мг, 0,062моль) розчиняють у чистій трифторметансульфоновій кислоті (0,4мл) в атмосферних умовах. Колбу герметично закривають і темно-червоний розчин залишають вистоюватися 51 79925 при кімнатній температурі протягом 5 годин. Потім колбу охолоджують на льоді і по краплях додають МеОН (2мл). Внаслідок додавання концентрованого водного розчину аміаку (2мл) утворюється яскраво-жовтий осад. Суспензію вводять у верхню частину хроматографічної колонки, що містить діоксид кремнію для хроматографії з оберненою фазою, яку заздалегідь врівноважують 50% МеОН/вода. Жовту суспензію вводять у колонку з 20% МеОН/вода (50мл). Полярність системи розчинників, що елююють, зменшують до системи 80% МеОН/вода (50мл) і потім до системи 85% МеОН/вода, яка містить 0,1% ТФОК, після чого починається елюювання жовтого продукту. Яскраво-жовті фракції об'єднують і концентрують у вакуумі, одержуючи при цьому варіолін В у вигляді його трифторацетату (сіль). Додають МеОН (10мл) і потім концентрований водний розчин аміаку (12мл), одержуючи вільну основу. Розчинники видаляють при зниженому тиску, продукт сушать (35°С, 0,03мм Hg) протягом ночі та одержують варіолін В (1) (10мг, 55%), який за всіма характеристиками ідентичний природній речовині. Приклад способу одержання 2. Сполука 4 (дезоксиваріолін) (Дана сполука не входить в об'єм даного винаходу) Розчин mCPBA (Aldrich, 70%) (98мг, 0,39моль) у DCM (4мл), заздалегідь висушеному над Na2SO4 додають по краплях до охолодженого (-30°С) розчину простого дитіоефіру 19 (приклад 4) (61мг, 0,18моль) у DCM (5мл). Жовтий розчин перемішують протягом 15 хвилин при 0°С. Додають насичений водний розчин Na 2S2O3 (5мл) і органічний шар промивають насиченим розчином NaHCO3 (5мл). Об'єднані водні шари екстрагують DCM (3´10мл). Об'єднані органічні екстракти сушать, фільтрують і концентрують. Жовтий залишок виливають у герметично закриту пробірку з діоксаном (4мл) і додають 32% розчин аміаку (8мл). Коричневу суміш перемішують протягом 14 годин при 85°С. Одержану жовту суміш упарюють у вакуумі, додають DCM/MeOH (10:1) (11мл) і розчинник випарюють при зниженому тиску. Жовту тверду речовину очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (5%), та одержують дезоксиваріолін 4 (14мг, 29%, 2 стадії) у вигляді жовтої твердої речовини. 1 Н ЯМР (300МГц, ДМСО): 8,92 (дд, J=8,1 і 1,5Гц, 1Н), 8,45 (дд, J=4,6 і 1,4Гц, 1Н), 8,22 (д, J=5,5Гц, 1Н), 7,68 (д, J=6,6Гц, 1Н), 7,63 (д, J=6,6Гц, 1Н), 7,58 (дд, J=8,1 і 4,6Гц, 1Н), 7,06 (д, J=5,4Гц, 1Н). (ESI) 278 (М+1). Приклад способу одержання 3. Сполука 5 (тіодезоксиваріолін) (Дана сполука не входить в об'єм даного винаходу) 52 32% розчин аміаку (3мл) додають до розчину простого дитіоефіру 19 (приклад 4) (12мг, 0,035моль) у діоксані (2мл). Коричневу суміш перемішують протягом 14 годин при 85°С у герметично закритій пробірці. Жовту суміш, що утворилася, упарюють у вакуумі, додають DCM (5мл), розчин сушать і розчинник випарюють при зниженому тиску. Жовту тверду речовину очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (3%), та одержують тіодезоксиваріолін 5 (8мг, 73%) у вигляді жовтої твердої речовини. 1 Н ЯМР (300МГц, CDCI3): 8,72 (дд, J=8,1 і 1,5Гц, 1Н), 8,48 (д, J=5,4Гц, 1Н), 8,39 (дд, J=4,8 і 1,6Гц, 1Н), 7,66 (д, J=6,8Гц, 1Н), 7,56 (д, J=6,7Гц, 1Н), 7,48 (дд, J=8,1 і 4,6Гц, 1Н), 7,32 (д, J=5,3Гц, 1Н), 2,67 (с, 3Н). (ESI) 309 (M+1). Приклад способу одержання 4. Сполука 4 (дезоксиваріолін) (Дана сполука не входить в об'єм даного винаходу) N',N-біс(п-метоксибензил)дезоксиваріолін 29 (приклад 5) (15мг, 2,9´10-5моль) обробляють чистою трифторметансульфоновою кислотою (1,5мл) і перемішують протягом 17 годин при 24°С. Чорний розчин упарюють при зниженому тиску, чорну суспензію розчиняють у DCM (4мл) і промивають насиченим розчином NaHCO3 (5мл). Водний шар екстрагують DCM (3´5мл) і об'єднані органічні шари сушать, фільтрують і упарюють. Коричневий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (1%) DCM/MeOH (5%), і одержують дезоксиваріолін 4 (1,5мг, 19%) у вигляді жовтої твердої речовини. 1 Н ЯМР (300МГц, ДМСО): 8,92 (дд, J=8,1 і 1,5Гц, 1Н), 8,45 (дд, J=4,6 і 1,4Гц, 1Н), 8,22 (д, J=5,5Гц, 1Н), 7,68 (д, 1=6,6Гц, 1Н), 7,63 (д, J=6,6Гц, 1Н), 7,58 (дд, J=8,1 і 4,6Гц, 1Н), 7,06 (д, J=5,4Гц, 1Н). (ESI) 278 (М+1). Приклад способу одержання 5. Сполуки 6 і 22 (Дані сполуки не входять в об'єм даного винаходу) 53 79925 54 Йодпіримідин 8 одержують експериментальним способом, [описаним у науковій літературі: Majeed, A.J.; Antonsen, О.; Benneche, Т.; Undheim, К. Tetrahedron 1989, 45, 993]. Довідковий приклад 2. Сполука 9 Розчин mCPBA (Aldrich, 70%) (70мг, 0,30моль) у DCM (3мл), заздалегідь висушеному над Na3SO4, по краплях додають до розчину тіодезоксиваріоліну 5 (39мг, 0,13моль) у DCM (7мл). Жовтий розчин перемішують протягом 2 годин при 24°С. Додають насичений водний розчин Na2S2O3 (5мл) і органічний шар промивають насиченим розчином NaHCO3 (5мл). Об'єднані водні шари екстрагують DCM (3´20мл). Об'єднані органічні екстракти сушать, фільтрують і концентрують. Жовтий залишок очищають флеш-хроматографією, використовуючи як елюент DCM/MeOH (2%) - DCM/MeOH (5%), і одержують сульфінілдезоксиваріолін 22 (15мг, 35%) у вигляді жовтої олії і сульфонілдезоксиваріолін 6 (25мг, 58%) у вигляді жовтої твердої речовини. 1 H ЯМР (300МГц, CDCI3): 8,86 (дд, J=8,1 і 1,5Гц, 1Н), 8,74 (д, J=5,6Гц, 1Н), 8,43 (дд, J=4,6 і 1,3Гц, 1Н), 7,77 (д, J=6,8Гц, 1H), 7,72 (д, J=6,6Гц, 1H), 7,67 (д, J=5,8Гц, 1Н), 7,54 (дд, J=8,0 і 4,6Гц, 1Н), 3,02 (с, 3Н). (ESI) 325 (М+1). Заздалегідь охолоджений (-97°С) розчин нBuLi у гексанах (1,55М, 10,0мл, 15,5моль) повільно додають протягом 21 хвилини до розчину 4-йод-2метилтіопіримідину (8) (3,90г, 15,5моль) у щойно перегнаному ТГФ (47мл) при -97°С (баня з сумішшю метанолу і рідкого N2). Уважно стежать за тим, щоб температура не підіймалася вище -97°С. Закінчивши додавання, чорну суміш перемішують протягом 30 хвилин при -97°С, після чого протягом приблизно 3 хвилин додають заздалегідь охолоджений (-97°С) розчин діетилкарбонату (0,94мл, 7,8моль) у ТГФ (4мл). Суміш витримують протягом 15 хвилин при -97°С, після чого баню залишають нагріватися до -35°С протягом 2 годин і потім до кімнатної температури. Реакційну суміш стр ушують з водним розчином NH4CI та екстрагують EtOAc (3 рази). Сиру речовину піддають звичайній обробці і частково очищають вакуумною перегонкою в апараті Кугельрора (160°С, 0,03мм Hg). Потім продукт очищають флеш-хроматографією на силікагелі, проводячи градієнтне елюювання (25, 30 і потім 50% ЕtOАс/гексани), і одержують чистий кетон 9 у вигляді жовтої твердої речовини (1,14г, 53%). Т.п. 106-107°С; 1Н ЯМР (500МГц, CDCI3): δ 2,51 (с, 6Н), 7,54 (д, J=4,9Гц, 2Н), 8,79 (д, J=4,9Гц, 2Н); 13С Я МР (75МГц, CDCI3): δ 14,2, 114,9, 158,8, 159,2, 173,2, 190,7; IR (KBr disc): 1695см-1; HRMS: обчислено для C11H10N4O32S2 (M+) 278,0296, знайдено 278,0289. Довідковий приклад 3. Сполука 11 1 H ЯМР (300МГц, CDCI3): 8,80 (дд, J=8,1 і 1,4Гц, 1Н), 8,71 (д, J=5,6Гц, 1Н), 8,41 (дд, J=4,8 і 1,4Гц, 1Н), 7,76 (д, J=5,6Гц, 1Н), 7,74 (д, J=6,4Гц, 1Н), 7,64 (д, J=6,4Гц, 1Н), 7,52 (дд, J=8,2 і 4,8Гц, 1Н), 3,40 (с, 3Н). Довідковий приклад 1. Сполука 8 4-метокси-2-піридон (10) (0,805г, 6,43моль) і щойно перегнаний РОСl3 (8мл) нагрівають зі зворотним холодильником протягом 15 годин. Надлишок РОСl3 видаляють у вакуумі, в'язку олію, що утворилася, охолоджують на льоді та обережно нейтралізують насиченим розчином NaHCO3. Суміш екстрагують ЕtOАс (3 рази) і екстракти обробляють звичайним чином, одержуючи при цьому коричневу олію. Одержану речовину частково очищають вакуумною перегонкою в апараті Кугельрора (100°С, 0,07мм Hg). Дистилят розтирають з петролейним ефіром і білий осад відфільтрову 55 79925 ють. Фільтрат концентрують, продукт остаточно очищають флеш-хроматографією на силікагелі, використовуючи як елюент 30% EtOАс/гексани, і Комп’ютерна в ерстка Т. Чепелев а 56 одержують 2-хлор-4-метоксипіридин (11) у вигляді безбарвної олії (0,586г, 63%). Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюVariolin derivatives, process for the preparation thereof (variants) and use of these compounds as anti-cancer agents
Назва патенту російськоюПроизводные вариолина, способ их получения (варианты) и применение указанных веществ как противоракового средства
МПК / Мітки
МПК: C07D 471/14, C07B 61/00, C07D 487/14, C07D 401/14, A61P 35/00, A61K 31/506
Мітки: спосіб, речовин, протиракового, одержання, похідні, варіанти, застосування, варіоліну, засобу, вказаних
Код посилання
<a href="https://ua.patents.su/28-79925-pokhidni-variolinu-sposib-kh-oderzhannya-varianti-ta-zastosuvannya-vkazanikh-rechovin-yak-protirakovogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Похідні варіоліну, спосіб їх одержання (варіанти) та застосування вказаних речовин як протиракового засобу</a>












