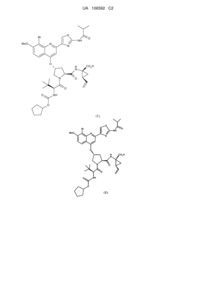
Кристалічна форма 2-тіазоліл-4-хінолінілоксипохідного, активного інгібітора hcv
Номер патенту: 106592
Опубліковано: 25.09.2014
Автори: Єгер Буркхард, Беркенбуш Тіло, Бусакка Карл Алан, Варсолона Річард Дж.
Формула / Реферат
1. Натрієва сіль сполуки формули (1):
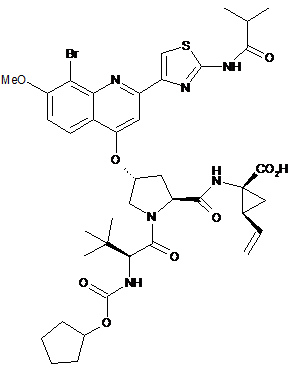 (1).
(1).
2. Натрієва сіль за п. 1 у кристалічній формі.
3. Кристалічна натрієва сіль за п. 2, що має порошкову рентгенограму, яка містить пік при 10,1 градусах 2θ (±0,2 градуси 2θ), вимірюваний з використанням випромінювання СuKα.
4. Кристалічна натрієва сіль за п. 3, для якої порошкова рентгенограма додатково містить піки при 13,0 і 18,2 градусах 2θ (±0,2 градуси 2θ), вимірювані з використанням випромінювання СuKα.
5. Кристалічна натрієва сіль за п. 4, для якої порошкова рентгенограма додатково містить піки при 5,4 і 8,7 градусах 2θ (±0,2 градуси 2θ), вимірювані з використанням випромінювання СuKα.
6. Кристалічна натрієва сіль за п. 2, що має порошкову рентгенограму, яка містить піки при 5,4, 6,5, 8,7, 10,1, 11,9, 13,0, 18,2, 20,2 і 24,7 градусах 2θ (±0,2 градуси 2θ), вимірювані з використанням випромінювання СuKα.
7. Кристалічна натрієва сіль за п. 2, що має порошкову рентгенограму, отриману з використанням випромінювання СuKα, яка в основному така, як наведена на фіг. 3.
8. Суміш, що містить сполуку формули (1)
 (1)
(1)
та її натрієву сіль, в якій не менше 50 % зазначеної сполуки міститься у формі натрієвої солі, як визначено у пп. 1, 2, 3, 4, 5, 6 або 7.
9. Фармацевтична композиція, що містить натрієву сіль за будь-яким з пп. 1, 2, 3, 4, 5, 6 або 7 і фармацевтично прийнятний носій або розріджувач.
10. Фармацевтична композиція за п. 9, в якій не менше 50 % натрієвої солі сполуки формули (1) у композиції міститься у формі кристалічної сполуки за будь-яким з пп. 2, 3, 4, 5, 6 або 7.
11. Застосування натрієвої солі сполуки формули (1) за п. 1 для виготовлення фармацевтичної композиції, призначеної для лікування вірусної інфекції гепатиту С у ссавця.
12. Застосування суміші за п. 8 для виготовлення фармацевтичної композиції, призначеної для лікування вірусної інфекції гепатиту С у ссавця.
Текст
Реферат: У заявці описані нові кристалічні форми сполуки (1) та її натрієвої солі й способи їх одержання, фармацевтичні композиції, що містять описані форми, та їх застосування для лікування вірусної інфекції гепатиту С (HCV): UA 106592 C2 (12) UA 106592 C2 S Br O NH MeO N N O CO2 H H N N O O O NH O (1). S Br NH MeO O N N O H N N O O NH O O (1) CO2H UA 106592 C2 5 За даною заявкою витребовується пріоритет за наступними попередніми заявками U.S.: 61/097291, поданою 16 вересня 2008 р., і 61/150826, поданою 9 березня 2009 р. ОБЛАСТЬ ТЕХНІКИ, ДО ЯКОЇ ВІДНОСИТЬСЯ ВИНАХІД Даний винахід відноситься до нових кристалічних форм сполуки (1) і натрієвої солі сполуки (1), описаних у даному винаході, способів їх одержання, фармацевтичних композицій, що містять їх, та їх застосування для лікування вірусної інфекції гепатиту C (HCV). РІВЕНЬ ТЕХНІКИ Наступна сполука (1): S Br O NH MeO N N O H N N CO2H O O NH O O (1) 10 15 відома, як селективний і активний інгібітор серинпротеази HCV NS3. Сполука (1) входить до числа серії ациклічних пептидних інгібіторів HCV, розкритих у патентах U.S. 6323180 і 7514557 і у публікації заявки на патент U.S. № 2005/0020503. Сполука (1), зокрема, розкрита, як сполука № 1055 у публікації заявки на патент U.S. 2005/0020503 і як сполука № 1008 у патенті U.S. 7514557. Сполуку (1) можна одержати за загальними методиками, наведеними у цитованих вище посиланнях, які включені у даний винахід як посилання. Сполука (1) також може бути відома у вигляді наведеного нижче альтернативного зображення її хімічної структури, що еквівалентна описаній вище структурі: 2 R 1 L 0 L N S N O O B O N H N O OH O N R H O O 0 20 25 1 2 N H в якій B означає ; L означає MeO-; L означає Br; і R означає . При синтезі за загальними методиками, наведеними у зазначених вище посиланнях, сполуку (1) одержують у вигляді аморфної твердої речовини, що являє собою форму, звичайно менше придатну для великомасштабного фармацевтичного виробництва. Таким чином, необхідно одержати сполуку (1) у кристалічній формі, щоб приготувати препарати, які відповідають діючим фармацевтичним вимогам і специфікаціям. Крім того, спосіб, за допомогою якого одержують сполуку (1), повинен бути придатним для великомасштабного виробництва. Крім того, бажано, щоб продукт перебував у формі, яку легко фільтрувати й легко сушити. Нарешті, з економічної точки зору бажано, щоб продукт був стабільним протягом тривалих періодів часу й не були потрібні спеціальні умови зберігання. КОРОТКИЙ ВИКЛАД СУТНОСТІ ВИНАХОДУ 1 UA 106592 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до винаходу зненацька й непередбачено вперше було встановлено, що сполуку (1) можна одержати у кристалічній формі, а також у формі її натрієвої солі, і більше переважно натрієвої солі у кристалічній формі. Таким чином, даний винахід відноситься до сполуки (1) у кристалічній формі, яка в одному варіанті здійснення являє собою нову кристалічну поліморфну форму, позначену у даному винаході, як тип A, а також нову кристалічну натрієву сіль сполуки (1). Ці нові кристалічні форми дозволяють перебороти утруднення при фармацевтичній обробці, характерні для використання аморфної форми й форми натрієвої солі, зокрема вони мають інші характеристики, що роблять їх особливо придатними для обробки фармацевтичної композиції, як це докладно описано нижче. В одному варіанті здійснення даний винахід відноситься до сполуки (1) у кристалічній формі. У більше кращому варіанті здійснення автори даного винаходу відкрили нову кристалічну поліморфну форму сполуки (1), позначену нижче у даному винаході як "тип A". Тип A має характеристичну порошкову рентгенограму (XRPD) з характеристичними піками, вираженими у градусах 2θ (± 0,2 градусів 2θ), при 4,8, 6,8, 9,6, 13,6, 17,3, 19,8 і 24,5, вимірюваними з використанням випромінювання CuKα. Інший варіант здійснення відноситься до натрієвої солі сполуки (1) і цю натрієву сіль можна одержати у кристалічній формі. Кристалічна натрієва сіль сполуки (1) має характеристичну порошкову рентгенограму (XRPD) з характеристичними піками, вираженими у градусах 2θ (± 0,2 градусів 2θ), при 5,4, 6,5, 8,7, 10,1, 11,9, 13,0, 18,2, 20,2 і 24,7, вимірюваними з використанням випромінювання CuKα. Ще один варіант здійснення відноситься до фармацевтичної композиції, що містить тип A або натрієву сіль сполуки (1), або їх суміші, і щонайменше один фармацевтично прийнятний носій або розріджувач. Ще один варіант здійснення відноситься до способу лікування інфекції HCV у ссавця, що включає введення зазначеному ссавцеві типу A або натрієвої солі сполуки (1), або їх сумішей, у терапевтично ефективній кількості. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1 наведена характеристична порошкова рентгенограма (XRPD) типу A. На фіг. 2 наведена термограма ДСК кристалів типу A, причому ДСК проводять при швидкості нагрівання, рівній 10 °C/хв., у закритому тиглі. На фіг. 3 наведена характеристична порошкова рентгенограма (XRPD) кристалічної натрієвої солі сполуки (1). На фіг. 4 наведена термограма ДСК кристалів кристалічної натрієвої солі сполуки (1), причому ДСК проводять при швидкості нагрівання, рівній 10 °C/хв., у відкритій чашці. На фіг. 5 наведені XRPD для кристалічної форми типу A сполуки (1) (внизу); кристалічної форми типу A сполуки (1) після диспергування у пропіленгліколі (у середині); і кристалічної форми типу A сполуки (1) після диспергування в етанолі (вгорі). ДОКЛАДНИЙ ОПИС ВИНАХОДУ Визначення Термінам, спеціально не визначеним у даному винаході, варто надавати значення, які їм повинен надавати фахівець у даній області техніки відповідно до розкриття й контексту. Однак, якщо не зазначене інше, то при використанні в описі й прикладеній формулі винаходу, наведені нижче терміни мають зазначені значення: Термін "тип A" означає кристалічну поліморфну форму сполуки (1), що має порошкову рентгенограму, яка містить щонайменше характеристичний пік при 9,6 градусах 2θ (± 0,2 градусів 2θ), вимірюваний з використанням випромінювання CuKα. Передбачається, що цей характеристичний пік відрізняє тип A від інших кристалічних форм сполуки (1). Термін "приблизно" означає з відхиленням, що становить не більше 5 % і більше переважно не більше 1 % від даного значення або діапазону. Наприклад, "приблизно 3,7 %" означає від 3,5 до 3,9 %, переважно від 3,66 до 3,74 %. Якщо термін "приблизно" відноситься до діапазону значень, наприклад, "приблизно від X до Y%", то термін "приблизно" вказує на зміну й верхнього (X) і нижнього (Y) значень зазначеного діапазону. Наприклад, вираження "приблизно 20 до 40 %" еквівалентно вираженню "від приблизно 20 до приблизно 40 %". Термін "фармацевтично прийнятний" стосовно до речовини при використанні у даному винаході означає, що речовина відповідно до ретельної медичної оцінки придатна для використання при взаємодії з тканинами людини й нижчих тварин без небажаної токсичності, прояву роздратування, алергійної реакції тощо, відповідно до розумного відношення ризик/користь і ефективна для призначеного застосування, коли речовина використовується у фармацевтичній композиції. Термін "лікування" стосовно до лікування патологічного стану пацієнта включає: 2 UA 106592 C2 5 10 (i) придушення або поліпшення протікання патологічного стану у пацієнта, наприклад, зупинку або вповільнення його розвитку; або (ii) полегшення патологічного стану у пацієнта, тобто забезпечення ремісії або лікування патологічного стану. У випадку HCV лікування включає зменшення навантаження вірусом HCV у пацієнта. Кристалічна сполука (1) Сполука (1) виділена у вигляді кристалічної поліморфної форми, позначеної у даному винаході, як "тип A". Звичайно тип A має характеристичну порошкову рентгенограму (XRPD) з піками, вираженими у градусах 2θ (± 0,2 градусів 2θ), при 4,8, 6,8, 9,6, 13,6, 17,3, 19,8 і 24,5. XRPD типу A наведена на фіг. 1. Положення й відносні інтенсивності характеристичних піків на XRPD, наведеної на фіг. 1, представлені нижче у таблиці 1. Таблиця 1 Сполука (1) тип A Кут 2-тета,° 4,8 6,8 9,6 13,6 17,3 19,8 24,5 15 20 25 30 35 40 45 Відносна інтенсивність, % 100 6 24 6 8 16 11 На фіг. 2 наведена отримана за допомогою диференціальної скануючої калориметрії (ДСК) термограма кристалів типу A, причому ДСК проводять при швидкості нагрівання, рівній 10 °C/хв, у закритому тиглі. В одному загальному варіанті здійснення даний винахід відноситься до сполуки (1) у кристалічній формі. Інший більше кращий варіант здійснення відноситься до кристалічної поліморфної форми сполуки (1), що має щонайменше наступну характеристику: порошкова рентгенограма, що містить пік при 9,6 градусах 2θ (± 0,2 градусів 2θ), вимірюваний з використанням випромінювання CuKα. Інший варіант здійснення відноситься до кристалічної поліморфної форми сполуки (1), що має XRPD, яка містить пік при 9,6 градусах 2θ (± 0,2 градусів 2θ), описаний вище, і додатково містить пік при 19,8 градусах 2θ (± 0,2 градусів 2θ), вимірюваний з використанням випромінювання CuKα. Інший варіант здійснення відноситься до кристалічної поліморфної форми сполуки (1), що має XRPD, яка містить пік при 9,6 градусах 2θ (± 0,2 градусів 2θ), описаний вище, і додатково містить піки при 4,8 і 19,8 градусах 2θ (± 0,2 градусів 2θ), вимірювані з використанням випромінювання CuKα. Інший варіант здійснення відноситься до кристалічної поліморфної форми сполуки (1), що має XRPD, яка містить пік при 9,6 градусах 2θ (± 0,2 градусів 2θ), описаний вище, і додатково містить піки при 4,8, 6,8, 13,6, 17,3, 19,8 і 24,5 градусах 2θ (± 0,2 градусів 2θ), вимірювані з використанням випромінювання CuKα. Інший варіант здійснення відноситься до кристалічної поліморфної форми сполуки (1), що має XRPD, в основному таку же, як наведена на фіг. 1. Інший варіант здійснення відноситься до кристалічної поліморфної форми сполуки (1), що має XRPD, яка містить пік при 9,6 градусах 2θ (± 0,2 градусів 2θ), описаний вище, і також має термограму ДСК, в основному таку же, як наведена на фіг. 2, при швидкості нагрівання, рівній 10 °C/хв., у закритому тиглі. Інший варіант здійснення відноситься до кількості сполуки (1), в якій не менше 50 %, переважно не менше 75 %, більше переважно не менше 95 %, більше переважно не менше 99 % зазначеної сполуки міститься у кристалічній формі, наприклад, у формі типу A кристалічної поліморфної форми, охарактеризованої за допомогою будь-якого з описаних вище за допомогою XRPD варіантів здійснення. Наявність таких кількостей типів A у кількості сполуки (1) звичайно вимірюється за допомогою проведеного за допомогою XRPD аналізу сполуки. Інший варіант здійснення відноситься до фармацевтичної композиції, що містить сполуку (1) і фармацевтично прийнятний носій або розріджувач, в якій не менше 50 %, переважно не 3 UA 106592 C2 5 10 15 20 25 30 35 40 45 менше 75 %, більше переважно не менше 95 %, більше переважно не менше 99 %, сполуки (1) у композиції міститься у кристалічній формі, наприклад у формі типу A кристалічної поліморфної форми, охарактеризованої за допомогою будь-якого з описаних вище за допомогою XRPD варіантів здійснення. Даний винахід відноситься до способу одержання типу A, що включає кристалізацію сполуки (1) з розчину у розчинниках при умовах, які дають тип A. Точні умови, при яких утворюється тип A, можна визначити емпірично й, можна привести тільки методики, які виявилися придатними при практичному застосуванні. Відповідно до винаходу встановлено, що тип A сполуки (1) можна одержати способом, що включає наступні стадії, який також є варіантом здійснення даного винаходу: (i) розчинення сполуки (1) в аліфатичному спиртовому розчиннику, що необов'язково містить воду в якості співрозчинника, шляхом нагрівання суміші до температури, рівній приблизно 6575 °C, з одержанням розчину; (ii) додавання води до розчину, отриманому на стадії (i), з підтримкою температури розчину рівною приблизно 70-75 °C, з одержанням суспензії; (iii) охолодження суспензії, отриманої на стадії (ii), з одержанням твердої речовини; (iv) збирання твердої речовини, отриманої на стадії (iii), і сушіння зазначеної речовини при температурі, рівній приблизно 65-80 °C, з одержанням сполуки (1) типу A. Аліфатичні спирти, які можна використовувати у цьому способі, включають, наприклад, етанол (наприклад, денатурований, міцністю 100 градусів або 100 % чистоти), 1-пропанол, 2пропанол, 1-бутанол, ізобутиловий спирт і ізопентиловий спирт, переважно етанол. Отримані кристали типу A можна витягти за будь-якими звичайними методиками, відомими у даній області техніки. На кінцевій стадії (iv), тверді речовини, отримані на стадії (iii), можна зібрати й висушити при високій температурі за звичайними методиками збирання й високотемпературного сушіння, наприклад, фільтруванням і сушінням у вакуумній сушильній шафі. В одному кращому варіанті здійснення аморфну сполуку (1) розчиняють в аліфатичному спиртовому розчиннику (наприклад, етанолі), що містить приблизно до 10 % об./об. води в якості співрозчинника, шляхом перемішування й нагрівання суміші до температури, рівній приблизно 72-74 °C, поки сполука (1) повністю не розчиниться. Готують окремий додатковий водний розчин, що містить воду й приблизно до 10 % об./об. аліфатичного спирту (наприклад, етанолу), і цей додатковий водний розчин додають приблизно з лінійною швидкістю до розчину сполуки (1), підтримуючи температуру суміші рівною приблизно 72-74 °C. Тип A сполуки (1) починає кристалізуватися під час додавання водного розчину. Отриману суспензію кристалів охолоджують і перемішують і потім кристали відфільтровують, промивають і сушать при температурі, рівній приблизно 65-75 °C, за звичайними методиками. Зрозуміло, ці стадії способу можна полегшити за допомогою звичайних методик змішування, наприклад, перемішування й інших звичайних методик, для яких добре відомо, що вони полегшують проведення способу. Натрієва сіль сполуки (1) Встановлено, що натрієва сіль сполуки формули (1) є особливо придатною для фармацевтичної обробки, оскільки її можна одержати у вигляді стабільної кристалічної форми. Звичайно кристалічна натрієва сіль сполуки (1) має характеристичну порошкову рентгенограму (XRPD) з характеристичними піками, вираженими у градусах 2θ (± 0,2 градусів 2θ) при 5,4, 6,5, 8,7, 10,1, 11,9, 13,0, 18,2, 20,2 і 24,7. XRPD кристалічної натрієвої солі сполуки (1) наведена на фіг. 3. Положення й відносні інтенсивності характеристичних піків на XRPD, наведеної на фіг. 3, представлені нижче у таблиці 2. 4 UA 106592 C2 Таблиця 2 Сполука (1) кристалічна Na сіль Кут 2-тета,° 5,4 6,5 8,7 10,1 11,9 13,0 18,2 20,2 24,7 5 10 15 Відносна інтенсивність, % 42 29 43 100 39 52 51 42 30 На фіг. 4 наведена отримана за допомогою диференціальної скануючої калориметрії (ДСК) термограма кристалічної натрієвої солі сполуки (1) кристалів, причому ДСК проводять при швидкості нагрівання, рівній 10 °C/хв., у відкритому тиглі. Відповідно до винаходу зненацька встановлено, що форма натрієвої солі має особливі характеристики, що роблять її особливо придатною для обробки фармацевтичної композиції. Зокрема, форма натрієвої солі має деякі характеристики, що роблять її особливо придатною для готування системи доставки лікарського засобу на основі ліпідів (LBDDS). По-перше, відповідно до винаходу зненацька встановлено, що форма натрієвої солі має набагато поліпшену розчинність в інертних наповнювачах, що звичайно використовуються для готування LBDDS, включаючи, наприклад пропіленгліколь і етанол. У наведеній нижче таблиці представлені дані, які підтверджують набагато поліпшену розчинність форми натрієвої солі сполуки (1) у порівнянні з розчинністю форми типу A сполуки (1) у конкретних розчинниках: Зіставлення розчинності Na солі сполуки (1) з розчинністю сполуки (1) типу A у різних інертних наповнювачах Інертний наповнювач ПЕГ 400 Пропіленгліколь Етанол Capmul PG8 Capmul MCM Транскутол P Labrasol Сполука (1) Na сіль (мг/мл) 233,6±34 >468 187,0±23,9
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline forms of a 2-thiazolyl-4-quinolinyl-oxy derivative, a potent hcv inhibitor
Автори російськоюBerkenbusch, Thilo, Busacca, Carl Alan, Jaeger, Burkhard, Varsolona, Richard J.
МПК / Мітки
МПК: C07D 417/14, A61K 31/4709, A61P 31/12
Мітки: активного, інгібітора, кристалічна, 2-тіазоліл-4-хінолінілоксипохідного, форма
Код посилання
<a href="https://ua.patents.su/22-106592-kristalichna-forma-2-tiazolil-4-khinoliniloksipokhidnogo-aktivnogo-ingibitora-hcv.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма 2-тіазоліл-4-хінолінілоксипохідного, активного інгібітора hcv</a>
Попередній патент: Спосіб лікування гепатиту с з використанням інтерферону та інтерлейкіну-1
Наступний патент: Пристрій для пролонгованого введення ліків, який містить полімери на основі поліуретану, та спосіб його виготовлення
Випадковий патент: Багатошарові системи для селективного відбиття електромагнітного випромінювання в діапазоні довжин хвиль сонячного світла і спосіб їхнього виробництва