Застосування імунокон’югованого із майтанзиноїдом антитіла проти cd19 для лікування симптомів в-клітинних злоякісних новоутворень
Формула / Реферат
1. Спосіб лікування симптому CD19+ В-клітинних злоякісних новоутворень у потребуючого цього пацієнта, що є людиною, де вказаний спосіб включає стадії, на яких:
a) вводять вказаному пацієнту початкову дозу 55 мг/м2 імунокон'югата майтанзиноїду проти CD19,
b) вводять пацієнту щонайменше 3 подальших дози по 55 мг/м2 імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної одним тижнем, і
c) вводять пацієнту щонайменше 3 подальших дози по 55 мг/м2 імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної двома тижнями,
де вказаний імунокон'югат майтанзиноїду проти CD19 містить антитіло, яке специфічно зв'язується з антигеном CD19, що містить:
a) CDR1 важкого ланцюга, що містить SNWMH (SEQ ID NO:4); CDR2 важкого ланцюга, що містить EIDPSDSYTN (SEQ ID NO:5); і CDR3 важкого ланцюга, що містить GSNPYYYAMDY (SEQ ID NO:6); і
b) CDR1 легкого ланцюга, що містить SASSGVNYMH (SEQ ID NO:l); CDR2 легкого ланцюга, що містить DTSKLAS (SEQ ID NO:2); і CDR3 легкого ланцюга, що містить HQRGSYT (SEQ ID NO:3),
де майтанзиноїд являє собою DM4; і де антитіло кон'юговане з DM4 через лінкер N-cyкцинiмiдил-4-(2-пipидилдитio)бyтaнoaт (SPDB).
2. Спосіб за п. 1, який відрізняється тим, що спосіб зводить до мінімуму пов'язані із зором небажані явища.
3. Спосіб за п. 2, де частота виникнення всіх ступенів пов'язаних із зором небажаних явищ складає менше 40 %.
4. Спосіб за п. 2, де частота виникнення пов'язаних із зором небажаних явищ 3 або 4 ступеня складає менше 13 %.
5. Спосіб за будь-яким із пп. 1-4, де вказане CD19+ В-клітинне злоякісне новоутворення являє собою лейкоз або лімфому.
6. Спосіб за п. 5, де вказана лімфома являє собою неходжкінську лімфому (NHL).
7. Спосіб за п. 5, де вказаний лейкоз являє собою гострий лімфобластний лейкоз (ALL).
8. Спосіб за п. 6, де вказана неходжкінська лімфома являє собою дифузну великоклітинну В-клітинну лімфому (DLBCL), фолікулярну лімфому (FL), лімфому мантійних клітин (MCL), лімфому клітин маргінальної зони (MZL), дрібноклітинну лімфому (SLL) або макроглобулінемію Вальденстрема (WM).
9. Спосіб за п. 6, де вказана неходжкінська лімфома являє собою рецидивуючу або рефрактерну неходжкінську лімфому.
10. Спосіб за п. 6, де вказана неходжкінська лімфома являє собою неходжкінську лімфому із експресією CD19.
11. Спосіб за п. 6, де у вказаного пацієнта вже проводили лікування неходжкінської лімфоми.
12. Спосіб за п. 6, де для вказаного пацієнта терапія ритуксимабом виявилася неефективною.
13. Спосіб за п. 6, де вказана неходжкінська лімфома не є резистентною до ритуксимабу.
14. Спосіб за п. 6, де вказаному пацієнту проводили трансплантацію аутологічних або алогенних стовбурових клітин.
15. Спосіб за будь-яким із пп. 1-14, де імунокон'югат майтанзиноїду проти CD19 вводять внутрішньовенно.
16. Спосіб за будь-яким з пп. 1-15, де імунокон'югат майтанзиноїду проти CD19 містить антитіло HuB4, кон'юговане із DM4 через лінкер SPDB.
17. Спосіб за будь-яким із пп. 1-16, де імунокон'югат майтанзиноїду проти CD19 має наступну нижченаведену формулу:
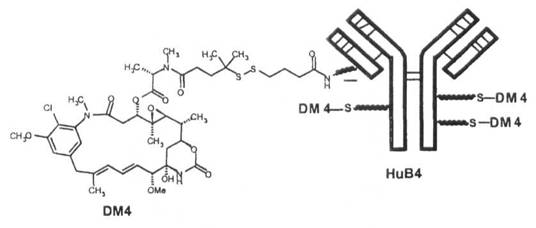 .
.
18. Спосіб за будь-яким із пп. 1-16, де антитіло містить легкий ланцюг з послідовністю SEQ ID NО:7 і важкий ланцюг з послідовністю SEQ ID NО:8.
19. Спосіб за п. 16, який відрізняється тим, що 3,5 молекул DM4 зв'язані через лінкер SPDB з кожною молекулою антитіла HuB4.
20. Спосіб за будь-яким із пп. 1-19, який включає стадії, на яких вводять пацієнту 4 дози по 55 мг/м2 імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної одним тижнем, і вводять пацієнту 4 подальших дози по 55 мг/м2 імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної двома тижнями.
21. Спосіб за п. 20, в якому антитіло містить легкий ланцюг з послідовністю SEQ ID NО:7 і важкий ланцюг з послідовністю SEQ ID NO:8.
22. Спосіб за п. 20, в якому антитілом є антитіло HuВ4.
Текст
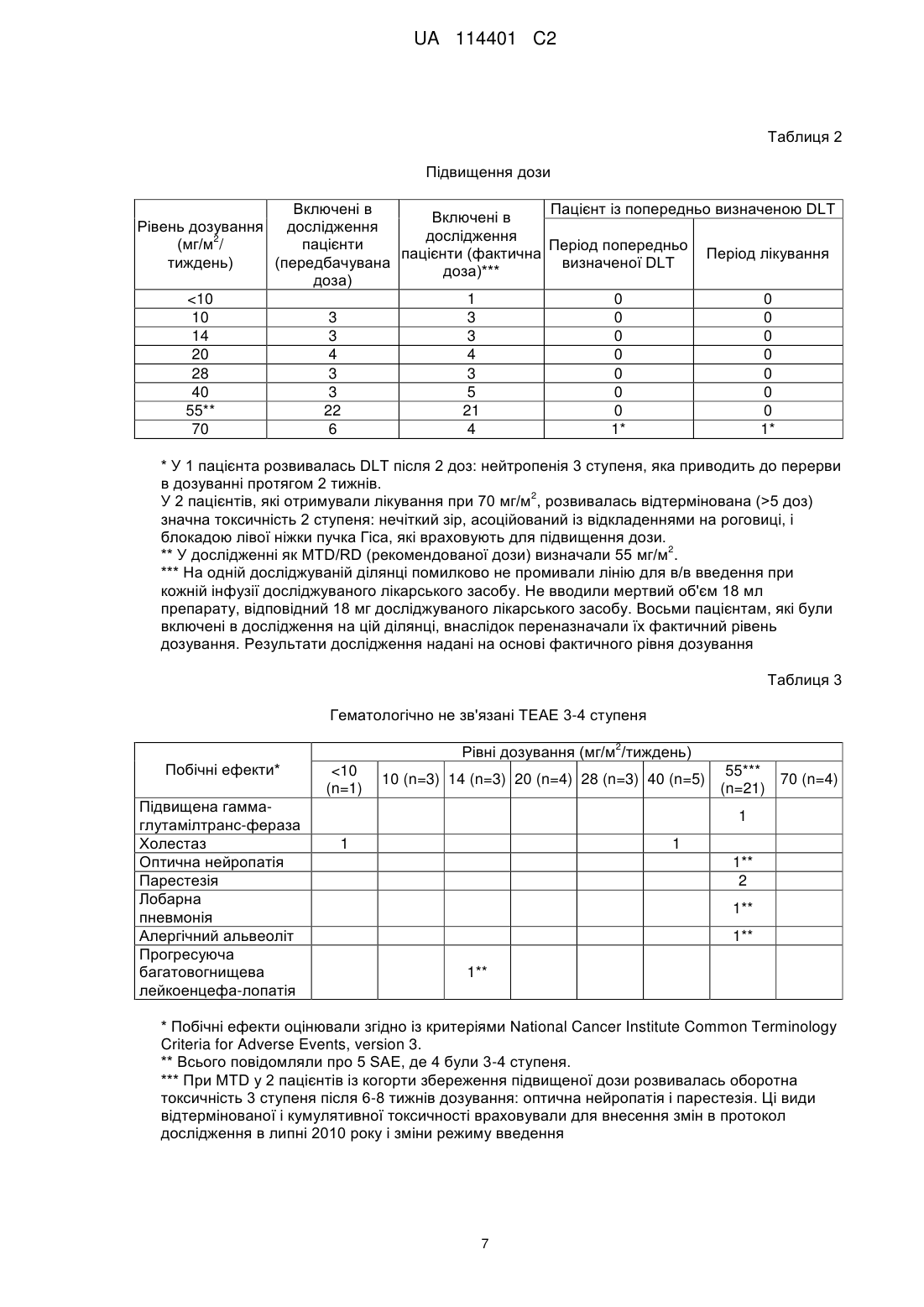
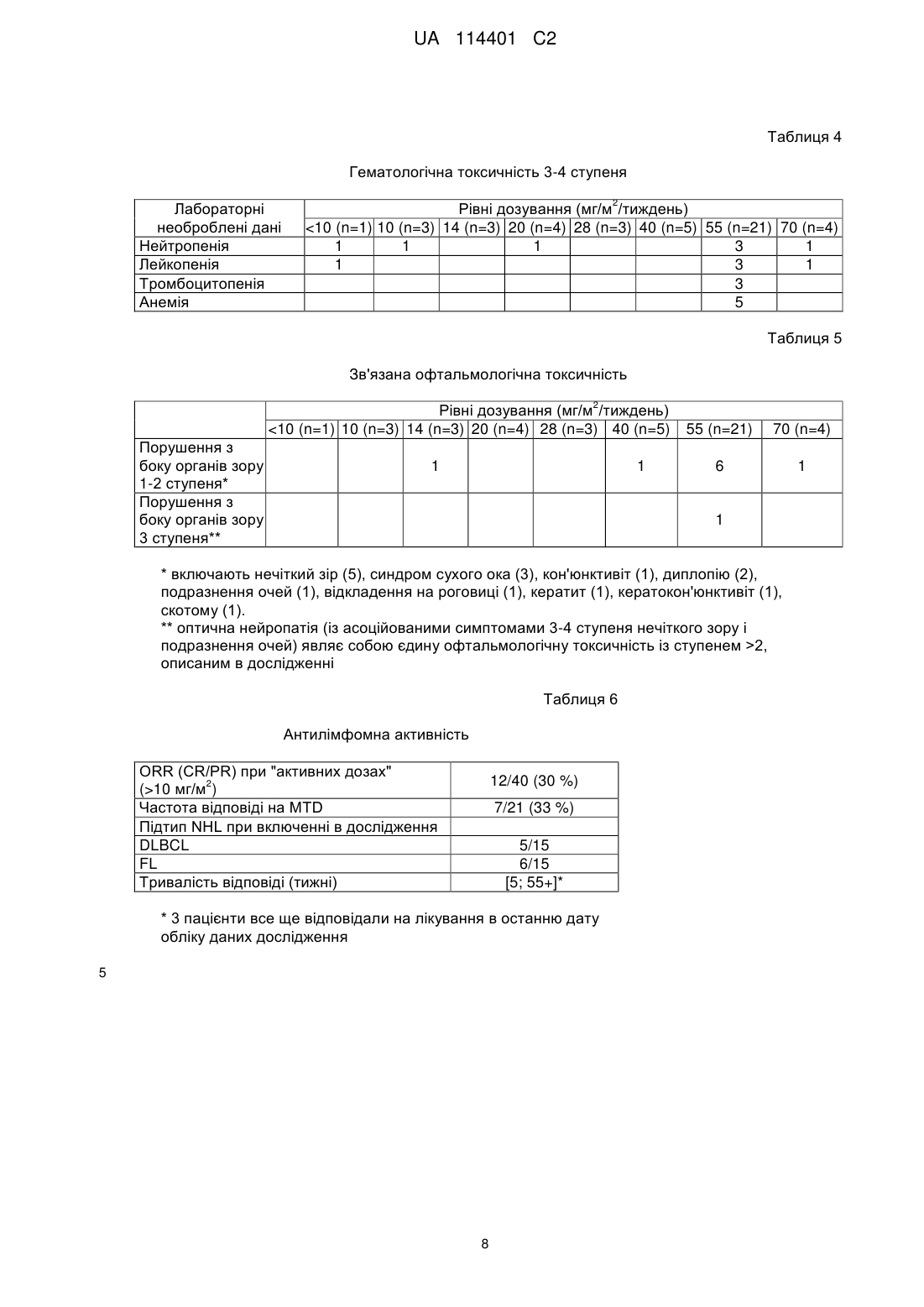
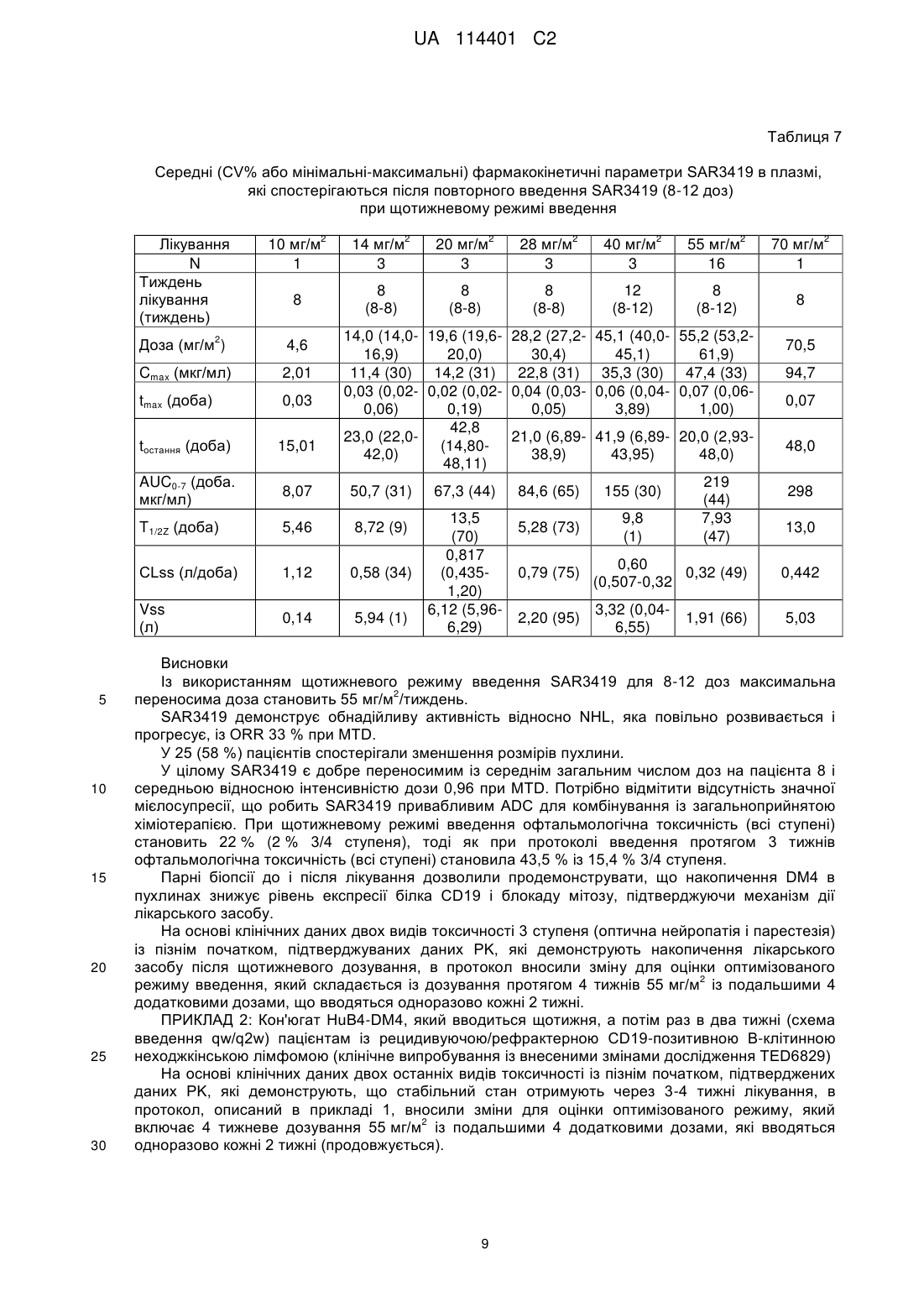
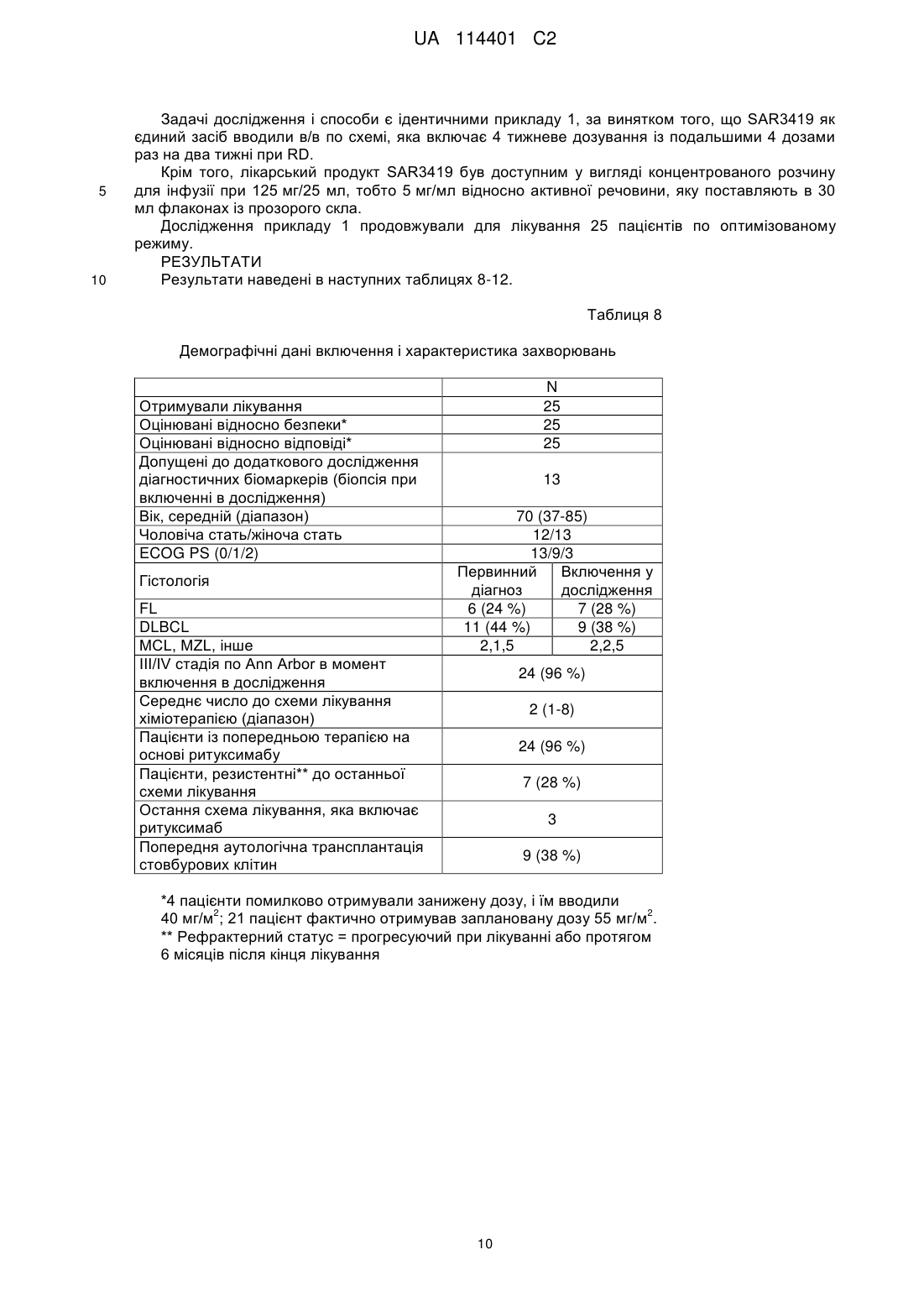
Реферат: Винахід стосується способу лікування симптому CD 19+ В-клітинних злоякісних новоутворень у потребуючого цього пацієнта, що є людиною, де вказаний спосіб включає стадії, на яких: 2 a) вводять вказаному пацієнту початкову дозу 55 мг/м імунокон'югата майтанзиноїду проти CD 19, 2 b) вводять пацієнту щонайменше 3 подальших дози по 55 мг/м імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної одним тижнем, і 2 c) вводять пацієнту щонайменше 3 подальших дози по 55 мг/м імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної двома тижнями, де вказаний імунокон'югат майтанзиноїду проти CD19 містить антитіло, яке специфічно зв'язується з антигеном CD 19, що містить: UA 114401 C2 (12) UA 114401 C2 a) CDR1 важкого ланцюга, що містить SNWMH (SEQ ID NO:4); CDR2 важкого ланцюга, що містить EIDPSDSYTN (SEQ ID NO:5); і CDR3 важкого ланцюга, що містить GSNPYYYAMDY (SEQ ID NO:6); і b) CDR1 легкого ланцюга, що містить SASSGVNYMH (SEQ ID NO:l); CDR2 легкого ланцюга, що містить DTSKLAS (SEQ ID NO:2); і CDR3 легкого ланцюга, що містить HQRGSYT (SEQ ID N0:3), де майтанзиноїд являє собою DM4; і де антитіло кон'юговане з DM4 через лінкер Ncyкцинiмiдил-4-(2-пipидилдитio)бyтaнoaт (SPDB). UA 114401 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується застосування імунокон'югату майтанзиноїду проти CD19 для лікування симптому В-клітинних злоякісних новоутворень. Клітинна поверхня молекул, експресованих В-клітинами і їх злоякісними аналогами, являє собою основну мішень імунотерапії. CD19 являє собою ранній антиген диференціювання В-лімфоцитарної лінії, експресований на більшості В-клітин, але не детектований на плазматичних клітинах, стовбурових клітинах або нормальній мієлоїдній лінії. Таким чином, CD19 експресується на пухлинних клітинах всіх В-клітинних неоплазій (Вклітинна неходжкінська лімфома, гострий лімфобластний лейкоз, хронічний лімфоцитарний лейкоз) за винятком мієломи. В-клітинна неходжкінська лімфома (B-NHL) є п'ятим найбільш поширеним злоякісним новоутворенням в Сполучених Штатах Америки, і частота її виникнення продовжує підвищуватися, особливо у пацієнтів похилого віку. Незважаючи на те, що протягом останнього десятиріччя на пацієнтів із гемобластозами сприятливо вплинула терапевтична оптимізація із використанням загальноприйнятої лікарської терапії, більшість пацієнтів все ще вмирають від свого захворювання, і лікарська терапія залишається високотоксичною. Таким чином, додаткові зусилля відносно розробки нових видів терапії для поліпшення виживаності і якості життя пацієнтів із лімфомою повинні включати стратегії, які конкретно направлені на злоякісні клітини і мають поліпшену безпеку і ефективність. HuB4-DM4 являє собою кон'югат антитіло-лікарський засіб, який складається із гуманізованого моноклонального антитіла IgG1, huB4, яке специфічно направлене проти антигену CD19, кон'югованого через дисульфідний зв'язок із похідним майтанзиноїду DM4, ефективним інгібітором тубуліну. Структура SAR3419 кон'югата HuB4-DM4 описана на фігурі 1, і в прикладеному списку послідовностей наведена послідовність важкого і легкого ланцюга антитіла, де вказаний легкий ланцюг містить послідовність, надану в SEQ ID NO.7, і вказаний важкий ланцюг містить послідовність, надану в SEQ ID NO.8. Після зв'язування із антигеном CD19 кон'югат HuB4-DM4 піддається інтерналізації і внутрішньоклітинному вивільненню DM4. У першому дослідженні у людини TED6828 HuB4-DM4 кон'югата SAR3419, який вводиться одноразово в/в кожні 3 тижні протягом 6 циклів (N=39) пацієнтам із 2 рефрактерною/рецидивуючою CD19+NHL, тестували 7 рівнів дозування (від 10 мг/м до 2 2 270 мг/м ). Максимальна переносима доза (MTD) становила 160 мг/м кожні 3 тижні. Обмежуюча дозу токсичність являла собою оборотні токсичні зміни рогівки. Найчастіше виникаюча токсичність, пов'язана із досліджуваним лікарським засобом, була офтальмологічною (всі ступені), яка спостерігається у 43,5 % пацієнтів, де у 15,4 % була 3/4 ступеня. Токсичність, яка полягає в основному в нечіткому зорі, асоційованому із мікрокістозними відкладеннями на епітелії рогівки (токсичні зміни рогівки), була оборотною у всіх випадках. Попередні результати цього випробування були опубліковані в тезах ASH 2009 (Younes et al., ASH ANNUAL Meeting Abstracts, 2009, 114(22):585). На даний час виявлено, що можна зменшувати токсичність, і зокрема офтальмологічну токсичність, яка виникає внаслідок лікування кон'югатом HuB4-DM4, за допомогою введення кон'югата HuB4-DM4 при іншому режимі дозування. Крім того, продемонстровано, що кон'югат SAR3419 забезпечує лікування пацієнтів із Вклітинною неходжкінською лімфомою, зокрема дифузною великоклітинною В-клітинною лімфомою (DLBCL). Винахід стосується способів, композицій і готових виробів, як описано в даному описі. У одному із аспектів винахід стосується способу лікування симптомів CD19+ В-клітинних злоякісних новоутворень у потребуючого цього пацієнта, де вказаний спосіб включає введення вказаному пацієнту терапевтично ефективних кількостей імунокон'югату майтанзиноїду проти CD19. У конкретному варіанті здійснення вказаний спосіб включає введення вказаному пацієнту терапевтично ефективних кількостей імунокон'югату майтанзиноїду проти CD19 при режимі дозування, який знижує офтальмологічну токсичність, яка спричиняється лікуванням. У одному із варіантів здійснення така токсичність виникає в результаті лікування кон'югатом HuB4-DM4. У іншому конкретному варіанті здійснення даного способу частота виникнення пов'язаних із зором побічних ефектів (всіх ступенів) складає менше 40 %. У іншому конкретному варіанті здійснення даного способу частота виникнення пов'язаних із зором побічних ефектів ступеня 3 або 4 складає менше 13 %. Даний спосіб є безпечним і ефективним. 1 UA 114401 C2 5 10 15 20 25 30 35 40 45 50 55 Хоч даний винахід переважно стосується лікування симптому CD19+ В-клітинних злоякісних новоутворень у потребуючого цього пацієнта, також можна лікувати симптом В-клітинних злоякісних новоутворень незалежно від рівня експресії CD19 в клітинах. Таким чином, в іншому аспекті винахід стосується способу лікування симптому В-клітинних злоякісних новоутворень у потребуючого цього пацієнта, де вказаний спосіб включає введення вказаному пацієнту терапевтично ефективних кількостей імунокон'югату майтанзиноїду проти CD19. Дані способи лікування можуть включати стадії введення пацієнту початкової дози 2 приблизно 55 мг/м імунокон'югату майтанзиноїду проти CD19 і введення пацієнту ряду 2 подальших доз приблизно 55 мг/м імунокон'югату майтанзиноїду проти CD19, де подальші дози вводять окремо одна від одної у часі приблизно через один тиждень. У конкретному варіанті здійснення даного способу після введення початкової дози іде введення щонайменше 6 доз, розділених у часі одна від одної одним тижнем. У іншому варіанті здійснення за початковою дозою іде введення щонайменше 7 або 8 доз, розділених у часі одна від одної одним тижнем. У іншому конкретному варіанті здійснення даного способу після введення початкової дози іде введення від 6 до 14 доз, розділених у часі одна від одної приблизно одним тижнем. У іншому варіанті здійснення за введенням початкової дози іде введення від 7 до 13 доз або від 8 до 12 доз. Таким чином, в цьому конкретному варіанті здійснення вказаний спосіб включає стадії: - введення пацієнту початкової дози імунокон'югату майтанзиноїду проти CD19 приблизно 2 55 мг/м і - введення пацієнту щонайменше 6 подальших доз імунокон'югату майтанзиноїду проти 2 CD19 приблизно 55 мг/м , розділених у часі одна від одної приблизно одним тижнем. Даний спосіб лікування може включати додаткову стадію введення подальших доз 2 імунокон'югату майтанзиноїду проти CD19 приблизно 55 мг/м , де дози вводять розділено у часі одна від одної приблизно через два тижні. У цьому конкретному варіанті здійснення даного способу за введенням початкової дози іде введення щонайменше 3 доз, розділених у часі одна від одної приблизно одним тижнем, а потім введення щонайменше 3 доз, розділених у часі одна від одної приблизно двома тижнями. Цей варіант здійснення, як правило, позначають в даній заявці як кожний тиждень/кожні 2 тижні або qw/q2w, або навіть як оптимізований режим. Таким чином, в цьому конкретному варіанті здійснення вказаний спосіб включає стадії: - введення пацієнту початкової дози імунокон'югату майтанзиноїду проти CD19 приблизно 2 55 мг/м , - введення пацієнту щонайменше 3 подальших доз імунокон'югату майтанзиноїду проти 2 CD19 приблизно 55 мг/м , розділених у часі одна від одної приблизно одним тижнем, і - введення пацієнту щонайменше 3 подальших доз імунокон'югату майтанзиноїду проти 2 CD19 приблизно 55 мг/м , розділених у часі одна від одної приблизно двома тижнями. CD19+ В-клітинні злоякісні новоутворення визначають як будь-які злоякісні новоутворення, експресуючі антиген клітинної поверхні CD19. Вказаний симптом CD19+ В-клітинних злоякісних новоутворень може являти собою симптом лейкозу, такий як симптом гострого лімфобластного лейкозу (ALL) або симптом лімфоми, такий як симптом неходжкінської лімфоми (NHL). Симптом неходжкінської лімфоми може являти собою дифузну великоклітинну В-клітинну лімфому (DLBCL), фолікулярну лімфому (FL), лімфому мантійних клітин (MCL), лімфому клітин маргінальної зони (MZL), дрібноклітинну лімфому (SLL) або макроглобулінемію Вальденстрема (WM). У конкретному варіанті здійснення даного способу вказаний симптом неходжкінської лімфоми являє собою рецидивуючу або рефрактерну В-клітинну неходжкінську лімфому. У іншому конкретному варіанті здійснення даного способу вказаний симптом неходжкінської лімфоми являє собою В-клітинну неходжкінську лімфому із експресією CD19. У іншому конкретному варіанті здійснення даного способу вказаному пацієнту вже проводили лікування симптому неходжкінської лімфоми. Зокрема, у вказаного пацієнта терапія могла виявитися безрезультатною, і зокрема хіміотерапія або терапія ритуксимабом. У іншому конкретному варіанті здійснення даного способу вказаний симптом неходжкінської лімфоми являє собою резистентне до ритуксимабу захворювання. У іншому конкретному варіанті здійснення даного способу вказаний пацієнт отримував трансплантат аутологічних або алогенних стовбурових клітин. 2 UA 114401 C2 5 10 У конкретному варіанті здійснення даного способу імунокон'югат майтанзиноїду проти CD19 містить антитіло, яке специфічно зв'язується із антигеном CD19, кон'юговане із DM4. Антитіло, яке специфічно зв'язується із антигеном CD19, можна кон'югувати із DM4 через розщеплюваний лінкер, зокрема лінкер N-сукцинімідил-4-(2-піридилдитіо)бутаноат (SPDB). У конкретному варіанті здійснення даного способу імунокон'югат майтанзиноїду проти CD19 містить антитіло, яке специфічно зв'язується із антигеном CD19, кон'юговане із DM4 через SPDB, де приблизно 3,5 молекул DM4 є зв'язаними через лінкер SPDB із кожною молекулою huB4. У конкретному варіанті здійснення імунокон'югат майтанзиноїду проти CD19 має наступну нижчевказану формулу: . 15 20 25 30 35 40 У одному із варіантів здійснення вказане антитіло містить шість визначальних комплементарність областей (CDR), де вказана CDR містить послідовності, представлені в SEQ ID NO.1-6. У іншому варіанті здійснення антитіло містить легкий ланцюг, де послідовність вказаного легкого ланцюга має щонайменше 60 %, щонайменше 75 %, щонайменше 85 %, щонайменше 95 % або щонайменше 99 % ідентичності із послідовністю, яка демонструється в SEQ ID NO.7. У ще одному варіанті здійснення антитіло містить важкий ланцюг, де послідовність вказаного важкого ланцюга має щонайменше 60 %, щонайменше 75 %, щонайменше 85 %, щонайменше 95 % або щонайменше 99 % ідентичності із послідовністю, яка демонструється в SEQ ID NO.8. У іншому варіанті здійснення антитіло за винаходом являє собою гуманізоване антитіло huB4, описане у Roguska et al. (Proc. Natl. Acad. Sci. USA, 91: 969-973, 1994). Антитіло huB4 за винаходом містить легкий ланцюг і важкий ланцюг, де вказаний легкий ланцюг містить послідовність, представлену в SEQ ID NO.7, і вказаний важкий ланцюг містить послідовність, представлену в SEQ ID NO.8. У конкретному варіанті здійснення кон'югат являє собою кон'югат HuB4-DM4. У одному із аспектів винахід стосується імунокон'югату майтанзиноїду проти CD19 для лікування пацієнта, який є людиною, у якої діагностували симптом CD19+ В-клітинних злоякісних новоутворень, способом, що включає стадії введення пацієнту початкової дози 2 приблизно 55 мг/м імунокон'югату майтанзиноїду проти CD19, і введення пацієнту ряду 2 подальших доз приблизно 55 мг/м імунокон'югату майтанзиноїду проти CD19, де подальші дози вводять окремо одну від одної у часі через один тиждень. У одному із аспектів винахід стосується імунокон'югату майтанзиноїду проти CD19 для лікування пацієнта, який є людиною, у якої діагностували симптом CD19+ В-клітинних злоякісних новоутворень, способом, що включає стадії введення пацієнту початкової дози 2 приблизно 55 мг/м імунокон'югату майтанзиноїду проти CD19, а потім введення пацієнту ряду 2 подальших доз приблизно 55 мг/м імунокон'югату майтанзиноїду проти CD19, розділених у часі одна від одної одним тижнем, і на додатковій стадії введення ряду подальших доз приблизно 2 55 мг/м імунокон'югату майтанзиноїду проти CD19, розділених у часі одна від одної двома тижнями. У іншому аспекті винахід стосується промислового виробу, який містить: 3 UA 114401 C2 5 10 15 20 25 30 35 40 45 50 55 60 - пакувальний матеріал, - імунокон'югат майтанзиноїду проти CD19 і - етикетку або вкладиш в упаковку, що міститься у вказаному пакувальному матеріалі, в якому вказують, що вказаний імунокон'югат майтанзиноїду проти CD19 вводять пацієнту в 2 початковій дозі приблизно 55 мг/м і в ряді подальших доз, розділених у часі одна від одної 2 одним тижнем, в кількість, яка становить приблизно 55 мг/м . У іншому аспекті винахід стосується промислового виробу, що містить: - пакувальний матеріал, - імунокон'югат майтанзиноїду проти CD19 і - етикетку або вкладиш в упаковку, що міститься у вказаному пакувальному матеріалі, в якому вказують, що вказаний імунокон'югат майтанзиноїду проти CD19 вводять пацієнту в 2 початковій дозі приблизно 55 мг/м , потім в ряді подальших доз, розділених у часі одна від одної 2 одним тижнем, в кількість, яка становить приблизно 55 мг/м , а потім в ряді подальших доз, 2 розділених у часі одна від одної двома тижнями, в кількість, яка становить приблизно 55 мг/м . У одному із аспектів винахід стосується промислового виробу, що містить: - пакувальний матеріал, - імунокон'югат майтанзиноїду проти CD19 і - етикетку або вкладиш в упаковку, що міститься у вказаному пакувальному матеріалі, в якому вказують, що вказаний імунокон'югат майтанзиноїду проти CD19 вводять пацієнту в 2 початковій дозі приблизно 55 мг/м для мінімізації ризиків токсичності, такої як відстрочена і кумулятивна токсичність, і зокрема ризиків офтальмологічної токсичності. Такий пакувальний матеріал, який вказує, що вказаний імунокон'югат майтанзиноїду проти 2 CD19 вводять пацієнту в дозі приблизно 55 мг/м (4 дози, розділені у часі одна від одної одним тижнем, а потім 4 подальші дози, розділені у часі одна від одної двома тижнями) для обмеження накопичення лікарського засобу, для якого передбачають, що він є причиною щонайменше частково - кумулятивної токсичності або підвищення ступеня такої токсичності, такої як токсичні зміни рогівки, периферійна сенсорна нейропатія і парестезія. У конкретному варіанті здійснення в етикетці або вкладиші в упаковку, що міститься у вказаному пакувальному матеріалі, вказують, що частота виникнення пов'язаних із зором побічних ефектів (всі ступені) складає менше 40 %, 30 % або 25 %. У конкретному варіанті здійснення в етикетці або вкладиші в упаковку, що міститься у вказаному пакувальному матеріалі, вказують, що частота виникнення пов'язаних із зором побічних ефектів 3/4 ступеня складає менше 13 %, 10 % або 5 %. Офтальмологічна токсичність характеризується порушеннями із боку органів зору, що спостерігаються у пацієнтів. Порушення із боку органів зору визначені у версії 3.0 документа, який має назву "Common Terminology Criteria for Adverse Events (CTCAE)", опублікованого 28 травня 2009 року Міністерством охорони здоров'я і соціальних служб США, до якої може звертатися фахівець в даній галузі. Згідно із даним описом порушення із боку органів зору класифікує по побічних ефектах (AE), які кількісно оцінюють залежно від їх тяжкості. У CTCAE представлені ступені від 1 до 5 із унікальним клінічним описом тяжкості кожного AE на основі цього основного загального керівництва: Ступінь 1 легкий, безсимптомний або помірні симптоми; тільки клінічні або діагностичні спостереження; втручання не показано; Ступінь 2 помірний; показано мінімальне, місцеве або неінвазивне втручання; обмежуюча відповідна віку інструментальна активність в повсякденному житті (ADL); Ступінь 3 важкий або значущий із медичної точки зору, але безпосередньо не небезпечний для життя; показана госпіталізація або продовження госпіталізації; втрата працездатності; яка обмежує самообслуговування ADL; Ступінь 4 небезпечні для життя наслідки; показано термінове втручання; Ступінь 5 смерть, пов'язана із AE. Імунокон'югат майтанзиноїду проти CD19 можна вводити в фармацевтичних композиціях, які містять: - ефективну кількість імунокон'югату майтанзиноїду проти CD19 і - фармацевтично прийнятний носій, який може бути інертним або фізіологічно активним. Як застосовують в даному описі, "фармацевтично прийнятні носії" включають будь-які і всі розчинники, диспергуючі середовища, покриття, антибактеріальні і протигрибкові засоби і т. п., які є фізіологічно сумісними. Приклади придатних носіїв, розчинників і/або ексципієнтів включають один або більше із води, фізіологічного розчину, фосфатно-сольового буфера, 4 UA 114401 C2 5 10 15 20 25 30 35 40 45 50 55 60 декстрози, гліцерину, етанолу і т. п., а також їх поєднання. У багатьох випадках в композицію переважно вводити засоби надання ізотонічності, такі як цукри, багатоатомні спирти або хлорид натрію. Зокрема, відповідні приклади придатного носія включають: 1) фосфатно-сольовий буфер Дульбекко, pH~7,4, який містить або не містить приблизно від 1 мг/мл до 25 мг/мл сироваткового альбуміну людини, 2) 0,9 % фізіологічний розчин (0,9 % мас./об. хлориду натрію (NaCl)) і 3) 5 % (мас./об.) декстрозу; і також можуть містити антиоксидант, такий як триптамін, і стабілізатор, такий як Tween 20. У іншому варіанті здійснення імунокон'югат майтанзиноїду проти CD19 вводять внутрішньовенно. Однак можна використовувати інший спосіб парентерального введення: наприклад, внутрішньом'язовий, інтраперитонеальний або підшкірний. Коли імунокон'югат майтанзиноїду проти CD19 вводять внутрішньовенно, його можна вводити у вигляді болюсу або за допомогою безперервної інфузії протягом періоду часу, який, як правило, складає від 10 хвилин до 4 годин. У іншому варіанті здійснення для надання місцевих, а також системних терапевтичних ефектів їх ін'єктують внутрішньом'язовим, підшкірним, внутрішньосуглобовим, інтрасиновіальним, внутрішньопухлинним, перитуморальним шляхами, всередину ураженої ділянки або по периферії ураженої ділянки. Їх також можна вводити за допомогою розпилення. Імунокон'югат майтанзиноїду проти CD19 можна вводити в ряді форм. Вони включають, наприклад, рідкі, напівтверді і тверді лікарські форми, але форма залежить від передбачуваного способу введення і терапевтичного застосування. Характерні композиції знаходяться в формі ін'єкційних або інфузійних розчинів. Стерильні композиції для парентерального введення можна отримувати введенням імунокон'югату майтанзиноїду проти CD19 в необхідній кількості у придатний розчинник із подальшою стерилізацією за допомогою мікрофільтрації. Як розчинник або носій можна використовувати воду, фізіологічний розчин, фосфатно-сольовий буфер, декстрозу, гліцерин, етанол і т. п., а також їх поєднання. У багатьох випадках в композицію переважно вводити засоби надання ізотонічності, такі як цукри, багатоатомні спирти або хлорид натрію. Такі композиції також можуть містити ад'юванти, зокрема зволожувачі, засоби надання ізотонічності, емульгуючі засоби і стабілізатори. Стерильні композиції для парентерального введення також можна отримувати в формі стерильних твердих композицій, які можна розчиняти в момент застосування в стерильній воді або в будь-якому іншому ін'єктованому стерильному середовищі. Імунокон'югат майтанзиноїду проти CD19 можна вводити спільно із додатковим терапевтичним засобом, таким як хіміотерапевтичний засіб, по мірі необхідності для конкретного підлягаючого лікуванню порушення. Переважно імунокон'югат майтанзиноїду проти CD19 і додатковий активний засіб мають комплементарні активності, які не впливають несприятливо одна на одну. Такий хіміотерапевтичний засіб можна вводити одночасно, із невеликим інтервалом, окремо або із інтервалами протягом періоду часу, таким чином, щоб отримувати максимальну ефективність спільного введення; де для кожного введення можна змінювати його тривалість від швидкого введення до безперервної перфузії. Для здійснення даного винаходу фахівець в даній галузі може звертатися, зокрема, до EP1651162. Фігури Фіг. 1 - структура кон'югата HuB4-DM4 SAR3419. Фіг. 2 - відповідь на лікування за рівнем дозування. Фіг. 3 - відповідь на лікування за гістологією. Фіг. 4 - зменшення розміру пухлини у часі при MTD. Наступний нижченаведений приклад ілюструє комбінацію за винаходом. ПРИКЛАД 1. Кон'югат HuB4-DM4, який вводиться щотижня пацієнтам із рецидивуючою/рефрактерною CD19-позитивною В-клітинною неходжкінською лімфомою (дослідження TED6829) ЗАДАЧІ ДОСЛІДЖЕННЯ Первинні: Визначити максимальну переносиму дозу (MTD) SAR3419 по обмежуючих дозу видах токсичності (DLT), які спостерігаються при введенні в/в у вигляді окремого засобу один раз на тиждень пацієнтам із рецидивуючою або рефрактерною В-клітинною NHL. Повторні: Охарактеризувати загальний профіль безпеки SAR3419. Оцінити фармакокінетичний (PK) профіль SAR3419. 5 UA 114401 C2 5 10 15 20 25 Провести фармакодинамічні (PD) оцінки. Оцінити потенційну імуногенність SAR3419. Оцінити попередні показники антилімфомної активності. СПОСОБИ План дослідження У дослідження включали дорослих пацієнтів із рефрактерною або рецидивуючою Вклітинною NHL із експресією антигену CD19. Підвищення дози основувалося на безпеці плану 3+3. Підвищення дози проводили, керуючись частотою виникнення попередньо визначеної DLT протягом початкового періоду лікування тривалістю 3 тижні. Для визначення рекомендованої дози, також необхідно враховувати відстрочену або кумулятивну токсичність протягом періоду лікування. Лікарський продукт SAR3419 був доступним у вигляді розчину для інфузії при 25 мг/25 мл (1 мг/мл) відносно активної речовини, яка поставляється в 30 мл флаконі із прозорого скла. SAR3419 у вигляді окремого засобу вводили в/в один раз на тиждень для 8 доз. Дослідники і спонсор могли обговорювати і давати згоду на будь-яке додаткове лікування, яке могло забезпечувати клінічну перевагу для пацієнта. Перед кожною інфузією потрібна була премедикація дифенгідраміном 50 мг в/в і ацетамінофеном 650 мг перорально. Оцінки Проводили сканування комп'ютерною томографією (CT) і/або позитронно-емісійною томографією (PET) при включенні в дослідження, після 8 доз і через 42-49 діб після останнього лікування (EOT). За пацієнтами, які відповідали на лікування, спостерігали кожні 3 місяці протягом періоду до 1 року. Оцінки PK і імуногенності проводили із використанням зразків крові, які збираються на момент включення, в конкретні часові точки під час лікування і при EOT. РЕЗУЛЬТАТИ У наступних таблицях 1-7 наведені результати. Таблиця 1 Демографічні дані включення і характеристика захворювання Отримували лікування Підвищення дози/збереження підвищеної дози Оцінювані відносно безпеки Оцінювані відносно відповіді Вік, середній (діапазон) Чоловічої статі/жіночої статі Гістологія FL DLBCL MCL, MZL, SLL, змішана Стадія III/IV при включенні в дослідження Середнє число попередніх схем лікування Пацієнти із попередньою терапією ритуксимабом Пацієнти із резистентним до ритуксимабу захворюванням Попередня трансплантація стовбурових клітин аутологічна/алогенна N 44 28/16 44 43 67 (36-82) 30/14 Включення в Первинний діагноз дослідження* 19 (43 %) 15 (34 %) 16 (36 %) 17 (39 %) 3, 4, 1, 1 4, 0, 1, 1 39 (89 %) 3(1-8) 43 (98 %) 21 (48 %) 18 (41 %)/1 (2 %) * у 6 відсутні гістологічні дані на момент включення в дослідження 30 6 UA 114401 C2 Таблиця 2 Підвищення дози Включені в Пацієнт із попередньо визначеною DLT Включені в Рівень дозування дослідження дослідження 2 (мг/м / пацієнти Період попередньо пацієнти (фактична Період лікування тиждень) (передбачувана визначеної DLT доза)*** доза) 5 доз) значна токсичність 2 ступеня: нечіткий зір, асоційований із відкладеннями на роговиці, і блокадою лівої ніжки пучка Гіса, які враховують для підвищення дози. 2 ** У дослідженні як MTD/RD (рекомендованої дози) визначали 55 мг/м . *** На одній досліджуваній ділянці помилково не промивали лінію для в/в введення при кожній інфузії досліджуваного лікарського засобу. Не вводили мертвий об'єм 18 мл препарату, відповідний 18 мг досліджуваного лікарського засобу. Восьми пацієнтам, які були включені в дослідження на цій ділянці, внаслідок переназначали їх фактичний рівень дозування. Результати дослідження надані на основі фактичного рівня дозування Таблиця 3 Гематологічно не зв'язані TEAE 3-4 ступеня 2 Рівні дозування (мг/м /тиждень) Побічні ефекти* Підвищена гаммаглутамілтранс-фераза Холестаз Оптична нейропатія Парестезія Лобарна пневмонія Алергічний альвеоліт Прогресуюча багатовогнищева лейкоенцефа-лопатія 10 %) незалежно від відношення до досліджуваного лікарського засобу (N=25) Всі ступені* 7 (28,0 %) 4 (16,0 %) 4 (16,0 %) 3 (12,0 %) 3 (12,0 %) 3 (12,0 %) 3 (12,0 %) 3 (12,0 %) Астенія Діарея Біль у животі/у верхній частині Тошнота Запор Бронхіт Пірексія Міалгія 3-4 ступені** 1 1 * оборотний нечіткий зір 1 ступеня і парестезія 1 ступеня описані у 1 пацієнта кожний. ** інші 3-4 ступені, описані у дослідженні (кожний 1 випадок): увеїт, пієлонефрит, інфаркт міокарда, лімфатичний набряк Таблиця 10 Гематологічна токсичність (N=25) Лабораторні необроблені дані Лейкопенія Нейтропенія Анемія Тромбоцитопенія Всі ступені 18 12 23 16 3 ступінь 2 (1)* 3 (2)* 1 3 (2)* 4 ступінь 1 3 (2)* 1 (0)* * 2 пацієнти отримували додаткову протиракову терапію без виключення із гематологічної характеристики. 1 пацієнт відхилявся від норми при включенні у дослідження і її включали із 3 ступенем нейтропенії/лейкопенії Таблиця 11 Антилімфомна активність при схемі qw/q2w 7/25 (28 %), включаючи 3 CRu* 3/9 (33 %) 64 % [8; 35+]** потрібно уточнити ORR (CR/PR) ORR у підтипі DLBCL Зменшення розміру пухлини Тривалість відповіді (тижні) *1 CRu у пацієнта, резистентного до останньої схеми лікування. ** х пацієнтів все ще відповідали на лікування у останню дату обліку даних дослідження 5 11 UA 114401 C2 Таблиця 12 Середні(CV%) PK параметри SAR3419 після першої і останньої дози SAR3419 b AUC0-T Cavg N (доба) Cmax (мкг/мл) (мкг доба/ (мкг/мл) мл) 0,06 [0,0420 28,6 (19) 107 (22) 15,3 (22) 0,24] а tmax 1-е введення SAR3419 Останнє введення SAR3419 (із 5-го по 12е введення) 9 CLss (л/доба) Vss (л) t1/2Z (доба) Н/З Н/З Н/З 0,06 41,6 260 18,6 0,438 4,34 7,99 [0,06-0,22] (26) (31) (31) (56) (28) (27) Cmax: максимальна спостережувана концентрація; tmax: перший момент часу отримання Cmax; AUC: область під кривою концентрації в порівнянні із кривою часу; Cavg: середня концентрація під час інтервалу дозування; CLss: кліренс при стабільному стані; Vss: об'єм розподілу при стабільному стані; t1/2z: кінцевий період напіввиведення. a b : середнє значення [мінімальне-максимальне], : T відповідає інтервалу дозування (через 7 діб і 14 діб після 1-го і останнього введення відповідно); Н/З: незастосовно. 5 10 15 20 25 Висновки Середнє число отримуваних доз становило 8, як планували, із середньою відносною інтенсивністю дози 1,0 [0,8-1,0] при RD. Найбільш часті зв'язані TEAE являли собою астенію у 5 (23,8 %) пацієнтів (1 випадок 3 ступеня) і шлунково-кишкові порушення у 7 (33 %) пацієнтів. Оборотний нечіткий зір/випадок відносно рогівки 1 ступеня виникав у 1 пацієнта. Гематологічна токсичність 3-4 ступеня була мінімальною. Зменшення розміру пухлини спостерігали у 16 (64 %) пацієнтів. У семи (28 %) пацієнтів отримували цільову відповідь, включаючи 1 CR і 3 повних відповіді (CRu). Частота відповіді по суті зберігалася при прогресуючому захворюванні (3/9 пацієнти із DLBCL). У висновку схема, яка включає 4 тижневе дозування із подальшим 4 дозами раз на два тижні, демонструє поліпшений профіль безпеки в порівнянні із тестованими раніше режимами введення, де клінічна ефективність по суті зберігалася при прогресуючій лімфомі. Загальні висновки 2 MTD/RD SAR3419 визначали під час цього дослідження як 55 мг/м (максимальна 2 переносима доза), тоді як максимальна доза (MAD), що вводиться становила 70 мг/м . 2 Для оптимізованого режиму введення (55 мг/м щотижня/раз на два тижні) продемонстрували поліпшені профіль безпеки в порівнянні із раніше тестованими режимами, із вираженим клінічним контролем частоти виникнення і тяжкості пов'язаної із ADC (зміною рогівки)/DM4 (нейро-, травної і гематологічної) токсичності. При обох режимах введення спостерігали антилімфомну активність приблизно у 30 % 2 пацієнтів при 55 мг/м MTD/RD, зокрема у пацієнтів із прогресуючої гістологією (DLBCL) в цій дозі при рекомендованому режимі введення, щотижня/раз на два тижні. 12 UA 114401 C2 13 UA 114401 C2 14 UA 114401 C2 15 UA 114401 C2 16 UA 114401 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 1. Спосіб лікування симптому CD19+ В-клітинних злоякісних новоутворень у потребуючого цього пацієнта, що є людиною, де вказаний спосіб включає стадії, на яких: 2 a) вводять вказаному пацієнту початкову дозу 55 мг/м імунокон'югата майтанзиноїду проти CD19, 2 b) вводять пацієнту щонайменше 3 подальших дози по 55 мг/м імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної одним тижнем, і 2 c) вводять пацієнту щонайменше 3 подальших дози по 55 мг/м імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної двома тижнями, де вказаний імунокон'югат майтанзиноїду проти CD19 містить антитіло, яке специфічно зв'язується з антигеном CD19, що містить: a) CDR1 важкого ланцюга, що містить SNWMH (SEQ ID NO:4); CDR2 важкого ланцюга, що містить EIDPSDSYTN (SEQ ID NO:5); і CDR3 важкого ланцюга, що містить GSNPYYYAMDY (SEQ ID NO:6); і b) CDR1 легкого ланцюга, що містить SASSGVNYMH (SEQ ID NO:1); CDR2 легкого ланцюга, що містить DTSKLAS (SEQ ID NO:2); і CDR3 легкого ланцюга, що містить HQRGSYT (SEQ ID NO:3), де майтанзиноїд являє собою DM4; і де антитіло кон'юговане з DM4 через лінкер Ncyкцинiмiдил-4-(2-пipидилдитio)бyтaнoaт (SPDB). 2. Спосіб за п. 1, який відрізняється тим, що спосіб зводить до мінімуму пов'язані із зором небажані явища. 17 UA 114401 C2 5 10 15 20 25 30 35 3. Спосіб за п. 2, де частота виникнення всіх ступенів пов'язаних із зором небажаних явищ складає менше 40 %. 4. Спосіб за п. 2, де частота виникнення пов'язаних із зором небажаних явищ 3 або 4 ступеня складає менше 13 %. 5. Спосіб за будь-яким із пп. 1-4, де вказане CD19+ В-клітинне злоякісне новоутворення являє собою лейкоз або лімфому. 6. Спосіб за п. 5, де вказана лімфома являє собою неходжкінську лімфому (NHL). 7. Спосіб за п. 5, де вказаний лейкоз являє собою гострий лімфобластний лейкоз (ALL). 8. Спосіб за п. 6, де вказана неходжкінська лімфома являє собою дифузну великоклітинну Вклітинну лімфому (DLBCL), фолікулярну лімфому (FL), лімфому мантійних клітин (MCL), лімфому клітин маргінальної зони (MZL), дрібноклітинну лімфому (SLL) або макроглобулінемію Вальденстрема (WM). 9. Спосіб за п. 6, де вказана неходжкінська лімфома являє собою рецидивуючу або рефрактерну неходжкінську лімфому. 10. Спосіб за п. 6, де вказана неходжкінська лімфома являє собою неходжкінську лімфому із експресією CD19. 11. Спосіб за п. 6, де у вказаного пацієнта вже проводили лікування неходжкінської лімфоми. 12. Спосіб за п. 6, де для вказаного пацієнта терапія ритуксимабом виявилася неефективною. 13. Спосіб за п. 6, де вказана неходжкінська лімфома не є резистентною до ритуксимабу. 14. Спосіб за п. 6, де вказаному пацієнту проводили трансплантацію аутологічних або алогенних стовбурових клітин. 15. Спосіб за будь-яким із пп. 1-14, де імунокон'югат майтанзиноїду проти CD19 вводять внутрішньовенно. 16. Спосіб за будь-яким з пп. 1-15, де імунокон'югат майтанзиноїду проти CD19 містить антитіло HuB4, кон'юговане із DM4 через лінкер SPDB. 17. Спосіб за будь-яким із пп. 1-16, де імунокон'югат майтанзиноїду проти CD19 має наступну нижченаведену формулу: . 18. Спосіб за будь-яким із пп. 1-16, де антитіло містить легкий ланцюг з послідовністю SEQ ID NО:7 і важкий ланцюг з послідовністю SEQ ID NО:8. 19. Спосіб за п. 16, який відрізняється тим, що 3,5 молекул DM4 зв'язані через лінкер SPDB з кожною молекулою антитіла HuB4. 20. Спосіб за будь-яким із пп. 1-19, який включає стадії, на яких вводять пацієнту 4 дози по 55 2 мг/м імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної одним 2 тижнем, і вводять пацієнту 4 подальших дози по 55 мг/м імунокон'югата майтанзиноїду проти CD19, відокремлених в часі одна від одної двома тижнями. 21. Спосіб за п. 20, в якому антитіло містить легкий ланцюг з послідовністю SEQ ID NО:7 і важкий ланцюг з послідовністю SEQ ID NO:8. 22. Спосіб за п. 20, в якому антитілом є антитіло HuВ4. 18 UA 114401 C2 19 UA 114401 C2 Комп’ютерна верстка Л. Ціхановська Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of anti-cd19 maytansinoid immunoconjugate antibody for the treatment of b-cell malignancies symptoms
Автори англійськоюMorariu, Rodica
Автори російськоюМорарию Родика
МПК / Мітки
МПК: C07K 16/28, A61K 39/395, A61K 39/44
Мітки: застосування, в-клітинних, імунокон'югованого, злоякісних, антитіла, новоутворень, майтанзиноїдом, симптомів, лікування
Код посилання
<a href="https://ua.patents.su/22-114401-zastosuvannya-imunokonyugovanogo-iz-majjtanzinodom-antitila-proti-cd19-dlya-likuvannya-simptomiv-v-klitinnikh-zloyakisnikh-novoutvoren.html" target="_blank" rel="follow" title="База патентів України">Застосування імунокон’югованого із майтанзиноїдом антитіла проти cd19 для лікування симптомів в-клітинних злоякісних новоутворень</a>
Попередній патент: Паперовий лист високої зносостійкості для виробництва банкнот
Наступний патент: Композиція для біоконтролю у вигляді гранул, що диспергуються у воді
Випадковий патент: Спосіб магнітної сепарації