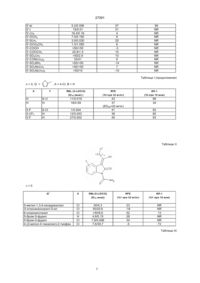
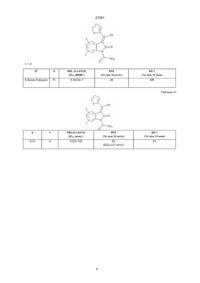
Спосіб одержання 3-заміщених 2-оксоіндолів
Номер патенту: 27291
Опубліковано: 15.09.2000
Автори: Шульте Гері Річард, Ехрготх Фредерік Джакоб, Годдарт Карл Джозеф
Текст
27291 Настоящее изобретение относится к способу получения производных 3- замещенных 2оксоиндолов, которые являются ингибиторами простагландин Н 2 синтазы, 5-липоксигеназы и биосинтеза интерлейкина-1. Соединения изобретения являются полезными в качестве ингибиторов простагландин Н 2 синтазы и биосинтеза интерлейкина-1, самих по себе, а такж е в качестве анальгетических, противовоспалительных и противоаритмических агентов при лечении хронических воспалительных заболеваний. В патенте США 4 569 942 описаны некоторые 2-оксиндол-1-карбоксамиды формулы: O R1 X O N Y N H -R 2 O где X является Н, фтором, хлором, бромом, (C1-C4)алкилом, (С3-С7)циклоалкилом, (C1-C4)алкокси, (C1C4)алкилтио, трифторметилом, (C1-C4) алкилсульфинилом, (C1-C4) алкилсульфонилом, нитро, фенилом, (С2-С4) алканоилом, бензоилом, теноилом, (C1-C4) алканамидо, бензамидо или N,Nдиалкилсульфамоилом, имеющим 1-3 атома углерода в каждом из указанных алкилов, Y является Н, фтором, хлором, бромом, (C1-C4) алкилом, (С3-С7)циклоалкилом, (C1-C4)алкокси, (C1-C4)алкилтио и трифторметилом, R1 является (C1-С6)алкилом, (С3-С7)циклоалкилом, (С4-С7)циклоалкенилом, фенилом, замещенным фенилом, фенилалкилом, имеющим 1-3 атома углерода в указанном алкиле, (замещенным фенокси)алкилом, содержащим 1-3 атома углерода в указанном алкиле, (тио-фенокси)алкилом, содержащим 1-3 атома углерода в указанном алкиле, нафтилом, бицикло(2.2.1)гептан-2-илом, бицикло(2.2.1)гепт-5-ен-2-илом или -(СН2)n-O-R0, n равно нулю, 1 или 2, 0 является двухвалентным радикалом, происходящим из фурана, тиофена, пиррола, пиразола, имидазола, тиазола, изотиазола, оксазола, изоксазола, 1,2,3-тиадиазола, 1,3,4-тиадиазола, 1,2,5-тиадиазола, тетрагидрофурана, тетрагидротиофена, тетрагидропирана, тетрагидротиопирана, пиридина, пиримидина, пиразина, бензо [в] фурана и бензо [в] тиофена, R0 является Н или (C1-С3) алкилом, и R2 является (C1-C6)алкилом, (С3С7)циклоалкилом, бензилом, фурилом, тиенилом, пиридилом или где R3 и R4 каждый является Н, фтором, хлором, (C1-C4) алкилом, (C1-C4) алкокси или трифторметилом. В этом патенте также описано, что указанные 2-оксиндол-1-карбоксамиды являются ингибиторами циклооксигеназы и липоксигеназы, обладают анальгетической активностью у млекопитающих и являются полезными при лечении боли и облегчения симптомов хронических заболеваний, таких как воспаление и боль, связанные с ревматоидным артритом и остеоартритом. В патенте США 4 556 672 описаны некоторые 3-ацилзамещенные 2-оксиндол-1-карбоксамиды формулы: где X, Y и R1 имеют значения, указанные ранее для соединений патента США 4 569 942. Соединения патента США 4 556 672 описаны как имеющие такую же активность, как и соединения патента США 4 569 942, указанную выше. В патенте США 4 861 794 описано использование соединений формулы: и их фармацевтически приемлемых основных солей, где Х является Н, Сl или F, Y является Н или Cl, a R является бензилом или тиенилом, для ингибирования биосинтеза интерлейкина-1 (ИЛ-1) и для лечения вызванных ИЛ-1 расстройств и дисфункций. В заявке на патент РСТ серийный № РСТ (US88) 03658, поданной 18 октября 1988 года, описаны нестероидные противовоспалительные агенты формулы: 1 27291 где каждый Х и Y является водородом, фтором или хлором, R1 является 2-тиенилом или бензилом, и R является алканоилом, циклоалкилкарбонилом, фенилалканоилом, бензоилом и некоторыми замещенными бензоильными группами, теноилом, омега-алкоксикарбонилалканоилом, алкокси карбонилом, феноксикарбонилом, 1- алкоксикарбонилокси, алкилсульфонилом, метилфенилсульфонилом и диалкилфосфанатом. Уже сообщалось, что интерлейкин-1 (ИЛ-1) стимулирует ресорбцию кости как in vitro, так и in vivo. Hayward M. и Fiedler-Hagy Cn. , Агенты и Действия, 22, 251-254 (1987). Также сообщалось здесь, что ИЛ-1, между прочим, индуцирует продуцирование простагландина E2 (ПГЕ2), является стимулятором резорбции кости и участвует в потере кости. Смотри Hayward М. и Caggiano T.J., Annual Reports in Medicinal Chemistry, 22, Secf. IV, Chapter 17, 169-178 (1987) . Остеопороз определяется как ослабление потери минеральных составляющих кости, что в результате приводит к более высокой скорости перелома. Смотри Hayward М. и Caggiano T.J., выше, и приведенные здесь ссылки. Уже сообщалось, что интерлейкин-1 включается в патогенез многих заболеваний. Смотри Dinarello С.A., J.Clin. Immunol., 5, 287-297 (1985), содержание которых приводится здесь в качестве уровня техники. Кроме того, было обнаружено, что повышенные уровни ИЛ-1 подобного материала ассоциируются с псориазом. Camp R.D. et al., J. Immunol., 137, 3469-3474 (1986). Настоящее изобретение обеспечивает новый способ получения производных 3-замещенных 2оксоиндолов формулы: A -Q OH X O N R7 N O R8 (I) в которой Х = водород, хлор, фтор, (C1-C6)алкил, трифторметил; R7, R8 = одинаковые или разные водород, (C1-C6)алкил; Q = тиенил, фурил, пиридил, изотиазолил, изоксазолил; А = водород, хлор, фтор, бром, группы OR8, CONR8R10, SO2NR8R10, SOpR9, COOR10; группа формулы: N N R12 z 12 , z R12 , где R - водород или (C1-C6) алкил; Z означает S или О; R9 = (C1-С6) алкил или фенил; R10 = водород, (C1-С6)алкил, фенил; р = 0, 1 или 2 заключающийся в том, что соединение общей формулы (II): A-Q-COOH (II), в которой А и Q имеют вышеуказанные значения, подвергают взаимодействию с молярным избытком 1, 1‘карбонилдиимидазола в инертном растворителе и инертной атмосфере с последующим взаимодействием полученного продукта с замещенным 2-оксоиндолом формулы (III): , где X, R7 и R8 имеют указанные выше значения, в присутствии основного агента при температуре 0-50°С в инертном растворителе и атмосфере. Хотя приведенные выше соединения формулы I показаны как энолы, простые и сложные эфиры энолов, должно быть понятно, что соединения формулы I могут быть в их таутомерной кетонной форме. Все такие таутомерные формы входят в область настоящего изобретения и изображаются формулой I. Далее, заместители у экзоциклической двойной связи в положении 3 соединений формулы I могут быть син, анти или смесью обоих изомеров и входят в область настоящего изобретения, и все такие изомеры описываются формулой I и входят в область приложенной формулы изобретения. 2 27291 Соединения формулы I являются активными как ингибиторы простагландин H2 синтазы (циклооксогеназы), как ингибиторы 5-липоксигеназы и как ингибиторы биосинтеза интерлейкина-1 (ИЛ-1) у млекопитающих. Соединения формулы I в дополнение к их полезности в качестве ингибиторов являются полезными как анальгетики, противовоспалительные и антиартритные агенты при лечении хронических воспалительных заболеваний у млекопитающих. Настоящее изобретение также обеспечивает фармацевтические композиции, содержащие соединения формулы I. Далее, настоящим изобретением обеспечиваются способы ингибирования простагландин H2 синтазы и биосинтеза интерлейкина-1 у млекопитающих при введении эффективного количества соединений формулы I указанному млекопитающему. Настоящим изобретением также обеспечиваются способы лечения вызванных интерлейкином-1 расстройств и иммунных дисфункций и/или хронических воспалительных заболеваний у млекопитающих при введении указанным млекопитающим эффективного количества соединения формулы I. В рамках настоящего изобретения такие хронические заболевания включают, но не ограничиваются ими, псориаз, ревматоидный артрит или остеоартрит. Кроме того, настоящее изобретение обеспечивает новый способ получения соединений формулы I, который заключается во взаимодействии соединения формулы A-Q-COOH (II), где Q и А имеют указанные ранее для соединения формулы I значения, с молярным избытком 1,11- карбонилдиимидазола в инертном реакционном растворителе в инертной атмосфере с последующим взаимодействием полученного продукта в присутствии основного агента с производным 2-оксоиндола формулы III, указанной выше, где X, Y, R7 и R8 определены выше для соединений формулы I, при температуре около 0-50°С в инертном реакционном растворителе в инертной атмосфере. Соединения формулы I могут быть получены по новому способу изобретения, описанному ниже. Карбоновые кислоты формулы II, полученные, как описано ниже, вводят в реакцию с небольшим молярным избытком 1, 1’-карбонилдиимидазола в инертном реакционном растворителе. Реакцию проводят при температуре около 25°С и перемешивают в инертной атмосфере. Реакцию проводят в течение примерно 2 часов, после чего всю реакционную смесь прибавляют к смеси, состоящей из, примерно, эквимолекулярного количества замещенного 2-оксоиндольного соединения формулы III в присутствии молярного избытка основного агента в инертном реакционном растворителе, в инертной атмосфере. Подходящими инертными реакционными растворителями являются те, которые будут, по крайней мере, частично растворять один или все реагенты или продукт, а предпочтительным для использования здесь растворителем является N,N-диметилформамид. Инертную атмосферу получают при проведении реакции в инертном газе, таком как азот или аргон. Предпочтительными основными агентами являются 4- (N,Nдиметиламино)пиридин и триэтиламин. Некоторые карбоновые кислоты формулы II являются известными или могут быть получены известными способами или по способам, аналогичным известным методикам. Такие способы могут включать получение соответствующих сложных эфиров или нитрилов соответствующих карбоновых кислот, которые в случае гидролиза по известным методикам дают интересующие карбоновые кислоты. Такие способы описаны в: Taylor, E.C., et al. , J. О.С. 50:1002 (1985); Noto, R., et al., J. Chem. Soc. P.T. II, 689 (1987); Schick, J.W., et al., J. Chem. Soc. 70:286 (1948); Carpenter, A.J., et al., Tetrahedron 41:3808 (1985); Gronowitz, S., et al., Arkiv. for Kemi. 21:265 (1963); Benkeser, R.A., et al., J.O.C. 38:3660 (1973); Corral, C., et al., Heterocycles 23:1431 (1985); Iriarte, J., et al., J. Het. Chem. 13:393 (1976); Reinecke, M.G., et al. Synthesis, 327 (1980); Lawesson, S.O., Arkiv. for Kemi. 11:317 (1957); Gronowitz, S., Arkiv. for Kemi. 8:87 (1955); Knight, D.W., et al., J. Chem. Soc. P.T.I. 791 (1987); Gronowitz, S., Arkiv. for Kemi. 12:239 (1958); Sice, J., J. Am. Chem. Soc. 75:3697 (1953); Bohlmann, F., et al., Chem. Ber. 106:497 (1973); Thames, S.F., et al., J. Het. Chem. 3:104 (1966); Arndt, F., et al., Chem. Ber. 94:1757 (1961); Cymerman-Craig, J., et al., J. Chem. Soc. :237 (1954); LoraTamayo, M., et al., Anales Real Soc. Espan. Fis. Quim. Ser. В 62:187 (1966); Nemec, N., et al., Coll. Czech. Chem. Comm. 39:3527 (1974); Janda, M., et al., Coll. Czech. Chem. Comm. 27:1191 (1962); Carpenter, A.J., et al., Tetrahedron Letters. 26:1777 (1985); Satonaka, H., Bull. Chem. Soc. Japan 56:2463 (1983); Kinoshita, Т., et al., Bull. Chem. Soc. Japan 48:1865 (1975); Schwertner, E., et al., CA 88:105790c (1978); Takaya, Т., et al., Bull. Chem. Soc. Japan 41:2086 (1968); Kim, H., et al., J. Med. Chem. 29:1374 (1986); Dostert, P., et al., Eur. J. Med. Chem.-Chim. Ther. 17:437 (1982); Sato, N., et al., J. Heterocyclic Chem. 19:407 (1982); Ladruee, D., et al., Heterocycles 22:299 (1984); Leanza, W.J., et al., JACS 75:4086 (1953); Barlin, G.B., et al., Aust. J. Chem. 30:2319 (1977); Gregory, G.I., et al., JCS P.T. 1:47 (1973); Moriarty, R.M., et al., JACS 89:5958 (1967); Ross, J.M., et al., JACS. 86:2861 (1964); Goerdeler, J., et al., Chem. Ber. 99:1618 (1966); Demaree, P., et al., Can. J. Chem. 55:243 (1977); U.S. Patent 4,001,238; Kamazu, M., et al., J. Med. Chem. 15:914 (1972); Buckle, D.R., et al., JCS P.T. 1:627 (1982); Naik, S.R., et al., JOC 38:4353 (1973); Okada, M., et al., Marcomolecules 19:503 (1986); On-detti, M.A., et al., CA 92:76268p (1980); Neth. Appl. 6,503,440, Sept. 20, 1965; Kenley, R.A., CA101:90841f (1984); Schmidt, U., et al., CA 96:104572m (1982); Lukes, R., et al., Chem. listy 51:1510 (1957); Krowicki, К., et al., JOC 52:3493-3501 (1987); Goya, P., et al., Heterocycles 24:3451 (1986); Montero, J.L., et al., J. Heterocyclic Chem. 15:929 (1978); Yasuda, N., et al., J. Heterocyclic Chem. 24:303 (1987); Hosmane, R.S., et al., Heterocycles 24:2743 (1986); Rapoport, H., et al., Environ. Health Persp. 67:41 (1986); Kravchenko, Т.В., et al., CA107:189533t (1987); Stanovnik. В., et al., Heterocycles 12:761 (1979); Smith, R.C., et al., Biochem. Pharmacol 36:1457 (1987); Bosso, С., et al., Org. Mass Spectrom 20:263 (1985); Takagi, Т., et al., CA83:164172x (1975); Bende, Z., et al., CA98:89254e (1983); Sarodnick, G., et al., CA101:38426k (1984); Fletton, R.A., et al., CA107:3947k (1987); Solomon, D.M., et al., Heterocycles 26:651 (1987); Erlenmeyer, H., et al., Helv. Chim. Acta 27:1432 (1944); CA98:95673g (1983); U.S. Patent 4 437 876; Hundle, B.S., et al., Biochemistry 26:4505 (1987); Marutani, Y., et al., CA104:193202q (1986); Golubev, A.A., et al., CA107:236584x (1987); Higuchi, M., et al., CA104:216392t (1986); Nakagawa, M., et al., Tetrahedron Letters 27:6087-6090 (1986); Pereira, M.A., et al., 3 27291 CA101:165001t (1984); Fujii, S., et al., CA102:45788d (1985); Bredereck, H., et al., Chem. Ber. 97:1414 (1964); Howe, R.K., et al., CA95: 80933f (1981); Ibarra, C.A., et al., Tetrahedron Letters 26:243 (1985); Hoppe, D., Justus Liebigs Ann. Chem: 1843 (1976); Evans, D.L., et al., JOC 44:497 (1979); Ozaki, Y., et al., Synthesis (1979) 216; Ehler, K.W., et al., CA87:136361x (1977); Scolastico, C., et al., Synthesis: 850 (1985); Corsico Coda, A., et al., Heterocycles 26:745 (1987); Fields, R. , et al., CA90:152072w (1979); Farina, F., et al., Heterocycles 24:2587 (1986); Manaev, Y.A., et al., CA98:71993k (1983); Beck, J.R., CA107:23332b (1987); Aoki, I., et al., СА107:176057r (1987); Beck, J.R., et al., J. Heterocyclic Chem. 24:267 (1987); Sato, Т., et al., CA107:39807w (1987); Ege, G., et al., Chem. Ber 120:1375 (1987); Klein, H.J., et al., СА102:203932с (1985); Perevalov, V.P., et al., CA101:171198d (1984); Hamilton, H.W., CA107:59053a (1987); Sabate-Alduy, С., et al., CA87:23137k (1977); Bastide, J. , et al., Tetrahedron 30:3355 (1974); Chrzaszcewska, A., Lodz. Tow. Navk. Wydz III, 12:119 (1967) CA71:124091r (1969); British Patent 705 950 (CA49:2233 (1955)); and Denardo, M., CA87:118063x (1977); и ссылках, приведенных здесь в качестве уровня техники. Соединения формулы I являются кислотными и они образуют основные соли. Все такие основные соли входят в область изобретения и они могут быть получены традиционными методами. Например, они могут быть получены при простом контактировании кислотных и основных веществ, обычно в стехиометрическом соотношении, или в водной, или в неводной, или в частично водной среде, соответственно. Соли извлекают или фильтрованием, или осаждением нерастворителем с последующей фильтрацией, или выпариванием растворителя, как подходит, или в случае водных растворов, лиофилизацией. Типичные соли соединений формулы I, которые могут быть получены, являются солями первичных, вторичных и третичных аминов, солями щелочных металлов и солями щелочно-земельных металлов. Особенно ценными являются соли этаноламина, диэтаноламина, триэтаноламина. Основные агенты, особенно пригодные для образования солей, принадлежат как к органическому, так и к неорганическому типу,и они включают органические амины, гидроксиды щелочных металлов, биокарбонаты щелочных металлов, гидриды щелочных металлов, алкоксиды щелочных металлов, гидроксиды щелочно-земельных металлов, карбонаты щелочно-земельных металлов, гидриды щелочноземельных металлов и алкоксиды щелочно-земельных металлов. Типичными примерами таких оснований являются первичные амины, такие как н-пропиламин, н-бутиламин, анилин, циклогексиламин, бензиламин, п- толуидин, этаноламин и глюкамин, вторичные амины, такие как диэтиламин, диэтаноламин, Nметилглюкамин, N-метиланилин, морфолин, пирролидин и пиперидин, третичные амины, такие как триэтиламин, триэтаноламин, N,N-диметиланилин, N- этилпиперидин и N-метилморфолин, гидроксиды, такие гидроксид натрия, алкоксиды, такие как этоксид натрия и метоксид калия, гидриды, такие как гидрид кальция и гидрид натрия, и карбонаты, такие как карбонат калия и карбонат натрия. Способность соединений формулы I ингибировать биосинтез интерлейкина-1 показана в процедуре, описанной ниже. СЗН/HeN мышей (Чарльз Райвер, Уилмингтон, Массачусетс) умерщвляют шейной дислокацией и их брюшную полость опрыскивают 70%-ным этанолом, чтобы предотвратить бактериальное загрязнение полученных впоследствии клеточных препаратов. В брюшину каждой мыши вводят 8 мл KPMI [KPMI - 1640 среда (Хазелтон Рисерч Продакс, Инк., Ленекса, Канзас)], содержащей 5% FCS [Фетальная сыворотка теленка, которая была скринирована на хорошую отзывчивость к ИЛ-1 в тимоцитном анализе (Хиклон Лабораториз, Логан, Ута/ и низкую спонтанную пролиферацию в отсутствии ИЛ-1 ], пенициллинстрептомицин (100 единиц/мл-100 мкг/мл) и глют-амин (2 мМ). Содержание брюшины смешивают в общую массу, чтобы помочь высвободить клетки. Затем делают надрез через кожу брюшины, чтобы раскрыть лежащий под ней мышечный слой. Удаляют перитонеальную жидкость иглой 20 калибра путем вставки иглы острием вниз через обнаженный мышечный слой точно ниже грудины. Перитонеальную жидкость от шести мышей объединяют в пластиковую коническую пробирку и приводят микроскопическое исследование на бактериальное загрязнение. Незагрязненную жидкость центрифугируют при примерно 600хg в течение 6 минут и декантируют надосадочный слой. Объединяют клеточные шарики из 5-6 пробирок и повторно суспендируют все 20 мл KPMI-FCS [PPMI - 1640 среда, содержащая 5% фетальной сыворотки теленка]. Затем выясняют число клеток, используя гемацитометр, и определяют жизнеспособность клеток окрашиванием Трипан блю, также используя гемацитометр. Клетки потом разбавляют до концентрации 3.106 клеток/мл, используя KPMI-FCS. В ячейные пластины с 35 мм-выми ячейками вносят 1 мл указанной выше суспензии клеток. Клетки инкубируют 2 часа при 37°С в атмосфере 5% С02, чтобы вызвать прикрепление макрофагов к стенкам ячеек. Удаляют надосадочный слой, создавая интенсивное кружение суспензии в ячейках и декантируя. Прикрепившиеся клетки (т.е. макрофаги) дважды промывают KPMI-CF [KPMI, содержащая пенициллин-стрептомицин (100 единиц/мл- 100 мкг/мл) и глютамин (2 мМ)]. В ячейки, содержащие прикрепившиеся клетки, прибавляют 1 мл изучаемых соединений в концентрациях от 0,1 до 100 мкг/мл. в PPMI-SF или 1 мл PPMI-SF в качестве контроля. Затем в каждую ячейку прибавляют 100 мкл LPS [Тонко очищенный липополисахарид из Salmonella Minnesota, который был проконтролирован, чтобы определить, что СЗН/HeN мыши не дают ответа на него] в KPMI-SF (1 мг/5 мл). Пластины инкубируют при 37°С в атмосфере 5%-й СО2; в течение 24 часов. Надосадочные жидкости удаляют и анализируют на ИЛ-1 и сразу же после охлаждения или замораживания для следующего анализа. Надосадочные жидкости анализировали количественно на ИЛ-1 в соответствии с аналитическими рецепторами связывания, описанными ниже. Стандартную кривую строят следующим образом. EL4-6.1 клетки тимуса мыши (10-15.106 клеток в 0,4 мл связующего буфера (KPMI-1640, 5% FCS, 25 мМ HEPES, 0,01% NaN3, pH 7,3)) прибавляют, варьируя количества немеченого мышиного rIL-Ia (рекомбинант IL-Ia, продуцированный в Escherichia coli от опубликованной последовательности аминокислот 115-270 для IL-Ia, 4 27291 Lomedico, P.M. et аl., Nature 312, 458-462 (1983)) (40 пг до 40 нг в 0,5 мл буфера) и инкубируют 1 час при 4°С при непрерывном встряхивании, после чего прибавляют 0,8 нг (0,1 мл) человеческого 125I-rlL-Ib (Нью Инглэнд Нуклеар, Бостон, Массачусеттс) и продолжают встряхивать еще 3 часа. Образцы фильтруют на устройстве Йеда (Линса Ко., Тель-Авив, Израиль) через стекловолокнистые фильтры Ватман GF/C2.4 см (блокированный с 0,5% порошковым молоком в течение 2 часов при 37°С) и один раз промывают 3 мл охлажденного льдом буфера. Фильтры подсчитывают в гамма-счетчике Сирла и неспецифическое связывание рассматривают как спм связывание в присутствии 200 нг немеченого rIL-Ia. Калибровочная кривая Хилла строится как график log /Y/ 100-Y/ по отношению к log С, где Y представляет собой процент контроля 125I-rlL-Ia связывания, а С представляет собой концентрацию немеченого rIL-Ia. Линия, спрямленная по методу наименьших квадратов, соответствует величинам Y между 20 и 80%. Затем для количественного определения уровней ИЛ-1 в надосадочных жидкостях, полученных, как описано выше, разбавленные надосадочные жидкости заменяют rIL-Ia в приведенном выше протоколе, и используют измеренный процент величин связывания для определения концентраций ИЛ-1 из стандартного графика Хилла. Каждое разбавление анализируют дважды и обычно используют только те разбавления, у которых величины Y находятся между 20 и 80%, чтобы рассчитать средние уровни ИЛ-1. Способность соединений формулы I ингибировать простагландин Н2 синтазу и 5-липоксигеназу показана в следующей процедуре анализа. Применяя описанную ниже процедуру, измеряют уровни известных продуктов простагландин Н2 синтазы и 5-липоксигеназы для клеток, обработанных изучаемым соединением для ингибирования простагландин Н2 синтазы и/или 5-липоксигеназы, которое доказывается снижением количества или отсутствием известных продуктов этих ферментов. Клетки RBL-I, поддерживаемые в монослое, выращивают в течение 1-2 дней в культуре Спиннера в Минимальной основной среде (Игла) с солями Ирла плюс 15% фетальной коровьей сыворотки, дополненной раствором антибиотик/антимикотик (Гибко) согласно методу Jakschik В.A. Nature 287:51052 (1980). Клетки дважды промывают и повторно суспендируют в холодный RPMI 1640 до плотности клеток 4·106 клеток/мл. Затем 0,25 мл аликвоту изучаемого соединения при желаемой концентрации в RPMI 1640 уравновешивают при 37°С в течение 5 минут. К уравновешенной аликвоте прибавляют аликвоту равную 0,25 мл предварительно подогретой клеточной суспензии и смесь инкубируют при 37°С в течение 5 минут. Прибавляют 10 мкл раствора, содержа-щего 14-С-арахидоновой кислоты и А-23187 (ионофора кальция, Сигма Кемикал) и смесь инкубируют при 37°С в течение еще 5 минут. Затем прибавляют 267 мкл ацетонитрила/0,3% уксусной кислоты и смесь оставляют стоять на льду в течение 30 минут. Перемешивают содержимое пробирки, осветляют центрифугированием (3000 об/мин, 10 минут), декантируют надосадочную жидкость и повторно центрифугируют 2 минуты в микропробирке с высокой скоростью. После этого анализируют аликвоту, равную 100 мкл надосадочного слоя с помощью высокоэффективной жидкостной хроматографии на колонке Перкин-Эльмер-Н5 (3 микрона), используя градиент системы ацетонитрил/Н2О с 0,1% трифторуксусной кислоты и скорость потока 2 мл/мин. Определение радиоактивности выполнено на приборе по определению радиоактивности Бертольд LB504, снабженном проточной ячейкой 800 мкл, смешивающей 2,4 мл/мин Омнифлауэр (торговое название Нью Инглэнд Нуклеар, Бостон, Массачусеттс) на выходе из колонки. Количественную оценку радиоактивности осуществляют с использованием компьютерного интегратора спектра Физикс SP4200. Полученные таким образом данные используют в программе данные-снижение, где интегрированные единицы каждого продукта рассчитываются как процент от суммы интегрированных единиц и сравниваются со средними контрольными уровнями. Соединения формулы I обладают анальгетической активностью. Эта активность показана на мышах путем блокирования брюшного вытягивания, вызванного введением 2-фенил-1,4-бензохинона (ФБХ). Использованный способ основан на методике Siegmund et al., Proc. Soc. Exp. Biol. Med., 95, 729-731 (1957), как приспособлено для большого расхода материала в единицу времени (смотри, кроме того, Milne and Twomey, Agets and Actions, 10, 31-37 (1980)). Всех мышей не кормили всю ночь перед введением лекарства и испытаниями. Соединения формулы I растворяют или суспендируют в носителе, состоящем из этанола (5%), эмульфора 620 (смесь полиэтоксилированных сложных эфиров жирных кислот) (5%) и солевого раствора (90%). Этот носитель также служит в качестве контроля. Дозы взяты по логарифмической шкале (а именно, … 0,32, 1,0, 3,2, 10, 32 ... мг/кг) . Путь введения является оральным, концентрации меняются, остается постоянным объем дозировки 10 мг/кг веса тела. Вышеупомянутый метод Милна и Твоми используют для определения эффективности и мощности. Мыши, обработанные орально испытуемым соединением, через час получают интраперитонеально 2 мг/кг ФБХ. Индивидуально мышь затем немедленно помещают в теплую прозрачную клетку и начинают через 5 минут после введения ФБХ регистрировать число брюшных сокращений в течение следующих 5 минут. Рассчитывается степень анальгетической защиты (% МРЕ) на основе подавления брюшинного сокращения по отношению к данным для конкурентных контрольных животных в опыте в тот же день. По крайней мере, четыре таких определения (N = 5) обеспечивают данные доза-ответ для получения МРЕ, лучшей оценке дозы, которая снижает брюшинные сокращения на 50% от уровня контроля. Соединения формулы I также обладают противовоспалительной активностью. Эта активность показана на крысах с помощью метода, основанного на стандартном тесте с карагенином, вызывающим одеому лапы крысы (Winter et al., Proc. Soc. Exp. Biol. Med., Ш, 544 (1963)). Подсчитывают и взвешивают неанастезированных взрослых самцов белых крыс с массой тела от 150 г до 190 г и помечают чернилами правую лодыжку. Каждую лапу погружают в ртуть точно до чернильной метки. Ртуть находится в стеклянном цилиндре, соединенном с преобразователем давления Статама. 5 27291 Выход из преобразователя поддерживается через контрольный элемент погруженной лапой. Лекарства дают с питьем. Через час после введения лекарства индуцируют одеому инъекцией 0,05 мл 1%-ного раствора карагинина в подошвенную ткань помеченной лапы. Сразу после этого измеряют объем конечности, в которую была сделана инъекция. Увеличение объема конечности через 3 часа после инъекции карагинина составляет индивидуальный противовоспалительный ответ. Анальгетическая активность соединений формулы I делает их полезными для срочного введения их млекопитающим для контроля боли при травме. Кроме того, соединения формулы I являются полезными для хронического введения млекопитающим для облегчения симптомов хронических заболеваний, таких как воспаление ревматоидного артрита, и боле ассоциированных с остеоартритами и другими мышечноскелетными расстройствами. Способность соединений формулы I ингибировать биосинтез ИЛ-1 делает их полезными в качестве ингибитора биосинтеза ИЛ-1 вообще. Она также делает их полезными при лечении ме-диированных ИЛ-1 расстройств и иммунных дисфункций у млекопитающих. Указанные медиированные ИЛ-1 расстройства включают, но не ограничиваются ими, расстройства метаболизма в костях и соединительных тканях, такие как остеопороз, периодонтитная болезнь и рубцы тканей. Медиированные ИЛ-1 иммунные дисфункции включают, но не ограничиваются ими, аллергию и псориаз. Способность соединений формулы I ингибировать простагландин Н2 синтазу делает их полезными в качестве ингибиторов простагландин Н2 синтазы вообще, поскольку функционирование этого фермента, как известно, включает патогенез артритных сочленений у млекопитающих. Таблица І Х = 5-Сl, n = 0, Q1 = , А S B=H RBL (5-LO/CO) (IC50 (мкм) ) RFE (%I при 32 мг/кг) ИЛ-1 (%I при 10 мкм) 3'-F 3'-Сl 3'-Вг 3'-СН3 3'-ОСН3 3'-SСН3 4'-Сl 9.2/0.009 7.2/0.440 11.4/1.990 14.5/5.000 >50/8.720 NR 4.5/0.006 NR NR NR NR NR NR 80 4'-Вг 4'-ОСН3 4'-SСН3 4'-SОСН3 4'-СООСН3 4'-SO2СН3 4'-CON (СН3)2 5'-Сl 1.6/0.001 37/0.02 10.7/0.005 >50/3.8 8.99/>50 >50/1.2 >50/1.7 4.9/0.004 44 10 5 15 12 0 40 (ED50=4 мг/кг) 40 40 11 18 7 14 4 35 6 79 NR NR NR NR NR NR 96 27291 5'-Вr 5'-І 5'-СН3 5'-ОСН3 5'-SСН3 5'-ОСН2СН3 5'-СООН 5'-СООСН3 5'-SO2СН3 5'-CON(СН3)2 5'-SO2NH2 5'-SO2NНСН3 5'-SO2N(СН3)2 5.2/0.006 15/0.01 18.4/0.19 7.0/0.150 3.5/0.030 1.3/1.050 >50/>50 20.8/1.5 >50/2.9 33/41 >50/>50 >50/>50 >50/10 57 51 4 8 20 6 -3 10 10 6 -14 7 -10 99 NR NR NR NR NR NR NR NR NR NR NR NR Таблица І (продолжение) S n = 0, Q΄ = , A = 4-Cl, B = H X Y RBL (5-LO/CO) (IC50 (мкм) ) RFE (%І при 32 мг/кг) ИЛ-1 (%І при 10 мкм) 43 37 (ED50=20 мг/кг) 41 36 45 99 34 H H 6-Сl Н 11/0.019 18/0.59 5-F 5-СF3 5-F 6-Сl Н H 1/0.004 12/0.003 27/0.002 93 80 93 Таблица ІІ n =0 1 Q Х RBL(5-LO/CO) (IC50 мкм)) RFE (%1 при 32 мг/кг) ИЛ-1 (%1 при 10 мкм) 5-метил-1,3,4-оксадиазолил З-этоксиизоксазол-5-ил 6-хлорникотинил 5-бром-З-фурил 5-бром-З-фурил 4-(2-метил-4-тиазолил)-2-тиофен Сl Сl Сl Н Сl Сl 50/4,3 50/20,6 >50/6,6 4,6/0,15 7,8/0,006 7,6/39,7 23 -18 52 28 34 -5 NR NR 13 NR NR 73 Таблица ІІІ 7 27291 n=0 1 Q X RBL (5-LO/CO) (IC50 (МКМ) ) RFE (%І при 32 мг/кг) ИЛ-1 (%І при 10 мкм) 5-бром-З-фурил Fl 5.50/24.7 28 NR Таблица ІV X Y RBL(5-LO/CO) (IC50 (мкм) ) RFE (%І при 32 мг/кг) ИЛ-1 (%І при 10 мкм) 5-Сl H 7/0/0.100 55 (ED50=21 мг/кг) 61 8 27291 Таблицы I-III иллюстрируют биологическую активность соединений настоящего изобретения и таблица IV - известных. Когда соединения формулы I или их фармацевтически приемлемые соли используют в качестве ингибитора ИЛ-1, ингибитора простагландин Н2 синтазы, анальгетического агента или противовоспалительного агента, они могут быть введены млекопитающему или один или, предпочтительно, в сочетании с фармацевтически приемлемыми носителями или разбавителями в фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Соединения могут быть введены орально или парентерально. Парентеральное введение включает внутривенное, внутримышечное, интраперитонеальное, подкожное или местное введение. В фармацевтической композиции, состоящей из соединения формулы I или его фармацевтически приемлемой соли, массовое отношение носителя к активному ингредиенту обычно находится в интервале от 1:4 до 4:1, а предпочтительно от 1:2 до 2:1. Однако в любом данном случае выбранное отношение будет зависеть от таких факторов, как растворимость активного ингредиента, ожидаемая дозировка и точный путь введения. При оральном использовании соединений формулы I настоящего изобретения соединения могут быть введены, например, в виде таблеток или капсул, или в виде водных растворов или суспензий. В случае таблеток для орального введения носители, которые обычно используют, включают лактозу и кукурузный крахмал и смазки, такие как стеарат магния, обычно добавляют. Для орального введения в виде капсул полезными разбавителями являются лактоза и высушенный кукурузный крахмал. Когда для орального введения требуются водные суспензии, активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При желании могут быть добавлены подслащиватели и/или отдушки. Для внутримышечного, интраперитонеального, подкожного и внутривенного использования обычно готовят стерильные растворы активного ингредиента и рН растворов должен быть соответственно установлен или забуферирован. Для внутривенного использования должна контролироваться общая концентрация солюта, чтобы препарат был изотоническим. При использовании соединения формулы I или его соли на людях ежедневная дозировка обычно будет определяться лечащим врачом. Кроме того, дозировка будет варьироваться в зависимости от возраста, веса и индивидуальной реакции пациента, а также от тяжести симптомов пациента и мощности конкретного вводимого соединения. Однако для острого введения для снятия боли доза, дающая эффективный анальгетический ответ, в большинстве случаев будет составлять от, примерно, 5 мг до 500 мг, в зависимости от необходимости (например, каждые четыре часа). При хроническом введении для облегчения (лечения) воспаления и боли, ингибирования биосинтеза ИЛ-1 и/или инги-бирования простагландин Н2 синтазы в большинстве случаев эффективная доза будет составлять, примерно, от 5 мг до 1,0 г в день, а предпочтительно от 50 мг до 500 мг в день, в виде единичной или раздельных доз. С другой стороны, может быть необходимым использование дозировок вне этих пределов в некоторых случаях. Следующие примеры иллюстрируют настоящее изобретение и не должны рассматриваться как ограничивающие его область каким-либо образом. Пример 1 4- Метилсульфинил- 2- тиофенкарбоновая кислота Охлаждают до температуры ледяной бани при перемешивании раствор 2,46 г (14,1 ммоль) 4-метилтио2-тиофенкарбоновой кислоты, полученной как описано в примере 28, в 150 мл ди-хлорметана и 10 мл метанола. К охлажденному реакционному раствору медленно прибавляют 120 мл дихлорметанового раствора 2,82 г (13,9 ммоль) м-хлорпербензойной кислоты (технической, 80-85%). После 1 ч реакция по существу заканчивается с образованием бесцветного осадка. Осадок отфильтровывают и сушат, получая 1,18 г (6,20 ммоль) целевого соединения в виде бесцветного твердого продукта, т.пл. 188-190°С. Концентрированный маточник хроматографируют на силикагеле, чтобы получить дополнительное 0,83 г (4,36 ммоль) целевой 4-метилсульфинил-2-тиофенкарбоновой кислоты, общий выход 75% (10,56 ммоль). Вычислено для С6Н6О3S2: С 37,88%, Н 3,18%. Найдено: С 37,89%, Н 3,18%. EJMS (m/z): 190 (M+, 45%) и 175 (M+-СН3) . 1 H-ЯМР (ДМСО-d6) дельта; 13,4 (1Н, обмениваемый), 8,27 (1Н, д, J=1,5 Гц), 7,96 (1Н, д J=1,5 Гц) и 2,86 (ЗН, с). 13 СЯМР (ДМСО-d6) дельта; 162,1 146,4 137,2 131,7 128,9 и 42,2. ИК-спектр (бромистый калий): 3420, 2550, 1705, 1245, 1015 см-1. Пример 2 5-(N-метиламиносульфонил)-2- тиофенкарбоновая кислота Готовят диизопропиламид лития путем медленного прибавления 17,5 г (43,8 ммоль) 2,5 М н-бутиллития в гексане к 200 мл охлажденного (2-пропанол/сухой лед) тетрагидрофуранового раствора 7 мл (50 ммоль) диизопропиламина, поддерживая температуру реакции ниже -60°С. Через 5 мин реакционный раствор нагревают до комнатной температуры в течение 30 мин, а затем снова охлаждают до температуры ниже 70°С. Медленно прибавляют 100 мл тетрагидрофуранового раствора 3,54 г (20 ммоль) 2-(Nметиламиносульфонил) тиофена при температуре реакции ниже -70°С. После этого реакционную смесь перемешивают 30 мин, а затем барботируют через раствор избыток двуокиси углерода. Затем раствор нагревают до 5°С и закаливают 50 мл 1н. гидроксида натрия. К водному тетрагидрофурановому раствору прибавляют порцию 300 мл диэтилового эфира и разделяют фазы в делительной воронке. Органический слой экстрагируют 50 мл 1 н. гидроксида натрия. Объединяют оба основных водных раствора, промывают 50 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Подкисленную водную 9 27291 смесь экстрагируют 2 х 100 мл диэтилового эфира. Эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая 3,38 г (15,3 ммоль) целевой тиофенкарбоновой кислоты в виде бесцветного твердого продукта, т.пл. 145-148°С. Общий выход составляет 76%. Вычислено для C6H7NO4S2: С 32,57%, Н 3,19%, N 6,33%. Найдено: С 32,43%, Н 3,08%, N 6,30%. EJMS (m/z): 221 (М+, основание), 191 (M+-NHMe, 98%), 157 (неизвестный, 95%), 127 (неизвестный, 45%) и 115 (неизвестный, 73%). 1 H-ЯМР (ДМСО-d6) дельта; 7,92 (1Н, обмениваемый), 7,74 (1Н, д, J=4,0 Гц), 7,58 (1Н, д, J=4,0 Гц) и 2,51 (ЗН, д, J=5,2 Гц). ИК-спектр (бромистый калий): 3420 плечо, 3000 плечо, 1680, 1170 см-1. Пример 3 5-Иод-2-тиофенкарбоновая кислота Целевое соединение было получено согласно следующей процедуре. Медленно прибавляют шприцом 25 мл (62,5 ммоль) 2,5 М гексанового раствора н-бутиллития к охлажденному (сухой лед/пропанол-2) тетрагидрофурановому раствору (100 мл) 9,0 мл (64,2 ммоль) диизопропиламина. Раствор выдерживают при температуре ниже -60°С во время прибавления н-бутиллития. По окончании прибавления удаляют охлаждающую баню и дают раствору нагреться до комнатной температуры (22°С), а затем снова охлаждают ниже -60°С. В охлажденную реакционную колбу медленно прибавляют 3,2 г (25 ммоль) 2тофенкарбоновой кислоты, растворенной в 100 мл тетрагидрофурана. Через 30 мин по окончании прибавления 2-тиофенкарбоновой кислоты в реакционную смесь конденсируют примерно 17,2 г (87,8 ммоль) йодтрифторметана. Через 5 мин убирают охлаждающую баню и реакционную смесь нагревают до 0°С и закаливают 50 мл воды. Щелочной водный раствор промывают 500 мл диэтилового эфира. Эфирный раствор экстрагируют 50 мл 1 н. гидроксида натрия и два объединенных водных раствора промывают эфиром. Далее щелочной раствор подкисляют и экстрагируют 3 раза по 100 мл диэтилового эфира. Органический раствор сушат над безводным сульфатом магния, затем фильтруют, концентрируют и получают сырой твердый продукт. Частичная очистка достигается при переосаждении твердого продукта из горячего водного этанола, получают 3,79 г слабозагрязненного, целевого продукта в виде смеси темнокрасного раствора и желтых кристаллов. Перекристаллизация твердой смеси дает 2,18 г (8,58 ммоль, выход 34%) чистого целевого соединения в виде светло-желтых игл, т.пл. 132-134°С (гексаны). Вычислено для С5Н3IO2S: С 23,64%, Н 1,19%. Найдено: С 23,86%, Н 1,10%. EIMS (m/z): 254 (М+ основание), 237 (M+-OH, 79%), 209 (M+-CO2H, 5%), 127 (M+-1,18%) и 82 (C4H2S, 36%). 1 H-ЯМР (CDCl3) дельта: 7,50 (1Н, д, J = 3,9 Гц) и 7,29 (1Н, д, J = 3, 9 Гц). ИК-спектр (СНСl3): 2977, 2565, 1679 и 1410 см-1. Пример 4 5- [(N,N- диметиламино) карбонил]- 2- тиофенкарбоксальдегид К раствору 2,75 г (17,61 ммоль) 5-формил-2-тиофенкарбоновой кислоты, полученной согласно методике Карпентера, в 75 мл тетрагидрофурана прибавляют 3,71 г (22,88 ммоль) 1,11-карбонилдиимидазола, раствор перемешивают 2,5 ч в атмосфере сухого аргона и обрабатывают избытком газообразного диметиламина. Раствор концентрируют в вакууме до масла, которое растворяют в 100 мл этилацетата и экстрагируют 2 х 50 мл 1 н. соляной кислоты, затем 2 х 50 мл 5%-ного бикарбоната натрия. Каждый водный слой снова промывают 2 х 50 мл этилацетата и сушат объединенные органические слои (сульфат магния) . Концентрирование в вакууме дает 2,42 г (75%) светло-желтого твердого продукта. EIMS (m/z): 183 (М+, 82%), 154 (М+-СНО, 7%), 139 (М+- (CH3)2N, основание) и m (M+- (СН3)2NCO, 59%). 1 H-ЯМР (CDCI3)дельта: 9,91 (1Н, с) 7,67 (1Н, д, J = 4,0 Гц), 7,35 (1Н, д, J=4,0 Гц), 3,13 (6H, шир.с). Этот материал используют непосредственно без дальнейшей очистки. Пример 5 5-[(N,N-диметиламино)карбонил]-2- тиофен-карбоновая кислота Прибавляют 2,39 г (13,04 ммоль) в виде части сырого 5-[(N,N-диметиламино)карбонил]-2тиофенкарбоксальдегида к перемешиваемой суспензии оксида серебра, приготовленного при добавлении 2,29 г (57,13 ммоль) гидроксида натрия к 5,85 г (34,44 ммоль) нитрата серебра в 100 мл воды. После 15 мин перемешивания при комнатной температуре и фильтрации через слой диатомитовой земли фильтрат подкисляют от рН 12 до 2 концентрированной соляной кислотой и экстрагируют этилацетатом. Экстракты сушат (сульфат магния) и концентрируют в вакууме, получают 2,01 г (77%). Аналитический образец получают при тщательном растирании с теплым этилацетотом, т.пл. 158-159°С. Вычислено для С8Н9NОЗS: С 48,23%, Н 4,55%, N 7,03%. Найдено: С 48,30%, Н 4,42%, N 6,79%. EIMS (m/z): 199 (M+, 68%), 155 (M+-(CH3)2N, основание), m (M+- (CH3)2NCO, 44%). 1 H-ЯМР (ДМСО-d6) дельта: 7,66 (1Н, д, J = 4,0 Гц), 7,46 (1Н, д, J = 4,0 Гц), 3,09 (6Н, с). ИК-спектр (бромистый калий): 3430, 1710, 1594, 1246 см-1. Пример 6 4- [(N,N- диметиламино)карбонил]-2- тиофенкарбоксальдегид К раствору 1,24 г (7,94 ммоль) 2-формил-4-тиофенкарбоновой кислоты в 50 мл тетрагидрофурана прибавляют 1,80 г (11,10 ммоль) 1,1-карбонилдиимидазола, раствор перемешивают 1,5 ч в сухом аргоне и обрабатывают избытком газообразного диметиламина. Раствор концентрируют в вакууме до масла, которое растворяют в 60 мл этилацетата и экстрагируют 1 х 30 мл 1 н. соляной кислоты, затем 1 х 30 мл 5%-ного бикарбоната натрия. Каждый из водных экстрактов снова промывают 2 х 50 мл этилацетата и объединенные органические слои сушат (сульфат магния). Концентрирование в вакууме дает 15 г (79%) каштанового твердого продукта. 10 27291 EIMS (m/z): 183 (М+, 31%), 155 (М+-СО, 38%), 139 (М+-(СН3)2N, основание) и 111 (M+- (СН3)2NCO, 25%). H-ЯМР (ДМСО-d6) дельта: 9,89 (1Н, д, J = 1,4 Гц), 7,89 (1Н, дд, J = 1,5, 1,4 Гц), 7,86 (1Н, д, J = 1,5 Гц), 3,08 (6Н, с). Этот материал используют непосредственно без дополнительной очистки. Пример 7 4- [(N,N- диметиламино)карбонил]-2- тиофенкарбоновая кислота Прибавляют 1,12 г (6,11 ммоль) сырого 4- [(N,N-диметиламино)карбонил]-2-тиофенкарбокс-альдегида к перемешиваемой суспензии оксида серебра, приготовленного прибавлением 1,08 г (26,90 ммоль) гидроксида натрия к 2,74 г (16,14 ммоль) нитрата серебра в 40 мл воды. После 15 мин перемешивания смесь фильтруют через диатомитовую землю, подкисляют от рН 12 до 2 концентрированной соляной кислотой и насыщают хлористым натрием (твердым). После экстракции 3 х 75 мл этилацетата сушат экстракты (сульфат магния) и концентрируют их в вакууме, получают 1,10 г (90%) светло-желтых кристаллов. Аналитический образец получают при тщательном растирании с теплым этилацетатом, т.пл. 112-114°С. Вычислено для С8Н9NОЗS: С 48,23%, Н 4,55%, N 7,03%. Найдено: С 48,07%, Н 4,58%, N 6,86%. EIMS (m/z): 199 (M+, 26%), 181 (M+-H2O, 7%), 155 (M+-(СН3)2N, основание) . 1 H-ЯMP(ДMCO-d6) дельта: 8,09 (1Н, д, J = 1,8 Гц), 7,74 (1Н, д, J = 1,8 Гц), 2,98 (6Н, д, J = 13,0 Гц). ИК-спектр (бромистый калий): 3388, 1706, 1594, 1250, 1186 см-1. Пример 8 Метил 2-формил-4-тиофенкарбоксилат Целевое соединение было получено в соответствии со следующей методикой. Прибавляют 1,32 г (9,30 ммоль) метилиодида к перемешиваемой суспензии 1,21 г (27,12 ммоль) 2-формил-4-тиофенкарбоновой кислоты и 2,87 г (27,12 ммоль) бикарбоната натрия в 40 мл N,N-диметилформамида. После перемешивания в течение ночи при комнатной температуре смесь выливают в 200 мл воды, насыщают твердым хлористым натрием и экстрагируют этилацетатом. Объединенные экстракты промывают рассолом, сушат (сульфат магния) и концентрируют в вакууме, получают 1,20 г (91%), т.пл. 110-112°С. EIMS (m/z): 170 (М+, 84%), 139 (М+-СН3О, основание), 111 (М+-СН3О2С, 29%). 1 H-ЯМР (CDСl3) дельта: 9,90 (1Н, д, J = 1,5 Гц), 8,41 (1Н, с), 8,13 (1Н, д, J = 1,5 Гц), 3,88 (ЗН, с). Пример 9 4-Метоксикарбонил-2-тиофенкарбоновая кислота Обрабатывают при перемешивании раствор 823 мг (4,84 ммоль) метил 2-формил-4тиофенкарбоксилата в 50 мл реактива Джонса. По окончании прибавления смесь перемешивают при комнатной температуре в течение 30 мин, избыток окислителя разлагают изопропанолом и смесь фильтруют через диатомитовую землю. Ацетон удаляют в вакууме, остаток растворяют в 30 мл этилацетата и раствор сушат над сульфатом магния. Концентрируют в вакууме, получают 880 мг (98%) беловатого твердого продукта. Аналитический образец получают при тщательном растирании с небольшим количеством этилацетата, т.пл. 141-143°С. Вычислено для С7Н6O4S: С 45,15%, Н 3,25%. Найдено: С 45,09%, Н 3,14%. EIMS (m/z): 186 (M+, 42%), 155 (М+-СН3О, основание). 1 H-ЯМР (ДМСО-d6) дельта: 8,59 (1Н, д, J = 1,2 Гц), 7,91 (1Н, д, J = 1,2 Гц), 3,81 (ЗН, с). ИК-спектр (бромистый калий): 3419, 1706, 1681 см-1. Пример 10 Метил 5-формил-2-тиофенкарбоксилат Целевое соединение было получено согласно следующей методике. Прибавляют 4,36 г (30,74 ммоль) метилиодида к суспензии 4 г (25,61 ммоль) 5-формил-2-тиофенкарбоновой кислоты и 9,50 г (89,65 ммоль) бикарбоната натрия в 75 мл N,N-диметилформамида при перемешивании. При перемешивании в течение ночи при комнатной температуре смесь выливают в 350 мл воды, насыщают твердым хлористым натрием и экстрагируют этилацетатом. Объединенные экстракты промывают рассолом, сушат (сульфат магния) и концентрируют в вакууме, получают 3,83 г (88%) серого твердого продукта, т.пл. 85-872°С. EIMS (m/z): 170 (М+, 95%), 139 (М+-СНзО, основание), m (М+-СН3О2С, 64%) . 1 H-ЯМР (ДМСО-d6) дельта: 9,94 (1Н, с), 7,81 (1Н, д, J = 3,9 Гц), 7,71 (1Н, д, J = 3,9 Гц), 3,91 (ЗН, с). Пример 11 5-Метоксикарбонил-2-тиофенкарбоновая кислота Целевое соединение было получено по следующей методике. Обрабатывают при перемешивании раствор 2 г (11,75 ммоль) метил 5-формил-2-тиофенкарбоксилата в 100 мл ацетона, прибавляя по каплям 9 мл реактива Джонса. После этого смесь перемешивают при комнатной температуре в течение часа, избыток окислителя разлагают изопропанолом и смесь фильтруют через диатомитовую землю. Ацетон удаляют в вакууме, остаток растворяют в 75 мл этилацетата и раствор сушат над сульфатом магния. После фильтрации и концентрирования получают 1,60 г (73%) желтого твердого продукта. Аналитический образец получают при тщательном растирании с теплым этилацетатом, т.пл. 186-189°С. Вычислено для С7Н6O4S: С 45,15%, Н 3,25%. Найдено: С 45,12%, Н 3,09%. EIMS (m/z): 186 (M+, 70%), 169 (M+-ОН, 7,0%), 155 (М+-СН3О, основание). 1 H-ЯМР (ДМСО-d6) дельта: 7,78 (1Н, д, J = 4,0 Гц), 7,72 (1Н, д, J = 4,0 Гц), 3,85 (ЗН, с). ИК-спектр (бромистый калий): 3416, 1712, 1666, 1258 см-1. Пример 12 5-Метоксикарбонил-2-тиофенкарбоновая кислота, гидразид 1 11 27291 Кипятят 2 ч с обратным холодильником при перемешивании суспензию 1,86 г (10 ммоль) 5метоксикарбонил-2-тиофенкарбоновой кислоты в 20 мл тионилхлорида. Охлаждают раствор до комнатной температуры и концентрируют в вакууме до почти бесцветного масла, которое кристаллизуется в вакууме. Затем растворяют этот твердый продукт в 25 мл хлороформа и прибавляют по каплям к охлажденному (5°С) раствору 800 мг (25 ммоль) безводного гидразина в 25 мл хлороформа в атмосфере аргона. По окончании прибавления смесь перемешиваю 1 ч при комнатной температуре, затем выпаривают досуха в вакууме. Оставшийся твердый продукт суспендируют в 25 мл воды, перемешивают 15 мин и фильтруют, получают 1,79 г (90%) беловатого твердого продукта. Аналитический образец готовят перекристаллизацией из этанола, т.пл. 198-200°С. Вычислено для С7Н8N2О3S: С 41,99%, Н 4,03%, N 13,99%. Найдено: С 41,88%, Н 3,91%, N 13,86%. EIMS (m/z): 200 (M+, 26%), 169 (М+-СН3О или N2Н3, основание ). 1 H-ЯМР (ДМСО-d6) дельта: 10,05 (1Н, шир.с), 7,77 (1Н, д, J = 3,9 Гц), 7,71 (1Н, д, J = 3,9 Гц), 4,56 (2Н, шир.с), 3,82 (ЗН, с). ИК-спектр (бромистый калий): 3319, 3285, 1723, 1618, 1264, 746 см-1. Пример 13 Метил 5-(5-метил-1,З,4-оксадиазол-2-ил)-2-тиофенкарбоксилат Кипятят с обратным холодильником в течение 4 ч 548 мг (2,74 ммоль) гидразида 5-метоксикарбонил-2тиофенкарбоновой кислоты и 372 мг (3,01 ммоль) солянокислого этилацетимидата в 10 мл пиридина, охлаждают до комнатной температуры и выпаривают в вакууме. Растворяют остаточный маслянистый продукт в этилацетате и промывают водой, 1 н. соляной кислотой и 5%-ным бикарбонатом натрия. Этилацетатный раствор сушат (сульфат магния) и выпаривают в вакууме, получают 242 мг (39%) светлокаштанового твердого продукта, т.пл. 142-5°С. Этот материал используют непосредственно без дополнительной очистки. Точная масса: 224,0253. Вычислено 224,0256. EIMS (m/z): 224 (M+, основание), 193 (М+-СН3О 33%), 169 (С7Н5OЗS, 83%). 1 H-ЯМР (ДМСО-d6) дельта: 7,88 (1Н, д, J = 3,9 Гц), 7,80 (1Н, д, J = 3,9 Гц), 3,87 (ЗН, с), 2,58 (ЗН, с). ИК-спектр (бромистый калий): 1705, 1571, 1291, 1101, 751 см-1. Пример 14 5- (5-метил-1,3,4-оксадиазол-2-ил)-2- тиофенкарбоновая кислота Смесь 100 мг (0,45 ммоль) метил 5-(5-метил-1,3,4-оксадиазол-2-ил)-2-тиофенкарбокси-лата в 3 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и перемешивают 2 ч при комнатной температуре. Раствор фильтруют для удаления следов нерастворимых продуктов и подкисляют до рН 3 концентрированной соляной кислотой. Осадок собирают и сушат на воздухе, получают 67 мг (71%) светло-желтого твердого продукта, т.пл. 281-4°С. Вычислено для С8Н6N2O3S: С 45,70%, Н 2,88%, N 13,33%. Найдено: С 45,81%, Н 2,81%, N 13,26%. EIMS (m/z): 210 (М+, основание), 193 (М+-ОН 3%), 168 (неизвестен, 8%), 155 (С6Н3ОЗS, 56%). 1 H-ЯМР (ДМСО-d6) дельта: 7,79 (1Н, д, J = 3,9 Гц), 7,77 (1Н, д, J = 3, 9 Гц), 3,57 (ЗН, с). ИК-спектр (бромистый калий): 3443, 1693, 1599, 1574, 1264, 744 см-1. Пример 15 Метил 4-ацетил-2-тиофенкарбоксилат Прибавляют 783 мг (5,51 ммоль) метилиодида при перемешивании к суспензии 782 мг (4,59 ммоль) 4ацетил-2-тиофенкарбоновой кислоты и 1,70 г (16,08 ммоль) карбоната натрия в 25 мл N,Мдиметилформамида. После перемешивания в течение ночи при комнатной температуре смесь выливают в 125 мл воды, насыщают твердым хлористым натрием и экстрагируют 3 х 50 мл этилацетата. Объединенные экстракты промывают рассолом, сушат над сульфатом магния и концентрируют в вакууме, получают 761 мг (90%) беловатого твердого продукта, т.пл. 94-6°С. EIMS (m/z): 184 (М+, 74%), 169 (М+-СН3, основание), 153 (М+-СН3О, 51%). 1 H-ЯМР (ДМСО-d6) дельта: 8,17 (1Н, д, J = 1,5 Гц), 8,13 (1Н, д, J = 1,5 Гц), 3,88 (ЗН, с). Пример 16 Метил 4-бромацетил-2-тиофенкарбоксилат Работают по методике, описанной в Japan Kokal Tokkyo Koho, прибавляют по каплям раствор 4,29 г (26,87 ммоль) в 40 мл хлороформа при перемешивании к раствору 4,95 г (26,87 ммоль) метил 4-ацетил-2тиофенкарбоксилата, полученного в примере 15, в 150 мл хлороформа, содержащего 4 капли 50%-й (объем/объем) 48%-й бромистоводородной кислоты (ледяной уксусной кислоты). После 10 мин при 40°С раствор охлаждают до комнатной температуры, концентрируют в вакууме и остаток тщательно растирают с 25 мл метанола. После фильтрации получают 4,96 г (63%) беловатого твердого продукта, т.пл. 112-4°С. EIMS (m/z): 264/262 (М+, 11%), 233/231 (M+-СН3, 11%), 171/169 (M+-CH2Br, основание). 1 H-ЯMP (CDCI3) дельта: 8,31 (1Н, д, J = 1,5 Гц), 8,17 (1Н, д, J = 1,5 Гц), 4,29 (2Н, с), 3,90 (ЗН, с). Пример 17 Монобромид метил 4-(2-метилтиазол-4-ил)-2-тиофенкарбоксилата Кипятят с обратным холодильником 2 ч раствор 398 г (1,51 ммоль) метил 4-бромацетил-2тиофенкарбоксилата, полученного по примеру 16, и 125 мг (1,66 ммоль) тиоацетамида в 15 мл ацетона. Смесь охлаждают до комнатной температуры, фильтруют и остаток сушат в вакууме, получают 375 мг (77%) белого продукта, т.пл. 224-5°С. Вычислено для C10H9NO2S2HBr: С 37,50%, Н 3,15%, N 4,36%. Найдено: С 37,53%, Н 3,09%, N 4,28%. EIMS (m/z): 239 (M+, основание), 208 (М+-СН3О, 65%), 198 (M+-C2Н3N, 76%). 12 27291 1 H-ЯМР (ДМСО-d6) дельта: 8,25 (1Н, д, J = 1,5 Гц), 8,22 (1Н, д, J = 1,5 Гц), 7,98 (1Н, с), 5,98 (обменивающийся), 3, 82 (ЗН, с) , 2, 68 (ЗН, с) . ИК-спектр (бромистый калий): 3091, 1703, 1285 см-1. Пример 18 4-(2-Метилтиазол-4-ил)-2-тиофенкарбоновая кислота Смесь 3,20 г (10,0 ммоль) метил-4-(2- метилтиазол-4-ил)-2-тиофенкарбоксилата моногидробромида, полученного по методике примера 15, в 50 мл 2 н. гидроксида натрия разбавляют 15 мл метанола и кипятят с обратным холодильником 1 ч. Метанол удаляют в вакууме и оставшийся водный раствор подкисляют до рН 3 концентрированной соляной кислотой. Смесь экстрагируют 3 х 50 мл этилацетата и сушат над сульфатом магния, экстракты концентрируют, получают 2,12 г (94%) белого твердого продукта. Аналитический образец получают при тщательном растирании с теплым этилацетатом, т.пл. 195-7°С. Вычислено для С9Н7NO2S2: С 47,98%, Н 3,13%, N 6,22%. Найдено: С 47,84%, Н 3,01%, N 6,14%. EIMS (m/z): 225 (M+, основание), 208 (M+-OH, 1%), 184 (M+-С2Н3N, 90%). ИК-спектр (бромистый калий): 3103, 1676, 1284 см-1. Пример 19 Оксим метил 5-формил-2-тиофенкарбокси-лата Раствор 6,26 г (36,78 ммоль) метил 5-формил-2-тиофенкарбоксилата, полученного по методике примера 10, 3,07 г (44,14 ммоль) солянокислого гидроксиламина и 3,49 г (44,14 ммоль) пиридина в 200 мл этанола кипятят с обратным холодильником в течение 2 ч. Удаляют этанол в вакууме, остаток растворяют в эфире и промывают водой. Органический слой сушат над сульфатом магния и выпаривают, получают желтый твердый продукт. Тщательное растирание с небольшим количеством эфира дает целевое соединение в виде белого твердого продукта (4,93 г, 72%), т.пл. 164-7°С. Оксим Z:E соотношение равно 82:18. Вычислено для С7H7NO3S: С 45,39%, Н 3,81%, N 7,56%. Найдено: С 45,41%, Н 3,69%, N 7,48%. EIMS (m/z): 185 (M+, 97%), 154 (M+-СН3О, основание). 1 H-ЯМР (ДМСО-d6) дельта: Z изомер-12,52 (1Н, шир.с), 7,99 (1Н, с), 7,77 (1Н, д, J = 4,0 Гц), 7,50 (2Н, д, J = 4,0 Гц), 3,83 (ЗН, с), Е изомер-11,66 (1Н, шир.с), 8,38 (1Н, с), 7,74 (1Н, д, J = 4,0 Гц), 7,34 (1Н, д, J = 4,0 Гц), 3,82 (ЗН, с). ИК-спектр (бромистый калий): 3400, 1646, 918 см-1. Пример 20 Метил 5-циано-2-тиофенкарбоксилат Целевое соединение было получено по следующей методике. Кипятят с обратным холодильником в течение ночи при перемешивании 4,87 г (26,29 ммоль) оксима метил 5-формил-2-тиофенкарбоксилата, полученного по методике примера 19, в 60 мл уксусного ангидрида. Раствор охлаждают до комнатной температуры, выливают в 400 мл воды и энергично встряхивают. Смесь экстрагируют 3 х 100 мл эфира и экстракты промывают 3 х 50 мл 10%-ного гидроксида калия. Объединенные органические слои сушат над сульфатом магния и концентрируют, получая 3,50 г, (80%) беловатого твердого продукта, т.пл. 76-8°С. EIMS (m/z): 167 (М+, 34%) и 136 (M+-СН3О, основание). 1 H-ЯМР (ДМСО-d6) дельта: 8,03 (1Н, д, J = 4,2 Гц), 7,88 (1Н, д, J = 4,2 Гц), 7,88 (1Н, д, J = 4,2 Гц), 3,87 (ЗН, с). ИК-спектр (бромистый калий): 2228, 1726 см-1. Пример 21 Метил 5-(N-окси) карбоксимидамидо-2-тио-фенкарбоксилат Кипятят с обратным холодильником в течение 45 мин смесь 901 мг (5,39 ммоль) метил 5-циано-2тиофенкарбоксилата, полученного по методике примера 20, 412 мг (5,93 ммоль) соля-нокислого гидроксиламина и 553 мг (6,74 ммоль) ацетата натрия в 25 мл (5:1) этанол-вода. Этанол удаляют в вакууме и отфильтровывают кристаллический осадок. Дополнительный продукт выделяют из охлажденного фильтрата, суммарный выход 932 мг (86%) светло-желтых кристаллов, т.пл. 144-6°С. Вычислено для С7Н8NOЗS: С 41,99%, Н 4,03%, N 13,99%. Найдено: С 42,24%, Н 3,91%, N 13,59%. EIMS (m/z): 200 (M+, основание), 185 (М+-СН, 83%), 169 (М+-СН3О, 60%). 1 H-ЯМР (ДМСО-d6) дельта: 9,97 ( 1Н, с), 7,72 (1Н, д, J = 4,0 Гц), 7,51 (1Н, д, J = 4,0 Гц), 6,11 (2Н, шир.с), 3,80 (ЗН, с). ИК-спектр (бромистый калий): 3491, 1725 и 1636 см-1. Пример 22 Метил 5-(5- метил-1,2,4- оксадиазол-З-ил)-2- тиофенкарбоксилат Кипятят с обратным холодильником в течение 24 час при перемешивании 734 мг (3,67 ммоль) метил 5-(Nокси)карбоксимидамидо-2-тиофенкарбоксилата, полученного по методике примера 21, и 1,12 г (11,0 ммоль) уксусного ангидрида в 25 мл толуола. Растворитель удаляют в вакууме и остаток тщательно растирают с малым количеством толуола, получают 547 мг (67%) беловатого твердого продукта, т.пл. 134-6°С. EIMS (m/z): 224 (М+ , 99%), 193 (М+ -СН3О, основание), 183 (M+ -C2Н3N, 58%), 152 (C6H2NO 2S, 89%). 1 с). H-ЯМР (ДМСО-d6) дельта: 7,77 (1Н, д, J = 4,0 Гц), 7,69 (1Н, д, J = 4,0 Гц), 3,89 (ЗН ,с), 2,64 (ЗН, ИК-спектр (бромистый калий): 1720, 1597 и 887 см-1. Этот материал используют непосредственно без дополнительной очистки. Пример 23 5-(5-Метил-1,2,4-оксадиазол-З-ил)-2-тиофенкарбоновая кислота 13 27291 Смесь 86 мг (0,38 ммоль) метил 5-(5-метил-1,2,4-оксадиазол-3-ил)-2-тиофенкарбокси-лата, полученного по методике примера 22, в 3 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и нагревают до 60°С в течение 10 мин. Раствор охлаждают до комнатной температуры, разбавляют 2 мл воды и подкисляют до рН 2 концентрированной соляной кислотой. После 30 мин стояния выделяются кристаллический хлопьевидный продукт, который медленно отделяется, его фильтруют и сушат в вакууме, получают 45 мг (56%) целевого продукта, т.пл. 218-20°С. Вычислено для C8H6N2O3S: С 45,70%, Н 2,88%, N 13,33%. Найдено: С 45,69%, Н 2,81%, N 13,06%. EIMS (m/z): 210 (M+, 89%), 169 (M+-C2H3N, основание), 152 (C6H2NO2S, 27%). 1 H-ЯМР (ДМСО-d6) дельта: 7,77 (2Н, с), 2,65 (ЗН, с). ИК-спектр (бромистый калий): 3429, 1668 и 889 см-1. Пример 24 Метил 5-(5-трифторметил-1,2,4-оксадиазол- З-ил)- 2-тиофенкарбоксилат Кипятят с обратным холодильником в течение 1 час при перемешивании 833 мг (4,16 ммоль) метил 5(N-окси)карбоксимидамидо-2-тиофенкарбоксилата, полученного по методике примера 21, и 2,62 г (12,48 ммоль) ангидрида трифторуксусной кислоты в 25 мл толуола. Растворитель выпаривают в вакууме, остаток тщательно растирают с небольшим количеством толуола и фильтруют, получают 400 мг (35%) белых кристаллов, т.пл. 126-7°С. Продукт используют непосредственно без дополнительной очистки. Точная масса: 277,9998. Вычислено: 277,9974. EIMS (m/z): 278 (М+, 67%), 247 (М+-СН3О, основание), 152 (С6Н2NO2S, 41%). 1 H-ЯМР(СDСl3)дельта: 7,81 (2Н, с), 3,91 (ЗН, с). ИК-спектр (бромистый калий): 1712, 1255, 912 см-1. Пример 25 5-(5-Трифторметил-1,2,4-оксадиазол-З-ил)-2-тиофенкарбоновая кислота Смесь 100 мг (0,36 ммоль) метил 5-(5-три-фторметил-1,2,4-оксадиазол-З-ил)-2-тиофенкар-боксилата, полученного по примеру 24, в 3 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и нагревают до 50°С в течение 10 мин. Раствор охлаждают до комнатной температуры, разбавляют 3 мл воды и подкисляют до рН 2 концентрированной соляной кислотой. После отстоя в течение 1 ч отфильтровывают беловатые кристаллы и сушат в вакууме, получают 41 мг (43%) белых кристаллов, т.пл. 175-7°С. Вычислено для C8H3F3N2O3S: С 36,37%, Н 1,14%, N 10,61%. Найдено: С 36,65%, Н 1,18%, N 10,24%. EIMS (m/z): 264 (M+, основание), 247 (M+-ОН, 43%), 169 (M+-C2F3N, 24%). 1 H-ЯМР (ДМСО-d6) дельта: 7,94 (1Н, д, J = 4,0 Гц), 7,83 (1Н, д, J = 4,0 Гц). ИК-спектр (бромистый калий): 3430 плечо, 1661, 1208, 847 см-1. Пример 26 Гидробромид метил 4-(тиазол-4-ил)-2- тиофенкарбоксилат Кипятят с обратным холодильником раствор 1,25 г (4,75 ммоль) метил 4-(бромацетил)-2тиофенкарбоксилата, полученного по примеру 16, и 436 мг (7,13 ммоль) тиоформамида в 35 мл ацетона в течение 1 ч. Смесь слегка охлаждают и фильтруют, получают 941 мг (65%) желтого твердого продукта. Аналитический образец перекристаллизовывают из этанола, т.пл. 201-2°С. Вычислено для C9H7NO2S2·HBr: С 35,30%, Н 2,63%, N 4,58%. Найдено: С 35,31%, Н 2,60%, N 4,48%. EIMS (m/z): 225 (М+, основание), 194 (М+-СН3О, 92%), 167 (C8H7O2S, 25%). 1 H-ЯМР (ДМСО- d6) дельта: 9,18 (1Н, д, J = 1,7 Гц), 8,31 (1Н, д, J = 1,2 Гц), 8,30 (1Н, д, J = 1,2 Гц), 8,21 (1Н, д, J = 1,7 Гц), 4,50 (1Н, обмениваемый), 3,85 (ЗН, с). ИК-спектр (бромистый калий): 3054, 1711, 1272, 778 см-1. Пример 27 4-(тиазол-4-ил)-2-тиофенкарбоновая кислота Смесь 500 мг (1,63 ммоль) гидробромида метил (тиазол-4-ил)-2-тиофенкарбоксилата, полученного по методике примера 26, в 8 мл 2 н. гидроксида натрия разбавляют 1 мл метанола и кипятят с обратным холодильником 30 мин. Метанол удаляют в вакууме и остаточный водный раствор подкисляют до рН 2 концентрированной соляной кислотой. Смесь экстрагируют этилаце-татом и высушенные сульфатом магния экстракты концентрируют, получают 318 мг (92%) светло-желтого твердого продукта, т.пл. 183-5°С. Вычислено для C8H5NO2S2: С 45,48%, Н 2,39%, N 6,63%. Найдено: С 45,42%, Н 2,29%, N 6,46%. EIMS (m/z): 211 (М+, основание), 194 (M+-OH, 23%), 184 (C7H4O2S2, 80%). 1 H-ЯМР (ДМСО- d6) дельта: 9,16 (1Н, д, J = 1,2 Гц), 8,23 (2Н, шир.с), 8,16 (1Н, д, J = 1,2 Гц). ИК-спектр (бромистый калий): 3440 плечо, 3110, 1691, 1285 см-1. Пример 28 4-Метилтио-2-тиофенкарбоновая кислота Готовят диизопропиламид лития, медленно прибавляя 31 мл (77,5 ммоль) 2,5 М н-бутиллития в гексане к 200 мл тетрагид-рофуранового раствора 11 мл (78,5 ммоль) диизопропиламина, охлажденного на бане 2пропанол/сухой лед, температуру реакции поддерживают ниже -60°С. Через 15 мин реакционный раствор нагревают до комнатной температуры в течение 30 мин, затем снова охлаждают до температуры ниже 70°С. Медленно прибавляют 100 мл тетрагидрофуранового раствора 9,9 г (76 ммоль) 3-метилтиотиофена, контролируя температуру реакции ниже -70°С. По окончании прибавления реакционную смесь перемешивают в течение 15 мин, затем через раствор барботи-руют избыток двуокиси углерода. Затем раствор нагревают до 10°С и закаливают 100 мл воды. После нескольких минут перемешивания реакционную смесь выливают в делительную воронку и экстрагируют порцией 500 мл диэтилового эфира. Органический слой экстрагируют 100 мл 1 н. гидроксида натрия, затем объединяют оба основных раствора, промывают 100 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Под 14 27291 кисленную водную смесь затем экстрагируют 2 х 250 мл диэтилового эфира. Эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая 11,75 г (67,4 ммоль) желтого твердого продукта, который по данным ЯМР представляет собой смесь (3:2) изомеров (4- и 3-) целевой тиофенкарбоновой кислоты. Этот сырой продукт перемешивают 30 мин с порцией диэтилового эфира, затем фильтруют и концентрируют фильтрат в вакууме, получают 8,68 г (49,8 ммоль) твердого продукта, который содержит более 80% (оценено ЯМР) целевой 4-метилтио-2-тиофенкарбоновой кислоты. Перекристаллизация из хлороформа дает 4,11 г (23,6 ммоль) светло-желтого твердого продукта, т.пл. 118120° (лит. т.пл. 123-124°С), который содержит 95% 4-метилтио-2-тиофенкарбоновой кислоты (чистота оценена с помощью ЯМР). Общий выход составляет 31%. Пример 29 5-(N,N-диметиламиносульфонил)-2-тиофенкарбоновая кислота Готовят диизопропиламид лития, медленно прибавляя 10,5 мл (26,3 ммоль) 2,5 М н-бутиллития в гексане к 200 мл тетра-гидрофуранового раствора, 5,0 мл (35,7 ммоль) диизопропиламина, охлажденного на бане 2-пропанол/сухой лед, температуру реакции поддерживают ниже -60°С. Через 5 мин реакционную смесь нагревают до комнатной температуры в течение 30 мин, затем охлаждают снова до температуры ниже -70°С. Медленно прибавляют 100 мл тетрагидрофуранового раствора 3,4 г (17,8 ммоль) 2-(N,Nдиметиламиносульфонил) тиофена, поддерживая температуру реакции ниже -70°С. По окончании прибавления реакционную смесь перемешивают в течение 30 мин, а затем барботируют через раствор избыток двуокиси углерода. Далее раствор нагревают до 0°С и закаливают 50 мл 1 н. гидроксида натрия. Добавляют порцию 300 мл диэтилового эфира к водно- тетрагидрофурановому раствору и разделяют фазы в делительной воронке. Органический слой экстрагируют 50 мл 1 н. гидроксида натрия. Объединяют оба основных раствора, промывают 50 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Кислотную водную смесь экстрагируют 2 х 100 мл диэтилового эфира. Эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получают 3,66 г (15,6 ммоль) целевого продукта - тиофенкарбоновой кислоты в виде бесцветного твердого продукта, т.пл. 184186°С (лит. т.пл. 170-172°С) . Общий выход составляет 87%. Пример 30 5-Аминосульфонил-2-тиофенкарбоновая кислота Готовят диизопропиламид лития, медленно прибавляя 26,5 мл (66,3 ммоль) 2,5 М н-бутиллития в гексане к охлажденному на бане 2-пропанол/сухой лед тетрагидрофурановому (200 мл) раствору 11 мл (78,5 ммоль) диизопропиламина, поддерживая температуру реакции ниже -60°С. Через 5 мин реакционный раствор нагревают до комнатной температуры в течение 30 мин, затем снова охлаждают до температуры ниже -70°С. Медленно прибавляют 100 мл тетрагидрофуранового раствора 3,26 г (20 ммоль) 2-аминосульфонилтиофена, контролируя температуру реакционной смеси ниже -70°С. По окончании прибавления реакционную смесь перемешивают в течение 30 мин, а затем барботируют через раствор избыток диоксида углерода. Далее раствор нагревают до 2°С и закаливают 50 мл 1 н. гидроксида натрия. Добавляют порцию 300 мл диэтилового эфира к воднотетрагидрофурановому раствору и разделяют фазы в делительной воронке. Органический слой экстрагируют 50 мл 1 н. гидроксида натрия. Объединяют оба основных раствора, промывают 50 мл диэтилового эфира и подкисляют концентрированной соляной кислотой. Подкисленную водную смесь экстрагируют 2 х 100 мл диэтилового эфира. Эфирный раствор промывают рассолом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получают 2,56 г (12,4 ммоль) целевой тиофенкарбоновой кислоты в виде бесцветного твердого продукта. Перекристаллизация из воды дает 1,79 г (8,6 ммоль) каштанового твердого продукта, т.пл. 228-231°С (лит. т.пл. 231-232°С) . Общий выход составляет 43%. Пример 31 5- Хлор- З- (4- ацетил- 2- теноил)- 2- оксиндол-1-карбоксамид 0,78 г (4,59 ммоль) образца 4-ацетил-2-тио-фенкарбоновой кислоты соединяют с 0,95 г (5,85 ммоль) 1,11-карбонил-диимидазола в 10 мл N,N-диметилформамида и перемешивают при комнатной температуре в атмосфере азота. Спустя 2 ч содержимое реактора переносят в дополнительную воронку и медленно добавляют к взвеси 0,88 г (4,18 ммоль) 5-хлор-2-оксиндол-1-карбо-ксамида и 1,38 г (11,28 ммоль) 4-(N,Nдиметил-амино)пиридина в 30 мл N,N-диметилформа-мида, перемешиваемого при 5°С (ледяная баня) в инертной атмосфере. Содержимое реактора перемешивают 15 мин при 5°С после завершения добавления, а затем 24 ч при комнатной температуре. Реакционную смесь выливают в 110 мл 0,3 н. соляной кислоты, что вызывает выпадение в осадок зеленовато-желтого твердого продукта. После фильтрования с последующей промывкой 3 н. соляной кислотой и водой получают неочищенный продукт, который дважды пе-рекристаллизовывают из уксусной кислоты до получения 0,34 г (0,94 ммоль, выход 22%) чистого 5-хлорЗ-(4-ацетил-2-теноил)-2-оксиндол-1-карбоксамида в виде зеленовато-желтого сольватированного комплекса с 0,2 эквивалентами уксусной кислоты, т.пл. 230-233°С. Рассчитано для C16H11ClN2О4S x C2H4O: С 52,55%, Н 3,17%, N 7,47%. Найдено: С 52,24%, Н 2,88%, N 7,01%. EIMS(m/z): 362/364 (М+, 9%), 319/321 (M+-CONH, 43%), 193/195 (M+-CONH-С6Н6ОS, основной) и 153 (C7H5O2S, 79%). 1 H-ЯMP (ДMCO- d6)d: 8,64 (1Н, шир.с), 8,47 (1Н, д, J = 1,3 Гц), 8,07 (1Н, д, J = 8,5 Гц), 8,00 (1Н, шир.с), 7,07 (1Н, шир.д, J = 8, 5 Гц), 5,94 (1Н, шир. с в обмене) и 2,52 (ЗН, с). ИК (КВr): 3387, 3230 шир, 1743, 1692, 1623, 1592, 1577, 1384, 1272 и 1192 см-1. Пример 32 5-Хлор-З-(4-метилсульфинил-2-теноил)-2- оксиндол- 1-карбоксамид Указанное соединение получают по способу примера 31. Ацильное активирование 1,64 г (8,6 ммоль) 4метилсульфинил-2-тиофенкарбо-новой кислоты, полученной по способу примера 1,и 1,65 г (10 ммоль) 1,11-карбонилдиимидазола приводит к получению реакционноспособного промежуточного соединения, которое используют непосредственно и соединяют с 1,65 г (7,8 ммоль) 5-хлор-2-оксиндол-1-карбоксамида 15 27291 в присутствии 2,87 г (23,5 ммоль) 4-(N,N-диметил-амино) пиридина до получения неочищенного желтого продукта. После тщательного растирания желтого твердого продукта с 2-бутаноном получают 1,67 г (4,36 ммоль, выход 56%) чистого 5- хлор-3-(4-метилсульфинил-2-теноил)-2- оксиндол-1-карбоксамида в виде желтого твердого вещества, т.пл. 204-206°С. Рассчитано для C15H11ClN2O4S2: С 47,06%, Н 2,90%, N 7,32%. Найдено: С 47,11%, Н 2,91%, N 7,27%. EIMS (m/z): 382/384 (M+, 7%), 339/341 (M+-CONH, 16%), 193/195 (М+-СОNН-C5Н6OS2, основной) и 173 (C6H5O2S2, 31%). 1 H-ЯМР (ДМСО- d6)d: 8,36 (1Н, шир. с), 8,27 (1Н, шир. с), 8,11 (1Н, д, J = 8,5 Гц), 7,99 (1Н, шир.с), 7,13 (1Н, шир.д, J = 8,5 Гц) и 2,88 (ЗН, с). ИК (КВr): 3385, 3220 шир, 1721, 1612, 1573, 1376 и 1193 см-1. Пример 33 5-Хлор-З-(5-сульфонамидо-2-теноил)-2-оксиндол-1-карбоксамид 1,48 г (7,2 ммоль) образца 5- сульфонамидо-2-тиофенкарбоновой кислоты, полученной по способу примера 30, превращают в ацилимидазол в реакции с 1,39 г (8,6 ммоль) 1,11-карбонилдиимидазола. Промежуточный ацилимидазол соединяют непосредственно с 1,26 г (6,0 ммоль) 5-хлор-2-оксиндол-1карбоксамида в присутствии 2,2 г (18 ммоль) 4-(N,N- диметиламино)пиридина до получения 2,34 г неочищенного твердого продукта. После перекристаллизации получают 1,22 г (3,05 ммоль, выход 51%) чистого 5-хлор-З-(5-сульфонамидо-2-теноил)-2- оксиндол -1-карбоксамида в виде желто-зеленого твердого продукта, т.пл. 227-229°С (уксусная кислота). Рассчитано для C14H10ClN3O5S2: С 42,06%, Н 2,52%, N 10,51%. Найдено: С 41,78%, Н 2,48%, N 10,15%. EIMS (m/z): 399/401 (M+, 2%), 356/358 (M+-CHNO, 23%), 193/195 (M+-CHNO-C4H5NO2S2, основной) и 190 (С5Н4NО3S2, 53%). 1 H-ЯМР (ДМСО- d6)d: 8,23 (1Н, д, J = 4 Гц) , 8,05 (1Н, шир.д, J = 1,5 Гц), 8,02 (1Н, д, J = 8,5 Гц), 7,71 (шир.с в обмене), 7,49 (1Н, д, J = Гц), 6,95 (1Н, дв.д, J = 8,5, 1,5 Гц) и 5,56 (шир.с, в обмене). ИК (КВr): 3393, 3250, 3109 шир, 1722, 1600, 1569, 1345, 1203 и 1150 см-1. Пример 34 5-Хлор-З-[5-(N-метилсульфонамидо)-2-теноил]-2- оксиндол-1-карбоксамид Указанное соединение было получено по способу примера 31. Ацильное активирование 2,21 г (10,0 ммоль) 4-(N-метилсульфониламидо)-2- тиофенкарбоновой кислоты, полученной как указано в примере 2, 1,95 г (12 ммоль) 1,11- карбонилдиимидазола приводит к получению соответствующего ацилимидазольного промежуточного в 20 мл N,N- диметилформамида. Этот раствор переносят и медленно добавляют к 1,75 г (8,33 ммоль) 5-хлор-2оксиндол-1-карбоксамида в 40 мл N,N- диметилформамида с 3,05 г (25 ммоль) 4- (N,N- диметиламино) пиридина. После кислотной обработки реакция завершается получением 2,96 г желтовато-оранжевого твердого продукта. После перекристаллизации из уксусной кислоты получают 1,90 г (4,59 ммоль, выход 55%) чистого указанного соединения в виде желтого твердого вещества, т.пл. 225-227°С. Рассчитано для C15H12ClN3O5S2: С 43,53%, Н 2,92%, N 10,15%. Найдено: С 43,49%, Н 2,86%, N 10,15%. EIMS (m/z): 413/415 (M+, 2%), 370/372 (M+-CHNO, 20%), 205 (С6Н7NО3S2, 68%) и 193/195 (M+-CHNO-C5H7NO2S2 основн.). 1 H-ЯМР (ДМСО- d6)d: 8,32 (1H, д, J = 4 Гц), 8,08 (1Н, д, J = 1,5 Гц), 8,05 (1H, д, J = 8,5 Гц), 7,71 (шир.с. в обмене), 7,53 (1H, д, J = 4 Гц), 6,97 (1H, дв. д, J = 8,5, 1,5 Гц), 5,77 (1H, шир. с, в обмене) и 2,54 (ЗН, с). ИК (КВr) : 3433 шир, 3323 шир, 1731, 1607, 1566 и 1161 см-1. Пример 35 5-Хлор-З-(5-карбокси-2-теноил)-2- оксиндол-1- карбоксамид Указанное в заглавии соединение получают по способу примера 31: 1 г (5,81 ммоль) образца коммерческого 2,5-тиофендикарбоновой кислоты подвергают взаимодействию с 1,88 г (11,62 ммоль) 1,11карбонилдиимидазола в 15 мл N,N-диметилформамида до получения активированного ацилимидазола. Медленное добавление ацилимидазола к 1,11 г (5,28 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,92 г (15,68 ммоль) 4-(N,N-диметиламино)пиридина в N,N- диметилформамиде приводит к получению желтозеленого твердого продукта после кислотной обработки. Окончательная очистка достигается из горячей суспензии указанного соединения в уксусной кислоте. Это приводит к получению 1,51 г (4,14 ммоль, выход 78%) 5-хлор-3-(5-карбокси-2-теноил)-2-оксиндол-1-карбоксамида в виде желтого твердого продукта, т.пл. 274-278°С. Рассчитано для C15H9ClN2O5S: С 49,39%, Н 2,49%, N 7,68%. Найдено: С 49,19%, Н 2,45%, N 7,38%. EIMS (m/z): 364/366 (M+, 17%), 321/323 (M+-CHNO, 73%), 193/195 (M+-CHNO-C5H4O2S, 98%) и 186 (неизв. основной). 1 H-ЯМР (ДМСО- d6)d: 8,10 (1Н, д, J = 4 Гц), 8,09 (1Н, д, J = 8,5 Гц), 8,03 (1Н, шир.д, J = 1,5 Гц), 7,74 (1Н, д, J = 4 Гц) и 7,08 (1Н, дв. д, J = 8,5, 1,5 Гц). ИК (КВr): 3388, 3276 шир, 1718, 1695, 1551 и 1273 см-1. Пример 36 5-Хлор-З-(4-метоксикарбонил-2-теноил)-2- оксиндол- 1-карбоксамид Указанное соединение получают по способу примера 31. Раствор 1,5 г (8,06 ммоль) 4метоксикарбонил-2-тиофенкарбоновой кислоты, полученной по способу примера 9, в 15 мл N,Nдиметилформамида добавляют к 1,57 г (9,67 ммоль) 1,11-карбонилдиимидазола. Спустя 2 ч содержимое реактора медленно добавляют к 1,54 г (7,32 ммоль) 5-хлор-2-оксиндол-1- карбоксамида и 2,66 г (21,75 ммоль) 4-(N,N- диметиламино) пиридина в N,N-диметилформамиде. После кислотной обработки реакционного раствора с последующим фильтрованием его сушат и тщательно растирают с горячей 16 27291 уксусной кислотой, в результате чего получают 1,88 г (4,97 ммоль, 68% выход ) указанного соединения в виде желтого твердого продукта, т.пл. 244-246°С. Рассчитано для C16H11ClN2O5S: С 50,73%, Н 2,93%, N 7,40%. Найдено: С 50,52%, Н 2,86% N 7,12%. EIMS (m/z): 378/380 (M+, 1%), 335/337 (M+-CONH, 7%), 193/195 (M+-CONH-C6H5O2S, основной), 169 (С7Н5О3S, 35%). 1 H-ЯМР (ДМСО- d6):d 8,59 (1Н, д, J = 1,4 Гц), 8,48 (1Н, шир.с), 8,06 (1Н, д, J = 8,5 Гц), 8,05 (1Н, шир.с), 7,02 (шир.д, J = 8,5 Гц), 4,64 (1Н, шир.с в обмене) и 3,82 (ЗН, с). ИК (КВr): 3383, 3217 шир., 1746, 1590, 1375, 1276 и 745 см-1. Пример 37 5-Хлор-З-(5-метоксикарбонил-2-теноил)-2-оксиндол -1-карбоксамид По способу примера 31 N,N- диметилформамидный раствор 1,25 г (6,71 ммоль) 5-метоксикарбонил-2тиофенкарбоновой кислоты, полученной по способу примера 11, добавляют к 1,19 г (7,35 ммоль) 1,11карбонилдиимидазола до получения активированного ацильного промежуточного соединения. Реакционный раствор этого промежуточного соединения медленно добавляют к 1,29 г (6,10 ммоль) 5-хлор-2-оксиндол-1карбоксамида и 2,02 г (16,54 ммоль) 4-(N,N-диметиламино) пиридина также в N,N-диметилформамиде. После кислотной обработки с последующим фильтрованием, сушкой и перекристаллизацией получают 1,29 г (3,41 ммоль, выход 56%) указанного соединения в виде желтого твердого продукта, т.пл. 219-221°С (уксусная кислота). Рассчитано для С16Н11СlN2О5S: С 50,73%, Н 2,93%, N 7,40%. Найдено: С 50,56%, Н 2,84%, N 7,38%. EIMS (m/z): 378/380 (M+, 2%), 335/337 (M+-CONH, 11%), 193/195 (M+-CONH-C6H5S , основной) и 169 (C7H5O3S, 46%). 1 H-RMP (ДMCO- d6)d: 8,16 (1Н, д, J = 3,9 Гц), 8,05 (1Н, д, J = 8,5 Гц), 8,03 (1Н, шир.с), 7,78 (1Н, д, J = 3,9 Гц), 7,02 (1Н, дв.д, J = 8,5, 2,3 Гц), 5,55 (1Н, шир.с в обмене) и 3,84 (ЗН, с). ИК (KBr) : 3388, 3216 шир. , 1730, 1589, 1290 и 745 см-1. Пример 38 5-Хлор-З-(4-N,N–диметилкарбамидо-2-теноил)-2- оксиндол-1-карбоксамид Указанное соединение получают по способу примера 31: 1,70 г (8,56 ммоль) образца 4-[(N,Nдиметиламино) карбонил]-2-тиофенкарбоновой кислоты, полученной по способу примера 5, подвергают взаимодействию с 1,77 г (10,90 ммоль) 1,11-карбонилдиимидазола до получения ацилимидзольного промежуточного соединения, которое медленно добавляют к N,N- диметилформамидному раствору 1,64 г (7,80 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 2,57 г (21,02 ммоль) 4-(N,N-диметиламино)пиридина. После кислотной обработки с последующим фильтрованием получают оранжевое твердое вещество, которое дважды перекристаллизовывают из уксусной кислоты до получения 0,86 г (2,19 ммоль, выход 28%) чистого указанного соединения в виде желтого сольватированного комплекса с 0,2 эквивалентами уксусной кислоты, т.пл. 240-243°С. Рассчитано для C17H14ClN3O4S х 0,2 С2Н4O2: С 51,75%, Н 3,69%, N 10,41%. Найдено: С 51,58%, Н 3,46%, N 10,42%. EIMS (m/z): 391/393 (M+, 26%), 348/350 (M+-CONH, 20%), 193/195 (M+-CONH-C7H8NOS, основной) и 182 (C8H8NO2S, 46%). 1 H-ЯМР (ДМСО- d6)d: 8,16 (1Н, шир.с), 8,08 (1Н, д, J = 8,5 Гц), 8,04 (1Н, шир.с), 7,95 (1Н, шир.с), 7,10 (1Н, шир.д, J = 8,5 Гц), 6,38 (1Н, шир. с в обмене), 3,07 (ЗН, шир. с) и 2,98 (ЗН, шир.с). ИК (KBr): 3390, 3233, 1744, 1622, 1735 и 1195 см-1. Пример 39 5- Хлор- З- [(4-(2- метил-4-тиазолил)-2-теноил]-2-оксиндол-1-карбоксамид Указанное соединение получают по способу примера 31: 1,25 г (5,55 ммоль) образца 4-(2- метил-4тиазолил)-2-тиофенкарбоновой кислоты, полученной по способу примера 18, превращают в ацилимидазол при взаимодействии с 0,98 г (6,05 ммоль) 1,11-карбонилдиимидазола в 15 мл N,N-диметилформамида. После завершения реакции этот раствор переносят в дополнительную воронку и медленно добавляют 1,06 г (5,04 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,66 г (13,59 ммоль) 4- (N, N- диметиламино) пиридина в 50 мл N,N-диметилформамида. Кислотная обработка с последующей фильтрацией и тщательным растиранием с 2-бутаноном дает 0,50 г (1,20 ммоль) указанного соединения в виде желтого твердого продукта, т.пл. 238-241°С. Рассчитано для C18H12ClN3O3S2: С 51,73%, Н 2,90%, N 10,06%. Найдено: С 51,63%, Н 2,95%, N 9,75%. EIMS (m/z): 417/419 (M+, 1%), 374/376 (M+-CONH, 8%), 208 (C9H6NOS2, 34%), 193/195 (M+-CONH-C8H7NS2, 20%) и 181 (C8H7NS2, основной). 1 H-ЯMP (ДMCO- d6)d: 8,44 (1H, шир.с), 8,13 (1Н, шир.с), 8,09 (1H, д, J = 8,4 Гц), 7,94 (1H, шир.с), 7,79 (1H, с), 7,10 (1H, д, J = 8,4 Гц), 4,88 (1H, шир.с, в обмене) и 2,71 (ЗН, с). ИК (КВr): 3385, 2919, 1747, 1587, 1374, 1196 и 729 см-1. Пример 40 5- Хлор-З-(6-хлорникотиноил)-2-оксиндол-1- карбоксамид Указанное соединение получают по способу примера 31. Ацилактивирование 823 мг (5,22 ммоль) коммерческого образца 6- хлорникотиновой кислоты 924 мг (5,70 ммоль) 1,11- карбонилдиимидазола приводит к получению соответствующего реакционноспособного ацилимидазольного промежуточного соединения, которое используют непосредственно и соединяют с 1 г (4,75 ммоль) 5хлор-2- оксиндол-1-карбоксамида в присутствии 1,57 г (12,85 ммоль) 4-(N,N-диметиламино)пиридина до получения неочищенного зеленовато-коричневого твердого продукта. После перекристаллизации этого твердого продукта получают 400 мг (1,14 ммоль, выход 24%) зеленовато-желтого твердого продукта, т.пл. 236-238°С (уксусная кислота). Рассчитано для С15Н9Сl2N3О3: С 51,45%, Н 2,59%, N 12,00%. Найдено: С 51,54%, Н 2,54%, N 11,69%. 17 27291 EIMS (m/z): 349/351/353 (M+, 8%), 306/308/310 (M+-CONH, 64%), 193/195 (M+-CONH-C5H4ClN, основной), 140/142 (C6H3CINO, 61%). 1 H-ЯМР (ДМСО-d6): 8,56 (1Н, д, J = 2,3 Гц), 8,37 (шир.с в обмене), 8,07 (1Н, д, J = 8,5 Гц), 8,01 (1Н, дв.д, J = 8,2, 2,3 Гц), 7,94 (1Н, д, J = 2,3 Гц), 7,60 (1Н, д, J = 8,2 Гц), 7,41 (шир. в обмене), 7,11 (1Н, дв.д, J = 8,5, 2,3 Гц) и 4,93 (шир.с в обмене). ИК (RBr): 3390, 3210, шир. 1730, 1580, 1380, 1290, 1110 и 820 см-1. Пример 41 5- Фтор-З-(4-хлор-2-теноил)-2-оксиндол-1- карбоксамид Указанное соединение получают по способу примера 31: 329 мг (2,02 ммоль) 4-хлор-2тиофенкарбоновой кислоты соединяют с 358 мг (2,21 ммоль) 1,11 -карбонилдиимидазола в 5 мл N,Nдиметилформамида и промежуточный имидазол соединяют непосредственно с 357 мг (1,84 ммоль) 5-хлор2-оксиндол-1-карбоксамида в присутствии 607 мг (4,96 ммоль) 4-(N,N- диметиламино)пиридина. Полученный неочищенный желтый продукт перекристаллизовывают и получают 189 мл (0,558 ммоль, выход 30%) твердого вещества желтого цвета, т.пл. 224-226°С (уксусная кислота). Рассчитано для С14Н8СlN2ОЗS: С 49,64%, Н 2,38%, N 8,27%. Найдено: С 49,41%, Н 2,28%, N 8,12%. EIMS (m/z): 338/340 (M+, 4%), 295/297 (M+-CONH, 19%), 177 (M+-CONH-C4H3CIS, основной) и 145/147 (C5H2ClOS, 39%). 1 H-ЯМР (ДМСО- d6)d: 8,80 (шир.с в обмене), 8,42 (1Н, д, J = 1,8 Гц), 8,04 (1Н, дв.д, J = 9,0, 5,8 Гц), 7,80 (1Н, дв.д, J = 10,5, 2,1 Гц), 7,74 (1Н, шир.с), 7,30 (шир. с в обмене), 6,74 (1Н, ддд, J = 10,1, 9,0, 2,1 Гц) и 5,0 (шир.с в обмене). ИК (RBr): 3392, 3242, шир. 3112, 1743, 1588, 1381, 1182 и 838 см-1. Пример 42 5-Трифторметил-З-(4-хлор-2-теноил)-2- оксиндол-1-карбоксамид Для получения указанного соединения используют способ примера 31: 388 мг (2,39 ммоль) образца 4-хлор-2тиофенкарбоновой кислоты превращают в ацилимидазол при взаимодействии с 420 мг (2,59 ммоль) 1,11карбонилдиимидазола. Промежуточный 4-хлор-2- тиофен-(1-имидазо)карбоксамид соединяют непосредственно с 486 мг (1,99 ммоль) 5- трифторметил-2-оксиндол-1-карбоксамида в присутствии 657 мг (5,37 ммоль) 4-(N,Nдиметиламино)пиридина до получения 634 мл (1,63 ммоль, 82%) указанного соединения в виде желтого твердого продукта, т.пл. 164-166°С. Рассчитано для C15H8ClF3N2O3S: С 46,34%, Н 2,07%, N 7,21%. Найдено: С 46,29%, Н 2,07%, N 7,79%. EIMS (m/z): 338/390 (M+, 7%), 345/347 (M+-CONH, 25%), 227 (M+-CONH-CH4H3CIS, основной) и 145/147 (C5H2ClOS, 26%). 1 H-ЯМР (ДМСО- d6)d: 9,10 (шир.с в обмене), 8,63 (1Н, д, J = 1,1 Гц), 8,46 (1Н, с), 8,20 (1Н, д, J = 8,4 Гц), 7,69 (1Н, д, J = 1,1 Гц), 7,30 (1Н, шир.с в обмене), 7,20 (1Н, дв.д., J = 8,4, 1,4 Гц) и 5,28 (шир.с в обмене). ИК (YBr): 3397, 3233 (шир) 1747, 1583, 1324, 1270, 1188 и 1122 см-1. Пример 43 6- Хлор- 3-(4-хлор-2-теноил)-2- оксиндол-1-(N-этил) карбоксамид Указанное соединение получают по способу примера 31. Ацилактивирование 381 мг (2,34 ммоль) 4хлор-2-тиофенкарбоновой кислоты с 412 мг (2,54 ммоль) 1,11-карбонилдиимидазола приводит к получению соответствующего реакционноспособного ацилимидазола, который используют непосредственно, его соединяют с 466 мг (1,95 ммоль) 6-хлор-2-оксиндол-1-(N-этил) карбоксамида в присутствии 644 мг (5,27 ммоль) 4-(N,N-диметиламино)пиридина до получения 445 мг (59%) неочищенного желтого продукта. После перекристаллизации получают чистое указанное соединение (200 мг, 0,522 ммоль, выход 27%) в виде желтого кристаллического твердого вещества, т.пл. 164-6°С (уксусная кислота). Рассчитано для С16Н12Сl2N2ОЗS: С 50,14%, Н 3,16%, N 7,31%. Найдено: С 49,95%, Н 3,01%, N 7,21%. EIMS (m/z): 382/ 384/ 386 (M+, 5%), 311/313/ 315 (М+-С3Н5NО, 21%), 193/195 (M+-C3H5NO, С4Н3СlS, основной) и 145/147 (C5H2ClOS, 40%). 1 H-ЯМР (ДМСО-d6)d: 9,43 (шир.с в обмене), 8,34 (1Н, д, J = 1,8 Гц), 8,12 (1Н, д, J = 1,9 Гц), 8,04 (1Н, д, J = 8,2 Гц), 7,74 (1Н, шир.с), 7,04 (1Н, дв. д. , J = 8,2, 1,9 Гц), 4,92 (шир. с в обмене), 3,29 (2Н, шир. KB . , J = 7,3 Гц) и 1,13 (ЗН, т, J = 7,3 Гц). ИК (КВr): 3336, 3084, 1720, 1530, 1375, 1196 и 809 см-1. Пример 44 5- Фтор- З-(4-хлор-2-теноил)- 2-оксиндол-1-(N-третбутил) карбоксамид Для получения указанного соединения используют способ примера 31: 390 мг (2,40 ммоль) образца 4хлор-2-тиофенкарбоновой кислоты подвергают взаимодействию с 481 мг (2,60 ммоль) 1,11карбонилдиимидазола до получения промежуточного соединения, которое медленно добавляют к раствору в N,N-диметилформамиде 500 мг (2 ммоль) 5-хлор-2-оксиндол-1-(N- третбутил)карбоксамида и 659 мг (5,39 ммоль) 4-(N,N-диметиламино)пиридина. Кислотная обработка с последующей перекристаллизацией дает указанное соединение (260 мг, 0,66 ммоль, выход 33%) в виде желтого твердого продукта, т. пл. 202-5°С (уксусная кислота). Рассчитано для C18H16ClFN2O3S: С 54,75%, Н 4,08%, N 7,10%. Найдено: С 54,21%, Н 3,76%, N 6,94%. EIMS (m/z): 394/396 (M+, 1%), 295/297 (M+-C5H9NO, 28%), 177 (M+-C5H9NO, С4Н3СlS, основной) и 145/147 (C5H2ClOS, 24%). 1 H-ЯМР (ДМСО-d6)d: 9,55 (шир.с в обмене), 8,37 (1Н, д, J = 1,1 Гц), 8,05 (1Н, дв.д, J = 9,0, 5,2 Гц), 7,81 (1Н, дв.д., J = 10,5, 2,0 Гц), 7,73 (1Н, шир.с), 6,73 (1Н, ддд., J = 10,5, 9,0, 2,0 Гц), 4,13 (шир. с в обмене) и 1,38 (9Н, с) . ИК (КВr): 3305, 3075, 2988, 1721, 1615, 1548, 1193 и 835 см-1. 18 27291 Пример 45 6- Хлор-З-(4-хлор-2-теноил)-2-оксиндол-1- карбоксамид Для получения указанного в заглавии соединения использовали способ примера 31: 463 мг (2,85 ммоль) 4-хлор-2-тиофенкарбоновой кислоты превращают в ацилимидазол с 500 мг (3,09 ммоль) 1,11карбонилдиимидазола. Промежуточный 4-хлор-2-тиофен-1-имидазокарбоксамид соединяют непосредственно с 500 мг (2,37 ммоль) 6-хлор-2-оксиндол-1-карбоксамида з присутствии 783 мг (6,41 ммоль) 4-(N,N-диметиламино) пиридина до получения 665 мг неочищенного зеленовато-желтого твердого вещества. После перекристаллизации получают 450 мг (1,27 ммоль, выход 53%) чистого указанного соединения в виде желтого твердого продукта, т.пл. 231-3°С (уксусная кислота). Рассчитано для С14Н8Сl2N2OЗS: С 47,34%, Н 2,27%, N 7,89%. Найдено: С 47,11%, Н 2,11%, N 7,73%. EIMS (m/z): 354/356/358 (M+, 5%), 311/ 313/ 315 (M+-CONH, 15%), 193/195 (M+-CONH, С4Н3СlS, основной) и 145/147 (С5Н2СlOS, 49%). 1 H-ЯМР (ДМСО-d6)d: 8,80 (шир.с в обмене), 8,31 (1Н, д, J = 1,1 Гц), 8,10 (1Н, д, J = 2,2 Гц), 8,03 (1Н, д, J = 8,2 Гц), 7,74 (1Н, шир.с), 7,36 (шир. с в обмене), 7,04 (2Н, дв.д, J = 8,2, 2,2 Гц) и 5,32 (шир.с, в обмене). ИК (КВr): 3398, 3191 (шир.), 1799, 1726, 1587, 1368, 1196 и 807 см-1. Пример 46 3-(4-Хлор-2-теноил)-2-оксиндол-2- карбоксамид Указанное соединение получают по способу примера 31: 831 мг (5,11 ммоль) 4-хлор-2тиофенкарбоновой кислоты соединяют с 897 мг (5,53 ммоль) 1,11-карбонилдиимидазола в 5 мл N,Nдиметилформамида, промежуточный имидазолид соединяют непосредственно с 750 мг (4,26 ммоль) 2оксиндол-1-карбоксамида в присутствии 1,40 г (11,49 ммоль) 4-(N,N-диметиламино) пиридина. Полученный неочищенный желтый твердый продукт (803 мг, 59% выход) перекристаллизовывают из уксусной кислоты до получения 376 мг (1,17 ммоль, выход 27%) пушистых желтых кристаллов, т.пл. 221-3°С. Рассчитано для С14Н9СlN2ОЗS: С 52,42%, Н 2,83%, N 8,74%. Найдено: С 52,04%, Н 2,62%, N 8,51%. EIMS (m/z): 320/322 (M+, 3%), 277/279 (M+-CONH, 6%), 159 (M+- CONH, С4Н3СlS, основной) и 145/147 (С5Н2СlOS, 50%). 1 H-ЯMP (ДMCO-d6)d: 8,10 (1Н, шир.с), 8,09 (1Н, д, J = 8,5 Гц), 7,95 (шир.с), 7,83 (шир.с), 7,75 (1Н, шир.с), 7,30 (шир.), 7,08 (шир.) и 4,82 (шир.с в обмене). ИК (КВr): 3392, 3243 (шир.), 3117, 1744, 1591, 1379, 1268 и 1188 см-1. Пример 47 5-Фтор-6-хлор-З-(4-хлор-2-теноил)-2-оксиндол-1-карбоксамид Указанное соединение получают, используя способ примера 31: 427 мг (2,62 ммоль) образца 4-хлор-2тиофенкарбоновой кислоты подвергают взаимодействию с 461 мг (2,84 ммоль) 1,11-карбонилдиимидазола в 5 мл N,N- диметилформамида до получения активированного ацилимидазола. Медленное добавление ацилимидазола к 500 мг (2,19 ммоль) 5-фтор-6-хлор-2-оксиндол-1-карбоксамида и 721 мг (5,90 ммоль) 4-(N,Nдиметиламино)пиридина в N,N-диметиламиноформамиде приводит к получению неочищенного желтого продукта (635 мг, 78%) после кислотной обработки. После перекристаллизации из уксусной кислоты получают желтокоричневый кристаллический твердый продукт (390 мг, 1,05 ммоль, выход 48%), т.пл. 235-237°С. Рассчитано для C14H7Cl2FN2O3S: С 45,05%, Н 1,89%, N 7,51%. Найдено: С 44,81%, Н 1,87%, N 7,44%. EIMS (m/z): 372/374/376 (M+, 7%), 329/ 331/ 333 (M+-CONH, 23%), 211/213 (M+-CONH, С4Н3СlS, основной) и 145/147 (С5Н2СlOS, 33%). 1 H-ЯМР (ДМСО-d6)d: 9,00 (шир.с в обмене), 8,62 (1Н, д, J = 1,2 Гц), 8,14 (1Н, д, J = 7,2 Гц), 8,02 (1Н, д, J = 11,2 Гц), 7,69 (1Н, д, J = 1,2 Гц), 7,25 (шир.с в обмене) и 4,32 (шир.с, в обмене). ИК (КВr): 3386, 3231, 1715, 1610, 1580, 1464, 1366 и 1183 см-1. Пример 48 5- Хлор-З-(5-бром-З-фуроил)-2-оксиндол-1- карбоксамид Указанное соединение получают по способу примера 31: 750 мг (3,93 ммоль) 5-бром-Зфуранкарбоновой кислоты превращают в ацилимидазол при взаимодействии с 690 мг (4,25 ммоль) 1,11карбонилдиимидазола. Промежуточный 5-бром-З-фуран-(1-имидазо) карбоксамид непосредственно соединяют с 689 мг (3,27 ммоль) с 6-хлор-2-оксиндол-1-карбоксамида в присутствии 1,08 г (8,83 ммоль) 4(N,N- диметиламино)пиридина до получения 500 мг (выход 40%) неочищенного зеленовато-желтого твердого продукта. После перекристаллизации получают 143 мг (0,37 ммоль, 11% выход ) чистого указанного соединения в виде зеленоватого твердого продукта, т.пл. 232-4°С (уксусная кислота). Рассчитано для С14Н8ВrСlN2O4: С 43,83%, Н 2,10%, N 7,30%. Найдено: С 43,54%, Н 2,00%, N 7,19%. EIMS (m/z): 382/384/386 (M+, 11%), 339/341/ 343 (M+-CONH, 30%), 260/262 (M+-CONH-Br, 90%), 232/234 (неизв. 90%), 193/194 (М+-СОNН-C4Н3-ВrО, 92%) и 173/175 (С5Н2ВrO2, основной). 1 H-ЯМР (ДМСО- d6)d: 8,43 (шир.с в обмене), 8,40 (1Н, шир.с), 8,14 (1Н, д, J = 1,8 Гц), 7,92 (1Н, д, J = 8,2 Гц), 7,54 (шир.с в обмене), 7,15 (1Н, дв.д., J = 8,2, 1,9 Гц), 6,96 (1Н, д, J = 1,8 Гц), и 4,04 (шир.с, в обмене). ИК (КВr): 3470, 3389, 3305 (шир.), 1757, 1718, 1759, 1387, 1198, 1122 и 915 см-1. Пример 49 5-Фтор-З- (5-бром-З-фуроил)-2-оксиндол-1-(N-трет-бутил) карбоксамид Для получения указанного соединения используют способ примера 31: 641 мг (3,36 ммоль) образца 5-бром-З-фуранкарбоновой кислоты подвергают взаимодействию с 590 мг (3,64 ммоль) 1,11карбонилдиимидазола до получения ацилимидазольного промежуточного, которое медленно добавляют к N,N- диметилформамидного раствора 700 мг (2,80 ммоль) 5-фтор-2-оксиндол-1-(N-трет-бутил) карбоксамида и 923 мг (7,56 ммоль) 4-(N,N- диметиламино) пиридина. 19 27291 Кислотная обработка дает неочищенное указанное соединение (777 мг, 66% выход) в виде желтокоричневого твердого продукта. После перекристаллизации получают 256 мг (0,60 ммоль, 22% выход) грязно-белого кристаллического продукта, т.пл. 190-2°С (ацетонитрил). Рассчитано для C18H16BrFN2O4: С 51,08%, Н 3,81%, N 6,62%. Найдено: С 50,98%, Н 3,57%, N 6,61%. EIMS (m/z): 423/425 (M+, 1%), 323/325 (M+-C5H10NO, 35%), 244 (M+-C5H10NO-Br, основной), 216 (неизв., 95%) и 57 (С4Н9, 99%). 1 H-ЯМР (ДМСО- d6)d: 9,07 (шир.с в обмене), 8,44 (1Н, д, J = 1,4 Гц), 8,10 (1Н, дв.д., J = 9,0, 4,1 Гц), 7,67 (1Н, дв.ж., J = 9,5, 2,8 Гц), 6,96 (1Н, д, J = 1,4 Гц), 6,91 (1Н, ддд, J = 9,5, 9,0, 2,8 Гц), 3,93 (шир.с в обмене) и 1,36 (9Н, с). ИК (КВr): 3300, 3205, 2960, 1720, 1550, 1179 и 820 см-1. Пример 50 5-Хлор-З-(5-бром-З-теноил)-2-оксиндол-1-карбоксамид Указанное соединение получают по способу примера 31: 100 мг (4,83 ммоль) 5-бром-Зтиофенкарбоновой кислоты соединяют с 848 мг (5,23 ммоль) 1,11-карбонилдиимидазола в 5 мл N,Nдиметилформамида, а промежуточный имидазол соединяют непосредственно с 848 мг (4,02 ммоль) 5хлор-2-оксиндол-1-карбоксамида в присутствии 1,33 г (10,89 ммоль) 4-(N,N-диметиламино)пиридина. Полученный неочищенный зеленый продукт (1,22 г, 76% выход ) перекристаллизовывают до получения 540 мг (1,35 ммоль, 34%) желтого твердого продукта, т.пл. 238-240°С (уксусная кислота). Рассчитано для C14H8BrClN2O3S: С 42,07%, Н 2,02%, N 7,01%. Найдено: С 42,26%, Н 1,98%, N 6,99%. EIMS (m/z): 398/400/402 (M+, 39%), 355/ 357/359 (M+-CONH, основной), 276/278 (M+-CONH-Br, 30%) и 193/195 (M+-CONH-C4H3-BrS, 75%). 1 H-ЯМР (ДМСО- d6)d: 8,36 (шир.с в обмене), 8,09 (1Н, д, J = 8,5 Гц), 8,08 (1Н, д, J = 1,6 Гц), 7,85 (1Н, д, J = 2,0 Гц), 7,52 (шир.с в обмене), 7,49 (1Н, д, J = 1,6 Гц), 7,16 (1Н, дд, J = 8,5, 2,0 Гц) и 3,73 (шир.с, в обмене). ИК (КВr): 3389, 3218 (шир.), 1744, 1585, 1391, 1272 и 1194 см-1. Пример 51 5-Хлор-З-(5-хлор-2-тиофенацетил)-2-оксиндол-1- карбоксамид Указанное соединение получают, используя способ примера 31: 1 г (5,66 ммоль) 5-хлор-2тиофенуксусной кислоты подвергают взаимодействию с 995 мг (6,13 ммоль) 1,11- карбонилдиимидазола в 5 мл N,N- диметилформамида до получения активированного ацилимидазола. Медленное добавление ацилимидазола к 994 мг (4,72 ммоль) 5-хлор-2-оксиндол-1-карбоксамида и 1,44 г (11,79 ммоль) 4-(N,Nдиметиламино) пиридина в N,N- диметилформамиде приводит к получению неочищенного коричневатосерого твердого продукта (1,52 г, 87% выход). После перекристаллизации из уксусной кислоты получают указанное соединение в виде серого кристаллического твердого продукта (387 мг, 1,05 ммоль, выход 22%), т.пл. 238-41°С. Рассчитано для С15Н10Сl2N2O3S: С 48,74%, Н 2,68%, N 7,51%. Найдено: С 48,79%, Н 2,73%, N 7,59%. EIMS (m/z): 368/370/372 (M+, 4%), 324/ 326/ 328 (M+-CONH, 4%), 237/239 (M+-C5H4ClS, 49%) и 194/195 (M+-CONH-C5H4ClS, основной). 1 H-ЯМР (ДМСО- d6)d: 8,07 (1H, д, J = 8,5 Гц), 7,80 (1Н, д, J = 2,6 Гц), 7,12 (1H, дв.д., J = 8,5, 2,6 Гц), 6,94 (1H, д, J = 4,1 Гц), 6,90 (1H, д, J = 4,1 Гц), 4,43 (2Н, с) и 3,71 (шир.с, в обмене). ИК (КВr): 3392, 3249 (шир.), 1724, 1695, 1664, 1582, 1381, 1287, 1202, 995 и 847 см-1. Пример 52 Метил З-этокси-5-изоксазолкарбоксилат Перемешиваемую суспензию 3,53 г (24,67 ммоль) коммерческого образца метил З-гидрокси-5изоксазолкарбоксилата в 50 мл метиленхлорида обрабатывают по каплям раствором триэтилоксонийтетрафторбората (5,62 г 29,60 ммоль) растворенного в 30 мл метиленхлорида при комнатной температуре. После перемешивания в течение ночи раствор промывают водой (2 х 30 мл) , 5%-ным бикарбонатом натрия (2,30 мл) и еще раз водой. Органический слой сушат над сульфатом магния и выпаривают в вакууме до получения указанного соединения (3,61 г, 86%) в виде светло-желтого твердого продукта, т.пл. 77-79°С. 1 H-ЯМР (ДМСО- d6)d: 6,65 (1Н, с), 3,93 (2Н, KB, J = 7,4 Гц), 3,87 (ЗН, с) и 1,21 (ЗН, т, J = 7,4 Гц). EIMS (m/z): 171 (M+, 48%), 156 (М+-СН3, 4%), 143 (C5H5NO4, 31%), 112 (C4H2NO3, 12%) и 69 (С3Н3NО, основной). ИК (KBr): 3105, 1744, 1611, 1441, 1241, 1106, 974 и 797 см-1. Пример 53 З-Этокси-5-изоксазолкарбоновая кислота Перемешиваемый раствор метил З-этокси-5-изоксазолкарбоксилата, полученный по способу примера 52, (3 г, 17,53 ммоль) в 75 мл 2 н. гидроксида натрия перемешивают при комнатной температуре в течение 10 мин, охлаждают в бане со льдом и подкисляют до рН 3 концентрированной соляной кислотой. Осевший твердый продукт собирают фильтрованием. Оставшийся целевой продукт выделяют, насыщая водный фильтрат хлористым натрием и экстрагируя этилацетатом (3 х 100 мл). Таким образом получают 2,46 г (выход 89%) указанного соединения. Образец перекристаллизовывают из ацетонитрила, т.пл. 210-213°С. Рассчитано для С6Н7NO4: С 45,86%, Н 4,49%, N 8,92%, Найдено для C6H7NO4: С 45,80%, Н 4,32%, N 8,87%. EIMS (m/z): 157 (M+-СН3, 22%), 129 (С4Н3NO4, 70%), 112 (C4H2NO3, 15%) и 69 (C3H3NO, основной). 1 H-ЯМР (ДМСО- d6)d: 6,51 (1Н, с), 3,91 (2Н, KB, J = 7,4 Гц) и 1,20 (ЗН, т, J = 7,4 Гц). ИК (КВr): 3136 (шир.), 1726, 1626, 1238 и 984 см-1. Пример 54 20 27291 5-Хлор-З-(З-этоксиизоксазол-5-ил)-2-оксиндол-1-карбоксамид Указанное соединение получают по способу примера 31: 1,5 г (9,55 ммоль) З-этокси-5изоксазолкарбоновой кислоты, полученной по способу примера 53, подвергают взаимодействию с 1,68 г (10,34 ммоль) 1,11-карбонилдиимидазола до получения ацилимидазольного промежуточного соединения, которое медленно добавляют к N,N-диметилформамидному раствору 1,68 г (7,96 ммоль) 5-хлор-2оксиндол-1-карбоксамида и 2,62 г (21,48 ммоль) 4-(N,М-диметиламино)пиридина. После кислотной обработки получают неочищенное указанное соединение в виде оранжево-желтого твердого продукта (2,43 г, выход 87%). Его суспендируют в горячей ледяной уксусной кислоте, а затем фильтруют, получая чистое указанное соединение в виде ярко-желтого твердого продукта (1,75 г, 5,00 ммоль, выход 63%), т.пл. 2602°С. Рассчитано для С15Н12СlN3О5: С 51,51%, Н 3,46%, N 12,01%. Найдено: С 51,57%, Н 3,22%, N 11,89%. EIMS (m/z): 349/351 (M+, 10%), 306/308 (M+-CONH, 45%), 235/237 (M+-C5H8NO2, 20%) и 193/195 (М+-СОNН-С5H7NO2, 44%). 1 H-ЯМР (ДМСО- d6)d: 8,76 (шир.с в обмене), 8,01 (1Н, д, J = 8,6 Гц), 7,97 (1Н, д, J = 2,2 Гц), 7,30 (шир.с в обмене), 6,96 (1Н, дв.д., J = 8,6, 2,2 Гц), 6,30 (1Н,с), 4,98 (шир.с в обмене), 3,86 (2Н, KB, J = 7,4 Гц) и 1,21 (ЗН, т, J = 7,4 Гц). ИК (КВr): 3315, 3228 (шир.), 1748, 1673, 1549, 1370, 843 и 819 см-1. Пример 55 Метил 5-(3-метил-1,2,4-оксадиазол-5-ил)-2-тиофенкарбоксилат Перемешиваемую суспензию 5- метоксикарбонил-2-тиофенкарбоновой кислоты (1,50 г, 8,06 ммоль) в 15 мл тионилхлорида кипятят с обратным холодильником в течение 2 ч. Раствор охлаждают до комнатной температуры и концентрируют в вакууме до получения почти бесцветного масла, которое кристаллизуется в вакууме. Этот твердый продукт растворяют в 5 мл хлороформа и добавляют по каплям при комнатной температуре к перемешиваемой смеси ацетамидоксима (657 мг, 8,86 ммоль) и триэтиламина (897 мг, 1,24 мл, 8,86 ммоль) в 30 мл хлороформа. После завершения добавления раствор перемешивают при комнатной температуре в течение часа и промывают водой (2 х 20 мл). Органический слой сушат (сульфат магния), выпаривают и остаток тщательно растирают с толуолом до получения промежуточного О-(2-метоксикарбонил-5-теноил)ацетамидоксима, 1,55 г (80% выход), в виде белого твердого продукта, т.пл. 150-152°С. 1 H-ЯMP(ДMCO-d6)d: 8,03 (1Н, д, J = 3,9 Гц), 7,83 (1Н, д, J = 3,9 Гц), 6,54 (шир.с в обмене), 3,85 (ЗН, с) и 1,80 (ЗН, с). Этот материал используют без дополнительной очистки. Часть 1,43 г (5,90 ммоль) О-(2метоксикарбонил-5-теноил) ацетамидоксима суспендируют в 75 мл толуола и нагревают до кипения с обратным холодильником в течение ночи. Растворитель удаляют в вакууме и остаток тщательно растирают с небольшим количеством толуола до получения 1,10 г (83%) указанного соединения в виде грязно-белого кристаллического твердого продукта, т.пл. 154-156°С. Этот материал используют непосредственно без дополнительной очистки. Точная масса 224,0241. Рассчитано: 224,0256. EIMS (m/z): 224 (M+, 98%) и 193 (M+-СН3О, основной). 1 Н-ЯМР (ДМСО- d6)d: 8,01 (1Н, д, J = 4,3 Гц), 7,92 (1Н, д, J = 4,3 Гц), 3,88 (ЗН, с) и 2,41 (ЗН, с). Пример 56 5- (З-метил-1,2,4-оксадиазол-5-ил)-2- тиофенкарбоновая кислота Смесь метил-5-(З-метил-1,2,4-оксадиазол-5-ил)-2-тиофенкарбоксилата, полученного по способу примера 55: 1,09 г (4,86 ммоль) в 35 мл 2 н. гидроксида натрия разбавляют 5 мл этанола и нагревают до 65°С в течение 30 мин. Этот раствор охлаждают в ледяной бане и подкисляют до рН 2 концентрированной соляной кислотой. После фильтрации и сушки получают 870 мг (выход 85%) указанного соединения в виде грязно-белого твердого вещества. Аналитический образец перекристаллизовывают из метанола, т.пл. 226-228°С. Рассчитано для C8H6N2O3S: С 45,70%, Н 2,88%, N 13,33%. Найдено: С 45,57%, Н 2,75%, N 13,37%. EIMS (m/z): 210 (М+, основной) и 153 (М+-C2H3NO, 99%). 1 H-ЯМР (ДМСО- d6)d: 7,97 (1Н, д, J = 3,9 Гц), 7,82 (1Н, д, J = 3,9 Гц) и 2,40 (ЗН, с). ИК (KBr): 3112 (шир.), 1699, 1289, 1112 и 840 см-1. 21 27291 22
ДивитисяДодаткова інформація
Назва патенту англійськоюThe method for obtaining of 3-substituted 2-oxoindols
Автори англійськоюEhrgotch Frederik Jacob, Goddart Karl Joseph, Shulte Heri Richard
Назва патенту російськоюСпособ получения 3-замещенных 2-оксоиндолов
Автори російськоюЕхрготх Фредерик Джакоб, Годдарт Карл Джозеф, Шульте Гери Ричард
МПК / Мітки
МПК: A61K 31/4427, A61K 31/4433, C07D 413/06, C07D 403/06, A61K 31/495, A61K 31/40, A61K 31/38, A61P 25/04, A61K 31/44, A61K 31/403, A61P 43/00, C07D 409/06, A61P 3/00, A61K 31/41, A61K 31/381, C07D 405/06, C07D 333/38, A61K 31/443, A61K 31/425, C07D 333/40, C07D 407/06, C07D 417/04, A61P 29/00, C07D 413/04, A61K 31/445, C07D 401/06, C07D 417/14, C07D 417/06, A61K 31/404, C07D 209/34
Мітки: 3-заміщених, одержання, 2-оксоіндолів, спосіб
Код посилання
<a href="https://ua.patents.su/22-27291-sposib-oderzhannya-3-zamishhenikh-2-oksoindoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-заміщених 2-оксоіндолів</a>
Попередній патент: Регулювальний орган для клапана
Випадковий патент: Пестицидна композиція