Молекула днк, що кодує ліпазу людини, що стимулюється солями жовчних кислот, клонована молекула кднк
Номер патенту: 39165
Опубліковано: 15.06.2001
Автори: Бьюрселл Гуннар, Хернелл Олле, Олівекрона Томас, Енербук Свен, Карлссон Петер, Нілссон Женетт, Блукберг Ларс
Формула / Реферат
1. Молекула ДНК, кодирующая липазу человека, стимулируемую солями желчных кислот, имеющую следующую аминокислотную последовательность:
Met
Leu
Thr
Met
Gly
Arg
Leu
Gln
Leu
Val
1
5
10
Val
Leu
Gly
Leu
Thr
Cys
Cys
Trp
Ala
Val
Ala
Ser
Ala
Ala
Lys
Leu
15
20
25
Gly
Ala
Val
Tyr
Thr
Glu
Gly
Gly
Phe
Val
Glu
Gly
Val
Asn
Lys
Lys
30
35
40
Leu
Gly
Leu
Leu
Gly
Asp
Ser
Val
Asp
Ile
Phe
Lys
Gly
Ile
Pro
Phe
45
50
55
Ala
Ala
Pro
Thr
Lys
Ala
Leu
Glu
Asn
Pro
Gln
Pro
His
Pro
Gly
Trp
60
65
70
Gln
Gly
Thr
Leu
Lys
Ala
Lys
Asn
Phe
Lys
Lys
Arg
Cys
Leu
Gln
Ala
75
80
85
90
Thr
Ile
Thr
Gln
Asp
Ser
Thr
Tyr
Gly
Asp
Glu
Asp
Cys
Leu
Tyr
Leu
95
100
105
Asn
Ile
Trp
Val
Pro
Gln
Gly
Arg
Lys
Gln
Val
Ser
Arg
Asp
Leu
Pro
110
115
120
Val
Met
Ile
Trp
Ile
Tyr
Gly
Gly
Ala
Phe
Leu
Met
Gly
Ser
Gly
His
125
130
135
Gly
Ala
Asn
Phe
Leu
Asn
Asn
Tyr
Leu
Tyr
Asp
Gly
Glu
Glu
Ile
Ala
140
145
150
Thr
Arg
Gly
Asn
Val
Ile
Val
Val
Thr
Phe
Asn
Tyr
Arg
Val
Gly
Pro
155
160
165
170
Leu
Gly
Phe
Leu
Ser
Thr
Gly
Asp
Ala
Asn
Leu
Pro
Gly
Asn
Tyr
Gly
175
180
185
Leu
Arg
Asp
Gln
His
Met
Ala
Ile
Ala
Trp
Val
Lys
Arg
Asn
Ile
Ala
190
195
200
Ala
Phe
Gly
Gly
Asp
Pro
Asn
Asn
Ile
Thr
Leu
Phe
Gly
Glu
Ser
Ala
205
210
215
Gly
Gly
Ala
Ser
Val
Ser
Leu
Gln
Thr
Leu
Ser
Pro
Tyr
Asn
Lys
Gly
220
225
230
Leu
Ile
Arg
Arg
Ala
Ile
Ser
Gln
Ser
Gly
Val
Ala
Leu
Ser
Pro
Trp
235
240
245
250
Val
Ile
Gln
Lys
Asn
Pro
Leu
Phe
Trp
Ala
Lys
Lys
Val
Ala
Glu
Lys
255
260
265
Val
Gly
Cys
Pro
Val
Gly
Asp
Ala
Ala
Arg
Met
Ala
Gln
Cys
Leu
Lys
270
275
280
Val
Thr
His
Pro
Arg
Ala
Leu
Thr
Leu
Ala
Tyr
Lys
Val
Pro
Leu
Ala
285
290
295
Gly
Leu
Glu
Tyr
Pro
Met
Leu
His
Tyr
Val
Gly
Phe
Val
Pro
Val
Ile
300
305
310
Asp
Gly
Asp
Phe
Ile
Pro
Ala
Asp
Pro
Ile
Asn
Leu
Tyr
Ala
Asn
Ala
315
320
325
330
Ala
Asp
Ile
Asp
Tyr
Ile
Ala
Gly
Thr
Asn
Asn
Met
Asp
Gly
His
Ile
335
340
345
Phe
Ala
Ser
Ile
Asp
Met
Pro
Ala
Ile
Asn
Lys
Gly
Asn
Lys
Lys
Val
350
355
360
Thr
Glu
Glu
Asp
Phe
Tyr
Lys
Leu
Val
Ser
Glu
Phe
Thr
Ile
Thr
Lys
365
370
375
Gly
Leu
Arg
Gly
Ala
Lys
Thr
Thr
Phe
Asp
Val
Tyr
Thr
Glu
Ser
Trp
380
385
390
Ala
Gln
Asp
Pro
Ser
Gln
Glu
Asn
Lys
Lys
Lys
Thr
Val
Val
Asp
Phe
395
400
405
410
Glu
Thr
Asp
Val
Leu
Phe
Leu
Val
Pro
Thr
Glu
Ile
Ala
Leu
Ala
Gln
415
420
425
His
Arg
Ala
Asn
Ala
Lys
Ser
Ala
Lys
Thr
Tyr
Ala
Tyr
Leu
Phe
Ser
430
435
440
His
Pro
Ser
Arg
Met
Pro
Val
Tyr
Pro
Lys
Trp
Val
Gly
Ala
Asp
His
445
450
455
Ala
Asp
Asp
Ile
Gln
Tyr
Val
Phe
Gly
Lys
Pro
Phe
Ala
Thr
Pro
Thr
460
465
470
Gly
Tyr
Arg
Pro
Gln
Asp
Arg
Thr
Val
Ser
Lys
Ala
Met
Ile
Ala
Tyr
475
480
485
490
Trp
Thr
Asn
Phe
Ala
Lys
Thr
Gly
Asp
Pro
Asn
Met
Gly
Asp
Ser
Ala
495
500
505
Val
Pro
Thr
His
Trp
Glu
Pro
Tyr
Thr
Thr
Glu
Asn
Ser
Gly
Tyr
Leu
510
515
520
Glu
Ile
Thr
Lys
Lys
Met
Gly
Ser
Ser
Ser
Met
Lys
Arg
Ser
Leu
Arg
525
530
535
Thr
Asn
Phe
Leu
Arg
Tyr
Trp
Thr
Leu
Thr
Tyr
Leu
Ala
Leu
Pro
Thr
540
545
550
Val
Thr
Asp
Gln
Glu
Ala
Thr
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Glu
555
560
565
570
Ala
Thr
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Glu
Thr
Ala
Pro
Val
Pro
575
580
585
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
590
595
600
Gly
Ala
Pro
Pro
Leu
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
605
610
615
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
620
625
630
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
635
640
645
650
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
655
660
665
Asp
Ala
Gly
Pro
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
670
675
680
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Thr
Pro
Thr
685
690
695
Gly
Asp
Ser
Glu
Thr
Ala
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
700
705
710
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
715
720
Или ее вариант или биологический активный фрагмент.
2. Молекула ДНК по п.1, отличающаяся тем,что является кДНК.
3. Клонированная молекула кДНК или ее фрагмент, полученная из молочной железы человека,
кодирующая липазу человека, стимулируемую солями желчных кислот,имеющую следующую аминокислотную последовательность:![]()
Met
Leu
Thr
Met
Gly
Arg
Leu
Gln
Leu
Val
1
5
10
Val
Leu
Gly
Leu
Thr
Cys
Cys
Trp
Ala
Val
Ala
Ser
Ala
Ala
Lys
Leu
15
20
25
Gly
Ala
Val
Tyr
Thr
Glu
Gly
Gly
Phe
Val
Glu
Gly
Val
Asn
Lys
Lys
30
35
40
Leu
Gly
Leu
Leu
Gly
Asp
Ser
Val
Asp
Ile
Phe
Lys
Gly
Ile
Pro
Phe
45
50
55
Ala
Ala
Pro
Thr
Lys
Ala
Leu
Glu
Asn
Pro
Gln
Pro
His
Pro
Gly
Trp
60
65
70
Gln
Gly
Thr
Leu
Lys
Ala
Lys
Asn
Phe
Lys
Lys
Arg
Cys
Leu
Gln
Ala
75
80
85
90
Thr
Ile
Thr
Gln
Asp
Ser
Thr
Tyr
Gly
Asp
Glu
Asp
Cys
Leu
Tyr
Leu
95
100
105
Asn
Ile
Trp
Val
Pro
Gln
Gly
Arg
Lys
Gln
Val
Ser
Arg
Asp
Leu
Pro
110
115
120
Val
Met
Ile
Trp
Ile
Tyr
Gly
Gly
Ala
Phe
Leu
Met
Gly
Ser
Gly
His
125
130
135
Gly
Ala
Asn
Phe
Leu
Asn
Asn
Tyr
Leu
Tyr
Asp
Gly
Glu
Glu
Ile
Ala
140
145
150
Thr
Arg
Gly
Asn
Val
Ile
Val
Val
Thr
Phe
Asn
Tyr
Arg
Val
Gly
Pro
155
160
165
170
Leu
Gly
Phe
Leu
Ser
Thr
Gly
Asp
Ala
Asn
Leu
Pro
Gly
Asn
Tyr
Gly
175
180
185
Leu
Arg
Asp
Gln
His
Met
Ala
Ile
Ala
Trp
Val
Lys
Arg
Asn
Ile
Ala
190
195
200
Ala
Phe
Gly
Gly
Asp
Pro
Asn
Asn
Ile
Thr
Leu
Phe
Gly
Glu
Ser
Ala
205
210
215
Gly
Gly
Ala
Ser
Val
Ser
Leu
Gln
Thr
Leu
Ser
Pro
Tyr
Asn
Lys
Gly
220
225
230
Leu
Ile
Arg
Arg
Ala
Ile
Ser
Gln
Ser
Gly
Val
Ala
Leu
Ser
Pro
Trp
235
240
245
250
Val
Ile
Gln
Lys
Asn
Pro
Leu
Phe
Trp
Ala
Lys
Lys
Val
Ala
Glu
Lys
255
260
265
Val
Gly
Cys
Pro
Val
Gly
Asp
Ala
Ala
Arg
Met
Ala
Gln
Cys
Leu
Lys
270
275
280
Val
Thr
His
Pro
Arg
Ala
Leu
Thr
Leu
Ala
Tyr
Lys
Val
Pro
Leu
Ala
285
290
295
Gly
Leu
Glu
Tyr
Pro
Met
Leu
His
Tyr
Val
Gly
Phe
Val
Pro
Val
Ile
300
305
310
Asp
Gly
Asp
Phe
Ile
Pro
Ala
Asp
Pro
Ile
Asn
Ltu
Tyr
Ala
Asn
Ala
315
320
325
330
Ala
Asp
Ile
Asp
Tyr
Ile
Ala
Gly
Thr
Asn
Asn
Met
Asp
Gly
His
Ile
335
340
345
Phe
Ala
Ser
Ile
Asp
Met
Pro
Ala
Ile
Asn
Lys
Gly
Asn
Lys
Lys
Val
350
355
360
Thr
Glu
Glu
Asp
Phe
Tyr
Lys
Leu
Val
Ser
Glu
Phe
Thr
Ile
Thr
Lys
365
370
375
Gly
Leu
Arg
Gly
Ala
Lys
Thr
Thr
Phe
Asp
Val
Tyr
Thr
Glu
Ser
Trp
380
385
390
Ala
Gln
Asp
Pro
Ser
Gln
Glu
Asn
Lys
Lys
Lys
Thr
Val
Val
Asp
Phe
395
400
405
410
Glu
Thr
Asp
Val
Leu
Phe
Leu
Val
Pro
Thr
Glu
Ile
Ala
Leu
Ala
Gln
415
420
425
His
Arg
Ala
Asn
Ala
Lys
Ser
Ala
Lys
Thr
Tyr
Ala
Tyr
Leu
Phe
Ser
430
435
440
His
Pro
Ser
Arg
Met
Pro
Val
Tyr
Pro
Lys
Trp
Val
Gly
Ala
Asp
His
445
450
455
Ala
Asp
Asp
Ile
Gln
Tyr
Val
Phe
Gly
Lys
Pro
Phe
Ala
Thr
Pro
Thr
460
465
470
Gly
Tyr
Arg
Pro
Gln
Asp
Arg
Thr
Val
Ser
Lys
Ala
Met
Ile
Ala
Tyr
475
480
485
490
Trp
Thr
Asn
Phe
Ala
Lys
Thr
Gly
Asp
Pro
Asn
Met
Gly
Asp
Ser
Ala
495
500
505
Val
Pro
Thr
His
Trp
Glu
Pro
Tyr
Thr
Thr
Glu
Asn
Ser
Gly
Tyr
Leu
510
515
520
Glu
Ile
Thr
Lys
Lys
Met
Gly
Ser
Ser
Ser
Met
Lys
Arg
Ser
Leu
Arg
525
530
535
Thr
Asn
Phe
Leu
Arg
Tyr
Trp
Thr
Leu
Thr
Tyr
Leu
Ala
Leu
Pro
Thr
540
545
550
Val
Thr
Asp
Gln
Glu
Ala
Thr
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Glu
555
560
565
570
Ala
Thr
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Glu
Thr
Ala
Pro
Val
Pro
575
580
585
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
590
595
600
Gly
Ala
Pro
Pro
Leu
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
605
610
615
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
620
625
630
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
635
640
645
650
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Pro
Pro
Thr
Gly
655
660
665
Asp
Ala
Gly
Pro
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
670
675
680
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
Pro
Pro
Val
Thr
Pro
Thr
685
690
695
Gly
Asp
Ser
Glu
Thr
Ala
Pro
Val
Pro
Pro
Thr
Gly
Asp
Ser
Gly
Ala
700
705
710
Pro
Pro
Val
Pro
Pro
Thr
Gly
Asp.
715
720
Текст
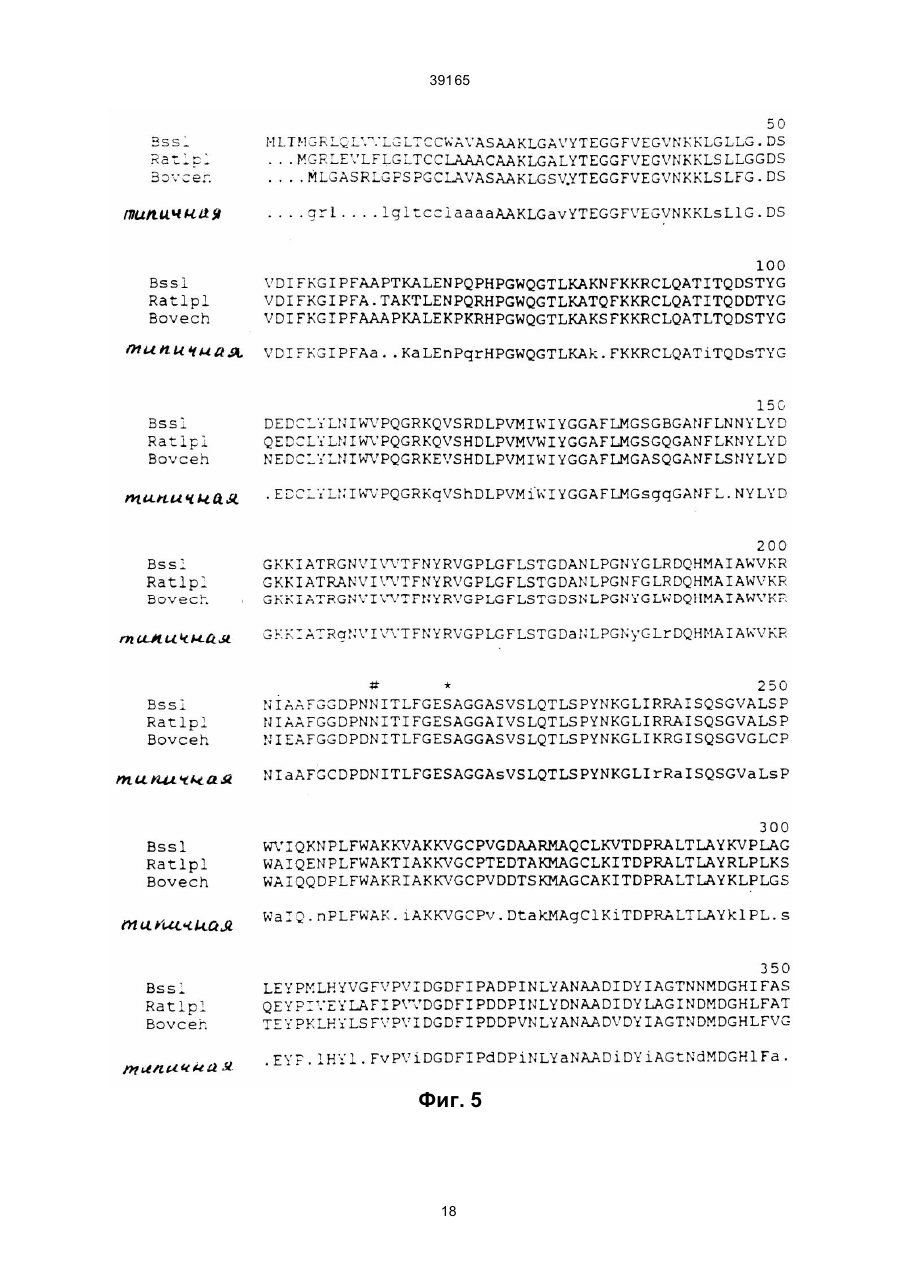
1. Молекула ДНК, кодирующая липазу человека, стимулируемую солями желчных кислот, имеющую следующую аминокислотную последовательность: (19) UA (11) 39165 (13) C2 (21) 93003780 (22) 30.05.1991 (24) 15.06.2001 (31) 9001985-2 (32) 01.06.1990 (33) SE (86) PCT/SE91/00381, 30.05.1991 (46) 15.06.2001, Бюл. № 5, 2001 р. (72) Бьюрселл Гуннар, SE, Блукберг Ларс, SE, Карлссон Петер, SE, Енербук Свен, SE, Хернелл Зоя 39165 2 39165 или ее вариант или биологический активный фрагмент. 3. Клонированная молекула кДНК или ее фрагмент, полученная из молочной железы человека, кодирующая липазу человека, стимулируемую солями желчных кислот, имеющую следующую аминокислотную последовательность: 2. Молекула ДНК по п.1, отличающаяся тем, что является кДНК. 3 39165 _______________________ Настоящее изобретение относится к новым ДНК последовательностям, к новым белкам, кодируемым такими ДНК последовательностями, и к использованию, как будет раскрыто далее, таких белков. Настоящее изобретение охватывает также такие векторы, как плазмидные конструкции, содержащие такие ДНК последовательности, способные к экспрессии целевого фер мента. Настоящее изобретение включает также организмы хозяев трансфе цированные такими конструкциями, например, дрожжевые бактерии, клетки млекопитающи х и трансгенные животные. Настоящее изобретение включает также способы получения новых продуктов настояще го изобретения. Новые белки настояще го изобретения относятся к ферменту, из вестному как липаза, стимулированная солями желчи человека. Мо лочная железа человека синтезирует и выделяет с молоком стимулируе мую солью желчи липазу (BSSL) (1), которая, после специфи ческой активации первичными солями желчи (2, 57, 58) обеспечивает эндогенную способность у вскармливаемых грудью младенцев усвоения жира в кишечнике (3–5). Этот фермент, кото рый составляет приблизительно 1% от полного количества молочного белка (6), является неспецифи ческой липазой; in vitro он гидролизует не только три-, ди- и моно-ацилглицерины, но также сложные эфиры хо лесте рина и ретинила, а также липофосфатдиглицерины (7–10). Более того, ее активность не ограничивается эмульгируемыми субстратами, но также мицеллярные и растворимые субстраты гидролизуются с та кими же скоростями (11). 4 39165 BSSL не разлагаются при прохождении с молоком через желудок, а в двенадцатиперстной кишке она защище на солями желчи от инактивации такими протеазами поджелудочной железы как трипсин и химотрипсин (2, 11). Однако, она инактиви руется при пастеризации молока, например, при нагрева нии до 62,5оС в течение 30 минут (12). Модельные эксперименты in vitro дают возможность предположить, что конечные продукты переваривания триацилглицерина различны в присутствии BSSL (5,7). Из-за низких внутрипросветных концентраций соли желчи во время младенческого периода (13, 14), это может помочь усвоению продук та (5, 15). Гидролаза сложных эфиров карбоновых кислот (СЕН) секрета поджелудочной железы человека (16) функционирует, по-ви димому, идентично, или, по крайней мере, весьма похо же на функцию BSSL (8). Они также имеют общие эпитопы, (8, 17), имеют идентичные N-терминальные аминокислотные последовательности (17) и ингибируются ингибиторами серинэстераз, например, эсерином и диизопропилфторфосфа том (6, 8, 16). Была выдвинута гипотеза, что эти два фермента являются продуктами одного и того же гена (18, 19). Наблюдающуюся разность в размерах молекул (8, 19) можно объяснить различным ходом гликозилирования, как было предложено недавно (17). Пище вые липиды являются важным источником энергии. Богатые энергией триацилглицерины составляют более чем 95% этих липидов. Некоторые из этих ли пидов, например, некоторые жирные кислоты и растворимые в жирах ви тамины составляют существенную часть питания. Перед усвоением в желудочно-кишечном тракте триацилглицеринов, а также меньших компонентов, то есть, этерифицированных растворимых в жирах витаминов и холестерина, а также диацилфосфатдиглицеринов, требуется гидролиз сложноэфирных связей до получения менее гидрофобных абсорбируемых продуктов. Эти реакции катализируются специфи ческой группой ферментов, называемых липазами. У взрослых людей наиболее важные липазы включают желудочную ли пазу, ли пазу зависимую от солипаз поджелудочной железы (три- и диацилглицерин гидролиз), панкреатиновую фосфолипазу А2 (диацилфосфатдиглицерины) и карбоксиэфиргидролазу (холестерин – и жирорастворимых витаминов сложные эфиры). У новорожденных вскармливаемых грудью стимулируемая желчными солями липаза играет существенную роль в гидролизе некото рых вышеуказанных липидов. Наряду с со лями желчи, продукты расщепления липидов образуют смешанные мицеллы, из которых и происхо дит усвоение (3–5). Функции поджелудочной железы и печени не развиты полностью при рождении, и особенно у преждевременно родившихся младенцев. Недостаточное усвоение жиров по физиологическим причинам обычно является результатом низкого содержания липазы зависимой от панкреатических солипаз и концентраций солей желчи (3, 4, 13– 15). Однако, благодаря BSSL, такое недостаточное усвоение гораздо менее часто встречается у младенцев, вскармливаемых грудью, нежели у младенцев, которым дают пастеризованное женское молоко состава для младенцев (3–5, 12, 59, 60, 61). Вот почему всегда требовалось, чтобы новорожденных, которых нет возможности кормить молоком собственной матери, кормили непастеризованным молоком других кормящи х матерей (12). В настоящее время лечение пациентов, страдающи х недостатком панкреатической липазы, состоит в оральном приеме очень больших доз неочищенного препарата свиных панкреати ческих ферментов. Панкреатическая липаза, зависящая от солипаз, инактивируется низкими значениями рН. Именно такие условия превалируют в желудке, что приводит к тому, что проглоченная липаза практически полностью инакти вируется при прохождении через желудок к кишечнику. Поэтому это не удавалось преодолеть полностью за счет приема больших доз фермента. Большие принимаемые дозы неадекватны для большинства пациентов, а препараты неочище ны и неприятны. Были приготовлены некоторые таблетки, кото рые проходят через кислотные области желудка, и высвобождают фермент только в относительно щелочном окружении тощей кишки. Однако, многие пациенты, которые страдают расстройством поджелудочной железы, имеют ненормально кислотную среду в тощей кишке, и такие таблетки поэтому не смогут высвободить фермент, и следовательно, окажутся неэффективными. Более того, так как имеющиеся на рынке препараты имеют животное происхождение, возникает риск иммунореакции, которая может оказать вредное воздействие на пациента или привести к снижению эффективности лечения. Другим недостатком этих пациентов является то, что в них содержатся и другие неуказанные липолитически активные агенты, по мимо липазы, зави сящей от солипаз. В действительности, большинство из них содержит весьма низкие уровни CEH/BSSL-активностей. Это может быть одной из причин, по кото рым многие пациенты, страдающие цистофиброзом, невзирая на дополнительное лечение, страдают от не достатка растворимых в жирах ви таминов и важных аминокислот. Таким образом, существует большая необхо димость в продук тах со свойствами и структурой полученными из липаз человека и с широкой специфичностью субстрата, причем эти продукты можно орально вводить пациентам, страдающим недостатком одного или нескольких панкреатических липолитических ферментов. Продукты настояще го изобретения удовлетворяют эту необхо димость сами по себе или в сочетании с другими липазами или в сочетании с препаратами, содержащи ми другие липазы. Более того, для некоторых младенцев существует существенная необхо димость в улучше нии усвоения жиров из обычных питательных смесей для младенцев, или пастери Обычными случаями недостаточного поглоще ния липидов, и, следовательно, недоста точного питания, являются пониженные внутрипросветные уровни липаз, зависящи х от панкреатических солипаз и/или солей желчи. Типичными примерами такого дефицита липаз являются пациенты, страдающие цистофиброзом, общегенетическими расстройствами, приводящими к сокращению жизни в 80% случаев и хро ническими панкреати тами, часто связанными с хроническим алкоголизмом. 5 39165 зованного материнского молока, из, так называемых, молочных банков. BSSL обладает несколькими уникальными свойствами, которые делают его идеально подходящим для замещающей и дополнительной терапии: он был создан по природе для орального приема. Таким образом, он устойчив при прохождении желудка и активи руется в среде тонкого кишечника. Его специфи ческий механизм активации должен предотвратить вредный липолиз пищи или липидов тканей при хранении и прохождении к месту е го действия. За счет ши рокой специфичности субстрата он потенциально способен сам по себе обеспечить полное расщепление большей части липидов пищи, вк лючая сложные эфиры растворимых в жирах ви таминов. BSSL может лучше чем липаза, зависящая от панкреатической солипазы, гидролизовать сложно-эфирные связи с длинноцепочечных полиненасыщенных жирных кислотах. В присутствии липазы желудка и при отсутствии или низком содержании липазы, зависящей от солипазы, BSSL, может обеспечить полное расщепление триацилглицерина in vitro даже если уровень солей желчи низок, как например, у новорожденных. При наличии BSSL конечные продуктов расщепления триацилглицерина становятся свободными жирными кислота ми и свободными глицеринами вместо сво бодных жирных кислот и моноацилглицеринов, кото рые образуются за счет двух др угих ли паз (5). Это может облегчить усвоение продуктов, особенно если низко содержание внутрипросветной соли желчи (13, 15). С исторической точки зрения питательный состав для новорожденных разрабатывался и усовершенствовался исхо дя из концепции, что его составы должны быть как можно ближе по составу к материнскому молоку. Же лательно дополнить эти составы. Использование для дополнения, замены или лечения липаз стимулируе мых солями желчи (BSSL), или белков с основными функциями BSSL, требует, однако, крупномасштабных количеств продукта. В промышленных масшта бах не представляется, однако, возможным полагаться на природные источники (такие как молоко) в качестве исходных материалов. Кроме указанных ранее проблем инактивации BSSL во время пастеризации, существует до полнительный риск загрязнения мате риала из природных источников, такими инфекционными агентами, как вирусы HIV и C MV. Следовательно, для крупномасштабного производства необхо димы продукты, обладающие свойствами BSSL. Настоящее изобретение обеспечивает получение таких продуктов и способы их получения. Настоящее изобретение основано на клонировании кДНК кодирующей BSSL полученный из молочной железы женщи ны. Выделена также из поджелудочной железы человека частичная кДНК кодирующая СЕН. Выделенные из кДНК человека аминокислотные последовательности и их сравнение с СЕН из други х источников, подтверждают предположение об идентичности BSSL и СЕН. Как будет подробно раскрыто далее, мы с удивлением обнаружили, что строение белка, выделенного из кДНК последовательности, совершенно отлично от строения других ли паз. Было показано, неожиданно, что его строение ближе к типичным эстеразам, таким как холинэстераза. С привлечением фиг. 2 и фиг. 7, продукты настояще го изобрете ния можно охарактеризовать как: а) белок, определяемый аминокислотной последовательностью 1-722 на фиг. 7, b) белок, определяемый аминокислотной последовательностью 1-535 на фиг. 7, с) белок, определяемый аминокислотной последовательностью 1-278 на фиг. 7, d) белок, определяемый аминокислотной последовательностью 1-341 на фиг. 7, e) белок, определяемый аминокислотной последовательностью 1-409 на фиг. 7, f) белок, определяемый аминокислотной последовательностью 1-474 на фиг. 7, g) комбинацию белков, определенную п унктами b) – f), например, как определено аминокислотными последовательностями в положениях 1278, 279-341, 279-409, 279-474, 342-409, 342-474 и 536-722, g) комбинацию белков, определенных в пункта х b) – g) в со четании с одним или более из повторов в соответствии с фиг. 5, h) белок, определенный в пунктах a) – h) содержащий, кроме того, N-терминальную аминокислоту, а именно, метионин, и функционально эквивалентные варианты и мутанты белков, определенных ранее в пунктах а) – i); Следуе т отметить, что белки по пунктам а, b, c, d, e, f, h (и i) не будут идентичны во все х отношениях природному BSSL, но они будут демонстрировать одну или более из критических функций встречающи хся в природе BSSL. Крити ческие функции приведены далее. j) ДНК последовательность кодирующая белки, определенные в а, b, c, d, e, f, h и i указанных ранее, k) ДНК последовательность в соответствии с фиг. 2, определяемая нуклеотидными номерами на фиг. 2: а) ДНК последова тельность 151-2316 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–722 на фиг. 7, b) ДНК последова тельность, по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–535 на фиг. 7, с) ДНК последовательность 151-985 по фиг. 2, кодирующая белок, определенный аминокислотной последовательностью 1–278 на фиг. 7, d) ДНК последова тельность 151-1172 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–341 на фиг. 7, е) ДНК последова тельность 151-1376 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–409 на фиг. 7, f) ДНК последовательность 151-1574 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–474 на фиг. 7, g) сочетания белков, определенных по пунктам b) – f), например, определенных аминокислотными последовательностями в положениях 1-278, 279341, 279-409, 279-474, 342-409, 342-474 и 536-722, h) ) сочетания белков, определенных по пунктам b) – g), в сочетании с одним или более из повторов в соответствии с фиг. 5, 6 39165 i) белок, определенный по пунктам а) – h), содержащий дополнительно N-терминальную аминокислоту, а именно, метионин, и функционально эквива лентные варианты и мутанты белков, определенных в п унктах а) – i) ра нее. Следуе т отметить, что белки по пунктам a, b, c, d, e, f, h и i не будут полностью идентичны природному BSSL, но в них будет содержаться одна или более из критических функций природного BSSL. Критические функции приводятся далее. j) ДНК последовательность, кодирующая белки по пунктам a, b, c, d, e, f, h и i; k) ДНК последовательность по фиг. 2, определенная следующими нуклеотидными последовательностями под номерами на фиг. 2: а) ДНК последова тельность 151-2316 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–722 на фиг. 7, b) ДНК последова тельность 151-1755 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–535 на фиг. 7, с) ДНК последовательность 151-985 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–278 на фиг. 7, d) ДНК последова тельность 151-1172 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–341 на фиг. 7, е) ДНК последова тельность 151-1376 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–409 на фиг. 7, f) ДНК последовательность 151-1574 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 1–474 на фиг. 7, g) ДНК последова тельность 986-1172 по фиг. 2, кодирующая белок, определяемый аминокислотными последовательностями 279-341 на фиг. 7, h) ДНК последова тельность 986-1376 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 279-409 на фиг. 7, i) ДНК последова тельность 986-1574 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 279-474 на фиг. 7, j) ДНК последовательность 1173-1376 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 342-409 на фиг. 7, k) ДНК последовательность 1173-1574 по фиг. 2, кодирующая белок, определяемый аминокислотной последовательностью 342-474 на фиг. 7. Существенные черты белков настоящего изобретения: а) пригодны для орального вве дения, b) акти вируются специфи ческими солями желчи, с) действуют как неспецифи ческая липаза в содержании тонких кишок, то есть способны гидролизовать липиды относительно независимо от их хи мического строения, и фи зического состояния (эмульсии, мицелий, раствор), d) способны гидролизовать триацилглицерины с жирными кислотами различных длин цепей и с различной степенью ненасыщен ности, е) способны гидролизовать также диацилглицерины, моноацилглицерины, сложные эфиры хо лесте рина, лизофосфатдиацилглицерин, ретинил и другие сложные эфиры витаминов растворимые в жирах, f) способны гидролизовать не только Sn-1/3/ сложно-эфирные связи в триацилглицерине, но также Sn-2 сложно-эфирные связи, g) способны взаимодействовать не только с первичными, но и с вто ричными солями желчи, h) их оптимальная активность зависит от солей желчи, i) они настолько стабильны, что желудочный сок существенно не влияет на их каталитическую эффективность, j) их стабильность не нарушается под действием протеаз поджелудочной железы, например, трипсина, при условии присутствия солей желчи, k) способны связываться с гепарином и производными гепарина, например, сульфатом гепарина, l) способны связываться с межфазой липецвода, m) стабильны при лиофилизации, n) стабильны при смешивании с такими составляющи ми пищи, как материнское молоко или молочные структуры. Крити ческими функциями для дополнения, замены или терапии являются функции по пунктам а, c, d, e, f, i, j и l. Для др угих це лей могут понадобиться не все критические функции. Для экспрессии указанных ранее белков соответственные указанные ранее ДНК последовательности нужно встроить в подхо дящий вектор, который затем вводят в подхо дящий организм-хозяин. Указанный вектор должен также содержать соответствующий сигнал и другие последовательности, обеспечивающие экспрессию целевого белка этим организмом. Организмы, подходящие для экспрессии: С помощью методик рекомбинантных ДНК возможно клонировать и осуществлять экспрессию целевого белка в различные прокариотные и эукариотные организмы-хозяева. Возможными для экспрессии орга низмами являются бакте рии, простые эукариоты (дрожжи), клеточные культуры животных, клеточные культуры насекомых, клеточные культуры растений, растения и трансгенетические животные. Каждая отдельная система имеет свои собственные конкретные преимущества и недостатки. Короче говоря, каждый подлежащий экспрессии ген представляет отдельную проблему, и не существуе т стандартных решений. Обычно используют такие системы бакте рий, как: E. coli, Bacillus Subtilis, Streptomyces. Обычно используют такие дрожжи как Saccharomyces и Pichia Pastoris. Обычно используют та кие клетки животных, как СНО и COS. В качестве клеточных культур насекомых используют клетки, полученные от мухи дрозофи лы. Из растений обычно используют растение табака. Возможными трансгенными животными являются козы и коровы. Возможные бакте риальные векторы представлены рVC и белком А. Возможный дрожжевой вектор представлен рМА 91. Возможные векторы насекомых получены из Baculo-вирусов. Возможные векторы клеток животных получены из SV/40. Возможные векторы расте ний получены из Ti-плазмид. В каждой систе 7 39165 ме можно использовать как природные, так и синтетические промоторы и терминаторы. Следуе т учи тывать, что в зависимости от выбора системы экспрессии, экспрессируе мый протеин может содержать дополнительную N-терминальную аминокислоту (метионин), содержать несколько дополнительных аминокислот или может быть сплавлен с гетерологичным белком (например, белком А) или отличаться от нативного белка при гликозилирова нии. Более того, векторы могут также содержать сигнальные последовательности, определяющие экспорт белка в периплазму или в к ультуральную среду. Таким образом, следующи ми аспектами изобретения будут: а) вектор, содержащий ДНК последовательность, кодирующую бе лок, как указано ранее, b) организм-хозяин, содержащий ДНК последовательность, как указано ранее, с) способ получения белка, как указано ранее, за счет выращи вания организма-хозяина содержаще го вектор, как указано ранее в пункте а), и выделения белка. Способы очистки зависят от используе мых систем экспрессии (например, белок A(IgG) и/или используют способы очистки природных фер ментов, как указано в ссылке 6. Дополнительные аспекты настояще го изобрете ния: – фармацевтическая композиция, содержащая белок, как указано ранее, – использование белка, определенного ранее для изготовления медикаментов для лечения патологических состояний, связанных с экзокринной недоста точностью панкреати на, – использование определенного ранее белка для изготовления медикаментов для ле чения цистофиброзов, – использование определенного ранее белка в качестве добавки к питательным смесям для младенцев, – использование определенного ранее белка для изготовления медикаментов для ле чения хронических панкреатитов, – использование определенного ранее белка для изготовления медикаментов для ле чения недостаточного усвоения жиров любой этиологии, – использование определенного ранее белка для изготовления медикаментов для ле чения недостаточного усвоения растворимых в жирах витаминов, – использование определенного ранее белка для изготовления медикаментов для ле чения недостаточного усвоения жиров по физиологическим причинам, например, у но ворожденных. ДНК последовательность на фиг. 2, начиная с положения 151 и до (и включая) положения 2316, представляет собой последовательность, кодирующую полный белок. Последовательность с положения 2317 до (и включая) положения 2415 не транслируется в белок, но она включена в экзон d, идентифицированный далее в таблице 2. В одном из вариантов изобретения белок, определенный ранее в пунктах а) – i), получают в выделенном виде и/или в практически чистом виде. ДНК последовательности, определенные в пункта х а) – k) ранее представляют собой один из вариантов изобретения, и получаются в выделенном виде и/или практически чистом виде. Экспериментальная часть Сокраще ния в тексте: аа – аминокислота, bp – пары оснований, BSSL – липаза, стимулированная солями желчи, с-АМР циклический аденозинмонофосфат, СЕНгидролиза сложного эфи ра карбоновой кислоты, Да – дальтон, с 7GTP –7-деаза-2-деоксигуанозин5'- трифосфат, ЕДТА – эти лендиаминтетраацетат, кb – кило-пары оснований, MOPS – 3-N-морфо линопропансульфо кислота, nt – нуклеотид, PAGE – электрофорез на полиакриламидном геле, SDS – натрийдодецилсульфат, SSC – цитрат NaCl, xGal – 5-бром-4-хлор- 3-индолил-b-Д-галактопиранозид. Ферменты: Липаза стимулированная солями желчи – ЕС 3.1.1.3. Гидролаза сложного эфи ра карбоновой кислоты ЕС 3.1.1.3. Ма териалы и способы: А. Ферменты и получение антител. BSSL очищают из материнского молока как описано ранее (6). Если его используют для получения антител, фермент очищают дополнительно с помощью SDS–PAGE. Полосу белка соответствующую липазе после подкраши вания Coomassic Brilliant blue электроэлюируют из ге ля. 25 мкг очищенного фер мента вместе с эквивалентным объемом полного адъюванта Freund используют для первой подкожной инъекции, и такое же количество фер мента с не полным адъювантом для последующи х ежемесячных бустерных инъекций. У кроликов брали кровь спустя две недели после каждого бусте ра, приготавливали сыворотку и хранили ее при –20оС. В. Получение триптик-фрагментов и анализ аминокислотной последовательности. 3 мг очищенного BSSL растворяют в 1 мл 0,1 М Трис-Cl буфере, рН 8,5, содержаще м 6М гуанидингидрохлорида и 2 мМ ЕДТА. Добавляют дитиоэритритол до 5 мМ. После инкубирования при 37оС в течение 2 часов добавляют 300 мкл 50 мМ иодацетата. После 90 минут инкубирования при 25оС в темноте восстановленный и карбоксиметилированный фермент обессоливают на колонке с Sephades G-25, уравновешенной 0,5 М бикарбонатом аммония. 30 мкг тозил-L- фенилаланинхлорметаном обработанного бычьего трипсина (Worthington diagnostic System Inc., Triehold, NJ, USA) добавляют перед лиофи лизацией. Лиофи лизированный белок растворяют в 4 мл 0,1 М бикарбоната аммония, и добавляют дополнительно 90 мкг трипсина. После 5 часов инкубирова ния при 37оС белок снова лиофилизируют. Трипсиновый перевар растворяют в 0,1% трифторуксусной кислоте (2 мг/мл). 300 мкг обработанного трипсином BSSL хроматографируют на высокоэффективном жидкостном хроматографе, используя колонку с С18 обращен ной фазой и элюируя с градиентом 0– 50% ацетонитрила в 0,1% трифторуксусной кислоте. Сбор белка непрерывно контролируют, за писывая поглоще ние на 214 нм. Белки, подлежащие секвенированию очищают да лее повторным хроматографированием на той же колонке с установленными градиентами. 8 39165 Образцы белковых фрагментов подлежащих секвенированию сушат в атмосфе ре азота для уда ления ацетонитрила и вводят в секвенсор. Для анализа N-терминальной последовательности нативный BSSL растворяют в 0,1% уксусной кислоте. Анализ последовательности осуществляют на жидкофазном импульсном секвенаторе Applied Biosystem Inc., 477А и на встроенном РТН 120А анализаторе с регулярной циклической программой и препаратами от изгото вителя. Начальный и повторные выхо ды, рассчитанные из секвенированного стандартного протеина, b-лактоглобулина составляют 27 и 97% соответственно. С. Выделение РНК. Образцы жировой ткани поджелудочной железы и молочной железы человека были получены во время операций и немедленно помеще ны в гуанидинтиацианат (1–5 г в 50 мл). Полную РНК экстрагировали по способу Chirgwin (20). Поли(А)-РНК получают хро матографи чески на колонке с олигодеокситимидилат/олиго/ДТ/ /-целлюлозой (21). Д. Конструи рование и скринирование кДНК библиотек. Приблизительно 15 мкг полиаденилированной РНК из поджелудочной железы человека денатурируют гидроксидом метилртути (22) и примируют олиго (дТ)12–18 праймерами (Рharmacia, Uppsala, Sweden), и подвергают обратной транскрипции по способу (23). Синтез вто рой нити ве дут по способу Gubber and Hoffman (24), но только опускают ДНК лигазу и b-N AD, и температуру реакции устанавливают при 15оС. Избыток РНК переваривают РН Казой А (50 мкг/мл), а двунитевую кДНК обрабатывают ЕсоR1 метилазой (25). Концы ослепляют ферментом Кленова. После лигирования с ЕсоR1 линкерами и расщепления EcoR1 кДНК фракционируют на колонке чс Sepharose 4В-С1. Фракции вредного объема осаждают этанолом, и кДНК лигируют в ЕсоR1 сайт gt 11 вектора обработанного фосфатазой (26). Упаковка in vitro дает более 7х105 рекомбинант. Библиотека кДНК молочной железы женщины, полученная от женщи ны на восьмом месяце беременности, была получена (Clontech Lboratories, Inc., Palo Alto, CA; USA). Фаги из кДНК библиотек помеща ли на 120мм пластины в количестве 5х104 ед. Ан тисыворотку разбавляли до отношения 1:3200, и скринирование вели по способу Янга и Дэвиса (27). Щелочно-фосфатазный конъюгат козел-анти-кролик антител использовали в качестве вторых антител (Bio-Rad, Richmond, CA USA). С выделенными клонами соответствующи ми 5'-концу иРНК гибридизацию нуклеиновой кислоты проводили в стандартных условиях (23), используя субклонированный фрагмент из одного из иммунопозитивных клонов в качестве зонда. Е. РНК анализ. Электрофо рез проводят на 1% агарозном геле в 40 мМ МОPS буфера, рН 7,0 после денатурации глиоксалем и диметилсульфоксидом (28). Затем глиоксилированную полную РНК переносят на нитроцеллюлозные фильтры (29). Блоты зондируют субклонами BSSL и СЕН рекомбинант, которые были мечены способом олигометок (30). Прегибридизацию и гибридизацию проводят 50% формамидом при 46оС (23). Постгибридизацион ные промывки осуществляли при высоких эффективностях (0,1% SDS и 0,1 х SSC при 60оС). (1 х SSC, 0,15 М NaCl, 0,0015M Na 3 цитрат, рН 7,6). кДНК вставки из BSSL и СЕН рекомбинант были либо непосредственно клонированы в МЗмр18 и мр19 после обработки ультразвуком и фракционирования по размерам или некото рые из них были далее субклонирова ны в pTZI9R после переваривания PS т1, BS тХ1, N аг1, S ма1 и Aha11. Нуклеотидную последовательность определяли с помощью дидеоксицепитерминантного способа (31). Богатые GC повторы (см. далее) также были секвенированы Taq1 полимеразой и dc 7 GTP. Были секве нированы обе нити. Информацию по секвенированию получили из авторадиограммы с применением программ MS-EdSeq описанных Sjoberg еt.аl. (55). G. Предсказания и гомологи аминокислотной последовательности. Для предсказания соответствующей аминокислотной последовательности кДНК вставок сравнивали с помощью кодона различные считывающие рамки по Стадену, и получили одну открытую счи тывающую рамку (32). По программам UW GCG (33) провели поиск гомологов. Результа ты и обсуждения: А. Последовательности триптик-фрагментов и N-конца BSSL. Трипсиновый перевар очищенных BSSL приводит к получению приблизительно 50 фрагментов, о чем можно судить по количеству пиков, полученных с помощью высокоэффективной жидкостной хроматографии (фиг. 1). Пики собирают, и показательные пики, которые могут быть выделены с высокой степенью чистоты и в разумных количествах, секвенируют. Полученные последовательности представлены в таблице 1. Кроме того, 30 наиболее N-терминальных остатков также секвенируют (фиг. 11), и они подтверждают описанную ранее последовательность Abonakil et. al (30 остатков) (17). 22 оста ток длинно N-терминальной последовательности по данным Wang and Johnson (34) является в нашем сообще нии глицином, и у Wang and Johnson он описан как лизин. В. Нук леотидная последовательность BSSL. Для конструи рования lgtII кДНК библиотеки были использованы полиаденилированные РНК из поджелудочной железы человека. Вначале выделили 4 иммунопозитивных клона, а затем библиоте ку кДНК экспрессии поджелудочной железы скринировали с анти сывороткой против BSSL. Анализ нуклеотидных последовательностей четырех клонов показал, что они находятся в прекрасном соответствии, и соответствуют 3' концу иРНК. Все они начинаются с поли А хвоста и отличаются только по длине; причем наиболее длинная вставка обозначенная АСЕН содержит 996 пар оснований. кДНК библиотек из молочной железы женщи ны скринируют с ан тисывороткой, и панкреатическим клоном АСЕН в качестве зонда. В обоих скринирования выделяют положительные клоны, которые все начинаются с 3' конца. Самый длинный клон молочной железы, обозначенный ABSSL, достигает 2100 пар оснований в обратном направлении. Он содержит четыре из секвениро 9 39165 ванных триптик-фрагментов (фиг. 2), но не включает N-терминальную аминокислотную последовательность. Для распространения последовательности за трансляционный старт, библиоте ку кДНК молочной железы повторно скринировали с зондом длиной 118 пар оснований, полученным из большей части 5' проксимальной ABSSL. Выделяют один клон, которые продолжает дальнейшие 328 нуклеотидов в обратном направлении. Он совмещает N-терминальную аминокислотную последовательность, и содержит остальной триптикфрагмент. Как показано на фиг. 2, кДНК имеет длину 2428 нуклеотидов и содержит 81 пару оснований в обратном направлении от первого ATG кодона. Сигнал полиаденилирования, ААТААА расположен на 13 нуклеоти дов в обратном направлении от поли А хвоста, а терминальный кодон TAG, как было обнаружено, содержится у 2317 нуклетида, и после него следует 3' нетранслируе мый участок 112 bp. Богатый GO участок, содержащий 16 повторов 33 оснований, был обнаружен в 3'-конце последовательности между основаниями 1756 и 2283. Нуклеотидная последовательность повтора, представленная на фиг. 3, состоит из 6 идентичных повто ров, окруженных 10 повторами с различными количествами заместителей, кото рые возможно возникают после нескольких дупликаций. Небольшое количество замеще ний предполагает, что эти повторы возникли позднее во время эволюции. С. Тканевое распределение экспрессии. РНК из молочной женской железы, поджелудочной железы, жировой ткани и клеточной линии гепатомы (Нер G2) анализируют Нозерн-блоттингом. Размер мессенджера оказался приблизительно 2,5 кb как для молочной железы, так и для поджелудочной железы. В линиях с РНК, экстрагированными из Hep G2 или жировой ткани (фиг. 4), сигнал не обнаружен. Так как иРНК, использованную для библиотеки молочной железы, получали от женщин на 8 месяце беременности, очевидно, что транскрипция и возможно трансляция гена BSSL начинается до родов, в соответствии с ранее обнаруженной секрецией BSSL до родов (35). См. фиг.4. D. Аминокислотная последовательность BSSL. По данным SDS-PAGE молекулярная масса составляет 107–125 кДа (8,36), а по данным аналитического ультрацентрифугирования, составляет 105 кДа (37). Фермент, что следует из кДНК, состоит из 722 аминокислотных остатков (фиг. 2), что дает молекулярную массу 76,271 Да, что указывает на то, что фермент содержит, по крайней мере, 15–20% углеводородов. Лидерная последовательность содержит 23 остатка. Предполагаемый активный сайт серинового остатка локализован по серину 217 (фиг. 5). Последовательность вокруг это го серина соответствует активному сайту последовательности серин-гидролазы (38). Недавно было высказано предположение, что основные остатки, нахо дящиеся вблизи активного сайта серина, могут быть вовлечены в отщепление ацилглицериновых сложноэфирных связей липазами (39). Интересно отметить, что та ких остатков нет в BSSL. Единственный предполагаемый сайт N-гликозилирования расположен только в семи ос татках от серина. Степень гликозилирования (6, 16) предполагает, что фермент содержит О-связанный углеводород. Существует множество сайтов, по которым может происхо дить такое гликозилирование. Композиция аминокислот в расчете на очищенный фермент демонстрирует высокое содержание пролиновых остатков (6). Аминокислотная последовательность, полученная из кДНК, подтверждает это. Более того, большая часть пролиновых остатков локализована в 16 повторах по 11 остатков каждый, составляющи х основную часть С-терминальной половины фермента. Е. Сравнение ферментов молочной железы (BSSL) и поджелудочной железы (СЕН). BSSL женского молока и СЕН поджелудочной железы человека, как было ранее показано, аналогичны, если не сказать идентичны. Имеющиеся данные дают существенное подтверждение тому, что эти два фер мента являются продуктами одного и того же гена. Нуклеотидная последовательность кДНК клонов показывает, что панкреатический клон АСЕН идентичен клону молочной железы АBSSL из поли А хвоста и 996 оснований по направлению к 5' концу, включая последовательность, кодирующую богатые пролином повторы. Нозерн-блоттинг дает одну полосу 2,5 кb в РНК для панкреатитной и молочной желез (фиг. 4). Геномный Саузерн-блоттинг далее подтверждает идею, что только один ген кодирует BSSL и СЕН. Разницу в подвижностях BSSL и СЕН при SDS-PAGE можно объяснить как следствие различного гли козилирования или различного сплайсинга. Близкость BSSL к ферментам крыс и коров (см. далее) и к результатам геномных блоттов подтверждает возможность того, что различный сплайсинг не может отвечать за различия в подвижности. Так как С-терминальная последовательность не была подтверждена на белковом уровне, маловероятно, что СЕН может быть включена протеолитическим расщеп лением в С-терминальном конце. Насколько нам известно, панкреатичные ферменты, которые очевидно соответствуют СЕН, часто называли по видам и конкретным субстратам, которые использовали для определения их соответствующи х активностей; лизофосфо липазой, холестеринэстеразой, стиролэстергидролазой, неспецифической липазой, липазой сложного эфи ра карбоновой кислоты и гидролазой сложного эфи ра холестерина. Доступные данные совместимы с представлением того, что все эти активности заключены в одной функции (42, 43). Это иллюстрирует ши рокую специфичность субстрата, и дает возможность охарактеризовать их как неспецифические липазы. При сравнении последовательности BSSL (СЕН человека и последовательности лизофосфолипазы из жира поджелудочной железы (40) и холестеринэстеразы из поджелудочной железы быка (41), обнаруживается значительное сходство на протяжении около 530 остатков от Nконца (фиг. 5); но они различаются в той части молекулы, где наблюдаются повторы. У фермента крыс только четыре повто ра, а у фермента быка – три. Следовательно, фермент человека представляет собой значительно более длинный белок. Более того, уди вительное сходство было обнаружено между BSSL и множеством типичных 10 39165 эстераз, например, ацетилхолинэстеразами из различных видов, включая человека и Дрозофи лу, а также карбоксилэстеразами (фиг. 6). Эти участки сходства ограничиваются N-терминальными 300 остатками BSSL, которые включает предположительный сайт остатка серина. Сходство с ацетилхолинэстеразой было предсказано из того факта, что BSSL ингибируется типичными ингибиторами холинэстеразы (6, 8, 16). За возможным исключением карбоксилэстеразы печени крысы (45), ни один из этих похожих ферментов, как было показано, не имеет такой же зависимости от солей желчи, как у BSSL; это дает возможность предположить, что структур ная основа для этих свойств заключена в С-терминальной части белка. Более того, BSSL может эффективно атаковать эмульгированные субстраты, что не соответствует известным характеристикам аналогичных эсте раз. Необхо димым условием для той активности является соль желчи. Предсказанную последовательность для BSSL человека сравнивали с другими хорошо известными липазами млекопитающи х. Кроме согласующейся последовательности вокруг активного сайта серина (G-X-S-X-G) не было обнаружено очевидного сходства (44). В дополнении к сходству с др угими ферментами, существуют также значительные аналоги с одним с-АМР зависимым белком из Dictyostelium hiscoideum (46), а также с тироглобулином от различных видов (фиг. 6) (47–49). Такое сходство между BSSL и ти роглобулином, которое включает участок активного сайта, но не сам активный сайт, указывает на то, что эти участки аминокислот имеют гораздо большее значение нежели просто поддерживающее фер мента тивную активность эстераз. В заключение можно сказать, что BSSL материнского молока состоит из 722 аминокислотных остатков. Имеющие ся данные четко указывают, что его белковая цепь идентична цепи панкреатичной СЕН, и они кодируются тем же самым геном. Самым серьезным доказательством является то, что идентичны из 3 – концы и их N-терминальные аминокислотные последовательности. Удивительная гомологичность, обнаруженная для панкреатической лизофосфолипазы крыс и панкреатической холестеринэстеразы быка, поддерживает гипотезу о функциональной идентичности этих ферментов. Однако, как и предполагалось, различные размеры молекул, обнаруженные среди видов, не связаны с различиями только в гликозилировании; вместо это го они отражают различное количество повторов одиннадцати аминокислот. Сходство последовательностей активный сайтов между этими эстеразами предполагает, что они получены из обще го гена-предшественника. Ниже приводятся объяснения фиг. 1–7. Фиг.1: pазделение BSSL с помощью высокоэффективной жидкостной хроматографии. определяют их аминокислотные последовательности. Фиг. 2: кДНК нуклеотидная последовательность и уста новленная аминокислотная последовательность для липазы, стимулированной солью желчи человека. кДНК имеет длину 2428 оснований. N-терминальная 23-кодоновая последовательность (nt 82– 150) начинающаяся с ATG, ин терпрети руется как лидерный белок, так как N-терминальная аминокислотная последовательность зрелого белка начинается у кодона 24 (нт 151 А1а). Этот лидерный белок подчеркнут. Знак звездочки указывает стартовую точку экзона. Значок # указывает, стартовую точку повторяющей части. Фиг. 3: н уклеотидная последовательность Стерминальных GC-богатых повторов в липазе стимулированной солями желчи. Заместители обозначены *. Фиг. 4: но зерн-блотт гибридизация. Нозерн-блоттинг полной РНК, выделенной из молочной железы женщи ны, поджелудочной железы, жировой ткани и клеточной линии гепатомы человека (Нер G2). Полные TNA (10 мкг) из жировой ткани (lane C) и HepG2 (lane Д) были подвергнуты электрофо резу в 1% агарозном геле в 40 мМ МОРS буфе ра при рН 7,0 после денатурирования РНК в 1М глиоксале, 50% диметилсульфоксиде и 40 мМ MOPS. Затем глиоксилированную РНК перенесли на нитроцеллюлозную бумагу для гибридизации [32P] меченой BSSL кДНК /АBSSL/. Фиг. 5: сравнение определенной аминокислотной последовательности в BSSL материнского молока, панкреати ческой лизофосфолипазы крыс (Рат1р1) (4) и панкреатической холестеринэстеразы быка (Bovceh) (41). Сериновые остатки включенные в активный сайт обозначены *, а знаком # обозначается единственный возможный сигнал N-гликозилирования белка. Прямые повто ры аминокислотных последовательностей заключены в рамки. Совместимые последовательности обозначены заглавными буквами, совместимые последовательности для двух ферментов обозначены маленькими буквами, а несовмести мые точкой. Фиг. 6 : сравнение первичных структур BSSL с другими эстеразами, тироглобулином и одним сАМР зависимым ферментом из Dictiostelium discoideum. BSSL: липаза стимулированная солями желчи человека; Cheshum: холинэстераза из тканей беременной женщины (50), Torpace: ацетилхолинэстераза от Torpedo marmorata (51), Drosceh: гидролиза сложного эфи ра карбоновой кислоты от Drosophila melaogaster (52), Ratli vce: карбоксиэсте раза из печени крыс (53), D rosace: аце тилхолинэсте раза от Drosophila melagaster (54), Th yrhum: тироглобулин чело века (49) и Dici. Di: сАМР за висимый фер мент от Dictiostelium discoideum (46). Существует 7 раз личны х до менов, кото рые демонстрируют схо дство между фер мента ми. В рамки заключены фер менты , кото рые идентичны, а мелкими буква ми в согласующи хся последова тельностя х ука заны идентичные оста тки во все х фер мента х, кроме одного. Точками указаны несогла сования. Серино Очищенный BSSL обрабатывают трипсином и хроматографи руют на высокоэффективном жидкостном хроматографе в соответствии с описанием в разделе Материалы и Мето ды. Указанные пики собирают и подвергают дополнительной очистке повторной хроматографи ческой обработкой и 11 39165 вый оста ток включает акти вный сайт, кото рый обозначен *. Рисунок в правом углу показывает, как ориенти рова ны домены. ный код) и указывает эксоны, a, b, c и d. Значок # указывает старто вые точки повторяющей ся части. Из-за перекрывающихся пиков не удалось провести положительную идентифи кацию остатка в циклах 1 и 2 секвенирования в белке номер 26. Номера пептидов относятся к пикам на фиг. 1. Фиг. 7 показывает аминокислотную последовательность 1-722 для полного белка (однобуквен Таблица 1 Аминокислотная последовательность BSSL белка Tрипсиновые фрагменты TP16:LysValThrGluGluAspPheTyrL ys TP19:GlyIleProPheAlaAlaProThrLys Tp20:LeuValSerGluPheThrIleThrLys TP24:ThrTyrAlaTyrLeuPheSerHisProSerArg TP26:PheAspValTyrThrGluSerTrpAlaGlnAsp ProSerGlnGluAsnLys Таблица 2 Идентифи кация эксонов a, b, c и d пронумерованных в соответствии с фиг. 2 и 7 Экзон а b c d Полный белок Полный белок без повторов Положение между нуклеотидами номер между аминокислотами номер 986–1172 1173-1376 1377–1574 1575–2415 151–2316 151–1755 279–341 342-409 410–474 475–722 1–722 1–535 Фиг. 1 12 39165 Фиг. 2 13 39165 Фиг. 2 (продолжение) 14 39165 Фиг. 2 (продолжение) 15 39165 Фиг. 2 (продолжение) 16 39165 Фиг. 3 Фиг. 4 17 39165 Фиг. 5 18 39165 Фиг. 5 (продолжение) 19 39165 Фиг. 6 20 39165 Фиг. 6 (продолжение) 21 39165 Фиг. 6 (продолжение) 22 39165 Фиг. 7 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 23
ДивитисяДодаткова інформація
Назва патенту англійськоюDna molecule coding humans lipase stimulated by bile acids salts, cloned cdna molecule
Автори англійськоюBJURSELL GUNNAR, BLAECKBERG LARS, Karlsson Peter, ENERBAECK SVEN, Hernell Olle, Nilsson Genette, Olivecrona Thomas
Назва патенту російськоюМолекула днк, которая кодирует липазу человека, стимулируемую солями желчных кислот, клонированная молекула кднк
Автори російськоюБьюрселл Гуннар, Блукберг Ларс, Карлссон Петер, Энербук Свен, Хернелл Олле, Нилссон Женетт, Оливекрона Томас
МПК / Мітки
МПК: A61P 1/00, C12N 15/09, A61K 38/46, A23L 1/30, C12N 15/55, C07K 14/00, A61K 38/00, A61P 3/06, C12N 9/18
Мітки: жовчних, кислот, стимулюється, людини, кднк, кодує, клонована, днк, ліпазу, солями, молекула
Код посилання
<a href="https://ua.patents.su/23-39165-molekula-dnk-shho-kodueh-lipazu-lyudini-shho-stimulyuehtsya-solyami-zhovchnikh-kislot-klonovana-molekula-kdnk.html" target="_blank" rel="follow" title="База патентів України">Молекула днк, що кодує ліпазу людини, що стимулюється солями жовчних кислот, клонована молекула кднк</a>
Попередній патент: Елемент насадки
Наступний патент: Похідні n-гідроксисечовини, що є інгібіторами ліпоксигенази у ссавців, спосіб їх одержання і спосіб інгібування ліпоксигенази у ссавців
Випадковий патент: Низьколегована високоміцна сталь та її застосування