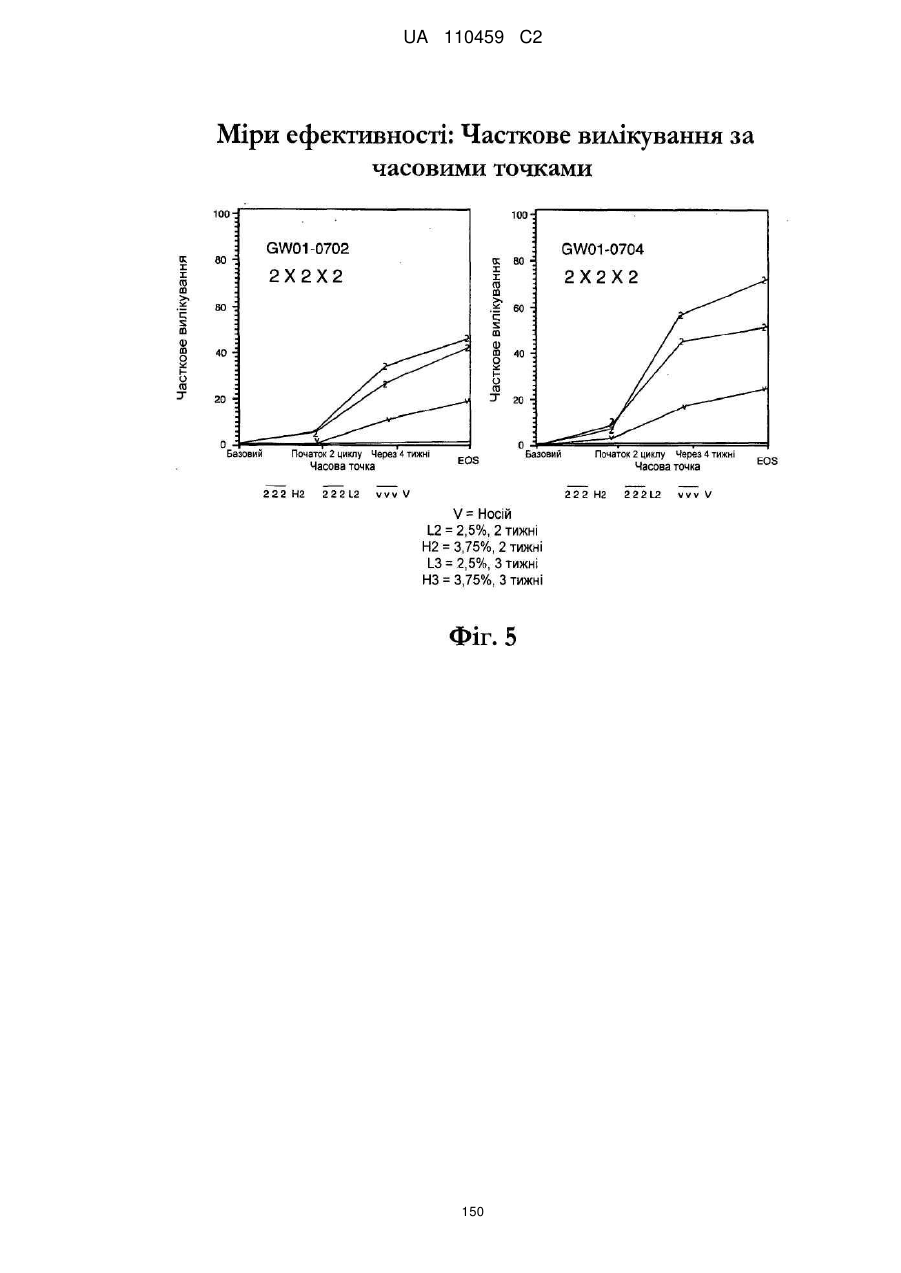
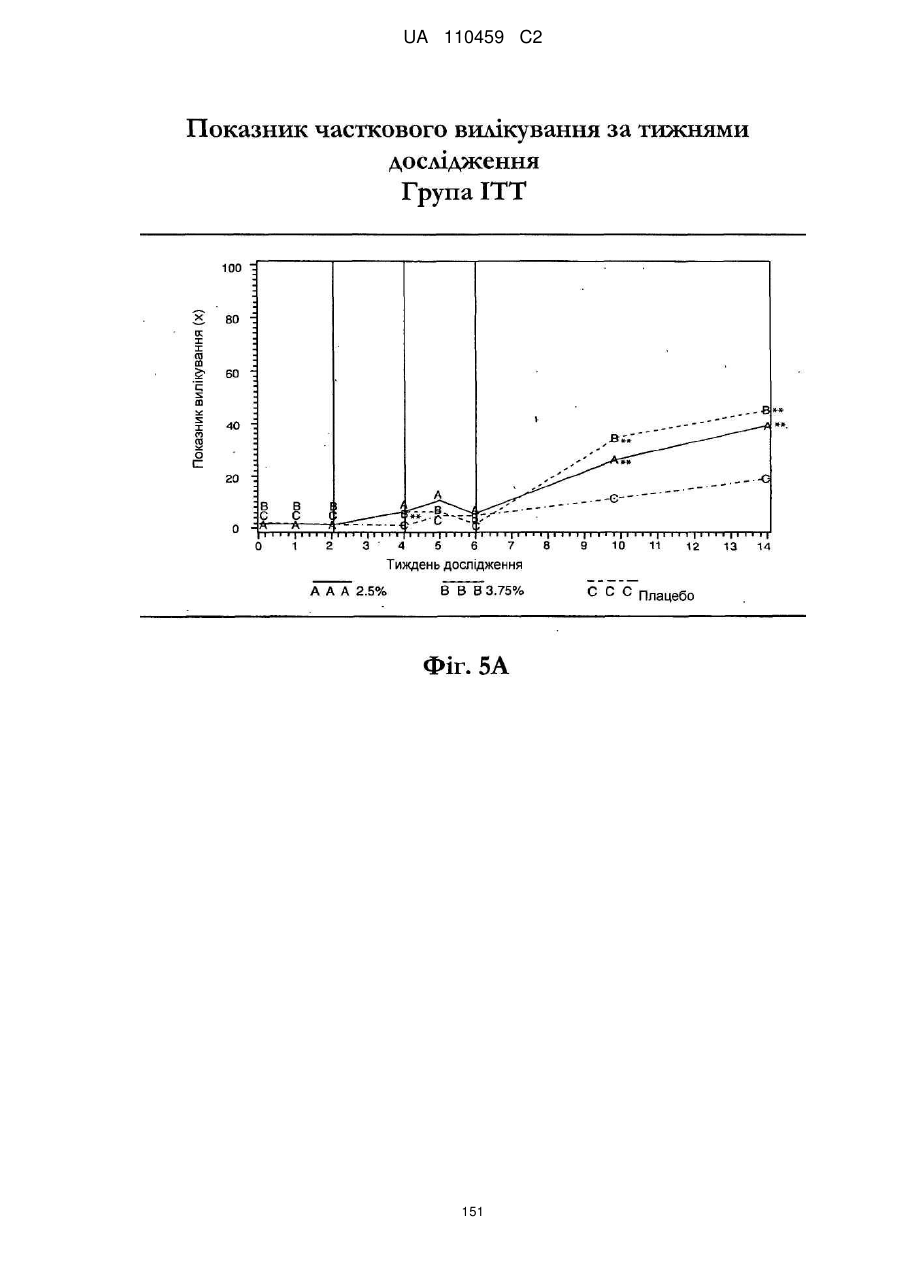
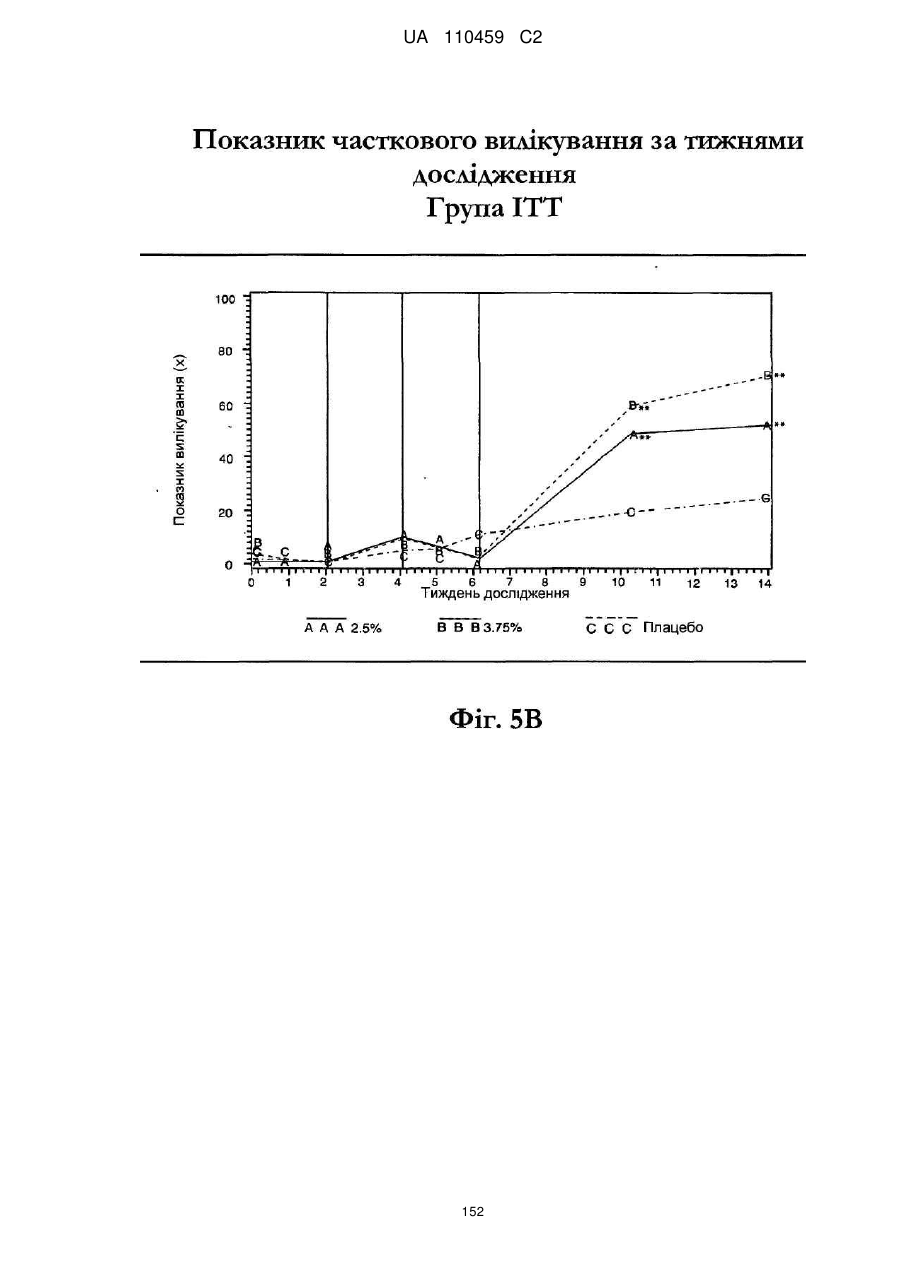
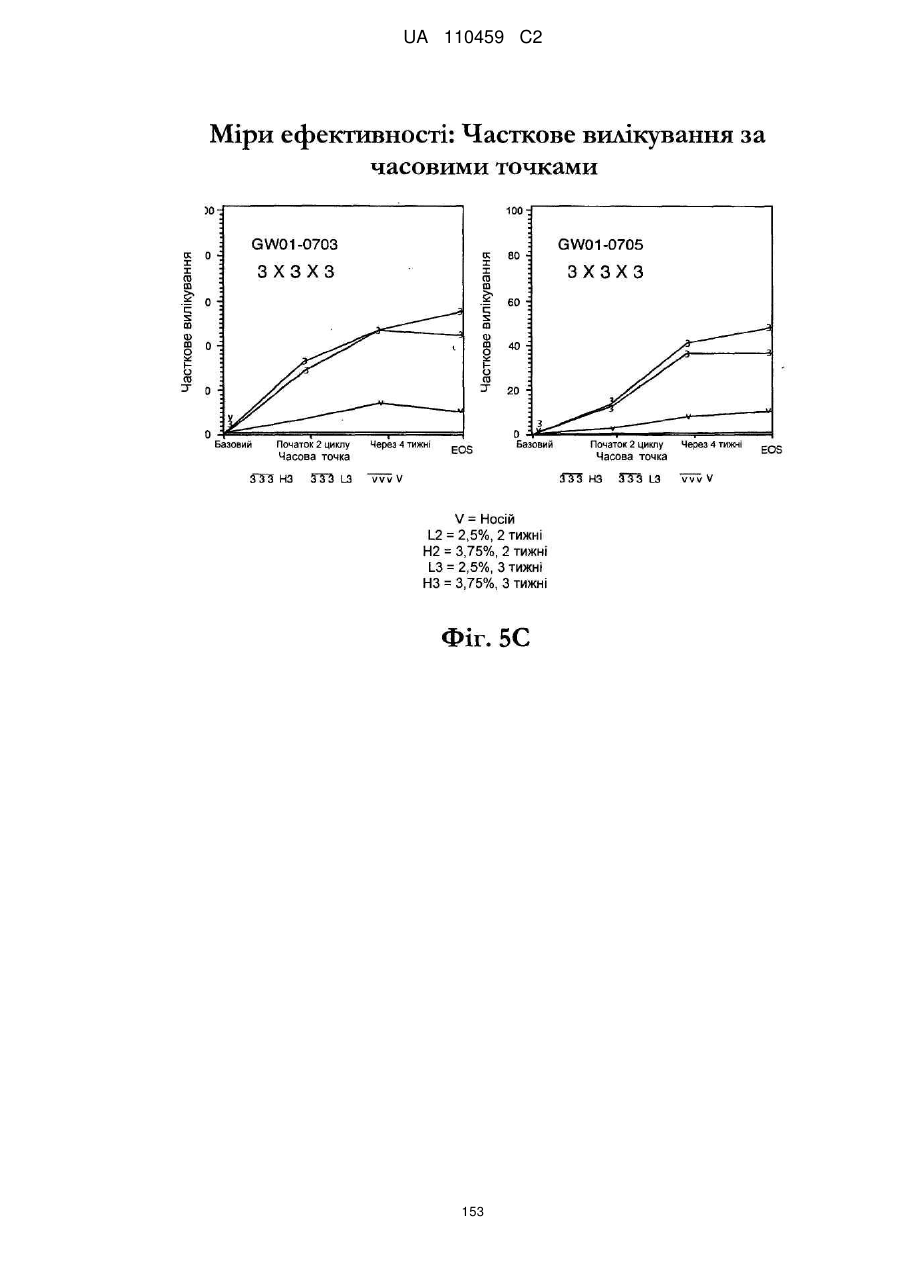
Композиція іміквімодного препарату і спосіб лікування актинічного кератозу
Номер патенту: 110459
Опубліковано: 12.01.2016
Автори: Нордсік Майкл Т., Менг Тзе-Чіанг, Бам Велін С., Бабілон Роберт, Леві Шерон Ф., Баладжі Кодумуді С., Ву Джейсон Дж., Лі Джеймс Х., Калп Джеймс Х.
Формула / Реферат
1. Композиція з низьким вмістом іміквімоду для лікування актинічного кератозу, яка містить іміквімод у кількості близько 2,5 мас. % або близько 3,75 мас. % та фармацевтично прийнятний носій для іміквімоду, що містить жирну кислоту, де композиція являє собою крем, і де 250 мг крему містять 6,25 мг або 9,375 мг іміквімоду.
2. Композиція за п. 1, де низький вміст іміквімоду становить близько 2,5 мас. %, і де 250 мг крему містять 6,25 мг іміквімоду.
3. Композиція за п. 1, де низький вміст іміквімоду становить близько 2,5 мас. %, і де 500 мг крему містять 12,5 мг іміквімоду.
4. Композиція за п. 1, де низький вміст іміквімоду становить близько 3,75 мас. %, і 250 мг крему містять 9,375 мг іміквімоду.
5. Композиція за п. 1, де низький вміст іміквімоду становить близько 3,75 мас. %, і де 500 мг крему містять 18,75 мг іміквімоду.
6. Композиція за п. 1, де жирна кислота вибирається з групи, що складається з пальмітинової кислоти, лінолевої кислоти, стеаринової кислоти, ізостеаринової кислоти, неочищеної олеїнової кислоти, олеїнової кислоти високого ступеня очищення та їх сумішей.
7. Композиція за п. 6, де жирна кислота являє собою ізостеаринову кислоту.
8. Композиція за п. 1, де жирна кислота присутня в кількості між близько 5 мас. % і 30 мас. %.
9. Композиція за п. 1, яка додатково містить принаймні один засіб, вибраний з групи, що складається зі зм'якшуючого засобу, емульгатора, загусника, консерванту, солюбілізуючого засобу, зволожувача та засобу, що сприяє проникненню.
10. Композиція за будь-яким з пп. 1-9, яка має пропорційні дозі швидкості вивільнення, відносно як швидкостей вивільнення іміквімоду, так і загальної кількості вивільненого іміквімоду, порівняно з кремом Алдара® (іміквімод 5 %).
11. Композиція за будь-яким з пп. 1-9, де композиція з більш низьким вмістом іміквімоду не містить продуктів розпаду, при зберіганні при близько 25 °C/60 % RH, близько 30 °C/65 % RH і близько 40 °C/75 % RH, протягом близько одного, близько двох, близько трьох і близько шести місяців, і при аналізі при довжині хвилі близько 318 нм.
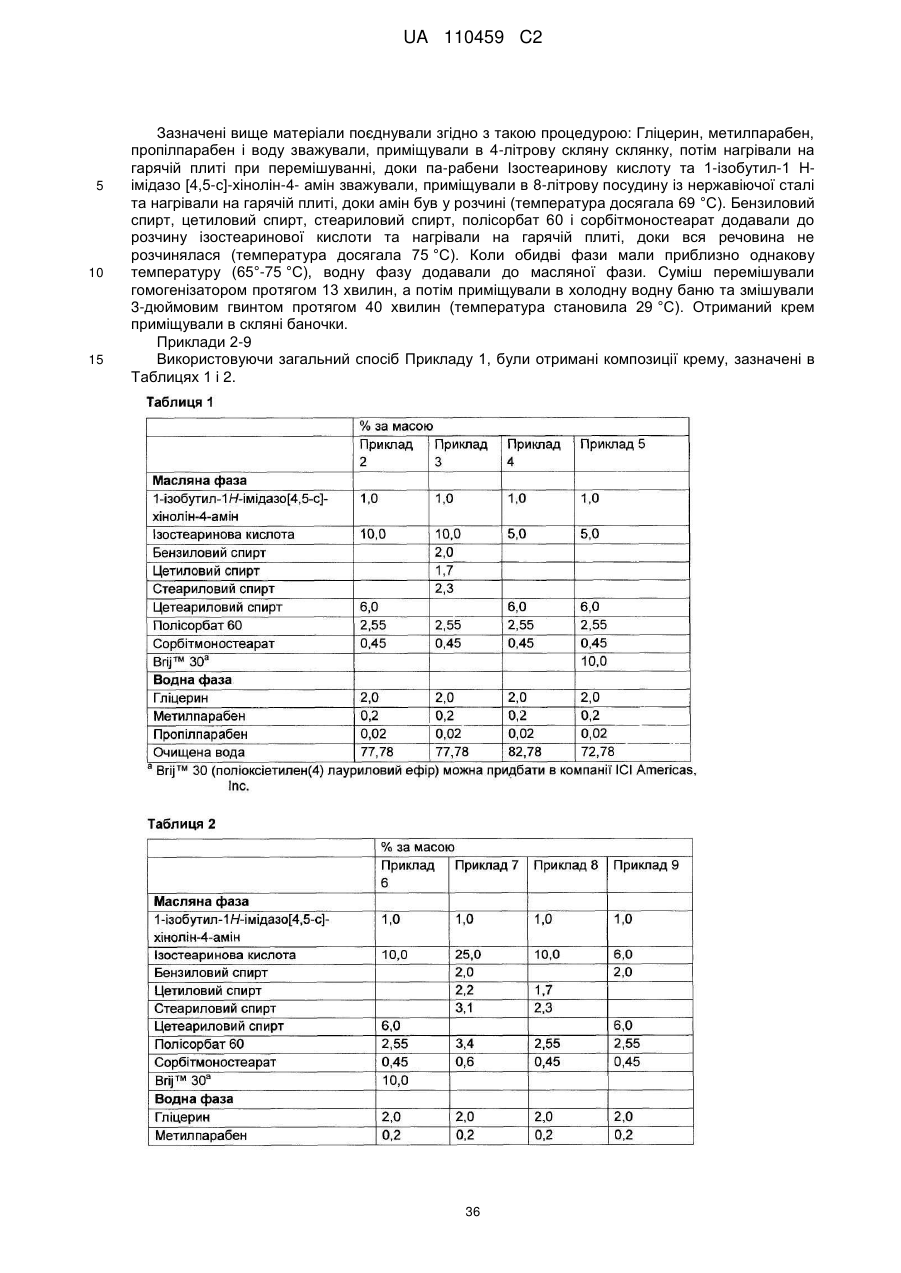
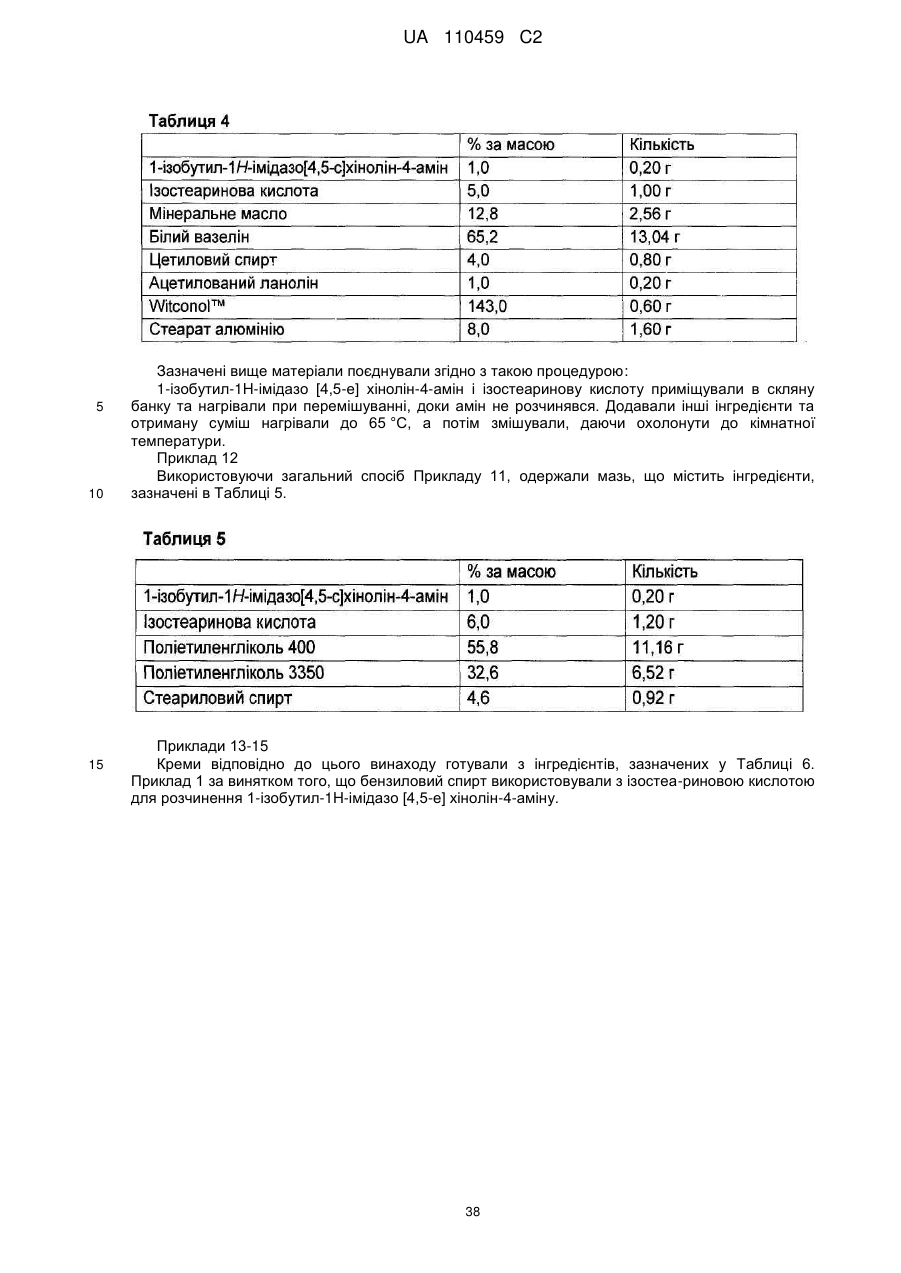
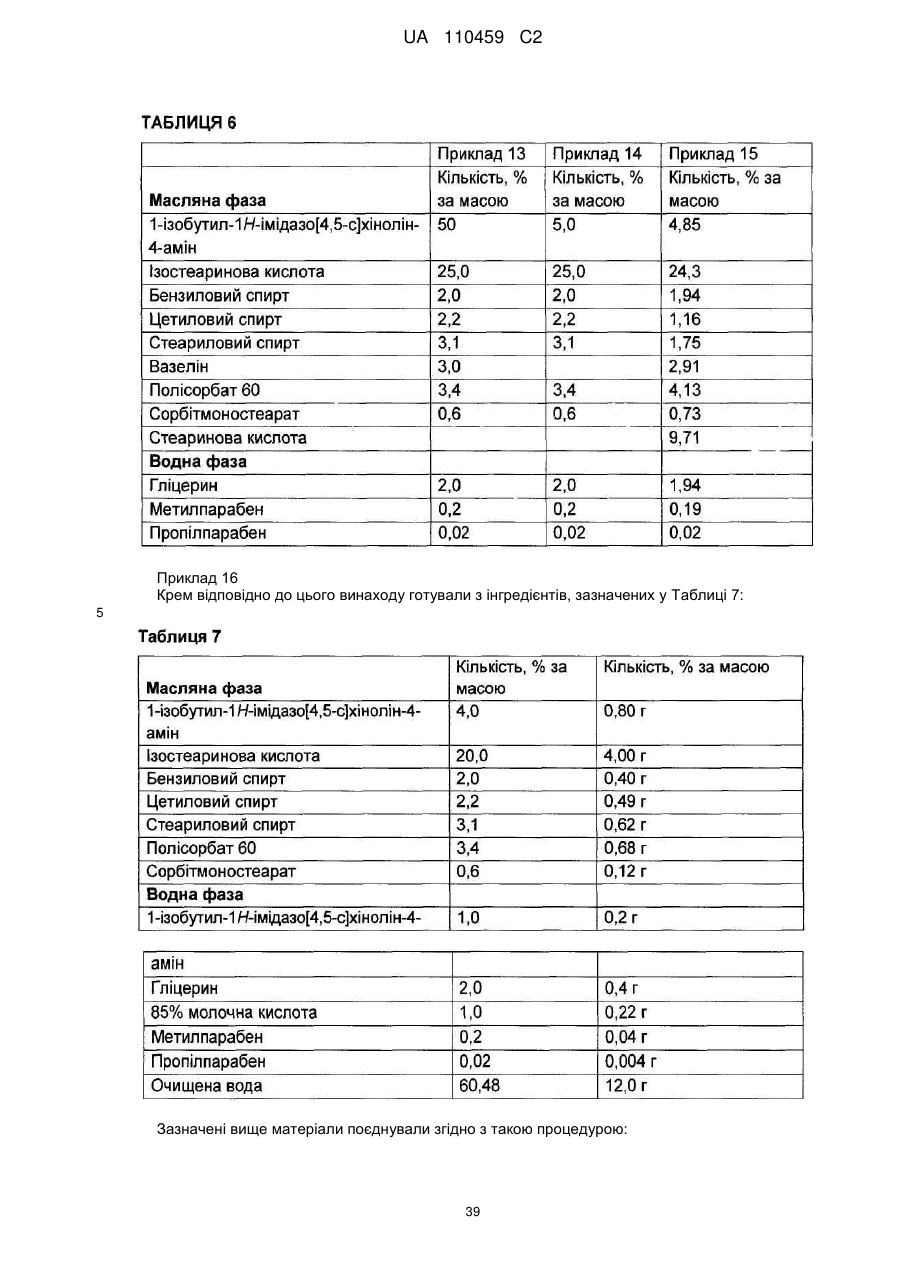
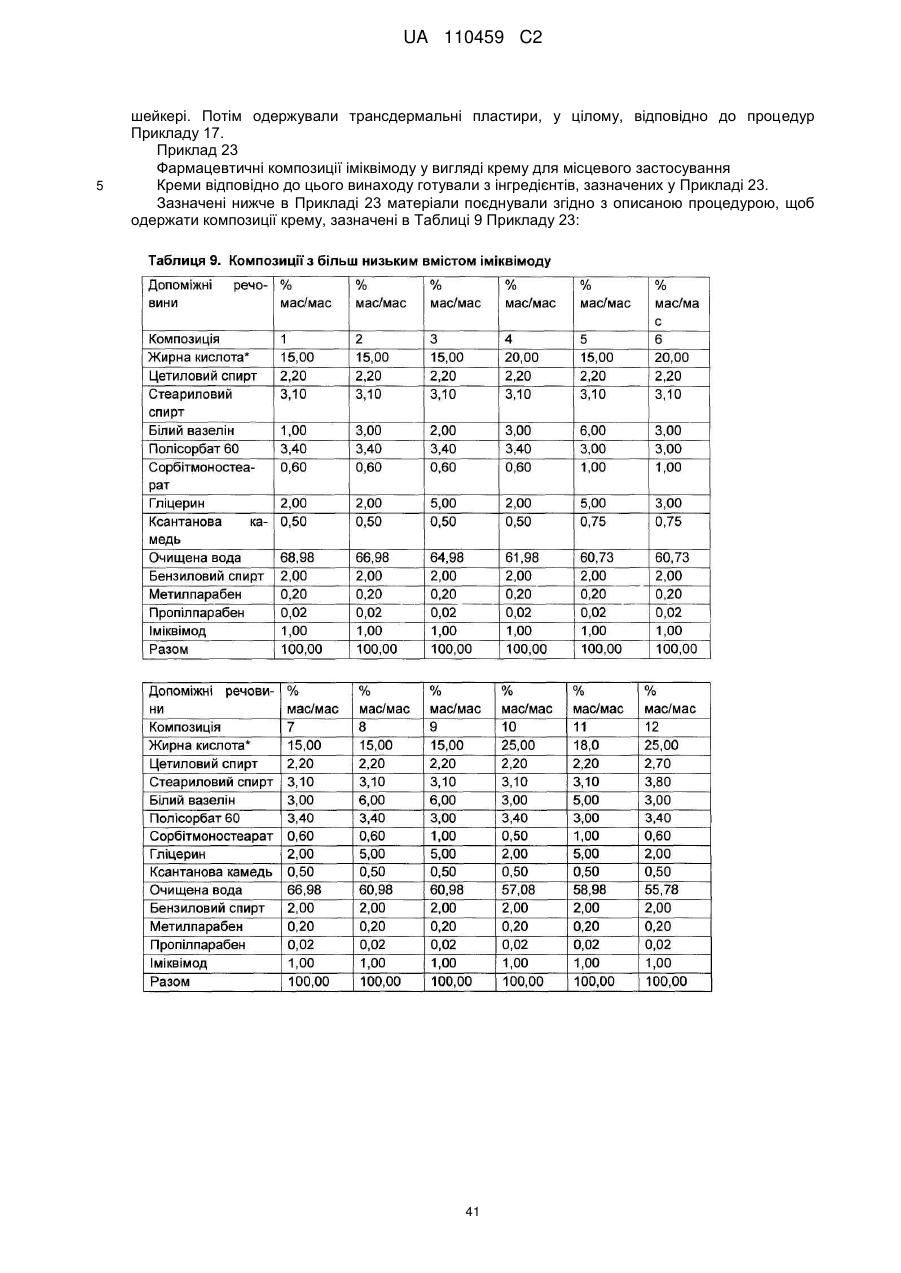
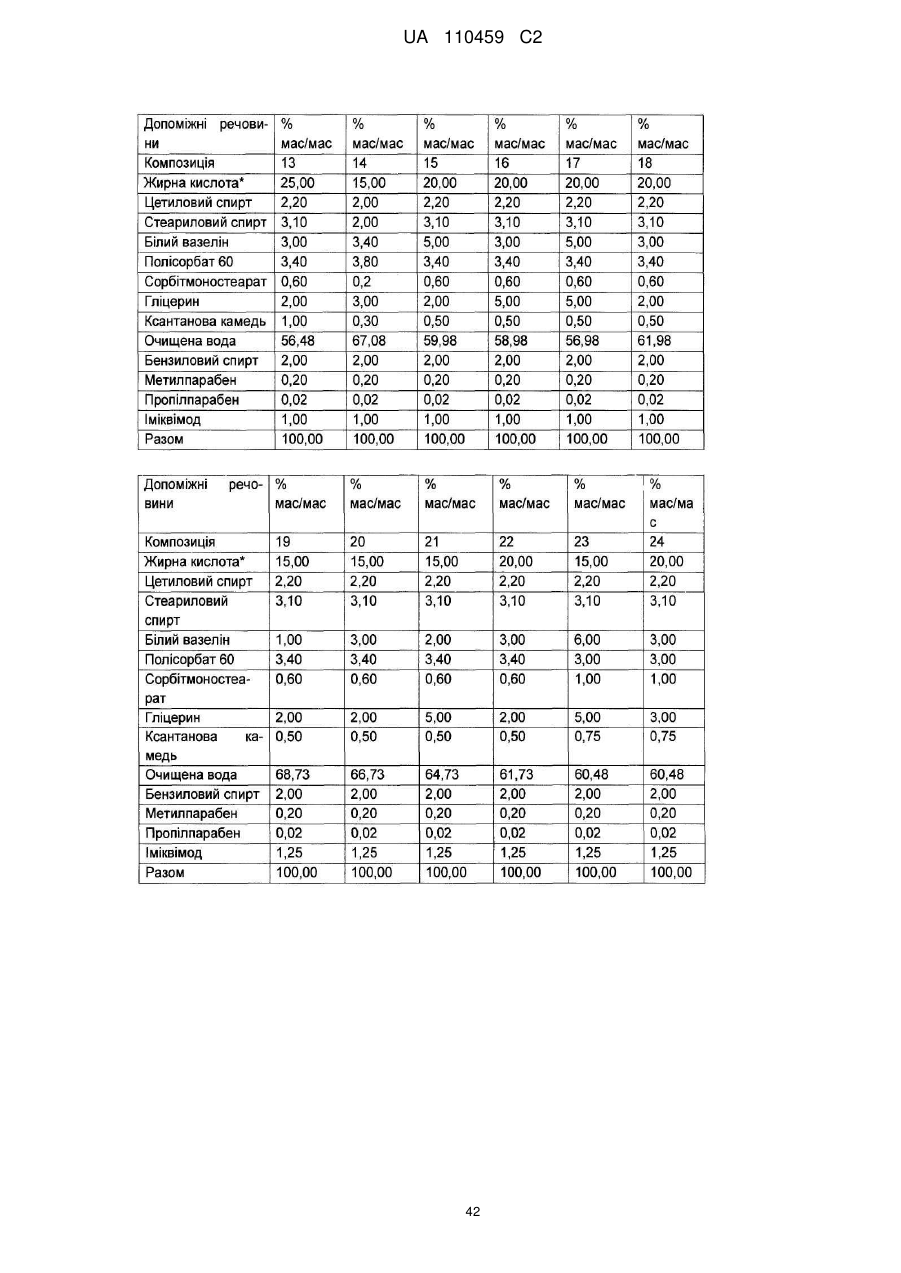
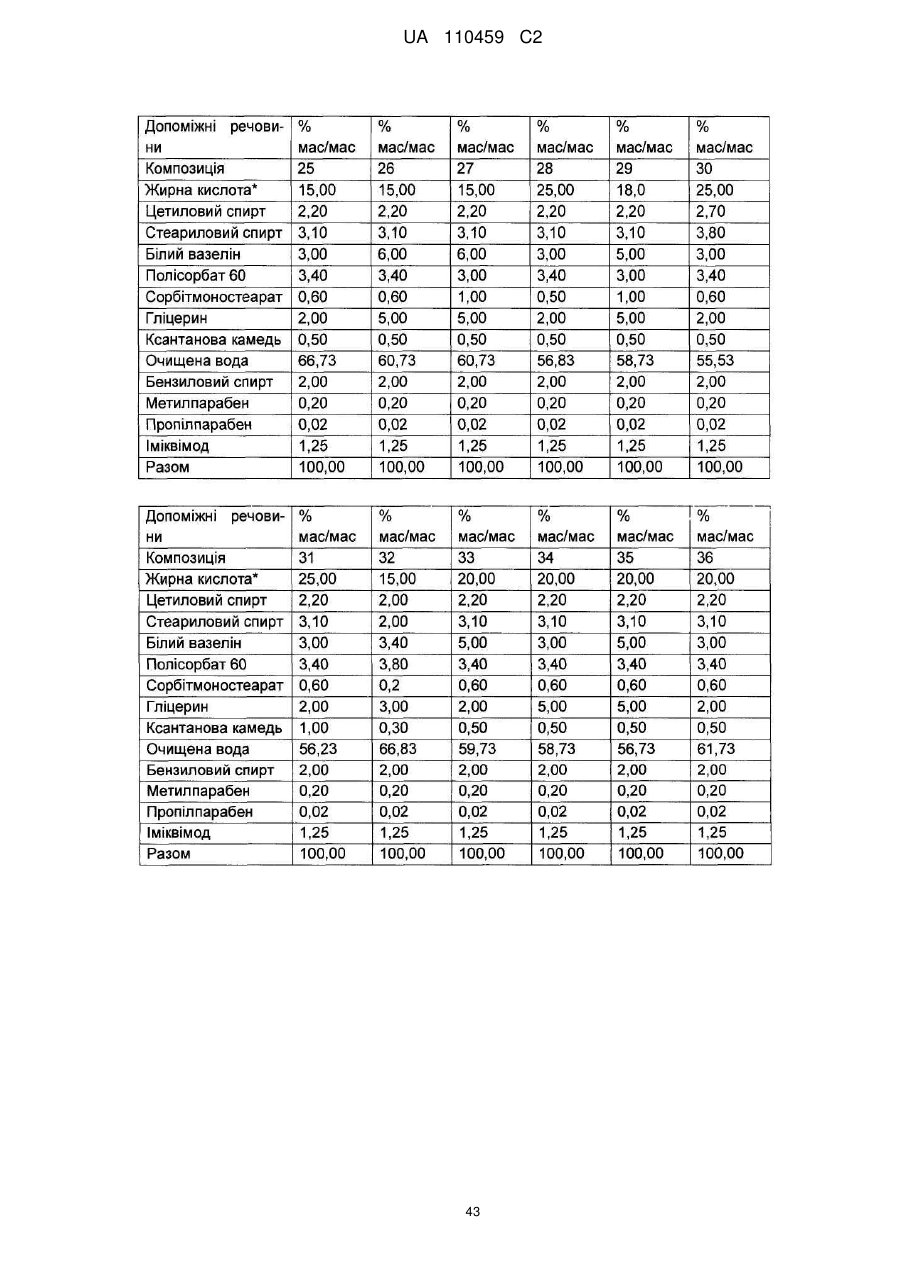
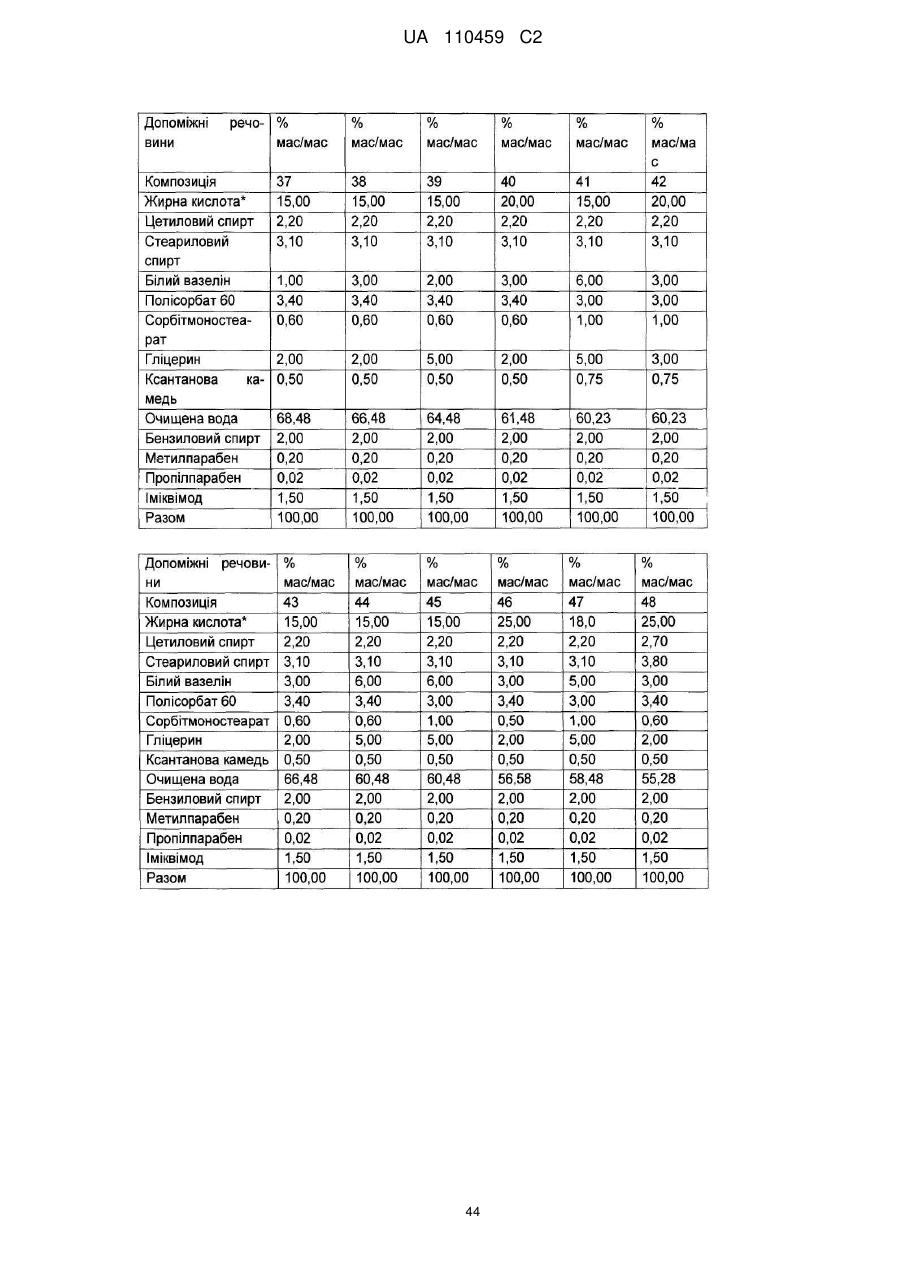
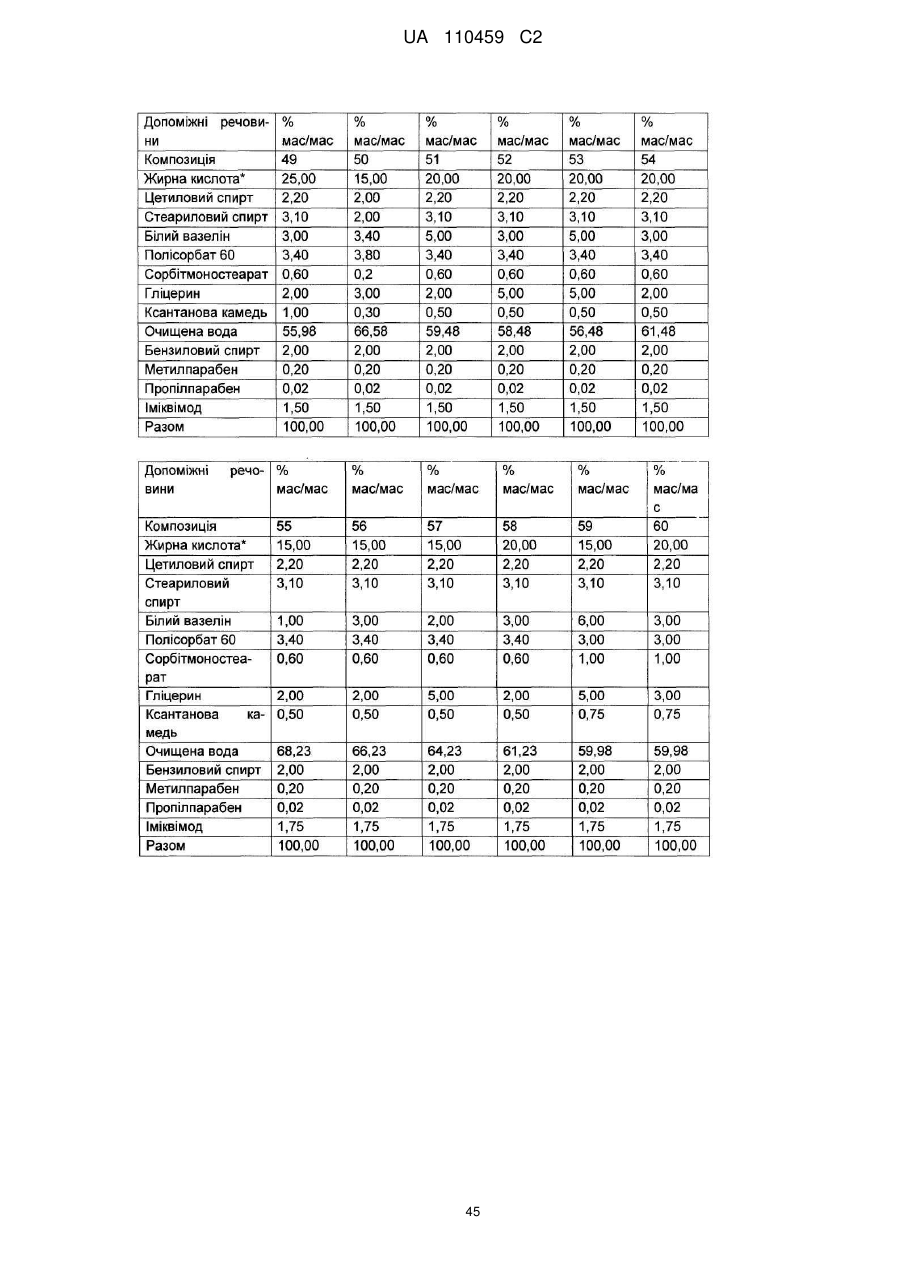
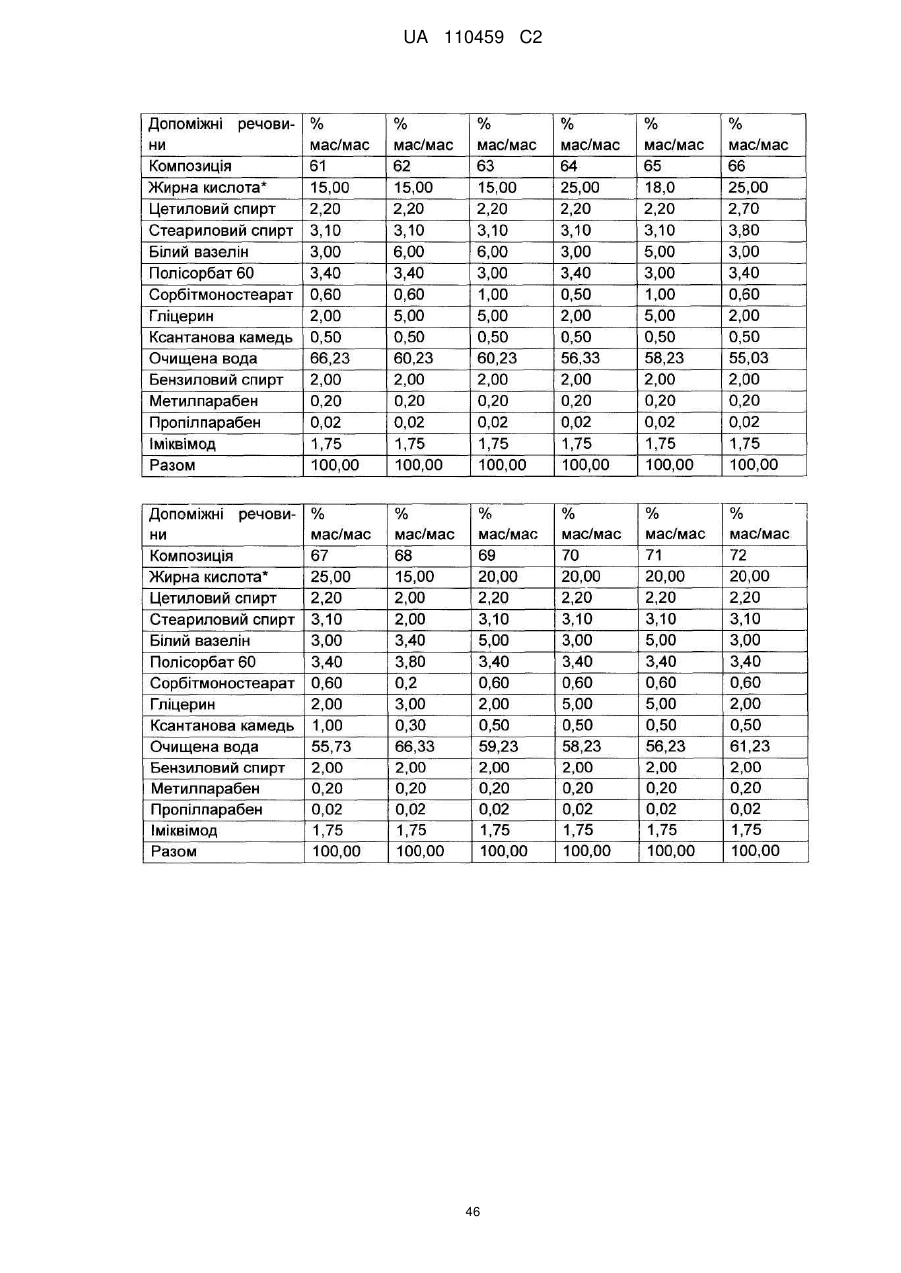
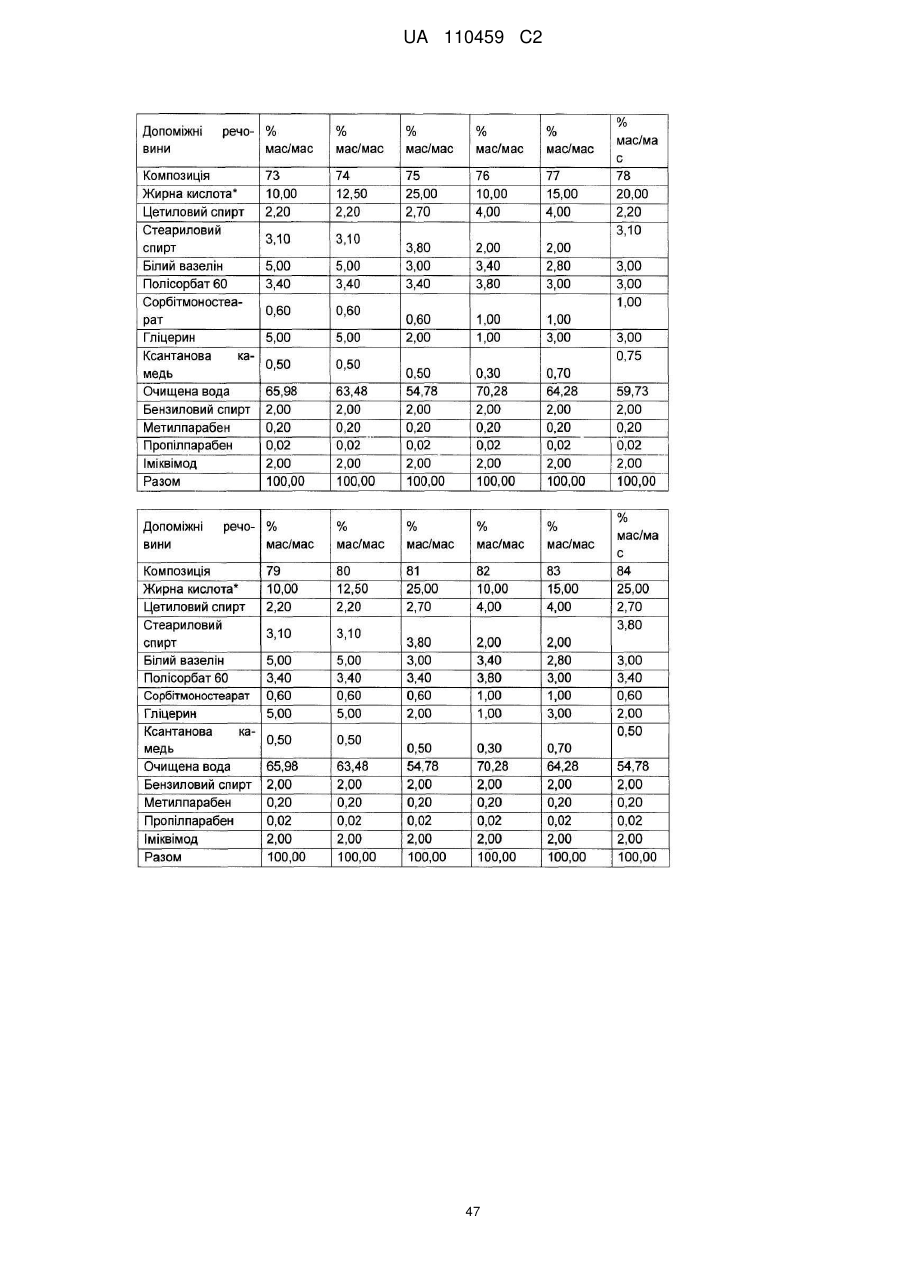
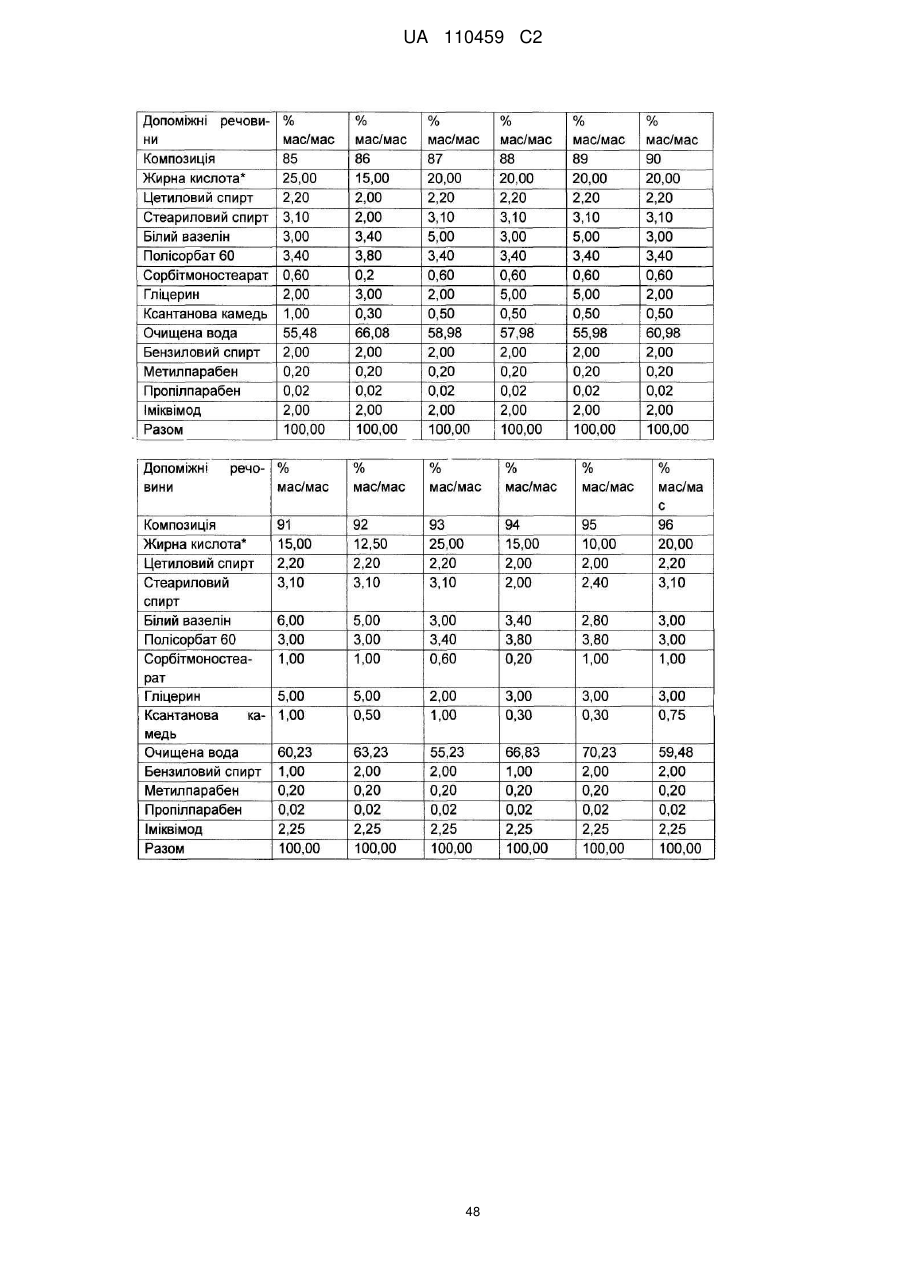
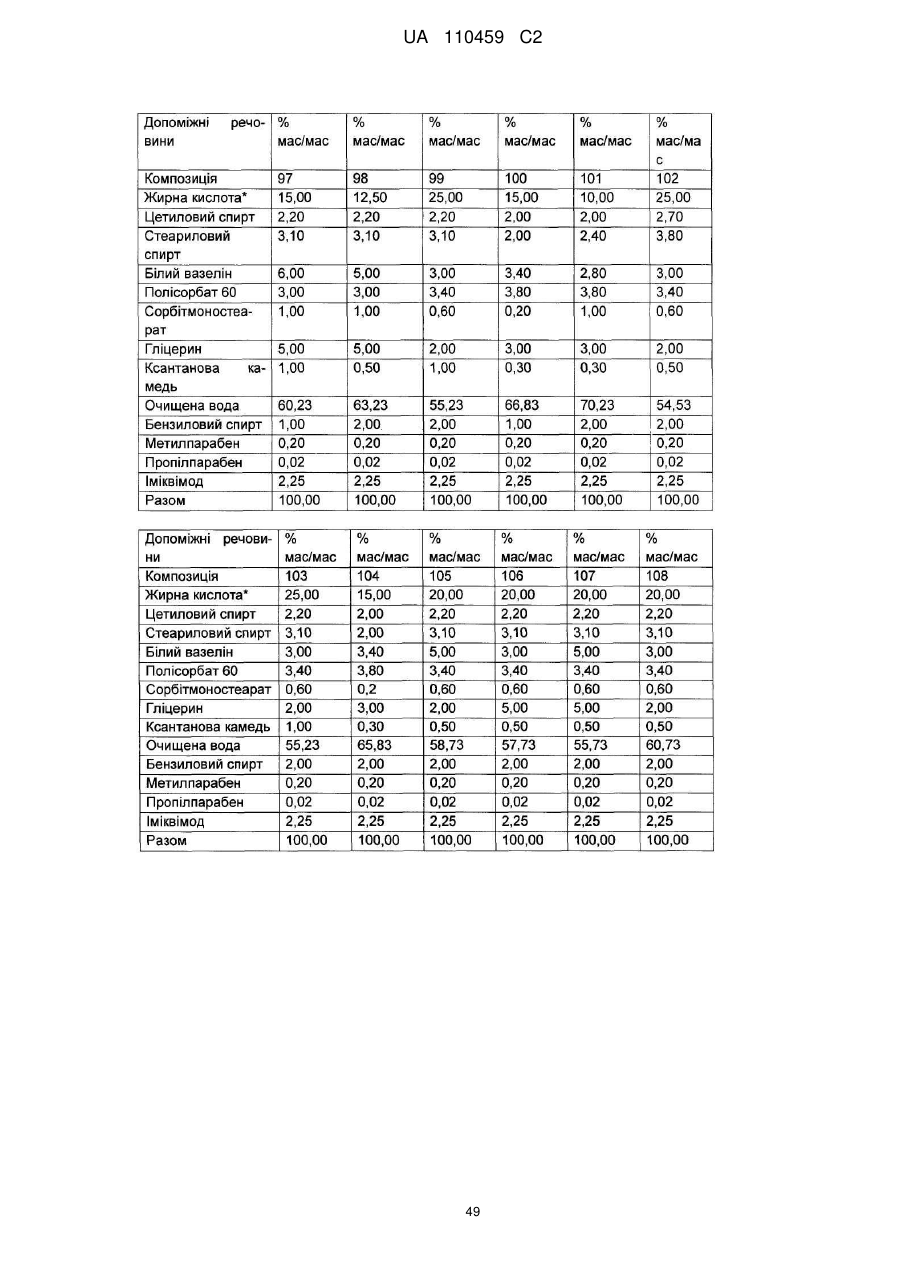
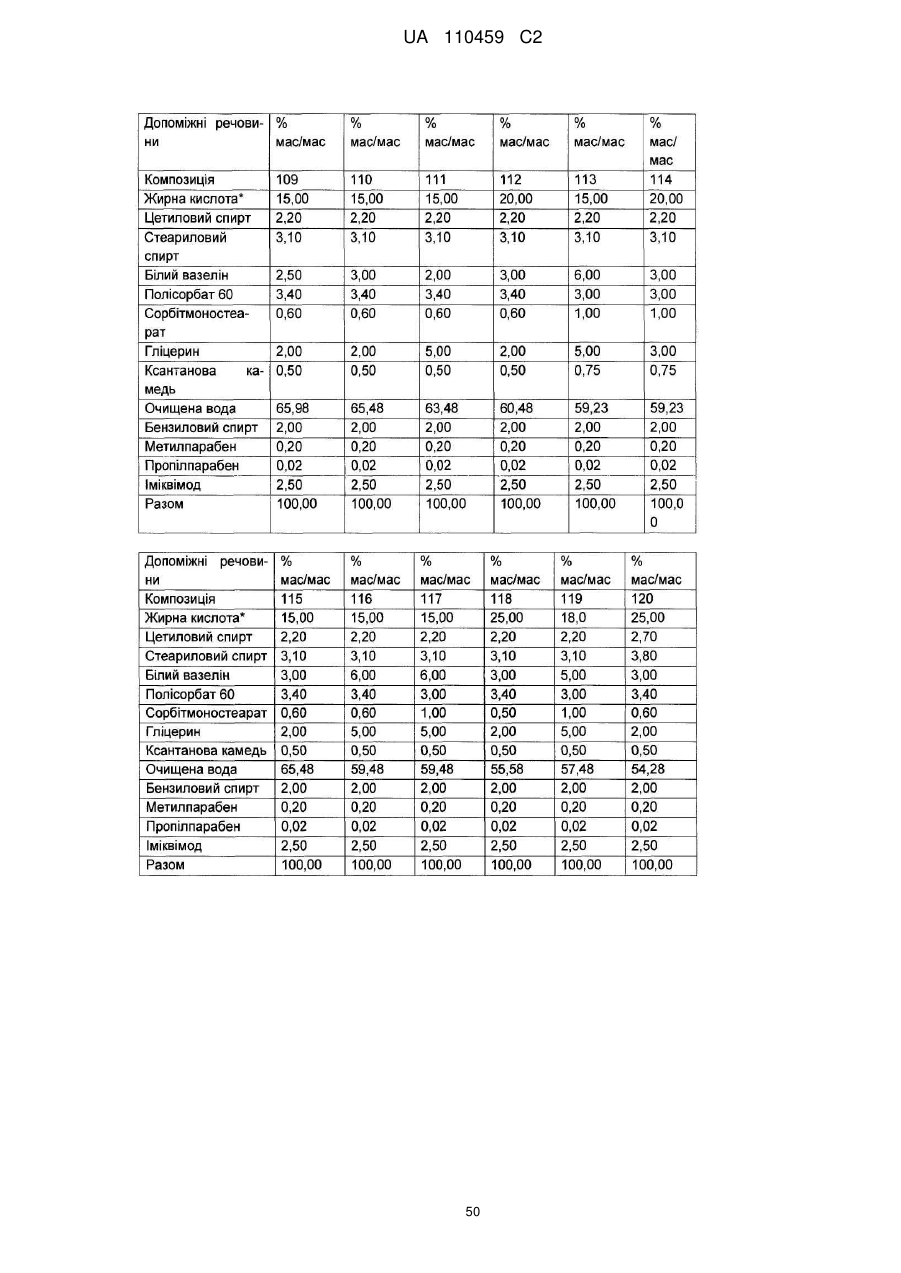
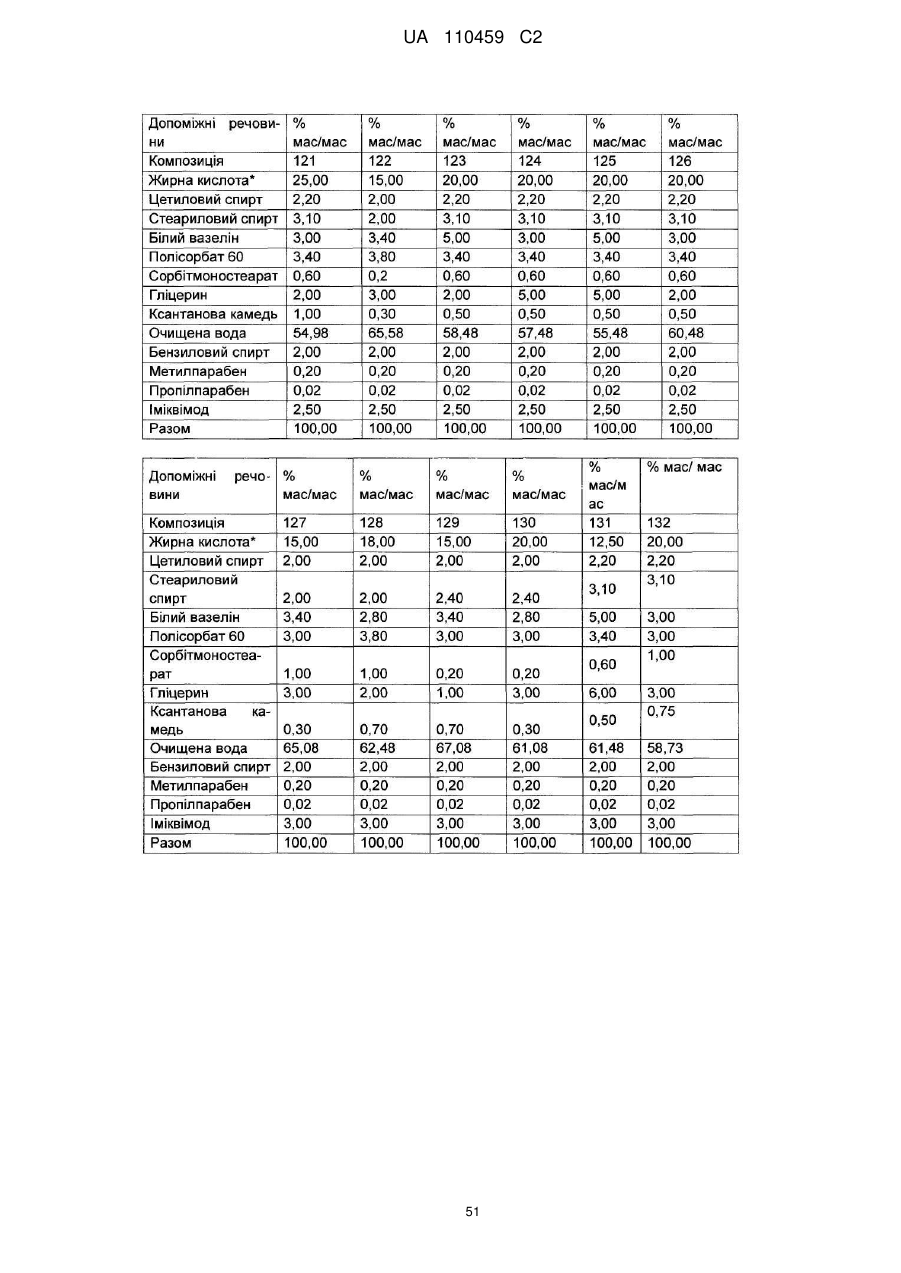
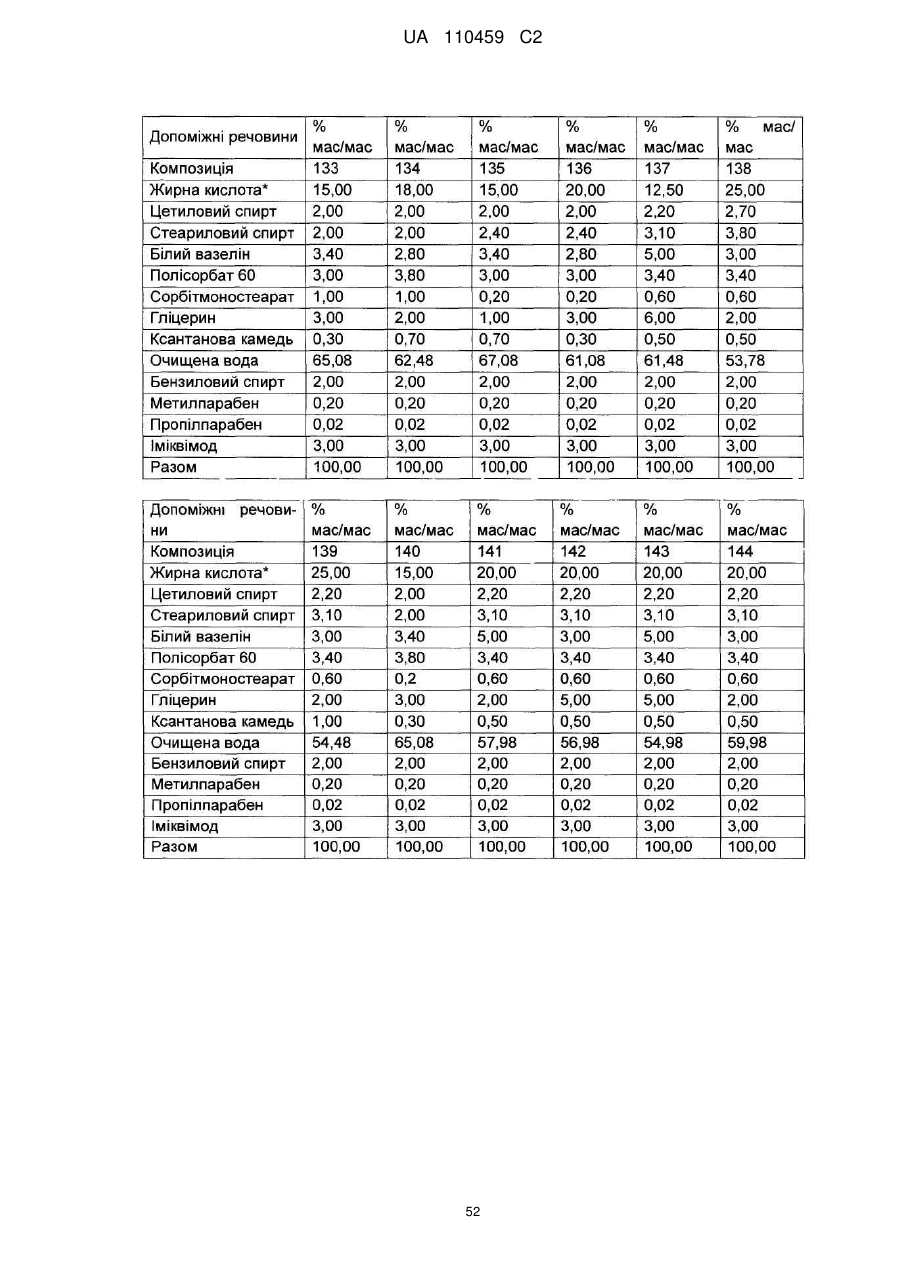
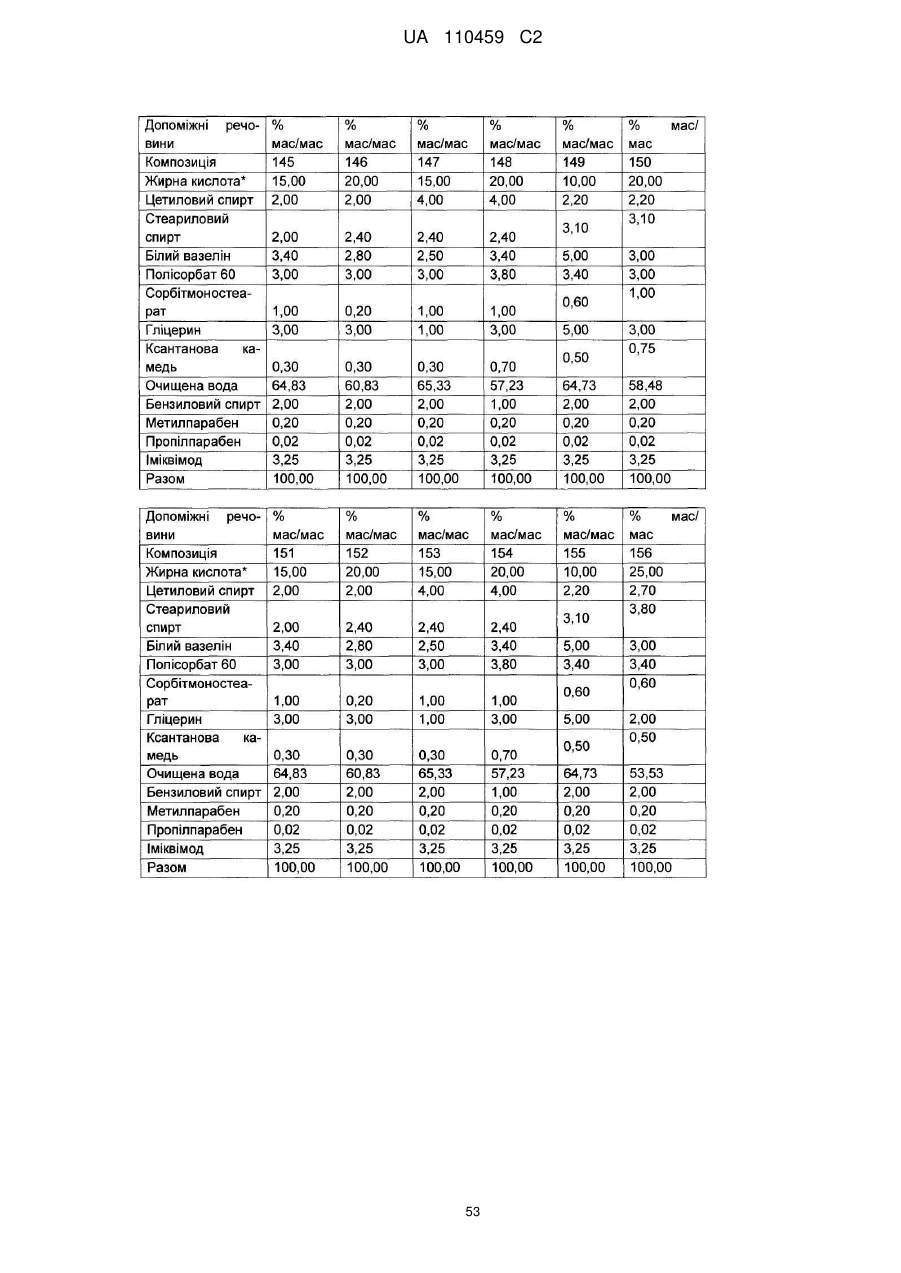
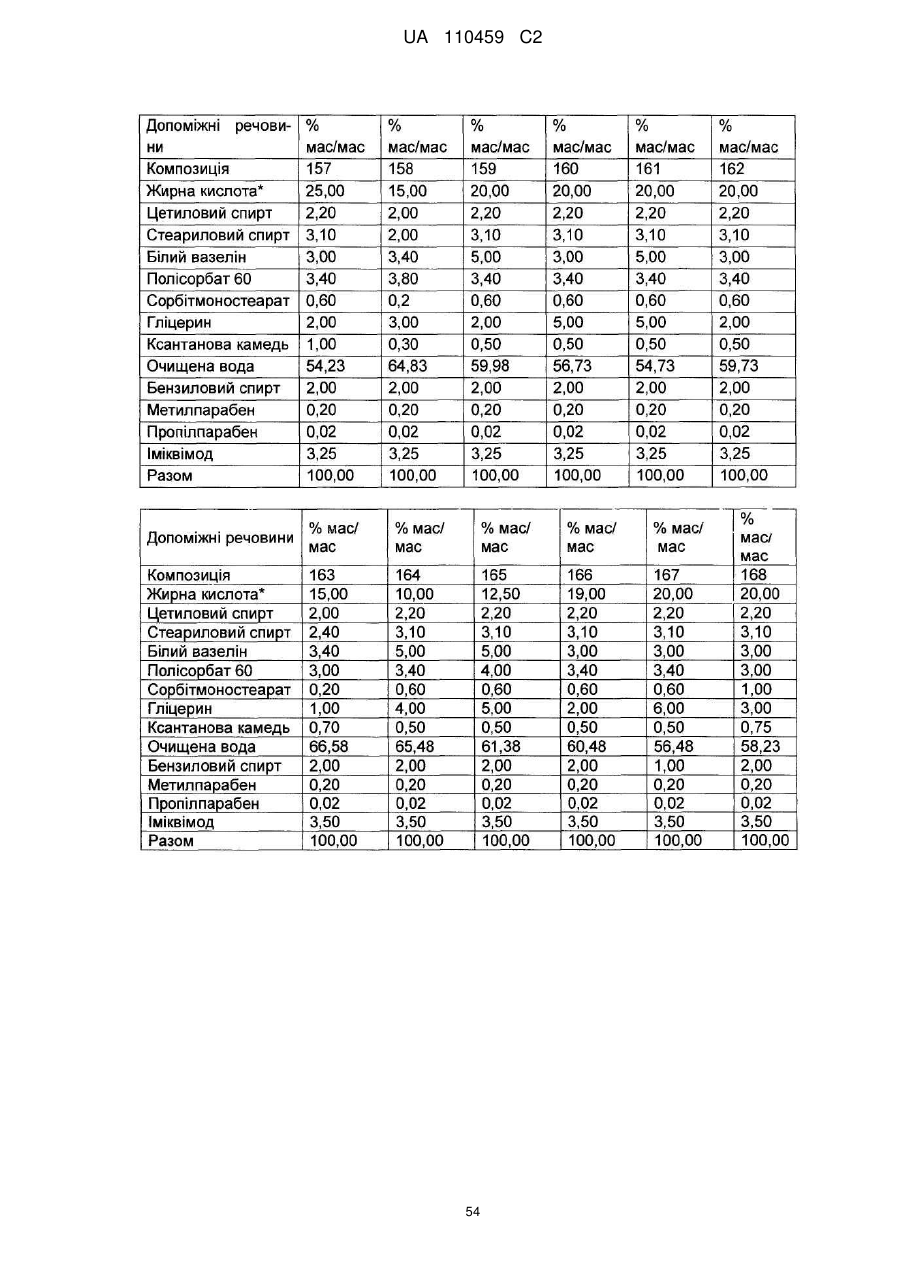
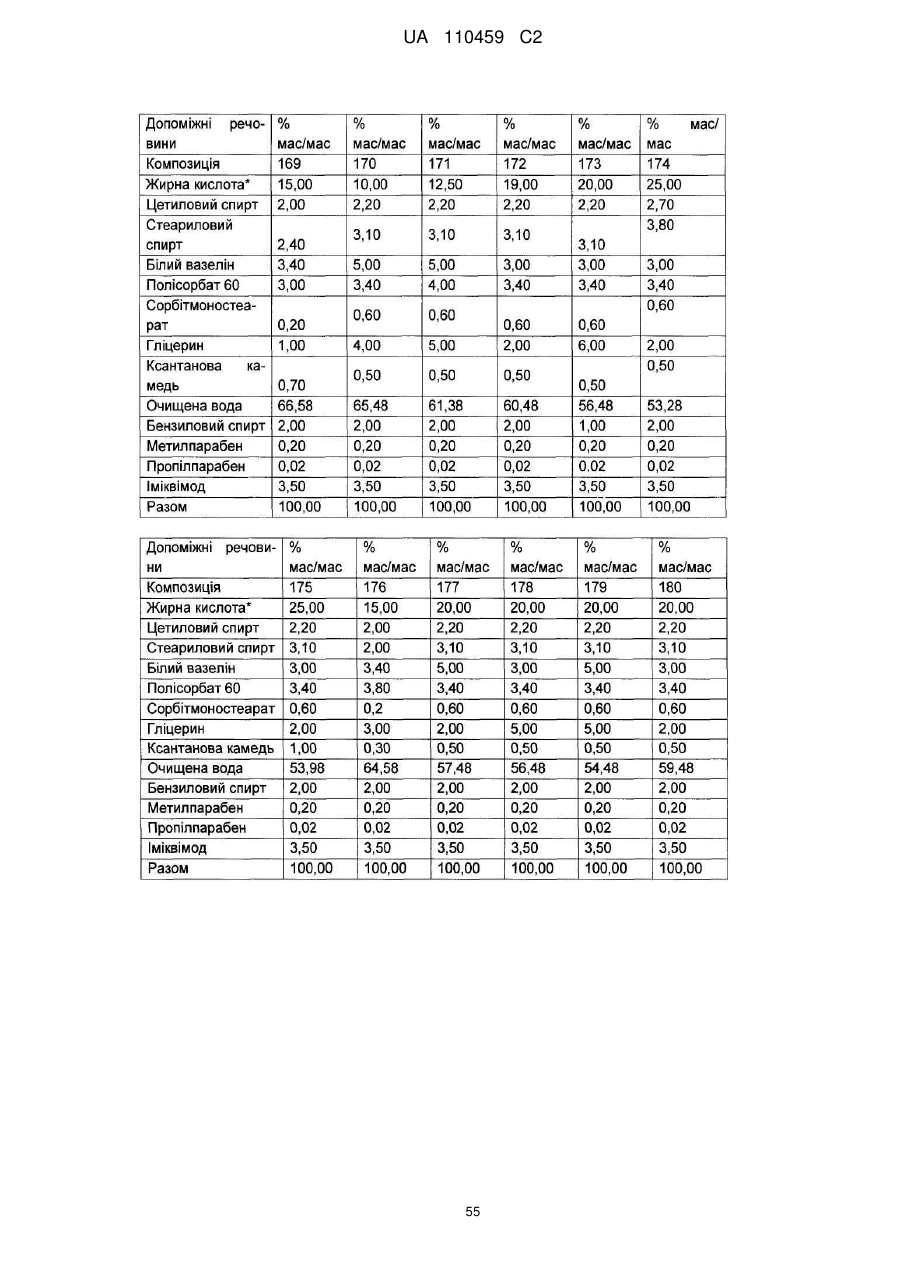
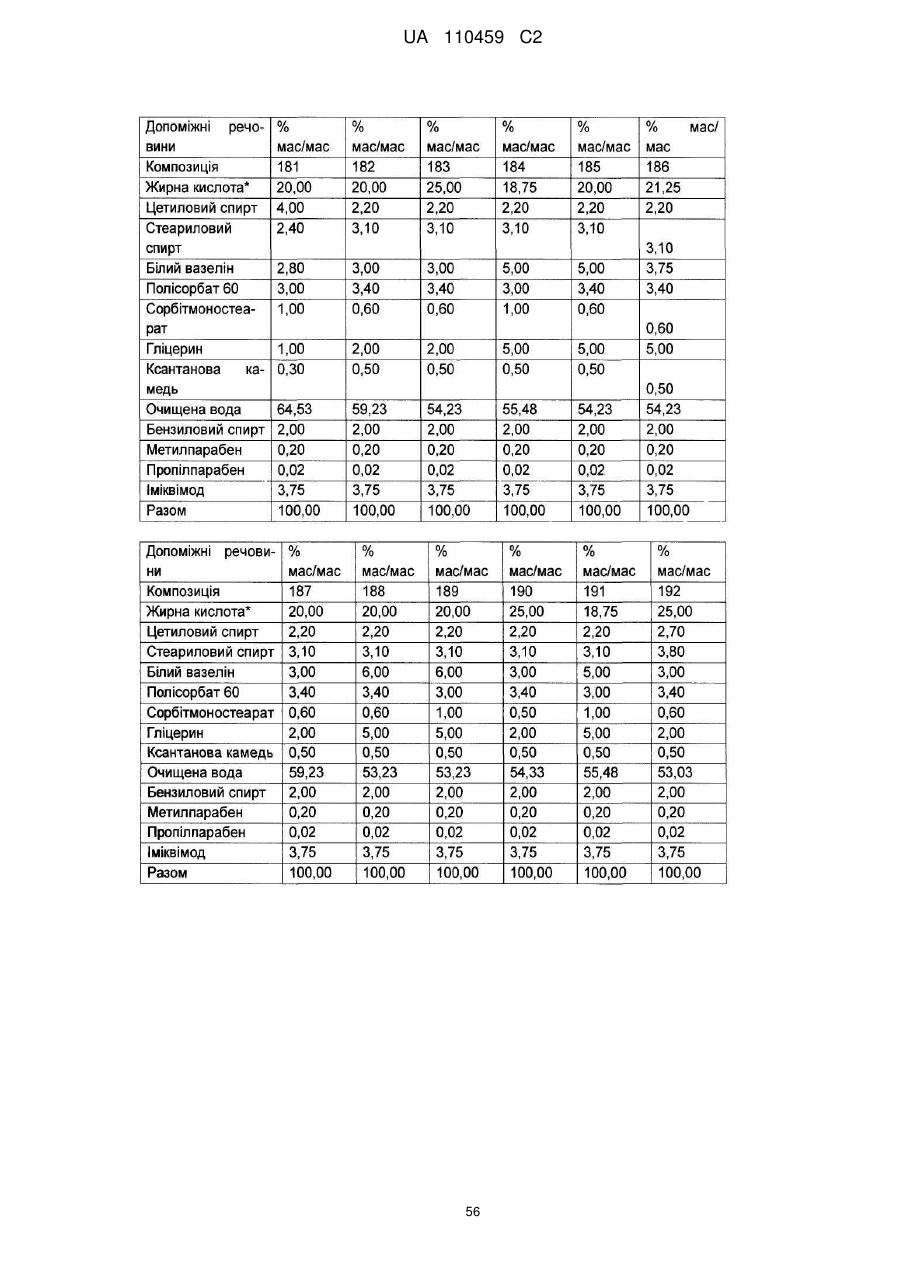
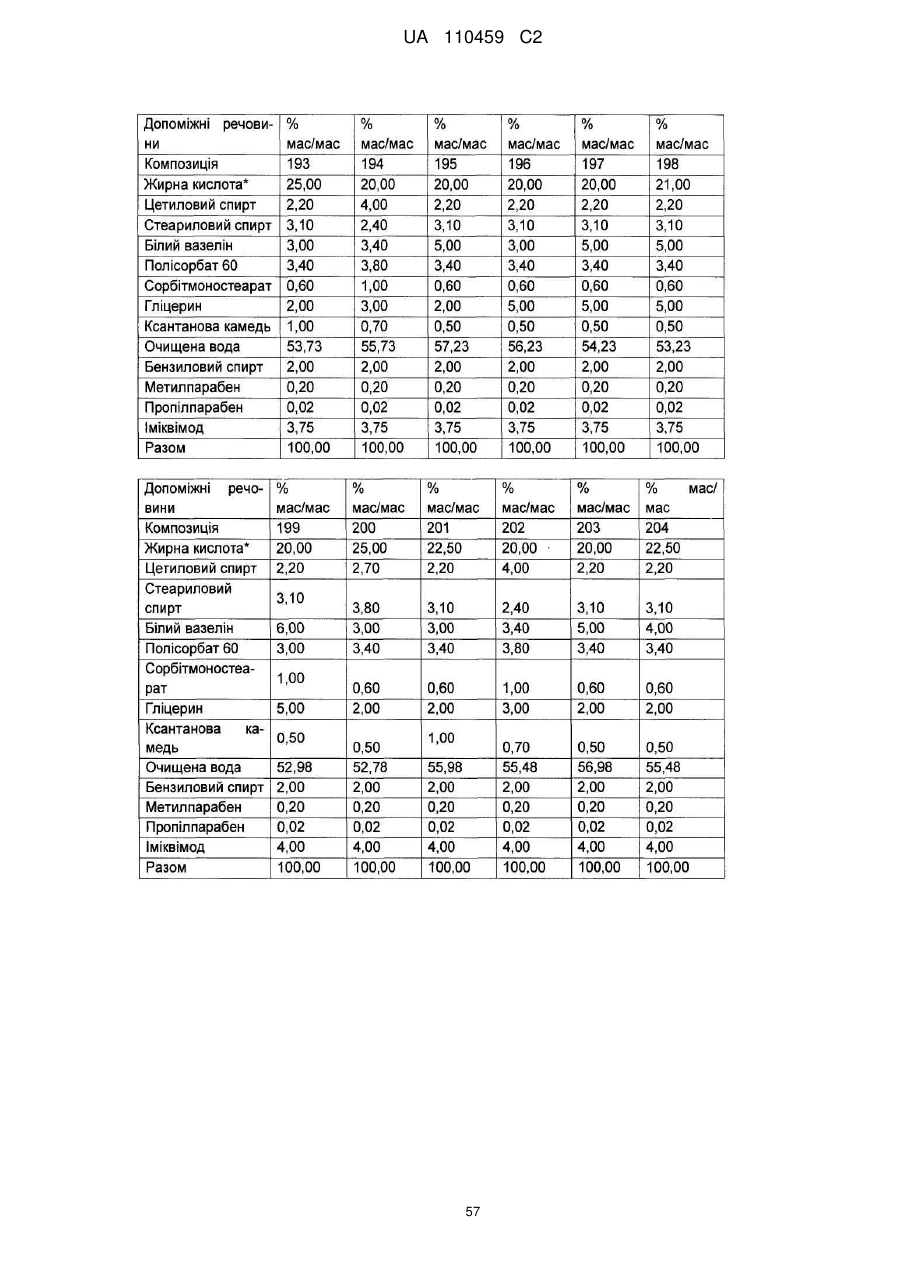
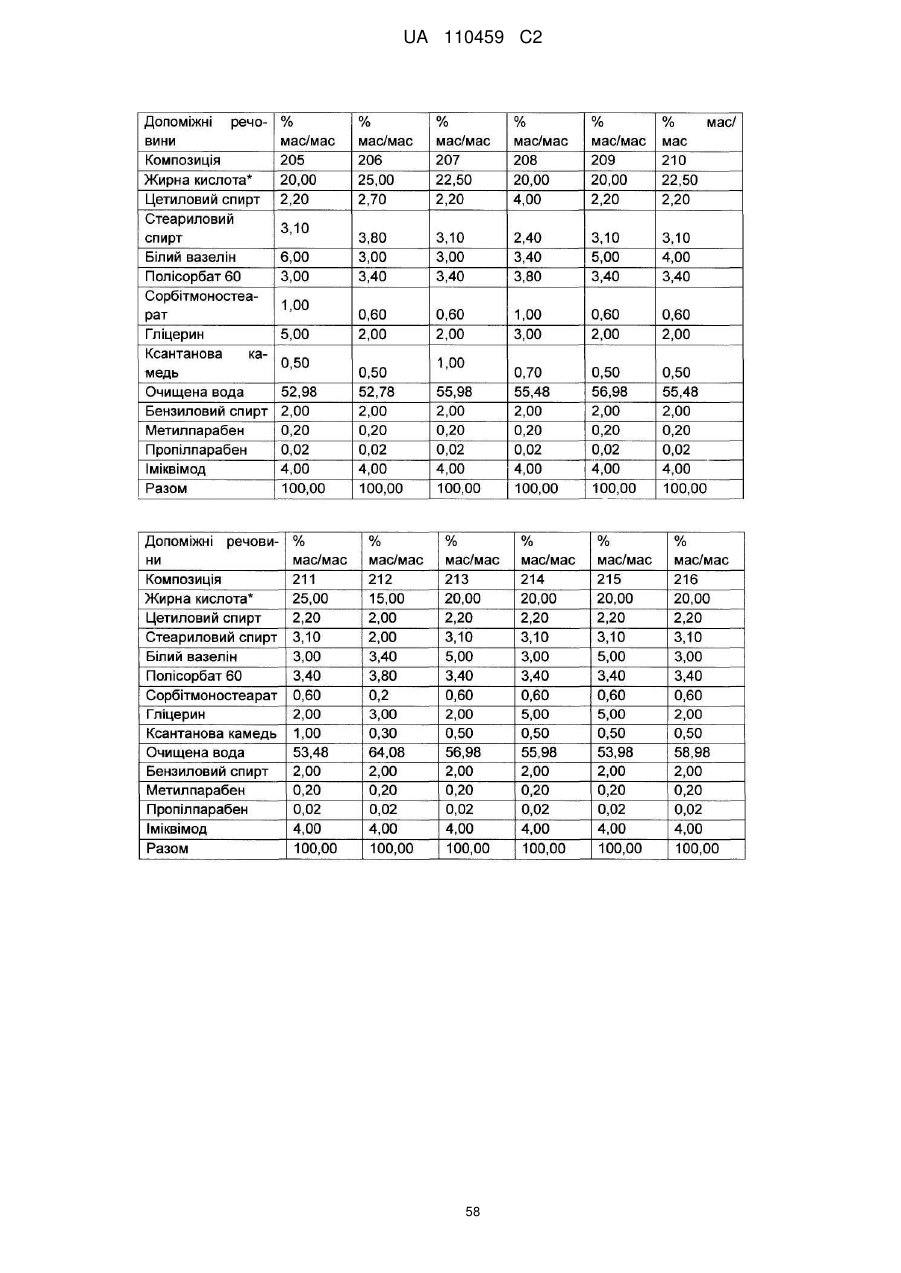
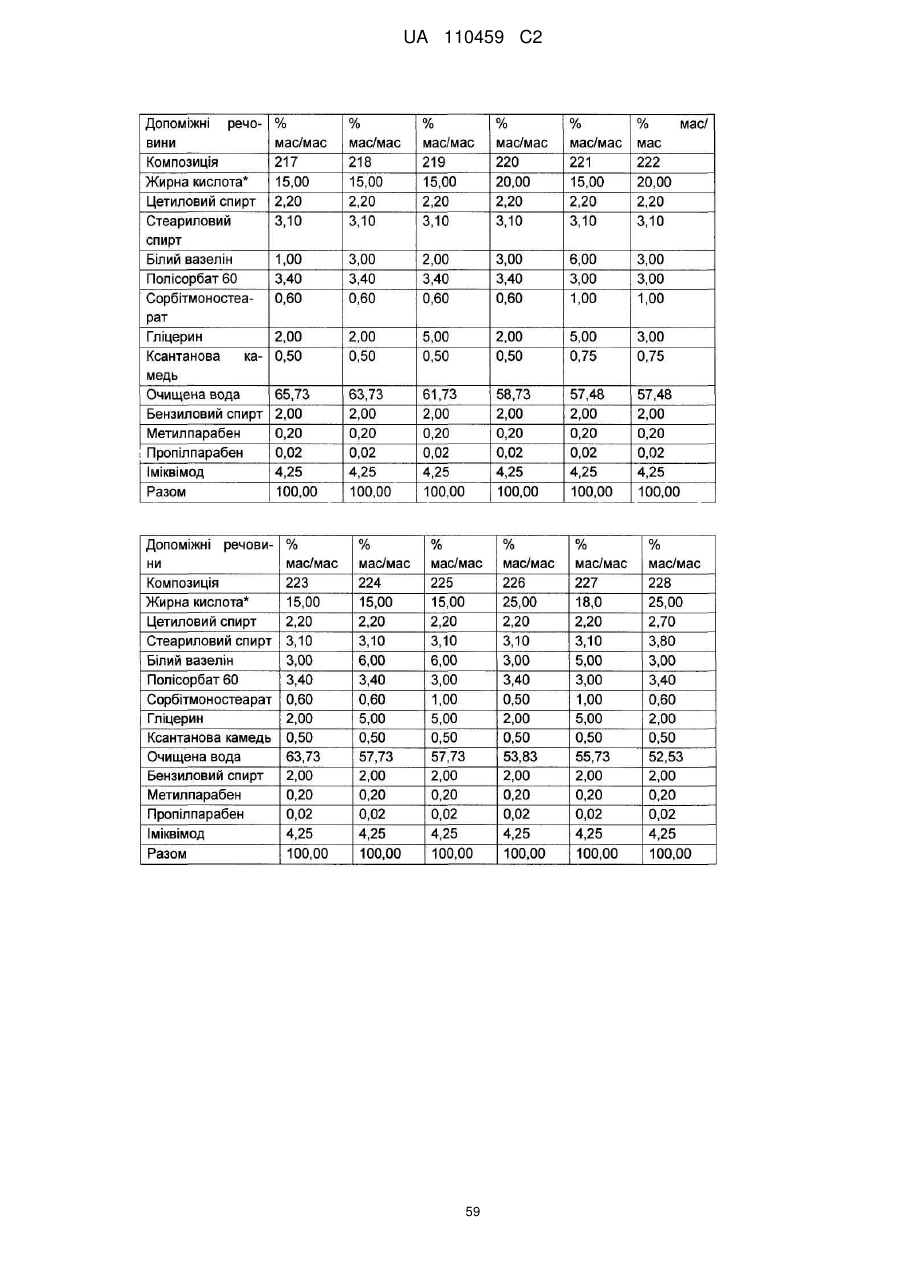
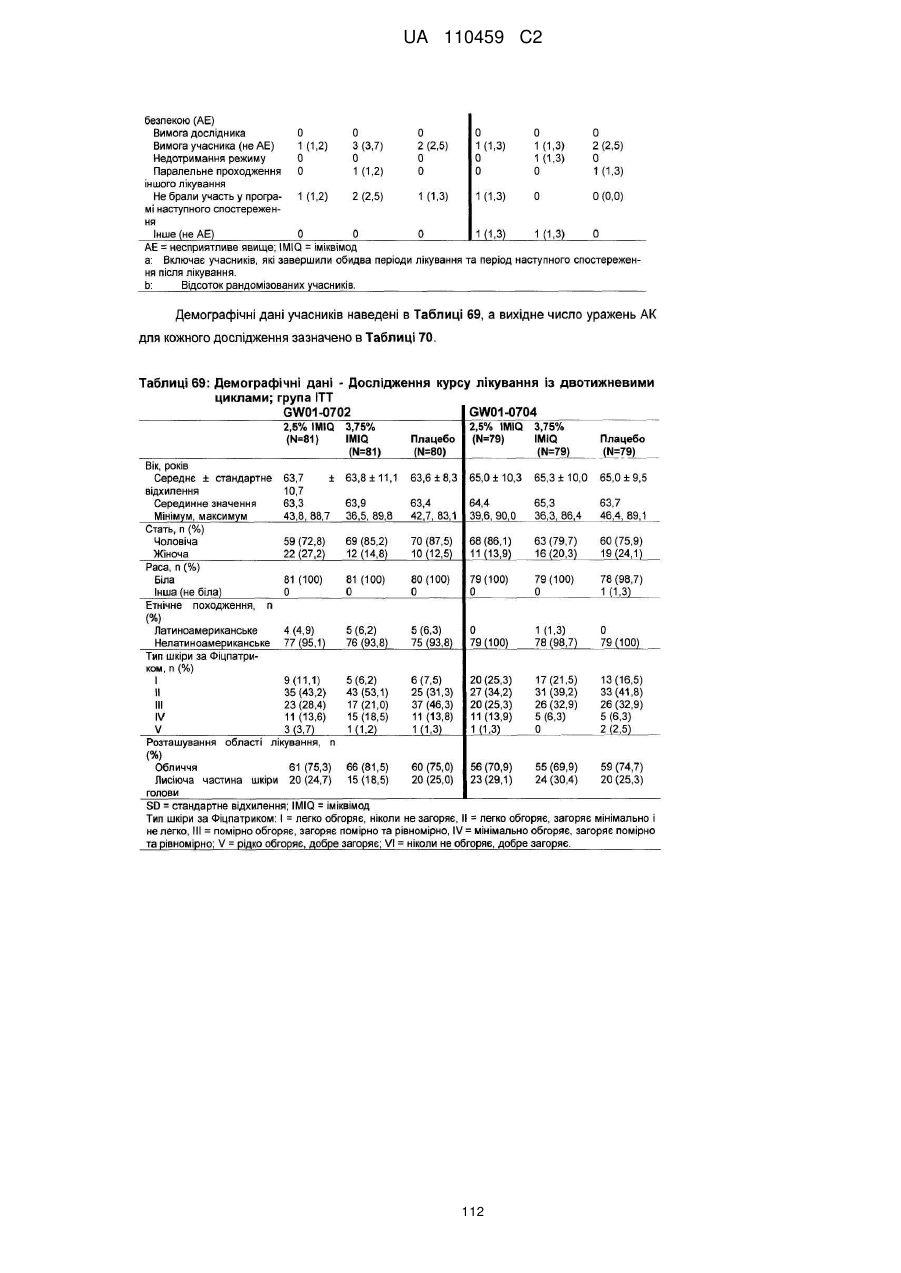
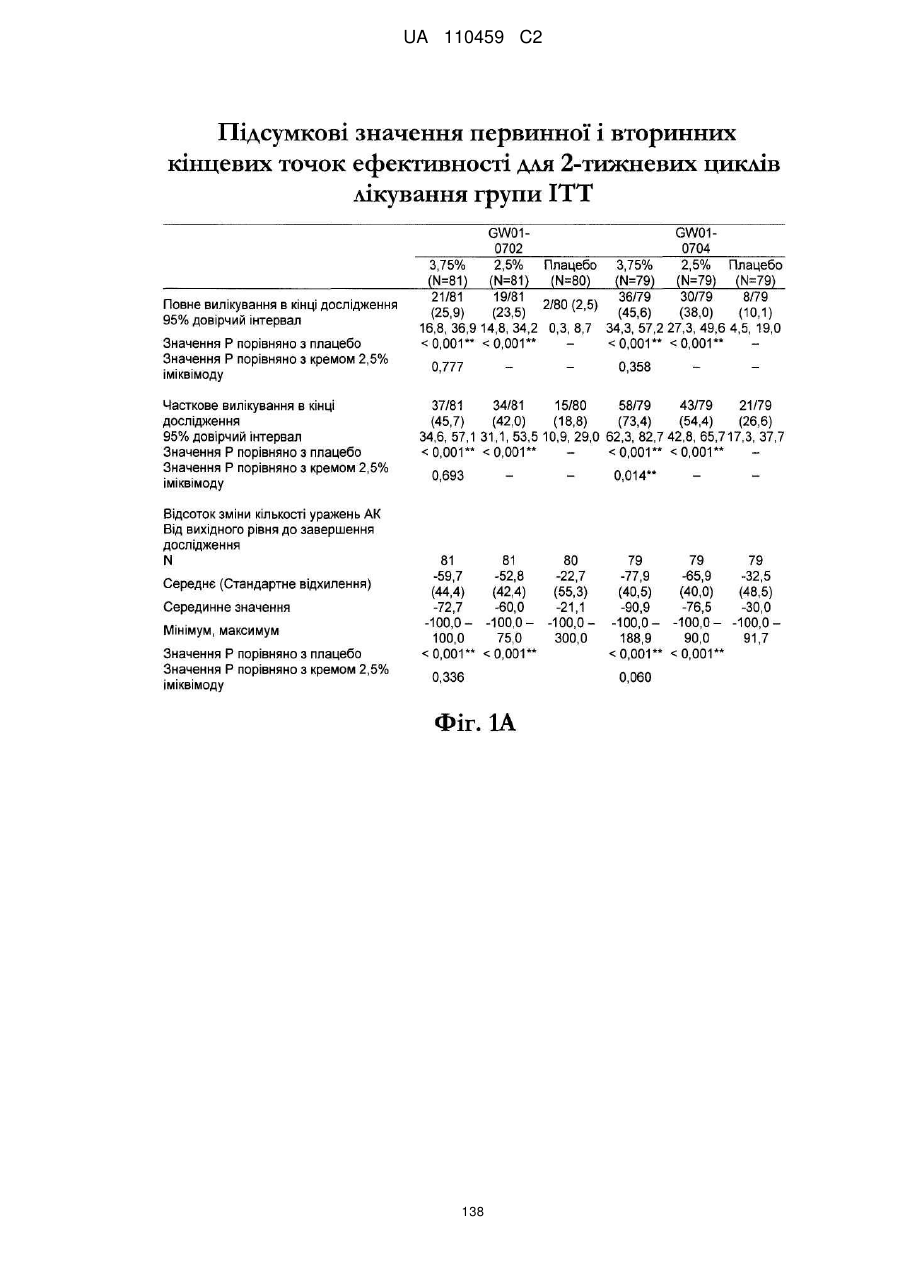
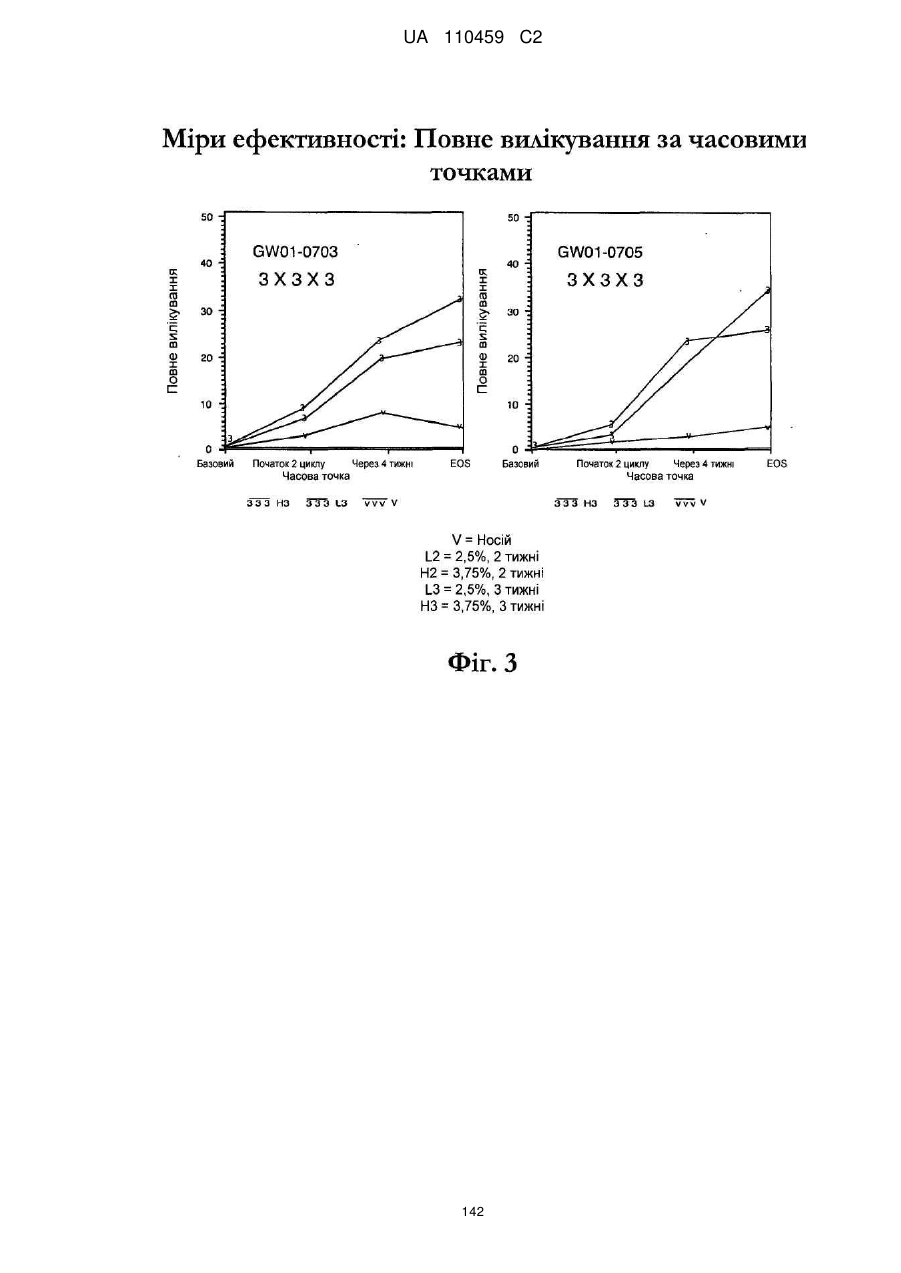
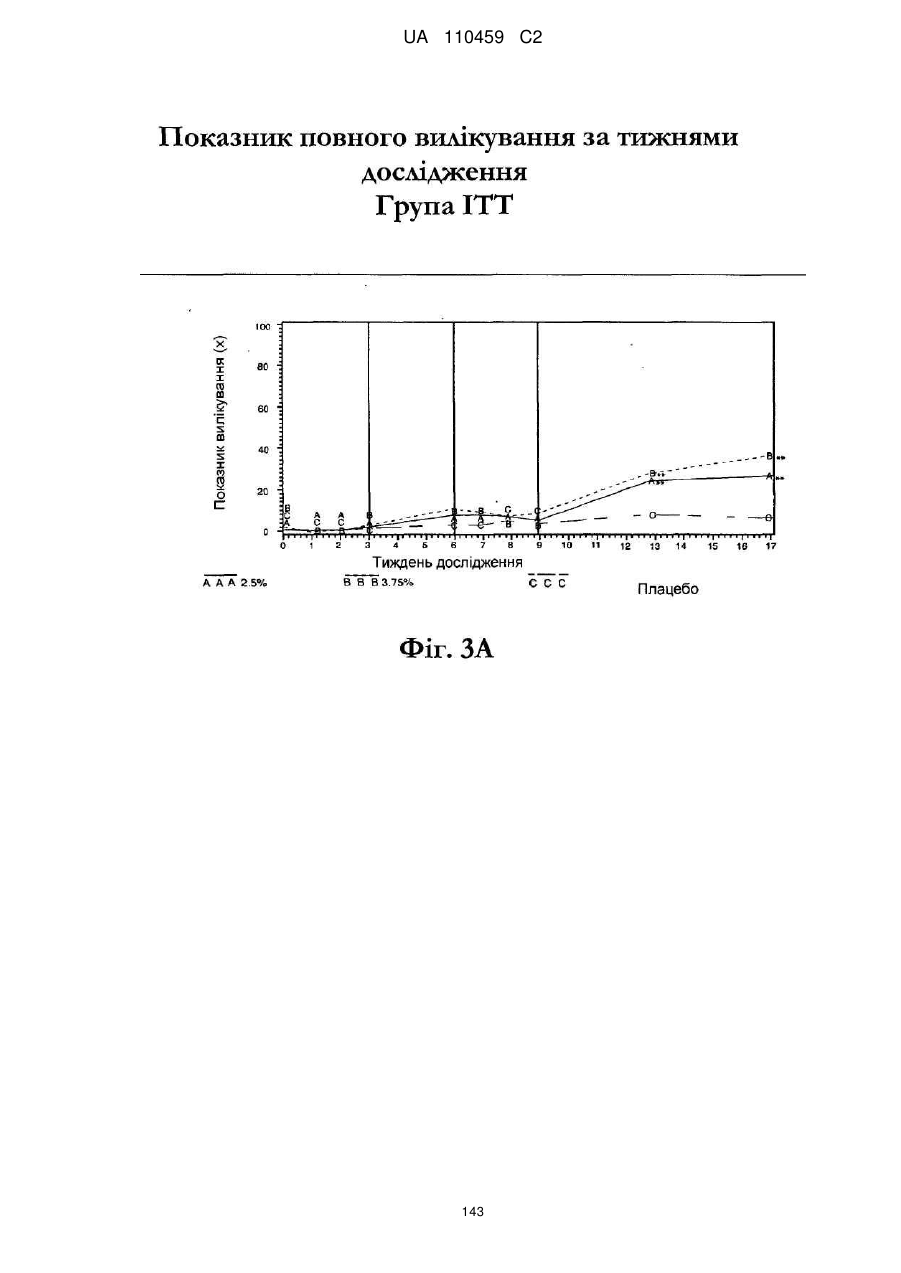
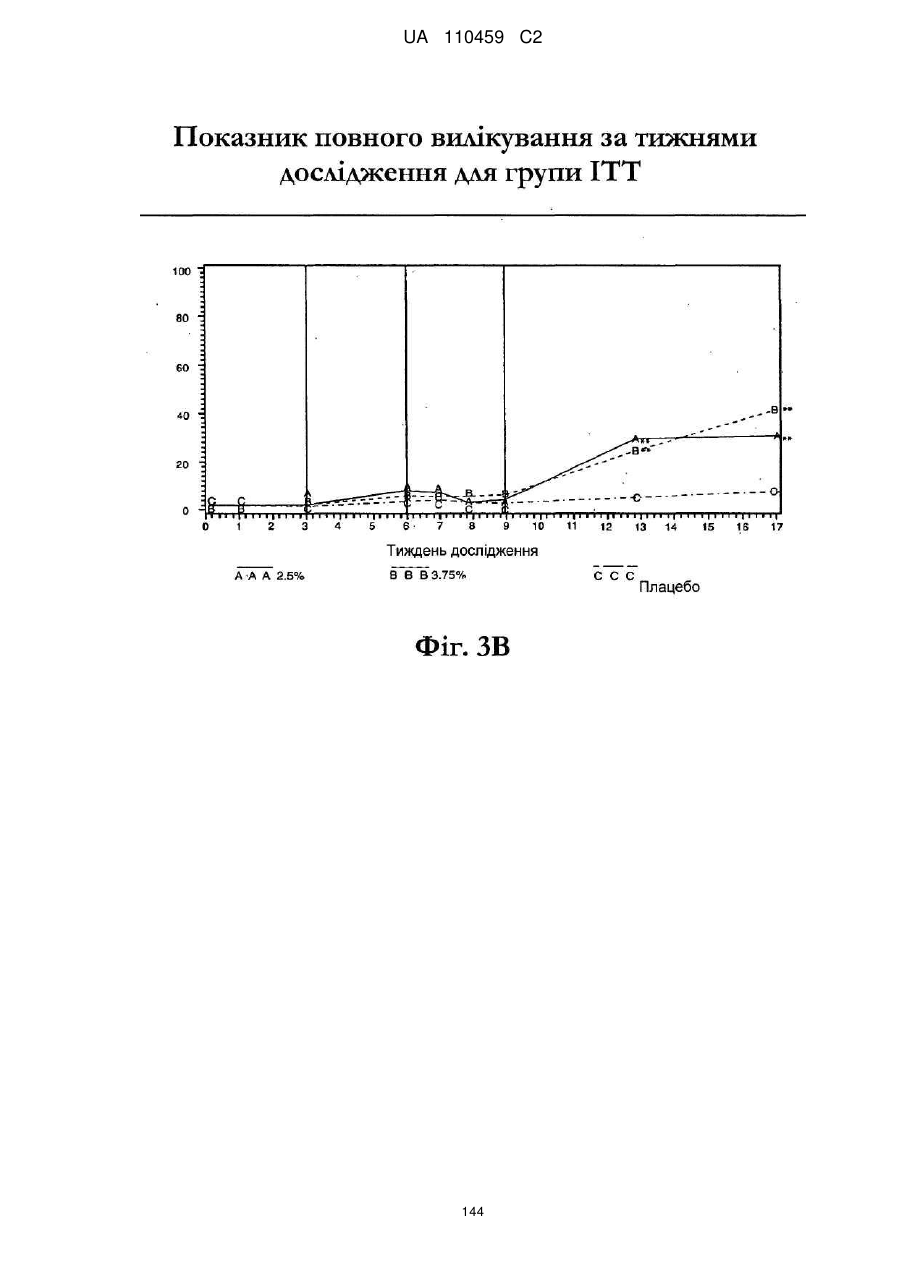
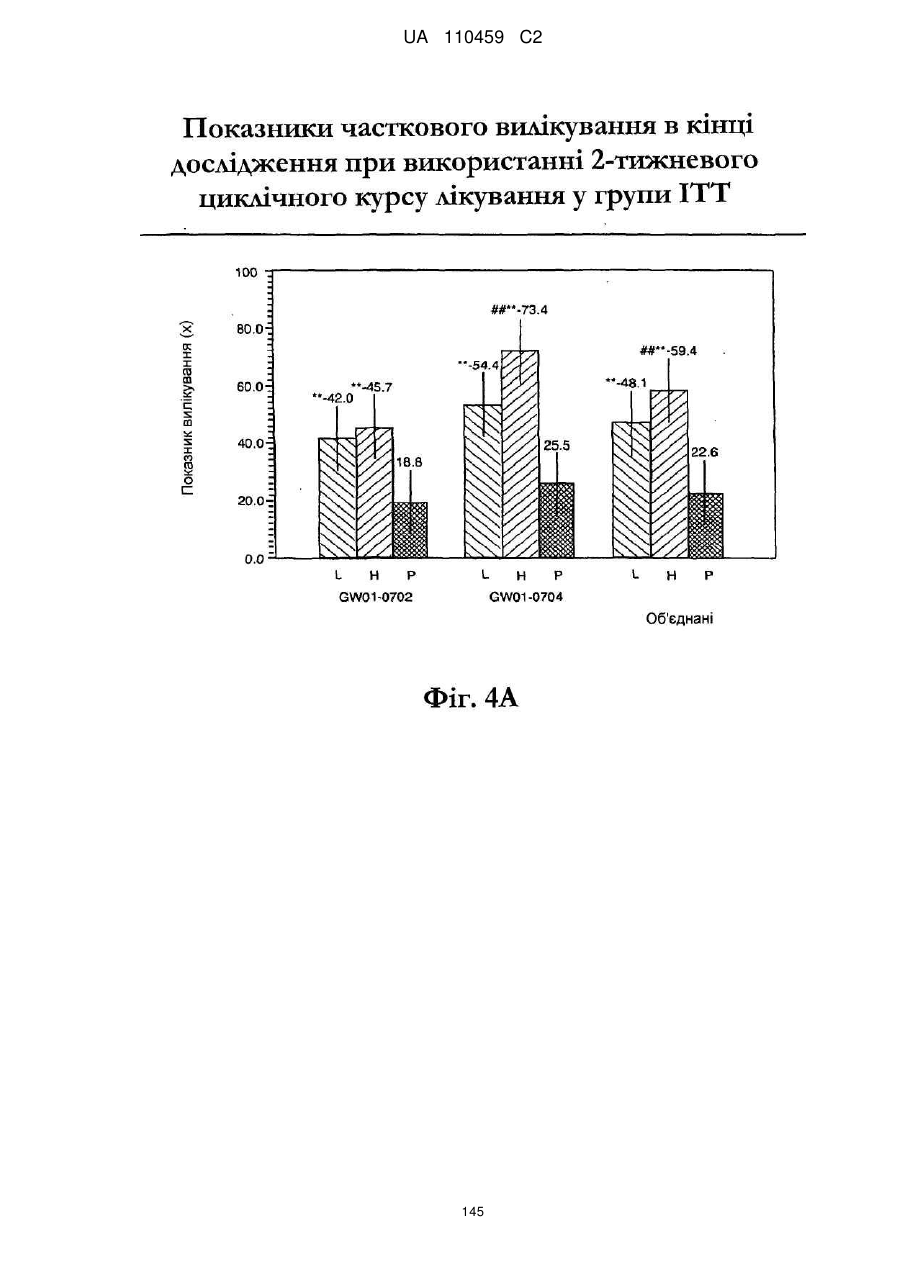
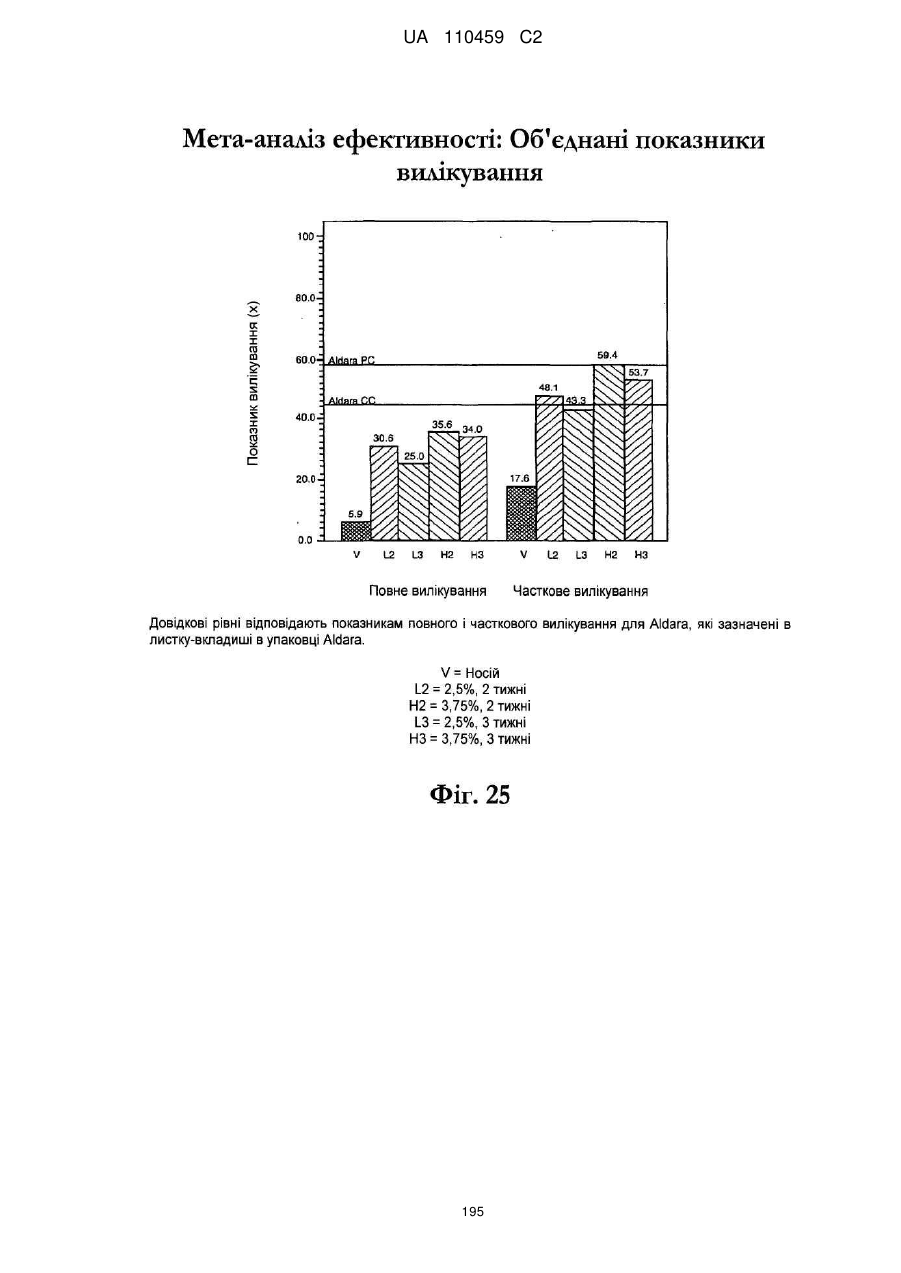
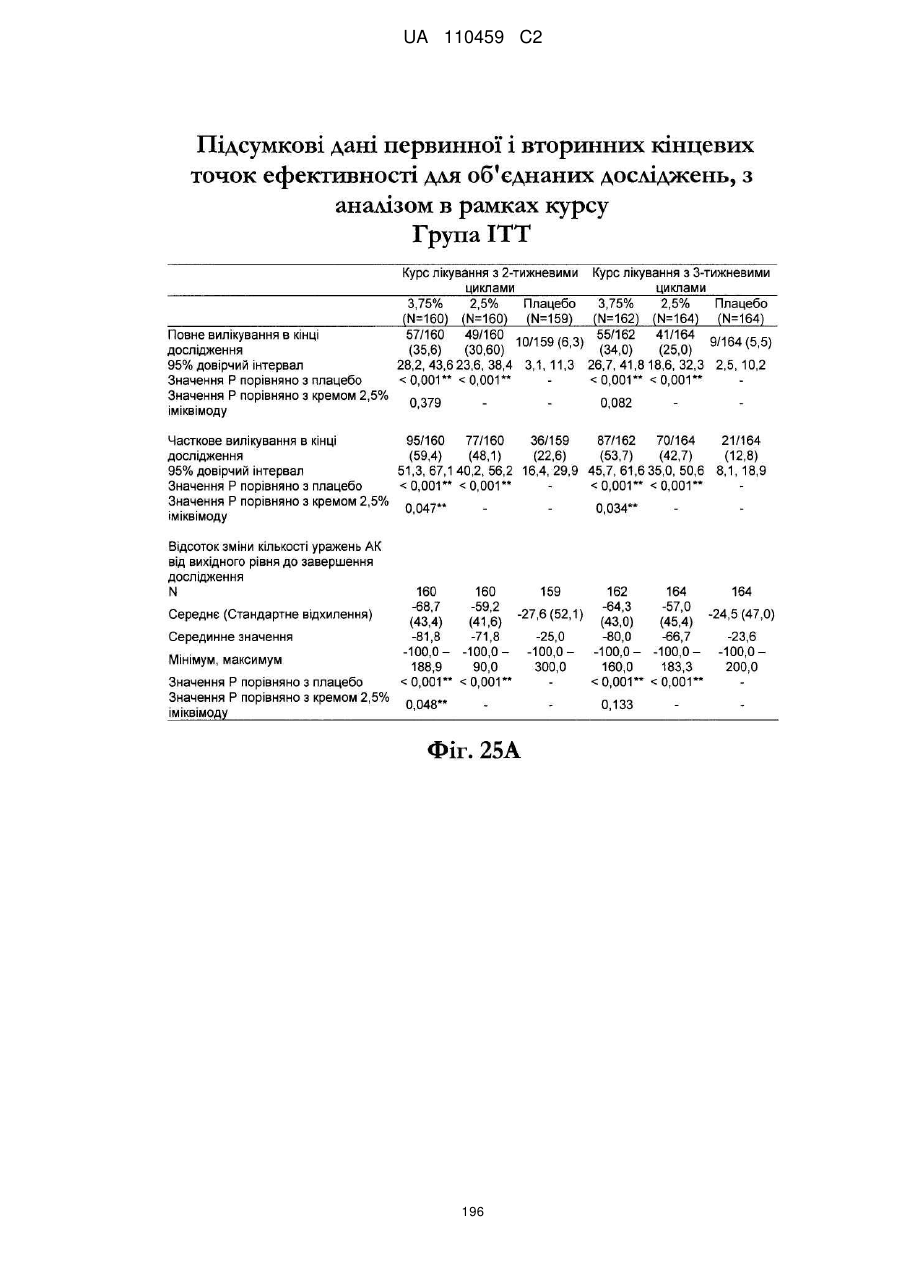
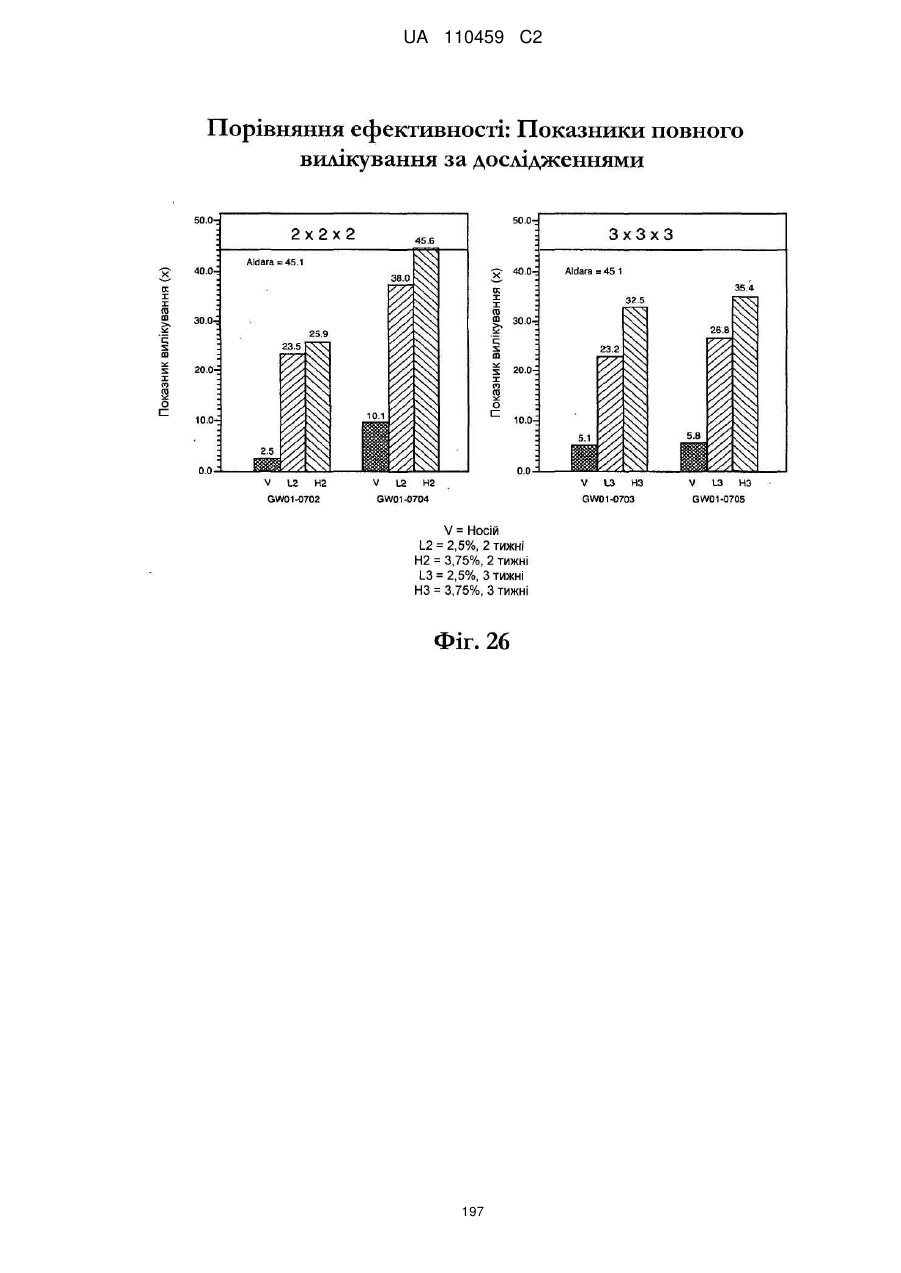
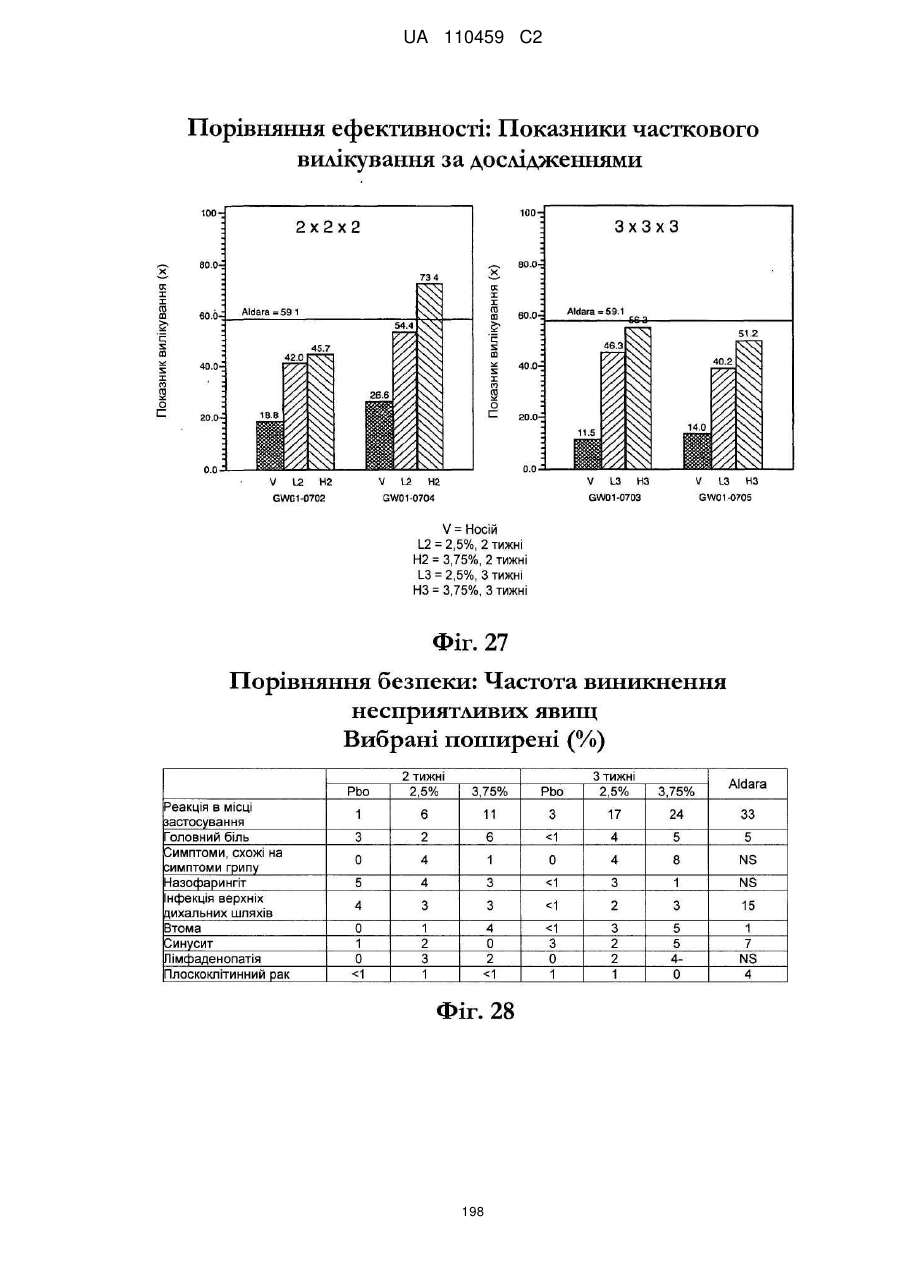
12. Композиція за будь-яким з пп. 1-9, де композиція з більш низьким вмістом іміквімоду вибирається з групи композицій із вмістом іміквімоду 2,5 мас. % і 3,75 мас. %, наведених у Таблиці 9.
13. Композиція іміквімоду для місцевого застосування, яка містить іміквімод у кількості близько 2,5 мас. % або близько 3,75 мас. % і фармацевтично прийнятний носій для іміквімоду, що містить жирну кислоту в кількості від 5 до 30 мас. %, де жирна кислота вибирається з групи, що складається з пальмітинової кислоти, лінолевої кислоти, стеаринової кислоти, ізостеаринової кислоти, неочищеної олеїнової кислоти, олеїнової кислоти високого ступеня очищення та їх сумішей, і де композиція являє собою крем, і де 250 мг крему містять 6,25 мг або 9,375 мг іміквімоду.
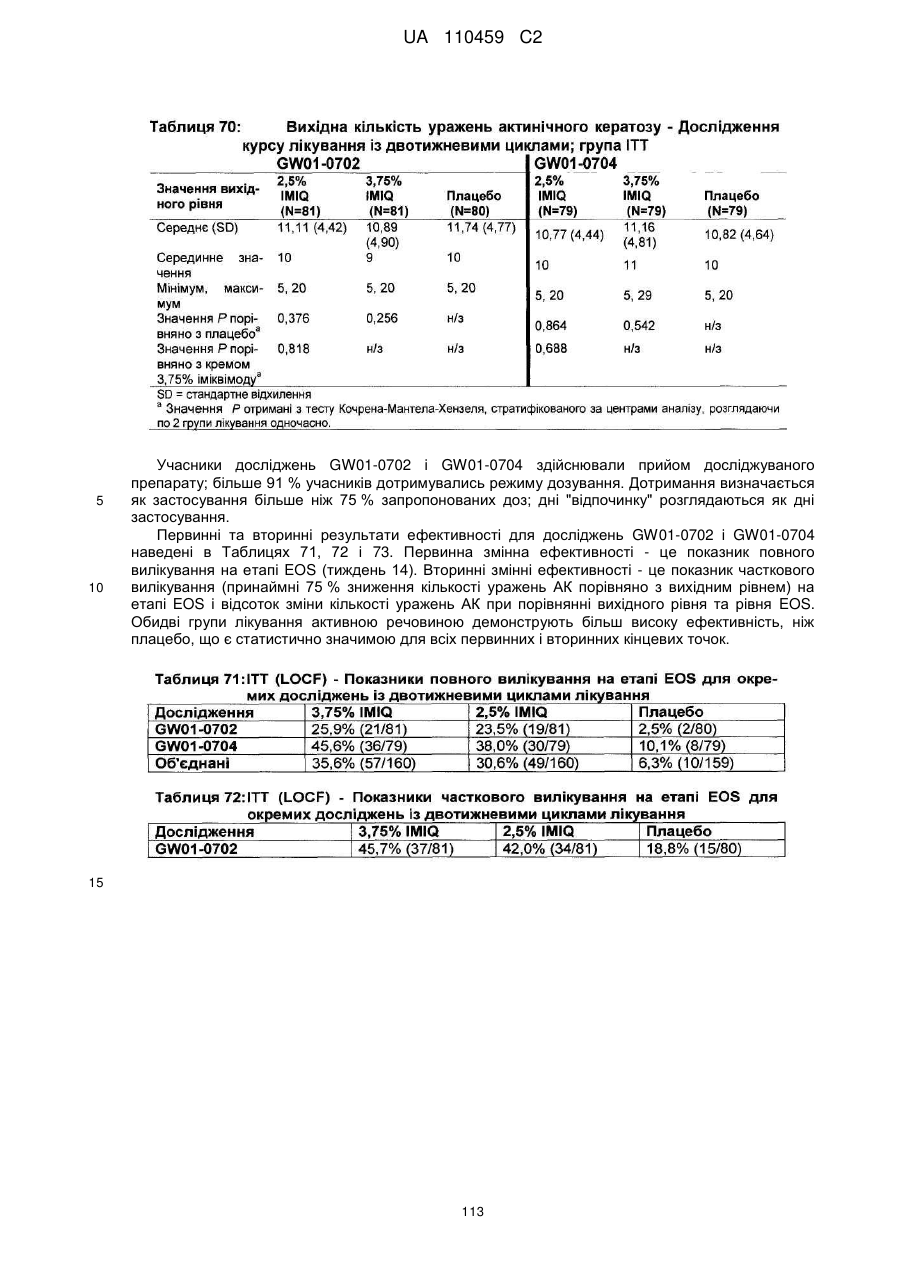
14. Композиція для місцевого застосування, яка містить іміквімод у кількості близько 2,5 мас. % або близько 3,75 мас. % і фармацевтично прийнятний носій для іміквімоду, що містить жирну кислоту в кількості від 5 до 30 мас. %, де жирна кислота являє собою ізостеаринову кислоту, і де композиція являє собою крем, і де 250 мг крему містять 6,25 мг або 9,375 мг іміквімоду.
15. Спосіб лікування суб'єкта, у якого діагностовано актинічний кератоз, що включає нанесення композиції за будь-яким з пп. 1-14 на оброблювану область один раз на день, тривалістю до двох тижнів з завершенням першого циклу, перерву тривалістю до двох тижнів, протягом яких композиція з більш низьким вмістом іміквімоду не наноситься, нанесення зазначеної композиції на оброблювану область один раз на день, тривалістю до двох тижнів з завершенням другого циклу і досягненням принаймні часткового очищення місць ураження АК.
16. Спосіб за п. 15, який включає нанесення композиції за будь-яким з пп. 1-14 на оброблювану область один раз на день протягом двох тижнів із завершенням першого циклу, перерву протягом двох тижнів, протягом яких іміквімод не наноситься, нанесення композиції за будь-яким з пп. 1-14 на оброблювану область один раз на день протягом двох тижнів із завершенням другого циклу і досягненням принаймні часткового очищення місць ураження АК.
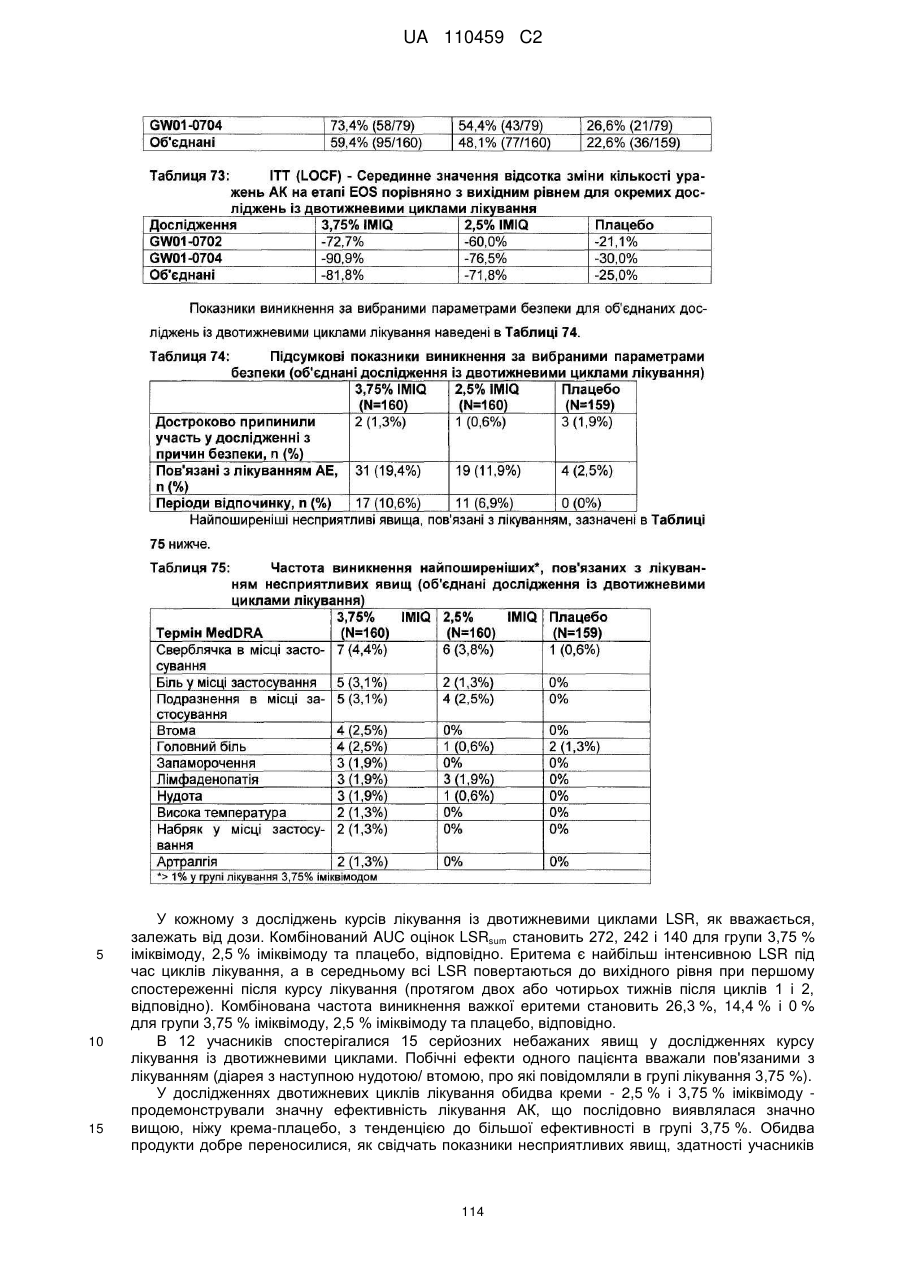
17. Спосіб за п. 15, де спосіб включає:
(a) місцеве нанесення композиції іміквімоду один раз на день на все обличчя або на лисіючу частину голови імунокомпетентного дорослого пацієнта протягом першого двотижневого періоду лікування; і
(b) місцеве нанесення композиції іміквімоду один раз на день на все обличчя або на лисіючу частину голови імунокомпетентного дорослого пацієнта протягом другого двотижневого періоду; і де перший і другий періоди розділені одно- або двотижневим періодом без обробки, протягом якого зазначена композиція іміквімоду не застосовується імунокомпетентним дорослим пацієнтом,
і де курс лікування завершується через 6 тижнів.
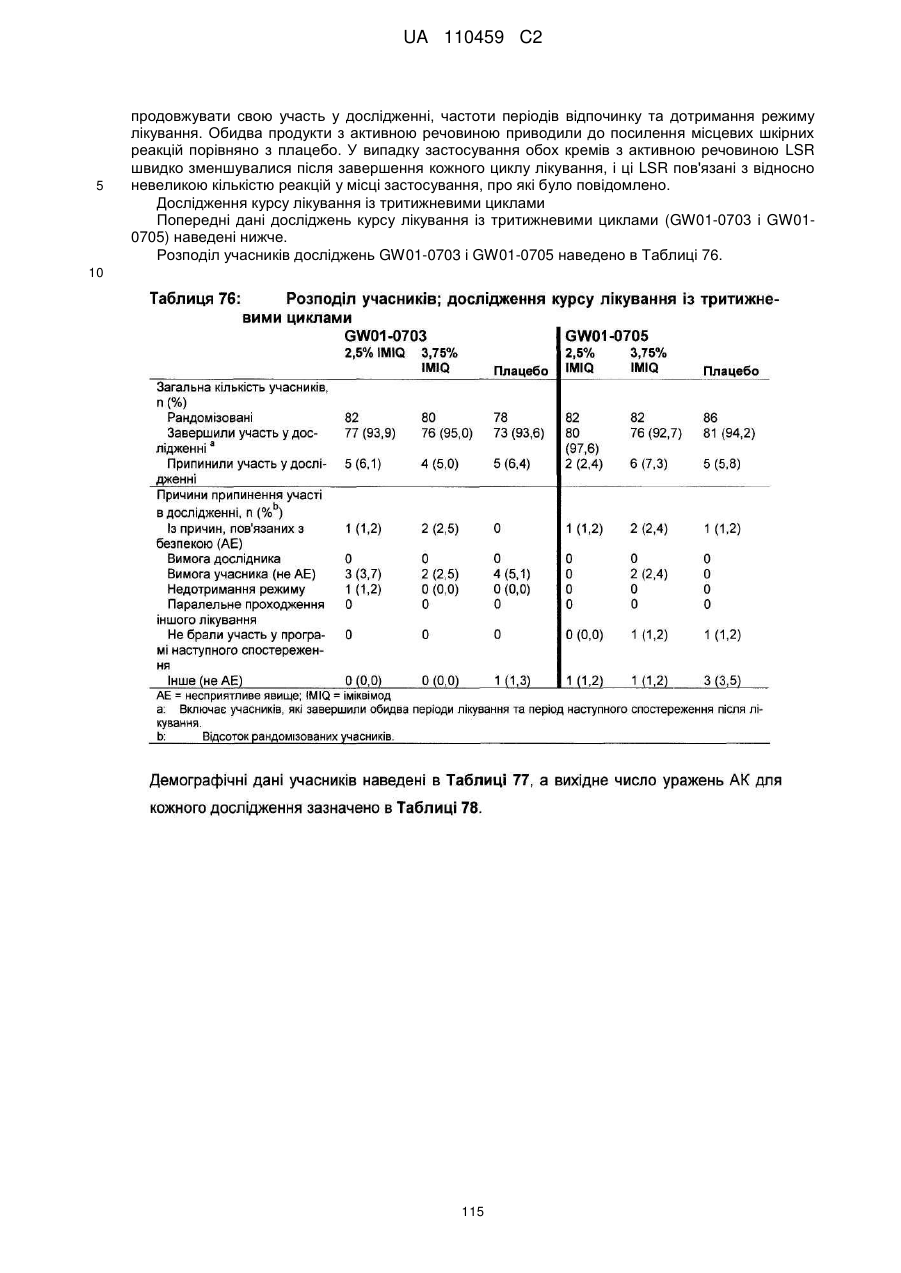
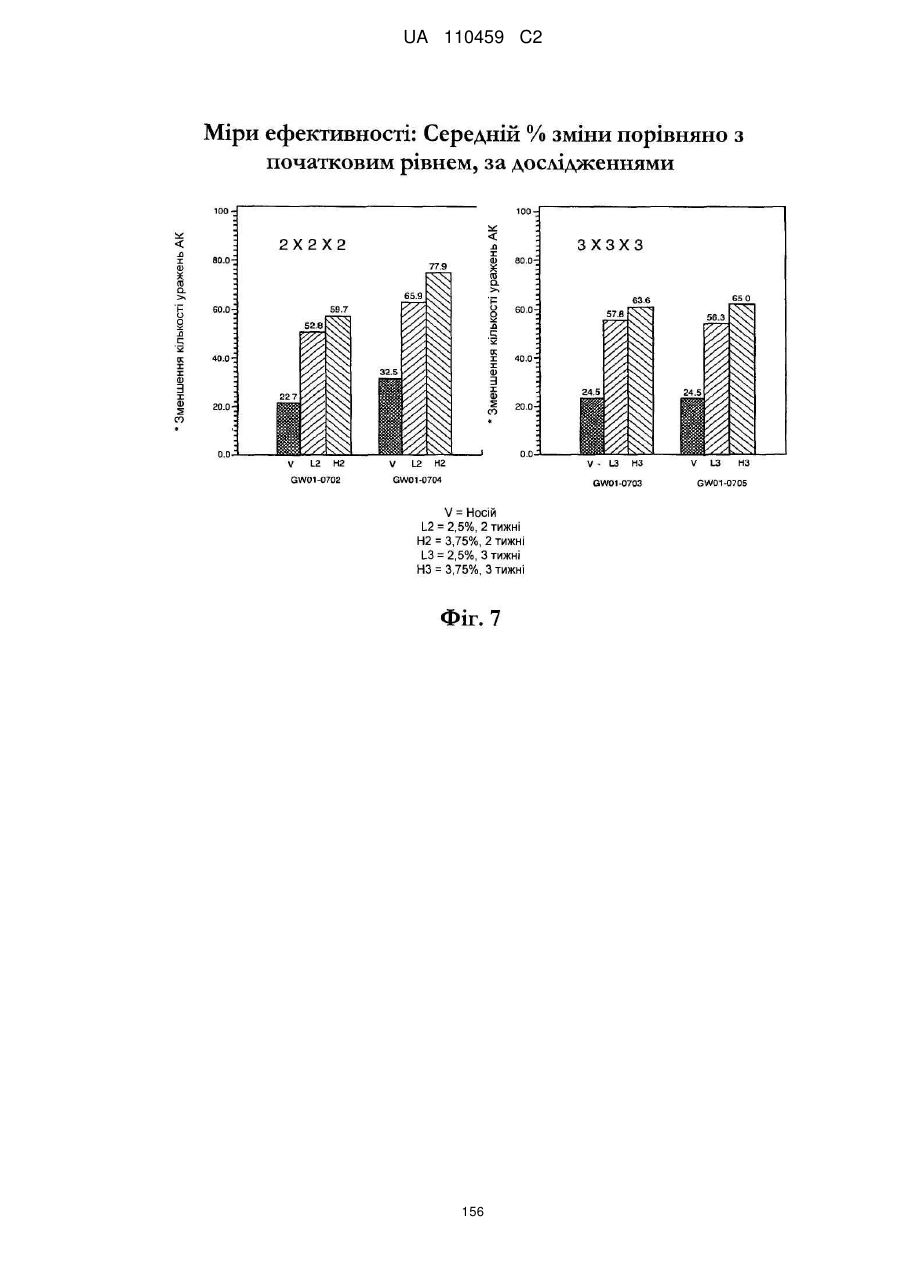
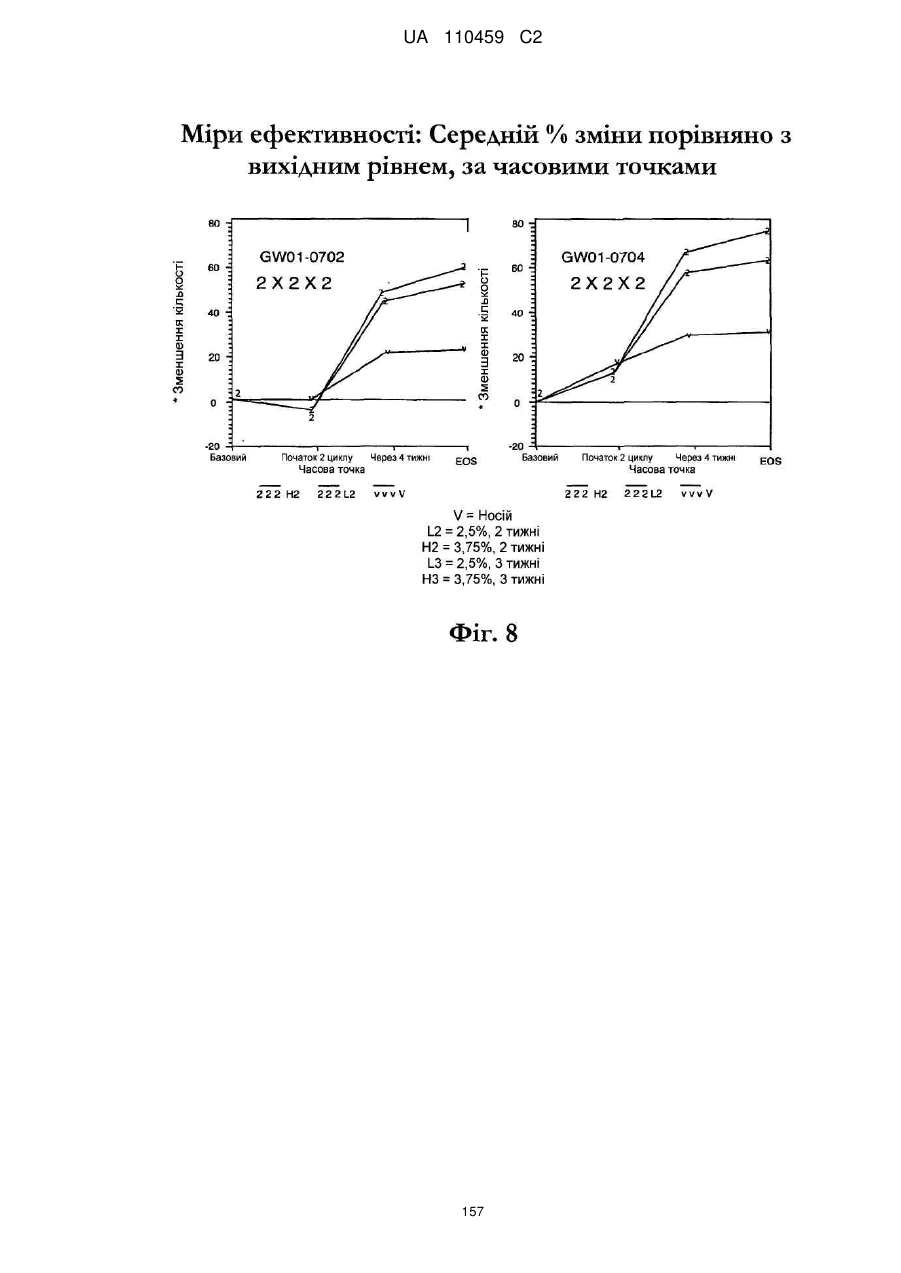
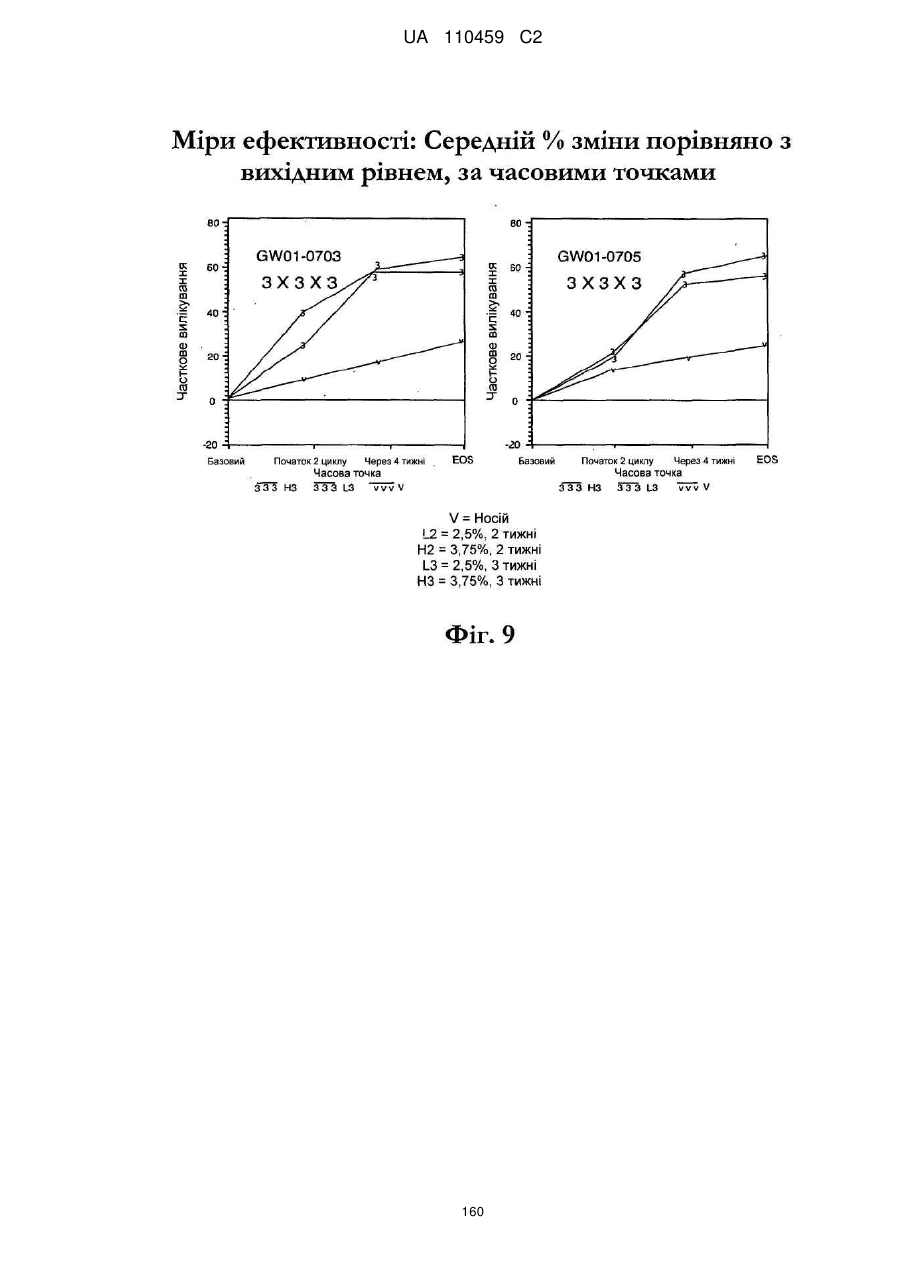
18. Спосіб за п. 17, де наноситься 250-500 мг композиції іміквімоду.
19. Спосіб за п. 17, де композиція іміквімоду не видаляється зі шкіри протягом близько 8 годин.
20. Спосіб за п. 17, де композиція іміквімоду містить іміквімод у кількості 2,5 мас. %.
21. Спосіб за п. 20, де щоденно наноситься від 6,25 до 12,5 мг іміквімоду.
22. Спосіб за п. 20, де від 43,75 до 87,5 мг іміквімоду наноситься за один тиждень двотижневого періоду лікування.
23. Спосіб за п. 20, де від 131,2 до 262,5 мг іміквімоду наноситься за двотижневий період лікування.
24. Спосіб за п. 20, де від 175 мг до 350 мг іміквімоду наноситься протягом курсу лікування з 6-ти тижнів.
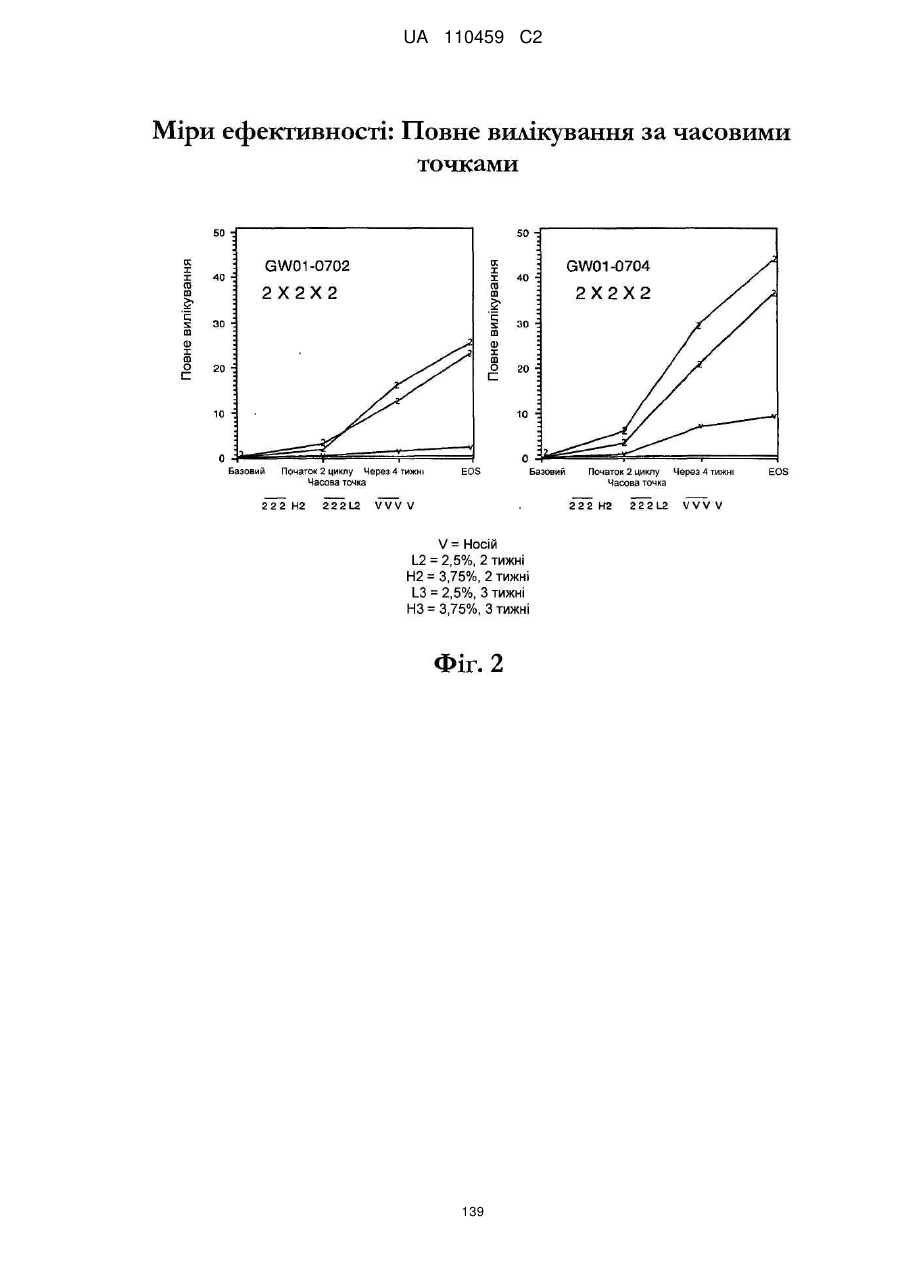
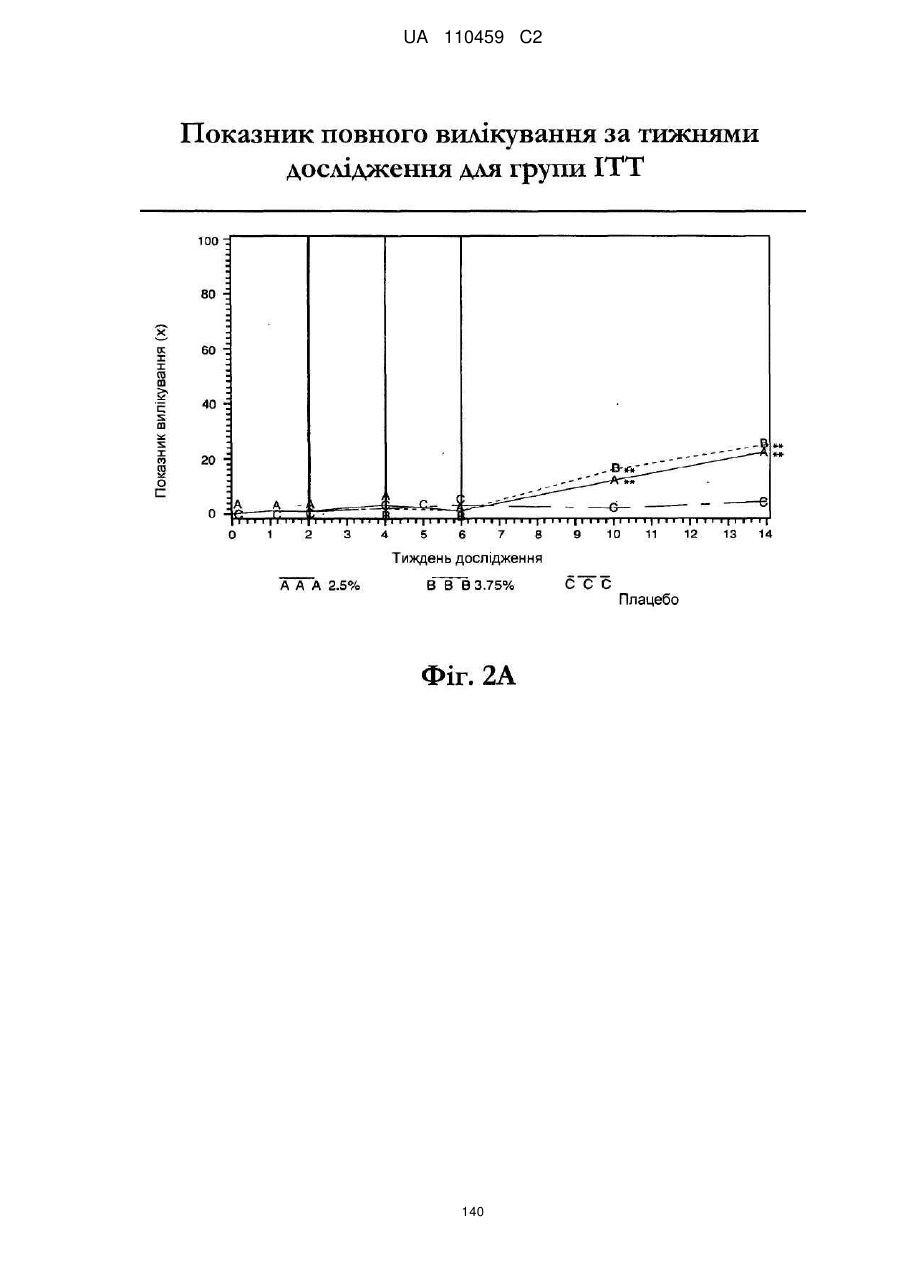
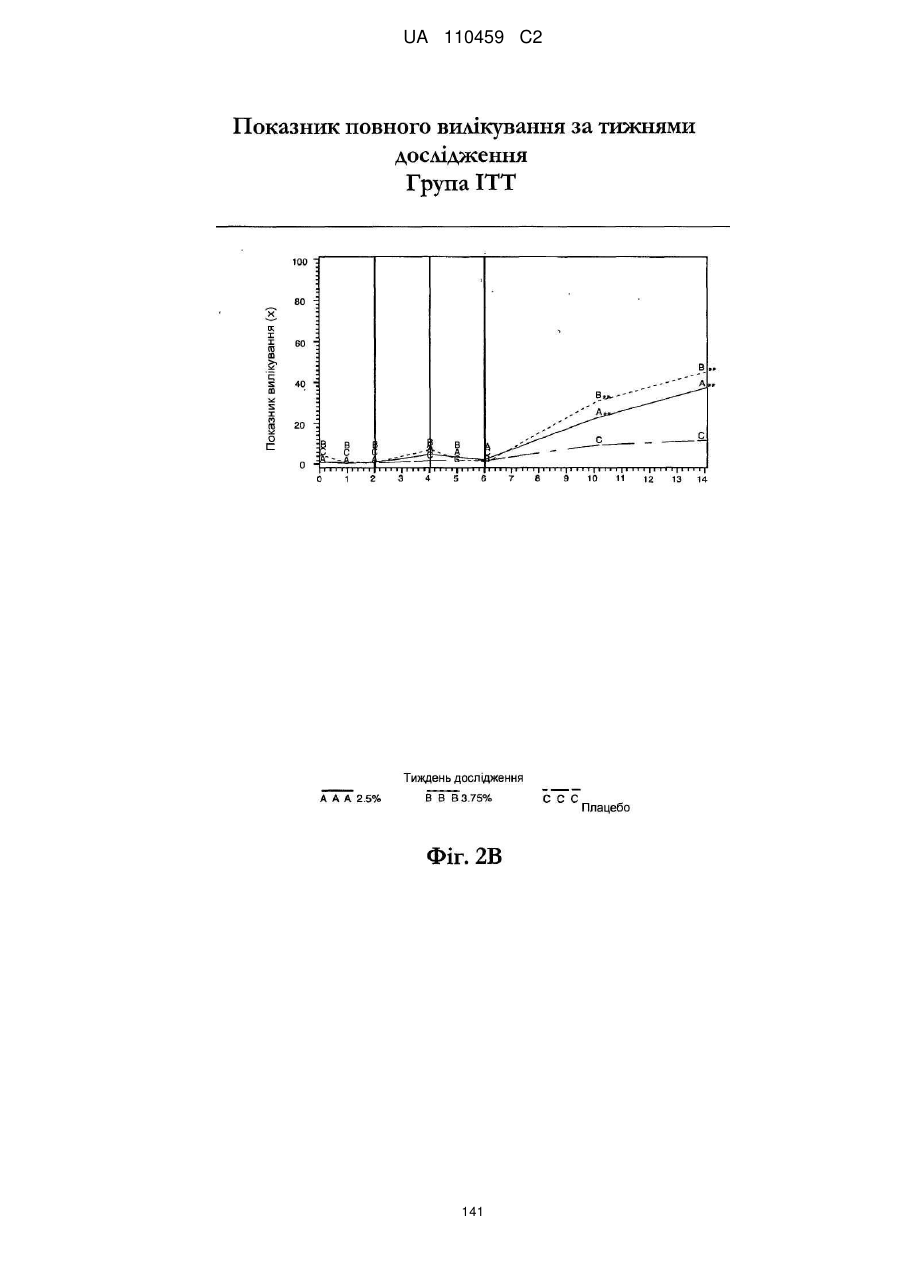
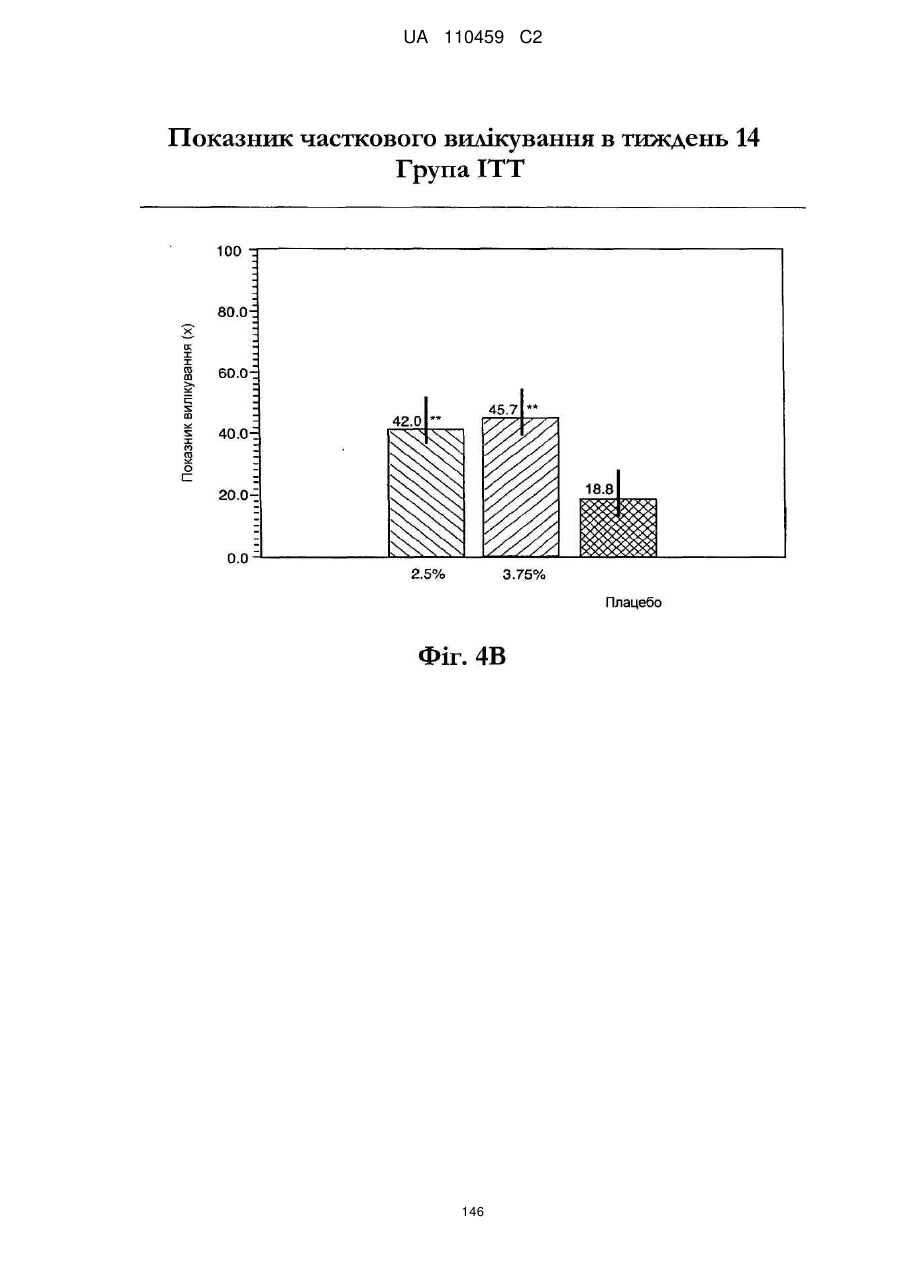
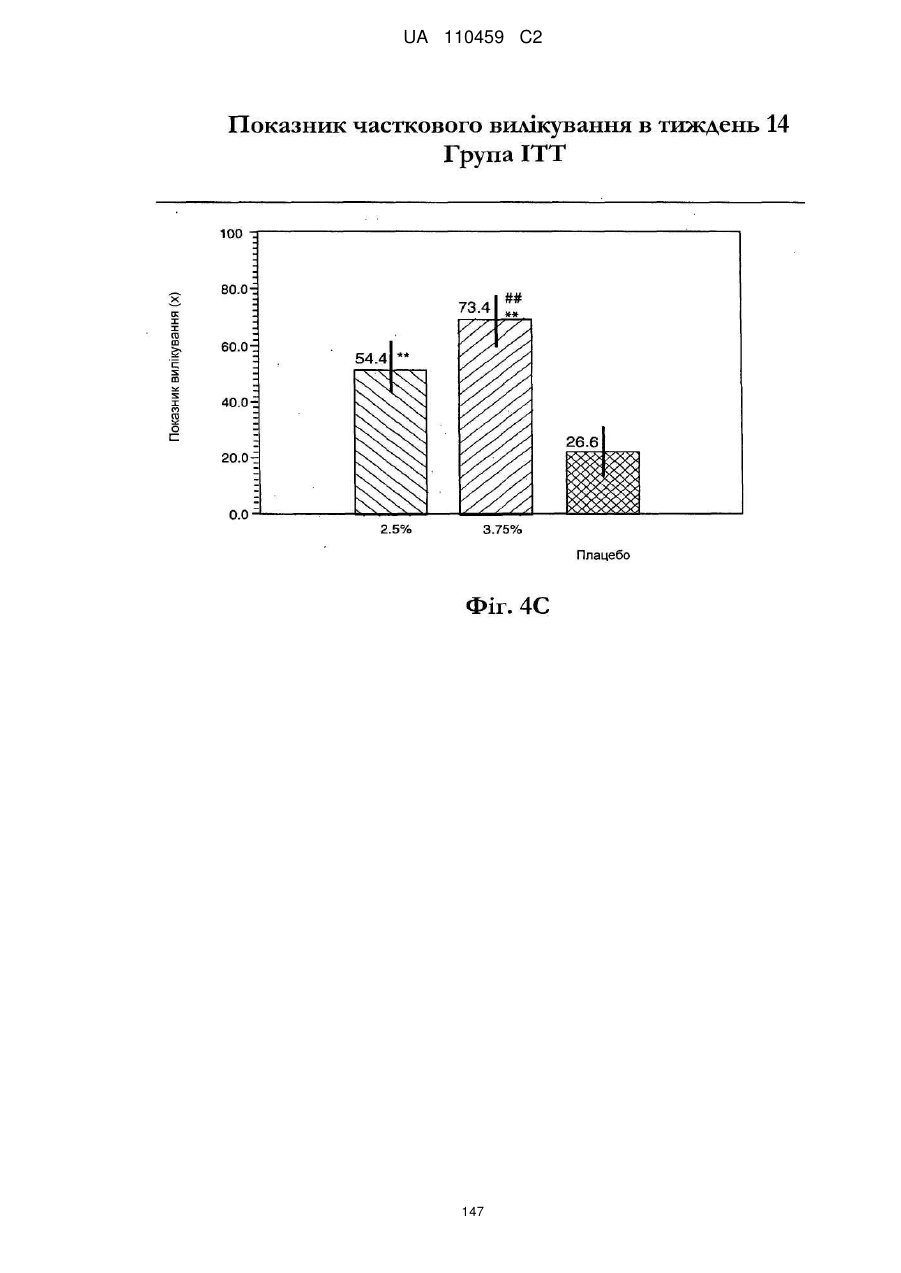
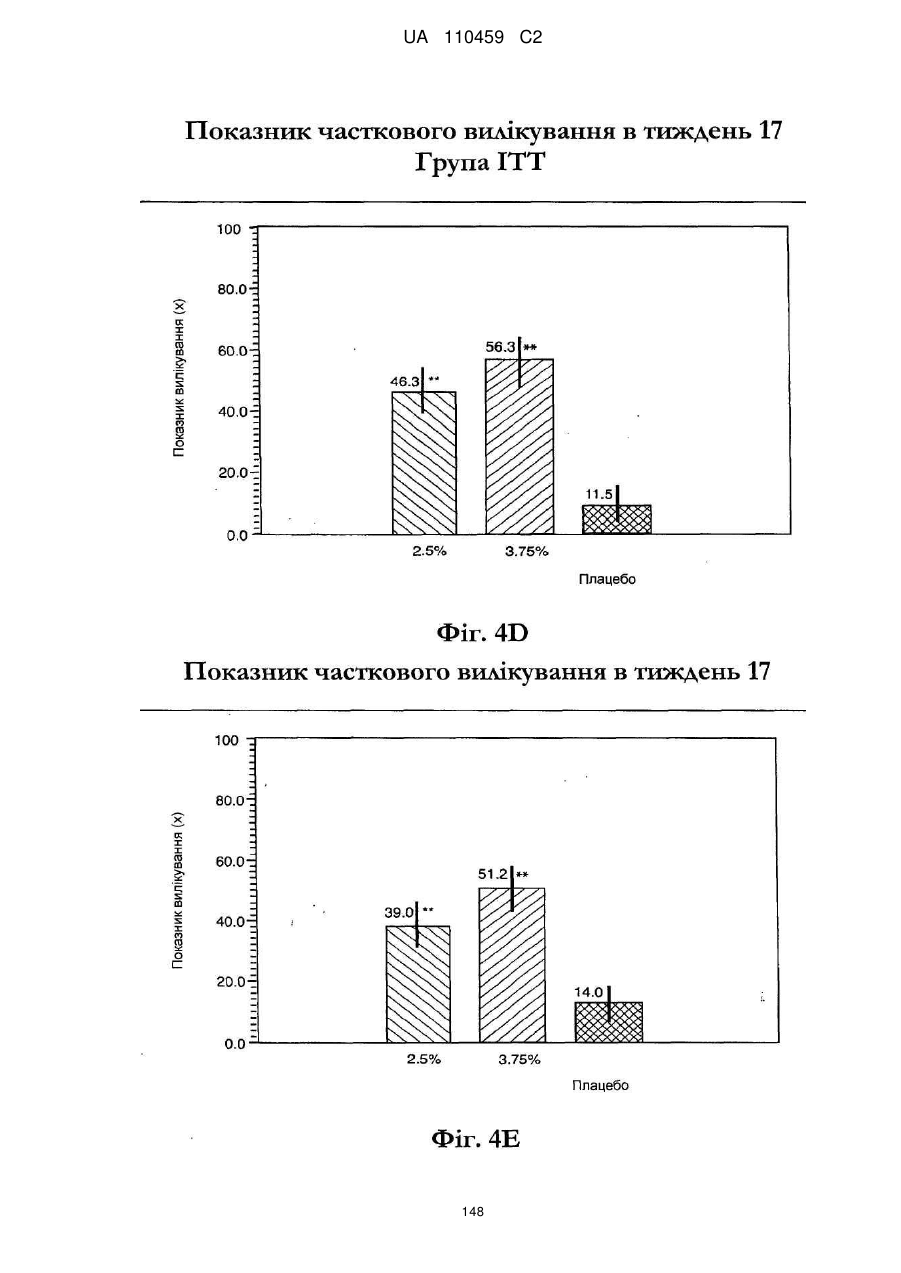
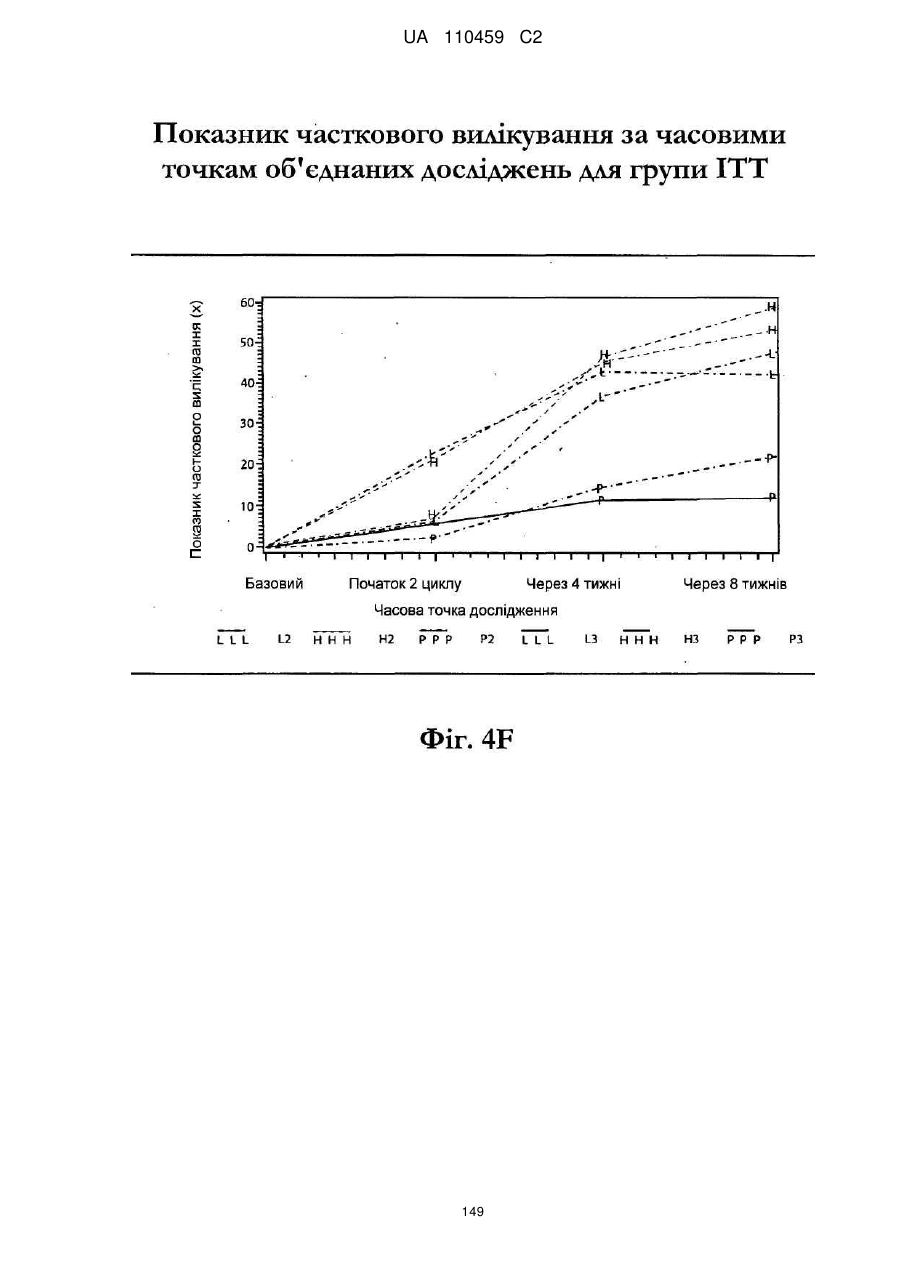
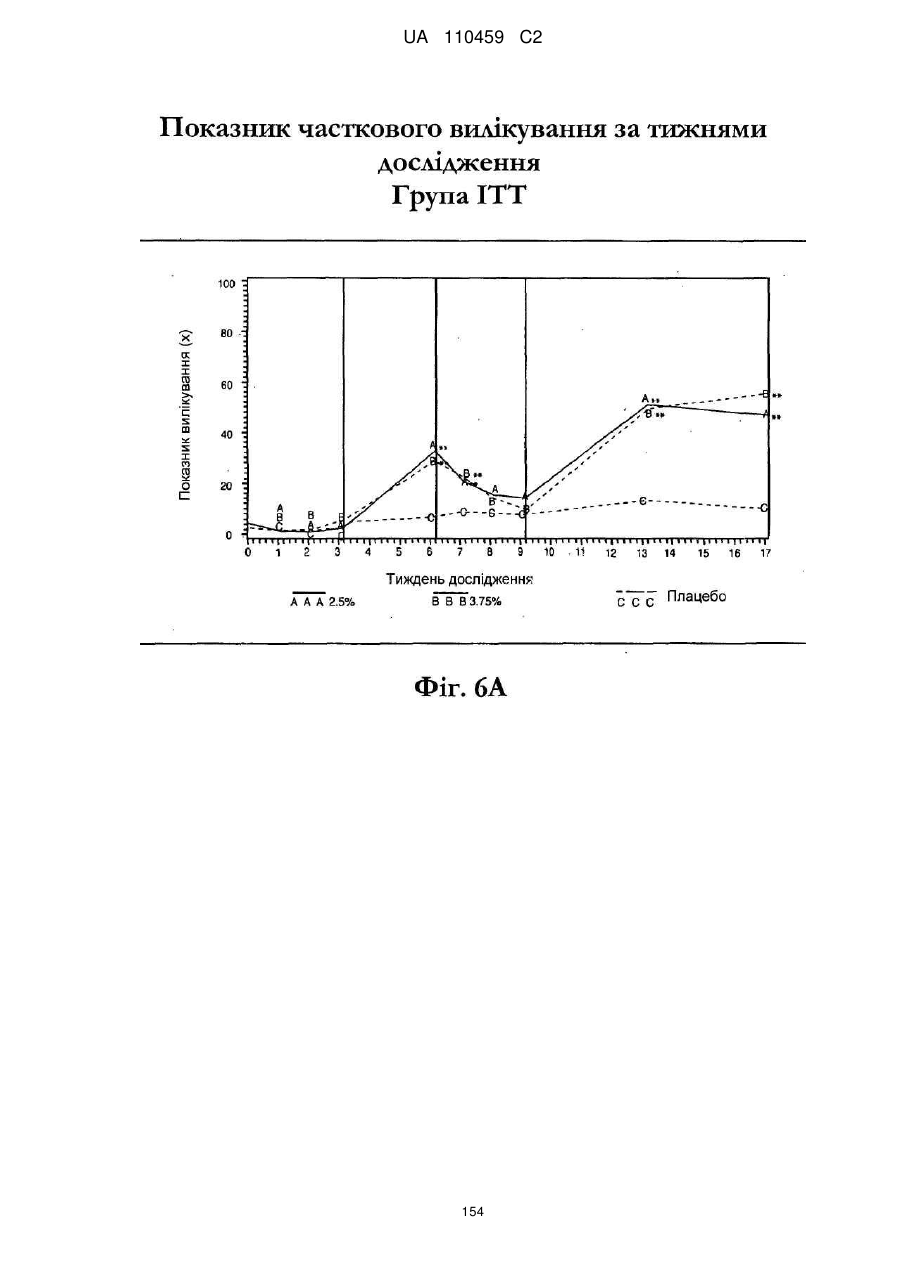
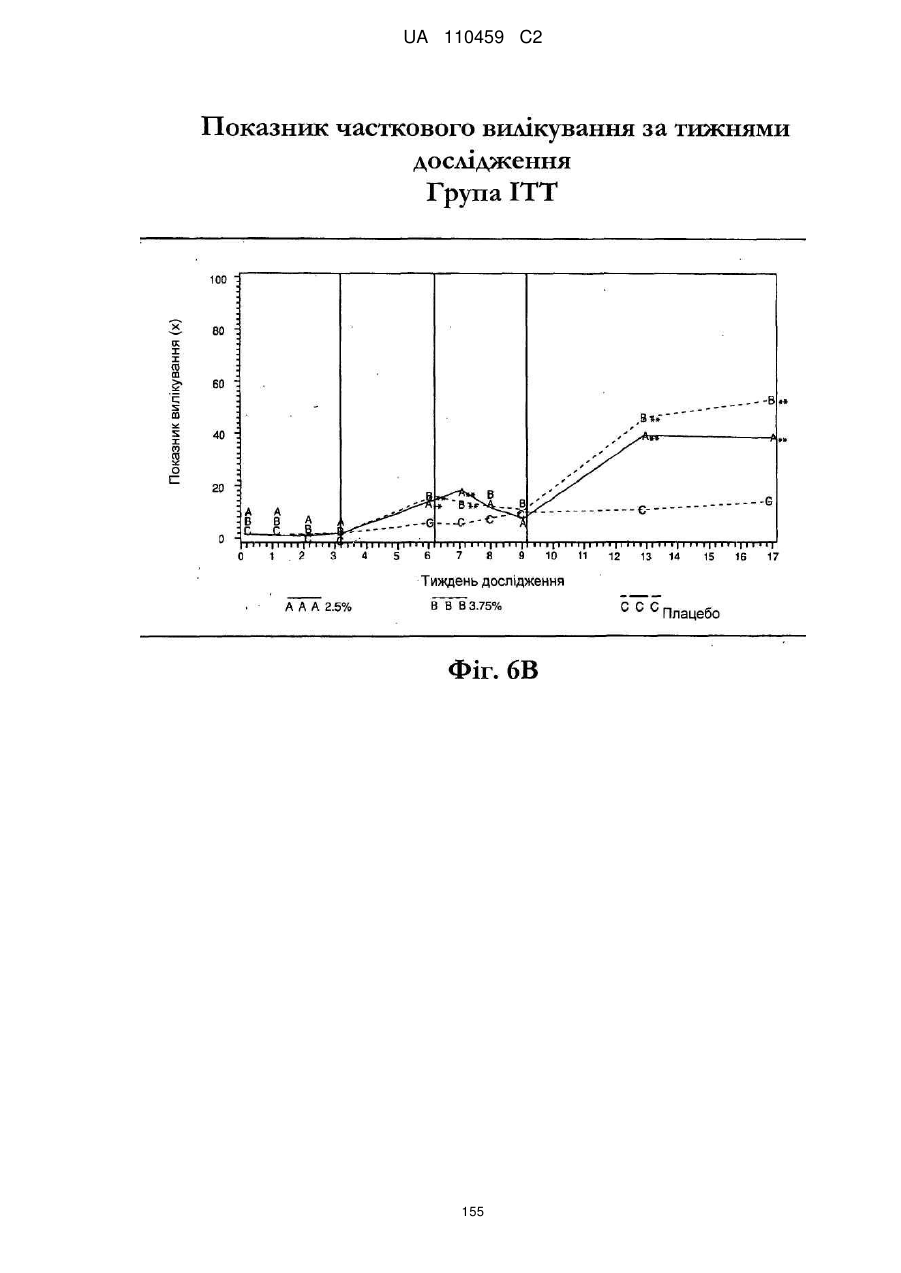
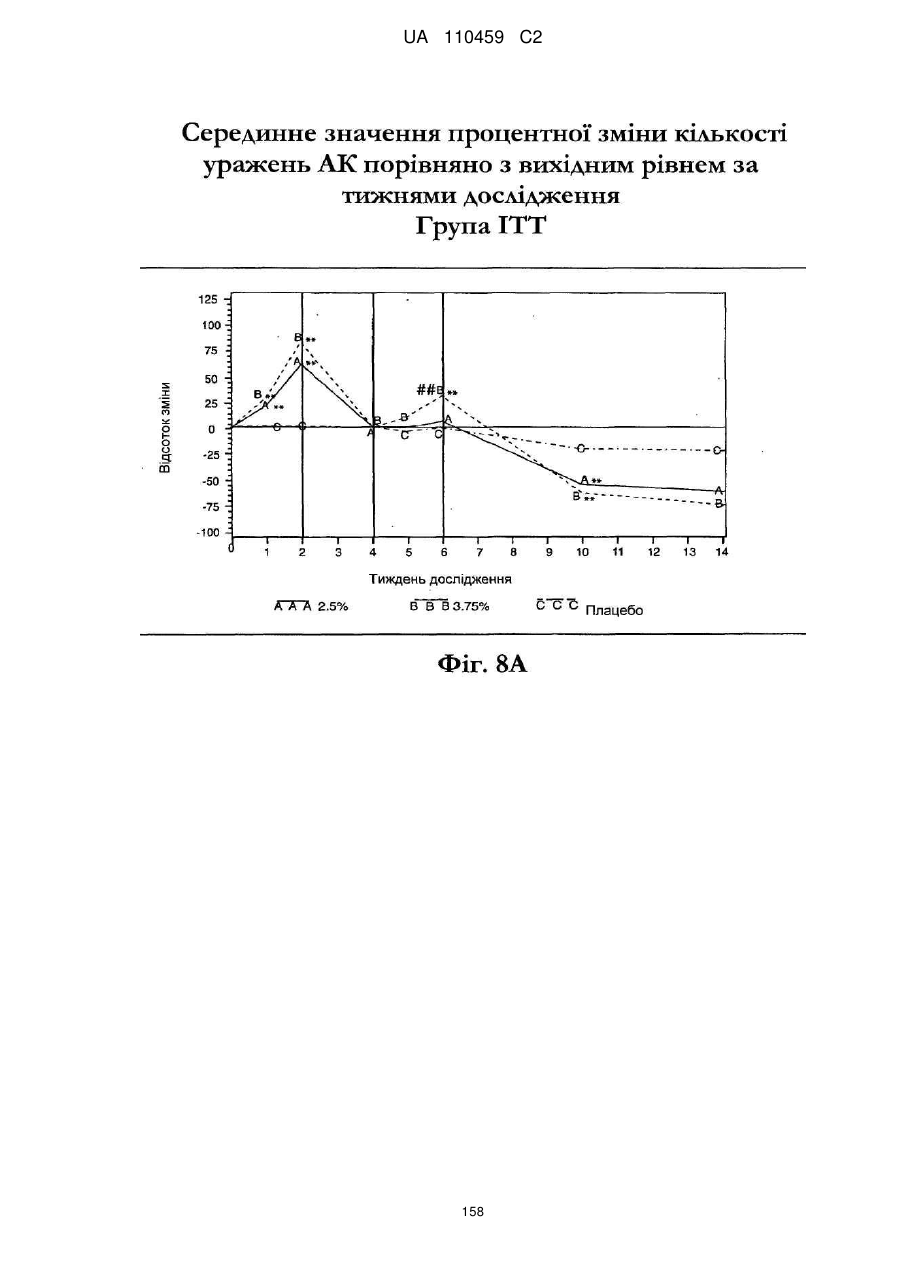
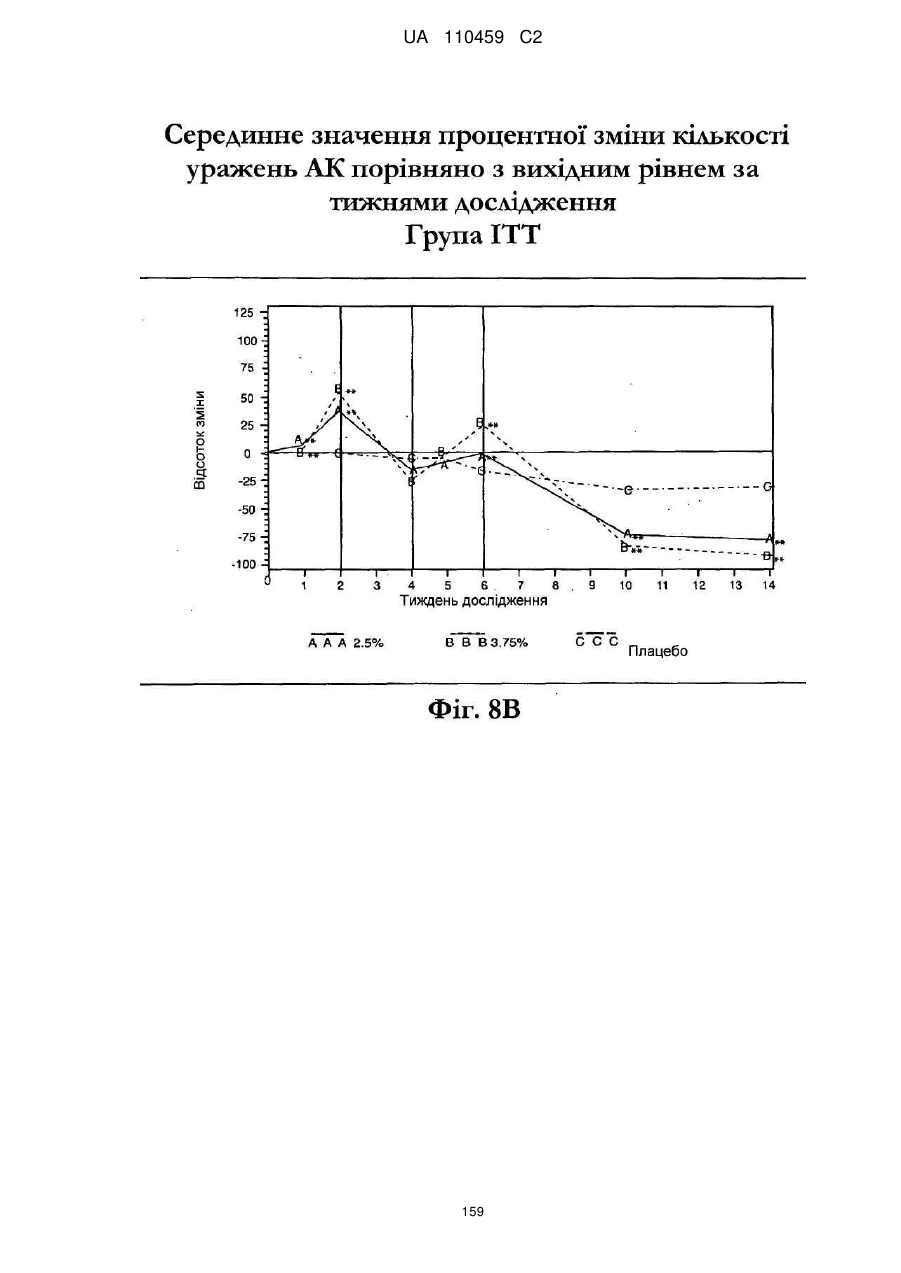
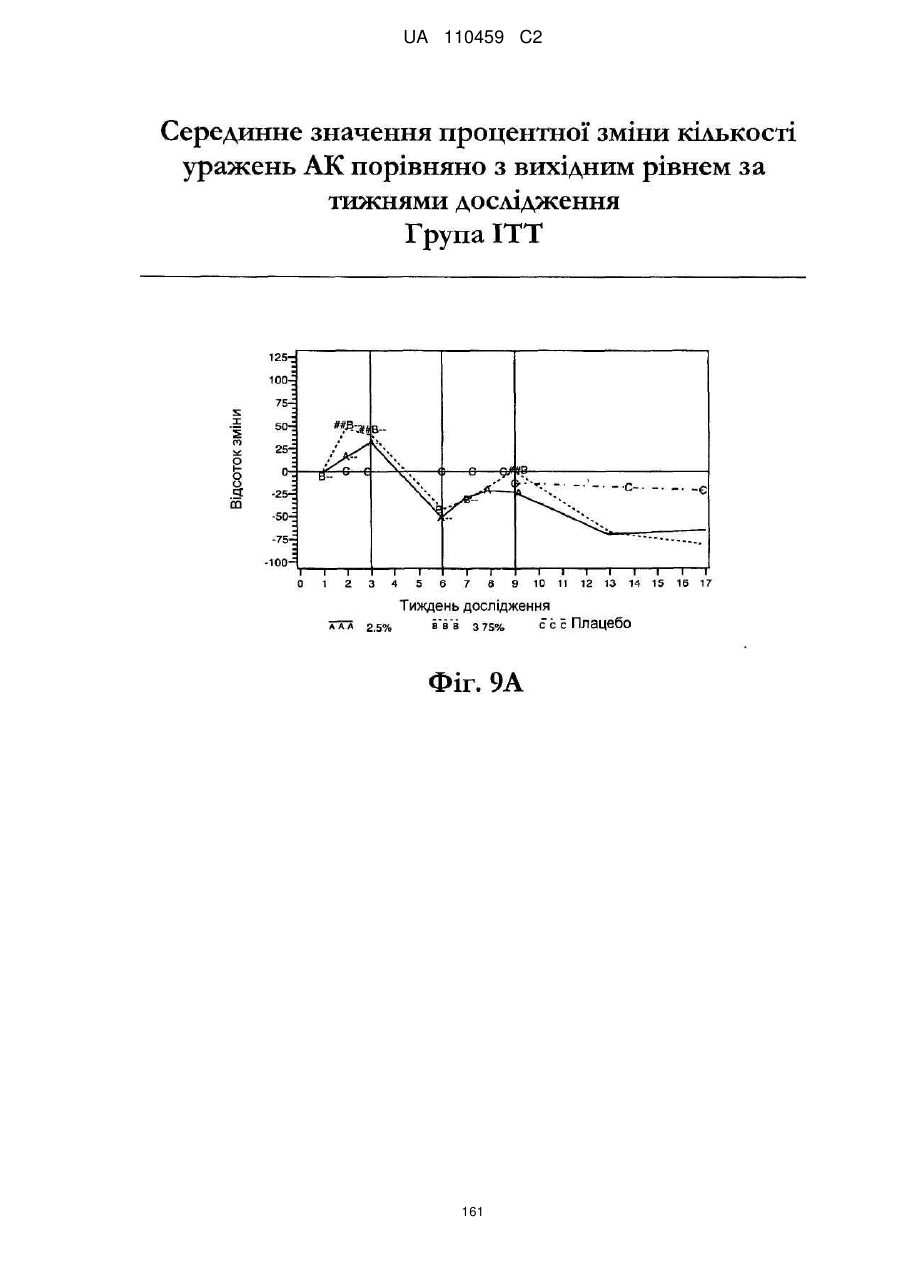
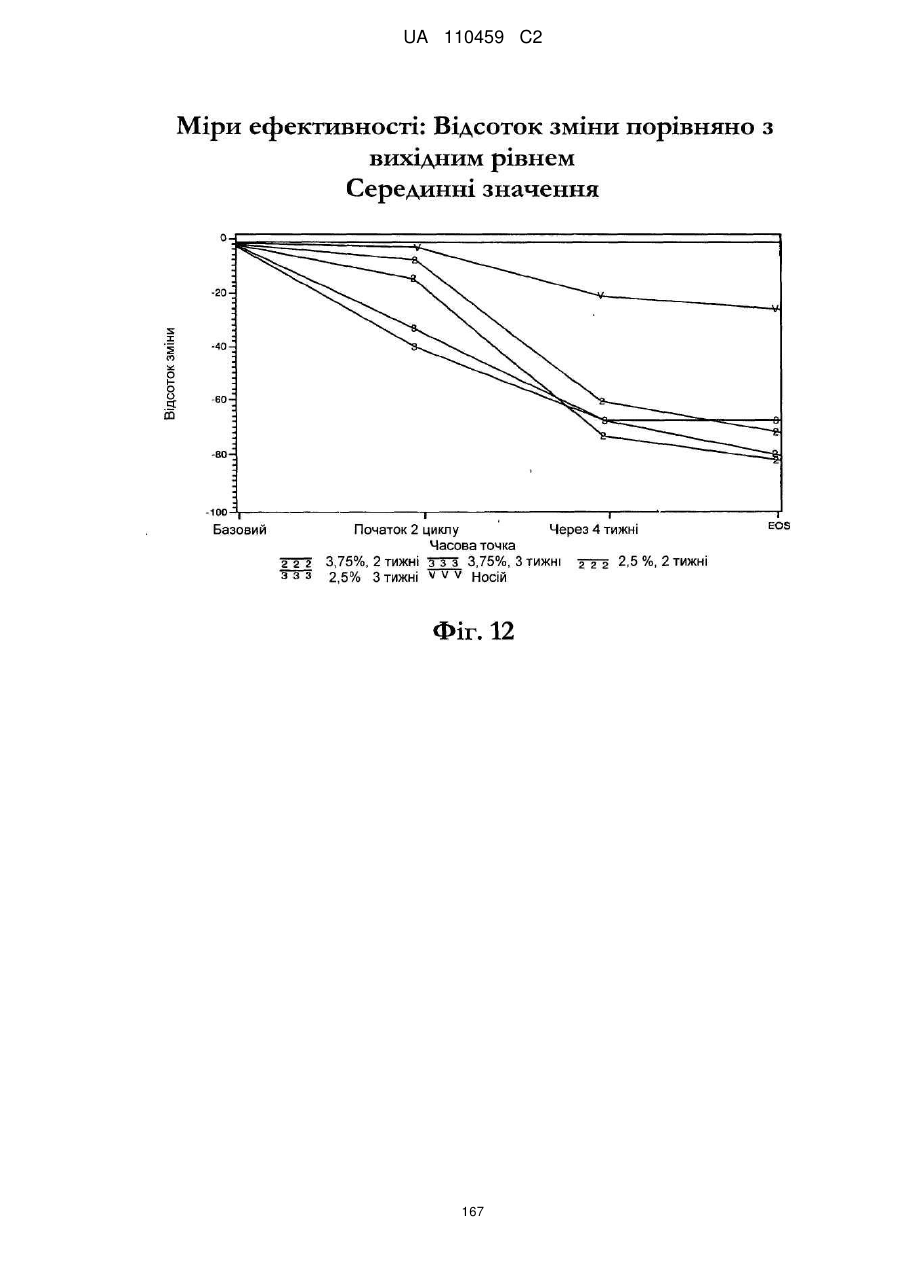
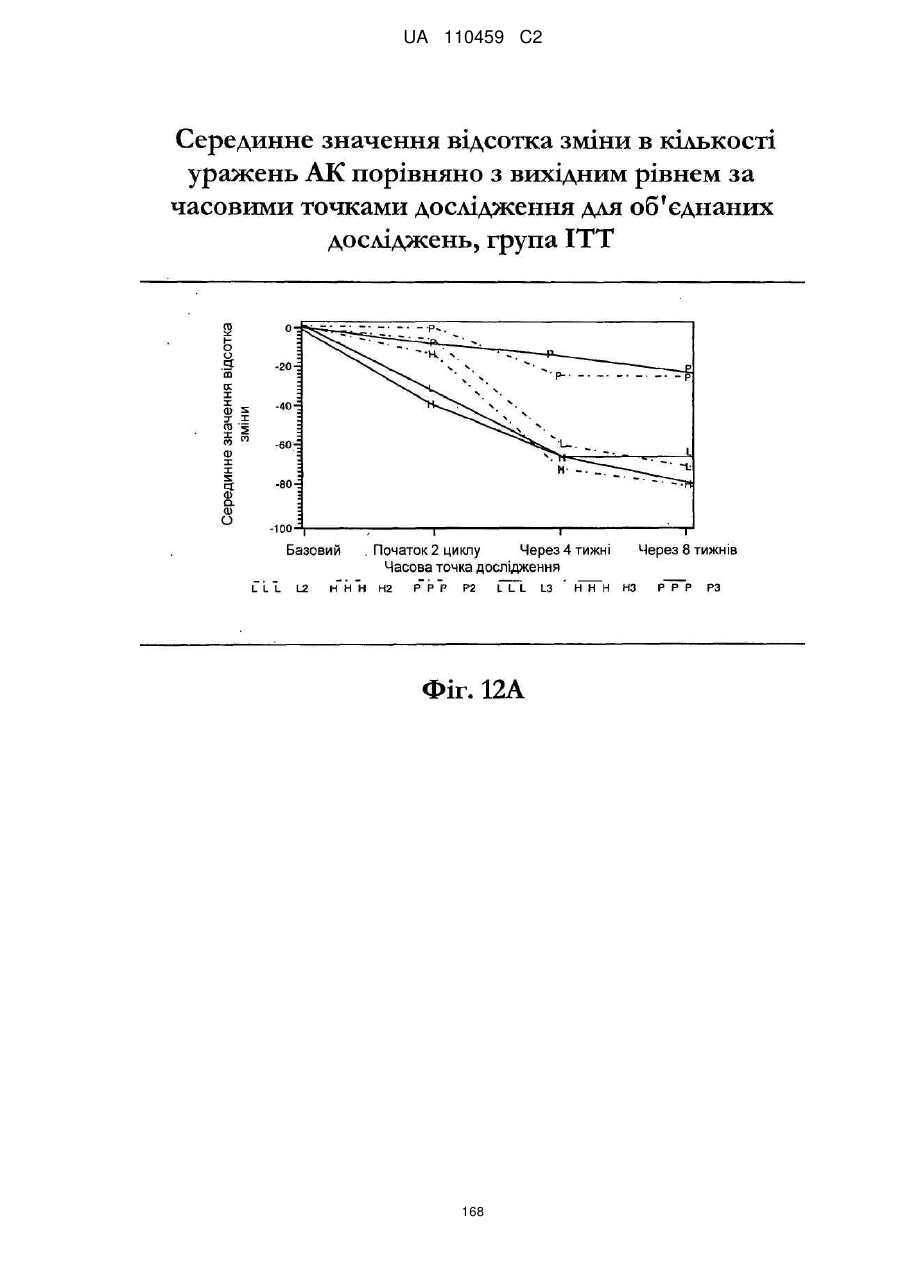
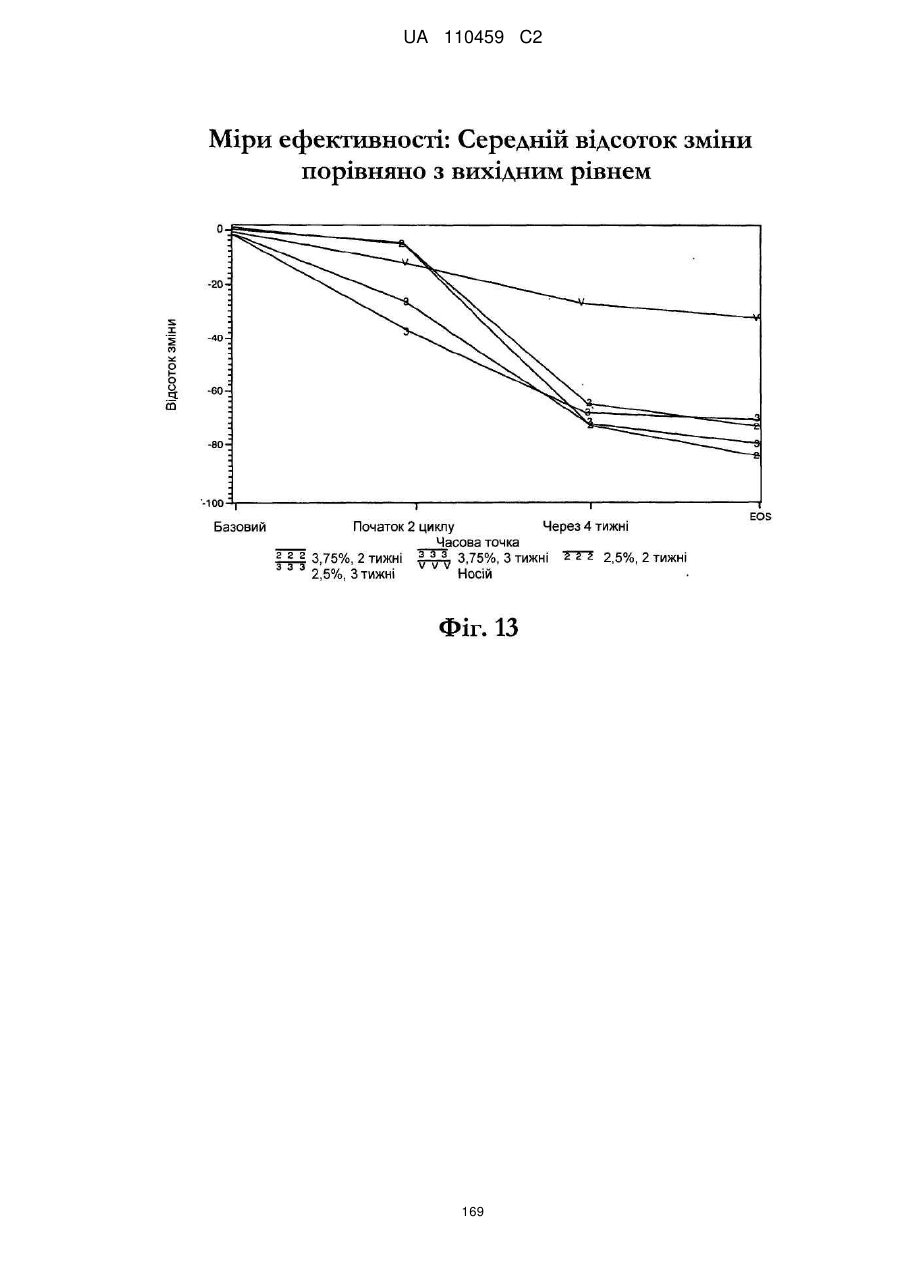
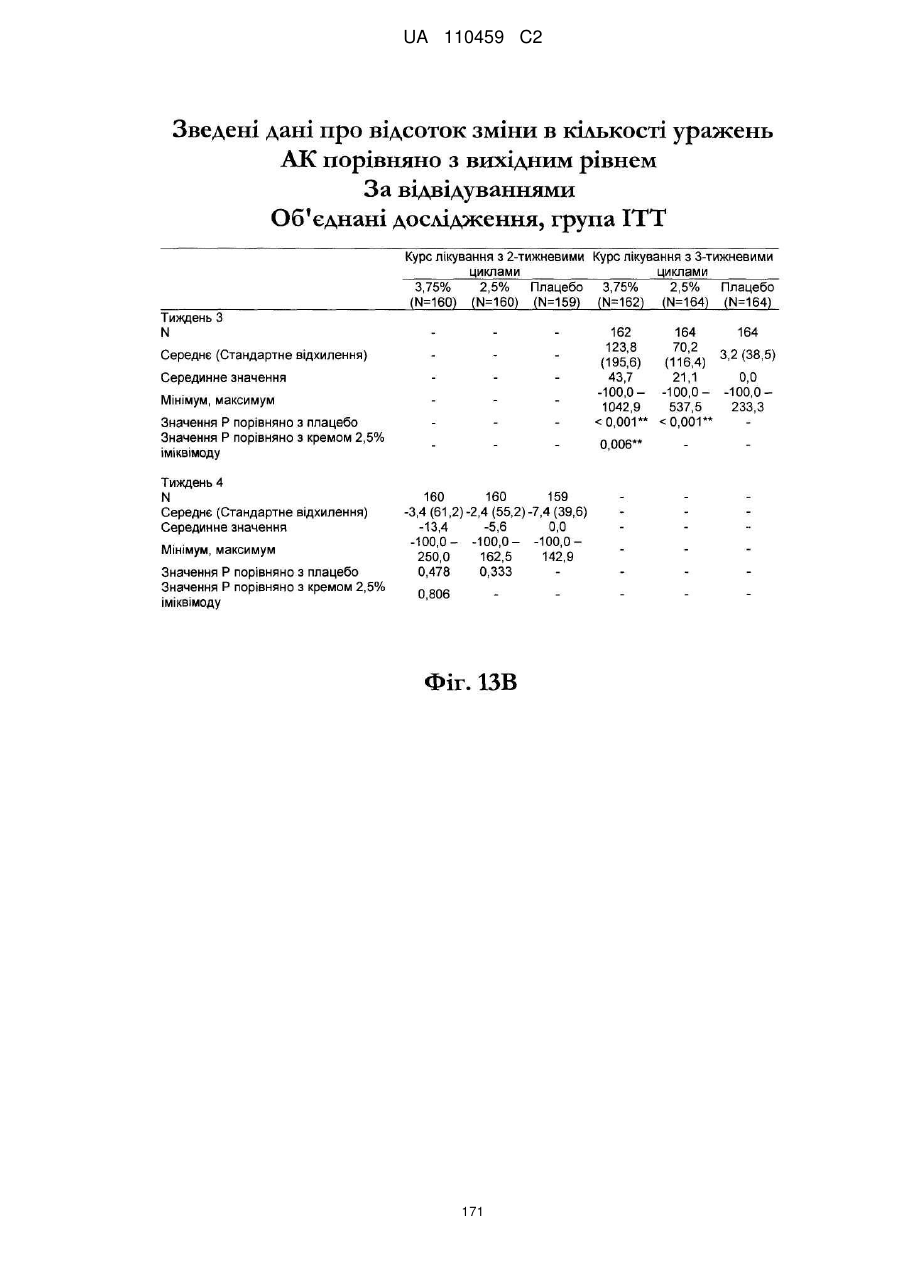
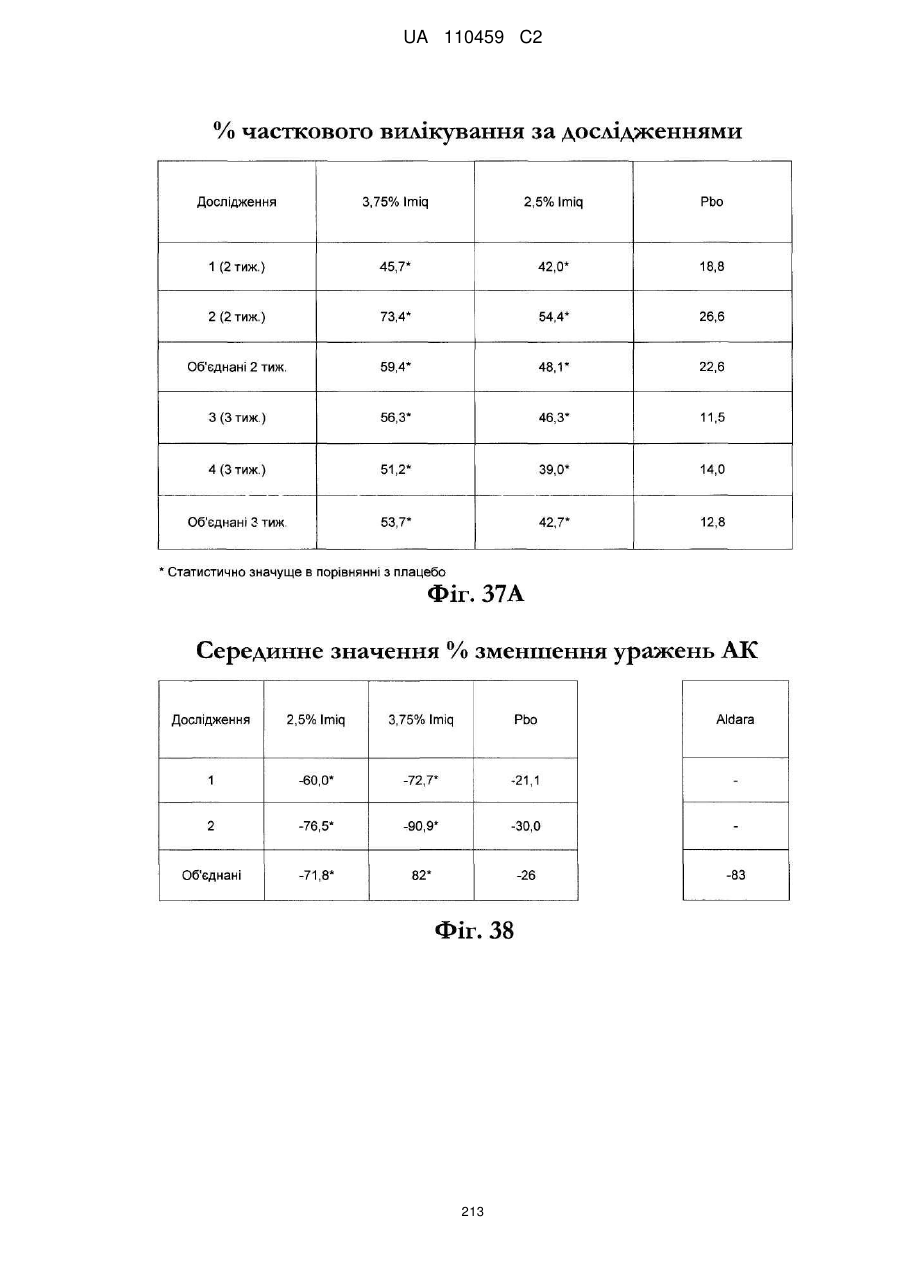
25. Спосіб за п. 20, де застосування композиції іміквімоду з вмістом іміквімоду 2,5 мас. % зменшує кількість місць ураження АК протягом періоду лікування.
26. Спосіб за п. 20, де застосування композиції іміквімоду з вмістом іміквімоду 2,5 мас. % триває протягом двотижневого періоду, навіть якщо актинічний кератоз не є видимим.
27. Спосіб за п. 17, де композиція іміквімоду містить іміквімод у кількості 3,75 мас. %.
28. Спосіб за п. 27, де щоденно наноситься від 9,3 до 18,8 мг іміквімоду.
29. Спосіб за п. 27, де від 65,6 до 131,3 мг іміквімоду наноситься за один тиждень двотижневого періоду лікування.
30. Спосіб за п. 27, де від 131,2 до 262,5 мг іміквімоду наноситься протягом двотижневого періоду лікування.
31. Спосіб за п. 27, де від 262,5 мг до 525 мг іміквімоду наноситься протягом 6-тижневого курсу лікування.
32. Спосіб за п. 27, де застосування композиції іміквімоду з вмістом іміквімоду 3,75 мас. % зменшує кількість місць ураження АК протягом періоду лікування.
33. Спосіб за п. 27, де застосування композиції іміквімоду з вмістом іміквімоду 3,75 мас. % триває протягом двотижневого періоду, навіть якщо актинічний кератоз не є видимим.
34. Спосіб за будь-яким з пп. 17-33, де здійснення способу приводить до повного очищення від актинічного кератозу у імунокомпетентного дорослого пацієнта.
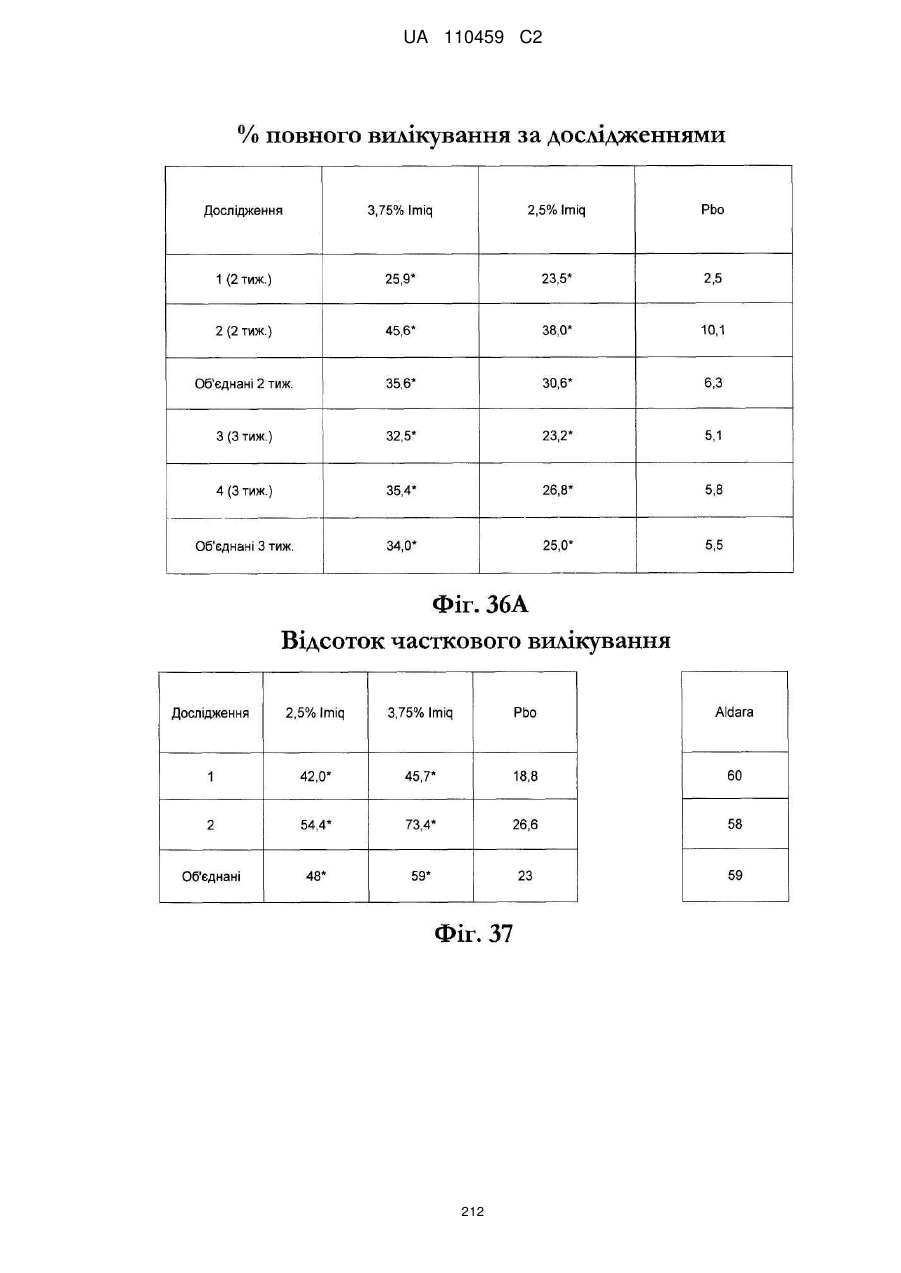
35. Спосіб за будь-яким з пп. 17-33, де застосування способу на популяції імунокомпетентних дорослих пацієнтів приводить до статистично значимого поліпшення у відсотку від загального очищення від актинічного кератозу порівняно з лікуванням плацебо.
36. Спосіб за будь-яким з пп. 17-33, де застосування способу на популяції імунокомпетентних дорослих пацієнтів приводить до близько 25 % або більше очищення від актинічного кератозу у імунокомпетентних дорослих пацієнтів в популяції.
37. Спосіб за будь-яким з пп. 17-33, де актинічний кератоз є клінічно типовим, видимим або відчутним.
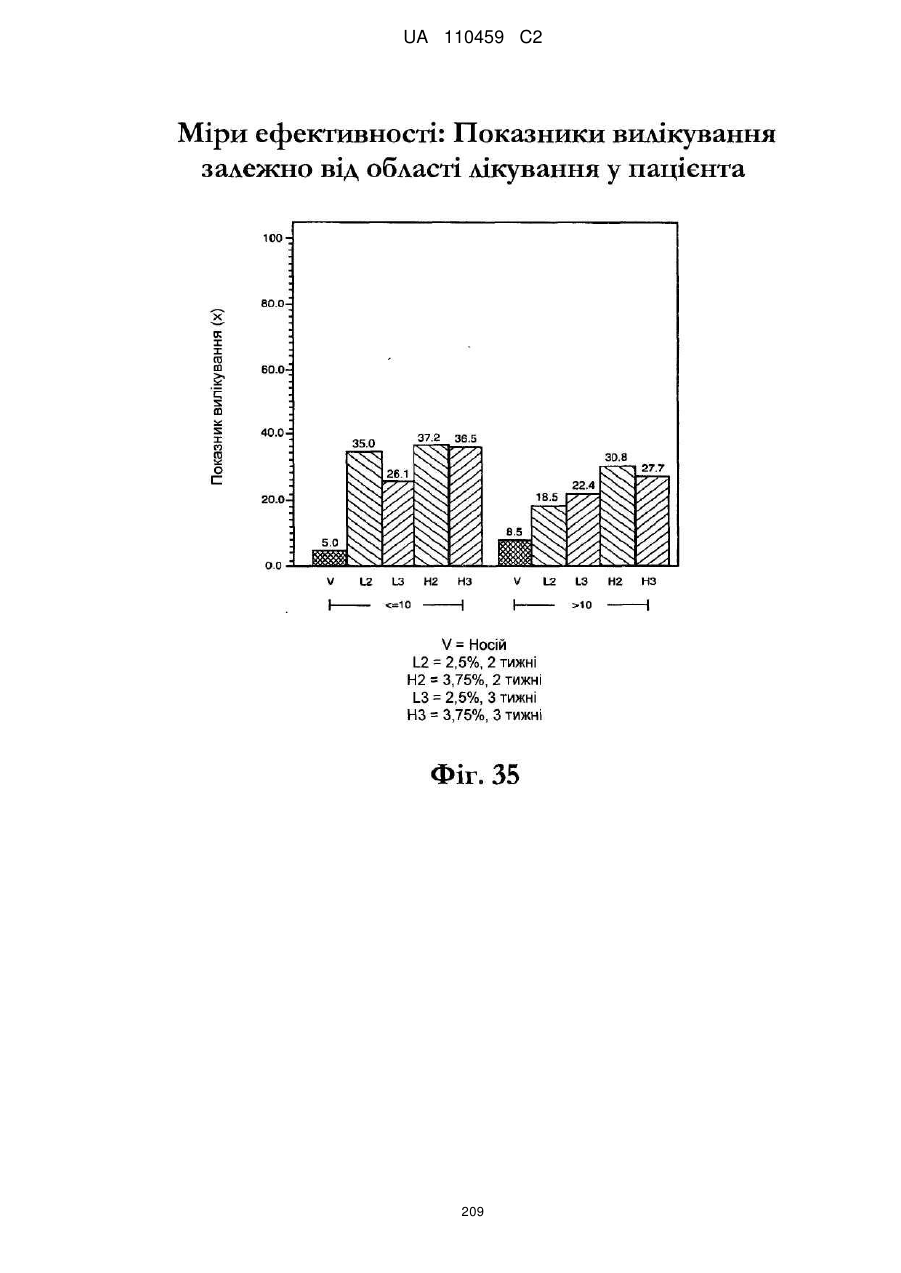
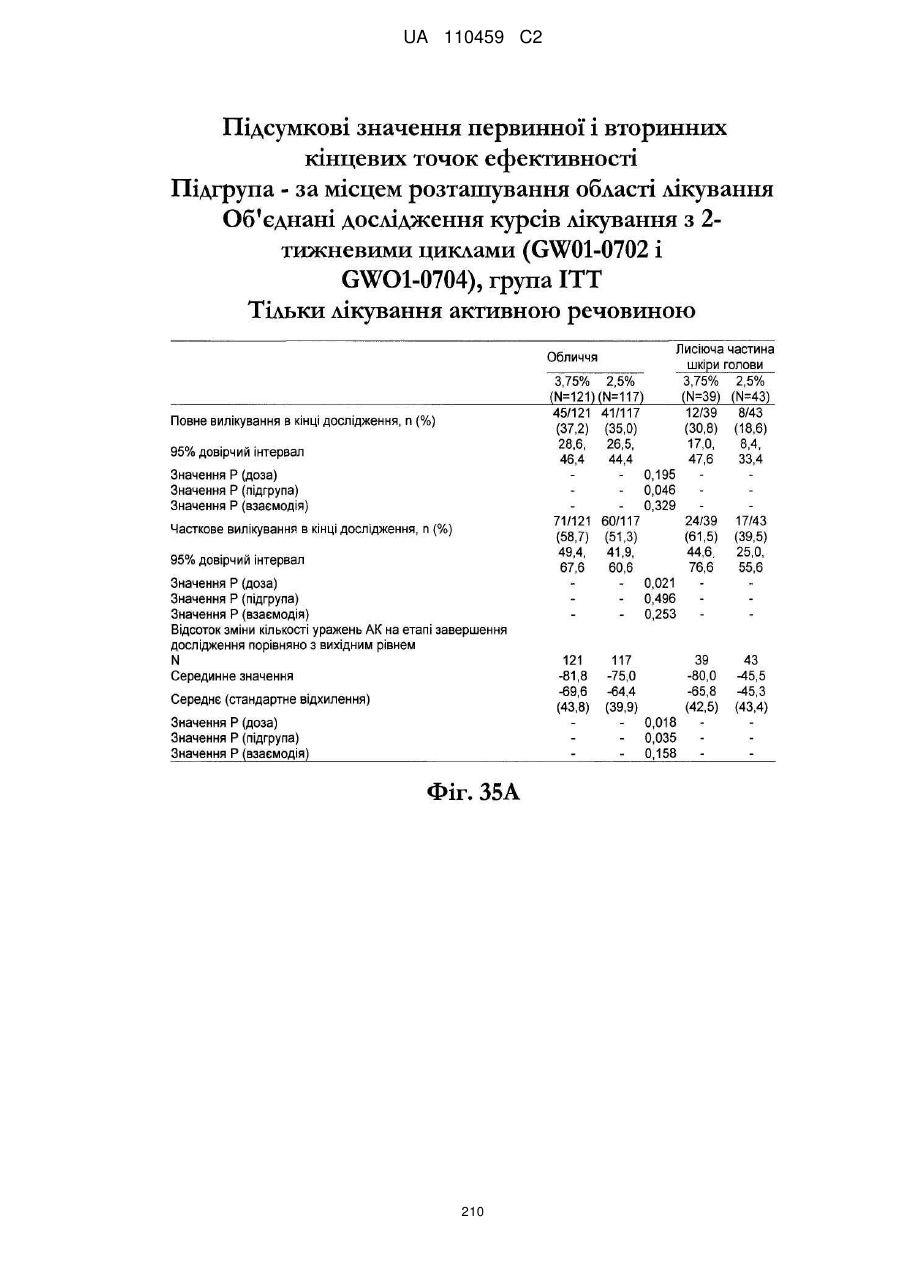
38. Спосіб за будь-яким з пп. 17-33, де композиція наноситься на все обличчя.
39. Спосіб за будь-яким з пп. 17-33, де композиція наноситься на лисіючу частину голови.
40. Спосіб за будь-яким з пп. 17-33, де все обличчя становить принаймні 200-250 см2.
41. Спосіб за п. 19, де вісім годин складають всю ніч.
42. Спосіб за будь-яким з пп. 17-33, де спосіб приводить до принаймні 75 % очищення від актинічного кератозу.
Текст
Реферат: UA 110459 C2 (12) UA 110459 C2 Винахід належить до фармацевтики та медицини і стосується композицій з низьким вмістом іміквімоду для лікування актинічного кератозу, що містять іміквімод у кількості близько 2,5 мас. % або близько 3,75 мас. % та фармацевтично прийнятний носій для іміквімоду, що містить жирну кислоту, де композиція являє собою крем, і де 250 мг крему містять 6,25 мг або 9,375 мг іміквімоду. Винахід також стосується способів лікування актинічного кератозу із застосуванням вказаних композицій. UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Цей винахід стосується фармацевтичних композицій і способів місцевої або трансдермальної доставки 1-ізобутил-1H-імідазо[4,5-с]-хінолін-4-аміну, також відомого як 1-(2метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-аміну, також відомого як іміквімод, для лікування актинічного кератозу у рамках менш тривалої терапії, ніж та, що зараз прописується для комерційно доступного крему Aldara® (іміквімод 5 %), який схвалено агентством з контролю за ліками і харчовими продуктами США ("FDA"). Більш конкретно, цей винахід стосується композицій з більш низьким вмістом іміквімоду для доставки ефективної кількості іміквімоду з метою лікування актинічного кератозу, із прийнятним безпечним профілем і режимами дозування, які є більш короткими та зручними для пацієнта, ніж режими дозування, який зараз застосовуються та схвалені агентством з контролю за ліками та харчовими продуктами США ("FDA") для крему Aldara® (іміквімод 5 %). Рівень техніки Актинічний кератоз (АК) є передраковим (передзлоякісним) ушкодженням шкіри, спричиненим або пов'язаним із хронічним впливом променистої енергії, такої як сонячне світло. Ушкодження при актинічному кератозі мають форму маленьких, червоних, шорсткуватих плям або уражень, які спостерігаються на ділянках шкіри, які піддавалися впливу сонячних променів. Багато клітинних змін в ушкодженнях при актинічному кератозі подібні до клітинних змін при раку шкіри - плоскоклітинному раку (SCC). Дослідження показують, що варіант гена р53 з мутацією виявляли в ушкоджених сонцем клітинах в організмі та у більш ніж 90 % людей, що страждають на АК і плоскоклітинний рак. Хоча більшість актинічних кератозних ушкоджень не перетворюються на рак, деякі такі ушкодження можуть стати злоякісними. Вважається, що актинічний кератоз розвивається в клітинах шкіри, які називають кератиноцитами, що становлять близько 90 % епідермісу - верхнього шару шкіри. Постійний вплив сонячних променів згодом породжує мутації в цих клітинах, у результаті чого клітини міняють свій розмір, форму, порядок розташування та поводження. Крім того, ушкодження клітин можуть поширюватися навіть на дерму, тобто шар шкіри під епідермісом. Діаметр ушкоджень при актинічному кератозі становить від приблизно 2 до приблизно 6 мм. Ушкодження АК можуть міняти колір від кольору шкіри до червонуватого та часто покриті зверху білими лусочками. В окремих випадках ушкодження при АК набувають форми рогів тварин. Тоді АК ще називають "шкірними рогами". Більш високому ризику розвитку актинічного кератозу піддаються, як правило, люди зі світлою шкірою, які проводять значний час на відкритому повітрі, наприклад, у справах або на відпочинку, протягом багатьох років. АК ураження звичайно з'являються на тих ділянках тіла, які постійно перебували на сонці протягом багатьох років. Крім того, постійний вплив сонячних променів викликає появу зморшок, плям на шкірі, а також знебарвлення її ділянок. Як правило, актинічний кератоз виникає на обличчі, вухах, губах, облисілих ділянках на голові, задній частині шиї, на зовнішніх частинах передпліч і кистей. Стан, при якому ураження АК з'являються на губах, відомий як актинічний хейліт. Актинічний хейліт може проявлятися у вигляді дифузійного відшаровування на нижній губі, що тріскається та висихає. У деяких випадках на стовщеній частині губ спостерігаються білуваті плями. Актинічний кератоз звичайно зустрічається в людей після 40 років, оскільки для його розвитку потрібні роки. Однак, актинічний кератоз може розвитися навіть у молодих дорослих людей, які живуть у географічних районах, що піддаються впливу сонячного світла високої інтенсивності протягом усього року, наприклад, у Флориді та Південній Каліфорнії. Актинічний кератоз став серйозною проблемою охорони здоров'я в Сполучених Штатах Америки. Відповідно до оцінок, понад 20 мільйонів американців страждають на це захворювання, і їхнє число продовжує зростати. Дійсно, актинічний кератоз став настільки поширеним, що наразі його лікування є однією з найбільш частих причин звертання до дерматолога. Сполука, охарактеризована як 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2метилпропіл)-1H-імідазо[4,5-с] хінолін-4-амін, також відома за назвою іміквімод, розкрита в патенті США № 4,689,338 і описана в ньому як противірусний засіб і індуктор інтерферону. Зазначений патент включено сюди у всій його повноті шляхом посилання. Там же описані різні композиції іміквімоду для місцевого застосування. Зазначений патент США № 4,689,338 включено сюди у всій його повноті шляхом посилання. У патенті США № 4,751,087 розкрите використання сполучення етилолеату та гліцерилмонолаурату як засобу, що поліпшує проникнення нітрогліцерину, причому всі три зазначені компоненти містяться в клейкому шарі трансдермального пластиру. Зазначений патент США включено сюди у всій його повноті шляхом посилання. 1 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 У патенті США № 4,411,893 розкрите використання Ν,Ν-диметилдодециламін-N-оксиду як засобу, що поліпшує проникнення у водних системах. Зазначений патент США включено сюди у всій його повноті шляхом посилання. У патенті США № 4,722,941 розкриті легко абсорбовані фармацевтичні композиції, які містять фармакологічно активну речовину, розподілену в носії, що містить поліпшуючу абсорбцію кількість, принаймні, однієї жирної кислоти, яка містить від 6 до 12 атомів вуглецю, та, необов'язково, моногліцериду жирної кислоти. Такі композиції вважаються особливо корисними для поліпшення абсорбції фармакологічно активних основ. Зазначений патент США включено сюди у всій його повноті шляхом посилання. У патенті США № 4,746,515 розкритий спосіб використання гліцерин монолаурату для поліпшення проходження через шкіру лікарського засобу, що доставляється крізь неушкоджену шкіру. Зазначений патент США включено сюди у всій його повноті шляхом посилання. У патенті США № 5,238,944, патенті США № 7,038,051, патенті США № 6,693,113, патенті США № 6,894,060, публікації патенту США № 2007/0123558, публікації патенту США № 2004/087614, публікації патенту США № 2002/147210 і WO2008US53522 розкриті композиції для місцевого застосування та/або системи місцевої та трансдермаль-ної доставки, що містять 1ізобутил-1H-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1H-імідазо[4,5-с]хінолін-4-амін. Кожний(а) із зазначених патентів і публікацій включені сюди у всій їхній повноті шляхом посилання. Зараз FDA схвалило крем 5 % іміквімоду, що продають під торговою маркою Aldara® (Алдара), для лікування деяких станів шкіри та слизових оболонок, а саме: (1) місцевого лікування клінічно типового, негіперкератозного актинічного кератозу (АК) на обличчі або шкірі голови імунокомпетентних дорослих, (2) місцевого лікування підтвердженою біопсією, первинної поверхневої базально-клітинної карциноми (sBCC) у імунокомпетентних дорослих і (3) місцевого лікування бородавок/кондиломи на зовнішніх статевих органах і періанальної області при загостренні у пацієнтів віком 12 років і старших. Aldara® (Алдара) - торгова марка схваленого FDA крему 5 % іміквімоду, що є модифікатором імунного відгуку. Кожний грам крему Aldara® (іміквімод 5 %) містить 50 мг іміквімоду в білуватій основі типу "масло у воді", що швидко всмоктується, до складу якої входять: ізостеаринова кислота, цетиловий спирт, стеариловий спирт, білий вазелін, полісорбат 60, сорбітмоностеарат, гліцерин, ксантенова камедь, вода очищена, бензиловий спирт, метилпарабен і пропілпарабен. Крем Aldara® (іміквімод 5 %) упакований в одноразові пакети або саше, кожний з яких містить 250 мг крему, що еквівалентно 12,5 мг іміквімоду. Як зазначено вище, хімічна структура іміквімоду є відомою. Це 1-(2-метилпропіл)-1Hімідазо[4,5-с]хінолін-4-амін або 1-ізобутил-1H-імідазо[4,5-с]-хінолін-4-амін. Іміквімод має молекулярну формулу C14H16N4 і молекулярну масу 240,3. Хімічна структурна формула іміквімоду: Незважаючи на схвалення FDA, лікування кремом Aldara® (іміквімод 5 %) не позбавлене обмежень, у т.ч. непросте нанесення та тривалий строк лікування. У цілому, схема лікування актинічного кератозу з використанням затвердженого FDA крему Aldara® (іміквімод 5 %) включає нанесення крему Aldara® (іміквімод 5 %) два рази на тиждень протягом повних 16 тижнів на певну/обмежену область лікування на обличчі або шкірі голови (але не одночасно). 2 Площа поверхні лікування кремом Aldara® (іміквімод 5 %) обмежена приблизно 25 см (наприклад, область 5 см χ 5 см, що може бути будь-якої форми; оброблювана ділянка не обов'язково повинна бути квадратною) і визначається як одна безперервна ділянка. Кількість ушкоджень АК, які обробляють кремом Aldara® (іміквімод 5 %) в області лікування, як правило, становить від приблизно 4 до приблизно 8. Через невеликі розміри області нанесення при одному нанесенні звичайно використовують менше одного одноразового пакета або саше Aldara® (250 мг крему, що містить 12,5 мг іміквімоду). Невідповідності в дотриманні режиму та 2 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтичних результатів часто виникають при лікуванні актинічного кератозу з використанням схваленого FDA крему Aldara® (іміквімод 5 %) через тривалий період лікування - 16 тижнів, складного режиму дозування - два рази на тиждень і високу частоту появи реакцій на місці нанесення. Після схвалення FDA крему Aldara® (іміквімод 5 %) для лікування актинічного кератозу було проведено початкове відкрите дослідження за участю 25 пацієнтів, у яких спостерігалося від 5 до 20 дискретних уражень АК на відкритій частині чола, волосистій частині голови або щоці. Впродовж цього початкового дослідження лікування полягало в нанесенні на всю косметичну область один раз на день крему 5 % іміквімоду, три рази на тиждень протягом чотирьох тижнів, з наступним періодом відпочинку протягом чотирьох тижнів. Цикл повторювали, якщо після завершення восьмитижневого циклу залишалися ще ушкодження АК. Допускалося проведення максимум трьох циклів (24 тижні). Вивчали тридцять три ділянки (тобто косметичні області) у 25 пацієнтів. На думку авторів, дотримання режиму було відмінним при досить прийнятному профілю безпеки. Повне усунення всіх уражень АК спостерігалося на 82 % (27/33) ділянках тіла 25 учасників дослідження. Майже половина ділянок (15/33) була вільною від уражень наприкінці першого циклу. Протягом періоду відпочинку спостерігався "терапевтичний інтервал", коли клінічне запалення знижувалося, а ураження АК продовжувалі. зникати. На думку авторів додатковий ефект полягав у виявленні, клінічному прояві та подальшій ліквідації початкових (субклінічних) уражень АК в області лікування. У результаті автори дійшли висновку, що досліджуваний циклічний режим лікування відмінно дотримується, а визначення терапевтичного інтервалу може виявитися корисним для розробки індивідуальних схем дозування. Проте, автори попереджають, що результати даного дослідження повинні оцінюватися з обережністю. Автори також застерігають, що, оскільки це дослідження є відкритим, з малою кількістю учасників, безпеку, ефективність і тривалість дії необхідно підтвердити в ході контрольованих, ран-домізованих досліджень із більшим числом учасників. Див. Salasche S.J., Levine N., and Morrison L: Cycle therapy of actinic keratoses of the face and scalp with 5 % topical imiquimod cream: An open-label trial. J Am Acad Dermatol. 47(4):571-7 (Oct. 2002). Також після схвалення FDA крему Aldara® (іміквімод 5 %) для лікування актинічного кератозу було проведено двохцентрове, рандомізоване, подвійне сліпе, контрольоване носієм дослідження для оцінки безпеки та ефективності коротких курсів лікування кремом Aldara® (іміквімод 5 %) при усуненні > 75 % вихідних уражень сонячного кератозу (SK) в області лікування. Учасники з 5-15 вихідними ураженнями SK у межах однієї області лікування (волосиста частина голови, чоло та скроні або обидві щоки) були випадково розподілені в групи учасників, які наносили іміквімод або носій на всю область лікування три рази на тиждень протягом 3 тижнів. Стан пацієнтів оцінювали через 4 тижні після закінчення першого курсу з усунення уражень. Учасники з 75 % проходили спостереження до завершення дослідження без лікування. Всі учасники проходили обстеження по закінченні дослідження, тобто через 14 тижнів після початку лікування, для визначення первинних результатів (усунення > 75 % вихідних уражень сонячного кератозу). За даними авторів у двадцять одного з 29 (72 %) учасників, які проходили лікування іміквімодом, зникло > 75 % вихідних ушкоджень порівняно з 3/10 (30 %) пацієнтів, які наносили крем з носієм (точний критерій Фішера, Ρ = 0,027), та іміквімод добре переносився. Крім того, на думку авторів, результати даного дослідження свідчать про те, що нанесення 5 % іміквімоду три рази на тиждень може являти собою альтернативу для пацієнтів з SK на обличчі та волосистій частині голови, і що один або два короткі курси можуть бути альтернативою безперервному та більш тривалому нанесенню крему Aldara® (іміквімод 5 %), який схвалено FDA. Однак, автори застерігають, що, оскільки дослідження має відносно короткий період подальшого спостереження, необхідні додаткові дослідження для оцінки стабільного терапевтичного результату. Див. Chen K. et al.\ Links Short-course therapy with imiquimod 5 % cream for solar keratoses: a randomized controlled trial. Australasian J Dermatol. 44(4):250-5 (Nov 2005). Крім того, в 2007 році було проведено багатоцентрове, контрольоване носієм, подвійне сліпе дослідження для оцінки безпеки та ефективності крему 5 % іміквімоду при нанесенні один раз на день 3 рази на тиждень у вигляді одного або двох курсів лікування актинічного кератозу на голові. У тому ж році були опубліковані його результати. На думку авторів, у цілому 259 пацієнтів з діагнозом АК взяли участь у дослідженнях у двадцяти центрах у Європі та наносили іміквімод протягом 4 тижнів, припиняли лікування на 4-тижневий період відпочинку, і якщо ушкодження не проходили - починали другий курс лікування. Область лікування була обмежена 2 приблизно 25 см . Автори повідомили, що у пацієнтів у групі лікування іміквімодом спостерігалося повне усунення уражень в 55,0 % (71/129) випадках порівняно з групою, що 3 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 наносила носій, у якої цей показник становив 2,3 % (3/130). Спостерігалася добра відповідність між клінічними та гістологічними результатами дослідження усунення уражень АК. Автори також повідомили, що при обох відвідуваннях через 8 тижнів після лікування негативне прогностичне значення оцінок дослідника становило 92,2 % для клінічних оцінок порівняно з гістологічними результатами. Автори дійшли висновку, що 4-тижневий курс лікування при нанесенні крему 5 % іміквімоду три рази на тиждень із повторним курсом лікування для тих пацієнтів, які не вилікувалися в результаті першого курсу лікування, є безпечним і ефективним засобом для лікування АК, а загальний показник повного вилікування (після першого або другого курсу) є зіставним з 16-тижневим курсом нанесення крему Aldara® (іміквімод 5 %) при одночасному зменшенні впливу ліків на пацієнта та зменшенні загального часу лікування. Див. Alomar, A., J. Bichel, et a/.: Vehicle-controlled, randomized, double-blind study to assess safety and efficacy of imiquimod 5 % cream applied once daily 3 days per week in one or two courses of treatment of actinic keratoses on the head. British Journal of Dermatology. 157(1): 133-41 (2007). В 2007 році було проведено та повідомлено про результати іншого контрольованого носієм, подвійного сліпого, рандомізованого дослідження, у якому крем 5 % іміквімоду наносили 3 рази на тиждень у вигляді одного або двох курсів лікування актинічного кератозу на голові. За даними авторів пацієнти з актинічним кератозом на голові наносили крем іміквімоду або носія 3 рази на тиждень протягом 4 тижнів (курс 1), пацієнти з невилікуваними ушкодженнями проходили ще один курс лікування, і показники повного та часткового вилікування оцінювали по закінченні курсу 1, курсу 2 (повна тривалість) і через 1 рік. Автори дійшли висновку, що нанесення іміквімоду 3 рази на тиждень у рамках одного або двох курсів лікування є ефективним для лікування актинічного кератозу на голові, забезпечуючи довгострокові клінічні переваги. При цьому, у деяких випадках спостерігаються рецидиви, тому рекомендується довгострокове наступне спостереження. Див. Jorizzo, J., S. Dinehart, et a/.: Vehicle-controlled, double-blind, randomized study of imiquimod 5 % cream applied 3 days per week in one or two courses of treatment for actinic keratoses on the head. Journal of the American Academy of Dermatology. 57(2): 265-8 (2007). В 2007 році було проведено (і повідомлено про його результати) інше багатоце-нтрове, відкрите дослідження, у якому крем 5 % іміквімоду наносили в рамках одного або двох 4тижневих курсів лікування кількох уражень актинічного кератозу на голові. За даними авторів це було відкрите дослідження (фаза ІІІЬ) за участю 180 дерматологічних клінік і практик у Німеччині. До участі в ньому допускалися пацієнти із клінічно типовою картиною захворювання, видимими ураженнями АК, розташованими в будь-якому місці на голові, за винятком верхніх і нижніх вік, ніздрів, червоної частини губ і внутрішньої частини вух. Автори повідомили, що пацієнти наносили досліджуваний крем іміквімоду на область лікування один раз на день 3 рази на тиждень протягом 4 тижнів (курс 1), потім наставав 4-тижневий період після лікування, і пацієнти, у яких усе ще залишалися ураження АК в області лікування, проходили другий 4тижневий курс. Зважаючи на все, область лікування не була обмежена, і пацієнти могли використовувати один або два пакетики при кожному нанесенні. Дані про розмір області лікування та кількості використовуваних пакетиків не наведені. Серединна кількість уражень АК на початку дослідження становила 7. Автори також повідомили, що в цілому в дослідженні взяли участь 829 пацієнтів. Показник повного вилікування становив 68,9 % (571/829), часткового (відсоток пацієнтів з > 75 %-ним зниженням числа уражень АК порівняно з вихідною кількістю) 80,2 %. Автори визнають, що місцеві шкірні реакції (LSR) і реакції в місці нанесення (ASR) були найбільш частими побічними ефектами, про які повідомлялося, а чотири пацієнти припинили свою участь у дослідженні через LSR або ASR. Автори дійшли висновку, що більш короткий курс лікування кремом 5 % іміквімоду, тобто один раз на день 3 рази на тиждень протягом 4 тижнів у рамках 1 або двох курсів, може забезпечити показники повного вилікування, аналогічні показникам 16-тижневого лікування кремом Aldara® (іміквімод 5 %) і перевагу, що полягає в меншому впливі ліків, завдяки якому досягається краще співвідношення користі та ризику для пацієнта. Див. Stockfleth, Ε., W. Sterry, et a/.: Multicentre, open-label study using imiquimod 5 % cream in one or two 4-week courses of treatment for multiple actinic keratoses on the head. British Journal of Dermatology. 157 Suppl 2: 41-6 (2007). Було проведено ще одне дослідження, що включає місцеве застосування 5 % іміквімоду порівняно з місцевим застосуванням 5-фторурацилу та у порівнянні із кріо-хірургією в імунокомпетентних пацієнтів з актинічним кератозом, а також порівняння клінічних і гістологічних результатів, у т.ч. і протягом 1 року наступного спостереження. За даними авторів у цьому дослідженні порівнювали первісне вилікування та вилікування через 12 місяців відповідно до клінічних даних, гістологічних і косметичних результатів місцевого застосування крему 5 % іміквімоду (IMIQ), мазі 5 % 5-фторурацилу (5-FU) і кріохірургії при лікуванні АК у 4 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнтів, які були випадково розподілені в одну з трьох груп лікування: один або два курси кріохірургії (20-40 секунд на кожну ушкоджену ділянку), місцеве застосування 5-FU (два рази на день протягом 4 тижнів) або один або два курси місцевого застосування іміквімоду (три рази на тиждень протягом 4 тижнів кожний). У цьому дослідженні область лікування була обмежена 2 однією анатомічною ділянкою площею 50 см або менше. Автори повідомляють: (1) шістдесят вісім відсотків (17/25) пацієнтів, які проходили лікування кріохірургією, 96 % (23/24) пацієнтів, які застосовували 5-FU, і 85 % (22/26) пацієнтів, які застосовували IMIQ, досягли первісного клінічного вилікування, Ρ = 0,03; (2) гістологічний показник вилікування для кріохірургії становив 32 % (8/25), 67 % (16/24) - для 5-FU і 73 % (19/26) - для групи іміквімоду, Ρ = 0,03; (3) подальше спостереження протягом 12 місяців показало високу частоту рецидивів і нових уражень у групах 5-FU і кріохірургії; (4) стабільність показника первісного вилікування становила 28 % (7/25) для кріохірургії, 54 % (13/24) - для 5-FU і 73 % (19/26) - для іміквімоду (р < 0,01); (5) стабільність області повного вилікування становила 4 % (1/25), 33 % (8/24) і 73 % (19/26) пацієнтів після кріохірургії, застосування 5-FU і іміквімоду, відповідно (Р 25 2 2 см порівняно з до 25 см для крему Aldara® (іміквімод 5 %)), (2) більш короткому періоді лікування, наприклад, два 2-тижневих або два 3-тижневих цикли лікування із проміжним 2тижневим або 3-тижневим періодом без лікування між ними, відповідно, порівняно з повним 16тижневим курсом лікування кремом Aldara® (іміквімод 5 %), (3) більш інтуїтивному режимі дозування (добова доза порівняно з дозуванням два рази на тиждень у випадку крему Aldara® (іміквімод 5 %)) і (4) меншій частоті виникнення та інтенсивності реакцій у місці застосування. Фармацевтичні композиції з меншою подразнюючою дією, більш низьким вмістом іміквімоду відповідно до даного винаходу можуть включати: a) меншу дозу 1-ізобутил-1H-імідазо[4,5-с]-хінолін-4-аміну або 1-(2-метилпропіл)-1Hімідазо[4,5-с]хінолін-4-аміну (іміквімоду) для доставки ефективної кількості іміквімоду; і b) фармацевтично прийнятний носій для іміквімоду, що включає жирну кислоту, таку як ізостеаринова кислота, пальмітинова кислота, стеаринова кислота, лі-нолева кислота, неочищена олеїнова кислота, очищена олеїнова кислота, така як олеїнова кислота Super Refined® NF (наприклад, олеїнова висота високого ступеня очищення, тобто олеїнова кислота з низьким вмістом полярних домішок, таких як перекиси, низьким показником пероксидів, що продається CRODA; див., наприклад, www.crodausa.com) і їх поєднання, у кількості від приблизно 3 % до приблизно 45 % за масою від загальної маси композиції. Композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, особливо ті, в яких носій включає ізостеаринову кислоту як жирну кислоту, мають унікальний склад, що забезпечує фізичну та хімічну стабільність, розчинність, заспокоюючі властивості та пропорційну дозі доставку на рівні або краще, ніж показники крему Aldara® (іміквімод 5 %). 6 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 Конкретніше, вважається, що композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, особливо ті, у яких носій включає ізостеаринову кислоту як жирну кислоту, мають аналогічну або кращі заспокійливі для шкіри властивості в місці нанесення та пропорційні дозі швидкості вивільнення, як відносно швидкості вивільнення іміквімоду, так і відносно загальної кількості вивільненого іміквімоду, порівняно з кремом Aldara® (іміквімод 5 %). Інакше кажучи, композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу залежать від концентрації та мають швидкості вивільнення, аналогічні крему Aldara® (іміквімод 5 %). Крім того, чим більша кількість іміквімоду в композиції, тим швидшим та більшим є вивільнення загальної кількості іміквімоду, що вказує на те, що кількість, яка вивільняється, і швидкість вивільнення з композицій залежать від концентрації іміквімоду. Таким чином, у той час, як композиції з більш низьким вмістом іміквімоду згідно з цим винаходом доставляють різні загальні кількості в stratum corneum (роговий шар) і епідерміс, тобто забезпечують місцеву доставку на шкіру, порівняно з кремом Aldara® (іміквімод 5 %), вважається, що зазначені композиції з більш низьким вмістом іміквімоду, характеризуються пропорційною та лінійною залежністю, аналогічною Aldara® (іміквімод 5 %), як відносно швидкості вивільнення іміквімоду, так і відносно загальної кількості іміквімоду, вивільненого та доставленого місцево на шкіру за період часу, так що концентрації іміквімоду в композиціях згідно з цим винаходом, швидкості вивільнення іміквімоду та кількість неабсорбованого та доставленого в роговий шар і епідерміс іміквімоду, що був вивільнений з композицій, як правило, пропорційні та лінійні відносно крему Aldara® (іміквімод 5 %). Крім того, композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, особливо ті, у яких носій включає ізостеаринову кислоту як жирну кислоту, мають унікальний склад, що забезпечує стабільність і відповідність діапазону характеристик комерційно доступного крему Aldara® (іміквімод 5 %), таких як в'язкість, рН і стабільність, у т.ч. мікроскопічна та макроскопічна стабільність. Зокрема, іміквімод, присутній у композиціях з більш низьким вмістом іміквімоду відповідно до даного винаходу, особливо тих, у яких носій містить ізостеаринову кислоту як жирну кислоту (монографічний діапазон: 90-110 %) і бензиловий спирт (монографічний діапазон: 50-105 %), залишаються в межах при приблизно 25 °C і приблизно 40 °C протягом приблизно одного місяця та у межах при приблизно 25 °C і приблизно 40 °C протягом приблизно шести місяців. Крім того, композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, особливо ті, у яких носій включає ізостеаринову кислоту як жирну кислоту, зберігають стабільність протягом приблизно шести місяців при приблизно 25 °C і приблизно 40 °C, а також зберігають стабільність щодо макроскопічного та мікроскопічного вигляду, в'язкості (монографічний діапазон: 2 000-35000 сПуаз) і рН (монографічний діапазон: 4,0-5,5). Крім того, композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу мають унікальний склад, що відповідає вимогам Фармакопеї США ("USP") і Європейської Фармакопеї ("ЕР") щодо ефективності при зберіганні та відсутності продуктів розпаду при зберіганні при близько 25 °C/60 %RH (відносної вологості), близько 30 °C/65 %RH і близько 40 °C/75 %RH протягом близько одного, близько двох, близько трьох і близько шести місяців, і при аналізі при довжині хвилі близько 318 нм. Даний винахід також включає композиції з більш низьким вмістом іміквімоду, які мають унікальні фармакокінетичні профілі при використанні, наприклад, у зв'язку з короткою за тривалістю терапією для лікування актинічного кератозу відповідно до цього винаходу. Так, наприклад, композиція з більш низьким вмістом іміквімоду -3,75 % згідно з цим винаходом при нанесенні приблизно 500 мг такої композиції (близько 18,75 мг іміквімоду) або менше щодня 2 протягом 21 днів на область обробки площею близько 200 см на обличчі або лисіючій частині голови забезпечує досягнення стійкого стану приблизно до тижня 2, наприклад, між приблизно днем 8 і днем 14, а також має in-vivo профіль у сироватці, вибраний з наведених нижче (див. Фіг. 54): (a) День 21, Ттах від близько 4 годин до близько 16 годин, і більш прийнятно середнє значення Тmах становить близько 7,4 годин, зі стандартним відхиленням ("SD") близько 3,5, серединне значення Тmах становить близько 9 годин, середнє геометричне значення Т mах становить близько 6,6 годин, і коефіцієнт варіації ("CV") становить близько 48 %; (b) День 21, Сmах від близько 0,07 до близько 0,6 нг/мл, і більш прийнятно середнє значення Сmах становить близько 0,3 нг/мл зі стандартним відхиленням близько 0,16, серединне значення Сmах становить близько 0,35, середнє геометричне значення Сmах становить близько 0,27 нг/мл, і коефіцієнт варіації становить близько 49 %; (c) День 21, Т1/2 від близько 9,7 до близько 84 годин, і більш прийнятно середнє значення Т /2 становить близько 29,3 годин зі стандартним відхиленням близько 17, серединне значення Т1/2 7 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 становить близько 25,6 годин, середнє геометричне значення Т 1/2 становить близько 26 годин, і коефіцієнт варіації становить близько 58 %; (d) День 21, AUC0-24 від близько 1,1 до близько 12 нг.год./мл, і більш прийнятно середнє значення AUC0-24 становить близько 6 нг.год./мл зі стандартним відхиленням близько 3, серединне значення AUC0-24 становить близько 7 нг.год./мл, середнє геометричне значення AUC0-24 близько 5 нг.год./мл, і коефіцієнт варіації становить близько 52 %; -1 -1 (e) День 21, λz становить від близько 0,008 год. до близько 0,07 год. і більш прийнятно -1 середнє значення λz становить близько 0,03 год. зі стандартним відхиленням близько 0,01, -1 серединне значення λz становить близько 25,6 год. , середнє геометричне значення λz -1 становить близько 0,03 год. , і коефіцієнт варіації становить близько 49 %; (f) День 21, Сmin від близько 0,06 до близько 0,4, і більш прийнятно середнє значення Cmin становить близько 0,20 з SD близько 0,11, серединне значення Сmin становить близько 0,19, середнє геометричне значення Сmin становить близько 0,17, і коефіцієнт варіації становить близько 55 %; (g) День 14/7 (відношення залишкової концентрації у день 14 до залишкової концентрації у день 7), середнє геометричне значення відношення залишкових концентрацій становить близько 1,09, з 90 % довірчим інтервалом ("СІ") в інтервалі від близько 0,8 до близько 1,5; (h) День 21/14 (відношення залишкової концентрації у день 21 до залишкової концентрації у день 14), середнє геометричне значення відношення залишкових концентрацій становить близько 1,33, з 90 % довірчим інтервалом ("СІ") в інтервалі від близько 0,9 до близько 1,9; (і) День 22/21 (відношення залишкової концентрації у день 22 до залишкової концентрації у день 21), середнє геометричне значення відношення залишкових концентрацій становить близько 0,93, з 90 % довірчим інтервалом ("СІ") в інтервалі від близько 0,6 до близько 1,3; (j) середня максимальна концентрація іміквімоду в сироватці становить близько 0,323 нг/мл у день 21; (k) День 21, RAUC від близько 1 до близько 7, і більш прийнятно середнє значення RAUC становить близько 4 зі стандартним відхиленням близько 2, серединне значення RAUC становить близько 3,5, середнє геометричне значення RAUC становить близько 3,3, і коефіцієнт варіації становить близько 56 %; (І) День 21, RCmax від близько 0,5 до близько 5, і більш прийнятно середнє значення RCmax становить близько 3 зі стандартним відхиленням близько 1,5, серединне значення RCmax становить близько 2,7, середнє геометричне значення RCmax становить близько 2,4, і коефіцієнт варіації становить близько 54 %; -1 -1 (m) День 21, Lλzeff від близько 0,006 год. до близько 0,08 год. , і більш прийнятно середнє -1 значення Lλzeff становить близько 0,02 год. зі стандартним відхиленням близько 0,02, -1 серединне значення Lλzeff становить близько 0,01 год. , середнє геометричне значення Lλzeff -1 становить близько 0,16 год. , і коефіцієнт варіації становить близько 97 %; і 1/2 (n) День 21, T eff від близько 8 год. до близько 110 год., і більш прийнятно середнє значення 1/2 T eff становить близько 55 год. зі стандартним відхиленням близько 36, серединне значення 1/2 1/2 T eff становить близько 50 год., середнє геометричне значення T eff становить близько 42 год. 1 , і коефіцієнт варіації становить близько 66 %. Відповідно до цього винаходу середня максимальна концентрація в сироватці досягається при використанні композиції з більш низьким вмістом іміквімоду - 3,75 % відповідно до Прикладів 23-28. Зокрема, середня максимальна концентрація в сироватці близько 0,323 нг/мл досягається при використанні композиції з більш низьким вмістом іміквімоду - 3,75 % відповідно до Прикладів 23-28 після нанесення приблизно 18,75 мг іміквімоду на область лікування 2 площею близько 200 см на обличчі або лисіючій частині голови щодня протягом 21 дня. Крім того, даний винахід включає композиції з більш низькою дозою, які є фармацевтично, терапевтично, біологічно еквівалентними та/або рівнозначними, незалежно від методу, обраного для демонстрації еквівалентів або біоеквівалентності, такого як дерматофармакокінетичні та фармакокінетичні методики, мікродіаліз, методи in vitro та in vivo і/або клінічні кінцеві точки. Таким чином, даний винахід включає композиції з більш низьким вмістом іміквімоду, які є біологічно, фармацевтично та/або терапевтично еквівалентними, особливо, 2,5 % і 3,75 % композиції з більш низьким вмістом іміквімоду, які є біологічно, фармацевтично та/або терапевтично еквівалентними при щоденному використанні в рамках нетривалої терапії відповідно до даного винаходу для лікування актинічного кератозу, наприклад, при нанесенні на області лікування, а саме: все обличчя або лисіюча частина 2 2 голови, площа яких становить між більш ніж приблизно 25 см і близько 250 см , щодня протягом приблизно до шести тижнів, включаючи схему лікування з 2 циклами 3×3×3 тижні та, більш прийнятно, приблизно до 4 тижнів, включаючи схему лікування з 2 циклами 2×2×2 тижні. 8 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 Таким чином, даний винахід охоплює: (а) фармацевтично еквівалентні композиції з більш низьким вмістом іміквімоду, які містять таку ж кількість іміквімоду в такій самій лікарській формі; (b) біоеквівалентні композиції з більш низьким вмістом іміквімоду, які є хімічно еквівалентними і які при введенні тим самим особам при тій самій схемі лікування забезпечують порівнянні значення біодоступності; (с) терапевтично еквівалентні композиції з більш низьким вмістом іміквімоду, які при введенні тим самим особам при тій самій схемі лікування забезпечують по суті таку ж ефективність і/або токсичність; і (d) рівноцінні композиції з більш низьким вмістом іміквімоду згідно з цим винаходом, які є фармацевтично еквівалентними, біоеквівалентними та терапевтично еквівалентними. Використовуваний тут термін "з більш низьким вмістом" стосується фармацевтичної композиції, що містить іміквімод у кількості від близько 1,0 % до близько 4,25 % за масою від загальної маси композиції та, більш прийнятно, фармацевтичної композиції, що містить іміквімод у кількості близько 2,5 % або близько 3,75 %. Використовуваний тут термін "нетривала" терапія стосується щоденного місцевого застосування ефективної кількості іміквімоду на певній області лікування в осіб з діагнозом ураження при АК протягом загального періоду лікування строком до приблизно 6 тижнів, залежно від якого вибирають композицію з більш низьким вмістом іміквімоду згідно з цим винаходом для щоденного застосування, і ще більш прийнятно загальний період лікування становить приблизно до 4 тижнів, причому необов'язковий певний проміжний період відпочинку (без лікування) до приблизно 3 тижнів і, ще більш прийнятно, період відпочинку (без лікування) до приблизно 2 тижнів може розпочинатись у якийсь момент періоду лікування актинічного кератозу. Таким чином, "нетривала терапія" може включати, наприклад, загальну тривалість 9 тижнів (З тижні лікування, 3 тижні відпочинку, 3 тижні лікування), і, ще більш прийнятно, 6 тижнів (2 тижні лікування, 2 тижні відпочинку, 2 тижні лікування) від початку до завершення застосування ліків, включаючи період відпочинку. Проте, фахівцеві у цій галузі техніки має бути зрозуміло, що схема лікування з 2 циклами, між якими розташований період відпочинку, є більш прийнятною. Крім того, "нетривала" терапія може також включати 8-тижневий період обстеження (без подальшого лікування) після періоду лікування. Термін "нетривала" терапія згідно з цим винаходом також стосується двоступінчастої схеми лікування, що включає 4-тижневий або 6-тижневий курс лікування, у якій кожний цикл лікування складається із двох або трьох тижнів щоденного однократного нанесення ефективної кількості іміквімоду, між якими передбачений 2-тижневий або 3-тижневий період без лікування, відповідно, таким чином: (а) нанесення ефективної кількості іміквімоду в області лікування, ураженої актинічним кератозом, один раз на день протягом 14 (чотирнадцяти) днів поспіль або 2 тижнів (цикл 1 лікування), далі - відсутність застосування протягом 14 (чотирнадцяти) днів або 2 тижнів (без лікування), потім - знову нанесення ефективної кількості іміквімоду на уражену ділянку один раз на день протягом 14 (чотирнадцяти) днів або 2 тижнів (цикл 2 - лікування), тобто всього 28 (двадцять вісім) доз або 4 тижні терапії для ефективного лікування актинічного кератозу; або (b) нанесення ефективної кількості іміквімоду в області лікування, ураженої актинічним кератозом, один раз на день протягом 21 (двадцяти одного) дня поспіль або 3 тижнів (цикл 1 лікування), далі - відсутність застосування протягом 21 (двадцяти одного) дня або 3 тижнів (без лікування), потім - знову нанесення ефективної кількості іміквімоду на уражену ділянку один раз на день протягом 21 (двадцяти одного) дня або 3 тижнів (цикл 2 - лікування), тобто всього 42 (сорок дві) дози або 6 тижнів терапії для ефективного лікування актинічного кератозу. Як зазначалось вище, при використанні нетривалої терапії в поєднанні з композиціями з більш низьким вмістом іміквімоду згідно з цим винаходом несподівано було виявлено, що (1) може використовуватись спрощена щоденна схема дозувань, (2) область лікування може бути 2 збільшена, наприклад, для лікування більш ніж приблизно 25 см , наприклад, таких великих 2 2 ділянок, як близько 200 см -250 см і більше (тобто все обличчя або лисіюча частина голови), і (3) кількість оброблюваних уражень АК збільшено, тобто до рівня між приблизно 5 і приблизно 20 ураженнями АК в області лікування. Також, досить несподівано, було виявлено, що композиції з більш низьким вмістом іміквімоду дозволяють ефективно проводити лікування на збільшеній області обробки та більшої кількості уражень АК, не викликаючи на оброблюваній області істотних місцевих шкірних реакцій чи подразнення або побічних явищ, що обмежують лікування, які можуть призводити до передчасного завершення лікування або значних довільних перерв у лікуванні протягом кількох днів, що, як правило, пов'язане з більш високими концентраціями іміквімоду. Також несподівано було виявлено, що приблизно між 250 мг і 500 мг або більше композиції з більш низьким вмістом іміквімоду може використовуватись при кожному 9 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосуванні відповідно до цього винаходу, особливо при використанні нетривалої терапії в поєднанні з композиціями з більш низьким вмістом іміквімоду згідно з цим винаходом. Для порівняння: схвалений FDA для лікування актинічного кератозу крем Aldara® (іміквімод 2 5 %) призначений для нанесення на одну безперервну область обробки площею близько 25 см на обличчі (наприклад, на чолі або одній щоці) або шкірі голови для лікування не більш, ніж приблизно 4-8 уражень АК в одній області обробки, при схемі лікування: нанесення два рази на тиждень протягом повних 16 тижнів на певну область лікування на обличчі або шкірі голови (але не одночасно), а також застосування не більше 250 мг крему Aldara® (іміквімод 5 %) в області лікування за одне нанесення. Також, досить несподівано, сумарна оцінка місцевих шкірних реакцій і середня оцінка місцевих шкірних реакцій, пов'язаних з еритемою, проведені при нетривалій терапії із застосуванням композицій з більш низьким вмістом іміквімоду відповідно до даного винаходу, створюють унікальні бімодальні або двохпікові моделі, які відповідають 2-цикловим способам лікування іміквімодом відповідно до цього винаходу, причому (1) найвища сумарна оцінка місцевих шкірних реакцій і середня оцінка місцевих шкірних реакцій, пов'язаних з еритемою, звичайно та характерно спостерігаються або досягають пікових значень під час або наприкінці першого циклу лікування, (2) сумарна оцінка місцевих шкірних реакцій і середня оцінка місцевих шкірних реакцій, пов'язаних з еритемою, повертаються до нормального або базового або приблизно нормального або базового рівня наприкінці періоду відсутності лікування між циклами, (3) сумарна оцінка місцевих шкірних реакцій і середня оцінка місцевих шкірних реакцій, пов'язаних з еритемою, знову спостерігаються у пацієнта під час або наприкінці другого циклу лікування, як правило, але не обов'язково, зі зниженим рівнем порівняно з сумарною оцінкою місцевих шкірних реакцій і середньою оцінкою місцевих шкірних реакцій, пов'язаних з еритемою, під час першого циклу лікування, і (4) сумарна оцінка місцевих шкірних реакцій і середня оцінка місцевих шкірних реакцій, пов'язаних з еритемою, звичайно повертаються до нормального або базового рівня незабаром після завершення другого циклу лікування. Див., наприклад, Фіг. 18, 18А-В, 20, 20А-В і 43-50 та Приклад 28. У випадку подання бімодальної або двохпікової моделі сумарної оцінки місцевих шкірних реакцій і середньої оцінки місцевих шкірних реакцій, пов'язаних з еритемою, у вигляді 2-вимірного графіка, на якому сумарна оцінка місцевих шкірних реакцій і середня оцінка місцевих шкірних реакцій, пов'язаних з еритемою, відкладаються на вертикальній осі, а відвідування пацієнта під час 2-циклового лікування іміквімодом - на горизонтальній, спостерігаються унікальні бімодальні або двохпікові моделі. Див., наприклад, Фіг. 18, 18А-В, 20 і 20А-В. З огляду на цей несподіваний результат - загальне зниження сумарної оцінки місцевих шкірних реакцій і середньої оцінки місцевих шкірних реакцій, пов'язаних з еритемою, у процесі лікування та повернення до приблизно нормального або базового рівня наприкінці двотижневого періоду без лікування між двома періодами лікування, а також повторне повернення до нормального або базового рівня приблизно наприкінці другого циклу лікування, дотримання запропонованого лікування іміквімодом повинне значно покращитися, що забезпечить більш стабільне досягнення терапевтичних результатів, наприклад, повного або часткового усунення уражень АК або зменшення ураження при АК. Також, досить несподівано, ефективність, що досягається при використанні композицій з більш низьким вмістом іміквімоду в нетривалій терапії, наприклад, двотижневі або тритижневі 2циклові схеми лікування, відповідно до цього винаходу для лікування актинічного кератозу, відносно повного вилікування, часткового вилікування та зниження кількості уражень АК, є статистично значимою порівняно з плацебо. Див., наприклад, Фіг. 51. Також несподіваним є те, що ефективність, яка досягається при лікуванні актинічного кератозу, щодо повного вилікування або часткового вилікування ураження при АК, є по суті статистично еквівалентною при порівнянні двох 2-циклових схем лікування відповідно до цього винаходу - двотижневого та тритижневого - з використанням однакових композицій з більш низьким вмістом іміквімоду. Див., наприклад, Фіг. 51. Ще більш несподіваним є те, що ефективність, яка досягається при використанні 3,75 % композиції з більш низьким вмістом іміквімоду у двотижневій або тритижневій 2-цикловій схемі лікування згідно з цим винаходом для лікування актинічного кератозу, щодо часткового усунення уражень АК, є статистично значимою порівняно з використанням 2,5 % композиції з більш низьким вмістом іміквімоду у двотижневій або тритижневій 2-цикловій схемі лікування. Див., наприклад, Фіг. 51. Проте, слід зазначити, що ефективності, які досягаються щодо повного вилікування та часткового вилікування при використанні композиції з більш низьким вмістом іміквімоду, тобто 2,5 % або 3,75 %, у двотижневій або тритижневій 2-цикловій схемі лікування згідно з цим винаходом, визначають при приблизно 95 % довірчому інтервалі та значенні Ρ менш ніж приблизно 0,001 порівняно з плацебо. Див. Фіг. 51. Слід також зазначити, що значенняΡ ефективності, яка досягається щодо 10 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 часткового вилікування при використанні 3,75 % композиції з більш низьким вмістом іміквімоду порівняно з 2,5 % композицією з більш низьким вмістом іміквімоду, у двотижневій або тритижневій 2-цикловій схемі лікування відповідно до цього винаходу, становить близько 0,047 або близько 0,034, відповідно. Див., наприклад, Фіг. 51. Також досить несподіваним є те, що ефективність, яка досягається при використанні 3,75 % композиції з більш низьким вмістом іміквімоду у двотижневій 2-цикловій схемі лікування згідно з цим винаходом для лікування актинічного кератозу, щодо зменшення кількості уражень АК, є статистично значимою порівняно з використанням 2,5 % композиції з більш низьким вмістом іміквімоду у двотижневій 2-цикловій схемі лікування, однак використання обох зазначених композицій з більш низьким вмістом іміквімоду в тритижневій 2-цикловій схемі лікування згідно з цим винаходом не має відмінностей або є по суті еквівалентним. Див., наприклад, Фіг. 51. Слід зазначити, що значення Ρ ефективності, що досягається відносно відсотка зниження кількості уражень АК при використанні 3,75 % композиції з більш низьким вмістом іміквімоду порівняно з 2,5 % композицією з більш низьким вмістом іміквімоду, у двотижневій або тритижневій 2цикловій схемі лікування відповідно до цього винаходу, становить близько 0,048 або близько 0,133, відповідно. Однак значення Ρ 0,133 не є статистично значимим. Див., наприклад, Фіг. 51. Крім того, досить несподівано було виявлено, що, очевидно, відсутня статистична значимість ефективності, яка досягається при використанні тритижневої 2-циклової схеми лікування порівняно з двотижневою 2-цикловою схемою лікування, незалежно від застосовуваної для лікування актинічного кератозу композиції з більш низьким вмістом іміквімоду. Див., наприклад, Фіг. 52. Інакше кажучи, автори вважають, що відсутня додаткова перевага щодо ефективності при використанні більш тривалої, тритижневої 2-циклової схеми лікування, ніж при використанні двотижневої 2-циклової схеми лікування відповідно до цього винаходу для лікування актинічного кератозу, незалежно від застосовуваної композиції з більш низьким вмістом іміквімоду в кожній з 2-циклових схем лікування відповідно до цього винаходу. Див., наприклад, Фіг. 52, 1-13G, 25-27, 36-38А і 42. Слід зазначити, що значення Р, які досягаються у відношенні (а) повного зцілення, (b) часткового зцілення та (с) зменшення кількості уражень, при використанні двотижневих 2-циклових схем лікування та тритижневих 2циклових схем лікування згідно з цим винаходом, становлять: (а) приблизно 0,462 за Загальною лінійною моделлю ("GLM") і близько 0,499 (LA), (b) близько 0,233 (GLM) і близько 0,164 (LA), і (с) близько 0,635 (GLM), відповідно. Див., наприклад, Фіг. 52. Хоча вважається, що відсутній додатковий виграш у ефективності при порівнянні двох 2циклових схем лікування відповідно до цього винаходу, автори виявили, що, як правило, більша частота виникнення побічних ефектів, наприклад, місцевих шкірних реакцій, і періодів відпочинку пов'язана із тритижневим 2-цикловим періодом лікування порівняно з двотижневим 2-цикловим періодом лікування при використанні однакових композицій з більш низьким вмістом іміквімоду. Незважаючи на збільшення частоти побічних ефектів і періодів відпочинку, пов'язаних із тритижневою 2-цикловою схемою лікування, вважається, що при використанні двотижневих або тритижневих 2-циклових схем лікування відповідно до цього винаходу профіль безпеки зберігається на прийнятному рівні. Див., наприклад, Фіг. 14А-23, 28, 28А-В і 39-42. Проте, досить несподівано автори виявили, що частота виникнення реакцій у місці застосування є нижчою при використанні кожної з 2-циклових схем лікування відповідно до цього винаходу, ніж при використанні крему Aldara® (іміквімод 5 %) для лікування актинічного кератозу відповідно до схваленого FDA режиму лікування, хоча крем Aldara® (іміквімод 5 %) 2 наноситься тільки два рази на тиждень на область площею близько 25 см протягом 16 тижнів. Див., наприклад, Фіг. 28, 28А-В, 41 і 41А. Таким чином, фахівцям у цій галузі буде зрозуміло, що, у той час як обидві 2-циклові схеми лікування відповідно до даного винаходу забезпечують ефективні режими дозування із прийнятними профілями безпеки, які є короткими та більше зручними для пацієнтів, ніж режим дозування зараз схваленого FDA крему Aldara® (іміквімод 5 %) для лікування актинічного кератозу, 2-тижнева 2-циклова схема лікування відповідно до даного винаходу є більш прийнятною. Слід також розуміти, що мала тривалість лікування та застосування композицій з більш низьким вмістом іміквімоду згідно з цим винаходом, вважаються оптимізованими для лікування актинічного кератозу. Тут термін "оптимізовані" означає, що нетривале лікування та композиції з більш низьким вмістом іміквімоду згідно з цим винаходом розроблені для досягнення ефективності, стабільності та швидкості вивільнення, які, принаймні, по суті, еквівалентні та лінійно відповідають крему Aldara® (іміквімод 5 %), відповідно, але з поліпшеним прийнятним профілем безпеки. Термін "прийнятний профіль безпеки" означає, що лікування актинічного кератозу за допомогою нетривалої терапії із застосуванням композиції з більш низьким вмістом іміквімоду згідно з цим винаходом, у т.ч. 2-циклових схем лікування, не викликає обмежуючих лікування 11 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 побічних ефектів або періодів відпочинку у значної кількості пацієнтів, які проходять лікування актинічного кератозу, такою мірою, що зумовлює передчасне припинення лікування. Термін "прийнятний профіль безпеки" також означає, що лікування актинічного кератозу за допомогою нетривалої терапії із застосуванням композиції з більш низьким вмістом іміквімоду згідно з цим винаходом, характеризується меншою частотою появи реакцій на місці нанесення порівняно з лікуванням актинічного кератозу із застосуванням крему Aldara® (іміквімод 5 %). Також, досить несподівано, було з'ясовано, що при використанні композиції з більш низьким вмістом іміквімоду, тобто близько 2,5 % в 2-цикловій схемі лікування 2×2×2 тижні відповідно до цього винаходу для лікування актинічного кератозу у жінок досягаються показники лікування, включаючи повне та часткове вилікування, близько 60 %. Див. Фіг. 31. Не менш несподівано було виявлено, що при використанні композиції з більш низьким вмістом іміквімоду, тобто близько 3,75 %, в 2-цикловій схемі лікування 2×2×2 тижні або 2-цикловій схемі лікування 3×3×3 тижні відповідно до цього винаходу для лікування актинічного кератозу у чоловіків або жінок, у пацієнтів з типом шкіри І, II або III, близько 10 ураженнями або менше на початковому етапі, с ураженнями на обличчі або шкірі голови, досягаються еквівалентні або порівнянні показники вилікування, включаючи повне та часткове вилікування. Див., наприклад, Фіг. 31, 33, ЗЗА, 34, 34А, 35 і 35А-В. Також несподівано було виявлено, що при використанні композиції з більш низьким вмістом іміквімоду, тобто близько 3,75 %, в 2-цикловій схемі лікування 2 × 2x2 тижні або 2-цикловій схемі лікування 3 × 3x3 тижні відповідно до цього винаходу для лікування актинічного кератозу у пацієнтів у віці 65 років або старших або у пацієнтів з більш ніж 10 ураженнями на початковому етапі, 2-циклова схема лікування 2 × 2x2 тижні виявляється більш ефективною. Див., наприклад, Фіг. 32, 32А, 34 і 34А. Також несподівано було виявлено, що при використанні композиції з більш низьким вмістом іміквімоду в нетривалій терапії, наприклад, у двотижневій або тритижневій 2-цикловій схемі лікування згідно з цим винаходом для лікування актинічного кератозу, Глобальна інтегрована оцінка фотоушкодження дослідниками (Investigators Global Integrated Photodamage-IGIP) значно або помітно поліпшувалася порівняно з вихідним рівнем. Див., наприклад, Фіг. 24 і 53. Наприклад, як показано на Фіг. 53, при комбінуванні результатів досліджень 3,75 % іміквімоду приблизно у 44 % (132 з 299) пацієнтів, які проходять лікування, спостерігалося значне поліпшення, приблизно у 25 % (76 з 299) - помітне поліпшення, а у приблизно 17 % (51 з 299) незначне поліпшення оцінки IGIP порівняно з вихідним рівнем. При комбінуванні результатів досліджень 2,5 % іміквімоду приблизно у 32 % (97 з 304) пацієнтів, які проходять лікування, спостерігалося значне поліпшення, приблизно у 26 % (78 з 304) - помітне поліпшення та приблизно у 23 % (69 304) - незначне поліпшення оцінки IGIP порівняно з вихідним рівнем. Основними компонентами фармацевтичної композиції згідно з цим винаходом є: (а) іміквімод і (b) жирна кислота, наприклад, ізостеаринова, пальмітинова, стеаринова, лінолева, неочищена олеїнова кислота або очищена олеїнова кислота, така як олеїнова кислота Super Refined® NF (наприклад, олеїнова кислота високого ступеня очищення, тобто олеїнова кислота з низьким вмістом полярних домішок, таких як перекиси, низьким показником пероксидів, що продається CRODA; див., наприклад, www.crodausa.com), і їх суміші. Фармацевтична композиція відповідно до цього винаходу може мати будь-яку форму, відому з рівня техніки, наприклад, крем, мазь, піна, гель, лосьйон або чутлива до тиску клейова композиція, причому кожна така форма містить необхідні елементи у відповідних кількостях, а також містить різні додаткові елементи. Крем відповідно до даного винаходу містить ефективну кількість іміквімоду, таку як від приблизно більше 1 % до приблизно 4,25 % іміквімоду за масою від загальної маси крему; від приблизно 5 % до приблизно 30 % жирних кислот за масою від загальної маси крему; а також необов'язкові інгредієнти, такі як зм'якшуючі речовини, емульгатори, загусники та/або консерванти. Мазь відповідно до даного винаходу містить основу мазі на додаток до іміквімоду та жирної кислоти. Мазь відповідно до даного винаходу містить ефективну кількість іміквімоду, таку як від приблизно більше 1 % до приблизно 4,25 % іміквімоду за масою; від приблизно 3 % до приблизно 45 %, більш прийнятно, від приблизно 3 % до приблизно 30 % жирних кислот за масою; і від приблизно 40 % до приблизно 95 % основи мазі за масою, у всіх випадках - на основі загальної маси мазі. Необов'язково, мазь відповідно до даного винаходу може також містити емульгатори, пом'якшуючі речовини та загусники. Чутлива до тиску клейова композиції відповідно до даного винаходу містить іміквімод, жирні кислоти та клей. Клеї, що використовуються в чутливих до тиску клейових композиціях згідно з цим винаходом, більш прийнятно є, по суті, хімічно інертними відносно іміквімоду. Чутлива до тиску клейова композиція відповідно до даного винаходу більш прийнятно містить ефективну 12 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількість іміквімоду, таку як від приблизно більше 1 % до приблизно 4,25 % іміквімоду за масою; від приблизно 10 % до приблизно 40 %, більш прийнятно, від приблизно 15 % до приблизно 30 % і, найбільш прийнятно, від приблизно 20 % до приблизно 30 % жирних кислот за масою; у всіх випадках - на основі загальної маси чутливої до тиску клейової композиції. Необов'язково, чутлива до тиску клейова композиція відповідно до даного винаходу може також містити один або кілька підсилювачів проникнення через шкіру. Загальна кількість підсилювача (підсилювачів) проникнення через шкіру, що є присутнім (присутніми) у складі чутливої до тиску клейової композиції відповідно до даного винаходу, становить більш прийнятно, від близько 3 % до близько 25 % за масою, ще більш прийнятно, від близько 3 % до близько 10 % за масою від загальної маси чутливої до тиску клейової композиції. Чутливий до тиску листовий матеріал, покритий клеєм, відповідно до даного винаходу може бути виготовлений із чутливої до тиску клейової композиції відповідно до винаходу у вигляді такого виробу, як стрічка, пластир, аркуш або пов'язка. Композиція з більш низьким вмістом іміквімоду відповідно до даного винаходу може використовуватись для місцевого та/або трансдермального введення ефективної кількості іміквімоду для ефективного лікування актинічного кератозу в рамках нетривалої терапії із прийнятним профілем безпеки. Таким чином, композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу можуть наноситися на будь-яке підходяще місце, наприклад, місцево на поверхню шкіри, губ і/або слизових оболонок. У випадку нанесення на шкіру, наприклад, залежно від концентрації, складу препарату та поверхні шкіри, терапевтичний ефект іміквімоду може поширюватися лише на поверхневі шари шкіри або на тканини під шкірою. Слід розуміти, що, хоча композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу можуть містити за масою від загальної маси композиції від приблизно 1 % до приблизно 4,25 % іміквімоду, більш прийнятними є композиції з вмістом між приблизно 1,5 %, 1,75 %, 2,0 %, 2,25 %, 2,5 %, 2,75 %, 3,0 %, 3,25 %, 3,5 %, 3,75 %, 4,0 % і 4,25 %, більш прийнятними - між приблизно 2,0 %, 2,25 %, 2,5 %, 2,75 %, 3,0 %, 3,25 %, 3,5 %, 3,75 % і 4,0 %, і ще більш прийнятними - між приблизно 2,5 %, 2,75 %, 3,0 %, 3,25 %, 3,5 % і 3,75 %. Композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, які містять близько 2,5 % іміквімоду або близько 3,75 % іміквімоду за масою в розрахунку від загальної маси композиції, є найбільш прийнятними. Слід також розуміти, що композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, які мають пропорційну дозі швидкість вивільнення, відносно як швидкостей вивільнення іміквімоду, так і загальної кількості, що вивільнилася, іміквімоду, порівняно з кремом Aldara® (іміквімод 5 %), також є більш прийнятними. Таким чином, фахівцеві у цій галузі техніки має бути зрозуміло, що кількість іміквімоду, присутнього в композиції згідно з цим винаходом, буде ефективною кількістю, якщо при щоденному нанесенні композиції відповідно до цього винаходу відповідно до нетривалої, описаної тут терапії на цільову область із діагностованим актинічним кератозом і забезпеченні контакту композиції після кожного нанесення із цільовою областю протягом достатнього часу для того, щоб ефективна кількість іміквімоду вилікувала захворювання або викликані ним порушення, частково вилікувала захворювання або викликані ним порушення, зменшила кількість уражень, запобігла повторній появі захворювання, не викликаючи обмежуючих лікування місцевих реакцій на шкірі або побічних ефектів, включаючи незаплановані періоди відпочинку, викликані обмежуючими лікування місцевими реакціями на шкірі або побічними ефектами, у значної кількості пацієнтів, які проходять лікування. Наприклад, при лікуванні актинічного кератозу відповідно до цього винаходу ефективна кількість забезпечує часткове усунення уражень АК в якості цільової кінцевої точки, наприклад, принаймні близько 40 %, більш прийнятно, принаймні, близько 50 %, ще більш прийнятно, принаймні, близько 60 %, ще більш прийнятно, принаймні, близько 70 % і найбільш прийнятно, принаймні, близько 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем, або, принаймні близько 60 %, більш прийнятно, принаймні, близько 70 %, ще більш прийнятно, принаймні, близько 80 % і найбільш прийнятно, принаймні, близько 90 % серединне значення зниження кількості уражень АК в області лікування порівняно з вихідним рівнем, в якості вторинної кінцевої точки, або, принаймні близько 25 %, більш прийнятно, принаймні, близько 30 %, ще більш прийнятно, принаймні, близько 35 % і найбільш прийнятно, принаймні, близько 45 % повного вилікування уражень АК, в якості первинної кінцевої точки. Див., наприклад, Фіг. 36, 36А, 37, 37А, 38, 38А, 51 і 52. Використовуваний тут термін "повне вилікування" означає відсутність клінічно видимих або пальпованих уражень АК в області лікування. Результати використання композицій з більш низьким вмістом іміквімоду в нетривалій терапії відповідно до даного винаходу показують, що композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу, застосовувані один раз на день протягом двох тижнів 13 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 або трьох тижнів 2-циклових періодів лікування, є ефективним і добре стерпним лікуванням актинічного кератозу на обличчі та лисіючій частині голови. Скорочені схеми дозування відповідно до цього винаходу забезпечують нетривалі періоди лікування, які зводять до мінімуму вплив іміквімоду та додатково поліпшують співвідношення користі та ризику порівняно зі схваленим FDA кремом Aldara® (іміквімод 5 %), застосовуваним два рази на тиждень протягом 16 тижнів. Переваги лікування з використанням композицій з більш низьким вмістом іміквімоду в нетривалій терапії відповідно до даного винаходу включають повне або часткове вилікування (> 66 %, більш прийнятно > 75 %, ще більш прийнятно > 88 % і ще більш прийнятно > 95 %) уражень АК для більшості пацієнтів, які проходять лікування. Див. Приклад 24 і Фіг. 51 і 52. Зокрема, повне або часткове вилікування викликаних АК уражень досягається в такий спосіб: (1) > 35 % (57 з 160 пацієнтів) повне вилікування досягається при 2-тижневому 2-цикловому лікуванні з використанням 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; (2) > 30 % (49 з 160 пацієнтів) повне вилікування досягається при 2-тижневому 2-цикловому лікуванні з використанням 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; (3) > 34 % (55 з 162 пацієнтів) повне вилікування досягається при 3-тижневому 2-цикловому лікуванні з використанням 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; і (4) > 25 % (41 з 164 пацієнтів) повне вилікування досягається при 2-тижневому 2-цикловому лікуванні з використанням 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; причому (5) 2 59 % (95 з 160 пацієнтів) часткове вилікування досягається при 2-тижневому 2-цикловому лікуванні з використанням 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; (6) > 48 % (77 з 160 пацієнтів) часткове вилікування досягається при 2тижневому 2-цикловому лікуванні з використанням 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; (7) > 53 % (87 з 162 пацієнтів) часткове вилікування досягається при 3-тижневому 2-цикловому лікуванні з використанням 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу; і (8) > 42 % (70 з 164 пацієнтів) часткове вилікування досягається при 2-тижневому 2-цикловому лікуванні з використанням 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до даного винаходу. Хоча пацієнти, яких лікують композиціями з більш низьким вмістом іміквімоду відповідно до даного винаходу, використовуючи нетривалу терапію відповідно до цього винаходу, можуть мати місцеві шкірні реакції (LSR); див., наприклад, Фіг. 16А-20, 20А-В і 29 і 40, лікування добре переноситься, і спостерігається помітне зниження частоти виникнення реакцій на місці застосування; див., наприклад, Фіг. 14А-Е, 28, 28В, 41 і 41 А, порівняно з більш тривалою схемою лікування АК схваленим FDA кремом Aldara® (іміквімод 5 %), тобто 16 тижнів, застосування два рази на тиждень. Також більша "область лікування" згідно з цим винаходом може бути визначена як область 2 понад 25 см (наприклад, область лікування площею більше 5 см × 5 см будь-якої форми) і до 2 2 приблизно між 200 см і 250 см або більше на обличчі (наприклад, чолі або щоці) або на лисіючій частині голови, у т.ч. все обличчя або вся лисина. Кількість уражень АК, які можуть оброблятися в області лікування, може становити від приблизно 5 до приблизно 20 або більше. Фахівцеві у цій галузі техніки також буде зрозуміло, що даний винахід забезпечує додаткову перевагу, яка полягає у виявленні та клінічному прояві, а також подальшому повному або частковому усуненні початкових (субклінічних) уражень АК в області лікування. Зараз 2 вважається, що, оскільки площа області лікування перевищує 25 см , композиції з більш низьким вмістом іміквімоду та нетривалі курси терапії, проведені відповідно до цього винаходу, підвищать стерпність і дотримання режиму лікування, поліпшать терапевтичні результати, наприклад, повне або часткове вилікування або зменшення кількості уражень АК, зменшать частоту виникнення реакцій у місці застосування (див., наприклад, Фіг. 28, 28А-В, 41 і 41 А) і скоротять довільні періоди відпочинку (див., наприклад, Фіг. 39 і 39А) під час терапії порівняно з нанесенням крему Aldara® (іміквімод 5 %) на таку ж збільшену область обробки відповідно до цього винаходу. Більше того, вважається, що, оскільки збільшена область лікування настільки 2 більша, ніж менша область лікування, тобто менша або дорівнює приблизно 25 см , які зараз обробляють кремом Aldara® (іміквімод 5 %), збільшена область обробки відповідно до даного винаходу буде мати набагато краще співвідношення уражень і неушкодже-ної/нормальної шкіри, ніж це було у випадку меншої області лікування кремом Aldara® (іміквімод 5 %). Більш прийнятна концентрація іміквімоду, що наноситься, становить між приблизно 1 % і приблизно 4,25 % іміквімоду за масою в розрахунку на загальну масу композиції згідно з цим винаходом. Крім того, для лікування актинічного кератозу відповідно до цього винаходу ефективну кількість іміквімоду необхідно наносити один раз на день протягом, принаймні, до приблизно 6 тижнів, 14 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 наприклад, один раз на день протягом повних 2 або 3 тижнів (14 або 21 днів) на діагностовану або визначену область лікування, наприклад, на обличчя або лисіючу частину голови (цикл 1), потім призупинити або припинити на 2 або 3 тижні (14 або 21 днів) - на запланований період відпочинку, після чого - знову наносити один раз на день протягом повних 2 або 3 тижнів (14 або 21 днів) на визначену область обробки (цикл 2) для досягнення вторинної та, ще більш прийнятно, первинної кінцевої точки, наприклад, щоб забезпечити, принаймні, близько 75 % скорочення уражень АК в якості цільової вторинної кінцевої точки та, ще більш прийнятно, повне зникнення уражень АК - в якості первинної кінцевої точки. Також при лікуванні актинічного кератозу відповідно до двотижневих або тритижневих 2-циклових періодів лікування згідно з цим винаходом ефективна кількість іміквімоду, що наноситься на область лікування, не тільки забезпечить досягнення вторинної або первинної кінцевої точки, але й меншу кількість шкірних реакцій у місці застосування, незапланованих періодів відпочинку у пацієнтів, які проходять лікування, наприклад, не більш, ніж приблизно 11 %, більш прийнятно, не більш, ніж приблизно 7 % пацієнтів зроблять один або кілька перерв для відпочинку протягом нетривалого двотижневого 2-циклового періоду лікування, і не більш, ніж приблизно 17 %, більш прийнятно, не більш, ніж приблизно 27 % пацієнтів зроблять один або кілька перерв для відпочинку протягом нетривалого тритижневого 2-циклового періоду лікування. Див., наприклад, Фіг. 21, 39 і 39А. Хоча даний винахід визначив концентрації іміквімоду в композиціях, що вважаються більш прийнятними, кількість застосувань на тиждень і тривалість терапії, фахівцеві у цій галузі має бути зрозуміло, що даний винахід охоплює будь-яку ефективну концентрацію іміквімоду в композиції, яка доставляє ефективну кількість іміквімоду, і будь-яку кількість застосувань на тиждень протягом нетривалої терапії, описаної тут, які можуть ефективно лікувати актинічний кератоз, не викликаючи обмежуючих лікування місцевих шкірних реакцій або небажаних явищ, у т.ч. занадто великої кількості періодів відпочинку. Наведений вище короткий опис винаходу не ставить на меті описати кожний розкритий варіант або здійснення цього винаходу. Нижче наведений опис, проілюстрований прикладами конкретних втілень. У кількох частинах матеріалів заявки наведені списки прикладів, які можуть використовуватись в різних поєднаннях. У кожному випадку наведений список служить лише як репрезентативна група та не повинен розглядатися як обмежуючий. Короткий опис креслень Зазначені вище та інші об'єкти, переваги та ознаки цього винаходу, а також способи їх досягнення стануть більш зрозумілими з наведеного далі докладного опису винаходу в поєднанні із кресленнями та прикладами, що ілюструють варіанти реалізації, де: Фіг. 1 ілюструє міри ефективності відносно показників повного вилікування за дослідженнями для досліджень GW01-0702, GW01-0703, GW01-0704 і GW01-0705 для 2циклового 2×2×2 (2 тижні) курсу лікування та для 2-циклового 3×3×3 (3 тижні) курсу лікування; Фіг. 1А містить підсумкові значення первинних і вторинних кінцевих точок ефективності для двотижневого курсу лікування групи ІТТ у дослідженнях GW01-0702 і GW01-0704. Повне вилікування визначене як відсутність клінічно видимих або пальпованих уражень АК в області лікування. Часткове вилікування визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Значення Ρ отримані з тесту Кочрена-МантелаХензеля, стратифікованого за центрами аналізу, розглядаючи по 2 групи лікування одночасно. Значення Р, позначені **, є статистично значимими при використанні модифікованої Хохбергом процедури Бонфероні. LOCF = Останнє спостереження, що переноситься вперед. Довірчі інтервали розраховуються з використанням точної біноміальної статистики. На Фіг. 1А "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" -3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 2 ілюструє міри ефективності відносно показників повного вилікування за часовими точками для досліджень GW01-0702 і GW01-0704 для 2-циклового 2×2×2 (2 тижні) курсу лікування. На Фіг. 2 "Повне вилікування" стосується показника повного усунення уражень АК, "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, a "EOS" означає завершення дослідження; Фіг. 2А ілюструє показник повного вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0702. Позначені ** точки означають статистичну відмінність від плацебо. На Фіг. 2А "Показник повного вилікування" означає показник повного усунення уражень АК, "А" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" плацебо; 15 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 2В ілюструє показник повного вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0704. Позначені ** точки означають статистичну відмінність від плацебо. Позначені ## точки означають статистичне розходження між схемами лікування активною речовиною. На Фіг. 2В "Показник повного вилікування" означає показник повного усунення уражень АК, "А" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 3 ілюструє міри ефективності відносно показників повного вилікування за часовими точками для досліджень GW01-0703 і GW01-0705 для 2-циклового 3×3×3 (3 тижні) курсу лікування. На Фіг. 3 "Повне вилікування" стосується показника повного усунення уражень АК, "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, a "EOS" означає завершення дослідження. Див. також Фіг. 2А і 2В; Фіг. 3А ілюструє показник повного вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0703. Позначені ** точки означають статистичну відмінність від плацебо. Позначені ## точки означають статистичне розходження між схемами лікування активною речовиною. На Фіг. 3А "Показник повного вилікування" означає показник повного усунення уражень АК, "А" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 3В ілюструє показник повного вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0705. Позначені ** точки означають статистичну відмінність від плацебо. Позначені ## точки означають статистичне розходження між схемами лікування активною речовиною. На Фіг. 3В "Показник повного вилікування" означає показник повного усунення уражень АК, "А" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 4А ілюструє показники часткового вилікування наприкінці дослідження при використанні двотижневого циклічного курсу лікування в групи ІТТ у дослідженнях GW01-0702 і GW01-0704. На Фіг. 4А "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "L" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "Н" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, Ρ = плацебо, позначені ** стовпчики показують статистично значиму відмінність від плацебо, позначені ## стовпчики показують статистично значиму відмінність від 2,5 %. Вертикальні сині лінії позначають 95 % довірчий інтервал; Фіг. 4В ілюструє показник часткового вилікування в тиждень 14 для групи ІТТ у дослідженні GW01-0702. Часткове вилікування визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Позначені ** стовпчики показують статистична значиму відмінність від плацебо. Темні чорні вертикальні лінії позначають 95 % довірчий інтервал для показників. На Фіг. 4В "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду згідно з Прикладами 23-28; Фіг. 4С ілюструє показник часткового вилікування в тиждень 14 для групи ІТТ у дослідженні GW01-0704. Часткове вилікування визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Позначені ** стовпчики показують статистична значиму відмінність від плацебо. Позначені ## стовпчики показують статистичне розходження між схемами лікування активною речовиною. Темні чорні вертикальні лінії позначають 95 % довірчий інтервал для показників. На Фіг. 4С "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду згідно з Прикладами 23-28; Фіг. 4D ілюструє показник часткового вилікування в тиждень 17 для групи ІТТ у дослідженні GW01-0703. Часткове вилікування визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Позначені ** стовпчики показують статистична значиму відмінність від плацебо. Темні чорні вертикальні лінії позначають 95 % довірчий інтервал для показників. На Фіг. 4D "Показник часткового вилікування" означає 16 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду згідно з Прикладами 23-28; Фіг. 4Е ілюструє показник часткового вилікування в тиждень 17 для групи ІТТ у дослідженні GW01-0705. Часткове вилікування визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Позначені ** стовпчики показують статистична значиму відмінність від плацебо. Темні чорні вертикальні лінії позначають 95 % довірчий інтервал для показників. На Фіг. 4Е "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду згідно з Прикладами 23-28; Фіг. 4F ілюструє показник часткового вилікування за часовими точками дослідження для об'єднаних досліджень і групи ІТТ при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Зверніть увагу: L2=2,5 %, курс лікування із двотижневим циклом лікування, L3=2,5 %, курс лікування із тритижневим циклом лікування, Н2=3,75 %, курс лікування із двотижневим циклом лікування, Н3 = 3,75 %, курс лікування із тритижневим циклом лікування, Р2 = плацебо, курс лікування із двотижневим циклом лікування та Р3 = плацебо, курс лікування із тритижневим циклом лікування. На Фіг. 4F "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, "через 8 тижнів" означає 8 тижнів після лікування; Фіг. 5 ілюструє міри ефективності відносно показників часткового вилікування за часовими точками для досліджень GW01-0702 і GW01-0704. Див. також Фіг. 37А. На Фіг. 5 "Часткове вилікування" означає часткове усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, "EOS" означає завершення дослідження, а "2×2×2" означає двотижневе 2-циклове лікування, зазначене на Фігурах і в описі; Фіг. 5А ілюструє показник часткового вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0702. Позначені ** точки показують статистичну відмінність від плацебо. Позначені ## точки показують статистичне розходження між схемами лікування активною речовиною. На Фіг. 5А "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "А" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" плацебо; Фіг. 5В ілюструє показник часткового вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0704. Позначені ** точки показують статистичну відмінність від плацебо. Позначені ## точки показують статистичне розходження між схемами лікування активною речовиною. На Фіг. 5В "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "А" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг.5С ілюструє міри ефективності відносно показників часткового вилікування за часовими точками для досліджень GW01-0703 і GW01-0705. На Фіг.5С "Часткове вилікування" означає відсоток часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним різнем), "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, a "EOS" означає завершення дослідження. Див. також Фіг. 37А; Фіг. 6А ілюструє показник часткового вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0703. Позначені ** точки показують статистично значиму відмінність від плацебо. Позначені ## точки показують статистично значиме розходження між схемами лікування активною речовиною. На Фіг. 6А "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "А" стосується 2,5 % 17 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 6В ілюструє показник часткового вилікування за тижнями дослідження для групи ІТТ у дослідженні GW01-0705. Позначені ** точки показують статистично значиму відмінність від плацебо. Позначені ## точки показують статистично значиме розходження між схемами лікування активною речовиною. На Фіг. 6В "Показник часткового вилікування" означає показник часткового усунення уражень АК (яке визначається як, принаймні, приблизно 75 % зменшення кількості уражень АК в області лікування порівняно з вихідним рівнем), "А" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 7 ілюструє міри ефективності у відношенні середнього % зміни порівняно з вихідним рівнем, за дослідженнями, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 9А; Фіг. 8 ілюструє міри ефективності у відношенні середнього % зміни порівняно з вихідним рівнем, за часовими точками, для досліджень GW01-0702 і GW01-0704. На Фіг. 8 "% зменшення кількості" стосується процентного зниження кількості уражень АК порівняно з вихідним рівнем, "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, a "EOS" означає завершення дослідження. Див. також Фіг. 9А; Фіг. 8А ілюструє серединне значення процентної зміни кількості уражень АК порівняно з вихідним рівнем за тижнями дослідження для групи ІТТ у дослідженні GW01-0702. Позначені ** точки показують статистично значиму відмінність від плацебо. Позначені ## точки показують статистично значиме розходження між схемами лікування активною речовиною. На Фіг. 8А "Серединне значення процентної зміни" означає серединне значення процентної зміни кількості уражень АК порівняно з вихідним рівнем, "А" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 8В ілюструє серединне значення процентної зміни кількості уражень АК порівняно з вихідним рівнем за тижнями дослідження для групи ІТТ у дослідженні GW01-0704. Позначені ** точки показують статистично значиму відмінність від плацебо. Позначені ## точки показують статистично значиме розходження між схемами лікування активною речовиною. На Фіг. 8В "Серединне значення процентної зміни" означає серединне значення процентної зміни кількості уражень АК порівняно з вихідним рівнем, "А" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо; Фіг. 9 ілюструє міри ефективності у відношенні середнього % зміни порівняно з вихідним рівнем, за часовими точками, для досліджень GW01-0703 і GW01-0705. На Фіг. 9 "Середній % зміни порівняно з вихідною кількістю" стосується середнього процентного зниження кількості уражень АК, "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, a "EOS" означає завершення дослідження. Див. також Фіг. 8А і 8В; Фіг. 9А ілюструє сумарну кількість уражень АК для групи ІТТ у дослідженні GW01-0703. На Фіг. 9А "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення Ρ отримані з тесту Кочрена-Мантела-Хензеля, стратифікованого за центрами аналізу, розглядаючи по дві групи лікування одночасно. Значення Р, позначені **, є статистично значимими при використанні модифікованої Хохбергом процедури Бонфероні. Кількості уражень, які реєструються як "невизначені", виключені з аналізу; Фіг. 9В ілюструє сумарну кількість уражень АК для групи ІТТ у дослідженні GW01-0705. На Фіг. 9А "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення Ρ отримані з тесту Кочрена-Мантела-Хензеля, стратифікованого за центрами аналізу, розглядаючи по дві групи лікування одночасно. Значення Р, позначені **, є статистично значимими при використанні модифікованої Хохбергом процедури Бонфероні. Кількості уражень, які реєструються як "невизначені", виключені з аналізу; Фіг. 10 ілюструє міри ефективності відносно показників лікування, залежно від статі пацієнта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 10 "Показник лікування" означає показник повного усунення уражень АК; Фіг. 10А містить зведені дані первинних і вторинних кінцевих точок ефективності для підгруп чоловіків і жінок для об'єднаних досліджень GW01-0702 і GW01-0704, двотижневого циклу лікування та групи ІТТ при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення Ρ для показників лікування засновані на 18 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 узагальненому лінійному модулі (GENMOD), з передбачуваним поліноміальним розподілом (DIST=MULT) і кумулятивною logit-функцією зв'язку (LINK=CLOGIT), враховуючи вплив дози, підгрупи та взаємодії. Значення Ρ для процентної зміни в кількості уражень АК отримані з дисперсійного аналізу (GLM), що включає вплив дози, підгрупи та взаємодії; Фіг. 10В містить зведені дані змінної первинної ефективності, аналізу показника повного вилікування в тиждень 17 (завершення дослідження) підгрупи η/Ν (%) для дослідження GW010703, при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 10С містить зведені дані змінної первинної ефективності, аналізу показника повного вилікування в тиждень 17 (завершення дослідження) підгрупи n/Ν (%) для дослідження GW010705, при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 11 ілюструє міри ефективності відносно показників лікування, залежно від області лікування, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 11 "Показник лікування" означає показник повного усунення уражень АК; Фіг. 12 ілюструє міри ефективності відносно серединного значення % зміни порівняно з вихідним рівнем, між 0 і -100, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 11 "Процентна зміна" стосується серединного значення відсотка зміни в кількості уражень АК при використанні 2,5 % або 3,75 % композицій з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28 у рамках двотижневого 2-циклового або тритижневого 2циклового лікування; Фіг. 12А ілюструє серединне значення відсотка зміни в кількості уражень АК порівняно з вихідним рівнем за часовими точками дослідження для об'єднаних досліджень і групи ІТТ при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Зверніть увагу: L2=2,5 %, курс лікування із двотижневим циклом лікування, L3=2,5 %, курс лікування із тритижневим циклом лікування, Н2=3,75 %, курс лікування із двотижневим циклом лікування, Н3 = 3,75 %, курс лікування із тритижневим циклом лікування, Р2 = плацебо, курс лікування із двотижневим циклом лікування та Р3 = плацебо, курс лікування із тритижневим циклом лікування. На Фіг. 12А "Серединне значення відсотка зміни" означає серединне значення процентної зміни в кількості уражень АК порівняно з вихідним рівнем, "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, "через 8 тижнів" означає 8 тижнів після лікування, а "Р" відповідає плацебо; Фіг. 13 ілюструє міри ефективності відносно серединного значення відсотка зміни порівняно з вихідним рівнем, від 0 до -80, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW010705, при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. На Фіг. 13 "Процентна зміна" означає середній відсоток зміни в кількості уражень АК порівняно з вихідним рівнем, "Початок 2 циклу" означає початок другого циклу, "через 4 тижні" означає 4 тижні після лікування, a "EOS" означає завершення дослідження (8 тижнів після лікування); Фіг. 13A-G містять зведені дані про процентну зміну в кількості уражень АК порівняно з вихідним рівнем за відвідуваннями для об'єднаних досліджень і групи ІТТ при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення Ρ отримані з тесту Кочрена-Мантела-Хензеля, стра-тифікованого за центрами аналізу, розглядаючи по дві групи лікування одночасно. Значення Р, позначені **, є статистично значимими при використанні модифікованої Хохбергом процедури Бонфероні. Фіг. 14А-Е містять зведені дані про викликані лікуванням несприятливі явища n (%) у пацієнтів у порядку убування частоти в групі 3,75 % або 2,5 % двотижневого або тритижневого циклічного лікування, у випадках, коли дослідник вважає, що несприятливі явища пов'язані з лікуванням, для об'єднаних досліджень і групи ІТТ при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення відбивають кількість пацієнтів у кожній групі лікування, які повідомили про одне або кілька несприятливих явищ, які відповідають класу органів за системою MedDRA. Пацієнт може враховуватися тільки один раз у кожному рядку таблиці. Пов'язані з лікуванням явища охоплюють "Імовірно пов'язані" і "Пов'язані". Викликані лікуванням АЕ (несприятливі явища) - це АЕ з датою настання в день 1 лікування або пізніше; Фіг. 15 ілюструєміри безпеки відносно частоти виникнення пов'язаних з лікуванням несприятливих явищ для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 15 "Н" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, a "L" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "V" - носія. Див. також Фіг. 14А-14Е; 19 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 16А-C містять зведені дані про місцеві шкірні реакції (LSR) найвищого ступеня важкості під час дослідження для об'єднаних досліджень і групи ІТТ при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду у рамках 2-тижневого або 3-тижневого двохциклового лікування відповідно до цього винаходу. Оскільки один пацієнт із групи двотижневого лікування 3,75 % композицією, один пацієнт із групи тритижневого лікування 2,5 % композицією, один пацієнт із групи лікування 3,75 % композицією та два пацієнти із тритижневої групи плацебо не з'явилися на відвідування після початкового, вони були виключені з аналізу; Фіг. 17 ілюструє міри безпеки відносно сумарної оцінки LSR AUC для досліджень GW010703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 17 "Н" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "L" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28 Фіг. 17А містить зведені дані про місцеві шкірні реакції (LSR) - площі під кривою сумарної оцінки LSR (дні) для об'єднаних досліджень і групи ІТТ при використанні 2,5 % або 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення Ρ отримані з дисперсійного аналізу (GLM), що включає вплив дози, режиму та центра аналізу в режимі. Часовий період AUC поширюється на вісім тижнів після закінчення лікування як для двотижневого циклічного курсу лікування (тиждень 14), так і для тритижневого циклічного курсу лікування (тиждень 17). В аналіз включені тільки пацієнти, які пройшли лікування протягом обох циклів; Фіг. 18 ілюструє міри безпеки відносно сумарної оцінки LSR, за часовими точками, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Фіг. 18А ілюструє середнє значення сумарної оцінки LSR за часовими точками дослідження для двотижневих циклічних курсів лікування та групи ІТТ при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Зверніть увагу: Bsl = вихідний рівень, ЕоС1 = кінець циклу 1, SoC2 = початок циклу 2, ЕоС2 = кінець циклу 2, 4WP=4 тижні після лікування, 8WP=8 тижнів після лікування, L2=2,5 %, двотижневий циклічний режим лікування, Н2=3,75 %, двотижневий циклічний режим лікування, Р2 = плацебо, двотижневий циклічний режим лікування; Фіг. 18В ілюструє середнє значення сумарної оцінки LSR за часовими точками дослідження для тритижневих циклічних курсів лікування та групи ІТТ при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Зверніть увагу: Bsl = вихідний рівень, ЕоС1 = кінець циклу 1, SoC2 = початок циклу 2, ЕоС2 = кінець циклу 2, 4WP=4 тижні після лікування, 8WP=8 тижнів після лікування, L3=2,5 %, тритижневий циклічний режим лікування, НЗ = 3,75 %, тритижневий циклічний режим лікування, РЗ = плацебо, тритижневий циклічний режим лікування; Фіг. 19 ілюструє міри безпеки відносно частоти виникнення сильних LSR, пов'язаних з еритемою, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 19 "Н" стосується 3,75 % композиції з більш низьким вмістом іміквімоду, a "L" -2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "V" - носія. Див. також Фіг. 16А-С; Фіг. 20 ілюструє середню оцінку LSR, пов'язаних з еритемою, за часовими точками, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705; Фіг. 20А ілюструє середню оцінку LSR за тижнями дослідження для випадків еритеми в групі ІТТ у дослідженні GW01-0702. На Фіг. 20А "А" стосується 2,5 % композиції з більш низьким вмістом іміквімоду, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо. Фіг. 20В ілюструє середню оцінку LSR за тижнями дослідження для випадків еритеми в групі ІТТ у дослідженні GW01-0704. На Фіг. 20В "А" стосується 2,5 % композиції з більш низьким вмістом іміквімоду, "В" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "С" - плацебо. Фіг. 21 ілюструє міри безпеки відносно частоти виникнення періодів відпочинку для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 30; Фіг. 22 ілюструє міри безпеки відносно частоти припинення дослідження із причин безпеки для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 22 "Н" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "L" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "V" - носія. Фіг. 23 містить зведені дані про вибрані параметри безпеки, пов'язаних із застосуваннями 2,5 % і 3,75 % композицій з більш низьким вмістом іміквімоду відповідно до Прикладу 23, які використовуються в курсах лікування 2×2×2 тижні, 2-цикли та 3×3×3 тижні, 2 цикли. Результати демонструє загальний прийнятний профіль безпеки для 2,5 % і 3,75 % композицій іміквімоду 20 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 відповідно до прикладу 23 відповідно до 2- або 3-тижневого циклічного режиму. Слід зазначити, що результати свідчать про кращий профіль безпеки при використанні 2,5 % або 3,75 % композиції іміквімоду в режимі 2×2×2 тижні, 2 цикли порівняно з режимом 3×3×3 тижні, 2 цикли. Фіг. 24 демонструє поліпшення Глобальної інтегрованої оцінки фотоушкодження дослідниками порівняно з вихідним рівнем для двотижневого 2-циклового періоду лікування (2×2×2 тижнів). На Фіг. 24, Дослідження 1 стосується дослідження GW01-0702, Дослідження 2 стосується дослідження GW01-0704 тут і далі. На Фіг. 24 "Рbо" стосується плацебо, a "Imiq" іміквімоду; Фіг. 25 ілюструє мета-аналіз ефективності об'єднаних показників лікування для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705; Фіг. 25А містить підсумкові дані первинних і вторинних кінцевих точок ефективності для об'єднаних досліджень, з аналізом у рамках курсу для групи ІТТ при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Повне вилікування визначене як відсутність клінічно видимих або пальпованих уражень АК в області лікування. Часткове вилікування визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Значення Ρ отримані з тесту Кочрена-МантелаХензеля, стратифікованого за центрами аналізу, у рамках курсу, розглядаючи по 2 групи лікування одночасно. Значення Р, позначені **, є статистично значимими при використанні модифікованої Хохбергом процедури Бонфероні. LOCF = Останнє спостереження, що переноситься вперед. Довірчі інтервали розраховуються з використанням точної біноміальної статистики; Фіг. 26 ілюструє порівняння ефективності відносно показників повного вилікування, за дослідженнями, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 26 "2×2×2" стосується двотижневого, 2-циклового лікування, а "3×3×3" - тритижневого, 2-циклового лікування. Див. також Фіг. 25А; Фіг. 27 ілюструє порівняння ефективності відносно показників часткового вилікування, за дослідженнями, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. На Фіг. 27 "2 χ 2 χ 2" стосується двотижневого, 2-циклового лікування, а "З χ 3 χ 3" - тритижневого, 2циклового лікування. Див. також Фіг. 25А; Фіг. 28 ілюструє порівняння безпеки відносно частоти виникнення несприятливих явищ для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705 порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 28 "2 тижні" відповідає двотижневому 2-цикловому лікуванню, "З тижні" відповідає тритижневому 2-цикловому лікуванню, "РЬо" - плацебо, "2,5 %" відповідає 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 28А-В ілюструє кількість (%) пацієнтів у дослідженнях фази 3 з викликаними лікуванням небажаними явищами, частота яких перевищує 1 %, у групі двотижневого циклічного лікування 3,75 % іміквімодом групи ІТТ. Значення відбивають кількість пацієнтів у кожній групі лікування, які повідомили про одне або кілька несприятливих явищ, які відповідають класу органів за системою MedDRA. Пацієнт може враховуватися тільки по одному разу в кожному рядку таблиці. Викликані лікуванням АЕ (несприятливі явища) - це АЕ з датою настання в день 1 лікування або пізніше. На Фіг. 28А-В "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 29 ілюструє порівняння частоти виникнення тяжкої еритеми (місцевої шкірної реакції (LSR)) для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705 порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 29 Ή" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "L" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "V" - носія, "2×2×2" стосується двотижневого, 2циклового курсу лікування, а "3×3×3" - тритижневого, 2-циклового курсу лікування. Див. також Фіг. 16А; Фіг. 30 ілюструє міри безпеки відносно частоти періодів відпочинку для досліджень GW010703, GW01-0702, GW01-0704 і GW01-0705 порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 30 "Н" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "L" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "V" - носія, "2×2×2" стосується двотижневого, 2-циклового курсу лікування, а "3×3×3" тритижневого, 2-циклового курсу лікування. Див. також Фіг. 21; Фіг. 31 ілюструє міри ефективності відносно показників лікування, залежно від статі пацієнта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 10А-10С; 21 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 32 ілюструє міри ефективності відносно показників лікування, залежно від віку пацієнта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 10В-10С; Фіг. 32А містить зведені дані первинних і вторинних кінцевих точок ефективності для вікових підгруп у віці понад і до 65 років для об'єднаних досліджень двотижневого циклу лікування (GW01-0702 і GW01-0704) і групи ІТТ тільки з лікуванням активним препаратом при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 2328. Значення Ρ для показників лікування засновані на узагальненому лінійному модулі (GENMOD), з передбачуваним поліноміальним розподілом (DIST=MULT) і кумулятивною logitфункцією зв'язку (LINK=CLOGIT), враховуючи вплив дози, підгрупи та взаємодії. Значення Ρ для процентної зміни в кількості уражень АК отримані з дисперсійного аналізу (GLM), що включає вплив дози, підгрупи та взаємодії. На Фіг. 32А "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "= 65" - вікової групи 65 років і більше; Фіг. 33 ілюструє міри ефективності відносно показників лікування, залежно від типу шкіри пацієнта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 10В-10С; Фіг. ЗЗА містить зведені дані первинних і вторинних кінцевих точок ефективності для груп з різним типом шкіри за Фіцпатриком, для об'єднаних досліджень двотижневого циклу лікування (GW01-0702 і GW01-0704) і групи ІТТ тільки з лікуванням активним препаратом при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 2328. Значення Ρ для показників лікування засновані на узагальненому лінійному модулі (GENMOD), з передбачуваним поліноміальним розподілом (DIST=MULT) і кумулятивною logitфункцією зв'язку (LINK=CLOGIT), враховуючи вплив дози, підгрупи та взаємодії. Значення Ρ для процентної зміни в кількості уражень АК отримані з дисперсійного аналізу (GLM), що включає вплив дози, підгрупи та взаємодії. На Фіг. ЗЗА "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "І", "II", "III", "IV" "V" або "VI" означають типи шкіри за Фіцпатриком; Фіг. 34 ілюструє міри ефективності відносно показників лікування, залежно від вихідної кількості уражень, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 10В-10С; Фіг. 34А містить зведені дані первинних і вторинних кінцевих точок ефективності для груп з різною вихідною кількістю уражень, для об'єднаних досліджень двотижневого циклу лікування (GW01-0702 і GW01-0704) і групи ІТТ тільки з лікуванням активним препаратом при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 2328. Значення Ρ для показників лікування засновані на узагальненому лінійному модулі (GENMOD), з передбачуваним поліноміальним розподілом (DIST=MULT) і кумулятивною logitфункцією зв'язку (LINK=CLOGIT), враховуючи вплив дози, підгрупи та взаємодії. Значення Ρ для процентної зміни в кількості уражень АК отримані з дисперсійного аналізу (GLM), що включає вплив дози, підгрупи та взаємодії. На Фіг. 34А "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 35 ілюструє міри ефективності відносно показників лікування, залежно відобласті лікування, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також Фіг. 10В-10С; Фіг. 35А містить зведені дані первинних і вторинних кінцевих точок ефективності для груп з різним місцем розташування області лікування (обличчя або лисіюча частина голови), для об'єднаних досліджень двотижневого циклу лікування (GW01-0702 і GW01-0704) і групи ІТТ тільки з лікуванням активним препаратом при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Значення Ρ для показників лікування засновані на узагальненому лінійному модулі (GENMOD), з передбачуваним поліноміальним розподілом (DIST=MULT) і кумулятивною logit-функцією зв'язку (LINK=CLOGIT), враховуючи вплив дози, підгрупи та взаємодії. Значення Ρ для процентної зміни в кількості уражень АК отримані з дисперсійного аналізу (GLM), що включає вплив дози, підгрупи та взаємодії. На Фіг. 35А "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "Обличчя" або "Лисіюча частина голови" позначає область обробки; Фіг. 35В містить зведені дані первинних і вторинних кінцевих точок ефективності для груп з різним місцем розташування області лікування (обличчя або лисіюча частина голови), для 22 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 об'єднаних досліджень двотижневого циклу лікування (GW01-0702 і GW01-0704) і групи ІТТ при використанні 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 2328. Значення Ρ для показників лікування засновані на узагальненому лінійному модулі (GENMOD), з передбачуваним поліноміальним розподілом (DIST=MULT) і кумулятивною logitфункцією зв'язку (LINK=CLOGIT), враховуючи вплив дози, підгрупи та взаємодії. Значення Ρ для процентної зміни в кількості уражень АК отримані з дисперсійного аналізу (GLM), що включає вплив дози, підгрупи та взаємодії. На Фіг. 35В "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" -3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "Обличчя" або "Лисіюча частина голови" позначає область обробки; Фіг. 36 ілюструє процентний показник повного вилікування порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 36 і в описі "дослідження 1" стосується дослідження GW01-0702, "дослідження 2" - дослідження GW01-0704. На Фіг. 36 "Рbо" стосується плацебо, "Imiq" іміквімоду, a "Aldara" - крему Aldara® (іміквімод 5 %). Див. також Фіг.1; Фіг. 36А ілюструє процентний показник повного вилікування порівняно з плацебо. На Фіг. 36 і в описі "дослідження 1" стосується дослідження GW01-0702, "дослідження 2" - дослідження GW01-0704, "дослідження 3" - дослідження GW01-0703, а "дослідження 4" - дослідження GW010705. На Фіг. 36А "Рbо" стосується плацебо, а "Imiq" - іміквімоду; Фіг. 37 ілюструє процентний показник часткового вилікування порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 37 і в описі "дослідження 1" стосується дослідження GW01-0702, "дослідження 2" - дослідження GW01-0704. На Фіг. 37 "Рbо" стосується плацебо, "2,5 % Imiq" 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, a "Aldara" - крему Aldara® (іміквімод 5 %). Див. також Фіг. 4А; Фіг. 37А ілюструє часткове вилікування порівняно з плацебо. На Фіг. 37А і в описі "дослідження 1" стосується дослідження GW01-0702, "дослідження 2" - дослідження GW010704, "дослідження 3" - дослідження GW01-0703, а "дослідження 4" -дослідження GW01-0705. На Фіг. 37А "Рbо" стосується плацебо, "2,5 % Imiq" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28; Фіг. 38 ілюструє серединне значення % зменшення уражень АК порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 38 і в описі "дослідження 1" стосується дослідження GW01-0702, "дослідження 2" - дослідження GW01-0704. На Фіг. 38 "Рbо" стосується плацебо, "2,5 % Imiq" 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, a "Aldara" - крему Aldara® (іміквімод 5 %). Фіг. 38А ілюструє серединне значення % зменшення уражень АК порівняно з плацебо. На Фіг. 38А і в описі "дослідження 1" стосується дослідження GW01-0702, "дослідження 2" дослідження GW01-0704, "дослідження 3" - дослідження GW01-0703, а "дослідження 4" дослідження GW01-0705. На Фіг. 38А "Рbо" стосується плацебо, "2,5 % Imiq" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, a "Aldara" - крему Aldara® (іміквімод 5 %); Фіг. 39 ілюструє періоди відпочинку для курсу лікування 2 цикли, 2×2×2 (2 тижні) порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 39 "Рbо" стосується плацебо, "2,5 % Imiq" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, a "Aldara" крему Aldara® (іміквімод 5 %). Фіг. 39А ілюструє вибрані параметри безпеки для об'єднаних досліджень двотижневого 2циклового лікування (GW01-0702 і GW01-0704) або тритижневого 2-циклового лікування (GW010703 і GW01-0705). На Фіг. 39А "2,5 % Imiq" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "Тх" - лікування; Фіг. 40 ілюструє місцеві шкірні реакції ("LSR"); % пацієнтів із сильними LSR при курсі лікування 2 цикли, 2×2×2 (2 тижні) порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 40 "Рbо" стосується плацебо, "2,5 % Imiq" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, a "Aldara" - крему Aldara® (іміквімод 5 %). Див. також Фіг. 16А-С; 23 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 41 ілюструє порівняння частоти виникнення деяких загальних несприятливих явищ при курсі лікування 2 цикли, 2×2×2 (2 тижні) порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 41 "Рbо" стосується плацебо, "2,5 % Imiq" - 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 % Imiq" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "Aldara" - крему Aldara® (іміквімод 5 %), a "NS" означає "Не зазначено"; Фіг. 41А ілюструє частоту виникнення найпоширеніших (понад 1 %), пов'язаних з лікуванням несприятливих явищ для об'єднаних двотижневих (GW01-0702 і GW01-0704) або тритижневих (GW01-0703 і GW01-0705) досліджень; Фіг. 42 ілюструє співвідношення користь/ризик для курсу лікування 2 цикли, 2×2×2 (2 тижні) порівняно з кремом Aldara® (іміквімод 5 %). На Фіг. 42 "Важка еритема" означає важку еритему, "Реакції в місці нанесення" означає реакції в місці застосування, "Періоди відпочинку" означає відсоток пацієнтів, які зробили перерви - періоди відпочинку - під час дослідження на додаток до двох тижнів відпочинку (періоду без лікування) між 2 циклами двотижневого лікування, "Повне вилікування" означає показник повного усунення уражень АК, "Часткове вилікування" означає показник часткового усунення уражень АК (яке визначене як, принаймні, 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем),"% зниження" означає серединне значення відсотка зниження кількості уражень АК, "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, "3,75 %" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, і "Aldara" стосується до крему Aldara® (іміквімод 5 %); Фіг. 43 ілюструє досліджуваний клінічний випадок: 39-річний білий чоловік, застосування композиції 2,5 % іміквімоду (IMIQ) протягом 2 циклів, 2×2×2 тижнів для лікування актинічного кератозу; Фіг. 44 ілюструє досліджуваний клінічний випадок: 74-річний білий чоловік, застосування композиції 2,5 % іміквімоду (IMIQ) протягом 2 циклів, 2×2×2 тижнів для лікування актинічного кератозу; Фіг. 45 ілюструє досліджуваний клінічний випадок: 66-річна біла жінка, застосування композиції 3,75 % іміквімоду (IMIQ) протягом 2 циклів, 2×2×2 тижнів для лікування актинічного кератозу; Фіг. 46 ілюструє досліджуваний клінічний випадок: 73-річний білий чоловік, застосування композиції 3,75 % іміквімоду (IMIQ) протягом 2 циклів, 2×2×2 тижнів для лікування актинічного кератозу; Фіг. 47 ілюструє досліджуваний клінічний випадок: 70-річний білий чоловік, застосування композиції 2,5 % іміквімоду (IMIQ) протягом 2 циклів, 3×3×3 тижнів для лікування актинічного кератозу; Фіг. 48 ілюструє досліджуваний клінічний випадок: 65-річна біла жінка, застосування композиції 2,5 % іміквімоду (IMIQ) протягом 2 циклів, 3×3×3 тижнів для лікування актинічного кератозу; Фіг. 49 ілюструє досліджуваний клінічний випадок: 79-річний білий чоловік, застосування композиції 3,75 % іміквімоду (IMIQ) протягом 2 циклів, 3×3×3 тижнів для лікування актинічного кератозу; Фіг. 50 ілюструє досліджуваний клінічний випадок: 78-річний білий чоловік, застосування композиції 3,75 % іміквімоду (IMIQ) протягом 2 циклів, 3×3x3 тижнів для лікування актинічного кератозу; і Фіг. 51 містить підсумкові дані первинних і вторинних кінцевих точок ефективності, у яких (а) результати досліджень GW01-0702 і GW01-0704 (2 × 2x2) для кожної концентрації іміквімоду в композиції, тобто близько 2,5 % або близько 3,75 % мас/мас, які використовуються в дослідженнях об'єднані, відповідно, (b) результати досліджень GW01-0703 і GW01-0705 (3×3×3) для кожної концентрації іміквімоду в композиції, тобто близько 2,5 % або близько 3,75 % мас/мас, які використовуються в дослідженнях об'єднані, відповідно, і (с) аналіз здійснюється в рамках курсу лікування для групи ІТТ. Повне вилікування визначене як відсутність клінічно видимих або пальпованих уражень АК в області лікування. Часткове вилікування визначене як, принаймні, приблизно 75 % зниження кількості уражень АК в області лікування порівняно з вихідним рівнем. Значення Ρ отримані з тесту Кочрена-Мантела-Хензеля, стратифікованого за центрами аналізу, у рамках курсу, розглядаючи по 2 групи лікування одночасно. Значення Р, позначені **, є статистично значимими при використанні модифікованої Хох-бергом процедури Бонфероні. LOCF = Останнє спостереження, що переноситься вперед. Довірчі інтервали розраховуються з використанням точної біноміальної статистики. На Фіг. 51 "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" 24 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Див. також Фіг. 25А; Фіг. 52 містить підсумкові значення первинних і вторинних кінцевих точок ефективності для об'єднаних досліджень і аналізу за курсами лікування для групи ІТТ. Значення Ρ у стовпці (1) для всіх параметрів отримані з дисперсійного аналізу на основі загальної лінійної моделі (GLM), що включає вплив дози, режиму та центра аналізу в рамках режиму. Значення Ρ у стовпці (2) засновані на логістичному аналізі впливу дози, режиму та центра аналізу. На Фіг. 52 "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Фіг. 53 містить підсумкові значення Глобальної інтегрованої оцінки фотоушко-дження дослідниками (Investigators Global Integrated Photodamage-IGIP) для (а) досліджень GW01-0702 і GW01-0704, (b) досліджень GW01-0703 і GW01-0705 і (с) об'єднаних досліджень, тобто GW010702, GW01-0703, GW01-0704 і GW01-0705, двотижневого 2-циклового періоду лікування (2×2×2 тижні) і тритижневого 2-циклового періоду лікування (3×3×3 тижні) у групі пацієнтів, які мають намір пройти лікування ("ІТТ"). На Фіг. 53 "2,5 %" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28, а "3,75 %" - 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Фіг. 54 містить підсумкові дані фармакокінетичних параметрів сироватки в день 21 для 3,75 % композиції іміквімоду відповідно до Прикладів 23-28, група РК. Аналізованою речовиною в сироватці є іміквімод. Розрахунок показника накопичення (RAUC, RCmax) і ефективний період напіввиведення для накопичення (Т 1/2 і Т1/2 eff) обмежений пацієнтами, які приймають всі сім доз протягом тижня лікування і які приймають, принаймні, 80 % запропонованих доз протягом попередніх двох тижнів. РК параметри не розраховували для пацієнтів 001-619 і 001-608. Відсутні дані концентрації для пацієнта 001-619, а пацієнт 001-608 не прийняв всі необхідні дози протягом 21 дня лікування. AUC0-24 дорівнює AUCss, Cmin дорівнює концентрації перед введенням дози (t=0). На Фіг. 51, "Іміквімод" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28. Див. також Приклад 25; Фіг. 55 ілюструє калібровану масштабну шкалу при збільшенні х400, де нанесені ділення 10 мкм, 50 мкм і 100 мкм; Фіг. 56 - це схематичне зображення елемента Франца; Фіг. 57 містить зображення під мікроскопом восьми 2,5 % мас/мас композицій іміквімоду, тобто композиції 113, 246, 247, 248, 249, 251, 252 і 253 (композиції, вивчення яких продовжилося у вигляді програми стабільності, включені у вигляді 1 кг партій відповідно до Таблиці 18 і Фіг. 64); 2 Фіг. 58 ілюструє порівняння середньої сукупної кількості іміквімоду, вивільненого (мкг/см ) через 3 год. у дослідженнях вивільнення через мембрану (для всіх композицій, відібраних для досліджень проникнення на всю товщину шкіри та вивчення стабільності) (середнє ± стандартне відхилення, де n = 4); 2 Фіг. 59 ілюструє порівняння середньої сукупної вивільненої кількості (мкг/см ) через 3 год. для кожної концентрації іміквімоду в тестованих композиціях (середнє ± стандартне відхилення, де n = 4 для 1 %, n = 16 для 2,5 %, n = 20 для 3,75 % і n = 12 для 5 %); Фіг. 60 ілюструє загальну кількість іміквімоду, отриманого після балансування за масою для кожної композиції (див. також Таблиці 35-40, де наведений статистичний аналіз) (середнє ± стандартне відхилення, див. Таблицю 34, де наведені значення η для кожної вибірки); Фіг. 61 ілюструє загальну кількість іміквімоду, отриманого для кожної композиції в приймачі рідини, при об'єднанні епідермісу та дерми (середнє ± стандартне відхилення, див. Таблицю 34, де наведені значення n для кожної вибірки); Фіг. 62 ілюструє загальну кількість іміквімоду, отриманого для середніх значень концентрації іміквімоду з кожної шкірної матриці. Фіг. 63А-С містять зображення під мікроскопом 13 композицій іміквімоду, а саме: крем 3М Aldara® іміквімод, 1 кг партія, крем Graceway 3M Aldara® іміквімод, 1 кг партія та композиції 110, 123, 125, 126, 182, 183, 195, 197, 250, 256 і 257 (t=0, 1, 2, 3 і 6 місяців) - збільшення х400; Фіг. 64 містить зображення під мікроскопом композицій плацебо Pbo1-Pbo4 (t=0, 1, 2, 3 і 6 місяців) - збільшення х400; Фіг. 65А-В містять зображення під мікроскопом 10 композицій іміквімоду, а саме: композицій 116, 117, 254, 120, 235, 188, 189, 184, 255, 124 після 1 місяця тесту на стабільність (t=0 і 1 місяць) - збільшення х400; 2 Фіг. 66 ілюструє порівняння середньої кількості іміквімоду, що вивільняється (мкг/см ) протягом 3 годин у випадку використання крему ЗМ Aldara® іміквімод, 1 кг партія, крему ЗМ 25 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 Aldara® іміквімод, у пакетиках, крему Graceway ЗМ Aldara® іміквімод, 1 кг партія та композиції 257-1 % композиції іміквімоду (середнє ± стандартне відхилення, де n = 4); 2 Фіг. 67 ілюструє порівняння середньої кількості іміквімоду, що вивільняється (мкг/см ) за 3 години у випадку використання чотирьох 2,5 % композицій іміквімоду: 110, 123, 125 і 250 (середнє ± стандартне відхилення, де n = 4). 2 Фіг. 68 ілюструє порівняння середньої кількості іміквімоду, що вивільняється (мкг/см ) за 3 години у випадку використання п'яти 3,75 % композицій іміквімоду: 182, 183, 195, 197 і 256 (середнє ± стандартне відхилення, де n = 4); і 2 Фіг. 69 ілюструє порівняння середньої кількості іміквімоду, що вивільняється (мкг/см ) за 3 години у випадку використання наступних композицій іміквімоду: 2,5 % (▲), 3,75 % (●), крем ЗМ Aldara® іміквімод, партія ( ), крем Graceway Aldara® іміквімод, 1 кг партія (м) і композиція 257 ( ) (середнє ± стандартне відхилення, де n = 4). Докладний опис винаходу У порядку ілюстрації, для кращого розуміння цього винаходу та забезпечення інших додаткових переваг далі наведений докладний опис нових способів і композицій і їхні приклади. У цілому, даний винахід стосується фармацевтичної композиції, що містить іміквімод і фармацевтично прийнятний носій для іміквімоду, причому зазначений носій містить жирну кислоту. Хоча даний винахід може бути реалізований в різних формах, тут будуть розглянуті деякі конкретні варіанти втілення при розумінні того, що їхнє розкриття слід вважати лише ілюстрацією принципів винаходу, і вони не повинні обмежувати винахід рамками описаних або проілюстрованих варіантів здійснення. Використовуваний в описі та формулі винаходу термін "які мають значно меншу подразнюючу дію" стосується композицій, що не викликають неприйнятного подразнення шкіри у звичайних тестах на подразнення шкіри у кроликів-альбіносів, таких як описані в Draize et al., "Appraisal of the Safety of Chemicals in Food, Drugs and Cosmetics" ("Оцінка безпеки хімічних речовин у харчових продуктах, ліках і косметиці"), підготовленим Відділом фармакології Агентства з контролю за ліками та харчовими продуктами США ("FDA"), перша публікація в 1959 році Асоціацією фахівців з харчових продуктів і медикаментів США, Топека, Канзас (2-е видання в 1965 p.), що включений сюди шляхом посилання. Якщо не зазначено інше, всі числа, що виражають кількості, співвідношення та чисельні властивості інгредієнтів, умови реакції тощо, використовувані в описі та формулі винаходу, треба у всіх випадках розуміти як супроводжувані терміном "приблизно". Всі частини, відсотки, коефіцієнти тощо є тут масовими, якщо не зазначено інше. Використовувані тут терміни в однині є взаємозамінними та покликані включати також і множину та всі можливі значення, якщо прямо не зазначено інше. Крім того, використовуваний тут термін "принаймні один" означає "один або кілька" відносно зазначеного елемента. Використовувані тут терміни в однині є взаємозамінними та включають також і множину та всі можливі значення, якщо прямо не зазначено інше. Якщо не обговорено інше, написані із заголовної та малої літери терміни мають однакове відповідне значення. Використовуваний тут термін "біоеквівалентність або біологічно еквівалентні" стосується композицій з більш низьким вмістом речовини, що є фармацевтично еквівалентним, а їх біодоступність (швидкість і ступінь абсорбції) після введення однакової молярної дози або кількості подібна токаю мірою, що їхній терапевтичний ефект, безпека та ефективність є, по суті, однаковими. Інакше кажучи, "біоеквівалентність" або "біоеквівалентний" означає відсутність істотних розходжень у швидкості та ступені, в якому іміквімод стає доступним з таких композицій у місці дії іміквімоду, при введенні однакової молярної дози в подібних умовах, наприклад, швидкість, з якою іміквімод може залишати зазначену композицію, і швидкість, з якою іміквімод може пройти через роговий шар і/або стати доступним у місці дії для лікування актинічного кератозу. Інакше кажучи, існує високий ступінь подібності біодоступності у двох фармацевтичних препаратів іміквімоду (однакової галенової форми) з однаковою молярною дозою, які навряд чи приведуть до клінічно значимих розходжень у терапевтичних ефектах, несприятливих реакціях або і тому, і іншому. Терміни "біоеквівалентність", а також "фармацевтична еквівалентність" і "терапевтична еквівалентність" також використовуються тут відповідно до визначення та/або використання (a) FDA, (b) Зводу федеральних правил (Code of Federal Regulations - "C.F.R."), Заголовок 21, і/або (с) Міністерства охорони здоров'я Канади. Використовуваний тут термін "біодоступність або біодоступний" як правило стосується швидкості та міри поглинання іміквімоду в системний кровотік і, більш конкретно, показників або мір, покликаних відбити швидкість і ступінь, з якими іміквімод стає доступним у місці дії або поглинається з лікарського препарату та стає доступним у місці дії. Іншими словами і як приклад, ступінь і швидкість абсорбції іміквімоду з композиції з більш низьким його вмістом 26 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 відповідно до даного винаходу відображається кривою залежності між часом і концентрацією іміквімоду в системному кровотоці. Використовуваний тут термін "фармацевтична еквівалентність або фармацевтично еквівалентні" стосується композицій з більш низьким вмістом іміквімоду відповідно до цього винаходу, які містять однакову кількість іміквімоду, в однакових лікарських формах, але не обов'язково містять однакові неактивні інгредієнти, які призначені для того самого шляху введення та відповідають однаковому або порівнянному загальному або іншому застосовному стандартам ідентичності, сили, якості та чистоти, включаючи силу дії та, де це застосовно, однорідність і/або стабільність. Використовуваний тут термін "терапевтична еквівалентність або терапевтично еквівалентні" стосується композицій з більш низьким вмістом іміквімоду, які (а) забезпечують той самий клінічний ефект і профіль безпеки при використанні в нетривалому лікуванні актинічного кератозу відповідно до даного винаходу і (Ь) є фармацевтично еквівалентними, наприклад, містять іміквімод в однаковій лікарській формі, призначені для однакових шляхів введення та характеризуються однаковим вмістом іміквімоду. Інакше кажучи, терапевтична еквівалентність означає, що хімічно еквівалентна композиція з більш низьким вмістом іміквімоду відповідно до даного винаходу (наприклад, що містить таку ж кількість іміквімоду в тій самій лікарській формі) при введенні тим самим пацієнтам у тому ж режимі дозування буде мати по суті таку ж ефективність і токсичність. "Тmax" означає час досягнення максимальної концентрації іміквімоду в сироватці в стійкому стані після місцевого застосування композиції з більш низьким вмістом іміквімоду згідно з цим винаходом, тобто коли швидкість абсорбції іміквімоду дорівнює швидкості виведення іміквімоду. Іншими словами, це час, коли спостерігається Сmах іміквімоду. "Сmах" означає максимальну концентрацію іміквімоду в сироватці, яка досягається в стійкому стані після місцевого застосування композиції з більш низьким вмістом іміквімоду згідно з цим винаходом, тобто коли швидкість абсорбції іміквімоду дорівнює швидкості виведення іміквімоду. Інакше кажучи, це максимальна концентрація в сироватці; найбільша концентрація в сироватці, що спостерігається під час дозування іміквімоду або інтервалу вибірки. "Сmin" означає мінімальну вимірну концентрацію іміквімоду в сироватці, наприклад, концентрацію іміквімоду в сироватці, що спостерігається безпосередньо перед введенням дози в дні 7, 14, 21 і 22 (через 24 години після введення дози). "Т1/2" означає час, необхідний для виведення половини максимальної концентрації іміквімоду в сироватці після досягнення стійкого стану після місцевого застосування композиції з більш низьким вмістом іміквімоду згідно з цим винаходом. Наприклад, позірний період напіввиведення для іміквімоду розраховується як приблизно 0,693/λz відповідно до прикладу 24. "AUC0-24" означає площу під кривою концентрації іміквімоду в сироватці, що відповідає 24 годинам після місцевого застосування композиції з більш низьким вмістом іміквімоду згідно з цим винаходом, тобто міру впливу іміквімоду протягом 24 годин. Наприклад, площа під кривою залежності концентрації іміквімоду в сироватці від часу: від 0 до 24 годин, що розраховується з використанням лінійної формули трапецій або екстраполяції до 24 годин у випадках, коли не вдається одержати значення до необхідного моменту часу. "AUCo-t" означає площу під кривою залежності концентрації іміквімоду в сироватці від часу: від 0 до часу останньої ненульової концентрації в день 1, що розраховується з використанням лінійної формули трапецій. "RAUC" означає відношення накопичення; яке розраховується як значення AUC0-24 під час введення кількох доз іміквімоду, ділене на значення AUC0-24 після першої дози (тобто день 21/день 1); показники накопичення, які розраховуються для метаболіту іміквімоду тільки при наявності достатньої кількості ненульових часових точок для розумної оцінки AUC0-24. "AUC0-inf" означає площу під кривою залежності концентрації іміквімоду в сироватці від часу: від 0 до нескінченності; AUC0-inf. розраховується для дня 1 як AUC(0-inf) = AUC(0-t) + Ct/Kel (де Ct = підігнана остання ненульова концентрація, AUC0-t=AUC від нульового часу до часу останньої ненульової концентрації та Кеl = постійна швидкості виведення). "Rcmax" означає показник накопичення, який розраховується як значення С mах при введенні кількох доз, ділене на значення Сmах після першої дози (тобто день 21/день 1) "z EFF" означає постійну ефективної швидкості виведення, що розраховується як -ln(11/RAUC)/tau. "Т1/2 EFF" означає ефективний період напівжиття для накопичення, що розраховується ЯК 0,693/λz EFF. 27 UA 110459 C2 5 10 15 20 25 30 35 40 45 50 55 60 "λz" означає постійну швидкості виведення, тобто швидкість, при якій іміквімод зникає з місця вимірювання після досягнення стійкого стану після місцевого застосування композиції з більш низьким вмістом іміквімоду згідно з цим винаходом. Інакше кажучи, це очевидна постійна швидкості виведення, що розраховується з використанням лінійної регресії на кінцевій частині залежності In концентрації від часу. "Середнє геометричне" - це статистичне середнє множини трансформованих чисел, що часто використовується для подання центральної тенденції даних, які сильно змінюються. Воно розраховується на основі даних, перетворених з використанням ступенів або логарифмів, з наступним зворотним перетворенням до вихідного масштабу після усереднення. "Відношення середніх геометричних" - це відношення двох середніх геометричних значень, де чисельником є "критерій середнього геометричного методом найменших квадратів", а знаменником - "опорне значення середнього геометричного методом найменших квадратів". "RH" означає відносну вологість. "cPs" означає сантипуаз. "h" означає години. "ІТТ" означає групу пацієнтів, які збираються пройти лікування. "Pbo" означає плацебо. "EOS" означає закінчення дослідження. "V" означає носій. Дослідження GW01-0702 і GW01-0704 є дублюючими дослідженнями 2-тижневих циклів лікування, в яких 2-тижневі цикли лікування розділені двома тижнями відпочинку (без лікування) (2×2×2), а дослідження GW01-0703 і GW01-0705 є дублюючими дослідженнями 3-тижневих циклів лікування, в яких 3-тижневі цикли лікування розділені двома тижнями відпочинку (без лікування) (3×3×3). Див. схеми в Таблиці 64 нижче. "L2" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28 і Фіг., що використовується у зв'язку з дослідженнями GW01-0702 iGW01-0704. "L3" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28 і Фіг., що використовується у зв'язку з дослідженнями GW01-0702 iGW01-0704. "Н2" стосується 2,5 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28 і Фіг., що використовується у зв'язку з дослідженнями GW01-0703 і GW01-0705. "Н3" стосується 3,75 % композиції з більш низьким вмістом іміквімоду відповідно до Прикладів 23-28 і Фіг., що використовується у зв'язку з дослідженнями GW01-0703 і GW01-0705. "АЕ" означає несприятливі явища. Використовуваний тут термін "2×2×2" означає двотижневий 2-цикловий режим лікування АК, у якому (1) протягом перших 2 тижнів (перший цикл лікування) композицію з більш низьким вмістом іміквімоду наносять раз на добу щодня на область лікування АК, (2) протягом других 2 тижнів проходить період лікування, протягом якого лікування не проводять, і (3) протягом третіх 2 тижнів (другий цикл лікування) ту саму композицію наносять раз на добу щодня на ту саму область лікування АК. Інакше кажучи, протягом перших 2 тижнів проводять лікування, протягом других 2 тижнів лікування не проводять, а протягом третіх 2 тижнів знову проводять лікування. Використовуваний тут термін "3×3×3" означає тритижневий 2-цикловий режим лікування АК, у якому (1) протягом перших 3 тижнів (перший цикл лікування) композицію з більш низьким вмістом іміквімоду наносять раз на добу щодня на область лікування АК, (2) протягом других 3 тижнів проходить період лікування, протягом якого лікування не проводять, і (3) протягом третіх 3 тижнів (другий цикл лікування) ту ж композицію наносять раз на добу щодня на ту саму область лікування АК. Інакше кажучи, протягом перших 3 тижнів проводять лікування, протягом других 3 тижнів лікування не проводять, а протягом третіх 3 тижнів знову проводять лікування. Цей винахід пропонує фармацевтичні композиції, такі як креми, мазі, піни, гелі, лосьйони та клейкі покриття, які містять іміквімод і жирну кислоту, таку як ізостеарино-ва, лінолева, неочищена олеїнова кислота, очищена олеїнова кислота, така як олеїнова кислота Super Refined® NF (наприклад, олеїнова кислота високого ступеня очищення, тобто олеїнова кислота з низьким вмістом полярних домішок, таких як перекиси, низьким показником пероксидів, що продається CRODA; див., наприклад, www.crodausa.com), і їхні суміші. Композиції даного винаходу забезпечують бажану проникність шкіри для іміквімоду. Сполука іміквімод є відомим противірусним препаратом, який, як відомо, індукує біосинтез інтерферону. Він може бути отриманий методом, описаним у патенті США № 4,689,338, розкриття якого включено сюди у всій його повноті шляхом посилання. Ця сполука може використовуватись для лікування актинічного кератозу. Кількість іміквімоду, присутнього в композиції згідно з цим винаходом, є ефективною кількістю для лікування актинічного кератозу, щоб досягти повного усунення уражень АК або часткового зменшення уражень АК, щоб 28
ДивитисяДодаткова інформація
Назва патенту англійськоюLower dosage strength imiquimod formulations and short dosing regimens for treating actinic keratosis
Автори російськоюNordsiek, Michael, T., Levy, Sharon, F., Lee, James, H., Kulp, James H., Balaji, Kodumudi, S., Meng, Tze-Chiang, Wu, Jason, J., Bahm, Valyn, S., Babilon, Robert
МПК / Мітки
МПК: A61K 31/437, A61K 31/4353, A61P 35/00, A61P 17/12, A61K 31/4745
Мітки: іміквімодного, композиція, кератозу, лікування, препарату, актинічного, спосіб
Код посилання
<a href="https://ua.patents.su/237-110459-kompoziciya-imikvimodnogo-preparatu-i-sposib-likuvannya-aktinichnogo-keratozu.html" target="_blank" rel="follow" title="База патентів України">Композиція іміквімодного препарату і спосіб лікування актинічного кератозу</a>