Стабілізована фармацевтична композиція фезотеродину
Номер патенту: 94107
Опубліковано: 11.04.2011
Автори: Міка Ганс-Юрген, Лінднер Ганс, Паулюс Керштін, Бікане Фатіма, Коменда Міхаель, Ірнґартінґер Майке, Арт Кріштоф
Формула / Реферат
1. Фармацевтична композиція, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор, де названий стабілізатор вибрано з наступного: ксиліт, сорбіт, полідекстроза, ізомалт, декстроза та їх комбінації.
2. Фармацевтична композиція за п. 1, де названий стабілізатор - ксиліт, сорбіт або полідекстроза.
3. Фармацевтична композиція за п. 1, де названий стабілізатор - ксиліт.
4. Фармацевтична композиція за будь-яким з попередніх пунктів, де співвідношення фезотеродин:стабілізатор дорівнює 1-20 мас. %.
5. Фармацевтична композиція за будь-яким із попередніх пунктів, котра містить сіль фезотеродину, котра має рН у воді 3-5.
6. Фармацевтична композиція за п. 5, де сіль фезотеродину - сіль ди- або трикарбонової кислоти або частково гідрогенізованої ди- або трикарбонової кислоти.
7. Фармацевтична композиція за будь-яким із попередніх пунктів, котра містить фезотеродину гідрогенфумарат.
8. Фармацевтична композиція за п. 7, котра є у формі одиничного дозування та в якій фезотеродину гідрогенфумарат є присутнім у кількості 0,5-12 мг на одиницю дозування.
9. Фармацевтична композиція за будь-яким із попередніх пунктів, котру отримано способом, що залучає, принаймні, один етап грануляції.
10. Фармацевтична композиція за п. 9, де грануляцією є волога грануляція.
11. Фармацевтична композиція за п. 10, де грануляцію виконують в присутності води.
12. Фармацевтична композиція за будь-яким із попередніх пунктів, де фармацевтична композиція далі містить засіб подовженого вивільнення.
13. Фармацевтична композиція за п. 12, де засобом подовженого вивільнення є етер або естер целюлози або їх суміш.
14. Фармацевтична композиція за п. 13, де засобом подовженого вивільнення є гідроксипропілметилцелюлоза.
15. Фармацевтична композиція за будь-яким із пп. 12-14, де засіб подовженого вивільнення міститься приблизно у кількості 20-80 мас. %, переважно приблизно 25-65 %, краще 30-65 %, а ще краще приблизно 35-55 мас. %, на основі повної композиції.
16. Фармацевтична композиція за будь-яким із пп. 12-15, котра показує кумулятивне вивільнення фезотеродину у мас. %, базоване на теоретичній кількості фезотеродину у композиції, в аналізі розчинення in vitro згідно з USP 711 у фосфатному буфері, рН 6,8, 37 °С, при 75 об./хв. наступним чином:
- через 1 годину вивільнення фезотеродину дорівнює приблизно 5 % - 30 %, переважно приблизно 6 % - 26 %,
- через 2 години вивільнення фезотеродину дорівнює приблизно 15 % - 40 %, переважно приблизно 18 % - 38 %,
- через 4 години вивільнення фезотеродину дорівнює приблизно 35 % - 65 %, переважно приблизно 36 % - 56 % та
- принаймні, через 16 годин вивільнення фезотеродину дорівнює приблизно 75 %, переважно принаймні приблизно 80 %.
17. Фармацевтична композиція, що містить:
(a) 0,3-5,0 мас. % фезотеродину гідрогенфумарату;
(b) 5-25 мас. % сорбіту або ксиліту;
(c) 20-40 мас. % суміші, що містить 45-80 мас. % моногідрату лактози та 55-20 мас. % мікрокристалічної целюлози;
(d) 20-65 % гідроксипропілметилцелюлози;
(e) 1-5 мас. % гліцерину дибегенату; та
(f) 1-5 мас. % тальку.
18. Фармацевтична композиція за п. 17, що містить:
(а) приблизно 4,0 мг фезотеродину гідрогенфумарату;
(b) приблизно 32-40 мг ксиліту з середнім розміром частинок приблизно 0,001-0,30 мм;
(с) приблизно 115-130 мг MICROCELAC® 100;
(d) приблизно 65-75 мг ГПМЦ, що має при розчиненні у воді приблизно 2 мас.% номінальну в'язкість приблизно 100000 мПа;
(e) приблизно 65-75 мг ГПМЦ, що має номінальну в'язкість при розчиненні у воді приблизно 2 мас. % приблизно 4000 мПа;
(f) приблизно 8-12 мг гліцерину дибегенату;
(g) приблизно 7-10 мг тальку та, необов'язково,
(h) покриття.
19. Фармацевтична композиція за п. 17, що містить:
(а) приблизно, 8,0 мг фезотеродину гідрогенфумарату;
(b) приблизно, 65-80 мг ксиліту з середнім розміром частинок, приблизно 0,001 - 0,30 мм;
(c) приблизно 70-85 мг MICROCELAC® 100;
(d) приблизно 110-130 мг ГПМЦ, що має номінальну в'язкість при розчиненні у воді приблизно 2 мас. % приблизно 100000 мПа;
(е) приблизно, 20-30 мг ГПМЦ, що має номінальну в'язкість при розчиненні воді приблизно 2 мас .% приблизно 4000 кПа;
d) приблизно 8-12 мг гліцерину дибегенату;
(g) приблизно 7-10 мг тальку та, необов'язково,
(h) покриття.
20. Спосіб лікування пацієнта, що потерпає від надактивного сечового міхура, призначенням терапевтично ефективної кількості фармацевтичної композиції за будь-яким із попередніх пунктів.
21. Спосіб за п. 20, де пацієнт має симптоми, вибрані із групи, що складається з енурезу, нетримання сечового позиву, настійного сечового позиву та/або підвищеної частоти сечовиділення.
22. Застосування субстанції, вибраної із ксиліту, сорбіту, полідекстрози, ізомалту та декстрози, для стабілізації фармацевтичної композиції, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват.
23. Спосіб отримання фармацевтичної композиції за будь-яким пп. 1-19, що полягає у змішуванні фезотеродину або його фармацевтично прийнятної солі, або сольвату зі стабілізатором, вибраним з групи, що складається з ксиліту, сорбіту, полідекстрози, ізомалту, декстрози та їх комбінаціями.
24. Спосіб за п. 23, котрий далі має етап грануляції.
25. Спосіб за п. 24, де грануляцією є волога грануляція.
26. Спосіб за будь-яким з пп. 23-25, що має етапи:
- гранулювання фезотеродину або його фармацевтично прийнятної солі, або сольвату зі стабілізатором, вибраним із групи, що складається із ксиліту, сорбіту, полідекстрози, ізомалту, декстрози та їх комбінації в присутності води,
- висушування грануляту,
- змішування сухих гранулятів з, принаймні, одним іншим наповнювачем, що дає суміш для пресування,
- пресування суміші для пресування до бажаної форми та, необов'язково,
- нанесення покриття.
27. Фармацевтична композиція, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор, де названий стабілізатор ототожнюють із фармакологічно прийнятними наповнювачами групи високомолекулярних спиртів, цукрів та цукрових спиртів способом, що має наступні етапи:
отримання подвійного грануляту з 1 масової частки фезотеродину та 9 масових часток поліолу, цукру або цукрового спирту;
зберігання названого грануляту при наступних трьох умовах;
а) 25 °С та 60 % відносна вологість у закритих посудинах протягом 6 тижнів;
b) 40 °С та 75 % відносна вологість у закритих посудинах протягом 6 тижнів;
с) 40 °С та 75 % відносна вологість у відкритих посудинах протягом 6 тижнів визначення вмісту активного метаболіту формули (II) способом ВЕРХ площа-%
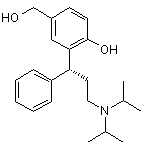 , (II)
, (II)
та вибір із названих високомолекулярних спиртів, цукрів або цукрових спиртів стабілізатора, котрий лімітує утворення активного метаболіту формули (II) протягом збереження, принаймні, при двох із вищеназваних умов:
і) приблизно 1 мас. % або менше при умовах збереження а),
іі) приблизно 2 мас. % або менше за умови збереження b),
ііі) приблизно 2 мас. % або менше за умови збереження с).
28. Фармацевтична композиція за п. 27, що містить сіль фезотеродину, котра має значення рН у воді 3-5.
29. Фармацевтична композиція за п. 27, що містить сіль фезотеродину ди- або трикарбонової кислоти або частково гідрогенізованої ди- або трикарбонової кислоти.
30. Фармацевтична композиція за п. 27, що містить фезотеродину гідрогенфумарат.
Текст
1. Фармацевтична композиція, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор, де названий стабілізатор вибрано з наступного: ксиліт, сорбіт, полідекстроза, ізомалт, декстроза та їх комбінації. 2. Фармацевтична композиція за п. 1, де названий стабілізатор - ксиліт, сорбіт або полідекстроза. 3. Фармацевтична композиція за п. 1, де названий стабілізатор - ксиліт. 4. Фармацевтична композиція за будь-яким з попередніх пунктів, де співвідношення фезотеродин:стабілізатор дорівнює 1-20 мас. %. 5. Фармацевтична композиція за будь-яким із попередніх пунктів, котра містить сіль фезотеродину, котра має рН у воді 3-5. 6. Фармацевтична композиція за п. 5, де сіль фезотеродину - сіль ди- або трикарбонової кислоти або частково гідрогенізованої ди- або трикарбонової кислоти. 7. Фармацевтична композиція за будь-яким із попередніх пунктів, котра містить фезотеродину гідрогенфумарат. 2 (19) 1 3 (a) 0,3-5,0 мас. % фезотеродину гідрогенфумарату; (b) 5-25 мас. % сорбіту або ксиліту; (c) 20-40 мас. % суміші, що містить 45-80 мас. % моногідрату лактози та 55-20 мас. % мікрокристалічної целюлози; (d) 20-65 % гідроксипропілметилцелюлози; (e) 1-5 мас. % гліцерину дибегенату; та (f) 1-5 мас. % тальку. 18. Фармацевтична композиція за п. 17, що містить: (а) приблизно 4,0 мг фезотеродину гідрогенфумарату; (b) приблизно 32-40 мг ксиліту з середнім розміром частинок приблизно 0,001-0,30 мм; (с) приблизно 115-130 мг MICROCELAC® 100; (d) приблизно 65-75 мг ГПМЦ, що має при розчиненні у воді приблизно 2 мас.% номінальну в'язкість приблизно 100000 мПа; (e) приблизно 65-75 мг ГПМЦ, що має номінальну в'язкість при розчиненні у воді приблизно 2 мас. % приблизно 4000 мПа; (f) приблизно 8-12 мг гліцерину дибегенату; (g) приблизно 7-10 мг тальку та, необов'язково, (h) покриття. 19. Фармацевтична композиція за п. 17, що містить: (а) приблизно, 8,0 мг фезотеродину гідрогенфумарату; (b) приблизно, 65-80 мг ксиліту з середнім розміром частинок, приблизно 0,001 - 0,30 мм; (c) приблизно 70-85 мг MICROCELAC® 100; (d) приблизно 110-130 мг ГПМЦ, що має номінальну в'язкість при розчиненні у воді приблизно 2 мас. % приблизно 100000 мПа; (е) приблизно 20-30 мг ГПМЦ, що має номінальну в'язкість при розчиненні у воді приблизно 2 мас .% приблизно 4000 кПа; d) приблизно 8-12 мг гліцерину дибегенату; (g) приблизно 7-10 мг тальку та, необов'язково, (h) покриття. 20. Спосіб лікування пацієнта, що потерпає від надактивного сечового міхура, призначенням терапевтично ефективної кількості фармацевтичної композиції за будь-яким із попередніх пунктів. 21. Спосіб за п. 20, де пацієнт має симптоми, вибрані із групи, що складається з енурезу, нетримання сечового позиву, настійного сечового позиву та/або підвищеної частоти сечовиділення. 22. Застосування субстанції, вибраної із ксиліту, сорбіту, полідекстрози, ізомалту та декстрози, для стабілізації фармацевтичної композиції, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват. 23. Спосіб отримання фармацевтичної композиції за будь-яким пп. 1-19, що полягає у змішуванні фезотеродину або його фармацевтично прийнятної солі, або сольвату зі стабілізатором, вибраним з групи, що складається з ксиліту, сорбіту, полідекстрози, ізомалту, декстрози та їх комбінаціями. 24. Спосіб за п. 23, котрий далі має етап грануляції. 25. Спосіб за п. 24, де грануляцією є волога грануляція. 26. Спосіб за будь-яким з пп. 23-25, що має етапи: 94107 4 - гранулювання фезотеродину або його фармацевтично прийнятної солі, або сольвату зі стабілізатором, вибраним із групи, що складається із ксиліту, сорбіту, полідекстрози, ізомалту, декстрози та їх комбінації в присутності води, - висушування грануляту, - змішування сухих гранулятів з, принаймні, одним іншим наповнювачем, що дає суміш для пресування, - пресування суміші для пресування до бажаної форми та, необов'язково, - нанесення покриття. 27. Фармацевтична композиція, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор, де названий стабілізатор ототожнюють із фармакологічно прийнятними наповнювачами групи високомолекулярних спиртів, цукрів та цукрових спиртів способом, що має наступні етапи: отримання подвійного грануляту з 1 масової частки фезотеродину та 9 масових часток поліолу, цукру або цукрового спирту; зберігання названого грануляту при наступних трьох умовах; а) 25 °С та 60 % відносна вологість у закритих посудинах протягом 6 тижнів; b) 40 °С та 75 % відносна вологість у закритих посудинах протягом 6 тижнів; с) 40 °С та 75 % відносна вологість у відкритих посудинах протягом 6 тижнів визначення вмісту активного метаболітуформули (II) способом ВЕРХ площа-% HO OH N , (II) та вибір із названих високомолекулярних спиртів, цукрів або цукрових спиртів стабілізатора, котрий лімітує утворення активного метаболіту формули (II) протягом збереження, принаймні, при двох із вищеназваних умов: і) приблизно 1 мас. % або менше при умовах збереження а), іі) приблизно 2 мас. % або менше за умови збереження b), ііі) приблизно 2 мас. % або менше за умови збереження с). 28. Фармацевтична композиція за п. 27, що містить сіль фезотеродину, котра має значення рН у воді 3-5. 29. Фармацевтична композиція за п. 27, що містить сіль фезотеродину ди- або трикарбонової кислоти або частково гідрогенізованої ди- або трикарбонової кислоти. 30. Фармацевтична композиція за п. 27, що містить фезотеродину гідрогенфумарат. 5 Заявлений винахід, взагалі, стосується фармацевтичної композиції, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват, та способу її отримання. Фезотеродин − міжнародна невласна назва (INN) сполуки формули (I), котру можна описати як хімічну сполуку 2-[(2R)-3-(діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)феніл ізобутират. Фезотеродин − нові ліки для лікування надактивного сечового міхура, енурезу та інших дисфункцій сечового тракту. Його розкрито, між іншим, у EP 1077912 Bl, стосовно нових похідних 3,3дифенілпропіламінів. У EP 1230209 Bl розкрито стабільні солі названих нових похідних 3,3дифенілпропіламінів, охоплюючи фезотеродин гідрогенфумарат. Надактивний сечовий міхур (OAB) − дуже розповсюджений розлад, що вражає 17% дорослого населення головних європейських країн. OAB може траплятися в будь-якому віці та в будь-якої статі, хоча більш поширений в осіб похилого віку та жіночого населення. OAB − розлад функції сечового міхура, отриманий у симптомах настійності з або без нетримання прагнення, та звичайно охоплює підвищену частоту сечовиділення та ніктурію. Розлад обумовлено спастичним скороченням стискувального м'язу сечового міхура, отриманого при тривалому сильному тиску сечового міхура та невідкладної потреби мочитися. Це може спричинятися кількома причинами, як-то травматичним або токсичним ураженням нерву (наприклад, черевною травмою, травмою тазу або хірургічним втручанням, камінням у сечовому міхуру, шкідливими діями ліків, неврологічними хворобами (наприклад, ураженнями спинного мозку, розсіяним склерозом, хворобою Паркінсона, надмірним вивільненням нейромедіаторів у сечовий міхур) або міогенною лабільністю (наприклад, гіпертрофією сечового міхура, спричиненою дисхезією або інфікуванням сечового тракту). Інколи при OAB можна надавати допомогу без медикаментозного лікування, застосовуючи песарії, імплантати, зворотній біологічний зв’язок або психологічне лікування. Але в найбільшій кількості випадків медикаментозна терапія є кращим варіантом. Знайдено, що антимускаринові холіноблокатори є особливо ефективними для лікування OAB. Протягом нормального сечовипускання ацетилхолін, виділений із постгангліонарних парасимпатичних нейронів, діє на мускаринові рецептори детрусорних гладеньких м’язів у сечовому міхурі для 94107 6 стимулювання скорочення м’язів. Антимускаринові блокатори заважають цій дії, таким чином, зменшуючи детрусорні скорочення. Однак, незважаючи на наявність різних антимускаринових ліків, лікарі та пацієнти залишаються невдоволеними наявним лікуванням, що обумовлено шкідливими наслідками та/або недостатньою ефективністю. Отже, існує потреба в нових засобах із поліпшеною безпечністю та дієвістю для більше ефективного лікування OAB. Фезотеродин є відомим у рівні техніки як ефективний у лікуванні енурезу. Однак, фезотеродин може виявляти суттєву деградацію при напружених умовах, наприклад, у вологому середовищі та при підвищеній температурі. Вважається, що гідролізування та окиснення є серед головних механізмів, отриманих при деградації. Отже, було б бажаним розробляти нові фармацевтичні композиції, що містять фезотеродин, який є більш стабільним стосовно деградації тривалий період часу навіть при напружених умовах. Із цією метою тепер несподівано знайдено, що деякі фармацевтичні наповнювачі є здатними значно сповільнювати деградацію фезотеродину при напружених умовах. Згідно із заявленим винаходом запропоновано фармацевтичну композицію, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор. Придатні стабілізатори можна вибирати із групи, що складається з наступного: ксиліт, сорбіт, полідекстроза, ізомалт, декстроза та їх комбінації. Найкращий − ксиліт. Ще одним кращим стабілізатором є сорбіт. Ще одним кращим стабілізатором є полідекстроза. Фармацевтична композиція заявленого винаходу є придатною, переважно, для перорального застосування. Придатними та переважними пероральними формами дозування фармацевтичних композицій згідно із заявленим винаходом є таблетки, грануляти та покриті таблетки. Капсули, коржі та інші тверді пероральні форми застосування також охоплено в межах заявленого винаходу. Також розкрито фармацевтичну композицію, як визначено вище, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват, фармацевтично прийнятний стабілізатор, як визначено вище, та, принаймні, один подальший наповнювач, переважно, принаймні, один тип гідроксипропілметилцелюлози. Згідно із ще одним підходом винахід стосується фармацевтичної композиції для перорального застосування фезотеродину або його фармацевтично прийнятої солі, або сольвату, яку можна отримувати гранулюванням фезотеродину із придатним наповнювачем, переважно, з фармацевтично прийнятним стабілізатором, який вибрано з наступного: ксиліт, сорбіт, полідекстроза, ізомалт та декстроза, та найкраще − ксиліт. Тоді гранулят можна змішувати, принаймні, з одним подальшим наповнювачем, переважно, принаймні, одним типом гідроксипропілметилцелюлози, та нео 7 бов’язково з іншими наповнювачами. У ще одному підході розкрито фармацевтичну композицію, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват, де фармацевтична композиція може бути твердою та може бути придатною для перорального застосування. Фезотеродин або його сіль можна вводити в гелеву матрицю, утворену, принаймні, одним типом здатного до набухання у воді засобу подовженого вивільнення, як-то естер або етер целюлози, та, переважно, утворений, принаймні, одним типом гідроксипропілметилцелюлози (гіпромелози), та, необов’язково, подальшими наповнювачами. Краще, якщо фезотеродин та стабілізатор можна вводити в гелеву матрицю, утворену, принаймні, одним типом гідроксипропілметилцелюлози (гіпромелози) та, необов’язково, подальшими наповнювачами. У деяких утіленнях сіль фезотеродину може бути сіллю багатоосновної кислоти, переважно, у воді з авто-рН, приблизно, у діапазоні 3 − 5 (виміряли у воді при 25°C при концентрації 1 мас.%). Приклади можна вибирати із групи багатоосновних мінеральних кислот, як-то, наприклад, сульфатна кислота та фосфатна кислота, або багатоосновних органічних кислот. Переважними прикладами є солі ди- або трикарбрнових кислот, як-то фезотеродин малєат, фезотеродин оксалат, фезотеродин цитрат, фезотеродин фталат, фезотеродин фумарат, фезотеродин сукцинат, фезотеродин тартрат, фезотеродин малонат, фезотеродин малат т.д. У конкретних утіленнях сіллю фезотеродину може бути частково гідрогенізована сіль ди- або трикарбонової кислоти, конкретно, сіль з авто-рН 3 − 5, конкретно, 3 − 4, краще 3,2 5 − 3,75, як-то гідрогенфумарат або гідромалєат. Конкретною переважною сіллю є фезотеродин гідрогенфумарат. У ще одному підході розкрито фармацевтичну композицію, як описано вище, що містить фезотеродин фумарат як фармацевтично прийнятну сіль, та, переважно, фезотеродин гідрогенфумарат. У ще одному підході розкрито фармацевтичну композицію, як описано вище, що містить фезотеродин гідрогенфумарат як фармацевтично прийнятну сіль, приблизно, у кількості 0,5 − 28 або 0,5 − 20 мг, переважно, приблизно, 1 − 16 мг, краще, приблизно, 1 − 12 мг, навіть краще, приблизно, 1 − 8 мг, та конкретно переважно, приблизно, 2, 4 або 8 мг на одиницю дозування (базовано на умісті фезотеродину або його солі, наприклад, фезотеродин гідрогенфумарату). Також розкрито спосіб лікування пацієнтів, що потерпають від надактивного сечового міхура та мають симптоми, як-то енурез, конкретно, нетримання сечового позиву, настійний сечовий позив та/або підвищену частоту сечовиділення, застосуванням терапевтично ефективної кількості будьяких описаних тут композицій. Зокрема, розкрито спосіб лікування пацієнтів, що потерпають від надактивного сечового міхура, які можуть мати симптоми, як-то енурез, нетримання сечового позиву, нетримання сечі та/або частоту сечовипускання, застосуванням описаної тут форми одиничного дозування композицій фезотеродину. Форма одиничного дозування може містити, приблизно, 0,5 − 94107 8 2 8 або 0,5 − 2 0 мг фезотеродину, переважно, приблизно, 1 − 16 мг, краще, приблизно, 1 − 12 мг, навіть краще, приблизно, 1 − 8 мг, та конкретно, переважно, приблизно, 2, 4 або 8 мг на одиницю дозування (базовано на умісті фезотеродину або його солі, наприклад, фезотеродин гідрогенфумарату). Форму одиничного дозування можна призначати пацієнту один раз на добу або в деяких випадках, більше одного разу на добу, якщо це може бути придатним. Крім того, ця заявка розкриває спосіб виготовлення фармацевтичної композиції, як описано вище, що полягає в продукуванні суміші фезотеродину або його фармацевтично прийнятної солі та фармацевтично прийнятного стабілізатору, як визначено вище. Тоді ці складові можна змішувати, принаймні, з одним типом гідроксипропілметилцелюлози та необов’язково з іншими наповнювачами. Необов’язково отримані композиції можна пресувати в таблетки та покривати. Один переважний спосіб виготовлення фармацевтичної композиції, що містить фезотеродин, полягає в гранулюванні композиції, що містить фезотеродин або його фармацевтично прийнятну сіль та фармацевтично прийнятний стабілізатор, як визначено вище, і тоді в змішуванні утвореного таким чином грануляту, принаймні, з одним типом гідроксипропілметилцелюлози та необов’язково з іншими наповнювачами. Тоді отриману композицію можна пресувати в таблетки та покривати. Спосіб грануляції можна здійснювати як суху процедуру грануляції без додавання рідини або, переважно, у присутності рідини, як-то вода ("волога грануляція"). При вологій грануляції, наприклад, фезотеродин або його фармацевтично прийнятну сіль та стабілізатор, як визначено вище, можна змішувати в присутності води. Тоді гранулят можна сушити. Цей висушений гранулят тоді можна змішувати, принаймні, з одним подальшим наповнювачем, переважно, принаймні, з одним типом гідроксипропілметилцелюлози та необов’язково з іншими наповнювачами. Несподівано було знайдено, що вологу грануляцію можна завершувати без зростання деградації фезотеродину, обумовленої гідролізуванням естерового зв’язку. Тому ще більш несподіваним було те, що фезотеродин є більш стабільним у композиції, яку отримано в присутності води, наприклад, вологою грануляцією, ніж у композиції, яку отримано сухою грануляцією (дивись, наприклад, таблицю 9), або сухим змішуванням та пресуванням наповнювачів (дивись таблицю 8). У ще одному та більш загальному підході заявлений винахід стосується фармацевтичної композиції, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор, де стабілізатор ідентифікують способом, що складається з наступних етапів: отримання подвійного грануляту з 1 частини маси фезотеродину та 9 частин стабілізатору; зберігання названого грануляту при наступних трьох умовах: a) 25°C та 60% відносна вологість у закритих посудинах протягом 6 тижнів 9 b) 40°C та 75% відносна вологість у закритих посудинах протягом 6 тижнів c) 40°C та 75% відносна вологість у відкритих посудинах протягом 6 тижнів визначення вмісту активного метаболіту формули (II) через ВЕРХ способом площа-% вибір стабілізатору з тих, що лімітують утворення активного метаболіту формули (II) протягом збереження, принаймні, при двох із вищеназваних умов: i) приблизно, 1 мас.% або менше за умови збереження a) ii) приблизно, 2 мас.% або менш за умови збереження b) iii) приблизно, 2 мас.% або менш за умови збереження c) Такий стабілізатор переважно вибрано з наступного: високомолекулярні спирти, цукри або цукрові спирти. Найкращим таким стабілізатором є ксиліт, сорбіт, полідекстроза, ізомалт, декстроза або їх комбінації та, навіть краще − ксиліт, сорбіт або полідекстроза. Композиція, що містить стабілізатор, переважно, містить сіль фезотеродину, котра має авто-рН у воді 3 − 5. Авто-pH є величиною pH, котру можна визначати після розчинення 1 мас.% солі фезотеродину у воді при 25°C. Короткий опис фігур На фіг. 1 показано профілі розчинення in vitro фармацевтичних композицій, що містять фезотеродин, базовані на таблетці 4 мг На фіг. 2 показано профілі розчинення in vitro фармацевтичних композицій, що містять фезотеродин, базовані на таблетці 8 мг. Детальний опис У найбільш загальному підході цієї заявки, запропоновано фармацевтичну композицію, що містить фезотеродин або його фармацевтично прийнятну сіль та фармацевтично прийнятний стабілізатор. Фезотеродин Якщо не вказано інше, термін "фезотеродин", як тут застосовано, охоплює фармацевтично прийнятні сольвати 2-[(2R)-3-(діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенілізобутирату (формула I), конкретно, гідрати фезотеродину. "Фезотеродин" також охоплює фармацевтично прийнятні солі 2-[(2R)-3-(діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенілізобутирату (формула I), конкретно, сіль гідрогенфумарат, а також вільну основу. Указані у всій цій заявці кількості стосуються фезотеродину в тій формі, котру застосовано, тобто, у формі вільної основи або солі. Фезотеродин − естер, котрий є чутливим до гідролізування після застосування in vivo, а також протягом збереження при напружених умовах, що 94107 10 дає головний продукт (2-[(2R)-3-(діізопропіламіно)1-фенілпропіл]-4-(гідроксиметил)фенол) (формула II), котрий вказаний тут як "активний метаболіт" та відповідає наступній структурі: У всій цій заявці термін "продукт гідролізування" стосується активного метаболіту формули II. Інші продукти деградації також можуть бути результатом метаболізму та/або деградації фезотеродину, як тут застосовано, "загальні продукти деградації" повинні охоплювати, принаймні, частково, продукт гідролізування. Уміст недеградованого фезотеродину, а також відносні кількості продукту гідролізування та надані загальні продукти деградації можна визначати способом площа-% ВЕРХ. У цьому способі площа% співвідношення недеградованого фезотеродину визначали співставленням площі відповідного піку ВЕРХ із повною площею всіх сигналів профілю ВЕРХ, що можуть бути спорідненими з фезотеродином та продуктами його гідролізування та/або деградації. Стабілізатор "Фармацевтично прийнятний" стабілізатор − це стабілізатор, котрий не є біологічно або стосовно деякого іншого способу небажаним, тобто, стабілізатор можна призначати індивідууму без спричинення значних небажаних біологічних дій або взаємодії шкідливим способом з будь-яким складовим композиції, у котрій вони містяться. Застосований тут термін "стабілізатор" означає субстанцію, конкретно, фармацевтично прийнятний наповнювач, котрий інгібує, попереджує, уповільнює або зменшує деградацію фезотеродину в порівнянні з фезотеродином при відсутності субстанції в певних умовах, як тут застосовано, термін "стабілізатор" згідно з винаходом також охоплює композицію двох або більше стабілізаторів. Наприклад, можна згадати композицію ксиліту та сорбіту або композицію ксиліту, сорбіту та полідекстрози, або композицію ксиліту та полідекстрози. Якщо згідно із заявленим винаходом деякий наповнювач є придатним як стабілізатор, то його, наприклад, можна визначати наступним способом: Спочатку отримували гранулят: - Роздільно зважували 1 еквівалент по масі фезотеродину або його солі, переважно, фезотеродин гідрогенфумарату, та 9 еквівалентів по масі наповнювачу. Якщо наповнювач агломеровано, його пропускали через сито (1,5 мм). - Фезотеродин та наповнювач пропускали через сито (0,8 мм). - Фезотеродин та наповнювач переносили в придатний гранулятор (наприклад, змішувальний гранулятор високої інтенсивності, як-то виробле 11 ний Lodige, тип Diosna Pi/6), при температурі приблизно, нижче 3 5°C, та змішували протягом 1 хвилини. - При перемішуванні до сухої суміші додавали, приблизно, 5,5 мас.% очищеної води. - Суміш перемішували подрібнювачем, приблизно, протягом 9 0 − 120 секунд. - Міксер спорожнювали, умісти переносили до ситового пристрою для утворення вологого грануляту, котрий тоді пропускали через сито або грохот (4,0 мм). - Просіяний гранулят сушили на лотках, приблизно, при 45°C протягом мінімум 8 год. у сушильній шафі/термостаті до вмісту води, приблизно, не більше 0,5%. - Сухий гранулят пропускали через сито (0,5 − 1,0 мм). - Тоді сухий гранулят перемішували (при швидкості, приблизно, 8 оберт./хвил.) протягом 5 хвилин. - Одну частину грануляту аналізували для визначення вихідної кількості продукту гідролізування та деградації, ще одну частину зберігали у відкритих посудинах, як описано вище, та потім аналізували для визначення кінцевої кількості продукту гідролізування та деградації. Партії цього грануляту тоді зберігали згідно із трьома наступними умовами: a) 25°C та 60% відносна вологість у закритих посудинах протягом 6 тижнів b) 40°C та 75% відносна вологість у закритих посудинах протягом 6 тижнів c) 40°C та 75% відносна вологість у відкритих посудинах протягом 6 тижнів Уміст активного метаболіту формули (II) визначали способом площа-% ВЕРХ. У цьому способі площа-% кількість активного метаболіту визначали співставленням площі відповідного піку ВЕРХ із повною площею всіх сигналів профілю ВЕРХ, які можуть бути спорідненими до фезотеродину та його продуктів гідролізування та/або деградації. Згідно з винаходом субстанція є стабілізатором, якщо він лімітує утворення активного метаболіту формули (II) протягом збереження, принаймні, при двох із вищезгаданих наступних умов a), b) та c): a) приблизно, 1 мас.% або менше, переважно, 0,5 мас.% або менше, та конкретно, переважно, 0,3 6 мас.% або менше b) приблизно, 2 мас.% або менше, переважно, 1 мас.% або менше, та конкретно, переважно, 0,5 мас.% або менше c) приблизно, 2 мас.% або менше, переважно, 1,5 мас.% або менше, та конкретно, переважно, 0,58 мас.% або менше Стабілізатори згідно із заявленим винаходом можна вибирати, наприклад, з деяких цукрів, цукрових спиртів, високомолекулярних спиртів або їх похідних, що задовольняють вищезгаданим критеріям. Конкретно, переважні стабілізатори вибрано з наступного: ксиліт, сорбіт, полідекстроза, ізомалт та декстроза. Ксиліт є одним переважним стабілізатором. Ці субстанції є здатними до інгібування, попередження, сповільнення або зниження гідролізування фезотеродину до активного метаболіту 94107 12 формули (II) та, таким чином, діють як стабілізатори. Таким чином, винахід стосується фармацевтичних композицій, що містять фезотеродин та стабілізатор, вибраний із ксиліту, сорбіту, полідекстрози, ізомалту та декстрози, та найкраще - із ксиліту, де фезотеродин захищено стосовно гідролізування при різних напружених умовах (дивись, наприклад, таблицю 6 та таблицю 7). Також переважними як стабілізатори є субстанції, які здатні знижувати дестабілізувальні дії на фезотеродин деяких інших наповнювачів, як-то лактоза. Стабілізатори заявленого винаходу також можуть інгібувати, попереджувати, сповільнювати або зменшувати деградацію наступних естерових сполук, що є чутливими до гідролізу. Зокрема, стабілізатори заявленого винаходу є корисними для стабілізації естерів активного метаболіту фезотеродину формули II. Таким чином, ще один підхід цього винаходу стосується застосування субстанції, вибраної із групи, що складається з наступного: ксиліт, сорбіт, полідекстроза, ізомалт та декстроза, для стабілізації фармацевтичної композиції, що містить як активну складову сполуку естеру, що є чутливою до гідролізу, конкретно, естер активного метаболіту фезотеродину формули (II) та, переважно, такий естер, як указано нижче, або її фармацевтично прийнятну сіль або сольват. Естери активного метаболіту фезотеродину формули II, які можна стабілізувати таким шляхом, охоплюють наступні сполуки: a) фенольні моноестери формули III де R1 − C1-C6 алкіл або феніл b) ідентичні діестери формули IV де кожне R1 визначено вище; с) змішані діестери формули V 13 де r1 визначено вище, R1 − гідроген, C1-C6 алкіл або феніл за умови, що R1 та R2 є відмінними, d) бензилові моноестери формули VІ де R1 визначено вище; е) внутрішньомолекулярні циклічні діестери формули VІІ та VІІІ де o та p є однаковими або відмінними та означають число метиленових часток -(CH2)-, що може бути в діапазоні 0 − 6; та f) неорганічні естери, як-то (±)-бензойної кислоти 2 - (3-діізопропіламіно-1-фенілпропіл)-4сульфоксиметил-феніл естер; та їх солі, з фізіологічно прийнятними кислотами, їх вільні основи, та, якщо сполуки можуть бути у формі оптичних ізомерів, то рацемічна суміш та індивідуальні енантіомери. У ще одному підході ця заявка також охоплює фармацевтичну композицію, що містить такий естер, як визначено вище, або його фармацевтично прийнятну сіль, або сольват та фармацевтично прийнятний стабілізатор, де названий стабілізатор вибрано з наступного: ксиліт, сорбіт, полідекстроза, ізомалт, декстроза та їх комбінації. 94107 14 Переважними фармацевтичними композиціями є такі, що містить наступне: (a) фенольний моноестер формули (III), як визначено вище, конкретно, переважно, фенольний моноестер, де R1 − лінійний або розгалужений C3C5 алкіл або його фармацевтично прийнятна сіль, або сольват та (b) фармацевтично прийнятний стабілізатор, де названий стабілізатор вибрано з наступного: ксиліт, сорбіт, полідекстроза, ізомалт, декстроза та їх комбінації. В одному підході заявленого винаходу фармацевтична композиція, що містить естер, як описано вище, переважно, фенольний моноестер формули (III) та стабілізатор, містить названий естер у формі солі, переважно, солі ди- або трикарбонової кислоти або частково гідрогенізованої ди- або трикарбонової кислоти, де названа сіль названого естеру має авто-рН у воді, що є близьким до оптимального pH стабільності відповідного естеру, наприклад, приблизно, при pH 3 − 5. Типові фармацевтичні композиції Типові невичерпні приклади різних стабілізованих композицій можна описати наступним чином. Фармацевтична композиція, що містить фезотеродин та стабілізатор, як визначено вище, де фезотеродин є стабільним стосовно деградації, приблизно, при 40°C, відносній вологості 75% у відкритій посудині, за умови, щоб після, приблизно, 12 тижнів, приблизно, при 40°C, відносній вологості75% у відкритій посудині фармацевтична композиція містила, принаймні, приблизно, 85%, 86%, 87%, 88%, 89% або, приблизно, 90% фезотеродину. Краще, щоб така фармацевтична композиція після зберігання в таких умовах містила, принаймні, приблизно, 89% фезотеродину. Фармацевтична композиція, що містить фезотеродин та стабілізатор, як визначено вище, де фезотеродин є стабільним стосовно деградації, приблизно, при 40°C, 75% відносній вологості у відкритій посудині, за умови, щоб після, приблизно, 6 тижнів, приблизно, при 40°C, відносній вологості 75% у відкритій посудині фармацевтична композиція містила не більше, приблизно, 7%, 6%, 5%, 4,9%, 4,8%, 4,7%, 4,6%, 4,5% або 4,4% активного метаболіту формули (II). Фармацевтична композиція, що містить фезотеродин та стабілізатор, як визначено вище, де фезотеродин є стабільним стосовно деградації, приблизно, при 40°C, відносній вологості 75% у закритій посудині, за умови, щоб після, приблизно, 6 тижнів, приблизно, при 40°C, відносній вологості 75% у закритій посудині фармацевтична композиція містила не більше, приблизно, 2,5%, 2,2%, 2,1%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1% або 1% активного метаболіту формули (II). Краща така фармацевтична композиція після зберігання в таких умовах містила не більше, приблизно, 1,09% активного метаболіту формули (II). Фармацевтична композиція, що містить фезотеродин та стабілізатор, як визначено вище, де фезотеродин є стабільним стосовно деградації, приблизно, при 25°C, відносній вологості 60% у 15 закритій посудині, за умови, щоб після, приблизно, 6 тижнів, приблизно, при 25°C, відносній вологості 60% у закритій посудині фармацевтична композиція містила не більше, приблизно, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2% або 0,1% активного метаболіту. Краща така фармацевтична композиція після зберігання в таких умовах містила не більше, приблизно, 0,18% активного метаболіту формули (II). У переважних втіленнях стабілізатор, застосований у фармацевтичній композиції, яка містить фезотеродин, може бути полідекстрозою, сорбітом або, переважно, конкретно, ксилітом. Грануляти Як наведено вище, фармацевтична композиція заявленого винаходу може бути у формі грануляту. Гранулят може необов’язково містити, принаймні, один подальший наповнювач. Сам фезотеродин деградував, приблизно, після 12 тижнів, приблизно, при 40°C, відносній вологості 75% у відкритих посудинах, приблизно, тільки до того ступеню, що тільки 50% вихідного фезотеродину залишалось в недеградованій формі, то було знайдено, що в грануляті фезотеродину та ксиліту залишалось, приблизно, 93% вихідної кількості фезотеродину в недеградованій формі після, приблизно, 12 тижнів перебування в таких самих умовах. Таким чином, запропоновано типові, невичерпні приклади гранулятів фезотеродину. Гранулят фезотеродину та стабілізатору, як визначено вище, де фезотеродин у грануляті є стабільним стосовно деградації, приблизно, при 40°C, відносній вологості 75% у відкритій посудині, за умови, щоб після, приблизно, 6 тижнів, приблизно, при 40°C, відносній вологості 75% у відкритій посудині, гранулят містив, приблизно, не більше 2%, 1,5%, 1%, 0,9%, 0,8%, 0,7%, 0,6% або 0,5% активного метаболіту формули (II) за масою. Кращий такий гранулят містить, приблизно, не більше 0,58% активного метаболіту формули (II) після зберігання в таких умовах. Гранулят фезотеродину та стабілізатору, як визначено вище, де фезотеродин у грануляті є стабільним стосовно деградації, приблизно, при 40°C, відносній вологості 75% у закритій посудині, за умови, щоб після, приблизно, 6 тижнів, приблизно, при 40°C, відносній вологості 75% у закритій посудині гранулят містив, приблизно, не більше 2%, 1,5%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3% або 0,2% активного метаболіту формули (II). Кращий такий гранулят містить, приблизно, не більше 0,23% активного метаболіту формули (II) після зберігання в таких умовах. Гранулят фезотеродину та стабілізатору, як визначено вище, де фезотеродин у грануляті є стабільним стосовно деградації, приблизно, при 25°C, відносній вологості 60% у закритій посудині, за умови, щоб після, приблизно, 6 тижнів при 25°C, відносній вологості 60% у закритій посудині гранулят містив, приблизно, не більше 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2% або 0,1% активного метаболіту формули (II). Кращий такий гранулят містить, приблизно, не більше 0,3 6%, навіть краще, приблизно, не більше 0,12% активного ме 94107 16 таболіту формули (II) після зберігання в таких умовах. У переважних втіленнях гранулят охоплює як стабілізатор полідекстрозу, сорбіт або переважно, конкретно, ксиліт. Подалі запропоновано грануляти фезотеродину, утворені способом грануляції, переважно, вологої грануляції, із придатним наповнювачем, якто стабілізатор, як визначено вище. Гранулят, отриманий на такому етапі грануляції, переважно, має співвідношення фезотеродин/стабілізатор, приблизно, 1-30 мас.%, краще, приблизно, 1-20 мас.%, краще, приблизно, 3-15 мас.%, та ще краще, приблизно, 5-10 мас.%. У конкретному переважному втіленні гранулят охоплює співвідношення фезотеродин/ксиліт або фезотеродин/сорбіт, приблизно, 1-30 мас.%, переважно, приблизно, 1-20 мас.%, краще, приблизно, 315 мас.% та, навіть краще, приблизно, 5-10 мас.%. Середній розмір грануляту можна контролювати звичайними способами, як-то просівання або помел, та типово може бути меншим, приблизно, 4 мм, переважно, меншим, приблизно, 2 мм, краще, приблизно, меншим 1 мм та, навіть краще, приблизно, меншим 0,75 мм, наприклад, приблизно, 0,5 мм. Грануляти фезотеродину, як описано тут, конкретно отримані вологим способом грануляції, є несподівано стабільними при вологих напружених умовах. Грануляти далі можна обробляти та вводити у фармацевтичні композиції, і вони також є несподівано стабільними. Далі несподівано знайдено, що гранулювання фезотеродину із ксилітом або сорбітом передбачає підсилену стабільність протягом процесу грануляції в порівнянні із гранулюванням фезотеродину з манітом або малтитолом. Коли фезотеродин гранулювали роздільно із цими чотирма цукровими спиртами та визначали ступінь гідролізування або повну деградацію, що відбувається протягом грануляції, знайдено, що гранулювання із ксилітом або сорбітом призводить до меншої деградації продуктів ніж гранулювання з манітом або малтитолом. Гранулювання із ксилітом або сорбітом призводить до утворення, приблизно, 0,06% − 0,07% продукту гідролізування та загальних продуктів деградації, а гранулювання з манітом або малтитолом призводить до утворення, приблизно, 0,42% − 0,73% продуктів гідролізування та загальних продуктів деградації (дивись таблицю 7). Несподівано кращий результат, який спостерігали для грануляції із ксилітом або сорбітом, також спостерігали, коли грануляти фезотеродину, які містять ксиліт або сорбіт, застосовували для отримання фармацевтичних композицій. Фармацевтичні композиції у формі таблеток, які отримували із гранулятів фезотеродину, що містить ксиліт або сорбіт, показували значно менше продуктів гідролізування та загальних продуктів деградації (приблизно, 0,06% − 0,11%) ніж таблетки, отримані із гранулятів фезотеродину, що містять маніт або малтитол (приблизно, 1,1% − 1,7%) (дивись таблицю 8). 17 Різниця між сорбітом та манітом є особливо несподіваною, оскільки ці два цукрові спирти є ізомерами. У ще одному втіленні заявленого винаходу запропоновано застосування гранулятів, що містять фезотеродин та стабілізатор, як описано тут, для лікування енурезу, конкретно, нетримання сечового позиву, невідкладності сечовипускання та/або частоти сечовипускання, та отримання медикаменту для лікування таких станів. Переважно грануляти, котрі застосовані для отримання медикаменту (як-то, наприклад, таблетки), містять цукор, цукровий спирт, поліол або його похідне (як-то, наприклад, ксиліт, сорбіт, полідекстроза, ізомалт або декстроза). Медикамент може бути, наприклад, у формі грануляту, капсул, таблеток або покритих таблеток. Композиції подовженого вивільнення У ще одному подальшому втіленні запропоновано тверду фармацевтичну композицію для перорального застосування фезотеродину або його фармацевтично прийнятої солі, або сольвату, переважно, фезотеродин гідрогенфумарату, який можна отримувати змішуванням описаного тут грануляту, принаймні, з одним подальшим наповнювачем, переважно, принаймні, з одним типом засобів подовженого вивільнення, як-то гідроксипропілметилцелюлоза (ГПМЦ), та необов’язково з іншими наповнювачами. У ще одному підході активну складову (фезотеродин або його фармацевтично прийнятну сіль) уведено в гелеву матрицю, утворену засобом подовженого вивільнення, як описано нижче, переважно, у гелеву матрицю, утворену, принаймні, одним типом здатного до набухання у воді засобу подовженого вивільнення, як-то целюлоза-естер або -етер, та, переважно, утворену, принаймні, одним типом ГПМЦ. Краще − гранулят, що містить активну складову (фезотеродин або його фармацевтично прийнятну сіль) та стабілізатор, як визначено вище, уведений у гелеву матрицю, утворену, принаймні, одним типом ГПМЦ. Така композиція, що містить фезотеродин, стабілізатор та гелеву матрицю, утворену, принаймні, одним типом ГПМЦ, переважно, призначено для вивільнення фезотеродину протягом подовженого періоду часу, переважно, для перорального застосування один раз на добу. Відповідно, така одноразова на добу композиція містить, принаймні, приблизно, 20% ГПМЦ (масова частка від повної маси композиції), та краще, принаймні, приблизно, 25 мас.%, як-то 25% − 65% та, навіть краще, принаймні, приблизно, 30 мас.%, як-то 30% − 65%, та конкретно, переважно, принаймні, приблизно, 35 мас.%, як-то 35% − 55% ГПМЦ. Конкретно, у клінічних дослідженнях та біоеквівалентних дослідженнях показано, що переважні композиції заявленого винаходу, як-то, наприклад, композиції "A", "B", "C", "D", "E", "F", "G" та "H", надані в таблицях 1 та 2 експериментальної частини цієї заявки, є ефективними для людини при застосуванні один раз на добу. Усі вони показують конкретний профіль вивільнення фезотеродину в аналізах розчинення in-vitro. Ці композиції та інші 94107 18 композиції, що показують відповідні профілі розчинення, формують ще одне втілення заявленого винаходу. Конкретно, переважні фармацевтичні композиції, що містить фезотеродин, показують наступні кумулятивні вивільнення фезотеродину (у мас.%, базованих на теоретичній кількості фезотеродину у композиції) в аналізі розчинення in vitro згідно з USP 711 (у фосфатному буфері, pH 6,8, 37°C, при 75 оберт./хвил.): - приблизно, 5 − 30%, переважно, приблизно, 6 − 26% вивільнення фезотеродину через 1 годину, - приблизно, 15% − 40%, переважно, приблизно, 18% − 3 8% вивільнення фезотеродину через 2 години, - приблизно, 35% − 65%, переважно, приблизно, 36% − 56% вивільнення фезотеродину через 4 години та - принаймні, приблизно, 75%, переважно, принаймні, приблизно, 80% вивільнення фезотеродину через 16 годин. Гелеву матрицю для вивільнення фезотеродину переважно, утворено засобом подовженого вивільнення, конкретно, засобом, здатним до набухання при контакті з водою, приблизно, у кількості 20 − 80 мас.%, переважно, приблизно, 25 − 65%, краще 30 − 65% та, навіть ще краще, приблизно, 35 − 55 мас.%, на основі повної композиції. Матриця необов’язково може містити наступні інгредієнти. Також, зокрема, можна вводити в матрицю наповнювач, як-то лактоза та/або мікрокристалічна целюлоза. У ще одному втіленні тверда композиція фезотеродину містить, принаймні, два типи гідроксипропілметилцелюлози (ГПМЦ). Два типи ГПМЦ можуть бути хімічно ідентичними але відмінними в їх в’язкості при розчиненні у воді в стандартних умовах. Альтернативно, можна застосовувати два хімічно відмінні типи ГПМЦ. Конкретно, сприятливі композиції можна отримувати, якщо один тип ГПМЦ має номінальну в’язкість, приблизно, 100000 мПа (тобто, 100000 ± 20000 мПа) та інший має номінальну в’язкість, приблизно, 4000 мПа (тобто, 4000 + 1000 мПа) при розчиненні воді, приблизно, при 22°C і концентрації, приблизно, 2% за масою. В одному переважному втіленні співвідношення фезотеродину або фармацевтично активної солі або його сольвату та ГПМЦ дорівнює, приблизно, 1:80 − 1:5 [масова частка]. Ще кращим є співвідношення маси, приблизно, 1:70 − 1:10 [масова частка], та, навіть краще, приблизно, 1:40 − 1:15 [масова частка]. Ще одним кращим втіленням є тверда фармацевтична композиція, що містить, приблизно, 0,25 − 10 мас.% фезотеродину або його фармацевтично прийнятної солі або сольвату. Найкращі композиції охоплюють фезотеродин у кількості, приблизно, 0,5 − 4 мас.%. Далі переважна композиція може містити один або більше додаткових наповнювачів, як-то один або більше наповнювачів, зв’язувачів та/або змащувачів, та серед них є переважним лактоза, мікрокристалічна целюлоза, тальк, та, конкретно, − гліцерин дибегенат. Складові фармацевтичної композиції 19 Композиції переважно, розробляють у формі одиничного дозування. Кожна форма одиничного дозування може містити, приблизно, 0,5 − 20 мг, переважно, приблизно, 1 − 8 мг та краще, приблизно, 2, 4 або 8 мг фезотеродину або його фармацевтично прийнятної солі, як-то, наприклад, сіль гідрогенфумарату. Термін "форма одиничного дозування" стосується фізично дискретних одиниць, придатних як одиничні дозування для людей або інших ссавців, кожну одиницю, що містить призначену кількість фезотеродину або його солі, розраховано для отримання бажаної терапевтичної дії, крім того, із придатним фармацевтичними наповнювачами. Найкращими для досягнення бажаної терапевтичної дії є призначені тверді форми (як-то таблетки, покриті таблетки, грануляти та капсули), які потребують одноразового застосування пацієнтом на добу. Фармацевтичні наповнювачі, які можна вводити в описані тут композиції, охоплюють засоби подовженого вивільнення ("SR"], дезінтегранти, наповнювачі та змащувачі. Також можна уводити інші наповнювачі. Засоби подовженого вивільнення ("SR") Якщо фармацевтична композиція заявленого винаходу є композицією подовженого вивільнення, вони повинні містити один або більше засобів подовженого вивільнення. Придатними засобами подовженого вивільнення переважно є такі, що здатні набухати при контакті з водою, як-то полівінілпіролідон, пептизований крохмаль, поліметакрилат, полівінілацетат, декстрани, крохмаль, целюлоза, етери та естери целюлози, як-то метилцелюлоза, метилетилцелюлоза, гідроксиетилцелюлоза, гідроксипропілметилцелюлоза, гідроксипропілцелюлоза або карбоксиметилцелюлоза або їх суміші. Переважними прикладами засобів подовженого вивільнення є гідроксипропілметилцелюлоза (ГПМЦ) або суміші різних ГПМЦ. ГПМЦ може діяти як зв’язувач та засіб подовженого вивільнення. ГПМЦ переважно є присутньою в кількості, яка дозволяє утворити гелеву матрицю, з котрої активна складова повільно вивільнюється. У переважному втіленні застосовано два типи гідроксипропілметилцелюлози різної в’язкості. У цій суміші одна ГПМЦ може мати високу в’язкість, та одна ГПМЦ може мати низьку в’язкість. "ГПМЦ високої в’язкості" є такими, що мають (при 22°C) номінальну в’язкість (віскозиметри Ubbelohde), приблизно, 70000 − 150000, та переважно, приблизно, 100000 (тобто, 100000 + 20000) мПа при розчиненні у воді (приблизно, 2 мас.%). "ГПМЦ низької в’язкості " стосуються ГПМЦ, що мають при кімнатній температурі номінальну в’язкість, приблизно, 3000 − 20000, та переважно, приблизно, 4000 мПа (тобто, 4000 ± 1000 мПа) при розчиненні (приблизно, 2 мас.%) у воді. Переважно, процент заміщення метоксильними групами застосованої ГПМЦ дорівнює, приблизно, 15 − 35% та, конкретно, переважно, приблизно, 18 − 30%, тоді як процент заміщення гідроксипропоксигрупами дорівнює, переважно, приблизно, 5 − 14%, та краще, приблизно, 7 − 12%. Придатні якості знайдено, наприклад, для METHOCEL® E4M, 94107 20 METHOCEL® K4M, METHOCEL® K15M та METHOCEL® K100M, котрі є доступними з Dow Chemical Company. Конкретно, переважними є METHOCEL® K100M, що має номінальну в’язкість, приблизно, 100000 мПа та METHOCEL® K4M, що має номінальну в’язкість, приблизно, 4000 мПа. Співвідношення маси METHOCEL® K100M та K4M, застосованих у композиціях та в описаних тут композиціях, може дорівнювати, приблизно, 20:1 − 1:2 та, переважно, приблизно, 10:1 − 1:1,5 та, навіть краще, приблизно, 7:1 − 1:1,3. В одному втіленні можна застосовувати один особливий тип ГПМЦ, як-то, наприклад, ГПМЦ із номінальною в’язкістю, приблизно, 50000 − 120000 мПа, де переважною є ГПМЦ з в’язкістю, приблизно, 50000 − 100000 мПа. Дезінтегранти Крім того, композиції та описані тут композиції також можуть містити дезінтегранти, як-то пептизований крохмаль, натрій крохмальгліколат, мікрокристалічна целюлоза, натрій карбоксиметилцелюлоза (CMC-Na), поперечно зв’язана CMC-Na, калій полакрилін, низькозаміщена гідроксипропілцелюлоза або їх суміші. Присутність дезінтегранту в композиціях та описаних тут композиціях не є необхідною, але може бути бажаною. Наповнювачі / зв’язувачі Описані тут фармацевтичні композиції далі можуть містити наповнювачі та/або зв’язувачі, якто мікрокристалічна целюлоза, порошкована целюлоза, пресований цукор, крохмаль (наприклад, кукурудзяний крохмаль або картопляний крохмаль), пептизований крохмаль, фруктоза, сахароза, декстроза, декстрани, інші цукри, як-то очеретяний цукор, силіконізована мікрокристалічна целюлоза, кальцій гідрогенфосфат, кальцій гідрогенфосфат дигідрат, дикальційфосфат дигідрат, трикальційфосфат, кальцій лактат або їх суміші. Переважні наповнювачі охоплюють, принаймні, один наповнювач, вибраний із мікрокристалічної целюлози та лактози моногідрату. Краще застосовувати як наповнювач суміш лактози та мікрокристалічної целюлози в співвідношенні, приблизно, 1:1 − 3:1 [масова частка]. Конкретно, переважним наповнювачем є MICROCELAC® 100, котрий є співперетвореною сумішшю лактози моногідрату та мікрокристалічної целюлози (обидві фармакопейні якості − у співвідношенні 3:1), виготовленою висушуванням комбінованим розпиленням. Обидві властивості лактози як наповнювача та здатності до зв’язування мікрокристалічної целюлози синергічно перетворені до одного наповнювача, що продукує покращені властивості текучості та кращого таблетування композиції. Описані тут композиції також можуть містити зв’язувачі, як-то похідні целюлози (наприклад, метилцелюлоза та натрій карбоксиметилцелюлоза), желатина, глюкоза, лактоза, цукроза, поліетилeнгліколь, поліметакрилати, гідроксипропілцелюлоза, цукрові спирти, пептизований крохмаль та натрій альгінат. Вони можуть бути корисними для утворення гранул. Деякі переважні стабілізатори, як-то ксиліт та сорбіт, також мають властивості зв’язувача. 21 Якщо зв’язувачі застосовано для утворення гранулятів, їх, переважно, можна застосовувати при середньому розмірі часточок, приблизно, 1 − 300 мкм, краще приблизно, 1 − 200 мкм та, навіть краще, приблизно, 5 − 100 мкм. Найкраще, коли часточки зв’язувача, приблизно, менше 1 мм. Наприклад, якщо для утворення гранул застосовано ксиліт, придатні якості забезпечено XYLITAB® 3 00 або XYLITOL® CM50 (обидві продуковані в Xyrofin Oy, Kotka, Фінляндія, та промислове впровадження здійснено Danisco) та XYLITOL 90 (продуковані Roquette GmbH, Германія) Змащувачі Композиції та розкриті тут композиції також можуть містити змащувачі, засоби проти злипання та/або ковзні засоби, як-то стеаринова кислота, магній стеарат, кальцій стеарат, натрій лаурилсульфат, гідрогенізована рослинна олія, гідрогенізована рицинова олія, натрій стеарил фумарат, макроголі, гліцерин дибегенат, тальк, кукурудзяний крохмаль, силіцій діоксид або їх суміші. Переважними змащувачами є тальк та гліцерин дибегенат. Термін "гліцерин дибегенат", як тут застосовано, слід вважати синонімом терміну "гліцерил бегенат". Покриття Композиції та описані тут композиції, охоплюючи ядра/таблетки, необов’язково можна покривати звичайними матеріалами, застосованими для покриття плівкою, наприклад, як описано в Pharmaceutical Coating Technology, 1995, виданому Graham Cole. Композиції для покриття плівкою, звичайно, містять наступні складові: полімери, пластифікатори, барвники/ засоби замутнення, носії. Також можна застосовувати в розчині або суспензії для покриття плівкою незначні кількості барвників, поверхнево активних речовин та восків. Більшість полімерів, застосованих у покриттях плівкою, є похідними целюлози, як-то етери целюлози або акрилові полімери та coполімери. Інколи зустрічаються поліетилeнгліколі високої молекулярної маси, полівінілпіролідон, полівініловий спирт та воскові матеріали. Типовими етерами целюлози є гідроксиетилцелюлоза, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза та метилцелюлоза. Акрилові полімери містять групу синтетичних полімерів з іншими функціональними можливостями. Деякі з них можна далі модифікувати для підсилення набухання та проникнення уведених матеріалів, якто вода розчинні етери целюлози та крохмалі для того, щоб забезпечити повну дезінтеграцію/розчинення плівки. Загальноприйнятні для застосування пластифіктори можна розподілити на три групи: високомолекулярні спирти (гліцерин, пропіленгліколь, макроголі), органічні естери (фталат-естери, дибутилсебацетат, цитрат-естери, триацетин), олії/гліцериди (рицинова олія, ацетиловані моногліцериди, фракціоноване кокосове масло). Барвники/засоби замутнення розподілено на окремі групи: органічні барвники та їх краплаки, неорганічні барвники, натуральні барвники. Різні 94107 22 матеріали з кожної групи також можна комбінувати у визначених співвідношеннях. Одна придатна композиція суспензії для покриття (розраховано на сухий матеріал) містить: - приблизно, 1-99 мас.% полімеру, переважно, приблизно, 1-95% полімеру, - приблизно, 1-50 мас.% пластифікатору, переважно, приблизно, 1 - 40% пластифікатору, - приблизно, 0,1-20% барвнику/засобу замутнення, переважно, приблизно, 0,1 − 10% барвнику/засобу замутнення. Плівкові покриття можна отримати як готові для вживання, котрі є доступними в продажу. Один переважний матеріал для плівкового покриття є OPADRY®, конкретно, OPADRY® блакитний, котрий є сумішшю 6 складових, як-то полівініловий спирт (плівкоутворювальний засіб), PEG (пластифікатор), лецитин (пом’якшувач), тальк (змащувач), титан діоксид (білий пігмент), барвниковий лак індигокармін-алюміній (барвник). Залежно від бажаної прозорості переважна кількість покриття дорівнює, приблизно, 4 − 6 мас.% таблетки, переважно, приблизно, 4,5%. Дисперсію або суспензію для покриття плівкою можна отримати, застосовуючи різні розчинники (як-то вода, спирти, кетони, естери, хлоровані вуглеводні), але вода є переважною. Оскільки покриття, у принципі, можна застосовувати для модифікування вивільнення активної складової з композиції, покриття фармацевтичної композиції заявленого винаходу, переважно, не модифікує або незначно модифікує профіль вивільнення фезотеродину. Переважно, покриття застосовують у композиції фезотеродину тільки для зручності пацієнтів, тобто для покращення зручності застосування та зовнішнього вигляду кінцевої таблетки Переважна кількості інгредієнтів Тепер слід описати переважні типові, невичерпні приклади твердих фармацевтичних композицій. Усі проценти є базованими на масі [масова частка], яка стосується повної маси композиції, якщо не вказано інше. Одне втілення стосується фармацевтичної композиції, яка містить: - приблизно, 0,3 − 5,0 мас.% фезотеродину або його солі, переважно, фезотеродин гідрогенфумарату, - приблизно, 5 − 25 мас.% стабілізатору, наприклад, наступного: ксиліт, сорбіт, полідекстроза, ізомалт або декстроза. Стабілізатор, переважно, має середній розмір частинок, приблизно, 0,001 − 0,30 мм), - приблизно, 20-40 мас.% наповнювачів та/або зв’язувачів, як-то лактоза моногідрат та мікрокристалічна целюлоза, - приблизно, 20 − 65 мас.% гідроксипропілметилцелюлози та, переважно, приблизно, 25 − 65%, краще 30 − 65% та, навіть ще краще, приблизно, 35 − 55 мас.% гідроксипропілметилцелюлози, - приблизно, 1 − 10 мас.% змащувачів, як-то гліцерин дибегенат та/або тальк. Більше переважна − фармацевтична композиція, яка містить: - приблизно, 0,3 − 5,0 мас.% фезотеродину 23 або його солі, переважно, фезотеродин гідрогенфумарату; - приблизно, 5 − 25 мас.% стабілізатору, наприклад, наступного: ксиліт, сорбіт, полідекстроза, ізомалт або декстроза (переважно, що має середній розмір частинок 0,001-0,30 мм); - приблизно, 20 − 40 мас.% суміші, що містить, приблизно, 45 − 80%, переважно, приблизно, 75 мас.% лактози моногідрату та, приблизно, 55 − 20%, переважно, приблизно, 25 мас.% мікрокристалічної целюлози; - приблизно, 20 − 65%, переважно, приблизно, 25 − 65%, краще, приблизно, 30 − 65% та, навіть ще краще, приблизно, 35 − 55 мас.% гідроксипропілметилцелюлози; - приблизно, 1 − 10 мас.% змащувачів, як-то гліцерин дибегенат та/або тальк. У ще одному конкретному втіленні фармацевтична композиція містить: - приблизно, 0,5-4,0 мас.% фезотеродину гідрогенфумарату; - приблизно, 5 − 25 мас.% стабілізатору, наприклад, наступного: ксиліт, сорбіт, полідекстроза, ізомалт або декстроза (переважно, що має середній розмір частинок, приблизно, 0,001 − 0,30 мм); - приблизно, 20 − 40 мас.% суміші, що містить, приблизно, 45 − 80%, переважно, приблизно, 75 мас.% лактози моногідрату та, приблизно, 55 − 20%, переважно, приблизно, 25 мас.% мікрокристалічної целюлози; - приблизно, 15 − 55% та, переважно, приблизно, 15-40 мас.% гідроксипропілметилцелюлози високої в’язкості; - приблизно, 5 − 30% та, переважно, приблизно, 5 − 25 мас.% гідроксипропілметилцелюлози низької в’язкості; - приблизно, 1 − 5 мас.% гліцерин дибегенату; та - приблизно, 1 − 5 мас.% тальку. До такої композиції необов’язково можна застосовувати покриття. Одним переважним матеріалом для покриття плівкою − OPADRY®, але відомі інші покриття. Ще одне втілення стосується фармацевтичної композиції, яка містить: - приблизно, 0,1 − 10%, переважно, приблизно, 0,2 − 7%, краще 0,3 − 5% та ще краще, приблизно, 0,5 − 4,0% фезотеродину або його солі, переважно, гідрогенфумарату, - приблизно, 20 − 65%, переважно, приблизно, 25-65%, краще, приблизно, 30 − 65% та, навіть ще краще, приблизно, 35 − 55% ГПМЦ, де ГПМЦ може містити два або більше різних типи, як-то ГПМЦ високої в’язкості (наприклад, METHOCEL® K100M) та ГПМЦ низької в’язкості (наприклад, METHOCEL® K4M). Співвідношення ГПМЦ високої в’язкості до ГПМЦ низької в’язкості може бути, приблизно, 20:1 − 1:2 (масова частка) та, переважно, дорівнює, приблизно, 10:1 − 1:1,5 (масова частка) та, навіть кращою є, приблизно, 7:1 − 1:1,3 (масова частка). - приблизно, 1-45%, переважно, приблизно, 2 − 35% та краще, приблизно, 5 − 25% стабілізатору, наприклад, наступного: ксиліт, сорбіт, полідекстроза, ізомалт або декстроза, 94107 24 - приблизно, 10 − 70%, переважно, приблизно, 15 − 50% та краще, приблизно, 20 − 40% наповнювачу, та - приблизно, 0,5 − 10%, переважно, приблизно, 1 − 8% та краще, приблизно, 2 − 7% змащувачу. Конкретно, переважна тверда фармацевтична композиція містить [масова частка]: Фезотеродин гідрогенфумарат, приблизно, 0,5 − 4,0% Ксиліт, приблизно, 5 − 25% MICROCELAC® 100, приблизно, 20 − 40% ГПМЦ (високов’язка), приблизно, 15 − 40% ГПМЦ (низьков’язка), приблизно, 5 − 25% Гліцерин дибегенат, приблизно, 1 − 5% Тальк, приблизно, 1 − 5% та необов’язково фармацевтично прийнятне покриття. Конкретно, у цьому переважному втіленні переважний середній розмір частинок ксиліту є, приблизно, 1 − 300 мкм, краще, приблизно, 1 − 200 мкм, та, навіть краще, приблизно, 5 − 100 мкм. У найкращому втіленні усі частинки, переважно, повинні бути меншими 1 мм. Деякі загальні та переважні розміри частинок також застосовують в інших стабілізаторах згідно з винаходом. Ще одним кращим втіленням є покриті таблетки, яка містить ядро наступного складу: Фезотеродин гідрогенфумарат, приблизно, 4,0 мг Ксиліт (переважно, зі середнім розміром частинок, приблизно, 0,001 − 0,30 мм), приблизно, 32 − 40 мг MICROCELAC® 100, приблизно, 115 − 130 мг ГПМЦ, що має номінальну в’язкість, приблизно, 100000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K100M, приблизно, 65-75 мг ГПМЦ, що має номінальну в’язкість, приблизно, 4000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K4M, приблизно, 65-75 мг Гліцерин дибегенат, приблизно, 8 − 12 мг Тальк, приблизно, 7 − 10 мг та покриття, переважно, OPADRY®, переважно, у кількості, приблизно, 10 − 20 мг та краще, приблизно, 15 мг OPADRY®. Ще одним кращим втілення є покриті таблетки, що містять ядро, яке далі містить: Фезотеродин гідрогенфумарат, приблизно, 4,0 мг Ксиліт (переважно, з середнім розміром частинок, приблизно, 0,001 − 0,30 мм), приблизно, 36,0 мг MICROCELAC® 100, приблизно, 121,5 мг ГПМЦ, що має номінальну в’язкість, приблизно, 100000 мПа при розчиненні (приблизно, 2 мас.%) у воді, переважно, METHOCEL® K100M, приблизно, 70,0 мг ГПМЦ, що має номінальну в’язкість, приблизно, 4000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K4M, приблизно, 70,0 мг Гліцерин дибегенат, приблизно, 10,0 мг Тальк, приблизно, 8,5 мг, та покриття, переважно, OPADRY®, переважно, у кількості, приблизно, 10 − 20 мг та краще, 25 приблизно, 15 мг OPADRY®. Фармацевтичні композиції, крім того, можуть містити менші кількості (приблизно, менше 3%, та краще, приблизно, менше 1 мас.%) домішок. Крім того, композиції, переважно, містять, приблизно, не більше 5 мас.% води, котру можна застосовувати протягом способу виготовлення. У ще одному втіленні запропоновано покриті таблетки, що містять ядро, яке містить: Фезотеродин гідрогенфумарат, приблизно, 8,0 мг Ксиліт (переважно, з середнім розмір частинки, приблизно, 0,001 − 0,20 мм), приблизно, 65 − 80 мг MICROCELAC® 100, приблизно, 7 0 − 85 мг ГПМЦ, що має номінальну в’язкість, приблизно, 100000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K100M, приблизно, 110 − 130 мг ГПМЦ, що має номінальну в’язкість, приблизно, 4000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K4M, приблизно, 2 0 − 30 мг Гліцерин дибегенат, приблизно, 8 − 12 мг Тальк, приблизно, 7 − 10 мг та покриття, переважно, OPADRY®, переважно, у кількості, приблизно, 10 − 20 мг та краще, приблизно, 15 мг OPADRY®. У ще одному втіленні запропоновано покриті таблетки, що містять ядро, яке містить: Фезотеродин гідрогенфумарат, приблизно, 8,0 мг Ксиліт (переважно, з середнім розміром частинки, приблизно, 0,001 − 0,20 мм), приблизно, 72,0 мг MICROCELAC® 100, приблизно, 77,5 мг ГПМЦ, що має номінальну в’язкість, приблизно, 100000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K100M, приблизно, 120,0 мг ГПМЦ, що має номінальну в’язкість, приблизно, 4000 мПа при розчиненні у воді (приблизно, 2 мас.%), переважно, METHOCEL® K4M, приблизно, 24,0 мг Гліцерин дибегенат, приблизно, 10,0 мг Тальк, приблизно, 8,5 мг та покриття, переважно, OPADRY®, переважно, у кількості, приблизно, 10 − 20 мг та краще, приблизно, 15 мг OPADRY®. Спосіб отримання Заявлені фармацевтичні композиції можна отримати відомими процедурами, наприклад, пресуванням або грануляцією. При отриманні фармацевтичних композицій фезотеродин або його фармацевтично прийнятну сіль, або сольват, звичайно, можна змішувати з наповнювачем або сумішшю наповнювачів, або розбавляти наповнювачем або сумішшю наповнювачів, або уводити у наповнювач або суміш наповнювачів. Грануляти, що містить фезотеродин або його фармацевтично прийнятну сіль, або сольват, можна отримувати грануляцією, наприклад, сухою грануляцією або, переважно, вологою грануляцією. Вологу грануляцію звичайно роблять додаванням рідини, наприклад, води, до суміші активної 94107 26 складової (тобто, фезотеродину або його солей або сольватів), а потім наповнювачів для утворення гранулятів (наприклад, цукрового спирту, вибраного з сорбіту та ксиліту), і тоді − гранулювання вологої суміші. В одному втіленні зволоження суміші фезотеродину та сорбіту або ксиліту можна здійснювати в апаратурі для звичайної грануляції, як-то міксер високоінтенсивного змішування (наприклад, Lodige MGT 250) або сушарка розпилюванням у псевдозрідженому шарі (наприклад, Glatt GPCG 60/90), розпилюванням рідини, як-то, наприклад, етанол, ізопропанол, водних розчинів етанолу або ізопропанолу, або, переважно, води, або водної гранулювальної рідини на суміш фезотеродину та ксиліту або сорбіту звичайною фармацевтичною технікою. Зволоження також можна здійснювати безпосереднім додаванням рідини, як-то вода або водна гранулювальна рідина, до вищезгаданої суміші протягом операції змішування у придатному апараті для змішування, наприклад, грануляторі високоінтенсивного змішування. Термін "водна гранулювальна рідина" стосується водної дисперсії, котра містить очищену або демінералізовану воду (Ph.Eur.) як рідину та тверду субстанцію, котру диспергували, суспендували або розчиняли у рідині. Змішування самих наповнювачів або з фезотеродином може бути ефективним у звичайних апаратах, застосовуваних для змішування порошків, наприклад, як-то нерухомі (пасивні) міксери, у псевдозрідженому шарі, дифузійні, двоконусні дифузійні, двоконусні, турбулаторні, кубатурні, планетарні, Y-, V-фасонні або міксери високоінтенсивного змішування. Для висушування вологого грануляту можна застосовувати звичайні системи висушування, якто сушилки у псевдозрідженому шарі або сушильні шафи. У способах, як описано вище, пресування, зокрема, таблеток, може бути ефективним при застосуванні автоматичного роторного таблетувального механізму від різних товаровиробників апаратури для застосування у фармацевтичній промисловості. Для покриття плівкою можна застосовувати звичайну апаратуру, як-то система покриття Driacoater 1200 або інші звичайні пристрої для покриття для застосування у фармацевтичній промисловості. Отримання фармацевтичної композиції можна реалізувати вологим або сухим способом грануляції або способом прямого пресування. Несподівано, було визначено, що, конкретно, фезотеродин є стабільним у фармацевтичній композиції, яку отримано у присутності рідини, переважно, води, та конкретно, якщо фармацевтичну композицію, що містить фезотеродин, отримано способом вологої грануляції, конкретно, переважно, якщо у вологому способі грануляції застосовано воду як рідину. Оскільки фезотеродин містить функціональну групу естеру, здавалося вірогідним, що дія води на фезотеродин призведе до більшого гідролізування естеру ніж при відсутності води. Таким чином, ра 27 ніше до заявленої роботи очікували більшого гідролізування при вологих способах грануляції ніж при сухих способах грануляції. Несподівано знайдено, що, наприклад, фармацевтичні композиції фезотеродину та ксиліту у формі таблеток, отриманих способом, що залучає вологу грануляцію, після тестування на стабільність протягом 6 тижнів при 40°C, відносній вологості 75% у закритих посудинах містили тільки, приблизно, 0,5% продукту гідролізування (тобто, активного метаболіту) та тільки, приблизно, 0,7% загальних продуктів деградації (дивись таблицю 8). Навпаки, знайдено, що таблетки, які містять фезотеродин та ксиліт, які отримували безпосереднім пресуванням (тобто, способом, що не залучає вологу грануляцію), збережені у таких самих умовах, містять, приблизно, 1,3% продукт гідролізування (тобто, активного метаболіту) та, приблизно, 2,1% загальних продуктів деградації (дивись таблицю 8). Таким чином, згідно з ще одним втіленням тут запропоновано фармацевтичну композицію, що містить фезотеродин та ксиліт, яка містить, приблизно, не більше 0,5% (та зокрема, приблизно, не більше 0,48%) продукту гідролізування (тобто, активного метаболіту) та, приблизно, не більше 0,7% (та зокрема, приблизно, не більше 0,68%) загальних продуктів деградації після збереження протягом 6 тижнів, приблизно, при 40°C, відносній вологості 75% у закритих посудинах. Фармацевтичні композиції фезотеродину та ксиліту у формі таблеток, які отримували способом, що залучає вологу грануляцію, тестували на стабільність протягом 6 місяців при кімнатній температурі у закритих посудинах та знаходили, що вони містять, приблизно, тільки 0,2% продукту гідролізування (тобто, активного метаболіту) (за масою у порівнянні з фезотеродином) та тільки, приблизно, 1,3% загальних продуктів деградації (дивись таблицю 9). Навпаки, знаходили, що таблетки, які містять фезотеродин та ксиліт, які отримували сухою грануляцією, зберігали у таких самих умовах, містять, приблизно, 0,8% продукту гідролізування (тобто, активного метаболіту) та, приблизно, 1,7% загальних продуктів деградації (за масою у порівнянні з фезотеродином) (дивись таблицю 9). Таким чином, тут також запропоновано фармацевтичну композицію, що містить фезотеродин та ксиліт, котра містить, приблизно, не більше 0,2% (та зокрема, приблизно, не більше 0,27%) продукту гідролізування (тобто, активного метаболіту) та, приблизно, не більше 1,3% (та зокрема, приблизно, не більше 1,33%) загальних продуктів деградації після збереження протягом 6 місяців при кімнатній температурі у закритих посудинах. Також запропоновано покращений спосіб продукування грануляту фезотеродину та стабілізатору, як визначено вище, що полягає в етапі вологого гранулювання фезотеродину та стабілізатору. Подібно, запропоновано гранулят фезотеродину та стабілізатору, як визначено вище, досяжний або отриманий способом, що полягає в етапі вологого гранулювання фезотеродину та стабілізатору, як визначено вище. У переважному втіленні при вологій грануляції застосовано воду. 94107 28 Спосіб вологої грануляції може полягати у наступному: (a) отримання суміші фезотеродину та стабілізатору, як визначено вище; (b) додавання води до суміші для утворення вологої суміші; та (c) гранулювання вологої суміші. Співвідношення фезотеродин:стабілізатор у суміші етапу (a) може дорівнювати, приблизно, 1:1 − 1:20, та краще − приблизно, 1:1 − 1:10. У переважному втіленні спосіб грануляції водним зволоженням полягати у наступному: - отримання фезотеродину, який необов’язково тонко помелений, або його фармацевтично прийнятної солі, або сольвату, - гранулювання названого фезотеродину або його названої солі, або сольвату разом із придатними наповнювачами, як-то, наприклад, стабілізатор, як визначено вище, застосовуючи воду або базовану на воді дисперсію як грануляційну рідину для отримання грануляту, - змішування вищеназваного, необов’язково з ГПМЦ та/або іншими наповнювачами, що дало суміш для пресування, - пресування суміші для пресування до бажаної форми, та - необов’язково, застосування покриття. У ще одному втіленні фармацевтичну композицію, що містить фезотеродин або його фармацевтично прийнятні солі, отримано згідно із наступним: (a) отримання сухої суміші фезотеродину та цукру, цукрового спирту, поліолу або їх похідних, переважно, вибраних з наступного:, сорбіт, полідекстроза, ізомалт та декстроза; (b) додавання рідини, переважно, води, до суміші, отриманої в (a) для утворення вологої суміші; (c) гранулювання вологої суміші; (d) висушування гранулятів; (e) змішування гранулятів із, принаймні, одним іншим наповнювачем, переважно, принаймні, одним типом гідроксипропілметилцелюлози, для утворення суміші гранулятів та, принаймні, одним іншим наповнювачем, переважно, гідроксипропілметилцелюлозою, та, необов’язково, додавання подальших наповнювачів; (f) пресування суміші гранулятів та, принаймні, одного іншого наповнювача, переважно, гідроксипропілметилцелюлози, у таблетки; та (g) покриття таблеток. Описані тут фармацевтичні композиції у формі таблетки або, необов’язково, покритої таблетки, несподівано виявились стабільними у жорстких умовах (40°C, 75% відносна вологість). Термін придатності переважної композиції при кімнатній температурі може дорівнювати 2 рокам. Приклади 1. Отримання грануляту вологою грануляцією - 6,4 кг фезотеродин гідрогенфумарату та 57,6 кг ксиліту зважували роздільно. Якщо ксиліт агломеровано, його пропускали через сито (1,5 мм). - Фезотеродин гідрогенфумарат та ксиліт пропускали через сито (0,8 мм). - Матеріали переносили у придатний гранулятор високоінтенсивного змішування (наприклад, 29 94107 Lodige Diosna V2 5 або Lodige Diosna Pi/6) та змішували протягом 1 хвилини. - 3,6 л очищеної води додавали до сухої суміші при перемішуванні. - Суміш перемішували з подрібнювачем протягом 9 0 − 12 0 секунд. - Міксер спорожнювали та умісти переносили до пристрою для просівання. Вологий гранулят пропускали через сито або грохот (4,0 мм). - Просіяний гранулят сушили на лотках при 45°C мінімум протягом 8 год. у сушильній шафі/термостаті до умісту води не більше 0,5%. - Сухий гранулят пропускали через сито (0,5 − 1,0 мм). - Змішування (швидкість: 8 оберт./хвил.) робили протягом 5 хвилин. 2. Отримання пресованої суміші 2.1. SR-таблетки 4 мг - 16,0 кг грануляту та 48,6 кг MICROCELAG® 100 пропускали через сито (0,5 − 1,0 мм) (наприклад, FREWITT), переносили до контейнеру для змішування та змішували (швидкість: 8 оберт./хвил.) протягом 10 хвилин. - 28,0 кг гіпромелози (наприклад, METHOCEL® K100M), 28,0 кг гіпромелози (наприклад, METHOCEL® K4M), 4,0 кг гліцерин дибегенату та 3,4 кг тальку додавали до попередньої суміші та змішували (швидкість: 8 оберт./хвил.) протягом 1 хвилини. - Суміш пропускали через сито (0,5 − 1,0 мм) (наприклад, FREWITT) у контейнер для змішування. - Змішування (швидкість: 8 оберт./хвил.) робили протягом 10 − 30 хвилин. 30 2.2. SR-таблетки 8 мг - 32,0 кг грануляту та 31,0 кг MICROCELAC® 100 пропускали через сито (0,5 − 1,0 мм) (наприклад, FREWITT), переносили до контейнеру для змішування та змішували (швидкість: 8 оберт./хвил.) протягом 10 хвилин. - 48,0 кг гіпромелози (наприклад, METHOCEL® K100M), 9,6 кг гіпромелози (наприклад, METHOCEL® K4M), 4,0 кг гліцерин дибегенату та 3,4 кг тальку додавали до попередньої суміші та змішували (швидкість: 8 оберт./хвил.) протягом 1 хвилини. - Суміш пропускали через сито (0,5 − 1,0 мм) (наприклад, FREWITT) у контейнер для змішування. - Змішування (швидкість: 8 оберт./хвил.) робили протягом 10 − 30 хвилин. 3. Таблетування Кінцеву суміш для пресування переносили до роторного пристрою для таблетування та пресували до двоопуклих овальних таблеток. 4. Покриття OPADRY® та очищену воду додавали до посудини для перемішування. Суміш перемішували, принаймні, протягом 1 год.. Тоді суспензію пропускали через сито придатного розміру (наприклад, 300 мкм) та переносили до резервуару для розчину системи для покриття (наприклад, Driacoater 1200). Покриття плівкою наносили на ядра при постійному перемішуванні суспензії поки маса покритої таблетки дорівнювала 335 мг. 5. Зразкові композиції композицій подовженого вивільнення Таблиця 1 Композиції SR-таблеток фезотеродину 4 мг A Ядро таблетки Фезотеродин гідрогенфумарат Ксиліт Лактоза моногідрат (75%) / мікрокристалічна целюлоза (25%) (наприклад MICROCELAC® 100) Гіпромелоза (наприклад METHOCEL® K100M) Гіпромелоза (наприклад METHOCEL® K4M) Гліцерин дибегенат Тальк Очищена вода ПРИКЛАДИ B C 4,0 36,0 4,0 36,0 4,0 36,0 124,5 121,5 121,5 70,0 70,0 8,0 7,5 q.s. * 70,0 70,0 10,0 8,5 q.s. * 70,0 70,0 10,0 8,5 q.s. * Очищена вода Біле 10,0 q.s.* Біле 10,0 q.s.* Блакитне 15,0 q.s.* Повна 330,0 330,0 335,0 Плівкове покриття q.s. = guantum satis = скільки потрібно * видаляли протягом висушування вологого грануляту або протягом покриття плівкою до повної залишкової вологості, приблизно, 2,5 − 3,5% Числа - у міліграмах. 31 94107 32 Таблиця 2 Композиції SR-таблеток фезотеродину 8 мг D E ПРИКЛАДИ F G H 8,0 72,0 8,0 72,0 8,0 72,0 8,0 72,0 8,0 72,0 Ядро таблетки Фезотеродин гідрогенфумарат Ксиліт Лактоза моногідрат (75%) / мікрокристалічна целюлоза (25%) (наприклад MICROCELAC® 100) Гіпромелоза (наприклад METHOCEL® K100M) Гіпромелоза (наприклад METHOCEL® K4M) Гліцерин дибегенат Тальк Очищена вода 80,5 140,0 80,5 77,5 77,5 120,0 24,0 8,0 7,5 q. s. * 165,0 33,0 11,0 11,0 q. s. * 120,0 24,0 8,0 7,5 q. s. * 120,0 24,0 10,0 8,5 q. s. * 120,0 24,0 10,0 8,5 q. s. * Плівкове покриття Очищена вода 15,0 q. s. * 15,0 q. s. * 10,0 q. s. * 10,0 q. s. * 15,0 q. s. * Повна 335,0 455,0 330,0 330,0 335,0 q.s. = quantum satis, скільки потрібно * видаляли протягом висушування вологого грануляту або протягом покриття плівкою до повної залишкової вологості, приблизно, 2,5 − 3,0% Числа - у міліграмах. 6. Тести стабільності a) Збереження таблеток у закритих контейнерах Композиції таблеток прикладів A, F та G, що містить 4, 8 та 8 мг фезотеродин гідрогенфумарату, відповідно, тестували на стабільність. Результати показано нижче у таблиці 3. Недеградований фезотеродин у таблетках вимірювали при наступних умовах ВЕРХ та приймали як показник стабільності: - Колонка: Prontosil Spheribond CN, 5 мкм, 250 мм x 4 мм або еквівалентна - Складова A: вода/трифлуороцтова кислота 1000/1 (об’ємна частка) - Складова B: ацетонітрил/трифлуороцтова кислота 1000/1 (об’ємна частка) - Градієнтний профіль: Час (хвил.) %A %B 0,0 75 25 10,0 75 25 10,1 50 50 19,0 50 50 - Швидкість потоку: 1,2 мл/хвил.. - Температура колонки: 35°C - Об’єм ін’єкції: 75 мкл - Довжина хвилі визначення: 220 нм Час збереження активного метаболіту дорівнював, приблизно, 4,7 хвил.; фактор відгуку: 1,5. Визначення результатів ВЕРХ робили способом площ, відображених у процентах. Середній вміст продукту гідролізування або деградації ( мас.%), спостережених після збереження при 25°C, відносній вологості 60% у закритих контейнерах (25 мл коричневій скляній колбі, герметизованій пластиковою заглушкою та парафіновою пломбою, без будь-якого поглинача вологи), показано для типових композицій нижче у таблиці 3. Таблиця 3 Час збереження Вихідний 3 місяці 6 місяців 9 місяців 12 місяців 18 місяців 24 місяці Прикл. A 4 мг % гідроліз. 0,47 0,50 0,53 0,70 0,88 0,85 0,94 Прикл. F 8 мг % гідроліз. 0,51 0,58 0,69 0,65 0,75 1,01 1,14 % гідроліз. = Продукт гідролізування фезотеродину (активного метаболіту) [ мас.%] % деградац. = Загальна деградація фезотеродину [ мас.%] b) Збереження у відкритих посудинах Фезотеродин гідрогенфумарат, гранулят, що Прикл. G 8 мг % гідроліз. 0,11 0,16 0,21 0,31 0,39 0,37 0,78 Прикл. G 8 мг % деградац. 0,69 1,05 1,10 1,20 1,37 1,26 1,95 містить фезотеродин гідрогенфумарат та ксиліт у співвідношення маси 10:90, а також композицію, що містить фезотеродин гідрогенфумарат та ксиліт, зберігали у відкритих посудинах (25 мл коричневих скляних колбах) протягом до 12 тижнів при 40°C та 75% відносній вологості. Результати пока 33 94107 зано нижче у таблиці 4. Деградацію фезотеродину вимірювали способом ВЕРХ. Застосовували наступні умови для вимірювання деградації продуктів при тестуванні стабільності фезотеродин гідрогенфумарату: - Колонка: Polaris C18-Ether, 3 мкм, 250 мм x 4,6 мм - Елюент A: Вода/метансульфокислота 1000 : 0,5 (об’ємна частка) - Елюент B: Ацетонітрил/метансульфокислота 1000 : 0,5 (об’ємна частка) - Типовий градієнтний профіль: Час (хвил.) %A %B 0,0 67 33 16,0 38 62 18,1 0 100 34 - Температура колонки: 35°C - Швидкість потоку: 1,2 мл/хвил. - Довжина хвилі визначення: 220 нм - Об’єм ін’єкції: 20 мкл Час збереження активного метаболіту дорівнював, приблизно, 4,1 хвил. (rrt = 0,50); фактор відгуку: 1,4. Визначення результатів ВЕРХ робили способом площ, відображених у процентах. Співставлення спостереження середнього недеградованого фезотеродину у грануляті, що містить фезотеродин, та у відповідній композиції у порівнянні з чистим фезотеродином після відкриття збереженого при напружених умовах надано у таблиці 4, де величини вказано у % залишку фезотеродин гідрогенфумарату при різному часі. Таблиця 4 Збереження при 40°C та 75% відносній вологості Вихідний 1 тиждень 2 тижні 4 тижні 12 тижнів Фезотеродин (чистий) Гранулят, що містить фезотеродин/ксиліт 10%/90% (мас.%/мас.%) Композиція (Прикл. B) 98,96% 98,56% 97,67% 94,32% 50,39% 99,04% 98,83% 98,61% 97,45% 92,83% 99,18% не виміряли 96,98% 94,79% 89,76% c) Стабільність сумішей фезотеродину з цукровими спиртами Суміші фезотеродин гідрогенфумарату з ксилітом, сорбітом, манітом та малтитолом зберігали протягом 6 тижнів та 3 місяців, відповідно, у закритих посудинах при 25°C та 60% відносній вологості у закритих посудинах при 40°C та 75% відносній вологості, або у відкритих посудинах при 40°C та 75% відносній вологості і тоді тестували для ви значення стабільності вимірюванням порції недеградованого фезотеродину. Вихідна порція недеградованого фезотеродину у сумішах дорівнювала 99,7%. У таблиці 5a показано, що тоді як фезотеродин стабілізовано проти деградації у відкритих посудинах при змішуванні з ксилітом або сорбітом, він розкладається швидше, ніж при змішуванні з манітом та малтитолом. Таблиця 5a Недеградований фезотеродин у сумішах після 6 тижнів та 3 місяців, відповідно Суміш фезотеродину з наступним: Ксиліт 1:9 6 тижнів 3 місяці Ксиліт 1:1 6 тижнів 3 місяці Сорбіт 1:9 6 тижнів 3 місяці Сорбіт 1:1 6 тижнів 3 місяці Маніт 1:9 6 тижнів 3 місяці Маніт 1:1 6 тижнів Закрита посудина 25°C, 60% відносна вологість Відкрита посудина 40°C, 75% відносна вологість 99,6 99,6 98,7 98,2 99,6 99,6 98,6 65,2 99,4 99,0 99,0 98,5 99,6 99,5 98,7 70,2 99,6 99,4 91,7 42,8 99,7 94,5 35 94107 36 Продовження таблиці 5а 3 місяці Малтитол 1:9 6 тижнів 3 місяці Малтитол 1:1 6 тижнів 3 місяці Фезотеродин 6 тижнів 3 місяці 99,6 41,3 99,6 99,5 95,4 53,7 99,6 99,6 96,3 51,2 99,6 96,3 99,7 53,1 У таблиці 5b показано, що лактоза дестабілізує фезотеродин, а ксиліт є здатним до зниження дестабілізувальної дії лактози. Таблиця 5b Недеградований фезотеродин у сумішах після 6 тижнів та 3 місяців, відповідно Суміш фезотеродину з наступним: Лактоза 1:9 6 тижнів 3 місяці Лактоза 1:1 6 тижнів 3 місяці Лактоза/ксиліт 1:20:9 6 тижнів 3 місяці Лактоза/ксиліт 1:1:1 6 тижнів 3 місяці Закрита посудина 25°C, 60% відносна вологість Відкрита посудина 40°C, 75% відносна вологість 99,7 99,6 86,2 42,8 99,6 99,5 96,2 59,8 99,9 99,6 98,8 97,8 99,6 99,5 98,6 83,8 d) Деградація фезотеродину протягом продукування грануляту Грануляти фезотеродину з різними цукрами, цукровими спиртами, високомолекулярними спиртами або їх похідними отримували як описано у прикладі 1. Після продукування гранулятів та після шести тижнів та 3 місяців збереження, відповідно, у різних умовах, визначали деградацію фезотеродину у гранулятах. Результати надано у таблиці 6. Таблиця 6 Деградація фезотеродину у різних гранулятах Закрита посудина 25°C, 50% відносна вологість 50% Фезо-гранулят з наступним: Маніт 1:9 Початок 6 тижнів 3 місяці Малтитол 1:9 Початок 6 тижнів 3 місяці Закрита посудина 40°C, 75% відносна вологість Відкрита посудина 40°C, 75% відносна вологість %гідроліз. %деградац. %гідроліз. %деградац. %гідроліз. %деградац. лі 0.45 6.08 10.37 0.87 8.03 12.83 0.45 10.40 28.15 0.87 18.86 57.64 0.45 28.14 40.52 0.87 40.72 63.62 0.42 3.80 13.85 0.83 5.43 17.71 0.42 7.90 11.44 0.83 16.77 29.72 0.42 22.14 43.11 0.83 45.52 72.05 37 94107 38 Продовження таблиці 6 Ксиліт 1:9 Початок 6 тижнів 3 місяці Сорбіт 1:9 Початок 6 тижнів 3 місяці Лактоза 1:9 Початок 6 тижнів 3 місяці Авіцел 1:9 Початок 6 тижнів 3 місяці Декстроза моногідрат 1:9 3 тижні 6 тижнів 0.06 0.23 7.04 0.06 0.37 14.77 0.06 0.58 1.14 0.06 1.25 4.01 0.07 0.36 0.74 0.07 0.51 0.99 0.07 1.47 7.58 0.07 2.79 18.03 0.07 0.48 0.91 0.07 0.91 3.38 0.35 nd 20.90 0.63 nd 27.90 0.35 19.67 17.32 0.63 46.23 92.55 0.35 20.69 21.14 0.63 44.73 88.25 0.19 nd 5.43 0.55 nd 6.92 0.19 8.47 10.65 0.55 13.31 19.81 0.19 23.57 20.78 0.55 55.14 64.40 0.36* 0.39* 0.83* 0.81* 0.73 1.3 1.3 2.3 nd nd 0.79* 1.2* 0.75 1.0 1.3 1.8 nd nd 0.21* 0.25* Полідекстроза 1: 9 3 тижні 6 тижнів 0.06 0.22 0.28 0.39* 0.73* Ізомалт 1:9 3 тижні 6 тижнів 0.06 0.12 0.23 0.58* 0.71* 0.41 0.42 0.8 0.9 nd nd % гідроліз. = Продукт гідролізування фезотеродину (активного метаболіту) [ мас.%] % деградац. = Загальні продукти деградації фезотеродину [ мас.%] * = виміряли при 30°C, 65% відносній вологості e) Деградація фезотеродину протягом продукування таблеток Грануляти фезотеродину з різними цукрами та цукровими спиртами отримували як описано у прикладі 1. Тоді ці грануляти застосовували для отримання 4 мг таблеток згідно з прикладом 2,1 та з композицією, наданою як "приклад C" у таблиці 1, а також, де ксиліт заміщували на маніт, малтитол, сорбіт або лактозу. Після продукування таблеток та після шести тижнів та 3 місяців зберігання, відповідно, у різних умовах кількість деградації фезотеродину визначали вимірюванням недеградованої порції фезотеродину. Результати показано у таблиці 7: Таблиця 7 Деградація фезотеродину у таблетках з різними гранулятами з цукром та цукровим спиртом Таблетки фезотеродину з наступним: Маніт 1:9 Початок 6 тижнів 3 місяці Малтитол 1:9 Початок 6 тижнів 3 місяці Ксиліт 1:9 Початок 6 тижнів 3 місяці Сорбіт 1:9 Початок 6 тижнів Закрита посудина 25°C, 60% відносна вологість 6 тижнів %гідроліз. %деградац. Закрита посудина 40°C, 75% відносна вологість 6 тижнів %гідроліз. %деградац. Відкрита посудина 40°C, 75% відносна вологість 6 тижнів %гідроліз. %деградац. 1,23 6,29 16,58 1,95 8,61 23,21 1,23 14,68 24,06 1,95 29,32 60,11 1,23 22,24 26,62 1,95 42,84 69,83 1,11 5,31 11,16 1,78 7,68 15,95 1,11 11,46 26,87 1,78 23,67 68,52 1,11 22,38 26,65 1,78 40,38 69,94 0,06 0,18 0,64 0,12 0,31 0,88 0,06 1,09 3,91 0,12 1,54 6,68 0,06 4,40 6,76 0,12 6,78 13,51 0,11 0,39 0,21 0,64 0,11 2,14 0,21 3,66 0,11 6,72 0,21 10,48 39 3 місяці 94107 1,03 1,29 9,81 40 18,54 10,79 20,49 41 94107 42 Продовження таблиці 7 Лактоза 1:9 Початок 6 тижнів 3 місяці 0,67 3,94 11,14 1,03 5,47 15,24 0,67 22,96 41,54 %гідроліз. = Продукт гідролізування фезотеродину (активного метаболіту) [ мас.%] %деградац. = Загальні продукти деградації фезотеродину [мас.%] f) Стабільність фезотеродину у таблетках після вологої грануляція у порівнянні з безпосереднім пресуванням Таблетки з композицією «прикладу C" таблиці 1,03 41,54 51,14 0,67 23,56 42,74 1,03 43,39 51,17 1 отримували (a) способом згідно з прикладами 1 та 2,1., тобто, вологим гранулюванням фезотеродину та ксиліту або (b) безпосереднім пресуванням усіх наповнювачів. Тоді таблетки піддавали тестуванню на стабільність протягом 6 тижнів та 3 місяців, відповідно, при 40°C, відносній вологості 75% у закритих посудинах. Результати показано у таблиці 8. Таблиця 8 Співставлення стабільності фезотеродину у таблетках протягом 6 тижнів та 3 місяців стресових умов, відповідно, після (a) вологої грануляції або (b) безпосереднього пресуванням у присутності ксиліту Таблетки, отримані вологою грануляцією 6 тижнів 3 місяці безпосереднє пресування 6 тижнів 3 місяці % гідролізування мас.% % загальної деградації мас.% 0,48 1,69 0,68 2,92 1,32 4,71 2,08 8,72 Гідролізування за масою стосується проценту від маси активного метаболіту. Загальна деградація за масою стосується проценту від маси загальних продуктів деградації фезотеродину. g) Стабільність фезотеродину у таблетках після сухої грануляції Таблетки з композицією «прикладу C" таблиці 1 отримували наступним чином: 3,5 кг фезотеродин гідрогенфумарату змішували з 31,5 кг ксиліту, просіяного через сито 0,032". Суху суміш пресували пресувальним валиком при тиску 1250 фунтів/кв.дюйм. Пресовані стрічки гранулювали через 20коміркову сітку у вібраторному грануляторі. Потім матеріал просівали через терковий грохот 0,040". Додавали 33,91 MICROCELAC® 100 та 15,09 кг гіпромелози K100M та змішували. Після просівання через 0,040", суху суміш пресували при 700 фунтів/кв.дюйм. Після пресування матеріал гранулювали через вібраційне сито 16-меш та, остаточно − через терковий грохот 0,062". Додавали 37,41 кг гіпромелози K100 M, 0,5 кг гіпромелози K4M та 3,72 кг тальку, змішували та суміш просівали через терковий грохот 0,062". Після подальшого змішування додавали 4,38 кг гліцерилбегенату та суміш змішували до пресувальної суміші. Кінцеву суміш для пресування переносили до роторного пристрою для таблетування та пресували до двоопуклих овальних таблеток. Додавали до посудини для перемішування OPADRY® та очищену воду. Суміш перемішували, принаймні, протягом 1 год.. Тоді суспензію пропускали через сито придатного розміру (наприклад, 300 мкм) та переносили до резервуару для розчинення системи для покриття (наприклад, driacoater 1200). Покриття плівкою наносили на ядра при постійному перемішуванні суспензії поки маса покритої таблетки дорівнювала 335 мг. Таблетки піддавали тестуванню стабільності при кімнатній температурі протягом 6 місяців у закритих посудинах. У таблиці 9 показано результат тестування стабільності композиції, отриманої сухою грануляцією у порівнянні з композицією, отриманою вологою грануляцією згідно з прикладом 1. Таблиця 9 Композиція, отримана наступним способом: Суха грануляція Волога грануляція Гідролізування, мас.% Загальна деградація, мас.% 0,83 0,27 1,79 1,33 43 94107 Гідролізування за масою стосується проценту від маси активного метаболіту. Загальна деградація за масою стосується проценту від маси загальних продуктів деградації фезотеродину. 7. Профіль розчинення фармацевтичних ком 44 позицій іn vitro, які містять різні кількості ГПМЦ Визначали профілі розчинення таблеток фезотеродину іn-vitro з різними умістами ГПМЦ. Композиції таблеток показано нижче у таблиці 10. Таблиця 10 Номер композиції Дозування I 4 мг [мг] Гранулят фезотеродин/ксиліт 1:9 MICROCELAC® 100 METHOCEL® K100M METHOCEL® K4M Compritol 888 ATO Тальк Загальне J 4 мг [мг] K 4 мг [мг] L 8 мг [мг] M 8 мг [мг] N 8 мг [мг] 40,00 40,00 40,00 80,00 80,00 80,00 121,50 70,00 70,00 10,00 8,50 320,00 165,50 48,00 48,00 10,00 8,50 320,00 197,50 32,00 32,00 10,00 8,50 320,00 77,50 120,00 24,00 10,00 8,50 320,00 125,50 80,00 16,00 10,00 8,50 320,00 157,50 53,00 11,00 10,00 8,50 320,00 Профілі розчинення іn-vitro визначали наступними способами аналізу: Тестування вивільнення ліків SR-таблетками фезотеродину по 4 мг та 8 мг Параметри розчинення. Тестер розчинення: наприклад, Erweka DT800 Спосіб розчинення: згідно з USP Drug Release, App. 2 Температура: 3 7°C + 0,5°C Оберт../хвил.: 75 Об’єм зразку: 5 мл (заміна середовища після кожного середовища) Синкер: так Середовище для розчинення: фосфатний буфер pH 6,8 Умови хроматографії. Колонка: Spherisorb CN, 5 мкм, 250 мм x 4 мм Мобільна фаза: Ацетонітрил/вода/трифлуороцтова кислота 550:450:1 (об’ємна частка) Швидкість потоку: 0,8 мл/хвил. Температура термостату: 35°C Температура автоматичного відбірника проб: 2 0°C Об’єм ін’єкції: 50 мкл Визначення: УФ при 220 нм Час утримання: Фезотеродин гідрогенфумарат, приблизно, 4,4 хвил. Активний метаболіт, приблизно, 4,0 хвил. Час перебігу: 6,5 хвил. Результати розчинення показано нижче у таблиці 11а та таблиці 11b, та на фіг. 1 та 2. Таблиця 11а Номер партії Відповідна ГПМЦ Час у годинах 0 1 2 4 16 I кількість J K 43,75 мас.% 3 0 мас.% 20 мас.% 0 18 31 49 93 % Вивільнення фезотеродин гідрогенфумарату 0 21 35 55 96 0 19 37 59 76 Таблиця 11b Номер партії Відповідна ГПМЦ Час у годинах 0 1 2 4 16 L кількість M N 45 мас.% 3 0 мас.% 20 мас.% 0 18 31 50 93 % Вивільнення фезотеродин гідрогенфумарату 0 21 37 60 100 0 23 40 63 96 45 Кількості стосуються проценту вивільнення фезотеродин гідрогенфумарату. Повна кількість фезотеродин гідрогенфумарату у таблетках дорівнює 4 мг. Конкретно, переважними є базовані на цьому 94107 46 профілі розчинення композиції, що мають вміст ГПМЦ понад 30 % (композиції "I" та "L"). Ще одна композиція, що відповідає найкращому профілю розчинення, була композиція "О", приведена у таблиці 11с нижче: Таблиця 11с Композиція О Ядро таблетки Фезотеродин гідрогенфумарат Ксиліт Лактоза моногідрат Мікрокристалічна целюлоза Гіпромелоза (наприклад METHOCEL® K100M) Гіпромелоза (наприклад METHOCEL® K4M) Гліцерин дибегенат Тальк Очищена вода Плівкове покриття 4,0 76,0 43,0 41,5 70,0 70,0 8,0 7,5 q. s. * Повна 330,0 8. Співставлення ефективності, прийнятності та безпечності композицій фезотеродин гідрогенфумарату та толтеродину Рандомізоване, подвійно сліпе, подвійно імітоване, плацебо та активно контрольоване випробування проводили на дорослих чоловіках та жінках. Один раз на добу 4 мг та 8 мг фезотеродин гідрогенфумарату призначали перорально пацієнтам з надактивним сечовим міхуром і зіставляли з плацебо та активним контролем (4 мг/добу толтеродину ER (подовжене вивільнення)). Були наступні композиції фезотеродину : 4 мг: Приклад A − тут згідно з таблицею 1 8 мг: Приклади F та G − тут згідно з таблицею 2 Іспит проводили у 19 країнах. Усіх 1135 суб’єктів рандомізували та 1103 суб’єктів залучали у групу для повного аналізу: 279 − у групу лікування плацебо, 265 − у групу лікування 4 мг фезотеродину, 276 − у групу лікування 8 мг фезотеродину та 283 − у групу лікування 4 мг толтеродину ER. Середній вік суб’єктів був 57 років. 81% були самицями та 97% − білими. Не було відмінностей між групами лікування щодо статі, раси, віку або маси/індексу маси тіла. Ефективні результати продемонстрували статично значні (усі p ≤ 0,001) покращення головних перемінних у порівнянні з плацебо при кінці лікування, що вимагають USFDA (зміна середнього числа сечовипускань за 24 години та зміна середнього числа випадків позивів нетримання за 24 години) та European regulatory authorities (зміна середнього числа сечовипускань за 24 години, та у відгуку на лікування (перемінна так/ні), отримані з 4-category Treatment Benefit Scale). Зменшення числа сечовипускань та випадків позивів нетримання за 24 години у групах з фезотеродином 8 мг/добу та 4 мг/добу були значно вищими ніж у групах з плацебо. Швидкості відгуку на лікування також були вищими при кінці лікування у обох групах з дозування фезотеродину у порівнянні з пла цебо. Показано, що при кінці лікування толтеродин ER статистично значно (усі p ≤ 0,008) покращує у порівнянні з плацебо вищезгадані головні перемінні. Для усіх головних перемінних показано при фезотеродині 4 мг/добу злегка вище число змін у порівнянні з плацебо ніж при толтеродині ER. Відмінність у числі більш явно виражено для фезотеродину 8 мг/добу. Усіх 1132 суб’єктів залучали у групу безпечності: 283 у групу для лікування плацебо, 272 у групу для лікування фезотеродином 4 мг/добу, 2 87 у групу для лікування фезотеродином 8 мг/добу та 290 у групу для лікування толтеродином ER 4 мг/добу. Найбільше загальних типових несприятливих випадків при цьому спостерігали у суб’єктів, що приймали мускаринові холіноблокатори з продажу. Сухість у роті частіше виникала у суб’єктів, яких лікували фезотеродином та толтеродином, у порівнянні з суб’єктами, яких лікували плацебо (фезотеродин 4 мг/добу 22%, фезотеродин 8 мг/добу 34%, толтеродин 4 мг/добу − 17%, плацебо − 7%). Запор частіше виникав у суб’єктів, яких лікували фезотеродином та яких лікували толтеродином у порівнянні з суб’єктами, яких лікували плацебо (фезотеродин 4 мг/добу 3%, фезотеродин 8 мг/добу 5%, толтеродин 4 мг/добу − 3%, плацебо − 1%). Сухий кератокон’юктивіт частіше виникав у суб’єктів, яких лікували фезотеродином та яких лікували толтеродином у порівнянні з суб’єктами, яких лікували плацебо (фезотеродин 4 мг/добу 2%, фезотеродин 8 мг/добу 4%, толтеродин 4 мг/добу 1%, плацебо 0%). Інциденти сухого горла були низькими в усіх групах ((фезотеродин 4 мг/добу 1%, фезотеродин 8 мг/добу 3%, толтеродин 4 мг/добу 1%, плацебо 0%), як і затримка сечі (фезотеродин 4 мг/добу 1%, фезотеродин 8 мг/добу 1%, толтеродин 4 мг/добу 0%, плацебо 0%] та нерізкий зір (фезотеродин 4 мг/добу 1%, фезотеродин 8 мг/добу 1%, толтеродин 4 мг/добу 1%, плацебо 2%). 47 94107 Підсумок результатів завершеної процедури 48 тестування запропоновано у таблиці 12. Таблиця 12 Підсумок статистичних аналізів ефективності головних перемінних, застосовуючи завершену процедуру тестування (FAS з LOCF у SP583) Процедура тестування р-Величинаa a United States Food та Drug Administration Етап 1: Число сечовипускань за 24 години Фезо 8 мг/добу відносно
ДивитисяДодаткова інформація
Назва патенту англійськоюStabilized pharmaceutical composition comprising fesoterodine
Автори англійськоюArth Christoph, Mika Hans-Juergen, Komenda Michael, Lindner Hans, Bicane Fatima, Paulus Kerstin, Irngartigner Meike
Назва патенту російськоюСтабилизированная фармацевтическая композиция фезотеродина
Автори російськоюАрт Криштоф, Мика Ганс-Юрген, Коменда Михаэль, Линднер Ганс, Бикане Фатима, Паулюс Керштин, Ирнгартингер Майке
МПК / Мітки
МПК: A61K 47/26, A61K 31/222, A61P 13/10
Мітки: композиція, фармацевтична, стабілізована, фезотеродину
Код посилання
<a href="https://ua.patents.su/24-94107-stabilizovana-farmacevtichna-kompoziciya-fezoterodinu.html" target="_blank" rel="follow" title="База патентів України">Стабілізована фармацевтична композиція фезотеродину</a>
Попередній патент: Горизонтальна коксова піч, подова фасонна цегла для коксових печей та спосіб одержання коксу у цій печі
Наступний патент: Спосіб та установка для виготовлення прокату у вигляді гарячекатаної штаби з крем’янистої сталі на базі тонких слябів
Випадковий патент: 1-аміноалкілциклогексани як трипаноцидні агенти












