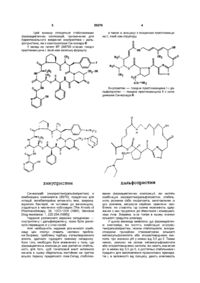
Стабілізована фармацевтична композиція на основі хінупристину та дальфопристину та спосіб її одержання
Формула / Реферат
1.Стабілізована фармацевтична композиція на основі хінупристину і дальфопристину, яка відрізняється тим, що вона містить принаймні стехіометричну кількість метансульфокислоти або хлористоводневої кислоти, і її величина рН знаходиться в межах від 3,5 до 5,0.
2.Стабілізована фармацевтична композиція згідно з п. 1, яка відрізняється тим, що вона може бути в ліофілізованому, замороженому або рідкому стані.
3.Стабілізована фармацевтична композиція згідно з п.1 або 2, яка відрізняється тим, що вона містить:
- дальфопристин і хінупристин;
- метансульфокислоту або хлористоводневу кислоту у кількості принаймні стехіометричній по відношенню до введених дальфопристину і хінупристину;
- у разі необхідності надлишок метансульфокислоти або хлористоводневої кислоти для доведення рН утвореного розчину до величини в межах від 3,5 до 5,0;
- можливо, ізотонічний агент і/або інші фармацевтично прийнятні добавки;
- відповідну воду у кількості, необхідній для потрібної концентрації розчину, і у випадку ліофілізату воду видаляють.
4. Стабілізована фармацевтична композиція згідно з п. 3, яка відрізняється тим, що концентрація активного начала хінупристин/дальфопристин становить від 5 до 250 мг/мл, а у випадку ліофілізату концентрація активного начала становить від 5 до 95%.
5. Стабілізована фармацевтична композиція згідно з п. 4, яка відрізняється тим, що концентрація активного начала хінупристин/дальфопристин в ліофілізаті становить від 20 до 90%.
6. Стабілізована фармацевтична композиція згідно з будь-яким із пп. 1-4, яка відрізняється тим, що її рН знаходиться в межах від 3,5 до 4,5.
7. Стабілізована фармацевтична композиція згідно з п. 6, яка відрізняється тим, що її рН становить 3,5.
8. Стабілізована фармацевтична композиція згідно з будь-яким із пп. 1-4, яка відрізняється тим, що її рН знаходиться в межах від 4,5 до 5,0.
9. Препарат у вигляді готового до вживання стабілізованого розчину, одержаний із стабілізованої ліофілізованої або замороженої фармацевтичної композиції згідно з п. 2.
10. Спосіб одержання фармацевтичної композиції згідно з п. 1, який відрізняється тим, що здійснюють одночасне або послідовне розчинення хінупристину, дальфопристину і метансульфокислоти або хлористоводневої кислоти у воді з наступним доведенням рН до величини у межах від 3,5 до 5,0.
11. Спосіб згідно з п. 10, який відрізняється тим, що здійснюють послідовне розчинення хінупристину, а потім дальфопристину у воді, підкисленій метансульфокислотою або хлористоводневою кислотою з наступним доведенням рН до величини у межах від 3,5 до 5,0.
12. Спосіб згідно з п. 10 або 11 для приготування фармацевтичної композиції згідно з п. 2, який відрізняється тим, що у разі необхідності приготований розчин додатково ліофілізують і/або заморожують.
Текст
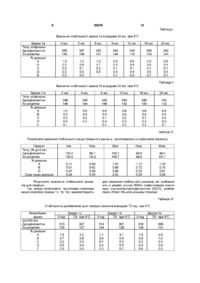
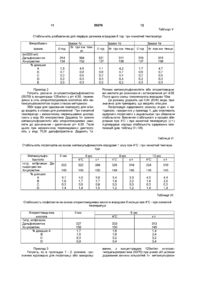
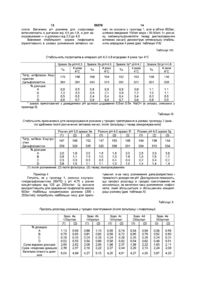
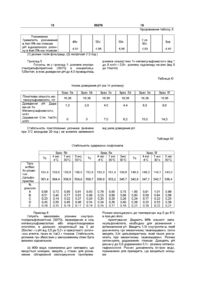
1 Стабілізована фармацевтична композиція на основі хінупристину і дальфопристину, яка відрізняється тим, що вона містить принаймні стехіометричну КІЛЬКІСТЬ метан сульфокислоти або хлористоводневої кислоти, і и величина рН знаходиться в межах від 3,5 до 5,0 2 Стабілізована фармацевтична композиція згідно 3 п 1, яка відрізняється тим, що вона може бути в люфілізованому, замороженому або рідкому стані З Стабілізована фармацевтична композиція згідно з п 1 або 2, яка відрізняється тим, що вона містить - дальфопристин і хінупристин, - метансульфокислоту або хлористоводневу кислоту у КІЛЬКОСТІ принаймні стехіометричній по відношенню до введених дальфопристину і хінупристину, - у разі необхідності надлишок метансульфокислоти або хлористоводневої кислоти для доведення рН утвореного розчину до величини в межах від 3,5 до 5,0, - можливо, ІЗОТОНІЧНИЙ агент і/або ІНШІ фармацевтично прийнятні добавки, - відповідну воду у КІЛЬКОСТІ, необхідній для потрібної концентрації розчину, і у випадку люфілізату воду видаляють 4 Стабілізована фармацевтична композиція згідно з п 3, яка відрізняється тим, що концентрація активного начала хінупристин/дальфопристин становить від 5 до 250 мг/мл, а у випадку люфілізату концентрація активного начала становить від 5 до 95% 5 Стабілізована фармацевтична композиція згідно з п 4, яка відрізняється тим, що концентрація активного начала хінупристин/дальфопристин в люфілізаті становить від 20 до 90% 6 Стабілізована фармацевтична композиція згідно з будь-яким із пп 1-4, яка відрізняється тим, що и рН знаходиться в межах від 3,5 до 4,5 7 Стабілізована фармацевтична композиція згідно з п 6, яка відрізняється тим, що її рН становить 3,5 8 Стабілізована фармацевтична композиція згідно з будь-яким із пп 1-4, яка відрізняється тим, що и рН знаходиться в межах від 4,5 до 5,0 9 Препарат у вигляді готового до вживання стабілізованого розчину, одержаний із стабілізованої люфілізованої або замороженої фармацевтичної композиції згідно з п 2 10 Спосіб одержання фармацевтичної композиції згідно з п 1, який відрізняється тим, що здійснюють одночасне або послідовне розчинення хінупристину, дальфопристину і метан сульфокислоти або хлористоводневої кислоти у воді з наступним доведенням рН до величини у межах від 3,5 до 5,0 11 Спосіб згідно з п 10, який відрізняється тим, що здійснюють послідовне розчинення хінупристину, а потім дальфопристину у воді, підкисленій метансульфокислотою або хлористоводневою кислотою з наступним доведенням рН до величини у межах від 3,5 до 5,0 12 Спосіб згідно з п 10 або 11 для приготування фармацевтичної композиції згідно з п 2, який відрізняється тим, що у разі необхідності приготований розчин додатково люфілізують і/або заморожують О (О со о> ю 59376 Цей винахід стосується стабілізованих фармацевтичних композицій, призначених для парентерального введення хінупристина і дальфопристина, які є компонентами Синерсида ® У заявці на патент ЕР 248703 описані ПОХІДНІ пристинаміцина І, який має загальну формулу а також їх асоціації з похідними пристинаміцина II, який має структуру он Хінупристин — похідне пристинаміцина І і дальфопристин — похідне пристинаміцина II є складниками Синерсида ® / 4 / \ / V хинулристин Синерсид® (хінупристин/дальфопристин) є комбінацією компонентів (30/70), придатною для ІН'ЄКЦІЙ, антибактерійна активність якої, зокрема, відносно бактерій, не чутливих до ванкоміцину, згадується в численних публікаціях [The Annals of Pharmacotherapy, 29, 1022-1026 (1995), Microbial Drug resistance, 1, 223-234 (1995)] Надання розчинності окремим складникам — хінупристину і дальфопристину, може бути досягнуто переводом їх у стан солей Але необхідність надання розчинності комбінації цих сполук ставить численні проблеми Зокрема, проблему підбору солеутворюючого агента, здатного підходити кожному складнику Крім того, необхідно бути впевненим у тому, що фармацевтична композиція має достатню стабільність для того, щоб початковий вміст активного начала в ньому зберігалось постійним на протязі всього терміну придатності ЛІКІВ Склад стабілізо 0 H дальфопристин ваних фармацевтичних композицій, які містять комбінацію хінупристин/дальфопристин, стабільність розчинів і/або люфілізатів, виготовлених із цих розчинів, висунули серйозні практичні проблеми, які ставлять під сумнів можливість одержання з них придатних до зберігання і комерціалізації ЛІКІВ Зокрема, із-за появи в ньому значної КІЛЬКОСТІ продуктів розкладу У цьому винаході виявлено, що фармацевтичні композиції, які містять комбінацію хінупристин/дальфопристин, можна стабілізувати, використовуючи принаймні стехіометричні КІЛЬКОСТІ метансульфокислоти або хлористоводневої кислоти, при значенні рН у межах від 3,5 до 5 Таким чином, розчини на основі метансульфокислоти або хлористоводневої кислоти, які мають значення рН в межах від 3,5 до 5, є достатньо стабільними і придатні для виготовлення промислових препаратів і, в залежності від процесу, дають можливість 59376 одержати люфілізати, стабільні відновлені після люфілізацм розчини і/або заморожені розчини, і, отже, придатні для зберігання, що необхідно для їх комерціалізації і/або терапевтичного застосування Стабілізовані фармацевтичні композиції згідно з винаходом являють собою, зокрема, водні розчини, які містять дальфопристин і хінупристин, — метан сульфокислоту або хлористоводневу кислоту в принаймні стехіометричній КІЛЬКОСТІ по відношенню до сумарної КІЛЬКОСТІ введених дальфопристина і хінупристина, — у разі необхідності надлишок метансульфокислоти або хлористоводневої кислоти для доведення рН розчину до інтервалу значень від 3,5 до 5, — за бажанням, ІЗОТОНІЧНИЙ агент і/або ІНШІ фармацевтичне прийнятні добавки, — відповідну воду у КІЛЬКОСТІ, необхідній для забезпечення потрібної концентрації розчину Одержані таким чином розчини мають перевагу, обумовлену їх стабільністю У ВІДПОВІДНОСТІ з іншим аспектом винаходу, розчини можуть бути люфілізовані з залученням звичайних методів після зниження температури і видалення води Під час ін'єкції люфілізати можуть бути розбавлені водою У ВІДПОВІДНОСТІ із ще одним аспектом винаходу розчини можуть бути заморожені Утому випадку, коли одержана композиція ліофілізована, вона може бути знову переведена у розчин в момент и використання у будь-якому придатному для ІН'ЄКЦІЙ І фармацевтичне прийнятному середовищі Переважно люфілізат розбавляють, наприклад, водою для одержання препарата, який вводять ІН'ЄКЦІЄЮ, або перфузійними розчинами (наприклад, хлоридом натрію або розчином глюкози) У випадку, коли розчин заморожено (наприклад, в заморожених контейнерах), його можна легко розморозити в момент застосування У другому альтернативному варіанті люфілізат також може бути переведений у розбавлений розчин (який переважно містить менше, ніж 20мг/мл активного начала) і зберігатися до моменту застосування Зрозуміло, що цей винахід може також застосовуватись і щодо інших розчинних похідних пристинаміцина Наприклад, він може застосовуватись до таких похідних, які описані в Європейських патентах ЕР 133097, ЕР 191662 і ЕР 248703 Концентрація активного начала хінупристин/дальфопристин в стабілізованих фармацевтичних композиціях цього винаходу складає переважно від 5 до 250мг/мл, або, у випадку люфілізата, в пропорціях від 5 до 95%, переважно від 20 до 90% Однак зрозуміло, що можуть бути виготовлені і використані у КЛІНІЦІ І менш концентровані стабілізовані фармацевтичні композиції Останні також входять до обсягів цього винаходу КІЛЬКІСТЬ КИСЛОТИ знаходиться у залежності від КІЛЬКОСТІ дальфопристина і хінупристина Вона визначається необхідністю наявності кислоти принаймні у стехіометричних співвідношеннях і одержання розчину з величиною рН у межах від 3,5 до 5 У ВІДПОВІДНОСТІ з переважним аспектом цього винаходу рН початкового розчину знаходиться у межах від 3,5 до 4,5, переважно 3,5 6 У ВІДПОВІДНОСТІ з іншим аспектом винаходу, якому слід віддати перевагу, у випадку люфілізованої композиції рН розчину, який люфілізують, знаходиться у межах від 4,5 до 5 У тому випадку, коли стабілізовані фармацевтичні композиції цього винаходу містять фармацевтичне прийнятну добавку, остання може, зокрема, відноситись до числа співрозчинників, стабілізаторів, крюпротекторів, вологопоглинаючих агентів, наповнювачів та ІЗОТОНІЧНИХ агентів Як не обмежуючі приклади співрозчинників і солюбілізуючих агентів можна назвати поліетиленГЛІКОЛІ (ПЕГ 300 і 400), пропіленгліколь, етанол і такі поверхнево-активні речовини, як, наприклад, полісорбат 80 або полюксиетиленовані ПОХІДНІ (кремофори), як наповнювачі і крюпротектори можна назвати сполуки, вибрані, зокрема, із простих сахарів, (наприклад, глюкоза, манніт, фруктоза, сорбіт), дисахаридів (наприклад, сахароза, лактоза, трегалоза, мальтоза), або водорозчинні полімери (наприклад, декстрани, карбоксиметилцелюлоза, полівшілпірролідон або желатин), стабілізуючі агенти можна вибрати, зокрема, із антиоксидантів і т д , ІЗОТОНІЧНІ агенти можуть бути вибрані, зокрема, із глюкози, хлориду натрію, гліцерину, сорбіту, манніту, фруктози або декстранів 40 і 70 Якщо рН розчину підвищений (рН=5 або близько до 5) або коли хочуть приготувати концентрований розчин, перевагу віддають використанню ІЗОТОНІЧНОГО агента, який не є хлоридом натрію Стабілізовані фармацевтичні композиції згідно з винаходом більш конкретно призначені для парентерального введення Вони можуть також вводитись перорально, шляхом закапування в очі, через суглоби або шляхом місцевого нанесення на шкіру і слизисті поверхні Стабілізовані фармацевтичні композиції згідно з винаходом готують шляхом одночасного або послідовного розчинення у воді хінупристина, дальфопристина, метан сульфокислоти або хлористоводневої кислоти з наступним доведенням рН до величини від 3,5 до 5 і/або додавання ІЗОТОНІЧНОГО агента і/або додавання інших фармацевтично прийнятних добавок, або, у разі необхідності, шляхом люфілізацм і/або заморожування У ВІДПОВІДНОСТІ з переважним варіантом композиції згідно з винаходом готують шляхом розчинення хінупристинової компоненти, а потім дальфопристинової компоненти у воді, підкисленій метансульфокислотою або хлористоводневою кислотою, після чого, у разі необхідності, доводять рН до величини у межах від 3,5 до 5 і/або добавляють ІЗОТОНІЧНИЙ агент і/або ІНШІ фармацевтично прийнятні добавки У разі необхідності приготовані розчини люфілізують або заморожують Приготування розчину і його розливання проводять звичайно при температурі від 0°С до кімнатної температури, працюючи переважно при низькій температурі в залежності від тривалості приготування і рН розчину Зокрема, операції проводяться при температурі нижче 10°С Стабілізовані фармацевтичні композиції згідно з винаходом можуть бути при бажанні стерилізовані Для цього переважно використовують стерилізуючу фільтрацію Стабілізовані фармацевтичні композиції згідно 59376 з винаходом у рідкому, люфілізованому або замороженому стані мають оптимальну фізико-хімічну стабільність, яка забезпечує їх зберігання на протязі часу, достатнього для виготовлення з них придатних для зберігання і комерціалізації ЛІКІВ У ВІДПОВІДНОСТІ з переважаючим аспектом цього винаходу під стабілізованими фармацевтичними композиціями розуміють композиції, які не дають більше, ніж — 2,0% збільшення вмісту кожної з основних домішок, які є продуктами розкладу (А і В) після зберігання впродовж 24 МІСЯЦІВ при 4°С або 12 МІСЯЦІВ при 20°С у тому випадку, коли композиція являє собою люфілізат, — 2,0% збільшення вмісту кожної з основних домішок, які є продуктами розкладу (А і В) після зберігання впродовж 18 МІСЯЦІВ при температурі 0 до 6°С у тому випадку, коли композиція являє собою концентровані розчини до або після люфілізацм, — 2,0% збільшення вмісту кожної з цих основних домішок (А і В) після зберігання впродовж З МІСЯЦІВ при -20°С утому випадку, коли композиція знаходиться у замороженому стані, — 5,0% збільшення вмісту кожної з цих основних домішок (А і В) після зберігання впродовж 6 годин при кімнатній температурі або 72 години при 4°С у тому випадку, коли композиція являє собою приготовлені для перфузм розбавлені розчини Наступні приклади ілюструють цей винахід, не обмежуючи його обсягу Приклад 1 8 Готують 1л розчину хінупристин/дальфопристина (30/70) в концентрації 125мг/мл, переведених в сіль введенням метансульфокислоти (приблизно 16,7мг/мл) при рН 4,75 шляхом введення 810г води, для препарата, що вводиться ІН'ЄКЦІЄЮ, у стакані для розчинення, обладнаному охолоджуючім пристроєм Розчин охолоджують до температури від 0 до 6°С в процесі його приготування Добавляють 16,4г метансульфокислоти, а потім послідовно 37,5г хінупристина, який розчиняють при механічному перемішуванні, і 87,5г дальфопристина, який також розчиняють при механічному перемішуванні Значення рН розчину доводять до 4,75 за допомогою 1н розчину метансульфокислоти Розчин доповнюють 1 літром (1030г) води для одержання препарата, який вводиться ІН'ЄКЦІЄЮ Приготовлений розчин стерилізуюють шляхом стерилізуючої фільтрації (розмір пор фільтра 0,22 мкм) і розливають по флаконах (500мг суміші хінупристин/дальфопристин (30/70) на флакон), після чого люфілізують [заморожування температура від -ЗО до -50°С, швидкість заморожування приблизно 0,57хв, сублімація тиск 0,5бар, вторинне обезводнення тиск приблизно ЗОмкбар, температура 40°С] Якість І стабільність при зберіганні люфілізатів або відновленого розчину визначається за допомогою високоефективної рідинної хроматографії із зворотньою фазою (ВЕЖХ), яка дає можливість визначити вміст дальфопристина і хінупристина, а також вміст домішкових продуктів розкладу Результати хроматографічного аналізу ВЕЖХ Стаціонарна фаза Детектування Розміри колонки Температура колонки Рухома фаза А Рухома фаза В Градієнт Швидкість рухомої фази Силікагель з привитим октадецилсиланом, Lichrospher -100 RP-18,5MKM УФ зона, 254нм 125 х 4мм 40°С Фосфатний буфер, рН 2,9,, ,,, 80v Фосфатний буфер, рН 2,9 35v Ацетонітрил 65v Від 0% рухомої фази В до 66% рухомої фази В за 42,5хв , після чого повернення до 0% рухомої фази В за 1,5хв і повторне урівноважування впродовж 5хв 1,1 мл/хв Використаний метод хроматографічного аналізу (ВЕЖХ) дає можливість визначити вміст хінупрстина і дальфопристина з точністю до 2%, в той час як продукти розкладу визначаються з точністю приблизно 0,1% За допомогою описаного вище способу приготовлені два зразка люфілізованої композиції хінупристин/дальфопристина (30/70), які містять по 500мг активного начала (партія 1 а і 1 в) і вивчена їх стабільність при 4°С у процесі зберігання впродовж 2 років Результати дослідження на стабільність кожного із цих двох зразків демонструють хорошу здатність до збереження концентрації активних начал і незначний розклад, (див таблиці І і II) Розчини хінупристин/дальфопристина (30/70) приготовляють із люфілізатів, використовуючи для цього по 5,0мл 5%-ного розчину глюкози За цих умов стабільність одержаного таким чином концентрованого розчину (премікса), вивчена упродовж 60 хв , розцінюється як задовільна в широкому діапазоні відносно наступного розбавлення в перфузійній посудині (дивтаблицю III) За умов розбавлення, призначеного для використання у КЛІНІЦІ (500мг хінупристин/дальфопристина (30/70) в посудині з 250мл 5%-ного розчину глюкози), склад гарантує задовільну стабільність впродовж принаймні 72 годин при 4°С або 6 годин при 25°С (див таблиці IV і V) Результати вивчення стабільності впродовж 2 років 59376 10 Таблиця Вивчення стабільності зразка 1 а впродовж 24 міс при 4°С Зразок 1а Титр, мг/флакон Дальфопристин Хінупристин 0 міс 3 міс 6 МІС 9 міс 12 міс 18 міс 24 міс 350 149 347 146 343 343 149 345 145 358 153 342 144 1,0 0,5 0,2 0,5 0,3 1,0 0,6 0,1 0,5 0,2 0,9 0,4 0,1 0,4 0,1 0,9 0,6 0,1 0,4 0,2 1,0 0,6 0,1 0,5 0,1 0,8 0,5 0,1 0,3 0,1 147 % ДОМІШОК А В С D Е 1,0 0,7 0,2 0,5 Таблиця Вивчення стабільності зразка 1 b впродовж 24 міс при 4°С Зразок 1 b Титр, мг/флакон Дальфопристин Хінупристин 0 міс 6 МІС 9 міс 12 міс 18 міс 24 міс 349 148 340 343 146 343 142 340 143 340 142 1,0 0,5 0,2 0,4 0,1 0,8 0,8 0,4 0,1 0,4 0,2 0,9 0,6 0,2 0,4 0,2 0,9 0,4 0,1 0,4 0,2 0,8 0,5 0,2 0,3 0,1 144 % ДОМІШОК А В С D Е 0,6 0,2 0,4 Таблиця Результати вивчення стабільності концентрованого розчину, приготованого із люфілізатів (премікс) Прем і кс Титр, (% до 0 хв ) Дальфопристин Хінупристин Ох в 15хв ЗОхв 45хв бОхв 100,0 100,0 99,7 100,2 100,2 100,7 99,0 99,6 99,0 101,1 0,74 0,51 0,47 0,28 0,89 0,62 0,49 0,30 1,02 0,69 0,46 0,32 1,12 0,72 0,53 0,33 1,28 0,78 0,61 0,38 % ДОМІШОК А В D Сума інших домішок Результати вивчення стабільності розчинів для перфузії Три зразка люфілізатів, приготовані описаним вище способом (зразки 1с, 1d, 1e), використовують для вивчення стабільності розчинів, які розбавляють в умовах КЛІНІКИ (500мг люфілізованої композиції хінупристин/дальфопристин (30/70), розбавленої 250мл 5%-ного розчину глюкози) Таблиця IV Стабільність розбавлених для перфузії розчинів впродовж 72 год при 4°С Випробувані зразки (мг/250 мл) Дальфопристин Хінупристин Огод Зразок 1с 72г при 4°С Огод Зразок1d 72г при 4°С Огод Зразок1е 72г при 4°С 313 135 297 127 314 134 301 129 318 136 306 131 1,5 0,7 0,2 0,3 0,3 4,2 0,9 0,3 0,4 0,3 1,1 0,6 0,1 0,4 0,2 4,1 0,8 0,3 0,5 0,2 1,6 0,8 0,2 0,4 0,6 4,5 1,0 0,3 0,4 0,3 % ДОМІШОК А В С D Е 11 59376 12 Таблиця V Стабільність розбавлених для перфузії розчинів впродовж 6 год при кімнатній температурі Випробувані зразки (мг/250 мл) Дальфопристин Хінупристин Зразок 1с 6г при кім темОгод рі Зразок1d Зразок1е Огод 6г при кім тем-рі Огод 6г при кім тем-рі 314 134 304 132 321 137 311 136 319 137 313 136 1,3 0,7 0,2 0,2 0,3 4,5 0,8 0,5 0,3 0,3 1,1 0,6 0,2 0,3 0,2 4,2 0,7 0,4 0,4 0,2 1,7 0,6 0,2 0,2 0,3 4,7 0,7 0,5 0,3 0,3 % ДОМІШОК А В С D Е Приклад 2 Готують розчини хгнупристин/дальфопристин (30/70) в концентрації 125мг/мл з рН 4,50, переведених в сіль хлористоводневою кислотою або метансульфокислотою згідно з такою методикою 350г води для одержання препарату для ін'єкції вводять в стакан для розчинення При кімнатній температурі і механічному перемішуванні диспергують у воді 30г хінупристина Додають 1н розчин метансульфокислоти або хлористоводневої киислоти до розчинення і досягнення рН 4,50 Після цього при механічному перемішуванні диспергують у воді 70,0г дальфопристина Додають 1н Розчин метансульфокислоти або хлористоводневої кислоти до розчинення і встановлення рН 4,50 Після ЦЬОГО суміш гомогенізують впродовж Юхв До розчину додають ще 0,8л (824г) води, призначеної для препарату, що вводять ІН'ЄКЦІЄЮ Люфілізація одержаного розчину згідно з методикою, наведеною у прикладі 1, дає можливість одержати люфілізати з задовільною при зберіганні стабільністю Вивчення стабільності в процесі зберігання при 4°С і при кімнатній температурі (кт) підтверджує хорошу стабільність одержаних композицій (див таблиці VI і VII) Таблиця VI Стабільність ліофілізатів на основі метансульфокислоти впродовж 1 року при 4°С і при кімнатній температурі Метан сульфокислота титр, мг/флакон Дальфопристин Хінупристин 0 міс 12 міс 9 міс 6 МІС 4°С кт 4°С кт 4°С кт 332 322 299 328 319 324 310 143 150 135 149 145 146 143 3,7 1,9 0,3 1,4 4,0 1,7 0,5 1,4 3,9 1,7 0,9 1,5 3,4 1,6 0,3 1,2 3,3 2,2 0,3 1,2 4,3 1,9 0,3 1,4 4,4 2,8 0,3 1,4 % ДОМІШОК А В С D Таблиця VII Стабільність ліофілізатів на основі хлористоводневої кислоти впродовж 6 МІСЯЦІВ при 4°С і при кімнатній температурі Хлористоводнева кислота Титр, мг/флакон Дальфопристин Хінупристин % домішок А В С D 0 міс 6 МІС 4°С 327 156 1,7 1,6 0,3 0,9 Приклад З Готують, як в прикладах 1 і 2, розчини, призначені ВІДПОВІДНО для люфілізацм або заморожу кт 333 150 1,6 1,6 0,2 0,4 313 145 1,4 2,4 0,2 0,4 вання, з концентрацією 125мг/мл хінупристин/дальфопристина (30/70) при різних рН шляхом додавання змінних кількостей 1н метансульфоки 59376 14 13 слоти Величину рН розчинів для люфілізацм чал, як описано у прикладі 1, але в об'ємі 600мл, встановлюють в діапазоні від 4,5 до 4,8, а для зашляхом введення 150мл води і 35-50мл 1н розчиморожування — в діапазоні від 3,5 до 4,5 ну метансульфокислоти перед диспергуванням активних начал) демонструє оптимальну стабільВивчення стабільності зразків ліофілізатів ність впродовж 4 років (див таблицю VIII) (приготованих в умовах розчинення активних наТаблиця VIII Стабільність ліофілізатів в інтервалі рН 4,3-4,8 впродовж 4 років при 4°С Зразок За рН=4,3 4 роки То 4°С Титр, мг/флакон Хінупристин Дальфопристин Зразок ЗЬ рН=4,5 4 роки То 4°С Зразок Зс* рН=4,7 4 роки То 4°С Зразок 3d рН=4,8 4 роки То 4°С 175 148 159 154 152 153 159 149 384 291 343 313 331 321 351 328 % ДОМІШОК А В С D * зразок приготований прикладі 5) 0,6 0,5 0,6 0,8 0,8 1,0 3,3 0,8 2,1 0,9 0,5 0,5 0,4 0,4 0,4 0,8 0,7 0,9 0,6 0,7 з доведенням рН шляхом додавання 6,5мл 0,5н 0,9 1,1 1,1 1,2 1,0 1,1 0,4 0,3 0,5 0,6 0,8 0,5 NaOH (в умовах, описаних у Таблиця IX Стабільність призначених для заморожування розчинів у процесі приготування в умовах прикладу 2 (аналіз здійснено після розчинення активних начал, після фільтрації і перед заморожуванням) Титр, мг/4мм Хінупристин Дальфопристин Розчин рН 3,5 зразок Зе (2) (3) (1) Розчин рН 4,0 зразок 3f (2) (3) (1) Розчин рН 4,5 зразок Зд (2) (3) (1) 147 148 152 147 153 148 144 136 144 339 328 335 320 336 331 334 313 334 2,0 1,6 0,4 1,0 2,6 1,0 0,2 1,4 3,3 1,5 0,4 1,4 3,6 1,7 0,2 1,4 % ДОМІШОК А В С D (1) після розчинення, 2,0 1,9 0,9 1,1 0,3 0,3 0,9 1,0 (2) після фільтрації, 2,0 1,8 1,8 1,3 1,0 1,0 0,3 0,3 0,4 1,1 1,1 1,0 (3) перед заморожуванням Приклад 4 Готують, як у прикладі 1, розчини хінупристин/дальфопристина (30/70) з рН 4,75 у різних концентраціях від 125 до 250мг/мл Ці розчини використовують для одержання ліофілізатів масою 500мг Найбільш концентровані розчини (200 і 250мг/мл) потребують найбільше часу для приго тування із-за часу розчинення дальфопристина і тривалості доведення рН Дослідження показують, що профілі розкладу в процесі приготування не змінюються, за винятком часу розчинення ліофілізатів, який збільшується із збільшенням концентрації розчину (див таблицю X) Таблиця X Профіль розкладу розчинів у процесі приготування (після фільтрації і люфілізації) Зраз 4а 125мг/мл (2) (1) Зраз 4Ь 143мг/мл (2) (1) Зраз 4с 167мг/мл (2) (1) Зра з 4d 200м г/мл (2) (1) Зраз 4е 250м г/мл О) (2) % ДОМІШОК А В С D Сума відомих домішок Сума невідомих домішок 1,10 0,78 0,26 0,52 2,66 2,38 0,99 0,83 0,25 0,55 2,62 2,37 0,66 0,61 0,24 0,58 2,09 2,18 1,13 0,92 0,28 0,60 2,93 2,22 0,58 0,58 0,24 0,58 1,98 2,27 0,74 0,72 0,29 0,62 2,37 2,44 0,54 0,65 0,25 0,54 1,98 2,29 0,58 0,76 0,26 0,62 2,22 2,13 0,38 0,52 0,24 0,49 1,63 2,24 0,56 0,80 0,24 0,51 2,11 2,09 Загальна КІЛЬКІСТЬ ДОМІ 5,04 4,99 4,27 5,15 4,25 4,81 4,27 4,35 3,87 4,20 ШОК 15 59376 16 Продовження таблиці X Розчинення Тривалість розчинення 40с 50с в 4мл 5%-ноі глюкози рН відновленого розчи4,54 4,56 ну в 4мл 5%-ноі глюкози (1) розчин після фільтрації, (2) люфілізат (12 год ) Приклад 5 Готують, як у прикладі 1, розчини хінупристин/дальфопристина (30/70) в концентрації 125мг/мл, в яких доведення рН до 4,5 проводилось 50с 2хв 30с Зхв 4,56 4,55 4,44 різними кількостями 1н метан сульфокислоти (від 1 до 9 мл/л і 0,5н розчину гідроксиду натрію (від 0 до 15мл/л) Таблиця XI Умови доведення рН (на 1л розчину) Зраз 5а Початкова КІЛЬКІСТЬ ме тансульфокислоти, г/л Доведення рН Додавання 1н Метансульфокислоти, мл/л Додавання 0,5н NaOH, мл/л Зраз 5Ь Зраз 5с Зраз 5d Зраз 5е Зраз 5f 16,36 16,36 16,36 16,36 16,36 16,36 1,0 2,0 4,0 4,4 8,0 9,0 0 0 7,0 6,2 15,0 14,0 Стабільність приготованих розчинів (вивчена при 3°С впродовж 20 год ) не виявляє залежності від умов доведення рН Таблиця XII Стабільність одержаних ліофілізатів Зра: 5Ь 4 міс 4°С тин Дальфопристин 30°С 154,4 153,5 153,6 156,5 361,4 364,4 358,9 0,73 0,45 0,14 0,35 0,15 0,88 0,77 0,22 0,45 0,19 Зра 4 міс 3 міс 30°С 0,88 0,51 0,23 0,40 0,16 Титр м г/б мл Хшуприс 1 МІС з, 5а 1 МІС 4°С 30°С 152,8 153,3 151,4 150,8 354,8 358,7 359,6 353,2 0,81 0,91 0,27 0,46 0,17 0,83 0,49 0,26 0,34 0,16 0,76 0,53 0,20 0,34 0,15 0,85 0,86 0,29 0,39 0,17 Зраз, 5f 4 міс 1 MIC 3 міс Зміс 30°С 4°С 30°с 30°С 146,3 146,2 144,1 143,0 345,7 345,9 347,1 340,7 336,4 0,78 0,98 0,26 0,40 0,16 1,00 0,60 0,24 0,39 0,21 0,91 0,58 0,17 0,33 0,19 1,01 0,84 0,22 0,33 0,22 0,96 0,98 0,25 0,39 0,21 ДОМІШОК А В С D Е Приклад 6 Готують заморожені розчини хінупристин/дальфопристина (30/70), переведених в сіль метансульфокислотою або хлористоводневою кислотою, в діапазоні концентрацій від 5 до 20мг/мл і з рН від 3,5 до 5,0 і в присутності ІЗОТОНІ ЧНИХ агентів, таких як NaCI і глюкоза Стабільність розчинів при зберіганні у замороженому стані була визнана задовільною (а) 800г води, призначеної для препарату, що вводиться ІН'ЄКЦІЄЮ, ВВОДЯТЬ у стакан для розчи нення, обладнаний охолоджуючим пристроєм Розчин охолоджують до температури від 0 до 6°С в процесі його приготування Додають 98% КІЛЬКОСТІ метансульфокислоти, необхідної для розчинення і встановлення рН Вводять 1,5г хінупристина, який розчиняють при механічному перемішуванні, потім вводять 3,5г дальфопристина, який також розчиняють при механічному перемішуванні Розчин ізотонізують додаванням глюкози Доводять рН розчину до 5,0 додаванням 0,1 н розчину метансульфокислоти Розчин доповнюють Ілітром води, призначеної для препарата, що вводиться ІН'ЄКЦІЄЮ 17 59376 Таблиця XIII Стабільність зразка, приготованого способом (а), 18 натрію, доводячи рН до 3,5 за допомогою 0,1 н розчину метансульфокислоти Після цього розчин доповнюють 1 літром води, призначеної для препарата, що вводиться ІН'ЄКЦІЄЮ впродовж 3 МІСЯЦІВ при -22°С Таблиця XV То Титр, мг/мл Дальфопристин Хінупристин 3 міс 3,37 1,41 3,38 1,37 2,42 0,32 0,18 0,32 2,55 0,37 0,29 0,37 0,12 Стабільність зразка, приготованого способом (в), впродовж 3 МІСЯЦІВ при -22°С То % ДОМІШОК А В С D Е (б) Повторюють описані вище операції за винятком того, що вводять 6г хінупристина і 14г дальфопристина Значення рН розчину доводять до 3,5 за допомогою 0,1н розчину метансульфокислоти Після ЦЬОГО розчин доповнюють 1 літром води, призначеної для препарата, що вводиться ІН'ЄКЦІЄЮ Титр, мг/мл Дальфопристин Хінупристин 3 міс 3,57 1,42 3,90 1,57 0,25 0,20 0,21 0,30 2,56 0,21 0,15 0,35 % ДОМІШОК А В С D (г) Повторюють описані в пункті (в) операції за винятком того, що доводять рН до 5,0 за допомогою 0,1н розчину хлористоводневої кислоти Після цього розчин доповнюють 1 літром води, призначеної для препарата, що вводиться ІН'ЄКЦІЄЮ Таблиця XIV Таблиця XVI Стабільність зразка, приготованого способом (б), Стабільність зразка, приготованого способом (г), впродовж 3 МІСЯЦІВ при -22°С впродовж 3 МІСЯЦІВ при -22°С То Титр, мг/мл Дальфопристин Хінупристин 3 міс 14,0 16,8 5,5 6,6 0,29 0,26 0,27 0,31 0,74 0,30 0,28 0,40 % ДОМІШОК А В С D То Титр, мг/мл Дальфопристин Хінупристин 3 міс 3,41 1,45 3,89 1,63 2,77 0,32 0,21 0,32 2,64 0,35 0,15 0,37 % ДОМІШОК А В С D (в) Повторюють описані в пункті (а) операції за винятком того, що розчин ізотонізують хлоридом Комп'ютерна верстка Н Кураєва Підписано до друку 06 10 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюStabilized pharmaceutical composition with quinopristine and dalfopristine and method for its production
Назва патенту російськоюСтабилизированная фармацевтическая композиция на основе хинопристина и дальфопристина и способ ее получения
МПК / Мітки
МПК: A61K 31/42, A61K 31/44, A61K 47/02
Мітки: спосіб, основі, дальфопристину, фармацевтична, одержання, хінупристину, композиція, стабілізована
Код посилання
<a href="https://ua.patents.su/9-59376-stabilizovana-farmacevtichna-kompoziciya-na-osnovi-khinupristinu-ta-dalfopristinu-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Стабілізована фармацевтична композиція на основі хінупристину та дальфопристину та спосіб її одержання</a>
Попередній патент: Суміш для гідроксилювання, спосіб гідроксилювання ароматичних сполук та спосіб одержання фенолу
Наступний патент: Стріловий гідравлічний кран
Випадковий патент: Фармацевтична композиція на основі продуктів бджільництва для місцевого лікування виразки шлунка та дванадцятипалої кишки