Спосіб збільшення кількості невластивих жирних кислот в рослинному матеріалі
Номер патенту: 113834
Опубліковано: 27.03.2017
Автори: Шанклін Джон, Нгуйєн Там Хуу, Підковіч Марк С., Уіттл Едвард Дж., Уолш Теренс А.
Формула / Реферат
1. Спосіб збільшення кількості невластивих жирних кислот в рослинному матеріалі, причому спосіб включає:
трансформацію рослинного матеріалу, що містить LnΔ9 або AnΔ9 десатуразу з молекулою нуклеїнової кислоти, що містить функціональний в рослині промотор, функціонально зв'язаний з полінуклеотидом, що кодує Δ9 десатуразний фермент, що включає амінокислотну послідовність, щонайменше на 80 % ідентичну послідовності SEQ ID NO: 2, де полінуклеотид містить нуклеотидну послідовність, яка щонайменше на 60 % ідентична послідовності SEQ ID NO: 1,
з тим, щоб кількість невластивих жирних кислот у вказаному рослинному матеріалі збільшувалася.
2. Спосіб за п. 1, де рослинний матеріал включає додатковий засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі.
3. Спосіб за п. 2, де засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою пригнічення KASII.
4. Спосіб за п. 3, де пригнічення KASII забезпечується мутантним геном fab1.
5. Спосіб за п. 2, де засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою зниження елонгації жирних кислот 16:0 в рослинному матеріалі.
6. Спосіб за п. 5, де зниження елонгації жирних кислот 16:0 в рослинному матеріалі забезпечується мутантним геном fae1.
7. Спосіб за п. 1, де рослинний матеріал отримують з рослини, вибраної з роду, вибраного з групи, що включає Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, ріпак, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale або інших представників Gramineae.
8. Спосіб за п. 1, де рослинний матеріал включає два додаткові засоби підвищення рівнів 16:0-АПБ в рослинному матеріалі.
9. Спосіб за п. 8, де перший засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою пригнічення KASII і де другий засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою зниження елонгації жирних кислот 16:0 в рослинному матеріалі.
10. Спосіб за п. 1, причому спосіб додатково включає культивування трансформованого рослинного матеріалу з отриманням рослини.
11. Спосіб за п. 10, де рослина вибрана з роду, вибраного з групи, що включає Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, ріпак, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale або інших представників Gramineae.
12. Спосіб за п. 1, де полінуклеотид, що кодує ∆9 десатуразний фермент, щонайменше на 80 % ідентичний послідовності SEQ ID NO:1.
13. Спосіб за п. 1, де функціональний в рослині промотор являє собою промотор фазеоліну або промотор LTP170.
14. Рослинний матеріал, який включає:
LnΔ9 або AnΔ9 десатуразу; і
молекулу нуклеїнової кислоти, що містить функціональний в рослині промотор, функціонально зв'язаний з полінуклеотидом, що кодує Δ9 десатуразний фермент, що включає амінокислотну послідовність, щонайменше на 80 % ідентичну послідовності SEQ ID NO: 2, де полінуклеотид містить нуклеотидну послідовність, яка щонайменше на 60 % ідентична послідовності SEQ ID NO: 1.
15. Рослинний матеріал за п. 14, де рослинний матеріал являє собою цілу рослину.
16. Рослинний матеріал за п. 15, де рослинний матеріал являє собою насіння.
Текст
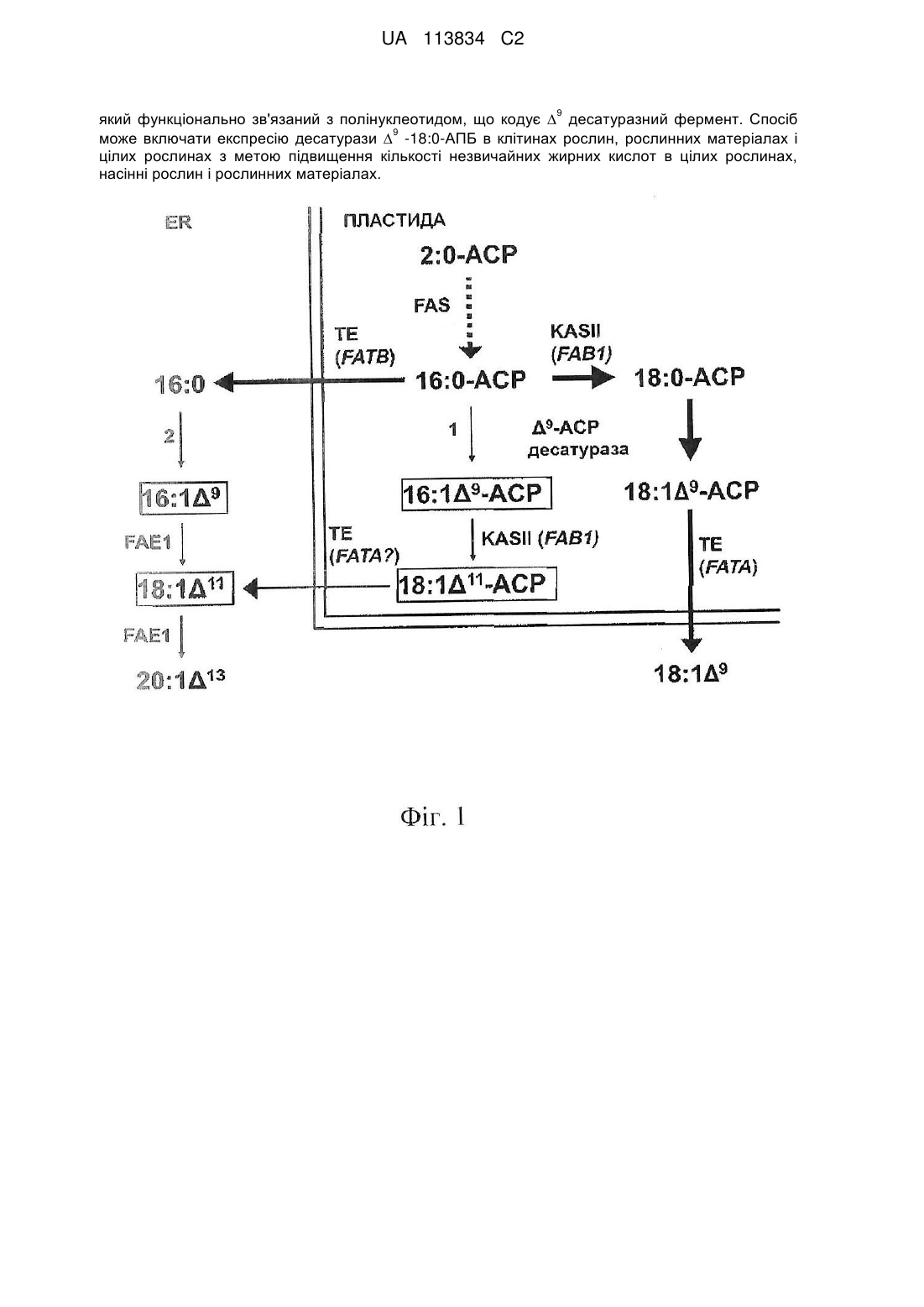
Реферат: Винахід належить до способу збільшення кількості незвичайних жирних кислот в рослинному матеріалі, причому спосіб включає трансформацію рослинного матеріалу, що включає LnΔ9D або AnΔ9 десатуразу молекулою нуклеїнової кислоти, що включає регуляторний елемент гена, UA 113834 C2 (12) UA 113834 C2 9 який функціонально зв'язаний з полінуклеотидом, що кодує ∆ десатуразний фермент. Спосіб 9 може включати експресію десатурази -18:0-АПБ в клітинах рослин, рослинних матеріалах і цілих рослинах з метою підвищення кількості незвичайних жирних кислот в цілих рослинах, насінні рослин і рослинних матеріалах. UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вимога пріоритету По даній заявці вимагається пріоритет дати подачі попередньої патентної заявки Сполучених Штатів з порядковим номером 61/358318, зареєстрованої 24 червня 2010 р. як «Акумуляція N-7 жирних кислот в насінні рослин». Галузь техніки, до якої належить винахід 9 У конкретних варіантах здійснення винахід стосується нової мутантної десатурази ∆ -18:09 АПБ Ricinus, що позначається Com25, яка працює як десатураза ∆ -16:0-АПБ. Інший варіант здійснення стосується способів метаболічного конструювання для маніпулювання точками метаболічного переходу у рослин, наприклад, для перенаправлення вуглецю в -7 жирні кислоти. У певних варіантах здійснення винахід стосується способів експресії Com25 як частини стратегії метаболічного конструювання, так що вуглець перенаправляється в -7 жирні кислоти в насінні рослин. Відомий рівень техніки Було підраховано, що в природі може існувати понад 1000 структур жирних кислот. Millar et al., (2000) Trends Plant Sci 5(3):95-101. Багато з цих жирних кислот синтезуються шляхом дериватизації жирних кислот за допомогою набору варіантів прототипних десатураз. Першою з цих варіантів десатураз, що піддавалася виділенню, була олеатгідроксилаза Ricinus з ендосперма рицини, фермент, що відповідає за синтез рицинолевої кислоти. Van de Loo et al., (1995) Proc. Natl. Acad. Sci. USA 92(15):6743-6747. За цим йшли гени, що кодують лінолеатепоксидазу Vernonia і олеатацетиленазу Crepis. Lee et al., (1998) Science 280(5365):915-18. Виділення цих генів привело до уявлення про те, що їх гетерологічна експресія в олійних рослинах може полегшити акумуляцію відповідних незвичайних жирних кислот. Broun et al., (1997) Plant Journal 13:201-10. Однак результуюча акумуляція незвичайних жирних кислот була постійно нижчою, ніж та, що виявляється в природному рослинному джерелі, з якого був виділений ген. Napier, J.A. (2007) Annu. Rev. Plant Biol. 58:295-319. Профілі специфічної активності варіантів десатуразних ферментів, які були виділені з тканин, що акумулюють незвичайні жирні кислоти, узгоджуються з їх роллю в продукції відповідних незвичайних жирних кислот. Однак вони виявляють дуже слабку специфічну активність в порівнянні з усіма десатуразами стеароїл-АПБ, описаними до теперішнього часу, і, як доведено, є неефективними при отриманні змінених фенотипів жирних кислот при гетерологічній експресії. Cahoon et al., (1994) Prog. Lipid Res. 33: 155-63. Наприклад, специфічна для насіння експресія гідроксилази рицини під контролем сильного специфічного для насіння промотору в модельній рослині Arabidopsis приводила до акумуляції тільки приблизно 17% рицинолевої кислоти, дуже малої в порівнянні з приблизно 90%, що виявляються в насінні рицини. Broun and Somerville (1997) Plant Physiol. 113:933-42. Схоже повідомлялося про невтішні результати для епокси- і ацетиленової жирних кислот, які, як показано, акумулювалися в кількості від 15 до 25% відповідно при гетерологічній експресії епоксигенази і ацетиленази в Arabidopsis. Lee et al., (1998) Science 280(5365):915-18. В доповнення до показаної низької активності варіанти десатураз мали тенденцію утворювати нерозчинні агрегати при очищенні. Низька стабільність і погані швидкості каталітичної активності є властивостями, що виявляються багатьма недавно еволюціонуючими ферментами, які виникли в результаті подій дуплікації генів, в яких селекція на стабільність і/або оновлення розблокована, тоді як мутації акумулюються, що в кінцевому результаті веде до зміни функції. Govindarajan and Goldstein (1998) Proc. Natl. Acad. Sci. USA 95:5545-49; Goldstein (2001) in Protein Folding, Evolution and Design (Broglia, R. A., Shakhnovich, E. I., and Tiana, G., eds) CXLIV Vols., I.O.S. Press, Amsterdam. Було висунуто багато можливих пояснень низьких рівнів акумуляції цільових жирних кислот. Napier, J.A. (2007) Annu. Rev. Plant Biol. 58:295-319. Є підстава вважати, що спеціальні ферменти можуть відіграти ключову роль у включенні незвичайної жирної кислоти в триацилгліцериди. Наприклад, акумуляція лаурату в насінні трансгенної Brassica napus підвищувалася від 50% до 60% при коекспресії ацилтрансферази лізофосфатидної кислоти кокоса спільно з тіоестеразою середніх ланцюгів каліфорнійського лавра. Knutzon et al., (1999) Plant Physiol. 120(3):739-46. Недавно було показано, що коекспресія ацил-коензим А:діацилгліцеролацилтрансферази типу 2 (RcDGAT2) спільно з гідроксилазою рицини підвищувала акумуляцію рицинолевої кислоти з приблизно 17% до приблизно 30%. Burgal et al., (2008) Plant Biotechnol. J.6(8):819-31. Досі не була описана акумуляція високих рівнів незвичайних жирних кислот в трансгенних рослинах, еквівалентна акумуляції, що виявляється в природних видах. Оскільки незвичайні жирні кислоти досить бажані для різноманітних видів виробництва і типів застосування, існує необхідність в вищій експресії незвичайних жирних кислот в трансгенних рослинах, що створюються для їх продукції. 1 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розкриття винаходу У даному описі розкриваються нуклеотидні послідовності, що кодують новий варіант десатурази, що позначається Com25, і її амінокислотна послідовність. Розкриваються також способи експресії Com25 в рослинній клітині для отримання переваги 9 в підвищенні активності ферменту десатурази Com25 відносно WT десатурази ∆ -18:0 рицини, так що процентний склад незвичайних жирних кислот в насінні рослини підвищується. У деяких варіантах здійснення способи включають експресію Com25 в Arabidopsis. У певних варіантах здійснення незвичайні жирні кислоти, підвищені в насінні рослини, являють собою -7 жирні 19 кислоти. У цих варіантах здійснення -7 жирні кислоти можуть являти собою 16:1∆ і/або 11 18:1∆ . Пропонуються також способи експресії Com25 в рослинній клітині, де рослинна клітина характеризується погіршеною елонгацією жирних кислот в пластидах і поза пластидами, так що процентний склад незвичайних жирних кислот в насінні рослини підвищується. У деяких варіантах здійснення способи включають експресію Com25 в Arabidopsis. У певних варіантах здійснення незвичайні жирні кислоти, підвищені в насінні рослини, являють собою -7 жирні 19 кислоти. У цих варіантах здійснення -7 жирні кислоти можуть являти собою 16:1∆ і/або 11 18:1∆ . Пропонуються додаткові способи експресії Com25 в рослинній клітині, в яких в рослинній клітині інгібується KASII так, що процентний склад незвичайних жирних кислот в насінні рослини підвищується. У деяких варіантах здійснення способи включають експресію Com25 в Arabidopsis. У певних варіантах здійснення незвичайні жирні кислоти, підвищені в насінні рослини, являють собою -7 жирні кислоти. У цих варіантах здійснення -7 жирні кислоти 19 11 можуть являти собою 16:1∆ і/або 18:1∆ . Пропонуються також способи експресії Com25 в рослинній клітині, в яких в рослинній клітині інгібуються KASII і елонгація жирних кислот в пластидах і поза пластидами, так що процентний склад незвичайних жирних кислот в насінні рослини підвищується. У деяких варіантах здійснення способи включають експресію Com25 в Arabidopsis. У певних варіантах здійснення незвичайні жирні кислоти, підвищені в насінні рослини, являють собою -7 жирні кислоти. У цих 19 11 варіантах здійснення -7 жирні кислоти можуть являти собою 16:1∆ і/або 18:1∆ . Вказані вище і інші особливості повинні стати більш зрозумілими з подальшого докладного опису деяких варіантів здійснення, який представлений з посиланням на супроводжуючі фігури. Короткий опис фігур На фіг. 1 схематично зображений синтез жирних кислот і їх модифікація в пластиді і ендоплазматичному ретикулумі Arabidopsis. Вказані реакції, опосередковані десатуразами 16:0: 9 9 9 1: десатураза Δ -16:0-АПБ; 2: позапластидна десатураза Δ -16:0-АПБ. -7 РК, тобто 16:1 ∆ і/або 11 18:1 ∆ взяті в прямокутники. На фіг. 2 зображене ілюстративне розділення за допомогою газової хроматографії FAMEs при експресії Com25 в Arabidopsis з різним генетичним фоном. Панелі А і В, WT; С і D, fab1; Е і V, fab1/fae1. Панелі А, С і Е, нетрансформовані; У, D і F, трансформовані Phas:Com25. Вказані 9 9 11 11 піки FAME: 16:0 (1), 16:1∆ (2), 16:2 (3), 18:0 (4), 18:1 ∆ (5), 18:1∆ (6), 18:2 (7), 20:0 (8), 20:1∆ 11 13 (6), 18:2 (7), 20:0 (8), 20:1∆ (9), 18:3+20:1∆ (10) і 22:1 (11). На фіг. 3 показані відношення між 16:0 в насінні хазяїна і акумуляцією -7 (у вигляді мол. процента). На фіг. 4 зображене ілюстративне розділення за допомогою газової хроматографії FAMEs при експресії Com25 в Arabidopsis з різним генетичним фоном. Панель А: кращі трансформовані лінії fab1/fae1, Phas:Com25, Fab1-HPAS, An∆9DS, Ln∆9DS; панель В: насіння Doxantha. Позначення піків описані на фіг. 2. На фіг. 5 представлена схематична організація елементів ДНК в конкретних варіантах здійснення конструкта за винаходом. Спосіб(и) здійснення винаходу I. Огляд деяких варіантів здійснення 9 У даному описі розкриваються молекули нуклеїнової кислоти, що кодують ∆ десатуразний фермент, що включають нуклеотидну послідовність щонайменше на 60% ідентичну SEQ ID NO:1. Молекули нуклеїнової кислоти можуть додатково включати регуляторний елемент гена. У деяких варіантах здійснення регуляторний елемент гена може являти собою промотор фазеоліну. 9 Розкриваються також ферменти десатурази ∆ , що включають амінокислотну послідовність 9 щонайменше на 80% ідентичну SEQ ID NO:2. Ферменти десатурази ∆ за даним винаходом, у яких амінокислотна послідовність щонайменше на 80% ідентична SEQ ID NO:2, можуть додатково включати серин в положенні, аналогічному положенню 114 в SEQ ID NO: 2; аргінін в 2 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 положенні, аналогічному положенню 117 в SEQ ID NO: 2; цистеїн в положенні, аналогічному положенню 118 в SEQ ID NO: 2; лейцин в положенні, аналогічному положенню 179 в SEQ ID NO: 2; і/або треонін в положенні, аналогічному положенню 188 в SEQ ID NO: 2. 9 Молекули нуклеїнової кислоти і десатуразні ферменти ∆ за даним винаходом можуть експресуватися в рослинному матеріалі, клітинах, тканинах або в цілих рослинах для підвищення кількості незвичайних жирних кислот в рослинному матеріалі, клітинах, тканинах або в цілих рослинах відносно кількості, що виявляється в рослині дикого типу того ж виду. Альтернативні варіанти здійснення винаходу включають способи підвищення кількості незвичайних жирних кислот в рослинному матеріалі, клітинах, тканинах або в цілих рослинах, що включають трансформацію рослинного матеріалу, клітин, тканин або цілих рослин молекулою нуклеїнової кислоти з SEQ ID NO:1, так що кількість незвичайних жирних кислот у вказаних рослинному матеріалі, клітинах, тканинах або в цілих рослинах підвищується. У переважних варіантах здійснення рослинний матеріал, клітини, тканини або цілі рослини, які трансформуються за допомогою розкритих способів, додатково включають один або більше засобів підвищення рівнів 16:0-АПБ в рослинному матеріалі, клітинах, тканинах або в цілих рослинах. У певних варіантах здійснення засобу підвищення рівнів 16:0-АПБ в рослинному матеріалі, клітинах, тканинах або в цілих рослинах можуть являти собою: експресію позапластидної десатурази; придушення KASII, наприклад, шляхом введення мутації в ген fab1; і/або зниження елонгації 16:0 жирних кислот, наприклад, шляхом введення мутації в ген fae1. Розкриті в даному описі способи можуть бути здійснені, наприклад, на рослинах або рослинному матеріалі, що походять від рослин роду Arabidopsis. Конкретний варіант здійснення вироблений для способів створення або регенерації генетично модифікованої рослини, що включає підвищені кількості незвичайних жирних кислот в рослині в порівнянні з рослиною дикого типу того ж виду, що включають трансформацію рослинного матеріалу молекулою нуклеїнової кислоти з SEQ ID NO:1; і культивування трансформованого рослинного матеріалу для отримання рослини. Розкриваються також рослини, рослинні матеріали, рослинні клітини і насіння, що отримуються вказаними вище способами. II. Абревіатури Z x:y∆ Жирна кислота, що містить х вуглеців і у подвійних зв'язків в положенні z при розрахунку з карбоксильного кінця АПБ Ацилпереносний білок COA Коензим А KASII В-кетоацил-АПБ синтаза II РК Жирні кислоти FAS Синтез жирних кислот FAME Метиловий ефір жирної кислоти WT Дикий тип III. Терміни Жирна кислота: При застосуванні в даному описі термін «жирна кислота» стосується довголанцюжкових аліфатичних кислот (алканових кислот) з варіюючими довжинами ланцюгів від приблизно C12 до C22, хоча відомі кислоти як з довшими, так і з коротшими довжинами z ланцюгів. Структуру жирної кислоти представляють за допомогою позначень x:y∆ , де «х» являє собою сумарну кількість вуглецевих (С) атомів в конкретній жирній кислоті, а «у» являє собою кількість подвійних зв'язків у вуглецевому ланцюгу в положенні «z» при підрахунку з карбоксильного кінця кислоти. Незвичайна жирна кислота: У плані даного винаходу незвичайні жирні кислоти являють собою кислоти, чий синтез в природних системах ініціюється шляхом модифікації проміжного продукту FAS за допомогою варіанту десатуразного ферменту. Метаболічний шлях: Термін «метаболічний шлях» стосується серій хімічних реакцій, виникаючих в клітині, каталізованих ферментами, для досягнення або утворення метаболічного продукту, або ініціації іншого метаболічного шляху. Метаболічний шлях може включати декілька або багато стадій і може конкурувати з іншим метаболічним шляхом за специфічні субстрати реакцій. Схоже, продукт одного метаболічного шляху може являти собою субстрат іншого метаболічного шляху. Метаболічне конструювання: У плані даного винаходу «метаболічне конструювання» стосується конструктивної розробки стратегій зміни одного або більше метаболічних шляхів в клітині, так що поетапно досягається модифікація вихідної речовини в продукт, що має бажану точну хімічну структуру в межах загальної схеми всіх метаболічних шляхів, задіяних в клітині. Десатураза: При застосуванні в даному описі термін «десатураза» стосується поліпептиду, який може зменшувати насиченість (тобто вводити подвійний зв'язок) в одну або більше жирних 3 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислот з отриманням жирної кислоти, яка цікавить, або попередника. Розчинні рослинні ферменти десатурази жирних кислот вводять подвійний зв'язок регіоспецифічно в насичений ацил-АПБ субстрат. Реакція включає активацію молекулярного кисню за допомогою центра з відновленим двома електронами двовалентним залізом, який координований вузлом з чотирьох спіралей, що формує каркас структури десатурази. Особливий інтерес в даному описі 9 представляють десатурази ∆ . 9 Десатураза ∆ -18:01 необхідна для всіх рослин для підтримування текучості мембран. Нарівні з тим, що цей фермент насамперед знижує насиченість стеароїл-АПБ, він також в меншій мірі активний на пальмітоїл-АПБ. Варіант десатурази: При застосуванні в даному описі термін «варіант десатурази» охоплює ті десатурази, які виявляють профілі специфічної активності, які узгоджуються з їх роллю в продукції незвичайних жирних кислот. Варіант десатурази може бути виділений з організму або сконструйований за допомогою програми спрямованої еволюції. Рослина-нащадок: З метою даного винаходу «рослина-нащадок» стосується будь-якої рослини або отриманого з неї рослинного матеріалу, яка може бути отримана за допомогою методів селекції рослин. Методи селекції рослин добре відомі в даній галузі техніки і включають природну селекцію, штучну селекцію, вибіркову селекцію, що включає аналіз молекулярних маркерів ДНК, трансгенні методи і комерційну селекцію. Рослинний матеріал: При застосуванні в даному описі термін «рослинний матеріал» стосується будь-якої клітини або тканини, отриманої з рослини. Молекула нуклеїнової кислоти: Полімерна форма нуклеотидів, яка включає як смисловий, так і антисмисловий ланцюги РНК, кДНК, геномної ДНК і синтетичні форми, і змішані форми вказаного вище. Нуклеотид стосується рибонуклеотиду, дезоксинуклеотиду або модифікованої форми будь-якого типу нуклеотиду. При застосуванні в даному описі «молекула нуклеїнової кислоти» є синонімом «нуклеїнової кислоти» і «полінуклеотиду». Термін включає одно- і дволанцюжкову форми ДНК. Молекула нуклеїнової кислоти може включати будь-які природні і модифіковані нуклеотиди або обидва типи нуклеотидів, пов'язані один з одним природними і/або неприродними нуклеотидними зв'язками. Молекули нуклеїнової кислоти можуть бути модифіковані хімічно або біохімічно, або можуть містити неприродні або дериватизовані нуклеотидні основи, як повинно бути з легкістю зрозуміло фахівцями в даній галузі техніки. Такі модифікації включають, наприклад, промічування, метилування, заміну одного або більше природних нуклеотидів аналогом, міжнуклеотидні модифікації, такі як незаряджені зв'язки (наприклад, метилфосфонати, фосфотриефіри, фосфорамідати, карбамати і т. д.), заряджені зв'язки (наприклад, фосфоротіоати, фосфородитіоати і т. д.), звисаючі частини (наприклад, пептиди), інтеркалятори (наприклад, акридин, псорален і т. д.), хелатори, алкілуючі агенти і модифіковані зв'язки (наприклад, альфа-аномерні нуклеїнові кислоти і т. д.). Термін «молекула нуклеїнової кислоти» включає також будь-яку топологічну конформацію, включаючи одноланцюжкову, дволанцюжкову, частково дуплексну, триплексну, шпилькову, кругову конформації і конформацію висячого замка. Функціонально зв’язана: Перша послідовність нуклеїнової кислоти функціонально зв’язана з другою послідовністю нуклеїнової кислоти, коли перша послідовність нуклеїнової кислоти має функціональний зв'язок з другою послідовністю нуклеїнової кислоти. Наприклад, промотор функціонально зв’язаний з кодуючою послідовністю, якщо промотор впливає на транскрипцію або експресію кодуючої послідовності. При рекомбінантному отриманні функціонально зв’язані послідовності нуклеїнової кислоти звичайно є прилягаючими і при необхідності об'єднують дві кодуючі білок області в одній і тій же рамці зчитування. Однак для функціонального зв’язування нуклеїновим кислотам не обов'язково бути прилягаючими. Регуляторний елемент: При застосуванні в даному описі термін «регуляторний елемент» стосується молекули нуклеїнової кислоти, що має регуляторну активність відносно гена; тобто молекули, яка має здатність впливати на транскрипцію або трансляцію функціонально зв’язаної молекули нуклеїнової кислоти. Регуляторні елементи, такі як промотори, лідируючі послідовності, інтрони і області термінації транскрипції, являють собою некодуючі молекули нуклеїнової кислоти, що мають регуляторну активність відносно гена, які відіграють інтегративну роль в сумарній експресії гена в живих клітинах. Виділені регуляторні елементи, які функціонують в рослинах, є, отже, придатними для модифікації фенотипів рослин за допомогою методів молекулярної інженерії. Під «регуляторним елементом» маються на увазі послідовності нуклеотидів, які визначають, чи буде, коли і на якому рівні експресуватися конкретний ген. Регуляторні послідовності ДНК специфічно взаємодіють з регуляторними білками або з іншими білками. 4 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 При застосуванні в даному описі термін «регуляторна активність відносно гена» стосується молекули нуклеїнової кислоти, здатної впливати на транскрипцію або трансляцію функціонально зв’язаної молекули нуклеїнової кислоти. Виділена молекула нуклеїнової кислоти, що має регуляторну активність відносно гена, може забезпечити тимчасовою експресією або експресією, що залежить від місцеположення, або модулювати рівні і швидкості експресії функціонально зв’язаної молекули нуклеїнової кислоти. Виділена молекула нуклеїнової кислоти, що має регуляторну активність відносно гена, може включати промотор, інтрон, лідируючу послідовність або 3'-область термінації транскрипції. Промотори: При застосуванні в даному описі термін «промотор» стосується молекули нуклеїнової кислоти, яка залучена до пізнавання і зв’язування РНК-полімерази II або інших білків, таких як транскрипційні фактори (транс-діючі білкові фактори, які регулюють транскрипцію), для ініціації транскрипції функціонально зв’язаного гена. Самі промотори можуть містити субелементи, такі як цис-елементи або енхансерні домени, які впливають на транскрипцію функціонально зв’язаних генів. «Рослинний промотор» являє собою природний або неприродний промотор, який функціонує в рослинних клітинах. Рослинний промотор може використовуватися як 5'-регуляторний елемент для модуляції експресії функціонально зв’язаного гена або генів. Рослинні промотори можуть бути визначені по їх патерну експресії, що залежить від часу, місцеположення або стадій онтогенезу. Молекули нуклеїнової кислоти, описані в цьому документі, можуть включати послідовності нуклеїнової кислоти, що включають промотори. Ідентичність послідовностей: Схожість між двома послідовностями нуклеїнової кислоти або між двома амінокислотними послідовностями виражається в термінах ступеня ідентичності послідовностей, що є між послідовностями. Ідентичність послідовностей звичайно виражається у вигляді процента ідентичності; чим вищий цей процент, тим більш схожі дві послідовності. Способи вирівнювання послідовностей для їх порівняння детально описані нижче. Аналогічне положення в амінокислотній послідовності: Послідовності нуклеїнової кислоти і амінокислотні послідовності можуть бути вирівняні за допомогою методів, описаних в подальших параграфах. При вирівнюванні положення в одній послідовності є «аналогічним положенням» відносно положення у вирівнюваній послідовності, якщо положення є ідентичними в межах консенсусної послідовності. Методи вирівнювання послідовностей для порівняння добре відомі в даній галузі техніки. Різні програми і алгоритми вирівнювання описані в: Smith and Waterman, Adv. Appl. math. 2:482, 1981; Needleman and Wunsch, J. Mol. Biol. 48:443, 1970; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444, 1988; Higgins and Sharp, Gene 73:237-44, 1988; Higgins and Sharp, CABIOS 5:151-3, 1989; Corpet et al., Nucleic Acids Research 16:10881-10890, 1988; Huang, et al., Computer Applications in the Biosciences 8:155-65, 1992; Pearson et al., Methods in Molecular Biology 24:30731, 1994; Tatiana et al., FEMS Microbiol. Lett., 174:247-50, 1990. Altschul et al., J. Mol. Biol. 215:40310, 1990 (докладний розгляд методів вирівнювання послідовностей і розрахунків гомології). Програма Basic Local Alignment Search Tool (BLAST) національного центру біотехнологічної інформації (NCBI) доступна по Інтернету (сайт blast.ncbi.nlm.nih.gov/Blast.cgi) для використання в поєднанні з програмами аналізу послідовностей, наприклад, blastp і blastn. Опис того, як визначити ідентичність послідовностей з використанням цієї програми, доступний по Інтернету через NCBI на сайті blast.ncbi.nlm.nih.gov/Blast.cgi?CMD=Web&PAGE_TYPE=BlastDocs. Для порівняння амінокислотних послідовностей застосовується функція «Blast 2 sequences» програми BLAST (bl2seq) з використанням параметрів за умовчанням. Конкретні параметри можуть бути доведені в межах свободи дії фахівцем в даній галузі техніки, наприклад, для надання штрафу за відсутність збігу або винагороди за збіг. Трансформований: При застосуванні в даному описі термін «трансформований» стосується клітини, тканини, органу або організму, в які введена чужорідна молекула нуклеїнової кислоти, така як конструкт. Введена молекула нуклеїнової кислоти може бути інтегрована в геномну ДНК реципієнтних клітини, тканини, органу або організму, так що введена полінуклеотидна молекула успадковується подальшим поколінням. «Трансгенна» або «трансформована» клітина або організм також включає нащадків клітини або організму і потомство, отримане шляхом програми селекції, що застосовує таку трансгенну рослину як батьківська, наприклад, при схрещуванні, і що виявляє альтернативний фенотип в результаті присутності чужорідної молекули нуклеїнової кислоти. IV. Систематичні підходи до метаболічного конструювання для акумуляції незвичайних жирних кислот в клітині-, тканині- або організмі-хазяїні А. Загальні уявлення 5 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 Варіант здійснення винаходу включає систематичний підхід до метаболічного 9 конструювання -7 жирних кислот (РК), що складаються з пальмітолеїнової (16:1∆ ) і вакценової 11 (18:1∆ ) кислот, наприклад, в насінні рослин. Для ілюстрації методів переведення потоку знову синтезованих жирних кислот в пластидах, Com25, десатуразу 16:0-АПБ, отриману в результаті 9 програми направленої еволюції для збільшення 16:0-десатуразної активності десатурази ∆ 18:0 рицини, експресували під контролем специфічного для насіння промотору фазеоліну. У розкритих в цьому документі варіантах здійснення може бути використаний будь-який специфічний для насіння промотор. При цьому підході підвищувалася акумуляція -7 РК від менше ніж 2% в дикому типі до приблизно 14% в трансформантах Com25. У додаткових ілюстративних підходах експресія Com25 в подвійному мутанті fab1/fae1, у якого погіршена елонгація пластидних і позапластидних жирних кислот, відповідно, приводила до підвищення акумуляції -7 РК до приблизно 50%. Більше того, введення додаткового Com25 під контролем промотору LTP170 підвищувало акумуляцію -7 РК до приблизно 58%, що передбачає межу десатуразної активності, ймовірно в результаті подолання її низького коефіцієнта оборотності. Конструкт фазеолін:Com25 експресували в серіях генотинів, дефіцитних по KASII, і виявили вміст -7 РК, що підвищується пропорційно вмісту 16:0 до приблизно 30% з сумарною акумуляцією -7 РК до приблизно 55%. Цікаво, що трансгенні рослини, що акумулюють 56% -7 РК, все ще містили приблизно 19% 16:0, в два рази більше ніж в рослинах WT. Досліджували експресію позапластидних десатураз 16:0 для переведення потоку по 16:0 ен-шляху, що веде до триацилгліцериду. Спільна експресія пластидних і позапластидних десатураз паралельно з придушенням KASII у генотипу подвійного мутанта fab1/fae1 приводила до підвищеної акумуляції -7 РК від приблизно 2% у WT до приблизно 71% у найкращим чином сконструйованої лінії, що еквівалентно акумуляції, що виявляється в насінні Doxantha. -7 РК були вибрані як мішень, оскільки їх синтез в природних системах, подібних до систем для інших незвичайних РК, ініціюється шляхом модифікації проміжного продукту FAS варіантом десатуразного ферменту. Cahoon et al., (1997) Plant Mol. Biol. 33:1105-10; і Cahoon et al., (1998) Plant Physiol. 117(2):593-8. Крім того, 7 РК мають потенційні комерційні варіанти застосування як полімерна сировина для промисловості, оскільки мають фізичні властивості, схожі з природними ненасиченими жирними кислотами. Дослідження метаболічного конструювання були початі введенням раніше не описаної 9 десатурази, Com25, ∆ -16:0-ацилпереносного білка (АПБ) в рослинну модель Arabidopsis під контролем специфічного для насіння промотору. Досліджувалися підходи до переведення потоку вуглецю в сторону -7 РК за допомогою вибору мутантних генотипів, які містять підвищені рівні 16:0, і за допомогою спільної експресії конструктів, створених для переведення потоку вуглецю у бік жирної кислоти-мішені шляхом впливу на конкуренцію за субстрат. Експресували позапластидні десатуразні ферменти, щоб знизити насиченість залишкових 16:0 після експорту з пластиди. Спільна експресія пластидних і позапластидних десатураз паралельно з придушенням KASII в fab1/fae1 генотипі приводила до підвищеної акумуляції -7 РК до приблизно 71% в порівнянні з менше ніж 2% в WT, вищої, ніж що виявляється в Asclepias, і еквівалентній, що виявляється в насінні Doxantha. 16:0-АПБ, попередник -7 жирних кислот, знаходиться в першій точці гілкування шляху біосинтез жирних кислот, конкуруючи за тіоестеразу FatB і елонгазу KASII; і введення десатурази 16:0-АПБ робить цю конкуренцію тристоронньою. Придушення KASII і FATB створює ефективні шляхи для зниження конкуренції за субстрат і підвищення акумуляції -7 РК. Підвищення акумуляції -7 РК є насичуваним при приблизно 30% в лінії хазяїна, оскільки при перевищенні цього рівня десатураза не є лімітуючим фактором. Підвищення дози Com25 шляхом експресії другої копії під контролем специфічного для насіння промотору додатково підвищувало акумуляцію -7 жирних кислот. Однак насіння з високою акумуляцією -7 РК також містили рівні 16:0 в діапазоні приблизно 20%, надаючи можливість зниження насиченості позапластидних 16:0. Експресія двох позапластидних десатураз підвищувала акумуляцію -7 РК, приводячи приблизно до 50% зниження 16:0 в зрілому насінні. Як більш детально описано нижче, систематичне метаболічне конструювання може бути успішною стратегією для конструювання рівнів акумуляції незвичайних жирних кислот, порівнянних з рівнями, що виявляються в природних джерелах, оскільки найкращі лінії fab1/fae1/Com25/Ln∆9D і An∆9D акумулюють 71% -7 РК, суттєво вищі рівні, ніж в Asclepias і еквівалентні рівням, що виявляються в насінні Doxantha. В. Нуклеїнові кислоти 6 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 Послідовності нуклеїнових кислот в деяких варіантах здійснення даного винаходу характеризуються підвищеним процентом ідентичності при вирівнюванні з SEQ ID NO:1. Специфічні послідовності нуклеїнових кислот в межах цих і інших варіантів здійснення можуть включати послідовності, що мають, наприклад, щонайменше 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95% 96%, 97%, 98% або 100% ідентичність з SEQ ID NO:2. Фахівцям в даній галузі техніки зрозуміло, що молекули нуклеїнових кислот можуть бути модифіковані по суті без зміни амінокислотної послідовності кодованого поліпептиду, наприклад, відповідно до дозволених нуклеотидних замін відповідно до виродженості кодонів. У деяких варіантах здійснення молекули нуклеїнової кислоти за даним винаходом включають промотори. Промотори можуть бути вибрані на основі клітинного типу, в який буду вставлений векторний конструкт. Промотори, які функціонують в бактеріях, дріжджах і рослинах, добре відомі в даній галузі техніки. Промотори можуть бути також вибрані на основі їх регуляторних характеристик. Приклади таких характеристик включають підвищення транскрипційної активності, індуцибельність, тканинну специфічність і специфічність відносно стадії розвитку. У рослин описані промотори, які є індуцибельними, промотори вірусного або синтетичного походження, конститутивно активні, регульовані у часі і регульовані в просторовому відношенні промотори (наприклад, див. Poszkowski, et al., (1989) EMBO J. 3:2719; Odell et al., (1985) Nature 313:810; Chau et al., (1989) Science 244:174-81). Часто використовувані конститутивні промотори включають, наприклад, CaMV 35S промотор, посилений CaMV 35S промотор, промотор вірусу мозаїки ранника, промотор манопинсинтази, промотор норалінсинтази і промотор октопинсинтази. Придатні індуцибельні промотори включають, наприклад, промотори, що індукуються саліциловою кислотою або поліакриловими кислотами, що індукуються нанесенням антидотів (заміщених бензолсульфонамідних гербіцидів), промотори, що індукуються тепловим шоком, промотор, що індукується нітратом, що походять від транскрибованої послідовності молекули нуклеїнової кислоти нітратредуктази шпинату, і промотори, що індукуються світлом, пов'язані з малою субодиницею карбоксилази RuBP і сімействами LHCP. Приклади придатних тканиноспецифічних, регульованих на стадіях розвитку промоторів включають промотор 7S -конгліциніну і промотори, специфічні для насіння рослин. Функціонуючі в рослинах промотори, придатні для переважної експресії в пластидах насіння, включають промотори для білків, залучених до біосинтезу жирних кислот в насінні олійних культур, і для запасаючих білків рослин. Приклади таких промоторів включають 5'-регуляторні області таких транскрибованих послідовностей молекул нуклеїнових кислот як послідовності фазеоліну, напіну, зеїну, інгібітору трипсину сої, АПБ, десатурази стеароїл-АПБ і олеозину. Іншим прикладом тканиноспецифічного промотору є промотор лектину, який специфічний для тканини насіння. Інші придатні промотори включають промотори нопалінсинтази, манопінсинтази і октопінсинтази, які переносяться на індукуючі пухлини плазміди Agrobacterium tumefaciens; промотори 19S і 35S віруси мозаїки цвітної капусти (CaMV); посилений промотор 35S CaMV; промотор 35S вірусу мозаїки ранника; індукований світлом промотор малої субодиниці рибулозо-1,5-бісфосфаткарбоксилази (ssRUBISCO); промотор EIF-4A тютюну (Mandel et al., (1995) Plant Mol. Biol. 29:995-1004); промотор синтетази сахарози кукурудзи; промотор алкогольдегідрогенази I кукурудзи; промотор світлозбираючого комплексу кукурудзи; промотор білка теплового шоку кукурудзи; промотор хітинази з Arabidopsis; промотори LTP (білка, що переносить ліпіди); промотор халконізомерази петунії; промотор збагаченого гліцином білка 1 бобів; промотор пататину картоплі; промотор убіквітину і промотор актину. Придатні промотори переважно є селективними для насіння, селективними для тканини або індуцибельними. Специфічна для насіння регуляція обговорюється, наприклад, в патенті EP 0255378. С. Амінокислотні послідовності Амінокислотні послідовності по деяких варіантах здійснення даного винаходу характеризуються підвищеним процентом ідентичності при вирівнюванні з SEQ ID NO:2. Специфічні амінокислотні послідовності в межах цих і інших варіантів здійснення можуть включати послідовності, що мають, наприклад, щонайменше 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95% 96%, 97%, 98% або 100% ідентичність з SEQ ID NO:2. У багатьох варіантах здійснення амінокислотна послідовність, що характеризується вказаною вище ідентичністю послідовності при вирівнюванні з SEQ ID NO:2, 9 кодує пептид з ферментативною активністю десатурази Δ -18:0-АПБ. D. Зміна Com25: 5 мутацій 7 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аспекти даного винаходу стосуються нових, сконструйованих за допомогою генної інженерії десатураз, що походять від батьківської десатурази рицини. У конкретних варіантах здійснення генний конструкт десатурази являє собою Com25. Com25 відрізняється від батьківської десатурази рицини в наступних п'яти положеннях амінокислот: M114S, T117R, L118C, P179L і G188T (при нумерації відповідно до запису 1AFR в PDB зрілої десатурази рицини). У додаткових варіантах здійснення генний конструкт десатурази може включати одну або більше з цих 5 мутацій в Com25. Наприклад, генний конструкт десатурази може відрізнятися від батьківської десатурази рицини по наступних положеннях: M114S; T117R; L118C; P179L; G188T; M114S і T117R; M114S і L118C; M114S і P179L; M114S і G188T; T117R і L118C; T117R і P179L; T117R і G188T; L118C і P179L; L118C і G188T; P179L і G188T; M114S, T117R і L118C; M114S, T117R і P179L; M114S, T1117R і G188T; M114S, L118C і P179L; M114S, L118C і G188T; M114S, P179L і G188T; T117R, L118C і P179L; T117R, L118C і G188T; T117R, P179L і G188T; або L118C, P179L і G188T. Е. Хазяїни з підвищеним рівнем жирних кислот 16:0. У переважних варіантах здійснення клітини-хазяїни або матеріали, трансформовані Com25, можуть виявляти підвищений рівень жирних кислот 16:0. Клітини-хазяїни можуть виявляти підвищений рівень жирних кислот 16:0, наприклад, завдяки послабленому метаболізму 16:0АПБ в цих клітинах-хазяїнах. Для підвищення рівня жирних кислот 16:0 в клітинах-хазяїнах можуть бути використані інші методи, і такі методи можуть бути вибрані по розсуду фахівця в даній галузі техніки. Приклади методів підвищення рівня жирних кислот 16:0 в клітині-хазяїні включають, але не обмежуються цим: 1) експресію позапластидної десатурази в клітині-хазяїні; 2) придушення KASII в клітині-хазяїні, наприклад, шляхом введення мутації в ген fab1; і 3) зниження елонгації жирних кислот 16:0, наприклад, шляхом введення мутації в ген fae1. F. Методи генетичної трансформації генетичного матеріалу Даний винахід спрямований також на методи отримання трансформованих клітин, які включають одну або більше молекул нуклеїнової кислоти, що включають послідовність нуклеїнової кислоти щонайменше на 60% ідентичну SEQ ID NO:1. Такі молекули нуклеїнової кислоти можуть також включати, наприклад, некодуючі регуляторні елементи, такі як промотори. Нарівні з некодуючими регуляторними елементами і транскрибованими послідовностями молекули нуклеїнової кислоти в клітину також можуть бути введені інші послідовності. Ці інші послідовності можуть включати 3' термінатори транскрипції, сигнали 3' поліаденілування, інші нетрансльовані послідовності, що переносять або спрямовують послідовності, маркери селекції, енхансери і оператори. Метод трансформації звичайно включає стадії відбору прийнятної клітини-хазяїна, трансформації клітини-хазяїна рекомбінантним вектором і отримання трансформованою клітини-хазяїна. Техніка введення ДНК в клітини добре відома фахівцям в даній галузі техніки. Ці методи звичайно можна розділити на п'ять категорій: (1) хімічні методи (Graham and Van der Eb (1973) Virology 54(2):536-9; Zatloukal et al., (1992) Ann. N.Y. Acad. Sci. 660:136-53); (2) фізичні методи, такі як мікроін’єкція (Capechi (1980) Cell 22(2):479-88), електропорація (Wong and Neumann, Biochim. Biophys. Res. Commun. (1982) 107(2):584-7; Fromm et al., (1985) Proc. Natl. Acad. Sci. USA 82(17):5824-8; патент США No. 5384253), іприскорення частинок (Johnston and Tang (1994) Methods Cell Biol. 43(А):353-65; Fynan et al., (1993) Proc. Natl. Acad. Sci. USA 90(24):11478-82; (3) вірусні вектори (Clapp (1993) Clin. Perinatol. 20(1): 155-68; Lu et al., (1993) J. Exp. Med. 178(6):2089-96; Eglitis and Anderson (1988) Biotechniques 6(7):608-14); (4) опосередковані рецепторами механізми (Curiel et al., (1992) Hum. Gen. Ther. 3(2):147-54; Wagner et al., (1992) Proc. Natl. Acad. Sci. USA 89(13):6099-103); і (5) опосередковані бактеріями механізми, такі як при використанні Agrobacterium. Альтернативно, нуклеїнові кислоти можуть бути введені безпосередньо в пилок шляхом прямої ін'єкції до репродуктивних органів рослини (Zhou et al., (1983) Methods in Enzymology 101:433; Hess (1987) Intern. Rev. Cytol. 107:367; Luo et al., (1988) Plant Mol. Biol. Reporter 6:165; Pena et al., (1987) Nature 325:274). Інші методи трансформації включають, наприклад, трансформацію протопласта, як продемонстровано в патенті США No. 5508184. Молекули нуклеїнової кислоти можуть бути також ін’єктовані в незрілі зародки (Neuhaus et al., (1987) Theor. Appl. Genet. 75:30).) Найчастіше використовуваними методами трансформації рослинних клітин є: опосередкований Agrobacterium процес перенесення ДНК (Fraley et al., (1983) Proc. Natl. Acad. Sci. USA 80:4803) (як проілюстровано в патенті США No. 5824877; патенті США No. 5591616; патенті США No. 5981840; і патенті США No. 6384301) і біолістичний, або опосередкований бомбардуванням процес мікроін’єкції (тобто генною гарматою) (такий, як описаний в патенті США No. 5550318; патенті США No. 5538880; патенті США No. 6160208; патенті США No. 8 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 6399861; і патенті США No. 6403865). Звичайно бажана трансформація ядра, але коли бажана вибіркова трансформація пластид, таких як хлоропласти або амілопласти, пластиди рослини можуть бути трансформовані за допомогою опосередкованої мікробомбардуванням доставки бажаної молекули нуклеїнової кислоти у випадку деяких видів рослин, таких як Arabidopsis, тютюн, картопля і види Brassica. Опосередкована Agrobacterium трансформація досягається за допомогою використання генетично сконструйованої ґрунтової бактерії, що стосується роду Agrobacterium. Декілька видів Agrobacterium опосередковують перенесення специфічної ДНК, відомої як “T-DNA", яка може бути генетично сконструйована для перенесення бажаного фрагмента ДНК у багато видів рослин. Основними подіями, характерними для процесу опосередкованого T-DNA патогенезу, є: індукція генів вірулентності, процесинг і перенесення TDNA. Цей процес розглянутий в багатьох оглядах (Ream (1989) Ann. Rev. Phytopathol. 27:583-618; Howard and Citovsky (1990) Bioassays 12:103-8; Kado (1991) Crit. Rev. Plant Sci. 10:1-32; Zambryski (1992) Annual Rev. Plant Physiol. Plant Mol. Biol. 43:465-90; Gelvin (1993) в Transgenic Plants, Kung and Wu eds., Academic Press, San Diego, pp. 49-87; Binns and Howitz (1994) в Bacterical Pathogenesis of Plants and Animals, Dang, ed., Berlin: Springer Verlag., pp. 119-38; Hooykaas and Beijersbergen (1994) Ann. Rev. Phytopathol. 32:157-79; Lessl and Lanka (1994) Cell 77:321-4; Zupan and Zambryski (1995) Annual Rev. Phytopathol. 27:583-618). Для селекції або підрахунку трансформованих рослинних клітин введена в клітину ДНК, незалежно від методу трансформації, може містити ген, який діє в регенеруючій тканині рослини з утворенням сполуки, що надає тканині рослини стійкості до токсичної в інших умовах сполуки. Гени, які цікавлять, для використання як маркерів селекції, скринінгу або підрахунку включають, але не обмежуються цим, гени GUS, зеленого флуоресцентного білка (GFP), люциферази і стійкість до антибіотика або гербіциду. Приклади генів стійкості до антибіотика включають гени, що надають стійкості до пеніцилінів, канаміцину (і неоміцину, G418, блеоміцину); метотрексату (і триметоприму); хлорамфеніколу; і тетрацикліну. Наприклад, стійкість до гліфосату може забезпечуватися геном стійкості до гербіциду. Della-Cioppa et al., (1987) Bio/Technology 5:579-84. Можуть бути використані і інші засоби селекції, включаючи, але не обмежуючись цим, толерантність до фосфінотрицину, біалафосу, і механізми позитивної селекції, Joersbro et al., (1998) Mol. Breed. 4: 111-7, які розглядаються як такі, що входять в об'єм даного винаходу. Трансформованим клітинам, ідентифікованим за допомогою селекції або скринінгу і культивованим у прийнятному середовищі, яке підтримує регенерацію, далі може бути надана можливість розвитку в рослини. Розкриті в даному описі методи можуть бути застосовані до будь-якої трансформованої рослинної клітини або тканини. Застосовувані в даному описі трансформовані рослинні клітини або тканини включають, але не обмежуються цим, ті клітини або тканини, які здатні до подальшого розмноження, що дає в результаті рослину. Фахівцям в даній галузі техніки зрозуміло, що ряд рослинних клітин або тканин є що трансформованими, коли після введення екзогенної ДНК і у прийнятних умовах культивування рослинні клітини або тканини можуть перебудовуватися в диференційовану рослину. Тканини, придатні для цих цілей, можуть включати, але не обмежуються цим, незрілі зародки, щіткову тканину, суспензійні клітинні культури, незріле суцвіття, меристему пагонів, вузлові експланти, тканину напливу, тканину гіпокотилю, сім’ядолі, коріння і листя. Регенерація, розвиток і культивування рослин з трансформованого протопласта або експлантів рослин відомі в даній галузі техніки. Weissbach and Weissbach (1988) Methods for Plant Molecular Biology, (Eds.) Academic Press, Inc., San Diego, CA; Horsch et al., (1985) Science 227:1229-31. Цей процес регенерації і вирощування звичайно включає стадії селекції трансформованих клітин і культивування цих клітин з проходженням звичайних стадій зародкового розвитку через стадію проростка з корінням. Схожим чином регенерують трансгенні зародки і насіння. При даному способі трансформанти звичайно культивують в присутності селективних середовищ, які забезпечують відбір успішно трансформованих клітин і індукують регенерацію паростків рослини. Fraley et al., (1993) Proc. Natl. Acad. Sci. USA 80:4803. Ці паростки звичайно отримують в межах від двох до чотирьох місяців. Після цього отримані трансгенні паростки з корінням висаджують у прийнятне середовище для вирощування рослини, таке як ґрунт. Клітини, які виживають при експозиції з агентом селекції, або клітини, які були визначені як позитивні при тестуючому скринінгу, можна культивувати в середовищах, які підтримують регенерацію рослин. Після цього паростки можуть бути перенесені у прийнятне середовище, що індукує ріст коріння і містить агент селекції і антибіотик для запобігання бактерійному росту. У багатьох паростків звичайно розвивається коріння. Потім їх переносять в 9 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 ґрунт або інші середовища для забезпечення подальшого розвитку коріння. Стисло описаний вище метод звичайно повинен варіювати залежно від конкретного використовуваного штаму рослини і, отже, особливості методології знаходяться в компетенції фахівця в даній галузі техніки. Регенеровані трансгенні рослини можуть бути самозапилюваними з отриманням гомозиготних трансгенних рослин. Альтернативно, пилок з регенерованих трансгенних рослин може бути схрещений з рослинами без трансгена, переважно з інбредними лініями важливих для сільського господарства видів. І навпаки, пилок від рослин без трансгена може бути використаний для запилення регенерованих трансгенних рослин. Трансгенна рослина може передавати послідовність трансформованої нуклеїнової кислоти своїм нащадкам. Трансгенна рослина переважно є гомозиготною відносно послідовності трансформованої нуклеїнової кислоти і передає цю послідовність всім своїм нащадкам при статевому розмноженні. Потомство може бути вирощене з насіння, продукованого трансгенною рослиною. Ці додаткові рослини потім можуть бути піддані самозапиленню з отриманням дійсно розмноженої лінії рослин. Потомство цих рослин може бути оцінене, нарівні з іншим, на предмет експресії гена. Генна експресія може бути визначена декількома загальноприйнятими способами, такими як імуноблотинг, нозерн-блотинг, імунопреципітація і ELISA (твердофазний імуноферментний аналіз). Трансформовані рослини можна також аналізувати на наявність введеної ДНК і рівень експресії і/або профіль жирних кислот, що додається молекулами нуклеїнової кислоти або амінокислотними молекулами за даним винаходом. Фахівцям в даній галузі техніки відомі численні методи, придатні для аналізу трансформованих рослин. Наприклад, методи аналізу рослин включають, але не обмежуються цим, саузерн-блотинг або нозерн-блотинг, підходи на основі ПЛР, біохімічні аналізи, методи скринінгу фенотипу, оцінки в полі- і імунодіагностичні тести. Методи специфічної трансформації дводольних добре відомі фахівцям в даній галузі техніки. Трансформація і регенерація рослини з використанням цих методів були описані для ряду сільськогосподарських культур, включаючи, але, не обмежуючись цим, представників роду Arabidopsis, бавовник (Gossypium hirsutum), сою (Glycine max), арахіс (Arachis hypogaea), і представники роду Brassica. Методи трансформації дводольних, головним чином шляхом використання Agrobacterium tumefaciens, і отримання трансгенних рослин були описані для бавовнику (патент США No. 5004863; патент США No. 5159135; патент США No. 5518908); сої (патент США No. 5569834; патент США No. 5416011; McCabe, et al., (1988) Biotechnology 6:923; Christou et al., (1988) Plant Physiol. 87:671-4; Brassica (патент США No. 5463174); арахісу (Cheng et al., (1996) Plant Cell Rep. 15:653-7; McKently et al., (1995) Plant Cell Rep. 14:699-703; папайї; і гороху (Grant et al., (1995) Plant Cell Rep. 15:254-8). Методи трансформації однодольних рослин також добре відомі в даній галузі техніки. Трансформація і регенерація рослини з використанням цих методів були описані для ряду сільськогосподарських культур, включаючи, але не обмежуючись цим, ячмінь (Hordeum vulgarae); маїс (Zea mays); овес (Avena sativa); траву фруктового саду (Dactylis glomerata); рис (Oryza sativa, включаючи індійський і японський різновиди); сорго (Sorghum bicolor); цукрову тростину (Saccharum sp); високу вівсяницю (Festuca arundinacea); види газонної трави (наприклад, Agrostis stolonifera, Poa pratensis, Stenotaphrum secundatum); пшеницю (Triticum aestivum); і люцерну (Medicago sativa). Фахівцям в даній галузі техніки зрозуміло, що ряд методів трансформації може бути використаний і модифікований для отримання стабільних трансгенних рослин для будь-якої кількості цільових сільськогосподарських культур, які цікавлять. Для використання в методах, розкритих в даному описі, може бути вибрана будь-яка рослина. Переважні рослини для модифікації за даним винаходом включають Arabidopsis thaliana, огірочник аптечний (Borago spp.), канолу, рицину (Ricinus communis), боби какао (Theobroma cacao), кукурудзу (Zea mays), бавовник (Gossypium spp), Crambe spp., Cuphea spp., льон (Linum spp.), Lesquerella і Limnanthes spp., Linola, настурцію (Tropaeolum spp.), Oenothera spp., оливу (Olea spp.), пальму (Elaeis spp.), арахіс (Arachis spp.), ріпак, сафлор (Carthamus spp.), сою (Glycine і Soja spp.), соняшник (Helianthus spp.), тютюн (Nicotiana spp.), Vernonia spp., пшеницю (Triticum spp.), ячмінь (Hordeum spp.), рис (Oryza spp.), овес (Avena spp.) сорго (Sorghum spp.), жито (Secale spp.) або інші представники Gramineae. Фахівцям в даній галузі техніки зрозуміло, що ряд методів трансформації може бути використаний і модифікований для отримання стабільних трансгенних рослин з будь-якої кількості цільових сільськогосподарських культур, які цікавлять. G. Трансгенне насіння 10 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення винаходу трансгенне насіння містить поліпептид, що включає амінокислотну послідовність щонайменше на 90% ідентичну SEQ ID NO:2. У цих і інших варіантах здійснення трансгенне насіння містить послідовність нуклеїнової кислоти щонайменше на 60% ідентичну SEQ ID NO:1. У певних варіантах здійснення насіння за даним винаходом виявляє підвищені рівні незвичайних жирних кислот, наприклад, -7 жирних кислот, 19 11 таких як 16:1∆ і/або 18:1∆ . Насіння може бути зібране з плодоносних трансгенних рослин і використане для вирощування поколінь нащадків трансформованих рослин за даним винаходом, включаючи гібридні лінії рослин, що містять послідовність нуклеїнової кислоти за даним винаходом і інший ген, який цікавить, або конструкт нуклеїнової кислоти. Наступні приклади пропонуються для ілюстрації певних конкретних особливостей і/або варіантів здійснення. Ці приклади не треба тлумачити як обмеження винаходу описаними конкретними особливостями або варіантами здійснення. Приклади Приклад 1: Матеріали і методи Вирощування рослини і трансформація Рослини Arabidopsis вирощували в ґрунті при безперервній експозиції при 300 мікроейнштейнів світла (1 мікроейнштейн = 1 моль світла) в камерах для вирощування в ™ контрольованому середовищі E7/2 (Conviron). Рослини трансформували по методу Clough і Bent, Clough and Bent (1998) Plant J. 16(6):735-43, з використанням штаму GV3101 Agrobacterium tumefaciens. Заявники ідентифікували індивідуальне насіння T 1, що несе трансгени, по емітованій флуоресценції, Stuitje et al., (2003) Plant Biotechnol. J. 1(4): 301-9, при освітленні ™ зеленим світлом від імпульсної лампи X5 LED (Inova) в поєднанні з червоним світлофільтром 25A. Pidkowich et al., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7. Для розділення насіння, ™ що несе маркери Zs-Green і Ds-Red, використовували анатомічний мікроскоп WILD M3Z, ™ забезпечений системою освітлення Olympus U-LH100HG , із застосуванням фільтрів FITC 535 і FITC 515, відповідно. Специфічна для насіння експресія була досягнута поміщенням конструктів під контроль промотору зберігаючого насіння білка фазеоліну або промотору LTP170. Slightom et al., (1983) Proc. Natl. Acad. Sci. USA 80(7):1897-1901; і van der Geest and Hall (1997) Plant Mol Biol. 33(3):553-7. Джерело Com25 9 Com25 являє собою варіант десатурази Δ -18:0-АПБ Ricinus communis, який з'явився в результаті здійснення програми комбінаторного насичуючого мутагенезу/селекції, призначеної для виявлення варіантів з поліпшеною активністю відносно ацильних ланцюгів з довжиною меншою ніж 18C. Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. Com25 відрізняється від вихідної десатурази рицини по наступних 5 положеннях амінокислот: M114S, T117R, L118C, P179L і G188T (нумерація відповідно до зрілої десатурази рицини, PDB введення 1AFR). Плазмідні конструкти Phas:Com25. Всю відкриту рамку зчитування варіанту Com25 рицини, сконструйованого так, щоб він містив аутентичну транспортну пептид і був оточений 5' PacI і 3' XhoI сайтами рестрикції, клонували у відповідні сайти плазміди pDs-Red-Phas, Pidkowich et al., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7, (з маркером Ds-Red) для створення Phas:Com25 (фіг. 5). Phas:Com25, LTP170:Com25. Промотор LTP170 ампліфікували з геномною ДНК Arabidopsis з використанням праймерів P17-5'BamHI (GGGATCCCCGGGTTGACATTTTTA CCTTTTT; SEQ ID NO:3) і P17-3'PacI (GGTTAATTAAGTCTTCAAACTCTAGGA; SEQ IDNO:4), субклонували в pGEMT-Easy перед виділенням фрагмента BamHI-PacI, який клонували у відповідні сайти плазміди pDs-Red-Phas:Com25 (описаної вище) для створення pDs-Red-LTP170:Com25. Фрагмент, що містить Com25 разом термінатором фазеоліну, вирізали за допомогою BamHI і EcoRV і клонували в сайти рестрикції BamHI і SmaI вектора pDs-Red-LTP170-Com25 зі створенням Phas:Com25/LTP170:Com25 (фіг. 5). Phas:Fabl-HPAS. Цей конструкт був створений в дві стадії; спочатку був сконструйований Phas:FatB-HP, а потім була зроблена вставка антисмислової частини гена FatB із заміною частини інтрону Fad2, що розділяє смислову і антисмислову частини гена FatB, що включає шпильку. З цією метою 150 п. н. з FatB 3'UTR Arabidopsis ампліфікували з геномною ДНК і в смисловій (з використанням праймерів FatB-hps-5'PstI GGGCTGCAGAAACAAGTTTCGGCCACCAACC С; SEQ ID NO:5 і FatB-hps-3'XhoI CCCCTCGAGACATCAGAATTCGTAATGAT; SEQ ID NO: 6), і в антисмисловій (з використанням праймерів FatB-hpa-5'NheI GGGGCTAGCAAGTTTCGGCCACCAAC CC; SEQ ID NO:7 і FatB-hpa3'PacI CCCTTAATTAAACATCAGAATTCGTAATGAT; SEQ ID NO:8) орієнтаціях. Ці фрагменти вирізали за допомогою PstI/XhoI і NheI/PacI і використовували для заміни 5'UTR смислової і антисмислової частин FabI в pGEM-T-Easy-HTM3, Pidkowich et al., (2007) Proc. Natl. Acad. Sci. 11 UA 113834 C2 5 10 15 20 25 30 35 40 45 50 55 60 USA 104(11): 4742-7, по їх еквівалентних сайтах з створенням проміжної плазміди pGEM-TEasy-HTM4. Для створення антисмислової частини з 300 п. н. кодуючої області гена FatB фрагмент ампліфікували за допомогою праймерів FatB-Exon-5'Sp-Bam (CCACTAGTGGATCCACCTCTGCTACGTCGTCATT; SEQ ID NO:9) і FatB-Exon-3'Bg-Sal (GGAGATCTGTCGACGTAGTTATAGCAGCAAGA AG; SEQ ID NO: 10), і фрагмент, вирізаний за допомогою BamHI і SalI, використовували для заміни частини інтрону Fad2 після рестрикції за допомогою BglII і SpeI зі створенням pGEM-T-Easy-HTM5. Зібраний фрагмент HPAS вирізали за допомогою PacI і XhoI і клонували в еквівалентні сайти pZs-Green-Phas:Com25 (плазміди pDs-Red-Phas:Com25, описаної вище, в якій флуоресцентний маркер pCVMV:Ds-Red був замінений маркером зеленого флуоресцентного TM білка pCVMV:Zs-Green (Clonetech)) зі створенням плазміди Phas:FatB-HPAS (фіг. 5). Phas:AnD9d, Phas:LnD9D. Дві ацил-СоА D9 десатурази грибів були об'єднані в плазміді pDAB7318, причому обидва гени знаходилися під керуванням специфічного для насіння 9 промотору Phas з Phaseolus vulgaris. Перший ген в конструкті являв собою ацил-СоА ∆ десатуразу з Aspergillus nidulans, який був переконструйований і синтезований для оптимальної експресії в рослинах (патентна заявка США 20080260933A1) і з’єднаний з 3' нетрансльованою областю і 3' MAR з гена фазеоліну Phaseolus vulgaris. Другий ген десатурази в цьому конструкті 9 являв собою ацил-СоА ∆ -десатуразу з Leptosphaeria nodorum, який також був переконструйований і синтезований для експресії в рослинах і з’єднаний з ORF23 3' нетрансльованої області Agrobacterium tumefaciens. Ця десатураза була ідентифікована при пошуку гомології геномної послідовності S. nodorum, що виявляється Leptosphaeria nodorum. Sequencing Project, Broad Institute of Harvard and MIT (http://www.broad.mit.edu). Було показано, що вона виявляє перевагу відносно зниження насиченості пальмітату, доповнюючи дію мутантного ole1 Saccharomyces cerevisiae. Phas:Fab1-HPAS-Phas:Com25. Для спрощення експериментів по укладанню генів була сконструйована плазміда Phas:Fab1/HPAS-Phas:Com25 зі сполученою експресією Com 25 і KASII. З цією метою був виділений термінатор фазеоліну з Phas:Com25 і клонований в проміжний вектор pBL з фрагментом EcoRV-EcoRV, що містить керований промотором фазеоліну Com25, зі створенням pBL-Phas:Com25-PhasTer. Цю експресійну касету Com25 вирізали з використанням фланкуючих сайтів рестрикції EcoRI-EcoRI і клонували у відповідний сайт в Phas:Fab1-HPAS зі створенням Phas:Fab1-HPAS-Phas-Com25. Див. фіг. 5. Аналіз жирних кислот Для аналізу жирних кислот одиночного насіння був отриманий метилові складні ефіри жирних кислот (FAMEs) шляхом інкубації насіння з 0,2 М гідроксидом триметилсульфонію в метанолі. Butte et al., (1982) Anal. Lett. 15(10):841-50. Для схожого аналізу великої кількості насіння FAMEs отримували інкубацією насіння в 0,5 мл BCl3 протягом 1 години при 80°С, їх екстракцією 1 мл гексану і подальшого висушування в атмосфері N 2. FAMEs аналізували за ™ допомогою або HP6890 газового хроматографа-детектора полум'яної іонізації (Agilent TM Technologies), або HP5890 газового хроматографа-мас-спектрометра (Hewlett-Packard), забезпеченого капілярними колонками 60-м × 250-мкм SP-2390 (Supelco). Температуру нагрівника підвищували під час аналізу з 100°С до 240°С зі швидкістю 15º/хв при швидкості потоку 1,1 мл/хв. Мас-спектрометрію проводили за допомогою вибіркового по масі детектора TM HP5973 (Hewlett-Packard). Заявники визначали положення подвійного зв'язку в мононенасичених FAMEs шляхом диметилсульфідної дериватизації. Yamamoto et al., (1991) Chem. and Phys. Lipids 60(1):39-50. Приклад II: Експресія Com25 в WT Arabidopsis Повідомлялося, що декілька рослин, включаючи Asclepias, Hopkins and Chisholm (1961) Can. J. Biochem. Physiol. 39:829-35, і Doxantha, Chisholm and Hopkins (1965) J. Am. Oil Chem. Soc. 42:49-50, акумулюють -7 РК в насінні. Були виділені гени, що кодують десатуразні ферменти, що відповідають за синтез пальмітолеату. Активність відповідних рекомбінантних десатуразних ферментів, Cahoon et al., (1997) Plant Mol. Biol. 33:1105-10; Cahoon et al., (1998) Plant Physiol. 117(2):593-8, як і активність багатьох варіантів десатураз, була нижча за активність, що повідомлялася для вихідних стеароїл-АПБ десатураз. Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. Заявники порівняли ефекти експресії в Arabidopsis десатураз Asclepias і Doxantha і декількох варіантів десатурази рицини, включаючи десатуразу з різновиду 5.2 рицини і Com25, яка виникла в результаті експериментів по спрямованій еволюції, призначених 9 для підвищення 16:0-десатуразної активності ∆ -18:0-десатурази рицини, Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. В цих експериментах Com25 перевершувала інші десатуразні ферменти, Bondaruk et al., (2007) Plant Breeding 126:186-94, підвищуючи акумуляцію 9 11 16:1Δ і продукт її елонгації, 18:1∆ в WT Arabidopsis з ледве визначного рівня в 12 UA 113834 C2 5 10 15 нетрансформованих рослинах до приблизно 2% і приблизно 12%, відповідно; з сумарним виходом 14% -7 жирних кислот в трансформантах Com25. Фіг. 1A; фіг. 2B. -1 У таблиці 1 показано, що хоча Com25 має значно поліпшену k cat (11,1 хв ) в порівнянні з WT -1 рицини (2,8 хв ) відносно субстрату 16:0-АПБ, вона поступається величині, що повідомлялася -1 для варіанту рицини 5.2 (25,3 хв ). Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. Однак Km Com25 відносно 16:0-АПБ (0,12 мкМ) в 4,6 рази нижче величини Km варіанту рицини 5.2 (0,55) і в 42 рази нижче величини Km WT рицини (5,0). У результаті коефіцієнт специфічності -1 -1 відносно субстрату 16:0-АПБ, що дорівнює для com25 91 мкМ ·хв , приблизно в два рази перевищує цей показник для варіанту рицини 5.2 і в 163 рази перевищує цей показник для WT рицини. Дійсно, коефіцієнт специфічності Com25 відносно 16:0-АПБ еквівалентний даному -1 -1 показнику WT рицини відносно її природного субстрату 18:0- АПБ (92 мкМ ·хв ). Поліпшена Km Com25 відносно 16:0-АПБ в порівнянні з варіантом рицини 5.2 дозволяє передбачати, що цей фермент ефективніше конкурує з FatB і KASII за субстрат, що дозволяє пояснити, чому його експресія сприяє більшій акумуляції -7 РК в порівнянні з варіантом рицини 5.2, незважаючи на його нижчу Kcat. Таблиця 1 Кінетичні параметри десатурази рицини і її варіантів з різними субстратами коефіцієнт специфічності Фермент Субстрат -1b хв мкМ com25 16:0-ACP 5,2 16:0-ACP WT 16:0-ACP WT 16:0-ACP 20 25 30 35 40 45 kcat Km мкМ хв 11,1 (0,6) 25,3 (1,1) 2,8 (0,1) 42,3 (1,6) -1 kcat/Km 0,12 (0,03) 0,55 (, 06) 5,0 (0,5) 0,46 (0,05) 91 46 0,56 92 -1 Приклад IV: Експресія Com25 в хазяїнах з підвищеним рівнем 16:0 У WT Arabidopsis жирні кислоти синтезуються de novo по шляху АПБ до першої точки гілкування на рівні 16:0-АПБ. Фіг. 1. При дії на цей субстрат FATB, пальмітоїлтіоестерази, вільна жирна кислота 16:0 виділяється з пластиди в цитоплазму, де ця жирна кислота утворює ефір з CoA і потім переноситься на фосфоліпіди системи внутрішніх мембран. Альтернативно, кетоацил-АПБ-синтаза II (KASII) подовжує більшість 16:0-APC до 18:0-APC, після чого цей 9 субстрат піддається зниженню ступеня насиченості під дією ∆ -стеароїл-АПБ-десатурази з утворенням олеоїл-АПБ. FATA, олеоїл-АПБ-тіоестераза, вивільняє олеїнову кислоту, яка залишає пластиду і, подібно до пальмітату, активується до CoA-тіоефіру і переноситься на 11 фосфоліпіди. У ER олеат може бути подовжений до 10:1Δ завдяки дії елонгази жирних кислот (FAE)I або піддадуть послідовному зниженню ступеня насиченості під дією FAD2 і FAD3 з утворенням ліноленової і ліноленової кислот, відповідно. 16:0-АПБ є найбільш раннім метаболітом на шляху синтезу FA, який може бути зв'язаний з 9 продукцією -7 шляхом зниження насиченості жирної кислоти до 16:1∆ - АПБ. З цією метою 9 досліджували можливість експресії специфічної відносно ∆ -16:1-АПБ десатурази пластид під контролем специфічного для насіння промотору (див. фіг. 1 (реакція 1)). Як описано вище, -кетоацил-АПБ-синтаза II (KASII) подовжує 16:0-APC до 18:0-APC. Тому вважали, що лінії зі зниженою активністю KASII повинні стримати підвищений рівень субстрату 16:0. На фіг. 2 показані типові ГХ-профілі складного метилового ефіру FA. Незважаючи на неодноразовий скринінг мутагенезом, є повідомлення лише про одного мутанта fab1, James and Dooner (1990) Theor. Apple Genet. 80:241-45, який виявляв підвищений рівень 16:0 в листі і насінні, яке містило приблизно 21% 16:0 в порівнянні приблизно з 10% в WT, як показано на фіг. 2C і в таблиці 2. Біохімічні дані показали, що пошкодження fab1 знаходиться в KASII, оскільки активність цього ферменту була знижена у мутанта. Carlsson et al., (2002) Plant J. 29(6):761-70. 9 11 Експресія Com25 в fab1 підвищувала акумуляцію 16:1∆ і 18:1∆ до приблизно 23% і приблизно 16%, відповідно, з сумарним виходом 39% -7 FA. Фіг. 2D і таблиця 2. Це значне підвищення 7 РК після експресії Com25 при генотипі fab1 корелює із збільшенням сумарної акумуляції 16:0 в зрілому насінні і, мабуть, є результатом зниженої конкуренції KASII за субстрат 16:0-АПБ. Заявники також з'єднали мутацію fab1 з fae1 завдяки тому, що недостатність ферменту у позапластидній елонгації жирних кислот з C18 до C20 додатково збільшує кількість 16:0 жирних кислот і спрощує аналіз. Нетрансформований подвійний мутант містить приблизно 9% -7 13 UA 113834 C2 5 10 15 20 25 30 35 40 45 жирних кислот, що, ймовірно, відображає посилене підвищення рівня ненасиченості 16:0-АПБ 9 під дією Δ -18:0-АПБ-десатурази в умовах підвищеного рівня субстрату 16:0-АПБ. Фіг. 2E і 9 11 таблиця 2. Експресія Com25 в fab1/fae1 приводила до підвищення 16:1∆ і 18:1∆ до приблизно 26% і приблизно 23%, відповідно, з підвищенням -7 РК до приблизно 50%. Фіг. 2F і таблиця 2. З представлених вище результатів випливає, що акумуляція 16:1 в fab1 і fab1/fae1 корелює з 16:0, і тому заявники зробили пошук ліній для експресії Com25, в яких рівень 16:0 перевищує цей рівень в подвійному мутанті fab1/fae1. Недавно з'явилися повідомлення про двох таких мутантів, в яких був придушений Fab1, в одному випадку за допомогою шпилькової (HP)RNAi, Pidkowich et al., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7, а в іншому за допомогою нового методу придушення, названого шпильковою-антисмисловою (HPAS)RNAi, Nguyen and Shanklin (2009) Journal of the American Oil Chemists Society 86:41-9. В цих лініях значно підвищений рівень акумуляції 16:0 до 42% і 46%, відповідно. Фіг. 3. Трансформація за допомогою Com25 привела до додаткового підвищення приблизно на 5% -7 РК в обох випадках. Таблиця 2. Таким чином, підвищення акумуляції 16:0 при низьких рівнях 16:0 дозволяє передбачати підвищення ступеня ненасиченості під дією Com25, як це виходить з пропорційного підвищення акумуляції -7 FA, але ця відповідь, мабуть, насичуємо при рівні, трохи перевищуючому 30%, оскільки не було різниці в ступені акумуляції -7 РК у хазяїнів, що акумулюють або 42%, або 46% 16:0. Фіг. 3. Поза зв'язком з якою-небудь теорією, можливо, що лімітуючими в цих трансгенних організмах стають фактори, відмінні від субстрату, тобто кількість десатурази і/або доступність відновника. Недавно був описаний нокаутний алель T-DNA, fab1-2, при якому у гетерозигот був підвищений рівень 16:0; однак було показано, що у гомозигот ця мутація летальна для зародків. Pidkowich et al., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7. Заявники передбачили, що летальний фенотип є наслідком зниження ненасичених жирних кислот, і передбачили, що експресія Com25 в цій лінії може забезпечити життєздатність. Навпаки, подвійний мутант fab1/fae1 життєздатний в гомозиготному стані і невідмітний по росту і розвитку від WT. Тому заявники використовували подвійний мутант fab1/fae1 як експериментального хазяїна для подальших експериментів. Приклад V: Збільшення дози гена Com25 веде до підвищеної акумуляції -7 9 -1 Вихідна десатураза Δ -18:0-АПБ рицини має kcat, що дорівнює 42 хв , Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5, яка в декілька разів перевищує величини, що 9 повідомлялися для десатураз Δ -16:0-АПБ. Cahoon et al., (1997) Plant Mol. Biol. 33:1105-10; і Cahoon et al., (1998) Plant Physiol. 117(2):593-8. Хоча цей оберт співставний з обертом схожих залежних від Fe реакцій окиснення, таких як каталізовані цитохромами P450, ці швидкості нижчі (в багатьох випадках на порядки величин) в порівнянні зі швидкостями багатьох ферментів метаболізму. Низькі швидкості оберту десатураз спричиняють необхідність у високому рівні експресії білка для забезпечення зниження рівня насиченості значної частини вуглецю, що запасається в насінні, що дозволяє передбачити, що вміст десатуразного ферменту може лімітувати акумуляцію -7. Для перевірки цієї гіпотези був сконструйований Com25 під контролем специфічного для насіння промотору LTP170 (який контролює експресію білка збереження насіння) і експресували його спільно з описаним вище конструктом керованого фазеоліном Com25. Спільна експресія Com25 під контролем промоторів фазеоліну і LTP170 при генотипі fab1/fae1 вела до підвищення акумуляції -7 РК з приблизно 50% до приблизно 58%; 9 11 при цьому збільшення 16:1∆ було сильніше (приблизно 6%), ніж збільшення 18:1∆ (приблизно 2%). Це збільшення акумуляції -7 РК є скромним, що дозволяє передбачити, що Com25, мабуть, не є лімітуючим в насінні, що експресує обидва конструкта Com25. 14 UA 113834 C2 Приклад VI: Експресія позапластидних десатураз ∆ -16:0 підвищує акумуляцію -7 FA Як обговорювалося раніше, використання генотипу Arabidopsis, який акумулює 16:0 на високому рівні, корелює з утворенням -7 РК після експресії десатурази 16:0-АПБ, але велика кількість 16:0 все ще залишає пластиду і акумулюється в олії насіння. Див. таблицю 2. Тому було розглянуто два підходи до зниження акумуляції 16:0 в олії насіння. Одна стратегія полягала в зниженні активності пальмітаттіоестерази FATB (фіг. 1), яка вищипує 16:0 з 16:0АПБ. Придушення FATB за допомогою HPAS-RNAi знижувало акумуляцію 16:0 приблизно на 3% при приблизно 6% підвищенні -7 FA. Див. таблицю 2. Була досліджена можливість додаткового зниження акумуляції 16:0 в насінні відносно зниження, що спостерігається при придушенні FATB, шляхом зниження ступеня насиченості 16:0 після експорту з пластиди. Вільні жирні кислоти, що виходять з пластиди, утворюють складні ефіри з CoA під дією ацилСоА-синтаз на шляху до акумуляції тригліцеридів. Shockey et al., (2003) Plant Physiol. 132(2):1065-76. Ці цитоплазматичні жирні ацил-CoAs і зв'язані з фосфоліпідами РК являють собою пули субстрату, потенційно доступних для позапластидних десатураз. Експресія позапластидних десатураз грибів Aspergillus nidulans (An) і Leptosphaeria nodurum (Ln), або окремо, або в поєднанні, була оцінена в плані зниження рівня 16:0 в Arabidopsis. Спільна експресія двох десатураз з Ln і An під контролем промотору фазеоліну дала результати, які подають надію, по зниженню 16:0 в WT Arabidopsis. Тому було проведено тестування експресії конструкта Ln і An нарівні з експресією єдиної копії Com25 в лінії з придушенням KASII за допомогою HPAS-RNAi. Експресія LnΔ9D і AnΔ9 десатураз приводила до перетворення 9 приблизно половини 16:0 в 16:1Δ , що забезпечувало зниження акумуляції 16:0 в насінні з приблизно 19% до приблизно 11% (що приблизно дорівнює рівню в насінні WT) при 9 11 відповідному підвищенні 16:1∆ від приблизно 27% до 43%. Рівні 18:1∆ в лінії хазяїна fab1/fae1/Com25 і цій лінії, трансформованій десатуразами LnΔ9D і AnΔ9, були однаковими (приблизно 25% і приблизно 23%, відповідно), що вказує на те, що мутант fae1 майже повністю 9 позбавлений елонгуючої активності відносно 16:1Δ . Ця стратегія спільної експресії пластидних і позапластидних десатураз забезпечила акумуляцію -7 РК в середньому на рівні 67%, причому в окремих рослинах ця акумуляція перевищувала 71%. 9 5 10 15 20 25 30 15 UA 113834 C2 16 UA 113834 C2 17 UA 113834 C2 18 UA 113834 C2 19 UA 113834 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 1. Спосіб збільшення кількості невластивих жирних кислот в рослинному матеріалі, причому спосіб включає: трансформацію рослинного матеріалу, що містить LnΔ9 або AnΔ9 десатуразу з молекулою нуклеїнової кислоти, що містить функціональний в рослині промотор, функціонально зв'язаний з 9 полінуклеотидом, що кодує Δ десатуразний фермент, що включає амінокислотну послідовність, щонайменше на 80 % ідентичну послідовності SEQ ID NO: 2, де полінуклеотид містить нуклеотидну послідовність, яка щонайменше на 60 % ідентична послідовності SEQ ID NO: 1, з тим, щоб кількість невластивих жирних кислот у вказаному рослинному матеріалі збільшувалася. 2. Спосіб за п. 1, де рослинний матеріал включає додатковий засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі. 3. Спосіб за п. 2, де засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою пригнічення KASII. 4. Спосіб за п. 3, де пригнічення KASII забезпечується мутантним геном fab1. 5. Спосіб за п. 2, де засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою зниження елонгації жирних кислот 16:0 в рослинному матеріалі. 6. Спосіб за п. 5, де зниження елонгації жирних кислот 16:0 в рослинному матеріалі забезпечується мутантним геном fae1. 7. Спосіб за п. 1, де рослинний матеріал отримують з рослини, вибраної з роду, вибраного з групи, що включає Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, ріпак, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale або інших представників Gramineae. 8. Спосіб за п. 1, де рослинний матеріал включає два додаткові засоби підвищення рівнів 16:0АПБ в рослинному матеріалі. 9. Спосіб за п. 8, де перший засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою пригнічення KASII і де другий засіб підвищення рівнів 16:0-АПБ в рослинному матеріалі являє собою зниження елонгації жирних кислот 16:0 в рослинному матеріалі. 10. Спосіб за п. 1, причому спосіб додатково включає культивування трансформованого рослинного матеріалу з отриманням рослини. 11. Спосіб за п. 10, де рослина вибрана з роду, вибраного з групи, що включає Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, ріпак, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale або інших представників Gramineae. 9 12. Спосіб за п. 1, де полінуклеотид, що кодує Δ десатуразний фермент, щонайменше на 80 % ідентичний послідовності SEQ ID NO: 1. 13. Спосіб за п. 1, де функціональний в рослині промотор являє собою промотор фазеоліну або промотор LTP170. 14. Рослинний матеріал, який включає: LnΔ9 або AnΔ9 десатуразу; і молекулу нуклеїнової кислоти, що містить функціональний в рослині промотор, функціонально 9 зв'язаний з полінуклеотидом, що кодує Δ десатуразний фермент, що включає амінокислотну послідовність, щонайменше на 80 % ідентичну послідовності SEQ ID NO: 2, де полінуклеотид містить нуклеотидну послідовність, яка щонайменше на 60 % ідентична послідовності SEQ ID NO: 1. 15. Рослинний матеріал за п. 14, де рослинний матеріал являє собою цілу рослину. 16. Рослинний матеріал за п. 15, де рослинний матеріал являє собою насіння. 20 UA 113834 C2 21 UA 113834 C2 22 UA 113834 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Автори англійськоюShanklin, John, Nguyen, Tam Huu, Walsh, Terence A., Whittle, Edward, J., Pidkowich, Mark, S.
Автори російськоюШанклин Джон, Нгуйен Там Хуу, Уолш Теренс А., Уиттл Эдвард Дж., Пидкович Марк С.
МПК / Мітки
МПК: C12N 15/53, C12N 9/02, C12N 15/82, A01H 5/00
Мітки: кількості, кислот, спосіб, матеріали, рослинному, збільшення, жирних, невластивих
Код посилання
<a href="https://ua.patents.su/25-113834-sposib-zbilshennya-kilkosti-nevlastivikh-zhirnikh-kislot-v-roslinnomu-materiali.html" target="_blank" rel="follow" title="База патентів України">Спосіб збільшення кількості невластивих жирних кислот в рослинному матеріалі</a>