Гуманізоване антитіло, що зв’язується з бета-амілоїдним пептидом (ab), полінуклеїнова кислота, що його кодує, фармацевтична композиція, що його містить, та застосування даного гуманізованого антитіла для вигото
Номер патенту: 75881
Опубліковано: 15.06.2006
Автори: Пол Стівен М., Холцмен Дейвід М., Дематтос Роналд, Бейлз Келлі Р., Цурушіта Нойа, Васкес Максіміліано
Формула / Реферат
1. Гуманізоване антитіло або його фрагмент, до складу якого входять:
а) легкий ланцюг, який включає три гіперваріабельні ділянки (CDR) легкого ланцюга, що мають такі амінокислотні послідовності:
CDR-1 легкого ланцюга:
(Послідовність № 1) або
(Послідовність № 15)
CDR-2 легкого ланцюга:
(Послідовність № 2)
та CDR-3 легкого ланцюга:
(Послідовність № 3);
і каркасну послідовність легкого ланцюга з легкого ланцюга гуманізованого імуноглобуліну; та
b) важкий ланцюг, який включає три гіперваріабельні ділянки (CDR) важкого ланцюга, які мають такі амінокислотні послідовності:
CDR-1 важкого ланцюга:
CDR-2 важкого ланцюга:
(Послідовність № 16)
та CDR-3 важкого ланцюга:
(Послідовність № 6);
та каркасну послідовність важкого ланцюга з важкого ланцюга гуманізованого імуноглобуліну.
2. Гуманізоване антитіло або його фрагмент за п. 1, де:
CDR-1 легкого ланцюга має таку амінокислотну послідовність:
(Послідовність № 1), та
CDR-2 важкого ланцюга має таку амінокислотну послідовність:
(Послідовність № 5).
3. Гуманізоване антитіло або його фрагмент за п. 1, до складу якого входить гуманізована варіабельна ділянка легкого ланцюга, яка включає таку послідовність:
(Послідовність № 7), де:
Хаа у положенні 2 - Val або Ilе;
Хаа у положенні 7 - Ser або Thr;
Хаа у положенні 14 - Thr або Ser;
Хаа у положенні 15 - Leu або Pro;
Хаа у положенні 30 - Ilе або Val;
Хаа у положенні 50 - Arg, Gln або Lys;
Хаа у положенні 88 - Val або Leu;
Хаа у положенні 105 - Gin або Gly;
Хаа у положенні 108 - Lys або Arg та
Хаа у положенні 109 - Val або Leu;
та варіабельна ділянка важкого ланцюга, яка включає таку послідовність:
(Послідовність № 8), де:
Хаа у положенні 1 - Glu або Gln;
Хаа у положенні 7 - Ser або Leu;
Хаа у положенні 46 - Glu, Val, Asp або Ser;
Хаа у положенні 63 - Thr або Ser;
Хаа у положенні 75 - Ala, Ser, Val або Thr;
Хаа у положенні 76 - Lys або Arg;
Хаа у положенні 89 - Glu або Asp та
Хаа у положенні 107 - Leu або Thr.
4. Гуманізоване антитіло або його фрагмент за п. 1, що має варіабельну ділянку легкого ланцюга з послідовністю, представленою Послідовністю № 9, та варіабельну ділянку важкого ланцюга, представлену Послідовністю № 10.
5. Гуманізоване антитіло або його фрагмент за п. 4, що має легкий ланцюг із послідовністю, представленою Послідовністю № 11, та важкий ланцюг із послідовністю, представленою Послідовністю № 12.
6. Фрагмент гуманізованого антитіла за п. 1 або п. 5.
7. Гуманізоване антитіло або фрагмент за п. 1, що являє собою ізотип імуноглобуліну IgG1.
8. Гуманізоване антитіло або фрагмент за п. 1, продуковане у клітині-хазяїні, вибраній з групи, до складу якої входять клітина мієломи, клітина яєчника китайського хом'ячка, клітина яєчника сірійського хом'ячка та клітина нирок людського зародка.
9. Полінуклеїнова кислота, яка включає послідовність, що кодує легкий ланцюг або важкий ланцюг гуманізованого антитіла або його фрагмент за будь-яким з пп. 1-8.
10. Полінуклеїнова кислота за п. 9, яка включає послідовність, що кодує варіабельну ділянку легкого ланцюга, представлену Послідовністю № 7 або Послідовністю № 9.
11. Полінуклеїнова кислота за п. 9, яка включає послідовність, що кодує варіабельну ділянку важкого ланцюга, представлену Послідовністю № 8 або Послідовністю № 10.
12. Полінуклеїнова кислота за п. 9, яка включає послідовність, що кодує легкий ланцюг, представлений Послідовністю № 11.
13. Полінуклеїнова кислота за п. 9, яка включає послідовність, що кодує важкий ланцюг, представлений Послідовністю № 12.
14. Фармацевтична композиція, яка містить гуманізоване антитіло або його фрагмент за будь-яким з пп. 1-8, а також фармацевтично прийнятний наповнювач.
15. Застосування гуманізованого антитіла або його фрагмента за будь-яким з пп. 1-8 для виготовлення лікарського засобу, здатного до пролонгованої експресії рекомбінантних послідовностей антитіла або фрагмента антитіла в тканинах людини, для лікування клінічної або передклінічної форми хвороби Альцгеймера, синдрому Дауна або клінічної чи передклінічної форми церебральної амілоїдної ангіопатії, або для лікування, запобігання або реверсування погіршення пізнавальної діяльності при клінічній або передклінічній формі хвороби Альцгеймера, синдромі Дауна або клінічній чи передклінічній формі церебральної амілоїдної ангіопатії.
Текст
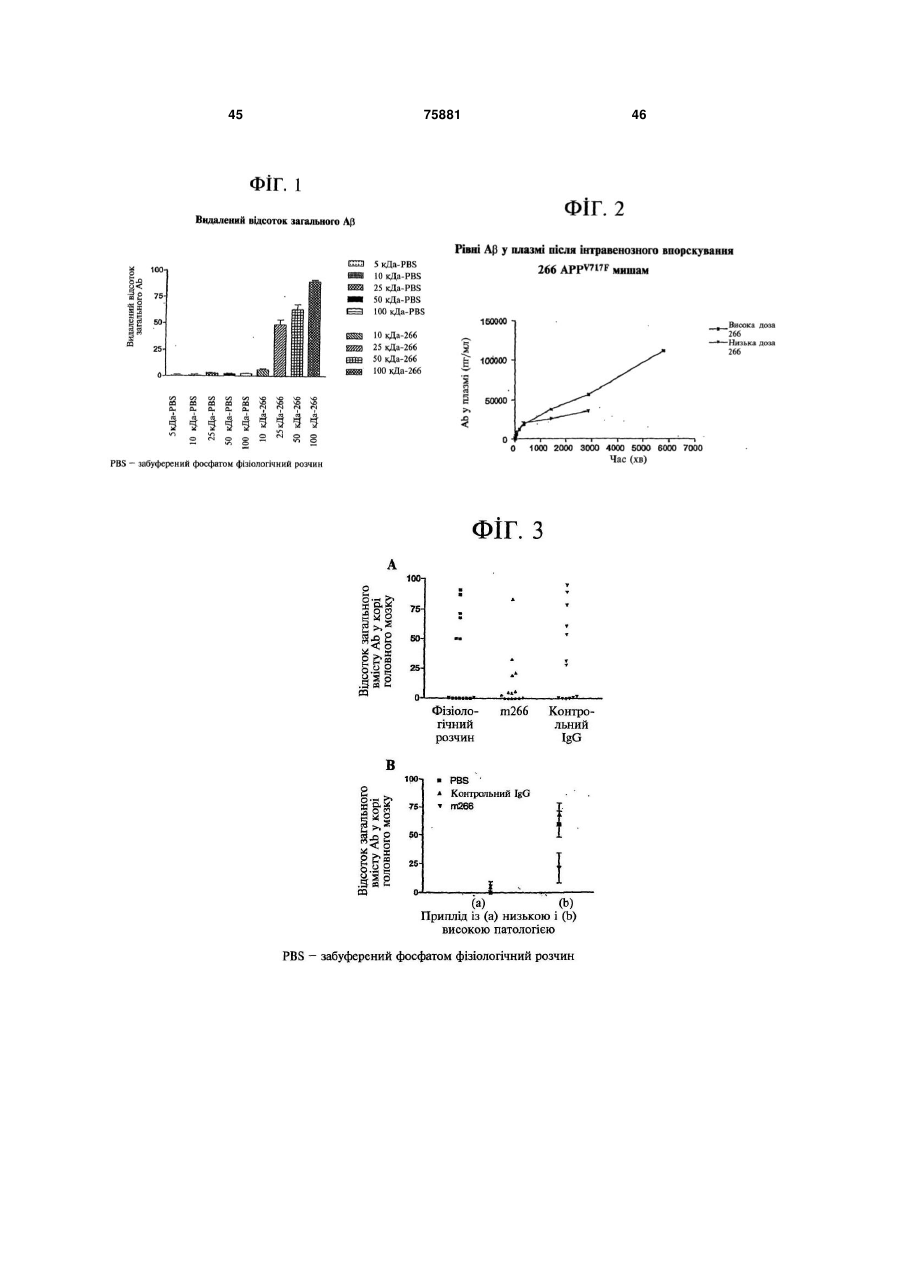
1. Гуманізоване антитіло або його фрагмент, до складу якого входять: а) легкий ланцюг, який включає три гіперваріабельні ділянки (CDR) легкого ланцюга, що мають такі амінокислотні послідовності: CDR-1 легкого ланцюга: 2 UA ЩО (19) АНТИТІЛО, ДО ПАТЕНТУ НА ВИНАХІД ПЕПТИДОМ СТИТЬ, ТА ЗАСТОСУВАННЯ ДАНОГО ГУМАНІЗОВАНОГО АНТИТІЛА ДЛЯ ВИГОТОВЛЕННЯ ЛІКАРСЬКОГО ЗАСОБУ ДЛЯ ПРОФІЛАКТИКИ ТА ЛІКУВАННЯ СТАНІВ, ПОВ'ЯЗАНИХ З УТВОРЕННЯМ БЕТААМІЛОЇДНИХ БЛЯШОК (54) ГУМАНІЗОВАНЕ ОПИС 3 75881 4 та варіабельну ділянку важкого ланцюга, представлену Послідовністю № 10. 5. Гуманізоване антитіло або його фрагмент за п.4, що має легкий ланцюг із послідовністю, представленою Послідовністю № 11, та важкий ланцюг із послідовністю, представленою Послідовністю № 12. 6. Фрагмент гуманізованого антитіла за п.1 або п.5. 7. Гуманізоване антитіло або фрагмент за п.1, що являє собою ізотип імуноглобуліну IgG1. 8. Гуманізоване антитіло або фрагмент за п.1, продуковане у клітині-хазяїні, вибраній з групи, до складу якої входять клітина мієломи, клітина яєчника китайського хом'ячка, клітина яєчника сірійсь(Послідовність № 7), де: кого хом'ячка та клітина нирок людського зародка. Хаа у положенні 2 - Val або Ilе; 9. Полінуклеїнова кислота, яка включає послідовХаа у положенні 7 - Ser або Thr; ність, що кодує легкий ланцюг або важкий ланцюг Хаа у положенні 14 - Thr або Ser; гуманізованого антитіла або його фрагмент за Хаа у положенні 15 - Leu або Pro; будь-яким з пп.1-8. Хаа у положенні 30 - Ilе або Val; 10. Полінуклеїнова кислота за п.9, яка включає Хаа у положенні 50 - Arg, Gln або Lys; послідовність, що кодує варіабельну ділянку легХаа у положенні 88 - Val або Leu; кого ланцюга, представлену Послідовністю № 7 Хаа у положенні 105 - Gin або Gly; або Послідовністю № 9. Хаа у положенні 108 - Lys або Arg та 11. Полінуклеїнова кислота за п.9, яка включає Хаа у положенні 109 - Val або Leu; послідовність, що кодує варіабельну ділянку важта варіабельна ділянка важкого ланцюга, яка кого ланцюга, представлену Послідовністю № 8 включає таку послідовність: або Послідовністю № 10. 12. Полінуклеїнова кислота за п.9, яка включає послідовність, що кодує легкий ланцюг, представлений Послідовністю № 11. 13. Полінуклеїнова кислота за п.9, яка включає послідовність, що кодує важкий ланцюг, представлений Послідовністю № 12. 14. Фармацевтична композиція, яка містить гуманізоване антитіло або його фрагмент за будь-яким з пп.1-8, а також фармацевтично прийнятний наповнювач. 15. Застосування гуманізованого антитіла або його фрагмента за будь-яким з пп.1-8 для виготовлення лікарського засобу, здатного до пролонгованої експресії рекомбінантних послідовностей антитіла (Послідовність № 8), де: або фрагмента антитіла в тканинах людини, для Хаа у положенні 1 - Glu або Gln; лікування клінічної або передклінічної форми хвоХаа у положенні 7 - Ser або Leu; роби Альцгеймера, синдрому Дауна або клінічної Хаа у положенні 46 - Glu, Val, Asp або Ser; чи передклінічної форми церебральної амілоїдної Хаа у положенні 63 - Thr або Ser; ангіопатії, або для лікування, запобігання або реХаа у положенні 75 - Ala, Ser, Val або Thr; версування погіршення пізнавальної діяльності Хаа у положенні 76 - Lys або Arg; при клінічній або передклінічній формі хвороби Хаа у положенні 89 - Glu або Asp та Альцгеймера, синдромі Дауна або клінічній чи пеХаа у положенні 107 - Leu або Thr. редклінічній формі церебральної амілоїдної ангіо4. Гуманізоване антитіло або його фрагмент за патії. п.1, що має варіабельну ділянку легкого ланцюга з послідовністю, представленою Послідовністю № 9, Ця заявка претендує на пріоритет за тимчасовими [заявками США 60/184,601, яка була подана 24 лютого 2000 року, 60/254,465, яка була подана 8 грудня 2000 року, та 60/254,498, яка була подана 8 грудня 2000 року], вміст кожної з яких включено до цього опису як посилання. Цей винахід має відношення до гуманізованих антитіл, які зв'язуються з епітопом між амінокислотами 13 та 28 Αβ пептиду та до профілактики та лікування станів, які пов'язуються з бетаамілоїдом, наприклад, хвороби Альцгеймера, синдрому Дауна та церебральної амілоїдної ангіопатії. Зокрема, він має відношення до використання гуманізованих моноклональних антитіл для секве 5 75881 6 стрування бета-амілоїдного (Αβ) пептиду у плазмі, опублікована 10 червня 1999 року]. У згаданому головному мозку та цереброспінальній рідині для описі стверджується, що повномірний агрегований запобігання накопичення або для реверсування Αβ пептид може бути придатним імуногеном. Ввевідкладення Αβ пептиду у межах головного мозку дення фрагмента Αβ (амінокислот 13-28), кон'югота судинної сітки головного мозку, та поліпшення ваного з овечім антимишачим IgG, не викликало пізнавальної діяльності. змін у загальному вмісті амілоїду у корі головного Видається, що з бляшками у периферичних мозку, і лише одна з дев'яти тварин, які одержали нервах та судинах головного мозку, які вміщують впорскування кон'югованого 13-28 фрагмента Αβ, бета-амілоїдний пептид (Αβ), пов'язується цілий демонструвала деякі ознаки лімфопроліферації у ряд симптоматологічних комплексів, наслідком відповідь на Αβ40. У згаданій заявці вказується яких є порушення пізнавальної діяльності, інсульт, також, що антитіла, які специфічно зв'язуються з внутрішньомозковий крововилив та загальне посΑβ пептидом, можуть використовуватись як тералаблення розумової діяльності. До цих станів відпевтичні засоби. Однак це видається здогадами, носять як передклінічну, так і клінічну форми хвооскільки підтверджувальні дані свідчать про застороби Альцгеймера, синдром Дауна та сування протоколів, які залучають активну імунізапередклінічну та клінічну форми церебральної цію з використанням, наприклад, Αβ42. Пептиди амілоїдної ангіопатії (САА). Амілоїдні бляшки постачаються за допомогою ад'ювантів і визначаутворюються з бета-амілоїдних пептидів. Ці пепються як титри антитіл, які є наслідком імунізації, тиди циркулюють у крові та у цереброспінальній так і рівні Αβ пептиду та пептиду-попередника. Ця рідині (CSF), як правило, у формі комплексних публікація дозволяє майже з певністю стверджусполук із ліпопротеїнами. Αβ пептид у циркуляторвати, що для полегшення симптомів хвороби Альній формі складається з 39-43 амінокислот (головцгеймера Αβ бляшки повинні зменшуватись і для ним чином, з 40 або 42 амінокислот) і є наслідком успішного зменшення Αβ бляшок необхідними є розщеплення загального білка-попередника, білкаклітинно-опосередковані процеси. попередника амілоїду, який часто позначають як [WO 99/60024, яка була опублікована 25 лисАРР. Деякі форми розчинного Αβ є нейротоксичтопада 1999 року], спрямована на способи виданими самі по собі і можуть визначати тяжкість делення амілоїду за допомогою антиамілоїдних ангенерації нервових волокон та/або погіршення титіл. Стверджується, однак, що цей механізм пізнавальної діяльності (Маклін К.А. (McLean C.A.) використовує здатність анти-Αβ антитіл до зв'язута інші, Ann. Neurol. (1999) 46:860-866; Ламберт вання із попередньо утвореними відкладами аміМ.П.(Lambert M.P.) та інші, (1998) 95:6448-6453; лоїду (наприклад, бляшками) із подальшим місцеНесланд Дж. (Naslund J.), J. Am. Med. Assoc. вим виведенням з мікроглії локалізованих бляшок. (2000) 283:1571). Цей механізм не було випробувано in vivo. У цій Наявні дані дозволяють зробити припущення публікації додатково стверджується, що для того, про те, що Αβ може транспортуватись між головщоб бути ефективними проти Αβ бляшок, анти-Αβ ним мозком та кров'ю як у прямому, так і у зворотантитіла повинні одержати доступ до паренхіми ному напрямках (Герсі-Еджа Дж-Ф. (Ghersi-Egea Jголовного мозку та подолати гематоенцефалічний F.) та інші, J. Neurochem. (1996) 67:880-883; Злобар'єр. ковіч Б.В. (Zlokovic B.V.) та інші, Biochem. Biophys. 7 грудня 2000 року були опубліковані декілька Res. Comm. (1993) 67:1034-1040; Шібата Μ. міжнародних заявок, які мають відношення до (Shibata Μ.) та інші, J. Clin. Invest. (2000) 106:1489спроб контролювання амілоїдних бляшок. [У WO 1499). Додаткова кількість Αβ у бляшках знахо00/72880] описується значне зменшення бляшок у диться у рівновазі з розчинним Αβ у головному корі головного мозку та гіпокампі трансгенної мимозку та крові (Каварабаяші Т. (Kawarabayashi Т.) шачої моделі хвороби Альцгеймера у разі обробки та інші, J. Neurosci. (2001) 21:372-381). мишей з використанням N-кінцевих фрагментів Αβ За описом, який наведено [у міжнародній заяпептидів та антитіл, які зв'язуються з ними, але не вці PCT/US00/35681 та заявці США №09/153,130] у разі обробки 13-28 фрагментом Αβ, кон'югова(обидві включено до цього опису як посилання), ним з овечим антимишачим IgG або з антитілом загальні циркуляторні рівні Αβ пептиду у церебропроти 13-28 фрагмента, антитілом 266. Результати спінальній рідині є однаковими у нормальних індидосліджень in vitro підтвердили, що антитіла, відів та індивідів, які мають схильність до демонспрямовані проти N-кінцевої ділянки, долають гестрування симптомів хвороби Альцгеймера. Однак матоенцефалічний бар'єр та індукують фагоцитоз рівні А042 є нижчими, за середніми показниками, в амілоїдних бляшок. індивідів, які мають хворобу Альцгеймера (Нітш [WO 00/72876] має по суті таке ж саме розкP.M. (Nitsch R.M.) та інші, Ann. Neurol. (1995) риття, що і [WO 00/72880], і спрямовується на іму37:512-518). Відомо, що Αβ42 має більшу схильнізацію за допомогою самих складових амілоїдних ність до агрегування, аніж Αβ40, і, у разі, коли це фібрил. трапляється, виникають негативні наслідки, такі як [WO 00/77178] описує антитіла, які були розвідкладення Αβ у амілоїдних бляшках, перетвороблені для каталізування гідролізу β-амілоїду, у рення Αβ на токсичні розчинні форми, пошкоджентому числі антитіла, які були одержані проти суміня нервових клітин та порушення поведінки, такі як ші фенілаланін-статинових перехідних сполук Cysслабоумство (Голд Т.Е. (Golde Т.Е.) та інші, Aβ10-25, статин Phe19-Phe20 та Cys-Aβ10-25 статин Biochem. Biophys. Acta. (2000) 1502:172-187). Phe20-Ala21, та антитіла, одержані проти Αβ10-25, які Опис способів індукування імунної реакції для мають відновлений амідний зв'язок між Phe19 та зменшення відкладення амілоїду наводять [у пубРhе20. У цьому документі згадується секвеструлікації міжнародної заявки WO 99/27944, яка була вання Αβ, але це лише здогади, оскільки у ньому 7 75881 8 не наводяться дані на підтвердження такого сексеквестрування розчинних форм Αβ з їхніх зв'язавестрування. Цей документ, окрім того, не навоних, циркуляторних форм у крові, і що наслідком дить даних in vivo про те, що введення антитіл периферичного введення антитіла 266 є швидкий викликає відтік Αβ з центральної нервової систевідтік відносно великих кількостей Αβ пептиду з ми, перешкоджає утворенню бляшок, зменшує центральної нервової системи до плазми. Наслідзагальний вміст бляшок, утворює комплекси між ком цього є зміна виведення розчинного Αβ, запоантитілами та Αβ у зразках тканин або впливає на бігання утворенню бляшок і, що викликає найбіпізнавальну діяльність. льший подив, поліпшення пізнавальної діяльності, Було показано, що одним із шляхів метаболізнавіть без обов'язкового зменшення загального му Αβ є перенесення з центральної нервової сисвмісту Αβ амілоїдних бляшок, подолання гематоетеми до плазми (Злоковіч Б.В. (Zlokovic B.V.) та нцефалічного бар'єру у скільки-небудь значному інші, Ргос. Natl. Acad. Sci. (США) (1996) 93:4229обсязі, сполучення із бляшками, активування клі4234; (Герсі-Еджа Дж-Ф. (Ghersi-Egea J-F.) та інші, тинних механізмів або зв'язування з великою споJ. Neurochem. (1996) 67:880-883). На додаток до рідненістю до агрегованого Αβ. цього, було показано, що Αβ у плазмі може долати Цей винахід надає гуманізовані антитіла або гематоенцефалічний бар'єр та потрапляти до гоїхні фрагменти, які позитивно впливають на пізналовного мозку (Злоковіч Б.В. (Zlokovic B.V.) та інші, вальну діяльність у разі хвороб та станів, до яких Biochem. Biophys. Res. Comm. (1993) 67:1034може залучатись Αβ, наприклад, при клінічній або 1040). Було показано також, що введення певних передклінічній формах хвороби Альцгеймера, сиполіклональних та моноклональних Αβ антитіл ндромі Дауна та клінічній або передклінічній форзменшує відкладення Αβ у амілощних бляшках у мах церебральної амілоїдної ангіопатії. Згадані APPV717F трансгенної мишачої моделі хвороби антитіла або їхні фрагменти не повинні долати Альцгеймера (Бард Ф. (Bard F.) та інші, Nature гематоенцефалічний бар'єр, сполучатись з амілоїMed. (2000) 6:916-919); однак вказувалось на те, дними бляшками, активізувати клітинні реакції або що згадане обумовлювалось певними анти-Αβ навіть у обов'язковому порядку зменшувати загаантитілами, які долають гематоенцефалічний бальний вміст амілоїдних бляшок. За іншим аспекр'єр та стимулюють фагоцитоз амілоїдних бляшок том, цей винахід надає гуманізовані антитіла або клітинами мікроглії. У експериментах Барда аналіз їхні фрагменти, які секвеструють Αβ пептид з його зрізів головного мозку ex vivo показав, що присутзв'язаної, циркуляторної форми у крові та змінюність додаткових Αβ антитіл, разом з екзогенно ють виведення розчинних та зв'язаних форм Αβ у доданою мікроглією, індукувала фагоцитоз Αβ, центральній нервовій системи та плазмі. За іншим наслідком чого було видалення відкладів Αβ. аспектом, цей винахід надає гуманізовані антитіла Рівні розчинних Аβ40 та Αβ42 у цереброспіната їхні фрагменти, де згадані гуманізовані антитіла льній рідині та крові можуть легко виявлятись за специфічно зв'язуються з епітопом між амінокисдопомогою стандартизованих аналізів з викорислотами 13 та 28 молекули Αβ. За іншим аспектом, танням антитіл, спрямованих проти епітопів цей винахід надає гуманізовані антитіла або їхні вздовж ланцюга Αβ. Про такі аналізи повідомляфрагменті, де гіперваріабельні ділянки одержують лось, наприклад, [у патентах США №5,766,846, з мишачого моноклонального антитіла 266 і де №5,837,672 та №5,593,846]. Ці патенти описують згадані антитіла зберігають приблизно зв'язувальпродукування мишачих моноклональних антитіл ні властивості мишачого антитіла і мають in vitro та до центрального домену Αβ пептиду, які, за повіin vivo властивості, функціонально еквівалентні домленням, мають епітопи довкола та із включенмишачому антитілу (послідовності №1-6). За інням положень 16 та 17. Було також наведено опис шим аспектом, цей винахід надає гуманізовані антитіл, спрямованих проти N-кінцевої ділянки. антитіла та їхні фрагменти, де згадані варіабельні Стверджувалось, що декілька моноклональних ділянки мають послідовності, які включають гіперантитіл вступали до імунної реакції з положеннями варіабельну ділянку мишачого антитіла 266 та 13-28 Αβ пептиду; вони не зв'язувались із пептиспецифічні людські каркасні послідовності (послідом, який представляв положення 17-28, що, за довності №7-10), де згадані антитіла зберігають згаданим патентом, встановлювало, що ця ділянприблизно зв'язувальні властивості мишачого анка, із включенням положень 16-17 (сайт αтитіла і мають in vitro та in vivo властивості, функсекретази), була мішенню цих антитіл. До числа ціонально еквівалентні мишачому антитілу 266. За антитіл, які, як відомо, зв'язуються між амінокислоіншим аспектом, цей винахід надає гуманізовані тами 13 та 28 Αβ, належать мишачі антитіла 266, антитіла та їхні фрагменти, де легким ланцюгом є 4G8 та 1С2. послідовність №11 і важким ланцюгом є послідовМи несподівано встановили, що введення анність №12. титіла 266 дуже швидко і майже повністю відновКрім того, частиною цього винаходу є полінуклює пізнавальну здатність (пам'ять на об'єкти) у леотидні послідовності, які кодують гуманізовані 24-місячних гемізиготних трансгенних мишей антитіла або їхні фрагменти, які були розкриті пе(APPV717F). Ці антитіла, однак, не мають властиворед тим, вектори, до складу яких входять полінукстей, які, за положеннями цієї галузі, є необхіднилеотидні послідовності, які кодують гуманізовані ми для того, щоб антитіло було ефективним при антитіла та їхні фрагменти, клітини-хазяї, транслікуванні хвороби Альцгеймера, синдрому Дауна формовані векторами або такі, що включають пота інших станів, пов'язаних з Αβ пептидом. Додатлінуклеотиди, які експресують гуманізовані антитіковий подив викликало спостереження, яке поляла або їхні фрагменти, фармацевтичні композиції гало у тому, що антитіла, які зв'язують Αβ між погуманізованих антитіл та їхніх фрагментів, які розложеннями 13 та 28 (266 та 4G8), є здатними до кривають у цьому описі, та способи їх одержання 9 75881 10 та використання. іншим аспектом, цей винахід спрямовано на спосіб Такі гуманізовані антитіла та їхні фрагменти є пригнічення утворення амілоїдних бляшок та випридатними для секвестрування Αβ у людей; для ведення амілоїдних бляшок у людей, який включає лікування та запобігання хвороб та станів, які хавведення людині, яка потребує такого пригнічення, рактеризуються Αβ бляшками або Αβ токсичністю ефективної кількості гуманізованого антитіла, яке у головному мозку, наприклад, хвороби Альцгейсеквеструє Αβ пептид з його циркуляторної форми мера, синдрому Дауна та церебральної амілоїдної у крові та індукує відтік із головного мозку, а також ангіопатії у людей; для діагностування цих хвороб змінює виведення Αβ із плазми та головного мозу людей; та для визначення, чи буде людина реаку. За додатковими аспектами, цей винахід спрягувати на лікування з використанням людських мовано на такі гуманізовані антитіла, у тому числі антитіл проти Αβ. на їхні імунологічно ефективні ділянки, та на споВведення відповідного гуманізованого антитісоби їх одержання. ла in vivo для секвестрування Αβ пептиду, який Цей винахід включає також способи реверсуциркулює у біологічних рідинах, є корисним для вання погіршення пізнавальної діяльності, поліппрофілактики та лікування станів, зв'язаних з шення пізнавальної діяльності, лікування погірутворенням Αβ-вмісних дифузних бляшок у перишення пізнавальної діяльності та запобігання феричних нервах та кровоносних судинах головпогіршення пізнавальної діяльності у суб'єкта, у ного мозку. Згадане гуманізоване антитіло, а таякого була діагностована клінічна або передклінічкож його імунологічно реактивний фрагмент, на форма хвороби Альцгеймера, синдром Дауна забезпечує видалення Αβ пептиду з макромолекуабо клінічна чи передклінічна форма церебральної лярних комплексів, які, за нормальних умов, були амілоїдної ангіопатії, які включають введення згаб залучені до його перенесення у загальній воді даному суб'єкту ефективної кількості гуманізованоорганізму до/з місць, у яких можуть утворюватись го антитіла за цим винаходом. бляшки або де він може бути токсичним. На додаЦей винахід включає також використання гуток до цього, секвестрування Αβ пептиду, який манізованого антитіла за цим винаходом для вигознаходиться у плазмі, антитілом або його фрагметовлення лікарського засобу, у тому числі пролоннтом, відіграє роль "поглинача", який ефективно гованої експресії рекомбінантних послідовностей секвеструє розчинний Αβ пептид у плазмовому антитіла або фрагмента антитіла у тканинах люкомпартменті та індукує проникнення Αβ до плаздини, для лікування, запобігання або реверсуванми з місцеположень у центральній нервовій сисня хвороби Альцгеймера, синдрому Дауна або темі. Завдяки секвеструванню Αβ у крові, стимуцеребральної амілоїдної ангіопатії; для лікування, люється загальний відтік із головного мозку і запобігання або реверсування погіршення пізназапобігається відкладення розчинного Αβ у формі вальної діяльності у разі клінічної або передклінічнерозчинних бляшок та утворення токсичних розної форм хвороби Альцгеймера, синдрому Дауна чинних видів у головному мозку. На додаток до або клінічної чи передклінічної форм церебральної цього, нерозчинний Αβ у бляшках, який знаходитьамілоїдної ангіопатії; або для пригнічення утвося у рівновазі з розчинним Αβ, може видалятись із рення амілоїдних бляшок або ефектів токсичних головного мозку завдяки секвеструвальному еферозчинних видів Αβ у людей. кту у крові. Секвестрування Αβ пептиду антитілом Цей винахід має відношення до спостережентакож стимулює його видалення з тіла та пригнічує ня, яке викликає подив і полягає у тому, що у метоксичні ефекти розчинного Αβ у головному мозку жах короткого періоду часу після введення антитіта розвиток і додаткове накопичення нерозчинного ла за цим винаходом, відносно великі кількості Αβ Αβ у вигляді амілоїду у бляшках. Антитіла, які вивідтікають із центральної нервової системи до користовуються у цьому винаході, не долають гекрові. Таким чином, цей винахід включає способи матоенцефалічний бар'єр у значних кількостях визначення реакції людини на лікування антиті(
ДивитисяДодаткова інформація
Назва патенту англійськоюA humanized antibody being associated with beta-amyloid peptide ((ав- polynucleic acid coding it, a pharmaceutical composition containing it, and use of said humanized antibody for making medicinal agent for prophylaxis and treatment of states associated with formation of beta-amyloid plaques
Назва патенту російськоюГуманизированное антитело, которое связывается с бета-амилоидным пептидом ((ав- ???полинуклеиновая кислота, кодирующая его, фармацевтическая композиция, которая его содержит, и применение данного гуманизированного антитела для изготовления лекарственного средства для профилактики и лечения состояний, связанных с образованием бета-амилоидных бляшек
МПК / Мітки
МПК: C07K 16/18, A61K 39/395, C12N 5/10, A61P 25/28, C12N 15/13
Мітки: полінуклеїнова, кодує, застосування, пептидом, гуманізоване, ab, антитіло, бета-амілоїдним, гуманізованого, композиція, фармацевтична, містить, даного, вигото, антитіла, зв'язується, кислота
Код посилання
<a href="https://ua.patents.su/25-75881-gumanizovane-antitilo-shho-zvyazuehtsya-z-beta-amilodnim-peptidom-ab-polinuklenova-kislota-shho-jjogo-kodueh-farmacevtichna-kompoziciya-shho-jjogo-mistit-ta-zastosuvannya-danogo-gu.html" target="_blank" rel="follow" title="База патентів України">Гуманізоване антитіло, що зв’язується з бета-амілоїдним пептидом (ab), полінуклеїнова кислота, що його кодує, фармацевтична композиція, що його містить, та застосування даного гуманізованого антитіла для вигото</a>
Наступний патент: Спосіб поверхневої обробки імплантантів та титановий імплантант
Випадковий патент: Спосіб контролю і керування роботою циклонних пиловловлювачів