Спосіб стабільного безперервного вироблення етанолу
Номер патенту: 76117
Опубліковано: 17.07.2006
Автори: Філліпс Джон Рандалл, Уікстром Карл В., Арора Дінеш К., Базу Рахул, Клосен Едгар К., Гадді Джеймз Л., Ко Чінг-Ван
Формула / Реферат
1. Спосіб стабільного безперервного вироблення етанолу шляхом анаеробної бактеріальної ферментації газоподібного субстрату, що включає:
культивування в ферментаційному бiореакторi бактерій Clostridium ljungdahlii, які здатні виробляти етанол, в рідкому поживному середовищі при рН близько 5,5 або менше;
подачу в згаданий бiореактор газоподібного субстрату, що містить монооксид вуглецю;
подачу в згаданий бiореактор пантотенату кальцію у кількості від близько 0,5 до 50 мкг/г ваги сухих клітин бактерій, утворених в згаданому біореакторі; та
підтримування питомої швидкості поглинання СО в згаданому біореакторі, щонайменш, 0,5 ммоль CO/г ваги сухих клітин бактерій за хвилину;
при цьому вільна оцтова кислота утворюється в згаданому бiореакторi при концентрації менше 5 г/л вільної кислоти, а етанол утворюється в згаданому біореакторі з продуктивністю більше 10 г/л на день, причому етанол і ацетат виробляються в згаданому ферментаційному бульйоні в згаданому ферментаційному біореакторі в співвідношенні від 1:1 до 20:1 етанолу до ацетату.
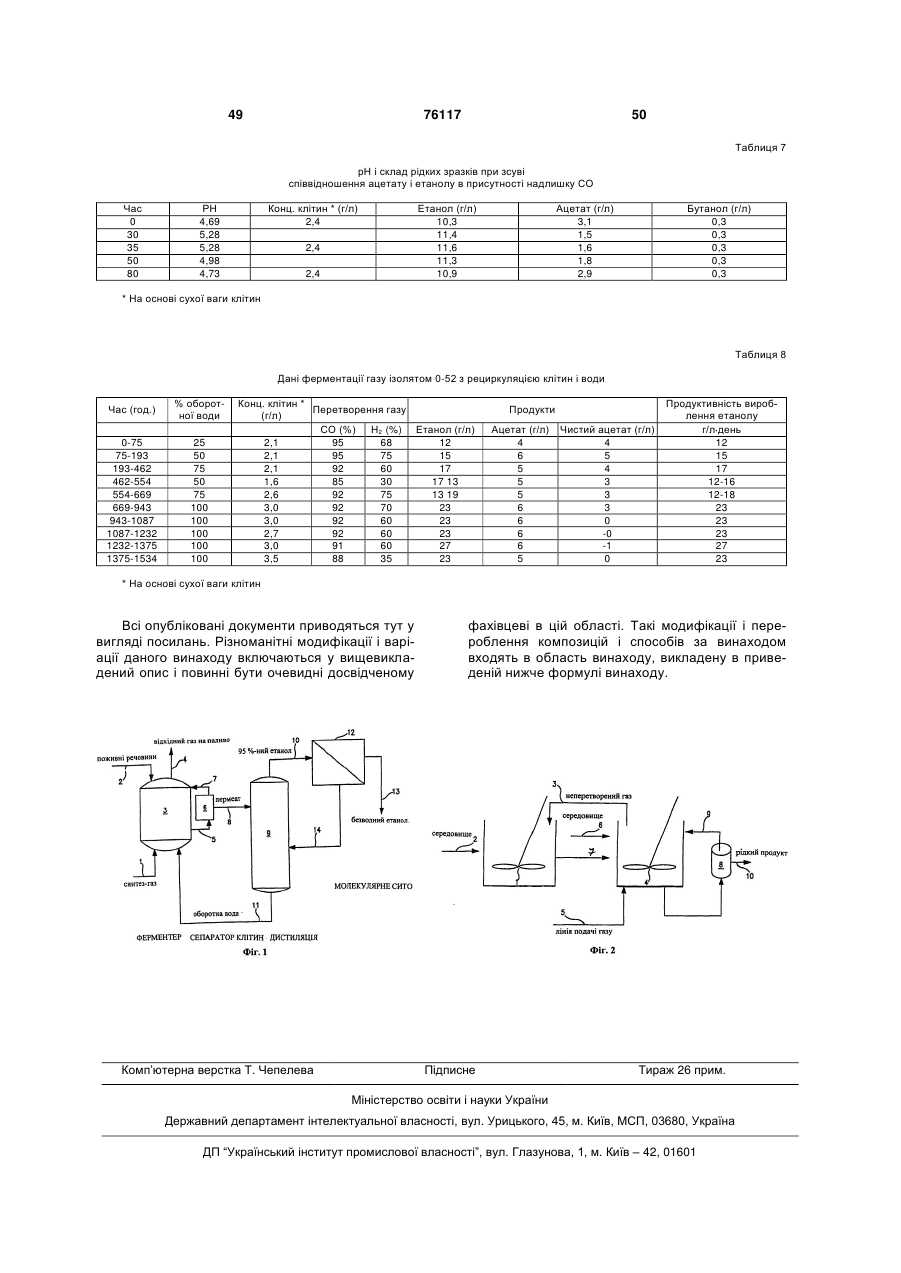
2. Спосіб за п. 1, в якому згаданий ферментаційний бiореактор включає реактор росту, з якого згаданий ферментаційний бульйон подають у другий ферментаційний бiореактор, в якому виробляється основна частина згаданого етанолу.
3. Спосіб за п. 1, який додатково включає етапи видалення згаданого ферментаційного бульйону зі згаданого бiореактора, дистиляції етанолу зі згаданого бульйону і відведення згаданого етанолу.
4. Спосіб за п. 3, який додатково включає етап рециркуляції води, що містить ацетат, відокремлюваної на згаданому етапі дистиляції, назад в згаданий ферментаційний бiореактор.
5. Спосіб за п. 1, в якому згадані Clostridium ljungdahlii вибирають зi штамiв, що включають РЕТС, ERI2, О-52 та С-01.
6. Спосіб за п. 1, в якому згаданий газоподібний субстрат вибирають з групи, що включає (а) монооксид вуглецю, (b) монооксид вуглецю і водень, та (с) монооксид вуглецю, дiоксид вуглецю і водень.
7. Спосіб за п. 1, в якому згаданий газоподібний субстрат додатково включає азот або метан.
8. Спосіб за п. 1, що додатково включає зміну щонайменше одного з параметрів, вибраних з групи, що включає склад поживного середовища, швидкість подачі поживних речовин, швидкість подачі води, робочий тиск, робочу рН, склад газоподібного субстрату, швидкість подачі газу, швидкість перемішування ферментаційного бульйону, iнгiбування продуктом, щільність клітин, iнгiбування субстратом та їх комбінації.
9. Спосіб за п. 8, що включає підвищення рН вище 4,5.
10. Спосіб за п. 8, що включає періодичне очищення згаданого бiореактора від згаданих бактеріальних клітин до отримання концентрації клітин нижче стабільної концентрації, при якій в згаданому бiореакторi використовується весь газоподібний субстрат або поживне середовище.
11. Спосіб за п. 8, який включає збільшення швидкості подачі води при перевищенні в згаданому ферментаційному бульйоні концентрації вільної оцтової кислоти, що міститься в ацетаті, значення 2 г/л для зменшення небажаного збільшення концентрації згаданої вільної оцтової кислоти.
12. Спосіб за п. 8, який включає зниження швидкості подачі згаданого газоподібного субстрату для ослаблення iнгiбування субстратом і підтримання згаданої продуктивності.
13. Спосіб за п. 8, який включає зниження згаданої швидкості перемішування для ослаблення iнгiбування субстратом і підтримання згаданої продуктивності.
14. Спосіб за п. 8, що включає подачу в згаданий бiореактор згаданого газоподібного субстрату при швидкості від 0,3 до 2 ммоль СО/г сухих клітин бактерій в згаданому бiореакторi за хвилину.
15. Спосіб за п. 14, в якому кількість СО, присутня в згаданому бiореакторi, перевищує кількість, що потрібна для підтримання стабільної концентрації згаданих бактерій, при якій буде повністю використаний присутній СО.
16. Спосіб за п. 14, в якому згадана кількість СО, присутня в згаданому бiореакторi, підтримує переважне вироблення етанолу в порівнянні з ацетатом.
17. Спосіб за п. 14, в якому згадана швидкість складає від 0,5 до 1,5 ммоль СО/г сухих клітин бактерій в згаданому бiореакторi за хвилину.
18. Спосіб за п. 6, в якому згаданий газоподібний субстрат містить монооксид вуглецю, діоксид вуглецю та водень, причому присутній надлишок водню по відношенню до зазначених монооксиду вуглецю та діоксиду вуглецю, і де зазначений надлишок водню викликає вироблення згаданими бактеріями в згаданому ферментаційному бульйоні високого відношення етанолу до ацетату.
19. Спосіб за п. 1, в якому згадана кількість пантотенату кальцію є меншою, ніж це потрібно для підтримання стабільної концентрації згаданих бактерій, при якій буде повністю використаний присутній пантотенат кальцію.
20. Спосіб за п. 1, в якому при згаданій кількості пантотенату кальцію підтримується переважне вироблення етанолу відносно вироблення ацетату.
21. Спосіб за п. 1, в якому згадана кількість пантотенату кальцію складає від 1 до 25 мкг пантотенату кальцію/г сухих клітин вироблених бактерій.
22. Спосіб за п. 1, в якому згадана кількість пантотенату кальцію складає від 2 до 25 мкг пантотенату кальцію/г сухих клітин вироблених бактерій.
23. Спосіб за п. 1, який додатково включає етап запобігання акліматизації згаданих бактерій в згаданому бiореакторi до згаданої кількості пантотенату кальцію шляхом регулювання параметрів, вибраних з групи, що включає швидкість газу, швидкість рідини та швидкість перемішування.
24. Спосіб за п. 8, в якому згадане поживне середовище додатково містить кобальт в кількості від 5 до 100 мкг/г сухих клітин бактерій, вироблених в згаданому бiореакторi.
25. Спосіб за п. 24, в якому згадана кількість кобальту менше, ніж потрібно для підтримання стабільної концентрації згаданих бактерій, при якій буде повністю використаний присутній кобальт.
26. Спосіб за п. 24, в якому при згаданій кількості кобальту підтримується переважне вироблення етанолу в порівнянні з ацетатом.
27. Спосіб за п. 24, в якому згадана кількість кобальту складає від 20 до 50 мкг кобальту/г сухих клітин вироблених бактерій.
28. Спосіб за п. 24, який додатково включає етап запобігання акліматизації згаданих бактерій в згаданому бiореакторi до згаданої кількості кобальту шляхом підтримання постійної концентрації кобальту і регулювання параметрів, вибраних з групи, що включає швидкість газу, швидкість рідини, швидкість перемішування і парціальний тиск газоподібного водню.
Текст
1. Спосіб стабільного безперервного вироблення етанолу шляхом анаеробної бактеріальної ферментації газоподібного субстрату, що включає: культивування в ферментаційному бiореакторi бактерій Clostridium ljungdahlii, які здатні виробляти етанол, в рідкому поживному середовищі при рН близько 5,5 або менше; подачу в згаданий бiореактор газоподібного субстрату, що містить монооксид вуглецю; подачу в згаданий бiореактор пантотенату кальцію у кількості від близько 0,5 до 50 мкг/г ваги сухих клітин бактерій, утворених в згаданому біореакторі; та підтримування питомої швидкості поглинання СО в згаданому біореакторі, щонайменш, 0,5 ммоль CO/г ваги сухих клітин бактерій за хвилину; при цьому вільна оцтова кислота утворюється в згаданому бiореакторi при концентрації менше 5 г/л вільної кислоти, а етанол утворюється в згаданому біореакторі з продуктивністю більше 10г/л на день, причому етанол і ацетат виробляються в згаданому ферментаційному бульйоні в згаданому ферментаційному біореакторі в співвідношенні від 1:1 до 20:1 етанолу до ацетату. 2. Спосіб за п.1, в якому згаданий ферментаційний бiореактор включає реактор росту, з якого згаданий ферментаційний бульйон подають у другий 2 (19) 1 3 76117 4 12. Спосіб за п.8, який включає зниження швидко20. Спосіб за п.1, в якому при згаданій кількості сті подачі згаданого газоподібного субстрату для пантотенату кальцію підтримується переважне ослаблення iнгiбування субстратом і підтримання вироблення етанолу відносно вироблення ацетазгаданої продуктивності. ту. 13. Спосіб за п.8, який включає зниження згаданої 21. Спосіб за п.1, в якому згадана кількість пантошвидкості перемішування для ослаблення тенату кальцію складає від 1 до 25 мкг пантотенаiнгiбування субстратом і підтримання згаданої ту кальцію/г сухих клітин вироблених бактерій. продуктивності. 22. Спосіб за п.1, в якому згадана кількість панто14. Спосіб за п.8, що включає подачу в згаданий тенату кальцію складає від 2 до 25 мкг пантотенабiореактор згаданого газоподібного субстрату при ту кальцію/г сухих клітин вироблених бактерій. швидкості від 0,3 до 2 ммоль СО/г сухих клітин 23. Спосіб за п.1, який додатково включає етап бактерій в згаданому бiореакторi за хвилину. запобігання акліматизації згаданих бактерій в зга15. Спосіб за п.14, в якому кількість СО, присутня в даному бiореакторi до згаданої кількості пантотезгаданому бiореакторi, перевищує кількість, що нату кальцію шляхом регулювання параметрів, потрібна для підтримання стабільної концентрації вибраних з групи, що включає швидкість газу, згаданих бактерій, при якій буде повністю викорисшвидкість рідини та швидкість перемішування. таний присутній СО. 24. Спосіб за п.8, в якому згадане поживне сере16. Спосіб за п.14, в якому згадана кількість СО, довище додатково містить кобальт в кількості від 5 присутня в згаданому бiореакторi, підтримує передо 100 мкг/г сухих клітин бактерій, вироблених в важне вироблення етанолу в порівнянні з ацетазгаданому бiореакторi. том. 25. Спосіб за п.24, в якому згадана кількість коба17. Спосіб за п.14, в якому згадана швидкість льту менше, ніж потрібно для підтримання стабіскладає від 0,5 до 1,5 ммоль СО/г сухих клітин льної концентрації згаданих бактерій, при якій бубактерій в згаданому бiореакторi за хвилину. де повністю використаний присутній кобальт. 18. Спосіб за п.6, в якому згаданий газоподібний 26. Спосіб за п.24, в якому при згаданій кількості субстрат містить монооксид вуглецю, діоксид вугкобальту підтримується переважне вироблення лецю та водень, причому присутній надлишок воетанолу в порівнянні з ацетатом. дню по відношенню до зазначених монооксиду 27. Спосіб за п.24, в якому згадана кількість кобавуглецю та діоксиду вуглецю, і де зазначений надльту складає від 20 до 50 мкг кобальту/г сухих клілишок водню викликає вироблення згаданими батин вироблених бактерій. ктеріями в згаданому ферментаційному бульйоні 28. Спосіб за п.24, який додатково включає етап високого відношення етанолу до ацетату. запобігання акліматизації згаданих бактерій в зга19. Спосіб за п.1, в якому згадана кількість пантоданому бiореакторi до згаданої кількості кобальту тенату кальцію є меншою, ніж це потрібно для шляхом підтримання постійної концентрації кобапідтримання стабільної концентрації згаданих бакльту і регулювання параметрів, вибраних з групи, терій, при якій буде повністю використаний присущо включає швидкість газу, швидкість рідини, тній пантотенат кальцію. швидкість перемішування і парціальний тиск газоподібного водню. Даний винахід стосується вдосконалених способів мікробної ферментації для отримання етанолу з газоподібного субстрату, що містить щонайменше один відновний газ, з використанням анаеробних (або факультативних) ацетогенних бактерій. Авторами цього винаходу попередньо були описані способи виробництва етанолу, в числі інших органічних кислот, спиртів, водню і солей органічних кислот, шляхом мікробної ферментації газоподібних субстратів у середовищі, яке містить поживні речовини і мікроелементи, з використанням певних анаеробних бактерій. Наприклад, автори описували введення розбавлених газових сумішей у біореактор, що містить один або декілька штамів анаеробних бактерій, які прямим шляхом використовують компоненти відпрацьованого газу з отриманням бажаної сполуки. Цю сполуку виділяють з водної фази в окремому резервуарі або резервуарах відповідним способом виділення цільового продукту. До способів виділення відно сяться, наприклад, екстракція, дистиляція або їх комбінації, а також інші ефективні способи виділення. Бактерії можна видаляти з водної фази і повертати в біореактор для підтримання високих концентрацій клітин і максимально високої продуктивності. Клітини відділяють, якщо це бажано, центрифугуванням, шляхом мембранної фільтрації або іншими способами. [Див., наприклад, міжнародну патентну заявку №WO98/00558, публ. 8 січня 1988; патент США №5,807,722; патент США №5,593,886 і патент США №5,821,111]. Крім основного продукту, яким є оцтова кислота, штами анаеробної бактерії Clostridium ljungdahlii здатні також виробляти етанол у якості продукту перетворення монооксиду вуглецю (СО), водню (Н2) і діоксиду вуглецю (СО2). Вироблення оцтової кислоти (СН3СООН) і етанолу (С2Н5ОН) з СО, СО2 і Н2 відбувається згідно з такими загальними стехіометричними рівняннями: (1) 4СО+2Н2О СН3СООН+2СО2 (2) 4Н2+2СО2 СН3СООН+2Н2О 5 76117 6 J.Bacteriol., 770(6):2809; Taherzadeh et al., 1996 (3) 6СО+3Н2О С2Н5ОН+4СО2 Appl. Microbiol. Biotechnol., 46:176]. (4) 6Н2+ 2СО2 С2Н5ОН+3Н2О Таким чином, в даній області техніки залишаДо штамів С ljungdahlii відносяться, наприклад, ється актуальною задача вирішення проблеми штам РЕТС [патент США №5,173,429], штам ERI2 використання промислових газоподібних субстра[патент США №5,593,886] і штами С-01 і 0-52 [патів, можливості отримання істотної вигоди від витент США №6,136,577]. Все ці штами депоновані в користання таких газів, зокрема, таких відпрацьоAmerican Type Culture Collection, 10801 University ваних газів, як Н2, CO і СО2. Існує також задача Boulevard, Manassas, VA 20110-2209 під інвентарзбільшення вироблення і етанолу відносно виробними номерами 55383 (раніше АТСС №49587), лення інших продуктів, які звичайно отримуються 55380, 55988 і 55989, відповідно. Кожний з штамів ферментацією таких газів ацетогенними бактеС. ljungdahlii є анаеробною грам-позитивною бакріями. терією з гуаніновим і цитозиновим (G+3) нуклеотиВідповідно до вказаної вище задачі, цей винадним вмістом близько 22мольних%. Для росту ці хід стосується нових способів безперервної дії, які бактерії використовують різноманітні субстрати, за є стійкими і забезпечують отримання етанолу з винятком метанолу або лактату. Ці штами відрізконцентрацією більше 10г/л при концентрації аценяються один від одного СО-толерантністю, питотату менше ~8-10г/л, з одночасним підтриманням мими швидкостями поглинання газу і питомою росту культури і її доброї стабільності. продуктивністю. У "диких" штамах, що зустрічаУ першому аспекті винахід стосується стабільються в природі, відмічений надто низький рівень ного способу безперервного вироблення етанолу вироблення етанолу. Штами С. ljungdahlii в "дикошляхом анаеробної бактеріальної ферментації му" стані відмінно функціонують при 37°С і звигазоподібного субстрату. Спосіб включає етапи чайно виробляють етанол і ацетил (що включає і культивування в ферментаційному біореакторі вільну, або молекулярну, оцтову кислоту, і її солі) анаеробних, ацетогенних бактерій в рідкому живиу співвідношенні близько 1:20 (1 частина етанолу льному середовищі і подачу в біореактор газопона 20 частин ацетилу). Концентрації етанолу звидібного субстрату, який містить щонайменше один чайно становлять лише 1-2г/л. Хоча ця здатність відновний газ, вибраний з групи, що включає CO і виробляти етанол і представляє інтерес, однак Н2. Бактерії в біореакторі піддаються впливу шлячерез низьку продуктивність "дикі" бактерії не мохом зниження окисно-відновного потенціалу або жуть бути використані для економічного виробницзбільшення відношення NAD(P)H до NAD(P) в фетва етанолу в промисловому масштабі. рментаційному бульйоні після досягнення бактеріПри невеликих удосконаленнях живильного ями сталого стану, наприклад, стабільної концентсередовища вищезазначені штами С ljungdahlii рації клітин в біореакторі. Концентрацію вільної були використані для виробництва етанолу і ацеоцтової кислоти в біореакторі підтримують на рівні тилу зі співвідношенням продуктів 1:1 (рівні частименше 5г/л. Етапи культивування і впливу забезни етанолу і ацетилу), однак концентрація етанолу печують вироблення бактеріями в біореакторі етаскладала менш 10г/л, внаслідок чого продуктивнолу в ферментаційному бульйоні з продуктивнісність не перевищувала 10г/л в день. Крім того, тю більше 10г/л на день. Етанол і ацетат існують проблеми зі стабільністю культури, головвиробляються в ферментаційному бульйоні в співним чином через відносно високу (8-10г/л) конценвідношенні від 1:1 до 20:1. трацію ацетилу (2,5-3г/л молекулярної оцтової У одному з варіантів здійснення цього способу кислоти) в присутності етанолу. Більш того, оскільвплив включає один або декілька наступних етаки для збільшення вироблення етанолу збільшупів: зміна щонайменше одного параметра, вибрається вміст газу, то відбувається інгібування кульного з групи, що включає склад живильного серетури, спочатку молекулярною оцтовою кислотою, а довища, швидкість подачі поживних речовин, потім СО. В результаті культура стає нестабільшвидкість подачі води, робочий тиск, робоча рН, ною, втрачає здатність поглинати газ і виробляти склад газоподібного субстрату, швидкість подачі додатковий продукт. Далі, в попередній роботі газу, швидкість перемішування ферментаційного авторів показана складність вироблення етанолу і бульйону, інгібування продуктом, щільність клітин і ацетилу в співвідношенні більше 2:1 при роботі інгібування субстратом. бактерій в сталому стані. [Див., наприклад, Klasson У іншому варіанті здійснення цього способу et al., 1990 Applied Biochemistry and Biotechnology, вплив включає подачу в згаданий біореактор згаProceedings of the 11th Symposium on Biotechnology даного газоподібного субстрату, що містить відноfor Fuels and Chemicals, 24/25: 857; Phillips et al., вний газ СО, при заданій швидкості поглинання. 1993 Applied Biochemistry and Biotechnology, Ця швидкість переважно складає від 0,3 до Proceedings of the 14th Symposium on Biotechnology 2ммоль СО/грам сухих клітин бактерій в згаданому for Fuels and Chemicals, 39/40: 559, та ін]. біореакторі за хвилину. У багатьох джерелах описана ферментація У наступному варіанті здійснення цього спосоцукру анаеробними бактеріями, які відрізняються бу вплив включає подачу в згаданий ферментавід С ljungdahlii і не споживають СО, СО2 і Н2 для ційний біореактор згаданого живильного середовироблення розчинників. Були зроблені спроби вища, що містить обмежену кількість пантотенату отримати високий вихід етанолу шляхом зміни кальцію. Пантотенат кальцію переважно міститься таких різноманітних параметрів, як типи поживних в кількості від 0,5 до 50мкг/г сухих клітин бактерій, речовин, мікроорганізми, специфічне додання відщо виробляються в біореакторі. новних агентів, варіювання рН і додання екзогенУ наступному варіанті здійснення способу виних газів. [Див., наприклад, Rothstein et al., 1986 користовують подачу надлишку відновного газу Н2 J.Bacteriol., 165(1 ):319-320; Lovitt et al., 1988 7 76117 8 в згаданий біореактор до подачі обмеженої кількоробництва, в якому виробляється основна частина сті пантотенату кальцію. етанолу. У наступному аспекті винахід стосується споУ наступному аспекті винаходу спосіб, описасобу, в якому етап впливу включає подачу в зганий вище, включає необов'язкові етапи виділення даний ферментаційний біореактор згаданого жиетанолу шляхом видалення ферментаційного бувильного середовища, що містить обмежену льйону з біореактора, дистиляції етанолу з булькількість кобальту. Кобальт переважно міститься в йону і відбір етанолу. Додатково або переважно, кількості від 5 до 100мкг/г сухих клітин бактерій, зразок бульйону піддають центрифугуванню для що виробляються в згаданому біореакторі. видалення клітин і за допомогою газової хроматоУ наступному варіанті здійснення спосіб за виграфії контролюють підтримання співвідношення. находом включає запобігання акліматизації згадаУ наступному аспекті спосіб за винаходом моних бактерій в згаданому біореакторі до згаданої же додатково включати етап рециркуляції води кількості кобальту шляхом підтримання постійної (що містить до 5г/л ацетилу) з реактора дистиляції концентрації кобальту і регулювання одного або етанолу назад в реактор для того, щоб в реакторі декількох параметрів, таких як швидкість газу, встановилася рівновага між етанолом і ацетилом. швидкість рідини, швидкість перемішування і парВнаслідок цього для вироблення етанолу викорисціальний тиск газоподібного Н2. товується більша кількість CO, CO2 і Н2, що подаДодаткові необов'язкові етапи цих способів ються в реактор і перетворюються в продукти. включають центрифугування зразка бульйону для Інші аспекти і переваги цього винаходу описані видалення клітин і контролю підтримання співвіднижче в докладному описі переважних варіантів ношення і/або продуктивності методом газової його здійснення. хроматографії. На Фіг.1 представлена принципова схема споУ наступному варіанті здійснення спосіб вклюсобу безперервної ферментації з виділенням прочає подачу у якості газоподібного субстрату деякої дукту за винаходом. Газоподібний субстрат 1 і кількості Н2 при невеликому перевищенні стехіорідку живильне середовище 2 подають в біореакметричної кількості, що потрібна для вироблення тор 3, в якому міститься відповідна бактеріальна етанолу. культура. Перетворення газоподібного субстрату в У наступному варіанті здійснення газоподібний етанол і оцтову кислоту здійснюється в біореакторі субстрат додатково містить СО при невеликому 3. Відхідний газ 4, що містить такі гази, як непереперевищенні кількості, потрібної бактеріям, при творені CO, СО2 і Н2 та інші гази, виводиться з цьому поглинання бактеріями водню інгібується, і біореактора 3, і його використовують у якості павідношення NAD(P)H до NAD(P) в бульйоні збільлива або спалюють в факелі. Якщо застосовується шується. Рециркуляція клітин, тоді рідкий ефлюент 5 напраУ наступному варіанті здійснення способу певляють у сепаратор клітин 6, де клітини 7 відділяредбачено етап, на якому інгібування молекулярють від пермеату 8. Клітини 7 направляють назад ною оцтовою кислотою знижують шляхом збільв біореактор 3, а пермеат 8 направляють на видішення швидкості подачі води, коли молекулярна лення продукту. Етанол може бути виділений з оцтова кислота, присутня в ферментаційному бупермеату 8 (або, в альтернативі, з ефлюенту 5, льйоні, досягає або перевищує концентрацію 2г/л. якщо сепарація клітин не використовується). ПерУ наступному варіанті здійснення способу етап меат 8 розділяють в дистиляційній колоні 9 з впливу може включати перемішування середовиотриманням дистилятного 95%-го етанолу 10 і ща, бактерій і газоподібного субстрату в біореаккубової води 11, яку направляють назад в біореакторі із заданою швидкістю перемішування. Напритор 3. Дистилятний 95%-ний етанол 10 пропускаклад, зниження швидкості перемішування знижує ють через молекулярне сито 12, де цільовий кінкількість CO, що переноситься в ферментаційний цевий продукт у вигляді безводного етанолу 13 бульйон. При такій зниженій швидкості перенесенвідокремлюють від розбавленого етанолу 14, який ня CO відбувається збільшення перетворення Н2, направляють назад в дистиляційну колону 9. внаслідок чого кількість відновного газу Н2 в біореНа Фіг.2 представлена принципова схема двоакторі перевищує кількість, потрібну для росту ступеневої системи реакторів CSTR з безперервбактерій. Подібним чином, також може бути зниним перемішуванням (CSTR - Continuous Stirred жена швидкість газу для зменшення кількості CO, Tank Reactor) для більш високої стабільності кульщо переноситься, за рахунок чого збільшується тури. На стадію росту CSTR 1 подають рідке сереперетворення Н2, внаслідок чого відновний газ Н2 довище 2. Неперетворений газ 3 зі стадії виробниприсутній в ферментаційному біореакторі в надцтва CSTR 4 подають на стадію росту CSTR 1. На лишку порівняно з необхідною для росту бактерій стадію виробництва CSTR 4 веде лінія подачі свікількістю. жого газу 5, лінія подачі свіжого середовища 6, а У наступному варіанті здійснення способу контакож лінія подачі культури 7 зі стадії росту CSTR центрація клітин бактеріальної культури в біореак1. Рециркуляція клітин 8 використовується для торі на початковій стадії може бути доведена до отримання максимального вироблення від клітин бажаної перед тим, як обмежують концентрацію 9, що направляються на стадію виробництва пантотенату кальцію або кобальту в живильному CSTR 4. Клітини 9 не повертаються на стадію россередовищі. ту CSTR 1. Рідкий продукт 10, який складається з У наступному варіанті здійснення способу за розчину етанолу в ферментаційному бульйоні, винаходом використовують двоступеневий біореанаправляють на дистиляцію, де з нього виділяють ктор CSTR, який включає реактор росту, з якого цільовий продукт у вигляді безводного етанолу, як ферментаційний бульйон подають в реактор вице показано на Фіг.1. 9 76117 10 Даний винахід включає способи анаеробної страт містить CO і Н2. У найбільш переважному ферментації газоподібних субстратів, що містять варіанті здійснення газоподібний субстрат містить щонайменше один відновний газ, зокрема, газопоCO, CO2 і Н2. Інші субстрати за винаходом можуть дібні компоненти промислових відходів і синтезвключати згадані вище компоненти і, щонайменгази (наприклад, CO, CO2 і Н2), в етанол. Ці спосоше, один такий газ, як азот, СО2, етан або метан. би забезпечують отримання етанолу з продуктивТаким чином, ці субстрати містять те, що звичайно ністю більше 10г/л в день шляхом впливу з виконазивають "синтез-газ", який утворюється при гаристанням біологічних процесів відповідних зифікації вуглецевих продуктів (включаючи метан), бактерій. Один зі способів за винаходом спричиняє а також відпрацьовані гази різних промислових утворення надлишку NAD(P)H над NAD(P). Окисвиробництв. нення NAD(P)H в NAD(P) приводить до відновленВираз "відновний газ" стосується CO або Н2, ня оцтової кислоти, що виробляється культурою, в або обох цих газів. Вираз "кількість відновного газу етанол. В альтернативі, один зі способів вироббільша, ніж потрібно для росту бактерій" означає лення високих концентрацій етанолу шляхом анатаку кількість відновного газу, яка перевищує кільеробної ферментації за винаходом включає зникість, яку бактерії можуть використати для росту ження окисно-відновного потенціалу або метаболізму при даних інгредієнтах живильноферментаційного бульйону і, таким чином, відновго середовища. Ця кількість може бути досягнута лення оцтової кислоти в етанол. Способи за винашляхом збільшення загальної кількості відновного ходом забезпечують високі концентрації етанолу газу, або шляхом зниження концентрації ключових (більше ~10г/л, переважно більше ~15г/л) і низькі поживних речовин, внаслідок чого надлишкова концентрації ацетату (менше ~5г/л вільної оцтової кількість газу досягається без збільшення подачі кислоти в біореакторі). У цих способах також здійгазу, або шляхом збільшення швидкості доставки снюється ефективне управління параметрами тегазу до бактерій. Коли бактерії зазнають впливу хнологічного процесу, які потрібні для безперервбільшої кількості відновного газу, ніж потрібно для ного вироблення етанолу і оцтової кислоти, і росту, вони реагують збільшенням вироблення забезпечується швидке відновлення системи при етанолу. збоях технологічного процесу. Крім того, способи Вираз "відповідні бактерії" означає ацетогенні за винаходом допомагають запобігти акліматизації анаеробні (або факультативні) бактерії, які здатні культури до низької концентрації поживних речоперетворювати CO і воду або Н2 і СО2 в етанол і вин, згубної для продуктивності культури. Даним оцтову кислоту. Корисні бактерії за винаходом винаходом забезпечується надійний промисловий включають, але не обмежені, штами Acetogenium спосіб виробництва етанолу. kivui, Acetobacterium woodii, Acetoanaerobium I. Визначення noterae, Clostridium aceticum, Butyribacterium Якщо не вказано інше, то перелічені нижче теmethylotrophicum, C. acetobutylicum, С рміни, що використовуються в даному описі, маthermoaceticum, Eubacterium limosum, C. ljungdahlii ють такі визначення. PETC, C. ljungdahlii ERI2, C. ljungdahlii C-01, C. Вираз "спосіб безперервної дії" стосується ljungdahlii О-52 і Peptostreptococcus productus. Фаспособу ферментації, який включає безперервні хівцями в цій області можуть бути вибрані інші процеси подачі живильного середовища, подачі ацетогенні анаеробні бактерії для використання в субстрату, продукування клітин в біореакторі, вицих способах. далення клітин (або очищення) з біореактора і Під "змішаними штамами" слід розуміти змівидалення продукту. Ці безперервні процеси пошану культуру з двох або більш відповідних бакдачі, видалення або продукування клітин можуть терій. Такі "змішані штами" перелічених вище бакздійснюватися в одному або в різних потоках. Безтерій можуть бути використані в способах за перервний процес забезпечує досягнення сталого винаходом. стану всередині біореактора. Під "сталим станом" Терміни "біореактор", "реактор" або "ферменслід розуміти, що всі ці змінні величини, які можуть таційний біореактор" означають ферментаційний бути виміряні (швидкості подачі, концентрації субпристрій, який складається з одного або більше страту і живильного середовища, що підтримуютьрезервуарів і/або колон або системи трубопровося в біореакторі, концентрація клітин в біореакторі дів, який включає бак-реактор з безперервним і швидкість видалення клітин з біореактора, швидперемішуванням CSTR (Continuous Stirred Tank кість видалення продукту з біореактора, а також Reactor), реактор для іммобілізованих клітин ICR параметри середовища типу температури і тиску) (Immobilized Cell Reactor), реактор з шаром струйзалишаються постійними у часі. ної течії рідини TBR (Tricle Bed Reactor), барботаВираз "газоподібний субстрат" означає тільки жну колону, газліфтний ферментер, статичну міCO, або суміш CO і Н2, або суміш СО2 і Н2, або шалку або інший пристрій, придатний для суміш CO, CO2 і Н2, можливо, змішані з іншими створення газорідинного контакту. У способі за елементами або сполуками, включаючи азот і мевинаходом переважно, щоб ферментаційний біотан в газоподібному стані. Такі газоподібні субреактор містив реактор росту, з якого ферментастрати містять гази або потоки, які звичайно випуційний бульйон поступає у другий ферментаційний скають або викидають безпосередньо в біореактор, в якому виробляється основна частина атмосферу або спалюють. У деяких варіантах продукту - етанолу. здійснення цього способу газоподібний субстрат Вираз "живильне середовище" тут використомістить СО. У інших варіантах здійснення цього вується загалом для позначення звичайного сереспособу газоподібний субстрат містить СО2 і Н2. У довища для бактеріального росту, яке містить відеяких варіантах здійснення газоподібний субтаміни і мінерали в достатній для росту вибраних 11 76117 12 відповідних бактерій кількості. Цукор в це середоферментаційному бульйоні, або співвідношення вище не входить. Компоненти різноманітних живиетанолу і ацетату 5:1 або більше. льних середовищ, придатні для використання в "Надлишок Н2" присутній в стадії виробництва цьому винаході, відомі і описані в попередніх пубетанолу, коли відношення молей Н2 в газі, що полікаціях, включаючи публікації авторів цього винадається, до суми подвоєної кількості молей перетходу. Див., наприклад, склади живильних середовореного CO і потроєної кількості молей перетвовищ, описані [в міжнародній патентній заявці реного СО2 перевищує 1,0. Якщо це відношення №WO98/00558, патенті США №5,807,722, патенті менше 1,0, то надлишок Н2 відсутній, і етанол моСША №5,593,886 і патенті США №5,821,111], а же бути вироблений тільки за допомогою іншого також в перелічених вище публікаціях. Типове ларегулюючого механізму. бораторне живильне середовище для виробництII. Біологічні процеси, що використовуються в ва ацетату з СО, СО2 і Н2 за винаходом містить способі за винаходом 0,9мг/л пантотенату кальцію, тоді як відоме типове Не претендуючи на створення теорії, автори лабораторне живильне середовище для виробнизробили припущення, що способи збільшення цтва етанолу з СО, СО2 і Н2 містить 0,02мг/л пананаеробного вироблення етанолу в технологічних тотенату кальцію. процесах, описаних тут, засновані на біологічних Вираз "обмежуючий субстрат" або "обмежуюпроцесах, що включають перетворення NAD(P)H в ча поживна речовина" означає речовину живильNAD(P) в основних циклах ацетогенного процесу ного середовища або газоподібного субстрату, яка автотрофного росту. Винахід включає такий вплив під час росту бактеріальної культури в біореакторі на ці процеси, який забезпечує можливість безпевичерпується культурою до рівня, при якому вже рервного виробництва і підтримання високих конне підтримується сталий стан або стабільний бакцентрацій етанолу при низьких концентраціях ацетеріальний ріст в біореакторі. Таким чином, всі інші тату в стабільних робочих умовах, що дозволяє речовини в живильному середовищі або газоподіреалізувати ефективне в промислових масштабах бному субстраті присутні в надлишку і є "необмевиробництво етанолу з промислових газів. жуючими". Ознака обмеження полягає в тому, що Суть перетворення NAD(P)H в NAD(P) в біолозбільшення швидкості додання в культуру обмегічних процесах описується таким чином. Виробжуючого субстрату, тобто, швидкості подачі пожилення етанолу з газоподібних компонентів, таких вної речовини або швидкості подачі газу, спричияк CO, CO2 і Н2, здійснюється біологічним шляхом няє відповідне збільшення швидкості поглинання в три етапи. На першому етапі субстрати CO і Н2 газу (ммоль газу в хвилину) внаслідок збільшення окиснюються, і при цьому вивільняється NAD(P)H: щільності клітин. NAD(P) NAD(P)H + Якщо не вказано інше, то вираз "ацетат" викоCO+Н2+H2O СО2+4Н ристовується для позначення суміші молекулярної Продукти етапу 1 потім перетворюються в оцабо вільної оцтової кислоти і її солей, присутньої в тову кислоту на етапі, який потребує NAD(P)H: ферментаційному бульйоні. Співвідношення молеNAD(P)H NAD(P) кулярної оцтової кислоти і ацетату залежить від CO+CO2+6H+ CH3COOH+H2O рН системи: що нижче рН при постійній концентНарешті, якщо реакція етапу 1 здійснюється зі рації "ацетату", то вище концентрація молекуляршвидкістю більшою, ніж швидкість реакції етапу 2, ної оцтової кислоти відносно її солей. і утворюється надлишок NAD(P)H, то оцтова кисВираз "концентрація клітин" в даному описі лота відновлюється в етанол: означає кількість бактерій в сухій вазі на літр зразNAD(P)H NAD(P) ка. Концентрація клітин вимірюється прямим виміСН3СООН+4Н+ С2Н5ОН+Н2О рюванням або шляхом обчислення з вимірювань Таким чином, наявність надлишку NAD(P)H оптичної густини. внаслідок окиснення субстрату приводить до виВираз "природний стан" означає будь-яку спороблення етанолу з оцтової кислоти. луку, елемент або середовище, де не містяться Відомі два основні цикли в ацетогенному прододаткові електрони або протони до присутніх цесі: (1) цикл ацетил-СоА і (2) цикл THF, в якому звичайно. І навпаки, вираз "відновлений стан" СО2 відновлюється в метильну групу. Послідовозначає будь-яку сполуку, елемент або середовиність подальшого вироблення етанолу і оцтової ще, де є один або декілька електронів у надлишку. кислоти показана у J. R. Phillips et аі, 1994 Applied "Відновлений стан" досягається шляхом додання Biochemistry and Biotechnology, 45/46:145. Цикл одного або більше електронів до "природного стаацетил-СоА має внутрішній цикл, що називається ну" і зниження окисно-відновного потенціалу фертут СО-циклом. Оскільки СО-цикл звичайно відбументаційного бульйону. вається за годинниковою стрілкою, то фередоксин "Продуктивність вироблення етанолу" означає відновлюється. Фередоксин, по мірі того як він об'ємну продуктивність, розраховану як відношенокиснюється в реакції, що каталізується фермення концентрації етанолу в сталому стані до триватом гідрогеназою, також може відновлюватися за лості утримання рідини (LRT) в системах безпередопомогою Н2. У результаті цикл ацетил-СоА тарвної дії, або відношення концентрації етанолу до кож відбувається за годинниковою стрілкою, і відчасу, потрібного для отримання цієї концентрації в бувається окиснення фередоксину. Якщо внутрішсистемах періодичної дії. Вираз "висока продуктиній СО-цикл і цикл ацетил-СоА здійснюються з вність вироблення етанолу" означає об'ємну прооднаковою швидкістю, фередоксин знаходиться в дуктивність понад 10г/л в день. окисно-відновній рівновазі. Однак, якщо ці два Вираз "висока концентрація етанолу" означає цикли здійснюються з різними швидкостями, тобто, більше ~10г/л, переважно більше 15г/л етанолу в якщо СО-цикл відбувається з більшою швидкістю, 13 76117 14 ніж цикл ацетил-СоА, то накопичується відновлеметодом. Наприклад, клітини виділяють із зразка, ний фередоксин. Крім того, при надлишку Н2 відзокрема, шляхом центрифугування, і потім аналіновлений фередоксин також може вироблятися в зують вільний від клітин зразок, переважно метонадлишку. Цей надлишок відновленого фередокдом газової хроматографії. Проте досвідченими сину викликає регенерацію (відновлення) NAD(P) в фахівцями в цій області можуть бути вибрані і інші NAD(P)H, надлишок якого, який накопичується, аналітичні методики. Додаткові необов'язкові етаповинен бути знижений до рівноваги, в процесі пи способу можуть бути введені для досягнення чого оцтова кислота відновлюється в етанол. і/або підтримання потрібного співвідношення. У Цикл THF має певне значення для клітинного Прикладі 2 показаний такий метод аналізу. росту і потрібний для процесу безперервного куПроцес впливу на компоненти системи і підтльтивування, тому він не може бути повністю зуримання і/або досягнення заданої продуктивності пинений. Зниження швидкості циклу THF також вироблення етанолу або співвідношення етанолу і підвищує відношення NAD(P)H до NAD(P). ацетату включає щонайменше один, а переважно NAD(P)H окиснюється в двох місцях. Шляхом обкомбінацію таких етапів: зміна складу живильного меження цього окиснення, яке буде підтримувати середовища, швидкості подачі живильного серезагальне клітинне відношення NAD(P)H до NAD(P) довища, швидкості подачі води, робочого тиску, в рівновазі, NAD(P)H використовується для відноробочої рН, складу газоподібного субстрату, швивлення оцтової кислоти в етанол. дкості подачі газу, швидкості перемішування ферДругий основний спосіб відновлення оцтової ментаційного бульйону, етап запобігання інгібукислоти в етанол складається в прямому зниженні ванню продуктом, зниження щільності клітин в окисно-відновного потенціалу ферментаційного біореакторі або запобігання інгібуванню субстрабульйону. Відновлений стан, коли окиснотом. Деякі переважні впливи включають подачу в відновний потенціал істотно нижче, ніж в природбіореактор рідкофазної обмежуючої поживної реному стані культури, зумовлює надлишок NAD(P)H човини (пантотенату або кобальту), створення і сприяє відновленню оцтової кислоти в етанол. невеликого надлишку CO і Н2 в газі, що подається, III. Способи за винаходом мінімізацію концентрації ацетату, запобігання Основні етапи способу викладені далі. Спосіб акліматизації культури до низьких концентрацій безперервної ферментації з виділенням продукту поживних речовин в рідкій фазі, доведення кульописаний з посиланням на Фіг.1 і на основі приветури до потрібної концентрації клітин з відносно деного нижче Прикладу 1. Безперервний потік гависокою швидкістю, підйом рН культури вище 4,5, зоподібного субстрату 1, що містить щонайменше очищення біореактора від бактеріальних клітин до один відновний газ, наприклад, CO або Н2, із задаотримання концентрації клітин нижче концентрації ною швидкістю і безперервний потік рідкого живисталого стану, при якій використовується весь відльного середовища 2 із заданою швидкістю подановний газ або поживні субстрати в біореакторі, і ються в ферментаційний біореактор 3, що містить збільшення швидкості подачі води в той момент, відповідні бактерії. У біореакторі 3 середовище і коли частина вільної оцтової кислоти в ацетаті, газоподібний субстрат ферментуються бактеріями присутньому в ферментаційному бульйоні, перез утворенням етанолу і оцтової кислоти. Коли довищує 2г/л, за рахунок чого відвертається небажасягається стабільна концентрація клітин в умовах не збільшення концентрації вільної оцтової кислосталого стану, компоненти безперервного процесу ти. Всі ці етапи детально описані нижче. піддають впливу, який знижує окисно-відновний Відхідний газ 4, що містить не перероблені в потенціал або підвищує відношення NAD(P)H до реакторі СО, СО2 і Н2 і інші гази, відводять з реакNAD(P) в ферментаційному бульйоні. При цьому тора через вентиляційні канали і використовують концентрація вільної оцтової кислоти в біореакторі відповідно до їх теплотворної здатності. Якщо у підтримується на рівні менше 5г/л. Способи за якості контрольного показника використовують винаходом забезпечують і підтримують виробленнадлишок Н2, то параметрами контролю співвідня етанолу і ацетату в ферментаційному бульйоні ношення етанолу і ацетату на цьому етапі є парцітаким чином, щоб продуктивність вироблення етаальний тиск Н2 у відхідному газі і відношення парнолу складала більше 10г/л в день при співвідноціального тиску Н2 до парціального тиску СО2 у шенні етанолу і ацетату від 1:1 до 20:1. В одному з відхідному газі. Для збільшення концентрації кліваріантів здійснення це співвідношення складає тин всередині біореактора і, таким чином, посибільше 3:1. У іншому варіанті здійснення це співлення біокаталізатора для перетворення СО, СО2 і відношення складає більше 5:1. У третьому варіаН2, може бути використана (але не обов'язково) нті здійснення це співвідношення складає більше рециркуляція клітин. У цьому випадку рідкий еф10:1. У наступному варіанті здійснення це співвідлюент з реактора 5 направляють у сепаратор кліношення складає більше 15:1. Спосіб за винахотин 6, де відбувається його розділення на клітини дом ефективний для забезпечення стабільного 7 і пермеат (рідину, що не містить клітин) 8. Клітибезперервного (здійснюваного в сталому стані) ни 7 направляють назад в біореактор 3, а пермеат отримання з СО, СО2 і Н2 високих концентрацій 8 направляють на виділення продукту. етанолу (15-35г/л етанолу) і низьких концентрацій Клітини відокремлюють за допомогою ацетату (0-5г/л ацетату), а саме, при співвідноцентрифуги безперервної дії, фільтраційної сисшенні етанолу і ацетату 3:1 або більше, при добрій теми на основі порожнистих волокон або спіральстабільності технологічного процесу. них фільтруючих елементів, керамічної фільтруПеріодично в ході технологічного процесу за вальної системи або іншого сепаратора винаходом відбирають зразки бульйону для вирідин/твердих речовин. Етанол може бути виділезначення співвідношення звичайним аналітичним ний з пермеату (або, в альтернативі, ефлюенту з 15 76117 16 реактора 5, якщо сепарація клітин не використовуNAD(P)H, а отже, збільшує вироблення етанолу у ється) різними способами, включаючи дистиляцію і якості кінцевого продукту. адсорбцію. Пермеат 8 розділяють в дистиляційній Дефіцит пантотенату існує тоді, коли кількість колоні з отриманням дистилятного 95%-го етанолу пантотенату кальцію вмкг, яка подається в реактор 10 і води 11, яку направляють назад в біореактор на 1г клітин (суха вага), що виробляються в реак3. Оборотна вода 11 містить поживні речовини, які торі, знаходиться в діапазоні від 0,5 до 100. Більш не були використані при ферментації. Вітаміни, переважна дефіцитна кількість пантотенату леякщо вони були присутні після ферментації або жить в діапазоні від 2 до 75мкг пантотенату кальклітинного лізису, в процесі термічної дистиляції цію на грам сухих клітин, що виробляються в реакруйнуються. Дистилятний 95%-й етанол 10 пропуторі. У іншому варіанті ця кількість складає скають через молекулярне сито 12, де безводний близько 1-25мкг пантотенату кальцію на грам кліетанол 13 - цільовий кінцевий продукт - відокремтин, що виробляються в реакторі. У наступному люють від розбавленого етанолу 14, який направваріанті ця кількість складає близько 10-30мкг панляють назад в дистиляційну колону 9. тотенату кальцію на грам клітин, що виробляються Безперервні і одночасні процеси росту, загив реакторі. При такій кількості поживної речовини белі і видалення клітин забезпечують підтримання підтримується переважне вироблення етанолу в постійної концентрації клітин, внаслідок чого спопорівнянні з ацетатом. Один з варіантів цього спосіб безперервної дії, що використовується у вирособу показаний в Прикладі 4. бництві етанолу (і малих кількостей оцтової кислоУ іншому аспекті даного способу відвертається ти), може здійснюватися протягом багатьох місяців акліматизація бактерій в ферментаційному біореапри подачі CO, СО2 і Н2 і поживних речовин без кторі до низької обмежуючої концентрації пантотепоповнення культури. У способах за винаходом нату кальцію за рахунок регулювання параметрів підтримуються і контролюються умови для безпеферментації таким чином, що концентрація панторервного виробництва етанолу і оцтової кислоти і тенату кальцію залишається постійною, в той час відвертаються або швидко усуваються збої технояк щонайменше один, а іноді декілька параметрів, логічного процесу. У способах за винаходом також таких як швидкість подачі газу, швидкість подачі відвертається згубна для продуктивності акліматирідини, швидкість перемішування або парціальний зація культури до низької концентрації поживних тиск Н2, регулюється. Істотних змін концентрацій речовин. У приведеному нижче описі і в приклапоживних речовин не відбувається, навпаки, зберідах, якщо не вказано інше, тиск дорівнює 1 атмогається відносно постійна концентрація живильносфері, а значення температури становить 36-41°С. го середовища. Якщо дозволити культурі аклімаТемператури і тиски можуть бути задані досвідчетизуватися до низького вмісту рідкофазних ним фахівцем в цій області в залежності від мікрообмежуючих поживних речовин, то утворюються організму, вибраного для використання в біореакнесприятливі значення співвідношення продуктів торі. 1,0г етанолу/r ацетату або менше, і технологічний Різноманітні впливи, детально описані нижче, процес стає необоротним. У цьому випадку реакякі здійснюються в доповнення до основних етапів тор припиняє роботу і потрібна реінокуляція. Пеза винаходом, дозволяють збільшити вироблення реважно, біологічний процес контролюють з метою етанолу. Переважно, обмеження рідкофазної позбільшення вироблення етанолу і обмеження виживної речовини (пантотенату або кобальту) або роблення оцтової кислоти так, щоб спочатку газ, використання надлишку Н2 або CO є етапами спощо подається в біореактор, містив надлишок Н2, а собу за винаходом, які детально описані і які викопотім обмежують вміст пантотенату кальцію в жиристовуються для досягнення і підтримання задавильному середовищі, як описано вище. ної продуктивності вироблення етанолу і Фактично, при запуску системи обмежуюча різабезпечення стабільних концентрацій і співвіддкофазна поживна речовина пантотенат кальцію ношень етанолу і ацетату в ферментаційному бузвичайно міститься в надлишку, що запобігає льйоні. У переважному варіанті здійснення відноакліматизації до його низьких концентрацій, яка шення продуктів етанолу і ацетату, що може привести до дуже низької продуктивності виробляються в ферментаційному бульйоні, склакультури і втрати культурою здатності забезпечудає більше 10:1, а концентрація етанолу - більше вати високу продуктивність вироблення етанолу 15г/л. на рівні більше 10г/л в день, якщо надлишок Н2 не А. Обмеження пантотенатом кальцію використовується. Приклад такого регулювання В одному з окремих варіантів здійснення данопараметрів ферментації для конкретної бактеріаго винаходу вплив на біологічні процеси, який льної культури показаний в Прикладі 17. сприяє виробленню етанолу і обмежує виробленВ. Обмеження кобальтом ня оцтової кислоти, включає обмеження кількості У іншому варіанті здійснення цього винаходу пантотенату кальцію в поживному середовищі до вплив на біологічні процеси, який сприяє виробвеличини, яка є меншою, ніж це потрібно для підтленню етанолу і обмежує вироблення оцтової кисримання стабільної і сталої концентрації бактерій, лоти, полягає в обмеженні кількості кобальту в при якій може бути повністю використаний присутживильному середовищі до величини, яка є менній пантотенат кальцію. Пантотенат є компоненшою, ніж це потрібно для підтримання стабільної і том циклу ацетил-СоА, і тому за рахунок дефіциту сталої концентрації бактерій, при якій може бути пантотенату кальцію в поживному середовищі повністю використаний присутній кобальт. Дефіцит швидкість циклу ацетил-СоА знижується відносно кобальту існує тоді, коли кількість кобальту, що швидкості циклу CO. Це спричиняє накопичення подається в реактор в мкг, на 1 грам клітин (суха відновленого фередоксина і відновлення NAD(P) в вага), що виробляються в реакторі, знаходиться в 17 76117 18 діапазоні від 5 до 100. Переважно, кількість кобаСО2 перевищує 0,1атм., то, швидше за все, ріст льту обмежують значеннями від -20 до 50мкг кобув обмежений іншим впливом. Див. Приклад 20, бальту в реакторі на грам клітин, що виробляютьщо ілюструє цей етап способу. ся в реакторі. При цій кількості кобальту Під час запуску використання надлишку Н2 є підтримується переважне вироблення етанолу в більш сприятливим, ніж обмеження поживними порівнянні з ацетатом. У Прикладі 18 показаний речовинами, головним чином тому, що його легше варіант способу обмеження кобальтом в реакторі контролювати. Переваги використання надлишку відповідно до винаходу. Н2 полягають у тому, що це дозволяє запобігти Дефіцит кобальту в ферментаційному бульйонадлишковому виробленню оцтової кислоти, що ні також може знижувати швидкість циклу ацетилможе привести до небажаних співвідношень проСоА. Оскільки кобальт використовується для педуктів і потенційного інгібування оцтовою кислоренесення метильної групи з циклу THF в цикл тою, а також до акліматизації до низьких концентацетил-СоА, то дефіцит кобальту в ферментаційрацій поживних речовин. ному бульйоні також знижує функціонування циклу D. Надлишкова подача монооксиду вуглецю THF за рахунок обмеження перенесення. Дефіцит Інший спосіб впливу на компоненти способу кобальту знижує швидкість циклу THF, що також полягає в надлишковій подачі відновного газу СО спричиняє збільшення відношення NAD(P)H до в складі газоподібного субстрату з метою викорисNAD(P) і, отже, збільшення вироблення етанолу. тання в процесі, який служить для прямого зниСпосіб додатково включає вплив, що запобігає ження окисно-відновного потенціалу ферментаакліматизації до низької обмежуючої концентрації ційного бульйону. Відповідно до цього варіанту в кобальту. Найчастіше таким же чином, як у разі біореактор подають газоподібний субстрат, що запобігання акліматизації до низької концентрації містить СО, при цьому кількість СО, присутнього в пантотенату кальцію, підтримується постійна конбіореакторі, перевищує кількість, потрібну для підцентрація кобальту при регулюванні одного або тримання сталої, стабільної концентрації бактерій, декількох параметрів ферментації (швидкості газу, при якій може бути повністю використаний присутшвидкості рідини, швидкості перемішування, вмісній CO. Подача CO є надлишковою і служить для ту СО2 і парціального тиску газоподібного Н2). Ісзбільшення вироблення етанолу в порівнянні з тотних змін концентрацій поживних речовин не виробленням оцтової кислоти тоді, коли питома відбувається, навпаки, підтримується відносно швидкість поглинання CO (мілімолей СО на грам постійна концентрація живильного середовища. сухих клітин в реакторі за хвилину, або ммоль/г Приклад такого регулювання параметрів ферменклітин хв.) складає більше 0,3. Більш переважною тації для конкретної бактеріальної культури покає питома швидкість поглинання СО більше 0,5. Це заний в Прикладі 19. означає, що в середньому кожна клітина викорисПереважно, для збільшення вироблення етатовує СО в своєму метаболізмі зі швидкістю щонолу і обмеження вироблення оцтової кислоти, в найменше 0,3ммоль/г клітин хв., бажано зі швидкібіореактор спочатку подають надлишок Н2, а потім стю щонайменше 0,5ммоль/г клітин хв. обмежують кобальт в живильному середовищі, як Переважно, СО вводять зі швидкістю, при якій поописано вище. При запуску системи обмежуючу глинання СО складає від 0,3 до 2ммоль СО/г сухих рідкофазну поживну речовину кобальт підтримуклітин бактерій за хвилину. Приклад 24 показує ють в надлишку для запобігання акліматизації доодин з варіантів здійснення цього етапу способу. його низьких концентрацій, яка може привести до Така швидкість поглинання СО підтримує педуже низької продуктивності культури і втрати здареважне вироблення етанолу в порівнянні з оцтотності культури забезпечувати співвідношення вою кислотою. Якщо СО подається таким чином, продуктів вище, ніж 1:1. що кількість розчиненого СО в ферментаційному C. Надлишкова подача водню бульйоні буде значним за рахунок тиску газу або У іншому варіанті здійснення винаходу вплив дуже доброго масопереносу, то ферментаційний на біологічні процеси, що сприяє виробленню етабульйон буде відновлюватися сильніше. Надлишнолу і обмежує вироблення оцтової кислоти, полякова подача СО забезпечує дві додаткові перевагає в надлишковому вмісті Н2 в газі, що подається, ги. Надлишок СО може обумовити функціонування або обмеження газоподібного вуглецю, що привоСО-циклу в прискореному режимі, і, якщо цикл дить до надлишку Н2, який потім використовується ацетил-СоА обмежений іншим способом і не може в біологічному процесі. Переважно, відновний газ бути втриманий в рівновазі з циклом СО, то буде Н2 міститься в надлишку відносно СО, і цей наднакопичуватися відновлений фередоксин. СО молишок зумовлює вироблення бактеріями продуктів же також сповільнювати етап 2 (вироблення проз високим відношенням етанолу до ацетату в феміжної оцтової кислоти) в загальному триступенерментаційному бульйоні. Якщо відношення Н2 (в вому процесі за рахунок інгібування субстратом. молях газу, що подається ) до суми подвоєної кіЦя знижена швидкість етапу 2 відносно етапу 1 лькості перетвореного СО (в молях газу) і потроєобумовлює утворення надлишку NAD(P)H, що ної кількості молей перетвореного СО2 більше 1, приводить до переважного вироблення етанолу то ферментація буде обмежуватися вуглецем. порівняно з виробленням оцтової кислоти. Парціальний тиск Н2 у відхідному газі переважно Хоч надлишок CO може привести до підвищескладає більше 0,4атм. У кінцевому рахунку відного вироблення етанолу за рахунок прямого зниношення парціального тиску Н2 до парціального ження окисно-відновного потенціалу ферментатиску СО2 повинно бути більше 3,0 для того, щоб ційного бульйону, однак присутність надлишку CO кількість Н2 була гарантовано достатньою для витакож інгібує ріст культури шляхом інгібування СОкористання всього СО2. Якщо парціальний тиск дегідрогенази і, отже, поглинання Н2. Присутність 19 76117 20 надлишку СО, на жаль, також приводить до погір2. Надлишкова подача CO і Н2 шення перетворення Н2, що може бути економічно У іншому варіанті здійснення даного винаходу несприятливим чинником. Наслідком тривалої ростабільно висока концентрація етанолу і обмежене боти в умовах інгібування субстратом є погіршенвироблення оцтової кислоти досягається тоді, коня поглинання Н2. Зрештою це викликає лізис кліли обмежені кобальт або пантотенат кальцію або тин і необхідність перезапуску реактора. Якщо забезпечений надлишок Н2 або CO. Відповідно до відбувається ненавмисне інгібування субстратом цього, оскільки культура використовує субстрат (присутність дуже великої для клітин, що є кількосCO, Н2 і СО2 У якості джерела вуглецю і енергії, ті СО) під час первинного росту культури або після CO і Н2 подають з невеликим надлишком. Невелинього, то знижують швидкість подачі газу і/або пекий надлишок CO і Н2 створюють шляхом встаноремішування, доки інгібування субстратом не влення сталого стану, а потім поступово підвищуослабляється. Ілюстрація того, як регулюється ють швидкість подачі газу і/або швидкість швидкість газу або швидкість перемішування для перемішування (з 10% або меншими приростами), здійснення цього ефекту, дана в Прикладі 21. доки перетворення CO і Н2 не почне падати. Це Е. Додаткові етапи впливу дозволяє уникнути обмеження масопереносу, яке На додаток до основних етапів поліпшення сприяє виробленню оцтової кислоти, і забезпечити способу, описаних вище, спосіб виробництва етанадлишок відновленого фередоксина для відновнолу містить ще декілька додаткових прийомів. лення NAD(P) в NAD(P)H і вироблення етанолу. 1. Збільшення масопереносу Якщо CO і Н2 не подаються з невеликим надлишОдин з додаткових варіантів здійснення вклюком, відбувається обмеження масопереносу, і біочає забезпечення більш швидкого масопереносу логічний процес урівноважується. Це приводить до СО або Н2 з лінії подачі газу в рідкий ферментанебажаних співвідношень етанолу і ацетату (висоційний бульйон у порівнянні зі здатністю бактерій ких концентрацій ацетату). Високі концентрації використовувати розчинений газ. Наприклад, якщо ацетату можуть у кінцевому рахунку привести до в біореактор, що містить С ljungdahlii, подається інгібування оцтовою кислотою, яке обмежує здатCO, CO2 і Н2, і біореактор працює без обмежень ність бактерії поглинати Н2 і зрештою приводить поживними речовинами (такими як пантотенат і до загибелі культури. кобальт) або без надлишку Н2, ріст клітин обмежеЗапобігання обмеженню масопереносу скланий кількістю газу, що переноситься в рідку фазу, і дається в збільшенні швидкості перемішування система виробляє у якості продукту оцтову кислоабо швидкості газу для перенесення більшої кільту. Якщо в культуру подається незначний надликості CO і Н2 в рідку фазу і, таким чином, знов вишок CO або Н2 у порівнянні з необхідною для росникає невеликий надлишок CO і Н2. Якщо виникає ту культури кількістю, то вона виробляє етанол. інгібування продуктом внаслідок обмеження масоПроте, якщо в рідку фазу переноситься набагато переносу, необхідно збільшити швидкість подачі більше газу, ніж може використати культура, відрідини, щоб припинити інгібування оцтовою кислобувається інгібування субстратом, яке може притою за рахунок розбавлення до більш низької конвести до пошкодження культури і до загибелі кліцентрації ацетату. Оскільки при збільшенні швидтин. Таким чином, існує дуже вузький діапазон, в кості подачі середовища буде збільшуватися якому можлива робота з надлишковим масоперекількістьмкг пантотенату або кобальту на 1 г кліносом. Приклад 22 ілюструє цей варіант. тин, що виробляються, це треба робити короткоРозглянемо знову цикл ацетил-СоА. Для того, часно або потрібно видаляти надлишок пантотещоб вироблявся надлишковий відновлений ференату або кобальту за рахунок регулювання доксин, СО-цикл або відновлення фередоксина концентрації середовища або збільшення швидкогідрогеназою повинно здійснюватися з більшою сті подачі води. швидкістю, ніж цикл ацетил-СоА. В описаних тут 3. Контроль інгібування оцтовою кислотою, що способах обмежують швидкість, з якою мікрооргавиробляється нізми можуть використовувати розчинені гази, У описаних вище способах, якщо в біореакторі шляхом обмеження швидкості, з якою незамінні накопичується надто багато молекулярної оцтової поживні речовини, наприклад, пантотенат кальцію кислоти (>2г/л), яка перешкоджає подальшому або кобальт, або інші субстрати, такі як газоподібзростанню клітин і виробленню етанолу, то може ний СО2, подаються до бактерій, або шляхом постатися інгібування оцтовою кислотою, що виробдачі в культуру надлишку субстрату, Н2 або CO. ляється. Для запобігання пошкодженню культури Може бути обчислена теоретична швидкість використовують ще один вид впливу. Одна з момасопереносу, більша, ніж швидкість використандифікацій включає короткочасне збільшення швиня субстрату бактеріями, навіть без інших обмедкості подачі рідини або води для того, щоб знизижень. Коли ця швидкість досягається, вона обмети концентрацію інгібуючої оцтової кислоти в рідкій жується природною швидкістю росту організму. фазі до величини менше 2г/л. Опис цих варіантів Тому найбільш продуктивним буде такий варіант для конкретної культури в реакторі приведений в здійснення, в якому масоперенос (швидкість течії Прикладі 23. газу або швидкість перемішування) перевищує 4. Рециркуляція води швидкість, з якою максимально можлива концентНаступний необов'язковий прийом підтриманрація клітин може використовувати субстрат без ня стабільної культури, яка виробляє етанол у обмежень. Робочий діапазон буде дуже вузьким, якості єдиного продукту, без кінцевого вироблення оскільки інгібування субстратом може швидко виоцтової кислоти, способи за винаходом включають кликати загибель клітин і утворення токсичної для додання оборотної води з процесу дистиляції накультури концентрації побічного продукту. зад в ферментаційний реактор (див., зокрема, 21 76117 22 Приклад 5). Як зазначалося вище, рециркуляція реакторі росту не застосовуються обмеження поводи (що містить до 5г/л ацетату) забезпечує ту живних речовин, описані вище, внаслідок чого куперевагу, що утворений ацетат повертається нальтура не схильна до акліматизації до обмеженого зад в реактор, і оцтова кислота у якості кінцевого стану. продукту не виробляється. Таким чином, в реактоПринципова схема такої двоступеневої систері встановлюється рівновага між етанолом і ацетами CSTR показана на Фіг.2, і далі опис містить том. У результаті весь газ СО, СО2 і Н2, який подапосилання на цю фігуру. Відповідно до цього варіється в реактор і який перетворюється в продукти, анту здійснення стадія росту відбувається при використовується для вироблення етанолу, крім тривалості утримання рідини (LRT) близько 24 тієї частини, яка використовується для підтримангодин. Стадія росту CSTR 1 забезпечується достаня культури. тньою кількістю пантотенату або кобальту в сере5. Зменшення щільності клітин довищі 2 з отриманням здорової культури (а також Наступний метод впливу, корисний в даному з можливим утворенням оцтової кислоти). Таким способі, складається в здійсненні періодичного чином, в реакторі виробляється надлишок оцтової або безперервного очищення біореактора від баккислоти, але підвищується стабільність. Ця концетеріальних клітин для зниження концентрації клінтрація пантотенату або кобальту перевищує контин в біореакторі. Цей вплив спрямований на змецентрацію, яка подавалася б в одиночний CSTR ншення концентрації клітин до величини, меншої, для виробництва етанолу. Газ, що подається в цей ніж концентрація сталого стану, при якій викорисреактор, являє собою неперетворений газ 3 зі статовується весь відновний газ або поживні субстрадії виробництва 4, а рідина, що подається, являє ти в біореакторі. Таким чином, при зміні щільності собою свіже середовище 2. Стадія росту CSTR 1 клітин вироблення етанолу переважає над виробпрацює без рециркуляції клітин. У реакторі стадії ленням ацетату в біореакторі. Див., зокрема, Приросту вирішується задача отримання свіжої кульклад 25. тури для наступного виробництва етанолу, яка не 6. Двоступенева система CSTR акліматизується до низьких концентрацій пантотеОдна з проблем, пов'язаних з виробленням нату. етанолу за допомогою обмеження середовища, Реактор стадії виробництва 4 працює при нополягає в здатності або схильності культури зрешмінальній LRT менше 20 годин. Цей CSTR з рецитою пристосовуватися до обмежуючих умов і приркуляцією клітин отримує живлення через лінію пиняти вироблення етанолу через кілька місяців подачі свіжого газу 5 і може мати низькі ступені роботи. Замість етанолу домінуючим продуктом перетворення. Він також отримує живлення через стає ацетат. Така акліматизація до низьких обмелінію подачі свіжого середовища 6 і лінію подачі жуючих концентрацій поживної речовини привокультури 7 зі стадії росту. У цей реактор подається дить до розвитку культури, яка виробляє більше мінімум пантотенату або кобальту, оскільки є надоцтової кислоти, ніж етанолу (співвідношення еталишок зі стадії росту. Рециркуляція клітин 8 виконолу і ацетату 1,0 або менше) і в результаті дає ристовується в цьому реакторі для отримання манизькі концентрації етанолу (іноді всього лише ксимального вироблення від клітин, що 1г/л). Адаптація, найвірогідніше, відбувається у направляються назад в реактор 4. Кінцева конценвипадку, коли культура не отримує достатньої кітрація етанолу в рідкому продукті 10 повинна пелькості поживних речовин під час запуску, при ревищувати 20г/л. Особливості двоступеневих якому швидкість росту має важливіше значення, систем CSTR складаються в невеликих змінах, що ніж швидкість вироблення етанолу. Крім того, існує стосуються акліматизації до низьких концентрацій небезпека, що культура може акліматизуватися до пантотенату або кобальту, загальної LRT 30 годин, низьких обмежуючих концентрацій при роботі в очікуваної підвищеної продуктивності вироблення сталому стані, зокрема, коли концентрації обмеетанолу і підвищеної концентрації етанолу в поріжуючої поживної речовини знижуються для видавнянні з одиночним CSTR того ж розміру. лення ацетату з реакційної системи. 7. Модифікації при запуску Для запобігання такій адаптації при викорисІнші етапи способу, які переважно використотанні обмеження пантотенатом або кобальтом, вуються при практичному застосуванні даного виописаного вище, може бути застосована інша монаходу, включають продукування клітин під час дифікація способу. Двоступенева система CSTR, в первинного запуску ферментаційної культури. Заякій на першій стадії здійснюється активний перпуск біореактора, що живиться СО, СО2 і Н2 для винний ріст культури при невеликому надлишку вироблення етанолу і оцтової кислоти, виконують обмежуючих поживних речовин (який, можливо, шляхом періодичної інокуляції з маточної культури супроводжується виробленням оцтової кислоти), а (Приклад 11) або шляхом безперервної подачі на наступній стадії виробництва культура з першої посівного матеріалу з існуючого реактора у вигляді стадії обмежується обмежуючою поживною речолінії подачі культури (Приклад 12). Як було зазнавиною і використовується для вироблення високих чено вище в описі запобігання акліматизації кульконцентрацій етанолу, являє собою таку модифітури до низьких концентрацій пантотенату або кацію способу. Ця модифікація дає можливість кобальту, найбільш переважно культуру доводять підтримувати стабільність культури, яка не аклімадо високої концентрації клітин перед обмеженням тизується до знижених концентрацій пантотенату поживних речовин і подачею в культуру надлишку або кобальту. Така модифікація включає роботу Н2. Такий швидкий запуск запобігає акліматизації двоступеневої системи CSTR, в якій реактор росту культури і забезпечує добрі співвідношення проду(стадія 1) живить реактор виробництва (стадія 2), ктів (високі концентрації етанолу і низькі концентде відбувається основне вироблення етанолу. У рації оцтової кислоти). Якщо швидкий запуск не 23 76117 24 застосовується, то можуть виникати небажані Після досягнення цільової швидкості переміспіввідношення продуктів, і культура може аклімашування (800-100об./хв. в лабораторному реакторі тизуватися до низьких концентрацій рідкофазної New Brunswick Scientific Bioflo®) культуру залишапоживної речовини, що приведе до необхідності ють рости до сталого стану для того, щоб збільширеінокуляції реактора. ти поглинання Н2. Запуск переходить в режим, в Реактор запускають шляхом завантаження якому важливою стає швидкість вироблення. Бапорції рідкої фази (рідке середовище спочатку не жано отримати перетворення CO більше 80% і подається в реактор безперервно) при низьких високий парціальний тиск Н2 у відхідному газі щошвидкостях перемішування (можливо, 400найменше 0,55атм. для того, щоб забезпечити 600об/хв в лабораторному реакторі New Brunswick вироблення етанолу при обмеженій концентрації Scientific Bioflo®) і при заданій рН. Таким чином, ацетату і вільної молекулярної оцтової кислоти. рідка фаза в реакторі містить порцію живильного Потім включають подачу рідкого середовища (для середовища з вітамінами і солями, при номінальсистем з однократною інокуляцією з маточної куній концентрації обмежуючої поживної речовини, льтури) для ініціювання безперервної подачі рідипантотенату кальцію або кобальту (наприклад, ни, а швидкість подачі газу збільшують з 10%-ми 20мкг/л пантотенату або 75млн-1 кобальту). При приростами до досягнення цільової швидкості тевикористанні безперервної інокуляції з існуючого чії. Н2 залишається в надлишку для запобігання реактора завантаження порції рідкої фази може надлишковому виробленню оцтової кислоти. По бути необов'язковим. В цьому випадку газ безпемірі збільшення швидкості газу рідкофазні поживні рервно подають в реактор при первинному запуску речовини обмежують (пантотенат кальцію або з низькою швидкістю. В ідеалі газова фаза при кобальт), внаслідок чого відбувається невеликий запуску не повинна містити СО2, повинна містити спад в перетворенні Н2 при цільовій продуктивноснадлишок Н2, а швидкість газу і швидкість переміті. шування повинні бути невеликими для запобігання При роботі в сталому стані досягається вироінгібуванню субстратом CO. блення 15-35г/л етанолу і 0-5г/л ацетату. На цьому Типовий загальний протокол вироблення і підетапі необхідні невеликі коректування стосовно тримання ефективних в промисловому масштабі обмежуючих поживних речовин, швидкостей подаконцентрацій етанолу з CO, CO2 і Н2 складається з чі рідини і швидкостей подачі газу, які вибираються трьох окремих фаз: (а) первинний запуск, при якодосвідченим фахівцем на основі теоретичних дому найважливішим чинником є продукування клісягнень в цій області і принципів цього винаходу. тин; (b) запуск, при якому найважливішим чинниЯкщо спосіб виробництва етанолу повинен бути ком стає швидкість вироблення; і (с) робота в доповнений рециркуляцією клітин, то вона ввосталому стані. Первинний запуск по суті відрізнядиться на цьому етапі одночасно з регулюванням ється інокуляцією порції рідини, що містить номішвидкості газу (збільшенням) і концентрації пожинальну кількість обмежуючої поживної речовини, вної речовини (зменшенням). вибраної з кобальту (75 млн-1) або пантотенату Описані вище способи безперервного виробкальцію (20мкг/л), при заданій рН (звичайно 4,5лення і підтримання високих концентрацій етанолу 5,5). Для полегшення запуску швидкість подачі при низьких концентраціях побічного ацетату в газу і швидкість перемішування переважно підтстабільних робочих умовах покращують викорисримують низькими, а Н2 подають в надлишку. Чинтання відповідних бактерій для промислового виником вироблення етанолу під час запуску є надробництва етанолу з CO, CO2 і Н2. У способі перелишок Н2; поживну речовину обмежують пізніше. важним є використання біореактора безперервної Таким чином, під час запуску фактично присутній дії, хоч періодична ферментація і ферментація з надлишок рідких поживних речовин, що запобігає підживленням також придатні, але навряд чи бунебажаній акліматизації культури до низького вмідуть економічно ефективними для великомасштасту поживних речовин. По мірі продовження фербного виробництва етанолу. ментації протягом декількох годин після інокуляції, Наступні приклади ілюструють різні аспекти, відбувається вироблення СО2 і споживання Н2. способи і етапи способів за винаходом. Ці приклаЗміни в цих швидкостях означають, що швидкість ди не обмежують винахід, область якого викладеперемішування слід повільно підвищувати до нона в формулі винаходу, що додається. мінальної (можливо, на 200-300об./хв. в лаборатоПРИКЛАД 1. ІЛЮСТРАТИВНИЙ СПОСІБ ЗАрному реакторі протягом 2-3 днів) для запобігання ДАНИМ ВИНАХОДОМ обмеженню масопереносу. Синтез-газ або відпрацьований газ, що містить Початок вироблення СО2 відбувається набагаCO і/або СО2/Н2, безперервно вводять в бакто швидше в системах, в яких використана безпереактор з безперервним перемішуванням, що місрервна інокуляція, в протилежність від однократтить штам С. ljungdahlii, разом із звичайним рідким ної інокуляції з маточної культури. Проте, якщо середовищем, що містить вітаміни, мікроелементи швидкість перемішування збільшується дуже швиі солі. Склад одного з переважних живильних седко, відбувається інгібування субстратом CO. редовищ приведений нижче в Таблиці 1. Швидкість перемішування збільшують відносно При запуску з використанням інокуляту кульшвидко під контролем перетворення Н2 (або виротури 10% або менше реактор працює при заванблення СО2) доти, доки не буде досягнута цільова таженні порції рідкої фази, тобто, рідке середовишвидкість перемішування. Протягом цього часу ще не подають в реактор безперервно. Таким збільшення швидкості перемішування в порції рідчином, рідка фаза в реакторі складається з порції кої культури найважливіше значення має процес поживної середовища з номінальною концентраціпродукування клітин, а не вироблення продукту. єю обмежуючої поживної речовини, пантотенату 25 76117 26 кальцію або кобальту. У альтернативі також може 125мл/хв. бути використане збагачене середовище, що місВажливо забезпечити надлишок Н2 в газі, що тить дріжджовий екстракт, триптиказу або інші подається, для запобігання надлишковому виробкомплексні поживні речовини. ленню оцтової кислоти. По мірі збільшення швидВ ідеалі, газова фаза під час запуску не міскості газу збільшується продукування клітин, поки тить СО2 і містить надлишок Н2. Швидкість газу і не виникне обмеження в рідкофазних поживних швидкість перемішування підтримують на низькоречовинах (пантотенат кальцію або кобальт), що му рівні (нижче 500об./хв. в ферментаційному біобуде помітно через невелике падіння перетворенреакторі New Brunswick Scientific Bioflo®) з отриня Нг при цільовій продуктивності. У CSTR New манням CO і Н2 з невеликим надлишком, але, в Brunswick Scientific Bioflo® це можна помітити четой же час, із запобіганням інгібуванню СОрез 10%-не падіння перетворення Н2 при цільовій субстратом. В однолітровому лабораторному фепродуктивності 20г/л в день. рментаційному біореакторі New Brunswick Потім технологічний процес і систему реактоScientific Bioflo®, наприклад, в якому до складу рів підтримують в сталому стані при виробленні газу, що подається, входить 63% Н2, 32% CO і 5% 15-35г/л етанолу і 0-5г/л ацетату у якості продуктів, СН4, швидкість перемішування для первинного лише з невеликими коректуваннями в обмежуючих запуску становить 400об./хв., а швидкість газу поживних речовинах, швидкостях рідини і газу. 20мл/хв. Чинником вироблення етанолу під час Типові умови сталого стану в лабораторному фезапуску є надлишок Н2; обмеження поживної речорментаційному біореакторі New Brunswick вини здійснюється пізніше. Таким чином, під час Scientific Bioflo® без рециркуляції клітин включають запуску фактично присутній надлишок рідких потривалість утримання газу (рідинний об'єм реактоживних речовин (пантотенату, кобальту), що запора/швидкість течії газу) 20 хвилин, тривалість бігає небажаній акліматизації культури до низького утримання рідини (рідинний об'єм реактовмісту поживних речовин. ра/швидкість течії рідини) 30 годин і швидкість пеПо мірі продовження ферментації протягом кіремішування 900об./хв., з перетворенням CO 92% лькох годин після інокуляції, СО2 виробляється і перетворенням Н2 60% при обмеженні пантотешляхом перетворення CO, а Н2 споживається ранатом. зом з СО2, що є сигналом до підвищення швидкосВ одному з варіантів здійснення цього способу ті перемішування до номінальної величини, щоб система реакторів доповнена рециркуляцією кліуникнути обмеження масопереносу. У CSTR New тин, і рециркуляцію вводять на цьому етапі одноBrunswick Scientific Bioflo® відхідний газ включає часно з регулюванням швидкості газу (збільшен25% CO, 67% Н2, 2% СО2 і 6% СН4. Якщо швидням) і концентрації поживної речовини кість перемішування збільшується дуже швидко, (зменшенням). При рециркуляції клітин в CSTR відбувається інгібування субстратом CO, що відNew Brunswick Scientific Bioflo® тривалість утризначається зниженням концентрації метану після мання газу звичайно становить 8 хвилин, триваприскорення перемішування. Таким чином, швидлість утримання рідини 40 годин, а швидкість пекість перемішування, як правило, підвищується на ремішування 900об./хв. Ці умови звичайно 200 об/хв. за 24 години. Ця операція підвищення забезпечують перетворення 92% CO і 50% Н2 при швидкості перемішування під контролем виробобмеженні пантотенатом. лення СО2 (або перетворення Н2) здійснюється ПРИКЛАД 2. АНАЛІЗ ЗРАЗКІВ ШЛЯХОМ ГАдоти, доки не буде досягнута цільова швидкість ЗОВОЇ ХРОМАТОГРАФІЇ перемішування. Типова цільова швидкість переДля досягнення і/або підтримання потрібної мішування в ферментаційному біореакторі New продуктивності і співвідношення, періодично поBrunswick Scientific Bioflo® становить 900об./хв. Під винні відбиратися зразки ферментаційного бульчас цього підвищення швидкості перемішування в йону з ферментаційного біореактора. Зразок більпорції рідкої культури найважливіше значення має ше, ніж 1,5мл культури відбирають з культури в продукування клітин, а не вироблення продукту. біореакторі. Зразок вміщують в мікроцентрифужну Таким чином, досягається концентрація клітин пробірку, а пробірку вміщують в центрифугу Fisher близько 1,5г/л, при цьому типові концентрації проScientific Micro 14 з необхідним баластом для рівдуктів становлять 10г/л етанолу і 2г/л ацетату з новаги. Зразок центрифугують при 8000об./хв. порції культури. протягом 1,5хв. 0,500-мл зразок супернатанта Після досягнення цільової швидкості перемівміщують в 1,5-мл ампулу, призначену для викошування культуру залишають рости доти, доки ристання в автодозаторі газового хроматографа. поглинання Н2 не досягне максимального значен0,500-мл зразок внутрішнього еталонного розчину ня. Бажано отримати дуже високі концентрації Н2 в містить 5г/л n-пропанолу і 5% (об./об.) 85%-ної відхідному газі (звичайно >60%), щоб забезпечити фосфорної кислоти в деіонізованій воді. Наявність вироблення етанолу при обмеженому виробленні фосфорної кислоти гарантує, що весь ацетат пеоцтової кислоти. Потім включають подачу рідкого ретвориться на оцтову кислоту і буде виявлений середовища (для систем з однократною інокуляцігазовою хроматографією. єю з маточної культури) для ініціювання безперер1мкл підготовленого зразка вводять за доповної подачі рідини, а швидкість газу підвищують до могою автодозатора в Hewlett-Packard 5890 Series цільової. У лабораторному ферментаційному біоII Gas Gromatograph, оснащений капілярною колореакторі New Brunswick Scientific Bioflo® швидкість нкою 007 FFA Quadrex 25м 0,53мм (внутрішній подачі рідини звичайно становить 0,5мл/хв., а діаметр) з плавленим кварцом. Аналіз проводять з швидкість течії газу збільшують на 10-15% кожні використанням гелію у якості газу-носія у двопото24 години до досягнення цільової швидкості в чному режимі зі швидкістю 66мл/хв. розділеного 27 76117 28 потоку і 7,93мл/хв. інжекторної продувки. Тиск на чих рівнів пантотенату або кобальту. Щоб показавиході з колонки встановлюють на 27кПа (4 psig), ти це, однолітровий лабораторний ферментаційщо забезпечує швидкість течії носія в колонці ний біореактор New Brunswick Scientific Bioflo® мо7мл/хв. Температурна програма включає витримку дифікували таким чином, щоб істотно знизити при 75°С протягом 2 хвилин, підйом до 190°С зі подачу кобальту до рівня трохи вище концентрації швидкістю 30°С/хв. і витримку при 190°С протягом обмеження кобальтом. Реактор знову містив С. 5,17 хвилин. Загальний час прогону становить 8 Ijungdahlii, штам ERI2, для вироблення оцтової хвилин. Прилад калібрують для етанолу (0-25г/л), кислоти з CO, СО2 і Н2. Газ, що подавався, містив оцтової кислоти (0-25г/л), n-бутанолу (0-5г/л) і ма55% Н2, 25% CO і 5% СН4, а тривалість утримання сляної кислоти (0-5г/л). П'ять еталонів, приготовагазу становила 7,5-8,0 хвилин. Рідке середовище, них з матеріалів з різним вмістом реагенту, викощо містить вітаміни, солі і мікроелементи, подаваристовують для калібрування. Якщо зразок не ли при тривалості утримання рідини від 3,0 до 3,5 попадає в калібрувальний діапазон концентрацій годин, а тривалість утримання клітин становила 40 (наприклад, >25г/л етанолу), 0,250мл зразка і годин. рН становила 5,0-5,3, а швидкість перемі0,250мл деіонізованої води вміщують в ампулу з шування 900-1000об./хв. У цих умовах перетво0,500мл внутрішнього еталона і факт розбавлення рення CO склало 95-99%, а перетворення Н2 - 94враховують при аналізі. 98%. Концентрація клітин склала 2,5-4г/л, а ацетат ПРИКЛАД 3: ВИРОБЛЕННЯ КИСЛОТИ В ЛАбув єдиним продуктом, що вироблявся з концентБОРАТОРНОМУ CSTR З РЕЦИРКУЛЯЦІЄЮ КЛІрацією 10-14г/л. ТИН Кількість Ca-d-пантотенату, яка подавалася на У лабораторному ферментаційному біореакграм клітин, що виробляються, становила 2250торі New Brunswick Scientific Bioflo®, працюючому 3600мкг пантотенату/г вироблених клітин. Кількість з рециркуляцією клітин, використовували С кобальту, що подавалася на одиницю клітин, що ljungdahlii, штам ERI2, АТСС 55380, для виробленвиробляються, була знижена до діапазону 62,0ня оцтової кислоти з CO, CO2 і Н2. Газ, що подава99,2мкг кобальту/г вироблених клітин. Питома вся, містив 40% Н2, 50% CO і 10% N2, а тривалість швидкість поглинання CO склала 0,325-0,4ммоль/г утримання газу в однолітровому реакторі становиклітин хв. Відношення молей Н2, що подається, до ла 7,7-8,6 хвилин. Рідке середовище, що містить суми подвоєної кількості молей перетвореного CO вітаміни, солі і мікроелементи, подавали при триі потроєної кількості молей перетвореного СО2 валості утримання рідини від 2,6 до 2,9 годин. рН склало 0,875. становила 5,1-5,2, швидкість перемішування ПРИКЛАД 4. ВИРОБЛЕННЯ ЕТАНОЛУ В ЛА1000об./хв., а тривалість утримання клітин - близьБОРАТОРНИХ CSTRS З ОБМЕЖЕННЯМ ПАНТОко 40 годин. У цих умовах обмеження масопереноТЕНАТУ су (але не обмеження поживної речовини) перетЛабораторний ферментаційний біореактор ворення CO склало 94-98%, а перетворення Н2 New Brunswick Scientific Bioflo® II працював як 80-97%. Концентрація клітин склала 4-8г/л, а ацепрямоточний CSTR (без рециркуляції клітин) з тат вироблявся з концентрацією 10-13г/л. Етанол використанням С Ijungdahlii, штам С-01, АТСС не вироблявся. Хоча реактор працював в умовах 55988, для вироблення етанолу з CO, CO2 і Н2 при обмеження масопереносу (обмеження можливості обмеженні пантотенатом. Газ, що подавався, місперенесення газу в культуру) і, таким чином, виротив 63,3% Н2, 31,4% CO і 5,3% С2Н6 (газ порівнянбляв у якості продукту тільки оцтову кислоту, контня); тривалість утримання газу при подачі станоролювалися параметри, важливі для вироблення вила 27 хвилин. Рідке середовище, що містить етанолу шляхом обмеження пантотенатом, обменадлишок солей і мікроелементів і обмежену кільження кобальтом або при надлишку Н2 або CO, які кість пантотенату, подавали в 1,55-літровий реакслужили порівнянням для визначення моменту, тор при тривалості утримання рідини 31,4 години. коли етанол починає вироблятися як домінуючий рН становила 4,6-4,7, а швидкість перемішування продукт. 650об./хв. В цих умовах перетворення CO склало Як показано в Таблиці. 2, кількість Ca-d98%, перетворення Н2 - 83%, а концентрація кліпантотенату, яка подавалася на одиницю клітин, тин 1,5-2,0г/л. Етанол вироблявся з концентрацією що виробляються, становила 1575-3150мкг/г ви15-19г/л, ацетат - з концентрацією 1,5г/л. Продукроблених клітин. Подібним чином, кількість кобативність вироблення етанолу знаходилася в діапальту на грам вироблених клітин становила 1734зоні від 11,5 до 14,5г/л день. 3468мкг/г вироблених клітин. Питома швидкість При аналізі параметрів вироблення етанолу поглинання СО склала 0,35-0,61ммоль/г клітин хв. обмеження пантотенатом спостерігалося при поВідношення молей Н2, що подається, до суми поддачі пантотенату до клітин, що виробляються, у воєної кількості молей перетвореного СО і потроєкількості 17,7-23,6мкг пантотенату/г вироблених ної кількості молей перетвореного СО2 склало меклітин. Порівняйте цей коефіцієнт з 2250-3600мкг нше 0,46. Таким чином, жоден з параметрів не пантотенату/г вироблених клітин, і 1575-3150мкг попадав в бажаний робочий діапазон для виробпантотенату/г вироблених клітин у Прикладі 3, де лення етанолу культурою. вироблялася оцтова кислота. Кількість кобальту, Зрозуміло, що пантотенат і кобальт подавалищо подається на одиницю вироблених клітин, ся у вказаний реактор у великому надлишку під склала 5000-6000мкг кобальту/г вироблених клічас вироблення оцтової кислоти у якості продукту тин, значно більш високий рівень, ніж в Прикладі 3, в умовах обмеження масопереносу. Тобто, рівні в якому було гарантовано відсутнє обмеження пантотенату і/або кобальту могли бути істотно кобальтом. Питома швидкість поглинання CO знижені, і все одно залишалися б вище обмежуюсклала 0,23-0,30ммоль/г клітин«хв. Відношення Н2, 29 76117 30 що подається, до суми подвоєної кількості перетобмеженні кобальтом. Газ, що подавався, містив вореного CO і потроєної кількості перетвореного 60% Н2, 35% CO і 5% СН4 (газ порівняння); триваСО2 склало 1,03, а парціальний тиск Н2 у відхіднолість утримання газу при подачі становила 14 хвиму газі склав 0,55-0,64атм. Певно, або надлишок лин. Рідке середовище, що містить надлишок соН2, або обмежена кількість пантотенату зумовила лей, вітамінів і мікроелементів і обмежуючу вироблення етанолу. кількість кобальту, подавали в 2,5-літровий реакОбмеження пантотенату для вироблення етатор при тривалості утримання рідини 40 годин. рН нолу було також продемонстроване в іншому ластановила 4,9, а швидкість перемішування 650 бораторному реакторі New Brunswick Scientific об/хв. В цих умовах перетворення CO становило Bioflo® II, працюючому з рециркуляцією клітин при 91%, перетворення Н2 змінювалося від 20 до 80%, використанні С. ljungdahlii, штам С-01 АТСС 55988. але номінально становило 55%. Етанол вироблявУ цей реактор подавали газ, що містить 61,7% Н2, ся з концентрацією 26г/л, ацетат - з концентрацією 30,6% CO і 5,2% С2Н6 (газ порівняння) при трива4г/л, а концентрація клітин становила 2,5г/л. Пролості утримання газу 12,3 хвилини. Рідке середодуктивність вироблення етанолу склала вище, що містить обмежену кількість пантотенату і 15,6г/л день. надлишок солей і мікроелементів, подавали в 2,4При аналізі параметрів вироблення етанолу літровий реактор при тривалості утримання рідини подача пантотенату до клітин, що виробляються, 24,8 години. Рециркуляцію клітин проводили з вистановила 15,2мкг пантотенату/г вироблених клікористанням мембрани з порожнистих волокон, і тин. Цей рівень настільки низький, що обмеження тривалість утримання клітин становила 69 годин. кобальтом може не мати переваги перед обмерН становила 4,6, а швидкість перемішування 650 женням пантотенатом. Обмеження кобальтом спооб/хв. У цих умовах перетворення CO склало 90%, стерігалося при роботі з кількістю кобальту 33,3мкг перетворення Н2 - 53%, а концентрація клітин кобальту/г вироблених клітин, тобто, при рівні, 2,5г/л. Етанол вироблявся з концентрацією 18г/л, який в 100 раз менше, ніж використовується в реаацетат - з концентрацією 3г/л. Продуктивність викторах без обмеження кобальтом. Відношення Н2, роблення етанолу склала 17,4г/л день. що подається, до суми подвоєної кількості перетПри аналізі параметрів вироблення етанолу вореного CO і потроєної кількості перетвореного (Таблиця 2) подача пантотенату на одиницю кліСО2 склало 0,94. Питома швидкість поглинання тин, що виробляються, становила 8,08мкг пантоCO склала 0,37ммоль/г клітин хв. тенату/г вироблених клітин. Знов-таки, обмеження Обмеження кобальтом для вироблення етанопантотенату було забезпечене шляхом роботи лу було також продемонстровано в CSTR з рецирсистеми при рівні пантотенату набагато меншому, куляцією клітин, що використовував С ljungdahlii, ніж це потрібно для вироблення ацетату. Кількість штам С-01 АТСС 55988. Цей дослід був проведекобальту, що подається на одиницю клітин, що ний для демонстрації обмеження кобальтом в виробляються, склала 3960мкг кобальту/г виробприсутності надлишку пантотенату, в протилежлених клітин. Питома швидкість поглинання СО ність попередньому досліду в цьому прикладі. У склала 0,33ммоль/г клітин хв. Відношення Н2, що лабораторний ферментаційний біореактор New подається, до суми подвоєної кількості перетвореBrunswick Scientific Bioflo® 2000 з 0,2-мкм мембраного СО і потроєної кількості перетвореного СО2 ною з порожнистих волокон для рециркуляції клісклало 1,14, а парціальний тиск Н2 у відхідному тин подавався газ, що містить 60% Н2, 35% CO і газі склав 0,60-0,65атм. Надлишок Н2 міг би бути 5% СН4 (газ порівняння) при тривалості утримання причиною вироблення етанолу, проте високий газу 5 хвилин. Рідке середовище, що містить надвміст СО2 у відхідному газі (0,14атм.) показує, що лишок солей, вітамінів і мікроелементів і, зновріст був обмежений пантотенатом. таки, обмежуючу кількість кобальту, подавали в В іншому досліді в культуру С ljungdahlii, штам 1,2-літровий реактор при тривалості утримання ERI2, подавали 1500-3600мкг пантотенату/г вирорідини 16 годин. рН становила 5,1, а швидкість блених клітин під час вироблення оцтової кислоти перемішування 825об./хв. Тривалість утримання з СО, СО2 і Н2, що являє собою умову, при якій клітин в цьому CSTR з порожнистими волокнами система не обмежена пантотенатом (або будьдля рециркуляції клітин становила 40 годин. У цих яким іншим обмежуючим чинником, крім можливоумовах перетворення CO склало 83%, перетвості перенесення газу в культуру), і етанол не був рення Н2 - 50%, а концентрація клітин 4,2г/л. Етавиявлений в потоку продукту. нол вироблявся з концентрацією 18г/л, ацетат - з Під час обмеження пантотенатом для виробконцентрацією 4г/л. Продуктивність вироблення лення етанолу з CO, СО2 і Н2 в С. ljungdahlii, штам етанолу склала 27г/л день. С-01 подавали 8-24мкг пантотенату/г вироблених При аналізі параметрів вироблення етанолу в клітин, при підтриманні всіх інших поживних речоцьому реакторі (Таблиця 2) подача пантотенату на вин у надлишку. В цих умовах штам С-01 вирободиницю клітин, що виробляються, становила ляв 15-19г/л етанолу і 1,5-3,0г/л ацетату. 85,7мкг пантотенату/г вироблених клітин, тобто, в ПРИКЛАД 5. ВИРОБЛЕННЯ ЕТАНОЛУ В ЛА5,5 разів більше, ніж в попередньому досліді в БОРАТОРНИХ CSTRS З ОБМЕЖЕННЯМ КОБАцьому прикладі. Обмеження кобальтом спостеріЛЬТОМ галося при роботі з 47,6мкг кобальту/г вироблених Лабораторний ферментаційний біореактор клітин. Відношення Н2, що подається, до суми поNew Brunswick Scientific Bioflo® II працював як двоєної кількості перетвореного СО і потроєної прямоточний CSTR (без рециркуляції клітин) з кількості перетвореного СО2 склало 1,03, а парціавикористанням С. ljungdahlii, штам С-01, АТСС льний тиск Н2 у відхідному газі склав 0,60атм. 55988, для вироблення етанолу з CO, CO2 і Н2 при Знов-таки, надлишок Н2 міг би бути причиною ви 31 76117 32 роблення етанолу, проте високий вміст СО2 у відшування 1000об./хв., а швидкість рециркуляції хідному газі (0,1-0,15атм.) показує, що ріст був рідини 0,4-0,5 галонів на хвилину. У цих умовах обмежений кобальтом. Питоме поглинання СО перетворення CO склало 71,6%, а перетворення Н2 склало 11,8%. Концентрація клітин була 7,1г/л, склало 0,50ммоль/г клітин хв. етанол вироблявся з концентрацією 12,0г/л, а ацеПРИКЛАД 6. ВИРОБЛЕННЯ ЕТАНОЛУ В ЛАтат - з концентрацією 2,7г/л. Продуктивність вироБОРАТОРНИХ CSTRS ПРИ РОБОТІ З НАДЛИШблення етанолу склала 60г/л день. КОМ СО Реактор високого тиску AUTOCLAV™ (Buchi) При аналізі параметрів вироблення етанолу працював як CSTR з циркуляцією культури і реци(Таблиця 2) подача пантотенату на одиницю кліркуляцією клітин при використанні С ljungdahlii, тин, що виробляються, становила 294мкг пантотештам С-01, для вироблення етанолу з CO, СО2 і Н2 нату/г вироблених клітин. Цей рівень набагато в присутності надлишку CO протягом періоду 50 вище мінімального рівня, який викликає виробленгодин. Реактор працював при 170кПа (25 psig), а ня етанолу внаслідок обмеження пантотенатом. газ, що подавався, містив 57% Н2, 36% CO і 6% Кількість кобальту, яка подається на одиницю кліС2Н6. Тривалість утримання газу була змінною, тин, що виробляються, становила 735мкг кобальале номінально становила 3,0хв. Рідке середовиту/г вироблених клітин, також на рівні, який забезще, що містить надлишок солей, вітамінів (вклюпечує надлишок кобальту. Відношення Н2, що чаючи пантотенат) і мікроелементів, подавали в подається, до суми подвоєної кількості перетворе600-мл реактор при тривалості утримання рідини ного CO і потроєної кількості перетвореного СО2 8,2 години. Тривалість утримання клітин, отримана склало 0,3. Швидкість поглинання CO склала шляхом пропускання ефлюента з реактора через 0,67ммоль/г клітин хв., тобто, рівень, який знову керамічний фільтр з порожнистими волокнами, забезпечує надлишок CO як чинник вироблення становила 18,5 годин. рН становила 4,5, швидкість етанолу. перемішування 450об./хв., а швидкість рециркуляПРИКЛАД 7. ВИРОБЛЕННЯ ЕТАНОЛУ В ції рідини 0,4-0,5gpm (галонів на хвилину). У цих ПРИСУТНОСТІ НАДЛИШКУ Н2 умовах перетворення газів було змінним, але пеЛабораторний ферментаційний біореактор ретворення CO номінально склало 72%, а перетNew Brunswick Scientific Bioflo працював як прямоворення Н2 номінально склало 12%. Концентрація точний CSTR (без рециркуляції клітин) з викорисклітин була 2,7г/л. Етанол вироблявся з конценттанням С ljungdahlii, штам С-01, АТСС 55988, для рацією 9,9г/л, а ацетат - з концентрацією 2,6г/л. вироблення етанолу з CO, СО2 і Н2 в присутності Продуктивність вироблення етанолу склала надлишку Н2. Газ, що подавався в реактор, містив 29,0г/л день. 77% Н2, 19% CO і 4% СН4 (газ порівняння); триваПри аналізі параметрів вироблення етанолу лість утримання газу при подачі становила 30 хвиподача пантотенату на одиницю клітин, що вироблин. Рідке середовище, що містить надлишок соляються, становила 978мкг пантотенату/г вироблей, вітамінів і мікроелементів, подавали в лених клітин. Цей рівень досить високий для гарареактор при тривалості утримання рідини 36 гонтії того, щоб концентрація пантотенату не була дин. рН становила 5,0, а швидкість перемішування обмежуючою. Кількість кобальту, що подається на 1000об./хв. Уцих робочих умовах перетворення одиницю клітин, що виробляються - 836мкг кобаCO склало 97-99%, перетворення Н2 60-80%. Конльту/г вироблених клітин - також показує, що концентрація клітин склала 0,8-1,0г/л, етанол виробцентрація кобальту не була обмежуючою. Віднолявся з концентрацією 10г/л, а ацетат - з концентшення Н2, що подається, до суми подвоєної рацією 3,3г/л. Продуктивність вироблення етанолу кількості перетвореного CO і потроєної кількості склала 6,7г/л день. перетвореного СО2 склало 1,09, а парціальний При аналізі параметрів вироблення етанолу тиск Н2 склав 1,6атм. Високий вміст СО2 у відхідподача пантотенату на одиницю клітин, що виробному газі (0,5атм.) показує, що надлишок Н2 не ляються, становила 900-1125мкг пантотенату/г викликав вироблення етанолу. Питома швидкість вироблених клітин, що гарантує надлишок пантопоглинання CO становила 1,34ммоль/г клітин хв., тенату. Подібним чином, кількість кобальту, яка тобто, рівень, який забезпечує надлишок CO як подається на одиницю клітин, що виробляються, спосіб вироблення етанолу. становила 991-1239мкг кобальту/г вироблених Технологія використання надлишку СО для клітин, що також гарантує надлишок кобальту. вироблення етанолу також була продемонстроваПитома швидкість поглинання CO склала 0,28на в іншому досліді з С ljungdahlii, штам С-01, в 0,35ммоль/г клітин хв., тобто, такий рівень CO, реакторі AUTOCLAV™ (Buchi), також з рециркуляякий не викликає вироблення етанолу. Відношенцією клітин і з циркуляцією культури, протягом ня молей Н2, що подається, до суми подвоєної періоду 24 годин. У цьому досліді в 600-мл реаккількості молей перетвореного CO і потроєної кільтор подавався газ, що містить 15,8% Н2, 36,5% кості молей перетвореного СО2 склало 1,96, тобто, CO, 38,4% N2 і 9,3% СО2 при тривалості утримання коефіцієнт вище 1,0, що означає присутність надгазу 1,4хв. Тиск в реакторі підтримувався при лишку Н2, який може контролювати вироблення 275кПа (40psig). Рідке середовище, що містить етанолу. Парціальний тиск Н2 у відхідному газі надлишок солей, вітамінів і мікроелементів, подасклав 0,70-0,87атм., а відношення парціального вали при тривалості утримання рідини 4,8 години, тиску Н2 до парціального тиску СО2 у відхідному а тривалість утримання клітин, отримана шляхом газі склало 65. Таким чином, реактор виробляв пропускання ефлюенту з реактора через керамічетанол завдяки присутності надлишку Н2. ний фільтр з порожнистими волокнами, становила У другому досліді реактор високого тиску 19,2 години. рН становила 4,5, швидкість переміAUTOCLAV™ (Buchi) працював як CSTR з цирку 33 76117 34 ляцією культури і рециркуляцією клітин при викоРеактор працював як прямоточний CSTR (без ристанні С ljungdahlii, штам С-01, для вироблення рециркуляції клітин) в кожному досліді для різних етанолу з CO, CO2 і Н2 в присутності надлишку Н2. культур. Тривалість утримання газу була номінаГаз, що подавався в реактор, містив 81% Н2, 16% льно встановлена на 50 хвилин, тривалість утриCO і 3% СН4 (газ порівняння); тривалість утриманмання рідини була номінально встановлена на 40 ня газу при подачі становила 2,21 хвилин. Рідке годин, а швидкість перемішування була номінальсередовище, що містить надлишок солей, вітамінів но встановлена на 1000об./хв. Ці умови були вибі мікроелементів, подавали в реактор при триварані для можливості порівняння штамів, а не для лості утримання рідини 8,97 годин. Тривалість досягнення високої продуктивності. утримання клітин становила 22,7 годин, рН4,5 і Як зазначено в Таблиці 3, штам ERI2 був підшвидкість перемішування 800об./хв. У цих робочих даний п'яти змінам в середовищі, які зсували співумовах перетворення CO склало 91,5%, а перетвідношення продуктів вперед і назад від оцтової ворення Н2 43,4%. Концентрація клітин склала кислоти у якості домінуючого продукту до етанолу 5,5г/л, а концентрація ацетату 2,85г/л. Продуктиву якості домінуючого продукту. Було продемонстність вироблення етанолу в реакторі склала 215роване обмеження пантотенату і обмеження кобальту для вироблення етанолу цим штамом. Виро240г/л день. блення штаму С-01 зсували тричі, використовуючи При аналізі параметрів вироблення етанолу зміни середовища, також продемонструвавши обподача пантотенату на одиницю вироблення клімеження пантотенату і обмеження кобальту у якотин становила 46мкг пантотенату/г вироблених сті механізму для вироблення етанолу. Виробленклітин, що може означати обмеження пантотенаня штаму РЕТС зсували тільки один раз, у вигляді том. Кількість кобальту, яка подавалася на одинивироблення етанолу за рахунок обмеження кобацю клітин, що виробляються, становила 460мкг льтом. Кожний з штамів показав більш високе пекобальту/г вироблених клітин, що гарантує надлиретворення Н2 при виробленні оцтової кислоти, шок кобальту. Питома швидкість поглинання CO ніж при виробленні етанолу у якості домінуючого становила 1,68 ммоль/г клітин хв., тобто, рівень, продукту. Це зумовлене тим, що оцтова кислота який міг би означати присутність надлишку CO, виробляється в умовах обмеження масопереносу якби не висока швидкість поглинання Н2 (обмеження кількості газу, що подається в культу4,14ммоль/г клітин хв., яка означає, що інгібування ру), в той час як етанол виробляється при обмесубстратом, яке впливає на поглинання Н2, не відженні поживних речовин і, отже, надлишку газу, що бувалося. Відношення молей Н2, що подається, до може негативно вплинути на перетворення газу. суми подвоєної кількості молей перетвореного CO Малі кількості ацетату завжди присутні в потоку і потроєної кількості молей перетвореного СО2 продукту, коли домінуючим продуктом є етанол. становило 5,67, тобто, набагато вище за коефіціОднак, коли домінуючим продуктом є оцтова кисєнт 1,0, що означає присутність надлишку Н2. Палота, етанол звичайно не присутній у концентрацірціальний тиск Н2 у відхідному газі склав 2,61атм., ях, що вимірюються. При зсуві домінуючих продука відношення парціального тиску Н2 до парціальтів від етанолу до оцтової кислоті шляхом зміни ного тиску СО2 у відхідному газі склало 10,9. Таким поживних речовин було показано, що дуже важко чином, реактор виробляв етанол завдяки присутусунути всі сліди етанолу. Повне усунення етанолу ності надлишку Н2. відбувається лише через кілька тижнів безперервСумарне порівняння параметрів способу і реної роботи в середовищі, яке покращує вироблензультати Прикладів 3-7 показані в Таблиці 2, приня оцтової кислоти. веденій нижче. ПРИКЛАД 9. РОБОТА В СТАЛОМУ СТАНІ ПРИКЛАД 8. ЗСУВ У СПІВВІДНОШЕННІ ПРОЗ/БЕЗ РЕЦИРКУЛЯЦІЇ КЛІТИН ДУКТІВ У ШТАМАХ С LJUNGDAHLII ERI2, С-01 І Кінцевою метою промислового вироблення РЕТС ПРИ ВИКОРИСТАННІ РІЗНИХ СКЛАДІВ етанолу з CO, CO2 і Н2 є досягнення високих стаСЕРЕДОВИЩА лих концентрацій етанолу і одночасно - отримання Способи за винаходом можуть бути викорисвисоких співвідношень етанолу і ацетату в кінцетані для будь-якого з штамів С. ljungdahlii. Резульвому продукті і високої продуктивності. Дані сталотати дослідів стосовно зміни середовища, в яких го стану для вироблення етанолу з СОвикористовувалися штами ERI2, С-01 і РЕТС, позбагаченого газу, що містить 20% Н2, 65% CO, 10% казані в Таблиці 3, приведеній нижче. Метою цих СО2 і 5% СН4, з використанням штаму С. ljungdahli дослідів була демонстрація того, що кожний з С-01 в прямоточному (без рециркуляції клітин) штамів може бути підданий впливу, який забезпеCSTR приведені в Таблиці 4. У цій таблиці GRT чує зсув від вироблення оцтової кислоти до вироозначає тривалість утримання газу (рідинний блення етанолу лише за рахунок зміни середовиоб'єм/швидкість течії вхідного газу), LRT означає ща. Так, в культуру подавали надлишок поживних тривалість утримання рідини (рідинний речовин (включаючи пантотенат і кобальт) для об'єм/швидкість течії рідини) і XRT означає тривавироблення оцтової кислоти у якості домінуючого лість утримання клітин (середній час, який клітини продукту, а потім обмежували пантотенат або копроводять в реакторі). Як зазначено в Таблиці 4, бальт для вироблення етанолу у якості домінуючобули отримані концентрації етанолу від 17,5 до го продукту. Слід підкреслити, що єдиною метою 33г/л і продуктивність вироблення етанолу в діацих дослідів було показати, що зміна середовища пазоні від 14,4 до 21,1г/л день. може привести до зсуву в співвідношенні продуктів Подібні результати показані для вироблення для кожного з штамів. Таким чином, досягнення етанолу з газу, не настільки збагаченого CO. Газ, високих концентрацій продуктів і продуктивності не що використовується в досліді з С. ljungdahli C-01 було метою цих дослідів. 35 76117 36 без рециркуляції, результати якого представлені в Для отримання маточних культур для інокуляції Таблиці 5, містить 16% Н2, 27% СО, 6% СОг і 51% реактора вирощували культури С ljungdahlii, штам N2. За допомогою цього газу були отримані концеС-01 (інвентарний номер АТСС 55988) в 150-мл нтрації етанолу в діапазоні від 11 до 26г/л, з 2,0сироваткових колбах на CO, СО2 і Н2 в збагачено5,0г/л ацетату у якості вторинного продукту. Прому середовищі, що містить 1г/л дріжджового екстдуктивність вироблення етанолу склала від 11,1 ракту і 1г/л триптикази, солі і вітаміни. Концентрація вітамінів становила 0,4мл/л середовища до 20,1г/л день. "Концентрація клітин приведена в водного розчину, що містить 50,5мг/л пантотенату Таблиці 5 на основі сухої ваги клітин. кальцію, 20,6мг/л d-біотину і 50,6мг/л тіаміну-НСІ. Нарешті, дані сталого стану для перетворення Колби інкубували при 37°С у вібраційному інкубагазу, що містить 50% Н2, 45% СО і 5% СН4, в CSTR торі. Культури вирощували до експонентної фази з рециркуляцією клітин при використанні С росту, що визначається візуально. При кожній іноljungdahli O-52 (інвентарний номер АТСС 55989) куляції близько 90мл маточної культури переносипоказані в Таблиці 6. Були отримані концентрації ли з сироваткових колб в 1 літр середовища, етанолу 18-23,5г/л і концентрації ацетату 3,0отримуючи 9%-ну інокуляцію (за об'ємом). Успішна 5,7г/л. Продуктивність вироблення етанолу склала інокуляція описана нижче. Вказана процедура мовід 21,1 до 39,0г/л день. же повторюватися декілька разів до отримання ПРИКЛАД 10. ВИСОКА ПРОДУКТИВНІСТЬ успішної інокуляції. ВИРОБЛЕННЯ ЕТАНОЛУ В CSTR З РЕЦИРКУЛЯДля отримання успішної інокуляції 90мл/л іноЦІЄЮ КЛІТИН І ПІД ТИСКОМ куляту додавали в 1-літрову порцію основного Реактор високого тиску AUTOCLAV™ (Buchi) живильного середовища (показаного в Таблиці 1), працював як CSTR з циркуляцією культури і рецищо містило 0,4мл/л вітамінів і солей (t=0). Швидркуляцією клітин при використанні С ljungdahlii, кість перемішування становила 240об./хв., рН5,3, штам С-01, для вироблення етанолу з CO, СО2 і температура 38,5°С і тривалість утримання газу Н2. Реактор працював при 207кПа (30 psig), а газ, (при постійному потоку газу) 110 хвилин. Газ, що що подавався, містив 62% Н2, 31% CO і 2% С2Н6. подавався, містив 62% Н2, 31% CO і 7% С2Н6. ЧеТривалість утримання газу становила 1,14хв. (на рез 13 годин (t=13год.) було відзначене деяке пеоснові атмосферного тиску), при дійсній тривалості ретворення СО, а при t=23год. швидкість переміутримання газу 3,5хв. Рідке середовище, що місшування збільшили від 240об./хв. до 300об./хв. тить надлишок солей, вітамінів і мікроелементів, Тривалість утримання газу знижували до 100 хвиподавали в 600-мл реактор при тривалості утрилин при t=27год., а подальше зниження тривалості мання рідини 3,6 години. рН становила 4,5, а швиутримання газу виконали при t=46год. Швидкість дкість перемішування 825об./хв. У цих умовах конперемішування також підвищували з приростами центрація клітин склала 8г/л, перетворення CO 100об./хв. при t=28год., 59год., 72год. і 85год. 90%, а перетворення Н2 40%. Потік продукту місПри t=110год. система працювала при триватив 20г/л етанолу і 2,75г/л ацетату. Продуктивність лості утримання газу 80 хвилин і швидкості перевироблення етанолу склала 150г/л день. мішування 600об./хв. Концентрація клітин склала Інший реактор високого тиску AUTOCLAV™ 0,5г/л, а перетворення СО - 35%. Перетворення Н2 (Buchi), працюючий як CSTR з циркуляцією кульвсе ще не відбувалося, але малі кількості етанолу і тури і рециркуляцією клітин при використанні С ацетату (~1г/л кожного) накопичилися в цій порції ljungdahlii, штам С-01, працював при 6атм. (75 культурального бульйону. Всі зусилля до цього psig), а синтез-газ, що подавався в нього, містив часу були направлені на ріст культури в реакторі. 55% Н2, 30% CO, 5% СН4 і 10% СО2. Тривалість Течію середовища з використанням тих же утримання газу становила 1хв. (на основі атмосконцентрацій, що і в основному живильному сереферного тиску), при дійсній тривалості утримання довищі, почали зі швидкістю 0,4мл/хв. при газу 6,0хв. Рідке середовище, що містить надлиt=120год. Потім запустили програму номінальних шок солей, вітамінів і мікроелементів, подавали в приростів швидкості газу, швидкості перемішуван600-мл реактор при тривалості утримання рідини ня і швидкості середовища при обережному підт1,62 години. Тривалість утримання клітин станориманні надлишку Н2 в системі. При t=210год. конвила 24 години, рН4,5, а швидкість перемішування центрація етанолу склала 17г/л, концентрація 800об./хв. У цих умовах концентрація клітин склаацетату 1г/л, концентрація клітин 1,6г/л, перетвола 2,0г/л, перетворення CO 95%, а перетворення рення СО - близько 100%, і перетворення Н2 склаН2 60%. Потік продукту містив 25г/л етанолу і 3г/л ло 90%. Продуктивність вироблення етанолу досяацетату. Продуктивність вироблення етанолу стагла 11,4г/л день. новила 369г/л день. Програма поступового збільшення швидкості ПРИКЛАД 11. ЗАПУСК З МАТОЧНОЇ КУЛЬТУгазу була знов запущена. Були спільно збільшені РИ ПРИ НАДЛИШКУ Н2 кількості вітамінів (див. Таблиці 1) з доведенням Запуск з використанням однократної інокуляції швидкості введення вітамінів до 0,7мл/л середоз маточної культури забезпечує здоровий інокулят, вища. При t=610год. реактор виробляв 20г/л етащо не містить домішок, але не завжди буває успінолу і близько 2г/л ацетату. Перетворення CO шною сама процедура інокуляції через досить нисклало близько 100%, а перетворення Н2 - 85%. зьку щільність клітин, що використовується, особПродуктивність вироблення етанолу досягла ливо, якщо параметри технологічного процесу, такі 14г/л день. як швидкість газу і швидкість перемішування, підПРИКЛАД 12. ЗАПУСК З ВИКОРИСТАННЯМ вищуються дуже швидко відразу після інокуляції. ІНОКУЛЯТУ З ІСНУЮЧОГО CSTR Запуск з використанням однократної інокуляції Запуск CSTR з використанням безперервної з маточної культури описаний в цьому прикладі. 37 76117 38 подачі інокуляту з існуючого CSTR більш швидкий тривалого інгібування субстратом, надлишкової і надійний, чим запуск з порційних колб маточної подачі поживних речовин, накопичення СО2 або культури. CSTR, що містить ізолят С ljungdahlii, механічних пошкоджень різного характеру, насамштам С-01 (інвентарний номер АТСС 55988), який перед повинна бути усунена проблема, яка привемайже припинив вироблення етанолу і продукував ла до надлишкового вироблення оцтової кислоти. 2-3г/л етанолу, 7-8г/л ацетату і близько 0,3г/л буПотім надлишок оцтової кислоти, який швидко танолу у вигляді рідкофазних продуктів, заново приводить до інгібування продуктом, видаляють з запустили з використанням безперервної подачі системи шляхом збільшення швидкості рідини для інокуляту з існуючого CSTR. вимивання оцтової кислоти (але, на жаль, і етаноCSTR, з якого отримували інокулят, виробляв лу) з системи. Коли рівень ацетату становитиме 3близько 17г/л етанолу і 1-2г/л ацетату, працюючи 5г/л, швидкість рідини відновлюють і повертають при тривалості утримання газу 25 хвилин, тривареактор в умови надлишкової подачі Н2 або обмелості утримання рідини 32 години, швидкості пеження вітамінами або кобальтом (з рециркуляцією ремішування 650об./хв., температурі 38,5°С і або без рециркуляції клітин). Повернення реактора рН4,66. Концентрація клітин становила 1,7г/л, пев попередній стан включає зниження швидкості ретворення CO склало по суті 100%, а перетвогазу для запобігання інгібуванню субстратом і/або рення Н2 85%. швидкості перемішування до того, як почнеться Коли почали безперервну подачу інокуляту вимивання клітин і лізис. Потім збільшують швид(t=0), в цей же час знизили швидкість перемішукість перемішування або швидкість газу, як описавання до 500об./хв., а тривалість утримання газу но в Прикладі 1. встановили на 38 хвилин. Ефлюент з реактора У даному прикладі CSTR з рециркуляцією клівиробництва (0,5мл/хв.) служив у якості інокуляту тин, що містить С ljungdahlii, штам С-01, який видля CSTR, що інокулююється, при безперервній робляв етанол і оцтову кислоту з CO, СО2 і Н2, інокуляції протягом декількох годин. Через t=5год. почав виробляти оцтову кислоту у відповідь на (5 годин після початку безперервної інокуляції) механічну несправність. У 2100-мл реактор подабуло відзначене перетворення газу, і швидкість вали газ, що містить 62% Н2, 31% CO і 7% С2Н6, перемішування збільшили до 700об./хв. Безперерпри тривалості утримання газу 15 хвилин. Реактор вну подачу інокуляту припинили через t=28год. працював при швидкості перемішування 600об./хв. Перетворення газів рівномірно покращувалося, і рН4,86. Тривалість утримання рідини становила дозволяючи здійснювати рівномірні підвищення 23 години, а тривалість утримання клітин 68 годин. швидкості газу (знижуючи тривалість утримання Розчин вітаміну В (водна суміш 50,5мг/л пантотегазу) і підвищити швидкість перемішування до нату кальцію, 20,6мг/л d-біотину і 50,6мг/л тіаміну750об./хв. Через t=30год. перетворення СО склало НСІ) був присутнім в рідкому живильному середо95%, а перетворення Н2 80%. Концентрація етановищі, що містить солі і вітаміни, при концентрації лу склала 13г/л, концентрація ацетату 1,5г/л, і ці 0,4мл вітамінного розчину на літр середовища кількості були сталими значно довше 100 годин. (див. Таблицю 2). Концентрація етанолу впала до За цей час продуктивність вироблення етанолу 7г/л, в той час як концентрація ацетату виросла до 7г/л, створивши умови, які не є ні стабільними для склала 10-15г/л день. роботи реактора, ні економічними для виробництПРИКЛАД 13. ВІДНОВЛЕННЯ ПРИ СЕРЙОЗва етанолу. Концентрація клітин становила 2,4г/л, НОМУ ПОРУШЕННІ ТЕХНОЛОГІЧНОГО ПРОперетворення СО 85% і перетворення Н2 25%. ЦЕСУ Стратегія, що використовується для відновУ CSTR з рециркуляцією клітин, що містить С лення реактора, включала спочатку різке зниженljungdahlii, штам С-01, в який безперервно подаваня швидкості подачі газу в реактор, а потім постули газ і рідкі поживні речовини і який виробляв 15пове відновлення реактора в присутності 35г/л етанолу і 0-5г/л ацетату в сталому стані надлишку Н2. Швидкість подачі рідини в реактор (див., зокрема, Приклад 1), стався збій через недлязапобігання інгібуванню продуктом в даному передбачені зміни в умовах технологічного процеприкладі не знижували, оскільки концентрація ацесу, наприклад, механічні пошкодження в реакторі. тату не була дуже великою. Замість цього конценЗбій в реакторній системі може бути незначним, трації ацетату дозволили поступово знижуватися таким як короткочасне збільшення швидкості газу, до неінгібуючого рівня при зниженні швидкості теяке викликає короткочасне інгібування субстратом, чи газу і подальшій роботі в присутності надлишку або значним, таким як тривале збільшення швидН2. Докладна процедура відновлення реактора кості газу, яке зрештою приводить до підвищеного описана нижче. вироблення оцтової кислоти і серйознішого інгібуРециркуляцію клітин припинили і різко знизили вання молекулярною оцтовою кислотою, що вирошвидкість газу на 70% до тривалості утримання бляється. газу 62 хвилини, при цьому лише трохи змінивши Короткочасні збої легко виправляються шлятривалість утримання рідини з 23 до 30 годин хом простого регулювання порушених параметрів (t=0). Концентрацію вітамінів в середовищі не змі(наприклад, зниження швидкості газу до початконювали. При цій зміні в швидкості газу перетвового рівня) і спостереження за прогресом реакторення CO збільшилося до 98%, а перетворення Н2 ра, щоб пересвідчитися, що збій не привів до довдо 80%. Більш важливе те, що в системі з'явився готривалих проблем. надлишок Н2, про що свідчило зниження вмісту Однак інгібування молекулярною оцтовою киСО2 у відхідному газі з 19 до 5%. При появі надслотою, що виробляється, являє собою серйознілишку Н2 концентрація ацетату впала, а концентшу проблему. Якщо культурою виробляється надрація етанолу збільшилася. лишок молекулярної оцтової кислоти в результаті 39 76117 40 Наприклад, через t=66год. (66 годин після перетворення СО з 91% до 71%. При зменшенні припинення рециркуляції клітин) концентрація швидкості циркуляції культури з 0,4gpm до ацетату впала до 4г/л, а концентрація етанолу 0,15gpm рН в реакторі впала, але концентрації дещо піднялася до 7,5г/л. етанолу і ацетату зберігалися. Присутність надлишку Н2 (і зниження концентЧерез 50 хвилин після введення CO концентрації ацетату) дозволила здійснити подальше збірація етанолу становила 11,29г/л, а концентрація льшення швидкості газу, спочатку повільно, а поацетату 1,75г/л. В цей час подачу надлишкового тім швидше. Через t=215год. тривалість утримання CO припинили, і концентрація етанолу і рН почали газу становила 29хв., концентрація етанолу 12г/л і падати, а концентрація ацетату - рости. Зниження концентрація ацетату 3г/л. Продуктивність виробрН було зумовлене перетворенням етанолу в молекулярну оцтову кислоту. Таким чином, зсув еталення етанолу становила 8г/л день. СО2 був принол-оцтова кислота за рахунок подачі CO є оборосутнім у відхідному газі з концентрацією 6%, перетним. творення СО становило 98% і перетворення Н2 ПРИКЛАД 15. РЕЦИРКУЛЯЦІЯ ВОДИ ДЛЯ МІ80%. Через t=315год. концентрація етанолу станоНІМІЗАЦІЇ ВИРОБЛЕННЯ АЦЕТАТУ вила 16г/л, а концентрація ацетату 4г/л, також при Рециркуляція води, що використовується, назадовільному ступеню перетворення газу і тривазад в ферментаційний біореактор після дистиляції лості утримання газу 20 хвилин. Продуктивність з метою виділення етанолу важлива для мінімізавироблення етанолу становила 11г/л день. Через ції вироблення ефлюента і для максимізації вихоt=315год. концентрація етанолу досягла 20г/л, при ду етанолу, що утворюється в реакторі, а також вмісті ацетату 3,5-4г/л. Продуктивність вироблення для обмеження вироблення оцтової кислоти. Дисетанолу становила 16г/л день. Тривалість утритиляція виявилася найбільш економічним спосомання газу впала до 16 хвилин, а перетворення бом для концентрування 15-35г/л етанолу, отриСО і Н2 становило 95% і 73%, відповідно. Ці умови маного з реактора, до 95%-го етанолу. Потім підтримувалися майже 200 годин безперервної використовується адсорбція за допомогою молероботи, що показало відновлення здатності реаккулярних сит для подальшого концентрування торної системи виробляти етанол і, по суті, утриетанолу до бажаної концентрації. При проведенні мання колишніх робочих умов. дистиляції 95%-й етанол у воді утворюється у виПРИКЛАД 14. СПОСІБ ВИРОБНИЦТВА ЕТАгляді дистиляту. Вода під час дистиляції виробляНОЛУ З НАДЛИШКОВОЮ ПОДАЧЕЮ СО ється у якості кубового продукту. Кубовий продукт Простий дослід був проведений в реакторімістить оцтову кислоту з реактора, вироблену під баку високого тиску, безперервної дії, з перемішучас ферментації (3-5г/л ацетату), і поживні речованням, використовуючим рециркуляцію клітин, вини, невикористані під час ферментації або зруйдля демонстрації зсуву від вироблення оцтової новані впливом тепла при дистиляції, такі як міккислоти до вироблення етанолу завдяки присутнороелементи та інші мінерали. Рециркуляція сті високих концентрацій CO. Перед проведенням поживних речовин мінімізує кількість ефлюента, досліду реактор, що містить С ljungdahlii, штам Сщо повинен бути оброблений, а також кількість 01, працював під тиском 140-170кПа (20-25 psig), поживних речовин, яка згодом повинна додаватиде газ, що подавався, містив 57% Н2, 36% CO і 7% ся в ферментаційний біореактор. Рециркуляція С2Н6. Тривалість утримання газу становила менше ацетату запобігає утворенню додаткової оцтової 2 хвилин, тривалість утримання рідини 38 годин, кислоти шляхом встановлення рівноваги між етатривалість утримання клітин 28 годин, швидкість нолом і оцтовою кислотою. Таким чином, при виперемішування 600об./хв. і температура 38°С. У користанні рециркуляції води оцтова кислота на цих умовах перетворення CO було змінним і в севиході не утворюється. Рециркуляція більше ніж 3редньому становило 85%; перетворення Н2 було 5г/л ацетату може привести до інгібування реактозмінним і в середньому становило 20%. Концентра оцтовою кислотою. Таким чином, внаслідок рація клітин складала близько 2,5г/л, а потік прорециркуляції води разом з ацетатом субстрат СО, дукту містив 9г/л етанолу і 3г/л ацетату. СО2 і Н2 може перетворюватися на етанол у виНа першому етапі для підготовки досліду збігляді єдиного продукту. льшили тривалість утримання газу для забезпеТаблиця 8 показує результати ферментації гачення відсутності надлишку CO. Тиск підтримувазу, що містить 50% СО, 45% Н2 і 5% СН4 при виколи при 158-165кПа (23-24 psig). pH контролювали ристанні С. ljungdahlii, штам О-52, з рециркуляцією досить довго, щоб пересвідчитися в її стабільності води. У цих дослідах пермеат після фільтрації чев нормальному робочому діапазоні 4,5-4,6. Потім з рез порожнисті волокна, яка використовується для газом, що регулярно подавався, змішали чистий рециркуляції клітин, направляли на дистиляцію. СО для отримання складу газу 47% Н2, 47% CO і Після видалення етанолу воду фільтрували через 6% С2Н6, при тривалості утримання газу 2,3хв. 0,2-мкм фільтр для видалення осаджених побічних Потім рН в реакторі, склад відхідного газу і потік продуктів. Фракція оборотної води в загальній кіпродуктів спостерігали у часі. лькості води (у якості середовища), що подається Таблиця 7 показує зміни рН і склад продуктів у в реактор, в цих дослідах складала від 25 до часі після додання надлишку СО в систему. Через 100%. Дослід зі 100% оборотної води тривав май30 хвилин після додання СО рН в реакторі підняже 500 годин або близько 20 тривалостей утрилася до 5,25 і співвідношення в культурі здвинуломання рідини. З результатів зі 100% оборотної ся до 1,54г/ (0,0257моль/л) ацетату до 1,12г/л води видно, що оцтова кислота на виході не виро(0,0243моль/л) етанолу. Підвищення рН сталося бляється. Фактично, у кінцевому рахунку була вивнаслідок перетворення вільної оцтової кислоти в трачена невелика кількість оцтової кислоти. Проетанол. Ця зміна супроводжувалася зниженням 41 76117 42 дуктивність вироблення етанолу склала від 12 до зьке вироблення клітин в біореакторі. Подібним чином, концентрація кобальту в середовищі ста27г/л день. новила 1млн-1, яка також забезпечує надлишок ПРИКЛАД 16. ДВОСТУПЕНЕВА СИСТЕМА кобальту. Однак парціальний тиск Н2 у відхідному CSTR З ПОДАЧЕЮ ПАНТОТЕНАТУ НА СТАДІЮ газі підтримувався у надлишку величиною 0,55атм. РОСТУ шляхом подачі газу, який не містить СО2 і містить Правильна подача пантотенату на стадію рос63,3% Н2, 31,4% СО і 5,3% С2Н6, що забезпечило ту являє собою змінну величину, яка повинна опвідношення Н2,що подається/(2СОперетв.+3СО2перетв.) тимізуватися. Типові результати для реактора більше 1, і шляхом обережного регулювання швистадії росту з використанням С ljungdahlii, штам Сдкості подачі газу і швидкостей перемішування, 01, були описані в Прикладах 11 і 12, за винятком для досягнення ступеня перетворення СО більше того, що в цьому реакторі буде вироблятися дещо ніж 95% і перетворення Н2 більше ніж 80%. По мірі більше оцтової кислоти, оскільки на стадію росту досягнення цих високих ступенів перетворення подається додаткова кількість пантотенату або концентрація клітин збільшується від початкового кобальту для забезпечення вироблення здорової і рівня близько 0г/л до ~1,5г/л. стабільної культури. Концентрація вітамінів, що Оскільки концентрація пантотенату під час завикористовуються, становила 0,7-0,8мл/л середопуску підтримується постійною, кількість мкг панвища у вигляді водного розчину, що містить тотенату на грам клітин, що виробляються, посту50,5мг/л пантотенату кальцію, 20,6мг/л d-біотину і пово знижується до концентрації менше 15мкг 50,6мг/л тіаміну-НСІ. CSTR стадії виробництва з пантотенату/г вироблених клітин, що є умовою рециркуляцією клітин отримує ефлюент з реактора обмеження пантотенатом. Таким чином, в процесі стадії росту і виробляє етанол у якості домінуючоросту система переходить в умови обмеження го продукту. Концентрація пантотенату, що подапантотенатом. Високі співвідношення етанолу і ється в цей реактор, набагато нижче, ніж на стадії ацетату досягаються шляхом запуску з надлишком росту, всього 0,1-0,2мл всіх вітамінів/л середовиН2. В альтернативі, на ранніх стадіях запуску реакща у вигляді водного розчину, що містить 50,5мг/л тору дають можливість виробляти оцтову кислоту, пантотенату кальцію, 20,6мг/л d-біотину і 50,6мг/л а потім регулюють співвідношення продуктів шлятіаміну-НСІ. Тривалість утримання газу на стадії хом обмеження пантотенату. виробництва становила 11-30 хвилин, тривалість ПРИКЛАД 18. ОБМЕЖЕННЯ КОБАЛЬТУ В утримання рідини складала близько 20 годин, триРЕАКТОРІ валість утримання клітин 30-50 годин, а швидкість Культура С ljungdahlii, штам ERI2, отримувала перемішування 800-900об./хв. рН становила 5,0, а 62-3500мкг кобальту/г клітин, що виробляються, температура 38°С. Після досягнення реактором під час вироблення оцтової кислоти з CO, СО2 і Н2, сталого стану тривалість утримання газу підтритобто, реактор не був обмежений кобальтом (або мувалася постійною при 11хв., тривалість утрибудь-яким іншим обмежуючим чинником, крім момання рідини була встановлена на 19 годин, трижливості перенесення газу в культуру), і етанол не валість утримання клітин була постійною - 37 був виявлений в потоку продукту. Під час обмегодин, а швидкість перемішування становила ження кобальтом для вироблення етанолу з CO, 900об./хв. Перетворення CO в середньому станоCO2 і Н2 в С ljungdahlii, штам С-01 подавали 33вило 96%, а перетворення Н2 - в середньому 60%. 48мкг кобальту/г вироблених клітин, при підтриКонцентрація етанолу встановилася на 25-30г/л, манні всіх інших поживних речовин в надлишку. У при цьому також було присутньо 3г/л ацетату. цих умовах штам С-01 виробляв 18-26г/л етанолу і Продуктивність вироблення етанолу становила близько 4г/л ацетату. 31,6-37,9г/л день. ПРИКЛАД 19. ЗАПОБІГАННЯ АКЛІМАТИЗАЦІЇ ПРИКЛАД 17. РЕГУЛЮВАННЯ ПАРАМЕТРІВ ДО НИЗЬКОЇ ОБМЕЖУЮЧОЇ КОНЦЕНТРАЦІЇ КОФЕРМЕНТАЦІЇ ДЛЯ ЗАПОБІГАННЯ АКЛІМАТИЗАБАЛЬТУ ЦІЇ ДО НИЗЬКОЇ ОБМЕЖУЮЧОЇ КОНЦЕНТРАЦІЇ Акліматизації до низької обмежуючої концентПАНТОТЕНАТУ КАЛЬЦІЮ рації кобальту запобігають шляхом регулювання Акліматизації культури в ферментаційному параметрів ферментації (швидкість газу, швидкість бульйоні до низької обмежуючої концентрації панрідини, швидкість перемішування, вміст СО2), унитотенату кальцію запобігають шляхом регулюванкаючи істотних змін в поживних речовинах, замість ня параметрів ферментації (швидкість газу, швидцього підтримуючи порівняно постійну концентракість рідини, швидкість перемішування, цію поживних речовин, що подаються. Це здійспарціальний тиск Н2), уникаючи істотних змін в нюють таким чином. поживних речовинах, замість цього підтримуючи Під час запуску лабораторний CSTR New порівняно постійну концентрацію поживних речоBrunswick Scientific Bioflo® з С. ljungdahlii, штам Свин, що подаються. Це здійснюють таким чином. 01, отримував потік рідкого середовища, що місПід час запуску лабораторний CSTR New тить вітаміни, мікроелементи і солі, необхідні для Brunswick Scientific Bioflo® з С. ljungdahlii, штам Сживлення культури. Концентрація кобальту в жи01, отримував потік рідкого середовища, що міс-1 вильному середовищі становила 75 млн . Це контить вітаміни, мікроелементи і солі, необхідні для центрація, яка в поєднанні з повільною швидкістю живлення культури. Концентрація пантотенату в подачі середовища забезпечує подачу більше живильному середовищі становила 20мкг/л. Це 50мкг кобальту на грам клітин, що виробляються концентрація, яка в поєднанні з повільною швидкі(надлишок кобальту), через низьке вироблення стю подачі середовища забезпечує подачу більше клітин в біореакторі. Подібним чином, концентра100мкг пантотенату кальцію на грам клітин, що ція пантотенату в середовищі становила 20мкг/л, виробляються (надлишок пантотенату), через ни 43 76117 44 яка також забезпечує надлишок пантотенату. ОдПРИКЛАД 22. МАСОПЕРЕНОС нак парціальний тиск Н2 у відхідному газі підтриПриклад надлишкового масопереносу, ведучомувався у надлишку величиною 0,55атм. шляхом го до вироблення етанолу, представляє лаборатоподачі газу, що містить великі кількості Н2 і не місрний CSTR з рециркуляцією клітин, що містить С. тить СО2, і шляхом обережного регулювання швиIjungdahlii, штам ERI2, і працює без обмеження дкості подачі газу і швидкостей перемішування, поживними речовинами або надлишку Н2 або СО в для досягнення ступеня перетворення CO більше газі, що подається. Тобто, пантотенат подається зі ніж 95% і ступеня перетворення Н2 більше ніж швидкістю більше ніж 100мкг пантотенату кальцію 80%. По мірі досягнення цих високих ступенів пена г клітин, що виробляються, і кобальт подається ретворення концентрація клітин збільшується від з швидкістю більше за 100мкг на г клітин, що випочаткового рівня близько 0г/л до ~1,5г/л. Оскільки робляються. Н2 присутній у відхідному газі при концентрація кобальту під час запуску підтриму0,2атм., а питома швидкість поглинання СО склається постійною, кількість мкг кобальту на грам дає менше 0,3ммоль СО/г клітин хв. Швидкість клітин, що виробляються, поступово знижується перемішування складає 800об./хв. У цих умовах до концентрації менше 50мкг кобальту/г вироблекультура виробляє тільки оцтову кислоту (в потоку них клітин, що є умовою обмеження кобальтом. продукту етанол відсутній). Якщо швидко збільшиТаким чином, в процесі росту система переходить ти швидкість перемішування до 900об./хв. або в умови обмеження кобальтом. Високий вихід етазбільшити швидкість газу приблизно на 10%, тоді нолу досягається шляхом запуску з надлишком Н2 етанол виявляється в потоку продукту, доти, доки в газі, що подається. В альтернативі, на ранніх концентрація клітин не збільшиться, поглинаючи стадіях запуску реактору дають можливість вирогаз, або доти, доки культура не загине через інгібляти оцтову кислоту, а потім регулюють співвідбування субстратом. ношення продуктів шляхом обмеження кобальтом. ПРИКЛАД 23. КОНТРОЛЬ ІНГІБУВАННЯ ОЦПРИКЛАД 20. ПОДАЧА НАДЛИШКУ ВОДНЮ ТОВОЮ КИСЛОТОЮ, що ВИРОБЛЯЄТЬСЯ Під час роботи лабораторного реактора У лабораторному CSTR, що виробляє 8г/л оцAUTOCLAV™ (Buchi), працюючого як CSTR з ретової кислоти і 10г/л етанолу, тривалість утриманциркуляцією рідини і рециркуляцією клітин, кульня рідини знизили з 24 годин до 12 годин на період тура С ljungdahlii отримувала надлишок вітамінів, 36 годин у спробі вимити з реактора оцтову кисломікроелементів і солей, необхідних для живлення ту, яка обмежує здатність культури виробляти бікультури. Реактор працював з надлишком Н2 в льше етанолу. Всі інші робочі умови реактора і газі, що подається, таким чином, що відношення живильне середовище залишилися незмінними. молей Н2 в газі, що подається, до суми подвоєної По закінченні цього періоду тривалість утримання кількості молей перетвореного CO і потроєної кільрідини повернули до 24год. і отримали потік прокості молей перетвореного СО2 становило 5,67. дукту, що містив 3г/л ацетату і 15-25г/л етанолу. Якщо це відношення не більше 1,0, надлишок Н2 Для усунення інгібування продуктом було потрібно не може бути присутнім в реакторі, і вироблення декілька спроб. В альтернативі можна додати Н2 в етанолу не може відбуватися. Крім того, парціальгаз, що подається, для регулювання надлишком ний тиск Н2 у відхідному газі становив 2,61атм., Н2, оскільки надлишок СО2 також може привести тобто, рівень, що перевищує необхідну умову до переважання вироблення оцтової кислоти над 0,4атм. для вироблення етанолу за рахунок надвиробленням етанолу. Ці модифікації запобігають лишку Н2. Нарешті, співвідношення парціального надлишковому виробленню оцтової кислоти і, оттиску Н2 і парціального тиску СО2 у відхідному газі же, запобігають небажаному співвідношенню простановило 10,88, тобто, рівень, який перевищує дуктів і низькій продуктивності вироблення етано3,0 і який забезпечує присутність достатньої кільлу. Потім поновлюють використання надлишку Н2 кості Н2 для використання усього присутнього вугв газі, що подається, або обмежуючої концентрації лецю. У цих умовах реактор виробляв майже 26г/л рідкофазної поживної речовини. етанолу і менше 3г/л ацетату. Продуктивність виПРИКЛАД 24. НАДЛИШКОВА ПОДАЧА МОроблення етанолу склала більше ніж 200г/л день. НООКСИДУ ВУГЛЕЦЮ Якщо будь-який з вищезазначених критеріїв не Культура С. ljungdahlii, штам ERI2, що одержувиконується, реактор не може виробляти етанол вала надлишок поживних речовин (надлишок панза рахунок надлишку Н2. Другий аспект надлишкототенату і кобальту) і не одержувала надлишку Н2 вої подачі Н2 полягає в тому, що вона приводить в газі, що подається, мала питому швидкість погдо додаткового відновлення фередоксина, що линання CO 0,23-0,48ммоль/г хв., і етанол не був окиснюється гідрогеназою. виявлений в потоку продукту. Проте коли культура ПРИКЛАД 21. ОСЛАБЛЕННЯ ІНГІБУВАННЯ С ljungdahlii, штам С-01 подібним чином отримуваСУБСТРАТОМ ла надлишок поживних речовин і не отримувала Лабораторний CSTR New Brunswick Scientific надлишку Н2 в газі, що подається, але знаходилаBioflo®, працюючий при швидкості перемішування ся в умовах, коли надлишкова подача CO викли800об./хв., показав на виході концентрацію СО кала вироблення етанолу, питома швидкість пог10%, хоч до цього він працював лише з 5% СО у линання CO становила 0,67-1,34ммоль/г хв. У цих відхідному газі. Шляхом зниження швидкості пеумовах культура виробляла 9,9-12,0г/л етанолу і ремішування до 600об./хв. інгібування СО було 2,6-2,7г/л ацетату. усунено, і концентрація СО на виході повернулася ПРИКЛАД 25. КОНТРОЛЬ СПІВВІДНОШЕНЬ до 5%. Це привело до підвищення поглинання Н2, ПРОДУКТІВ ШЛЯХОМ ВИДАЛЕННЯ КЛІТИН необхідної умови ефективного використання всьоФерментація газоподібного субстрату (30% го газу, що подається в реактор. CO, 15 Н2, 10% СО2, 45% N2) здійснюється в CSTR 45 76117 46 (рН 5,0, температура 38°С, тиск 138кПа (20 psig)) з Середовище для вироблення етанолу використанням С. ljungdahlii, штам С-01, з рециркуляцією клітин (тривалість утримання клітин 40 Компонент Кількість на літр годин і тривалість утримання рідини 6 годин); ріст 2г/л FeCI2·4H2O 10мл 85% Н3РО4 0,05мл культури не обмежувався кобальтом, пантотенаМікроелементи MPFNa 20мл том кальцію або будь-якою іншою поживною речо(NH4)2HPO4 0,60г виною. В процесі росту культури досягається така NH4CI 2,00г щільність клітин, що питоме поглинання (ммоль NaCI 0,20г KСІ 0,15г СО на грам сухих клітин за хвилину) становить 0,5, MgCI2·6H2O 0,50г і вироблення оцтової кислоти переважає над виСаСІ2·2Н2О 0,20г робленням етанолу. Щоб запобігти такій можливоЦистеїн-НСІ·Н2О 0,25г сті, збільшують швидкість видалення клітин, щоб Розчин вітамінівb Зміннас запобігти збільшенню щільності клітин, так, щоб а Мікроелементи MPFN містять (на літр розчину): 10мл 85% стала концентрація клітин зберігалася досить ниН3РО4, 0,10г ZnSO4·7Н2О, 0,03г МnСІ2 4Н2О, 0,3г Н3ВО3, 0,20г зькою для підтримання питомого поглинання вище СоСІ2 6Н2О, 0,02г CuCI2·H2O, 0,04г NiCI2·6H2O, 0,03г 0,5ммоль СО на грам сухих клітин за хвилину. За NaMoO4·2H2O, 2,00г FeCI2·4H2O, 0,01г Na2SeO3 і 0,10г b рахунок цього тривалість утримання клітин знижуNa2WO4·2H2O Розчин вітамінів містить 20,6мг/л d-біотину, 50,6мг/л тіаміну-НСl і 50,5мг/л кальцієвої солі d-пантотенової ється до 6-25 годин. 3 кислоти Істотно змінюється· від 0,3-0,5мл під час інокуляції до 0,7-0,8мл при високих швидкостях газу Таблиця 1 Таблиця 2 Сумарне порівняння параметрів технологічного процесу і результати прикладів контролюючих механізмів Концентрації Продуктив- Подача пантоте- Подача кобаль- Н2, що подаєть- Парціальний Питоме поглиПрикпродукту ся Контрол. механість вироб- нату (мкг пантове- ту (мкг кобальту/ тиск Н2 у нання СО лад нізм г вироблених Етанол Ацетаτ лення етано- нату/г виробле(2СОперетв + відхідному газі (ммоль/г клі№ лу (г/л·день) них клітин) клітин) (атм.) тин·хв.) (г/л) (г/л) 3СО2перетв) 3 Масоперенос 0 10-13 0 1575-3150 1734-3468 0,46 0,06-0,07 0,275-0,48 3 Масоперенос 0 10-14 0 2250-3600 62-99 0,875 0,11-0,20 0,33-0,40 4 Пантотенат 15-19 1,5 11,5-14,5 18-24 5000-6660 1.03 0,55-0,64 0.23-0.30 4 Пантотенат 18 3 17,4 8,1 3960 1,14 0,60-0.65 0,33 5 Кобальт 26 4 15,6 15,2 33 0,94 0,63 0,37 5 Кобальт 18 4 27,0 85,7 47,6 1.03 0.60 0,50 6 Надлишок CO 9,9 2,6 29,0 97 83,6 1,09 1.6 1.34 6 Надлишок CO 12,0 2,7 60,0 294 735 0,30 0.6 0,67 7 Надлишок Н2 10,0 3,3 6,7 900-1125 991-1239 1,96 0,7-0,87 0.28-0.35 7 Надлишок Н2 25,96 2,85 215-240 46 460 5,67 2,61 1.68 Таблиця 3 Результати зсуву співвідношення продуктів штамів Clostridium ljungdahlii С. ljungdahlii Штам ERI2 ERI2 ERI2 ERI2 ERI2 ERI2 C-01 C-01 C-01 C-01 PETC PETC Середовище Обмеження Збільшення оцтової кислоти Обмеження пантотенату Збільшення оцтової кислоти Обмеження пантотенату Збільшення оцтової кислоти Обмеження кобальту Збільшення оцтової кислоти Обмеження пантотенату Збільшення оцтової кислоти Обмеження кобальту Збільшення оцтової кислоти Обмеження кобальту Конц. клітин* (г/л) 1,1 0,3 0,55 0,5 0,8 1,3 1,2 0,8 1,2 2,5 0,8 1,0 Перетворення газу CO Н2 90 80 88 20 90 85 90 20 100 93 80 20 96 90 60 30 96 90 80 20 65 55 95 55 Концентрація продукту Етанол Ацетат 0 10 2,5 0 1,0 5,5 10 1,0 1 7 9 3 1 8 4 0
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for a stable producing ethanol
Назва патенту російськоюСпособ стабильной непрервной выработки этанола
МПК / Мітки
МПК: C12P 7/06, C12R 1/01, C12N 1/18, C12R 1/145, C12M 1/04, C12R 1/02
Мітки: вироблення, етанолу, спосіб, стабільного, безперервного
Код посилання
<a href="https://ua.patents.su/25-76117-sposib-stabilnogo-bezperervnogo-viroblennya-etanolu.html" target="_blank" rel="follow" title="База патентів України">Спосіб стабільного безперервного вироблення етанолу</a>
Попередній патент: Спосіб (варіанти) і система для полегшення безпровідних електронних комерційних операцій
Наступний патент: Спосіб ураження броньованої цілі зверху обертовим снарядом (ракетою)
Випадковий патент: Спосіб склерохірургії для лікування варикозної хвороби