Заміщені імідазохіноліни
Номер патенту: 105764
Опубліковано: 25.06.2014
Автори: Зіммерманн Астрід, Джагтап Аніл П., Чауре Ганеш С., Кулкарні Санджів А., Гекелер Фолькер, Хофманн Ганс-Петер, Майер Томас
Формула / Реферат
1. Сполука за формулою I:
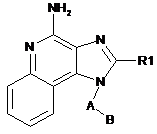 , (І)
, (І)
де
R1 вибрано з групи, до складу якої входять:
-Н, алкіл, алкініл, арил, алкокси, гетероцикліл і гетероарил, де алкіл, алкініл, арил, алкокси, гетероцикліл або гетероарил можуть бути незаміщеними або заміщеними одним або декількома замісниками, вибраними групи, до складу якої входять: -Н, -ОН, галоген, -CO-N(R4)2, -N(R4)2, -CO-С1-10алкіл, -СО-О-С1-10алкіл, -N3, арил і гетероцикліл, де кожний R4 є незалежно вибраним з групи, до складу якої входять: -Н, - С1-10алкіл, -С1-10алкіларил або арил;
А є С, -С6алкілом;
В є -N(R2)(R3);
R2 є Н або -(CO)-R5;
R5 вибрано з групи, до складу якої входять:
алкіл, що містить групи з прямим ланцюгом та з розгалуженим ланцюгом, а також циклічні групи, алкініл, арил, гетероцикліл і гетероарил, кожен з яких може бути незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що містить: -Н, -ОН, галоген, -СООН, -SH, -CO-C1-6алкіл, -СО-О-С1-6алкіл, -N3, арил, гетероцикліл, -СО-арил та -СО-гетероцикліл;
R3 вибрано з групи, до складу якої входять:
алкеніл, гетероарил, циклоалкіл і гетероцикліл, де алкеніл, гетероарил, циклоалкіл або гетероцикліл можуть бути незаміщеними або заміщеними одним або декількома замісниками, вибраними з групи, що містить: -Н, алкіл, алкеніл, алкокси, галоген, -ОН, -N3, трифторометил, -алкіларил, -О-алкіларил, -СО-арил, арил, гетероцикліл, гетероарил, -СО-гетероарил, -СО-О-алкіл, -CO-N-алкіл, -СО-N-арил;
або фармацевтично прийнятні сольвати, солі, N-оксиди або їх стереоізомери або їх комбінації.
2. Сполука відповідно до формули І за п. 1, у якій R1 є алкінілом або алкокси.
3. Сполука відповідно до формули І за п. 1 або 2, у якій R3 є гетероциклілом, який може бути заміщеним одним або декількома замісниками, які вибрані з групи, що містить: -Н, алкіл, алкеніл, галоген і -ОН.
4. Сполука відповідно до формули І за будь-яким з пп. 1-3, у якій R3 вибрано з групи, що містить діоксотетрагідротіофеніл, піперидиніл, тетрагідрофураніл, піридидин, тетрагідропіраніл і азобіциклооктаніл, кожен з яких може бути, за вибором, заміщений однією або декількома групами, вибраними з групи, що містить галоген, гідроксил, арил, алкіл, алкокси, трифторметил або їх комбінацію.
5. Сполука відповідно до формули І за будь-яким з пп. 1-4, у якій R1 є алкілом, переважно етилом.
6. Сполука відповідно до формули І за будь-яким з пп. 1-5, у якій R5 є алкілом, переважно метилом.
7. Сполука за п. 1, яка вибрана з групи:
N-[4-(4-аміно-2-етил-1Н-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1,1-діоксидотетрагідро-3-тієніл)ацетамід,
N-[4-(4-аміно-2-етил-1Н-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1-метил-1-оксидопіперидин-4-іл)ацетамід,
3-{ацетил[4-(4-аміно-2-етил-1Н-імідазо[4,5-с]хінолін-1-іл)бутил]аміно}-2,5-ангідро-1,3,4-тридеоксипептитол,
N-[4-(4-аміно-2-етил-1Н-імідазо[4,5-с]хінолін-1-іл)бутил]-N-(1-бензил-2-метил-1-оксидопіролідин-3-іл)ацетамід
або їх фармацевтично прийнятні сольвати, солі, N-оксиди або їх стереоізомери або їх комбінації.
8. Сполука за будь-яким з пп. 1-7 для застосування як медикаменту.
9. Фармацевтична композиція, яка відрізняється тим, що містить терапевтично ефективну кількість сполуки відповідно до формули І за будь-яким з пп. 1-7 у комбінації з фармацевтично прийнятним носієм.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що містить таку кількість сполуки відповідно до формули 1 або її фармацевтично прийнятних сольватів, солей, N-оксидів або їх стереоізомерів або їх комбінацій, якої достатньо для забезпечення суб'єкту дози, від 100 нг/кг до 50 мг/кг, переважно від 10 μ/кг до 5 мг/кг сполуки.
11. Сполука за будь-яким з пп. 1-7, яка використовується для лікування вірусної або неоплазійної хвороби.
12. Сполука за будь-яким з пп. 1-7, яка застосовується для лікування раку, вибраного з групи, що включає: рак грудей, сечового міхура, кістки, мозку, центральної і периферичної нервової системи, товстої кишки, ендокринних залоз, стравоходу, оболонки матки, клітин зародкових центрів, голови і шиї, нирки, печінки, легені, гортані і гортаноглотки, мезотеліоми, саркоми, яєчника, підшлункової залози, простати, прямої кишки, нирки, тонкої кишки, м'якої тканини, яєчка, шлунка, шкіри, сечоводу, піхви і вульви; спадковий рак, ретинобластому і пухлину Wilms; лейкоз, лімфому, хворобу non-Hodgkins, хронічну і гостру форми лейкемії, що стосуються спинного або кісткового мозку, гострий лімфобластний лейкоз, хворобу Hodgkins, множинну мієлому і Т-клітинна лімфому; мієлодиспластичний синдром, неоплазію плазматичної клітини, паранеопластичні (що стосуються пухлини) синдроми, рак невідомого первинного сайту і СНІД-залежні злоякісні новоутворення.
13. Сполука за будь-яким з пп. 1-7, яка застосовується для лікування захворювань, вибраних з групи, що включає: прості бородавки; підошовні бородавки; гепатит В; гепатит С; Herpes Simplex (простий герпес) типу І і типу II; контагіозний молюск; HIV (ВІЛ); СМV (цитомегаловірус); VZV (оперізувальний лишай); інтраепітеліальні неоплазії, такі як цервікальна інтраепітеліальна неоплазія; людський папіломавірус (HPV) і асоційовані неоплазії; грибкові хвороби, наприклад кандидоз, аспергильоз, а також криптококові менінгіти; пухлинні захворювання, наприклад базальноклітинний рак, волосатоклітинний лейкоз, саркома Капоші, нирковоклітинний рак, плоскоклітинний рак, мієлогенозний лейкоз, множинна мієлома, меланома, лімфома non-Hodgkin's, шкірна Т-лімфоцитарна лімфома, а також інші види раку; паразитарні хвороби, наприклад хвороби, спричинені грибком Pneumocystis carnii, криптоспоридіоз, гістоплазмоз, токсоплазмоз, трипаносомна (trypanosome) інфекція і лейшманіоз; а також бактеріальні інфекції, наприклад туберкульоз, і інфекції, спричинені мікобактеріями (mycobacterium avium), інші хвороби або хворобливі стані, які можуть лікуватися з використанням сполук за винаходом, включають екзему; еозинофілію; есенціальну тромбоцитанемію; лепру; розсіяний склероз; синдром Ommen's; дискоїдний вовчак; хворобу Боуена, сочевицеподібний дискоїдний дискератоз; бовеноїдний папульоз; алергічні хвороби, такі як алергічний дерматит; астма; алергія; алергічний риніт; системний червоний вовчак (еритематозний вовчак); як засіб для лікування рецидивних грибкових хвороб, періодонтиту і хламідозу; як вакцинний ад'ювант для забезпечення клітинного опосередкованого імунітету; а також як засіб для поліпшення або стимуляції загоєння ран, включаючи хронічні рани.
14. Застосування сполуки за будь-яким з пп. 1-7 для виготовлення медикаменту.
15. Фармацевтична композиція за пп. 9, 10, яка відрізняється тим, що використовується для лікування вірусної або неоплазійної хвороби.
16. Фармацевтична композиція за пп. 9, 10, яка відрізняється тим, що застосовується для лікування раку, вибраного з групи, що включає: рак грудей, сечового міхура, кістки, мозку, центральної і периферичної нервової системи, товстої кишки, ендокринних залоз, стравоходу, оболонки матки, клітин зародкових центрів, голови і шиї, нирки, печінки, легені, гортані і гортаноглотки, мезотеліоми, саркоми, яєчника, підшлункової залози, простати, прямої кишки, нирки, тонкої кишки, м'якої тканини, яєчка, шлунка, шкіри, сечоводу, піхви і вульви; спадковий рак, ретинобластому і пухлину Wilms; лейкоз, лімфому, хворобу non-Hodgkins, хронічну і гостру форми лейкемії, що стосуються спинного або кісткового мозку, гострий лімфобластний лейкоз, хворобу Hodgkins, множинну мієлому і Т-клітинну лімфому; мієлодиспластичний синдром, неоплазію плазматичної клітини, паранеопластичні (що стосуються пухлини) синдроми, рак невідомого первинного сайту і СНІД-залежні злоякісні новоутворення.
17. Фармацевтична композиція за пп. 9, 10, яка відрізняється тим, що застосовується для лікування захворювань, вибраних з групи, що включає: прості бородавки; підошовні бородавки; гепатит В; гепатит С; Herpes Simplex (простий герпес) типу I і типу II; контагіозний молюск; HIV (ВІЛ); СМV (цитомегаловірус); VZV (оперізувальний лишай); інтраепітеліальні неоплазії, такі як цервікальна інтраепітеліальна неоплазія; людський папіломавірус (HPV) і асоційовані неоплазії; грибкові хвороби, наприклад кандидоз, аспергильоз, а також криптококові менінгіти; пухлинні захворювання, наприклад базальноклітинний рак, волосатоклітинний лейкоз, саркома Капоші, нирковоклітинний рак, плоскоклітинний рак, мієлогенозний лейкоз, множинна мієлома, меланома, лімфома non-Hodgkin's, шкірна Т-лімфоцитарна лімфома, а також інші види раку; паразитарні хвороби, наприклад хвороби, спричинені грибком Pneumocystis carnii, криптоспоридіоз, гістоплазмоз, токсоплазмоз, трипаносомна (trypanosome) інфекція і лейшманіоз; а також бактеріальні інфекції, наприклад туберкульоз, і інфекції, спричинені мікобактеріями (mycobacterium avium), інші хвороби або хворобливі стані, які можуть лікуватися з використанням сполук за винаходом, включають екзему; еозінофілію; есенціальну тромбоцитанемію; лепру; розсіяний склероз; синдром Ommen's; дискоїдний вовчак; хворобу Боуена, сочевицеподібний дискоїдний дискератоз; бовеноїдний папульоз; алергічні хвороби, такі як алергічний дерматит; астма; алергія; алергічний риніт; системний червоний вовчак (еритематозний вовчак); як засіб для лікування рецидивних грибкових хвороб, періодонтиту і хламідозу; як вакцинний ад'ювант для забезпечення клітинного опосередкованого імунітету; а також як засіб для поліпшення або стимуляції загоєння ран, включаючи хронічні рани.
Текст
Реферат: Розкриті імідазохіноліни за формулою І, які включають сукупність функціональних ознак заміщеного аміну або аміду у 1-позиції і які діють як активатори Toll-подібного рецептора 7. Дані сполуки використовуються як протиракові засоби. UA 105764 C2 (12) UA 105764 C2 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область винаходу: Даний винахід відноситься до похідних імідазоліну і до фармацевтичних композицій, що містять похідні імідазохиноліну. Похідні імідазохінолінів використовуються як агоністи Toll – подібних рецепторів (TLR)/активаторів TLR7 (TLR є сімейством рецепторів, що спеціалізуються на розпізнаванні мікробних і вірусних структур, а також регулюють взаємостосунки між клітинами імунної системи, епітеліоцитами і мікроорганізмами). Передумови створення винаходу: Toll-подібні рецептори (TLR), які в даний час являються сімейством з 10 рецепторів різної специфічності, є частиною системи розпізнавання образу клітинної патогенної структури, яка введена для захисту від різних інфекцій (бактерійного, вірусного або грибкового походження). Активація TLR призводить до реакцій цитокіну, наприклад, з виходом інтерферонів і активацією позначених імунокомпетентних клітин. Функціональна експресія відібраних TLR в тканинах характеризується високим ступенем відмінності. Частина рецепторів розташована на поверхні клітини, наприклад, TLR4 (стимульований ліпополісахаридом LPS E.coli), наприклад, на епітеліальних клітинах, або TLR3, 7, 8 і 9 розташовані на ендосомальних мембранах позначених імунокомпетентних клітин. Всі останні рецептори активізовані нуклеїновими кислотами, але розпізнають різні їх типи. Наприклад, TLR9 активізується однонитковою DNA, що містить субпослідовності CpG; TLR7 і 8 активізуються однонитковою RNA, а TLR3 активізується двонитковою RNA. Були ідентифіковані деякі агоністи малої молекули (SMOL) TLR7 або TLR8. Такі агоністи можуть бути згруповані в пурин - подібні молекули, наприклад, такі як 7-тіа-8-оксогуанозин (TOG, ізаторібін) або імідазохіноліну іміхімод. На сьогоднішній день іміхімод є єдиним підтвердженим дійсним TLR-агоністом, відомим на ринку збуту у вигляді 5 % крему (виробник Aldara). Він забезпечує, приблизно, 80 %-ий 5-річний кліренс поверхневих базально-клітинних епітеліом, які є найпоширенішим раковим захворюванням у всьому світі. Іміхімод активізує TLR7. Функціональна експресія TLR7 виявляється звуженою до заданих імунокомпетентних клітин, тобто на даний момент винятково плазмацитоїдні дендритні клітини, В-лімфоцити, і можливо, еозинофіли є відомими як клітини, що активізовані агоністами TLR7 в організмі людини. Ось вже декілька років у всьому світі здійснюються активні дії по використовуванню сильної імунної активації, викликаної агоністами TLR7, 8 або 9 для лікування раку. Проте імунотерапія раку пройшла довгий шлях розвитку, на якому траплялося і численні невдачі. Проте, за останні роки накопичена велика інформація про імунне спостереження над раком і про функцію субпопуляций імунокомпетентних клітин. TLR7 або TLR9 агоністи проходять шлях клінічних досліджень, з метою розробки моно - або комбінованих терапевтичних методик лікування ракових новоутворень, або вакцинних ад'ювантів. Методика використовування TLR агоніста для імунотерапії раку відрізняється від раніших методик, що використовують, наприклад, цитокіни, інтерферони або одновалентні вакцинації. Імунна активація через TLR агоніста є плейтропною, завдяки вказаним імунокомпетентним клітинам (перш за все дендрітним клітинам і В-лімфоцитам, а потім і іншим клітинам), які генерують природну і адаптивну імунну реакцію. Крім того, індукується не тільки інтерферон, але також безліч різних ізоформ, і не тільки тип I (альфа, бета), але також і (опосередкований) тип II (гамма, клітини NK). Принаймні, для місцевого застосування, Aldara є переконливим доказом представленої вище концепції. Це говорить про те, що пухлини випускають антигени і що імунна терапія, у принципі, може сприяти виявленню симптомів раку навіть в процесі монотерапії. Проте, для розробки системного способу введення ліків, на порядку денному знаходиться РОС (доказ концепції), тобто клінічне дослідження TLR7 або TLR9 агоністов, які обидва присутні в постановці клінічних експериментів. Абсолютно очевидно, що при прогресуючих (з метастазами) формах раку і при системному застосуванні (переважно, sx. або при в/в способі введення ліків) TLR агоністи повинні використовуватися разом з іншими методами лікування. На ранніх стадіях раку ситуація може відрізнятися. Метастаз пухлини є найважчим аспектом розвитку ракової пухлини у хворих, в значній мірі, тому, що пухлини виявляються надто пізно, коли метастаз вже розвинувся. Встановлені методи лікування пухлини включають, головним чином, цитотоксичні препарати з досить вузькими терапевтичними сферами дії (вікнами). Отже, для лікування пухлини на ранніх стадіях розвитку, коли ще можливе придушення процесу розповсюдження метастаза, існує велика потреба в нових методах лікування, що характеризуються хорошою переносимістю і безпекою. Активація імунної системи, зокрема, активація сигналу toll - подібного рецептора (TLR), пропонує нові багатообіцяючі підходи до рішення проблеми лікування раку. TLR9 агоністичний 1 UA 105764 C2 5 10 15 20 25 30 35 40 45 CpG олігос, наприклад, H2006 або HI826, і TLR7 агоністи, наприклад, ізаторибін похідного гуанозину або похідне іміхімоду були досліджені в нашій мишачій моделі метастазу легені Ренка (Renca). Усі тестовані молекули, фактично, повністю придушили появу метастазів легені із забезпеченням хорошої переносимості і безпеки. Такі результати переконують в доцільності проведення клінічних досліджень і розробки таких молекул для придушення метастаза раку і указує на можливість системного застосування таких медикаментів. Проте агоністи TLR7 типу SMOL мають перевагу, яка полягає у використанні ефективного і економічно вигідного синтезу, порівняно з нуклеїно-кислотними агоністами TLR9, і відповідають вимогам локального застосування. Документ US-B-6,573,273 описує сполуки імідазохіноліну і тетрагідроїмідазохіноліну, які містять сечовину, тіосечовину, ацилсечовину, сульфонілсечовину, або сукупність функціональних характеристик карбамату. Існує думка, що сполуки доцільно використовувати як імуномодулятори. Документ US-B-6,677,349 описує сполуки імідазохіноліну і тетрагідроїмідазохіноліну, які містять сукупність функціональних характеристик сульфонаміду в 1-позиції. Існує думка, що сполуки доцільно використовувати як імуномодулятори. Документи US-A-2003/0144283 і WO-A-00/76505 описують сполуки імідазохіноліну і тетрагідроїмідазохіноліну, які містять сукупність функціональних характеристик аміду в 1позиції. Існує думка, що сполуки доцільно використовувати як імуномодулятори. Документ WO-A-2005/051324 описує імідазо-хінолін-, піридин - і нафтиридин - оболочкові системи, заміщені в 1 - позиції оксимом або спеціальними сукупністю функціональних характеристик N-окисиду. Існує думка, що сполуки доцільно використовувати як імуномодулятори. Суть винаходу: Було знайдено, що малі молекули, зокрема, похідні імідазохінолін-4-аміну є активаторами TLR7 з високою потенцією. Дані похідні імідазохіноліну володіють сприятливими физикохімічними і фармакокінетичними властивостями. Відповідно, даний винахід забезпечує сполуки, що, як було знайдено, є активаторами TLR7 і які визначені загальною структурною формулою I: (I) де: R1, А і B відповідають визначенню, наведеному нижче. Сполуки за формулою I є корисними як активатори TLR7. Крім того, винахід забезпечує фармацевтичні композиції, що містять ефективну кількість сполуки за формулою I. При цьому, описані способи здійснення синтезу сполук за формулою I. Опис малюнків: Фігура 1 представляє дію хлорохіну на цитокінову індукцію агоністів TLR в клітинах PCIR-1. Експресія IL8 mRNA вимірювалася за допомогою TaqMan PCR після 16-годинної інкубації клітин з H2006, LPS або Резихімодом окремо або в комбінації з хлорохіном. Фігура 2 представляє систему скринінгу агоніста TLR. Фігура 3 представляє індукцію mRNA цитокіну в hPBMC, обробленому за допомогою 3{ацетил[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]аміно}-2,5-ангідро-1,3,4тридеоксипентитолу (приклад III, TLR або 1). Фігура 4 представляє дослідження з використанням посилальних сполук в моделі метастазу легені Ренка (Renca) (Leja А, Hofmann HP, Maier T, Drache D, Grebe C, Fischer S, Gimmnich P, Sanders K, Gekeler V. Метастаз мишачих ниркових ракових клітин Ренка до легенів Balb/c мишей в значній мірі пригнічується TLR9 або TLR7 агоністами. Реферат 3552, Proc Am Cancer Res 48, 2007), TOG=7-тіа-8-оксогуанозин; IMDZQ = похідне імідазохіноліну). Зокрема, жіночі 2 UA 105764 C2 5 10 15 20 25 30 35 40 особини мишей Balb/c (n=10) одержували лікування протягом 4 подальших днів, починаючи з першого дня або восьмого дня після введення пухлинної клітини Renca LacZ, відповідно. Сполуки (малі молекули (SMOL)) застосовувалися в 20 % PEG, ODNs в 0,9 % NaCl, як було вказано. Легені були відсічені через 25 днів після введення пухлинної клітини (див. Фігуру 4A). Після цього жіночі особини мишей Balb/c (n=5) одержували лікування протягом 4 подальших днів по вказаній вище схемі. Сполуки (SMOL) застосовувалися в 20 % PEG (поліетиленгліколь), ODNs (олігодеоксирибонуклеотіди) у 0,9 % NaCl. На четвертий день була узята кров через орбітальне сплетення, і були відсічені селезінки. Згодом, mRNA була виділена для аналізу експресії через qPCR (метод полімеразної ланцюгової реакції із зворотною транскрипцією). Дані були нормалізовані для контролю наповнювача (носія) (середній ряд до 1). Статистична оцінка була виконана за допомогою тестування по методу Mann-Whitney (статистичний критерій для змінної, зміряної за допомогою порядкової шкали, який порівнює відмінність в показниках положення двох сукупностей, виходячи із спостережень, узятих з двох незалежних) (див. фігуру 4В). Фігура 5 представляє дослідження, подібні дослідженням, представленим на фігурі 4, але виконані з використанням 3-{ацетил[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]аміно)2,5-ангідро-1,3,4-тридеоксипентитолу (TLR аго 1, приклад III) і N-[4-(4-аміно-2-етил-1Hімідазо[4,5-c]хінолін-1-іл)бутил]-N-(1,1-діоксидотетрагідро-3-тієніл) ацетаміду (TLR аго 2, приклад I) в моделі метастазу легені Ренка. Докладний опис винаходу: Було знайдено, що похідні імідазохінолів, які детальніше описані нижче за текстом, є ефективними активаторами TLR7 і, несподівано, виявилися володарями надзвичайно сприятливих властивостей. Крім того, ґрунтуючись на сказаному вище, було знайдено, що цілий ряд фармацевтично прийнятних сольватів, солей, N-оксидів або стереоізомерів похідних даних імідазохінолінів або їх комбінації, несподівано, виявилися володарями надзвичайно сприятливих властивостей. Даний винахід забезпечує сполуки, які відповідають формулі I: (I) де R1 вибрано з групи, до складу якої входять: -H, алкіл, алкініл, арил, алкокси, гетероцикліл і гетероарил, де алкіл, алкініл, арил, алкокси, гетероцикліл або гетероарил, за вибором, можуть бути заміщені однією або декількома групами, які, наприклад, вибрані з групи, до складу якої входять: -H, -OH, галоген, -CO-N(R4)2, N(R4)2, -CO-C1-10 алкіл, -CO-O-C1-10 алкіл, -N3, за вибором, заміщений арил, гетероцикліл або CO-арил; кожний R4 незалежно вибраний з групи, до складу якої входять: -H, -C1-10 алкіл, -C1-10 aлкіл-арил, арил; A являє собою C1-C6 алкіл; B являє собою -N(R2)(R3); R2 являє собою водень або -(CO)-R5; R5 вибрано з групи, до складу якої входять: алкіл, алкініл, арил, гетероцикліл і гетероарил, кожен з яких може бути за вибором заміщений однією або декількома групами, які, наприклад, вибрані з групи, до складу якої 3 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 входять: -H, -OH, галоген, -CN, -NO2,-COOH, -SH, -CO-C1-6 алкіл, -CO-О-C1-6 алкіл, -N3, за вибором заміщений арил, гетероцикліл, -CO-арил або -CO-гетероцикліл; R3 вибрано з групи, до складу якої входять: -H, алкіл, алкеніл, арил, гетероарил, циклоалкіл і гетероцикліл, де алкіл, алкеніл, арил, гетероарил, циклоалкіл або гетероцикліл можуть бути незаміщеними або заміщеними одним або декількома замісниками, які, наприклад, вибрані з групи, до складу якої входять: -H, алкіл, алкеніл, алкокси, галоген, -OH, -N3, трифторметил, -алкіл-арил, -O-алкіл-арил, -CO-арил, арил, гетероцикліл, гетероарил, -CO-гетероарил, -CO-заміщений арил, -CO-заміщений гетероарил, CO-O-алкіл, -CO-N-алкіл, -CO-N-арил; або фармацевтично прийнятні сольвати, солі, N-оксиди або їх стереоізомери, або їх комбінації. У контексті даного документа, терміни "алкіл", "алкеніл", "алкініл", а також префікс "алк" включають поняття, які відносяться як до груп з прямим ланцюгом, так і до груп з розгалуженим ланцюгом, а також до циклічних груп, тобто до циклоалкілу і циклоалкенілу. Якщо не передбачене інше, дані групи містять від 1 до 20 атомів вуглецю, при цьому групи алкенілу і алкінілу містять від 2 до 20 атомів вуглецю. Переважні групи, в яких загальна кількість атомів вуглецю складає до десяти атомів. Циклічні групи можуть бути моноциклічними або поліциклічними і, переважно, містять від 3 до 10 циклічних атомів вуглецю. Циклічні групи, використані в прикладах здійснення, включають циклопропіл, циклопентил, циклогексил і адамантил. Зокрема, термін "алкіл" відноситься до прямого ланцюга або до розгалуженого алкілового радикалу, що має від 1 до 4 атомів вуглецю. Перелік прикладів включає метил, етил, пропіл, ізопропіл, бутил, ізобутил, сек-бутил, тер-бутил. Заміщений алкіл відповідає вказаному вище. Термін "алкініл" відноситься до алкілової групи, що містить, принаймні, два атоми вуглецю, і включає вуглець-вуглецевий потрійний зв'язок. Заміщений алкиніл відповідає вказаному вище. Подібно викладеному вище, термін "алкеніл" відноситься до алкілової групи, що має, принаймні, два атоми вуглецю, включаючи вуглець-вуглецевий подвійний зв'язок. Термін "алкокси" відноситься до алкілової групи, зв'язаної за допомогою атома кисню. Термін "арил" в контексті даного документа включає карбоциклічні ароматичні кільця або системи кілець. Приклади арилових груп включають феніл, нафтил, біфеніл, флуореніл і інденіл. Зокрема, термін "арил" відноситься до фенілу і нафталену. У переважному прикладі здійснення арил є фенілом. Заміщений арил відповідає вказаному вище. Термін "гетероарил" включає ароматичні кільця або системи кілець, які містять, принаймні, один кільцевий гетероатом (наприклад, О, S, N). Зокрема, використовувані в прикладах здійснення гетероарилові групи включають фурил, тієніл, піроліл, піразоліл, імідазоліл, триазоліл, тетразоліл, ізоксазоліл, оксазоліл, тіазоліл, ізотіазоліл, оксадіазоліл, оксатриазоліл, тіадіазоліл, піридил, піридазиніл, піримідиніл, бензофураніл, ізобензофураніл, тіонафтеніл, ізотіонафтеніл, індоліл, ізоїндоліл, індазоліл, бензизоксазоліл, бензоксазоліл, бензтіазоліл, бензизотіазоліл, пуриніл, бензопураніл, хінолініл, ізохінолініл, синолініл, хіназолініл, нафтиридиніл і бензоксазиніл, який в кожному з випадків є незаміщеним або може бути, за вибором, заміщеним в одному або декількох положеннях. Заміщений гетероарил заміщується, наприклад, одним або декількома компонентами з переліку, що включає галоген, гідроксил, арил, алкіл, аралкіл, алкокси, карбокси, циано, трифторометил, нітро, аміно, алкіламіно, діалкіламіно, або їх комбінації. У контексті даного документа, термін "гетероцикліл" відноситься до неароматичних кілець або моно-або біциклічних систем кілець, які містять, принаймні, один кільцевий гетероатом (наприклад, переважно, вибраний з O, SOx або N, де x=0, 1 або 2). У прикладах здійснення гетероциклічні групи включають піролідиніл, тетрагідрофураніл, морфолініл, тіоморфолініл, піперидиніл, піперазиніл, тіазолідиніл, імідазолідиніл, тетрагідропіраніл, азабіциклооктаніл, такий, як 1-азабіцикло[2.2.2]-октаніл, 1-оксо і діоксо-тетрагідротіофеніл або циклопентилсульфоніл, а також їх бензоконденсовані форми та/або n-оксиди, які у кожному випадку є незаміщеними або, за вибором, можуть бути заміщеними в одному або декількох положеннях. Заміщений гетероцикліл заміщається, наприклад, одним або декількома елементами з переліку, що включає галоген, гідроксил, арил, алкіл, аралкіл, алкокси, карбокси, циано, трифторометил, нітро, аміно, алкіламіно, діалкіламіно або їх комбінації. Слід віддавати собі звіт у тому, що даний винахід розповсюджується на всі комбінації згаданої групи замісників. Зокрема, винахід розповсюджується на всі комбінації описаних вище переважних груп. Фармацевтично прийнятні солі сполук за даним винаходом включають всі неорганічні і органічні кислі аддитивні солі і солі з основами, особливо, всі фармацевтично прийнятні 4 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 неорганічні і органічні кислі аддитивні солі і солі з основами, зокрема, всі фармацевтично прийнятні неорганічні і органічні кислі аддитивні солі і солі з основами, традиційно використовувані у фармації. Приклади кислих аддитивних солей включають, не обмежуючи у виборі, гідрохлориди, гідроброміди, фосфати, нітрати, сульфати, ацетати, цитрати, D-глюконати, бензоати, 2-(4гідроксибензоїл)бензоати, бутирати, субсаліцилати, малеати, лаурати, малати, фумарати, сукцинати, оксалати, тартарати, стеарати, толуолсульфонати, метансульфонати, 3-гідрокси-2нафтоати і трифторацетати. Приклади солей з основами включають, не обмежуючи у виборі, солі літію, натрію, калію, кальцію, алюмінію, магнію, титану, амонію, меглуміну і солі гуанідину. Переважними є солі натрію і солі амонію. Солі можуть бути як нерозчинними, так і розчинними у воді. Сполуки за даним винаходом і їх солі, будучи виділеними в кристалічній формі, можуть містити різні кількості розчинників. Тому всі сольвати сполук відповідно до формули (I) і їх солі входять до складу об'єму захисту винаходу. Гідрати є переважним прикладом вказаних сольватів. N-оксиди сполук за винаходом і їх солі включають сполуки, в яких атом азоту частини замісника є окисленим. У окремих прикладах здійснення, сполуки за винаходом і їх солі можуть включати стереоізомери. Кожний із стереогенних центрів, присутніх у вказаних стереоізомерах, може мати абсолютну конфігурацію R або абсолютну конфігурацію S (відповідно до правил Cahn, Ingold і Prelog). Всі подібні стереоізомери і їх солі є частиною даного винаходу. У область захисту винаходу також входять всі згадані вище суміші стереоізомерів, незалежно від співвідношення, включаючи рацемічні суміші. Сполуки за даним винаходом і їх солі, що містять подвійний зв'язок, можуть існувати у вигляді Е-ізомерів і у вигляді Z-ізомерів. Обидва ізомери включені в об'єм захисту винаходу. Zізомер є геометричним ізомером, в якому атоми вуглецю, сполучені подвійним зв'язком, кожен, мають дві групи найвищого рангу на одній і тій же стороні подвійного зв'язку. Е-ізомер є геометричним ізомером, в якому атоми вуглецю, сполучені подвійним зв'язком, кожен, мають дві групи найвищого рангу на протилежних сторонах подвійного зв'язку. Деякі сполуки і солі за даним винаходом можуть існувати в різних кристалічних формах (поліморфи), які включені в об'єм захисту винаходу. Крім того, похідні сполук за формулою (I) і їх солі, які конвертуються в сполуку (I) або її сіль в біологічній системі (біопрекурсори або проліки), включені в об'єм захисту винаходу. Дана біологічна система представлена, наприклад організмом ссавця, зокрема, людиною. Біопрекурсор, наприклад, конвертується в сполуку за формулою (I) або її сіль при здійсненні метаболічного процесу. Відповідно до переважного прикладу здійснення даного винаходу, сполуки відповідно до формули I, де R1 є -H, алкіл, за вибором, заміщений арил, гетероцикліл або, за вибором, заміщений гетероарил; R2 є -(CO) -R5, де R5 є алкілом, арилом або гетероарилом, а R3 є -H або алкілом, виключаються з об'єму захисту даного винаходу. У іншому переважному прикладі здійснення даний винахід відноситься до сполуки за формулою Iа, яка є сполукою за формулою I, як визначено вище, в якій R2 є воднем. Ще в одному переважному прикладі здійснення, даний винахід відноситься до сполуки за формулою Ib, причому дана сполука відповідає сполуці за згаданою вище формулою I, в якій R2 представлений -(CO) -R5; а R3 вибрано з груп, що складаються з: алкенілу, арилу, гетероарилу, циклоалкілу і гетероциклілу, кожний з яких може бути незаміщений або заміщений одним або декількома замісниками. Ще в одному переважному прикладі здійснення, даний винахід відноситься до сполуки за формулою Iс, причому дана сполука відповідає сполуці за згаданою вище формулою I, в якій R2 представлений -(CO) -R5. У переважному прикладі здійснення сполука за формулою I, включаючи сполуки за формулами la, lb і Ic, згідно даному винаходу, R 3 є гетероциклілом, який може бути незаміщений або заміщений одним або декількома замісниками, як визначено вище. У іншому переважному прикладі здійснення сполука за формулою I, включаючи сполуки за формулами la, lb і Ic, R1 є алкілом, переважніше, етилом. Ще в одному переважному прикладі здійснення сполука за формулою I, включаючи сполуки за формулами la, lb і Ic, R5 є алкілом, переважніше, метилом. 5 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому переважному прикладі здійснення сполука за формулою I, включаючи сполуки за формулами la, lb і Ic, R3 є гетероциклілом, який може бути незаміщений або заміщений одним або декількома замісниками, вибраними з групи, що складається з водню, алкілу, алкенілу, галогену або -ОН. Ще в одному переважному прикладі здійснення сполука за формулою I, включаючи сполуки за формулами la, lb і Ic, А є С2-4 алкіл, більш переважно, C4 алкіл. Ще один переважний приклад здійснення сполук, що відповідають данному винаходу, відноситься до сполук за формулою I, вибраних із наступного переліку: N-[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1,1-діоксидотетрагідро-3тієніл)ацетамід, N-[4-(4-амфно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1-метил-1-оксидопіперидин-4іл)ацетамід, 3-{ацетил[4-(4-аміно-2-етил-1-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1-бензил-2-метил-1оксидопіролідин-3-іл)ацетамід, 2-етил-1-[4-(тетрагідро-2H-піран-4-іламіно)бутил]-1H-імідазо[4,5-c]хінолін-4-амін, 1-[4-(1азабіцикло[2.2.2]окт-3-іламіно)бутил]-2-етил-1H-імідазо[4,5-c]хінолін-4-амін або 1-{4-[(1,1-діоксидо-3,4-дигідро-2H-тіохромен-4-іл)аміно]бутил}-2-етил-1H-імідазо[4,5c]хінолін-4-амін або фармацевтично прийнятні сольвати, солі, N-оксиди або їх стереоізомери, або їх комбінації. Фармацевтичні композиції за винаходом містять терапевтично ефективну кількість сполуки відповідно до формули I (включаючи формули la, lb і Ic), за даним винаходом, у комбінації з фармацевтично прийнятним носієм. Термін "фармацевтично ефективна кількість" означає кількість сполуки, достатня для забезпечення такого терапевтичного ефекту, як активація TLR7. Це може викликати індукцію цитокіну, протипухлинну активність та/або антивірусну активність. Хоча точна кількість активної сполуки, використовуваної у фармацевтичній композиції за винаходом, змінюватиметься відповідно до чинників, відомих кваліфікованому фахівцю з рівня техніки, наприклад, таким як фізична і хімічна природа сполуки, а також природа носія і розроблений режим дозування, передбачається, що композиції за винаходом міститимуть достатню кількість активного компоненту, щоб ввести суб'єкту дозу, що становить, приблизно, від 100 нг/кг до 50 мг/кг, переважно, приблизно, від 10 мкг/кг до 5 мг/кг з'єднання. Може бути використана будь-яка із звичайних форм дозування, наприклад, пігулки, коржики, склади для парентерального введення, сиропи, креми, мазі, склади в аерозольній упаковці, трансдермальні пластири, пластири для введення лікарського складу через слизисту оболонку і т.п… У режимі лікування сполуки за винаходом можуть призначатися як єдиний терапевтичний засіб, або вони можуть застосовуватися в комбінації одне з одним або з іншими активними засобами, включаючи додаткові протиракові засоби, імуномодулятори, противірусні препарати, антибіотики, і т.п… Крім того, винахід відноситься до фармацевтичних композицій, які включають, принаймні, одну із сполук і фармацевтично прийнятних солей, відповідних винаходу, разом, принаймні, з одним фармацевтично прийнятним допоміжним засобом. Переважно, фармацевтичні композиції включають одну або два із сполук і фармацевтично прийнятних солей, відповідних даному винаходу. Переважніше, фармацевтичні композиції містять одну із сполук і фармацевтично прийнятних солей, відповідних даному винаходу. У одному з особливо переважних прикладів здійснення винаходу фармацевтичні композиції містять сполуку, наведену в прикладі здійснення і відповідну даному винаходу, разом, принаймні, з одним фармацевтично прийнятним допоміжним засобом. Фармацевтичні композиції можуть включати, принаймні, одну із сполук і фармацевтично прийнятних солей, відповідних даному винаходу (далі по тексту зустрічається під назвою "активна сполука"), загальна кількість якої складає від 0,1 до 99,9 вагових відсотків (wt%), переважно, від 5 до 95 wt%, переважніше, від 20 до 80 wt%. Як фармацевтично прийнятні допоміжні засоби, можуть бути використані будь-які допоміжні засоби, відомі як прийнятні для приготування фармацевтичних композицій. Перелік їх прикладів, не обмежуючись перерахованим, включає розчинники, наповнювачі, диспергатори, емульгатори, солюбілізатори, гель-формуючі речовини, мазеві основи, антиоксиданти, консерванти, стабілізатори, носії, наповнювачі, що зв'язують речовини, загусники, комплексформуючі засоби, дезінтегратори, буфери, промотери проникнення, полімери, мастила, покривні речовини, пропеланти, тонус-регулючі речовини, сурфактанти, фарбники, 6 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 ароматизатори, що підсолоджують речовини і фарби. Зокрема, використовуються допоміжні засоби типу, відповідного заданій композиції і заданому способу введення. Фармацевтичні композиції можуть бути сформовані, наприклад, у вигляді пігулок, пігулок, покритих оболонкою (драже), пілюль, крохмальних облаток, капсул (caplets - наприклад, для спортивного живлення), гранул, порошків, свічок, розчинів (наприклад стерильних розчинів), емульсій, суспензій, мазей, кремів, лосьйонів, паст, масел, гелів, аерозолів і пластирів (наприклад, трансдермальних терапевтичних систем). Додатково, фармацевтичні композиції можуть бути приготовані, наприклад, у вигляді ліпосомних систем доставки лікувального засобу, систем, в яких активна сполука зв'язана з моноклональними антитілами і системами, де активна сполука приєднана до полімерів (наприклад розчинні або розкладані мікроорганізмами полімери). Фармацевтичні композиції, що включають активну сполуку і, принаймні, один допоміжний засіб, можуть бути виготовлені за способом, відомим з рівня техніки будь-якому кваліфікованому фахівцю, наприклад, шляхом розчинення, змішування, грануляції, виготовлення драже, розтирання в порошок, емульгування, інкапсуляції, захоплення "в пастку" або методом ліофілізації. Серед всього іншого, вибір форми залежить від шляху введення фармацевтичної композиції в організм пацієнта. Фармацевтичні композиції за винаходом можуть вводитися будь-яким відповідним шляхом, наприклад, пероральним, під'язиковим, щоковим, внутрішньовенним, внутрішньоартеріальним, внутрішньом'язовим, підшкірним, внутрішньошкірним, місцевим, трансдермальним, внутрішньоносовим, внутрішньоочним, інтраперітонеальним, інтрастернальним, інтракоронарним, трансуретральним, ректальним або вагінальним шляхом, інгаляцією або вдуванням. Перевагу становить пероральний прийом. Пігулки, пігулки, покриті оболонкою (драже), пілюлі, крохмальні облатки, капсули (caplets – наприклад, для спортивного живлення), гранули, розчини, емульсії, суспензії, являються зручними, наприклад, для перорального прийому. Зокрема, вказані вище фармацевтичні форми можуть бути пристосовані для забезпеченняформи з ентеросолюбільним результатом введення в організм, форми з негайним витяганням активної сполуки, форми з відстроченим витяганням активної сполуки, форми з повторною дозою витягання активнї сполуки, форми з пролонгованим витяганням активної сполуки, форми з підтримуваним витяганням активної сполуки. Згадані вище форми можуть бути одержані, наприклад, за рахунок покриття пігулок, розділення пігулки на декілька компартементів (відділень), відокремлених одне від одного шарами, що розпадаються за різних умов (наприклад, за умов, визначуваних показником рН), або приєднання активної сполуки до розкладаного мікроорганізмами полімеру. Введення за рахунок інгаляції, переважно, здійснювалося з використанням аерозолю. Аерозоль є рідинно-газоподібною дисперсією, твердо-газоподібною дисперсією або змішаною рідинно-твердо-гаsоподібною дисперсією. Аерозоль може генеруватися за допомогою аерозоль-утворюючих пристроїв, наприклад, сухопорошкових інгаляторів (DPIs), дозованих інгаляторів під тиском (РМDIs) і розпилювачів. Залежно від виду активної сполуки, що вводиться, аерозоль-утворюючий пристрій може містити активну сполуку у формі порошку, розчину або дисперсії. Порошок може включати, наприклад, один або декілька таких допоміжних засобів, як: носії, стабілізатори і наповнювачі. Розчин може містити на додаток до розчинника, наприклад, один або декілька таких допоміжних засобів, як: пропеланти, солюбілізатори (співрозчинники), сурфактанти, стабілізатори, буфери, тонусрегулюючі засоби, консерванти і ароматизатори. Дисперсія може містити на додаток до диспергатора, наприклад, один або декілька таких допоміжних засобів, як: пропеланти, сурфактанти, стабілізатори, буфери, консерванти і ароматизатори. Не обмежуючись названим, приклади носіїв включають сахариди, наприклад, лактозу і глюкозу. Приклади пропелантів включають, не обмежуючись названим, фторогідроуглероди, наприклад 1,1,1,2-тетрафтороетан і 1,1,1,2,3,3,3-гептафторопропан. Розмір частинки аерозольних частинок (твердих, рідких або твердих/рідких частинок), переважно, складає менш 100 мм, переважніше, даний розмір знаходиться в діапазоні від 0,5 до 10 мм, зокрема, в діапазоні від 2 до 6 мм (ID50 значення, отримане методом лазерної дифракції). Спеціальні аерозоль-утворюючі пристрої, які можуть бути використані для введення заданої речовини методом інгаляції, включають, не обмежуючись названим, такі інгалятори, як Cyclohaler®, Diskhaler®, Rotadisk®, Turbohaler®, Autohaler®, Turbohaier®, Novolizer®, Easyhaler®, Aerolizer®, Jethaler®, Diskus®, Ultrahaler® і Mystic®. Для підвищення ефективності інгаляції, аерозоль-утворюючі пристрої можуть бути забезпечені розпірками (спейсерамі) або розширювачами (експандерамі), наприклад, Aerochamber®, Nebulator®, Volumatic® і Rondo®. 7 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для місцевого застосування використовуються такі фармацевтичні продукти, як, наприклад, мазі, креми, лосьйони, пасти, гелі, порошки, розчини, емульсії, суспензії, масла, аерозолі і пластири (наприклад трансдермальні терапевтичні системи). Для парентеральних способів доставки ліків, наприклад, внутрішньовенного, внутрішньоартеріального, внутрішньом'язового, підшкірного, внутрішньошкірного, інтраперітонеального і надчеревного введення, переважно, використовуються розчини (наприклад, стерильні розчини і ізотонічні розчини). Вони, переважно, вводяться у вигляді вливань або ін'єкцій. При внутрішньоносовому введенні, переважними є, наприклад, аерозолі і розчини, що вводяться краплинним шляхом. Для внутрішньоочного введення в прикладах здійснення представлені розчини, що вводяться краплинним шляхом, гелі і мазі. Загалом, фармацевтичні композиції за винаходом можуть вводитися так, щоб доза активної сполуки знаходилася в діапазоні, загальноприйнятому для активаторів TLR7. Зокрема, доза в діапазоні від 0,01 мг до 4000 мг, переважно, від 0,1 мг до 2000 мг, переважніше, від 0,5 мг до 1000 мг і найбільш переважно, від 1 мг до 500 мг активної сполуки в день є переважною для дорослого пацієнта середнього віку з вагою тіла 70 кг. В зв'язку з цим, слід зазначити, що вказана доза залежить, наприклад, від специфіки сполуки, що вводиться, особливостей об'єкту лікування, віку, ваги тіла, загального стану здоров'я, статі і режиму харчування, способу і часу введення дози, норми екскреції, серйозності захворювання, що підлягає лікуванню, і комбінації лікарських засобів. Фармацевтична композиція за даним винаходом може призначатися у вигляді одиночної дози на один день прийому або у вигляді декількох субдоз, наприклад, від 2 до 4 субдоз на один день прийому. Одиночна доза фармацевтичної композиції може містити, наприклад, від 0,01 мг до 4000 мг, переважно, від 0,1 мг до 2000 мг, більш переважне, від 0,5 до 1000 мг, найбільш переважно, від 1 до 500 мг активної сполуки. Крім того, фармацевтична композиція може бути адаптована до щотижневого, щомісячного і навіть до ще більш розтягнутого в часі режиму введення доз, наприклад, шляхом використовування імплантата, зокрема, підшкірного або внутрішньом'язового імплантата, шляхом використовування активної сполуки у формі економно розчинної солі або при використовуванні активної сполуки, зв'язаної з полімером. За наслідками досліджень, представлених нижче в даному документі, сполуки, відповідні даному винаходу, забезпечують активацію TLR7. Сполуки за даним винаходом доцільно використовувати як протиракові засоби, відносно тих форм раку, які чутливі до активації TLR7. Перелік таких форм раку, не обмежуючись перерахованим, включає: рак грудей, сечового міхура, кістки, мозку, центральної і периферичної нервової системи, товстої кишки, ендокринних залоз, стравоходу, оболонки матки, клітин зародкових центрів, голови і шиї, нирки, печінки, легені, гортані і гортаноглотки, мезотеліоми, саркоми, яєчника, підшлункової залози, простати, прямої кишки, нирки, тонкої кишки, м'якої тканини, яєчка, шлунку, шкіри, сечоводу, піхви і вульва; спадковий рак, ретінобластома і пухлина Wilms; лейкоз, лімфома, хвороба nonHodgkins, хронічна і гостра форма лейкемії, що відноситься до спинного або кісткового мозку, гострий лімфобластний лейкоз, хвороба Hodgkins, множинна мієлома і Т-клітинна лімфома; мієлодиспластичний синдром, неоплазія плазматичної клітини, паранеопластичні (що відносяться до пухлини) синдроми, рак невідомого первинного сайту і СНІД - залежні злоякісні новоутворення. Переважно, якщо агоністи TLR7 використовуються для лікування раку шкіри або нирки. Чутливість даного виду раку до активації TLR7 може бути визначена, не обмежуючись тільки у такий спосіб оцінки, за допомогою вимірювання зниження тяжкості первинного або метастатичного стану пухлини (незначний, частковий або повний регрес), альтерації в гемограмі, концентрацій зміненого гормону або цитокіну в крові, інтенсивності придушення подальшого збільшення потенціалу пухлини, стабілізації хвороби в організмі пацієнта, дослідженням біомаркерів або сурогатних маркерів, релевантних хворобі, визначенням пролонгованого в часі повного виживання пацієнта, розтягнутого в часі прогресування хвороби пацієнта, продовженого терміну виживання пацієнта без прогресування хвороби, пролонгованого терміну практично здорового способу життя пацієнта, покращення якості життя пацієнта, або модуляції супутньої патології хвороби (наприклад, але не обмежуючись названим, болю, кахексії (загального виснаження), мобілізації, госпіталізації, зміненої гемограми, втрати у вазі, загоєння ран, лихоманки). Сполуки за даним винаходом додатково можуть бути використані як модифікатори імунної відповіді, які можуть багатьма різними способами забезпечити модуляцію імунної відповіді, повідомляючи їм (сполукам) про здатність сприяти лікуванню безлічі порушень. 8 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цитокіни, які можуть бути індуковані шляхом введення сполук, відповідних винаходу, в основному, включають інтерферон (IFN) та/або фактор некрозу пухлини- α (TNF- α), так само як і певні інтерлейкіни (IL). Цитокіни, біосинтез яких може бути індукований сполуками за винаходом, включають IFN-α, TNF- α, IL-1, 6, 10 і 12, а також безліч інших цитокінів. Серед інших дій, цитокини пригнічують розвиток вірусу і зростання пухлинної клітини, роблячи сполуки корисними в лікуванні пухлин і хвороб, викликаних вірусними інфекціями. На додаток до здатності індукувати продукування цитокінів, сполуки за винаходом впливають на інші аспекти природженої імунної відповіді. Наприклад, може стимулюватися природна активність клітини-кілера. Такий ефект може бути спричинений індукцією цитокіну. Сполуки за винаходом можуть також активізувати макрофаги, які, у свою чергу, стимулюють секрецію оксиду азоту і продукування додаткових цитокінів. Крім того, дані сполуки можуть викликати проліферацію і диференціювання B-лімфоцитів. Сполуки за винаходом можуть також впливати на придбану імунну відповідь. Наприклад, не посилаючись на будь-яку спеціальну наукову теорію, навряд чи можна говорити про пряму дію на Т-клітини або про безпосередню індукцію цитокінів Т-клітин, але продукування IFN-γ цитокіну Т-хелпера, тип 1 (Th 1), спричинено опосередковано, а продукування IL-4, IL-5, IL-13 цитокінів Тхелпера, тип 2 (Th 2), пригнічується після введення вказаних вище сполук. Така активність означає, що сполуки за винаходом доцільно використовувати при лікуванні хвороб, де бажана позитивна регуляція відповіді Th1 та/або бажаним є супресуючий (пригнічуючий) ефект відповіді Th2. Зважаючи на здатність певних сполук за формулою I пригнічувати імунну відповідь Th2, передбачається, що дані сполуки доцільно використовувати для лікування хворобливих станів, які асоціюються з гіперстимуляцією відповіді Th2, наприклад, алергічних хвороб, таких як алергічний дерматит; астма; алергія; алергічний риніт; системний червоний вовчак (еритематозний вовчак); як вакцинний допоміжний фактор (ад'юванта) для забезпечення клітинного опосередкованого імунітету; і можливо, як засіб для лікування рецидивних грибкових хвороб, періодонтиту і хламідозу. Імунна відповідь, що модифікує способи дії сполук, надає їм властивостей, корисних для лікування широкого спектру захворювань. Завдяки їх здатності порушувати продукування цитокінів, наприклад, IFN-α та/або TNF- α і IL-12, дані сполуки, зокрема, доцільно використовувати для лікування вірусних захворювань і пухлин. Така імуномодулююча активність надає можливості припустити, що сполуки за даним винаходом доцільно використовувати, не обмежуючись перерахованим нижче, таких хвороб, як вірусні захворювання, включаючи загострені бородавки; прості бородавки; підошовні бородавки; Гепатит B; Гепатит С; Herpes Simplex (простий герпес) типу I і типу II; контагіозний молюск; HIV (ВІЧ); CMV(цитомегаловірус); VZV(оперізувальний лишай); інтраепітеліальні неоплазії, такі як цервикальна інтраепітеліальна неоплазія; людський папіломавірус (HPV) і асоційовані неоплазії; грибкові хвороби, наприклад, кандидоз, аспергілюс, а також криптококові менінгіти; пухлинні захворювання, наприклад, базально-клітинний рак, волосатоклітинний лейкоз, саркома Капоши, нирково-клітинний рак, плоськоклітинний рак, мієлогенозний лейкоз, множинна мієлома, меланома, лімфома non-Hodgkin's, шкірна Т-лімфоцитарна лімфома, а також інші види раку; паразитарні хвороби, наприклад, хвороби, спричинені грибком Pneumocystis carnii, криптоспоридіоз, гістоплазмоз, токсоплазмоз, трипаносомна (trypanosome) інфекція, і лейшманіоз; а також бактеріальні інфекції, наприклад, туберкульоз, і інфекції, спричинені мікобактеріями (mycobacterium avium). Інші хвороби або хворобливі стани, які можуть лікуватися з використанням сполук за винаходом, включають екзему; еозинофілію; есенціальну тромбоцитанемію; лепру; розсіяний склероз; синдром Ommen's; дискоїдний вовчак; хворобу Боуена, сочевицеподібний дискоїдний дискератоз; бовеноїдний папульоз; а також поліпшення або стимуляцію загоєння ран, включаючи хронічні рани. Відповідно до викладеного вище, винахід забезпечує спосіб активації TLR7 у тварини, особливо ссавців, переважно у людини, що включає введення тварині ефективної кількості сполуки за формулою I. Ефективна кількість сполуки буде змінюватися відповідно до чинників, відомих з рівня техніки, і, імовірно, має складати, приблизно, від 100 нг/кг до 60 мг/кг, переважно, приблизно від 10 мкг/кг до 30 мг/кг, більш переважно, приблизно, від 10 мкг/кг до 5 мг/кг. Винахід також забезпечує спосіб лікування вірусної інфекції у тварини, включаючий введення в організм тварини ефективної кількості сполуки за формулою I. Кількістю, ефективною для лікування або придушення вірусної інфекції, є така кількість, яка викликає зниження активності вірусної інфекції в одному або декількох її проявах, таких як вірусні ураження, вірусний потенціал, інтенсивність вірусного продукування, а також летальність, в порівнянні з контрольними тваринами, відносно яких не проводилося лікування. Точна кількість 9 UA 105764 C2 5 10 15 20 буде змінюватися відповідно до чинників, відомих з рівня техніки, проте, імовірно, доза має бути такою ж, яка була вказана вище у зв'язку з активацією TLR7, або дозою, що становить, приблизно, від 100 нг/кг до 50 мг/кг, переважно, приблизно, від 10 мг/кг до 5 мг/кг. Кількістю, ефективною для лікування пухлинних новоутворень, є така кількість, яка здатна викликати зменшення розміру пухлини або числа фокусів пухлини. Знову-таки, точна кількість змінюватиметься відповідно до чинників, відомих з рівня техніки, проте, імовірно, доза буде такою ж, яка була вказана вище у зв'язку з активацією TLR7, або дозою, що становить, приблизно, від 100 мг/кг до 50 мг/кг, переважно, приблизно, від 10 мг/кг до 5 мг/кг. Сполуки за винаходом можуть бути приготовані, наприклад, відповідно до приведеного нижче опису і відповідно до наступних позначених етапів реакції або, зокрема, відповідно до одного із способів, описаних в прикладах здійснення. Як показано на схемі А реакції, сполука за формулою 7, де R3 має значення, визначене вище, може бути отримана шляхом обробки хінолін-4-олу азотною кислотою для отримання її нітро-похідного за формулою I, яке потім вступає в реакцію з оксихлоридом фосфору у присутності N,N-диметил-формальдегіду для отримання 4-хлоро-3-нітрохіноліну за формулою 2. Сполка за формулою 2, вступивши в реакцію з (4-аміно-бутил)-карбамінової кислоти тертбутилефіром, забезпечує отримання сполуки за формулою 4, яка потім вступає в реакцію з триетилортопропіонатом у присутності толуолу для отримання сполуки за формулою 5. [4-(2Етил-імідазо [4,5-c]хінолін-1-іл)-бутил]-карбамінової кислоти терт-бутилефір за формулою 5 далі позбувається захисту, з метою отримання 4-(2-етил-імідазо[4,5-c]хінолін-1-іл)-бутиламіну за формулою 6. Сполука за формулою 6 піддається обробці відповідними гетероциклічними кетонами для отримання заданої сполуки відповідно до формули 7. 25 30 Схема A Як представлено на реакційній схемі B, сполука за формулою I, де R2 представляє собою CO-R5, а усі інші символи мають значення, що відповідає вказаному вище, може бути отримана у результаті реакції сполуки за формулою 7 з відповідним кислотним ангідридом за формулою R5-CO-О-CO-R5, з метою отримання сполуки за формулою 8, яку потім піддають обробці мхлоропербензойною кислотою для отримання її N-оксидного похідного за формулою 9. Після цього сполуку за формулою 9 піддають анімації (активізації), використовуючи водний розчин аміака для отримання заданої сполуки за формулою I. 10 UA 105764 C2 5 10 15 20 25 30 Схема B Як представлено на реакційній схемі С, сполука за формулою I, де R2 представляє собою водень, а усі інші символи мають значення, що відповідає вказаному вище, може бути отримана у результаті реакції сполуки за формулою 7 з ди-тер-бутил-дикарбонатом, з метою отримання сполуки за формулою 10, яку потім піддають обробці м-хлоропербензойною кислотою для отримання її N-оксиду за формулою 11. Після цього сполуку за формулою 11 піддають анімації (активізації), використовуючи водний розчин аміака для отримання сполуки за формулою 12, яку позбувають захисних властивостей, забезпечуючи кислотну атмосферу, з метою отримання заданої сполуки відповідно до формули I. Схема C Кваліфікованому фахівцю в даній області знань відомо, що у разі наявності декількох реактивних центрів на стартовій або проміжній сполуці, може з'явитися необхідність в тимчасовому блокуванні одного або декількох реактивних центрів захисними групами, щоб дати можливість реакції продовжитися саме в заданому реактивному центрі. Сполуки за даним винаходом виділяють і очищають відповідно до способів, традиційно вживаних в даній області, наприклад, методом відгонки розчинника у вакуумі і рекристалізації осаду, одержаного з відповідного розчинника або, піддаючи його одному із загальноприйнятих методів очищення, наприклад, колончастої хроматографії на відповідному носієві. Солі сполук за формулою (I) відповідно до даного винаходу можуть бути одержані шляхом розчинення вільного з'єднання у відповідному розчиннику (наприклад, у кетоні, такому як ацетон, метилетилкетон або метилізобутилкетон, в будь-якому з таких, як діетилефір, тетрагідрофуран або діоксан, або в хлорованому гідрокарбоні, такому як метиленхлорид або хлороформ, або в низькомолекулярному аліфатичному спирті, наприклад, у метанолі, етанолі, ізопропанолі), який містить задану кислоту або основу або до якого задана кислота або основа додаються згодом. Кислоти або основи можуть бути використані для приготування солі, залежно від того, моно - або поліосновна кислота або основа є предметом обговорення, і 11 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 залежно від того, яка сіль задається в еквімолярному кількісному співвідношенні або будь-якому іншому вигляді. Солі одержують методом фільтрації, повторного осадження, осадження без використовування розчинника для солі або шляхом випаровування розчинника. Одержані солі можуть бути перетворені у вільні сполуки, які, у свою чергу, можуть бути перетворені в солі. Таким чином, фармацевтично неприйнятні солі, які можуть бути одержані, наприклад, як технологічна продукція промислового виробництва, можуть бути перетворені у фармацевтично прийнятні солі, використовуючи відповідні технології, відомі кваліфікованому у фахівцю з рівня техніки. Сполуки за формулою (I), відповідні даному винаходу, можуть бути перетворені в їх Nоксиди, наприклад, за допомогою пероксиду водню в метанолі або за допомогою мхлоропероксибензойної кислоти в дихлорометані. Для кваліфікованого фахівця в даній області знання відомі умови проведення реакції N-окиснення. Чисті діастереомери і чисті енантіомери сполук і солей за винаходом, які присутні у формі таких стереоізомерів, можуть бути одержані, наприклад, за допомогою асиметричного синтезу, при використовуванні в процесі синтезу хіральних стартових сполук і шляхом розщеплювання енантіомерних і діастеріомерних сумішей, одержаних в процесі синтезу. Енантіомерні і діастеріомерні суміші можуть бути розщеплені на чисті енантіомери і чисті діастеріомери з використанням способів, відомих кваліфікованому фахівцю з рівня техніки. Переважно, діастеріомерні суміші розділяються методом кристалізації, зокрема, методом фракційної кристалізації або методом хроматографії. Енантіомерні суміші можуть бути розділені, наприклад, шляхом формування діастереомерів з хіральною допоміжною речовиною, розчинення одержаних діастереомерів і видалення хіральної допоміжної речовини. Як допоміжні хіральні речовини, наприклад, можуть бути використані хіральні кислоти, з метою відділення енантіомерних основ, а хіральні основи можуть бути використані, з метою відділення енантіомерних кислот через формування діастереомерних солей. Крім того, діастереомерні похідні, наприклад, діастереомерні ефіри, можуть бути сформовані з енантіомерних сумішей спиртів або енантіомерних сумішей кислот, відповідно, використовуючи хіральні кислоти або хіральні спирти, відповідно, як хіральні речовини. Крім того, діастереомерні комплекси або діастереомерні культури можуть бути використані для розділення енантіомерних сумішей. Як альтернатива, діастереомерні комплекси або діастереомерні культури можуть бути використані для розділення енантіомерних сумішей. Як альтернатива, енантіомерні суміші можуть бути розділені, використовуючи хіральні розділові колонки в процесі хроматографії. Ще одним прийнятним для використовування способом виділення енантіомерів є спосіб з використанням ензиматичного розділення. Кваліфікований фахівець в даному виді знань віддає собі звіт у тому, що даний винахід не обмежується описаними в даному документі прикладами здійснення, а розповсюджується на всі модифікації вказаних прикладів здійснення, суть яких не виходить за межі об'єму захисту винаходу, визначеного сукупністю ознак, висловлених в пунктах прикладеної формули винаходу. Наступні приклади здійснення детальніше ілюструють винахід, не обмежуючи його. Інші сполуки за даним винаходом, приготування яких конкретно не описане в цьому документі, можуть бути приготовані аналогічним способом. Сполуки, згадані в прикладах здійснення, а також їх солі є переважними прикладами здійснення винаходу. Приклади: Приготування 4-(2-Етил-імідазо[4,5-c]хінолін-1-іл)-бутиламін за формулою 6 Етап-1:3-Нітро-хінолін-4-ол Суміш хіноліну-4-олу (1 eq.) у пропіоновій кислоті нагрівали до 125 °C з перемішуванням. Азотну кислоту (2,2 eq.) додавали по краплям до змішаного розчину при підтриманні температури реактивної суміші 125 °C. Реактивну суміш перемішували при 125 °C протягом 15 хвилин і охолоджували до кімнатної температури. Реактивну суміш розчиняли етанолом, а тверду фракцію відбирали методом вакуумної фільтрації. Тверду фракцію далі промивали етанолом, водою і етанолом. Отриману тверду речовину жовтого кольору нагрівали із зрошенням етанолом і відфільтровували з гарячої суміші для одержання чистого 3-нітрохінолін-4-олу. Етап-II: 4-Хлоро-3-нітро-хінолін Оксихлорид фосфору (1,2 eq.) поволі додавали до ретельно розмішуваної суспензії сполуки за формулою 1, одержаної на етапі I, в N,N-диметилформаміді. Потім реактивну суміш нагрівали до 50 °C при перемішуванні протягом 30 хвилин. Одержаний розчин охолоджували 12 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 при кімнатній температурі і вливали в суміш з льоду і води. Тверду речовину відбирали методом фільтрації і висушували, щоб одержати 4-хлоро-3-нітро-хінолін. Етап-Ill: терт-бутил{4-[(3-нітрохінолін-4-іл)аміно]Бутил}карбамат Сполуку за формулою 2 (1 eq.) додавали до розчину (4-Аміно-бутил)-карбамінової кислоти терт-бутилефіру (1,2 eq.) і триетиламіну (1,5 eq.) в етанолі. Далі реактивну суміш нагрівали із зворотним холодильником протягом 15 хвилин, після чого розбавляли водою для осадження неочищеного продукту, який відділяли фільтрацією. Насичений розчин гідроксиду амонію додавали до фільтрату, а випавшу в осад тверду речовину відбирали методом вакуумної фільтрації і висушували, щоб одержати терт-бутил{4-[(3-нітрохінолін-4-іл)аміно]бутил}карбамат за формулою 3. Етап-IV: терт-бутил{4-[(3-амінохінолін-4-іл)аміно]бутил}карбамат Суспензія сполуки сполуки за формулою 3 (1 eq.), 5 % паладію на вуглеці (2 % по вазі) і сульфату магнію в етилацетаті була гідрогенізована на реакторі (parr apparatus) при тиску 50 psi (фунтів на кв дюйм) газоподібного водню протягом 4 годин. Одержану реактивну суміш далі фільтрували, а фільтрат концентрували при пониженому тиску, щоб одержати неочищений твердий продукт, який потім очищали методом колончастої хроматографії на силікагелі, з метою отримання терт-бутил(4-[(3-амінохінолін-4-іл)аміно]бутил}карбамату за формулою 4. Етап-V: терт-бутил [4-(2-етил-1H-імідазо[4,S-с]хінолін-1-іл)бутил] карбамат До розчину сполуки за формулою 4 (1 eq.) в толуолі додавали триетилортопропіонат (2 eq.), а одержану реактивну суміш нагрівали при 80-90 °C протягом 5 годин. Після цього реактивну суміш охолоджували, а розчинника випаровували до тих пір, поки не видаляли 50 % кількості толуолу. До реактивної суміші, що залишилася, додавали воду з льодом а продукт осаджували у вигляді білої твердої речовини, яку потім відділяли методом вакуумної фільтрації і висушували, з метою отримання терт-бутил[4-(2-етил-1H-імідазо[4,5-с]хінолін-1іл)бутил]карбамату за формулою 5. Етап-VI: 4-(2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутан-1-амін Розчин [4-(2-Етил-імідазо[4,5-с]хінолін-1-іл)-бутил]-карбамінової кислоти терт-бутил ефіру за формулою 5, одержаного на етапі V, в трифторооцтовій кислоті перемішували при 40 °C протягом 4 годин. Далі реактивну суміш вливали в суміш води з льодом і екстрагували із застосуванням хлороформу. Органічний шар висушували над сульфатом натрію і концентрували під приведеним (виведеним) тиском, з метою отримання 4-(2-етил-1Hімідазо[4,5-с]хінолін-1-іл)бутан-1-аміну за формулою 6. Приклад I: N-[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]-]N-(1,1діоксидотетрагідро-3-тієніл) ацетамід Етап-I: N-[4-(2-етил-1H-імідазо [4,5-c]хінолін-1-іл)бутил] тетрагідротіофен-3-амін. До суспензії 4-(2-етил-імідазо[4,5-с]хінолін-1-іл)-бутиламіну, одержаного на етапі VI, в тетрагідрофурані була додана оцтова кислота (1 eq.) і дигідротіофен-3-он (1,1 eq.). Одержану реактивну суміш перемішували протягом 10 хвилин. Натрію триацетоксиборогідрид (2,2 eq.) додавали до реактивної суміші протягом 1 години, а одержану суспензію потім перемішували протягом 4-5 годин. Після цього реакція була припинена метанолом і була виконана концентрація одержаного продукту до стану сухої речовини. Реактивна суміш була перетворена у основу, завдяки використовуванню водного розчину гідроксиду натрію, і екстрагована за допомогою хлороформу. Органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання липкої твердої речовини. Потім продукт очищали методом колончастої хроматографії на силікагелі для отримання [4-(2-етил-імідазо[4,5-с]хінолін1-іл)-бутил]-(тетрагідро-тіофен-3-іл)-аміну. Етап-II: N-[4-(2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]-N-тетрагідро-3-тієніл)ацетамід До розчину [4-(2-етіл-імідазо[4,5-с]хінолін-1-іл)-бутил]-(тетрагідро-тіофен-3-іл)-аміну в дихлорометані був доданий триетиламін (1,5 eq.) і оцтовий ангідрид (1,5 eq.) і суміш перемішували при кімнатній температурі протягом 4 годин. Потім реактивна суміш була розбавлена дихлорометаном і промита насиченим розчином бікарбонату натрію. Органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання N-[4-(2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]-N-(тетрагідро-3-тієніл) ацетаміду. Етап-III: N-(1,1-діоксидотетрагідро-3-тієніл)-N-[4-(2-етил-5-оксидо-1H-імідазо[4,5-с]хінолін-1іл)бутил] ацетамід До розчину N-[4-(2-етил-імідазо[4,5-с]хінолін-1-іл)-бутил]-N-(тетрагідро-тіофен-3-іл)ацетаміду в хлороформі додавали м-хлоропербензойну кислоту (4 eq.) і перемішували при кімнатній температурі протягом 2 годин. Реактивну суміш потім розбавляли хлороформом і промивали насиченим розчином бікарбонату натрію. Органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання липкої маси. 13 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 Потім продукт очищали методом колончастої хроматографії на силікагелі для отримання N-(1,1діоксидотетрагідро-3-тієніл)-N-[4-(2-етил-5-оксидо-1H-імідазо[4,5-с]хінолін-1-іл)бутил] ацетаміду. Етап-IV: N-[4-(4-аміно-2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]-N-(1,1-діоксидотетрагідро-3тієніл) ацетамід До розчину (1,1-Діоксо-тетрагідро-1лямбда*6*-тіофен-3-іл)-N-[4-(2-етил-5-окси-імідазо[4,5с]хінолін-1-іл)-бутил]-ацетаміду в хлороформі додавали p-толуолу сульфонілхлорид (1,2 eq) з подальшим введенням водного розчину гідроксиду амонію. Одержану реактивну суміш перемішували при кімнатній температурі протягом 12 годин. Після цього реактивну суміш розбавляли хлороформом і промивали насиченим розчином бікарбонату натрію. Органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання липкої твердої речовини, яку потім очищали методом колончастої хроматографії на силікагелі для отримання сполуки під заголовною назвою. 1 H NMR (300 MHz, CDCl3) δ (ppm): 8,29(dd, 1H, J=8,4&J=3,0Hz), 8,21(dd, 1H, J=8,4Hz, J=3,0Hz), 7,65(m, 2H), 5,49(s, 2H), 4,58(t, 2H), 3,78(t, 2H),3,3(t, 2H), 3,02(q, 2H),2,34(d, 2H), 2,2(t, 1H), 2,1(s, 3H), 2,09(m, 2H), 1,9(m, 2H),1,79(m, 2H), 1,55(t, 3H) Приклади 2-4 також були приготовані відповідно до методики, викладеної у прикладі I. Приклад II: N-[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1-метил-1оксидопіперидин-4-іл) ацетамід 1 H NMR (300 MHz, CDCl3) δ (ppm): 8,24(dd, 1H, J=8,4&3,0Hz), 8,19(dd, 1H, J=8,4&J=3,0Hz), 7,60(m, 2H), 5,60(s, 2H), 4,52(t, 2H), 3,75(t, 2H), 3,4(m, 1H), 3,2(m, 4H), 3,12(q, 2H), 2,16(s, 3H), 2,01(m, 2H), 1,99(m, 4H), 1,70(m, 2H), 1,51(t, 3H) Приклад III: 3-{ацетил[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]аміно}-2,5ангідро-1,3,4-тридеоксипентитол 1 H NMR (300 MHz, CDCl3) δ (ppm):8,35(dd, 1H, J=8,4&J=3,0Hz), 8,29(dd, 1H; J=8,4&J=3,0Hz), 7,63(m, 2H), 5,56(s, 2H), 4,50(t, 2H), 4,42(m, 1H), 3,70(t, 2H),3,62(m, 1H), 3,35(t, 2H), 3,12(q, 2H),2,15(s, 3H), 2,05(m, 2H),1,92(d, 3H),1,8(t, 2H) 1,70(m, 2H), 1,51(t, 3H) Приклад IV: N-[4-(4-аміно-2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(бензил-2-метил-1оксидопіролідин-3-іл)ацетамід 1 H NMR (300 MHz, CDCl3) δ (ppm): 8,31(dd, 1H, J=8,4&J=3,0Hz), 8,15(dd, 1H, J=8,4Hz, J=3,0Hz), 7,62(m, 2H), 7,55(m. 5H), 5,59(s, 2H), 4,50(t, 2H), 3,71(t, 2H),3,35(t, 2H), 3,23(s, 2H), 3,21(q, 2H),2,19(d, 2H), 2,15(t, 1H), 2,10(s, 3H), 2,09(m, 2H), 1.9(m, 2H),1,79(m, 2H), 1,55(t, 3H). Приклад V: 2-етил-1-[4-(тетрагідро-2H-піран-4-іламіно)бутил]-1H-імідазо[4,5-c]хінолін-4-амін Етап-I: N-[4-(2-етил-1H-імідазо[4,S-c]хінолін-1-іл)бутил]тетрагідро-2H-піран-4-амін До суспензії 4-(2-eтил-1H-імідазо[4,5-с]хінолін-1-іл)бутан-1-аміну, одержаного на етапі VI прикладу I, у тетрагідрофурані була додана оцтова кислота (1 eq.) і тетрагідро-піран-4-он (1,1 eq.). Одержану реактивну суміш перемішували протягом 10 хвилин. Натрію триацетоксиборогідрид (2,2 eq.) додавали до реактивної суміші протягом 1 години, а одержану суспензію перемішували протягом 4-5 годин. Після цього реакція була припинена за допомогою метанолу і виконана концентрація до осушеного стану. Реактивна суміш була перетворена на основу, використовуючи водний розчин гідроксиду натрію, і екстрагована хлороформом. Органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання липкої твердої речовини. Потім продукт очищали методом колончастої хроматографії на силікагелі для отримання N-[4-(2-етил-1H-імідазо[4,5-с]хінолін-1іл)бутил]тетрагідро-2H-піран-4-аміну. Етап-II: терт-бутил [4-(2-етил-1H-імідазо[4,5-c]хінолін-1-іл)бутил]тетрагідро-2H-піран-4ілкарбамат До розчину N-[4-(2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2H-піран-4-аміну в дихлорометані додавали триетиламін (1,5 eq.) з подальшим додаванням ди-тер-бутилдикарбонату (1,5 eq.), а одержану реактивну суміш перемішували протягом 4 годин при кімнатній температурі. Потім реактивну суміш повністю випаровували і розчиняли в дихлорометані, промивали водою, а органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання терт-бутил[4-(2-етил-1H-імідазо[4,5с]хінолін-1-іл)бутил] тетрагідро-2H-піран-4-ілкарбамату. Етап-III: терт-бутил [4-(2-етил-5-оксидо-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2Hпіран-4-ілкарбамат До розчину терт-бутил [4-(2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2H-піран-4ілкарбамату в хлороформі додавали м-хлоропербензойну кислоту (4 eq.) і перемішували при кімнатній температурі протягом 2 годин. Після цього реактивну суміш розбавляли хлороформом і промивали насиченим розчином бікарбонату натрію. Органічний шар висушували над сульфатом натрію і концентрували під пониженим тиском, з метою отримання липкої маси. 14 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 Потім продукт очищали методом колончастої хроматографії на силікагелі для отримання тертбутил [4-(2-етил-5-оксидо-1H-імідазо[4,5-с] хінолін-1-іл)бутил]тетрагідро-2H-піран-4-ілкарбамату. Етап-IV: терт-бутил [4-(4-аміно-2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2Hпіран-4-ілкарбамат До розчину терт-бутил [4-(2-Етил]-5-оксидо-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2Hпіран-4-ілкарбамату в хлороформі додавали p-толуолу сульфонілхлорид (1,2 eq.) з подальшим додаванням водного розчину гідроксиду амонію. Одержану суміш перемішували при кімнатній температурі протягом 12 годин. Потім реактивну суміш промивали насиченим розчином бікарбонату натрію. Органічний шар відділяли, висушували над безводним сульфатом натрію і концентрували під пониженим тиском, з метою отримання липкої твердої речовини, яку потім очищали методом колончастої хроматографії на силікагелі для отримання терт-бутил [4-(4аміно-2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2H-піран-4-ілкарбамату. Етап-V: 2-етил-1-[4-(тетрагідро-2H-піран-4-іламіно)бутил]-1H-імідазо[4,5-с]хінолін-4-амін Розчин терт-бутил[4-(4-аміно-2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]тетрагідро-2H-піран4-ілкарбамату в трифтороцтовій кислоті перемішували при 40 °C протягом 4 годин. Потім реактивну суміш виливали на суміш води з льодом і екстрагували за допомогою хлороформу. Органічний шар висушували над сульфатом натрію і концентрували під приведеним (виведеним) тиском, з метою отримання сполуки під заголовною назвою. 1 H NMR (300 MHz, MeOD) δ (ppm):8,2(d, 1H, J=8,1Hz), 7,75(m, 2H), 7,6(dt, 1H, J=1.5 & 7,2Hz),4,69(t, 2H), 4,01(d, 1H), 3,98(d, 1H), 3,4(m, 3H), 3,2(m, 2H), 3,1(m, 2H), 2,0(m, 4H),1,9(m, 4H), L5(t, 3H) Приклади 6-7 були приготовані у відповідності до методики, яка є ідентичною методиці приклада 5. Приклад VI: 1-[4-(1-азабіцикло[2.2.2]окт-3-іламіно)бутил]-2-етил-1H-імідазо[4,5-c]хінолін-4амін 1 H NMR (300 MHz, MeOD) δ (ppm): 8,01(d, 1H, J=8,4Hz), 7,67(dd, 1H, J-1,2 & 8.4 Hz), 7,4(dt, 1H, J=1,5 & 7,8Hz), 7,33(dt, 1H, J=1,2 & 7,5Hz), 4,5 (m, 2H), 4,2(m, 2H), 3,6(m, 1H), 3,4(m, 1H), 3,1(m, 2H), 3,0(q, 2H), 2,7(m, 2H), 1,9(m, 3H), 1,7(m, 2H), 1,5(t, 3H), 1,4(m, 2H), 1,3(m, 3H.). Приклад VII: 1-{4-[(1,1-діоксидо-3,4-дигідро-2H-тіохромен-4-іл)аміно]бутил}-2-етил-1H-імідазо [4,5-c]хінолін-4-амін 1 H NMR (300 MHz, MeOD) δ (ppm):8,2(d, 1H, J=8,1Hz), 7,80(dt, 1H, 1-1,5 & 6,3Hz),7,73(d, 1H, J-7,5Hz), 7,64(dt, 1H, J-1,5 & 7,5Hz), 7,5(m, 4H), 4,59(t, 2H), 3,97(t, 1H), 3,70(m, 1H), 3,02(q, 2H), 2,71(m, 3H), 2,50(m, 2H), 1,99(m, 2H), 1,69(m, 2H), 1,48(t, 3H). Приклад A - профілізація in vitro: Використовуючи лінію ракової клітини людини (PCIR-1) або фракції PBMC людини, були забезпечені клітинні проби для тестування сполук на активацію TLR7. Специфічність для TLR7 і 9 перевіряли шляхом додавання хлорохіну, який анулює надходження сигналу через ендосомальні TLR. Система PCIR-1 підходить для вимірювання інтерферон – зв'язаного цитокіну IP10 з використанням так званої проби на кульці в 384лунковому форматі. TLR mRNA експрессія в PCIR-1 (TaqMan PCR проба) TLR1 ++, TLR2 (+), TLR3 +, TLR4 ++, TLR5 (+), TLR6 ++, TLR7 ++, TLR8 -, TLR9 +++, TLR10-. Лікування даної клітинної лінії за допомогою TLR агоніст – посилальних сполук LPS (TLR4 аго), резихімоду (імідазохіноліну) і H2006 (CpG олігонуклеотиду) призводить до сильної індукції mRNA цитокіну. Отримана також відповідь на полі I-C двохниткову RNA (TLR 3 аго); 40-кратна індукція IP-10 після закінчення 15 годин) і MALP-2 (TLR 2/6 гетеродімер аго, 100-кратна індукція IP-10 після закінчення 15 годин). Дані про індикацію RNA були підтверджені паралельними дослідженнями Luminex, показуючи сильний вихід IP-10 і IL8 цитокінів, зокрема, а також значні протєїнові рівні IL6, IL12p40/p70 і IL10. Передача сигналу через TLR7 і TLR9 (обидва експресовані в ендосомах) може бути повністю блокована, завдяки додаванню хлорохіну, який, як відомо, порушує ендосомальний градієнт pH. На відміну від TLR4, передача сигналу за допомогою LPS не порушується (фіг. 1). Концепція системи TLR агоніст-скринінгу у форматі високої або середньої пропускної спроможності представлена на фіг. 2. Сполуки за даним винаходом досліджуються відносно заданої індукції цитокіну в рівнях протеїну або mRNA. Сполуки проявляють ефективність при клітинних дослідженнях (фіг. 3). Приклад B-PD профілізація in vivo: Далі, дослідження з використанням посилальних сполук і сполук за даним винаходом показані на моделі метастазу легені Ренка, відповідно до опису, представленого в роботі Leja A, 15 UA 105764 C2 5 10 15 20 25 Hofinann HP, Maier T, Drache D, Grebe C, Fischer S, Gimmnich P, Sanders K, Gekeler V. Metastasis of murine Renca kidney cancer cells to the lungs of Balb/c mice is strongly suppressed by TLR9 or TLR7 agonists. (Метастаз від мишачих ниркових ракових клітин Ренка до легенів мишей Balb/c сильно пригнічується агоністами TLR9 або TLR7) Abstract 3552, Proc Am Cancer Res 48,2007. Фігури 4A і 4B демонструють результати, отримані відносно посилальних сполук (агоністи TLR9 і TLR7, якими є або SMOL, або олігонуклеотіди; TOG=7-тіа-8-оксогуанозин; IMDZQ = похідне імідазохіноліну). Зокрема, жіночі особини мишей Balb/c (n=10) були піддані лікуванню впродовж 4 подальших днів, починаючи з дня 1 або з дня 8 після ін'єкції ракової клітки Ренка LacZ, відповідно. Як було вказано, SMOL застосовувалися в 20 % PEG, олігонуклеотиди в 0,9 % NaCl. Легені були відсічені через 25 днів після ін'єкції ракової клітки (див. фігуру 4A). Після цього, жіночі особини мишей Balb/c (n=5) були піддані лікуванню впродовж 4 подальших днів за вказаною вище методикою. SMOL застосовувалися в 20 % PEG, олігонуклеотіди в 0,9 % NaCl. На четвертий день лікування через орбітальне сплетення була узята кров, а селезінки - відсічені. Слідом за цим була виділена mRNA для аналізу експресії через qPCR. Дані були нормалізовані до контролю носія (середній ряд до 1). Статистична оцінка була виконана з використанням тесту Mann-Whitney (див. фігуру 4B). За умов, ідентичних описаним вище для SMOL, вибраних як посилальні сполуки, на моделі метастазу легені Ренка досліджувалися сполуки 3-{ацетил[4-(4-аміно-2-етил-1H-імідазо[4,5с]хінолін-1-іл)бутил]аміно}-2,5-ангідро-1,3,4-тридеоксипентитол (TLR аго 1, приклад III) і N-[4-(4аміно-2-етил-1H-імідазо[4,5-с]хінолін-1-іл)бутил]-N-(1,1-діоксидотетрагідро-3-тієніл)ацетамід (TLR аго 2, приклад I)TLR аго 1, обидві сполуки відповідають винаходу. 3-{Ацетил[4-(4-аміно-2-етил-1H-імідазо[4,5-з]хінолін-1-іл)бутил]аміно}-2,5-ангідро-1,3,4тридеоксипентитол (TLR аго 1, приклад III) демонструє сильний анти-метастазний ефект, фактично, з повним кліренсом легенів після короткого періоду лікування (d1-4) (фігура 5). ФОРМУЛА ВИНАХОДУ 1. Сполука за формулою I: NH2 N N R1 N A 30 35 40 45 50 B , (І) де R1 вибрано з групи, до складу якої входять: -Н, алкіл, алкініл, арил, алкокси, гетероцикліл і гетероарил, де алкіл, алкініл, арил, алкокси, гетероцикліл або гетероарил можуть бути незаміщеними або заміщеними одним або декількома замісниками, вибраними групи, до складу якої входять: -Н, -ОН, галоген, -CO-N(R4)2, -N(R4)2, CO-С1-10алкіл, -СО-О-С1-10алкіл, -N3, арил і гетероцикліл, де кожний R4 є незалежно вибраним з групи, до складу якої входять: -Н, - С1-10алкіл, -С1-10алкіларил або арил; А є С, -С6алкілом; В є -N(R2)(R3); R2 є Н або -(CO)-R5; R5 вибрано з групи, до складу якої входять: алкіл, що містить групи з прямим ланцюгом та з розгалуженим ланцюгом, а також циклічні групи, алкініл, арил, гетероцикліл і гетероарил, кожен з яких може бути незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що містить: -Н, -ОН, галоген, -СООН, SH, -CO-C1-6алкіл, -СО-О-С1-6алкіл, -N3, арил, гетероцикліл, -СО-арил та -СО-гетероцикліл; R3 вибрано з групи, до складу якої входять: алкеніл, гетероарил, циклоалкіл і гетероцикліл, де алкеніл, гетероарил, циклоалкіл або гетероцикліл можуть бути незаміщеними або заміщеними одним або декількома замісниками, вибраними з групи, що містить: -Н, алкіл, алкеніл, алкокси, галоген, -ОН, -N3, трифторометил, алкіларил, -О-алкіларил, -СО-арил, арил, гетероцикліл, гетероарил, -СО-гетероарил, -СО-Оалкіл, -CO-N-алкіл, -СО-N-арил; або фармацевтично прийнятні сольвати, солі, N-оксиди або їх стереоізомери або їх комбінації. 16 UA 105764 C2 5 10 15 20 25 30 35 40 45 50 55 60 2. Сполука відповідно до формули І за п. 1, у якій R1 є алкінілом або алкокси. 3. Сполука відповідно до формули І за п. 1 або 2, у якій R3 є гетероциклілом, який може бути заміщеним одним або декількома замісниками, які вибрані з групи, що містить: -Н, алкіл, алкеніл, галоген і -ОН. 4. Сполука відповідно до формули І за будь-яким з пп. 1-3, у якій R3 вибрано з групи, що містить діоксотетрагідротіофеніл, піперидиніл, тетрагідрофураніл, піридидин, тетрагідропіраніл і азобіциклооктаніл, кожен з яких може бути, за вибором, заміщений однією або декількома групами, вибраними з групи, що містить галоген, гідроксил, арил, алкіл, алкокси, трифторметил або їх комбінацію. 5. Сполука відповідно до формули І за будь-яким з пп. 1-4, у якій R1 є алкілом, переважно етилом. 6. Сполука відповідно до формули І за будь-яким з пп. 1-5, у якій R5 є алкілом, переважно метилом. 7. Сполука за п. 1, яка вибрана з групи: N-[4-(4-аміно-2-етил-1Н-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1,1-діоксидотетрагідро-3тієніл)ацетамід, N-[4-(4-аміно-2-етил-1Н-імідазо[4,5-c]хінолін-1-іл)бутил]-N-(1-метил-1-оксидопіперидин-4іл)ацетамід, 3-{ацетил[4-(4-аміно-2-етил-1Н-імідазо[4,5-с]хінолін-1-іл)бутил]аміно}-2,5-ангідро-1,3,4тридеоксипептитол, N-[4-(4-аміно-2-етил-1Н-імідазо[4,5-с]хінолін-1-іл)бутил]-N-(1-бензил-2-метил-1-оксидопіролідин3-іл)ацетамід або їх фармацевтично прийнятні сольвати, солі, N-оксиди або їх стереоізомери або їх комбінації. 8. Сполука за будь-яким з пп. 1-7 для застосування як медикаменту. 9. Фармацевтична композиція, яка відрізняється тим, що містить терапевтично ефективну кількість сполуки відповідно до формули І за будь-яким з пп. 1-7 у комбінації з фармацевтично прийнятним носієм. 10. Фармацевтична композиція за п. 9, яка відрізняється тим, що містить таку кількість сполуки відповідно до формули 1 або її фармацевтично прийнятних сольватів, солей, N-оксидів або їх стереоізомерів або їх комбінацій, якої достатньо для забезпечення суб'єкту дози, від 100 нг/кг до 50 мг/кг, переважно від 10 мкг/кг до 5 мг/кг сполуки. 11. Сполука за будь-яким з пп. 1-7, яка використовується для лікування вірусної або неоплазійної хвороби. 12. Сполука за будь-яким з пп. 1-7, яка застосовується для лікування раку, вибраного з групи, що включає: рак грудей, сечового міхура, кістки, мозку, центральної і периферичної нервової системи, товстої кишки, ендокринних залоз, стравоходу, оболонки матки, клітин зародкових центрів, голови і шиї, нирки, печінки, легені, гортані і гортаноглотки, мезотеліоми, саркоми, яєчника, підшлункової залози, простати, прямої кишки, нирки, тонкої кишки, м'якої тканини, яєчка, шлунка, шкіри, сечоводу, піхви і вульви; спадковий рак, ретинобластому і пухлину Wilms; лейкоз, лімфому, хворобу non-Hodgkins, хронічну і гостру форми лейкемії, що стосуються спинного або кісткового мозку, гострий лімфобластний лейкоз, хворобу Hodgkins, множинну мієлому і Т-клітинну лімфому; мієлодиспластичний синдром, неоплазію плазматичної клітини, паранеопластичні (що стосуються пухлини) синдроми, рак невідомого первинного сайту і СНІДзалежні злоякісні новоутворення. 13. Сполука за будь-яким з пп. 1-7, яка застосовується для лікування захворювань, вибраних з групи, що включає: прості бородавки; підошовні бородавки; гепатит В; гепатит С; Herpes Simplex (простий герпес) типу І і типу II; контагіозний молюск; HIV (ВІЛ); СМV (цитомегаловірус); VZV (оперізувальний лишай); інтраепітеліальні неоплазії, такі як цервікальна інтраепітеліальна неоплазія; людський папіломавірус (HPV) і асоційовані неоплазії; грибкові хвороби, наприклад кандидоз, аспергильоз, а також криптококові менінгіти; пухлинні захворювання, наприклад базальноклітинний рак, волосатоклітинний лейкоз, саркома Капоші, нирковоклітинний рак, плоскоклітинний рак, мієлогенозний лейкоз, множинна мієлома, меланома, лімфома nonHodgkin's, шкірна Т-лімфоцитарна лімфома, а також інші види раку; паразитарні хвороби, наприклад хвороби, спричинені грибком Pneumocystis carnii, криптоспоридіоз, гістоплазмоз, токсоплазмоз, трипаносомна (trypanosome) інфекція і лейшманіоз; а також бактеріальні інфекції, наприклад туберкульоз, і інфекції, спричинені мікобактеріями (mycobacterium avium), інші хвороби або хворобливі стані, які можуть лікуватися з використанням сполук за винаходом, включають екзему; еозинофілію; есенціальну тромбоцитанемію; лепру; розсіяний склероз; синдром Ommen's; дискоїдний вовчак; хворобу Боуена, сочевицеподібний дискоїдний 17 UA 105764 C2 5 10 15 20 25 30 35 дискератоз; бовеноїдний папульоз; алергічні хвороби, такі як алергічний дерматит; астма; алергія; алергічний риніт; системний червоний вовчак (еритематозний вовчак); як засіб для лікування рецидивних грибкових хвороб, періодонтиту і хламідозу; як вакцинний ад'ювант для забезпечення клітинного опосередкованого імунітету; а також як засіб для поліпшення або стимуляції загоєння ран, включаючи хронічні рани. 14. Застосування сполуки за будь-яким з пп. 1-7 для виготовлення медикаменту. 15. Фармацевтична композиція за пп. 9, 10, яка відрізняється тим, що використовується для лікування вірусної або неоплазійної хвороби. 16. Фармацевтична композиція за пп. 9, 10, яка відрізняється тим, що застосовується для лікування раку, вибраного з групи, що включає: рак грудей, сечового міхура, кістки, мозку, центральної і периферичної нервової системи, товстої кишки, ендокринних залоз, стравоходу, оболонки матки, клітин зародкових центрів, голови і шиї, нирки, печінки, легені, гортані і гортаноглотки, мезотеліоми, саркоми, яєчника, підшлункової залози, простати, прямої кишки, нирки, тонкої кишки, м'якої тканини, яєчка, шлунка, шкіри, сечоводу, піхви і вульви; спадковий рак, ретинобластому і пухлину Wilms; лейкоз, лімфому, хворобу non-Hodgkins, хронічну і гостру форми лейкемії, що стосуються спинного або кісткового мозку, гострий лімфобластний лейкоз, хворобу Hodgkins, множинну мієлому і Т-клітинну лімфому; мієлодиспластичний синдром, неоплазію плазматичної клітини, паранеопластичні (що стосуються пухлини) синдроми, рак невідомого первинного сайту і СНІД-залежні злоякісні новоутворення. 17. Фармацевтична композиція за пп. 9, 10, яка відрізняється тим, що застосовується для лікування захворювань, вибраних з групи, що включає: прості бородавки; підошовні бородавки; гепатит В; гепатит С; Herpes Simplex (простий герпес) типу I і типу II; контагіозний молюск; HIV (ВІЛ); СМV (цитомегаловірус); VZV (оперізувальний лишай); інтраепітеліальні неоплазії, такі як цервікальна інтраепітеліальна неоплазія; людський папіломавірус (HPV) і асоційовані неоплазії; грибкові хвороби, наприклад кандидоз, аспергильоз, а також криптококові менінгіти; пухлинні захворювання, наприклад базальноклітинний рак, волосатоклітинний лейкоз, саркома Капоші, нирковоклітинний рак, плоскоклітинний рак, мієлогенозний лейкоз, множинна мієлома, меланома, лімфома non-Hodgkin's, шкірна Т-лімфоцитарна лімфома, а також інші види раку; паразитарні хвороби, наприклад хвороби, спричинені грибком Pneumocystis carnii, криптоспоридіоз, гістоплазмоз, токсоплазмоз, трипаносомна (trypanosome) інфекція і лейшманіоз; а також бактеріальні інфекції, наприклад туберкульоз, і інфекції, спричинені мікобактеріями (mycobacterium avium), інші хвороби або хворобливі стані, які можуть лікуватися з використанням сполук за винаходом, включають екзему; еозінофілію; есенціальну тромбоцитанемію; лепру; розсіяний склероз; синдром Ommen's; дискоїдний вовчак; хворобу Боуена, сочевицеподібний дискоїдний дискератоз; бовеноїдний папульоз; алергічні хвороби, такі як алергічний дерматит; астма; алергія; алергічний риніт; системний червоний вовчак (еритематозний вовчак); як засіб для лікування рецидивних грибкових хвороб, періодонтиту і хламідозу; як вакцинний ад'ювант для забезпечення клітинного опосередкованого імунітету; а також як засіб для поліпшення або стимуляції загоєння ран, включаючи хронічні рани. 18 UA 105764 C2 19 UA 105764 C2 20 UA 105764 C2 21 UA 105764 C2 22 UA 105764 C2 23 UA 105764 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel substituted imidazoquinolines
Автори англійськоюGekeler, Volker, Maier, Thomas, Zimmermann, Astrid, Hofmann, Hans-Peter, Kulkarni, Sanjeev A., Jagtap, Anil P., Chaure, Ganesh S.
Автори російськоюГекелер Фолкер, Зиммерманн Астрид
МПК / Мітки
МПК: A61K 31/4353
Мітки: імідазохіноліни, заміщені
Код посилання
<a href="https://ua.patents.su/26-105764-zamishheni-imidazokhinolini.html" target="_blank" rel="follow" title="База патентів України">Заміщені імідазохіноліни</a>
Попередній патент: 8-заміщені піридо[2,3-b]піразини та їх застосування
Наступний патент: Зчленований транспортний засіб, наприклад зчленований автобус або зчленований рейковий транспортний засіб
Випадковий патент: Самоцентруючий трикулачковий патрон












