Імідазохіноліни, заміщені ариловими етерами, фармацевтична композиція на їх основі
Номер патенту: 75622
Опубліковано: 15.05.2006
Автори: Меррілл Брайон А., Хеппнер Філіп Д., Міккельсон Джон У., Чарльз Леслі Дж., Делларіа Джозеф Ф.
Формула / Реферат
1. Сполука формули (І):
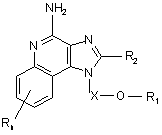 , (I)
, (I)
в якій:
X є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-алкенілу;
-арилу; і
-R4-арилу;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-алкенілу;
-алкіл-Y-арилу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН:
-галогену;
-N(R3)2;
-СО-N(R3)2;
-СО-С1-10 алкілу;
-CO-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
кожний Y є, незалежно, -О- або -S(О)0-2-;
n є від 0 до 4; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
2. Сполука або сіль за пунктом 1, в якій R1 є -алкіл-арилом.
3. Сполука або сіль за пунктом 1, в якій R1 є -(СН2)0-3-фенілом.
4. Сполука або сіль за пунктом 1, в якій R1 є -(СН2)0-3-заміщеним фенілом.
5. Сполука або сіль за пунктом 1, в якій Х є -СН(алкіл)(алкіл)-, де алкільні групи можуть бути однаковими або різними.
6. Сполука або сіль за пунктом 1, в якій Х є -СН2-СН2-.
7. Сполука або сіль за пунктом 1, в якій Х є -CH(С2H5)(CH2)-.
8. Сполука або сіль за пунктом 1, в якій R2 є Н.
9. Сполука або сіль за пунктом 1, в якій R2 є алкілом.
10. Сполука або сіль за пунктом 1, в якій R2 є -алкіл-О-алкілом.
11. Сполука формули (II)
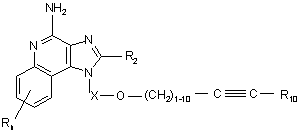 , (ІІ)
, (ІІ)
в якій Х є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-;
R10 вибраний з групи, яка складається з:
-Н;
-алкілу;
-алкенілу і
-арилу;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-алкенілу;
-алкіл-Y-арилу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-СО-N(R3)2;
-СО-С1-10 алкілу;
-СО-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
n є від 0 до 4;
кожний Y є, незалежно, -О- або -S(О)0-2-;
кожний R3 є, незалежно, Н або С1-10 алкілом; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
12. Сполука за пунктом 11, в якій R10 є арилом,
13. Сполука або сіль за пунктом 11, в якій R10 є -(СН2)0-3-фенілом.
14. Сполука або сіль за пунктом 11, в якій R10 є -(СН2)0-3-заміщеним фенілом.
15. Сполука або сіль за пунктом 11, в якій Х є -СН(алкіл)(алкіл)-, де алкільні групи можуть бути однаковими або різними.
16. Сполука або сіль за пунктом 11, в якій Х є -СН2-СН2-.
17. Сполука або сіль за пунктом 11, в якій Х є -CH(С2H5)(CH2)-.
18. Сполука або сіль за пунктом 11, в якій R2 є Н.
19. Сполука або сіль за пунктом 11, в якій R2 є алкілом.
20. Сполука або сіль за пунктом 11, в якій R2 є алкіл-О-алкілом.
21. Сполука формули (III)
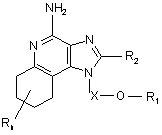 , (ІІІ)
, (ІІІ)
в якій:
Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-арилу;
-алкенілу і
-R4-арилу;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-арилу;
-алкіл-Y- алкенілу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-СО-N(R3)2;
-СО-С1-10 алкілу;
-СО-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю
-О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
кожний Y є, незалежно, -О- або -S(О)0-2-;
n є від 0 до 4; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
22. Сполука або сіль за пунктом 21, в якій R1 є -(СН2)0-3-заміщеним фенілом.
23. Сполука або сіль за пунктом 21, в якій R2 є Н або алкілом.
24. Сполука або сіль за пунктом 21, в якій R2 є -алкіл-O-алкілом.
25. Сполука формули (IV):
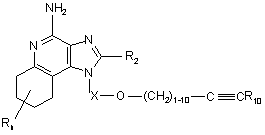 , (IV)
, (IV)
в якій:
Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R10 вибраний з групи, яка складається з:
-Н;
-алкілу;
-алкенілу і
-арилу;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-арилу;
-алкіл-Y-алкенілу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-CO-N(R3)2;
-СО-С1-10 алкілу;
-СО-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
кожний R3 є, незалежно, Н або С1-10 алкілом;
кожний Y є, незалежно, -О- або -S(O)0-2-;
n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
26. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки або солі за пунктом 1 і фармацевтично прийнятний носій.
27. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки або солі за пунктом 11 і фармацевтично прийнятний носій.
28. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки або солі за пунктом 21 і фармацевтично прийнятний носій.
29. Спосіб індукування біосинтезу цитокіну у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 1 тварині.
30. Спосіб за пунктом 29, в якому цитокіном є ![]() .
.
31. Спосіб індукування біосинтезу цитокіну у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 11 тварині.
32. Спосіб за пунктом 31, в якому цитокіном є ![]() .
.
33. Спосіб лікування вірусного захворювання у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 1 тварині.
34. Спосіб лікування неопластичного захворювання у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 1 тварині.
35. Спосіб лікування вірусного захворювання у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 11 тварині.
36. Спосіб лікування неопластичного захворювання у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 11 тварині.
37. Спосіб індукування біосинтезу цитокіну у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 21 тварині.
38. Спосіб за пунктом 37, в якому цитокіном є ![]() .
.
39. Спосіб лікування вірусного захворювання у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 21 тварині.
40. Спосіб лікування неопластичного захворювання у тварини, в якому вводять терапевтично ефективну кількість сполуки або солі за пунктом 21 тварині.
41. Сполука формули (V):
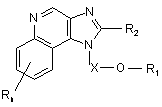 , (V)
, (V)
в якій Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-арилу;
-алкенілу;
-R4-арилу і
![]() ;
;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-алкенілу;
-алкіл-Y-арилу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-СО-N(R3)2;
-СО-С1-10 алкілу;
-CO-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу;
кожний Y є, незалежно, -О- або -S(O)0-2-;
n є від 0 до 4; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
42. Сполука формули (VI):
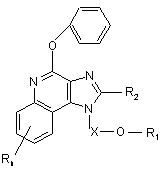 , (VI)
, (VI)
в якій
Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-арилу;
-алкенілу;
-R4-арилу і
![]() ;
;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-алкенілу;
-алкіл-Y-арилу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-СО-N(R3)2;
-СО-С1-10 алкілу;
-CO-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу;
кожний Y є, незалежно, -О- або -S(O)0-2-;
n є від 0 до 4; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
43. Сполука формули (VII):
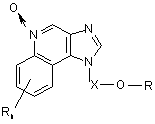 , (VII)
, (VII)
в якій:
X є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-арилу;
-алкенілу;
-R4-арилу і
![]() ;
;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу;
n є від 0 до 4; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
44. Сполука формули (VIII):
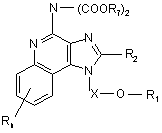 , (VIII)
, (VIII)
в якій:
X є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-арилу;
-алкенілу;
-R4-арилу і
![]() ;
;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-алкенілу;
-алкіл-Y-арилу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-СО-N(R3)2;
-CO-С1-10 алкілу;
-СО-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу;
кожний Y є, незалежно, -О- або -S(O)0-2;
n є від 0 до 4;
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; і
R7 є трет-бутилом або бензилом;
або її фармацевтично прийнятна сіль.
45. Сполука формули (IX)
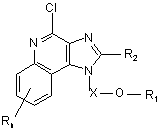 , (IX)
, (IX)
в якій:
X є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-;
R1 вибраний з групи, яка складається з:
-арилу;
-алкенілу;
-R4-арилу і
![]() ;
;
R2 вибраний з групи, яка складається з:
-водню;
-алкілу;
-алкенілу;
-арилу;
-гетероарилу;
-гетероциклілу;
-алкіл-Y-алкілу;
-алкіл-Y-алкенілу;
-алкіл-Y-арилу; і
-алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з:
-ОН;
-галогену;
-N(R3)2;
-CO-N(R3)2;
-СО-С1-10 алкілу;
-СО-O-С1-10 алкілу;
-N3;
-арилу;
-гетероарилу;
-гетероциклілу;
-СО-арилу і
-СО-гетероарилу;
R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп;
кожний R3 є, незалежно, Н або С1-10 алкілом;
кожний Y є, незалежно, -О- або -S(О)0-2-;
n є від 0 до 4; і
кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу;
або її фармацевтично прийнятна сіль.
Текст
1. Сполука формули (І): NH2 C2 2 (19) 1 3 75622 4 10. Сполука або сіль за пунктом 1, в якій R2 є 21. Сполука формули (III) алкіл-О-алкілом. NH2 11. Сполука формули (II) NH2 N N R2 R2 X O (CH2)1-10 C C X R10 , в якій Х є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл; R10 вибраний з групи, яка складається з: -Н; -алкілу; -алкенілу і -арилу; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-алкенілу; -алкіл-Y-арилу; і -алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -СО-N(R3)2; -СО-С1-10 алкілу; -СО-O-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу і -СО-гетероарилу; n є від 0 до 4; кожний Y є, незалежно, -О- або -S(О)0-2-; кожний R3 є, незалежно, Н або С1-10 алкілом; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; або її фармацевтично прийнятна сіль. 12. Сполука за пунктом 11, в якій R10 є арилом, 13. Сполука або сіль за пунктом 11, в якій R10 є (СН2)0-3-фенілом. 14. Сполука або сіль за пунктом 11, в якій R10 є (СН2)0-3-заміщеним фенілом. 15. Сполука або сіль за пунктом 11, в якій Х є СН(алкіл)(алкіл)-, де алкільні групи можуть бути однаковими або різними. 16. Сполука або сіль за пунктом 11, в якій Х є СН2-СН2-. 17. Сполука або сіль за пунктом 11, в якій Х є CH(С2H5)(CH2)-. 18. Сполука або сіль за пунктом 11, в якій R2 є Н. 19. Сполука або сіль за пунктом 11, в якій R2 є алкілом. 20. Сполука або сіль за пунктом 11, в якій R2 є алкіл-О-алкілом. (ІІІ) N (ІІ) N Rn N N Rn O R1 , в якій: Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу і -R4-арилу; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-арилу; -алкіл-Y- алкенілу; і -алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -СО-N(R3)2; -СО-С1-10 алкілу; -СО-O-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу і -СО-гетероарилу; R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп; кожний R3 є, незалежно, Н або С1-10 алкілом; кожний Y є, незалежно, -О- або -S(О)0-2-; n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; або її фармацевтично прийнятна сіль. 22. Сполука або сіль за пунктом 21, в якій R1 є (СН2)0-3-заміщеним фенілом. 23. Сполука або сіль за пунктом 21, в якій R2 є Н або алкілом. 24. Сполука або сіль за пунктом 21, в якій R2 є алкіл-O-алкілом. 25. Сполука формули (IV): 5 75622 6 33. Спосіб лікування вірусного захворювання у тварини, в якому вводять терапевтично ефективну N кількість сполуки або солі за пунктом 1 тварині. N R2 34. Спосіб лікування неопластичного захворюван(IV) ня у тварини, в якому вводять терапевтично ефекN тивну кількість сполуки або солі за пунктом 1 тваX O (CH2)1-10 C CR10 рині. 35. Спосіб лікування вірусного захворювання у Rn , тварини, в якому вводять терапевтично ефективну в якій: кількість сполуки або солі за пунктом 11 тварині. Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; 36. Спосіб лікування неопластичного захворюванR10 вибраний з групи, яка складається з: ня у тварини, в якому вводять терапевтично ефек-Н; тивну кількість сполуки або солі за пунктом 11 тва-алкілу; рині. -алкенілу і 37. Спосіб індукування біосинтезу цитокіну у тва-арилу; рини, в якому вводять терапевтично ефективну R2 вибраний з групи, яка складається з: кількість сполуки або солі за пунктом 21 тварині. -водню; 38. Спосіб за пунктом 37, в якому цитокіном є -алкілу; . IFN -алкенілу; 39. Спосіб лікування вірусного захворювання у -арилу; тварини, в якому вводять терапевтично ефективну -гетероарилу; кількість сполуки або солі за пунктом 21 тварині. -гетероциклілу; 40. Спосіб лікування неопластичного захворюван-алкіл-Y-алкілу; ня у тварини, в якому вводять терапевтично ефек-алкіл-Y-арилу; тивну кількість сполуки або солі за пунктом 21 тва-алкіл-Y-алкенілу; і рині. -алкілу або алкенілу, заміщеного однією або біль41. Сполука формули (V): шою кількістю замісників, вибраних з групи, яка N складається з: N -ОН; R2 -галогену; N (V) -N(R3)2; X O R1 -CO-N(R3)2; -СО-С1-10 алкілу; Rn -СО-O-С1-10 алкілу; , -N3; в якій Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; -арилу; R1 вибраний з групи, яка складається з: -гетероарилу; -арилу; -гетероциклілу; -алкенілу; -СО-арилу і -R4-арилу і -СО-гетероарилу; (CH 2 )1 10 C C R10 ; кожний R3 є, незалежно, Н або С1-10 алкілом; R2 вибраний з групи, яка складається з: кожний Y є, незалежно, -О- або -S(O)0-2-; -водню; n є від 0 до 4; і кожний присутній R, незалежно, -алкілу; вибраний з групи, яка складається з С1-10 алкілу, -алкенілу;С1-10 алкокси, гідрокси, галогену і трифторметилу; -арилу; або її фармацевтично прийнятна сіль. -гетероарилу; 26. Фармацевтична композиція, яка містить тера-гетероциклілу; певтично ефективну кількість сполуки або солі за -алкіл-Y-алкілу; пунктом 1 і фармацевтично прийнятний носій. -алкіл-Y-алкенілу; 27. Фармацевтична композиція, яка містить тера-алкіл-Y-арилу; і певтично ефективну кількість сполуки або солі за -алкілу або алкенілу, заміщеного однією або більпунктом 11 і фармацевтично прийнятний носій. шою кількістю замісників, вибраних з групи, яка 28. Фармацевтична композиція, яка містить тераскладається з: певтично ефективну кількість сполуки або солі за -ОН; пунктом 21 і фармацевтично прийнятний носій. -галогену; 29. Спосіб індукування біосинтезу цитокіну у тва-N(R3)2; рини, в якому вводять терапевтично ефективну -СО-N(R3)2; кількість сполуки або солі за пунктом 1 тварині. -СО-С1-10 алкілу; 30. Спосіб за пунктом 29, в якому цитокіном є -CO-O-С1-10 алкілу; . IFN -N3; 31. Спосіб індукування біосинтезу цитокіну у тва-арилу; рини, в якому вводять терапевтично ефективну -гетероарилу; кількість сполуки або солі за пунктом 11 тварині. -гетероциклілу; 32. Спосіб за пунктом 31, в якому цитокіном є -СО-арилу і . IFN NH2 7 75622 8 -СО-гетероарилу; кожний присутній R, незалежно, вибраний з групи, R4 є алкілом або алкенілом, який може перериваяка складається з С1-10 алкілу, С1-10 алкокси, гідротись одною або більшою кількістю -О-груп; кси, галогену і трифторметилу; кожний R3 є, незалежно, Н або С1-10 алкілом; або її фармацевтично прийнятна сіль. R10 вибраний з групи, яка складається з Н, алкілу, 43. Сполука формули (VII): алкенілу і арилу; O кожний Y є, незалежно, -О- або -S(O)0-2-; N N n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, N яка складається з С1-10 алкілу, С1-10 алкокси, гідро(VII) кси, галогену і трифторметилу; X O R або її фармацевтично прийнятна сіль. 42. Сполука формули (VI): Rn , в якій: X є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; O R1 вибраний з групи, яка складається з: -арилу; N -алкенілу; N (VI) R2 -R4-арилу і N (CH 2 )1 10 C C R10 ; X Rn O R1 , в якій Х є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; -R4-арилу і (CH2 )1 10 C C R10 ; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-алкенілу; -алкіл-Y-арилу; і -алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -СО-N(R3)2; -СО-С1-10 алкілу; -CO-O-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу і -СО-гетероарилу; R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп; кожний R3 є, незалежно, Н або С1-10 алкілом; R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу; кожний Y є, незалежно, -О- або -S(O)0-2-; n є від 0 до 4; і R4 є алкілом або алкенілом, який може перериватись одною або більшою кількістю -О-груп; кожний R3 є, незалежно, Н або С1-10 алкілом; R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу; n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; або її фармацевтично прийнятна сіль. 44. Сполука формули (VIII): N (COOR7)2 N N R2 (VIII) N X O R1 Rn , в якій: X є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; -R4-арилу і (CH 2 )1 10 C C R10 ; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-алкенілу; -алкіл-Y-арилу; і -алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; 9 75622 10 -СО-N(R3)2; (CH 2 )1 10 C CH ; -CO-С1-10 алкілу; R2 вибраний з групи, яка складається з: -СО-O-С1-10 алкілу; -водню; -N3; -алкілу; -арилу; -алкенілу; -гетероарилу; -арилу; -гетероциклілу; -гетероарилу; -СО-арилу і -гетероциклілу; -СО-гетероарилу; -алкіл-Y-алкілу; R4 є алкілом або алкенілом, який може перерива-алкіл-Y-алкенілу; тись одною або більшою кількістю -О-груп; -алкіл-Y-арилу; і кожний R3 є, незалежно, Н або С1-10 алкілом; -алкілу або алкенілу, заміщеного однією або більR10 вибраний з групи, яка складається з Н, алкілу, шою кількістю замісників, вибраних з групи, яка алкенілу і арилу; складається з: кожний Y є, незалежно, -О- або -S(O)0-2; -ОН; n є від 0 до 4; -галогену; кожний присутній R, незалежно, вибраний з групи, -N(R3)2; яка складається з С1-10 алкілу, С1-10 алкокси, гідро-CO-N(R3)2; кси, галогену і трифторметилу; і -СО-С1-10 алкілу; R7 є трет-бутилом або бензилом; -СО-O-С1-10 алкілу; або її фармацевтично прийнятна сіль. -N3; 45. Сполука формули (IX) -арилу; Cl -гетероарилу; -гетероциклілу; N -СО-арилу і N R2 -СО-гетероарилу; (IX) R4 є алкілом або алкенілом, який може перериваN тись одною або більшою кількістю -О-груп; X O R1 кожний R3 є, незалежно, Н або С1-10 алкілом; кожний Y є, незалежно, -О- або -S(О)0-2-; Rn n є від 0 до 4; і , кожний присутній R, незалежно, вибраний з групи, в якій: яка складається з С1-10 алкілу, С1-10 алкокси, гідроX є -CHR3-, -CHR3-алкіл- або -CHR3-алкеніл-; кси, галогену і трифторметилу; R1 вибраний з групи, яка складається з: або її фармацевтично прийнятна сіль. -арилу; -алкенілу; -R4-арилу і Даний винахід стосується сполук імідазохінолінів, які мають 1-замісник, який містить етерну та арильну, або алкенільну функціональну групу, а також до фармацевтичних композицій, які містять такі сполуки. Наступний аспект даного винаходу відноситься до застосування таких сполук у якості імуномодуляторів для індукування біосинтезу цитокінів у товарин, та при лікуванні захворювань, включно з вірусними та непластичними захворюваннями. Перша достовірна публікація щодо 1Німідазо[4,5-с]хінолінової циклічної системи, [Backman et al., J. Org. Chem. 15, 1278-1284 (1950)] описує синтез 1-(6-метокси-8-хінолініл)-2-метил1Н-імідазо[4,5-с]хіноліну для його можливого застосування у якості антималярійного агента. Відповідно було повідомлено про синтез різних заміщених 1Н-імідазо[4,5-с]хінолінів. Наприклад, [Jain et al., J. Med. Chem. 11, pp.87-92 (1968)] синтезували сполуку 1-[2-(4-піперидил)етил]-1Hімідазо[4,5-с]хіноліну у якості можливо протисудомного та серцево-судинного агента. Також, [Baranov et al., Chem. Abs. 85, 94362 (1976)] допо вів по декілька 2-оксоімідазо[4,5-с]хінолінів, та [Berenyi et al., J. Heterocvclic Chem. 18,1537-1540 (1981)], доповів про певні 2-оксоімідазо[4,5с]хіноліни. Пізніше було виявлено, що певні 1Hімідазо[4,5-с]хінолін-4-аміни і їх 1- та 2-заміщені похідні є корисними у якості антивірусних агентів, бронходилататорів та імуномодуляторів. Вони описані у, поміж іншого, в патентах Сполучних Штатів №№4,689,338; 4,698,348; 4,929,624; 5,037,986; 5,268,376; 5,346,905; і 5,389,640, які включені у якості посилань. Імідазохінолінова циклічна система все ще залишається предметом зацікавлення. Відомі деякі 1Н-імідазо[4,5-с]нафтирідин-4-аміни, 1Hімідазо[4,5-с]піридин-4-аміни та 1H-імідазо[4,5с]хінолін-4-аміни, які мають замісник, що містить етер, у 1 положенні. Вони описані в патентах Сполучених Штатів №№ 5,268,376; 5,389,640; 5,494,916; і WO 99/29693. Залишається необхідність у сполуках, які мають здатність модифікувати імунну відповідь шляхом індукування біосинтезу цитокіну, або за допо 11 75622 могою іншого механізму. Ми виявили новий клас сполук, які корисні при індукуванні біосинтезу цитокіну у тварин. Відповідно, даний винахід включає сполуки імідазо[4, 5с]хінолін-4-аміну та тетрагідроімідазо[4, 5с]хінолін-4-аміну, які мають замісник, що містить етер, у 1-положенні. Ці сполуки описані Формулами (І), (II), (III) і (IV), які більш детально описані нижче. Ці сполуки мають загальну структурну формулу: в якій X, R1, R2, i R мають визначенні тут значення для кожного класу сполук, які мають Формули (І), (II), (III) і (IV). Сполуки Формул (І), (II), (III) і (IV) є корисними у якості модифікаторів імунної відповіді через їх здатність індукувати біосинтез цитокіну та певним чином модифікувати імунну відповідь при введенні їх тваринам. Цей факт робить сполуки корисними при лікуванні ряду станів, таких як вірусні захворювання та пухлини, які реагують на такі зміни в імунній відповіді. Даний винахід також включає фармацевтичні композиції, які містять сполуки, що модифікують імунну відповідь, а також способи індукування біосинтезу цитокінів у тварини, лікування вірусних інфекцій у тварин, та/або лікування неопластичних захворювань у тварини шляхом введення сполуки Формули (І), (II), (III), або (IV) тварині. Крім того, винахід стосується способів синтезу сполук згідно з даним винаходом та проміжних сполук, корисних при синтезі цих сполук. Як було зазначено раніше, ми знайшли певні сполуки, які індукують біосинтез циокіну та модифікують імунну відповідь у тварин. Такі сполуки представлені Формулами (І), (II), (III) і (IV), які наведені нижче. Сполуки імідазохінолінів згідно з даним винаходом, які мають етерну і арильну, або алкенільну функціональну групу у 1-положенні, представлені Формулою (І): в якій: X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -алкенілу; 12 -арилу; - 4-арилу; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-алкенілу; -алкіл-Y-арилу; і - алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -CO-N(R3)2; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу; і -СО-гетероарилу; R4 є алкілом або алкенілом, кожен з яких може перериватись одною або більшою кількістю -Огруп; кожний R3 є, незалежно, Η або С1-10 алкілом; кожний Υ є, незалежно, -О- або -S(O)0-2-; n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; або її фармацевтично прийнятна сіль. Винахід також стосується сполук імідазохінолінів, які містять етерну функціональну групу у 1положенні, де замісник, який містить етер, також включає алкінільну групу. Ці сполуки представлені структурною формулою (II): в якій: X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R10 вибраний з групи, яка складається з: -Н; -алкілу; -алкенілу; і -арилу; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; 13 75622 14 -гетероциклілу; -СО-С1-10 алкілу; -алкіл-Y-алкілу; -СО-O-С1-10 алкілу; -алкіл-Y-алкенілу; -N3; -алкіл-Y-арилу; і -арилу; -алкілу або алкенілу, заміщеного однією або -гетероарилу; більшою кількістю замісників, вибраних з групи, -гетероциклілу; яка складається з: -СО-арилу; і -ОН; -СО-гетероарилу; -галогену; R4 є алкілом або алкенілом, кожен з яких може -N(R3)2; перериватись одною або більшою кількістю -О-CO-N(R3)2; груп; -СО-С1-10 алкілу; кожний R3 є, незалежно, Η або С1-10 алкілом; -CO-O-С1-10 алкілу; кожний Υ є, незалежно, -О- або -S(O)0-2-; -N3; n є від 0 до 4; і -арилу; кожний присутній R, незалежно, вибраний з -гетероарилу; групи, яка складається з С1-10 алкілу, С1-10 алкокси, -гетероциклілу; гідрокси, галогену і трифторметилу; -СО-арилу; і або її фармацевтично прийнятна сіль. -СО-гетероарилу; Додатковим класом сполук згідно з даним виn є від 0 до 4; находом, які модифікують імунну відповідь, є спокожний Υ є, незалежно, -О- або -S(O)0-2-; луки тетрагідроімідазохінолінів, які мають заміскожний R3 є, незалежно, Η або С1-10 алкілом; і ник, який містить етер, у 1-положенні, де замісник, кожний присутній R, незалежно, вибраний з що містить етер, також включає алкінільну групу. групи, яка складається з С1-10 алкілу, С1-10 алкокси, Ці сполуки представлені структурною формулою гідрокси, галогену і трифторметилу; (IV): або її фармацевтично прийнятна сіль. Винахід також включає сполуки тетрагідроімідазохінолінів, які мають замісник, який містить етер і арил або алкеніл, у 1-положенні. Такі сполуки тетрагідроімідазохінолінів представлені Формулою (III): в якій: X є -CHR3-, -СНR3-алкіл-, або-CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; і R4-арилу; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-арилу; - алкіл-Y-алкенілу; і - алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -CO-N(R3)2; де X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R10 вибраний з групи, яка складається з: -Н; -алкілу; -алкенілу; і -арилу; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-арилу; -алкіл-Y-алкенілу; і - алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -CO-N(R3)2; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; 15 75622 16 -СО-арилу; і жуть об'єднувати у двофазній суміші водного 50% -СО-гетероарилу; розчину гідроксиду натрію і інертного розчинника, кожний R3 є, незалежно, Η або С1-10 алкілом; такого як дихлорметан, у присутності каталізатора кожний Υ є, незалежно, -О- або - S(O)0-2-; переносу фаз, такого як хлорид бензилтриметиn є від 0 до 4; і ламонію. Реакцію можна проводити при темперакожний присутній R, незалежно, вибраний з турі навколишнього середовища. Багато сполук групи, яка складається з С1-10 алкілу, С1-10 алкокси, Формули XIII є відомими, див, наприклад, Gerster, гідрокси, галогену і трифторметилу; патент Сполучених Штатів 4,689,338; інші можуть або її фармацевтично прийнятна сіль. бути легко одержані шляхом відомих методів синСполуки згідно з даним винаходом можуть тезу, див, наприклад, Gerster et al., патент Сполуодержувати відповідно до Схеми реакції І, де R1, чених Штатів №5,605,899 і Gerster, патент СполуR2, X і n мають визначені вище значення і R11 є чених Штатів №5,175,296. алкілом, заміщеним арильною групою, де арильна На стадії (2) Схеми реакції II 1Н-імідазо[4,5група може бути незаміщеною або заміщеною, або с]хінолін-1-іловий етер Формули XIV окислюють з R11 є заміщеним арилом, за умови, що якщо R11 є одержанням 1Н-імідазо[4,5-с]хінолін-5N-оксиду заміщеним арилом, принаймні один замісник є Формули XV, застосовуючи відомий окислюючий сильною електрон-акцепторною групою, розміщеагент, здатний утворювати N-оксиди. Переважно, ною орто або para щодо етерного зв'язку. розчин сполуки Формули XIV у придатному розчиннику, такому як хлороформ або дихлорметан Схема реакції І окислюють, застосовуючи 3-хлорпероксибензойну кислоту, при температурі навколишнього середовища. На стадії (3) Схеми реакції II 1H-імідазо[4,5с]хінолін-5N-оксид Формули XV амінують з одержанням 1Н-імідазо[4,5-с]хінолін-4-аміну Формули XII, яка є підвидом Формули І. Стадія (3) включає (і) реакцію сполуки Формули XV з ацилюючим агентом з наступною (іі) реакцією продукту з амінуюНа Схемі реакції І 4-аміно-1H-імідазо[4,5чим агентом. Частина (і) стадії (3) включає реакцію с]хінолін-1-іловий спирт Формули X алкілюють гаN-оксиду Формули XV з ацилюючим агентом. Прилогенідом Формули XI з одержанням 1Ндатними ацилюючими агентами є алкіл- або арилімідазо[4,5-с]хінолін-4-аміну Формули XIІ, яка є сульфонілхлориди (наприклад, бензолсульфонілпідвидом Формули І. Спирт Формули X вступає в хлорид, метансульфонілхлорид, преакцію з гідридом натрію у придатному розчиннитолуолсульфонілхлорид). Арилсульфонілхлориди ку, такому як Ν,Ν-диметилформамід, з утворенням є переважними. Пара-толуолсульфонілхлорид є алкоксиду. Потім до реакційної суміші додають найбільш переважним. Частина (іі) стадії (3) вклюгалогенід. Реакцію можна проводити при темперачає реакцією продукту частини (і) з надлишком турі навколишнього середовища або при помірноамінуючого агента. Придатними амінуючими агенму нагріванні (~50°С), якщо бажано. Продукт або тами є аміак (наприклад, у формі гідроксиду амойого фармацевтично прийнятну сіль можна видінію) і солі аміаку (наприклад, карбонат амонію, лити за допомогою відомих методик. бікарбонат амонію, фосфат амонію). Гідроксид Багато сполук Формули X є відомими, див., амонію є переважним. Реакцію переважно провонаприклад, Gerster, патент Сполучених Штатів дять шляхом розчинення N-оксиду Формули XV в №4,689,338 і Gerster et. al., патент Сполучених інертному розчиннику, такому як дихлорметан, Штатів №5,605,899, описи яких включені тут у якододаючи до розчину амінуючий агент, і з наступсті посилань; інші можуть бути легко одержані ним повільним додаванням ацилюючого агента. шляхом відомих методів синтезу, див., наприклад, Продукт або його фармацевтично прийнятну сіль Andre et. al, патент Сполучених Штатів можна виділити за допомогою відомих методик. №5,578,727; Gerster, патент Сполучених Штатів Альтернативно, стадія (3) може проводитись №5,175,296; Nikolaides et al., патент Сполучених шляхом (і) реакції N-оксиду Формули XV з ізоціаШтатів №5,395,937; і Gerster et. al., патент Сполунатом з наступним (іі) гідролізом одержаного прочених Штатів №5,741,908, описи яких включені тут дукту. Частина (і) включає реакцію N-оксиду з ізоу якості посилань. Багато галогенідів Формули XI є ціанатом, де ізоціанатогрупа має зв'язок із комерційно доступними; інші можна легко одержакарбонільною групою. Переважними ізоціанатами ти шляхом відомих методів синтезу. є трихлорацетилізоціанат і ароїлізоціанати, такі як Сполуки згідно з даним винаходом можуть бензоїлізоціанат. Реакцію ізоціанату з N-оксидом одержувати відповідно до Схеми реакції II, де R, проводять в основному безводному середовищі R2, R11, X і n мають визначені вище значення. шляхом додавання ізоціанату до розчину N-оксиду На стадії (1) Схеми реакції II 1Н-імідазо[4,5в інертному розчиннику, такому як хлороформ або с]хінолін-1-іловий спирт Формули XIII алкілюють дихлорметан. Частина (іі) включає гідроліз продукгалогенідом Формули XI з одержанням 1Нту з частини (і). Гідроліз можна проводити відомиімідазо[4,5-с]хінолін-1-ілового етеру Формули XIV. ми методиками, такими як нагрівання у присутносСпирт Формули XIII вступає в реакцію з гідридом ті води або нижчого алканолу, необов'язково, у натрію у придатному розчиннику, такому як Ν,Νприсутності каталізатора, такого як гідроксид луждиметилформамід або тетрагідрофуран, з утвоного металу або нижчий алкоксид. Продукт або ренням алкоксиду. Алкоксид потім об'єднують з його фармацевтично прийнятну сіль можна видігалогенідом. Альтернативно, спирт і галогенід мо 17 лити за допомогою відомих методик. Схема реакції II Сполуки Формули І, в яких R, R2, X і n мають визначені вище значення і R1 є, необов'язково, заміщеним фенілом, можуть одержувати відповідно до Схеми реакції III, де m є від 0 до 3, і кожний R', незалежно, вибраний з групи, яка складається з алкілу, алкокси, алкілтіо, галоалкілу, галоалкокси, галоалкілтіо, галогену, нітро, меркапто, ціано, карбокси, формілу, арилу, арилокси, арилтіо, арилалкокси, арилалкілтіо, гетероарилу, гетероарилокси, гетероарилтіо, гетероарилалкокси, гетероарилалкілтіо, аміно, алкіламіно, діалкіламіно, гетероциклілу, гетероциклоалкілу, алкілкарбонілу, алкенілкарбонілу, арилкарбонілу, алкоксикарбонілу, галоалкілкарбонілу, галоалкоксикарбонілу, алкілтіокарбонілу, арилоксикарбонілу, алканоїлокси, алканоїлтіо, алканоїламіно, ароїлокси і ароїламіно. На Схемі реакції III 4-аміно-1Н-імідазо[4,5с]хінолін-1-іловий спирт Формули X конденсують з фенолом Формули XVI з одержанням 1Німідазо[4,5-с]хінолін-4-аміну Формули XVII, яка є підвидом Формули І. Переважно, розчин сполуки Формули X і фенол придатному розчиннику, такому як Ν,Ν-диметилформамід, оброблюють діетил азодикарбоксилатом і трифенілфосфіном при температурі навколишнього середовища. Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. Схема реакції III Сполуки згідно з даним винаходом можуть також одержувати відповідно до Схеми реакції IV, де R, R2, R11, X і n мають визначені вище значення. 75622 18 На стадії (1) Схеми реакції IV гідроксигрупу 1Hімідазо[4,5-с]хінолін-1-ілового спирту Формули XIII захищають бензильною групою. Спирт Формули XIII вступає в реакцію з гідридом натрію у придатному розчиннику, такому як Ν,Νдиметилформамід, з утворенням алкоксиду. Алкоксид потім алкілюють бензилбромідом з одержанням сполуки Формули XVIII. Реакцію можна проводити при температурі навколишнього середовища. На стадії (2) Схеми реакції IV сполуку Формули XVIII окислюють, використовуючи спосіб стадії (2) Схеми реакції II, з одержанням 1Н-імідазо[4,5с]хінолін-5N-оксиду Формули XIX. На стадії (3) Схеми реакції IV 1Н-імідазо[4,5с]хінолін-5N-оксид Формули XIX хлорують з одержанням 4-хлор-1Н-імідазо[4,5-с]хіноліну Формули XX. Переважно, розчин сполуки Формули XIX у придатному розчиннику, такому як толуол, оброблюють оксихлоридом фосфору при температурі навколишнього середовища. На стадії (4) Схеми реакції IV 4-хлор-1Hімідазо[4,5-с]хінолін Формули XX вступає в реакцію з фенолом з одержанням 4-фенокси-1Німідазо[4,5-с]хіноліну Формули XXI. Фенол вступає в реакцію з гідридом натрію у придатному розчиннику, такому як диглім, з утворенням феноксиду. Феноксид потім вступає в реакцію при підвищеній температурі з сполукою Формули XX. На стадії (5) Схеми реакції IV бензильну захисну групу видаляють зі сполуки Формули XXI з одержанням 4-фенокси-1H-імідазо[4,5-с]хінолін-1ілового спирту Формули XXII. Реакцію переважно проводять шляхом контрольованого додавання трифторметилсульфонової кислоти до розчину сполуки Формули XXI у придатному розчиннику, такому як дихлорметан, при температурі навколишнього середовища. На стадії (6) Схеми реакції IV 4-фенокси-1Німідазо[4,5-с]хінолін-1-іловий спирт Формули XXII алкілюють галогенідом Hal-R11 з одержанням 4фенокси-1H-імідазо[4,5-с]хінолін-1-ілового етеру Формули XXIII. Алкоксид сполуки Формули XXII утворюється шляхом додавання спирту до двофазної суміші водного 50% розчину гідроксиду натрію і інертного розчинника, такого як дихлорметан, у присутності каталізатора переносу фаз, такого як хлорид бензилтриметиламонію. Алкоксид потім алкілюють. Реакцію можна проводити при температурі навколишнього середовища. На стадії (7) Схеми реакції IV 4-фенокси-1Німідазо[4,5-с]хінолін-1-іловий етер Формули XXIII амінують з одержанням 1Н-імідазо[4,5-с]хінолін-4аміну Формули XII, яка є підвидом Формули І. Реакцію можна проводити шляхом об'єднання сполуки Формули XXIII з ацетатом амонію і нагрівання одержаної суміші при ~150°С. Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. 19 75622 20 R, R2, R11, X і n мають визначені вище значення. Схема реакції IV На стадії (1) Схеми реакції VI 4-хлор-3нітрохінолін Формули XXVI вступає в реакцію з аміном Формули R1-O-X-NH2 з одержанням 3нітрохінолін-4-аміну Формули XXVII. Реакцію можна проводити шляхом додавання аміну до розчину сполуки Формули XXVI у придатному розчиннику, такому як хлороформ або дихлорметан, і, необов'язково, нагрівання. Багато хінолінів Формули XXVI є відомими сполуками (див, наприклад, патент Сполучених Штатів 4,689,338 і цитовані тут посилання). На стадії (2) Схеми реакції VI 3-нітрохінолін-4амін Формули XXVII відновлюють з одержанням хінолін-3,4-діаміну Формули XXVIII. Переважно, відновлення проводять використовуючи відомий гетерогенний каталізатор гідрування, такий як платина на вугіллі або паладій на вугіллі. Реакцію зручно проводити на апараті Парра у придатному розчиннику, такому як ізопропіловий спирт або, переважно, толуол. На стадії (3) Схеми реакції VI хінолін-3,4-діамін Формули XXVIII вступає в реакцію з карбоновою кислотою або її еквівалентом з одержанням 1Німідазо[4,5-с]хіноліну Формули XXIX. Придатними еквівалентами карбонової кислоти є ортоестери і 1,1-діалкоксиалкіл алканоати. Карбонову кислоту або еквівалент вибирають таким чином, щоб одержати бажаний R2 замісник у сполуці Формули XXIX. Наприклад, застосовуючи триетилортоформат одержимо сполуку, в якій R2 є воднем, і застоТетрагідроімідазохіноліни згідно з даним винасовуючи триетилортоацетат одержимо сполуку, в ходом можуть одержувати відповідно до Схеми якій R2 є метилом. Реакція може проходити при реакції V, де R, R2, R11, X і n мають визначені вище відсутності розчинника, або в інертному розчиннизначення. ку, такому як толуол. Реакція проходить при досНа Схемі реакції V 4-аміно-6,7,8,9-тетрагідротатньому нагріванні для видалення спирту або 1H-імідазо[4,5-с]хінолін-1-іловий спирт Формули води, які утворились як побічні продукти реакції. XXIV алкілюють галогенідом Формули XI з одерНеобов'язково, каталізатор, такий як гідрохлорид жанням 6,7,8,9-тетрагідро-1Н-імідазо[4,5-с]хінолінпіридину, може бути включений. 4-аміну Формули XXV, яка є підвидом Формули III. Альтернативно, стадію (3) можуть проводити Спирт Формули XXIV вступає в реакцію з гідридом шляхом (і) реакції діаміну Формули XXVIII з ацилнатрію у придатному розчиннику, такому як Ν,Νгалоїдом Формули R2C(O)CI з наступною (іі) циклідиметилформамід, з утворенням алкоксиду. Алкозацією. В частині (і) ацилгалоїд додають до розчиксид потім об'єднують з галогенідом. Реакцію мону діаміну у придатному розчиннику, такому як жна проводити при температурі навколишнього ацетонітрил, піридин або дихлорметан. Реакцію середовища. Продукт або його фармацевтично можна проводити при температурі навколишнього прийнятну сіль можна виділити за допомогою вісередовища. В частині (іі) продукт частини (і) надомих методик. грівають в спиртовому розчиннику у присутності Багато тетрагідро-1Н-імідазо[4,5-с]хінолінів основи. Переважно, продукт частини (і) кип'ятять із Формули XXIV є відомими, див, наприклад, зворотнім холодильником в етанолі у присутності Nikolaides et al., патент Сполучених Штатів надлишку триетиламіну або нагрівають з метано№5,352,784; інші можуть одержувати шляхом вільним аміаком. Альтернативно, якщо стадія (і) домих методів синтезу, див, наприклад, Lindstrom, проходить в піридині, стадію (іі) можуть проводити патент Сполучених Штатів №5,693,811; описи яких шляхом нагрівання реакційної суміші після того як включені тут у якості посилань. аналіз вкаже на завершення стадії (і). На стадії (4) Схеми реакції VI 1Н-імідазо[4,5Схема реакції V с]хінолін Формули XXIX окислюють, використовуючи спосіб стадії (2) Схеми реакції II, з одержанням 1р-імідазо[4,5-с]хінолін-5Ν-оксиду Формули XXX. На стадії (5) Схеми реакції VI 1Н-імідазо[4,5с]хінолін-5N-оксид Формули XXX амінують, використовуючи спосіб стадії (3) Схеми реакції II, з одержанням 1Н-імідазо[4,5-с]хінолін-4-аміну ФорСполуки згідно з даним винаходом можуть тамули І. кож одержувати відповідно до Схеми реакції VI, де 21 Схема реакції VI 75622 22 переважно проводять при підвищеній температурі (60-80°С). Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. Схема реакції VII Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції VII, де R, R2, X і n мають визначені вище значення і R12 є арильною групою, яка може бути незаміщеною або заміщеною як визначено вище. На стадії (1) Схеми реакції VII 1H-iмідазо[4,5с]хінолін-1-іловий спирт Формули XIII алкілюють галогенідом Формули XXXI з одержанням 1Німідазо[4,5-с]хінолін-1-ілового етеру Формули XXXII. Сполуку Формули XIII і галогенід Формули XXXI об'єднують у двофазній суміші 50% водного розчину гідроксиду натрію і придатного розчинника, такого як дихлорметан, у присутності каталізатора переносу фаз, такого як хлорид бензилтриметиламонію. Реакція може проходити при температурі навколишнього середовища. На стадії (2) Схеми реакції VII 1Н-імідазо[4,5с]хінолін Формули XXXII окислюють, використовуючи спосіб стадії (2) Схеми реакції II, з одержанням 1Н-імідазо[4,5-с]хінолін-5N-оксиду Формули XXXIII. На стадії (3) Схеми реакції VII 1Н-імідазо[4,5с]хінолін-5N-оксид Формули XXXIII вступає в реакцію з трихлорацетилізоціанатом з одержанням 1Німідазо[4,5-с]хінолін-4-ілтрихлорацетаміду Формули XXXIV. Переважно, ізоціанат контрольовано додають при температурі навколишнього середовища до розчину 5Ν-оксиду у придатному розчиннику, такому як дихлорметан. На стадії (4) Схеми реакції VII 1Н-імідазо[4,5с]хінолін-4-ілтрихлорацетамід Формули XXXIV гідролізують з одержанням 1Н-імідазо[4,5с]хінолін-4-аміну Формули XXXV, яка є підвидом Формули II. Гідроліз можна проводити відомими методиками, переважно шляхом обробки розчину сполуки Формули XXXIV в метанолі метоксидом натрію. На стадії (5) Схеми реакції VII 1Н-імідазо[4,5с]хінолін-4-амін Формули XXXV конденсують з галогенідом формули Hal-R12 застосовуючи каталізатор на основі перехідного металу з одержанням 1Н-імідазо[4,5-с]хінолін-4-аміну Формули XXXVI, яка є підвидом Формули II. Переважно, сполуку Формули XXXV об'єднують з галогенідом у присутності йодиду міді (І), дихлорбіс(трифенілфосфін)паладію (II) і надлишкового триетиламіну у придатному розчиннику, такому як Ν,Ν-диметилформамід або ацетонітрил. Реакцію Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції VIII, де R, R2, R12, X і n мають визначені вище значення і ВОС є трет-бутоксикарбонілом. На стадії (1) Схеми реакції VIII аміногрупу 1-Німідазо[4,5-с]хінолін-4-аміну Формули XXXV захищають двома трет-бутоксикарбонільними групами. Сполуку Формули XXXV об'єднують із ди-третбутил дикарбонатом у придатному розчиннику, такому як Ν,Ν-диметилформамід, у присутності 4(диметиламіно)піридину і триетиламіну. Реакцію проводять при підвищеній температурі (80-85°С). На стадії (2) Схеми реакції VIII захищений 1Німідазо[4,5-с]хінолін-4-амін Формули XXXVII конденсують з галогенідом формули Hal-R12 застосовуючи каталізатор на основі перехідного металу з одержанням захищеного 1Н-імідазо[4,5-с]хінолінаміну Формули XXXVIII. Переважно, сполуку Формули XXXVII об'єднують з галогенідом у присутності йодиду міді (І), дихлорбіс(трифенілфосфін)паладію (II) і надлишкового триетиламіну у придатному розчиннику, такому як Ν,Ν-диметилформамід або ацетонітрил. Реакцію можна проводити при температурі навколишнього середовища або при підвищеній температурі (4080°С). На стадії (3) Схеми реакції VIII захисні групи видаляють шляхом гідролізу у кислотних умовах з одержанням 1Н-імідазо[4,5-с]хінолін-4-аміну Формули XXXVI, яка є підвидом Формули II. Переваж 23 75622 24 но, сполуку Формули XXXVIII оброблюють триаміну Формули XLII. фтороцтовою кислотою у придатному розчиннику, Переважно, сполуку Формули XLI об'єднують з такому як дихлорметан. Реакція може проходити галогенідом у присутності йодиду міді (І), дихлорпри температурі навколишнього середовища або біс(трифенілфосфін)паладію (II) і надлишкового при зниженій температурі (0°С). Продукт або його триетиламіну у придатному розчиннику, такому як фармацевтично прийнятну сіль можна виділити за Ν,Ν-диметилформамід або ацетонітрил. Реакцію допомогою відомих методик. можна проводити при температурі навколишнього На стадії (4) Схеми реакції VIII алкіновий зв'ясередовища або при підвищеній температурі (40зок захищеного 1Н-імідазо[4,5-с]хінолін-4-аміну 80°С). Формули XXXVII відновлюють з одержанням заНа стадії (3) Схеми реакції IX захисні групи вихищеного 1Н-імідазо[4,5-с]хінолін-4-аміну Формули даляють шляхом гідролізу з одержанням 1HXXXIX. Переважно, відновлення проводять викоімідазо[4,5-с]хінолін-4-аміну Формули XXXVI, яка є ристовуючи відомий гетерогенний каталізатор гідпідвидом Формули II. Переважно, сполуку Формурування, такий як оксид платини, платина на вули XLII оброблюють метоксидом натрію у придатгіллі або паладій на вугіллі. Реакцію зручно ному розчиннику, такому як метанол. Реакція може проводити на апараті Парра у придатному розчинпроходити при температурі навколишнього серенику, такому як метанол. довища. Продукт або його фармацевтично прийнНа стадії (5) Схеми реакції VIII захисні групи ятну сіль можна виділити за допомогою відомих сполуки Формули XXXIX видаляють таким же чиметодик. ном як на стадії (3) з одержанням 1Н-імідазо[4,5На стадії (4) Схеми реакції IX захисні групи с]хінолін-4-аміну Формули XL, яка є підвидом Фосполуки Формули XLII видаляють шляхом гідрогермули І. Продукт або його фармацевтично прийнянолізу і алкіновий зв'язок відновлюють з одержантну сіль можна виділити за допомогою відомих ням 1H-імідазо[4,5-с]хінолін-4-аміну Формули XL, методик. яка є підвидом Формули І. Переважно, гідрогеноліз/відновлення проводять, застосовуючи гідрокСхема реакції VIII сид паладію на вугіллі. Реакцію можна зручно проводити на апараті Парра у придатному розчиннику, такому як метанол. Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. Схема реакції IX Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції IX, де R, R2, R12, X і n мають визначені вище значення і CBZ є бензилоксикарбонілом. На стадії (1) Схеми реакції IX аміногрупу 1Hiмідазо[4,5-с]хінолін-4-аміну Формули XXXV захищають бензилоксикарбонільними групами. Сполуку Формули XXXV об'єднують з дибензил дикарбонатом у придатному розчиннику, такому як Ν,Νдиметилформамід. Реакцію можна проводити при температурі навколишнього середовища або при помірному нагріванні (40°С). На стадії (2) Схеми реакції IX захищений 1Hімідазо[4,5-с]хінолін-4-амін Формули XLI конденсують галогенідом формули Hal-R12 застосовуючи каталізатор на основі перехідного металу з одержанням захищеного 1Н-імідазо[4,5-с]хінолін-4 Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції X, де R, R1, R2, X і n мають визначені вище значення. На стадії (1) Схеми реакції X 2,4-дихлор-3нітрохінолін Формули XLII вступає в реакцію з аміном Формули R1-O-X-NH2 з одержанням 2-хлор-3нітрохінолін-4-аміну Формули XLIV. Реакцію можна проводити шляхом додавання аміну до розчину сполуки Формули XLIII у придатному розчиннику, такому як хлороформ або дихлорметан, і, необов'язково, нагрівання. Багато хінолінів Формули 25 75622 26 XLIII є відомими або можуть бути одержані шляцитовані тут посилання. хом відомих методів синтезу [див, наприклад, Andre et al., патент Сполучених Штатів №4,988,815 Схема реакції XI і цитовані тут посилання]. На стадії (2) Схеми реакції X 2-хлор-3нітрохінолін-4-амін Формули XLIV відновлюють, використовуючи спосіб стадії (2) на Схемі реакції VI, з одержанням 2-хлорхінолін-3,4-діаміну Формули XLV. На стадії (3) Схеми реакції X 2-хлорхінолін-3,4діамін Формули XLV циклізують, використовуючи Сполуки згідно з даним винаходом можуть спосіб стадії (3) на Схемі реакції VI, з одержанням одержувати відповідно до Схеми реакції XII, де R, 4-хлор-1Н-імідазо[4,5-фіноліну Формули XLVI. R1, R2, X і n мають визначені вище значення. На стадії (4) Схеми реакції X 4-хлор-1HНа стадії (1) Схеми реакції XII 4iмідазо[4,5-с]хінолін Формули XLVI амінують з нітротетразоло[1,5-а]хінолін-5-ол Формули XLIX одержанням 1H-імідазо[4,5-с]хінолін-4-аміну Форхлорують з одержанням 5-хлор-4мули І. Реакцію проводять шляхом нагрівання (нанітротетразоло[1,5-а]хіноліну Формули L. Можуть приклад,125-175°С) сполуки Формули XLVI під використовуватись придатні хлоруючі агенти. Петиском у герметичному реакторі у присутності розреважно, реакцію проводять застосовуючи оксихчину аміаку в спирті. Продукт або його фармацевлорид фосфору у придатному розчиннику, такому тично прийнятну сіль можна виділити за допомояк Ν,Ν-диметилформамід. 4-Нітротетразоло[1,5гою відомих методик. а]хінолін-5-оли Формули XLIX є відомими або можуть бути одержані шляхом відомих методів синСхема реакції X тезу [див, наприклад, Gerster, et al., патент Сполучених Штатів №5,741,908 і цитовані тут посилання]. На стадії (2) Схеми реакції XII 5-хлор-4нітротетразоло[1,5-а]хінолін Формули L вступає в реакцію з аміном Формули R1-O-X-NH2 з одержанням 4-нітротетразоло[1,5-а]хінолін-5-аміну Формули LI. Реакцію можна проводити шляхом додавання аміну до розчину сполуки Формули L у придатному розчиннику, такому як дихлорметан, у присутності триетиламіну. На стадії (3) Схеми реакції XII 4нітротетразоло[1,5-а]хінолін-5-амін Формули LI відновлюють, використовуючи спосіб стадії (2) на Схемі реакції VI, з одержанням тетразоло[1,5а]хінолін-4,5-діаміну Формули LII. На стадії (4) Схеми реакції XII тетразоло[1,5а]хінолін-4,5-діамін Формули LII циклізують, використовуючи спосіб стадії (3) на Схемі реакції VI, з одержанням 6H-імідазо[4,5-с]тетразоло[1,5Сполуки згідно з даним винаходом можуть а]хіноліну Формули LIII. одержувати відповідно до Схеми реакції XI, де R, На стадії (5) Схеми реакції XII 6Н-імідазо[4,5R1, R2, X і n мають визначені вище значення. с]тетразоло[1,5-а]хінолін Формули LII відновлюють На Схемі реакції XI 1H-імідазо[4,5-с]хінолін-4з одержанням 1H-імідазо[4,5-с]хінолін-4-аміну Фоамін Формули XLVII алкілюють галогенідом Форрмули І. Стадія (5) включає (і) реакцію сполуку мули XLVIII з одержанням 1H-імідазо[4,5-с]хінолінФормули LIII з трифенілфосфіном з наступним (іі) 4-аміну Формули І. Сполука Формули XLVII встугідролізом. Частину (і) можна проводити шляхом пає в реакцію з гідридом натрію у придатному розоб'єднання сполуки Формули LIII з трифенілфосчиннику, такому як Ν,Ν-диметилформамід. До реафіном у придатному розчиннику, такому як 1,2кційної суміші потім додають галогенід. Реакцію дихлорбензол, і нагрівання. Частина (іі) включає можна проводити при підвищеній температурі 1 гідроліз продукту з частини (і). Гідроліз можна про(~100°С). Алкілювання проходить як на N , так і на водити відомими методиками, такими як нагріванN3 атомах азоту; однак, бажаний 1-ізомер можна ня у присутності води або нижчого алканолу, нелегко відділити від 3-ізомеру застосовуючи відомі обов'язково, у присутності каталізатора, такого як методики, такі як колонкова хроматографія і перегідроксид лужного металу або нижчий алкоксид. кристалізація. Продукт або його фармацевтично прийнятну сіль Багато 1Н-імідазо[4,5-с]хінолін-4-амінів Форможна виділити за допомогою відомих методик. мули XLVII є відомими; інші можуть бути одержані шляхом відомих методів синтезу, див, наприклад, Gerster, патент Сполучених Штатів №5,756,747 і 27 Схема реакції XII Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції XIII, де R, R2, R12, X і n мають визначені вище значення. На стадії (1) Схеми реакції XIII 1H-імідазо[4,5с]хінолін-1-іловий етер Формули XXXII конденсують з галогенідом Формули Hal-R12, використовуючи спосіб стадії (5) на Схемі реакції VII, з одержанням 1H-імідазо[4,5-с]хінолін-1-ілового етеру Формули LIV. На стадії (2) Схеми реакції XIII 1Н-імідазо[4,5фінолін-1-іловий етер Формули LIV окислюють, використовуючи спосіб стадії (2) на Схемі реакції II, з одержанням 1H-імідазо[4,5-с]хінолін-5N-оксиду Формули LV. На стадії (3) Схеми реакції XIII 1H-імідазо[4,5с]хінолін-5N-оксид Формули LV амінують, використовуючи спосіб стадії (3) на Схемі реакції II, з одержанням 1Н-імідазо[4,5-с]хінолін-4-аміну Формули XXXVI, яка є підвидом Формули II. Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. Схема реакції XIII Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції XIV, де R, 75622 28 R2, R12, X і n мають визначені вище значення. На стадії (1) Схеми реакції XIV алкіновий зв'язок 1H-імідазо[4,5-с]хінолін-1-ілового етеру Формули LIV відновлюють, використовуючи спосіб стадії (4) Схеми реакції VIII, з одержанням 1Німідазо[4,5-с]хінолін-1-ілового етеру Формули LVI. На стадії (2) Схеми реакції XIV 1H-імідазо[4,5с]хінолін-1-іловий етер Формули LVI окислюють, використовуючи спосіб стадії (2) на Схемі реакції II, з одержанням 1H-імідазо[4,5-с]хінолін-5N-оксиду Формули LVII. На стадії (3) Схеми реакції XIV 1H-імідазо[4,5с]хінолін-5N-оксид Формули LVII амінують, використовуючи спосіб стадії (3) на Схемі реакції II, з одержанням 1Н-імідазо[4,5-с]хінолін-4-аміну Формули XL, яка є підвидом Формули І. Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. Схема реакції XIV Тетрагідроімідазохіноліни згідно з даним винаходом можуть одержувати відповідно до Схеми реакції XV, де R, R2, R12, X і n мають визначені вище значення. На стадії (1) Схеми реакції XV 4-аміно-6,7,8,9тетрагідро-1H-імідазо[4,5-с]хінолін-1-іловий спирт Формули XXIV алкілюють, використовуючи спосіб, описаний на Схемі реакції V, галогенідом Формули НаІ-(СН2)1-10-СН=СН з одержанням 6,7,8,9тетрагідро-1Н-імідазо[4,5-с]хінолін-4-аміну Формули LVIII, яка є підвидом Формули IV. На стадії (2) Схеми реакції XV 6,7,8,9тетрагідро-1H-імідазо[4,5-с]хінолін-4-амін Формули LVIII конденсують, використовуючи спосіб стадії (5) Схеми реакції VII, з галогенідом Формули HalR12 з одержанням 6,7,8,9-тетрагідро-1Німідазо[4,5-с]хінолін-4-аміну Формули LIX, яка є підвидом Формули IV. Продукт або його фармацевтично прийнятну сіль можна виділити за допомогою відомих методик. 29 75622 30 Схема реакції XV Сполуки згідно з даним винаходом можуть одержувати відповідно до Схеми реакції XVI, де R, R1, R2, X і n мають визначені вище значення. На стадії (1) Схеми реакції XVI 2,4-дигідрокси3-нітро-6,7,8,9-тетрагідрохінолін Формули LX хлорують з одержанням 2,4-дихлор-3-нітро-6,7,8,9тетрагідрохіноліну Формули LXI. Можуть застосовуватись відомі хлоруючі агенти. Переважно, реакцію проводять шляхом об'єднання сполуки Формули LX з оксихлоридом фосфору з наступним нагріванням (55-65°С). Сполуки Формули LX є відомими або можуть бути одержані шляхом відомих методів синтезу [див, наприклад, Nikolaides et al,. патент Сполучених Штатів 5,352,784 і цитовані тут посилання]. На стадії (2) Схеми реакції XVI 2,4-дихлор-3нітро-6,7,8,9-тетрагідрохінолін Формули LXI вступає в реакцію з аміном Формули R1-O-X-NH2 з одержанням 2-хлор-3-нітро-6,7,8,9тетрагідрохінолін-4-аміну Формули LXII. Реакцію можна проводити шляхом додавання аміну до розчину сполуки Формули LXI у придатному розчиннику, такому як Ν,Ν-диметилформамід, і нагрівання (55-65°С). На стадії (3) Схеми реакції XVI 2-хлор-3-нітро6,7,8,9-тетрагідрохінолін-4-амін Формули LXII вступає в реакцію з фенолом, використовуючи спосіб стадії (4) Схеми реакції IV, з одержанням 2фенокси-3-нітро-6,7,8,9-тетрагідрохінолін-4-аміну Формули LXIII. На стадії (4) Схеми реакції XVI 2-фенокси-3нітро-6,7,8,9-тетрагідрохінолін-4-амін Формули LXIII відновлюють, використовуючи спосіб стадії (2) Схеми реакції VI, з одержанням 1-фенокси6,7,8,9-тетрагідрохінолін-3,4-діаміну Формули LXIV. На стадії (5) Схеми реакції XVI 2-фенокси6,7,8,9-тетрагідрохінолін-3,4-діамін Формули LXIV циклізують, використовуючи спосіб стадії (3) Схеми реакції VI, з одержанням 4-фенокси-6,7,8,9тетрапдро-1Н-імідазо[4,5-с]хіноліну Формули LXV. На стадії (6) Схеми реакції XVI 4-фенокси6,7,8,9-тетрагідро-1H-імідазо[4,5-с]хінолін Формули LXV амінують, використовуючи спосіб стадії (7) Схеми реакції IV, з одержанням 6,7,8,9-тетрагідро1H-імідазо[4,5-с]хінолін-4-аміну Формули III. Схема реакції XVI Винахід також стосується нових сполук, корисних у якості проміжних сполук при синтезі сполук Формул (І), (II), (III) і (IV). Ці проміжні сполуки мають структурні формули (V)-(IX), які детально описані нижче. Один клас проміжних сполук має формулу (V): в якій: X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; -R4-арилу; і -(CH2)1-10-C=C-R10; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y- алкенілу; -алкіл-Y-арилу; і - алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -CO-N(R3)2; 31 75622 32 -CO-С1-10 алкілу; перериватись одною або більшою кількістю -О-СО-О-С1-10 алкілу; груп; -N3; кожний R3 є, незалежно, Η або С1-10 алкілом; -арилу; R10 вибраний з групи, яка складається з Н, ал-гетероарилу; кілу, алкенілу і арилу; -гетероциклілу; кожний Υ є, незалежно, -О- або -S(O)0-2-; -СО-арилу; і n є від 0 до 4; і -СО-гетероарилу; кожний присутній R, незалежно, вибраний з R4 є алкілом або алкенілом, який може перегрупи, яка складається з С1-10 алкілу, С1-10 алкокси, риватись одною або більшою кількістю -О-груп; гідрокси, галогену і трифторметилу; кожний R3 є, незалежно, Η або С1-10 алкілом; або її фармацевтично прийнятна сіль. R10 вибраний з групи, яка складається з Н, алІнший клас проміжних сполук є сполуками імікілу, алкенілу і арилу; дазохінолін-N-оксидів формули (VII): кожний Υ є, незалежно, -О- або -S(O)0-2; n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; або її фармацевтично прийнятна сіль. Інший клас проміжних сполук є сполуками імідазохінолін-4-фенокси формули (VI): в якій: X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; -R4-арилу; і -(CH2)1-10-C=C-R10; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -арилу; -гетероарилу; -гетероциклілу; -алкіл-Y-алкілу; -алкіл-Y-алкенілу; алкіл-Y-арил; і - алкілу або алкенілу, заміщеного однією або більшою кількістю замісників, вибраних з групи, яка складається з: -ОН; -галогену; -N(R3)2; -CO-N(R3)2; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу; і -СО-гетероарилу; R4 є алкілом або алкенілом, кожен з яких може в якій: X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; -R4-арилу; і -(СН2)1-10-С=С-R10; R4 є алкілом або алкенілом, кожен з яких може перериватись одною або більшою кількістю -Огруп; кожний R3 є, незалежно, Η або С1-10 алкілом; R10 вибраний з групи, яка складається з Н, алкілу, алкенілу і арилу; n є від 0 до 4; і кожний присутній R, незалежно, вибраний з групи, яка складається з С1-10 алкілу, С1-10 алкокси, гідрокси, галогену і трифторметилу; або її фармацевтично прийнятна сіль. Додатковий клас проміжних сполук має формулу (VIII): в якій: X є -CHR3-, -CHR3-алкіл-, або -CHR3-алкеніл-; R1 вибраний з групи, яка складається з: -арилу; -алкенілу; -R4-арилу; і -(CH2)1-10-C=C-R10; R2 вибраний з групи, яка складається з: -водню; -алкілу; 33 75622 34 -алкенілу; яка складається з: -арилу; -ОН; -гетероарилу; -галогену; -гетероциклілу; -N(R3)2; -алкіл-Y-алкілу; -CO-N(R3)2; -алкіл-Υ-алкенілу; -СО-С1-10 алкілу; -алкіл-Y-арилу; і -СО-О-С1-10 алкілу; - алкілу або алкенілу, заміщеного однією або -N3; більшою кількістю замісників, вибраних з групи, -арилу; яка складається з: -гетероарилу; -ОН; -гетероциклілу; -галогену; -СО-арилу; і -N(R3)2; -СО-гетероарилу; -CO-N(R3)2; R4 є алкілом або алкенілом, який може пере-СО-С1-10 алкілу; риватись одною або більшою кількістю -О-груп; -СО-О-С1-10 алкілу; кожний R3 є, незалежно, Η або С1-10 алкілом; -N3; кожний Υ є, незалежно, -О- або -S(O)0-2-; -арилу; n є від 0 до 4; і -гетероарилу; кожний присутній R, незалежно, вибраний з -гетероциклілу; групи, яка складається з С1-10 алкілу, С1-10 алкокси, -СО-арилу; і гідрокси, галогену і трифторметилу; або її фарма-СО-гетероарилу; цевтично прийнятна сіль. R4 є алкілом або алкенілом, який може переЯк вони тут вживаються, терміни "алкіл", "алриватись одною або більшою кількістю -О-груп; кеніл" і префікс "алк-" включають групи як з нерозкожний R3 є, незалежно, Η або С1-10 алкілом; галужними, так і з розгалуженими ланцюгами, а R10 вибраний з групи, яка складається з Н, алтакож циклічні групи, тобто циклоалкіл та циклоалкілу, алкенілу і арилу; кеніл. Якщо не зазначено інше, ці групи містять від кожний Υ є, незалежно, -О- або -S(O)0-2-; 1 до 20 атомів вуглецю, причому алкенільні групи n є від 0 до 4; містять від 2 до 20 атомів вуглецю. Переважні грукожний присутній R, незалежно, вибраний з пи мають загалом до 10 атомів вуглецю. Циклічні групи, яка складається з С1-10 алкілу, С1-10 алкокси, групи можуть бути моноциклічними, або поліциклігідрокси, галогену і трифторметилу; і чними, переважно мають від 3 до 10 атомів вуглеR7 є трет-бутилом або бензилом; цю кільця. У якості прикладу, циклічні групи вклюабо її фармацевтично прийнятна сіль. чають циклопропіл, циклопентил, циклогексил, Наступний клас проміжних сполук є сполуками циклопропілметил та адамантил. імідазохінолін-4-хлору формули (IX) Крім того, алкільні та акенільні частини -Xгруп можуть бути незаміщеними або заміщеними одним або більшою кількістю замісників, такі замісники вибрані з групи, яка складається з алкілу, алкенілу, арилу, гетероарилу, гетероциклілу, арилалкілу, гетероарилалкілу і гетероциклілалкілу. Термін "галоалкіл" включає групи, заміщені одною або більшою кількістю атомів галогену, включно з перфторованими групами. Термін також визначає групи, які включають префікс "гало". Прикладами придатних галоалкільних груп є хлорметил, трифторметил, і тому подібні. Термін "арил" як він вживається тут включає в якій: карбоциклічні ароматичні кільця або циклічні сисX є -CHR3-, -СНR3-алкіл-, або -CHR3-алкеніл-; теми. Прикладами арильних груп є феніл, нафтил, R1 вибраний з групи, яка складається з: дифеніл, фтореніл і інденіл. Термін "гетероарил" -арилу; включає ароматичні кільця чи циклічні системи, які -алкенілу; містять принаймні один гетероатом (наприклад, О, -R4-арилу; і S, N). Придатні гетероарильні групи включають -(СН2)1-10-С=СН; фурил, тієніл, піридил, хінолініл, ізохінолініл, індоR2 вибраний з групи, яка складається з: ліл, ізоіндоліл, тріазоліл, піроліл, тетразоліл, іміда-водню; золіл, піразоліл, оксазоліл, тіазоліл, бензофураніл, -алкілу; бензотіофеніл, карбазоліл, бензоксазоліл, піримі-алкенілу; диніл, хіноксалініл, бензімідазоліл, бензотіазоліл, -арилу; нафтиридиніл, ізоксазоліл, ізотіазоліл, хіназолініл, -гетероарилу; пуриніл і так далі. -гетероциклілу; "Гетероцикліл" включає неароматичні кільця -алкіл-Y-алкілу; або циклічні системи, які містять принаймні один -алкіл-Y- алкенілу; гетероатом (наприклад, О, S, N) і включає повніс-алкіл-Y-арилу; і тю насичені і частково ненасичені похідні будь-якої - алкілу або алкенілу, заміщеного однією або з вищезазначених гетероарильних груп. Приклабільшою кількістю замісників, вибраних з групи, 35 75622 36 дами гетероциклічних груп є піролідиніл, тетрагідсполуки згідно з даним винаходом, яка описана рофураніл, морфолініл, тіоморфолініл, піперидивище, у комбінації з фармацевтично прийнятним ніл, піперазиніл, тіазолідиніл, імідазолідиніл, ізотіносієм. азолідиніл і тому подібні. Термін "терапевтично ефективна кількість" Арильні, гетероарильні і гетероциклічні групи означає кількість сполуки, достатню для одержанможуть бути незаміщеними, або заміщеними одня терапевтичного ефекту, такого як індукування ним або більшою кількістю замісників, незалежно, цитокіну, протипухлинна активність та/або антивівибраних з групи, яка складається з алкілу, алкокрусна активність. Хота точна кількість активної сиу, алкілтіо, галоалкілу, галоалкокси, галоалкілсполуки, яка застосовується в фармацевтичних тіо, галогену, нітро, гідрокси, меркапто, ціано, каркомпозиціях згідно з даним винаходом, буде різнибокси, формілу, арилу, арилокси, арилтіо, тись через фактори, відомі фахівцям у цій галузі, арилалкокси, арилалкілтіо, гетероарилу, гетероатакі як фізична та хімічна природа сполуки, прирорилокси, гетероарилтіо, гетероарилалкокси, гетеда носія, передбачений режим дозування, передроарилалкілтіо, аміно, алкіламіно, діалкіламіно, бачається, що композиції згідно з даним винахогетероциклілу, гетероциклоалкілу, алкілкарбонілу, дом будуть містити достатньо активного алкенілкарбонілу, алкоксикарбонілу, галоалкілкарінгредієнта з одержанням дози від приблизно бонілу, галоалкоксикарбонілу, алкілтіокарбонілу, 100нг/кг до приблизно 50мг/кг, переважно від приарилкарбонілу, гетероарилкарбонілу, арилоксикаблизно 10мкг/кг до приблизно 5мг/кг сполуки, що є рбонілу, гетероарилоксикарбонілу, арилтіокарбопредметом розгляду. нілу, гетероарилтіокарбонілу, алканоїлокси, алкаМоже бути застосована будь-яка з відомих ноїлтіо, алканоїламіно, ароїлокси, ароїлтіо, форм дозування, така як таблетки, пігулки, паренароїламіно, алкіламіносульфонілу, алкілсульфонітеральні рецептури, сиропи, креми, мазі, аерозолу, арилсульфонілу, гетероарилсульфонілу, алкілльні рецептури, трансдермальні пластирі, транскарбоніламіно, алкенілкарбоніламіно, арилкарбомукозальні пластирі і тому подібне. ніламіно, арилалкілкарбоніламіно, Сполуки згідно з даним винаходом можуть гетероарилкарбоніламіно, гетероарилалкілкарбопризначатись у вигляді окремого терапевтичного ніламіно, алкілсульфоніламіно, алкенілсульфоніагента у режимі лікування, або сполуки згідно з ламіно, арилсульфоніламіно, арилалкілсульфоніданим винаходом можуть призначатись у комбіналаміно, гетероарилсульфоніламіно, ції одна з іншою, або з іншим активним агентом, гетероарилалкілсульфоніламіно, алкіламінокарбовключно з додатковими модифікаторами імунної ніламіно, алкеніламінокарбоніламіно, ариламіновідповіді, антивірусними засобами, антибіотиками і карбоніламіно, арилалкіламінокарбоніламіно, гет.д. тероариламінокарбоніламіно, Було показано, що сполуки згідно з даним вигетероарилалкіламінокарбоніламіно, і, у випадку находом індукують вироблення деяких цитокінів гетероциклілу, оксо. Якщо будь-які інші групи випід час експериментів, проведених відповідно до значені як "заміщені" або "необов'язково, заміщеописаних нижче тестів. Ці результати вказують на ні", тоді такі групи можуть також бути заміщеними те, що сполуки є корисними в якості модифікаторів одним або більшою кількістю перелічених вище імунної відповіді, що можуть модифікувати імунну замісників. відповідь різним чинним, що вважається корисним Деякі замісники є загалом переважними. Напри лікуванні ряду розладів. приклад, R4-арил є переважною R1 групою, і переЦитокіни, вироблення яких може бути індуковажними R10 групами є алкіл і арил, причому феніл ване шляхом введення сполук згідно з даним виабо заміщений феніл є переважною арильною находом, загалом включають інтерферон- (IFN- ) групою. Переважно, R замісники відсутні (тобто, n і/або фактор некрозу пухлини- (TNF- ), а також є 0). Переважними R2 групами є водень, алкільні деякі інтерлейкіни. Цитокіни, біосинтез яких може групи, які мають 1-4 атоми вуглецю (тобто, метил, бути індуковано сполуками згідно з даним винахоетил, пропіл, ізопропіл, н-бутил, втор-бутил, ізобудом, включають IFN- , TNF- , IL-1, IL-6, IL-10 і ILтил і циклопропілметил), метоксиетил і етоксиме12 і різні інші цитокіни. Поміж інших ефектів, ці та тил. Для заміщених груп, таких як заміщені алкільінші цитокіни можуть інгібувати вироблення вірусу ні або заміщені арильні групи, переважними та ріст клітин пухлини, що робить сполуки корисзамісниками є галоген, нітрил, нітро, карбокси, ними при лікуванні вірусних захворювань і пухлин. метокси, метилтіо, трифторметил і трифторметокВідповідно, винахід включає спосіб індукування си. Один або більша кількість цих замісників, якщо біосинтезу цитокіну у тварин, який включає ввеприсутні, можуть бути присутніми у сполуках згідно дення ефективної кількості сполуки, або композиції з даним винаходом у будь-якій комбінації. згідно з даним винаходом тварині. Винахід включає описані тут сполуки у будьБуло виявлено, що деякі сполуки згідно з даякій з їх фармацевтично прийнятних форм, вклюним винаходом є переважними при індукуванні чаючи ізомери (наприклад, діастереомери і енанекспресії IFN- у популяції гематопоетичних клітіомери), солі, сольвати, поліморфи і тому подібне. тин, таких як МКПК (мононуклеарні клітини периЗокрема, якщо сполука є оптично активною, винаферійної крові), які містять клітини pDC2 (дендрихід особливо включає кожний з енантіомерів спочні клітини прекурсору типу 2), без супутнього луки, а також рацемічні суміші енантіомерів. вироблення значного рівня запальних цитокінів. Фармацевтичні композиції і біологічна активКрім здатності індукувати вироблення цитокіність нів, сполуки з даним винаходом негативно вплиФармацевтичні композиції згідно з даним вивають на інші аспекти вродженої імунної відповіді. находом містять терапевтично ефективну кількість Наприклад, може стимулюватись активність при 37 75622 38 родних клітин-вбивць, такого ефекту можна досягстимулювати заживления ран, включаючи хронічні ти за допомогою індукування цитокіну. Сполуки рани. Сполуки можуть бути корисними для лікуможуть також активувати макрофаги, які, в свою вання опортунистичних інфекцій та пухлин, які чергу, стимулюють секрецію окису азоту і виробвиникають після пригнічення обумовленого клітилення додаткових цитокінів. До того ж, сполуки нами імунітету у, наприклад, пацієнтів, яким робможуть викликати проліферацію та диференціацію лять пересадку, раковим пацієнтам та ВІВ інфікоВ-лімфоцитів. ваним пацієнтам. Сполуки згідно з даним винаходом також маКількістю сполуки, ефективною для індукуванють вплив на набуту імунну відповідь. Наприклад, ня біосинтезу цитокіну, є кількість, достатня для хоча відсутній певний прямий вплив на Т-клітини, примушення одного або більшої кількості типів або безпосереднє індукування цитокінів Т-клітин, клітин, таких як моноцити, макрофаги, дендричних опосередковано індукується вироблення Τ допоклітин та В-клітин, виробляти певну кількість одного або більшої кількості цитокінів, таких як, наприміжного типу 2 (Тh1) цитокіну IFN- та інгібується вироблення Τ допоміжних типу 2 (Th2) цитокінів ILклад, IFN- , TNF- , IL-1, IL-6, IL-10 і IL-12, яка є 4, IL-5 і IL-13 при веденні сполук. Ця активність збільшеною відносно фонового рівню таких цитопередбачає, що сполуки корисні при лікуванні закінів. Точна кількість буде варіюватись в залежнохворювань, при яких є бажаним підвищення інтенсті від факторів, відомих у цій галузі, але передбасивності відповіді Th1 та/або пониження інтенсивчається, що вона складатиме дозу від приблизно ності відповіді Th2. Зважаючи на здатність сполук 100нг/кг до приблизно 50мг/кг, переважно від призгідно з даним винаходом інгібувати імунну відпоблизно 10мкг/кг до приблизно 5мг/кг. відь Тh2, передбачається, що сполуки мають бути Винахід також включає спосіб лікування вірускорисними при лікуванні атопічних захворювань, ної інфекції у тварин та спосіб лікування неопласнаприклад, атопічних дерматитів, астми, алергії, тичного захворювання у тварин, який включає алергічних ринітів; системної червоної вовчанки; у призначення ефективної кількості сполуки або якості вакцинного ад'юванту для обумовленого композиції згідно з даним винаходом тварині. Кільклітинами імунітету; та, можливо, як лікування рекістю, ефективною для лікування або інгібування цидивних грибкових захворювань та хламідіозу. вірусної інфекції, є кількість, яка викличе зменМодифікуюча імунну відповідь дія сполук рошення одного або більше проявів вірусної інфекції, бить їх корисними при лікуванні великої кількості таких як вірусне ураження, вірусне навантаження, станів. Через їх здатність індукувати вироблення рівень вироблення вірусу та смертність у порівнянні з нелікованими контрольними тваринами. цитокінів, таких як IFN- і/або TNF- , сполуки є Точна кількість буде варіюватись через відомі у цій особливо корисними при лікуванні вірусних захвогалузі фактори, але передбачається, що вона рювань і пухлин. Ця імуномодифікуюча активність складатиме дозу від приблизно 100нг/кг до прибнаводить на думку, що сполуки згідно з даним вилизно 50мг/кг, переважно від приблизно 10мкг/кг находом є корисними при лікуванні захворювань, до приблизно 5мг/кг. Кількістю сполуки, ефективтаких як, але не обмежуючись ними, вірусні захвоною для лікування неопластичного стану є кільрювання, включаючи генітальні бородавки; звикість, яка викличе зменшення розміру пухлини, або чайні бородавки; підошовну бородавку; гепатит В; кількість осередків пухлини. Знову, точна кількість гепатит С; вірус звичайного герпесу І і II типів; конбуде варіюватись через відомі у цій галузі фактотагіозний молюск; віспа, особливо майоральна ри, але передбачається, що вона складатиме дозу віспа; ріновірус; аденовірус; грип; парагрип; ВІЛ; від приблизно 100нг/кр до приблизно 50мг/кг, пеЦМВ; ВВВ(вірус вітряної віспи); внутрішньоепітеліреважно від приблизно 10мкг/кг до приблизно альний неоплазіаз, такий як внутрішньоепітеліаль5мг/кг. на неоплазія шийки матки; папіломавірус людини і Винахід далі описується наступними приклавикликані неоплазії; грибкові захворювання, надами, які наведені лише з метою ілюстрації і ніприклад Candida, Aspergillus і криптококовий меніяким чином не призначені для обмеження об'єму. нгіт; непластичні захворювання, наприклад, базаПриклади льно-клітинна карцинома, лейкозний У нижченаведених прикладах деякі сполуки ретікулоендотеліоз, саркома Капоши, карцинома очищували напівпрепаративною ВЕРХ. Були заниркових клітин, плоскоклітинна карцинома, мієлостосовані два різні методи, в яких використовувагенна лейкемія, множинна мієлома, меланома, нели 100 Gilson-6, оснащений інтелектуальним інтеходжкінська лімфома, лімфома шкірних Т-клітин і рфейсом серії 900. Фракції напівпрепаративої інші злоякісні пухлини; паразитарні захворювання, ВЕРХ аналізували шляхом РХ-ХІАТ/МС, і придатні наприклад Pneumocystis carnii, криптоспоридіоз, фракції об'єднували і ліофілізували з одержанням гістоплазмоз, токсоплазмоз, інфекція трипаносотрифторацетату бажаної сполуки. ми, і лейшманіоз; і бактеріальні інфекції, наприМетод А клад туберкульоз і Mycobacterium avium. ДодаткоКолонка: колонка Мікросорб С18, 21,4 250мм, вими захворюваннями або станами, які можуть лікуватись використовуючи сполуки згідно з даним розмір часток 8 мікрон, 60Å пора;швидкість потовинаходом, є актинічний кератоз; екзема; еозиноку: 10мл/хв.; градієнт елюентів з 2-95% В за 25хв., філія; ессенціальна тромбоцитемія; лепра; розсіяпідтримується на 95% В протягом 5хв., де А=0,1% ний склероз; синдром Омена; дискоїдна вовчанка; трифтороцтова кислота/вода і В=0,1% трифтороцхвороба Боуена; боуеноїдній папульоз; алопеція това кислота/ацетонітрил; визначення піку при ареата; інгібування післяопераційних келоїдних 254нм при збиранні фракцій тригеруванням. утворювань та інших видів післяопераційних рубМетод В ців. Крім того, ці сполуки можуть посилювати або Колонка: Феноменекс Капселл ПакС18, 39 75622 40 натрію. Водну фракцію потім декілька разів екстра35 20мм, розмір часток 5; швидкість потоку: гували дихлорметаном. Органічні фракції об'єдну20мл/хв.; градієнт елюентів з 5-95% В за 10хв., вали, сушили над сульфатом магнію, фільтрували підтримується на 95% В протягом 2хв., де А=0,1% і потім концентрували при зниженому тиску з одетрифтороцтова кислота/вода і В=0,1% трифтороцржанням 18,5г 1-[2-(2-пропінілокси)етил]-1Нтова кислота/ацетонітрил; визначення піку при імідазо[4,5-с]хінолін-5N-оксиду у вигляді жовтого 254нм при збиранні фракцій тригеруванням. масла. Приклад 1 ВРМС (ЕСІ) Розраховано для C15H14N3O2 1-[2-(2-Пропінілокси)етил]-1H-імідазо[4,5(МН+) 268,1086, знайдено 268,1098 с]хінолін-4-амін Частина С В атмосфері азоту, трихлорацетилізоціанат (15,5г, 82,2ммоль) додавали по краплях до суміші 1-[2-(2-пропінілокси)етил]-1H-імідазо[4,5-с]хінолін5N-оксиду (18,3г, 68,5ммоль) і дихлорметану (300мл). Спостерігали сильне виділення діоксиду вуглецю. Через приблизно 0,5 години весь матеріал перейшов у розчин. Реакційний розчин залишали перемішуватись на приблизно 1 годину після чого аналіз шляхом ТШХ вказав на присутність невеликої кількості початкового матеріалу. Ще раз Частина А додавали трихлорацетилізоціанат (4,5г). Через 1 2-(1Н-Імідазо[4,5-с]хінолін-1-іл)-1-етанол годину, аналіз шляхом ТШХ вказав на завершення (28,5г, 0,133моль) додавали порціями протягом 1 реакції. Леткі речовини видаляли при зниженому години до суміші гідроксиду натрію (240мл 50% тиску з одержанням N-{1-[2-(2-пропінілокси)етил]розчину), дихлорметану (240мл), пропаргілброміду 1N-імідазо[4,5-с]хінолін-4-іл}-2,2,2(39,6г 80% розчину, 0,266моль) і хлориду бензилттрихлорацетаміду у вигляді блідо-жовтої твердої риметиламонію (2,46г, 0,013ммоль). Одержану речовини. реакційну суміш залишали перемішуватись при Частина D температурі навколишнього середовища протягом Дихлорметан (150мл) додавали до суміші тве16 годин. Шари відділяли. Водну фракцію екстрардої речовини з Частини С і метанолу (200мл), гували додатковою кількістю дихлорметану. Оргавесь матеріал переходив в розчин. Додавали менічні фракції об'єднували, промивали водою, сутоксид натрію (50г 25% розчину в метанолі), розшили над сульфатом магнію і потім концентрували чин залишали перемішуватись при температурі при зниженому тиску. Одержаний залишок об'єднавколишнього середовища на ніч. Одержаний нували з діетиловим етером і суміш залишали осад виділяли шляхом фільтрації. Фільтрат концеперемішуватись. Оранжеву тверду речовину видінтрували до об'єму приблизно 100мл, другу порляли шляхом фільтрації. Цей матеріал перекрисцію осаду виділяли шляхом фільтрації. Дві порції талізовували з етилацетату з одержанням 19,8г 2об'єднували і сушили в вакуумній печі при 60°С (1Н-імідазо[4,5-с]хінолін-1-іл)етил (2-пропініл)протягом 16 годин з одержанням 16,4г 1-[2-(2етеру у вигляді жовтої кристалічної твердої речопропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4-аміну вини, температура плавлення 124-126°С. у вигляді не зовсім білої твердої речовини, темпеАналіз. Розраховано для C15H13N3O: %С, ратура плавлення 225-227°С. 71.70; %Н, 5.21; %N, 16.72. Знайдено: %С, 71.85; Аналіз. Розраховано для Ο15Η14Ν4Ο (Η2Ο)1/4: %Н, 5.25; %N, 16.90 %С, 66,53; %Н, 5,40; %Ν, 20,69. Знайдено: %С, 1 Н ЯМР (300МГц, ДМСО) 9,21 (с, 1Η), 8,44 66,33; %Н, 5,18; %Ν, 21,12. 1 (м, 1Η), 8,36 (с, 1Н), 8,18 (м, 1Н), 7,71 (м, 2 Н), 4,93 Н ЯМР (300МГц, ДМСО) 8,13 (с, 1Η), 8,08 (т, Дж=5,1Гц, 2 Н), 4,14 (д, Дж=2,4Гц, 2 Н), 3,98 (т, (широкий д, Дж=7,8Гц, 1Η), 7,62 (широкий д, Дж=5,1Гц, 2 Н), 3,35 (т, Дж=2,2Гц, 1Н) Дж=8,3Гц, 1Η), 7,44 (широкий т, Дж=7,6Гц, 1Η), ВРМС (ЕСІ) Розраховано для C15H14N3O (MH+) 7,24 (широкий т, Дж=7,5Гц, 1Η), 6,54 (с, 2Η), 4,81 252,1137, знайдено 252,1141 (т, Дж=5,4Гц, 2Η), 4,14 (д, Дж=2,4Гц, 2Η), 3,93 (т, Частина В Дж=5,1Гц, 2 Η), 3,38 (т, Дж=2,4Гц, 1Η). 2-(1H-Імідазо[4,5-с]хінолін-1-іл)етил (2ВРМС (ЕСІ) Розраховано для C15H15N4O (MH+) пропініл) етер (19,7г, 78,4ммоль) і хлороформ 267,1246, знайдено 267,1253. об'єднували і потім охолоджували до 0°С. 3Приклад 2 Хлорпероксибензойну кислоту (15,7г 57-86% роз2-{3-[2-(4-Аміно-1H-імідазо[4,5-с]хінолін-1чину) додавали і суміш залишали перемішуватись іл)етокси]-1-пропініл}бензонітрил на 0,5 години. Суміш залишали нагрітись до температури навколишнього середовища, після чого весь матеріал перейшов у розчин. Аналіз тонкошаровою хроматографією (ТШХ) вказав, що деяка кількість початкового матеріалу все же була присутня, тому ще додавали 3-хлорпероксибензойну кислоту (дві окремі порції по 4г). Через 0,5 години після додавання другої порції, ТШХ вказала на відсутність початкового матеріалу. Реакційний розчин екстрагували 10% розчином гідроксиду 41 Частина А В атмосфері азоту, 1-[2-(2-пропінілокси)етил]1Н-імідазо[4,5-с]хінолін-4-амін (16г, 60,1ммоль), ди-трет-бутил дикарбонат (32,7г, 150ммоль), триетиламін (21мл, 150моль), Ν,Ν-диметилформамід (150мл) і 4-(диметиламіно)піридин (0,1г) об'єднували і нагрівали до 80-85°С. Через приблизно 1 годину суміш ставала однорідною і аналіз шляхом ТШХ вказав на залишок дуже невеликої кількості початкового матеріалу. Розчин нагрівали протягом додаткової години. Розчин розводили етилацетатом і водою. Шари відділяли, і водну фракцію екстрагували етилацетатом. Органічні фракції об'єднували, промивали водою і потім розчином солі, сушили над сульфатом магнію, фільтрували і потім концентрували при зниженому тиску з одержанням блідої оранжево-жовтої твердої речовини. Цей матеріал розтирали з діетиловим етером з одержанням 22,6г N,N-(біс-трет-бутоксикарбоніл)1-[2-(2-пропінілокси)етил]-1H-імідазо[4,5-с]хінолін4-аміну у вигляді не зовсім білої твердої речовини, температура плавлення 139-142°С. Аналіз. Розраховано для C25H30N4O5: %С, 64,36; %Н, 6,48; %N, 12,01. Знайдено: %С, 64,40; %Н, 6,43; %N, 12,06. 1 Н ЯМР (300МГц, ДМСО) 8,44 (м, 1Н), 8,35 (с, 1Н), 8,08 (м, 1Н), 7,73 (м, 2Н), 4,94 (т, Дж=4,9Гц, 2Η), 4,12 (д, Дж=2,4Гц, 2Η), 3,98 (т, Дж=5,1Гц, 2Η), 3,31 (т, Дж=2,4Гц, 1Н), 1,34 (с, 18Η). ВРМС (ECI) розрах. для С25Н30N4О5 (МН+) 467,2294, знайдено 467,2307. Частина В В атмосфері азоту, 2-йодбензонітрил (0,54г, 2,35ммоль), дихлорбіс(трифенілфосфін)паладій(ІІ) (0,09г, 0,13ммоль), і йодид міді (І) (0,05г, 0,26ммоль) додавали до суміші N,N-(біс-третбутоксикарбоніл)-1-[2-(2-пропінілокси)етил]-1Hімідазо[4,5-фінолін-4-аміну (1,0г, 2,14ммоль) і безводного Ν,Ν-диметилформаміду (25мл). Через 2 години реакційну суміш повільно заливали у воду. Одержаний осад збирали і сушили при 35°С протягом 16 годин з одержанням 1,18г 2-(3-{2-[4-(бістрет-бутоксикарбоніл)аміно-1Н-імідазо[4,5с]хінолін-1-іл]етокси}-1-пропініл)бензонітрилу у вигляді твердої речовини. 1 Н ЯМР (300МГц, ДМСО) 8,47 (д, Дж=6,8Гц, 1Η), 8,39 (с, 1Η), 8,06 (д, Дж=7,8Гц, 1Η), 7,87 (д, Дж=7,3Гц, 1Н), 7,40-7,80 (м, 4Н), 7,34 (д, Дж=7,3Гц, 1Η), 5,00 (широкий с, 2Н), 4,47 (широкий с, 2Н), 4,13 (с, 2Н), 1,31 (с, 18Н). ВРМС (ЕСІ) Розраховано для C32H34N5O5 (МН+) 568,2560, знайдено 568,2565. Частина С 75622 42 Трифтороцтову кислоту (20мл) додавали до розчину матеріалу з Частини В в дихлорметані (20мл). Через 4 години реакційну суміш розводили дихлорметаном, який містив невелику кількість метанолу і 20% розчин гідроксиду натрію. Шари відділяли. Водну фракцію екстрагували дихлорметаном. Органічні фракції об'єднували, сушили над сульфатом магнію, фільтрували і потім концентрували при зниженому тиску з одержанням жовтого порошку. Цей матеріал очищували флешхроматографією елююючи сумішшю 9/1 дихлорметан/метанол з одержанням 0,48г 2-{3-[2-(4-аміно1H-імідазо[4,5-с]хінолін-1-іл)етокси]-1пропініл}бензонітрилу у вигляді жовтого порошку, температура плавлення 180-183°С. Аналіз. Розраховано для C22H17N5O·(Н2О)2/5: %С, 70,54; %Н, 4,79; %N, 18,70. Знайдено: %С, 70,61; %Н, 4,75; %N, 18,70 1 Н ЯМР (300МГц, ДМСО) 8,19 (с, 1 Η), 8,12 (д, Дж=8,3Гц, 1Η), 7,88 (д, Дж=7,8Гц, 1Η), 7,55-7,75 (м, 3Η), 7,40-7,50 (м, 2Η), 7,24 (широкий т, Дж=7,5Гц, 1Η), 6,68 (широкий с, 2Η), 4,87 (т, Дж=5,1Гц, 2Η), 4,50 (с, 2Η), 4,09 (т, Дж=5,1Гц, 2Η) Приклад 3 1-{2-[(3-Феніл-2-пропініл)окси]етил}-1Німідазо[4,5-с]хінолін-4-амін В атмосфері азоту, суміш 1-[2-(2пропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4-аміну (10г, 37,6ммоль), безводного Ν,Νдиметилформаміду (150мл) і карбонату калію (6,23г, 45,1ммоль) нагрівали до 70°С. Додавали йодбензол (4,43мл, 39,5ммоль), дихлорбіс(трифенілфосфін)паладій(ІІ) (0,53г, 0,75моль) і йодид міді (І) (0,29г, 1,50ммоль), суміш залишали перемішуватись на 0,5 години. Температура піднялась до приблизно 85°С. Через 1,5 години аналіз шляхом ВЕРХ (обернена фаза, суміш ацетонітрил/вода з 0,1% розчином трифтороцтової кислоти) вказав на завершення реакції. Суміш залишали охолоджуватись до температури навколишнього середовища і потім її фільтрували. Фільтрат концентрували при зниженому тиску. Залишок очищували двічі флеш-хроматографією (95/5 дихлорметан/метанол) з одержанням 2,7г 1{2-[(3-феніл-2-пропініл)окси]етил}-1H-імідазо[4,5с]хінолін-4-аміну у вигляді білої твердої речовини, температура плавлення 196-197°С. Аналіз. Розраховано для C21H18N4O: %C, 73,67; %Н, 5,30; %N, 16,36. Знайдено: %С, 73,29; %Н, 5,23; %N, 16,35. 1 Н ЯМР (300МГц, ДМСО) 8,17 (с, 1Η), 8,12 (д, Дж=7,4Гц, 1Η), 7,63 (дд, Дж=8,3, 0,9Гц, 1Η), 7,44 (т, 43 75622 44 Дж=7,5Гц, 1Η), 7,15-7,40 (м, 6Η), 6,60 (с, 2Η), 4,86 тім розчином солі, сушили над сульфатом магнію, (т, Дж=5,1Гц, 2Η), 4,39 (с, 2Η), 4,03 (т, Дж=5,1Гц,фільтрували і потім концентрували при зниженому 2Η). тиску з одержанням 0,95г N,N-(біс-третВРМС (ΕΘ) Розраховано для C21H18N4O (M+) бутоксикарбоніл)-1-(2-{[3-(4-метоксифеніл)-2342,1481, знайдено 342,1490. пропініл]окси}етил)-1H-імідазо[4,5-с]хінолін-4-аміну Приклад 4 у вигляді оранжевої твердої речовини. Гідрохлорид 1-{2-[(3-Феніл-2ВРМС (ЕІ) Розраховано для C32H36N4O6 (М+) пропініл)окси]етил}-1H-імідазо[4,5-с]хінолін-4-аміну 572,2635, знайдено 572,2635. 1-{2-[(3-Феніл-2-пропініл)окси]етил}-1НЧастина В імідазо[4,5-с]хінолін-4-амін (1,0г, 2,92ммоль) розN,N-(біс-трет-бутоксикарбоніл)-1-(2-{[3-(4чиняли в суміші метанолу (15мл) і дихлорметану метоксифеніл)-2-пропініл]окси}етил)-1Н(5мл). Додавали суміш хлорид водню/діетиловий імідазо[4,5-с]хінолін-4-амін (0,75г, 1,31ммоль), етер (10мл, 1М), реакційний розчин залишали пеетилацетат (25мл) і каталізатор (100мг 5% Pd/C з ремішуватись протягом 16 годин, після чого утво50% водним розчином) об'єднували і потім гідрурився осад. Суміш концентрували при зниженому вали на апараті Парра при 40псі (2,8кг/см2). Реактиску з одержанням твердої речовини. Цей матеція не відбулась. Додавали оксид платини (150мг) і ріал перекристалізовували з ацетонітрилу, який метанол (10мл) і суміш гідрували при 45псі містив невелику кількість метанолу, з одержанням (3,15кг/см2) 1 годину. Одразу ж спостерігали пог0,52г гідрохлориду 1-{2-[(3-феніл-2линання водню. Реакційну суміш фільтрували для пропініл)окси]етил}-1H-імідазо[4,5-с]хінолін-4-аміну видалення каталізатора. Фільтрат концентрували у вигляді не зовсім білої кристалічної твердої репри зниженому тиску з одержанням N,N-(біс-третчовини, температура плавлення 231-236°С. бутоксикарбоніл)-1-{2-[3-(4Аналіз. Розраховано для C21H19CIN4O·(Н2О)1/4: метоксифеніл)пропокси]етил}-1H-імідазо[4,5%С, 65,79; %Н, 5,13; %N, 14,61. Знайдено: %С, с]хінолін-4-аміну у вигляді жовто-коричневої губо65,72; %Н, 5,0; %N, 14,73. подібної речовини. 1 ВРМС (ЕІ) Розраховано для C32H40N4O6 (М+) Н ЯМР (300МГц, ДМСО) 8,49 (с, 1Η), 8,34 (д, 576,2948, знайдено 576,2965. Дж=8,3Гц, 1Η), 7,81 (широкий д, Дж=8,3Гц, 1Η), Частина С 7,72 (т, Дж=7,8Гц, 1Η), 7,56 (т, Дж=7,8Гц, 1Η), 7,30В атмосфері азоту трифтороцтову кислоту 7,40 (м, 3Η), 7,14 (дд, Дж=8,0, 1,5Гц, 2Η), 4,94 (т, (10мл) додавали до суміші матеріалу з Частини В і Дж=4,8Гц, 2Η), 4,38 (с, 2Η), 4,05 (т, Дж=4,9Гц, 2Η). дихлорметану (10мл). Одержаний розчин залишаВРМС (ΕΘ) Розраховано для C21H18N4O (M+) ли перемішуватись на 4 години. Розчин концент342,481, знайдено 342,1485. рували при зниженому тиску. Залишок розділяли Приклад 5 між 50% водним розчином гідроксиду натрію і дих1-{2-[3-(4-Метоксифеніл)пропокси]етил}-1Hлорметаном, який містив невелику кількість метаімідазо[4,5-с]хінолін-4-амін нолу. Органічну фракцію сушили над сульфатом магнію, фільтрували і потім концентрували при зниженому тиску з одержанням коричневої піни. Піну очищували флеш-хроматографією (9/1 дихлорметан/метанол) з одержанням світло-жовтої склоподібної речовини. Склоподібну речовину розтирали з діетиловим етером з одержанням білого порошку. Цей матеріал сушили у вакуумній печі 4 години при 60°С з одержанням 0,41г 1-{2-[3-(4метоксифеніл)пропокси]етил}-1Н-імідазо[4,5с]хінолін-4-аміну у вигляді білої твердої речовини, температура плавлення 116-118°С. Аналіз. Розраховано для C22H24N4O2: %С, 70,19; %Н, 6,43; %N, 14,88. Знайдено: %С, 69,79; %Н, 6,40; %N, 14,73. 1 Частина А Н ЯМР (300МГц, ДМСО) 8,17 (с, 1Η), 8,12 (д, В атмосфері азоту, N,N-(біс-третДж=8,3Гц, 1Η), 7,64 (д, Дж=8,3Гц, 1Η), 7,45 (т, бутоксикарбоніл)-1-[2-(2-пропінілокси)етил]-1HДж=7,8Гц, 1Η), 7,24 (т, Дж=7,6Гц, 1Η), 6,80 (д, імідазо[4,5-с]хінолін-4-амін (1,0г, 2,14ммоль), триеДж=8,8Гц, 2Н), 6,66 (д, Дж=8,8Гц, 2Н), 6,60 (с, 2Н), тиламін (0,8мл, 5,56ммоль), 4-йоданізоль (0,51г, 4,80 (т, Дж=5,1Гц, 2Н), 3,81 (т, Дж=4,9Гц, 2Н), 3,66 2,18ммоль) і безводний Ν,Ν-диметилформамід (с, 3Н), 3,27 (т, Дж=6,1Гц, 2Н), 2,32 (т, Дж=7,3Гц, (15мл) об'єднували. 2Н), 1,60 (м, 2Н). Додавали дихлорПриклад 6 біс(трифенілфосфін)паладій(ІІ) (0,09г, 0,13моль) і Ν1,4-Диметил-3-{3-[2-(4-аміно-1Н-імідазо[4,5йодид міді (І) (0,05г, 0,26ммоль), реакційну суміш с]хінолін-1-іл)етокси]пропіл}-1-бензолсульфонамід перемішували 1 годину при температурі навколишнього середовища, після чого аналіз шляхом ВЕРХ (обернена фаза, ацетонітрил/вода) вказав на завершення реакції. Реакційну суміш розділяли між етилацетатом і водним розчином бікарбонату натрію. Органічну фракцію промивали водою і по 45 75622 46 2,54 (с, 3Η), 2,40 (д, Дж=4,9Гц, 3Η). МС (XI) 584,476 Частина С Платину на вугіллі (0,08г, 10%) додавали до суміші бензил N-(1-{2-[(3-{2-метил-5[(метиламіно)сульфоніл]феніл}-2пропініл)окси]етил}-1H-імідазо[4,5-с]хінолін-4іл)карбамату (0,3г, 0,51ммоль) і метанолу (10мл). Суміш гідрували на апараті Парра при 40псі (2,8кг/см2) протягом 16 годин. Аналіз шляхом РХМС вказав на відновлення алкіну, і не вказав на видалення феноксикарбонілу. Додавали паладій на вугіллі (0,1г, 10%) і реакційну суміш гідрували при 40псі (2,8кг/см2) 8 годин. Аналіз шляхом РХЧастина А МС вказав на видалення тільки невеликої кількості В атмосфері азоту, 1-[2-(2-пропінілокси)етил]феноксикарбонілу. Додавали чорний паладій 1Н-імідазо[4,5-с]хінолін-4-амін (1,7г, 6,35ммоль), (0,1г), реакційну суміш гідрували при 40псі дибензил дикарбонат (4,55г, 15,9ммоль), триети(2,8кг/см2) протягом 16 годин. Аналіз шляхом РХламін (1,8мл, 13,0ммоль), 4МС вказав на один основний продукт з масою, що (диметиламіно)піридин і безводний Ν,Νвідповідала бажаному продукту. Реакційну суміш диметилформамід (20мл) об'єднували. Реакційну фільтрували і фільтрат промивали метанолом і суміш нагрівали до 90°С, після чого реакційна судихлорметаном. Розчинники видаляли при знижеміш ставала однорідною. Її потім нагрівали до ному тиску з одержанням не зовсім білого порош130°С 4 години. Реакційну суміш залишали охолоку. Цей матеріал перекристалізовували з ацетоніджуватись і потім її розділяли між дихлорметаном і трилу з одержанням 0,11г N1,4-диметил-3-{3-[2-(4водою. Водну фракцію екстрагували дихлорметааміно-1Н-імідазо[4,5-с]хінолін-1-іл)етокси]пропіл}ном. Органічні фракції об'єднували, сушили над 1-бензолсульфонаміду у вигляді світло-жовтої сульфатом магнію і потім концентрували до об'єму кристалічної твердої речовини, температура плав~10мл. Концентрат залишали відстоюватись на лення 207-209°С. вихідні і потім його розводили толуолом. ОдержаАналіз. Розраховано для C23H27N5O3S: %С, ний осад виділяли шляхом фільтрації і визначали 60,91; %Н, 6,00; %N, 15,44. Знайдено: %С, 60,87; як початкорий матеріал. Фільтрат розводили діе%Н, 5,75; %N, 15,51. тиловим етером. Одержаний осад виділяли шля1 Н ЯМР (300МГц, ДМСО) 8,16 (с, 1Η), ,12 (д, хом фільтрації з одержанням 1,1г бензил N-{1-[2Дж=8,3Гц, 1Η), 7,62 (д, Дж=8,3Гц, 1Н), 7,53 (д, (пропінілокси)етил]-1Н-імідазо[4,5-с]хінолін-4Дж=1,5Гц, 1Н), 7,44 (широкий т, Дж=7,6Гц, 1Н), іл}карбамату у вигляді білої твердої речовини. 7,38 (м, 1Н), 7,24 (широкий т, Дж=7,6Гц, 1Н), 7,16 1 Н ЯМР (300МГц, ДМСО) 9,98 (с, 1Η), 8,34 (д, (д, 7,8Гц, 1Н), 7,02 (дд, Дж=7,8, 2,0Гц, 1Н), 6,58 (с, Дж=7,8Гц, 1Η), 8,30 (с, 1Η), 7,97 (д, Дж=7,3Гц, 1Н), 2Н), 4,80 (т, 5,2Гц, 2Н), 3,82 (т, 5,2Гц, 2Н), 3,31 (т, 7,70 (т, Дж=7,8Гц, 1Н), 7,58 (т, Дж=7,8Гц, 1Н), 7,155,9Гц, 2Н), 2,47 (с, 3Н), 2,37 (д, 4,4Гц, 2Н), 7,50 (м, 5Н), 5,21 (с, 2Н), 4,90 (т, Дж=5,1Гц, 2Н), 1,65(м,2Н). 4,14 (д, Дж=2,4Гц, 2Н), 3,96 (т, Дж=4,9Гц, 2Н), 3,38 ВРМС (ΕΘ) Розраховано для C23H27N5O3S (М+) (т, Дж=2,4Гц, 2Н). 453,1835, знайдено 453,1834. Частина В Приклад 7 В атмосфері азоту, бензил N-{1-[2Гідрохлорид 1-(2-{[3-(2-ізопропілфеніл)-2(пропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4пропініл]окси}етил)-1Н-імідазо[4,5-с]хінолін-4-аміну іл}карбамат (0,37г, 0,91ммоль), 3-йод-4-метил-1бензолсульфонамід (0,3г, 0,96ммоль), триетиламін (0,2мл, 1,36ммоль) і безводний ацетонітрил (20мл) об'єднували. Додавали дихлорбіс(трифенілфосфін)паладій(ІІ) (13мг, 0,018моль) і йодид міді (І) (7мг, 0,036ммоль), реакційний розчин нагрівали до ~45°С. Через 3 години аналіз із використанням оберненої фази ВЕРХ вказав на завершення реакції. Реакційний розчин концентрували при зниженому тиску і залишок очищували флешхроматографією (98/2-95/5 дихлорметан/метанол) з одержанням 0,33г бензил N-(1-{2-[(3-{2-метил-5[(метиламіно)сульфоніл]феніл}-2В атмосфері азоту, 1-[2-(2-пропінілокси)етил]пропініл)окси]етил}-1Н-імідазо[4,5-с]хінолін-41Н-імідазо[4,5-с]хінолін-4-амін (0,50г, 1,88ммоль), іл)карбамату у вигляді блідо-жовтої твердої речо2-йодізопропілбензол (0,65г, 2,63ммоль), триетивини. ламін (0,68мл, 4,88ммоль) і Ν,Ν-диметилформамід 1 Н ЯМР (300МГц, ДМСО) 9,96 (с, 1Η), 8,36 (10мл) об'єднували і потім нагрівали до 60°С. До(м, 2Η), 7,96 (д, Дж=8,3Гц, 1Η), 7,55-7,70 (м, 4Η), давали йодид міді (І) (0,04г) і дихлор7,48 (м, 2Η), 7,30-7,45 (м, 5Η), 5,21 (с, 2Η), 4,95 (т, біс(трифенілфосфін)паладій(ІІ) (0,08г). Через 1,5 Дж=4,6Гц, 2Η), 4,40 (с, 2Η), 4,06 (т, Дж=5,1Гц, 2Η), години аналіз шляхом ТШХ (9/1 дихлорме 47 75622 48 тан/метанол) вказав на завершення реакції. Реак(д, Дж=8,1Гц, 1Η), 7,62 (д, Дж=7,9Гц, 1Η), 7,44 (т, ційну суміш концентрували при зниженому тиску. Дж=8,0Гц, 1Н), 7,23 (т, Дж=7,9Гц, 1Η), 7,09-7,14 (м, Залишок очищували колонковою хроматографією 1Η), 7,01-7,03 (м, 2Η), 6,76 (с, 2Η), 4,87 (т, елююючи сумішшю 9/1 дихлорметан/метанол. Дж=4,9Гц, 2Η), 4,48 (с, 2Η), 4,05 (т, Дж=4,9Гц, 2Η), Фракції продукту об'єднували і концентрували при 2,15 (с, 6Η). зниженому тиску. Залишок очищували колонковою ІЧ (KBr) 3379, 3065, 1659, 1530, 1483, 1107, хроматографією елююючи сумішшю 9/1 дихлорме751см-1 тан/метанол, яка містила 0,5% розчин концентроВРМС (ΕΘ) Розраховано для C23H22N4O (M+) ваного гідроксиду амонію. Фракції продукту об'єд370,1794, знайдено 370,1789. нували і концентрували при зниженому тиску з Приклад 9 одержанням ~0,38г твердої речовини. Цей матері1-(2-{[3-(4-Феноксифеніл)-2ал об'єднували з сумішшю хлорид водпропініл]окси}етил)-1H-імідазо[4,5-с]хінолін-4-амін ню/діетиловий етер (3,9мл 1,0М), перемішували протягом ночі і потім концентрували при зниженому тиску. Залишок перекристалізовували з суміші ізопропанол/метанол, відділяли шляхом фільтрації і потім сушили з одержанням 0,24г гідрохлориду 1(2-{[3-(2-ізопропілфеніл)-2-пропініл]окси}етил)-1Hімідазо[4,5-с]хінолін-4-аміну у вигляді твердої речовини, температура плавлення 239-241°С. Аналіз. Розраховано для C24H24N4O·ΗCI(Η2O)1/2: %С, 67,06; %Н, 6,09; %Ν, 13,03. Знайдено: %С, 67,07; %Н, 6,00; %Ν, 13,09. 1 Н ЯМР (300МГц, ДМСО-d6) 8,54 (с, 1Н), 8,39 (д, J=8,1Гц, 1Н), 7,85 (д, Дж=8,2Гц, 1Н), 7,76 (т, Дж=7,2Гц, 1Η), 7,59 (т, Дж=8,0Гц, 1Н), 7,30-7,38 (м, 2Η), 7,11-7,19 (м, 2Η), 5,00 (т, Дж=4,7Гц, 2Η), 4,47 (с, 2Η), 4,10 (т, Дж=4,7Гц, 2Η), 3,16 (м, 1Н), 1,13 (д, Дж=6,9Гц, 6Н). Відповідно до загального способу Прикладу 7, ІЧ (КВr) 3363, 3111, 2957,1672, 753см-1 1-[2-(2-пропінілокси)етил]-1Н-імідазо[4,5-с]хінолін+ ВРМС (ΕΘ) Розраховано для C24H24N4O (М ) 4-амін (0,50г, 1,88ммоль) вступав в реакцію з 4384,1950, знайдено 384,1943. йодфеніл феніловим етером (0,78г, 2,63ммоль). Приклад 8 Необроблений продукт очищували колонковою 1-(2-{[3-(2,6-Диметилфеніл)-2хроматографією елююючи сумішшю 95/5 дихлорпропініл]окси}етил)-1Н-імідазо [4,5-с]хінолін-4-амін метан/метанол з одержанням твердої речовини. Тверду речовину суспендували водним розчином гідроксиду натрію для видалення солей і потім очищували колонковою хроматографією елююючи сумішшю 9/1 етилацетат/метанол з одержанням твердої речовини. Цей матеріал знову очищували колонковою хроматографією елююючи сумішшю 99/1 етилацетат/метанол з одержанням 24мг 1-(2{[3-(4-феноксифеніл)-2-пропініл]окси}етил)-1Hімідазо[4,5-с]хінолін-4-аміну у вигляді твердої речовини, температура плавлення 146-148°С. Аналіз. Розраховано для С27Н22О2·(H2О)4/5: %С, 72,24; %Н, 5,30; %N, 12,48. Знайдено: %С, 71,82; %Н, 4,85; %N, 12,35. Відповідно до загального способу Прикладу 7, 1 Н ЯМР (300МГц, ДМСО-d6) 8,18 (с, 1Η), 8,12 1-[2-(2-пропінілокси)етил]-1H-імідазо[4,5-с]хінолін(д, Дж=7,4Гц, 1Η), 7,62 (д, Дж=7,7Гц, 1Н), 7,41-7,47 4-амін (0,50г, 1,88ммоль) вступав в реакцію з 2,6(м, 3Н), 7,18-7,27 (м, 4Н), 7,06 (дд, Дж=7,6, 1,0Гц, диметил йодбензолом (0,61г, 2,63ммоль). Необро2Н), 6,90 (дд, Дж=6,7Гц, 2Н), 6,71 (с, 2Н), 4,85 (т, блений продукт очищували колонковою хроматогДж=5,1Гц, 2Н), 4,37 (с, 2Н), 4,02 (т, Дж=5,0Гц, 2Н). рафією елююючи сумішшю 95/5 дихлормеІЧ (КВr) 3444, 3070, 2928, 1500, 1230см-1 тан/метанол з одержанням 0,056г 1-(2-{[3-(2,6ВРМС (ΕΘ) Розраховано для C27H22N4O2 (М+) диметилфеніл)-2-пропініл]окси}етил)-1H434,1743, знайдено 434,1748. імідазо[4,5-фхінолін-4-аміну у вигляді твердої реПриклад 10 човини, температура плавлення 200-201°С. 1-[2-({3-[2-(Трифторметил)феніл]-2Аналіз. Розраховано для C23H22N4O·(Н2О)2/5: пропініл}окси)етил]-1H-імідазо[4,5-с]хінолін-4-амін %С, 73,29; %Н, 6,07; %N, 14,86. Знайдено: %С, 73,36; %Н, 5,88; %N, 14,84. 1 Н ЯМР (300МГц, ДМСО-d6) 8,19 (с, 1Н), 8,13 49 Відповідно до загального способу Прикладу 7, 1-[2-(2-пропінілокси)етил]-1H-імідазо[4,5-с]хінолін4-амін (0,50г, 1,88ммоль) вступав в реакцію з 2йодбензотрифторидом (0,71г, 2,63ммоль). Реакційну суміш концентрували при зниженому тиску. Одержану склоподібну тверду речовину оброблювали водним розчином бісульфіту натрію (10мл) і метанолом (20мл). Тверду речовину видаляли шляхом фільтрації. Фільтрат концентрували при зниженому тиску з одержанням білого порошку. Цей матеріал промивали водою і сушили 4 дні в печі при 80°С з одержанням ~0,33г твердої речовини. Цей матеріал частково розчиняли в суміші дихлорметану (17мл) і метанолу (17мл). Додавали суміш хлорид водню/діетиловий етер (3,24мл 1,0М) і суміш ставала однорідною. Суміш концентрували при зниженому тиску з одержанням коричневого кристалічного залишку. Залишок об'єднували з сумішшю 50/50 ацетонітрил/етилацетат, яка містила невелику кількість метанолу. Додавали гідроксид натрію (0,5мл 20% розчину). Суміш концентрували при зниженому тиску з одержанням склоподібної твердої речовини. Цю склоподібну тверду речовину очищували колонковою хроматографією елююючи сумішшю 9/1 етилацетат/метанол з одержанням 14мг 1-[2-({3-[2(трифторметил)феніл]-2-пропініл}окси)етил]-1Німідазо[4,5-с]хінолін-4-аміну у вигляді білої кристалічної твердої речовини, температура плавлення 154-155°С. Аналіз. Розраховано для C22H17F3N4O: %С, 64,39; %Н, 4,18; %N, 13,65. Знайдено: %С, 64,39; %Н, 4,19; %N, 13,71. 1 Н ЯМР (300МГц, ДМСО-d6) 8,16 (с, 1Η), 8,11 (д, Дж=7,4Гц, 1Η), 7,74 (д, Дж=7,3Гц, 1Н), 7,56-7,64 (м, 3Н), 7,38-7,46 (м, 2Н), 7,22 (т, Дж=7,6Гц, 1Н), 6,59 (с, 2Н), 4,87 (т, Дж=5,1Гц, 2Н), 4,45 (с, 2Н), 4,04 (т, Дж=5,1Гц, 2Н). ІЧ (КВr) 3375, 3102, 1657, 1583, 1530, 1484, 1320, 1103, 765см-1 ВРМС (ΕΘ) Розраховано для C22H17F3N4O (М+) 410,1354, знайдено 410,1350. Приклад 11 Трифторацетат 1-(2-{3-[4-(1Н-1Піроліл)феніл]пропокси}етил)-1H-імідазо[4,5с]хінолін-4-аміну 75622 50 Частина А В атмосфері азоту дибензил дикарбонат (50г, 174ммоль) додавали до суміші 1-[2-(2пропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4-аміну (16,4г, 61,6ммоль) і безводного Ν,Νдиметилформаміду (200мл). Реакційну суміш залишали перемішуватись при температурі навколишнього середовища протягом 16 годин і реакційна суміш ставала однорідною. Реакційну суміш розділяли між етилацетатом і водою. Шари відділяли. Водний шар екстрагували етилацетатом. Органічні фракції об'єднували, промивали водою, промивали розчином солі, сушили над сульфатом магнію, фільтрували і потім концентрували при зниженому тиску з одержанням напівтвердої речовини. Цей матеріал розтирали з діетиловим етером з одержанням 27,4г N,N-(бісбензилоксикарбоніл)-1-[2-(2-пропінілокси)етил]-1Німідазо[4,5-с]хінолін-4-аміну у вигляді білої твердої речовини. Частина В В атмосфері азоту N,N-(бісбензилоксикарбоніл)-1-[2-(2-пропінілокси)етил]-1Німідазо[4,5-с]хінолін-4-амін (0,5г, 0,94ммоль), безводний ацетонітрил (5мл), триетиламін (0,34мл, 2,43ммоль) і 1-(4-йодфеніл)пірол (0,28г, 1,03ммоль) об'єднували і одержану однорідну суміш нагрівали до 80°С. Додавали йодид міді (І) (0,007г) і дихлорбіс(трифенілфосфін)паладій(ІІ) (0,013г). Реакція завершувалась за 30 хвилин. Продукт очищували рідкісною хроматографією використовуючи суміш 4/6 гексан/етилацетат з одержанням склоподібної твердої речовини. Цей матеріал очищували на другій колонці застосовуючи суміш 9/1 гексан/етилацетат з одержанням 0,229г N,N-(біс-бензилоксикарбоніл)-1-[2-({3-[4-(1Нпірол-1-іл)феніл]проп-2-ініл}окси)етил]-1Hімідазо[4,5-с]хінолін-4-аміну. 1 Н ЯМР (500МГц, ДМСО-d6) 8,49 (д, Дж=7,7Гц, 1Η), 8,44 (с, 1Η), 8,14 (д, Дж=7,9Гц, 1Η), 7,75-7,77 (м, 2Η), 7,54 (д, Дж=5,1Гц, 2Н), 7,40 (с, 2Н), 7,32 (д, Дж=6,8Гц, 2Н), 7,24-7,27 (м, 6Н), 7,147,16 (м, 4Н), 6,29 (с, 2Н), 5,18 (с, 4Н), 5,00 (т, Дж=5,2Гц, 2Н), 4,42 (с, 2Н), 4,10 (т, Дж=5,1Гц, 2Н). МС (XI) для C41H33N5O5 m/z 676 (МН+), 632, 524,408. Частина С Матеріал з Частини В, гідроксид паладію (0,24г 20% на вугіллі) і метанол (5мл) об'єднували у колбі Парра і гідрували при 45псі (3,2кг/см2) 3-4 години. Реакційну суміш фільтрували для видалення каталізатора, осад на фільтрі промивали додатковим 51 75622 52 метанолом, і фільтрат концентрували при знижегіллі) і суміш гідрували при 45псі (3,2кг/см2) при ному тиску. Залишок очищували напівпрепаративтемпературі навколишнього середовища ~2,25 ною ВЕРХ відповідно до Способу В з одержанням години. Додавали ще каталізатор (0,3г і гідрування 36,6мг трифторацетату 1-(2-{3-[4-(1Н-1продовжували додаткові 2 години. Реакційну супіроліл)феніл]пропокси}етил)-1H-імідазо[4,5міш фільтрували для видалення каталізатора і с]хінолін-4-аміну у вигляді твердої речовини, темосад на фільтрі ретельно прополіскували метанопература плавлення 179-181°С. лом. Фільтрат концентрували при зниженому тиску Аналіз. Розраховано для C25H25N5C·C2ΗF3Ο2: з одержанням ~1,2г N,N-(біс-трет%С, 61,71; %Н, 4,99; %Ν, 13,33. Знайдено: %С, бутоксикарбоніл)-3-{3-[2-(4-аміно-1Н-імідазо[4,561,49; %Н, 4,89; %Ν, 13,23. с]хінолін-1-іл)етокси]пропіл}бензойної кислоти. 1 1 Н ЯМР (500МГц, ДМСО-d6) 8,51 (с, 1Η), 8,38 Н ЯМР (300МГц, ДМСО-d6) 8,50 (д, (д, Дж=8,4Гц, 1Η), 7,84 (д, Дж=8,4Гц, 1Н), 7,73 (т, Дж=9,5Гц, 1Η), 8,40 (с, 1Η), 8,07-8,10 (м, 1Η), 7,70Дж=7,3Гц, 1Н), 7,56 (т, Дж=7,8, 1Н), 7,33 (д, 7,75 (м, 3Η), 7,65 (с, 1Η), 1,29 (с, 18Η), 7,29 (т, Дж=8,4Гц, 2Н), 7,26 (т, Дж=2,1Гц, 2Н), 6,96 (д, Дж=7,6Гц, 1Η), 7,10 (д, Дж=7,8Гц, 1Η), 4,94 (т, Дж=8,4, 2Н), 6,24 (т, Дж=2,1Н, 2Н), 4,91 (т, Дж=5,0, Дж=4,5Гц, 2Η), 3,88 (т, Дж=4,5Гц, 2Η), 3,32 (т, 2Н), 3,85 (т, Дж=5,0, 2Н), 3,3-3,4 (м, 2Н), 2,35 (т, Дж=6,0Гц, 2Η), 2,43 (т, Дж=7,0Гц, 2Η), 1,62 (м, 2Η). Дж=7,6, 2Н), 1,61 (м, 2Н). МС (XI) для C32H38N4O7 m/z 591 (МН+), 491, -1 ІЧ (КВr) 2949, 1705,1523,1204,1123, 721см 391. ВРМС (ΕΘ) Розраховано для C25H25N5O (М+) Частина С 411,2059, знайдено 411,2060. В атмосфері азоту матеріалу з Частини В Приклад 12 об'єднували з безводним дихлорметаном (10мл) і Біс(трифторацетат) 3-{3-[2-(4-аміно-1Нтрифтороцтовою кислотою (10мл). Реакційну суімідазо[4,5-с]хінолін-1-іл)етокси]пропіл}бензойної міш перемішували 1,5 години. Реакційну суміш кислоти концентрували при зниженому тиску з одержанням масла, яке сушили при високому вакуумі при температурі навколишнього середовища з одержанням твердої речовини. Цю тверду речовину розтирали з етером. Одержаний білий порошок сушили при 65°С у вакуумній печі протягом ночі з одержанням 1,19г біс(трифторацетат) 3-{3-[2-(4-аміно1Н-імідазо[4,5-с]хінолін-1іл)етокси]пропіл}бензойної кислоти, температура плавлення 138-140°С. Аналіз. Розраховано для C22H22N4O3 (C2HF3O2)2: %C, 50,49; %Н, 3,91; %N, 9,06. Знайдено: %С, 50,37; %Н, 3,67; %N, 9,08. 1 Н ЯМР (300МГц, ДМСО-d6) 9,07-7,14 (широкий с, 2Η), 8,51 (с, 1Η), 8,37 (д, Дж=7,8Гц, 1Н), 7,82 (д, Дж=8,0Гц, 1Н), 7,74 (м, 2Н), 7,64 (с, 1Н), 7,56 (т, Частина А Дж=7,1Гц, 1Н), 7,30 (т, Дж=7,7Гц, 1Н), 7,15 (д, В атмосфері азоту N,N-(біс-третДж=7,6Гц, 1Н), 4,91 (т, Дж=4,5Гц, 2Н), 3,86 (т, бутоксикарбоніл)-1-[2-(2-пропінілокси)етил]-1HДж=4,4Гц, 2Н), 3,34 (т, Дж=5,9Гц, 2Н), 2,44 (т, імідазо[4,5-с]хінолін-4-амін (2,82г, 6,04ммоль), беДж=7,4Гц, 2Н), 1,64 (м, 2Н). нзил 3-йодбензоат (2,245г, 6,64ммоль), триетилаІЧ (КВr) 3367, 3104, 2372,1685, 1204, 1146см-1 мін (2,2мл, 15,7ммоль), і безводний ацетонітрил ВРМС (ΕΘ) Розраховано для C22H22N4O3 (М+) (20мл) об'єднували і одержану суміш нагрівали до 390,1692, знайдено 390,1690. 60°С. Додавали йодид міді (І) (0,05г) і дихлорПриклад 13 біс(трифенілфосфін)паладій(ІІ) (0,008г). Реакція Трифторацетат 2-{3-[2-(4-аміно-1H-імідазо[4,5завершувалась за 30 хвилин. Реакційну суміш с]хінолін-1-іл)етокси]пропіл}бензойної кислоти концентрували при зниженому тиску і залишок очищували колонковою хроматографією елююючи спочатку дихлорметаном, а потім сумішшю 98/2 дихлорметан/метанол з одержанням 1,82г бензил 3-{3-[2-(4-(біс-трет-бутоксикарбоніл)аміно-1Німідазо[4,5-с]хінолін-1-іл)етокси]проп-1ініл}бензоату. 1 Н ЯМР (300МГц, ДМСО-d6) 8,46 (д, Дж=9,6Гц, 1Η), 8,39 (с, 1Η), 8,05 (д, Дж=9,8Гц, 1Η), 7,94-7,98 (м, 1Η), 7,84 (с, 1Η), 7,50-7,70 (м, 2Η), 7,36-7,49 (м, 7Η), 5,36 (с, 2Η), 4,98 (т, Дж=4,6Гц, 2Η), 4,37 (с, 2Η), 4,06-4,13 (м, 2Η), 1,30 (с, 18Η). МС (XI) для C39H40N4O7 m/z 677 (МН+), 577, 477. Частина В Частина А Розчин матеріалу з Частини А в метанолі об'єВідповідно до загального способу Прикладу днували з каталізатором (1,0г 10% паладій на ву12, Частини A, N,N-(біс-трет-бутоксикарбоніл)-1-[2 53 75622 54 (2-пропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4Частина А амін (2г, 4,3ммоль) конденсували з бензил 2Відповідно до загального способу Прикладу йодбензоатом (1,57г, 4,71ммоль) з одержанням 12, Частини A, N,N-(біс-трет-бутоксикарбоніл)-1-[21,79г суміші моно- і ди-ВОС захищеного бензил 2(2-пропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4{3-[2-(4-аміно-1H-імідазо[4,5-с]хінолін-1амін (2,82г, 6,04ммоль) конденсували з бензил 4іл)етокси]проп-1-ініл}бензоату. йодбензоатом (2,25г, 6,64ммоль) з одержанням 1 2,14г суміші моно- і ди-ВОС захищеного бензил 4Н ЯМР (300МГц, ДМСО-d6) 8,45 (д, [3-(2-{4-аміно-1Н-імідазо[4,5-с]хінолін-1-іл} етокДж=7,9Гц, 1Η), 8,39 (с, 1Η), 8,06-8,09 (м, 1Η), 7,85си)проп-1-ініл]бензоату. 7,88 (м, 1Η), 7,70-7,73 (м, 2Η), 7,47-7,51 (м, 2Η), 1 7,40-7,43 (м, 2Η), 7,28-7,37 (м, 3Η), 7,19 (м, 1Η), Н ЯМР (300МГц, ДМСО-d6) 8,47 (д, 5,23 (с, 2Η), 4,97 (т, Дж=5,0Гц, 2Η), 4,27 (с, 2Η), Дж=7,2Гц, 1Η), 8,40 (с, 1Η), 8,06 (д, Дж=6,5Гц, 1Η), 4,07 (т, Дж=4,9Гц, 2Η), 1,30(с, 18Н). 7,87-7,89 (м, 2Η), 7,70-7,73 (м, 2Η), 7,36-7,49 (м, МС (XI) для C39H40N4O7 m/z 677 (МН+), 5Η), 7,23-7,27 (м, 2Η), 5,35 (с, 2Η), 5,0 (т, Дж=4,5Гц, 577,477. 2Η), 4,40 (с, 2Η), 4,09 (т, Дж=4,5Гц, 2Η), 1,30 (с, Частина В 18Η). Відповідно до загального способу Прикладу МС (XI) для C392H40N4O7 m/z 677 (МН+), 577, 12, Частини В, матеріал з Частини А гідрували з 477. одержанням 0,041г суміші моно- і ди-ВОС захищеЧастина В ного 2-{3-[2-(4-аміно-1Н-імідазо[4,5-с]хінолін-1Відповідно до загального способу Прикладу іл)етокси]пропіл}бензойної кислоти. 12, Частини В, матеріал з Частини А гідрували з 1 одержанням 1,86г суміші моно- і ди-ВОС захищеН ЯМР (300МГц, ДМСО-d6) 8,50 (д, ної 4-{3-[2-(4-аміно-1Н-імідазо[4,5-с]хінолін-1Дж=7,3Гц, 1Η), 8,39 (с, 1Η), 8,08 (д, Дж=7,9Гц, 1Η), іл)етокси]пропіл}бензойної кислоти. 7,71-7,75 (м, 3Η), 7,22-7,28 (м, 2Η), 6,90 (д, 1 Дж=7,4Гц, 1Н), 4,93 (т, Дж=4,6Гц, 2Н), 3,87 (т, Н ЯМР (300МГц, ДМСО-d6) 8,51 (д, Дж=4,5Гц, 2Н), 3,30 (т, Дж=5,6Гц, 2Н), 2,73 (т, Дж=7,1Гц, 1Η), 8,40 (с, 1Η), 8,07-8,10 (м, 1Η), 1,72Дж=5,7Гц, 2Н), 1,61 (м, 2Η), 1,28 (с, 18Η). 7,75 (м, 4Η), 7,01 (д, Дж=8,4Гц, 2Η), 4,94 (т, МС (XI) для C32H38N4O7 m/z 591 (МН+), Дж=4,7Гц, 2Η), 3,88 (т, Дж=4,6Гц, 2Η), 3,30 (м, 2Η), 491,391. 2,38 (т, Дж=7,3Гц, 2Η), 1,62 (м, 2Η), 1,29 (с, 18Η). Частина С МС (XI) для C32H38N4O7 m/z 591 (MH+), 491, Відповідно до загального способу Прикладу 12 391. Частина С, матеріал з Частини В гідролізували з Частина С одержанням 0,28г 2-{3-[2-(4-аміно-1H-імідазо[4,5Відповідно до загального способу Прикладу с]хінолін-1-іл)етокси]пропіл}бензойної кислоти у 12, Частини С, матеріал з Частини В гідролізували вигляді твердої речовини, температура плавлення з одержанням 0,96г трифторацетату 4-{3-[2-(4186-188°С. аміно-1H-імідазо[4,5-с]хінолін-1Аналіз. Розраховано для C22H22N4O2·C2HF3O2: іл)етокси]пропіл}бензойної кислоти, температура %С, 57,14; %Н, 4,59; %N, 11,11. Знайдено: %С, плавлення 235-237°С. 56,81; %Н, 4,47; %N, 11,08. Аналіз. Розраховано для C22H22N4O3·C2HF3O2: 1 %C, 57,14; %Н, 4,59; %N, 11,11. Знайдено: %С, Н ЯМР (300МГц, ДМСО-d6) 8,90-9,20 (широ57,06; %Н, 4,47; %N, 11,03. кий с, 1Η), 8,50 (с, 1Η), 8,38 (д, Дж=10,1Гц, 1Н), 1 Н ЯМР (300МГц, ДМСО-d6) 9,00-9,11 (широ7,84 (д, Дж=8,3Гц, 1Н), 7,71-7,75 (м, 2Н), 7,56 (т, Дж=7,6Гц, 1Н), 7,21-7,32 (м, 2Н), 6,88 (д, Дж=6,9Гц, кий с, 2Н), 8,51 (с, 1Н), 8,37 (д, Дж=8,4Гц, 1Η), 7,83 2Н), 4,90 (т, Дж=4,8Гц, 2Н), 3,84 (т, Дж=4,6Гц, 2Н), (д, Дж=6,0Гц, 1Η), 7,71-7,76 (м, 3Н), 7,55 (т, 3,32 (м, 2Н), 2,72 (т, Дж=6,9Гц, 2Н), 1,62 (м, 2Н). Дж=9,7Гц, 1Η), 7,01 (д, Дж=8,2Гц, 2Η), 4,91 (т, ІЧ (КВr) 3212, 2929, 1709, 1204,1124, 747см-1 Дж=5,0Гц, 2Η), 3,84 (т, Дж=4,7Гц, 2Η), 3,32 (т, ВРМС (ΕΘ) Розраховано для C22H22N4O3 (М+) Дж=5,8Гц, 2Η), 2,38 (т, Дж=7,1Гц, 2Η), 1,62 (м, 2Η). 390,1692, знайдено 390,1693. ІЧ (KBr) 3266, 3014, 2361, 1667, 1277, 1201, Приклад 14 1142см-1 Трифторацетат 4-{3-[2-(4-аміно-1H-імідазо[4,5BPMC (ΕΘ) Розраховано для C22H227N4O3 (М+) с]хінолін-1-іл)етокси]пропіл}бензойної кислоти 390,1692, знайдено 390,1697. Приклад 15 Дигідрохлорид 1-(2-{3-[3(диметиламіно)феніл]пропокси}етил)-1Німідазо[4,5-с]хінолін-4-аміну 55 Частина А Відповідно до загального способу Прикладу 12, Частини А, за винятком того, що температуру для проведення реакції підвищили до 80°С, N,N(біс-трет-бутоксикарбоніл)-1-[2-(2пропінілокси)етил]-1H-імідазо[4,5-с]хінолін-4-амін (3г, 6,43ммоль) конденсували з 3-йод-N,Nдиметиланіліном (7,07ммоль) з одержанням 3,06г суміші моно захищеного і незахищеного 1-[2-({3-[3(диметиламіно)феніл]проп-2-ініл}окси)етил]-1Hімідазо[4,5-с]хінолін-4-аміну. Частина В Відповідно до загального способу Прикладу 12, Частини В, матеріал з Частини А гідрували з одержанням ~2,9г суміш моно Вос захищеного і незахищеного 1-(2-{3-[3(диметиламіно)феніл]пропокси}етил)-1Німідазо[4,5-с]хінолін-аміну. Частина С Матеріал з Частини В об'єднували з сумішшю хлорид водню/метанол (30мл 3М) і перемішували при температурі навколишнього середовища 19 годин. Осад видаляли шляхом фільтрації. Фільтрат концентрували при зниженому тиску і залишок розчиняли в невеликій кількості метанолу і потім нейтралізували концентрованим гідроксидом амонію до рівня рН ~11. Одержаний осад очищували колонковою хроматографією елююючи сумішшю 95/5/1 дихлорметан/метанол/гідроксид амонію. Цей матеріал об'єднували з сумішшю хлорид водню/діетиловий етер. Одержаний розчин концентрували при зниженому тиску. Залишок розтирали з діетиловим етером. Одержану тверду речовину виділяли шляхом фільтрації і потім сушили з одержанням 0,114г дигідрохлориду 1-(2-{3-[3(диметиламіно)феніл]пропокси}етил)-1Німідазо[4,5-с]хінолін-4-аміну, температура плавлення 180-183°С. Аналіз. Розраховано для C23H27N5O·(НСІ)2.1·(Н2О)2.1: %С, 54,82; %Н, 6,66; %N, 13,89. Знайдено: %С, 54,60; %Н, 6,50; %N, 13,66. 1 Н ЯМР (300МГц, ДМСО-d6) 8,71-8,73 (широкий с, 2Η), 8,44 (с, 1Η), 8,35 (д, Дж=7,4Гц, 1Н), 7,83 (д, Дж=8,0Гц, 1Н), 7,72 (т, Дж=7,6Гц, 1Н), 7,55 (т, Дж=6,8Гц, 1Н), 7,15 (м, 1Н), 7,05 (м, 1Н), 6,96 (с, 1Н), 6,66 (д, Дж=8,1Гц, 1Н), 4,88 (т, Дж=5,3Гц, 2Н), 4,02 (т, Дж=3,7Гц, 2Н), 3,37 (т, Дж=6,4Гц, 2Н), 2,94 (с, 6Н), 2,40 (т, Дж=7,6Гц, 2Н), 1,66 (м, 2Н). ІЧ (КВr) 3426, 3138, 2928, 1693, 1113см-1 ВРМС (ΕΘ) Розраховано для C23H27N5O (М+) 389,2216, знайдено 389,2217. 75622 56 Приклад 16 Гідрохлорид 2-(етоксиметил)-1-[2-(3фенілпропокси)етил]-1H-імідазо[4,5-с]хінолін-4аміну Частина А 2-[2-(Етоксиметил)-1H-імідазо[4,5-с]хінолін-1іл]етанол (3,50г, 12,9ммоль) повільно додавали протягом 20 хвилин до суспензії гідриду натрію (0,67г 60% дисперсії в мінеральному маслі, 16,77ммоль) в безводному Ν,Νдиметилформаміді. Реакційну суміш залишали перемішуватись на 1 годину і потім додавали 1бром-3-фенілпропан (2,16мл, 14,19ммоль). Реакційну суміш перемішували протягом ночі. Реакційну суміш розводили етилацетатом, промивали водою, промивали розчином солі, сушили над сульфатом магнію, фільтрували і потім концентрували при зниженому тиску. Залишок очищували колонковою хроматографією елююючи етилацетатом з одержанням 2,38г 2-(етоксиметил)-1-[2-(3фенілпропокси)етил]-1Н-імідазо[4,5-с]хінолін у вигляді жовтого масла. МС (XI) для C24H27N3O2 m/z 390 (МН+), 346. Частина В Матеріал з Частини А об'єднували з хлороформом (50мл) і охолоджували до 0°С. Додавали 3хлорпероксибензойну кислоту (2,22г 57-86% розчин). Через 1 годину реакційну суміш залишали нагрітись до температури навколишнього середовища. Реакційну суміш розділяли між водним розчином бікарбонату натрію і дихлорметаном. Органічну фракцію сушили над сульфатом магнію, фільтрували і потім концентрували при зниженому тиску з одержанням 2-(етоксиметил)-1-[2-(3фенілпропокси)етил]-1Н-імідазо[4,5-с]хінолін-5Nоксиду у вигляді коричневої твердої речовини. Частина С В атмосфері азоту трихлорацетилізоціанат (0,87мл, 7,33ммоль) повільно додавали до суміші матеріалу з Частини В і безводного дихлорметану (60мл). Через 1 годину реакційну суміш концентрували при зниженому тиску з одержанням 2,2,2трихлор-N-{2-(етоксиметил)-1-[2-(3фенілпропокси)етил]-1Н-імідазо[4,5-с]хінолін-1іл}ацетаміду. Частина D Метоксид натрію (4,79мл 25% розчину в метанолі) додавали до суміші матеріалу з Частини С і метанолу (30мл). Реакційну суміш залишали перемішуватись на ніч і потім її концентрували при зниженому тиску з одержанням темного масла. Темне масло очищували колонковою хроматографією елююючи 5% розчином метанолу в дихлор 57 75622 58 метані з одержанням світло-жовтого масла. Масло 3-Хлорпероксибензойну кислоту (2,84г 77% оброблювали 1,0Μ хлоридом водню з одержанням розчину) додавали порціями до розчину матеріалу білої твердої речовини. Матеріал виділяли шляз Частини А в хлороформі (60мл). Через 2 години хом фільтрації і потім сушили протягом ночі в вааналіз шляхом ТШХ (10% розчин метанолу в дихкуумній печі при 80°С з одержанням 0,79г гідрохлорметані) вказав на завершення реакції. Реакцію лориду 2-(етоксиметил)-1-[2-(3розводили хлороформом, промивали насиченим фенілпропокси)етил]-1Н-імідазо[4,5-с]хінолін-4розчином бікарбонату натрію, промивали розчиаміну у вигляді білої твердої речовини, температуном солі, сушили над сульфатом магнію і потім ра плавлення 128-134°С. концентрували при зниженому тиску з одержанням Аналіз для C24H28N4O2·1,55НСІ: %С, 62,53; необробленого 1-(1-{[(3%Н, 6,46; %Ν, 12,15; Знайдено: %С, 62,64; %Н, хлорбензил)окси]метил}пропіл)-1Н-імідазо[4,56,47; %Ν, 11,91. с]хінолін-5N-оксиду. 1 Частина С Н-ЯМР (300МГц, ДМСО-d6) 8,14 (широкий д, Гідроксид амонію (20мл) додавали до розчину Дж=8,3Гц, 1Η), 7,63 (дд, Дж=8,3, 1,0Гц, 1Η), 7,45 матеріалу з Частини В в дихлорметані (80мл). То(м, 1Η), 7,24 (м, 1Η), 7,05-7,15 (м, 3Н), 6,90 (м, 2Н), зилхлорид (2,42г) додавали порціями. Аналіз шля6,62 (с, 2Н), 4,80-4,90 (м, 4Н), 3,83 (т, Дж=5,4Гц, хом ТШХ (5% розчин метанолу в дихлорметані) 2Η), 3,56 (к, Дж=7,0Гц, 2Η), 3,27 (т, Дж=6,1Гц, 2Η), вказав, що реакція завершилась одразу після до2,37 (т, Дж=7,6Гц, 2Η), 1,63 (м, 2Н), 1,16 (т, давання тозилхлориду. Реакційну суміш розводиДж=6,8Гц, 3Н). ли дихлорметаном і насиченим розчином бікарбоІЧ (КВr) 3267, 3023, 1681, 1108см-1 нату натрію. Шари відділяли. Органічний шар ВРМС (ΕΘ) Розраховано для C24H28N4O2 (М+) промивали розчином солі, сушили над сульфатом 404,2212, знайдено 404,2215. магнію і потім концентрували при зниженому тиску Приклад 17 з одержанням світло-коричневого масла. Масло 1-(1-{[(3-Хлорбензил)окси]метил}пропіл)-1Ночищували флеш-хроматографією (силікагель імідазо[4,5-с]хінолін-4-амін елююючи 5% розчином метанолу в дихлорметані) з одержанням не зовсім білої в'язкої твердої речовини. Цей матеріал очищували флешхроматографією (силікагель елююючи 5% розчином метанолу в дихлорметані) з одержанням рожево-білої твердої речовини. Цей матеріал потім очищували флеш-хроматографією (силікагель елююючи етилацетатом) з одержанням ~1,0г 1-(1{[(3-хлорбензил)окси]метил}пропіл)-1H-імідазо[4,5с]хінолін-4-аміну у вигляді не зовсім білої твердої речовини, температура плавлення 60-62°С. Аналіз: Розраховано для C21H21CIN4O·¼Н2О: %С, 65,41: %Н, 5,62; %N, 14,54; Знайдено: %С, Частина А 65,5; %Н, 5,62; %N, 14,61. 2-Етил-2-(1Н-імідазо[4,5-с]хінолін-1-іл)-11 Н-ЯМР (300МГц, ДМСО-d6) 8,37 (с, 1Н), 8,19 етанол (3,0г, 12,43ммоль), дихлорметан (40мл), (д, Дж=8,3Гц, 1Н), 7,62 (дд, Дж=8,3, 1,5Гц, 1Н), водний розчин гідроксиду натрію (40мл 50% роз7,43 (дт, Дж=8,3, 1,5Гц, 1Н), 7,18-7,28 (м, 3Н), 7,09 чину), хлорид бензилтриметиламонію (0,01г) і 3(м, 1Н), 6,52 (широкий с, 2Н), 5,24 (м, 1Н), 4,48 (с, хлорбензилбромід (2,81г, 13,67ммоль) об'єднува2Н), 4,01 (дд, Дж=10,5, 6,6Гц, 2Н), 3,92 (дд, ли і одержаний розчин перемішували при темпеДж=10,3, 4,4Гц, 2Н), 2,10 (квінтет, Дж=7,3Гц, 2Н), ратурі навколишнього середовища протягом ночі. 0,88 (т, 7,3Гц, 3Н) Аналіз шляхом ТШХ (5% розчин метанолу в дихМС (XI) для C21H21CIN4O m/z 381 (МН+), 185. лорметані) вказав на завершення реакції. Реакцію Приклад 18 розводили дихлорметаном (100мл) і водою Трифторацетат 1-{2-[3-(2(100мл). Шари відділяли. Водну фракцію екстрагуамінофеніл)пропокси]етил}-1Н-імідазо[4,5вали дихлорметаном. Органічні фракції об'єднувас]хінолін-4-аміну ли, промивали розчином солі, сушили над сульфатом магнію і потім концентрували при зниженому тиску. Залишок очищували флешхроматографією (силікагель елююючи етилацетатом) з одержанням 4,22г 1-(1-{[(3хлорбензил)окси]метил}пропіл)-1Н-імідазо[4,5с]хіноліну у вигляді світло-оранжевого масла. 1 Н-ЯМР (300МГц, ДМСО-d6) 9,22 (с, 1Н), 8,63 (с, 1Н), 8,55 (д, Дж=7,8Гц, 1Н), 8,17 (дд, Дж=7,8, 1,5Гц, 1Н), 7,69 (м, 2Н), 7,23 (дд, Дж=4,9, 1,5Гц, 2Н), 7,08 (с, 1Н), 7,03 (м, 1Н), 5,40 (м, 1Н), 4,47 (с, 2Н), 3,34-4,07 (м, 2Н), 2,11 (м, 2Н), 0,88 (т, 7,3Гц, 3Н). МС (XI) для C21H20CIN3O m/z 366 (ΜΗ+), 332. Частина В Частина А В атмосфері азоту, N,N-(біс-трет 59 75622 60 бутоксикарбоніл)-1-[2-(2-пропінілокси)етил]-1Нхом фільтрації з одержанням 0,13г трифторацетаімідазо[4,5-с]хінолін-4-амін (0,50г, 1,07ммоль), ту 1-{2-[3-(2-амінофеніл)пропокси]етил}-1Нтриетиламін (0,39мл, 2,79ммоль) і безводий ацеімідазо[4,5-с]хінолін-4-аміну у вигляді білої твердої тонітрил (10мл) об'єднували. Одержаний розчин речовини. нагрівали до 80°С. Поки реакційна суміш нагріваАналіз: Розраховано для C21H23N5O·C2ΗF3Ο2: лась, додавали 2-йоданілін (0,26мл, 1,18ммоль), %С, 58,10; %Н, 5,09; %Ν, 14,73; Знайдено: %С, йодид міді (І) (0,012г) і дихлор57,78; %Н, 4,97; %Ν, 14,59. 1 біс(трифенілфосфін)паладій(ІІ) (0,023г). Реакційну Н-ЯМР (300МГц, ДМСО-d6) 8,87 (широкий с, суміш нагрівали при 80°С протягом ночі. Ацетоніт1Н), 8,49 (с, 1Н), 8,36 (д, Дж=7,8Гц, 1Η), 7,83 (д, рил видаляли при зниженому тиску і залишок Дж=8,3Гц, 1Н), 7,72 (т, Дж=7,3Гц, 1Н), 7,56 (т, очищували флеш-хроматографією (силікагель Дж=7,6Гц, 1Н), 6,81 (т, Дж=7,6Гц, 1Н), 6,51 (м, 2Н), елююючи 3% розчином метанолу в дихлорметані) 6,32 (т, Дж=6,8Гц, 1Н), 4,90 (т, Дж=4,6Гц, 2Н), 3,85 з одержанням 0,47г N,N-(біс-трет(т, Дж=4,9Гц, 2Н), 3,33 (т, Дж=6,1Гц, 2Н), 2,22 (т, бутоксикарбоніл)-1-(2-{[3-(2-амінофеніл)проп-2Дж=7,3Гц, 2Н), 1,55 (м, 2Н). ініл]окси}етил)-1H-імідазо[4,5-с]хінолін-4-аміну у ІЧ (КВr) 3414, 3335, 3253, 3019, 1738, 1202, вигляді коричневої твердої речовини. 1185, 1131см-1 1 Н-ЯМР (300МГц, ДМСО-d6, D2O) 8,47 (д, ВРМС (EI) Розраховано для C21H23N5O (М+) Дж=3,6Гц, 1Η), 8,37 (с, 1Η), 8,10 (д, Дж=9,6Гц, 1Н), 361,1903, знайдено 361,1903. 7,75 (м, 2Н), 7,04 (т, Дж=7,2Гц, 1Н), 6,80 (м, 1Н), Приклад 19 6,65 (д, Дж=8,3Гц, 1Н), 6,45 (т, Дж=7,3Гц, 1Н), 4,98 4-{[2-(4-Аміно-1H-імідазо[4,5-с]хінолін-1(т, Дж=4,4Гц, 2Н), 4,36 (с, 2Н), 4,08 (т, Дж=4,9Гц, іл)етокси]метил}бензонітрил 2Н), 1,31 (с, 18Н). Частина В Каталізатор (5% платина на вугіллі) додавали до розчину N,N-(біс-трет-бутоксикарбоніл)-1-(2-{[3(2-амінофеніл)проп-2-ініл]окси}етил)-1Німідазо[4,5-с]хінолін-4-аміну в метанолі. Суміш гідрували на апараті Парра при 50псі (3,5кг/см2) протягом ночі. Реакційну суміш фільтрували через шар Celite і осад на фільтрі промивали додатковим метанолом. Фільтрат концентрували при зниженому тиску з одержанням не зовсім білої твердої речовини. Цей матеріал очищували флешхроматографією (силікагель елююючи дихлорметаном, потім 1% розчином метанолу в дихлормеЧастина А тані, потім 2% розчином метанолу в дихлорметані 2-(1Н-Імідазо[4,5-с]хінолін-1-іл)етанол (1,5г, і наостанці 3% розчином метанолу в дихлормета7,0ммоль) додавали до суміші, що перемішується, ні) з одержанням ~0,25г N,N-(біс-трет-бром-п-толунітрилу (1,79г, 9,1ммоль), гідроксиду бутоксикарбоніл)-1-{2-[3-(2натрію (20мл, 50% розчин), дихлорметану (20мл) і амінофеніл)пропокси]етил}-1Н-імідазо[4,5хлориду бензилтриметиламонію (0,06г, 0,3ммоль). с]хінолін-4-аміну у вигляді світло-жовтого масла. Реакцію витримували 18 годин і потім розводили 1 Н-ЯМР (300МГц, ДМСО-d6) 8.23 (дд, Дж=8,4, дихлорметаном (20мл) і водою (20мл). Дві фази 0,9Гц, 1Н), 8,16 (дд, Дж=8,4, 0,9Гц, 1Η), 7,97 (с, відділяли і водну фракцію екстрагували додатко1Η), 6,96 (дт, Дж=7,5, 1,6Гц, 2Н), 6,87 (дд, Дж=7,5, вою кількістю дихлорметану. Органічні фракції 1,4Гц, 1Н), 6,62 (дт, Дж=7,3, 1,0Гц, 1Н), 6,57 (дд, об'єднували, промивали водою, сушили (MgSO4), Дж=8,3, 1,1Гц, 1Н), 5,29 (с, 1Н), 4,71 (т, Дж=5,3Гц, фільтрували і концентрували. Залишок очищували 2Н), 3,91 (т, Дж=5,1Гц, 2Н), 3,38 (т, Дж=6,0Гц, 2Н), флеш-колонковою хроматографією (силікагель, 2,39 (т, Дж=7,4Гц, 2Н), 1,76 (м, 2Н), 1,41 (широкий 9/1 дихлорметан/метанол) з одержанням 1,8г 4-{[2с, 18Н). (1H-імідазо[4,5-с]хінолін-1+ МС (XI) для C31H39N5O5 m/z 562 (МН ), 462, іл)етокси]метил}бензонітрилу. 362,229. 1 Н ЯМР (500МГц, ДМСО-d6) 9,22 (с, 1Н), 8,41 Частина С (с, 1Н), 8,40 (д, Дж=1,1Гц, 1Н), 8,17 (дд, Дж=8,3, Розчин матеріалу з Частини В в безводному 1,2Гц, 1Н), 7,72 (дт, Дж=7,6, 1,3Гц, 1Н), 7,66 (дт, дихлорметані (4мл) додавали при перемішуванні Дж=7,6, 1,3Гц, 1Н), 7,63 (д, Дж=8,3Гц, 2Н), 7,25 (д, до розчину трифтороцтової кислоти (2мл) і безвоДж=8,2Гц, 2Н), 4,97 (т, Дж=5,1Гц, 2Н), 4,53 (с, 2Н), дного дихлорметану (2мл), який охолоджували до 3,97 (т, Дж=5,5Гц, 2Н). 0°С. Реакційну суміш тримали на льодяній бані МС (XI) m/е 329 (М+Н). приблизно 2 години і потім її залишали нагрітись Частина В до температури навколишнього середовища. Реа3-Хлорпероксибензойну кислоту (1,6г, кційну суміш перемішували при температурі на5,5ммоль, 60% ваги) повільно додавали до розчивколишнього середовища протягом ночі. Леткі рену 4-{2-(1H-імідазо[4,5-с]хінолін-1човини видаляли при зниженому тиску з іл)етокси]метил}бензонітрилу (1,8г, 5,5ммоль) в одержанням рожевого масла. Масло розчиняли в хлороформі (50мл). Реакцію витримували протяетилацетаті (~3мл), триетиламін (~1мл) додавали гом ночі і потім послідовно промивали насиченим по краплях. Суміш залишали перемішуватись прирозчином бікарбонату натрію (200мл), водою близно на годину. Одержаний осад виділяли шля
ДивитисяДодаткова інформація
Назва патенту англійськоюAryl ether substituted imidazoquinolines, pharmaceutical composition based thereon
Назва патенту російськоюИмидазохинолины, замещенные ариловыми эфирами, фармацевтическая композиция на их основе
МПК / Мітки
МПК: A61P 31/12, C07D 471/04, C07D 235/00, C07D 221/00, A61K 31/437, A61P 35/00
Мітки: етерами, основі, композиція, фармацевтична, імідазохіноліни, заміщені, ариловими
Код посилання
<a href="https://ua.patents.su/61-75622-imidazokhinolini-zamishheni-arilovimi-eterami-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Імідазохіноліни, заміщені ариловими етерами, фармацевтична композиція на їх основі</a>
Попередній патент: Чорна матова глазур
Наступний патент: Відкривальний пристрій
Випадковий патент: Радіолокаційна станція












