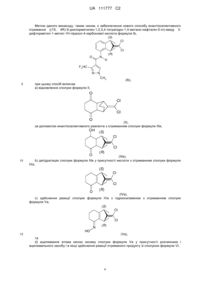
Спосіб стереоселективного отримання піразолкарбоксаміду
Формула / Реферат
1. Спосіб енантіоселективного отримання ((1S,4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іл)-аміду 3-дифторметил-1-метил-1Н-піразол-4-карбонової кислоти формули Іb
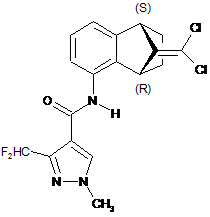 , (Ib)
, (Ib)
при цьому спосіб включає
а) відновлення сполуки формули II
 , (II)
, (II)
за допомогою енантіоселективного реагента з отриманням сполуки формули ІІІе
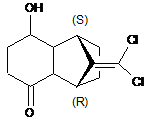 , (ІІІе)
, (ІІІе)
b) дегідратацію сполуки формули ІІІе в присутності кислоти з отриманням сполуки формули IVa
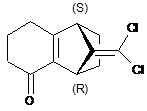 , (IVa)
, (IVa)
с) здійснення реакції сполуки формули IVa з гідроксиламіном з отриманням сполуки формули Va
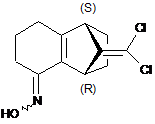 , (Va)
, (Va)
та
d) ацилювання атома кисню оксиму сполуки формули Va в присутності розчинника і ацилювального засобу і в кінці здійснення реакції отриманого продукту зі сполукою формули VI
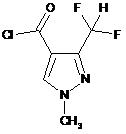 ,(VI) або
,(VI) або
e) здійснення реакції сполуки формули V з надлишком сполуки формули VI.
2. Спосіб за п. 1, який відрізняється тим, що енантіоселективне відновлення сполуки формули II здійснюють шляхом гідрування у присутності каталізатора на основі перехідного металу.
3. Спосіб за п. 1, який відрізняється тим, що енантіоселективне відновлення сполуки формули II здійснюють шляхом гідрування з перенесенням водню у присутності каталізатора на основі перехідного металу.
4. Спосіб за п. 1, який відрізняється тим, що енантіоселективний реагент являє собою рутенієвий каталізатор.
5. Спосіб за п. 2, який відрізняється тим, що енантіоселективний реагент являє собою рутенієвий каталізатор.
6. Спосіб за п. 3, який відрізняється тим, що енантіоселективний реагент являє собою рутенієвий каталізатор.
7. Спосіб за п. 1, який відрізняється тим, що енантіоселективний реагент являє собою хлор{(R)-(+)-2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'-бінафтил}[(2R)-(-)-1-(4-метоксифеніл)-1'-(4-метоксифеніл-kС)-3-метил-1,2-бутандіамін]рутеній(ІІ).
8. Спосіб за п. 1, який відрізняється тим, що енантіоселективний реагент являє собою дихлор[(4S,5S)-(+)-4,5-біс(дифенілфосфінометил)-2,2-диметил-1,3-діоксолан][(S)-(-)-2-(а-метилметанамін)-1Н-бензимідазол]рутеній(ІІ).
9. Сполука (1S,4R)-9-дихлорметилен-8-гідроксіоктагідро-1,4-метанонафталін-5-он формули ІІІе
 (ІІІе), та її ізомери.
(ІІІе), та її ізомери.
10. Сполука (1S,4R)-9-дихлорметилен-2,3,4,6,7,8-гексагідро-1Н-1,4-метанонафталін-5-он формули
 (IVa), та її ізомери.
(IVa), та її ізомери.
11. Сполука оксим (1S,4R)-9-дихлорметилен-2,3,4,6,7,8-гексагідро-1Н-1,4-метанонафталін-5-ону формули Va
 (Va)
(Va)
та її ізомери.
12. Сполука формули ХХІІІа
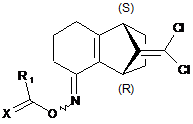 , (ХХІІІа)
, (ХХІІІа)
де X являє собою кисень або сірку, R1 являє собою С1-С6алкокси, СН3-С(=СН2)-О-, фенокси або трихлорметокси; та її ізомери.
13. Сполука формули XXIVa
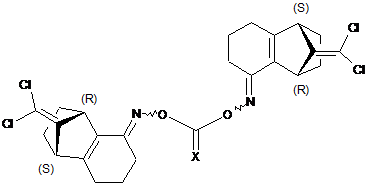 , (XXIVa)
, (XXIVa)
де X являє собою кисень або сірку, та її ізомери.
Текст
Реферат: Даний винахід стосується способу енантіоселективного отримання ((1S,4R)-9-дихлорметилен1,2,3,4-тетрагідро-1,4-метанонафталін-5-іл)-аміду 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти формули Іb (S) Cl Cl N O (R) H F2HC N N CH3 (Ib). UA 111777 C2 (12) UA 111777 C2 UA 111777 C2 5 10 Даний винахід відноситься до способу стереоселективного (енантіоселективного) отримання ((1S, 4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3-дифторметил1-метил-1H-піразол-4-карбонової кислоти. Сполуку (9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5-іл)-амід 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти описано, наприклад, в WO 2007/048556. Зазначена сполука проявляє високу фунгіцидну активність та є, наприклад, ефективною для зменшення забруднення мікотоксинами у рослин. Мікотоксини (афлатоксини, охратоксини, патулін, фумонізини, зеараленони, трихотецени, зокрема, деоксініваленол) продукуються, наприклад, різними видами Fusarium та Aspergillus, Penicillium та Alternaria, як описано в WO 2012/072575. Зазначена сполука може перебувати в двох енантіомерних формах: Ia, (R) Cl Cl O (S) N H F2HC N N CH3 (Ia), хімічною назвою якої є ((1R, 4S)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти, і Ib, (S) Cl Cl O N (R) H F2HC N N 15 20 25 CH3 (Ib), хімічною назвою якої є ((1S, 4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти. Енантіомер формули Ib проявляє більш виражену фунгіцидну активність. Фунгіцид з надлишком фунгіцидно більш активного енантіомеру можна застосовувати при більш низьких концентраціях з такою ж ефективністю, що і для рацемату, що є економічно вигідним. Таким чином, дуже бажано селективно отримувати Ib-енантіомер зазначеної сполуки. З WO 2011/015416 відомо отримання рацемічної форми (9-дихлорметилен-1,2,3,4тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3-дихлорметил-1-метил-1H-піразол-4-карбонової кислоти шляхом a) відновлення сполуки формули II, (II), у присутності відновлювального засобу з отриманням сполуки формули III, 1 UA 111777 C2 (III), b) дегідратації сполуки формули III у присутності кислоти з отриманням сполуки формули IV, (IV), c) здійснення реакції сполуки формули IV з гідроксиламіном з отриманням сполуки формули 5 10 15 20 V, (V), та d) ацилювання атома кисню оксиму сполуки формули V у присутності розчинника та ацилювального засобу і в кінці шляхом здійснення реакції отриманого продукту зі сполукою формули VI, (VI), або e) здійснення реакції сполуки формули V з надлишком сполуки формули VI. Отриманий таким способом продукт являє собою (9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти в формі рацемату. Два енантіомери (9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти можна розділяти, наприклад, за допомогою хіральної хроматографії рацемату. Однак, зазначений спосіб є дорогим і не підходить для великомасштабного отримання зазначеної сполуки. Сполуку формули III отримували згідно WO 2011/015416 в рацемічній формі у вигляді суміші ізомерів, показаних нижче як сполуки IIIa, IIIb, IIIc і IIId: (IIIa), (IIIb), 2 (IIIc), UA 111777 C2 5 (IIId), Несподівано було виявлено, що ((1S, 4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти (енантіомер формули Ib) може бути отриманий за допомогою даного способу в надлишку по відношенню до ((1R, 4S)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3-дифторметил1-метил-1H-піразол-4-карбонової кислоти (енантіомер формули Ia), якщо енантіоселективний етап являє собою енантіоселективний синтез сполуки формули III так, що енантіомер (1S, 4R)9-дихлорметилен-8-гідроксі-октагідро-1,4-метано-нафталін-5-он формули IIIe, OH (S) Cl Cl O 10 (IIIe), отримують у надлишку. Енантіоселективний синтез сполуки формули III забезпечує можливість економічно високоефективного отримання фунгіциду ((1S, 4R)-9-дихлорметилен1,2,3,4-тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти з високим виходом продукту. Сполука формули IIIe може перебувати у формі наступних ізомерів формул IIIf-IIIm: OH H (S) OH H (S) Cl H (R) O (IIIf), OH H (S) OH Cl H (S) Cl Cl 15 (R) Cl H (R) O (IIIg), OH H (S) Cl O OH H (R) (IIIh), H (S) OH Cl Cl Cl O Cl Cl Cl H (R) (IIIi), O OH H (S) H (R) (IIIj), 25 (IIIk), Cl Cl Cl H (R) O (IIIL), (IIIm). Даний винахід охоплює отримання усіх ізомерів формули IIIe. Крім того, було виявлено, що ((1S, 4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти (енантіомер формули Ib) може бути отриманий з високим виходом, якщо сполука формули IIIe може бути отримана селективно у формі її ізомеру формули IIIf. Отримання сполуки формули IIIf в енантіомерно збагаченій формі, тобто у надлишку по відношенню до ізомерів формул IIIg-IIIm, забезпечує можливість більш високого виходу продукту на етапі дегідратації, що призводить до більшого виходу енантіомеру формули Ib. O 20 H (R) H (S) Cl H (R) O 3 UA 111777 C2 Метою даного винаходу, таким чином, є забезпечення нового способу енантіоселективного отримання ((1S, 4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти формули Ib, (S) Cl Cl O (R) N H F2HC N N CH3 5 (Ib), при цьому спосіб включає a) відновлення сполуки формули II, (II), за допомогою енантіоселективного реагента з отриманням сполуки формули IIIe, OH (S) Cl Cl O 10 (R) (IIIe), b) дегідратацію сполуки формули IIIe у присутності кислоти з отриманням сполуки формули IVa, (S) (R) (IVa), c) здійснення реакції сполуки формули IVa з гідроксиламіном з отриманням сполуки формули Va, (S) (R) 15 (Va), та d) ацилювання атома кисню оксиму сполуки формули Va у присутності розчинника і ацилювального засобу і в кінці здійснення реакції отриманого продукту зі сполукою формули VI, 4 UA 111777 C2 5 10 15 20 25 30 35 40 45 (VI), або e) здійснення реакції сполуки формули V з надлишком сполуки формули VI. Отриманий цим способом продукт являє собою (9-дихлорметилен-1,2,3,4-тетрагідро-1,4метано-нафталін-5-іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти I у формі суміші сполук формули Ia і Ib, де ((1S, 4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти (Ib) присутній в суміші в надлишку 55-99 % по відношенню до сполуки формули Ia. Алкільні групи, що зустрічаються у визначеннях замісників, можуть мати прямий або розгалужений ланцюг і являють собою, наприклад, метил, етил, н-пропіл, н-бутил, н-пентил, нгексил, ізо-пропіл, втор-бутил, ізо-бутил або трет-бутил. Алкоксигрупи, що зустрічаються у визначеннях замісників, можуть мати прямий або розгалужений ланцюг і являють собою, наприклад, метоксі, етоксі, н-пропоксі, н-бутоксі, нпентоксі, н-гексилоксі, ізо-пропоксі, н-бутоксі, втор-бутоксі, ізо-бутоксі або трет-бутоксі. Згідно з даним винаходом отримання в енантіомерно збагаченій формі або у надлишку означає, що молярний вміст бажаного продукту (формули IIIe, формули IIIf і формули Ib) складає більше 50 % (наприклад, більше 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 або 99 %) від загальної кількості усіх ізомерів, присутніх в реакційній суміші. Етап реакції a) Відновлення карбонільних сполук з отриманням спиртів є реакцією, що представляє значний практичний інтерес. Як з економічної, так і з екологічної точки зору, каталітичні способи є більш доцільними, ніж системи стехіометричного відновлення. Гарні результати були отримані с із застосуванням каталітичних систем на основі перехідних металів, наприклад, Ir, Rh, Pd, Ni і Ru. Крім того, за допомогою придатного хірального каталізатора може бути досягнуто енантіоселективне гідрування карбонільних сполук з утворенням оптично активних спиртів з високими значеннями енантіомерного надлишку. (Catalytic asymmetric synthesis, Iwao Ojima, third Edition, Wiley-VCH 2010, pp 384-413 і літературні джерела, наведені в ньому.) У цьому відношенні похідні рутенію типу [Ru(фосфін або дифосфін)~(амін або діамін)] в основному середовищі, як було показано, проявляють себе як чудові каталізатори для селективного гідрування в гомогенній фазі різних типів кетонів. Реакції, як правило, здійснюють із застосуванням водню під тиском при помірних температурах. (R. Noyori, T. Ohkuma, Angew. Chem. Int. Ed. Engl. 2001, 40, 40-73) У якості альтернативи також були розроблені способи каталітичного відновлення на основі реакцій перенесення водню. У цих способах у якості джерела водню зазвичай застосовують 2пропанол або мурашину кислоту. У цьому відношенні похідні рутенію типу [Ru(арен)~(похідне діаміну)], а також похідні родію та іридію, як було показано, проявляють себе як чудові каталізатори для селективного гідрування в гомогенній фазі різних типів кетонів. (T. Ikariya, A. J. Blacker, Acc. Chem. Res. 2007, 40, 1300-1308) У відношенні як гідрування, так і гідрування з перенесенням водню було однак виявлено, що один конкретний каталізатор або клас каталізаторів не може однаково ефективно застосовуватися у всіх реакціях гідрування, але що кожну задачу відновлення необхідно розглядати окремо з урахуванням застосовуваного каталізатора і умов. Це особливо стосується випадку реакцій гідрування, які відбуваються з каталізаторами, які містять не тільки ліганд і перехідний метал, але які, як було зазначено в наведених вище випадках, потребують присутності двох різних лігандів і перехідного металу для того, щоб вони були достатньо активними. Мезо-дикетони формули VII, 5 UA 111777 C2 (VII), де A являє собою метиленову групу, яка може бути заміщеною, наприклад, A являє собою групу 5 1 3 10 15 20 25 2 де кожний з R і R незалежно один від одного являє собою водень, галоген, C 1-C4алкіл, C1C4алкоксі, C1-C4галогеналкіл або C1-C4галогеналкоксі; або A являє собою групу 4 де кожний з R і R незалежно являє собою водень, галоген, C1-C4алкіл, C1-C4алкоксі, C1C4галогеналкіл або C1-C4галогеналкоксі; без зусиль отримують з продуктів приєднання за реакцією Дильса-Альдера п-бензохінону і необов'язково заміщеного циклопентадієну, необов'язково з наступним відновленням подвійних зв'язків. На відміну від легкості і доступності синтезу, були проведені всього декілька досліджень з енантіоселективного відновлення з десиметризацією сполуки формули VII. S. Bräse та співавтори (C. F. Nising, U. K. Ohnemüller, S. Bräse, Synthesis 2006, 16, 2643–2645) повідомляли про енантіоселективну десиметризацію сполуки формули VIIa із застосуванням відновлення Кори-Бакши-Шибата (CBS), однак низька температура (від -30 до -78 °C) і висока вартість реагента катехолборану обмежує його практичне застосування. (VIIa) Marchand і співавтори (Marchand, A. P.; Xing, D.; Wang, Y.; Bott, S. G.Tetrahedron: Asymmetry 1995, 6, 2709-2714) розробляли асиметричне відновлення сполуки формули VIIa з використанням пекарських дріжджів, однак надзвичайно довгий час реакції (60 год.), невеликий вихід і малий об'єм виходу роблять даний спосіб непридатним для застосування в промисловому масштабі. Слід також відзначити, що ці каталізатори в цілому не дозволяють отримувати обидва енантіомери. Noyori і співавтори (S. Hashiguchi, A. Fujii, J.K. Haack, K. Matsumura, T. Ikariya, R. Noyori, Angew. Chem. Int. Ed. Engl. 1997, 36, 288-290) повідомляли про енантіоселективний синтез гідроксикетону (VIII) шляхом Ru-каталізованого перенесення водню, але тільки у напрямку окиснення (починаючи з відповідного мезо-діолу). (VIII) 6 UA 111777 C2 5 10 15 20 З реферату: "Даний спосіб забезпечує отримання спиртів, яке не доступно з відповідних кетонів шляхом стандартного енантіоселективного відновлення.“, та з посібника по енантіоселективному відновленню прохіральних кетонів за допомогою 2пропанола в якості джерела водню «…висока енантіоселективність неможлива при отриманні спиртів, що мають високий відновний потенціал, таких як 2,3-бензо-2-цикленоли і 1фенілетаноли з електронодонорною групою на ароматичному кільці". McIntosh і співавтори (D. R. Clay, A. G. Rosenberg, M. C. McIntosh, Tetrahedron:Asymmetry 2011, 22, 713-716.) повідомляли про енантіоселективне і діастереоселективне гідрування з перенесенням водню (про гідрування не повідомлялося) епоксидикетону з чотиричленним кільцем (XX). Однак фахівцю в даній галузі техніки було б зрозуміло, що α,β-епоксидне кільце викликає зміну стеричних та електронних властивостей карбонільного фрагмента. Таким чином, неможливо було очікувати, що сполука з тричленним кільцем без епоксидного кільця зможе реагувати аналогічно щодо стереоселективності. (XX) Таким чином, у світлі ідей посилальних матеріалів, згаданих вище, фахівець в даній галузі техніки не міг би очікувати, що стереоселективне відновлення сполуки формули II за допомогою гідрування або гідрування з перенесенням водню буде відбуватися з високою енантіоселективністю та/або діастереоселективністю. Переважними енантіоселективними реагентами є комплекси рутенію, обрані з наступної групи, що складається зі сполук формул IX-XIV: Z (IX), 25 30 (X), (XI), (XII), (XIII), (XIV), де X і Y є однаковими або різними і являють собою галоген, водень або аніонну групу, наприклад, BH4 ; Z являє собою аніон, наприклад, BF4 , [B(C6F5)4] , TfO , ClO4 , SbF6 або PF6 , L являє собою арил, а саме фенільну групу, яка може бути заміщена C 1-C4алкілом, C1C4алкоксі або триалкілсилілом. Конкретні приклади включають, але без обмеження, бензол, пцимол, мезителен і гексаметилбензол. Каталізатори згідно з даним винаходом повинні бути хіральними. Наприклад, нехіральні каталізатори, такі як RuCl2(PPh3)2(en) (описаний, наприклад, в JP 11189600A2 і CN1680412, номер по CAS 212210-86-1 або 83438-00-0), 7 UA 111777 C2 RuCl2(PPh3)2(en), RuCl2(PPh3)2(pica) (описаний, наприклад, в WO 2005/105819, номер по CAS 850346-91-7 або 850424-31-6), 5 10 15 20 25 30 35 2 RuCL2 (PPh3)2(pica) і каталізатор, (номер по CAS 850424-32-7, 850346-92-8 і 850424-33-8), призводять до покращення рацемічних продуктів. Група формули (XV), (XV), в сполуках формул IX-XII являє собою ліганд, що містить фосфор, переважно хіральний ліганд, що містить фосфор, більш переважно хіральний біфосфін або біфосфіт або їх змішані форми. Хіральні ліганди, що містять фосфор, відомі з рівня техніки і можуть застосовуватися в даному винаході, приклади наведені в „Catalytic asymmetric synthesis", Iwao Ojima, third Edition, Wiley-VCH 2010, pp 344-357 і літературних джерелах, наведених в ньому; і в каталозі STREM лігандів і сполук, що містять фосфор: http://www.strem.com/uploads/resources/documents/phosphorusligands.pdf Переважні дифосфінові ліганди, представлені формулою (XV), за даним винаходом обрані з групи, що складається з 2,2'-біс(дифенілфосфіно-1,1'-бінафтил (binap); 2,2'-біс[ди(п-толіл)фосфіно]-1,1'-бінафтил (tolbinap); 2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'-бінафтил (xylbinap); 2,2'-біс[ди(п-трет-бутилфеніл)фосфіно]-1,1'-бінафтил; 2,2'-біс[ди(п-метоксифеніл)фосфіно]-1,1'-бінафтил; 2,2'-біс(дифенілфосфіно)-5,5',6,6',7,7',8,8'-октагідро-1,1'-бінафтил; 2,2'-біс(ди-п-толілфосфіно)-5,5',6,6',7,7',8,8'-октагідро-1,1'-бінафтил; 2,2'-біс(ди-3,5-ксилілфосфіно)-5,5',6,6',7,7',8,8'-октагідро-1,1'-бінафтил (xylyl-H8-binap); ((4,4'-бі-1,3-бензодіоксол)-5,5'-дііл)біс(дифенілфосфін) (segphos); (4,4'-бі-1,3-бензодіоксол)-5,5'-дііл)біс(ди(3,5-ксиліл)фосфін) (dm-segphos); (4,4'-бі-1,3-бензодіоксол)-5,5'-дііл)біс(ди(3,5-ди-трет-бутил-4-метоксифеніл)фосфін); 2,2'-біс(дифенілфосфіно)-6,6'-диметокси-1,1'-біфеніл (MeO-biphep); 2,2'-біс(ди-п-толілфосфіно)-6,6'-диметокси-1,1'-біфеніл (tolyl-MeO-biphep); 2,2'-біс(ди-3,5-ксилілфосфіно)-6,6'-диметокси-1,1'-біфеніл (xylyl-MeO-biphep); 2,2'-біс(дифенілфосфіно)-6,6'-диметил-1,1'-біфеніл; 8 UA 111777 C2 5 10 15 20 25 30 35 40 45 50 55 2,2'-біс(ди-o-толілфосфіно)-6,6'-диметил-1,1'-біфеніл; 2,2'-біс(ди-м-фторфенілфосфіно)-6,6'-диметил-1,1'-біфеніл; 2,2',6,6'-тетраметокси-4,4'-біс(дифенілфосфіно)-3,3'-біпіридин (p-phos); 2,2',6,6'-тетраметокси-4,4'-біс(ди-п-толілфосфіно)-3,3'-біпіридин (p-tolyl-p-phos); 2,2',6,6'-тетраметокси-4,4'-біс(ди-o-толілфосфіно)-3,3'-біпіридин (o-tolyl-p-phos); 2,2',6,6'-тетраметокси-4,4'-біс(ди-3,5-ксилілфосфіно)-3,3'-біпіридин (xylyl-p-phos); 4,12-біс(ди-3,5-ксилілфосфіно)-[2.2]-парациклофан; 4,12-біс(дифенілфосфіно)-[2.2]-парациклофан; 4,12-біс(ди-п-толілфосфіно)-[2.2]-парациклофан; 4,12-біс(ди-o-толілфосфіно)-[2.2]-парациклофан; N, N-диметил-1-[1',2-біс(дифенілфосфіно)фероценіл]етиламін; 2,3-біс(дифенілфосфіно)бутан (chiraphos); 1-циклогексил-1,2-біс(бісдифенілфосфіно)етан; 2,3-O-ізопропіліден-2,3-дигідрокси-1,4-біс(дифенілфосфіно)бутан; 1,2-біс[(o-метоксифеніл)фенілфосфіно]етан (dipamp); 1,2-біс(2,5-диметилфосфорано)етан; N, N'-біс(дифенілфосфіно)-N, N'-біс(l-фенілетил)етилендамін; 1,2-біс(дифенілфосфіно)пропан (prophos); 2,4-біс(дифенілфосфіно)пентан; циклогексиланісилметилфосфін; 2,3-біс(дифенілфосфіно)-5-норборнен; 3,4-біс(дифенілфосфіно)-1-бензилпіролідин; 1-[1',2-біс(дифенілфосфіно)фероценіл]етиловий спирт; 4,5-біс(дифенілфосфінометил)-2,2-диметил-1,3-діоксолан (diop); 4-(ізо-пропіл)-2-{(S)-2-(дифенілфосфіно)фероценіл}оксазолін; 3,4-біс(дифенілфосфіно)-1-бензилпіролідин (deguphos), 2,3-біс(дифенілфосфіно)-біцикло[2.2. 1]гепто-5-ен (NORPHOS); l-третинний-бутоксикарбоніл-4-дифенілфосфіно-2-(дифенілфосфінометил)піролідин (BPPM); 2,3-біс(третинний-бутилметилфосфіно)хіноксалін (QuinoxP*); 2,4-біс(дифенілфосфіно)пентан (SKEWPHOS); 2,4-біс(ди(3,5-ксиліл)фосфіно)пентан (XylSKEWPHOS); 4,4'-біс(дифенілфосфіно)-2,2',5,5'-тетраметил-3,3'-бітіофен (TMBTP); ксиліл-C3-тунефос; ксиліл-синфос; ліганди по типу Josiphos; ліганди по типу Garphos; Deguphos; PhanePHOS; BDPP; Norphos; ProPhos; 1,1'-біс(дифенілфосфіно)фероцен (DPPF); біс(2-дифенілфосфінофеніловий) простий ефір (DPEphos); біс(дифенілфосфіно)метан; 1,2-біс(дифенілфосфіно)етан; 1,3-біс(дифенілфосфіно)пропан та 1,4біс(дифенілфосфіно)бутан; 1,5-біс(дифенілфосфіно)пентан. Дифосфін, зокрема, наведений вище, може являти собою оптично активний дифосфін. Група формули (XVI) в сполуках формул IX-X являє собою ліганд, що містить аміногрупу, переважно хіральний ліганд, що містить аміногрупу, більш переважно хіральний діамінний ліганд. Хіральні ліганди, що містять аміногрупу, відомі з рівня техніки і можуть застосовуватися в даному винаході, приклади приведені в R. Noyor, T. Ohkuma, Angew. Chem., Int. Ed. Engl. 2001, 40, 40-73; в WO2004/007506 і в каталозі STREM інших лігандів: http://www.strem.com/uploads/resources/documents/other_ligands.pdf Конкретні приклади діамінних лігандів, представлених формулою (XVI), за даним винаходом включають 1,2-дифенілетилендіамін (DPEN); 1,2-біс(нафтил)етилендіамін; 1,1-біс(4-метоксифеніл)-3-метил-1,2-бутандіамін (DAIPEN); 1,2-біс(2-метоксифеніл)етан-1,2-діамін; спіро[4.4]нонан-1,6-діамін; 1-піролідинкарбонова кислота, 4-аміно-2-(амінометил)-,1,1-диметилетиловий складний ефір; 9 UA 111777 C2 5 10 15 20 25 30 35 40 45 1,3-дифеніл-1,3-пропандіамін; 1,4-дифеніл-1,4-бутандіамін; 1-феніл-1,2-етандіамін; 2-пиролідинметанамін; 3,4-O-ізопропіліденгексан-2,5-діамін (IPHAN); 2,3-O-ізопропіліденбутан-1,4-діамін (IPBAN); 1,2-циклогександіамін (DACH); 1,2-етандіамін (en); 1,2-пропандіамін; 2,4-пентандіамін; 2,5-гександіамін; 1,2-бензолдіамін; N1,N2-диметил-1,2-етандіамін та DMDPEN. Діамінні ліганді, зокрема наведені вище, можуть бути оптично активними. Група формули (XVII) в сполуці формули XII являє собою ліганд, що містить аміногрупу, з другою донорною групою, D переважно являє собою азот, сірку або фосфор. XVII необов'язково являє собою хіральний ліганд. Ряд хіральних лігандів, що містятьаміногрупу, відомий і може застосовуватися в даному винаході, приклади наведені в каталозі STREM інших лігандів: http://www.strem.com/uploads/resources/documents/other_ligands.pdf Конкретні приклади лігандів, що містять аміногрупу, представлених формулою (XVII), за даним винаходом включають 2-(α-метилметанамін)-1H-бензимідазол (Me-BIMAH); 2-(α-(ізо-пропіл)метанамін)-1H-бензимідазол (i-Pr-BIMAH); 2-(α-(ізо-бутил)метанамін)-1H-бензимідазол (i-Bu-BIMAH); 2-(α-(трет-бутил) метанамін)-1H-бензимідазол (t-Bu-BIMAH); 2-(ді-ізо-пропілфосфіно)етанамін; 2-(дифенілфосфіно)етиламін; 2-піридинметанамін (PICA); 1-(2-піридил)етанамін; 2-(дифенілфосфіно)-1,2-дифенілетанамін; 2-аміно-1-фенілпропілдифенілфосфін і 3-(дифенілфосфіно]пропіламін. Ліганди, зокрема наведені вище, можуть бути оптично активними. Група формули (XVIII) в сполуці формули XIII являє собою аміносульфонамідний ліганд, більш переважно хіральний аміносульфонамідний ліганд. Ряд хіральних аміносульфонамідних лігандів відомий і може застосовуватися в даному винаході, приклади наведені в T. Ikariya, A. J. Blacker, Acc. Chem. Res. 2007, 40, 1300-1308. Конкретні приклади аміносульфонамідніх лігандів, що являють собою сполуку формули XVIII, включають N-(4-толуолсульфоніл)-1,2-дифенілетилендіамін (TsDPEN); N-(метансульфоніл)-1,2-дифенілетилендіамін (MsDPEN) та N-пентафторфенілсульфоніл-1,2-дифенілетилендіамін (FsDPEN). Група формули 10 UA 111777 C2 L 5 10 15 20 25 30 35 40 N (XIX) в сполуці формули XIV являє собою арил-аміно-сульфонамідний ліганд, більш переважно хіральний ліганд, що містить L (визначення вище) і N ∩ N-SO2R (VIII, визначення вище), з'єднані C1-6мостиком, який може бути необов'язково перерваний гетероатомом. Ряд хіральних арил-аміно-сульфонамідних лігандів відомий і може застосовуватися в даному винаході, приклади наведені в T. Touge, T. Hakamata, H. Nara, T. Kobayashi, N. Sayo, T. Saito, Y.Kayaki, T. Ikariya J. Am. Chem. Soc. 2011, 133, 14960-14963 і в Hannedouche, J.; Clarkson, G. J.; Wills, M. J. Am. Chem. Soc. 2004, 126, 986-987. Конкретні приклади арил-аміно-сульфонамідних лігандів, представлених формулою (XIX), за даним винаходом включають N-[2-(фенетилоксиметиламіно)-1,2-дифеніл-етил]бензолсульфонамід; N-[1,2-дифеніл-2-(3-фенілпропіламіно)етил]бензолсульфонамід та N-[1,2-дифеніл-2-(4-фенілбутиламіно)етил]бензолсульфонамід. Ліганди, зокрема наведені вище, можуть бути оптично активними. Група формули (XXI) в сполуці формули XI являє собою тридентатний діамінний ліганд, більш переважно a b c хіральний тридентатний діамінний ліганд. Кожний з R , R і R незалежно являє собою атом водню, необов'язково заміщену C1-C20алкільну групу, необов'язково заміщену C2-C20алкенільну групу, необов'язково заміщену C3-C8 циклоалкільну групу, необов'язково заміщену C7C20аралкільну групу, необов'язково заміщену арильну групу або необов'язково заміщену b c гетероциклічну групу, а R і R можуть утворювати алкіленову групу або алкілендіоксигрупу; N1 N2 N3 N4 кожний з R , R , R і R незалежно являє собою атом водню, необов'язково заміщену C1C20алкільну групу, необов'язково заміщену C2-C20алкенільну групу, необов'язково заміщену C3C8циклоалкільну групу, необов'язково заміщену C7-C20аралкільну групу, необов'язково заміщену N1 N2 N3 N4 C3-C8циклоалкільну групу, щонайменше один з R , R , R і R являє собою атом водню, а N1 a R і R можуть утворювати алкіленову групу; n являє собою ціле число від 0 до 3, а Ar являє собою необов'язково заміщену ариленову групу. Переважні необов'язкові замісники описані в WO 2011/135753. Ряд придатних тридентатних діамінних лігандів і відповідних комплексів рутенію (XI) відомий і може застосовуватися в даному винаході, приклади наведені в WO2011/135753. Конкретний тридентатний діамінний ліганд, представлений формулою (XXI), за даним винаходом являє собою 1-(4-метоксифеніл)-1’-(4-метоксифеніл-kC)-3-метил-1,2-бутандіамін. Конкретні приклади комплексів рутенію, представлених формулою (IX), за даним винаходом включають RuCl2[(R)-xylbinap][(R, R)-dpen] CAS= [220114-38-5]: дихлор{(R)-(+)-2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'-бінафтил0}[(1R, 2R)-(+)-1,2дифенілетилендіамін]рутеній(II) та RuCl2[(R)-xylbinap][(R)-daipen] CAS = [220114-32-9]: дихлор{(R)-(+)-2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'-бінафтил}[(2R)-(-)-1,1-біс(4-метоксифеніл)3-метил-1,2-бутандіамін]рутеній(II); RuCl2[(R)-xylbinap][(R, R)-dpen, CAS = [220114-38-5], та RuCl2[(R)-xyl-P-Phos][(R)-iphan], CAS = [832117-89-2]. 11 UA 111777 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважним прикладом комплексів рутенію, представлених формулою (XI), за даним винаходом є (R)-RUCY™-XylBINAP, номер в каталозі Strem 44-0217, хлор{(R)-(+)-2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'-бінафтил}[(2R)-(-)-1-(4-метоксифеніл)-1’-(4метоксифеніл-kC)-3-метил-1,2-бутандіамін]рутеній(II). Переважним прикладом комплексів рутенію, представлених формулою (XII), за даним винаходом є RuCl2[(S, S)-DIOP](S)-Me-BIMAH (номер в каталозі Strem=44-0955), дихлор[(4S, 5S)-(+)-4,5-біс(дифенілфосфінометил)-2,2-диметил-1,3-діоксолан][(S)-(-)-2-(αметилметанамін)-1H-бензимідазол]рутеній(II). Прикладом комплексів рутенію, представлених формулою (XIII), за даним винаходом є RuCl[(S, S)-Tsdpen](p-cymene), CAS = [192139-90-5], хлор{[(1S, 2S)-(+)-2-аміно-1,2-дифенілетил](4-толуолсульфоніл)амідо}(п-цимол)рутеній(II). Прикладом комплексів рутенію, представлених формулою (XIV), за даним винаходом є (S, S)-Ts-DENEB™, CAS = [1384974-37-1], N-[(1S, 2S)-1,2-дифеніл-2-(2-(4метилбензилоксі)етиламіно)-етил]-4-метилбензол-сульфонамід(хлор)рутеній(II). Відомі два варіанти способу здійснення реакцій енантіоселективного каталітичного гідрування, які принципово відрізняються (за допомогою молекулярного водню або гідрування з перенесенням водню). Також спосіб, що є об'єктом даного винаходу, можна здійснювати або у присутності молекулярного водню, або шляхом гідрування з перенесенням водню. Обидва типи способу були оцінені у рівні техніки і можуть застосовуватися аналогічним чином. (Catalytic asymmetric synthesis, Iwao Ojima, third Edition, Wiley-VCH 2010, pp 384-413) Було виявлено, що кислотні залишки впливають на дану реакцію таким чином, що, з одного боку, вони призводять до невеликого виходу продукту, а, з іншого боку, обумовлюють низьке енантіомерне збагачення продуктів. Таким чином, була доведена перевага присутності основи на етапі реакції a) згідно з даним винаходом. Придатними основами є, наприклад, алкоголяти лужних металів, такі як, наприклад, метанолат натрію, етанолат натрію або трет-бутилат калію або ізопропілат калію, або карбонати, або гідроксиди лужних або лужноземельних металів. Також переважними є органічні азотисті основи, такі як піридин, DMAP, триетиламін, основа Хуніга, 1,2-етилендіамін, дифенілендіамін, 1,2-ді-(4-анізил)-2-ізобутил-1,2-етилендіамін та 1,2-ді(4-анізил)-2-ізопропіл-1,2-етилендіамін. Особливо переважною основою є трет-бутилат калію. Фахівець в даній галузі техніки здатний визначити придатну достатню кількість надлишку основи. Молярний надлишок основи по відношенню до застосовуваного каталізатора від 1:1 до 1000: 1 є переважним, надлишок > 10: 1 є особливо переважним, а надлишок > 2: 1 є найбільш переважним. Одна з основ, зазначених вище, відповідно, додають до субстрату в кількості 0,150 мол. %, особливо переважно 0,1-10 % і найбільш переважно 0,1-5 % по відношенню до останнього. Усі інертні розчинники, відомі фахівцю в даній галузі техніки, можуть застосовуватися з цією метою, також можуть застосовуватися суміші таких розчинників в будь-якій композиції. Переважні класи розчинників включають спирти, прості ефіри, складні ефіри, нітрили, аміни, аміди, вуглеводні, ароматичні вуглеводні та хлоровані вуглеводні. Зокрема, зазначені розчинники та суміш розчинників згідно з даним винаходом включають метанол, етанол, ізопропанол, трет-бутанол, етилацетат, ізопропілацетат, ацетонітрил, триетиламін, тетрагідрофуран, 2-метил-тетрагідрофуран, тетрагідрофуран-2-ілметанол, толуол, ксилол, хлорбензол, диметилацетамід, диметилформамід-N-метил-2-піролідон. Включений в гідрування або гідрування з перенесенням водню каталізатор переважно застосовують в концентрації 0,001-5 мол. % по відношенню до субстрату, який передбачається гідрувати. Особливо переважно застосовувати каталізатор в як можна меншій концентрації, яка забезпечує оптимальну можливу швидкість перетворення. Особливо переважно каталізатор застосовують в концентрації 0,01-1 мол. %. Температура в ході реакції гідрування або гідрування з перенесенням водню може бути, в принципі, обрана довільно фахівцем в даній галузі техніки, за умови, що досягається достатньо швидка і селективна реакція. Реакцію, відповідно, переважно здійснюють при температурах від 10° до 100 °C, більш переважно від 0° до 80 °C і особливо переважно від 0° до 60 °C. Час реакції гідрування або гідрування з перенесенням водню складає від 10 хвилин до 48 годин, переважно від 30 хвилин до 24 годин, найбільш переважно від 1 години до 12 годин. Гідрування за даним винаходом здійснюють в присутності молекулярного водню, потім тиск водню слід відрегулювати до 0,1-20, переважно 0,2-10 і особливо переважно 1-8 МПа. Гідрування з перенесенням водню за даним винаходом здійснюють в присутності донора водню, такого як мурашина кислота або її сіль або 2-пропанол або інші спирти, що містять атом 12 UA 111777 C2 5 водню в α-положенні. Серед комбінацій донора водню і основи, якщо донором водню є мурашина кислота, переважно застосовувати амін у якості основи. В даному випадку мурашину кислоту і амін можна додавати окремо в реакційну систему або також допустимо використовувати суміш мурашиної кислоти та аміну (наприклад, азеотропну суміш мурашиною кислоти і триетиламіну), отриману заздалегідь. Якщо донор водню являє собою рідину, його можна застосовувати в якості розчинника або співрозчинника в реакції. Сполука формули IIIe, OH (S) Cl Cl O (R) (IIIe), та її ізомери формул IIIf-IIIm, OH H (S) OH Cl H (S) Cl 10 O (IIIf), H (S) O (IIIg), OH Cl H (S) OH (IIIi), H (S) OH 20 25 30 H (S) O OH Cl Cl (IIIj), O H (R) (IIIk), H (S) Cl Cl Cl H (R) O (IIIL), (IIIm), є новими і спеціально розробленими для способу згідно з даним винаходом і, таким чином, являють собою додаткову мету даного винаходу. В переважному варіанті здійснення даного винаходу енантіоселективне відновлення сполуки формули II здійснюють шляхом гідрування в присутності каталізатора на основі перехідного металу, переважно рутенієвого каталізатора. В іншому переважному варіанті здійснення даного винаходу енантіоселективне відновлення сполуки формули II здійснюють шляхом гідрування з перенесенням водню в присутності каталізатора на основі перехідного металу, переважно рутенієвого каталізатора. В особливо переважному варіанті здійснення даного винаходу енантіоселективним реагентом є хлор{(R)-(+)-2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'-бінафтил}[(2R)-(-)-1-(4метоксифеніл)-1’-(4-метоксифеніл-kC)-3-метил-1,2-бутандіамін]рутеній(II). Етап реакції b) можна здійснювати, як описано в WO 2011/015416. Придатними кислотами для етапу реакції b) є сильні кислоти, такі як фосфорна кислота, поліфосфорні кислоти, концентрована H2SO4, метансульфонова кислота, п-толуолсульфонова кислота, іммобілізовані кислоти (фіксовані на полімерних носіях) наприклад, такі як Amberlyst™, переважно концентрована H2SO4. В залежності від застосовуваної кислоти реакцію можна здійснювати при температурах від 10 °C до 150 °C. Переважний діапазон температури для застосування концентрованої H2SO4 в якості розчинника складає від 10 до 25 °C. Для концентрованої H2SO4 вагове співвідношення вихідного матеріалу і концентрованої H2SO4 складає від 1: 0,2 до 1: 10, переважно 1:1 або менше, у випадку чого необхідний розчинник, і при цьому переважний діапазон температури складає 70-90 °C. Сполуку формули IVa додають до кислоти в твердій формі або кислоту додають до розчину сполуки формули IVa в органічному розчиннику. Реакцію O 15 (IIIh), Cl H (R) Cl H (R) O H (R) Cl H (R) Cl Cl H (R) Cl O H (S) Cl Cl H (R) OH OH 13 UA 111777 C2 5 10 можна підтримувати за допомогою азеотропної дистиляції води, необов'язково при зниженому тиску, зокрема, якщо застосовують каталітичну кількість кислоти. Придатними органічними розчинниками для етапу реакції b) є, наприклад, толуол, ксилол, метилциклогексан, хлорбензол або дихлорбензол, переважно толуол. Як і будь-яке елімінування, дану реакцію можна здійсніти шляхом перетворення гідроксилу в придатну групу, що відходить, таку як, наприклад, галоген (Br, Cl, за допомогою реакції, наприклад, з PCl5, PBr3, SOCl2), або сульфонат (за допомогою реакції, наприклад, з метансульфонілхлоридом в присутності основи), або ацетат, з наступною обробкою основою, кислотою або кислотою t t Льюїса (наприклад, KOH, NaOH NaO Bu, KO Bu або третинними амінами, в тому числі ароматичними, такими як, наприклад, піридин). Сполука формули IVa, (S) (R) (IVa), може перебувати в формі наступних ізомерів або їх сумішей: (S) (S) (S) Cl Cl O Cl Cl Cl (R) (IVa), O Cl (R) (IVb), O (R) (IVc) та (S) Cl Cl 15 20 25 30 35 O (R) (IVd). Виділення або очищення конкретного ізомеру або суміші ізомерів формули IVa не обов'язкові. Сполука формули IVa та її ізомери є новими і спеціально розробленими для способу згідно з даним винаходу і, таким чином, являють собою додаткову мету даного винаходу. Етап реакції c) можна здійснювати, як описано в WO 2011/015416. Гідроксиламін може застосовуватися в якості вільної основи у воді (50 % розчин є комерційно доступним) або отриманий in situ з її солей, таких як, наприклад, гідрохлорид або сульфат, шляхом обробки основою (наприклад, триетиламіном, піридином, NaOH або KOH, ацетатом натрію, карбонатом калію або натрію). Гідроксиламін переважно використовують в формі його сульфату або гідрохлориду і в кількості від 1 до 2 еквівалентів, зокрема, від 1,1 до 1,3 еквівалента відносно сполуки формули IVa. Придатними основами для даного етапу реакції є, наприклад, піридин, третинні аміни, такі як триетиламін, NaOH або KOH, ацетат натрію, карбонат калію або натрію. Особливо переважним є ацетат натрію і NaOH. Основу застосовують в кількості від 1 до 2 еквівалентів, переважно 1-1,5 еквівалента відносно сполуки формули IVa. Придатними розчинниками є спирти (переважно безводні), диметилформамід, N-метил-2-піролідон або CH3CN, зокрема, безводний етанол або безводний метанол. Особливо переважним розчинником є безводний етанол. Етап реакції e) можна переважно здійснювати при температурах від 10 до 40 °C, переважно при 25 °C або температурі навколишнього середовища. Реакцію можна також здійснювати в двофазній системі (органічний розчинник/вода, органічний розчинник являє собою, наприклад, толуол, ксилол, метилциклогексан) при температурах від 50-100 °C із застосуванням вищезазначених джерел гідроксиламіну і основ в присутності каталізаторів міжфазного перенесення, обраних з карбонових кислот (наприклад, оцтової, пропіонової, ізомасляної, півалінової, валеріанової, ізовалеріанової, бензойної, 2-етилгексанової), застосовуваних в кількості 2-50 мол. %. 14 UA 111777 C2 5 Переважна кількість каталізатора складає 5-10 мол. %, переважна температура складає 8090 °C, переважними каталізаторами є бензойна кислота і 2-етилгексанова кислота. З ацетатом натрію в якості основи каталізатор міжфазного перенесення не потрібен. Зазначене є переважним варіантом здійснення способу. Сполука формули Va може перебувати в формі наступних ізомерів або їх сумішей: (S) (S) (S) (R) (R) (R) (Va), (Vb), (Vc) та (S) (R) 10 (Vd). Виділення або очищення конкретного ізомеру або суміші ізомерів формули Va не обов'язкові. Сполука формули Va та її ізомери є новими і спеціально розробленими для способу згідно з даним винаходом і, таким чином, являють собою додаткову мету даного винаходу. Етап реакції d) можна здійснювати, як описано в WO 2011/015416 або в WO2012/101139. Переважний варіант здійснення етапу реакції d) включає ацилювання атома кисню оксиму сполуки формули Va, (S) (R) 15 (Va), в присутності розчинника і ацилювального засобу формули XXIIa, R1-C(X)-Cl (XXIIa), де X являє собою кисень або сірку, переважно кисень; R 1 являє собою C1-C6алкоксі, CH3C(=CH2)-O-, феноксі або трихлорметоксі; переважно C1-C6алкоксі, феноксі або трихлорметоксі; та реакцію отриманого таким чином продукту формули XXIIIa, (S) Cl Cl R1 N 20 X (R) O (XXIIIa), де X являє собою кисень або сірку, переважно кисень, R 1 являє собою C1-C6алкоксі, CH3C(=CH2)-O-, феноксі або трихлорметоксі; зі сполукою формули VI, 15 UA 111777 C2 (VI). 5 10 15 20 25 30 Переважними ацилювальними засобами формули XXIIa є засоби, де R1 являє собою метоксі, етоксі, ізопропоксі, феноксі або ізопропенілоксі, а X являє собою кисень, більш переважно R1 являє собою метоксі, етоксі, ізопропоксі або феноксі, а X являє собою кисень, зокрема, R1 являє собою етоксі. Сполуки формули XXIIIa та їх ізомери є новими і були спеціально розроблені для способу згідно з даним винаходом і, таким чином, являють собою додаткову мету даного винаходу. Переважними сполуками формули XXIIa є сполуки, де R 1 являє собою метоксі, етоксі, ізопропоксі, феноксі або ізопропенілоксі, а X являє собою кисень, більш переважно R 1 являє собою метоксі, етоксі, ізопропоксі або феноксі, а X являє собою кисень, зокрема, R 1 являє собою етоксі. Спосіб згідно з даним винаходом складається з двох хімічних перетворень: реакції атома кисню оксиму з ацилювальним засобом з наступним перетворенням in situ ацильованого похідного в сполуку формули Ib шляхом реакції з від 1,0 до 1,3 еквівалента, переважно 1,05 еквівалента сполуки формули VI переважно в присутності кислоти (переважно HCl, H2SO4 або CH3SO3H, найбільш переважно CH3SO3H). Додавання кислоти прискорює утворення сполуки формули Ib і, таким чином, значно зменшує час реакції. Ацилювання переважно здійснюють в присутності основи. Основу застосовують в кількості від 1 до 1,5 еквівалента відповідно сполуки формули Va, зокрема, в кількості 1,2 еквівалента. Придатними основами для ацилювання є піридин або третинні аміни, такі як триетиламін. Триетиламін є особливо переважним в якості основи. Переважні температури реакції для способу складають від 60 до 150 °C, зокрема 85-125 °C, найбільш переважно від 95 до 115 °C. В іншому переважному варіанті здійснення даного винаходу реакцію здійснюють при температурі від 130 до 135 °C з ацилювальним засобом формули XXIIa, де R1 являє собою етоксі, а X являє собою кисень. Придатними розчинниками є толуол, діоксан, тетрагідрофуран, ксилол, хлорбензол або ацетонітрил. Найбільш переважним розчинником є ксилол. Якщо ацилювальним засобом є фосген або тіофосген, структура сполуки, отриманої в результаті реакції оксиму формули Va з фосгеном або тіофосгеном, залежить від порядку додавання реагентів. Якщо сполука формули XXIIa, де R1 являє собою хлор, а X являє собою кисень або сірку, додають до сполуки формули Va, сполуку формули XXIVa, (S) Cl Cl Cl N Cl (S) 35 N (R) (R) O O X (XXIVa), де X являє собою кисень або сірку; отримують. Якщо сполуку формули Va додають до сполуки формули XXIIa, де R 1 являє собою хлор, а X являє собою кисень або сірку; сполуку формули XXVa, 16 UA 111777 C2 (S) Cl Cl R1 N 5 10 15 (R) O X (XXVa), де X являє собою кисень або сірку, а R1 являє собою хлор; отримують. Для сполук формули XXIIIa, де R1 являє собою C1-C6алкоксі, CH3-C(=CH2)-O-, феноксі або трихлорметоксі, якщо X являє собою кисень; сполуку формули XVIa отримували незалежно від порядку додавання реагентів. Сполуки формули XXIVa і XXVa є новими і були спеціально розроблені для способу згідно з даним винаходом і, таким чином, являють собою додаткову мету даного винаходу. В переважній сполуці формули XXVa X являє собою кисень. Було також виявлено, що додавання CH3SO3H прискорює утворення сполуки формули Ib і, таким чином, значно зменшує час реакції. Сполука формули VI є відомою і комерційно доступною. Сполука розкрита, наприклад, в US5093347. Приклади отримання Система для ВЕРХ Waters Alliance 2695 Ультрафіолетовий детектор Waters 996 DAD Приклад P1: отримання енантіомерно збагаченого (1S, 4R)-9-дихлорметилен-8-гідроксіоктагідро-1,4-метано-нафталін-5-ону формули IIIf, OH H (S) Cl Cl O 20 25 30 35 H (R) (IIIf) В автоклаві з Hastelloy на 100 мл, обладнаному магнітною мішалкою, в атмосфері аргону суміш сполуки формули II (1,00 г, 3,86 ммоля), хлор{(R)-(+)-2,2'-біс[ди(3,5-ксиліл)фосфіно]-1,1'бінафтил}[(2R)-(-)-1-(4-метоксифеніл)-1’-(4-метоксифеніл-kC)-3-метил-1,2-бутандіамін]рутенію(II) ((R)-RUCY™-XylBINAP, номер в каталозі Strem 44-0217) (0,0183 г, 0,0154 ммоля), дихлорметану (10,0 мл) та ізо-пропанолу (8,0 мл) оброблювали трет-бутоксидом калію (0,0223 г, 0,193 ммоля), розчиненим в ізо-пропанолі (2,0 мл). Автоклав продували воднем при 0,5 МПа (триразово), подавали водень під тиском 5 МПа і інтенсивно перемішували при 25-28 °C протягом 22 годин. Неочищену реакційну суміш випарювали і продукт виділяли шляхом колонкової хроматографії (силікагель, градієнт гептани → 30 % етилацетату в гептанах) з отриманням 900 мг (1S, 4R)-9дихлорметилен-8-гідроксі-октагідро-1,4-метано-нафталін-5-ону в формі білої твердої речовини. Аналіз за допомогою хіральної ВЕРХ (Chiralpack ID, 0,46 см x 25 см, гептан:ізо-пропанол = 90:10, 1 мл/хв., детекція:220 нм): час утримання 8,83 хвилини (основний енантіомер, 83,4 %), 12,93 хвилини (неосновний енантіомер 16,6 %). Знаком оптичного обертання в CHCl3 був (+). 1 H ЯМР-аналіз показав, що діастереочистота продукту (співвідношення основний діастереоізомер IIIf/сумарна кількість усіх діастереоізомерів (формул IIIe-IIIm)) складала 96 %. 1 H ЯМР (CDCl3, 400 МГц) δ (основний ізомер) 1,58–1,72 (m, 3H), 1,84 (bs, 1H), 2,04 (m, 2H), 2,20–2,35 (m, 2H), 2,48–2,55 (m, 1H), 2,74 (m, 2H), 3,12 (m, 1H), 3,28 (m, 1H), 4,41 (m, 1H). Приклад P2: отримання енантіомерно збагаченої сполуки формули IVa, (S) (R) 40 (IVa) Тонкоздрібнену сполуку формули IIIf (0,50 г, 1,915 ммоля) додавали до інтенсивно перемішуваної 96 % сірчаної кислоти (2,5 мл) при 0 °C. Реакційну суміш перемішували 10 хв. при тій же температурі і при температурі навколишнього середовища протягом 1 години (оранжевий розчин). Реакційну суміш виливали в воду і екстрагували дихлорметаном. Органічну 17 UA 111777 C2 5 фазу сушили над Na2SO4 і випарювали в вакуумі з отриманням 417 мг коричневої твердої речовини. Аналіз за допомогою хіральної ВЕРХ (Chiralpack ID, 0,46 см x 25 см, гептан:ізо-пропанол = 90:10, 1 мл/хв., детекція: 240 нм): час утримання 7,61 хвилини (неосновний енантіомер, 14,5 %), 8,16 хвилини (основний енантіомер, 85,5 %). 1 H ЯМР (CDCl3, 400 МГц) δ 1,23–1,32 (m, 2H), 1,88–2,14 (m, 4H), 2,23–2,30 (m, 1H), 2,35–2,57 (m, 3H), 3,49 (m, 1H), 3,87 (m, 1H). Приклад P3: отримання енантіомерно збагаченої сполуки формули Va, (S) (R) 10 15 (Va) Суміш сполуки формули IVa (0,385 г, 1,584 ммоля), гідроксиламіну гідрохлориду (0,132 г, 1,900 ммоля), піридину (0,1879 г, 2,376 ммоля) і чистого етанолу (3,0 мл) перемішували при температурі навколишнього середовища протягом 4,5 години. До реакційної суміші додавали воду, а утворену тверду речовину фільтрували і сушили з отриманням 313 мг бажаного продукту. 1H-ЯМР (CDCl3, 400 МГц, ): δ 1,36-1,26 (m, 2H); 2,03-1,78 (m, 4H); 2,27-2,17 (m, 1H); 2,492,33 (m, 2H); 2,78-2,68 (m, 1H); 3,40 (d, 1H, J=2,6 Гц); 3,80 (d, 1H, J=3,3 Гц); Приклад P4: отримання енантіомерно збагаченого ((1S, 4R)-9-дихлорметилен-1,2,3,4тетрагідро-1,4-метано-нафталін-5-іл)-аміду 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти формули Ib, (S) Cl Cl O N (R) H F2HC N N 20 25 30 35 40 CH3 (Ib) До перемішаного розчину сполуки формули Va (0,100 г, 0,3874 ммоля) в діоксані (0,5 мл) додавали триетиламін (0,0392 г, 0,3874 ммоля) і потім повільно 4-(дифторметил)-1-метилпіразол-3-карбонілхлорид (0,1508 г, 0,775 ммоля). Реакційну суміш нагрівали повільно до температури 82° і витримували при даній температурі протягом 3 годин, а при температурі навколишнього середовища протягом 18 годин. Після охолодження до температури навколишнього середовища більшу частину розчинника видаляли шляхом випаровування в роторному випарнику і залишок перемішували з простим діетиловим ефіром і водою. Додавали розчин NaOH (48 мг) в воді (0,2 мл) і перемішували суміш протягом додаткових 10 хв. Відділяли водну фазу і екстрагували органічну фазу за допомогою 1M NaOH, 1M HCl, води, сушили над Na2SO4 і випарювали в вакуумі. Неочищений продукт очищали шляхом колонкової хроматографії (силікагель, гептани/етилацетат 2:1→1:1) з отриманням 75 мг бажаного продукту у вигляді жовтої твердої речовини. Аналіз за допомогою хіральної ВЕРХ (Chiralpack ID, 0,46 см x 25 см, гептан:ізо-пропанол = 90:10, 1 мл/хв., детекція: 260 нм): час утримання 10,04 хвилини (основний енантіомер, 85,4 %), 14,14 хвилини (неосновний енантіомер, 14,6 %). Знаком оптичного обертання в CHCl3 був (-). 1 H ЯМР (CDCl3, 400 МГц) δ 1,37 (m, 1H), 1,49 (m, 1H), 2,09 (m, 2H), 3,90 (s, 3H), 3,94 (m, 1H), 4,07 (m, 1H), 6,91 (t, JH-F=54,2 Гц, 1H), 7,02 (d, J=7,3 Гц, 1H), 7,16 (t, J=7,8 Гц, 1H), 7,79 (d, J=8,2 Гц, 1H), 8,01 (s, 1H), 8,15 (m, 1H). Приклад P5: отримання єдиного енантіомеру (1S, 4R)-9-дихлорметилен-8-гідроксі-октагідро1,4-метано-нафталін-5-ону формули IIIf, 18 UA 111777 C2 OH H (S) Cl Cl O 5 10 15 20 H (R) (IIIf) В автоклав з Hastelloy на 500 мл завантажували сполуку формули II (20,00 г, 74,9 ммоля). В атмосфері аргону додавали сухий і дегазований толуол (80,0 мл), а потім дегазований розчин дихлор[(4S, 5S)-(-)-4,5-біс(дифенілфосфінометил)-2,2-диметил-1,3-діоксолан][(S)-(+)-2-(αметилметанамін)-1H-бензимідазол]рутенію(II), мін. 98 %, номер в каталозі Strem 44-0955 (0,05 г, 0,060 ммоля), і трифенілфосфін (0,098 г, 0,375 ммоля) в толуолі (11,0 мл), і розчин третбутоксид калію (0,433 г, 3,75 ммоля) в ізопропанолі (10 мл). Автоклав продували воднем при 0,5 МПа (триразово), подавали водень під тиском 5 МПа і інтенсивно перемішували при 25-28 °C протягом 2 годин. Неочищену реакційну суміш випарювали, розчиняли в етилацетаті, фільтрували через набивку силікагелю і випарювали з отриманням 18,32 г (1S, 4R)-9дихлорметилен-8-гідроксі-октагідро-1,4-метано-нафталін-5-ону у вигляді коричневої смоли. Аналіз за допомогою хіральної ВЕРХ (Chiralpack ID, 0,46 см x 25 см, гептан:ізопропанол = 90:10, 1 мл/хв., детекція: 220 нм): час утримання 8,83 хвилини (основний енантіомер, 98,9 %), 12,93 хвилини (неосновний енантіомер 1,1 %). Знаком оптичного обертання в CHCl3 був (+). Продукт далі перекристалізовували з толуолу (35 мл) з отриманням 15 г (77 %) IIIf у вигляді белої твердої речовини. Аналіз за допомогою хіральної ВЕРХ (Chiralpack ID, 0,46 см x 25 см, гептан:ізопропанол = 90:10, 1 мл/хв., детекція:220 нм): час утримання 8,83 хвилини (основний енантіомер, 100 %), неосновний енантіомер не виявлений. 1 H ЯМР (CDCl3, 400 МГц) δ (основний ізомер) 1,58–1,72 (m, 3H), 1,84 (bs, 1H), 2,04 (m, 2H), 2,20–2,35 (m, 2H), 2,48–2,55 (m, 1H), 2,74 (m, 2H), 3,12 (m, 1H), 3,28 (m, 1H), 4,41 (m, 1H). Приклад P6: отримання єдиного енантіомеру сполуки формули IVa, (S) (R) 25 30 35 (IVa) Тонкоздрібнену сполуку формули IIIf (14 г, 53,6 ммоля) додавали до інтенсивно перемішуваної 96 % сірчаної кислоти (50 мл) при 0 °C. Реакційну суміш перемішували 10 хв. при тій же температурі та при температурі навколишнього середовища протягом 1 години (оранжевий розчин). Реакційну суміш виливали в лід/воду і екстрагували простим третбутилметиловим ефіром. Органічну фазу сушили над Na2SO4 і випарювали в вакуумі з отриманням 12,7 г (84 %) титульної сполуки у вигляді коричневої твердої речовини. Аналіз за допомогою хіральної ВЕРХ (Chiralpack ID, 0,46 см x 25 см, гептан:ізопропанол = 90:10, 1 мл/хв., детекція: 240 нм): час утримання 7,61 хвилини (основний енантіомер, 100 %), неосновний енантіомер не виявлений (
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the stereoselective preparation of a pyrazole carboxamide
Автори англійськоюSmejkal, Tomas
Автори російськоюСмейкал Томаш
МПК / Мітки
МПК: C07D 231/14
Мітки: стереоселективного, піразолкарбоксаміду, спосіб, отримання
Код посилання
<a href="https://ua.patents.su/26-111777-sposib-stereoselektivnogo-otrimannya-pirazolkarboksamidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб стереоселективного отримання піразолкарбоксаміду</a>
Попередній патент: Пристрій для транспортування та очистки коренебульбоплодів
Наступний патент: Спосіб лікування недрібноклітинного раку легень із застосуванням комбінації інгібітора кінази тоr та ерлотинібу або азацитидину
Випадковий патент: Вірус комах зі зниженою здатністю трансмісії від хазяїна до хазяїна в навколишньому середовищі, спосіб його одержання