Дигідрат (n)-((s)-2-гідрокси-3-метилбутирил)-1-(l-аланініл)-(s)-1-аміно-3-метил-2,3,4,5-тетрагідро-1н-3-бензазепін-2-ону, спосіб його одержання та фармацевтична композиція на його основі
Номер патенту: 77165
Опубліковано: 15.11.2006
Автори: Кьоніг Томас Мітчелл, Інджел Гарі Лоуелл, ОДІА Джеймс Едмунд, Макденіел Стейсі Л., Ейкінз Джеймз Ейбрахам, Мітчелл Дейвід, Буччіллі Лінн Енн
Формула / Реферат
1. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
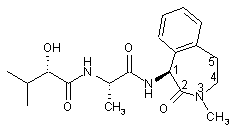 дигідрат.
дигідрат.
2. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 1, який додатково характеризується порошковою рентгенодифрактограмою, яка включає пік при 8,36, 12,43, 15,34, 19,22, 20,50 або 20,63 (2q±0,2°).
3. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 1, який додатково характеризується порошковою рентгенодифрактограмою, яка включає піки при 8,36 та 15,34 (2q±0,2°).
4. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 1, який додатково характеризується порошковою рентгенодифрактограмою, яка включає піки при 8,36 та 12,43 (2q±0,2°).
5. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 1, який додатково характеризується порошковою рентгенодифрактограмою, яка включає піки при 8,36, 12,43 та 15,34 (2q±0,2°).
6. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 1, який додатково характеризується порошковою рентгенодифрактограмою, яка включає піки при 8,36, 12,43, 15,34, 19,22, 20,50 та 20,63 (2q±0,2°).
7. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 2, який додатково характеризується спектром ядерного магнітного резонансу 13C у твердому стані, який включає значення хімічних зсувів (у млн-1) 75,6, 35,3, 21,4 або 16,6.
8. Кристалічний дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за п. 2, який додатково характеризується спектром ядерного магнітного резонансу 13C у твердому стані, який включає значення хімічних зсувів (у млн-1) 75,6, 35,3, 21,4 та 16,6.
9. Фармацевтична композиція, яка містить дигідрат (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 дигідрат
дигідрат
та фармацевтично прийнятний розріджувач.
10. Спосіб інгібування вивільнення b-амілоїдного пептиду та/або його синтезу, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 дигідрат.
дигідрат.
11. Спосіб лікування хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого лікування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 дигідрат.
дигідрат.
12. Спосіб лікування хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого лікування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за будь-яким із пп. 2, 3, 4, 5, 6 або 7.
13. Спосіб профілактики хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такої профілактики, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 дигідрат.
дигідрат.
14. Спосіб профілактики хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такої профілактики, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за будь-яким із пп. 2, 3, 4, 5, 6 або 7.
15. Спосіб інгібування розвитку хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості кристалічного дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 дигідрат.
дигідрат.
16. Спосіб інгібування розвитку хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за будь-яким із пп. 2, 3, 4, 5, 6 або 7.
17. Спосіб одержання кристалічного дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону, що додатково характеризується порошковою рентгенодифрактограмою, яка включає піки при 8,36, 12,43, 15,34, 19,22, 20,50 або 20,63 (2q±0,2°), який включає кристалізацію (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 дигідрат
дигідрат
з водного розчинника.
18. Спосіб за п. 17, де згаданий водний розчинник містить ацетон та воду.
19. Спосіб одержання лактамів формули I
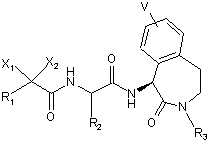 формула І,
формула І,
де
R1 є алкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, заміщений алкіл, заміщений алкеніл, заміщений алкініл, заміщений циклоалкіл, заміщений циклоалкеніл, арил, гетероарил і гетероцикліл;
R2 є алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, арил, гетероарил і гетероцикліл;
R3 є алкіл;
X1 є водень, гідроксил або фтор;
X2 є водень, гідроксил або фтор, або
X1 і X2 спільно утворюють оксогрупу; і
V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогрупа, гетероарил, тіоалкоксигрупа, заміщена тіоалкоксигрупа та тригалоїдметил;
який включає:
(a1) розділення лактаму формули (4)
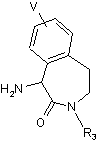 (4),
(4),
де R3 та V відповідають визначенням, поданим при описі сполуки формули I, шляхом кристалізації його солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота, з одержанням сполуки формули (10)
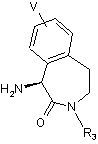 (10);
(10);
(b) сполучення сполуки формули (10) із придатною амінокислотою із захищеною аміногрупою формули PgNH-CHR2-C(O)-A, де R2 відповідає визначенню, поданому при описі сполуки формули I, а A є активуюча група, наприклад, -OH, -Br або -Cl, і Pg є група захисту аміну, з одержанням сполуки формули (11)
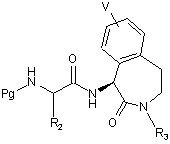 (11);
(11);
(с) відщеплення групи захисту від сполуки формули (11) з одержанням сполуки формули (12)
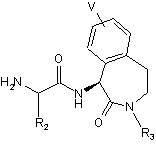 (12); і
(12); і
(d) сполучення сполуки формули (12) із відповідною сполукою формули R1CX1X2-C(O)A1, де R1, X1 і X2 відповідають визначенням, поданим при описі сполуки формули I, і A1 є активуюча група, наприклад, -OH, -Br або -Cl; або
(a2) сполучення сполуки формули (10) зі сполукою формули
R1CX1X2-C(O)NH-CHR2-C(O)-A, де R1, R2, X1 і X2 відповідають визначенням, поданим при описі сполуки формули I, і A є активуюча група, наприклад,
-OH, -Br або -Cl.
20. Спосіб за п. 19, де V є водень і R3 є нижчий алкіл.
21. Спосіб за п. 19, де згадана сіль є сіллю з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота.
22. Спосіб за п. 21, де згаданою кислотою є ди-п-толіл-L-винна кислота.
23. Спосіб за п. 21, де згаданою кислотою є (D)-(-)-мигдалева кислота.
24. Спосіб за п. 21, де згаданою кислотою є (R)-(-)-10-камфорасульфонова кислота.
25. Спосіб за будь-яким із пп. 17, 18, 19, 20 або 21, де процес проводять у присутності альдегіду.
26. Спосіб за п. 25, де згаданим альдегідом є саліциловий альдегід.
27. Спосіб за п. 26, де згаданий саліциловий альдегід вибраний із групи, до якої входять саліциловий альдегід, 5-нітросаліциловий альдегід та
3,5-дихлорсаліциловий альдегід.
28. Спосіб одержання (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
 ,
,
який включає: кристалізацію 1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
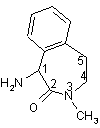
у формі солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота; сполучення (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
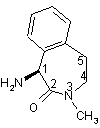
із залишком L-аланіну із захищеною аміногрупою з одержанням захищеного по аміногрупі 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону; відщеплення групи захисту з одержанням 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону; і сполучення його з (S)-2-гідрокси-3-метилмасляною кислотою.
29. Спосіб одержання (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
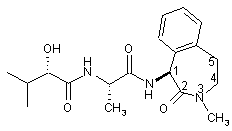 ,
,
який включає: кристалізацію 1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
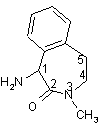
у формі солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота; сполучення (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону
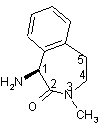
із залишком, який являє собою ((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл).
30. Спосіб одержання практично чистих лактамів формули (10)
 (10),
(10),
де
R3 є алкіл і
V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогрупа, гетероарил, тіоалкоксигрупа, заміщена тіоалкоксигрупа та тригалоїдметил;
який включає: кристалізацію сполуки формули (4)
 (4),
(4),
з одержанням сполуки формули (10) у формі її солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота.
31. Спосіб за п. 30, де V є водень і R3 є нижчий алкіл.
32. Спосіб за п. 30, де згадана сіль є сіллю з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота.
33. Спосіб за п. 32, де згаданою кислотою є ди-п-толіл-L-винна кислота.
34. Спосіб за п. 32, де згаданою кислотою є (D)-(-)-мигдалева кислота.
35. Спосіб за п. 32, де згаданою кислотою є (R)-(-)-10-камфорасульфонова кислота.
36. Спосіб за будь-яким із пп. 29, 30, 31 або 32, де процес проводять у присутності альдегіду.
37. Спосіб за п. 36, де згаданим альдегідом є саліциловий альдегід.
38. Спосіб за п. 37, де згаданий саліциловий альдегід вибраний із групи, до якої входять саліциловий альдегід, 5-нітросаліциловий альдегід та
3,5-дихлорсаліциловий альдегід.
39. Спосіб одержання лактаму формули I
 формула І,
формула І,
де
R1 є алкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, заміщений алкіл, заміщений алкеніл, заміщений алкініл, заміщений циклоалкіл, заміщений циклоалкеніл, арил, гетероарил і гетероцикліл;
R2 є алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, арил, гетероарил і гетероцикліл;
R3 є алкіл;
X1 є водень, гідроксил або фтор;
X2 є водень, гідроксил або фтор, або
X1 і X2 спільно утворюють оксогрупу; і
V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогрупа, гетероарил, тіоалкоксигрупа, заміщена тіоалкоксигрупа та тригалоїдметил;
який включає:
a) сполучення похідної фенілоцтової кислоти формули (5)
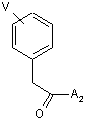 (5),
(5),
де
V відповідає визначенню, поданому при описі сполуки формули I, а A2 є активуюча група, вибрана із групи, до якої входять -OH, -Cl або -Br, з ацеталем формули (6)
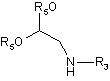 (6),
(6),
де
R3 має значення, яке бажано одержати у формулі I, і R5 є С1-С4-алкіл, з одержанням сполуки формули (7)
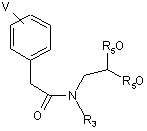 (7);
(7);
b) циклізацію сполуки формули (7) у кислоті, вибраній із групи, до якої входять сірчана кислота і трифторметансульфокислота, з одержанням сполуки формули (8)
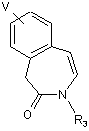 (8);
(8);
c) проведення реакції утворення оксиму зі сполукою формули (8) з одержанням сполуки формули (9)
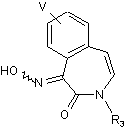 (9);
(9);
d) відновлення сполуки формули (9) з одержанням сполуки формули (4)
 (4);
(4);
e) розділення лактаму формули (4) шляхом фракційної кристалізації з одержанням сполуки формули (10) у формі її солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)-мигдалева кислота
 (10);
(10);
f) сполучення із придатною амінокислотою із захищеною аміногрупою формули PgNH-CHR2-C(O)-A, де R2 відповідає визначенню, поданому при описі сполуки формули I, а A є активуюча група, наприклад, -OH, -Br або -Cl, і Pg є група захисту аміну, з одержанням сполуки формули (11)
 (11);
(11);
g) відщеплення групи захисту від сполуки формули (11) з одержанням сполуки формули (12)
 (12); і
(12); і
h) сполучення сполуки формули (12) із придатною сполукою формули R1CX1X2-C(O)A1, де R1, X1 і X2 відповідають визначенням, поданим при описі сполуки формули I, і A1 є активуюча група, наприклад, -OH, -Br або -Cl; або
i) сполучення сполуки формули (10) зі сполукою формули
R1CX1X2-C(O)NH-CHR2-C(O)-A, де R1, R2, X1 і X2 відповідають визначенням, поданим при описі сполуки формули I, і A є активуюча група, наприклад,
-OH, -Br або -Cl.
40. Спосіб одержання лактаму формули (4)
 (4),
(4),
де
R3 є алкіл; і
V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогрупа, гетероарил, тіоалкоксигрупа, заміщена тіоалкоксигрупа та тригалоїдметил;
який включає:
a) сполучення похідної фенілоцтової кислоти формули (5)
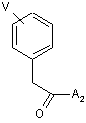 (5),
(5),
де
V відповідає визначенню, поданому при описі сполуки формули I, а A2 є активуюча група, вибрана із групи, до якої входять -OH, -Cl або -Br, з ацеталем формули (6)
 (6),
(6),
де
R3 має значення, яке бажано одержати у формулі I, і R5 є С1-С4-алкіл, з одержанням сполуки формули (7)
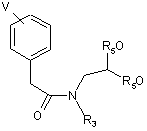 (7);
(7);
b) циклізацію сполуки формули (7) у кислоті, вибраній із групи, до якої входять сірчана кислота і трифторметансульфокислота, з одержанням сполуки формули (8)
 (8);
(8);
c) проведення реакції утворення оксиму зі сполукою формули (8) з одержанням сполуки формули (9)
 (9);
(9);
d) відновлення сполуки формули (9).
41. Сполука за будь-яким із пп. 1-8 для застосування як лікарського засобу.
42. Сполука за будь-яким із пп. 1-8 для застосування при лікуванні хвороби Альцгеймера.
43. Сполука за будь-яким із пп. 1-8 для застосування при профілактиці хвороби Альцгеймера.
44. Сполука за будь-яким із пп. 1-8 для застосування при інгібуванні виділення b-амілоїдного пептиду та/або його синтезу.
45. Сполука за будь-яким із пп. 1-8 для застосування при інгібуванні розвитку хвороби Альцгеймера.
46. Застосування сполуки за будь-яким із пп. 1-8 для виготовлення лікарського засобу для інгібування виділення b-амілоїдного пептиду та/або його синтезу, в тому числі для лікування хвороби Альцгеймера.
47. Застосування сполуки за будь-яким із пп. 1-7 для виготовлення лікарського засобу для профілактики хвороби Альцгеймера та/або для інгібування розвитку хвороби Альцгеймера.
Текст
1. Кристалічний дигідрат (N)-((S)-2-гідрокси-3метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону C2 2 (19) 1 3 OH O H N O 1 CH3 2 3 N O 77165 4 15. Спосіб інгібування розвитку хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості кристалічного дигідрату (N)-((S)-2-гідрокси-3метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону 5 4 CH3 дигідрат та фармацевтично прийнятний розріджувач. 10. Спосіб інгібування вивільнення -амілоїдного пептиду та/або його синтезу, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості дигідрату (N)-((S)2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1аміно-3-метил-2,3,4,5-тетрагідро-1H-3-бензазепін2-ону OH O H N O 1 CH3 2 3 N O 5 4 CH3 дигідрат. 11. Спосіб лікування хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого лікування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(Lаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро1H-3-бензазепін-2-ону OH O H N O 1 CH3 O 2 3 N O 1 CH3 O O 1 CH3 2 3 N дигідрат. 14. Спосіб профілактики хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такої профілактики, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(Lаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро1H-3-бензазепін-2-ону за будь-яким із пп. 2, 3, 4, 5, 6 або 7. CH3 O H N CH3 5 4 дигідрат. 16. Спосіб інгібування розвитку хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону за будьяким із пп. 2, 3, 4, 5, 6 або 7. 17. Спосіб одержання кристалічного дигідрату (N)((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3бензазепін-2-ону, що додатково характеризується порошковою рентгенодифрактограмою, яка включає піки при 8,36, 12,43, 15,34, 19,22, 20,50 або 20,63 (2 0,2 ), який включає кристалізацію (N)((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)1-аміно-3-метил-2,3,4,5-тетрагідро-1H-3бензазепін-2-ону OH 5 4 2 3 N O 1 CH3 O H N O H N 5 4 дигідрат. 12. Спосіб лікування хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого лікування, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(Lаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро1H-3-бензазепін-2-ону за будь-яким із пп. 2, 3, 4, 5, 6 або 7. 13. Спосіб профілактики хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такої профілактики, ефективної кількості дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(Lаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро1H-3-бензазепін-2-ону OH OH O CH3 O 2 3 N 5 4 CH3 дигідрат з водного розчинника. 18. Спосіб за п. 17, де згаданий водний розчинник містить ацетон та воду. 19. Спосіб одержання лактамів формули I V X1 X2 O H N N H R1 O R2 N O R3 формула І, де R1 є алкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, заміщений алкіл, заміщений алкеніл, заміщений алкініл, заміщений циклоалкіл, заміщений циклоалкеніл, арил, гетероарил і гетероцикліл; R2 є алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, арил, гетероарил і гетероцикліл; R3 є алкіл; X1 є водень, гідроксил або фтор; X2 є водень, гідроксил або фтор, або X1 і X2 спільно утворюють оксогрупу; і 5 77165 6 V є від 1 до 3 груп, вибраних незалежно одна від і X2 відповідають визначенням, поданим при описі одної із групи, до якої входять водень, гідроксил, сполуки формули I, і A1 є активуюча група, наприацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоклад, -OH, -Br або -Cl; або ксигрупа, заміщена алкоксигрупа, алкеніл, заміще(a2) сполучення сполуки формули (10) зі сполукою ний алкеніл, алкініл, заміщений алкініл, аміногруформули па, аміноацил, алкарил, арил, арилоксигрупа, R1CX1X2-C(O)NH-CHR2-C(O)-A, де R1, R2, X1 і X2 карбоксил, карбоксилалкіл, ціан, галоїд, нітрогрувідповідають визначенням, поданим при описі па, гетероарил, тіоалкоксигрупа, заміщена тіоалсполуки формули I, і A є активуюча група, наприкоксигрупа та тригалоїдметил; клад, який включає: -OH, -Br або -Cl. (a1) розділення лактаму формули (4) 20. Спосіб за п. 19, де V є водень і R3 є нижчий V алкіл. 21. Спосіб за п. 19, де згадана сіль є сіллю з кислотою, вибраною із групи, до якої входять ди-птоліл-L-винна кислота, (R)-(-)-10камфорасульфонова кислота і (D)-(-)-мигдалева (4), кислота. H2N 22. Спосіб за п. 21, де згаданою кислотою є ди-пN толіл-L-винна кислота. O 23. Спосіб за п. 21, де згаданою кислотою є (D)-(-)R3 мигдалева кислота. де R3 та V відповідають визначенням, поданим 24. Спосіб за п. 21, де згаданою кислотою є (R)-(-)при описі сполуки формули I, шляхом кристалізації10-камфорасульфонова кислота. його солі з кислотою, вибраною із групи, до якої 25. Спосіб за будь-яким із пп. 17, 18, 19, 20 або 21, входять ди-п-толіл-L-винна кислота, (R)-(-)-10де процес проводять у присутності альдегіду. камфорасульфонова кислота і (D)-(-)-мигдалева 26. Спосіб за п. 25, де згаданим альдегідом є салікислота, з одержанням сполуки формули (10) циловий альдегід. V 27. Спосіб за п. 26, де згаданий саліциловий альдегід вибраний із групи, до якої входять саліциловий альдегід, 5-нітросаліциловий альдегід та 3,5-дихлорсаліциловий альдегід. (10); 28. Спосіб одержання (N)-((S)-2-гідрокси-3H2N метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону N O R3 (b) сполучення сполуки формули (10) із придатною амінокислотою із захищеною аміногрупою формули PgNH-CHR2-C(O)-A, де R2 відповідає визначенню, поданому при описі сполуки формули I, а A є активуюча група, наприклад, -OH, -Br або -Cl, і Pg є група захисту аміну, з одержанням сполуки формули (11) V OH O H N O 1 CH3 O 2 3 N 5 4 CH3 , який включає: кристалізацію 1-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону O Pg H N (11); N H H2N N O R2 O R3 (с) відщеплення групи захисту від сполуки формули (11) з одержанням сполуки формули (12) V O H2N 2 3 N 5 4 CH3 у формі солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10камфорасульфонова кислота і (D)-(-)-мигдалева кислота; сполучення (S)-1-аміно-3-метил-2,3,4,5тетрагідро-1H-3-бензазепін-2-ону (12); і N H R2 1 N O R3 (d) сполучення сполуки формули (12) із відповідною сполукою формули R1CX1X2-C(O)A1, де R1, X1 1 H2N O 2 3 N 5 4 CH3 7 77165 8 із залишком L-аланіну із захищеною аміногрупою з па, гетероарил, тіоалкоксигрупа, заміщена тіоалодержанням захищеного по аміногрупі 1-(Lкоксигрупа та тригалоїдметил; аланініл)-(S)-аміно-3-метил-2,3,4,5-тетрагідро-1Hякий включає: кристалізацію сполуки формули (4) V 3-бензазепін-2-ону; відщеплення групи захисту з одержанням 1-(L-аланініл)-(S)-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону; і сполучення його з (S)-2-гідрокси-3-метилмасляною кис(4), лотою. H2N 29. Спосіб одержання (N)-((S)-2-гідрокси-3N метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилO 2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону R3 OH O H N 1 O CH3 O 2 3 N 5 4 CH 3, який включає: кристалізацію 1-аміно-3-метил2,3,4,5-тетрагідро-1H-3-бензазепін-2-ону 1 H2 N 2 3 N O 5 4 CH3 у формі солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10камфорасульфонова кислота і (D)-(-)-мигдалева кислота; сполучення (S)-1-аміно-3-метил-2,3,4,5тетрагідро-1H-3-бензазепін-2-ону 1 H2 N O 2 3 N V 5 4 X1 CH3 із залишком, який являє собою ((S)-2-гідрокси-3метилбутирил)-1-(L-аланініл). 30. Спосіб одержання практично чистих лактамів формули (10) V (10), H2N N O з одержанням сполуки формули (10) у формі її солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10камфорасульфонова кислота і (D)-(-)-мигдалева кислота. 31. Спосіб за п. 30, де V є водень і R3 є нижчий алкіл. 32. Спосіб за п. 30, де згадана сіль є сіллю з кислотою, вибраною із групи, до якої входять ди-птоліл-L-винна кислота, (R)-(-)-10камфорасульфонова кислота і (D)-(-)-мигдалева кислота. 33. Спосіб за п. 32, де згаданою кислотою є ди-птоліл-L-винна кислота. 34. Спосіб за п. 32, де згаданою кислотою є (D)-(-)мигдалева кислота. 35. Спосіб за п. 32, де згаданою кислотою є (R)-(-)10-камфорасульфонова кислота. 36. Спосіб за будь-яким із пп. 29, 30, 31 або 32, де процес проводять у присутності альдегіду. 37. Спосіб за п. 36, де згаданим альдегідом є саліциловий альдегід. 38. Спосіб за п. 37, де згаданий саліциловий альдегід вибраний із групи, до якої входять саліциловий альдегід, 5-нітросаліциловий альдегід та 3,5-дихлорсаліциловий альдегід. 39. Спосіб одержання лактаму формули I R3 де R3 є алкіл і V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогру X2 O H N N H R1 O R2 N O R3 формула І, де R1 є алкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, заміщений алкіл, заміщений алкеніл, заміщений алкініл, заміщений циклоалкіл, заміщений циклоалкеніл, арил, гетероарил і гетероцикліл; R2 є алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, арил, гетероарил і гетероцикліл; R3 є алкіл; X1 є водень, гідроксил або фтор; X2 є водень, гідроксил або фтор, або X1 і X2 спільно утворюють оксогрупу; і V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл,заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогру 9 77165 па, гетероарил, тіоалкоксигрупа, заміщена тіоалкоксигрупа та тригалоїдметил; який включає: a) сполучення похідної фенілоцтової кислоти формули (5) V 10 V (4); H2N N O (5), A2 O де V відповідає визначенню, поданому при описі сполуки формули I, а A2 є активуюча група, вибрана із групи, до якої входять -OH, -Cl або -Br, з ацеталем формули (6) R3 e) розділення лактаму формули (4) шляхом фракційної кристалізації з одержанням сполуки формули (10) у формі її солі з кислотою, вибраною із групи, до якої входять ди-п-толіл-L-винна кислота, (R)-(-)-10-камфорасульфонова кислота і (D)-(-)мигдалева кислота V R5O (10); R5O (6), H2N N R3 N H O де R3 має значення, яке бажано одержати у формулі I, і R5 є С1-С4-алкіл, з одержанням сполуки формули (7) V R3 f) сполучення із придатною амінокислотою із захищеною аміногрупою формули PgNH-CHR2-C(O)A, де R2 відповідає визначенню, поданому при описі сполуки формули I, а A є активуюча група, наприклад, -OH, -Br або -Cl, і Pg є група захисту аміну, з одержанням сполуки формули (11) V R5O (7); R5O N O O R3 b) циклізацію сполуки формули (7) у кислоті, вибраній із групи, до якої входять сірчана кислота і трифторметансульфокислота, з одержанням сполуки формули (8) V Pg H N (11); N H N O R2 R3 g) відщеплення групи захисту від сполуки формули (11) з одержанням сполуки формули (12) V (8); N O H2N V (9); N N O R3 d) відновлення сполуки формули (9) з одержанням сполуки формули (4) (12); і N H R3 c) проведення реакції утворення оксиму зі сполукою формули (8) з одержанням сполуки формули (9) HO O R2 N O R3 h) сполучення сполуки формули (12) із придатною сполукою формули R1CX1X2-C(O)A1, де R1, X1 і X2 відповідають визначенням, поданим при описі сполуки формули I, і A1 є активуюча група, наприклад, -OH, -Br або -Cl; або i) сполучення сполуки формули (10) зі сполукою формули R1CX1X2-C(O)NH-CHR2-C(O)-A, де R1, R2, X1 і X2 відповідають визначенням, поданим при описі сполуки формули I, і A є активуюча група, наприклад, -OH, -Br або -Cl. 40. Спосіб одержання лактаму формули (4) 11 V (4), 77165 12 b) циклізацію сполуки формули (7) у кислоті, вибраній із групи, до якої входять сірчана кислота і трифторметансульфокислота, з одержанням сполуки формули (8) V H2N N O R3 де R3 є алкіл; і V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, аміногрупа, аміноацил, алкарил, арил, арилоксигрупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітрогрупа, гетероарил, тіоалкоксигрупа, заміщена тіоалкоксигрупа та тригалоїдметил; який включає: a) сполучення похідної фенілоцтової кислоти формули (5) V (5), A2 O де V відповідає визначенню, поданому при описі сполуки формули I, а A2 є активуюча група, вибрана із групи, до якої входять -OH, -Cl або -Br, з ацеталем формули (6) R5O R5O (6), N H R3 де R3 має значення, яке бажано одержати у формулі I, і R5 є С1-С4-алкіл, з одержанням сполуки формули (7) V (8); N O R3 c) проведення реакції утворення оксиму зі сполукою формули (8) з одержанням сполуки формули (9) V HO (9); N N O R3 d) відновлення сполуки формули (9). 41. Сполука за будь-яким із пп. 1-8 для застосування як лікарського засобу. 42. Сполука за будь-яким із пп. 1-8 для застосування при лікуванні хвороби Альцгеймера. 43. Сполука за будь-яким із пп. 1-8 для застосування при профілактиці хвороби Альцгеймера. 44. Сполука за будь-яким із пп. 1-8 для застосування при інгібуванні виділення -амілоїдного пептиду та/або його синтезу. 45. Сполука за будь-яким із пп. 1-8 для застосування при інгібуванні розвитку хвороби Альцгеймера. 46. Застосування сполуки за будь-яким із пп. 1-8 для виготовлення лікарського засобу для інгібування виділення -амілоїдного пептиду та/або його синтезу, в тому числі для лікування хвороби Альцгеймера. 47. Застосування сполуки за будь-яким із пп. 1-7 для виготовлення лікарського засобу для профілактики хвороби Альцгеймера та/або для інгібування розвитку хвороби Альцгеймера. R5O (7); R5O N O R3 Цей винахід належить до галузі фармацевтичної та органічної хімії і стосується сполуки, яка інгібує вивільнення -амілоїдного пептиду та/або його синтез. Певні лактами, які інгібують вивільнення амілоїдного пептиду та/або його синтез і, відповідно, є корисними для лікування хвороби Альцгей мера, описані в патентній заявці PCT/US97/22986. Цей винахід пропонує новий кристалічний дигідрат (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(Lаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро1Н-3-бензазепін-2-ону, його композиції, способи його застосування та способи його одержання, а також способи одержання проміжних продуктів для 13 77165 14 нього. Кристалічний дигідрат згідно з цим винахосування дигідрату (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилдом є корисним для інгібування вивільнення 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону при вигоамілоїдного пептиду та/або його синтезу і, відповітовленні лікарського засобу для інгібування вивідно, є корисним при лікуванні хвороби Альцгейльнення -амілоїдного пептиду та/або його синтемера. Оскільки (N)-((S)-2-гідрокси-3-метил-бутирил)зу, в тому числі для лікування хвороби 1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5Альцгеймера. тетрагідро-1Н-3-бензазепін-2-он є корисним при Згідно з іншим варіантом, цей винахід прополікуванні хвороби Альцгеймера, існує потреба у нує спосіб одержання дигідрату (N)-((S)-2-гідроксивиготовленні його в чистій стабільній кристалічній 3-метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3формі з метою задоволення суворих фармацевтиметил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону. чних вимог та технічних умов. Новий кристалічний Згідно з ще одним варіантом, цей винахід продигідрат згідно з цим винаходом має властивості, понує спосіб одержання лактамів, в тому числі (N)придатні для зручного виготовлення лікарських ((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)форм у промислових масштабах у вигляді, напри1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3клад, таблеток для перорального застосування. бензазепін-2-ону, та способи одержання проміжІснує також потреба в способі виготовлення них продуктів для лактамів. (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)Терміни, вживані в цьому описі, мають зна(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3чення, вказані нижче. бензазепін-2-ону, який був би придатним для реаТермін "ее", або "енантіомерний надлишок", лізації у промислових умовах. Крім того, згаданий стосується надлишку процентного вмісту одного продукт має бути одержаний у формі, яка легко енантіомера, Е1, в суміші обох енантіомерів піддається фільтруванню та сушінню і є зручною (Е1+Е2), обчисленого за рівнянням ((Е1для зберігання. Кристалічний дигідрат згідно з цим Е2)/(Е1+Е2))х100=ее. Як добре відомо в практиці, винаходом, крім того, має властивості, сприятливі енантіомерний надлишок можна визначити метоз точки зору переробки та зберігання. дом капілярного електрофорезу та рідинної хроВиявлено, що (N)-((S)-2-гідрокси-3-метилматографії високої ефективності (РХВЕ) згаданих бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилсполук або їхніх похідних на хіральній нерухомій 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он може бути фазі. одержаний у формі дигідрату, яка має сприятливі В цьому описі для позначення стереохімічної властивості, і спосіб виготовлення цієї нової форконфігурації окремих ізомерів застосовано познами відповідає бажаним характеристикам, вказаним чення (R)- та (S)- за Каном-Прелогом-Інгольдом вище. (Cahn-Prelog-Inhold) та символи L- і D-. Цей винахід пропонує дигідрат (N)-((S)-2Цей винахід пропонує дигідрат (N)-((S)-2гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінаміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін2-ону. 2-ону і, зокрема, кристалічний дигідрат (N)-((S)-2Згідно з іншим варіантом здійснення, цей вигідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1нахід пропонує фармацевтичну композицію, яка аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінмістить дигідрат (N)-((S)-2-гідрокси-3-метил2-ону. бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилІснують численні методи визначення характе2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону та фарристик кристалічних форм органічних сполук. До мацевтично прийнятний розріджувач. таких способів належать, наприклад, диференційЗгідно з одним із аспектів щодо способів, цей на сканувальна калориметрія, ЯМР-спектрометрія винахід стосується способу інгібування вивільнену твердому стані, інфрачервона спектроскопія та порошкова рентгенографія. Серед цих методів ня -амілоїдного пептиду та/або його синтезу, який особливо корисними для ідентифікації та розрізвключає введення в організм пацієнта, що потренення кристалічних форм є порошкова рентгеногбує такого інгібування, ефективної кількості дигідрафія та ЯМР-спектроскопія у твердому стані. рату (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(LСтруктурний аналіз методом порошкової ренталанініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідрогенодифрактографії виконували, як описано ниж1Н-3-бензазепін-2-ону. Згідно з конкретним варіанче. Пробу неподрібненої або злегка подрібненої в том здійснення цього способу, цей винахід пропоагатовій ступці агатовим товкачиком речовини нує спосіб лікування хвороби Альцгеймера, який завантажували в тримач проби для вимірювання включає введення в організм пацієнта, що потредифракції рентгенівського проміння на порошку. бує такого лікування, ефективної кількості дигідраПорошкові рентгенограми знімали на порошковому ту (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(Lдифрактометрі D5000 фірми "Сіменс" (Siemens), аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідрообладнаному джерелом випромінювання СuK 1Н-3-бензазепін-2-ону. Цей винахід пропонує також спосіб профілактики або інгібування розвитку ( =1,54056Å), яке працювало при 50кВ і 40мА, захвороби Альцгеймера, який включає введення в стосовуючи ширину вихідної щілини 1мм, ширину організм пацієнта, що потребує такої профілактики приймальної щілини 1мм і ширину щілини детекабо інгібування, ефективної кількості дигідрату (N)тора 0,1мм. Кожну пробу сканували в межах кута ((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)2 від 4° до 35° із кроком 0,02° і максимальною 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3швидкістю сканування 3с/крок. Дані збирали, викобензазепін-2-ону. ристовуючи твердотільний кремнієво-літієвий деТаким чином, цей винахід передбачає застотектор "Кевекс" (Kevex). Для перевірки настройки 15 77165 16 приладу найкращим способом є проведення виміної проби. Подрібнення виконували в невеликій рювання звичайним способом із застосуванням агатовій ступці агатовим товкачиком. При подрібкремнієвого стандарту. ненні ступку притримували, а до товкачика прикУ практиці кристалографії добре відомо, що ладали незначний натиск. значення відносної інтенсивності та ширини дифОдержували характеристики положення піків ракційних піків для даної кристалічної форми мо(значення 2 ) і вимірювали інтенсивність найбільш жуть дещо змінюватися під впливом численних характерних рефлексів (відносні інтенсивності факторів, в тому числі ефектів переважної орієнпонад 20%), застосовуючи метод ідентифікації тації та/або розміру частинок. В разі присутності піків за другою похідною. ефектів переважної орієнтації та/або розміру часВідповідно, цей винахід стосується кристалічтинок значення інтенсивності піків можуть змінюного дигідрату (N)-((S)-2-гідрокси-3-метилватися, але положення піків, характерні для певної бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилполіморфної модифікації, залишаються незмінни2,3,4,5-тетрагідро-1 Н-З-бензазепін-2-ону, який ми. Дивись, наприклад, [The United States характеризується порошковою дифрактограмою, Pharmacopoeia #24, National Formulary #19, представленою в Таблиці 1, де перелічені значенpp.1843-1844, 2000]. ня 2 і відносні інтенсивності (І0/I100), виші ніж 20%, Для мінімізації варіацій інтенсивності деяких виміряні для неподрібненої проби і для проб, подпіків на представленій у цьому описі дифрактограрібнених протягом 5хв і 10хв, із застосуванням мі застосовували подрібнення. Проте в разі, якщо вищеописаної методики і джерела випромінюванподрібнення викликає значні зміни дифрактограми ня СuK . або спричиняє зміну кристалічного стану проби, то слід використовувати дифрактограму неподрібнеТаблиця 1 Неподрібнена проба І0/I100 (%) 2 (°) 8361 100 12,433 51,4 15,344 49,8 19,224 20,495 20,63 27,9 27,5 38,8 5-хвилинне подрібнення І0/I100 (%) 2 (°) 8,349 87,6 12,429 78,5 13,24 27,9 15,336 100 16,858 28,5 19,233 47,8 20,48 44,4 20,644 43 22,254 19,5 22,63 27,6 24,388 26,4 Інтенсивності піків для проб, подрібнених протягом 5хв і 10хв, є більш характерними для дифрактограм, де було зроблено спроби звести до мінімуму впливи переважної орієнтації та/або розміру частинок. Слід також зазначити, що в таблиці подано неокруглені цифри, одержані за допомогою комп'ютера. Таким чином, правильно підготовлена проба кристалічного дигідрату (N)-((S)-2-гідрокси-3метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1Н-3-бензазетн-2-ону може бути охарактеризована рентгенівською дифрактограмою, знятою в режимі 20 із використанням джерела випромінювання СuK , яка включає піки, представлені в Таблиці 1, і, зокрема, пік із значенням 2 8,36, 12,43, 15,34, 19,22, 20,50 або 20,63; більш конкретно, пік із значенням 2 8,36, 12,43 або 15,34; піки зі значеннями 2 8,36 і 12,43; 8,36 і 15,34; 8,36, 12,43 і 15,34; або 8,36, 12,43, 15,34, 19,22, 20,50 і 20,63. Кристалічний дигідрат (N)-((S)-2-гідрокси-3метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил 10-хвилинне подрібнення І0/I100 (%) 2 (°) 8,367 88,7 12,424 91,6 13,254 30,4 15,352 100 16,88 28,3 19,24 52 20,601 22,045 22,654 23,388 24,387 27,744 22,237 48,9 21,6 34,9 19,7 28,2 19 21,2 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону може бути охарактеризований також методом ЯМРспектроскопії у твердому стані. Хімічні зсуви 13С у твердому стані характеризують не тільки структуру молекули, але й електронне оточення молекули в кристалі. Аналіз ЯМР (13С) можна виконати, застосовуючи поперечну поляризацію 13С та обертання на магічний кут (CP/MAS). Спектри ЯМР (ЯМР у твердому стані, або SSNMR) одержували із застосуванням спектрометра фірми "Варіан" (Varian Unity 400MHz), який працював на частоті вуглецю 100,580МГц, обладнаного комплектом пристроїв для роботи із твердими пробами та 7-мм зондом VT CP/MAS фірми "Варіан". Параметри збирання даних були такі: ширина високочастотного імпульсу для повороту протона на 90° 4,0мкс, тривалість контакту 1,0мс, частота повторення імпульсів 5с, частота MAS 7,0кГц, спектральна ширина 50кГц, тривалість збирання даних 50мс. Хімічні зсуви вимірювали відносно метальної групи зовнішнього стандарту - гексаметилбензолу ( =17,3млн-1), тобто шляхом заміни проби на гексаметилбензол. 17 77165 18 Характеристики хімічних зсувів для дигідрату одержати шляхом кристалізації в контрольованих (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)умовах. Мається на увазі, що кристалізація з роз(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3чину та способи суспендування охоплюються оббензазепін-2-ону (базовані на ідентифікації піків) сягом згаданого способу. Дигідрат згідно з цим подано в Таблиці 2. винаходом можна одержати, зокрема, шляхом кристалізації з водного розчинника. Придатним розчинником є розчинник, здатний містити при застосовуваних концентраціях воду в кількості, достатній для утворення згаданого дигідрату. Перевага віддається розчинникам, які змішуються з водою, наприклад, ацетону, нижчим спиртам (наприклад, метанолу, етанолу та ізопропанолу), оцтовій кислоті та ацетонітрилу. На практиці виявлено, що перевагу слід віддати водному ацетону. Для даного водного розчинника кількість застосовуваної води залежить від відношення розчинності Положення Розчин у ДМСО Дигідрат (твердий) (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)169,27, 171,73, 169,9*, 174,1*, (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-32, 13, 16 172,89 176,7* бензазепін-2-ону в розчиннику і у воді і від засто3, 11, 14 51,45, 47,05, 47,72 46,9, 51,3 совуваного способу (кристалізації або суспенду4 134,14 134,8* вання). 5,6 124,18, 125,99 124,0 Кристалізацію, як правило, проводять шляхом 7 127,19 127,9, 128,9 розчинення (N)-((S)-2-гідрокси-3-метил-бутирил)-18 130,38 132,1 (L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро9 135,32 136,9* 1Н-3-бензазепін-2-ону у водному розчиннику, після чого дають розчину охолоджуватися (із додаван10, 18 30,73, 31,29 31,1 ням або без додавання додаткової кількості води) 17 75,01 75,6 для утворення твердої речовини. В типових випа19, 20, 22 15,99, 18,66, 19,13 16,6*, 21,4* дках кристалізацію проводять при початкових тем21 34,18 35,3* пературах приблизно від 40°С до кипіння (із зворотним холодильником) вибраного водного Зірочками (*) позначено піки, які з'являються в розчинника. Потім суміш охолоджують, причому переривчастому спектрі розв'язування. утворюється кристалічний дигідрат. Може бути доцільним застосування затравки. КристалізаційТаким чином, кристалічний дигідрат (N)-((S)-2ний розчин переважно охолоджують повільно. гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1Найбільш зручно виконувати кристалізацію при аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінохолодженні до температур у межах від темпера2-ону може бути охарактеризований спектром тури навколишнього середовища до приблизно ядерного магнітного резонансу 13С у твердому 20°С. стані, який включає значення хімічних зсувів (у Згідно з ще одним аспектом, цей винахід промлн.-1): 16,6; 176,7, 174,1, 169,9, 136,9, 134,8, понує способи одержання лактамів, в тому числі 132,1, 127,9, 128,9, 124,0, 75,6, 51,3, 46,9, 35,3, (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)31,1, 21,4 або 16,6; більш конкретно, 75,6, 35,3, (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-321,4 або 16,6; будь-які два значення з 75,6, 35,3, бензазепін-2-ону, та способи одержання проміж21,4 та 16,6; 75,6, 35,3, 21,4 та 16,6; або 176,7, них продуктів для цих речовин. 174,1, 169,9, 136,9, 134,8, 132,1, 127,9, 128,9, Більш конкретно, згідно з одним варіантом 124,0, 75,6, 51,3, 46,9, 35,3, 31,1, 21,4 та 16,6. здійснення способу, цей винахід пропонує спосіб Згідно з іншим аспектом, цей винахід пропонує одержання лактамів формули І спосіб одержання дигідрату (N)-((S)-2-гідрокси-3метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону, який включає кристалізацію (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону з водних розчинників в умовах, які забезпечують утворення дигідрату (N)-((S)-2-гідрокси-3-метил-бутирил)-1(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро1Н-3-бензазепін-2-ону. Точні умови утворення дигідрату (N)-((S)-2гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін2-ону можна визначити емпіричним шляхом, і можливо лише вказати кілька способів, які визнано придатними для практики. Так, наприклад, дигідрат (N)-((S)-2-гідрокси-3метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону можна де R1 є алкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл, заміщений алкіл, заміщений алкеніл, заміщений алкініл, заміщений циклоалкіл, заміщений циклоалкеніл, арил, гетероарил і гетероцикліл; R2 є алкіл, заміщений алкіл, алкеніл, заміще 19 77165 20 ний алкеніл, алкініл, заміщений алкініл, циклоалкіл, арил, гетероарил і гетероцикліл; R3 є алкіл; Х1 є водень, гідроксил або фтор; Х2 є водень, гідроксил або фтор, або Х1 і Х2 спільно утворюють оксогрупу; і V є від 1 до 3 груп, вибраних незалежно одна від одної із групи, до якої входять водень, гідроксил, ацил, ацилоксигрупа, алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, алкеніл, (d) сполучення сполуки формули (12) із відпозаміщений алкеніл, алкініл, заміщений алкініл, відною сполукою формули R1CX1X2-C(O)A1, де R1, аміногрупа, аміноацил, алкарил, арил, арилоксигΧ1 і Х2 відповідають визначенням, поданим при рупа, карбоксил, карбоксилалкіл, ціан, галоїд, нітописі сполуки формули І, і Α1 є активуюча група, рогрупа, гетероарил, тіоалкоксигрупа, заміщена наприклад, -ОН, -Вr або -СІ; або тіоалкоксигрупа та тригалоїдметил; (а2) сполучення сполуки формули (10) зі споякий включає: лукою формули R1CX1X2-C(O)NH-CHR2-C(O)-A, де (а1) розділення лактаму формули (4) R1, R2, Χ1 і Х2 відповідають визначенням, поданим при описі сполуки формули І, і А є активуюча група, наприклад, -ОН, -Вr або -СІ. Терміни, вживані в цьому описі, мають значення, вказані нижче. Термін "алкіл" стосується одновалентних алкільних груп, які містять у варіанті, якому віддається перевага, від 1 до 10 вуглецевих атомів, у варіанті, якому віддається більша перевага, від 1 до 6 вуглецевих атомів. Прикладами груп, які охоплюються цим терміном, є метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, н-гексил тощо. Термін "С1-С4-алкіл" стосується одновалентде R1 та V відповідають визначенням, поданим них алкільних груп, які містять у варіанті, якому при описі сполуки формули І, шляхом фракційної віддається перевага, від 1 до 4 вуглецевих атомів. кристалізації його дибензоїлтартрату, солей з (R)Прикладами груп, які охоплюються цим терміном, (-)-10-камфорасульфоновою кислотою і (D)-(-)є метил, етил, н-пропіл, ізопропіл, н-бутил, ізобумигдалевою кислотою з одержанням сполуки фотил, втор-бутил і трет-бутня. рмули (10) Термін "заміщений алкіл" стосується алкільної групи, яка містить у варіанті, якому віддається перевага, від 1 до 10 вуглецевих атомів, яка має від 1 до 5 замісників, у варіанті, якому віддається перевага, від 1 до 3 замісників, вибраних із групи, до якої входять алкоксигрупа, заміщена алкоксигрупа, циклоалкіл, заміщений циклоалкіл, циклоалкеніл, заміщений циклоалкеніл, ацил, ациламіногрупа, ацилоксигрупа, аміногрупа, аміноацил, аміноацилоксигрупа, ціан, галоїд, гідроксил, карбоксил, кетогрупа, тіокетогрупа, карбоксил алкіл, тіол, тіоалкоксигрупа, заміщена тіоалкоксигрупа, арил, (b) сполучення з відповідною амінокислотою із арилоксигрупа, гетероарил, гетероарилоксигрупа, захищеною аміногрупою формули PgNH-CHR2гетероцикліл, гідроксіаміногрупа, алкоксіаміногруC(O)-A, де R2 відповідає визначенню, поданому па, нітрогрупа, -SO-алкіл, -SO-заміщений алкіл, при описі сполуки формули І, а А є активуюча груSO-арил, -SO-гетероарил, -SО2-алкіл, -SО2па, наприклад, -ОН, -Вr або -СІ, і Pg є група захисзаміщений алкіл, -SO2-арил, -SО2-гетероарил, і ту аміну, з одержанням сполуки формули (11) моно- та діалкіламіногрупа, моно- та ди(заміщений алкіл)аміногрупа, моно- та діариламіногрупа, моно- та дигетероариламіногрупа, монота дигетероцикліламіногрупа, і несиметричні двозаміщені аміни, які містять різні замісники, вибрані із групи, до якої входять алкіл, заміщений алкіл, арил, гетероарил та гетероцикліл. Термін "алкілен" стосується двовалентних алкіленових груп, які містять у варіанті, якому віддається перевага, від 1 до 10 вуглецевих атомів, у варіанті, якому віддається більша перевага, від 1 (c) відщеплення групи захисту від сполуки фодо 6 вуглецевих атомів. Прикладами груп, які охормули (11) з одержанням сполуки формули (12); і плюються цим терміном, є метилен (-СН2-), етилен (-СН2СН2-), ізомери пропілену (наприклад, СН2СН2СН2- та -СН(СН3)СН2-) тощо. 21 77165 22 Термін "заміщений алкілен" стосується алкілебутоксигрупа, трет-бутоксигрупа, вторнової групи, яка містить у варіанті, якому віддаєтьбутоксигрупа, н-пентоксигрупа, н-гексоксигрупа, ся перевага, від 1 до 10 вуглецевих атомів, яка 1,2-диметилбутоксигрупа тощо. має від 1 до 3 замісників, вибраних із групи, до Термін "заміщена алкоксигрупа" стосується якої входять алкоксигрупа, заміщена алкоксигрупа, групи "заміщений алкіл-О-", де заміщений алкіл ацил, ациламіногрупа, ацилоксигрупа, аміногрупа, відповідає вищенаведеному визначенню. аміноацил, аміноацилоксигрупа, ціан, галоїд, гідТермін "алкілалкокси(група)" стосується груп роксил, карбоксил, кетогрупа, тіокетогрупа, карбо"алкілен-О-алкіл", до яких належать, наприклад, ксил алкіл, тіол, тіоалкоксигрупа, заміщена тіоалметиленметоксигрупа (-СН2ОСН3), етиленметоксикоксигрупа, арил, гетероарил, гетероцикліл, група (-СН2СН2ОСН3), н-пропіленізопропоксигрупа нітрогрупа, і моно- та діалкіламіногрупа, моно- та (-СН2СН2СН2ОСН(СН3)2), метилен-третди-(заміщений алкіл)аміногрупа, моно- та діарибутоксигрупа (-СН2ОС(СН3)3) тощо. ламіногрупа, моно-та дигетероариламіногрупа, Термін "алкілтіоалкокси(група)" стосується моно- та дигетероцикліламіногрупа, і несиметричні груп "алкілен-S-алкіл", до яких належать, напридвозаміщені аміни, які містять різні замісники, вибклад, метил ентіометоксигрупа (-СН2SСН3), етилерані із групи, до якої входять алкіл, заміщений алнтіометоксигрупа (-CH2CH2SCH3), нкіл, арил, гетероарил та гетероцикліл. Крім того, пропілентіоізопропоксигрупа (до таких заміщених алкіленових груп належать CH2CH2CH2SCH(CH3)2), метилентіо-тpетгрупи, в яких два замісники при алкіленовій групі бутоксигрупа (-CH2SC(CH3)3) тощо. конденсовані й утворюють одну або кілька циклоТермін "алкеніл" стосується алкенільних груп, алкільних, арильних, гетероциклічних або гетеаякі містять у варіанті, якому віддається перевага, рильних груп, конденсованих з алкіленовою грувід 2 до 10 і більше вуглецевих атомів, у варіанті, пою. Такі конденсовані циклоалкільні групи у якому віддається більша перевага, від 2 до 6 вугваріанті, якому віддається перевага, містять від 1 лецевих атомів, і включають щонайменше 1, у до 3 конденсованих циклічних структур. варіанті, якому віддається перевага, від 1 до 2 Термін "алкенілен" стосується двовалентних алкенільних ненасичених зв'язків. Прикладами алкеніленових груп, які містять у варіанті, якому алкенілів, яким віддається перевага, є етеніл (віддається перевага, від 2 до 10 і більше вуглецеСН=СН2), н-пропеніл (-СН2СН=СН2), ізопропеніл (вих атомів, у варіанті, якому віддається більша С(СН3)=СН2) тощо. перевага, від 2 до 6 вуглецевих атомів. ПрикладаТермін "заміщений алкеніл" стосується алкеніми груп, які охоплюються цим терміном, є етенілен льної групи, що відповідає поданому вище визна(-СН=СН-), ізомери пропенілену (наприклад, ченню, яка має від 1 до 3 замісників, вибраних із СН2СН=СН- та -С(СН3)=СН-) тощо. групи, до якої входять алкоксигрупа, заміщена Термін "заміщений алкенілен" стосується алалкоксигрупа, ацил, ациламіногрупа, ацилоксигрукеніленової групи, яка містить у варіанті, якому па, аміногрупа, аміноацил, аміноацилоксигрупа, віддається перевага, від 2 до 10 вуглецевих атоціан, галоїд, гідроксил, карбоксил, кетогрупа, тіомів, яка має від 1 до 3 замісників, вибраних із грукетогрупа, карбоксилалкіл, тіол, тіоалкоксигрупа, пи, до якої входять алкоксигрупа, заміщена алкокзаміщена тіоалкоксигрупа, арил, гетероарил, гетесигрупа, ацил, ациламіногрупа, ацилоксигрупа, роцикліл, нітрогрупа, -SO-алкіл, -SO-заміщений аміногрупа, аміноацил, аміноацилоксигрупа, ціан, алкіл, -SO-арил, -SO-гетероарил, -SО2-алкіл, -SО2галоїд, гідроксил, карбоксил, кетогрупа, тіокетогзаміщений алкіл, -SО2-арил, -SО2-гетероарил, і рупа, карбоксилалкіл, тіол, тіоалкоксигрупа, замімоно- та діалкіламіногрупа, моно- та дищена тіоалкоксигрупа, арил, гетероарил, гетеро(заміщений алкіл)аміногрупа, моно- та діариламіцикліл, нітрогрупа, і моно- та діалкіламіногрупа, ногрупа, моно- та дигетероариламіногрупа, мономоно- та ди-(заміщений алкіл)аміногрупа, моно- та та дигетероцикліламіногрупа, і несиметричні дводіариламіногрупа, моно-та дигетероариламіногрузаміщені аміни, які містять різні замісники, вибрані па, моно- та дигетероцикліламіногрупа, і несиметіз групи, до якої входять алкіл, заміщений алкіл, ричні двозаміщені аміни, які містять різні замісниарил, гетероарил та гетероцикліл. ки, вибрані із групи, до якої входять алкіл, Термін "алкініл" стосується алкінільних груп, заміщений алкіл, арил, гетероарил та гетероцикякі містять у варіанті, якому віддається перевага, ліл. Крім того, до таких заміщених алкеніленових від 2 до 10 і більше вуглецевих атомів, у варіанті, груп належать групи, в яких два замісники при алякому віддається більша перевага, від 2 до 6 вугкеніленовій групі конденсовані й утворюють одну лецевих атомів, і включають щонайменше 1, у або кілька циклоалкільних, арильних, гетероцикліваріанті, якому віддається перевага, від 1 до 2 чних або гетероарильних груп, конденсованих з алкінільних ненасичених зв'язків. До алкінільних алкеніленовою групою. груп, яким віддається перевага, належать етиніл (Термін "алкарил" стосується -алкіленСН=СН2), пропаргіл (-СН2С=СН) тощо. арильних груп, які містять у варіанті, якому віддаТермін "заміщений алкініл" стосується алкініється перевага, від 1 до 8 вуглецевих атомів в алльної групи, що відповідає поданому вище визнакіленовому фрагменті і від 6 до 10 вуглецевих ченню, яка має від 1 до 3 замісників, вибраних із атомів в арильному фрагменті. Прикладами таких групи, до якої входять алкоксигрупа, заміщена алкарильних груп є бензил, фенетил тощо. алкоксигрупа, ацил, ациламіногрупа, ацилоксигруТермін "алкокси(група)" стосується групи "алпа, аміногрупа, аміноацил, аміноацилоксигрупа, кіл-О-". До алкоксигруп, яким віддається перевага, ціан, галоїд, гідроксил, карбоксил, кетогрупа, тіоналежать, наприклад, метоксигрупа, етоксигрупа, кетогрупа, карбоксилалкіл, тіол, тіоалкоксигрупа, н-пропоксигрупа, ізопропоксигрупа, нзаміщена тіоалкоксигрупа, арил, гетероарил, гете 23 77165 24 роцикліл, нітрогрупа, -SO-алкіл, -SO-заміщений ди-(заміщений алкіл)аміногрупа, моно- та діариалкіл, -SO-арил, -SO-гетероарил, -SО2-алкіл, -SО2ламіногрупа, моно- та дигетероариламіногрупа, заміщений алкіл, -SO2-apiui, -SО2-гетероарил, і моно- та дигетероцикліламіногрупа і несиметричні моно- та діалкіламіногрупа, моно- та дидвозаміщені аміни, які містять різні замісники, виб(заміщений алкіл)аміногрупа, моно- та діариламірані із групи, до якої входять алкіл, заміщений алногрупа, моно- та дигетероариламіногрупа, монокіл, арил, гетероарил та гетероцикліл, тощо. До та дигетероцикліламіногрупа, і несиметричні двозамісників, яким віддається перевага, належать заміщені аміни, які містять різні замісники, вибрані алкіл, алкоксигрупа, галоїд, ціан, нітрогрупа, триіз групи, до якої входять алкіл, заміщений алкіл, галоїдметил та тіоалкоксигрупа. арил, гетероарил та гетероцикліл. Термін "арилокси(група)" стосується групи Термін "ацил" стосується груп алкіл-С(О)-, заарил-О, де арильна група відповідає поданому міщений алкіл-С(О)-, циклоалкіл-С(О)-, заміщений нижче визначенню, в тому числі є факультативно циклоалкіл-С(О)-, арил-С(О)-, гетероарил-С(О)-та заміщеною арильною групою, також визначеною гетероцикліл-С(О)-, де алкіл, заміщений алкіл, вище. циклоалкіл, заміщений циклоалкіл, арил, гетероаТермін "карбоксіалкіл" стосується групи "рил та гетероцикліл відповідають визначенням, С(О)Оалкіл", де алкіл відповідає поданому вище поданим у цьому описі. визначенню. Термін "ациламіно(група)" стосується груп Термін "циклоалкіл" стосується циклічних алкіC(O)NRR, де кожний R незалежно від іншого є льних груп, які містять від 3 до 12 вуглецевих атоводень, алкіл, заміщений алкіл, арил, гетероарил мів і включають один цикл або кілька з'єднаних або гетероцикліл, причому алкіл, заміщений алкіл, циклів, в тому числі конденсованих, місточкових та арил, гетероарил та гетероцикліл відповідають спіробіциклічних або поліциклічних сполук. До тавизначенням, поданим у цьому описі. ких циклоалкільних груп належать, наприклад, Термін "аміноацил" стосується груп -NRC(O)R, моноциклічні структури, наприклад, циклопропіл, де кожний R незалежно від іншого є водень, алкіл, циклобутил, циклопентил, циклооктил тощо, або заміщений алкіл, арил, гетероарил або гетероцикполіциклічні структури, наприклад, адамантил ліл, причому алкіл, заміщений алкіл, арил, гетеротощо. арил та гетероцикліл відповідають визначенням, Термін "заміщений циклоалкіл" стосується циподаним у цьому описі. клоалкільних груп, які мають від 1 до 5 (у варіанті, Термін "аміноацилокси(група)" стосується груп якому віддається перевага, від 1 до 3) замісників, -NRC(O)OR, де кожний R незалежно від іншого є вибраних із групи, до якої входять гідроксил, ацил, водень, алкіл, заміщений алкіл, арил, гетероарил ацилоксигрупа, алкіл, заміщений алкіл, алкоксигабо гетероцикліл, причому алкіл, заміщений алкіл, рупа, заміщена алкоксигрупа, алкеніл, заміщений арил, гетероарил та гетероцикліл відповідають алкеніл, алкініл, заміщений алкініл, аміногрупа, визначенням, поданим у цьому описі. аміноацил, алкарил, арил, арилоксигрупа, кетогТермін "ацилокси(група)" стосується груп алрупа, тіокетогрупа, карбоксил, карбоксилалкіл, кіл-С(О)О-, заміщений алкіл-С(О)О-, циклоалкілціан, галоїд, нітрогрупа, гетероарил, тіоалкоксигС(О)О-, арил-С(О)О-, гетероарил-С(О)О- та гетерупа, заміщена тіоалкоксигрупа, тригалоїдметил роцикліл-С(О)О-, де алкіл, заміщений алкіл, циктощо. лоалкіл, арил, гетероарил та гетероцикліл відповіТермін "циклоалкеніл" стосується циклічних дають визначенням, поданим у цьому описі. алкенільних груп, що містять від 4 до 8 вуглецевих Термін "арил" стосується ненасичених аромаатомів і включають один цикл і щонайменше один тичних карбоциклічних груп, які містять від 6 до 14 внутрішній ненасичений зв'язок. До прикладів ковуглецевих атомів і включають один цикл (напририсних циклоалкенільних груп належать у даному клад, феніл) або кілька конденсованих циклів (наразі циклобут-2-еніл, циклопент-3-еніл, циклоокт-3приклад, нафтил або антрил). До арилів, яким віденіл тощо. дається перевага, належать феніл, нафтил тощо. Термін "заміщений циклоалкеніл" стосується В разі відсутності у визначеннях спеціальних циклоалкенільних груп, які мають від 1 до 5 замісобмежень для замісників при арилах, такі арильні ників, вибраних із групи, до якої входять гідроксил, групи можуть бути факультативно заміщені замісацил, ацилоксигрупа, алкіл, заміщений алкіл, алкониками в кількості від 1 до 5, вибраними із групи, ксигрупа, заміщена алкоксигрупа, алкеніл, заміщедо якої входять ацилоксигрупа, від 1 до 5, у варіаний алкеніл, алкініл, заміщений алкініл, аміногрунті, якому віддається перевага, від 1 до 3 заміснипа, аміноацил, алкарил, арил, арилоксигрупа, ків, вибраних із групи, до якої входять гідроксил, карбоксил, кетогрупа, тіокетогрупа, карбоксилалацил, алкіл, алкоксигрупа, алкеніл, алкініл, замікіл, ціан, галоїд, нітрогрупа, гетероарил, тіоалкокщений алкіл, заміщена алкоксигрупа, заміщений сигрупа, заміщена тіоалкоксигрупа, тригалоїдмеалкеніл, заміщений алкініл, аміногрупа, аміноацил, тил тощо. ациламіногрупа, алкарил, арил, арилоксигрупа, Термін "галоїд" стосується фтору, хлору, броазидогрупа, карбоксил, карбоксил алкіл, ціан, галому та йоду, перевага віддається фтору або хлору. їд, нітрогрупа, гетероарил, гетероцикліл, аміноаТермін "гетероарил" стосується ароматичних цилоксигрупа, оксіациламіногрупа, тіоалкоксигрукарбоциклічних груп, які містять від 1 до 15 вуглепа, заміщена тіоалкоксигрупа, тіоарилоксигрупа, цевих атомів і від 1 до 4 гетероатомів, вибраних із тіогетероарилоксигрупа, -SO-алкіл, -SO-заміщений групи, до якої входять кисень, азот та сірка, щоалкіл, -SO-арил, -SO-гетероарил, -SO2-алкіл, -SO2найменше в одному циклі (у разі наявності більше заміщений алкіл, -SO2-арил, -SОг-гетероарил, триніж одного циклу). галоїдметил, моно- та діалкіламіногрупа, моно- та В разі відсутності у визначеннях спеціальних 25 77165 26 обмежень для замісників при гетероарилах, такі відає поданому вище визначенню, в тому числі є гетероарильні групи можуть бути факультативно факультативно заміщеною арильною групою, тазаміщені замісниками в кількості від 1 до 5, вибракож визначеною вище. ними із групи, до якої входять алкіл, заміщений У конкретних методичних варіантах здійснення алкіл, алкоксигрупа, заміщена алкоксигрупа, арил, цей винахід пропонує способи одержання сполук арилоксигрупа, галоїд, нітрогрупа, гетероарил, формули (4), описані в Схемах 1 і 2. У цих Схемах, тіол, тіоалкоксигрупа, заміщена тіоалкоксигрупа, поданих нижче, всі замісники, якщо не обумовлене тіоарилоксигрупа, тригалощметил тощо. Такі гетесупротивне, відповідають поданим вище визнароарильні групи можуть включати один цикл (наченням, а всі реагенти є добре відомими й прийняприклад, піридил або фурил) або кілька з'єднаних тими в практиці. циклів (наприклад, індолізиніл або бензотієніл), в тому числі конденсовані, місточкові або спіробіциклічні або поліциклічні сполуки. До гетероарилів, яким віддається перевага, належать піридил, піроліл та фурил. Терміни "гетероцикл" або "гетероцикліл" стосуються одновалентних насичених або ненасичених груп, які включають один цикл або кілька з'єднаних циклів, в тому числі конденсованих, місточкових та спіробіциклічних або поліциклічних сполук, які містять від 1 до 15 вуглецевих атомів і від 1 до 4 гетероатомів, вибраних із групи, до якої входять азот, сірка або кисень у циклі. В разі відсутності у визначеннях спеціальних обмежень для замісників при гетероциклілах, такі гетероциклічні групи можуть бути факультативно заміщені замісниками в кількості від 1 до 5, вибраними із групи, до якої входять алкіл, заміщений алкіл, алкоксигрупа, заміщена алкоксигрупа, арил, арилоксигрупа, галоїд, нітрогрупа, гетероарил, Згідно зі Схемою 1, стадія 1, придатний Nтіол, тіоалкоксигрупа, заміщена тіоалкоксигрупа, алкілфенетиламін формули (1) ацилюють відповітіоарилоксигрупа, тригалоїдметил тощо. Такі гетедним реагентом переносу бісалкоксикарбонілацероциклічні групи можуть включати один цикл або тату, одержуючи сполуку формули (2). Придатним кілька конденсованих циклів. До гетероциклілів, N-алкіл фенетил аміном формули (1) є сполука, де яким віддається перевага, належать морфоліно, V та R3 мають значення, які бажано одержати в піперидиніл тощо. кінцевому продукті формули І. Такі NПрикладами азотвмісних гетероциклів та гетеалкілфенетиламіни легко одержати шляхом реакроарилів є (але ними не обмежуються) пірол, іміції 2-бром- або 2-хлоретилбензолу з аміном фордазол, піразол, піридин, піразин, піримідин, піримули H2N-R3 в умовах, добре відомих і прийнятих дазин, індолізин, ізоіндол, індол, індазол, пурин, у практиці. Придатним реагентом переносу бісалхінолізин, ізохінолін, хінолін, фталазин, нафтилпікоксикарбонілацетату є сполука, де R4 є С1-С4ридин, хіноксалін, хіназолін, цинолін, птеридин, алкіл і яка переносить бісалкоксикарбонілацетил карбазол, карболін, фенантридин, акридин, фенадо сполуки формули (1), наприклад, бісалкоксикантролін, ізотіазол, феназин, ізоксазол, фенкосарбонілоцтові кислоти та бісалкоксикарбонілацетизин, фенотіазин, імідазолідин, імідазолін, піперилхлориди [дивись Бен-Ішаї Ben-Ishai, дин, піперазин, індолін, морфоліно, піперидиніл, Tetrahedron. 43, 439-450 (1987)]. тетрагідрофураніл тощо, а також N-алкоксиНаприклад, відповідний N-алкілфенетиламін азотвмісні гетероцикли. формули (1) уводять у контакт із відповідною бісаТермін "оксіациламіно(група)" стосується груп лкоксикарбонілоцтовою кислотою й одержують -OC(O)NRR, де кожний R незалежно від іншого є сполуку формули (2). Такі реакції сполучення є водень, алкіл, заміщений алкіл, арил, гетероарил звичайними в синтезі пептидів, і при їх проведенні або гетероцикліл, причому алкіл, заміщений алкіл, можна застосувати методи синтезу, використовуарил, гетероарил та гетероцикліл відповідають вані в цій галузі. Наприклад, для полегшення цього визначенням, поданим у цьому описі. ацилювання можна застосувати добре відомі агенТермін "тіол" стосується групи -SH. ти сполучення, наприклад, карбодііміди, з викориТермін "тіоалкокси(група)" стосується групи -Sстанням або без використання добре відомих доалкіл. мішок, наприклад, N-гідроксисукциніміду, 1Термін "заміщена тіоалкокси(група)" стосуєтьгідроксибензотриазолу тощо. В таких реакціях ся групи -S-заміщений алкіл. сполучення часто застосовують придатну основу Термін "тіоарилокси(група)" стосується групи для зв'язування кислоти, що вивільнюється при арил-S-, де арильна група відповідає поданому реакції. До придатних основ належать, наприклад, вище визначенню, в тому числі є факультативно триетиламін, Ν,Ν-діізопропілетиламін, Nзаміщеною арильною групою, також визначеною метилморфолін тощо. Реакцію зручно проводити в вище. інертному апротонному полярному розріджувачі, Термін "гетероарилокси(група)" стосується наприклад, в диметилформаміді, хлористому мегруп гетероарил-О-, де гетероарильна група відпо 27 77165 28 тилені, хлороформі, ацетонітрилі, тетрагідрофура"Групи захисту в органічному синтезі" (Theodora ні тощо. Як правило, реакцію проводять при темGreene, Protecting Groups in Organic Synthesis. 1st пературі від приблизно 0°С до приблизно 60°С, і and 2nd Editions, Wiley-Interscience) і роботу Бенвона, як правило, вимагає часу від приблизно 1год Ішаї (Ben-Ishai, Tetrahedron. 43, 439-450 (1987))]. до приблизно 24год. Після завершення реакції продукт формули (2) виділяють звичайними способами, в тому числі екстракцією, осадженням, хроматографією, фільтруванням, розтиранням, кристалізацією тощо. В альтернативному варіанті, наприклад, придатний N-алкілфенетиламін формули (1) уводять у контакт із придатним бісалкоксикарбонілацетилхлоридом і одержують сполуку формули (2). Такі хлорангідриди кислот легко одержати з відповідних кислот способами, добре відомими в практиці, наприклад, дією трихлористого фосфору, оксихлориду фосфору, п'ятихлористого фосфору, тіоніл хлориду або оксалілхлориду з використанням або без використання незначної кількості диметилформаміду в інертному розчиннику, наприклад, в толуолі, хлористому метилені або хлороформі, при температурах приблизно від 0 до 80°С. Реакцію, як правило, проводять протягом часу від 1год до 24год. Хлорангідрид кислоти можна виділити та очистити, або його часто можна використати безпосередньо, тобто з виділенням та/або очищенням або без цих операцій. В таких реакціях ацилювання часто застосовують придатну основу для зв'язування кислоти, що вивільнюється при реакції. До придатних основ належать, наприклад, піридин, триетиламін, Ν,Νдіізопропілетиламін, N-метилморфолін тощо. Реакцію зручно проводити в інертному апротонному полярному розріджувачі, наприклад, у хлористому Згідно зі Схемою 2, стадія 1, придатну похідну метилені, хлороформі, тетрагідрофурані тощо. Як феніл оцтової кислоти формули (5) сполучають із правило,реакцію проводять при температурі від придатним ацеталем формули (6) і одержують приблизно -20°С до приблизно 80°С, і вона, як сполуку формули (7). Придатною похідною феніправило, вимагає часу від приблизно 1год до прилоцтової кислоти формули (5) є сполука, де V має близно 24год. Після завершення реакції продукт значення, яке бажано одержати в кінцевому проформули (2) виділяють звичайними способами, в дукті формули І, і Аг є активуюча група, наприклад, тому числі екстракцією, осадженням, хроматогра-ОН, -СІ або -Вr. Придатним ацеталем формули (6) фією, фільтруванням, розтиранням, кристалізаціє сполука, де R3 має значення, яке бажано одерєю тощо. жати в кінцевому продукті формули І, і R5 є С1-С4Згідно зі Схемою 1, стадія 2, сполуку формули алкіл. Такі реакції сполучення є звичайними в син(2) циклізують і одержують сполуку формули (3). тезі пептидів, і при їх проведенні можна застосуваНаприклад, сполуку формули (2) уводять у коти методи синтезу, використовувані в цій галузі, як нтакт із кислотою, наприклад, із трифторметансуописано для Схеми 1, стадія 1. льфокислотою або сірчаною кислотою. Як правиСполучення, показане на Схемі 2, стадія 1, ло, реакцію проводять із використанням вибраної можна також виконувати в умовах реакції Шоттекислоти як розчинника. В типових випадках реагена-Баумана (Schotten-Baumann), застосовуючи нти спочатку змішують при температурі від прибхлорангідрид придатної фенілоцтової кислоти фолизно -20°С до приблизно 0°С, після чого дають рмули (5) та придатний ацеталь формули (6) у суміші нагріватися до температури в межах від змішаному розчиннику, наприклад, в метил-треттемператури навколишнього середовища до прибутиловому простому ефірі, етилацетаті, тетрагідблизно 60°С. Реакція циклізації вимагає, як правирофурані, ацетоні або діетиловому ефірі з водою. ло, часу від приблизно 12год до приблизно 72год. Таку реакцію проводять із використанням придатПісля завершення реакції продукт формули (3) ної основи, наприклад, гідроксиду натрію, гідроквиділяють звичайними способами, в тому числі сиду калію, карбонату натрію, карбонату калію, екстракцією, осадженням, хроматографією, фільтбікарбонату натрію або бікарбонату калію. Як праруванням, розтиранням, кристалізацією тощо. вило, реакцію проводять при інтенсивному переЗгідно зі Схемою 1, стадія 3, від сполуки формішуванні при температурах від приблизно -20°С мули (3) відщеплюють групу захисту й одержують до приблизно 80°С, і вона, як правило, вимагає сполуку формули (4). часу від приблизно 1год до приблизно 24год. Після Відщеплення таких алкоксикарбонільних груп завершення реакції продукт формули (7) виділязахисту аміну є добре відомим і прийнятим у пракють звичайними способами, в тому числі екстрактиці. Дивись, наприклад, [монографію Т. Гріні 29 77165 30 цією, осадженням, хроматографією, фільтрувантетрагідрофурані, етилацетаті або в нижчих спирням, розтиранням, кристалізацією тощо. тах, наприклад, у метанолі, етанолі та ізопропаноЗгідно зі Схемою 2, стадія 2, сполуку формули лі, в оцтовій кислоті, воді, водному розчині аміаку (7) циклізують і одержують сполуку формули (8). тощо або в їх сумішах. В типових випадках реакТакі реакції циклізації проводять у кислоті, наприцію проводять під тиском водню в межах від атмоклад, у сірчаній кислоті. Як правило, цю кислоту сферного тиску до приблизно 600 фунтів на кв. використовують як розчинник. В типових випадках дюйм (4137кПа). Як правило, реакцію проводять згадану реакцію проводять при температурі в мепри температурі від приблизно 20°С до приблизно жах від приблизно -20°С до приблизно 150°С, і 100°С, і вона, як правило, вимагає часу від прибвона вимагає, як правило, часу від приблизно 1год лизно 1год до приблизно 24год. Після завершення до приблизно 24год. Після завершення реакції реакції продукт формули (4) виділяють звичайнипродукт формули (8) виділяють звичайними споми способами, в тому числі екстракцією, осадженсобами, в тому числі екстракцією, осадженням, ням, хроматографією, фільтруванням, розтиранхроматографією, фільтруванням, розтиранням, ням, кристалізацією тощо. кристалізацією тощо. В альтернативному варіанті, де амін переноЗгідно зі Схемою 2, стадія 3, сполуку формули сять за участю азиду, відновлюють азидогрупу. (8) піддають реакції переносу аміну для одержанТакі реакції проводять шляхом гідрування, як опиня сполуки формули (9). На Схемі 2 показано оксано вище. симування. Таке оксимування проводять шляхом Згідно з іншим варіантом здійснення, цей виуведення еноляту сполуки формули (8) у реакцію з нахід пропонує стереоспецифічні способи одерреагентами переносу оксиму, наприклад, складжання лактамів, сполук формули І, в тому числі ним ефіром - алкілнітритом. Енолят сполуки фор(N)-((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)мули (8) можна одержати шляхом реакції сполуки (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3формули (8) із придатною основою, наприклад, із бензазепін-2-ону, та способи одержання хіральних трет-буилатом калію, діізопропіламідом літію, гекпроміжних продуктів для цих сполук. Такі способи саметилдисилазидом літію, гексаметилдисилазипоказані на Схемі А. дом натрію, гексаметилдисилазидом калію тощо. Приклади таких реакцій оксимування наведені в монографії Уїлера та інших "Органічні синтези" (Wheeler et al., Organic Syntheses, Coll. Vol.VІ, p.840)], де описані реакції ізоамілнітриту з кетоном для одержання цільового оксиму. Цю реакцію, як правило, проводять у розчиннику, наприклад, у тетрагідрофурані. У типових випадках реакцію проводять при температурі від приблизно -20°С до приблизно 50°С, і вона вимагає часу від приблизно 1 до приблизно 24год. Після завершення реакції продукт формули (8) виділяють звичайними способами, в тому числі екстракцією, осадженням, хроматографією, фільтруванням, розтиранням, кристалізацією тощо. В альтернативному варіанті таку реакцію переносу аміну можна проводити за участю азиду. Азид можна одержати шляхом реакції еноляту сполуки формули (8) із реагентами переносу азиду, наприклад, із толуолсульфонілазидом та тріізопропілбензолсульфонілазидом. Приклади таких реакцій наведено в роботі Еванса та інших [Evans et al., J. Am. Chem. Soc. 112:4011-4030 (1990) 41]. Цю реакцію, як правило, проводять у розчиннику, наприклад, у тетрагідрофурані. У типових випадках реакцію проводять при температурі від приблизно -20°С до приблизно 50°С, і вона, як правило, На Схемі А, стадія 1, представлено стереохівимагає часу від приблизно 1год до приблизно мічне розділення відповідного лактаму формули 24год. Після завершення реакції продукт формули (4) з одержанням лактаму формули (10). Для обіз(8), який містить азидогрупу замість оксиму, видінаного фахівця ясно, що представлені способи не ляють звичайними способами, в тому числі екстобов'язково обмежуються одержанням індивідуаракцією, осадженням, хроматографією, фільтрульного ізомеру. Навпаки, представлені способи ванням, розтиранням, кристалізацією тощо. уможливлюють одержання будь-якого з конкретЯк показано на Схемі 2, стадія 4, оксим відноних енантіомерів згаданих лактамів і придатні, влюють, одержуючи сполуку формули (4). Таке зокрема, для одержання ізомерів 1-аміно-3-метилвідновлення виконують шляхом оброблення вод2,3,4,5-тетрагідро- 1Н-3-бензазепін-2-ону. нем та відповідним каталізатором, наприклад, ніУ зв'язку з підвищеною біологічною активністю келем Ренея або паладієвими каталізаторами, (S)-ізомеру при фрагменті 2,3,4,5-тетрагідро-1Н-3наприклад, паладієм на вугіллі. Цю реакцію, як бензазепін-2-ону, цей винахід є найбільш корисправило, проводять у розчиннику, наприклад, у 31 77165 32 ним у варіанті одержання практично чистого (S)ції небажаної діастереомерної солі. ізомеру. Термін "практично чистий" у значенні, Як правило, кристалізацію виконують при повживаному в цьому описі, стосується енантіомерчатковій температурі від приблизно 40°С до темної чистоти (R)- або (S)-лактаму, зокрема, (R)- та ператури кипіння (із зворотним холодильником) (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3вибраного розчинника (розчинників) і при початкобензазепін-2-ону. Згідно з цим винаходом практивих концентраціях від приблизно 0,05Μ до приблично чистий (S)-1-аміно-3-метил-2,3,4,5-тетрагідрозно 0,25М. Потім суміш охолоджують і одержують 1Н-3-бензазепін-2-он можна одержати із вмістом згадану сіль. Може бути доцільним застосування (S)-енантіомера більше ніж 80%, у варіанті, якому затравки. Може бути доцільним перемішування віддається перевага, більше ніж 90%, у варіанті, початкового осаду протягом від приблизно 4год до якому віддається більша перевага, більше ніж 48год. Кристалізаційний розчин у варіанті, якому 95%, у варіанті, якому віддається найбільша перевіддається перевага, охолоджують повільно. Найвага, більше ніж 97%. більш зручно виконувати кристалізацію при охолоНаприклад, індивідуальні ізомери сполуки фодженні до температур у межах від температури рмули (4) можна розділити шляхом фракційної навколишнього середовища до приблизно -20°С. кристалізації її солей - дибензоїлтартрату, солей з Сіль можна відділити від маточного розчину, за(R)-(-)-10-камфорасульфоновою кислотою і (D)-(-)стосовуючи добре відомі в практиці способи, в мигдалевою кислотою. Очікується, що для цієї тому числі фільтрування, декантацію, центрифугумети придатними є різноманітні дибензоїлтартравання, випарювання, сушіння тощо. Сполуку форти. Зокрема, перевага віддається дибензоїльним мули (10) можна використовувати безпосередньо у складним ефірам, які мають у пара-положенні заформі солі з вибраною кислотою. В альтернативмісник, вибраний із групи, до якої входять водень, ному варіанті сполуку формули (10) перед викоригалоїд, С1-С4-алкіл та С1-С4-алкоксигрупа, а найбістанням можна виділити у формі солі з іншою кисльша перевага віддається ди-n-толуїлтартрату. лотою після заміни кислоти або у формі основи Для одержання (S)-ізомеру застосовують ди-nшляхом екстракції в основному середовищі, як толуїл-L-тартрат. добре відомо в практиці. У варіанті здійснення Схеми А, стадії 1, якому У варіанті здійснення, якому віддається перевіддається перевага, сполукою формули (4) є сповага, цей винахід пропонує динамічне розділення лука, де V є водень, a R3 є С1-С4-алкіл, в тому чис(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3лі метил, етил, пропіл, ізопропіл, бутил, ізобутил бензазепін-2-ону високої енантіомерної чистоти, та втор-бутил; найбільша перевага віддається яке включає кристалізацію 1-аміно-3-метилвикористанню сполук формули (4), де V є водень, 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону у формі a R3 є метил. його солі з кислотою, вибраною із групи, до якої Згідно із представленим способом, сполуку входять ди-n-толіл-L-винна кислота, (R)-(-)-10формули (4) уводять у контакт із вибраною кислокамфорасульфонова кислота і (D)-(-)-мигдалева тою. Як правило, можна використовувати кількість кислота, в динамічному процесі у присутності арокислоти в межах від приблизно 0,4 молярного екматичного альдегіду. Перевага цього динамічного вівалента до значного надлишку; перевага віддапроцесу полягає в тому, що під час кристалізації 1ється кількості від приблизно 0,4 до 1,5 молярного аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінеквівалента, а більша перевага - кількості від при2-он зазнає конверсії в індивідуальний ізомер, що близно 0,5 до 1,1 молярного еквівалента. забезпечує підвищення виходу та уникнення утвоПроцес проводять, як правило, шляхом крисрення відходів, які містять небажаний ізомер. талізації солі кислоти з розчину. При цьому придаОчікується, що для згаданого процесу придаттними є, зокрема, такі розчинники, як нижчі спирти, ні різноманітні альдегіди; виявлено, що певні альв тому числі метанол, етанол, н-пропанол, ізопродегіди є особливо придатними у практиці. Конкрепанол, бутанол, втор-бутанол, ізобутанол, треттно, з'ясовано, що перевагу слід віддавати бутанол, аміловий спирт, ізоаміловий спирт, третсаліциловим кислотам і що більшу перевагу при аміловий спирт, гексанол, циклопентанол та цикздійсненні цього динамічного процесу розділення логексанол, а перевага віддається метанолу, етаслід віддавати саліциловому альдегіду, 5-нітронолу та ізопропанолу. Може виявитися доцільним саліциловому альдегіду та 3,5-дихлорзастосування осаджувача. Термін "осаджувач" у саліциловому альдегіду. вживаному значенні означає розчинник, в якому Відповідно, якщо згаданий процес здійснюєтьрозчинність солі значно нижче, ніж у розчиннику. В ся в режимі динамічного розділення, 1-аміно-3разі застосування осаджувача перевага віддається метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он речовинам, які змішуються з вибраним розчинниуводять у контакт із вибраною кислотою у присутком. До придатних осаджувачів належать прості ності альдегіду. Як правило, для динамічного розефіри, наприклад, діетиловий ефір, метил-тpетділення використовують від приблизно 0,9 до 1,2 бутиловий ефір тощо, та нижчі алкілацетати, намолярного еквівалента кислоти, краще приблизно приклад, метилацетат, етилацетат, ізопропілаце1 молярний еквівалент. Альдегід, як правило, затат, пропілацетат, ізобутилацетат, вторстосовують у каталітичній кількості. В типових вибутилацетат, бутилацетат, амілацетат, ізоамілападках застосовують від приблизно 0,5 до 0,001 цетат тощо, а також алкани, наприклад, пентан, молярного еквівалента альдегіду, у варіанті, якому гексан, гептан, циклогексан тощо. Якщо описаний віддається перевага, від приблизно 0,1 до 0,01 процес здійснюють шляхом кристалізації солі кисмолярного еквівалента. лоти з рацемічної суміші, то застосовувати осаЗгаданий динамічний процес звичайно здійсджувач слід обережно для запобігання кристалізанюють у розчиннику або в розчиннику без осаджу 33 77165 34 вача, як описано вище. Суміш 1-аміно-3-метил(13) може також мати стереохімічну структуру, 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону, вибраної бажану для кінцевого продукту формули І. Реакцію кислоти та альдегіду перемішують для забезпесполучення, показану на стадії 3, проводять із вичення конверсії в бажаний ізомер. Як правило, цю користанням кислоти формули (13) (сполуки, де A1 конверсію здійснюють при температурах від темє -ОН) або галоїдангідриду такої кислоти (сполуки, ператури навколишнього середовища до темпераде А1 є -СІ або -Вr) за методикою, аналогічною тури кипіння розчинника. Конверсія вимагає часу, описаній для Схеми 1, стадія 1. як правило, від 6год до 48год. Альтернативний спосіб одержання сполук фоДля обізнаного фахівця зрозуміло, що в разі рмули І показано на Схемі А, стадія 5, де ілюстропроведення згаданого процесу в режимі динамічвана реакція сполучення придатної сполуки форного розділення, використання солі (S)-1-аміно-3мули (10) із придатною сполукою формули (14), метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону з R1CX1X2-C(O)-NH-CHR2-С(О)-А2, із безпосереднім кислотою може ускладнюватися внаслідок присутодержанням сполуки формули І. Придатною споності у виділеному продукті незначної кількості лукою формули (10) є сполука, описана на стадії 2. альдегіду. Тому перевага віддається виділенню Придатною сполукою формули (14) є сполука, де (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3R1, R2, Χ1 і Х2 мають значення, бажані в кінцевому бензазепін-2-ону після динамічного розділення продукті формули І. Відповідною сполукою форшляхом сольового обміну, у варіанті, якому віддамули (14) є також сполука, що має стереохімічну ється перевага, у формі гідрохлориду, перед його структуру, бажану для кінцевого продукту формувикористанням або одержанням основи. ли І. Для обізнаного фахівця зрозуміло, що сполуки Сполуки формули (14) легко одержати шляхом формули (10) можна використовувати у різноманісполучення амінокислот із захищеною карбокситних способах для одержання сполук, корисних льною групою, H2N-CHR2-C(O)OPg1, зі сполуками для лікування хвороби Альцгеймера. Ці способи формули (13), описаними вище. Такі реакції споописані в патентній заявці PCT/US97/22986, подалучення також добре відомі в практиці і дають ній 22 грудня 1997p., а також описані нижче. Спопродукти, які після відщеплення групи захисту соби згідно з цим винаходом відрізняються тим, утворюють сполуки формули (14). що вони забезпечують одержання сполук формули Цей винахід додатково ілюстрований поданиІ із використанням розділення, представленого на ми нижче прикладами та препаративними методиСхемі А, стадія 1. ками. Ці приклади та препаративні методики маНа Схемі А, стадія 2, показано реакцію сполують лише ілюстративний характер і не призначені чення придатної амінокислоти із захищеною амінодля будь-якого обмеження обсягу винаходу. групою формули PgNH-CHR2-C(O)-A та придатноТерміни, вживані в згаданих прикладах та го лактаму формули (10). Придатними препаративних методиках, мають звичайні знаамінокислотами із захищеними аміногрупами є чення, за винятком спеціально вказаних випадків. сполуки, де Pg є група захисту аміну, R2 має знаНаприклад, "°С" означає градуси за Цельсієм; чення, бажане в кінцевому продукті формули І, а А "ммоль" означає мілімоль або мілімолі; "г" означає є активуюча група, наприклад, -ОН або -СІ, здатна грам або грами; "мл" означає мілілітр або мілілітсполучатися з аміногрупою сполуки формули (10). ри; "розсіл" означає насичений водний розчин Такі амінокислоти із захищеними аміногрупами хлориду натрію; "ТГФ" означає тетрагідрофуран; легко одержати обізнаному фахівцеві. "РХВЕ" означає рідинну хроматографію високої Серед амінокислот із захищеними аміногрупаефективності (під високим тиском); тощо. ми формули PgNH-CHR2-С(О)-А перевага віддаПриклад 1 ється сполукам, де Pg є трет-бутоксикарбоніл та Синтез 1-аміно-3-метил-2,3,4,5-тетрагідро-1Нбензилоксикарбоніл, R2 є метил, та сполукам, сте3-бензазепін-2-ону реохімія яких відповідає L-амінокислотам. До суспензії гідриду натрію (1,1екв.) в 15мл Реакція сполучення, показана на Схемі А, стабезводного ДМФ додавали 2,3,4,5-тетрагідро-1Ндія 2, включає реакцію, яку звичайно проводять 3-бензазепін-2-он (0,0042моль) у формі розчину в при синтезі пептидів, і при ЇЇ проведенні можна 10мл ДМФ. Потім додавали метилйодид (приблиззастосовувати методи синтезу, використовувані в но 2екв.). Після завершення реакції, посвідченого цій галузі. Такі методи детально описані для СхеТШХ (хроматографією в тонкому шарі), реакційну ми 1, стадія 1. суміш виливали на лід і екстрагували етилацетаСхема А, стадія 3, ілюструє відщеплення групи том. Органічний шар промивали водою, а потім захисту від сполуки формули (11) з одержанням розсолом. Потім органічний шар сушили над сполуки формули (12). Відщеплення таких груп Na2SO4, фільтрували й концентрували під знижезахисту аміну є добре відомим і прийнятим у пракним тиском. Залишок очищали РХВЕ (LC 2000) тиці. при елююванні системою етилацетат/гексан і одеСхема А, стадія 4, ілюструє реакцію сполученржували 3-метил-2,3,4,5-тетрагідро-1Н-3ня придатної сполуки формули (13), R1CX1X2бензазепін-2-он. C(O)A1, зі сполукою формули (12) для одержання 3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2сполуки формули І. Придатними сполуками форон (1екв.) розчиняли в ТГФ і додавали ізоамілнітмули (13) є сполуки, де R1, X1 і Х2 мають значення, рит (1,2екв.). Охолоджували суміш до 0°С у бані з бажані в кінцевому продукті формули І, і добре льодом. Додавали крапля за краплею NaHMDS відомі у практиці, в тому числі описані в патентній (1,1екв., 1Mb ТГФ). Після перемішування протягом заявці PCT/US97/22986, поданій 22 грудня 1997p., 1год або до завершення реакції суміш концентруа також у цьому описі. Придатна сполука формули вали, а потім підкислювали 1н. водною хлористо 35 77165 36 водневою кислотою й екстрагували етилацетатом. охолоджували до 0°С і знижували рН з 12 до 2-3, Органічний шар сушили й концентрували, одерзастосовуючи водну НСI (2н.) Одержаний осад жуючи неочищений продукт, який очищали хромаперемішували протягом 12-16год, після чого віддітографією на силікагелі й одержували 1ляли фільтруванням і сушили, одержуючи 86,3г гідроксііміно-3-метил-2,3,4,5-тетрагідро-1Н-3(64,9%) 1-гідроксііміно-3-метил-6,7-дигідро-2Н-3+ + бензазепін-2-он. Мас-спектр (М+Н) 205,1. бензазепін-2-ону; т.пл. 225-226°С; (М+Н) =203,0. 1-гідроксііміно-3-метил-2,3,4,5-тетрагідро-1НРозчин 1-гідроксііміно-3-метил-6,7-дигідро-2Н3-бензазепін-2-он розчиняли в EtOH/NH3 (20:1) і 3-бензазепін-2-ону (35г, 0,173моль) в етанолі гідрували в автоклаві із застосуванням нікелю Ре(525мл) завантажували в автоклав разом із паланея і водню (500 фунтів на кв. дюйм, 3447 кПа) при дієм на вугіллі (10%, 3,5г) у формі суспензії у роз100°С протягом 10 год. Одержану суміш фільтрубавленій НСI (17,5г концентрованої водної НСI в вали й концентрували, одержуючи масло, яке 17мл води). Одержану суміш гідрували при 50°С і очищали хроматографією на силікагелі й одержутиску водню 250 фунтів на кв. дюйм (1723кПа) до вали сполуку, вказану в заголовку. завершення реакції. Реакційну суміш фільтрували Приклад 2 через шар целіту, використовуючи етанол як розСинтез 1-аміно-3-метил-2.3.4.5-тетрагідро- 1Нчинник, і концентрували фільтрат до об'єму 90мл. 3-бензазепін-2-ону Додавали до концентрату воду (350мл) і знов конУ посудину Мортона місткістю 20л завантажуцентрували одержаний розчин до об'єму приблизвали МТБЕ (5,52л, 7 об'ємів) і диметилацеталь (Nно 200мл. До цього водного розчину додавали метиламіно)-ацетальдегіду (614г, 5моль) і одержудихлорметан (350мл), після чого доводили рН до вали розчин при кімнатній температурі. Додавали 11-11,5 водним розчином гідроксиду натрію (1н.). в реакційну посудину Мортона розчин бікарбонату Органічну фазу відділяли, а водну фазу екстрагунатрію, приготований шляхом додавання бікарбовали дихлорметаном (175мл). Об'єднані екстракти нату натрію (546г, 6,5моль) до води (6,31л, 8 об'єконцентрували, одержуючи залишок, який при стомів). Одержану суміш охолоджували до темпераянні кристалізувався, і одержували сполуку, вказатури нижче ніж 10°С і додавали до охолодженої ну в заголовку: т.пл. 69-81°С; (М+Н)+=191,0. суміші крапля за краплею протягом 1год розчин Приклад 3 фенілацетилхлориду (789г, 5моль) в МТБЕ Синтез 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н(789мл). Після завершення додавання реакційну 3-бензазепін-2-ону суміш перемішували при кімнатній температурі У посудину Мортона місткістю 22л завантажупротягом 1год. На цей час аналіз методом РХВЕ вали дихлорметан (4,73л, 8 об'ємів), Nпосвідчив завершення реакції. Після екстракції метилфенетиламін (591г, 4,33моль) і водний розМТБЕ (4 об'єми), висушування над безводним сучин бікарбонату натрію (436,7г, 5,2ммоль в 4,73л льфатом магнію й концентрування в роторному води). Одержану суміш охолоджували до темпевипарнику одержано 1,187кг (98%) N-метил-N-(2,2ратури нижче ніж 5°С і додавали до охолодженої диметоксіетил)фенілацетаміду у вигляді рідини. суміші крапля за краплею розчин хлорацетилхло(М+Н)+=237,9. риду (513,7г, 4,55моль) у дихлорметані (887мл) на У посудину Мортона місткістю 5л завантажупротязі 70хв. Після завершення додавання аналіз вали в сильному потоці азоту H2SO4 (1,42л) і крапметодом РХВЕ посвідчив завершення реакції. Роля за краплею додавали в реакційну посудину Nзділяли шари й екстрагували водний шар дихлорметил-N-(2,2-диметоксіетил)фенілацетамід (712г, метаном. Об'єднані органічні фази сушили над 3моль), при цьому за рахунок тепла реакції темпебезводним сульфатом магнію і концентрували в ратура суміші підвищувалася на 22-78°С. Одержароторному випарнику; одержано 915,7г (99,8%) Nну реакційну суміш потім нагрівали при 110°С прометил-N-(2-фенілетил)-1-хлорацетаміду: тягом 3год, після чого охолоджували до кімнатної (М+Н)=212,1. температури і переносили в посудину Мортона У посудину місткістю 12л в атмосфері азоту місткістю 20л. При температурі нижче ніж 10°С завантажували N-метил-N-(2-фенілетил)-1реакційну суміш гасили водним розчином гідрокхлорацетамід (883,3г, 4,17моль) і ортосиду натрію (9,18л, 5н.). Після екстракції етилацедихлорбензол (6,18л). Додавали хлористий алютатом (двічі по 2,85л), висушування над сульфаміній (1319г, 10,13моль), при цьому за рахунок том натрію й концентруванням досуха одержано тепла реакції температура суміші підвищувалася 520г (73,5%) 3-метил-6,7-дигідро-2Н-3-бензазепінна 22-50°С. Одержану реакційну суміш потім на2-ону у вигляді твердої речовини. Цей матеріал грівали при 165°С протягом 2,5год, після чого охоможна з метою додаткового очищення перекрислоджували до кімнатної температури на протязі талізувати з МТБЕ, одержуючи твердий продукт із приблизно 14год. Охолоджували реакційну суміш т.пл. 81-82°С; (М+Н)+=174,2. приблизно до 0°С і додавали до холодної води Розчин 3-метил-6,7-дигідро-2Н-3-бензазепін-2(8,86л, приблизно 5°С) чотирма частинами з меону (113,8г, 0,657моль) в ТГФ (0,5л) охолоджували тою підтримувати температуру, яка підвищується до 0°С і додавали крапля за краплею ізоамілнітрит за рахунок тепла реакції, на рівні приблизно 40°С. (100,75г, 0,86моль). До одержаної суміші додавали Розділяли шари, водний шар екстрагували дихлоLiHMDS (854мл, 1Μ розчин в ТГФ, 0,854моль) із рметаном (7,07л) і знов розділяли шари. Органічні такою швидкістю, щоб температура залишалася шари об'єднували й екстрагували водною хлориснижче 10°С. Після завершення додавання реактоводневою кислотою (8,83л, 1н.), а потім насичеційну суміш перемішували при кімнатній темпераним водним розчином бікарбонату натрію (7,07л), турі протягом 2-3год, контролюючи хід реакції за сушили над сульфатом магнію, змішували із силідопомогою РХВЕ. Після завершення реакції суміш кагелем (883г) і вносили в колонку із силікагелем 37 77165 38 (3,53кг, колонка з пористим скляним фільтром, 2-ону і ди-n-толуїл-L-винної кислоти (вихід 96%, ее заповнення за допомогою суспензії в дихлормета94,7%). ні). Через колонку пропускали як елюент дихлорСіль (S)-1-аміно-3-метил-2,3,4,5-тетрагідрометан до об'єму елюату 25л, а потім етилацетат 1Н-3-бензазепін-2-ону і ди-n-толуїл-L-винної кисдля елюювання продукту. Фракцію, що містила лоти (11,83г, 20,5ммоль) розчиняли в 45мл 1,0н. продукт, випарювали й одержували 3-метилводного розчину гідроксиду натрію й екстрагували 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он у вигляді хлористим метиленом (тричі по 25мл). Об'єднані жовтувато-коричневої твердої речовини в кількості розчини в хлористому метилені промивали 35мл 608г (83%). 1,0н. водного розчину гідроксиду натрію, потім У посудину місткістю 22л в атмосфері азоту розсолом і сушили над безводним MgSO4. Після завантажували 3-метил-2,3,4,5-тетрагідро-1Н-3видалення розчинника у вакуумі одержано сполубензазепін-2-он (606г, 3,46моль) і ізоамілнітрит ку, вказану в заголовку (3,38г) у вигляді безбарв(543г, 4,5моль) в ТГФ (7,88л). Суміш охолоджуваного масла (вихід 87%, ее 93,2%). ли приблизно до 0°С і додавали LiHMDS (1н. розПриклад 5 чин в ТГФ, 4,5л, 4,5моль) із такою швидкістю, щоб Синтез (S)-1-аміно-3-метил-2,3,4,5-тетрагідротемпература залишалася нижче приблизно 7°С. 1Н-3-бензазепін-2-ону 1-аміно-3-метил-2,3,4,5Після завершення додавання реакційну суміш пететрагідро-1Н-3-бензазепін-2-он (6,0г, 31,5ммоль) ремішували при кімнатній температурі протягом обережно нагрівали в 75мл метанолу для розчиприблизно 2год, контролюючи хід реакції за допонення і поєднували з розчином ди-n-толуїл-Lмогою РХВЕ. Після завершення реакції суміш оховинної кислоти (12,2г, 31,5ммоль) в 75мл теплого лоджували приблизно до 0°С і знижували рН із 12 метанолу. В розчин вносили затравку, причому до 2-1, застосовуючи водну НСI (2н.) Одержаний утворювався твердий продукт. Додавали ще осад перемішували протягом приблизно 6год, піс100мл метанолу і перемішували суміш. Після пеля чого відділяли фільтруванням і сушили, одерремішування протягом приблизно 18год твердий жуючи 1-гідроксііміно-3-метил-2,3,4,5-тетрагідропродукт відділяли фільтруванням і промивали не1Н-3-бензазепін-2-он (604,7г, 85,6%). великою кількістю охолодженого метанолу. ОдерРозчин 1-гідроксііміно-3-метил-2,3,4,5жано 6,7г твердої речовини. Цю речовину змішутетрагідро-1Н-3-бензазепін-2-ону (625г, 3,06моль) вали з метанолом (200мл) і перемішували. Через в етанолі сорту 3А (15,6л) завантажували в авток18год відділяли твердий продукт, одержуючи сіль лав разом із паладієм на вугіллі (10%, 120г) у фо(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3рмі суспензії в розбавленій НСI (312г концентробензазепін-2-ону і ди-n-толуїл-L-винної кислоти ваної водної НСI у 320мл води). Одержану суміш (4,4г). Виділення основи за методикою, описаною гідрували при 50°С і тиску водню 250 фунтів на кв. в Прикладі 4, дало сполуку, вказану в заголовку дюйм (1723кПа) при інтенсивному перемішуванні (ее 96%). до завершення реакції (приблизно 4год). РеакційПриклад 6 ну суміш фільтрували через шар целіту, викорисСинтез (S)-1-аміно-3-метил-2.3.4.5-тетрагідротовуючи етанол як розчинник, і концентрували 1Н-3-бензазепін-2-ону В апараті місткістю 22л нафільтрат, одержуючи тверду речовину. Цей твергрівали в атмосфері азоту 1-аміно-3-метил-2,3,4,5дий продукт обробляли дихлорметаном (6л) і дотетрагідро-1Н-3-бензазепін-2-он (438г, 2,3моль) давали 1н. водний розчин гідроксиду натрію до приблизно до 40°С для одержання його розчину в значення рН водного шару в межах 11-11,5. Суміш метанолі (4,38л). У другій посудині розчиняли диперемішували, розділяли шари й екстрагували n-толуїл-L-винну кислоту (889,7г, 2,3моль) в 4,38л водний шар дихлорметаном (2л). Органічні шари метанолу, одержаний розчин нагрівали приблизно сушили над сульфатом магнію, фільтрували й видо 40°С і додавали до нього розчин 1-аміно-3парювали в роторному випарнику, одержуючи метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону. сполуку, вказану в заголовку (477г, 81,9%). Продовжували нагрівання і додавали ще 6,13л Приклад 4 метанолу, після чого суміш нагрівали зі зворотним Синтез (S)-1-аміно-3-метил-2,3,4,5-тетрагідрохолодильником протягом приблизно 45хв, а потім 1Н-3-бензазепін-2-ону повільно охолоджували до температури навколи1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3шнього середовища, причому утворювався твербензазепін-2-он (1,544г, 8,12ммоль) обережно надий продукт. Після перемішування протягом прибгрівали в 15мл метанолу до розчинення. У другій лизно 18год цей продукт відділяли фільтруванням склянці розчиняли ди-n-толуїл-L-винну кислоту і промивали невеликою кількістю маточного роз(3,12г, 8,08ммоль) в 15мл метанолу й одержаний чину, сушили на повітрі і промивали приблизно 2л розчин додавали за допомогою піпетки до теплого етилацетату. Одержано 561,6г солі (S)-1-аміно-3розчину аміну. Після випадання твердого продукту метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону і в осад суміш підігрівали. Додавали ще 30мл метади-n-толуїл-L-винної кислоти. Змішували сіль (S)нолу для одержання розчину, який нагрівали зі 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3зворотним холодильником протягом 30-40хв, а бензазепін-2-ону і ди-n-толуїл-L-винної кислоти, потім повільно охолоджували до температури надихлорметан (6,57л) і 1н. водний розчин гідроксивколишнього середовища, при цьому утворювався ду натрію (6,57л) і перемішували. Розділяли шари і твердий продукт. Після перемішування протягом двічі екстрагували органічний шар 1н. водним розприблизно 18год цей продукт відділяли фільтручином гідроксиду натрію (3,28л), один раз розсованням і промивали невеликою кількістю охололом (2,46л), сушили над сульфатом магнію, фільтдженого метанолу. Одержано 2,24г солі (S)-1рували й випарювали в роторному випарнику. аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінОдержано сполуку, вказану в заголовку (250г, 39 77165 40 57,4%, ее 94,1%). газоподібного безводного НСI. Закривали колбу з Приклад 7 розчином, відстороняли охолоджувальну баню і Синтез гідрохлориду (S)-1-аміно-3-метилдавали розчину нагріватися до температури на2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону вколишнього середовища при перемішуванні про1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3тягом 2-8год, контролюючи витрачання вихідного бензазепін-2-он (31,9г, 168ммоль) суспендували матеріалу за допомогою ТШХ. Розчин концентруприблизно в 300мл ізопропілацетату і нагрівали до вали й одержували 1-(L-аланініл)-(S)-аміно-345°С. В окремій посудині нагрівали (R)-(-)-Dметил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он, мигдалеву кислоту (25,0г, 164ммоль) приблизно в який використовували без додаткового очищення. 130мл ізопропілового спирту до утворення розчину 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5і додавали цей розчин до вищезгаданої суспензії тетрагідро-1Н-3-бензазепін-2-он (1,0екв.), гідрат 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3гідроксибензотриазолу (1,1екв.) і (S)-2-гідрокси-3бензазепін-2-ону в ізопропілацетаті, одержуючи метилмасляну кислоту (1,0екв.) змішували в ТГФ в розчин, з якого швидко випадав осад. Суміш пеатмосфері азоту. Додавали-основу Хуніга (Ν,Νремішували при 45°С протягом приблизно 3год. До діізопропілетиламін, 1,1екв.), а потім EDC теплого розчину додавали 5-нітросаліциловий (1,1екв.). Після перемішування протягом 4-17год альдегід (2-гідрокси-5-нітробензальдегід) (1,40г, при температурі навколишнього середовища роз8,38ммоль, 5% (моль)) і перемішували суміш при чинник видаляли під зниженим тиском, залишок 45°С. Приблизно через 14год суспензію охолоджурозчиняли в етилацетаті (або аналогічному розвали до температури навколишнього середовища і чиннику) та воді, промивали насиченим водним перемішували протягом 2год, після чого відділяли розчином бікарбонату натрію, 1н. НСI, розсолом, твердий продукт фільтруванням, промивали 70мл сушили над безводним сульфатом натрію і видаохолодженого ізопропілацетату і сушили у вакуумляли розчинник під зниженим тиском, одержуючи ній шафі при 40°С. Одержано 46,62г солі (S)-1сполуку, вказану в заголовку. аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінПриклад 9 2-ону і (R)-мигдалевої кислоти (вихід 82,9%, ее Синтез (N)-((5)-2-гідрокси-3-метил-бутирил)-198,4%). (L-аланініл)-(S)-аміно-3-метил-2,3,4,5-тетрагідроСіль (S)-1-аміно-3-метил-2,3,4,5-тетрагідро1Н-3-бензазепін-2-ону 1Н-3-бензазепін-2-ону і (R)-мигдалевої кислоти У круглодонну колбу завантажували N-трет(2,42г, 7,06ммоль, ее 98,4%) суспендували в 25мл Boc-L-аланін (249,5г, 1,32моль), гідрат гідроксибеетилацетату при температурі навколишнього сензотриазолу (232,2г, 1,52моль) і (S)-1-аміно-3редовища. Додавали концентровану водну хлориметил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он стоводневу кислоту (1,1мл, приблизно 11,2ммоль) (250,8г, 1,32моль) в ТГФ (3,76л) в атмосфері азоі при інтенсивному перемішуванні нагрівали суміш ту. Суміш охолоджували до температури нижче при 50°С протягом 3,5год. Охолоджували суспенніж 5°С і додавали основу Хуніга (Ν,Νзію до температури навколишнього середовища, діізопропілетиламін, 188,4г, 1,45моль), а потім фільтрували й промивали осад метил-третEDC (283,7г, 1,45моль). Після перемішування пробутиловим простим ефіром (приблизно 10мл). тягом 6год реакційну суміш нагрівали до темпераОдержано 1,48г сполуки, вказаної в заголовку (витури навколишнього середовища і перемішували хід 92,5%, ее 97,9%). протягом приблизно 14год. Видаляли розчинник Приклад 8 під зниженим тиском, залишок розчиняли в етилаСинтез (N)-((S)-2-гідрокси-3-метил-бутирил)-1цетаті (3,76л) та воді (1,76л), розділяли шари, ор(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідроганічний шар екстрагували водою (1,76л), водні 1Н-3-бензазепін-2-ону шари об'єднували й екстрагували етилацетатом У круглодонну колбу завантажували N-трет(1,76л). Органічні шари об'єднували, екстрагували Вос-L-аланін (1,0екв.), гідрат гідроксибензотриазонасиченим водним розчином бікарбонату натрію лу (приблизно 1,1екв.) і (S)-1-аміно-3-метил(1,76л), сушили над безводним сульфатом натрію, 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он (1,0екв.) в фільтрували й випарювали в роторному випарниТГФ в атмосфері азоту. До цієї суміші при ефектику. Одержано 1-(N-трет-Вос-L-аланініл)аміно-3вному перемішуванні додавали основу Хуніга метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он (Hunig) (Ν,Ν-діізопропілетиламін, 1,1екв.), а потім (463г, 97,2%). EDC (1,1екв.). Після перемішування протягом 4Готували розчин НСI в етилацетаті шляхом 17год при температурі навколишнього середовипропускання газоподібного безводного НСI через ща розчинник видаляли під зниженим тиском, заетилацетат (1,76л), охолоджений приблизно до лишок розчиняли в етилацетаті та воді, промивали 0°С, із використанням диспергувальної трубки, насиченим водним розчином бікарбонату натрію, зануреної в рідину. Виготовлений таким чином 1н. водною НСI, розсолом, сушили над безводним розчин НСI в етилацетаті додавали до інтенсивно сульфатом натрію, фільтрували й видаляли розпереміщуваної суспензії 1-(N-тpет-Вос-Lчинник під зниженим тиском. Одержано 1-(N-треталанініл)аміно-3-метил-2,3,4,5-тетрагідро-1Н-3Boc-L-аланініл)аміно-3-метил-2,3,4,5-тетрагідробензазепін-2-ону (462г, 1,28моль) в етилацетаті 1Н-3-бензазепін-2-он: мас-спектр (М+Н)+ 362,3. (3,7л). Додавали ще 1л етилацетату і давали реаЧерез перемішуваний розчин 1-(N-трет-Вос-Lкційній суміші нагрітися до кімнатної температури і аланініл)аміно-3-метил-2,3,4,5-тетрагідро-1Н-3перемішували протягом 22год. Фільтрували реакбензазепін-2-ону в 1,4-діоксані (0,03-0,09М), охоційну суміш і одержували твердий продукт. Цей лоджений у бані з льодом приблизно до 10°С в продукт суспендували в ацетонітрилі (5л), нагріваатмосфері N2, пропускали протягом 10-15хв потік ли до кипіння зі зворотним холодильником, після 41 77165 42 чого охолоджували приблизно до 60°С, фільтрувводити в організм різноманітними шляхами. Сповали й сушили осад, одержуючи 1-(L-аланініл)-(S)луку згідно з цим винаходом можна вводити в ораміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінганізм у будь-яких формах або різновидах, які за2-он (389,8г, 94,7%). безпечують біодоступність сполуки в ефективній 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5кількості, в тому числі пероральними та парентететрагідро-1Н-3-бензазепін-2-он (369,5г, ральними шляхами. Наприклад, сполуку згідно з 1,18моль), гідрат гідроксибензотриазолу (207,6г, цим винаходом можна вводити в організм перора1,36моль), основу Хуніга (Ν,Ν-діізопропілетиламін, льним, інгаляційним, підшкірним, внутрішньом'язо352,2г, 2,71моль) і (S)-2-гідрокси-3-метилмасляну вим, внутрішньовенним, черезшкірним, назальним, кислоту (140,6г, 1,18моль) змішували в ТГФ (4,8л) ректальним, внутрішньоочним, місцевим шляхами, в атмосфері азоту і охолоджували до температури способом розсмоктування під язиком або за щонижче ніж 5°С. Додавали EDC (253,7г, 1,3моль) і кою тощо. давали реакційній суміші нагріватися до темпераПри виготовленні композицій згідно з цим витури навколишнього середовища при перемішунаходом активний інгредієнт звичайно змішують із ванні. Приблизно через 25год реакційну суміш наповнювачем, розбавляють наповнювачем або розбавляли дихлорметаном (5,54л) і екстрагували вміщують у носій, який може мати форму капсули, водою (2,22л). Органічний шар екстрагували вопакета-саше, паперового пакетика або іншого кондою (2,22л), водні шари об'єднували й екстрагуватейнера. Сполуку згідно з цим винаходом можна ли дихлорметаном (5,54л). Органічні шари об'єдвводити в організм окремо або у формі фармацевнували, екстрагували двічі водою (2,22л), тичної композиції, тобто в комбінації з фармацевнасиченим водним розчином бікарбонату натрію тично прийнятними розріджувачами, наприклад, із (2,22л), сушили над безводним сульфатом натрію, носіями або наповнювачами, частка та природа фільтрували й випарювали в роторному випарнияких визначаються розчинністю та хімічними власку. Одержано сполуку, вказану в заголовку (428г, тивостями згаданої сполуки, вибраного шляху 100%). введення та стандартною фармацевтичною пракПриклад 10 тикою [дивись "Фармацевтичні науки" Ремінгтона Синтез дигідрату (N)-((S)-2-гідрокси-3-метилRemington's Pharmaceutical Sciences, 18th Edition, бутирил)-1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5Mack Publ. Co., 1990]. тетрагідро-1Н-3-бензазепін-2-ону Фармацевтичні композиції згідно з цим винаТвердий (N)-((S)-2-гідрокси-3-метил-бутирил)ходом виготовляють способами, добре відомими у 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5-тетрагідрофармацевтичній практиці. Носієм або наповнюва1Н-3-бензазепін-2-он розчиняли в ацетоні (3,42л) і чем може бути твердий, напівтвердий або рідкий воді (0,856л) при слабкому нагріванні (40°С). Одематеріал, який може бути носієм або середовиржаний розчин ділили на порції об'ємом приблизщем для активного інгредієнта. Придатні для цього но по 2л і додавали до кожної воду (7,19л) при носії або наповнювачі добре відомі в практиці. нагріванні каламутного розчину до 50°С. Після Фармацевтична композиція може бути пристосододавання всієї води каламутному розчину давали вана для перорального, інгаляційного, парентераохолодитися до температури навколишнього сельного або місцевого застосування і може бути редовища й одержували твердий продукт, суспенвведена в організм пацієнта у формі таблеток, зію якого перемішували при температурі навколикапсул, аерозолів, інгаляційних препаратів, супошнього середовища протягом приблизно 14год, зиторіїв, розчинів, суспензій тощо. після чого фільтрували й сушили, одержуючи споДля цілей перорального терапевтичного залуку, вказану в заголовку (310,6г, 66,2%). стосування сполуки можуть бути поєднані з наповПри застосуванні сполуки згідно з цим винахонювачами і застосовуватися у формі таблеток, дом як лікарського засобу її звичайно вводять в пастилок, капсул, еліксирів, суспензій, сиропів, організм у формі фармацевтичної композиції. Тавафель, жувальних гумок тощо. Такі препарати ким чином, згідно з іншим варіантом здійснення, мають містити щонайменше 4% сполуки згідно з цей винахід пропонує фармацевтичні композиції, цим винаходом як активний інгредієнт, проте його які містять ефективну кількість кристалічного дигівміст може варіювати залежно від конкретної фодрату (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(Lрми і може складати від 2% до приблизно 90% аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідромаси дозованої одиниці. Кількість згаданої сполу1Н-3-бензазепін-2-ону та фармацевтично прийняки, присутня в композиції, є такою, що забезпечує тний розріджувач. Такі композиції застосовують відповідне дозування. Композиції та препарати згідно з цим винаходом, яким слід віддавати передля інгібування вивільнення -амілоїдного пептиду вагу, може визначити обізнаний фахівець. та/або його синтезу, в тому числі при лікуванні Згадані таблетки, пілюлі, капсули, пастилки хвороби Альцгеймера. Таким чином, цей винахід тощо можуть також містити одну або кілька переохоплює використання кристалічного дигідрату лічених нижче допоміжних речовин: в'яжучі агенти, (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)наприклад, мікрокристалічну целюлозу, камедь, (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3трагант або желатин; наповнювачі, наприклад, бензазепін-2-ону для виготовлення лікарського крохмаль або лактозу; дезінтегратори, наприклад, засобу для інгібування вивільнення -амілоїдного альгінову кислоту, препарат "Primogel", кукурудзяпептиду та/або його синтезу, зокрема, при лікуний крохмаль тощо; змащувальні агенти, наприванні хвороби Альцгеймера. клад, стеарат магнію, силіконове масло або преКристалічний дигідрат (N)-((S)-2-гідрокси-3парат "Sterotex"; ковзні агенти, наприклад, метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилколоїдний діоксид кремнію; та підсолоджувачі, 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону можна 43 77165 44 наприклад, сахарозу або сахарин, або ароматизачервня 1991p., включений до цього опису за поситори та смакові домішки, наприклад, м'яту, метилланням. Такі пластирі можуть мати будову, розрасаліцилат або апельсиновий ароматизатор. Якщо ховану на безперервне, імпульсне постачання формою дозованої одиниці є капсула, то вона мофармацевтичних агентів або на їх уведення за же містити, окрім матеріалів вищезгаданих типів, потребою. рідкий носій, наприклад, поліетиленгліколь або З метою більш повної ілюстрації здійснення нелетку олію. Інші форми дозованих одиниць моцього винаходу нижче подано опис типових фаржуть містити різноманітні інші матеріали, які момацевтичних композицій. Ці приклади є лише ілюдифікують фізичну форму дозованої одиниці, настративними і не призначені для будь-якого обмеприклад, у вигляді оболонок. Так, таблетки або ження обсягу винаходу. пілюлі можуть мати оболонки з цукру, шелаку або Приклад композиції 1 інших покривних матеріалів. Сироп, окрім сполук Виготовляють тверді желатинові капсули, які згідно з винаходом, може містити сахарозу як підвміщують такі інгредієнти: солоджувач та деякі консерванти, фарбники та Інгредієнт Кількість, мг/капсулу смакові домішки. Матеріали, використовувані при Активний інгредієнт 30,0 виготовленні згаданих різноманітних композицій, Крохмаль 305,0 мають бути фармацевтично чистими й нетоксичСтеарат магнію 5,0 ними у застосовуваних кількостях. Вищезгадані інгредієнти змішують і заповнюДля цілей парентерального застосування споють сумішшю тверді желатинові капсули (по лука згідно з винаходом може бути введена в роз340мг). чин або суспензію. Такі препарати, як правило, Приклад композиції 2 містять щонайменше 0,1% сполуки згідно з винаКомпозицію для таблеток виготовляють, заходом, проте її вміст може варіювати й складати стосовуючи такі інгредієнти: від 0,1% до приблизно 90% маси композиції. КільКількість, Інгредієнт кість згаданої сполуки, присутня в композиції, є мг/таблетку такою, що забезпечує відповідне дозування. ЗгаАктивний інгредієнт 25,0 дані розчини або суспензії можуть також містити Целюлоза мікрокристалічна 200,0 одну або кілька перелічених нижче допоміжних Колоїдний діоксид кремнію 10,0 речовин: стерильні розріджувачі, наприклад, воду Стеаринова кислота 5,0 для ін'єкцій, сольовий розчин, нелеткі олії, поліеВищезгадані компоненти змішують і пресують тиленгліколі, гліцерин, пропіленгліколь або інші у таблетки масою по 240мг кожна. синтетичні розчинники; протимікробні агенти, наПриклад композиції 3 приклад, бензиловий спирт або метилпарабен; Композицію для інгаляції сухого порошку вигоантиоксиданти, наприклад, аскорбінову кислоту товляють, застосовуючи такі інгредієнти: або бісульфіт натрію; хелатоутворювальні агенти, Інгредієнт Маса, % наприклад, етилендіамінтетраоцтову кислоту; буАктивний інгредієнт 5 ферні сполуки, наприклад, ацетати, цитрати або Лактоза 95 фосфати; та агенти для забезпечення ізотонічносАктивний інгредієнт змішують із лактозою, й ті, наприклад, хлорид натрію або декстрозу. Пареодержану суміш уміщують у пристрій для інгаляції нтеральні композиції можуть бути вміщені в ампусухого порошку. ли, одноразові шприци або багатодозові Приклад композиції 4 пляшечки, виготовлені зі скла або пластмаси. Таблетки з умістом у кожній 30мг активного інКомпозиції та препарати, яким слід віддавати пегредієнта виготовляють, як описано нижче: ревагу, може визначити обізнаний фахівець. Кількість, Інгредієнт Сполуку згідно з цим винаходом можна вводимг/таблетку ти в організм також місцевим способом; в такому Активний інгредієнт 30,0 разі носій може містити розчин, основу мазі або Крохмаль 45,0 гелю. Згадана основа може містити, наприклад, Целюлоза мікрокристалічна 35,0 одну або кілька таких речовин: вазелін, ланолін, Полівінілпіролідон (у формі 10%поліетиленгліколі, бджолиний віск, мінеральне ного розчину в 4,0 масло, розріджувачі, наприклад, воду або спирт, а стерильній воді) також емульгатори та стабілізатори. Композиції Натрієва сіль карбоксиметильодля місцевого застосування можуть містити сполуваного крохмалю 4,5 ку формули І або її фармацевтичну сіль у конценСтеарат магнію 0,5 трації від приблизно 0,1% до приблизно 10% (маси Тальк 1,0 на одиницю об'єму). РАЗОМ 120 Іншою композицією згідно з цим винаходом, Активний інгредієнт, крохмаль та целюлозу якій віддається перевага, є засоби для черезшкірпропускають через сито 20меш за стандартом ного постачання ("пластирі"). Такі пластирі для США (розмір отворів 0,84мм) і ретельно перемічерезшкірного постачання можна застосовувати шують. З одержаним порошком змішують розчин для забезпечення безперервної або періодичної полівінілпіролідону і пропускають суміш через сито інфузії сполуки згідно з цим винаходом у контро16меш за стандартом США (розмір отворів 1,2мм). льованих кількостях. Будова та застосування плаОдержані таким чином гранули сушать при 50стирів для черезшкірного постачання фармацев60°С і пропускають через сито 16меш за стандартичних агентів добре відомі в практиці. Дивись, том США. Натрієву сіль карбоксиметильованого наприклад, патент США №5,023,252, виданий 11 крохмалю, стеарат магнію й тальк, попередньо 45 77165 46 пропущені через сито 30меш за стандартом США нюють сумішшю тверді желатинові капсули (по (розмір отворів 0,6мм), додають до гранул і після 560мг). перемішування пресують на таблетувальній маПриклад композиції 9 шині в таблетки масою по 150мг кожна. Композицію для підшкірного введення можна Приклад композиції 5 виготовити, як описано нижче: Капсули з умістом у кожній 40мг лікарської реІнгредієнт Кількість човини виготовляють, як описано нижче: Активний інгредієнт 1,0мг Інгредієнт Кількість, мг/капсулу Кукурудзяна олія 1мл Активний інгредієнт 40,0 Залежно від розчинності активного інгредієнта Крохмаль 109,0 в кукурудзяній олії, в цю композицію в разі потреби Стеарат магнію 1,0 можна вводити до приблизно 5,0мг або більше активного інгредієнта. РАЗОМ 150,0 Приклад композиції 10 Активний інгредієнт, крохмаль та стеарат магКомпозицію для місцевого застосування можнію змішують, пропускають через сито 20меш за на виготовити, як описано нижче: стандартом США (розмір отворів 0,84мм) і заповІнгредієнт Кількість нюють сумішшю тверді желатинові капсули (по Активний інгредієнт 1-10г 150мг). Емульгувальний віск 30г Приклад композиції 6 Вазелінове масло 20г Супозиторії з умістом у кожному 25мг активноМ'який безбарвний парафін до100г го інгредієнта виготовляють, як описано нижче: М'який безбарвний парафін нагрівають до роІнгредієнт Кількість зплавлення. Додають вазелінове масло та емульАктивний інгредієнт 25 гувальний віск і перемішують до розчинення. ДоГліцериди насичених жирних кислот дають активний інгредієнт і продовжують до 2000 перемішування до утворення дисперсії. Потім охоАктивний інгредієнт пропускають через сито лоджують суміш до затвердіння. 60меш за стандартом США (розмір отворів Згідно з одним із методичних аспектів, цей ви0,25мм) і суспендують у гліцеридах насичених жинахід стосується способу інгібування вивільнення рних кислот, попередньо розплавлених із застосуванням мінімальної необхідної кількості тепла. -амілоїдного пептиду та/або його синтезу, який Потім суміш розливають у форму для супозиторіїв включає введення в організм пацієнта, що потреномінальною місткістю 2г і дають захолонути. бує такого інгібування, ефективної кількості крисПриклад композиції 7 талічного дигідрату (N)-((S)-2-гідрокси-3-метилСуспензію з умістом лікарської речовини 50мг бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилу дозі 5мл виготовляють, як описано нижче: 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону. Згідно з Інгредієнт Кількість конкретним варіантом здійснення цього способу, Активний інгредієнт 50,0мг цей винахід пропонує спосіб лікування хвороби Ксантанова камедь 4,0мг Альцгеймера, який включає введення в організм Натрієва сіль карбоксиметилцепацієнта, що потребує такого лікування, ефективлюлози (11%) 50,0мг ної кількості кристалічного дигідрату (N)-((S)-2Целюлоза мікрокристалічна гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1(89%) аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінСахароза 1,75мг 2-ону. Бензоат натрію 10,0мг Мається також на увазі, що обізнаний фахіАроматизатор та барвник За потребою вець може вплинути на хворобу Альцгеймера Вода очищена до 5,0мл шляхом лікування пацієнта, який на даний час Активний інгредієнт, сахарозу та ксантанову уражений цим захворюванням, або ж шляхом камедь змішують, пропускають через сито 10меш профілактичного лікування пацієнта, у якого має за стандартом США (розмір отворів 2,0мм), після місце ризик розвитку цього захворювання. Таким чого змішують із попередньо приготованим розчичином, терміни "лікування", "лікувати" стосуються ном мікрокристалічної целюлози та натрієвої солі усіх процесів, де може мати місце уповільнення, карбоксиметилцелюлози у воді. Бензоат натрію, переривання, припинення, регулювання або заароматизатор і барвник розбавляють частиною тримання розвитку хвороби Альцгеймера, але не води і додають при перемішуванні. Потім додають обов'язково вказують на повне усунення всіх симводу в кількості, необхідній для забезпечення баптомів. Таким чином, пропоновані способи охопжаного об'єму. люють запобігання початку хвороби Альцгеймера Приклад композиції 8 у пацієнта, в якого має місце ризик розвитку хвоКапсули з умістом у кожній 15мг лікарської рероби Альцгеймера, інгібування розвитку хвороби човини виготовляють, як описано нижче: Альцгеймера та лікування прогресуючої хвороби Інгредієнт Кількість, мг/капсулу Альцгеймера. Активний інгредієнт 15,0 Термін "пацієнт" у значенні, вживаному в цьоКрохмаль 407,0 му описі, стосується теплокровної тварини, наприСтеарат магнію 3,0 клад, ссавця, яка уражена розладом, пов'язаним із РАЗОМ 425,0 підвищеним вивільненням -амілоїдного пептиду Активний інгредієнт, крохмаль та стеарат магта/або його синтезом, в тому числі хворобою Альнію змішують, пропускають через сито 20меш за цгеймера. Мається на увазі, що прикладами твастандартом США (розмір отворів 0,84мм) і заповрин, які охоплюються цим терміном, є морські сви 47 77165 48 нки, собаки, коти, пацюки, миші, коні, велика рога(імуноферментного твердофазного аналізу), які та худоба, вівці та люди. Пацієнтів, які потребують лежать у лінійному діапазоні (від приблизно згаданого лікування, легко діагностувати. 0,2нг/мл до 2,5нг/мл). Термін "ефективна кількість" сполуки формули Після інкубування протягом ночі при 37°С в інІ у значенні, вживаному в цьому описі, стосується кубаторі з рівноважною атмосферою з умістом кількості, яка забезпечує ефективне інгібування СО2 10% живильне середовище видаляли, замінювали на 200мкл на лунку середовища, яке місвивільнення -амілоїдного пептиду та/або його тило сполуку формули І (лікарську речовину), для синтезу і, особливо, лікування хвороби Альцгей2-годинного попереднього оброблення, і інкубувамера. ли клітини, як описано вище. Вихідні розчини ліЕфективну кількість легко визначити діагностукарських речовин були виготовлені в 100%-ному куратору як обізнаному фахівцеві, шляхом застодиметилсульфоксиді з таким розрахунком, щоб сування звичайних способів та спостереження при кінцевій концентрації лікарської речовини, зарезультатів, одержаних в аналогічних випадках. стосованій при випробуванні, концентрація димеПри визначенні ефективної кількості - дози кристил сульфоксиду не перевищувала 0,5%, а реальталічного дигідрату (N)-((S)-2-гідрокси-3-метилно дорівнювала, як правило, 0,1%. бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилПісля закінчення попереднього оброблення 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону - діагживильні середовища знов видаляли й замінюваност-куратор має брати до уваги численні фактоли на свіжі вищевказані середовища, що містили ри, в тому числі (але не тільки) ефективність та лікарські речовини, і інкубували клітини додатково характеристики (N)-((S)-2-гідрокси-3-метилпротягом 2год. Після оброблення планшети бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилцентрифугували в центрифузі "Beckman GPR" при 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону, вид паці1200об/хв протягом 5хв при кімнатній температурі єнта, його масу тіла, вік та загальний стан здородля відділення залишків клітин від кондиціоновав'я; ступінь розвитку або тяжкість захворювання; ного середовища. По 100мкл кондиціонованого індивідуальну реакцію пацієнта; шлях введення середовища з кожної лунки або відповідного розлікарського засобу; характеристики біодоступності ведення такого середовища переносили на планзастосовуваного препарату; обраний режим дозушет для ELISA, попередньо покритий антитілом вання; застосування інших способів лікування при 266 [див. С'юберт - P. Seubert, Nature (1992) комплексній терапії; та інші обставини. Очікується, що ефективна кількість кристаліч359:325-327] до амінокислот 13-28 -амілоїдного ного дигідрату (N)-((S)-2-гідрокси-3-метилпептиду, як описано в публікації міжнародної заявбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилки №94/105698, і зберігали при 4°С протягом ночі. 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону варіює Наступного дня виконували аналіз методом ELISA від приблизно 0,1мг на кілограм маси тіла на день з застосуванням міченого антитіла 3D6 [P. Seubert, (мг/(кг-день)) до приблизно 100мг/(кг-день). КількоNature (1992) 359:325-327] до амінокислот 1-5 сті, яким слід віддавати перевагу, має визначати амілоїдного пептиду для вимірювання кількості обізнаний фахівець. продукованого -амілоїдного пептиду. Дигідрат (N)-((S)-2-гідрокси-3-метил-бутирил)Цитотоксичний ефект згаданих сполук вимірю1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5вали модифікованим методом Гансена та інших тетрагідро-1Н-3-бензазепін-2-ону згідно з цим ви(Hansen et al.) До клітин, які залишалися на планнаходом можна випробовувати в різноманітних шеті з культурою тканини, додавали 25мкл вихідбіологічних системах, в тому числі в описаних ниного розчину (5мг/мл) 3-(4,5-диметилтіазол-2-іл)жче. 2,5-дифенілтетразолійброміду (МТТ) (фірма Приклад А Sigma, St. Louis, МО) до кінцевої концентрації Скринінг на культурах клітин для виявлення ін1мг/мл. Інкубували клітини при 37°С протягом 1год гібіторів продукування -амілоїду і припиняли активність клітин додаванням рівного Численні сполуки вищезазначеної формули І об'єму буфера лізису МТТ (20% (мас.) додецилсувипробовували для з'ясування їх здатності інгібульфату натрію на об'єм 50%-ного диметилформавати продукування -амілоїду в лінії клітин, що міду, рН 4,7). Повну екстракцію забезпечували зазнали шведської мутації. При цьому скринінгострушуванням протягом ночі при кімнатній темпевому випробуванні застосовували клітини (К293, ратурі. Різницю між значеннями оптичної густини лінія клітин нирок людини), які були стабільно трана довжинах хвиль 562нм і 650нм (OD562 нм і OD650 нсфіковані геном попередника амілоїду - протеїнм) як індикатор життєздатності клітин вимірювали ном 751 (АРР751), що містив подвійну мутацію із із застосуванням пристрою для зчитування мікрозаміною Lys651Met652 на Asn651Leu652 (нумерація планшетів UVmax фірми "Molecular Device". АРР751), способом, описаним у заявці на міжнаРезультати визначення -амілоїдного пептиду родний патент №94/105698 та в роботі Цитрона та методом ELISA зіставляли зі стандартною кривою ін.12 (Citron et al.). Цю мутацію звичайно називають і виражали як концентрацію -амілоїдного пептиду "шведською мутацією". Згадані клітини, позначені в нг/мл. З метою нормалізації на цитотоксичність "293 751 SWE", висівали на 96-лункових планшеці результати ділили на результати проби з МТТ і тах "Corning" по 2-4 104 клітин на лунку в мінімавиражали в процентах від результатів для контрольному необхідному середовищі за Дюльбекко льних проб, які не містили лікарських речовин. Усі (DMEM) (фірма Sigma, St. Louis, МО) із додаванрезультати є середніми значеннями для щонайням 10% сироватки плоду корови. Кількість клітин менше шести паралельних проб із визначенням має важливе значення з точки зору досягнення стандартного відхилення. результатів визначення -амілоїду методом ELISA Приклад В 49 77165 50 Вуд та інші - Johnson-Wood et al., Proc. Nat. Acad. Пригнічення вивільнення та/або синтезу Sci. USA, 94:1550-1555, 1997], специфічне до аміамілоїдного пептиду in vivo нокислот 1-5 -амілоїду, біотинілували і викорисЦей приклад ілюструє можливий спосіб випробування сполук згідно з цим винаходом на притовували в аналізі як репортер-антитіло. При біотинілуванні 3D6 застосовували методику гнічення вивільнення та/або синтезу -амілоїдного виробника (фірми Pierce, Rockford, IL) для мічення пептиду in vivo. Для цих дослідів використовували імуноглобуліну NHS-біотином за тим винятком, що мишей лінії PDAPP [Гейме та інші - Games et al., як буфер використовували 100мМ розчин бікарбоNature 373:523-527, 1995] у віці 3-4 місяців. Залежнату натрію, рН 8,5. Антитіло 3D6 не розпізнає ні но від конкретної випробовуваної сполуки, її розпродукований протеїн-попередник амілоїду (АРР), чин звичайно готували в концентрації від 1мг/мл ні повну послідовність АРР, а детектує лише різдо 10мг/мл. У зв'язку з низькою розчинністю згаданих сполук, їх розчини можна готувати із застосуновид -амілоїду з амінотермінальною аспарагінованням різних носіїв, наприклад, кукурудзяної олії вою кислотою. Аналіз має нижню границю чутли(фірма Safeway, South San Francisco, CA); 10% вості приблизно 50пг/мл (11пМ) і не виявляє перехресної реакційної здатності відносно ендоетанолу в кукурудзяній олії; 2-гідроксипропіл- генного муринового -амілоїдного пептиду в конциклодекстрині (фірма Research Biochemicals International, Natick, MA) та карбоксиметилцелюлоцентраціях до 1нг/мл. зі (фірма Sigma Chem. Co., St. Louis, MO). В конфігурації сендвічевого кількісного визнаМишам уводили випробовувані речовини підчення -амілоїду (амінокислоти 1-42) методом шкірно із застосуванням голки 26 калібру. Через ELISA як антитіло захоплення використовували 3год тварин умертвляли за допомогою СО2 і відmAb 21F12 [Johnson-Wood et al., Proc. Nat. Acad. бирали проби крові шляхом серцевої пункції із Sci. USA, 94:1550-1555, 1997], яке розпізнає амінозастосуванням туберкулінового шприца місткістю кислоти 33-42 -амілоїду. Біотильоване антитіло 3 1см і голки 25 калібру довжиною 5/8 дюйма 3D6 використовували як репортер-антитіло також і (16мм), попередньо промитих розчином ЕДТА (0,5 в цьому аналізі, який має нижню границю чутливоМ, рН 8,0). Кров переносили у вакутейнер Бектості приблизно 125пг/мл (28пМ). на-Дікінсона, який містив ЕДТА, і центрифугували Антитіла захоплення 266 та 21F12 наносили в при 1500 g протягом 15хв при 5°С. Потім видаляконцентрації 10мкг/мл на 96-лункові планшети для ли мозки мишей, відділяли кору та гіпокамп і зберіімунного аналізу (фірми Costar, Cambridge, MA) і гали на льоду. інкубували протягом ночі при кімнатній температу1. Дослідження мозку рі. Потім планшети піддавали аспірації і блокували Для підготовки тканин гіпокампу та кори до 0,25%-ним розчином сироваткового альбуміну імуноферментного твердофазного аналізу (ELISA) людини в PBS-буфері протягом щонайменше 1год кожну згадану частину мозку гомогенізували в 10 при кімнатній температурі, після чого зберігали у об'ємах охолодженого льодом гуанідинового бувисушеному вигляді при 4°С до використання. Пеферу (5,0Μ гуанідин-НСІ, 50мМ Трис-НСІ, рН 8,0), ред використанням планшети знову зволожували застосовуючи механічну ступку "Kontes" (фірма промивальним буфером (сольовим розчином із Fisher, Pittsburgh, PA). Гомогенати злегка струшуТрис-буфером, 0,05% Tween-20). На планшети вали на обертовій платформі протягом 3-4год при наносили проби та стандартні зразки й інкубували кімнатній температурі і зберігали при -20°С до випротягом ночі при 4°С. Після кожної стадії аналізу конання кількісного аналізу на -амілоїд. планшети тричі промивали промивальним буфеГомогенати мозку розводили (1:10) охолоджером. Біотинільоване антитіло 3D6, розведене до ним льодом казеїновим буфером (0,25% казеїну, концентрації 0,5мкг/мл інкубаційним казеїновим сольовий розчин із фосфатним буфером (PBS), буфером (0,25% казеїну, PBS, 0,05% Tween-20, рН 0,05% азиду натрію, 20мкг/мл апротиніну, 5мМ 7,4), інкубували в лунках протягом 1год при кімнаЕДТА, рН 8,0, 10мкг/мл лейпептину), знижуючи тній температурі. Додавали в лунки авідин-HRP тим самим кінцеву концентрацію гуанідину до (фірма Vector, Burlinggame, CA), розведений 0,5М, після чого центрифугували при 4°С протягом 1:4000 інкубаційним казеїновим буфером, і інкубували протягом 1год при кімнатній температурі. 20хв при 16000 g. В разі потреби проби додатково Додавали колориметричний субстрат Slow TMBрозводили казеїновим буфером із доданням 0,5Μ ELISA (фірма Pierce, Cambridge, MA) і витримувагуанідин-гідрохлориду з метою досягнення оптили 15хв для проходження реакції, після чого примального діапазону концентрацій для визначень пиняли ензиматичну реакцію додаванням 2н. методом ELISA. Готували стандартні проби H2SO4. Продукт реакції кількісно визначали, застоамілоїду (амінокислоти 1-40 або 1-42) таким чисовуючи пристрій UVmax (фірми Molecular Devices, ном, щоб кінцевий склад був еквівалентний 0,5Μ Menlo Park, CA) для вимірювання різниці поглигуанідину в присутності 0,1% бичачого сироватконання на довжинах хвиль 450нм і 650нм. вого альбуміну (BSA). 2. Дослідження крові Реагент для визначення загального -амілоїду Оброблену ЕДТА плазму розводили 1:1 розріметодом сендвічевого ELISA, який забезпечує джувачем для проб (0,2г/л фосфату натрію·Н2О кількісний аналіз як -амілоїдну (амінокислоти 1(одноосновного), 2,16г/л фосфату натрію·7Н2О 40), так і -амілоїду (амінокислоти 1-42), склада(двоосновного), 0,5г/л тимеросалу, 8,5г/л хлориду ється із двох моноклональних антитіл (mAb) до натрію, 0,5мл Тритон Х-405, 6,0г/л бичачого сироамілоїду. Антитіло захоплення, 266 [P. Seubert, ваткового альбуміну, вільного від глобуліну; і воNature (1992) 359:325-327] є специфічним до аміда). Проби та стандартні зразки в розріджувачі для нокислот 13-28 -амілоїду. Антитіло 3D6 [Джонсонпроб аналізували на загальний уміст -амілоїду 51 77165 52 (266 як антитіло захоплення/3D6 як репортер) за вці можуть вносити у згадані композиції та способи методикою, описаною вище, за тим винятком, що різноманітні модифікації та зміни. Мається на увазамість казеїнових буферів застосовували розрізі, що винахід охоплює всі такі модифікації, які не джувач для проб. виходять за межі обсягу пунктів формули винаНа основі поданого вище опису обізнані фахіходу. Комп’ютерна верстка О. Гапоненко Підписне Тираж26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською(n)-((s)-2-hydroxy-3-methyl-butyryl)-1-(l-alaninyl)-(s)-1-amino-3-methyl-4,5,6,7-tetrahydro-2h-3-benzazepin-2-one dihydrate, processes for manufacturing and pharmaceutical composition
Назва патенту російськоюДигидрат (n) -((s)-2-гидрокси-3-метилбутирил) -1-(l-аланинил) -(s) -1-амино-3-метил-4,5,6,7-тетрагидро-2н-3-бензазепин-2-она, способ его получения и фармацевтическая композиция на его основе
Автори російськоюAudia, James, Edmund
МПК / Мітки
МПК: C07D 223/00, A61P 43/00, A61P 25/28, A61K 31/55
Мітки: основі, фармацевтична, дигідрат, n)-((s)-2-гідрокси-3-метилбутирил)-1-(l-аланініл)-(s)-1-аміно-3-метил-2,3,4,5-тетрагідро-1н-3-бензазепін-2-ону, композиція, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/26-77165-digidrat-n-s-2-gidroksi-3-metilbutiril-1-l-alaninil-s-1-amino-3-metil-2345-tetragidro-1n-3-benzazepin-2-onu-sposib-jjogo-oderzhannya-ta-farmacevtichna-kompoziciya-na-jjogo-osnovi.html" target="_blank" rel="follow" title="База патентів України">Дигідрат (n)-((s)-2-гідрокси-3-метилбутирил)-1-(l-аланініл)-(s)-1-аміно-3-метил-2,3,4,5-тетрагідро-1н-3-бензазепін-2-ону, спосіб його одержання та фармацевтична композиція на його основі</a>
Попередній патент: Полімерний сплав та його застосування як допоміжного фільтрувального і/або стабілізуючого матеріалу
Наступний патент: Спосіб полімеризації суміші, яка містить вінілхлоридний мономер
Випадковий патент: Молотильно-сепаруючий пристрій з швидкісною сепарацією












