Поперечнозв’язані глікопептидцефалоспоринові антибіотики
Номер патенту: 80098
Опубліковано: 27.08.2007
Автори: Моран Едмунд Дж., Егген Джеймс, Лонг Даніель Д., Лінселл Мартін С., Нодвелл Меттью Б., Фазері Пол, Тьорнер С. Дерек, Маркусс Даніель
Формула / Реферат
(21) 20040503518
(57)
1. Сполука формули І
 (I)
(I)
або її фармацевтично прийнятна сіль, де
X1 та X2 незалежно вибрані з групи, що складається з водню та хлору;
R1 являє собою -Yа-(W)n-Yb-;
W вибраний з групи, яка складається з -О-, -N(Rd)-, -S-, -S(O) -, - S(O)2-, C3-6циклоалкілену, C6-10арилену та C2-9гетероарилену, при цьому кожна ариленова, циклоалкіленова та гетероариленова група є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з Rb;
Ya та Yb незалежно являють собою С1-5алкілен або, коли W є циклоалкіленом, ариленом або гетероариленом, Ya та Yb є незалежно вибраними з групи, яка складається з ковалентного зв'язку та C1-5алкілену, при цьому кожна алкіленова група є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з -ORd, -NRdRe, -CO2Rd, -C(O)NRdRe та -S(O)2NRdRe;
R2 являє собою водень або С1-6алкіл;
кожний R3 є незалежно вибраним з групи, яка складається з С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу, С6-10арилу, C2-9гетероарилу, С3-6гетероциклілу та Ra; або дві суміжні групи R3 поєднані разом з утворенням С3-6алкілену або -O-(С1-6алкілен)-O-, де кожна група алкілу, алкілену, алкенілу та алкінілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Ra та Rc; а кожна група арилу, циклоалкілу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Rb;
один з R4 та R5 являє собою гідрокси, а інший являє собою водень;
R6 та R7 незалежно являють собою водень або метил;
R8 являє собою водень або групу формули (і):
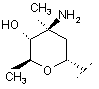 ,(i)
,(i)
кожний Ra є незалежно вибраним з групи, яка складається з -ORd, гало, -SRd, -S(O)Rd, -S(O)2Rd, -S(O)2ORd, -S(O)2NRdRe, -NRdRe, -CO2Rd, -OC(O)Rd, -C(O)NRdRe, -NRdC(O)Re, -OC(O)NRdRe, -NRdC(O)ORe, -NRdC(O)NRdRe, -СF3 та -OCF3;
кожний Rb є незалежно вибраним з групи, яка складається з С1-6алкілу, С2-4алкенілу, С2-6алкінілу та Ra;
кожний Rc є незалежно вибраним з групи, яка складається з С3-6циклоалкілу, С6-10арилу, С2-9гетероарилу та С3-6гетероциклілу, де кожна група циклоалкілу, арилу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з С1-6алкілу та Rf;
кожний Rd та Re є незалежно вибраним з групи, яка складається з водню, С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу, С6-10арилу, С2-9гетероарилу та С3-6гетероциклілу; або Rd та Re поєднані разом з атомами, до яких вони приєднані, з утворенням С3-6гетероциклічного кільця, що має від одного до трьох гетероатомів, незалежно вибраних з кисню, азоту або сірки; при цьому кожна група алкілу, алкенілу та алкінілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Rc та Rf та кожна група арилу, циклоалкілу, гетероарилу та гетероциклілу є необов'язково заміщеною 1-3 замісниками, незалежно вибраними з групи, яка складається з С1-6алкілу та Rf;
кожний Rf є незалежно вибраним з групи, яка складається з -ОН, -ОС1-6алкілу, -SC1-6алкілу, -F, -Сl, -NH2, -NН(С1-6алкіл), -N(C1-6алкіл)2, -ОС(O)С1-6алкілу, -С(O)ОС1-6алкілу, -NНС(O)С1-6алкілу, -С(O)ОН, -C(O)NH2, - C(O)NHC1-6алкілу, -С(O)N(С1-6алкіл)2, -СF3 та -OCF3;
m дорівнює 0, 1, 2 або 3; та n дорівнює 0 або 1.
2. Сполука згідно з пунктом 1, в якій n дорівнює 0, а Ya та Yb незалежно являють собою групу С1-5алкілену, де кожна алкіленова група є необов'язково заміщеною від 1 до 3 разів замісниками, незалежно вибраними з -ORd, -NRdRe, -CO2Rd, -C(O)NRdRe та - S(O)2NRdRe.
3. Сполука згідно з пунктом 1, в якій n дорівнює 0, a Ya та Yb поєднані разом з утворенням групи -(СН2)2-8-.
4. Сполука згідно з пунктом 3, в якій n дорівнює 0, a Ya та Yb поєднані разом з утворенням групи -(СН2)2-, -(СН2)3-, -(СН2)4-, -(CH2)5- або -(СН2)6-.
5. Сполука згідно з пунктом 4, в якій n дорівнює 0, а Ya та Yb поєднані разом з утворенням групи -(СH2)3-.
6. Сполука згідно з пунктом 1, в якій n дорівнює 1, а Ya та Yb є однаковими або різними і кожний з них вибраний з групи, яка складається з ковалентного зв'язку та С1-5алкілену, необов'язково заміщеного від одного до трьох разів замісниками, вибраними з -ORd, -NRdRe, -CO2Rd, -C(O)NRdRe та - S(O)2NRdRe.
7. Сполука згідно з пунктом 6, в якій W являє собою С6-10арилен або -O-.
8. Сполука згідно з пунктом 1, в якій n дорівнює 1, Ya та Yb обидва являють собою -CH2-, a W являє собою C6-10арилен, необов'язково заміщений від 1 до 3 разів замісниками, незалежно вибраними з Rb.
9. Сполука згідно з пунктом 8, в якій W являє собою фенілен.
10. Сполука згідно з пунктом 1, в якій n дорівнює 1, Ya та Yb обидва являють собою -СН2СН2-, a W являє собою -O-.
11. Сполука за будь-яким з пунктів 1-10, в якій R2 являє собою водень.
12. Сполука за будь-яким з пунктів 1-11, в якій m дорівнює 0.
13. Сполука за будь-яким з пунктів 1-11, в якій m дорівнює 1 або 2, а кожний з R3 є незалежно вибраним з групи, яка складається з С1-6алкілу, С3-6циклоалкілу, -ORd, -SRd, -F або -Сl; або дві сусідні групи R3 поєднані з утворенням С3-6алкілену.
14. Сполука за будь-яким з пунктів 1-13, в якій R4 являє собою гідрокси; R5 являє собою водень; R6 є воднем; R7 є метилом; R8 являє собою водень; а X1 та X2 обидва є хлором.
15. Сполука згідно з пунктом 1, в якій R1 являє собою -Ya-(W)n-Yb-, де n дорівнює 0, Ya та Yb поєднані разом з утворенням групи -(СН2)3-; R2 являє собою водень; R4 є гідрокси; R5 являє собою водень; R6 є воднем; R7 являє собою метил; R8 являє собою водень; X1 та X2 обидва є хлором; a m дорівнює 0.
16. Сполука згідно з пунктом 1, в якій R4 є гідрокси; R5 являє собою водень; R6 є воднем; R7 являє собою метил; R8 являє собою водень; X1 та X2 обидва є хлором; а R1, R2, R3 та m є такими, як вказано нижче:
№
R1
R2
R3
m
Ya
W
Yb
n
1
-CН2СН2-
—
-СН2-
0
-н
—
1
2
-CН2СН2-
—
-СН2-
0
-н
2-СН3-
1
3
-СН2СН2-
—
-СН2-
0
-н
3-СН3-
1
4
-СН2СН2-
—
-СН2-
0
-н
4-СН3-
1
5
-СН2СН2-
—
-СН2-
0
-н
2-СН3О-
1
6
-СН2СН2-
—
-СН2-
0
-н
3-СН3О-
1
7
-СН2СН2-
—
-СН2-
0
-н
4-СН3О-
1
8
-СН2СН2-
—
-СН2-
0
-н
2-CH3S-
1
9
-СН2СН2-
—
-СН2-
0
-н
3-CH3S-
1
10
-СН2СН2-
—
-СН2-
0
-н
4-CH3S-
1
11
-СН2СН2-
—
-СН2-
0
-н
2-F-
1
12
-СН2СН2-
—
-СН2-
0
-н
3-F-
1
13
-СН2СН2-
—
-СН2-
0
-н
4-F-
1
14
-СН2СН2-
—
-СН2-
0
-н
2-CI-
1
15
-СН2СН2-
—
-СН2-
0
-н
3-CI-
1
16
-СН2СН2-
—
-СН2-
0
-н
4-CI-
1
17
-СН2СН2-
—
-СН2-
0
-н
2-Ph-
1
18
-СН2СН2-
—
-СН2-
0
-н
3-Ph-
1
19
-СН2СН2-
—
-СН2-
0
-н
4-Ph-
1
20
-СН2СН2-
—
-СН2-
0
-н
4-циклопропiл-
1
21
-СН2СН2-
—
-СН2-
0
-н
4-[HOOCCH2S-]
1
22
-СН2СН2-
—
-СН2-
0
-н
4-NH2C(O)-
1
23
-СН2СН2-
—
-СН2-
0
-н
2,3-ди-СН3-
2
24
-СН2СН2-
—
-СН2-
0
-н
3,4-ди-СН3-
2
25
-СН2СН2-
—
-СН2-
0
-н
3,5-ди-СН3-
2
26
-СН2СН2-
—
-СН2-
0
-н
3,4-ди-СН3О-
2
27
-СН2СН2-
—
-СН2-
0
-н
3-СН3-4-СН3О-
2
28
-СН2СН2-
—
-СН2-
0
-н
3-СН3О-4-F-
2
29
- СН2СН2 -
—
-СН2-
0
-н
2,3-[-(СН2)4-]
2
30
- СН2СН2-
—
-СН2-
0
-н
2,3-(-СН2СН2СН2-)
2
31
-(СН2)з-
—
-(СН2)3-
0
-н
—
0
32
-СН2СН2-
-О-
-СН2СН2-
1
-н
—
0
33
-СН2-
1,4 -(-Ph-)
-СН2-
1
-н
—
0
17. Сполука формули II
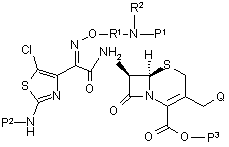 (II)
(II)
або її сіль, де
Р1 та Р2 незалежно являють собою водень або аміно-захисну групу;
Р3 являє собою водень або карбоксизахисну групу;
Q являє собою групу, що відходить, або групу формули:
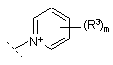 X-,
X-,
R1 являє собою -Yа-(W)n-Yb-;
W вибраний з групи, яка складається з -О-, -N(Rd)-, -S-, -S(O)-, -S(O)2-, С3-6циклоалкілену, С6-10арилену та С2-9гетероарилену, де кожна ариленова, циклоалкіленова та гетероариленова група є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з Rb,
Ya та Yb незалежно являють собою С1-5алкілен, або коли W являє собою циклоалкілен, арилен або гетероарилен, то Ya та Yb є незалежно вибраними з групи, яка складається з ковалентного зв'язку та C1-5алкілену, де кожна алкіленова група є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з -ORd, -NRdRe, -CO2Rd, -C(O)NRdRe та -S(O)2NRdRe;
R2 являє собою водень або С1-6алкіл;
кожний R3 є незалежно вибраним з групи, яка складається з С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу, С6-10арилу, С2-9гетероарилу, С3-6гетероциклілу та Ra; або дві сусідні групи R3 поєднані з утворенням С3-6алкілену або -О-(С1-6алкілен)-О-, де кожна група алкілу, алкілену, алкенілу та алкінілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Ra та Rc; а кожна група арилу, циклоалкілу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Rb;
кожний Ra є незалежно вибраним з групи, яка складається з -ORd, гало, -SRd, -S(O)Rd, -S(O)2Rd, -S(O)2ORd, -S(O)2NRdRe, -NRdRe, -CO2Rd, -ОС(O)Rd, -C(O)NRdRe, -NRdC(O)Re, -OC(O)NRdRe, -NRdC(O)ORe, -NRdC(O)NRdRe, -CF3 та -OCF3;
кожний Rb є незалежно вибраним з групи, яка складається з С1-6алкілу, С2-6алкенілу, С2-6алкінілу та Ra,
кожний Rc є незалежно вибраним з групи, яка складається з С3-6циклоалкілу, С6-10арилу, C2-9гетероарилу та С3-6гетероциклілу, де кожна група циклоалкілу, арилу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з С1-6алкілу та Rf;
кожний Rd та Ra є незалежно вибраним з групи, яка складається з водню, С1-6алкілу, С2-6алкенілу, С2-6алкінілу, С3-6циклоалкілу, С6-10арилу, С2-9гетероарилу та С3-6гетероциклілу; або Rd та Re поєднані разом з атомами, до яких вони прикріплені з утворенням С3-6гетероциклічного кільця, що має 1-3 гетероатоми, незалежно вибрані з кисню, азоту або сірки; при цьому кожна група алкілу, алкенілу та алкінілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Rc та Rf та кожна група арилу, циклоалкілу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з С1-6алкілу та Rf;
кожний Rf є незалежно вибраним з групи, яка складається з -ОН, -ОС1-6алкілу, -SC1-6алкілу, -F, -Cl, -NH2, -NН(С1-6алкіл), -N(С1-6алкіл)2, -ОС(O)С1-6алкілу, -С(O)ОС1-6алкілу, -NНС(O)С1-6алкілу, -С(O)ОН, -C(O)NH2, -С(O)NНС1-6алкілу, -С(O)N(С1-6алкіл)2, -CF3 та -OCF3;
X- є необов'язково присутнім аніоном;
m дорівнює 0, 1, 2 або 3;
та n дорівнює 0 або 1.
18. Сполука формули III
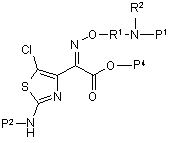 (III)
(III)
або її солі, де Р1 та Р2 незалежно являють собою водень або амінозахисну групу;
Р4 являє собою водень або карбоксизахисну групу;
R1 являє собою -Ya-(W)n-Yb-;
W вибраний з групи, яка складається з -О-, -N(Rd)-, -S-, -S(O)-, -S(O)2-, С3-6циклоалкілену, С6-10арилену та С2-9гетероарилену, де кожна ариленова, циклоалкіленова та гетероариленова група є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з Rb;
Ya та Yb незалежно являють собою C1-5алкілен, або коли W являє собою циклоалкілен, арилен або гетероарилен, то Ya та Yb є незалежно вибраними з групи, яка складається з ковалентного зв'язку та С1-5алкілену, де кожна алкіленова група є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з -ORd, -NRdRe, -CO2Rd, -C(O)NRdRe та -S(O)2NRdRe;
R2 являє собою водень або С1-6алкіл;
кожний Ra є незалежно вибраним з групи, яка складається з -ORd, гало, -SRd, -S(O)Rd, -S(O)2Rd, -S(O)2ORd, -S(O)2NRdRe, -NRdRe, -CO2Rd, -OC(O)Rd, -C(O)NRdRe, -NRdC(O)Re, -OC(O)NRdRe, -NRdC(O)ORe, -NRdC(O)NRdRe, -CF3 та -OCF3;
кожний Rb є незалежно вибраним з групи, яка складається з C1-6алкілу, C2-6алкенілу, C2-6алкінілу та Ra;
кожний Rc є незалежно вибраним з групи, яка складається з C3-6циклоалкілу, C6-10арилу, C2-9гетероарилу та C3-6гетероциклілу, де кожна група циклоалкілу, арилу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з C1-6алкілу та Rf; кожний Rd та Re є незалежно вибраними з групи, яка складається з водню, C1-6алкілу, C2-6алкенілу, C2-6алкінілу, C3-6циклоалкілу, C6-10арилу, C2-9гетероарилу та C3-6гетероциклілу; або Rd та Re поєднані разом з атомами, до яких вони прикріплені, з утворенням C3-6гетероциклічного кільця, що має 1-3 гетероатоми, незалежно вибрані з кисню, азоту або сірки; при цьому кожна група алкілу, алкенілу та алкінілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Rc та Rf; та кожна група арилу, циклоалкілу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з C1-6алкілу та Rf; кожний Rf є незалежно вибраним з групи, яка складається з -ОН, -OC1-6алкілу, -SC1-6алкілу, -F, -Сl, -NH2, -NН(C1-6алкіл), -N(C1-6алкіл)2, -ОС(O)C1-6алкілу, -С(O)ОC1-6алкілу, -NНС(O)C1-6алкілу, -С(O)ОН, -C(O)NH2, -C(O)NHC1-6алкілу, -С(O)N(C1-6алкіл)2, -CF3 та -OCF3; та n дорівнює 0 або 1.
19. Фармацевтична композиція, що містить фармацевтично прийнятний носій та терапевтично ефективну кількість сполуки згідно з будь-яким з пунктів 1-16.
20. Спосіб лікування бактеріальної інфекції у ссавців, при цьому вказаний спосіб включає введення ссавцеві фармацевтичної композиції, що включає фармацевтично прийнятний носій та терапевтично ефективну кількість сполуки згідно з будь-яким з пунктів 1-16.
21. Спосіб інгібування росту бактерій, при цьому у вказаному способі піддають контакту бактерії з такою кількістю сполуки у відповідності з будь-яким з пунктів 1-16, що інгібує ріст бактерій.
22. Спосіб інгібування біосинтезу клітинної стінки, при цьому у вказаному способі піддають контакту бактерії з такою кількістю сполуки у відповідності з будь-яким з пунктів 1-16, що інгібує синтез клітинної стінки.
23. Спосіб одержання сполуки згідно з будь-яким з пунктів 1-16; при цьому у вказаному способі піддають реакції глікопептид формули 1
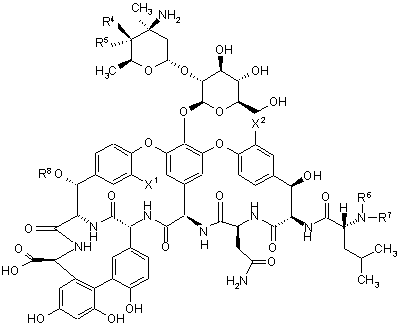 (1)
(1)
або його сіль зі сполукою формули 2:
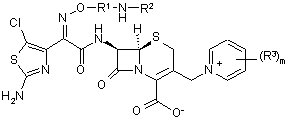 ,(2)
,(2)
або її сіллю з одержанням сполуки формули І або її солі.
24. Спосіб одержання сполуки згідно з будь-яким з пунктів 1-16, при цьому у вказаному способі піддають реакції сполуку формули 10
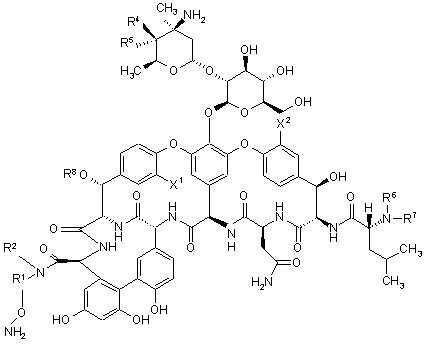 (10)
(10)
або її сіль зі сполукою формули 11:
 (11)
(11)
або її сіллю з одержанням сполуки формули І або її солі.
25. Спосіб одержання сполуки згідно з будь-яким з пунктів 1-16, при цьому у вказаному способі піддають реакції сполуку формули 9
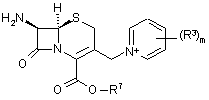 (9)
(9)
або її сіль зі сполукою формули 13
 (13)
(13)
або її сіллю з одержанням сполуки формули І або її солі.
26. Продукт, одержаний за допомогою способу за будь-яким з пунктів 23-25.
27. Сполука за будь-яким з пунктів 1-16 для застосування у терапії.
28. Сполука за будь-яким з пунктів 1-16 для виробництва лікарського засобу для лікування бактеріальної інфекції у ссавців.
Текст
1. Сполука формули І C2 2 (19) 1 3 80098 4 4. Сполука згідно з пунктом 3, в якій n дорівнює 0, NH2 a Ya та Yb поєднані разом з утворенням групи HO (СН2)2-, -(СН2)3-, -(СН2)4-, -(CH2)5- або -(СН2)6-. (i) 5. Сполука згідно з пунктом 4, в якій n дорівнює 0, O а Ya та Yb поєднані разом з утворенням групи CH3 , (СH2)3-. кожний Ra є незалежно вибраним з групи, яка 6. Сполука згідно з пунктом 1, в якій n дорівнює 1, складається з -ORd, гало, -SRd, -S(O)Rd, -S(O)2Rd , а Ya та Yb є однаковими або різними і кожний з них d d e d e d d S(O)2OR , -S(O)2NR R , -NR R , -CO2R , -OC(O)R , вибраний з групи, яка складається з ковалентного -C(O)NRdRe, -NRdC(O)Re, -OC(O)NRdRe, зв'язку та С1-5алкілену, необов'язково заміщеного NRdC(O)OR e, -NR dC(O)NRdRe, -СF 3 та -OCF3 ; від одного до трьох разів замісниками, вибраними кожний Rb є незалежно вибраним з групи, яка з -ORd, -NRdRe, -CO 2Rd, -C(O)NR dRe та складається з С 1-6алкілу, С2-4алкенілу, С2-6алкінілу S(O)2NRdRe. a та R ; 7. Сполука згідно з пунктом 6, в якій W являє сокожний Rc є незалежно вибраним з групи, яка бою С 6-10арилен або -O-. складається з С 3-6циклоалкілу, С6-10арилу, С28. Сполука згідно з пунктом 1, в якій n дорівнює 1, 9гетероарилу та С 3-6 гетероциклілу, де кожна група Ya та Yb обидва являють собою -CH2-, a W являє циклоалкілу, арилу, гетероарилу та гетероциклілу собою C6-10арилен, необов'язково заміщений від 1 є необов'язково заміщеною від одного до трьох до 3 разів замісниками, незалежно вибраними з разів замісниками, незалежно вибраними з групи, Rb. f яка складається з С 1-6алкілу та R ; 9. Сполука згідно з пунктом 8, в якій W являє сокожний Rd та Re є незалежно вибраним з групи, бою фенілен. яка складається з водню, С1-6алкілу, С2-6алкенілу, 10. Сполука згідно з пунктом 1, в якій n дорівнює 1, С2-6алкінілу, С3-6циклоалкілу, С6-10арилу, С2Ya та Yb обидва являють собою -СН2СН2-, a W явd e 9гетероарилу та С 3-6гетероциклілу; або R та R ляє собою -O-. поєднані разом з атомами, до яких вони приєднані, 11. Сполука за будь-яким з пунктів 1-10, в якій R2 з утворенням С 3-6гетероциклічного кільця, що має являє собою водень. від одного до трьох гетероатомів, незалежно виб12. Сполука за будь-яким з пунктів 1-11, в якій m раних з кисню, азоту або сірки; при цьому кожна дорівнює 0. група алкілу, алкенілу та алкінілу є необов'язково 13. Сполука за будь-яким з пунктів 1-11, в якій m заміщеною від одного до трьох разів замісниками, дорівнює 1 або 2, а кожний з R3 є незалежно вибнезалежно вибраними з групи, яка складається з раним з групи, яка складається з С 1-6алкілу, С3d d Rc та Rf та кожна група арилу, циклоалкілу, гете6циклоалкілу, -OR , -SR , -F або -Сl; або дві сусідні 3 роарилу та гетероциклілу є необов'язково заміщегрупи R поєднані з утворенням С3-6алкілену. ною 1-3 замісниками, незалежно вибраними з гру14. Сполука за будь-яким з пунктів 1-13, в якій R4 f пи, яка складається з С 1-6алкілу та R ; являє собою гідрокси; R5 являє собою водень; R6 є кожний Rf є незалежно вибраним з групи, яка воднем; R7 є метилом; R8 являє собою водень; а складається з -ОН, -ОС1-6алкілу, -SC1-6алкілу, -F, X1 та X2 обидва є хлором. Сl, -NH2, -NН(С1-6алкіл), -N(C1-6алкіл)2, -ОС(O)С115. Сполука згідно з пунктом 1, в якій R1 являє со-С(O)ОС1-6алкілу, -NНС(O)С1-6алкілу, 6алкілу, бою -Ya-(W) n-Yb-, де n дорівнює 0, Ya та Yb поєднаС(O)ОН, -C(O)NH2, - C(O)NHC1-6алкілу, -С(O)N(С1ні разом з утворенням групи -(СН2)3-; R2 являє со6алкіл)2, -СF3 та -OCF3 ; бою водень; R4 є гідрокси; R5 являє собою водень; m дорівнює 0, 1, 2 або 3; та n дорівнює 0 або 1. R6 є воднем; R7 являє собою метил; R8 являє со2. Сполука згідно з пунктом 1, в якій n дорівнює 0, бою водень; X1 та X2 обидва є хлором; a m дорівa b а Y та Y незалежно являють собою групу С 1нює 0. 5алкілену, де кожна алкіленова група є необов'яз16. Сполука згідно з пунктом 1, в якій R4 є гідрокси; ково заміщеною від 1 до 3 разів замісниками, неR5 являє собою водень; R6 є воднем; R7 являє d d e d залежно вибраними з -OR , -NR R , -CO2R , собою метил; R 8 являє собою водень; X1 та X2 C(O)NRdRe та - S(O) 2NRdRe. обидва є хлором; а R1, R2, R3 та m є такими, як 3. Сполука згідно з пунктом 1, в якій n дорівнює 0, вказано нижче: a Ya та Yb поєднані разом з утворенням групи (СН2)2-8-. CH3 R1 № R2 R3 m Ya W Yb n 1 -CН2СН2 — -С Н 2 0 -н — 1 2 -CН2СН2 — -С Н 2 0 -н 2-СН3 1 3 -СН2СН2 — -С Н 2 0 -н 3 -СН 3 1 4 -СН2СН2 — -С Н 2 0 -н 4 -С Н 3 1 5 -СН2СН2 — -С Н 2 0 -н 2-СН3 О 1 5 80098 6 6 -СН2СН2 — -С Н 2 0 -н 3-СН3О 1 7 -СН2СН2 — -С Н 2 0 -н 4 -С Н 3 О 1 8 -СН2СН2 — -С Н 2 0 -н 2-CH3S 1 9 -СН2СН 2 — -С Н 2 0 -н 3-CH3 S 1 10 -СН2СН2 — - С Н 2 0 -н 4-CH3S 1 11 -С Н 2 СН 2 — -С Н 2 0 -н 2-F 1 12 -СН 2 СН 2 — - С Н 2 0 -н 3-F 1 13 -СН2СН 2 — -С Н 2 0 -н 4 -F 1 14 -СН 2 СН 2 — -С Н 2 0 -н 2 -C I 1 15 -СН2СН 2 — -С Н 2 0 -н 3 -C I 1 16 -СН2СН 2 — -С Н 2 0 -н 4 -C I 1 17 -СН 2С Н 2 — -С Н 2 0 -н 2 -P h 1 18 -СН2СН2 — -С Н 2 0 -н 3-Ph 1 19 -СН2СН 2 — -С Н 2 0 -н 4 -Ph 1 20 -СН 2С Н 2 — -С Н 2 0 -н 4-циклопропiл 1 21 -СН2СН2 — -С Н 2 0 -н 4-[HOOCCH2S-] 1 22 -СН2СН 2 — -С Н 2 0 -н 4-NH2C(O) 1 23 -СН 2С Н 2 — -С Н 2 0 -н 2,3-ди-СН3 2 24 -СН2СН 2 — -С Н 2 0 -н 3,4-ди-СН3 2 25 -СН 2СН 2 — -С Н 2 0 -н 3,5-ди-СН3 2 26 -СН 2 СН 2 — -С Н 2 0 -н 3,4-ди-СН3О 2 27 -СН2СН2 — -С Н 2 0 -н 3 -СН 3 -4 -С Н 3 О 2 28 -СН2СН 2 — -С Н 2 0 -н 3 -С Н 3 О -4 - F 2 29 - СН2СН 2 — -С Н 2 0 -н 2,3-[-(СН2)4-] 2 30 - СН2СН 2 — -С Н 2 0 -н 2,3-(-СН2СН2СН2-) 2 31 -(СН 2 )з — -(СН2)3 0 -н — 0 32 -СН 2С Н 2 -О -СН2СН2 1 -н — 0 33 -С Н 2 1,4 -(-Ph-) -С Н 2 1 -н — 0 Р3 являє собою водень або карбокси-захисну групу; Q являє собою групу, що відходить, або груп у формули: 17. Сполука формули II R2 N Cl S P2 N H N O R1 N P 1 NH2 H S O (II) N Q O O O P3 або її сіль, де Р1 та Р2 незалежно являють собою водень або аміно-захисну гр упу; (R3) m N+ (X) , R1 являє собою -Yа-(W)n-Yb-; W вибраний з групи, яка складається з -О-, -N(Rd)-, -S-, -S(O)-, -S(O)2-, С3-6циклоалкілену, С6-10арилену та С2-9гетероарилену, де кожна ариленова, цикло 7 80098 8 алкіленова та гетероариленова група є необов'язR2 ково заміщеною від одного до трьох разів замісниO R1 N P1 ками, незалежно вибраними з Rb, N a b Cl Y та Y незалежно являють собою С 1-5алкілен, O P4 або коли W являє собою циклоалкілен, арилен або (III) a b гетероарилен, то Y та Y є незалежно вибраними S N O з групи, яка складається з ковалентного зв'язку та C1-5алкілену, де кожна алкіленова група є необоP2 N в'язково заміщеною від одного до трьох разів заміH d d e сниками, незалежно вибраними з -OR , -NR R , або її солі, де Р1 та Р2 незалежно являють собою CO2Rd, -C(O)NRdRe та -S(O) 2NRdRe; водень або амінозахисну груп у; R2 являє собою водень або С 1-6алкіл; Р4 являє собою водень або карбоксизахисну гр упу; кожний R3 є незалежно вибраним з групи, яка R1 являє собою -Ya-(W)n-Yb-; складається з С 1-6алкілу, С2-6алкенілу, С2-6алкінілу, W вибраний з групи, яка складається з -О-, -N(Rd)-, С3-6циклоалкілу, С6-10арилу, С2-9гетероарилу, С3-S-, -S(O)-, -S(O)2-, С3-6циклоалкілену, С6-10арилену a 3 6гетероциклілу та R ; або дві сусідні групи R пота С2-9гетероарилену, де кожна ариленова, циклоєднані з утворенням С 3-6алкілену або -О-(С1алкіленова та гетероариленова група є необов'яз6алкілен)-О-, де кожна група алкілу, алкілену, алково заміщеною від одного до трьох разів замісникенілу та алкінілу є необов'язково заміщеною від ками, незалежно вибраними з Rb; одного до трьох разів замісниками, незалежно Ya та Yb незалежно являють собою C1-5алкілен, вибраними з групи, яка складається з R a та Rc; а або коли W являє собою циклоалкілен, арилен або кожна група арилу, циклоалкілу, гетероарилу та гетероарилен, то Ya та Yb є незалежно вибраними гетероциклілу є необов'язково заміщеною від одз групи, яка складається з ковалентного зв'язку та ного до трьох разів замісниками, незалежно вибС1-5алкілену, де кожна алкіленова група є необораними з групи, яка складається з Rb; в'язково заміщеною від одного до трьох разів замікожний Ra є незалежно вибраним з групи, яка сниками, незалежно вибраними з -ORd, -NRdRe, d d d d складається з -OR , гало, -SR , -S(O)R , -S(O)2R , CO2Rd, -C(O)NRdRe та -S(O) 2NRdRe; S(O)2ORd , -S(O)2NRdRe, -NRdRe, -CO2R d, -ОС(O)Rd, R2 являє собою водень або С 1-6алкіл; d e d e d e -C(O)NR R , -NR C(O)R , -OC(O)NR R , кожний Ra є незалежно вибраним з групи, яка NRdC(O)OR e, -NR dC(O)NRdRe, -CF 3 та -OCF3 ; складається з -ORd, гало, -SRd, -S(O)Rd, -S(O)2Rd , b кожний R є незалежно вибраним з групи, яка S(O)2ORd , -S(O)2NRdRe, -NRdRe, -CO2R d, -OC(O)Rd, складається з С 1-6алкілу, С2-6алкенілу, С2-6алкінілу -C(O)NRdRe, -NRdC(O)Re, -OC(O)NRdRe, та Ra, NRdC(O)OR e, -NR dC(O)NRdRe, -CF 3 та -OCF3 ; c кожний R є незалежно вибраним з групи, яка кожний Rb є незалежно вибраним з групи, яка складається з С 3-6циклоалкілу, С6-10арилу, C2складається з C1-6алкілу, C2-6алкенілу, C2-6алкінілу 9гетероарилу та С 3-6 гетероциклілу, де кожна група та Ra; циклоалкілу, арилу, гетероарилу та гетероциклілу кожний Rc є незалежно вибраним з групи, яка є необов'язково заміщеною від одного до трьох складається з C3-6циклоалкілу, C6-10арилу, C2разів замісниками, незалежно вибраними з групи, 9гетероарилу та C 3-6 гетероциклілу, де кожна група яка складається з С 1-6алкілу та Rf; циклоалкілу, арилу, гетероарилу та гетероциклілу кожний Rd та Ra є незалежно вибраним з групи, є необов'язково заміщеною від одного до трьох яка складається з водню, С1-6алкілу, С2-6алкенілу, разів замісниками, незалежно вибраними з групи, С2-6алкінілу, С3-6циклоалкілу, С6-10арилу, С2яка складається з C1-6алкілу та Rf; кожний Rd та Re d e гетероарилу та С 3-6гетероциклілу; або R та R 9 є незалежно вибраними з групи, яка складається з поєднані разом з атомами, до яких вони прикріпводню, C1-6алкілу, C2-6алкенілу, C2-6алкінілу, C3лені з утворенням С 3-6гетероциклічного кільця, що 6циклоалкілу, C 6-10арилу, C 2-9ге тероарилу та C 3d e має 1-3 гетероатоми, незалежно вибрані з кисню, 6гетероциклілу; або R та R поєднані разом з атоазоту або сірки; при цьому кожна група алкілу, алмами, до яких вони прикріплені, з утворенням C3кенілу та алкінілу є необов'язково заміщеною від 6гетероциклічного кільця, що має 1-3 гетероатоми, одного до трьох разів замісниками, незалежно незалежно вибрані з кисню, азоту або сірки; при c f вибраними з групи, яка складається з R та R та цьому кожна група алкілу, алкенілу та алкінілу є кожна група арилу, циклоалкілу, гетероарилу та необов'язково заміщеною від одного до трьох рагетероциклілу є необов'язково заміщеною від одзів замісниками, незалежно вибраними з групи, яка ного до трьох разів замісниками, незалежно вибскладається з Rc та Rf; та кожна група арилу, цикраними з групи, яка складається з С1-6алкілу та Rf; лоалкілу, ге тероарилу та гетероциклілу є необокожний Rf є незалежно вибраним з групи, яка в'язково заміщеною від одного до трьох разів заміскладається з -ОН, -ОС1-6алкілу, -SC1-6алкілу, -F, сниками, незалежно вибраними з групи, яка Cl, -NH2, -NН(С1-6алкіл), -N(С1-6алкіл)2, -ОС(O)С1складається з C1-6алкілу та Rf; кожний Rf є незале-С(O)ОС1-6алкілу, -NНС(O)С1-6алкілу, 6алкілу, жно вибраним з групи, яка складається з -ОН, С(O)ОН, -C(O)NH2, -С(O)NНС1-6алкілу, -С(O)N(С1OC1-6алкілу, -SC1-6алкілу, -F, -Сl, -NH2, -NН(C16алкіл)2, -CF3 та -OCF3 ; 6алкіл), -N(C 1-6алкіл)2, -ОС(O)C 1-6алкілу, -С(O)ОC 1X- є необов'язково присутнім аніоном; 6алкілу, -NНС(O)C 1-6алкілу, -С(O)ОН, -C(O)NH 2, m дорівнює 0, 1, 2 або 3; C(O)NHC1-6алкілу, -С(O)N(C1-6алкіл)2, -CF3 та та n дорівнює 0 або 1. OCF3; та n дорівнює 0 або 1. 18. Сполука формули III 19. Фармацевтична композиція, що містить фармацевтично прийнятний носій та терапевтично 9 80098 10 CH ефективну кількість сполуки згідно з будь-яким з NH R пунктів 1-16. R OH 20. Спосіб лікування бактеріальної інфекції у ссавH C O O OH ців, при цьому вказаний спосіб включає введення OH ссавцеві фармацевтичної композиції, що включає O O X фармацевтично прийнятний носій та терапевтично O O ефективну кількість сполуки згідно з будь-яким з R O OH X пунктів 1-16. O O O H H 21. Спосіб інгібування росту бактерій, при цьому у N N N N O N вказаному способі піддають контакту бактерії з H H NH O H R O O такою кількістю сполуки у відповідності з будьO R N HN яким з пунктів 1-16, що інгібує ріст бактерій. 22. Спосіб інгібування біосинтезу клітинної стінки, OH O HO OH NH при цьому у вказаному способі піддають контакту бактерії з такою кількістю сполуки у відповідності з або її сіль зі сполукою формули 11: O будь-яким з пунктів 1-16, що інгібує синтез клітинCl H H ної стінки. N S 23. Спосіб одержання сполуки згідно з будь-яким з S N O N пунктів 1-16; при цьому у вказаному способі підN+ O дають реакції глікопептид формули 1 HN 3 4 2 5 3 2 8 (10) 1 R6 H N R7 CH3 2 1 CH3 2 2 2 CH3 NH 2 R4 R5 O OH O O O R8 O X O X2 O O H N N H O HO O O O H N H OH S H 2N (R 3)m O R7 O або її сіль зі сполукою формули 13 CH3 R4 OH H3C O R1 N R2 N H H H S N N O CH 3 NH2 R5 OH O N N (2) R8 O O O O , або її сіллю з одержанням сполуки формули І або її солі. 24. Спосіб одержання сполуки згідно з будь-яким з пунктів 1-16, при цьому у вказаному способі піддають реакції сполуку формули 10 R2 O N H NH O N Cl X2 O OH X1 O H N O R1 N OH O O (R3)m O O OH O O + (9) N+ O R7 N або його сіль зі сполукою формули 2: Cl O S N R6 CH3 H2N HO H H2N (1) OH 1 H N N H NH O O OH O (11) або її сіллю з одержанням сполуки формули І або її солі. 25. Спосіб одержання сполуки згідно з будь-яким з пунктів 1-16, при цьому у вказаному способі піддають реакції сполуку формули 9 OH H3 C O (R3 )m N H O O H2 N HO O H N N H H R6 N R7 (13) CH3 CH 3 OH OH OH S N O H 2N або її сіллю з одержанням сполуки формули І або її солі. 26. Продукт, одержаний за допомогою способу за будь-яким з пунктів 23-25. 27. Сполука за будь-яким з пунктів 1-16 для застосування у терапії. 28. Сполука за будь-яким з пунктів 1-16 для виробництва лікарського засобу для лікування бактеріальної інфекції у ссавців. Даний винахід спрямований на нові поперечно-зв'язані ванкоміцин-цефалоспоринові сполуки, які є корисними як антибіотики. Цей винахід також спрямований на фармацевтичні композиції, які 11 80098 12 включають вказані сполуки; на способи викорисленова група є необов'язково заміщеною від однотання таких сполук як антибактеріальних агентів; а го до трьох разів замісниками, незалежно вибратакож на способи та проміжні сполуки для одерними з Rb; жання таких сполук. Ya та Yb незалежно представляють собою С 1-5 У галузі техніки відомі різноманітні класи антиалкілен або, коли W є циклоалкіленом, ариленом або гетероариленом, Ya та Yb є незалежно вибрабіотичних сполук, що включають, наприклад, bними з групи, яка складається з ковалентного зв'ялактамові антибіотики, такі, як цефалоспорини, та глікопептидні антибіотики, такі, як ванкоміцин. Позку та С1-5 алкілену, при цьому кожна алкіленова група є необов'язково заміщеною від одного до перечно-зв'язані антибіотичні сполуки також відомі трьох разів замісниками, незалежно вибраними з у даній галузі техніки. [Див. наприклад, Патент ORd, - NR dRe , - CO 2Rd, - C(O)NR dRe та -S(O)2NRdRe ; США №5,693,791, автором якого є W. L. Truett, R2 представляє собою водень або С1-6 алкіл; який має назву «Ан тибіотики та способи їх одержання»; та WO 99/64049 А1, що опублікована 16 кожний R3 є незалежно вибраним з групи, яка складається з С 1-6 алкілу, С2-6 алкенілу, С3-6 алкінігрудня 1999 року, та яка має назву «Нові антибаклу, С3-6 циклоалкілу, С6-10 арилу, С2-9 гетероарилу, теріальні агенти»]. С3-6 гетероциклілу та Ra; або дві суміжні групи R3 Незважаючи на існування цих сполук, існує попоєднані разом з утворенням С 3-6 алкілену або -Отреба у нових антибіотиках, що мають поліпшені властивості, які включають, наприклад, підвищену (С1-6 алкілен)-О-, де кожна група алкілу, алкілену, алкенілу та алкінілу є необов'язково заміщеною ефективність проти грам-позитивних бактерій. Зовід одного до трьох разів замісниками, незалежно крема, існує потреба у нових антибіотиках, які є вибраними з групи, яка складається з R a та Rc; а високоефективними проти стійких до антибіотиків кожна група арилу, циклоалкілу, гетероарилу та штамів бактерій, таких, як стійкі до метициліну Staphylococci aureus (MSRA) та стійкі до метицилігетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибну Staphylococci epidermitis (MRSE). раними з групи, яка складається з Rb; Даний винахід забезпечує нові поперечноодин з R4 та R5 представляє собою гідрокси, а зв'язані глікопептид-цефалоспоринові сполуки, які інший представляє собою водень; є корисними як антибіотики. Серед інших властивостей, сполуки за даним винаходом були виявлеR6 та R7 незалежно представляють собою водень або метил; ні такими, що володіють несподіваною та непеR8 представляє собою водень або групу форредбаченою ефективністю проти грам-позитивних мули (і): бактерій, включаючи стійкі до метициліну Streptococci aureus (MSRA) та стійкі до метициліну Streptococci epidermitis (MRSE). Згідно з цим в одному із своїх аспектів винахід забезпечує сполук у формули І: або її фармацевтично прийнятну сіль, де X1 та X2 незалежно вибрані з групи, що складається з водню та хлору; R1 представляє собою -Ya-(W) n-Yb-; W вибраний з групи, яка складається з -О-, N(Rd)-, -S-, - S(O) -, - S(O) 2 -, С3-6 циклоалкілену, С6-10 арилену та С 2-9 гетероарилену, при цьому кожна ариленова, циклоалкіленова та гетероари кожний Ra є незалежно вибраним з групи, яка складається з - ORd, гало, -SR d , - S(O)R d, - S(O) 2Rd, - S(O)2OR d, - S(O)2NRdRe , - NRdRe, - CO 2Rd, OC(O)Rd, -C(O)NRdRe, - NRdC(O)Re, - OC(O)NR dRe, - NRdC(O)OR e, - NRdC(O)NRdRe, -CF3 та -OCF3; кожний Rb є незалежно вибраним з групи, яка складається з С 1-6 алкілу, С2-4 алкенілу, С2-6 алкінілу та Ra; кожний Rc є незалежно вибраним з групи, яка складається з С 3-6 циклоалкілу, С6-10 арилу, С2-9 гетероарилу та С 3-б гетероциклілу, де кожна група циклоалкілу, арилу, гетероарилу та гетероциклілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з С 1-6 алкілу та Rf; кожний Rd та Re є незалежно вибраним з групи, яка складається з водню, С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, С3-6 циклоалкілу, С6-10 арилу, С2d e 9 гетероарилу та С 3-6 гетероциклілу; або R та R поєднані разом з атомами, до яких вони приєднані, з утворенням С3-6 гетероциклічного кільця, що має від одного до трьох гетероатомів, незалежно вибраних з кисню, азоту або сірки; при цьому кожна група алкілу, алкенілу та алкінілу є необов'язково заміщеною від одного до трьох разів замісниками, незалежно вибраними з групи, яка складається з Rc та Rf; та кожна група арилу, циклоалкілу, гетероарилу та гетероциклілу є необов'язково заміще 13 80098 14 ною 1-3 замісниками, незалежно вибраними з грута захищені похідні; при цьому ці сполуки є кориспи, яка складається з С 1-6 алкілу та Rf; ними як проміжні сполуки для одержання сполук кожний Rf є незалежно вибраним з групи, яка формули І та/або як антибіотики. складається з - ОН, - ОС1-6 алкілу, - SC1-6 алкілу, В іншому із сукупності аспектів даний винахід F, -СІ, - NH2, - NH(C1-6 алкіл), - N(С1-6 алкіл)2, забезпечує фармацевтичну композицію, що місОС(О)С1-6 алкілу, - С(О)ОС1-6 алкілу, - NHC(O)C1-6 тить фармацевтично прийнятний носій та терапевалкілу, - С(О)ОН, - C(O)NH 2, - C(O)NHC1-6 алкілу, тично ефективну кількість сполуки формули І або її C(O)N(С1-6 алкіл)2, - CF3 та - OCF 3; фармацевтично прийнятну сіль. m дорівнює 0,1,2 або 3; та Незважаючи на те, що ми не маємо наміру N дорівнює 0 або 1. обмежуватися теорією, сполуки формули І, як очіДаний винахід також стосується проміжних кується, інгібують біосинтез клітинної стінки бактесполук, які є корисними для одержання сполук рій, і таким чином, інгібують ріст бактерій або формули І, та їх солей. Згідно з цим ще в одному спричинюють їх лізис. Таким чином, серед інших аспекті даний винахід забезпечує сполуку формувластивостей, сполуки формули І є корисними як ли II: антибіотики. Згідно з одним з аспектів, що стосуються способу, даний винахід забезпечує спосіб лікування бактеріальної інфекції у ссавців, при цьому спосіб включає введення ссавцеві фармацевтичної композиції, що містить фармацевтично прийнятний носій та терапевтично ефективну кількість сполуки формули І або її фармацевтично прийнятну сіль. Крім того, в іншому з аспектів, що стосуються способу, винахід забезпечує спосіб інгібування росту бактерій, при цьому спосіб передбачає приведення бактерії у контакт з такою кількістю сполуабо її сіль, ки формули І або її фармацевтично прийнятної де R1 та R2 є такими, як визначено у даній засолі, що інгібує ріст бактерій. явці; Ще в одному з аспектів, що стосуються спосоР1 та Р2 незалежно представляють собою вобу, даний винахід забезпечує спосіб інгібування день або аміно-захисну груп у; біосинтезу клітинної стінки бактерій, при цьому Р3 представляє собою водень або а карбоксиспосіб передбачає приведення бактерії у контакт з захисну гр упу; такою кількістю сполуки формули І або її фармаQ представляє собою групу, що відходить, або цевтично прийнятної солі, що інгібує біосинтез груп у формули: клітинної стінки. Винахід також направлений на способи приготування сполук формули І або їх солей. Згідно з цим, в іншому аспекті, що стосується способів, даний винахід забезпечує спосіб одержання сполуки формули І або її солей, при цьому спосіб включає: (a) реакцію глікопептиду формули 1, як визнаде R3 та m є такими, як визначено в даній зачено у даній заявці, зі сполукою формули 2, як явці; а X є необов'язково присутнім аніоном; такі визначено у даній заявці; або сполуки є корисними як проміжні сполуки для оде(b) реакцію сполуки формули 10, як визначено ржання сполук формули І та/або як антибіотики. далі, зі сполукою формули 11, як визначено у даВ іншому своєму аспекті даний винахід забезній заявці; або печує сполуку формули III: (c) реакцію сполуки формули 9, як визначено у даній заявці, зі сполукою формули 13, як визначено у даній заявці; для одержання сполуки формули І або її солі. В одному бажаному втіленні вказаний вище процес також включає етап одержання фармацевтично прийнятної солі сполуки формули І. Даний винахід також направлений на продукт, одержаний за допомогою будь-якого з цих способів. Даний винахід також направлений на сполуку формули І або її фармацевтично прийнятну сіль для використання їх при терапії. Крім того, даний або її солі, де R1, R2, Р1 та Р2 є такими, як вивинахід направлений на застосування сполуки значено в даній заявці, а Р4 представляє собою формули І або її фармацевтично прийнятної солі водень або карбокси-захисну груп у; при цьому ці для одержання лікарського засобу для лікування сполуки є корисними як проміжні сполуки для одебактеріальної інфекції у ссавців. ржання сполук формули І або II. Даний винахід забезпечує нові глікопептидВ окремих та індивідуальних аспектах даний цефалоспоринові сполуки формули І або їх фарвинахід також забезпечує сполуки формул 2, 5b, 7, мацевтично прийнятні солі. Такі сполуки мають 8, 10, 11 та 13, як визначено у даній заявці, їх солі 15 80098 16 численні хіральні центри, та в зв'язку з цим, вказані сполуки передбачаються як такі, що демонструють стереохімічні властивості. Зокрема, глікопептидна частина сполуки, як передбачається, володіє стереохімічними властивостями відповідного глікопептиду, що існує у природі (наприклад, ванкоміцину, хлорорієнтицину А, то що). Цефалоспоринова частина молекули, як передбачається, буде мати стереохімію відомих цефалоспоринових сполук. Спеціалістові у даній галузі при цьому зрозуміло, що у композиціях згідно з даним винаходом може бути присутня незначна кількість ізомерів, що мають стереохімію, відмінну від тієї, яка була показана, проте при цьому корисні властивості композиції у цілому суттєво не послаблюються завдяки присутності таких ізомерів. Крім того, зв'язувальна частина сполуки за даним винаходом (тобто, R1) може містити один або більше хіральних центрів. Типово, цю частину молекули будуть одержувати як рацемічну суміш. Проте, якщо це є бажаним, то можна використовувати чисті стереоізомери (тобто, індивідуальні або їх фармацевтично прийнятні солі, де R 1, енантіомери або діастереомери) або можна також 2 R , R3 та m є такими, як визначено у даній заявці, використовува ти збагачену стереоізомерами сувключаючи бажані втілення. міш. Усі такі стереоізомери та збагачені суміші У бажаному втіленні R1 представляє собою включені в об'єм даного винаходу. a Y - Yb -, тобто, коли n дорівнює 0. У цьому втіленні Крім того, сполуки за даним винаходом містять Ya та Yb незалежно представляютьсобою С 1-5 алдеякі кислотні групи (тобто, групи карбонових кискіленові групи, при цьому кожна алкіленова група є лот) та деякі основні групи (тобто, гр упи первинних необов'язково заміщеною від одного до трьох рата вторинних амінів), і, таким чином, сполуки форзів замісниками, незалежно вибраними з -ORd, мули І можуть існувати у різноманітних формах NRdRe, -CO2Rd , - C(O)NRdRe та - S(O) 2NRdRe, як солей. Усі такі солі включені в об'єм даного винавизначено у даній заявці. Бажано, коли Ya та Yb є ходу. Крім того, оскільки формули І містять кільця незалежно вибраними з С 1-3 алкілену; та більш піридинію, то може бути необов'язково присутнім бажано з С 1-2 алкілену. Більш бажано, коли Ya та аніонний протиіон для групи піридинію, що вклюYb поєднані разом (тобто, R1) з утворенням групи чає без обмеження, галіди, такі, як хлорид; карбо(СН2)2-8. Ще більш бажано, коли Ya та Yb поєднані ксилати, такі, як ацетат; тощо. разом з утворенням -(СН2)2-, - (СН2)3-, - (СН2)4-, Крім того, спеціалістові в даній галузі зрозумі(СН2)5- або - (СН2)6- груп. В особливо бажаному ло, що лабільні або хімічно нестабільні сполуки, у втіленні Ya та Yb поєднані разом з утворенням груяких відсутні корисні властивості завдяки їх нестапи - (СН2)3-. більності, не включаються в об'єм даного винахоВ іншому переважному втіленні R1 представду. Наприклад, бажано, щоб сполуки формули І ляє собою - Ya - W - Yb-, тобто, коли n дорівнює 1. містили, принаймні, два атоми вуглецю між будьУ цьому втіленні Ya та Yb незалежно представляякими атомами кисню 1 ють собою С 1-5 алкілен, або коли W представляє (-О-), азоту (-N < ) або сірки (-S-) у гр упі - О - R 2 собою циклоалкілен, арилен або гетероарилен, то - N(R ) -, оскільки у випадку, коли ці атоми відоYa та Yb є незалежно вибраними з групи, яка склакремлені одним атомом вуглецю, то одержана дається з ковалентного зв'язку та С 1-5 алкілену. сполука (тобто, та, що містить групи ацеталю, геКожна алкіленова група у цьому втіленні є необоміацеталю, кеталю, гемікеталю, аміналю, геміамів'язково заміщеною від одного до трьох разів заміналю або тіокеталю, тощо) може бути гідролітично сниками, вибраними з - ORd, - NRdRe , -CO2R d, нестабільною в кислотних умовах. C(O)NRdRe та - S(O) 2NRdRe, як визначено у даній Переважні втілення заявці. Коли Ya або Yb представляють собою алкіУ сполуках формули І бажаними є наступні ленову гр упу, то алкіленова група бажано предзамісники та значення: ставляє собою С 1-3 алкіленову груп у; більш бажаУ бажаному втіленні даний винахід направлено Сі-2 алкіленову гр упа; ще більш бажано, групу ний на сполуки формули Іа: (СН2)1-2-. В особливо бажаному втіленні Ya та Yb обидва представляють собою -СН2-, a W представляє собою С 6-10 арилен, необов'язково заміщений від одного до трьох разів замісниками, незалежно вибраними з Rb, як визначено у даній заявці; більш бажано, коли W представляє собою фенілен. В іншому бажаному втіленні Ya та Yb обидва представляють собою - СН2СН2 -, a W представляє собою -О-. У випадку присутності, W переважно предста 17 80098 18 вляє собою С 6-10 арилен або -О-. Більш бажано, В іншому бажаному втіленні R4 представляє коли W представляє собою фенілен або -О-. собою водень; R5 є гідрокси; R6 представляє соБажано, коли R2 представляє собою водень бою водень; R7 представляє собою метил; R8 є 2 або С1-3 алкіл. Більш бажано, коли R представляє групою формули (і); а X1 та X2 обидва представсобою водень. ляють собою хлор (тобто, глікопептидною частиУ разі присутності, кожний R3 є переважно неною є хлорорієнтицин або А82846В). залежно вибраним з С1-6 алкілу, С3-6 циклоалкілу, У бажаному втіленні m дорівнює 0. В іншому ORd, - SRd, - F або - СІ; або дві сусідні гр упи R3 бажаному втіленні m дорівнює 1 або 2; більш бапоєднані разом з утворенням С3-6 алкілену. жано, коли m дорівнює 1. Ще в одному бажаному У бажаному втіленні R4 представляє собою гівтіленні m дорівнює 2, а дві R3 гр упи поєднані ра5 дрокси, a R представляє собою водень. В іншому зом з утворенням С3-6 алкіленової групи; більш бажаному втіленні R4 представляє собою водень, бажано, С3-4 алкіленової групи. a R5 представляє собою гідрокси. Переважними групами сполук формули І є такі Бажано, коли R6 представляє собою водень, a формули Іа, в яких R1 представляє собою - Ya R7 є метилом. (W)n - Yb -, де n дорівнює 0, a Ya та Yb поєднані 8 Бажано, коли R представляє собою водень. разом з утворенням групи -(СН2)2-8-; R2 представ1 2 Бажано, коли один з X та X представляє соляє собою водень, a m дорівнює 0; або їх фармабою хлор, а інший є воднем; або обидва предстацевтично прийнятні солі. У цьому втіленні R1 (тоб1 2 вляють собою хлор. Більш бажано, коли X та X то, Ya та Yb, узяті разом) переважно представляє обидва є хлором. собою групу - (СН2)2-, - (СН2)3-, - (СН2)4-, - (СН2)5У бажаному втіленні R4представляє собою гіабо - (СН2)6; більш бажано, - (СН2)3-. дрокси; R5 є воднем; R6 є воднем; R7 представляє Іншою бажаною групою сполук формули І є тасобою метил; R 8 представляє собою водень; та X1 кі формули Іа, в яких R1, R2, R3 та m є такими, як та X2 обидва представляють собою хлор (тобто, визначено у Таблиці І, або їх фармацевтично приглікопептидною частиною є ванкоміцин). йнятні солі. Таблиця І № Пр. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 a Y -СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-СН2СН2-(СН2)3-СН2СН2-СН2 R1 W -ΟΙ,4-(-Ph-)2 Yb -СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-(СН2)3-СН2СН2-СН2 n 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 R2 R3 m -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н -Н 2-СН33-СН34-СН32-СН3О3-СН3О4-СН3О2-CH3S3-CH3S4-CH3S2-F3-F4-F2-СІ3-СІ4-СІ2-Ph-1 3-Ph4-Ph4-циклопропіл4-[HOOCCH2S-] 4-NH2C(O2,3-ди-СН33,4-ди-СН33,5-ди-СН33,4-ди-СН3О3-СН3-4-СН3О3-СН3О-4-F2,3-[-(СН2)4-] 2,3-(-СН2СН2СН2-) 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2 0 0 0 19 80098 20 1 Ph = феніл 1,4-(-Ph-) = 1,4-фенілен 2 У проміжній сполуці формули II: Q бажано представляє собою групу піридинію. Р1 бажано представляє собою водень або трет-бутоксикарбоніл. Р2 бажано представляє собою водень або трифенілметил. Р3 бажано представляє собою водень або пметокисбензил. R1, R2, R3 та m бажано такі, як визначено у даній заявці, включаючи будь-які бажані втілення, заміщення або значення. У проміжній сполуці формули III: Ρ1 бажано представляє собою водень або трет-бутоксикарбоніл. Р2 бажано представляє собою водень, форміл або трифенілметил. Р4 бажано представляє собою водень, С1-4 алкіл або п-метокисбензил. R1 та R2 бажано є такими, як визначено у даній заявці, включаючи будь-яке переважне втілення, заміщення або значення. Визначення При описуванні сполук, композицій, способів та процесів згідно з даним винаходом наступні терміни мають приведені нижчі значення, якщо інше не зазначено. Термін „алкіл" відноситься до моновалентної насиченої вуглеводневої групи, яка може бути лінійною або розгалуженою. Якщо інше не вказано, такі алкільні групи типово містять від 1 до 10 атомів вуглецю. Характерні алкільні групи включають, наприклад, метил, етил, н-пропіл, ізопропіл, нбутил, втор-бутил, ізобутил, трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-октил, н-ноніл, ндецил, тощо. Термін „алкілен" відноситься до моновалентної насиченої вуглеводневої групи, яка може бути лінійною або розгалуженою. Якщо інше не вказано, такі алкіленові групи типово містять від 1 до 10 вуглецевих атомів. Характерні алкіленові групи включають, наприклад, метилен, етан -1,2-діїл („етилен"), пропан-1, 2-діїл, пропан-1, 3-діїл, бутан1, 4-діїл, пентан-1, 5-діїл, тощо. Термін «алкеніл» відноситься до моновалентної ненасиченої вуглеводневої гр упи, яка може бути лінійною або розгалуженою, та яка має, принаймні, один, та типово 1, 2 або 3, вуглецьвуглецеві подвійні зв'язки. Якщо не вказано інше, то такі алкенільні групи типово містять від 2 до 10 атомів вуглецю. Типові алкенільні групи включають, наприклад, етеніл, н-пропеніл, ізопропеніл, нбут-2-еніл, н-гекс-3-еніл, тощо. Термін «алкініл» відноситься до моновалентної ненасиченої вуглеводневої гр упи, яка може бути лінійною або розгалуженою, та яка має, принаймні, один, та типово 1, 2 або 3 вуглецьвуглецеві потрійні зв'язки. Якщо не вказано інше, то такі алкінільні групи типово містять від 2 до 10 атомів вуглецю. Типові алкінільні групи включають, наприклад, етиніл, н-пропініл, н-бут-2-иніл, н-гекс3-иніл, тощо. Термін «арил» відноситься до моновалентної ароматичної вуглеводневої гр упи, яка має одне кільце (тобто, феніл) або сконденсовані кільця (тобто, нафталін). Якщо не вказано інше, то такі арильні групи типово містять від 6 до 10 кільцевих атомів вуглецю. Типові арильні групи включають, наприклад, феніл та нафталін-1-іл, нафталін-2-іл, тощо. Термін «арилен» відноситься до дивалентної ароматичної вуглеводневої гр упи, яка має одне кільце (тобто, фенілен) або сконденсовані кільця (тобто, нафталіндіїл). Якщо не вказано інше, то такі групи арилену типово містять від 6 до 10 кільцевих атомів вуглецю. Типові групи арилену включають, наприклад, 1, 2-фенілен, 1, 3-фенілен, 1, 4фенілен, нафталін-1, 5-діїл, нафталін-2, 7-діїл, тощо. Термін «циклоалкіл» відноситься до моновалентної насиченої карбоциклічної вуглеводневої групи. Якщо інше не вказано, то такі циклоалкільні групи типово містять від 3 до 10 атомів вуглецю. Типові циклоалкільні групи включають, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, тощо. Термін «циклоалкілен» відноситься до двовалентної насиченої карбоциклічної вуглеводневої групи. Якщо не вказано інше, то такі циклоалкіленові групи типово містять від одного до трьох атомів вуглецю. Типові циклоалкіленові групи включають, наприклад, циклопропан-1,2-діїл, циклобутил-1,2-діїл, циклобутил-1,3-діїл, циклопентил-1,2-діїл, циклопентил-1,3-діїл, циклогексил1,2-діїл, циклогексил-1,3-діїл, циклогексил-1,4-діїл, тощо. Термін «гало» відноситься до фтору, хлору, брому та йоду. Термін «гетероарил» відноситься до моновалентної ароматичної групи, що має одне кільце або два скондонсовані кільця, та містить у кільці, принаймні, один гетероатом (типово, від 1 до 3 гетероатомів), вибраних з азоту, кисню або сірки. Якщо не вказано інше, то такі гетероарильні групи типово містять загалом від 5 до 10 атомів кільця. Типові гетероарильні групи включають, наприклад, моновалентні види піролу, імідазолу, тіазолу, оксазолу, фурану, тіо фену, тріазолу, піразолу, ізоксазолу, ізотіазолу, піридину, піразину, піридазину, піримідину, тіазину, індолу, бензофурану, бензотіофену, бензимідазолу, бензтіазолу, хіноліну, ізохіноліну, хіназоліну, хіноксаліну, тощо, у яких точка приєднання знаходиться при будь-якому присутньому кільцевому атомі вуглецю або азоту. Термін «гетероарилен» відноситься до дивалентної ароматичної групи, що має одне кільце або два сконденсовані кільця, та містить, принаймні, один гетероатом (типово, від 1 до 3 гетероатомів), вибраних з азоту, кисню або сірки у кільці. Якщо не вказано інше, то такі гетероариленові групи типово містять загалом від 5 до 10 кільцевих атомів. Типові гетероариленові групи включають, наприклад, дивалентні види піролу, імідазолу, тіа 21 80098 22 золу, оксазолу, фурантіофену, триазолу, піразолу, ми є солі амонію, кальцію, магнію, калію та натрію. ізоксазолу, ізотіазолу, піридину, піразину, піридаСолі, що мають походження від фармацевтично зину, піримідину, тіазину, індолу, бензофурану, прийнятних органічних основ, включають солі пербензотіофену, бензимідазолу, бензтіазолу, хінолівинних, вторинних або третинних амінів, включаюну, ізохіноліну, хіназоліну, хіноксаліну, тощо, при чи заміщені аміни, циклічні аміни, аміни, що існуцьому точка приєднання знаходиться при будьють в природі, тощо, таких, як аргінін, бетаїн, якому присутньому кільцевому атомі вуглецю або кафеїн, холін, Ν,Ν'-дибензилетилендіамін, діетиазоту. ленамін, 2-діетиламіноетанол, 2Термін «гетероцикліл» або «гетероциклічний» диметиламіноетанол, етаноламін, етилендіамін, Nвідноситься до моновалентної насиченої або неетилморфолін, N-етилпіперидин, глюкамін, глюконасиченої (не ароматичної) групи, що має одне замін, гістидин, гідрабамін, ізопропіламін, лізин, кільце або багато сконденсованих кілець, та місметилглюкамін, морфолін, піперазин, піперидин, тить у кільці, принаймні, один гетероатом (типово, поліамінні смоли, прокаїн, пурини, теобромін, тривід 1 до 3 гетероатомів), вибраних з азоту, кисню етиламін, триметиламін, трипропіламін, трометаабо сірки. Якщо не вказано інше, то такі гетероцимін, тощо. Солі, які мають походження від фармаклічні групи типово загалом містять від 2 до 9 кільцевтично прийнятних кислот, включають солі, цевих атомів. Характерні гетероциклічні групи одержані при використанні оцтової, аскорбінової, включають, наприклад, моновалентні види піролібензолсульфонової, бензойної, камфосульфонодину, імідазолідину, піразолідину, піперидину, 1,4вої, лимонної, етансульфонової, фумарової, глюдіоксану, морфоліну, тіоморфоліну, піперазину, 3конової, глюкуронової, глютамової, гіпурової, бропіроліну, тощо, при цьому точка приєднання знамистоводневої, хлористоводневої, ізотіонової, ходиться при будь-якому наявному кільцевому молочної, лактобіонової, малеїнової, яблучної, атомі вуглецю або азоту. манделової, метансульфонової, муцинової, нафТермін «цефалоспорин» використовується у талінсульфонової, нікотинової, азотної, памоєвої, даній заявки так, як це прийнято у галузі техніки пантотенової, фосфорної, сукцинової, сірчаної, винної, п-толуолсульфонової, то що. Особливо для позначення кільцевої системи b-лактаму, що бажаними є лимонна, бромистоводнева, хлорисмає наступну загальну формулу та систему нумерації: товоднева, малеїнова, фосфорна, сірчана та винна кислоти. Термін «їх солі» відноситься до сполук, утворених, коли водень кислоти заміщується катіоном, таким, як катіон металу або органічний катіон, тощо (наприклад, катіон NH/, тощо). Бажано, коли сіль представляє собою фармацевтично прийнятну сіль, проте це не вимагається для солей проміжних сполук, які не призначені для введення пацієнтові. Термін «глікопептидний антибіотик» або «гліТермін «терапевтично ефективна кількість» копептид» використовується у даній заявці так, як відноситься до кількості, достатньої для досягненце прийнято у галузі техніки для позначення класу ня ефекту лікування при введенні пацієнтові, який антибіотиків, відомих як глікопептиди або далбахпотребує такого лікування. пептиди. [Див., наприклад, Р. Нагарайян, «ГлікоТермін «лікування» або «лікувати» як такий, пептидні антибіотики», Марсел Деккер, Інк. (1994) що використовується у контексті даної заявки, відта посилання, які там цитуються]. Характерні гліноситься до лікування захворювання або медичнокопептиди включають ванкоміцин, А82846А (ерего стану (такого, як бактеріальна інфекція) у паціємоміцин), А82846В (хлорорієнтицин А), А82846С, нта, такого, як ссавець (зокрема, людина або РА-42867-А (орієнтицин А), РА-42867-С, PA-42867домашні тварини), який включає: D, тощо. (a) запобігання виникненню захворювання або Термін «ванкоміцин» використовується у даній медичного стану, тобто профілактичне лікування заявці так, як це прийнято у галузі те хніки для попацієнта; значення глікопептидного антибіотику, що відомий (b) полегшення захворювання або медичного як ванкоміцин. У сполуках за даним винаходом стану, тобто усунення хвороби або медичного статочка приєднання зв'язувального залишку знахону або переведення хвороби або медичного стану диться на «С-термінальному кінці» ванкоміцину. пацієнта у більш легку форму; Термін «фармацевтично прийнятна сіль» від(c) пригнічення захворювання або медичного носиться до солі, яка є прийнятною для введення стану, тобто уповільнення або затримання розвитпацієнтові, такому, як ссавець (наприклад, солі, що ку захворювання або медичного стану у пацієнта; мають прийнятну безпеку для ссавців при викориабо стання даного дозового режиму). Такі солі можуть (d) полегшення симптомів захворювання або мати походження від фармацевтично прийнятних медичного стану у пацієнта. неорганічних або органічних основ та від фармаТермін «кількість, що інгібує ріст» відноситься цевтично прийнятних неорганічних або органічних до кількості, яка є достатньою для інгібування роскислот. Солі, що мають походження від фармацету або розмноження мікроорганізму або є достатвтично прийнятних неорганічних основ, включають ньою для спричинення загибелі або лізису мікросолі алюмінію, амонію, кальцію, міді, заліза (III), організму, включаючи грам-позитивні бактерії. заліза (II), літію, магнію, марганцю (III), марганцю Термін «кількість, яка інгібує біосинтез клітин(II), калію, натрію, цинку, тощо. Особливо бажани 23 80098 24 ної стінки» відноситься до кількості, достатньої спеціалістом у даній галузі за допомогою звичайдля інгібування біосинтезу клітинної стінки у мікроних оптимізаційних процедур. організмі, включаючи грам-позитивні бактерії. Крім того, як це зрозуміло спеціалістові у даній Термін «група, що відходить» відноситься до галузі техніки, традиційні захисні групи можуть функціональної групи або атому, що можуть бути бути необхідними або бажаними для запобігання заміщені іншою функціональною групою або атопіддання певних функціональних груп небажаним мом у реакції заміщення, такій, як нуклеофільна реакціям. Вибір прийнятної захисної групи для реакція заміщення. Наприклад, типові групи, що певної специфічної функціональної групи, а також відходять, включають групи хлору, брому та йоду; прийнятні умови для захисту та зняття захисту з групи естерів сульфонових кислот, такі, як мезитаких функціональних груп, добре відомі у галузі лат, тозилат, брозилат, нозилат, тощо; активовані техніки. Захисні групи, відмінні від тих, що проілюгрупи естерів, такі, як 7-азабензотриазол-1-окси, стровані у прописах, описаних у даній заявці, татощо; ацилокси групи, такі, як ацетокси, трифтокож можуть використовуватися, у разі необхідносрацетокси, тощо. ті. Наприклад, багаточисленні захисні групи, їх Термін «їх захищені похідні» відноситься до введення та видалення описані у [Т.В. Гріне та Дж. похідних вказаних сполук, в яких одна або більше Вате «Захисні групи в органічному синтезі» третє функціональних груп сполуки є захищеними від видання, Вілей, Нью-Йорк, 1999, та посилання, які небажаних реакцій за допомогою захисної групи там приводяться]. або блокувальної групи. Функціональні групи, які У бажаному способі синтезу сполуки формули можуть захищатися, включають, наприклад, групи І одержують шляхом реакції глікопептиду формукарбонових кислот, аміногрупи, гідроксильні групи, ли 1; групи тіолу, карбонільні групи, тощо. Характерні захисні групи для карбонових кислот включають естери (такі, як п-метоксибензиловий естер), аміди та гідразиди; для аміногруп захисні групи включають карбамати (такі, як трет-бутоксикарбоніл) та аміди; для гідроксильних груп - етери та естери; для тіолових груп - тіоетери та тіоестери; для карбонільних груп - ацеталі та кеталі; і т.п. Такі захисні групи добре відомі спеціалістові у даній галузі техніки і є добре описаними, наприклад, у [Т.В.Гріне та Дж. Вате «Захисні групи в органічному синтезі» третє видання, Вілей, Нью-Йорк, 1999, та посилання, які там приводяться]. Термін «аміно-захисна група» відноситься до захисної групи, прийнятної для запобігання небажаним реакціям на аміногрупі. Характерні амінозахисні групи включають без обмеження третбутоксикарбоніл (ВОС), тритил (Тr), бензилоксикарбоніл (Cbz), 9-фторенілметоксикарбоніл (Fmoc), форміл, триметилсиліл (TMS), третде R4, R5, R6, R 7, R8, X1 та X2 є такими, як вкабутилдиметилсиліл (TBS) і т. п. зано у даній заявці, або його солі зі сполукою фоТермін «карбокси-захисна група» відноситься до захисної групи, прийнятної для запобігання нермули 2: бажаним реакціям на карбоксигрупі. Характерні карбокси-захисні групи включають без обмеження естери, такі, як метиловий, етиловий, третбутиловий, бензиловий (Вn), п-метоксибензиловий (РМВ), 9-фторфенілметиловий (Fm), триметилсиліловий (TMS), трет-бутилдиметилсиліловий (TBS), дифенілметиловий (бензгідриловий, DPM) і т. п. Загальні способи синтезу де R1, R2, R3 та m є такими, як вказано у даній Поперечно-зв'язані глікопептидзаявці, її сіллю або її захищеною похідною; для цефалоспоринові сполуки за даним винаходом одержання сполуки формули І, її солі або її захиможуть бути одержані з легко доступних вихідних щеної похідної. матеріалів при використанні наступних загальних Звичайно цю реакцію проводять шляхом взаспособів та процедур. При цьому зрозуміло, що ємодії глікопептиду 1 або його солі з приблизно від приведені типові або переважні умови проведення 0,5 до приблизно 1,5 еквівалентами, бажано від процесу (тобто, температури реакції, час, мольне приблизно 0,9 до приблизно 1,1 еквівалентами, співвідношення реагентів, розчинники, тиски, тосполуки формули 2 в інертному розріджувачі, тащо) також можуть використовуватися, якщо не кому, як DMF, при використанні традиційного реавказано інше. Оптимальні умови проведення реагенту для конденсації карбонової кислоти та аміну кції можуть варіювати при використанні індивідуа(пептиду). У цій реакції глікопептид 1 або його сіль льних реагентів або розчинників, але такі умови звичайно спочатку приводять у контакт з конденпроведення реакції можуть бути легко визначені 25 80098 26 суючим реагентом у присутності надлишку, бажано від приблизно 1,8 до приблизно 2,2 еквіваленСхема А тів, аміну, такого, як діізопропілетиламін, при температурі, що коливається у межах від приблизно 20°С до приблизно 25°С, бажано при кімнатній температурі, протягом від приблизно 0,25 до приблизно 3 годин. Бажано, коли надлишок трифтороцтової кислоти (типово приблизно 2 еквіваленти) потім додають для утворення солі TFA з будьяким надлишком діізопропілетиламіну. Реакційну суміш потім, звичайно, охолоджують до температури від приблизно -20°С до приблизно 10°С, бажано до приблизно 0°С і додають проміжну сполуку 2, після цього додають надлишок 2, 4, 6колідину. Цю реакцію, звичайно, проводять при температурі приблизно 0°С протягом від приблизно 1 до приблизно 6 годин, або до тих пір, поки реакцію не буде суттєво завершено. Бажано, коли конденсуючий реагент для використання у цій реакції включає від приблизно 0,5 до приблизно 1,5 еквівалентів, бажано від приблизно 0,9 до приблизно 1,1 еквівалентів, гексафторфосфа ту бензотриазол-1-ілокситрипіролідинфосфонію (РуВОР) та від приблизно 0,5 до приблизно 1,5 еквівалентів, бажано від приблизно 0,9 до приблизно 1,1 еквівалентів, 1-гідроксибензотриазолу (НОВТ) або 1-гідрокси-7азабензотриазолу (НОАТ). Інші прийнятні конденЯк проілюстровано на Схемі А, триазолову суючі реагенти включають гексафторфосфат О-(7проміжну сполуку 3 (в якій R9 представляє собою азабензотриазол-1-іл)-N,Ν,Ν',N'-тетраметилуронію аміно-захисну гр упу, таку, як групу тритилу, a R10 (HATU); хлорид біс(2-оксо-3представляє собою карбокси-захисну гр упу, таку, оксазолідиніл)фосфіну (BOP-СІ), азид дифенілфояк етилова група) спочатку піддають реакції з wсфорилу (DPPA); хлорид дифенілфосфіну; ди фефункціоналізованим аміном формули 4 (в якому R1 нілхлорфосфат (DPCP) та НОАТ; пентафторфеніл та R2 є такими, як визначено у даній заявці, R11 дифенілфосфінат, і т. п. представляє собою аміно-захисну груп у, таку, як Після закінчення реакції конденсації будь-яку груп у трет-бутоксикарбонілу (ВОС), a Z1 є групою, захисну гр упу, що присутня у продукті, потім видащо відходить, такою, як хлор, бром, йод, мезилат, ляють при використанні традиційних способів та тозилат і т. п.) для одержання після видалення реагентів. Після завершення цієї реакції продукт карбокси-захисної групи (тобто, R10) проміжної реакції, тобто сполуку формули І, ізолюють та сполуки формули 5а. очищають при використанні традиційних способів, Цю реакцію, звичайно, проводять спочатку таких, як колонкова хроматографія, HPLC, перешляхом приведення у контакт сполуки 3 з від прикристалізація, і т. п. близно 1,0 до приблизно 1,1 еквівалентами, переГлікопептиди формули 1, прийнятні для виковажно з від приблизно 1,02 до приблизно 1,06 екристання у згаданому вище способі, є або комервівалентами, сполуки формули 4 в інертному ційно доступними, або вони можуть бути приготорозріджувачі, такому, як DMF у температурному влені шляхом ферментації прийнятного організму, інтервалі від приблизно 0°С до приблизно 50°С, що продукує глікопептид, після цього глікопептид бажано при кімнатній температурі, протягом від ізолюють з одержаного ферментаційного бульйону приблизно 0,5 до приблизно 6 годин, або до тих при використанні відомих у галузі те хніки способів пір, поки реакцію не бути суттєво завершено. Цю та обладнання. реакцію типово проводять у присутності надлишку, Цефалоспоринову проміжну сполуку формули бажано від приблизно 1,1 до приблизно 5 еквіва2, що використовується в описаному вище способі, лентів, основи, такої, як карбонат цезію. Крім того, легко одержують з комерційно доступних вихідних коли Z1 представляє собою хлор або бром, а катаматеріалів та реагентів при використанні традилітична кількість бажано складає від приблизно 0,2 ційних способів. Наприклад, проміжна сполука до приблизно 0,5 еквівалентів, то йодид триалкіформули 2 може бути одержана так, як показано ламонію, такий, як йодид тетрабутиламонію, нена Схемі А: обов'язково додають для покращення реакції шляхом одержання похідної сполуки йоду 4 in situ. 27 80098 28 приблизно 6 годин, або до тих пір, поки реакцію не Видалення карбокси-захисної групи (тобто, буде суттєво завершено, для одержання проміжR10) потім приводить до утворення проміжної споної сполуки 7. Для уникнення ізомеризації цю реалуки 5а. Наприклад, коли карбокси-захисна група кцію бажано проводити при температурі -35°С, представляє собою алкіловий естер, наприклад, використовуючи 2, 4, 6-колідин як основу. етилову груп у, то естер легко гідролізується до Проміжну сполуку 7 потім піддають реакції з карбонової кислоти шляхом приведення у контакт піридином або заміщеним піридином для одерестеру з надлишком, переважно з від приблизно жання проміжної сполуки 8, в якій R3 та n є такими, 1,1 до приблизно 2,5 еквівалентами, гідроксиду як визначено у даній заявці. Цю реакцію, звичайно, лужного металу, такого, як гідроксид натрію або спочатку проводять шляхом обміну атома хлору у гідроксид калію. Цю реакцію типово проводять в сполуці 7 на атом йоду шляхом приведення у конінертному розчиннику, такому, як етанол, при темтакт сполуки 7 з приблизно одним еквівалентом пературі, що коливається від приблизно 0°С до йодиду натрію в ацетоні (реакція Фінкельштейна) приблизно 100°С протягом від приблизно 0,5 до або DMF при кімнатній температурі протягом від приблизно 6 годин, або до тих пір, поки реакцію не приблизно 0,25 годин до приблизно 2 годин. Одебуде суттєво завершено, для отримання проміжної ржану проміжну сполуку йоду, звичайно, не ізолюсполуки формули 5а. ють, а піддають реакції в in situ з від приблизно 1,1 Тіалозові сполуки формули 3 є комерційно додо приблизно 1,6 еквівалентами піридину або заступними від, наприклад, Aldrich, Milwaukee, Wi, міщеного піридину для одержання сполуки форабо можуть бути одержані з комерційно доступних мули 8. Звичайно цю реакцію проводять при кімвихідних матеріалів та реагентів при використанні натній температурі протягом від приблизно 1 до традиційних способів. приблизно 12 годин, або до тих пір, поки реакцію не буде суттєво завершено. Піридин або заміщені Подібно до цього, w-функціоналізовані аміни піридини, що використовують у цій реакції, є комеформули 4 можуть бути легко одержані з комеррційно доступними або можуть бути одержані з ційно доступних вихідних матеріалів та реагентів комерційно доступних вихідних матеріалів та реапри використанні звичайних процедур. Переважні гентів при використанні стандартних способів. Тисполуки формули 4 включають, наприклад, такі, що приводяться для ілюстрації, N-ВОС-3пові піридинові похідні для використання у цій реакції включають піридин, 2-піколін, 3-піколін, 4бромпропіламін; N-ВОС-6-йодгексиламін; N-ВОСпіколін, 2-метоксипіридин, 3-метоксипіридин, 42-(2-йодетокси)етиламін; N-BOC-4метоксипіридин, 2-тіометоксипіридин, 3(йодметил)бензиламін; і т.п. Ці сполуки можуть тіометоксипіридин, 4-тіометоксипіридин, 4бути легко одержані з комерційно доступних ви хідних матеріалів при використанні добре відомих карбокситіометоксипіридин, 2-фторпіридин, 3фторпіридин, 4-фторпіридин, 2-хлорпіридин, 3реагентів та умов реакції. хлорпіридин, 4-хлорпіридин, 2-фенілпіридин, 3Проміжну сполуку 5а потім піддають хлоруфенілпіридин, 4-фенілпіридин, 4ванню для одержання сполуки 5b. Цю реакцію, циклопропілІпіридин, нікотинову кислоту, ізонікозвичайно, проводять шляхом приведення у контакт сполуки 5а з приблизно від 1,0 до приблизно тинову кислоту, нікотинамід, ізонікотинамід, 2,3лутидин, 3,4-лутидин, 3,5-лутидин, 3,41,2 еквівалентами хлорувального агенту, такого, диметоксипіридин, 4-метокси-3-метилпіридин, 4як N-хлорсукцинамід, в інертному розріджувачі, фтор-3-метоксипіридин, 2,3-циклопентенпіридин, такому, як хлороформ або DMF, при кімнатній те2,3- циклогексенпіридин і т. п. мпературі протягом приблизно від 6 до приблизно 24 годин, або до тих пір, поки реакцію не буде сутАльтернативно, проміжну сполуку формули 5b можна конденсувати зі сполукою формули 9: тєво завершено. Проміжну сполуку 5-хлор-1,3-тіазолу формули 5b потім піддають конденсації з проміжною сполукою 6 (в якій R12 представляє собою водень або прийнятну карбокси-захисну гр упу, таку, як група п-метоксибензилу), для одержання проміжної сполуки 7. Коли R12 представляє собою пметоксибензил, то проміжна сполука 6 є комерційно доступною від Otsuka, Japan. Звичайно цю реаде R3, R12 та m є такими, як визначено у даній кцію проводять шляхом приведення у контакт спозаявці, для одержання проміжної сполуки 8. Цю луки формули 5b з приблизно від 0,8 до приблизно реакцію типово проводять шляхом приведення у 1 еквівалентами сполуки 6 у присутності конденконтакт сполуки 5b з від приблизно 0,9 до приблисуючого реагенту в традиційних умовах проведензно 1,1 еквівалентами проміжної сполуки 9 або її ня реакції конденсації. Бажаний конденсуючий солі в інертному розчиннику, такому, як DMF, у реагент для цієї реакції представляє собою фосприсутності конденсуючого реагенту, такого, як 1форний оксихлорид (типово, у кількості від при(3-диметиламінопропіл)-3-етилкарбодіімід (EDC); близно 1,1 до приблизно 1,2 еквівалентів), бажаРуВОР та НОАТ або НОВТ; H ATU; BOP-CI; DPPA; ною також є надлишкова кількість аміну, такого, як DPCP та НОАТ; і т.п. Звичайно реакцію конденса2, 4, 6-колідин або діізопропілетиламін. Реакцію ції проводять при температурі, що коливається в конденсації типово проводять в інертному розрімежах від приблизно -40°С до приблизно 25°С джувачі, такому, як THF, при температурі, що копротягом від приблизно 1 до приблизно 12 годин ливається в межах від приблизно -50°С до приабо до тих пір, поки реакцію не буде суттєво завеблизно 25°С, протягом від приблизно 0,5 до 29 80098 30 ршено. Сполуки формули 9 легко одержують з їх суміші при значенні рН, що коливається від припроміжної сполуки б шляхом піддання сполуки близно 4 до приблизно 6,5. Цю реакцію, звичайно, формули 6 реакції з піридином або заміщеним проводять при температурі, що коливається від піридином в умовах реакції, які подібні до тих, що приблизно -20°С до приблизно 40°С протягом від описані у даній заявці. приблизно 1 до приблизно 6 годин, або до тих пір, Видалення захисних груп з проміжної сполуки поки реакцію не буде суттєво завершено. 8 при використанні стандартних способів та реагеПохідні ванкоміцину формули 10, що викориснтів забезпечує одержання цефалоспоринової товуються у цій реакції, можуть бути легко одерпроміжної сполуки 2. Наприклад, коли R9 предстажані шляхом конденсування ванкоміцину або його вляє собою тритил, R11 представляє собою третсолі з фталімідною похідною формули: бутоксикарбоніл, a R12 є пара-метоксибензилом, то захисні групи традиційно видаляють шляхом обробки сполуки 8 надлишком трифотороцтової кислоти та надлишком анізолу або триетилсилану в інертному розріджувачі, такому, як дихлорметан або гептан, при кімнатній температурі протягом від приблизно 1 до приблизно 12 годин, або до тих де R1 є таким, як визначено у даній заявці, у пір, поки реакцію не буде завершено. Одержану традиційних умовах здіснення реакції конденсації. цефалоспоринову сполуку 2, звичайно,ізолюють Наприклад, цю реакцію, звичайно, проводять шлята очищають при використанні стандартних прохом приведення у контакт ванкоміцину з від прицедур, таких, як преципітація, ліофілізація та HPLC близно 1,1 до приблизно 1,2 еквівалентами фталізі зворотною фазою. мідної сполуки у присутності конденсуючого Альтернативно, сполуки формули І можуть буреагенту, такого, як РуВОР та НОАТ і т.п., та прити одержані шляхом піддання реакції глікопептидйнятної основи, такої, як діізопропілетиламін. Звиної похідної формули 10: чайно реакцію проводять в інертному розріджувачі, такому, як DMF, при температурі, що коливається від приблизно -20°С до приблизно 40°С протягом від приблизно 0,5 до приблизно 6 годин або до тих пір, поки реакцію не буде суттєво завершено. Фталімідні сполуки, що використовуються у цій реакції, легко можна одержані при використанні традиційних процедур та реагентів. Цефалоспоринові похідні формули 11 можуть бути одержані, наприклад, шляхом конденсації сполуки формули 9, що описана вище, зі сполукою тіазолу формули 12: або її солі, де R1, R2, R4, R5, R6, R7, R8, X1 та X2 є такими, як визначено у даній заявці, з цефалоспориновою похідною формули 11: її сіллю або її захищеною похідною (при цьому R3 та m є такими, як визначено у даній заявці) для одержання сполуки формули І або її солі. Цю реакцію, звичайно, проводять шляхом приведення у контакт сполуки 10 з від приблизно 1 до приблизно 1,5 еквівалентами сполуки 11 в інертному розріджувачі, такому, як вода, метанол або або її сіллю, де R13 представляє собою водень або аміно-захисну групу (таку, як група формілу або тритилу). Реакцію конденсації, звичайно, проводять шляхом приведення у контакт сполуки 9 з від приблизно 0,9 до приблизно 1,1 еквівалентами сполуки 12 в інертному розріджувачі, такому, як DMF, у присутності конденсуючого агенту, такого, як EDC та НОАТ, та прийнятної основи, такої, як 2, 4, 6-колідин. Звичайно цю реакцію проводять при температурі, що коливається від приблизно -20°С до приблизно 20°С, протягом приблизно від 0,5 до приблизно 6 годин, або до тих пір, поки реакцію не буде суттєво завершено. Крім того, сполуки формули І можуть бути одержані шляхом піддання реакції глікопептидної похідної формули 13: 31 80098 32 шляхом інгаляції або парентеральне введення, буде добре відомим спеціалістові у галузі фармацевтичної науки. Крім того, інгредієнти для таких композицій є комерційно доступними, наприклад, від [Sigma, P.O.Box 14508, St. Louis, МО 63178]. З метою подальшої ілюстрації можна навести традиційні способи створення композицій, що описані у [«Фармацевтичних науках Ремінгтона», Mace Publishing Co., Філадельфія, PA 17-е вид. (1985) та у «Сучасній фармацевтиці» Марсел Деккер, Інк. 3є видання (G.S.Banker та C.T.Rhodes, ред.)]. Фармацевтичні композиції за даним винаходом будуть, звичайно, містити терапевтично ефективну кількість сполуки формули І або її фармацевтично прийнятної солі. Типово, такі фармацевтичні композиції будуть містити від приблизно 0,1мас.% до приблизно 90мас.% активного агенту, звичайно, від приблизно 10% до приблизно 30% активного агенту. Бажані фармацевтичні композиції за даним винаходом є такими, що є прийнятними для парентерального введення, зокрема, для внутрішньоабо її сіллю, де R 1, R, R4, R5, R6, R7, R8, X1 та венного введення. Такі фармацевтичні композиції, X2 є такими, як визначено у даній заявці, зі сполузвичайно, включають стерильний, фізіологічно кою формули 9, що представлена вище, для одеприйнятний водний розчин, що містить терапевтиржання сполуки формули І або її солі. чно ефективну кількість сполуки формули І або її Цю реакцію конденсації, звичайно, проводять фармацевтично прийнятої солі. шляхом приведення у контакт сполуки 13 з конФізіологічно прийнятні водні розчини носіїв, що денсуючим реагентом, таким, як DIPC та НОАТ, та є придатними для використання при внутрішньоз від приблизно 0,5 до приблизно 2 еквівалентами венному введенні активних агентів, є добре відосполуки 9 в інертному розріджувачі, такому, як мими у даній галузі техніки. Такі водні розчини DMF, у присутності прийнятної основи, такої, як 2, включають, наприклад, 5% декстрози, розчини 4, 6-колідин. Звичайно цю реакцію проводять при Рінгера (розчин Рінгера з лактатом для ін'єкції, температурі, що коливається від -20°С до приблирозчин Рінгера для ін'єкції, що містить лактат плюс зно 40°С, протягом від приблизно 1 до приблизно 5% декстроза, ацильований розчин Рінгера для 6 годин, або до тих пір, поки реакцію не буде сутін'єкцій), Нормосол-М, Ізоліт Е, і т.п. тєво завершено. Необов'язково такі водні розчини можуть місСполуку формули 13, що використовується у тити співрозчинник, наприклад, поліетиленгліколь; цій реакції, легко одержують шляхом конденсації хелатуючий агент, наприклад, етилендіамін тетраванкоміцину з проміжною сполукою 5Ь, що описаоцтову кислоту; солюбілізуючий агент, наприклад, на вище, використовуючи стандартні процедури циклодекстрин; антиоксидант, наприклад, метабіконденсації, що описані у даній заявці. сульфіт натрію, і т. п. Інші деталі стосовно специфічних умов реакЯкщо це є бажаним, то водні фармацевтичні цій та способів одержання характерних сполук за композиції за даним винаходом можуть бути ліоданим винаходом або їх проміжних сполук описані філізовані та відповідним чином відтворені перед у Прикладах, що представлені нижче. введенням. У бажаному втіленні фармацевтична Фармацевтичні композиції композиція представляє собою ліофілізовану комПоперечно-зв'язані глікопептидпозицію, що містить фармацевтично прийнятний цефалоспоринові сполуки згідно з даним винахоносій та терапевтично ефективну кількість сполуки дом, звичайно, вводяться пацієнтові у формі фарформули І або її фармацевтично прийнятної солі. мацевтичної композиції. Згідно з цим, в одному з Бажано, коли носій у цій композиції включає сахааспектів даний винахід спрямований на фармацерозу, манітол, декстрозу, декстран, лактозу або їх втичну композицію, що містить фармацевтично комбінацію. Більш бажано, коли носій включає прийнятний носій або наповнювач та терапевтичсахарозу, манітол або їх комбінацію. но ефективну кількість сполуки формули І або її В одному втіленні фармацевтичні композиції фармацевтично прийнятної солі. за даним винаходом містять циклодекстрин. При Будь-який традиційний носій або наповнювач використанні у фармацевтичних композиціях за може використовуватися у фармацевтичній комподаним винаходом циклодекстрин бажано предстазиції за даним винаходом. Вибір специфічного вляє собою гідроксипропіл-b-циклодекстрин або носія або наповнювача, або комбінації носіїв або сульфобутиловий етер b-циклодекстрину. У таких наповнювачів буде залежати від способу введенкомпозиціях циклодекстрин буде складати від ня, що використовується для лікування окремого приблизно 1 до приблизно 25мас.%; переважно пацієнта, або від типу бактеріальної інфекції. В від 2 до 10мас.% композиції. Крім того, вагові співзв'язку з цим, приготування прийнятної фармацеввідношення циклодекстрину та активного агенту тичної композиції для специфічного способу ввебудуть, звичайно, коливатися від приблизно 1:1 до дення, такого, як пероральне, місцеве, введення приблизно 10:1. 33 80098 34 Фармацевтичні композиції за даним винахопературі. дом бажано упаковують у вигляді однодозової Композиція Приклад С форми. Термін „однодозова форма" відноситься Розчин, прийнятний для внутрішньовенного до фізіологічно дискретної одиниці, прийнятної введення пацієнтові, одержують з композиції Придля дозування пацієнтові, наприклад, кожна одикладу В, яка описана вище, так як зазначено нижниця, що містить задану кількість активного агенту, че: розраховується таким чином, що викликати бажаТиповий пропис: Ліофілізований порошок комний терапевтичний ефект при використанні самопозиції Прикладу В (що містить, наприклад, від 10 стійно або у комбінації з однією або більше додатдо 1000мг активного інгредієнту) відтворювали за ковими одиницями. Наприклад, такі однодозові допомогою 20мл стерильної води, а одержаний форми можуть бути запаковані у стерильні, гермерозчин далі розводили 80мл стерильного фізіолотично закриті ампули, і т. п. гічного розчину у ємності для інфузії об'ємом Наступні композиції ілюструють характерні 100мл. Розведений розчин потім вводили пацієнфармацевтичні композиції за даним винаходом: тові внутрішньовенно протягом від 30 до 120 хвиКомпозиція Приклад А лин. Заморожений розчин, прийнятний для пригоВикористання тування розчину для ін'єкції, готували так, як опиПоперечно-зв'язані глікопептидсано далі: цефалоспоринові сполуки за даним винаходом є корисними як антибіотики. Наприклад, сполуки за даним винаходом є корисними для лікування бакІнгредієнти Кількість теріальних інфекцій та запобігання бактеріальним Активна сполука Від 10 до 1000мг інфекціям та іншим клінічним станам у ссавців, що Наповнювач (наприклад, декВід 0 до 50г пов'язані з бактеріями, включаючи людину та достроза) машніх тварин (тобто, собак, котів, тощо), які Вода для ін'єкційного розчину Від 10 до 100мл спричинені мікроорганізмами, чутливими до сполук за даним винаходом. Типовий пропис: Наповнювачі, у разі присутЗгідно з цим, в одному з аспектів, що стосуності, розчиняють приблизно у 80% води для ін'єкються способу, даний винахід забезпечує спосіб цій, а після цього додають та розчиняють активну лікування бактеріальної інфекції у ссавців, при сполуку. Значення рН доводять за допомогою 1М цьому вказаний спосіб включає введення ссавцеві, гідроксиду натрію до 3-4,5, а об'єм потім доводять що потребує такого лікування, фармацевтичної до 95% заключного об'єму водою для ін'єкцій. Пекомпозиції, що містить фармацевтично прийнятревіряють значення рН та доводять, у разі необний носій та терапевтично ефективну кількість хідності, об'єм водою для ін'єкцій. Потім композисполуки формули І або її фармацевтично прийнятцію стерильно фільтрують через фільтр з ної солі. розміром пор 0,22 мікрони та поміщають у стериДля ілюстрації можна сказати, що сполуки за льну пробірку в асептичних умовах. Пробірку заданим винаходом є особливо корисними для лікукривають, мітять та зберігають у замороженому вання інфекцій або запобігання інфекціям, спричивигляді. нених грам-позитивними бактеріями та споріднеКомпозиція Приклад В ними мікроорганізмами. Наприклад, сполуки за Ліофілізований порошок, прийнятний для приданим винаходом є ефективними для лікування готування розчину для ін'єкції, готують так, як опиінфекцій або запобігання інфекціям, спричинених сано далі: певними Enterococcus spp.; Staphylococcus spp., включаючи стафілококки негативні за коагулазою Інгредієнти Кількість (CNS); Streptococcus spp.; Listeria spp.; Clostridium Активна сполука Від 10 до 1000мг ssp.; Bacillus spp.; і т.п. Приклади видів бактерій, Наповнювач (наприклад, маніщо піддаються ефективному лікуванню за допомоВід 0 до 50г тол та/або сахароза) гою сполук за даним винаходом включають, але Буферний агент (наприклад, не обмежені, стійкий до метициліну Staphylococcus Від 0 до500мг цитрат) aureus (MRSA); чутливий до метициліну Вода для ін'єкційного розчину Від10 до 100мл Staphylococcus aureus (MSSA); чутливий до проміжних сполук глікопептиду Staphylococcus aureus Типовий пропис: Наповнювачі та/або буферні (GISA); стійкий до метициліну Staphylococcus агенти, у разі присутності, розчиняють приблизно у epidermitis (MRSE); чутли вий до метициліну 60% води для ін'єкцій. Активну сполуку додають та Staphylococcus epidermitis (MSSE); чутли вий до розчиняють, а значення рН доводять за допомованкоміцину Enterococcus faecalis (EFSVS); чутлигою 1М гідроксиду натрію до 3-4,5, потім об'єм довий до ванкоміцину Enterococcus faecium (EFMVS); водять до 95% заключного об'єму водою для ін'єкстійкий до пеніциліну Streptococcus pneumoniae цій. Перевіряють значення рН та доводять його, у (PRSP); Streptococcus pyogenes; і т. п. Сполуки за разі необхідності, об'єм доводять водою для ін'єкданим винаходом є менш ефективними або не цій. Композицію потім стерильно фільтрують через ефективними для лікування інфекцій або запобіфільтр з розміром пор 0,22 мікрони та поміщають у гання інфекціям, спричинених штамами бактерій, стерильну пробірку в асептичних умовах. Компоякі є стійкими як до ванкоміцину, так і до цефалосзицію потім висушують заморожуванням при викопоринів. ристанні прийнятного циклу ліофілізації. Пробірку Характерні типи інфекцій або медичних станів, закривають, мітять та зберігають при низькій темпов'язаних з бактеріями, які можуть лікуватися або 35 80098 36 яким можна запобігати за допомогою сполук за терій, включаючи лізис бактерій. даним винаходом, включають, але не обмежені, У доповнення до несподіваних та неочікуваних інфекції шкіри та структур шкіри, інфекції сечового антибактеріальних властивостей сполуки за даним тракту, пневмонію, ендокардит, інфекції, пов'язані винаходом володіють прийнятною безпекою для з введенням катетера у кровоносну систему, осссавців та прийнятною розчинністю у воді. Крім теомієліт, і т. п. При лікуванні таких станів пацієнт того, сполуки за даним винаходом були показані може бути вже інфікованим мікроорганізмами, які як такі, що володіють несподіваним та неочікувапіддають обробці, або просто є чутливими до інним швидким впливом, спрямованим проти певних фекцій, у цьому випадку активний агент вводиться бактерій, включаючи стійкі до метициліну з профілактичною метою. Staphylococci aureus (MRSA) та стійкі до метициліСполуки за даним винаходом звичайно ввону Staphylococci epidermitis (MRSE). Ці властивосдяться в терапевтично ефективній кількості за ті, а також використання сполук за даним винаходопомогою одного з прийнятних шляхів введення. дом як антибіотиків, можуть бути Бажано, коли сполуки вводяться парентерально. продемонстровані при використанні разноманітних Сполуки можуть вводитися у вигляді однієї добоаналізів in vitro та in vivo, що добре відомі спеціавої дози або декількома дозами на день. Режим лістові у даній галузі. Наприклад, типові аналізи лікування може вимагати введення протягом триописані більш детально у наступних Прикладах. валих періодів часу, наприклад, протягом декільПриклади кох днів або протягом періоду часу від одного до Наступні приклади, що ілюструють синтез та шести тижнів або довше. Кількість активного агенбіологічну активність, запропоновані для ілюстрату, що вводиться у складі однієї дози, або загальції даного винаходу, але вони не повинні сприймана кількість, що вводиться, буде типово визначатися як такі, що можуть обмежити об'єм даного тися лікарем та буде залежати від таких факторів, винаходу. У Прикладах, що приведені нижче, наяк природа та тяжкість інфекції, вік та загальний ступні абревіатури мають наступні значення, якщо стан здоров'я пацієнта, толерантність пацієнта до не вказано інше. Абревіатури, які не визначені активного агента, мікроорганізму(ів), що спричинижче, мають своє загальновживане розуміння. нюють інфекцію, способу введення і т.п. ВОС = трет-бутокси карбоніл Взагалі прийнятні дози будуть коливатися у CFU = колонієутворювальних одиниць межах від приблизно 0,25 до приблизно DCM = ди хлорметан 10,0мг/кг/день активного інгредієнту, бажано від DIPEA = діізопропілетиламін приблизно 0,5 до приблизно 2мг/кг/день. Для сеDMF = Ν,Ν-диметилформамід редньої ваги людини, що складає 70кг, ця кількість DMSO = диметилсульфоксид буде складати від приблизно 15 до приблизно EtOAc = е тилацетат 700мг на день активного агенту, або бажано від HOAT = 1-гідрокси-7-азабензотріозол приблизно 35 до приблизно 150мг на день. HPLC = високоефективна рідинна хроматогКрім того, сполуки за даним винаходом є еферафія ктивними для інгібування росту бактерій. У цьому МІС = мінімальна інгібувальна концентрація втіленні бактерії контактують або в умовах in vitro MS = мас-спектрометрія або в умовах in vi vo з такою кількістю сполуки фоРМВ = п-метоксибензил рмули І або її фармацевтично прийнятної солі, що РуВОР = гексафторфосфа т бензотріазол-1інгібує ріст бактерій. Звичайно кількість сполуки, ілокситрипіролідино-фосфонію що інгібує ріст бактерій, буде коливатися в межах THF = тетрагідрофуран від приблизно 0,008мкг/мл до приблизно 50мкг/мл; TLC = тонкошарова хроматографія бажано від приблизно 0,008мкг/мл до приблизно TFA = трифтороцтова кислота 25мкг/мл; та більш бажано від приблизно Усі температури, які наведені у наступних при0,008мкг/мл як зменшення або відсутність розкладах, вказані у градусах Цельсія (°С), якщо не множення бактерій та/або шляхом лізису бактерій, вказано інше. Якщо не вказано інше, реагенти, тобто, як зменшення кількості колонієвихідні матеріали та розчинники одержують від утворювальних одиниць у даному об'ємі (тобто, на комерційних постачальників (таких, як Aldrich, мл) протягом даного періоду часу (тобто, за годиFluka, Sigma, тощо), вони використовуються без ну) у порівнянні з бактеріями, які не піддавали обпопередньої очистки. Гідрохлорид напівгідрату робці. ванкоміцину одержують від Alpharma, Inc., Fort Сполуки за даним винаходом є також ефектиLee, NJ 07024 (Alpharma AS, Oslo, Norway). вними для інгібування біосинтезу клітинної стінки у HPLC зі зворотною фазою типово проводять бактерій. У цьому втіленні бактерії піддають контапри використанні C18 колонки та (А) 98% води, 2% кту або в умовах in vitro або в умовах in vivo з кільацетонітрилу, 0,1% TFA, зростаючого градієнту кістю сполуки формули І або її фармацевтично (наприклад, від 0 до приблизно 70%) (В) 10% води, прийнятної солі, що інгібує біосинтез клітинної сті90% ацетонітрилу, 0,1% TFA, якщо не вказане іннки. Звичайно кількість сполуки, що інгібує біосинше. тез клітинної стінки, буде коливатися в межах від Приклад А приблизно 0,04мкг/мл до приблизно 50мкг/мл; баСинтез солі біс-трифтороцтової кислоти та жано від приблизно 0,04мкг/мл до приблизно (7R)-7-[(Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(325мкг/мл; та більш бажано від приблизно амінопропоксііміно)ацетамідо]-3-[(10,04мкг/мл до приблизно 10мкг/мл. Інгібування піридиніо)метил]-3-цефем-4-карбоксилату біосинтезу клітинної стінки у бактерій типово виявВказаний синтез ілюструється, частково, Схеляється при інгібуванні або відсутності росту бакмою А, що приведена вище. 37 80098 38 Етап 1 - Одержання N-(трет-бутоксикарбоніл)вказаної у назві проміжної сполуки у вигляді тонко3-бромпропіламіну (тобто. Сполуки 4, де R1 предго білувато го порошку. 1 ставляє собою -(СН2)3-, R2 представляє собою Н ЯМР (ДМСО-d6, 300МГц): d = 1,01-1,1 (т, водень, R11 представляє собою ВОС, a Z1 пред3Н), 1,31 (с, 9Н), 1,60-1,70 (т, 2Н), 2,94-2,99 (м, 2Н), ставляє собою бром). 3,95-4,04 (м, 4Н), 6,77-6,81 (т, 1Η), 6,95 (с, 1Н), Гідробромід 3-бромпропіламіну (100г, 7,16-7,38 (м, 15Н), 8,80 (с, 1Н). 457ммолів) суспендували у 1,6л безводного THF. MS m/z: 615,4 [M+H]+. Цю суміш охолоджували до температури 0°С на Етап 3 Одержання (Z)-2-(2бані з льодом та енергійно перемішували у той трифенілметиламінотіазол-4-іл)-2-(3-М-ВОСчас, як додавали 190мл триетиламіну. До цієї суамінопропоксиіміно) ацетату (тобто. Сполуки 5а, в міші по краплях додавали ангідрид третякій R1 представляє собою -(СН2)3-, R2 представбутоксикарбонілу (112г, 516ммолів) у 200мл THF. ляє собою водень. R9 є трифенілметилом. R11 Крижану баню залишали нагріватися до кімнатної представляє собою ВОС, а А є воднем) температури, і суміш перемішували протягом ночі, Етиловий естер (84,2г, 137ммолів), одержаний за цей час TLC показувало, що реакцію було завена Етапі 2, що описаний вище, суспендували у ршено. Потім суміш фільтрували, а фільтрат під400мл безводного етанолу та підігрівали на масдавали концентруванню від вакуумом. Олію, що ляній бані до температури 80°С при перемішуванзалишилася, розводили за допомогою 1500мл ні. Після того, як весь матеріал розчинявся, по гексану та зберігали при температурі -20°С протякраплях додавали гідроксид калію (23,1г, гом 3 днів. Потім суміш піддавали декантуванню, 411ммолів) у 150мл етанолу до розчину протягом твердий осад, що залишився, висушували під ва20 хвилин. Преципітат починав утворюватися чекуумом для одержання 101г (94% виходу) вказаної рез 10 хвилин після того, як додання основи було у назві проміжної сполуки у вигляді кристалічної закінчено, протягом подальших 10 хвилин суміш білої твердої речовини. перетворювалася на тверду речовину. Суміш ви1 Н ЯМР (ДМСО-d6, 300МГц): d = 1,35-1,39 (с, даляли з масляної бані та охолоджували на кри9Н), 1,91-1,95 (м, 2Н), 2,99-3,04 (т, 2Н), 3,43-3,52 жаній бані. Етилацетат та воду додавали до охо(т, 2Н), 6,95-6,99 (т, 1Н). лодженої суміші, яку потім переносили в роздільну Етап 2 Одержання етил (Z)-2-(2лійку. Суміш промивали за допомогою 1N фосфотрифенілметиламінотіазол-4-іл)-2-(3-N-ВОСрної кислоти, що спричинює утворення білої тверамінопропоксііміно)ацетату (тобто, етилового есдої речовини (Примітка: промивання продукту за теру Сполуки 5а, де R1 представляє собою -(СН2)3допомогою більш сильної кислоти, такої, як 1N , R2 представляє собою водень, R9 представляє НСІ, спричинює деструкцію продукту). Воду додасобою трифенілметил, R11 є ВОС, а А представляє вали до роздільної лійки для розчинення цієї тверсобою водень) дої речовини, а органічний шар потім промивали Гідрохлорид етил(Z)-2-(2за допомогою насиченого водного розчину бікартрифенілметиламінотіазол-4-іл)-2-(3-N-ВОСбонату натрію та за допомогою сольового розчину. амінопропоксиіміно)ацетату (100г, 202,4ммолі) Органічний шар висушували над сульфатом нарозчиняли у 700мл безводного DMF. До цієї перетрію, фільтрували під вакуумом для одержання мішаної суміші додавали карбонат цезію (230,8г, вказаної у назві проміжної сполуки (80г, вихід 708,5ммоля), після цього додавали йодид тетра99% ) у ви гляді темної жовтої твердої речовини. бутиламонію (18,7г, 50,6ммолів). N-ВОС-3Етап 4 Одержання (Z)-2-(2бромпропіламін (50,6г, 212,5ммолів) у DMF трифенілметиламіно-5-хлортіазол-4-іл)-2-(3-N(100мл) потім додавали по краплях протягом 30 ВОС-амінопропоксиіміно) ацетату (тобто, Сполуки хвилин. Суміш перемішували протягом двох годин, 5b, в якій R1 представляє собою -(СН2)3-, R2 предпротягом яких HPLC показувало, що реакцію було ставляє собою водень, R9 є трифенілметилом, R11 завершено. Суміш потім фільтрували, а фільтр представляє собою ВОС, а А є хлором) промивали за допомогою 200мл DMF. Фільтрат Проміжну сполуку, одержану на Етапі 3, що розчиняли в 2л етилацетату та промивали за доописаний вище (10г, 17,04ммолів) розчиняли у помогою 700мл 1N НСІ, а потім 700мл насиченого 70мл хлороформу та перемішували у той час, як водного розчину бікарбонату натрію, а на завердодавали твердий N-хлорсукцинімід (2,28г, шення - за допомогою 500мл сольового розчину. 17,04ммолів) (Примітка: експерименти передбаОрганічний шар висушували над сульфатом начають, що надлишок NCS може приводити до трію, фільтрували та концентрували під вакуумом. утворення небажаних побічних продуктів). Суміш Масло, що залишилося, розчиняли у 250мл кипляперемішували протягом ночі (мінімум 15 годин), за чого етанолу та виливали у мензурку. Після того, цей час HPLC показувало, що реакцію було завеяк матеріал повністю охолоджувався, глиноподібршено. Потім суміш концентрували під вакуумом, а ну тверду речовину, що залишилася, поміщали у залишок розчиняли у мінімальній кількості DMF. лійку Бюхнера та промивали за допомогою 50мл Цю суміш додавали до води, яку піддавали енеретанолу, попередньо охолодженого до температугійному перемішуванню, для утворення преципітари -20°С (Примітка: продукт є помірно розчинним в ту, який потім збирали шляхом фільтрації. Тверду етанолі, і використання більших кількостей буде речовину висушували на повітрі для одержання зменшувати загальний вихід кінцевого продукту). 9,5г (вихід - 90%) вказаної у назві проміжної сполуПісля висушування на повітрі тверду речовину, що ки у вигляді жовто-коричневої твердої речовини. 1 залишилася, подрібнювали у тонкий порошок за НЯМР показувало тільки незначну кількість сукдопомогою ступки та товкачика, а потім висушувациніміду, що залишився (Примітка: ізоляція хлороли під вакуумом для одержання 117г (вихід - 94%) ваного продукту не є необхідною умовою для ус 39 80098 40 пішної конденсації на наступному етапі, але експіридиніо)метил]-3-цефем-4-карбоксилату, (тобто. перименти передбачають, що сукцинімід, який Сполуки 8. в якій R1 представляє собою -(СН2)3-, залишився, може перешкоджати подальшому заR2 представляє собою водень, R9 є трифенілмеміщенню піридину). Альтернативно, після того, як тилом, R11 представляє собою ВОС, R12 представреакцію хлорування було завершено, реакційну ляє собою п-метоксибензил, a m дорівнює 0) суміш промивали водою (3х), сольовим розчином, Проміжну сполуку, одержану на Етапі 5 (500мг, а потім висушують над безводним сульфатом на0,514ммоля), розчиняли в 2мл безводного ацетону трію. Цей розчин потім фільтрували та концентрута захищали від світла при використанні фольги. вали під вакуумом для одержання вказаної у назві Розчин перемішували в атмосфері азоту, додавапроміжної сполуки (90%) у ви гляді жовтоли 77мг (0,514ммоля) йодиду натрію до одержаної коричневої твердої речовини. суміші та перемішували протягом 1 години. Дода1 вали піридин (63мкл, 0,772ммоля) та через 90 Н ЯМР (ДМСО-d6, 300МГц): d = 1,37 (с, 9Н), 1,63-1,74 (т, 2Η), 2,94-2,99 (м, 2Н), 3,97-4,05 (т, хвилин суміш додавали до 25мл етилового етеру. Цю суміш знову центрифугували, а одержаний 2Н), 6,80-6,85 (т, 1Н), 7,18-7,41 (м, 15Н), 8,97 (с, осад промивали за допомогою етилового етеру та 1Н). знову центрифугували. Етер декантували, а осад MS m/z 621,3 [М+Н]+. висушували під вакуумом для одержання кількісЕтап 5 - Одержання п-метоксибензилового естеру (7R)-7-(Z)-2-(2-трифенілметиламіно-5ного виходу вказаної у назві проміжної сполуки як жовто-коричневої твердої речовини, яку викорисхлортіазол-4-іл)-2-(3-N-ВОСтовували без подальшої очистки. амінопропоксііміно)ацетамідо]-3-хлорметил-31 цефем-4-карбоксилату (тобто, Сполуки 7. в якій R1 Н ЯМР (ДМСО-d6, 300МГц): d = 1,37 (с, 9Н), 2 представляє собою -(СН2)3-, R представляє со1,63-1,74 (т, 2Н), 2,94-2,99 (м, 2Н), 3,3-3,50 (к, 2Н), бою водень, R9 є трифенілметилом, R11 представ3,4-3,74 (к, 2Н), 3,75 (с, 3Н), 3,97-4,05 (т, 2Η), 5,10ляє собою ВОС, R12 представляє собою п5,12 (д, 1Н), 5,21 (с, 2Н), 5,50-5,55 (м, 1Н), 5,6 (с, метоксибензил) 2Н), 6,75-6,81 (т, 1Н), 6,90-6,96 (д, 2Н), 7,18-7,41 Проміжну сполуку, одержану на Етапі 4 (0,62г, (м, 17Н), 8,16-8,21 (т, 2Н), 8,61-8,70 (т, 1Н), 8,96 (с, 1ммоль), розчиняли у 6мл безводного THF, до цієї 1Н), 8,98-9,02 (д, 2Н), 9,41-9,44 (д, 1Н). суміші додавали 0,34г (0,83ммоля) гідрохлориду пMS m/z 1014,2 [М+Н]+. метоксибензилового естеру 7-аміно-3Етап 7 - Одержання солі біс-трифтороцтової хлорметилцефалоспоранової кислоти (тобто, кислоти (7R)-7-[(Z)-2-(2-аміно-5-хлортіазол-4-іл)-2Сполуку 6, в якій R12 представляє собою РМВ; яку (3-амінопропоксііміно)ацетамідо]-3-[(1-піридиніо) одержували від Otsuka, Japan) у 4мл безводного метилі-3-цефем-4-карбоксилату (тобто, Сполуки 2, THF. Одержану суміш перемішували під азотом та в якій R1 представляє собою -(СН2)3-, R2 предстаохолоджували до температури -35°С. До цієї оховляє собою водень, a m дорівнює 0) лодженої суміші додавали діізопропілетиламін Проміжну сполуку, одержану на Етапі 6 (14,4г), (0,52мл, 3ммоля), після цього додавали фосфоррозчиняли у суміші 1:1 трифтороцтової кислоти та ний оксихлорид (0,11мл, 1,2ммоля). Цю суміш педихлорметану (120мл). До цієї перемішаної суміші ремішували при температурі -20°С протягом 30 додавали 6,2мл анізолу, а одержану суміш перехвилин, а потім зупиняли реакцію за допомогою мішували протягом 3 годин при кімнатній темперавологого THF та розводили етилацетатом. Цю турі. Потім суміш концентрували, а залишок розсуміш промивали за допомогою води, 1N НСІ, сочиняли в етилацетаті та екстрагували водою. льового розчину, висушували над сульфатом наВодні шари піддавали ліофілізації, а одержаний трію, фільтрували та концентрували для одержанпорошок розчиняли у воді та очищали при викориня 0,88г (вихід -100%) вказаної у назві проміжної станні препаративної HPLC зі зворотною фазою. сполуки у вигляді червоно-коричневої твердої реОдержаний очищений водний розчин потім піддачовини. 1Н ЯМР свідчило про відсутність небажавали ліофілізації для одержання 3,3г (вихід - 30%) ної ізомеризації та відсутність залишкового сукцивказаної у назві проміжної сполуки. 1 німіду. Н ЯМР (DMSO-d6, 300МГц): d = 1,80-1,97 (т, 1 Н ЯМР (ДМСО-d6, 300МГц): d = 1,37 (с, 9Н), 2Η), 2,79-2,92 (м, 2Н), 3,29-3,57 (к, 2Н), 4,02-4,15 1,63-1,74 (т, 2Η), 2,94-2,99 (м, 2Н), 3,4-3,74 (к, 2Н), (т, 2Н), 5,15-5,19 (д, 1Н), 5,41-5,63 (к, 2Н), 5,83-5,92 3,75 (с, 3Н), 3,97-4,05 (т, 2Н), 4,40-4,59 (к, 2Н), (м, 1Н), 7,39 (с, 2Н), 7,77 (с, 3Н), 8,17-8,22 (т, 2Η), 5,11-5,25 (м, 3Н), 5,49-5,54 (м, 1Н), 6,75-6,81 (т, 8,60-8,70 (т, 1Η), 9,0-9,08 (д, 2Н), 9,59-9,62 (д,1Н). 1Н), 6,90-6,96 (д, 2Н), 7,18-7,41 (м, 17Н), 8,97 (с, MS m/z 553,1 [М+Н]+. 1Н), 9,41-9,44 (д, 1Н). (Примітка: Вказана вище реакція може бути MS m/z 972,0 [M+H]+. проведена при використанні триетилсилану за(Примітка: Експерименти передбачають, що мість анізолу. Крім того, продукт може бути ізольоDIPEA спричинює ізомеризацію у випадку, коли ваний при використанні розтирання з доданням вказану реакцію проводять в більших об'ємах. Моетилового етеру). дифікована процедура, що використовує 2, 4, 6Приклад В колідин як основу, та яка проводиться при темпеСинтез солі біс-трифтороцтової кислоти (7R)ратурі - 35°С протягом усього часу реакції (протя7-[(Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(3гом 10 хвилин), дозволяє вирішити цю проблему). амінопропоксііміно)ацетамідо]-3-[(2,3Етап 6 - Одержання п-метоксибензилового есциклопентено-1-піридиніо)метил]-3-цефем-4теру (7R)-7-[(Z)-2-(2-трифенілметиламіно-5карбоксилату хлортіазол-4-іл)-2-(3-N-ВОСВикористовуючи процедуру, описану у Приамінопропоксііміно)ацетамідо]-3-[(1кладі А, та заміщення 2,3-циклопентенпіридином 41 80098 42 (одержаним від Коеі, Japan) піридину згідно з Ета4,19 (т, 2Н), 5,13 (д, 1Н), 5,31-5,64 (к, 2Н), 5,80 (дд, пом 6, одержували вказану у назві проміжну спо1Н), 7,40 (с, 2Н), 7,87 (с, широкий, ЗН), 8,20 (т, 2Н), луку. 8,64 (т, 1Н), 9,23 (д, 2Н), 9,55 (Д.1Н). 1 MS m/z 503,1 [М-піридин]+. Н ЯМР (DMSO-d6 , 300МГц): d = 1,82-1,947 (т, Приклад Ε 2Η), 2,18-2,29 (м, 2Н), 2,40-2,58 (м, 2Н), 2,81-2,95 Синтез солі біс-трифтороцтової кислоти (7R)(м, 2Н), 3,09-3,17 (т, 2Η), 3,21-3,30 (т 2Η), 4,10-4,19 7-[(Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(4(т, 2Н), 5,15-5,19 (д, 1Н), 5,40-5,61 (к, 2Н), 5,83-5,92 (м, 1Н), 7,39 (с, 2Н), 7,77 (с, 3Н), 7,89-7,96 (т, 2Н), амінометилбензилоксііміно)ацетамідо]-3-[(1піридиніо)метил]-3-цефем-4-карбоксилату 8,42-8,48 (д, 1Н), 8,62-8,69 (д, 1Н), 9,60 -9,63 Використовуючи процедуру, описану у При(д,1Н). кладі А та на Етапі 2 Прикладу D, та заміну NMS m/z 592,5 [М+Н]+. ВОС-4-(йодметил)бензиламіном (що одержаний Приклад С Синтез солі біс-трифтороцтової кислоти (7R)на четвертому етапі з 4-(амінометил)бензойної кислоти, тобто, (і) ВОС2О, KОН, (іі) LіАІН4, (ііі) 7-[(Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(6MsCI, Et3N та (iv) Nal) гідроброміду N-ВОС-2-(2аміногексоксііміно) ацетамідо]-3-[1йодетокси)етиламін-3-бромпропіламіну на Етапі 2, піридиніо)метил]-3-цефем-4-карбоксилату одержували вказану у назві сполуку. Використовуючи процедуру, описану у При1 кладі А, та заміну N-ВОС-6-йодгексиламіном NН ЯМР (DMSO-d6 , 300МГц): d = 3,18-3,59 (к, BOC-3-бромпропіламіну згідно з Етапом 2 (та ви2Н), 4,00 (с, широкий, 2Н), 5,13 (с, 2Н), 5,15 (д, 2Н), далення йодиду тетрабутиламонію), одержували 5,40-5,64 (к, 2Н), 5,85 (дд, 1Н), 7,38-7,43 (м, 6Н), вказану у назві проміжну сполуку. 8,19-8,23 (м, 4Н), 8,64 (т, 1Н), 9,17 (д, 2Н), 9,71 (д, 1 1Н). Н ЯМР (ДМСО-d6, 300МГц): d = 1,2м.ч. (шс, MS m/z 614,1 [М+Н]+, 535,1 [М-піридин]+. 4Н), 1,3м.ч. (м, 2Н), 1,5м.ч. (м, 2Н), 2,7м.ч. (м, 2Н), Приклад F (порівняльний) 3,3м.ч. (дд, 2Н), 4,0м.ч. (т, 3Н), 5,1м.ч. (д, 1Н), Синтез солі біс-трифтороцтової кислоти (7Р)5,5м.ч. (дд, 2Н), 5,8м.ч. (дд, 1Н), 7,25м.ч. (шс, 2Н), 7-[(Z)-2-(2-амінотіазол-4-іл)-2-(37,6м.ч. (шс, 3Н), 8,2м.ч. (дд, 2Н), 8,6м.ч. (дд, 1Н), амінопропоксііміно)ацетамідо]-3-[(1-піридиніо) ме9м.ч. (дд, 2Н), 9,5м.ч. (д, 1Н). тил]-3-цефем-4-карбоксилату MS m/z 594,3 (М+). Шляхом усунення Етапу 4 у Прикладі А, що Приклад D описаний вище, одержували позбавлену хлору Синтез солі біс-трифтороцтової кислоти (7R)похідну проміжної сполуки Прикладу А. 7-[(Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(2-(21 аміноетокси) етоксііміно)ацетамідо]-3-[(1Н ЯМР (ДМСО-d6, 300МГц): d = 1,75 -1,82 (т, піридиніо)метил]-3-цефем-4-карбоксилату 2Η), 2,67-2,82 (м, 2Н), 3,25-3,61 (к, 2Н), 3,98-4,09 Використовували процедуру Прикладу А, за (т, 2Н), 5,13-5,17 (д, 1Н), 5,38-5,58 (к, 2Н), 5,79-5,85 винятком того, що приведеною нижче процедурою (м, 1Н), 6,62 (с, 1Η) 7,15-7,25 (с, широкий, 2Н), замінювали процедуру Етапу 2: 7,60-7,75 (с, широкий, 3Н), 8,16-8,19 (т, 2Н), 8,58Етап 2 Одержання етил (Z)-2-(28,63 (т, 1Н), 8,95-9,01 (д, 2Н), 9,57-9,60 (д, 1Н). триФенілметиламінотіазол-4-іл)-2-[2-(2-N-ВОСMS m/z 518,6 [М+Н]+. аміноетил)етоксііміно]ацетату (тобто, етилового Приклад G естеру Сполуки 5а, в якій R1 представляє собою Синтез аміду ванкоміцин-3-(аміноокси)пропілу (СН2)2-О-(СН2)2-, R2 представляє собою водень, R9 Етап 1 - Одержання N-(3-амінопропокси) фтає трифенілметилом, R11 представляє собою ВОС, ліміду а А є воднем). N-(трет-бутоксикарбоніл)-3-бромпропіламін Проміжну сполуку, одержану на Етапі 1 При(одержаний на Етапі 1 Прикладу А, що описаний кладу А (42,5г, 86ммолів), додавали до перемішавище) (9,58г, 40,23ммолів) та N-гідроксифталімід ної суспензії N-ВОС-2-(2-йодоетокси)-етиламіну (6,36г, 39ммолів) у 70мл безводного DMF. До цьо(28,5г, 90ммолів) (готували у три етапи з 2-(2го розчину додавали діізопропілетиламін (7,01мл, гідроксіетокси)етанолу, тобто, (і) ВОС2О, KОН, (іі) 40,23ммолів), що приводило до утворення темноMsCI, Et3N та (ііі) Nal) та карбонату цезію (84,1г, червоного забарвлення. Перемішували реакційну 258ммолів) в DMF (300мл). Суспензію перемішусуміш при кімнатній температурі протягом 16 говали протягом 16 годин при кімнатній температурі, дин, після цього реакційну суміш переносили у протягом цього часу HPLC показувала, що реакцію 500мл діетилового етеру. Одержаний білий пребуло завершено. Реакційну суміш потім фільтруципітат відфільтровували та відкидали. Органічний вали, а фільтр промивали за допомогою DMF розчин промивали 2x200мл насиченим розчином (100мл). Фільтрат розводили етилацетатом (1л) та бікарбонату натрію та 2 x200мл водою. Органічний промивали водою (300мл), 1N НСІ (200мл), насирозчин висушували над безводним сульфатом ченим водним розчином бікарбонату натрію магнію, фільтрували та концентрували для одер(200мл) та сольовим розчином (200мл). Органічжання білої твердої речовини. Цю тверду речовиний шар висушували над сульфатом магнію, фільну потім розчиняли у 50мл DCM та 50мл TFA. Пістрували та концентрували під вакуумом. Залишок ля перемішування протягом 1 години розчин очищали за допомогою флеш-колонкової хроматопереносили у 300мл діетилового етеру. Одержаграфії (етилацетат:гексан, 1:1) для одержання ний преципітат фільтрували, промивали за допо49,7г (вихід - 90%) вказаної у назві проміжної спомогою діетилового етеру та висушували під вакуулуки у вигляді твердої білуватої речовини. мом для одержання вказаної у назві проміжної 1 сполуки у вигляді солі трифтороцтової кислоти. Н ЯМР (ДМСО-d6, 300 МГц): d = 2,96 (с, широ1 кий, 2Н), 3,20-3,55 (к, 2Н), 3,59 (т, 2Н), 3,70 (т, 2Н), Н ЯМР (ДМСО-d6, 300МГц): d = 1,90 (2Н, qn), 43 80098 44 2,95 (2Н, т), 4,18 (2Н, т), 7,79 (4Н, с), 7,92 (3Н, шивали за допомогою мінімальної кількості холодної рокий с). води та висушували на повітрі для одержання вкаЕтап 2 - Одержання аміду ванкоміцин 3заної у назві проміжної сполуки як білуватої твер(фталімідокси)пропілу дої речовини. 1 Гідрохлорид ванкоміцину (10,0г, 6,74ммолів) Н ЯМР (D MSO-d 6, 300МГц): d = 8,5 (с, 1Н). та проміжну сполуку, одержану на Етапі 1 (2,70г, Етап 3 - Одержання п-метоксибензилового ес8,09ммолів), суспендували у 100мл безводного теру (7R)-7-[2-(2-Форміламіно-5-хлорутіазол-4-іл)DMF. Додавали діізопропілетиламін (4,70мл, 2оксоацетамідо]-3-хлорметил-3-цефем-426,98ммолів) та одержану суміш перемішували карбоксилату при кімнатній температурі протягом 10 хвилин. Проміжну сполуку, одержану на Етапі 2 (1,03г, Потім додавали розчин РуВОР (5,61г, 4,37ммоля), гідрохлорид п-метоксибензилового 10,78ммолів) та HOAt (1,65г, 10,78ммолів) у D MF естеру 7-аміно-3-хлорметилцефалоспоранової (20мл), а реакційну суміш перемішували при кімкислоти (1,95, 4,81ммоля) та HOAt (0,74г, натній температурі. Через 1 годину реакційну су4,81ммоля) суспендували у 15мл безводного DMF. міш додавали до діетилового етеру (500мл). ОдеПробірку для реакції очищали за допомогою азоту, ржаний преципітат фільтр ували, промивали за а потім охолоджували до температури 0°С на зовдопомогою діетилового етеру та висушували під нішній крижаній бані. Гідрохлорид 1-(3вакуумом для одержання вказаної у назві проміждиметиламінопропіл)-3-етилкарбодііміду (0,92г, ної сполуки у вигляді білуватої твердої речовини. 4,81ммоля) додавали до охолодженої реакційної MS m/z = 1651,8 (М+Н)+. суміші, після цього додавали 2, 4, 6-колідин Етап 3 - Одержання аміду ванкоміиин-3(0,64мл, 4,81ммоля). Реакційну суміш перемішу(аміноокси)пропілу вали при температурі 0°С протягом 2 годин, а поПроміжну сполуку, одержану на Етапі 2 (11,2г, тім переносили у 200мл 0,5Μ НСІ. Одержаний 6,74ммолів), суспендували у 80мл безводного преципітат фільтрували, промивали водою та виDMF та додавали моногідрат гідразину (0,65мл, сушували на повітрі для одержання вказаної у на13,48ммолів). Реакційну суміш перемішували при зві сполуки у вигляді червоної твердої речовини. кімнатній температурі протягом 4,5 годин, а потім Сполуку використовували без подальшої очистки. до реакційної суміші додавали 1мл трифтороцтоMS m/z = 607 (M+Na)+. вої кислоти, після цього додавали 300мл діетилоЕтап 4 - Одержання п-метоксибензилового есвого етеру. Після інтенсивного перемішування теру (7R)-7-[2-(2-форміламіно-5-хлортіазол-4-іл)-2одержаний преципітат фільтрували, промивали за оксоацетамідо]-3-(1-піридиніо)метил-3-цефем-4допомогою діетилового етеру та висушували під карбоксилату вакуумом. Вказану у назві сполуку очищали за Проміжну сполуку, одержану на Етапі 3 (2,5г, допомогою HPLC зі зворотною фазою при викори4,27ммоля), та йодид натрію (0,64г, 4,27ммоля) станні градієнту вода/метанол для одержання вкарозчиняли в ацетоні та захищали від світла за дозаної у назві проміжної сполуки у вигляді ліофіліпомогою фольги. Реакційну суміш потім перемішузованого порошку. вали протягом 10 хвилин, а потім додавали піриMS m/z= 1522,9 (М+Н)+. дин (0,42мл, 5,12ммолів). Реакційну суміш потім Приклад Η перемішували при кімнатній температурі протягом Синтез біс-трифторацетату (7R)-7-[2-(2-аміно1 години, а потім додавали 300мл води. Одержа5-хлортіазол-4-іл)-2-оксоацетамідо]-3-(1ний преципітат фільтрували, промивали за допопіридиніо)метил-3-цефем-4-карбоксилату могою води та висушували на повітрі для одерЕтап 1 - Одержання етил 2- (2-форміламіно-5жання червоної твердої речовини. Цю тверду хлортіазол-4-іл)-2-оксоацетату речовину очищали шля хом HPLC зі зворотною Етил 2-(форміламінотіазол-4-іл)-2-оксоацетат фазою, а одержаний водний розчин піддавали (9,1г, 39,87ммолів) (одержаний від Aldrich, ліофілізації для одержання вказаної у назві проміMilwaukee, WI) суспендували у 50мл безводного жної сполуки у вигляді ліофілізованого порошка. DMF. N-хлорсукцинімід (5,6г, 41,86ммолів) додаMS m/z = 628,1 (М)+. вали як тверду речовину, розмішували суспензію Етап 5 - Одержання біс-трифторацетату (7Р)при кімнатній температурі. Через 18 годин реак7-[2-(2-аміно-5-хлортіазол-4-іл)-2-оксоацетамідо]ційну суміш переносили у 500мл води. Одержаний 3-(1-пірідиніо)метил-3-цефем-4-карбоксилату білий преципітат фільтрували, промивали та виПроміжну сполуку, одержану на Етапі 4 (0,11г, сушували на повітрі для одержання вказаної у на0,18ммолів) розчиняли у 5мл метанолу та додавазві проміжної сполуки. ли концентрований водний розчин соляної кислоти 1 Н ЯМР (ДМСО-d 6, 300МГц): d = 1,2 (т, 3Н), 4,3 (0,5мл). Одержаний розчин перемішували при кім(к, 2Н), 8,55 (с, 1Н). натній температурі протягом 1,5 годин. Метанол Етап 2 - Одержання 2-(-2-форміламіно-5видаляли під вакуумом та додавали ацетонітрил хлортіазол-4-іл)-2-оксооцтової кислоти (10мл). Потім розчин концентрували у вакуумі та До проміжної сполуки, одержаної на Етапі 1 до залишку додавали DCM (2мл) та TFA (2мл), (3,6г, 13,7ммолів), додавали 1М розчин NaOH одержану суміш перемішували при кімнатній тем(30мл, 30ммолів). Одержану суспензію перемішупературі протягом 1,5 годин. Потім додавали діевали при кімнатній температурі протягом 2 годин тиловий етер (50мл) та вказану у назві проміжну (протягом цього часу розчин був прозорим), а посполуку ізолювали шляхом центрифугування. тім додавали 1М НСІ (30мл, 30ммолів), після цього Цю проміжну сполуку використовують без пододавали 100мл води. Після інтенсивно перемішудальшої очистки. вання одержаний преципітат фільтрували, промиMS m/z = 479,9 (М)+. 45 80098 46 Приклад І мом. Одержаний порошок розчиняли у воді та Синтез Сполуки 13, в якій R1 представляє соочищали при використанні препаративної HPLC. бою -(СН2)2-, R2, R 5, R6 , R8 представляють собою Фракції, що містили бажаний продукт, ліофілізуваводень, R4 є гідрокси, R7 представляє собою мели для одержання солі трифтороцтової кислоти тил, X1 та X2 представляють собою хлор, a m дорівказаної у заголовки сполуки. Аніон у солі обмінювнює 0 вали при використанні амберлітової смоли для Етап 1 Одержання (Z)-2-(2-аміно-5одержання тригідрохлоридної солі вказаної у назві хлортіазол-4-іл)-2-(3-амінопропоксііміно)ацетату сполуки (1,4г, вихід - 27%) у вигляді білого порошПроміжну сполуку, одержану на Етапі 4 у Прику. кладі А (0,75г, 1,21ммоля), розчиняли в 5мл DCM MS m/z 953,3 [[М+Н]+-піридин]/2; 992,0 та 5мл трифтороцтової кислоти. Після перемішу[М+Н]+/2. вання протягом 1 години при кімнатній температуКрім того, сполуки 2-30, представлені у Таблирі додавали 100мл діетилового етеру. Одержаний ці І, готують або готували при використанні спосопреципітат фільтрували, промивали за допомогою бів Прикладу А та Прикладу 1, використовуючи діетилового етеру та висушували під вакуумом замість піридину Етапу 6 Прикладу А, наступні для одержання вказаної у назві проміжної сполуки заміщені піридини: у вигляді коричневої твердої речовини. Приклад 2 - 2-піколін Етап 2 - Одержання Сполуки 13, в якій R1 Приклад 3 - 3-піколін представляє собою - (СН2)3-, R2, R5, R6 , R8 предПриклад 4 - 4-піколін ставляють собою водень, R4 є гідрокси, R7 предПриклад 5 - 2-метоксипіридин ставляє собою метил, X1 та X2 є атомами хлору, a Приклад 6 - 3-метоксипіридин m дорівнює 0 Приклад 7 - 4-метоксипіридин Гідрохлорид ванкоміцину (1,3г, 0,88ммоля) та Приклад 8 - 2-тіометоксипіридин HOAt (0,14г, 0,088ммоля) суспендували у 3,5мл Приклад 9 - 3-тіометоксипіридин безводного DMSO. Додавали розчин РуВОР Приклад 10 - 4-тіометоксипіридин (0,46г, 0,88ммоля) у 3,5мл DMF, після цього додаПриклад 11 - 2-фторпіридин вали DIPEA (154мкл, 0,88ммоля). Після перемішуПриклад 12 - 3-фторпіридин вання протягом 20 хвилин додавали розчин проПриклад 13 - 4-фторпіридин міжної сполуки, одержаної на Етапі 1 (0,22г, Приклад 14 - 2-хлорпіридин 0,44ммоля), в 1мл DMF, після цього швидко додаПриклад 15 - 3-хлорпіридин вали DIEA (0,54мл, 3,08ммоля). Реакційну суміш Приклад 16 - 4-хлорпіридин перемішували при кімнатній температурі протягом Приклад 17 - 2-фенілпіридин 1 години, потім додавали 0,5мл трифтороцтової Приклад 18 - 3-фенілпіридин кислоти, після цього швидко додавали 100мл Еt2О. Приклад 19 - 4-фенілпіридин Одержаний преципітат фільтрували, промивали за Приклад 20 - 4-циклопропілпіридин допомогою Еt2О та висушували у вакуумі. Сировий Приклад 21 - 4-(карбокситіометокси)піридин продукт очищали за допомогою HPLC зі зворотПриклад 22 - ізонікотинамід ною фазою, а одержаний водний розчин піддавали Приклад 23 - 2,3-лутидин ліофілізації для одержання проміжної сполуки у Приклад 24 - 3,4-лутидин вигляді ліофілізованого порошку. Приклад 25 - 3,5-лутидин MS m/z= 1711,0 (М+Н)+. Приклад 26 - 3,4-диметоксипіридин Приклад 1 Приклад 27 - 4-метокси-3-метилпіридин Синтез Сполуки формули І, в якій R1 предстаПриклад 28 - 4-фтор-3-метоксипіридин вляє собою - (СН2)3-, R2, R5, R6, R 8 представляють Приклад 29 - 2,3-циклогексенпіридин собою водень, R4 представляє собою гідрокси, R1 Приклад 30 - 2,3-циклопентенпіридин є метилом, X1 та X2 представляють собою атоми Описані вище заміщені піридини є або комерхлору, a m дорівнює 0 (сполуки 1 в Таблиці 1) ційно доступними, або можуть бути одержані за Гідрохлорид ванкоміцину (4,2г, 2,8ммоля) роздопомогою способів, що описані у літературі. чиняли в 40мл DMSO. До цього розчину додавали Приклад 31 розчин РуВОР (1,3г, 2,6ммоля та НОАТ (0,35г, Синтез сполуки формули І, в якій R1 представ2,6ммоля в 40мл DMF, після цього додавали ляє собою - (СН2)6-, R2, R5, R6, R8 представляють 0,98мл (5,68ммолів) діізопропілетиламіну. Цю сусобою водень, R4 є гідрокси, R7 є метилом, X1 та міш перемішували при кімнатній температурі проX2 представляють собою хлор, a m дорівнює 0 тягом 30 хвилин, а потім реакцію зупиняли за до(Сполука 31 у Таблиці І) помогою 0,44мл (5,7ммолів) трифтороцтової Використовуючи спосіб, описаний у Прикладі кислоти. Суміш потім охолоджували до темпера1, та заміну проміжної сполуки Прикладу А на тури 0°С та додавали розчин проміжної сполуки, проміжну сполуку Прикладу С, одержували сполуодержаної Прикладі А, що описаний вище (1,3г, ку, вказану у назві. 2,6ммоля), у 20мл DMF при температурі 0°С, після МС m/z 2026,5 (М+). цього додавали 1,5мл (11,4ммол) 2, 4, 6-колідину. Приклад 32 Суміш витримували при температурі 0°С протягом Синтез сполуки формули і, в якій R1 представчотирьох годин, а потім реакцію зупиняли за доляє собою -(СН2)2-, R2, R5, R6, R8 представляють помогою 1,1мл трифтороцтової кислоти. Суміш собою водень, R4 є гідрокси, R7 є метилом, X1 та додавали до етилового етеру для утворення преX2 представляють собою хлор, a m дорівнює 0 ципітату, центрифугували, промивали за допомо(Сполука 32 у Таблиці І) гою етеру, декантували та висушували під вакууВикористовуючи спосіб, описаний у Прикладі 1 47 80098 48 та заміну проміжної сполуки Прикладу А на промігачений двухвалентними катіонами до рівнів, які жну сполуку Прикладу D одержували сполуку, вкавказані в інструкціях виробника). Бульйонну кульзану у назві. туру вирощували протягом ночі при температурі МС m/z 976,9 [(М-піридин)/2]+. 35°С, розводили свіжим, попередньо підігрітим Приклад 33 бульйоном та вирощували до логарифмічної фази; Синтез сполуки формули І, в якій R1 представце еквівалентно 0,5 стандарту МакФарланда або ляє собою - СН2-1,4-Ph-СН2, R2, R5, R6, R8 пред1x108 колоніє-утворювальних одиниць на мілілітр ставляють собою водень, R4 є гідрокси, R7 є ме(CFU/мл). З причини варіабельності не усі клітинні тилом, X1 та X2 представляють собою хлор, a m суспензії містили 1x108 CFU/мл, коли помутніння є дорівнює 0 (Сполука 33 у Таблиці І) еквівалентним стандарту МакФарланда, таким Використовуючи спосіб, описаний у Прикладі чином, здійснювали прийнятні доведення (базую1, та заміну проміжної сполуки Прикладу А на чись на керівництві NCCLS) розведень різноманітпроміжну сполуку Прикладу Е, одержували сполуних бактеріальних штамів. Інокулюм розводили ку, вказану у назві. так, щоб 100мкл цієї культури у бульйоні МюллеМС m/z 1967,0 [М+Н]+, 984,2 [М-піридин)/2]+. ра-Хінтона, модифікованому бульйоні МюллераПриклад 34 (порівняльний) Хінтона або середовищі для тестування Синтез знехлореної сполуки формули І, в якій Haemophilus при нашаровуванні на двократно розR1 представляє собою -(СН2)3-, R2, R5, R6, R8 предведені серійні концентрації антибіотиків у 100мкл ставляють собою водень, R4 є гідрокси, R7 є мевідповідного середовища у мікротитрувальних тилом, X1 та X2 представляють собою хлор, a m планшетах на 96 комірок приводило б до початкодорівнює 0 (Сполука 34) вої концентрації бактерій 5х105 CFU/мл. Планшети Використовуючи спосіб, описаний у Прикладі потім інкубували протягом 18-24 годин при темпе1, та заміну проміжної сполуки Прикладу А на знературі 35°С. Значення МІС зчитували візуально як хлорену цефалоспоринову проміжну сполуку Прикомірку з найнижчою концентрацією, в якій відсуткладу F, одержували сполуку, вказану у назві. ній ріст бактерій. Ріст бактерій визначали, коли МС m/z 935,3 [М+Н]-піридин]/2; 974,9 [М + було в наявності більше, ніж три точкові колонії, Н]+/2. коли осад преціпітованих клітин був більшим, ніж Приклад 35 2мм у діаметрі, або за наявності видимого замутВизначення мінімальних інгібувальних конценніння. трацій (МІС) Аналіз на мінімальну інгібіторну конШтами, які звичайно піддавали тестуванню у центрацію (МІС) проводили при використанні спопопередньому відборі, включали чутливий до месобу мікророзведень бульйону, що представлений тициліну Staphylococcus aureus (MSSA), стійкий до у керівництві NCCLS [див., NCCLS. 2000. Методи метициліну Staphylococcus aureus (MRSA), проведення тестів на чутливість до антимікробних Staphylococcus aureus, що виробляє пеніциліназу, речовин на основі розведення для бактерій, що чутливий до метициліну Staphylococcus epidermitis вирощуються аеробно, схвалений стандарт, - п'яте (MSSE), стійкий до метициліну Staphylococcus видання, том 20, №2]. Бактеріальні штами одерepidermitis (MRSE), чутливий до ванкоміцину жували з Американської колекції типових культур Enterococcus faecium (EFMVS), чутливий до ван(АТСС), госпіталю Стенфордського Університету коміцину Enterococcus faecalis (EFSVS), стійкий до (SU), Королівської постійно діючої регіональної ванкоміцину Enterococcus faecium, що також стійлабораторії у Берклі (КРВ), головного госпіталю кий до тейкопланіну (EFMVR Van А), стійкий до Масачусетса (MGH), центрів контролю за захвованкоміцину Enterococcus faecium, що є чутливим рюваннями (CDC), урядового госпіталю для ветедо тейкопланіну (EFMVR Van В), стійкий до ванкоранів Сан-Франциско (SFVA) або госпіталю Санміцину Enterococcus faecalis, що також стійкий до Франциско Каліфорнійського Університету (UCSF). тейкопланіну (EFSVR Van А), стійкий до ванкоміСтійкі до ванкоміцину ентерококи фенотипували як цину Enterococcus faecalis, що є чутливим до тейVan А або Van В, базуючись на їх чутливості до копланіну (EFSVR Van В), чутливий до пеніциліну тейкопланіну. Деякі стійкі до ванкоміцину ентероStreptococcus pneumoniae (PSSP), стійкий до пенікоки, що були генетично типовані як Van A, Van В, циліну Streptococcus pneumoniae (PSRP). З причиVan C1, Van C2, також одержували з клініки Майо. ни нездатності (PSSP) та (PSRP) до значного росУ цьому аналізі заморожені для зберігання бату на бульйоні Мюллера-Хінтона, МІС для цих ктеріальні культури стандартних та клінічних шташтамів визначали, використовуючи або бульйон мів висівали штрихом для ізоляції на прийнятному TS з добавкою дефібринованої крові або тестового агаровому середовищі (тобто, триптиказному соєсередовища для тестування Haemophilus. вому агарі, триптиказному соєвому агарі з бараняТестові сполуки, що мали значну активність чими еритроцитами, які піддавали дефібрінізації, проти штамів, згаданих вище, потім піддавали доінфузійному агарі на основі мозково-серцевого слідженню на значення МІС на більшому ряді клібульйону, шоколадному агарі). Після інкубації з нічних ізолятів, включаючи види, приведені вище, метою утворення колоній, планшети покривали а також неспецифічні негативні за коагулазою парафіном та зберігали замороженими протягом Staphylococcus, які є як чутливими, так і стійкими періоду часу до дво х тижнів. Для приготування до метициліну (MS-CNS та MR-CNS). Крім того, ці інокуляту для аналізу та для підтвердження низьдосліджувані сполуки також аналізували на знакої варіабельності декілька колоній з бактеріальночення МІС проти грам-негативних мікроорганізмів, го ізоляту, що вирощений на агарових пластинах, таких, як Escherichia coli, Pseudomonas aeruginosa, відбирали за допомогою петлі для інокуляції та Klebsiella pneumoniae, Enterobacter cloacae, переносили в бульйон Мюллера-Хінтона (що збаAcinetobacter baumannii, Haemophilus influenzae та 49 80098 50 Moraxella catarrhalis. метициліну S. aureus (MRSA) та стійких до метиТаблиця II представляє дані стосовно МІС90 циліну S. epidermitis (MRSE) у порівнянні з відомим для сполуки за даним винаходом проти стійких до антибіотиком, ванкоміцином. Таблиця II Мінімальні інгібувальні концентрації (МІС) Мікроорганізм Досліджувана сполука Сполука 1 1 Стійкий до метициліну S. aureus (MRSA) (n=53) Ванкоміцин Стійкий до метициліну S. epidermitis (MRSE) та інші негативні за Сполука 1 коагулазою стафілококи (n=34) Ванкоміцин 1 2 MIC902 (мкг/мл)
ДивитисяДодаткова інформація
Назва патенту англійськоюCross-linked glycopeptide-cephalosporin antibiotics
Назва патенту російськоюПоперечносвязанные гликопептидцефалоспориновые антибиотики
МПК / Мітки
МПК: A61P 31/04, A01N 37/46, A61P 31/00, C07D 501/00, C07D 277/40, C07K 7/02, C07K 9/00, A61K 38/00, C07D 277/42
Мітки: поперечнозв'язані, антибіотики, глікопептидцефалоспоринові
Код посилання
<a href="https://ua.patents.su/26-80098-poperechnozvyazani-glikopeptidcefalosporinovi-antibiotiki.html" target="_blank" rel="follow" title="База патентів України">Поперечнозв’язані глікопептидцефалоспоринові антибіотики</a>
Попередній патент: Спосіб одержання триптану
Наступний патент: Каталізатор окислення етану і/або етилену до оцтової кислоти та спосіб одержання оцтової кислоти
Випадковий патент: Спосіб виготовлення облицювальних матеріалів












