Антибіотики флорфеніколового типу
Номер патенту: 78026
Опубліковано: 15.02.2007
Автори: Хекер Скотт Дж., Шустер Дейл Е., Глінка Томаш В., Чонг Лі С., Бооямра Константін Дж.
Формула / Реферат
1. Сполука, що має формулу:
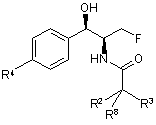 ,
,
в якій:
R2 і R3, незалежно, вибирають з групи, що містить водень, (1С-4С)алкіл, гало, -CF3, -NH2, -CN і N3;
R4 вибирають з групи, що містить: 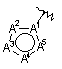 і
і 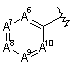 ,
,
де:
А1 є вуглецем або азотом і атоми вуглецю в кільці, незалежно, заміщені замісником, що вибирають з групи, яка містить водень, (1С-4С)алкіл, (3С-6С)циклоалкіл, (1С-4С)алкілО-, -СF3, -ОН, -CN, гало, (1С-4С)алкілSO-, (1С-4С)алкілSO2-, NH2SO2-, (1С-4С)алкілNНSO2-, ((1С-4С)алкіл)2NSO2-, -NH2, (1С-4С)алкілNН-, ((1С-4С)алкіл)2N-, (1С-4С)алкілSO2NН-, (1С-4С)алкілС(O)-, (3С-6С)циклоалкілС(О)-, (1С-4С)алкілОС(O)-, (1С-4С)алкілС(O)NН-, -C(O)NH2, (1С-4С)алкілNНС(O)- і ((1С-4С)алкіл)2NС(O)-, де будь-які алкільні групи в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН;
А2, А3, А4 і А5, незалежно, вибирають з групи, що містить вуглець, азот, кисень і сірку, за умови, що, принаймні, один з А1-А5 не є вуглецем, і що загальна кількість атомів азоту, кисню і сірки в кільці не перевищує 4, і що кільце є ароматичним; а якщо А1 є вуглецем і кільце не містить кисень або сірку, один з атомів азоту може, необов'язково, бути заміщений замісником, що вибирають з групи, яка містить (1С-4С)алкіл, (1С-4С)алкілSO2- і -NH2;
де:
А6, А7, А8, А9 і А10, незалежно, вибирають з групи, що містить вуглець, азот і 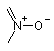 , за умови, що тільки один з А6-А10 може бути
, за умови, що тільки один з А6-А10 може бути 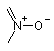 , а один, два або три атоми А6-А10 означають азот;
, а один, два або три атоми А6-А10 означають азот;
і атоми вуглецю в кільці, незалежно, заміщені замісником, що вибирають з групи, яка містить водень, (1С-4С)алкіл, (3С-6С)циклоалкіл, (1С-4С)алкілО-, -СF3, -ОН, -CN, гало, (1С-4С)алкілSO-, (1С-4С)алкілSO2-, NH2SO2-, (1С-4С)алкілNНSO2-, ((1С-4С)алкіл)2NSO2-, -NH2, (1С-4С)алкілNН-, ((1С-4С)алкіл)2N, (1С-4С)алкілSO2NН-, (1С-4С)алкілС(O)-, (3С-6С)циклоалкілС(О)-, (1С-4С)алкілОС(O)-, (1С-4С)алкілС(O)NН-, -C(O)NH2, (1С-4С)алкілNНС(O)-, ((1С-4С)алкіл)2NС(O)- і -ОСН2O-, при цьому атоми кисню в -ОСH2O- приєднані до сусідніх атомів вуглецю, де будь-які алкільні групи в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН;
R8 є воднем у всіх сполуках, за винятком, коли R2 і R3 обидва є F, тоді R8 є воднем або F; і
сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енантіомерно чистою і має показану абсолютну стереохімію.
2. Сполука згідно з пунктом 1, в якій: R2 і R3, незалежно, вибирають з групи, що містить Сl і F; і R8 є воднем.
3. Сполука згідно з пунктом 1 або 2, де R4 є 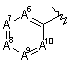 , де будь-який з А6-А10, що є вуглецем, є заміщеним замісником, що вибирають з групи, яка містить водень, -NH2, гало-, -CN, (1С-4С)алкіл-, (1С-4С)алкілС(O)-, (1С-4С)алкілSO-, (1С-4С)алкілSO2-, NH2SO2-, (1C-4C)алкілSO2NH-, (1С-4C)алкілNHSO2-, ((1C-4C)алкіл)2NSO2-, де будь-яка з алкільних груп в будь-якому з замісників може бути незаміщеною або заміщеною гало або -ОН.
, де будь-який з А6-А10, що є вуглецем, є заміщеним замісником, що вибирають з групи, яка містить водень, -NH2, гало-, -CN, (1С-4С)алкіл-, (1С-4С)алкілС(O)-, (1С-4С)алкілSO-, (1С-4С)алкілSO2-, NH2SO2-, (1C-4C)алкілSO2NH-, (1С-4C)алкілNHSO2-, ((1C-4C)алкіл)2NSO2-, де будь-яка з алкільних груп в будь-якому з замісників може бути незаміщеною або заміщеною гало або -ОН.
4. Сполука згідно з пунктом 1 або 2, де R4 є  , де будь-який з А6-А10, що є вуглецем може бути заміщений -NH2, а інші атоми вуглецю А6-А10 є незаміщеними.
, де будь-який з А6-А10, що є вуглецем може бути заміщений -NH2, а інші атоми вуглецю А6-А10 є незаміщеними.
5. Сполука згідно з пунктом 1 або 2, в якій R4 вибирають з групи, що містить:
 ,
,  ,
, 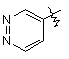 ,
, 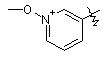 ,
, 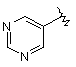 ,
,
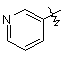 ,
, 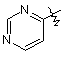 ,
, 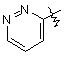 ,
, 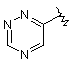 ,
, 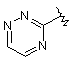 ,
,
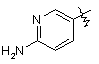 ,
, 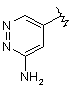 ,
,
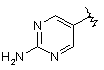 і
і 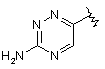 .
.
6. Сполука згідно з пунктом 1 або 2, в якій R4 є 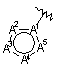 , де А1, А2, А3, А4 і А5 є такими, як визначено в пункті 1.
, де А1, А2, А3, А4 і А5 є такими, як визначено в пункті 1.
7. Сполука згідно з пунктом 6, в якій всі атоми вуглецю і азоту є незаміщеними.
8. Сполука згідно з пунктом 6, в якій один з А2-А5, що є вуглецем, заміщений -NH2 групою, всі інші вуглеці і атоми азоту в кільці є незаміщеними.
9. Сполука згідно з пунктом 1 або 2, в якій R4 вибирають з групи, що містить:
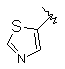 ,
, 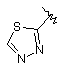 ,
, 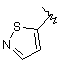 ,
, 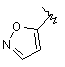 ,
, 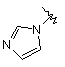 ,
,
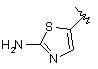 ,
, 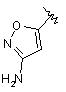 ,
, 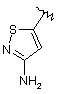 ,
, 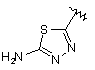 ,
,
і 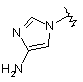 .
.
10. Сполука згідно з пунктом 2, яку вибирають з групи, що містить:
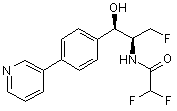 ,
, 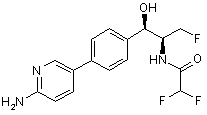 ,
,
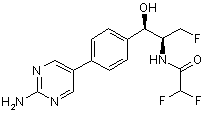 ,
, 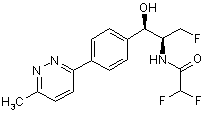 ,
,
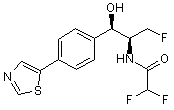 ,
, 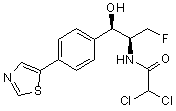 ,
,
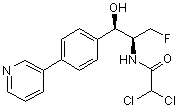 ,
, 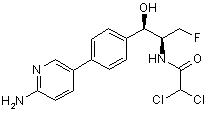 ,
,
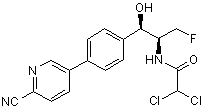 ,
, 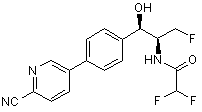 ,
,
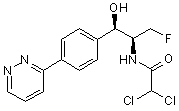 ,
, 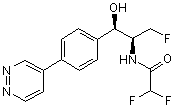 ,
,
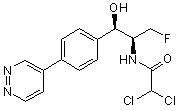 ,
, 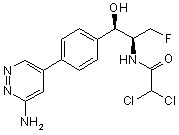 ,
,
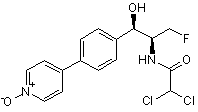 ,
, 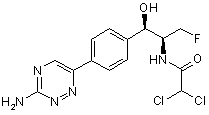 ,
,
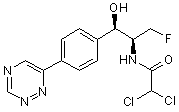 ,
, 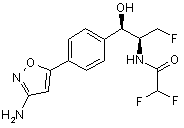 ,
,
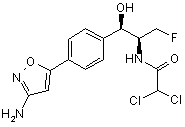 ,
, 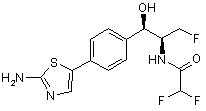 ,
,
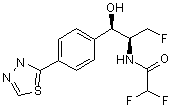 ,
, 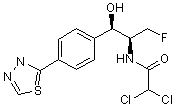 ,
,
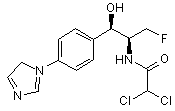 ,
,
де сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енантіомерно чистою і має показану абсолютну стереохімію.
11. Сполука згідно з пунктом 10, яку вибирають з групи, що містить:
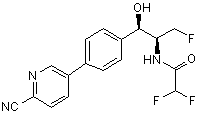 ,
, 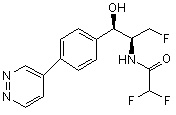 ,
,
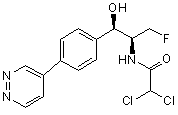 ,
, 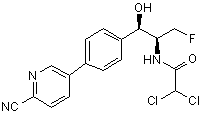 ,
,
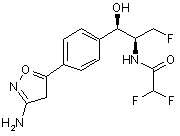 ,
, 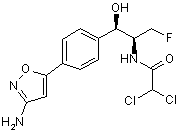 ,
,
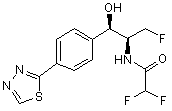 ,
, 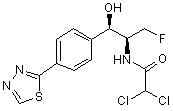 ,
,
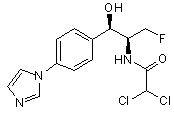 ,
,
де сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енантіомерно чистою і має показану абсолютну стереохімію.
12. Сполука згідно з пунктом 1, яку вибирають з групи, що містить:
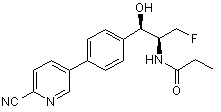 ,
, 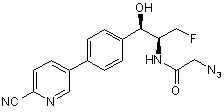 і
і
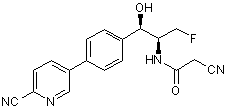 .
.
13. Сполука згідно з пунктом 1, яку вибирають з групи, що містить:
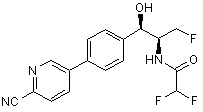 .
.
14. Сполука згідно з пунктом 13, яка є рацематом, що має показану відносну стереохімію.
15. Сполука згідно з пунктом 1 або 13, де сполука є, в основному, енантіомерно чистою і має абсолютну конфігурацію 1-(R)-2-(S).
16. Спосіб лікування або попередження бактеріальної інфекції, що включає введення пацієнтові, який цього потребує, фармацевтично ефективної кількості сполуки згідно з пунктом 1, 2 або 13.
17. Спосіб згідно з пунктом 16, де бактеріальна інфекція викликана бактеріями роду Pasteurella, Haemophilus, Fusobacterium, Bacterioides, Aeromonas, Enterobacter, Escherichia, Klebsiella, Salmonella, Shigella, Actinobacillus, Streptococcus, Mycoplasma, Edwardsiella, Staphylococcus, Enterococcus, Bordetella, Proteus або Mannheimia.
18. Спосіб згідно з пунктом 17, де бактеріальна інфекція викликана Mannhemia haemolytica, Pasteurella multocida, Haemophilus somnus, Fusobactehum necrophorum, Bacterioides melaninogenicus, Actinobacillus pleuropneumoniae, Streptococcus suis, Salmonella cholerasuis, Mycoplasma bovis, Mycoplasma hyopneumoniae, Mycoplasma hyorhinis, Mycoplasma gallisepticum, Edwardsiella ictaluri, Escherichia соli, Enterobacter cloacae, Staphylococcus aureus, Staphylococcus intermedius, Enterococcus faecalis, Enterococcus faecium, Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter cloacae, Proteus mirabilis або Aeromonas salmonicida.
Текст
1. Сполука, що має формулу: C2 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ U (13) A61K 31/165 A61K 31/36 (2007.01) A61K 31/381 A61K 31/415 A61K 31/4174 (2007.01) A61K 31/4178 (2007.01) A61K 31/4196 A61K 31/42 A61K 31/421 A61K 31/4245 A61K 31/426 A61K 31/433 A61K 31/4406 A61K 31/4409 A61K 31/4418 A61K 31/4425 A61K 31/4965 A61K 31/50 A61K 31/505 A61K 31/53 A61P 31/04 (2007.01) C07C 233/18 (2007.01) C07C 233/31 (2007.01) C07C 233/47 (2007.01) C07C 251/48 (2007.01) C07C 255/60 (2007.01) C07C 311/37 (2007.01) C07C 311/46 (2007.01) C07C 317/32 (2007.01) C07D 213/40 (2007.01) C07D 213/63 (2007.01) C07D 213/73 (2007.01) C07D 213/75 (2007.01) C07D 213/84 (2007.01) (13) 78026 (11) (11) UA (51) МПК (2006) UA (19) (19) УКРАЇНА 3 78026 4 R8 є воднем у всіх сполуках, за винятком, коли R2 і R3 обидва є F, тоді R8 є воднем або F; і F сполука є або рацематом, що має показану відноHN O сну стереохімію, або є, по суті, енантіомерно чисR4 тою і має показану абсолютну стереохімію. R2 R3 2. Сполука згідно з пунктом 1, в якій: R2 і R3, незаR8 , лежно, вибирають з групи, що містить Сl і F; і R 8 є в якій: 2 3 воднем. R і R , незалежно, вибирають з групи, що містить 3. Сполука згідно з пунктом 1 або 2, де R4 є водень, (1С-4С)алкіл, гало, -CF3, -NH 2, -CN і N3; 6 OH 7 A 2 A A A R4 вибирають з групи, що містить: A 5 3 4 A A і 6 7 A A 8 A 10 9 A A , де: А1 є вуглецем або азотом і атоми вуглецю в кільці, незалежно, заміщені замісником, що вибирають з групи, яка містить водень, (1С-4С)алкіл, (3С6С)циклоалкіл, (1С-4С)алкілО-, -СF3, -ОН, -CN, гало, (1С-4С)алкілSO-, (1С-4С)алкілSO2-, NH2SO2-, (1С-4С)алкілNНSO2-, ((1С-4С)алкіл)2NSO2-, -NH2, (1С-4С)алкілNН-, ((1С-4С)алкіл)2N-, (1С4С)алкілSO2NН-, (1С-4С)алкілС(O)-, (3С6С)циклоалкілС(О)-, (1С-4С)алкілОС(O)-, (1С4С)алкілС(O)NН-, -C(O)NH2, (1С-4С)алкілNНС(O)- і ((1С-4С)алкіл)2NС(O)-, де будь-які алкільні групи в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН; А2 , А3 , А4 і А5, незалежно, вибирають з групи, що містить вуглець, азот, кисень і сірку, за умови, що, принаймні, один з А1-А5 не є вуглецем, і що загальна кількість атомів азоту, кисню і сірки в кільці не перевищує 4, і що кільце є ароматичним; а якщо А1 є вуглецем і кільце не містить кисень або сірку, один з атомів азоту може, необов'язково, бути заміщений замісником, що вибирають з групи, яка містить (1С-4С)алкіл, (1С-4С)алкілSO2- і -NH2; де: А6 , А7, А8, А9 і А10, незалежно, вибирають з групи, N що містить вуглець, азот і + A10 9 , де будь-який з А6-А10, що є вуглецем, є заміщеним замісником, що вибирають з групи, яка містить водень, -NH2, гало-, -CN, (1С-4С)алкіл-, (1С-4С)алкілС(O)-, (1С-4С)алкілSO-, (1С4С)алкілSO2-, NH2SO2-, (1C-4C)алкілSO2NH-, (1С4C)алкілNHSO2-, ((1C-4C)алкіл)2NSO2-, де будьяка з алкільних груп в будь-якому з замісників може бути незаміщеною або заміщеною гало або ОН. 4. Сполука згідно з пунктом 1 або 2, де R4 є A 6 7 A A 8 A 9 A A10 , де будь-який з А6-А10 , що є вуглецем може бути заміщений -NH2, а інші атоми вуглецю А6-А10 є незаміщеними. 5. Сполука згідно з пунктом 1 або 2, в якій R4 вибирають з групи, що містить: N O N N + тільки один з А -А може бути , а один, два або три атоми А6-А10 означають азот; і атоми вуглецю в кільці, незалежно, заміщені замісником, що вибирають з групи, яка містить водень, (1С-4С)алкіл, (3С-6С)циклоалкіл, (1С4С)алкілО-, -СF3, -ОН, -CN, гало, (1С-4С)алкілSO-, (1С-4С)алкілSO2-, NH2SO2-, (1С-4С)алкілNНSO2-, ((1С-4С)алкіл)2NSO2-, -NH2, (1С-4С)алкілNН-, ((1С4С)алкіл)2N, (1С-4С)алкілSO2NН-, (1С4С)алкілС(O)-, (3С-6С)циклоалкілС(О)-, (1С4С)алкілОС(O)-, (1С-4С)алкілС(O)NН-, -C(O)NH2, (1С-4С)алкілNНС(O)-, ((1С-4С)алкіл)2NС(O)- і ОСН2O-, при цьому атоми кисню в -ОСH2O- приєднані до сусідніх атомів вуглецю, де будь-які алкільні групи в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН; N , , N O , + N N N N , , N N N 10 + , N N N , N , за умови, що O , O N 6 A 8 1 N N , , N N N H 2N NH2 , N N H 2N N і H 2N , N N . 5 78026 6. Сполука згідно з пунктом 1 або 2, в якій R4 є 6 OH OH F 2 A 1 A 3 A 4 A A , де А1, А2, А3, А4 і А5 є такими, як визначено в пункті 1. 7. Сполука згідно з пунктом 6, в якій всі атоми вуглецю і азоту є незаміщеними. 8. Сполука згідно з пунктом 6, в якій один з А2-А5, що є вуглецем, заміщений -NH2 групою, всі інші вуглеці і атоми азоту в кільці є незаміщеними. 9. Сполука згідно з пунктом 1 або 2, в якій R4 вибирають з групи, що містить: S Cl NC HN N , F O Cl , HN F F O Cl N HN Cl , N , OH F F HN O Cl Cl HN N -O H 2N , N H 2N NH 2 , N , Cl Cl O O N O F N , H2 N , OH N S F N OH F F F , F HN O F F N N , HN F N F H3 C F F O HN N F F F O , S O Cl Cl , HN O Cl N Cl , N S F , F S , OH F O OH HN S HN F OH N OH OH F F , OH N O F N Cl , N O H2N HN S F HN N OH H2 N Cl H2N F O HN N F O H2 N OH F N HN N N HN , і 2 10. Сполука згідно з пунктом 2, яку вибирають з групи, що містить: H 2N OH N O , F HN F HN N Cl N OH F N O Cl N + , S N Cl N H2 OH O O Cl N HN N N , OH S , F N OH H 2N O F N , N , OH F HN N , N N F NC OH OH , O F O Cl N , F F N O N Cl H2 N OH Cl N , O Cl N HN S N Cl , HN OH N S O Cl N 5 F HN N , N HN O Cl Cl , де сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енантіомерно чистою і має показану абсолютну стереохімію. 11. Сполука згідно з пунктом 10, яку вибирають з групи, що містить: 7 78026 8 OH OH OH HN F F F HN O HN O N N F NC F N , FF F F OH HN Cl Cl O Cl O Cl N N N NC N . 13. Сполука згідно з пунктом 1, яку вибирають з групи, що містить: , OH OH HN F NC , , N OH NC F HN O F O F N H2N , OH OH F HN O F O N Cl H 2N HN N O F N Cl F S , OH F N N , OH HN F O HN O Cl Cl N S Cl Cl , N , де сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енантіомерно чистою і має показану абсолютну стереохімію. 12. Сполука згідно з пунктом 1, яку вибирають з групи, що містить: OH OH F F HN HN NC N O NC CN O N N3 O , і Представлений винахід стосується органічної хімії, фармацевтичної хімії, біохімії і медицини. Зокрема, стосується нових антибіотиків флорфеніколового типу. Флорфенікол антибіотиком широкого спектру дії з активністю проти багатьох грам-негативних і грам-позитивних бактерій. Флорфенікол корисний для попередження і лікування бактеріальних інфекцій завдяки сприйняття патогенами птахів, рептилій, риб, молюсків і ссавців. Одним з його перших застосувань є використання при лікуванні пневмонії і пов'язаних респіраторних інфекцій у великої рогатої худоби (часто взагалі згадується як респіраторне захворювання корів або РЗК) викликаних Mannhemia haemolytica, Pasturella multocida і(або) Haemophilus somnus. Його також призначають при лікуванні пододерматиту у великої рогатої худоби HN O F F . 14. Сполука згідно з пунктом 13, яка є рацематом, що має показану відносну стереохімію. 15. Сполука згідно з пунктом 1 або 13, де сполука є, в основному, енантіомерно чистою і має абсолютну конфігурацію 1-(R)-2-(S). 16. Спосіб лікування або попередження бактеріальної інфекції, що включає введення пацієнтові, який цього потребує, фармацевтично ефективної кількості сполуки згідно з пунктом 1, 2 або 13. 17. Спосіб згідно з пунктом 16, де бактеріальна інфекція викликана бактеріями роду Pasteurella, Haemophilus, Fusobacterium, Bacterioides, Aeromonas, Enterobacter, Escherichia, Klebsiella, Salmonella, Shigella, Actinobacillus, Streptococcus, Mycoplasma, Edwardsiella, Staphylococcus, Enterococcus, Bordetella, Proteus або Mannheimia. 18. Спосіб згідно з пунктом 17, де бактеріальна інфекція викликана Mannhemia haemolytica, Pasteurella multocida, Haemophilus somnus, Fusobactehum necrophorum, Bacterioides melaninogenicus, Actinobacillus pleuropneumoniae, Streptococcus suis, Salmonella cholerasuis, Mycoplasma bovis, Mycoplasma hyopneumoniae, Mycoplasma hyorhinis, Mycoplasma gallisepticum, Edwardsiella ictaluri, Escherichia соli, Enterobacter cloacae, Staphylococcus aureus, Staphylococcus intermedius, Enterococcus faecalis, Enterococcus faecium, Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter cloacae, Proteus mirabilis або Aeromonas salmonicida. викликаного Fusobacterium necrophorum і Bacterioides melaninogenicus, респіраторного захворювання свиней викликаного Pasteurella multocida, Actinobacillus pleuropneumoniae, Streptococcus suis, Salmonella cholerasuis і(або) Mycoplasma spp., колібацилезу у к урей викликаного Escherichia coll, кишкової септицемії у сомів викликаної Edwardsiella ictaluri, і фур ункульозу у лосося викликаного Aeromonas salmonicida. Іншими видами бактерій, що є сприйнятливими до дії флорфеніколу є Enterobacter, Klebsiella, Staphylococcus, Enterococcus, Bordetella, Proteus, і Shigella. Зокрема, хлорамфеніколстійкі штами організмів, таких як К.рnеumоnіае, Е.cloacae, S.typhus і Е.coli є сприйнятливими до флорфеніколу. 9 78026 Флорфенікол є стр уктурним аналогом тіамфеніколу, який в свою чергу є похідним хлорамфеніколу, в якому присутня ароматична нітрогрупа, де нітрогрупа втягнута в хлорамфеніколіндуковану недозозалежну незворотну апластичну анемію у людей, замінена метилсульфонільною групою. Флорфенікол має атом фтор у на місці первинної гідроксильної групи хлорамфеніколу і тіамфеніколу. Це надає флорфеніколу меншої сприйнятливості до деактивування бактерійвмісним плазмідкодованим ферментом, хлорамфеніколацетилтрансфераза (ХАТ), який ацилює первинну гідроксильну груп у хлорамфеніколу і тіамфеніколу, таким чином перешкоджаючи їх зв'язуванню з рибосомальними підодиницями сприйнятливої бактерії. Рибосомальне зв'язування є первинним механізмом дії хлорамфеніколових антибіотиків і призводить до інгібування пептидилтрасферази, яка відповідає за перенесення амінокислот до пептидних ланцюгів, що будуються, і подальшого утворення білку в бактерії. Однак, сполуки, що мають первинну гідроксильну групу не придатні для лікування бактеріальних інфекцій, що підтверджено тривалим застосуванням хлорамфеніколу і тіамфеніколу у всьому світі. В останні роки, ряд бактеріальних родів і видів почали проявляти деяку стійкість до флорфеніколу. Наприклад, стійкість спостерігається для видів Salmonella [Bolton, L.F., et al., Clin. Microbiol. 1999, 37, 1348], E. соli [Keyes, K., et al., Antimicrob. Agents Chemother., 2000, 44, 421.], Klebsiella pneumoniae [Cloeckaert, Б., et al., Antimicrob. Agents Chemother., 2001, 45, 2381], і у водних патогенах, Photobacterium damselae subsp. piscicida [раніше Pasteurella piscicida] [Kim, E., et al., Microbiol. Immunol., 1996, 40, 665]. Ця стійкість пояснюється висококонсервативним геном (flo), що продукує антибіотичний насос витікання (Flo). Поява і загрозливе поширення стійкості до флорфеніколу створює необхідність у нових антибіотиках, що зберігають або перевищують активність флорфеніколу, підтримуючи його непроникність до ферменту ХАТ і, крім того, не є субстратом для насосу витікання Flo. Сполуки представленого винаходу є такими антибіотиками. Таким чином, втіленням цього винаходу є сполука, що має хімічну формулу: в якій: R1 вибирають з групи, що містить -ОН і -F; R2 і R3, незалежно, вибирають з групи, що містить водень, (1С-4С)алкіл, гало, -CF3, -NH2, -CN і N3; R4 вибирають з групи, що містить: -C(=R 5)R6, де: R5 вибирають з групи, що містить кисень, NC=N і NOR7, 10 де: R7 вибирають з групи, що містить водень, алкіл, арил, гетероарил, аліцикліл і гетероаліцикліл; R6 вибирають з групи, що містить водень, (1С4С)алкіл, (3С-6С)циклоалкіл, (1С-4С)алкокси, арил, гетероарил, аліцикліл і гетероаліцикліл; де: А1 є вуглецем або азотом; А2 , А3, А4 і А5 , незалежно, вибирають з групи, що містить вуглець, азот, кисень і сірку, при умові, що, принаймні, один з А1-А5 не є вуглецем, що загальна кількість атомів азоту, кисню і сірки в кільці не перевищує 4 і що кільце є ароматичним; атоми вуглецю в кільці, незалежно, заміщені замісником, що вибирають з групи, яка містить водень, (1С-4С)алкіл, (3С-6С)циклоалкіл, (1С4С)алкілО-, -CF3, -OH, -CN, гало, (1С4С)алкілS(О)-, (1С-4С)алкілS(О)2-, NH2SO2-, (1C4C)aлкілNHSO2-, ((1С-4C)алкіл)2NSO2-, -NH2, (1С4С)алкілNН-, ((1С-4С)алкіл)2N-, (1С4С)алкілSО2NН-, (1С-4С)алкілС(О)-, (3С6С)циклоалкілС(О)-, (1С-4С)алкілОС(О)-, (1С4С)алкілС(О)NH-, -C(O)NH2, (1С-4С)алкілNНС(О)- і ((1С-4С)алкіл)2NС(О)-, де будь-які алкільні групи в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН; якщо А1 є вуглецем і кільце не містить кисень або сірку, один з атомів азоту може, необов'язково, бути заміщений замісником, що вибирають з групи, яка містить (1С-4С)алкіл, (1С-4С)алкілS(О)2і -NH2; де: А6 , А7, А8, А9 і А10, незалежно, вибирають з групи, що містить вуглець, азот і ві, що тільки один з А6-А10 при умоможе бути атоми вуглецю в кільці, незалежно, заміщені замісником, що вибирають з групи, яка містить водень, (1С-4С)алкіл, (3С-6С)циклоалкіл, (1С4С)алкілО-, -CF3, -OH, -CN, гало, (1С4С)алкілS(О)-, (1С-4С)алкілS(О)2-, NH2SO2-, (1С4С)алкілNНSО2-, ((1С-4C)алкіл)2NSO2-, -NH2, (1С4С)алкілNН-, ((1С-4С)алкіл)2N-, (1C4C)алкілSO2NH-, (1С-4С)алкілС(О)-, (3С6С)циклоалкілС(О)-, (1С-4С)алкілОС(О)-, (1С4С)алкілС(О)NН-, -C(O)NH2, (1С-4С)алкілNHС(О)-, ((1С-4С)алкіл)2NС(О)- і -ОСН2О-, атоми кисню в ОСН2О-приєднані до сусідніх атомів вуглецю, де будь-які алкільні групі в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН; R8 є воднем у всіх сполуках, за винятком, коли R2 і R3 обидва є F, тоді R8 є воднем або F; і, сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енантіомерно 11 78026 12 чистою і має показану абсолютну стереохімію. У втіленні цього винаходу, R 1 є -F. У втіленні цього винаходу, R 2 і R3, незалежно, вибирають з групи, що містить СІ і F. У втіленні цього винаходу, R 8 є воднем. і один з А2-А5, що є вуглецем, є заміщеним У втіленні цього винаходу, R4 є -C(=R5)R6, де NH2 групою, всі інші атоми вуглецю і, якщо можлиR5 і R6 є такими як визначено вище. во, атоми азоту в кільці є заміщеними. У втіленні цього винаходу, R 4 є СН 3С(О)-. В переважному втіленні цього винаходу, R4 4 У втіленні цього винаходу, R є вибирають з групи, що містить: де: А6 , А7, А8 , А9 і А10 є такими як визначено вище, і, будь-який з А6-А10 що є вуглецем заміщений замісником, що вибирають з групи, яка містить водень, -NH2, гало-, -CN, (1С-4С)алкіл-, (1С4С)алкілС(О)-, (1С-4С)алкілS(О)-, (1С4С)алкілS(О)2-, NH 2SO2-, (1С-4C)алкілSO2NH-, (1С4С)алкілNНSО2-, ((1С-4С)алкіл)2NSО2-, де будь-які алкільні групі в будь-якому з замісників можуть, необов'язково, бути заміщені групою, що вибирають з гало і -ОН. У втіленні цього винаходу, R 4 є Переважним втіленням цього винаходу є сполука, що вибирають з групи, яка містить: і один, два або три з А6-А10 є азотом(ами); і, один або два атоми вуглецю в кільці, що залишились, необов'язково, заміщені -NH2, всі інші атоми вуглецю в кільці є незаміщеними. В переважному втіленні цього винаходу, R4 вибирають з групи, що містить: У втіленні цього винаходу, R 4 є як визначено вище. У втіленні цього винаходу, R 4 є і всі атоми вуглецю і атоми азоту є заміщеними. У втіленні цього винаходу, R 4 є де сполука є або рацематом, що має показану відносну стереохімію, або є, по суті, енанті 13 78026 14 омерно чистою і має показану абсолютну стереофтор у, хлор у, брому або йоду. хімію. Як тут використовується, "алкіл" стосується Переважним втіленням цього винаходу є спонасиченого (не містить багатократні зв'язки) алілука, що вибирають з групи, яка містить: фатичного (не делокалізованої p-електронної системи) вуглеводню (що містить, якщо незаміщений, тільки атоми вуглецю і водню). Позначення (n1Сn2С)алкіл, де n1 і n2 є цілим числом 1-6, стосується нерозгалуженого або розгалуженого алкілу, що містить від n1 до n2 атомів вуглецю. Наприклад, (1С-4С)алкіл стосується СН 3-, СН3СН2-, СН3СН2СН2-, СН3СН(СН3)-, СН3СН2СН2СН2-, СН3СН2СН(СН3)- або (СН3)3С-. Алкільна група може бути незаміщеною або заміщеною одним або більшою кількістю замісників, що вибирають з групи, яка містить гало, -ОН, ОСН3, і -CºN. Як тут використовується, "циклоалкіл" стосується вуглецевих циклічних або конденсованих багатоциклічних кілець, які, хоча і можуть містити один або більшу кількість подвійних зв'язків, зберігають, по суті, алі фатичний характер; тобто, подвійні зв'язки є взаємодіють з утворенням делокалізованої p-електронної системи навколо кільця. Для цілей цього винаходу, кільце може містити до де сполука є або рацематом, що має показану 7 атомів вуглецю. Позначення (3С-6С)циклоалкіл відносну стереохімію, або є, по суті, енантіомерно стосується 3, 4, 5, і 6-членних вуглецевих кілець. чистою і має показану абсолютну стереохімію. Як тут використовується, "конденсований" ознаВ іншому особливо переважному втіленні цьочає, що дві циклоалкільні групи ділять, принаймні, го винаходу, сполука є, по суті, енантіомерно чисодин кільцевий атом між собою. Таким чином, такі тою і має абсолютну конфігурацію 1-(R)-2-(S). сполуки як спіро[4.4]нонан розглядаються як "конВтіленням цього винаходу є спосіб лікування денсовані" для цілей цього винаходу. Більш загаабо попередження бактеріальної інфекції, що льно, конденсовані кільця мають два спільні сусідвключає введення пацієнтові, що який цього поні кільцеві атоми вуглецю. Прикладом такої требує, фармацевтично ефективної кількості споконденсованої системи є декалін. Циклоалкільне луки. кільце може бути незаміщеним або заміщеним У втіленні цього винаходу, бактеріальна інфезамісником, що вибирають з групи, яка містить кція викликана бактерією роду Pasteurella, HaemoОН, -ОСН3, гало і -CºN. philus, Fusobacterium, Bacterioides, Aeromonas, Як тут використовується, "арил" стосується вуEnterobacter, Escherichia, Klebsiella, Salmonella, глецевого 6-членного кільця або двох конденсоваShigella, Actinobacillus, Streptococcus, Mycoplasma, них шестичленних кілець, кільце або конденсовані Edwardsiella, Staphylococcus, Enterococcus, Bordeкільця мають делокалізовану p-електронну систеtella, Proteus або Mannheimia. му. Термін "конденсований" означає, що кожне У втіленні цього винаходу бактеріальна інфеккільце системи ділить два сусідні атоми вуглецю з, ція викликана Mannhemia haemolytica, Pasteurella принаймні, одним іншим кільцем. Арильне кільце multocida, Haemophilus somnus, Fusobacterium може бути незаміщеним або заміщеним одним або necrophorum, Bacterioides melaninogenicus, більшою кількістю замісників, що вибирають з груActinobacillus pleuropneumoniae, Streptococcus suis, пи, яка містить -ОН, -ОСН3, гало і -CºN. Salmonella cholerasuis, Mycoplasma bovis, MyЯк тут використовується, "гетероарил" стосуcoplasma hyopneumoniae, Mycoplasma hyorhinis, ється п'яти-членного абошести-членного кільця Mycoplasma gallisepticum, Edwardsiella ictaluri, Esабо двох кілець, тобто, двох 5-членних, дво х шесcherichia coli, Enterobacter cloacae, Staphylococcus ти-членних або п'яти- і шести-членного кільця конaureus, Staphylococcus intermedius, Enterococcus денсованих разом, де кільце або конденсоване faecalis, Enterococcus faecium, Klebsiella кільце має делокалізовану p-електронну систему. pneumoniae, Klebsiella oxytoca, Enterobacter Якщо кільце є шести-членним, воно повинно місcloacae, Proteus mirabilis або Aeromonas тити тільки атоми вуглецю і водню і може містити salmonicida. від одного до чотирьох атомів азоту. Якщо кільце є Короткий опис Таблиць п'яти-членним, воно повинно містити один атом Таблиця 1 показує структури типових сполук азоту, кисню або сірки і може містити один. Два цього винаходу. Таблиця і сполуки не повинні розабо три додаткові атоми азоту. П'яти-членне кільглядатись як обмеження цього винаходу будь-яким це з колом по середині вказує на те, що кільце є чином. гетероароматичним. Коло використовується для Таблиця 2 є переліком мікроорганізмів проти підкреслення факту, що розташування подвійних яких тестувались сполуки цього винаходу. Перелік зв'язків, які приймають участь в утворенні гетероне повинен розглядатись як обмеження рамок цьоароматичного кільця, не є статичними, або це заго винаходу будь-яким чином. лежить від природи атомів, які утворюють кільце, Визначення тобто, вони є вуглецем, азотом, киснем або сіркою Як тут використовується, "гало" стосується і що групи, якщо це має місце, зв'язані з ними. Фа 15 78026 ктична структура будь-якого п'яти-членного гетероароматичного кільця буде очевидна середньому спеціалісту в цій галузі виходячи із зображених атомів кільця. Відносно гетероароматичних груп, термін конденсована має теж саме значення як і випадку арильних груп. Гетероарильна група може бути незаміщеною або заміщеною будь-яким із замісників описаних вище стосовно арильних груп. Як тут використовується, "ге тероаліцикліл" стосується циклічної або конденсованої кільцевої системи, що містить атоми, які вибирають з групи, що містить вуглець, азот, кисень і сірку, але без утворення делокалізованої p-електронної системи. Термін "конденсована" має теж саме значення що приведено вище для циклоалкільних кілець. Крім того, гетероаліциклільне кільце може бути незаміщеним або заміщеним будь-яким із замісників описаних вище стосовно циклоалкільних кілець. Коли б не було атом вуглецю кільця знаходиться в стані "незаміщений", зрозуміло, що будьякі незаповнені валентності зайняті атомами водню. Крім того, якщо атом вуглецю здатен бути заміщеним і він знаходиться в стані незаміщений, це означає, що азот є зв'язаним з атомом водню. Як тут використовується, "відносна стереохімія" стосується розташування замісників у просторі відносно один одного. Як тут використовується, "абсолютна стереохімія" стосується чіткого розташування замісників в тривимірному просторі як визначається правилом Кана-Інгольда-Прелога, використання якого добре відоме середньому спеціалісту в цій галузі. Як тут використовується, "енантіомер" стосується однієї або двох абсолютних стереохімічних конфігурацій молекули, що обертає площину поляризованого світла в одному з напрямків або в іншому (тобто, проти годинникової стрілки від її оригінальної вісі, умовно називається "ліво" або проти годинникової стрілки, умовно називається "право"). Під терміном "по суті, енантіомерно чистий" означає, що сполука складається більше ніж на 90% з одного з енантіомерів, переважно більше ніж на 95%, і найбільш переважно більше ніж на 99%. Як тут використовується, "рацемат" стосується 1:1 суміші двох енантіомерів сполуки. Рацемічні суміші позначаються позначкою (+/-). По суті, енантіомерно чисті сполуки показуються без позначки. Як тут використовується, "пацієнт" стосується птахів, рептилій, риб, молюсків і ссавців. Зокрема, він стосується птахів, таких як, без обмеження, кури і індики, риб, таких як, без обмеження, лосося, форелі, сома і жовтохвіст, ссавців, таких як, без обмеження, кішки, собаки, кролики, вівці, велика рогата худоба, свині, коні і кози і люди. Обговорення Сполуки цього винаходу, як очікується, є корисними для лікування бактеріальних інфекцій у пацієнтів. Сполуки Сполуки представленого винаходу загалом приведені в розділі Короткий опис винаходу, вище. Характерні сполуки цього винаходу показані в Таблиці 1. Ні таблиця, а ні сполуки показані тут не призначені або не повинні розглядатись як обмеження рамок цього винаходу будь-яким чином. 16 17 78026 18 19 78026 20 21 78026 22 23 78026 24 Синтез Проміжні сполуки одержували в енантіомерно чистій формі, виходячи з комерційно доступної хлорамфеніколової основи (1), або як рацемічну суміш шля хом конденсування пбромбензальдегіду з гліцином в основному середовищі. Для енантіомерно чистого синтезу проміжних сполук, таких як 9, хлорамфеніколову основу перетворюють у сполуку 3 [Rebstock, М. С, et al., J. Am, Chem. Soc, 1949, 71, 2458; Evans, D. D., et al., J. Chem. Soc, 1954, 1687; Morris, D. S. і Smith, S. D., J. Chem. Soc, 1954, 1680]. Сполуку 3 піддають реакції Сандмейєра після якої ацетатну захисну груп у видаляють в кислому середовищі одержуючи енантіомерно чисту 9. Альтернативно, п-бромбензальдегід (5) можна перетворити у (d/І)-трео-п-бромфенілгліцин (6, Схема 1), [Bolhoffer, W.A. J. Am. Chem. Soc. 1954, 76, 1322; Herbert, R.В.; Wilkinson, В.; Ellames, G.J. Can. J. Chem. 1994, 72, 114], який можна захистити як N-Вос похідне 7 і потім відновити в дві стадії: активування DCC і N-гідроксисукцинімідом з наступною обробкою NaBH4 з одержанням 8. Сполуку 9 можна виділити як її ТФО сіль або як вільну основу. Регіоселективне введення фториду здійс 25 78026 26 нюється шляхом захисту аміну і бензильної гідровання з 22 дає менший вихід ніж у випадку 23. ксильної групи як фенілоксазоліну 10 з наступним Конденсування використовуючи 21 дає бажані фтор уванням використовуючи трифторид (діетипродукти забруднені аналогами ацетату і моноламіно)сірки (DAST) або трифторид [біс(2хлороацетату. метоксиетил)аміно]сірки [Lai, G. S., J. Org.Chem., Рацемічна сполука 20 була спектроскопічно 1999, 64, 7048] одержуючи 11. Сполуку 11 викориідентичною зразку синтезованому з напівсинтетистовують в реакції перехресного конденсування чного 11 шляхом гідролітичного відщеплення і осСузукі для синтезу барильних похідних. Інший парновної обробки. Це чітко підтверджує, що кондентнер реакції Сузукі, арилборна кислота, така як 12, сування фенілсерину 6 відбувається з прийнятною можна одержати як показано, реагує з арилгалоївідносною трео або син стереохімією. дами. Умови видалення фенілоксазолінзахичної групи несумісні з багатьма функціональними групами в п-положенні ароматичного кільця. Таким чином, нові захисні групи мотивують розвиток виходячи з літературних методів [Схема 2; Jommi, G., et al., Gazz. Chim. Ital., 1986, 116:485]. Фенілсерин 6 перетворюють у метиловий естер 13, який був за хищений як оксазолідинон 14, який, в свою чергу, відновлювали NaBH4 до 15. Фторування або DAST, або фтрифторидом [біс(2метоксиетил)аміно]сірки дає проміжний 16, який не забезпечує доброго виходу реакції Сузукі. Таким чином, 16 перетворювали у 17. Відщеплення оксазолідинонзахисної групи сприяє введення Восгрупи [Grehn, L, et al., Acta Chem. Scand. B, 1986, 40, 745] з наступним відщепленням, що каталізується основою, дає 18 [Ishizuka, Т. і Kunieda, Т., Tetrahedron Lett., 1987, 28, 4185; Jommi, G., et al., Gazz. Chim. Ital., 1988, 118:75]. Сполуку 18 захищали як ізопропіліденове похідне 19, яке перетворювали у борну кислоту 23 (Схема 3). Сполуки 18, 19, 22 і 23 використовували в реакції конденсування Сузукі. Сполука 23 є найбільш універсальною, оскільки, її можна конденсувати з будь-яким арилбромідом або йодидом і захисні групи можна легко видалити в м'я ких умовах. Сполука 22 цікава як партнер конденсування Сузукі, оскільки, реакції конденсування дають бажані аналоги флорфеніколу безпосередньо без зняття захисту і дигалоацетилювання. Однак, конденсу Сполуки 11 і 12 використовували для одержання сполук 28 і 29 (Схема 4). Сполуку 11 конденсували з 3-піридинборною кислотою за стандартних біфазних реакції Сузукі одержуючи захищений інтермедіат 26. N-C конденсований продукт 27 одержували згідно з нещодавно описаними Lam і співробітниками методами [Lam, P. Y.S., et al., Synlett, 2000, 674; Lam, P.Y.S., Tetrahedron, Lett., 1998, 39, 2941; Lam, P. Y.S., Tetrahedron Lett., 2001, 42, 3415]. І з 26, і з 27 знімали захист і дихлороацилювали одержуючи 28 і 29. Сполука 23 і 2-бром-1,3,4-тіадіазол (24) реагували даючи 48 (Схема 5). Конденсування Сузукі дає гетеробіарил 25. З сполуки 25 знімали захист використовуючи 9:1 ТФО/Н2 О, з одночасним видаленням Вос і ізопропіліденових груп, і потім дифторацилювали одержуючи 48. Не дивлячись на те, що похідні з пбромфункціональними групами, такі як 11, і відповідні борні кислоти, такі як 12, є достатньо корисними як синтетичні проміжні сполуки для аналогів флорфеніколу, п-ціаносполуки також є корисними як важливі проміжні сполуки. Використовуючи літературні методи [Morris, D.S.; Smith, S.D., вище], одержували проміжні сполуки, такі як 30, в енантіомерно чистій формі (Схема 6). Великі кількості 27 78026 проміжного продукту одержували використовуючи рацемічні повністю синтетичні проміжні сполуки, такі як 35. Альдольну конденсацію використовували для одержання 32 з п-ціанобензальдегіду і метилового естеру гліцину адаптували літературну методику [Pines, S.H. і Kazlowski, М.Б., J. Org. Chem., 1972, 37, 292]. Сполуку 41 (Схема 7) одержували з проміжної сполуки 36, одержання якої з 30 описано [von Strandtmann, M., et al., J. Med. Chem., 1967, 10, 888]. З Сполуки 36 знімали захист використовуючи водну H2SO 4 і потім регіоселективно захищали як фенілоксазолін 38. Сполуку 39 одержували обробкою DAST і потім знімали захист і дихлороацилювали одержуючи 41. Сполуку 47 одержували з проміжної сполуки 35 шляхом обробки гідрохлоридом гідроксиламіну і потім триетилортоформіатом одержуючи 43, який піддавали зняттю захисту одержуючи 46, який потім дихлорацилювали. п-Ацилпохідні одержували за допомогою реакції конденсування Стілла захищених проміжних сполук (Схема 9, сполуки 87 і 88) хлоридами кислот. Триметилстанільні групи вводили за допомогою Pd-медійованої реакції використовуючи гексаметилдиолово. 28 Циклобутилпохідне 73 одержували з 87 за допомогою реакції конденсування Стілла, що дає проміжну сполуку 89 (С хема 10), яку піддавали зняттю захисту і дихлорацилюванню. Невдала спроба зняти захист з циклопропілпохідного використовуючи НСІ с метою одержання відповідної 89 приводила до розкриття циклу. Таким чином, для одержання 91, використовується boc/ізопропіліденовий підхід, оскільки зняття захисту проводиться за умов, що не діють на циклопропільну гр упу. Коли необхідно, п-карбоксифенілпохідні захищених проміжних сполук феніколу можна одержати двома шляхами. Наприклад, гідроліз пнітрильного аналогу 17 дає відповідну карбонову кислоту. Однак, зазвичай нітрили складно одержати так легко, як бромпохідні. Таким чином, переважний підхід до карбоксилювання полягав у заміні бромгрупи. Наприклад, похідне карбонової кислоти 102 (Схема 11) одержували шляхом літіювання 17 з наступною обробкою СО2 і обробкою кислотою. Сполуку 102 перетворювали у метиловий естер 103, який реагував з гідразином даючи 104. Циклізування 104 з триетилортоформіатом давало оксадіазол 105, який піддавали зняттю захисту і дигалоацилюванню одержуючи 106 і 107. Похідне карбонової кислоти 102 також використовували для одержання сполук таких як 109 (Схема 12), шляхом відновлення спирту 108 з наступним зняттям захисту і ди хлорацетилюванням 29 78026 30 сполуки, що досліджуються, одержували в чотирикратних бажаних кінцевих концентраціях. Розведення до бажаної концентрації проводили безпосередньо на планшетах серією 2-кратних розведень використовуючи багатоканальну піпетку. Після розведення, додавали 25мкл САМНВ до Біологічна оцінка кожної лунки. Всі сполуки цього винаходу, як очікувалось, Бактерії для інокуляції одержували наступним демонструють антибактеріальну активність проти чином. Для кожного штаму, одну виділену колонію деяких бактерій, як і інші члени родини хлорамфевикористовували для інокуляції в САМНВ об'ємом ніколу. Крім того, як очікується, вони можуть бути 5мл. Культури інкубували протягом ночі (20 годин) активні проти видів, що є стійкими до лікування при 35°С інкубаторі, що збовтується. Потім їх розхлорамфеніколовими антибіотиками, зокрема, водили стерильним саліном до густини еквіваленфлорфеніколу. Також очікується, що представлені тної 0,5 суспензії МакФарланд (приблизно, сполуки можуть проявляти активність проти родів і 108КУО/мл). Суспензії надалі розводили в САМНВ видів бактерій проти яких антибіотики хлорамфедо приблизно 5x105КУО/мл. Об'єм 50мкл додавали ніколового типу не активні. до кожної лунки інокулюванням. Позитивні і негаТакож зрозуміло, стосовно біоактивності, що тивні контролі були включені до кожного планшеодин з енантіомерів сполуки може бути більш акту. Оригінальну інокулу визначали використовуючи тивним ніж інший. В такому випадку, це або чітко 10мкл декількох 10-кратних розведень на TSA констатується, або ні, більш активний ізомер розпланшетах. Планшети з агаром інкубували протяглядається як переважне втілення цього винаходу. гом ночі при 35°С і підраховували колонійутворюНайбільш переважним є найбільш активний енанючі одиниці (КУО). Мікротитрвані планшети інкубутіомер з 1-(R)-2(S) абсолютною конфігурацією вали протягом 20 годин при 35°С і зчитували будь-якої з тут описаних сполук. використовуючи зчитувач мікротитрованих планДля визначення діапазону і інтервалу активношетів (Molecular Devices) при 650нм і за допомості сполук цього винаходу можуть бути використані гою візуального спостереження використовуючи наступні протоколи. Інші такі протоколи будуть дзеркальний зчитувач мікротитрованих планшетів очевидні середньому спеціалісту в цій галузі ґрундля визначення МІК. туючись на описі приведеному тут і знаходяться в Сполука представленого винаходу, її пролімежах цього винаходу. Деякі сполуки представлені карська форма або фізіологічно прийнятна сіль тут не тільки проявляють значну антибактеріальну сполуки, або її пролікарської форми, можуть бути активність, але також є менш сприйнятливими до введенні, по суті, пацієнту, або можуть бути введії механізмів стійкості до хлорамфеніколу. Приденні у фармацевтичну композицію в якій згадані ведені протоколи скринінгу можуть бути викорисвище матеріали змішані з придатними екціпієнтатані для визначення таких характеристик. ми(ом). Методики формування і введення лікарсьДослідження чутливості ких засобів можна знайти в Remington's PharmaСполуки оцінювали проти панелей бактеріальcological Sciences, Mack Publishing Co., Easton, Pa., них штамів використовуючи досліджуваний мікроостаннє видання. Рецептури і методики обговорозведений бульйон одержаний як рекомендуєтьрюються Ремінгтоном стосовно застосування по ся NCCLS [Національний комітет з клінічних відношенню до людей; однак, вони можуть бути лабораторних стандартів (NCCLS) 2000, Methods легко модифіковані для використання по відноfor Dilution of Antimicrobial Susceptibility Tests for шенню до тварин використовуючи методики добре Bacteria That Grow Aerobically-Fifth Edition, Apвідомі спеціалісту в ветеринарній практиці. proved Standard, NCCLS Document M7-A5, Vol 20, Як тут використовується, "введення" стосуєтьNo.2]. Мінімальну інгібувальну концентрацію (МІК) ся вивільнення сполуки, солі або пролікарської визначають як найнижча концентрація сполуки, що форми представленого винаходу або фармацевпопереджає ріст бактерій. тичої композиції, що містить сполуку, сіль або проНаступні 10 організмів складають первинну лікарську форму цього винаходу в організмі з цілпанель оцінки: лю лікування або попередження мікробної інфекції. Придатними шляхами введення є, без обмеження, пероральний, ректальний, трансмукозальний, внутрішньом'язовий, підшкірний, внутрішньомозковий, інтратекальний, внутрішньошлунковий, внутрішньовенний, інтравитреальний, інтраперитонеальний, інтраназальний, ауральний або інтраокулярний. Переважними шляхами введення є пероральний і парентеральний. Альтернативно, сполука може переважно вводитись локально ніж систематично, наприклад, за допомогою мазі, що наноситься безпосередньо на Дослідження проводили в Cation-Adjusted інфіковану область або ін'єктування сполуки безMueller-Hinton Broth (CAMHB) при інокуляцій бакпосередньо в інфіковану тканину. В будь-якому 5 терій 5x10 КУО/мл і кінцевому об'ємі 100мкл. Фловипадку, може бути використана рецептура з трирфенікол і хлорамфенікол, як контрольні сполуки, і валим вивільненням. 31 78026 32 Композиція/Рецептура ктеризування різних комбінацій доз активної Фармацевтичні композиції представленого висполуки. находу можна одержати за допомогою способів Фармацевтичними композиціями, що можуть відомих в цій галузі, наприклад, використовуючи бути використані перорально є капсули з щільною різноманіття добре відомих процесів змішування, насадкою виготовлені з желатину, також як і м'які, розчинення, гранулювання, одержання драже, запечатані капсули виготовлені з желатину і пласрозтирання в порошок, емульсифікування, інкаптифікатору, такого як гліцерин або сорбіт. Капсули сулювання, включення або ліофілізації. Композиції з щільною насадкою можуть містити активні інгреможуть бути сформовані шляхом зв'язування з дієнти в суміші з наповнювачами, такими як лактоодним або більшою кількістю фізіологічно прийняза, зв'язувальний агент, такий як крохмаль, і/або тних носіїв, що включають екціпієнти і допоміжні змащувальний агент, такий як тальк стеарат магагенти, які полегшують обробку активних сполук нію і, необов'язково, стабілізатори. В м'яких капсупри одержанні і які можуть бути фармацевтично лах, активні сполуки можуть бути розчинені або використовуваними. Характерний склад залежить суспендовані в придатних рідинах, таких як жирні від вибраного шляху введення. олії, рідкий парафін або рідкі поліетиленгліколі. Для ін'єктування, включаючи, без обмеження, Також в ці рецептури можуть бути додані стабілівнутрішньовенне, внутрішньом'язове і підшкірне затори. ін'єктування, сполуки винаходу можна сформувати Для введення за допомогою інгаляції, сполуки у водні розчини, переважно у фізіологічно сумісні представленого винаходу зр учно вивільнювати у буфери, такі як розчин Ханка, розчин Рінгера, фізіформі аерозольного спрею використовуючи приологічний забуферений салін або полярні розчинстрій під тиском або розпилювач з придатним проники, такі як, без обмеження, N-метил-2-піролідон, пелантом, наприклад, без обмеження, дихлорди2-піролідон, інші піролідони, N,N-диметилацетамід, фторметан, трихлорофторметан, N,N-диметилформамід, диметилсульфоксид, ацедихлортетрафторетан або діоксид вуглецю у витон і гліцеринформаль. Для трансмукозального падку аерозолю під тиском, одиниця дозування введення, в рецептурі використовують прийнятні може контролюватись за допомогою клапану, що пенетранти, що покращують проникнення. Такі вивільнює вимірювану кількість. Капсули і картрипенетранти зазвичай відомі в цій галузі. джі, наприклад, желатинові для використання в Для перорального введення, сполука можна інгаляторі або апараті для вдування можуть бути сформувати шля хом об'єднання активних сполук з сформовані таким чином, що містять порошкопофармацевтино прийнятними носіями добре відодібну суміш сполуки і прийнятної основи, такої як мими в цій галузі. Такі носії дають можливість лактоза або крохмаль. сформувати сполуки винаходу як таблетки, пігулСполуки також можуть бути сформовані для ки, лозенги, драже, капсули, рідини, гелі, сиропи, парентерального введення, наприклад, у вигляді пасти, суспензії, розчини, суспензії, концентровані ін'єкції болюсу або тривалого вливання. Рецептури розчини і суспензії для розведення питною водою для ін'єктування можуть бути наявні в одиничній пацієнтом, заздалегідь приготовлені суміші для дозованій формі, наприклад, в ампулі або в багарозведення в їжі пацієнта, і т.і., для перорального тодозовому контейнері. Корисними композиціями вживання пацієнтом. Фармацевтичні рецептури є, без обмеження, суспензії, розчини або емульсії для перорального використання можуть бути одев масляному або водному розчиннику, і можуть ржані використовуючи тверді екціпієнти, необов'ямістити допоміжні агенти, такі як суспендувальні, зково, при бажанні, змелюючи одержану суміш і стабілізувальні і/або диспергувальні агенти. Фарпіддаючи суміш гранулюванню, після додавання мацевтичні композиції для парентерального ввеінших придатних допоміжних агентів, з одержандення включають водні розчини водорозчинних ням таблеток або ядер драже. Корисними екціпієнформ, такі як, без обмеження, солі активної сполутами є, зокрема, наповнювачі, такі як цукри, вклюки. Крім того, суспензії активних сполук можна чаючи лактоза, цукроза, маніт або сорбіт, похідні одержати в ліпофільному розчиннику. Придатними целюлози, такі як, наприклад, кукурудзяний крохліпофільними розчинниками є жирні кислоти, такі маль, пшеничний крохмаль, рисовий крохмаль і як кунжутова олія, синтетичні естери жирних кискартопляний крохмаль і інші матеріали, такі як желот, такі як етил олеат і тригліцериди або матеріалатин, трагакантова камедь, метилцелюлоза, гідли, такі як ліпосоми. Водні суспензії для ін'єктуроксипропілметилцелюлоза, натрій карбоксиметивання можуть містити речовини, що збільшують лцелюлоза і/або полівінілпіролідон (ПВП). При в'язкість суспензії, такі як натрій карбоксиметилцебажанні, можуть бути додані дезінтегрувальні агелюлоза, сорбіт або декстран. Необов'язково, сунти, такі як поперечнозв'язаний полівінілпіролідон, спензії також можуть містити придатні стабілізатоагар або алгінова кислота. Також можуть бути вири і/або агенти, що збільшують розчинність сполук, користана сіль, така як алгінат натрію. що дозволяє одержати висококонцентровані розЯдра драже забезпечують придатними почини. Альтернативно, активний інгредієнт може криттями. Для цих цілей, можуть бути використані бути у формі порошку для відновлення придатним концентровані розчини цукру, які можуть, необорозчинником, наприклад, стерильною пірогенвільв'язково, містити арабську камедь, тальк, полівініною водою, перед використанням. лпіролідон, гель карбополю, поліетиленгліколь Сполуки також можуть бути сформовані в рекі/або діоксид титану, лакувальні розчини і придатні тальні композиції, такі як супозиторії або клізми, органічні розчинники або суміші розчинників. Барщо утримуються, використовуючи, наприклад, завники або пігменти можуть бути додані до таблегальновідомі основи супозиторіїв, такі як масло ток або ядер драже для ідентифікуванні або харакакао або інші глицериди. 33 78026 34 На додаток до рецептур описаних вище, спо1975, в "The Pharmacological Basis of Therapeutics", луки також можуть бути сформовані як рецептури Ch.1 p,1]. Однак, зазвичай, необхідний переваждепо. Такі довгодіючі рецептури можуть бути ввений інтервал дозування для системного вивільденні шляхом імплантації (наприклад, підшкріно нення сполуки цього винаходу буде складати від або внутрішньом'язово) або за допомогою внутріприблизно 1 до приблизно 100мг/кг. Необхідний шньом'язової ін'єкції. Сполуки цього винаходу мопереважний інтервал дозування для місцевого жуть бути сформовані для цього шляху введення з застосування буде зазвичай складати від приблипридатними полімерними або гідрофобними матезно 0,1мг до приблизно 1г. ріалами (наприклад, у вигляді емульсії з фармакоРозмір дози і інтервал може підбиратись індилогічно прийнятним маслом), з іонообмінними відуально для забезпечення в плазмі рівнів сполусмолами, або як поганорозчинні похідні, такі як, ки, що є ефективною для підтримання концентрабез обмеження, поганорозчинна сіль. ції еквівалентної МІК або будь-якого бажаного Можуть бути використані інші системи вивільрівня. Такі рівні в плазмі часто відносять до мінінення для відносно гідрофобних фармацевтичних мальних ефективних концентрацій (МЕК). МЕК сполук. Ліпосоми і емульсії є добре відомими прибуде змінюватись для кожної сполуки, але можуть кладами розчинників носіїв вивільнення гідрофоббути оцінені з in vitro даних, наприклад, концентних лікарських засобів. Крім того, можуть бути вирація необхідна для досягнення 80+% інгібування користані органічні розчинники, такі як мікробу, може бути встановлена використовуючи диметилсульфоксид, хоча часто з ризиком більшої дослідження описані тут. Дози необхідні для досятоксичності. гнення МЕК будуть залежати від індивідуальних Крім того, сполуки можуть бути вивільнені вихарактеристик і шляху введення. Для визначення користовуючи системи тривалого вивільнення, такі концентрацій в плазмі можна використати ВЕРХ як напівпроникні матриці твердих гідрофобних дослідження або біодослідження. полімерів, що містять терапевтичний агент. Різні Інтервали дозування також можна визначити матеріали тривалого вивільнення загально прийнвикористовуючи значення МЕК. Сполуки слід ввояті і добре відомі спеціалістам в цій галузі. Капсули дити використовуючи режим, щоб підтримати рівні тривалого вивільнення можуть, в залежності від їх в плазмі приблизно МЕК для 10-90% часу, перехімічної природи, вивільнювати сполуку протягом важно приблизно 30-90% і найбільш переважно від декількох тижнів до понад 100 днів. В залежноприблизно 50-90%. сті від хімічної природи і біологічної стабільності У випадку локального введення або селективокремої сполуки, можуть бути використані додатного поглинання, ефективна локальна концентракові методики стабілізації. ція лікарського засобу може не залежати від конФармацевтичні композиції корисні тут також центрації в плазмі і можуть бути використані інші можуть включати тверді або гелеподібні носії або методики для визначення необхідної кількості дози екціпієнти. Прикладами таких носії або екціпієнтів і інтервалу відомі в цій галузі. є, але не обмежується, карбонат кальцію, фосфат Кількість композиції буде, звичайно, залежати кальцію, різні цукри, крохмалі, похідні целюлози, від пацієнта, що лікується, складності інфекції, желатин і полімери, такі як поліетиленгліколі. способу введення, призначення лікаря і т.і. Вираз "терапевтично ефективна кількість" стоПри бажанні, композиції будуть представлені у сується кількості сполуки ефективної для попереформі упаковки або роздаточного пристрою, такодження, полегшення або покращення симптомів го як FDA схвалений набір, якій може містити один мікробної інфекції. Визначення терапевтично ефеабо більшу кількість дозованих форм, що містять ктивної кількості знаходиться в межах кваліфікації активний інгредієнт. Упаковка може містити, наспеціаліста в цій галузі, особливо, в світлі описаприклад, металеву або пластикову фольгу, такий ного тут. як блістер. Упакування або роздаточний пристрій Для будь-якої сполуки використовуваної в споможе супроводжуватись інструкціями з введення. собах винаходу, терапевтично ефективна кількість Упакування або роздаточний пристрій також може може бути оцінена спочатку на основі клітинних супроводжуватись нотатком об'єднаним з контейдосліджень. Тоді, може бути сформована доза для нером у формі пропису урядової агенції з регулювикористання на тваринних моделях для досягвання виготовлення, використання або продажу нення циркулюючої концентрації в інтервалі, що фармацевтичних препаратів, де нотаток відобравключає МІК, як визначено в культурі клітин. Така жає у схваленій агенцією формі склад або шлях інформація може потім бути використана для введення людині або ветеринарне застосування. більш точного визначення доз корисних пацієнтам. Такий нотаток, наприклад, може бути помічений Токсичність і терапевтична ефективність спосхваленим адміністрацією Сполучених Штаті в з лук описаних тут може бути визначена за допомохарчових продуктів і лікарських засобів для рецепгою стандартних фармацевтичних методик для турних лікарських засобів або схваленого введенкультур клітин або експериментальних тварин. ня продукту. Композиції, що містять сполуку винаНаприклад, МІК і LD50 для окремої сполуки можуть ходу сформовані із сумісним фармацевтичним бути визначені за способами добре відомими в цій носієм також можуть бути одержані, шляхом помігалузі. Одержані дані можуть бути використані для щення їх в прийнятний контейнер і маркування для формування інтервалу доз корисного для пацієнлікування вказаного стану. тів. Дози, звичайно, можуть змінюватись в залежПриклади ності від форми дози і шляху введення. Рецептуру, Наступні приклади забезпечують ілюстрацію шлях введення і дозу може вибрати лікар з огляду деяких втілень цього винаходу і не призначені для на стан пацієнта. [Дивіться наприклад, Fingl, et al., його обмеження його границь будь-яким чином. 35 78026 36 Вихідні матеріали одержували з комерційних et al., supra, Crooks H.M. et al., supra; Evans, D.D.; постачальників і використовували без подальшого Morris, D.S. et al., supra]. Після промивання N2, очищення, якщо не вказано інше. Хімічними поPd/C додавали і суміш перемішували під Н 2 (1атм) стачальниками є Aldrich, Fluka, і Lancaster. протягом 16 годин. Pd/C потім видаляли фільтруPd(PPh3)4 одержували від Lancaster або Strem і ванням крізь Целіт. Розчин концентрували у вакунегайно переносили в пляшечки промиті N2 (приумі і залишок очищали за допомогою хроматограблизно 10 і 100мг кожного) в N2 захисному мішку. фії на силікагелі, використовуючи як елюент 15% Пляшечки загортали у алюмінієву фольгу і зберіМеОН в СН2СІ2 одержуючи 3 (7,13г, 31,7ммоль). 1Н гали в N2-наповненених саморобних мішках при ЯМР (300МГц, CD3OD): d 1,92 (с, 3Н), 3,40 (дд, 1Н, 20°С. PdCI2(dppf) одержували від Aldrich і викорисJ=11,1, 6,0), 3,61 (дд, 1Н, J=11,1, 5,7), 4,01 (м, 1Н), товували з пляшки. Використовували стандартні 4,73 (д, 1Н, J=5,4), 6,69 (д, 2Н, J=8,4), 7,11 (д, 2Н, ступені очистки розчинників, які необов'язково буJ=8,4). ли безводними. Безводні розчинники одержували від хімічних постачальників і використовували як є. 1 Н ЯМР спектр знімали на спектрометрі 300МГц Varian FT-ЯМР і виражали у форматі "хімічний зсув (мультиплентність, інтегрування, консВодний розчин NaNO2 (1,27г, 18,5ммоль, 50мл танта взаємодії)." Константи взаємодії виражали в Гц. Масспектр одержували на одноквадрупольноН2О) додавали по краплям до розчину 3 (3,76г, му спектрометрі Micromass Platform II спорядже16,8ммоль) в 35мл 48% водного НВr при 0°С. Пісному елеткросперейіонізацією (ЕСІ). ля завершення додавання, суміш перемішували протягом 30хв при 0°С. Суміш потім додавали по Використовували три наступні способи конкраплям до розчину CuBr (2,65г, 18,45ммоль) в денсування Сузукі: Спосіб А: арилборну кислоту (0,167ммоль) і 15мл 48% водного НВr. Суміш нагрівали до кімнаарилбромід (0,334ммоль) об'єднували в суміші тної температури і перемішували протягом ще 16 водного Na2CO3 (3мл 10% (в/в) розчину) і ТГФ годин. Реакційну суміш нейтралізували 3М водним NaOH, фільтрували крізь шар Целіту, і екстрагува(5мл). Суміш недовго промивали N2. Додавали ли EtOAc (3 x100мл). Об'єднані органічні фракції Pd(PPh3)4 (10моль %, 0,0167ммоль), суміш промивали N2, і потім кип'ятили протягом 16 годин. Реасушили над безводним Na2SO4 і концентрували у кційну суміш розводили етилацетатом (ЕtOАс), вакуумі одержуючи 1,2г (4,17ммоль) неочищеного промивали насиченим розчином розсолу, сушили продукту, що використовували без подальшого над безводним Na2SO4 і концентрували. Залишок очищення. 1Н ЯМР (300МГц, CD3OD): d 1,87 (с, потім очищали хроматографічно. 3Н), 3,48 (дд, 1Н, J=11,0, 5,9), 3,69 (дд, 1Н, J=11,0, Спосіб Б: арилборну кислоту (0,301ммоль), 6,5), 4,01 (м, 1Н), 4,91 (д, 1Н, J=3,6), 7,30 (д, 2Н, арилбромід (0,602ммоль) і Cs 2CO3 (0,903ммоль) J=8,3), 7,45 (д, 2Н, J=8,3). об'єднували в ТГФ (2,0мл), ДМФА (2,0мл) і Н2О (0,5мл) при кімнатній температурі. Суміш промивали N2 протягом 5хв і додавали дихлорметановий комплекс [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію (II) (0,0301ммоль). Суміш промивали N2 протягом 5 хвилин і потім перемішували при 55°С протягом 16 4-Бромбензальдегід (100г, 0,540моль) розчигодин. Суміш концентрували у вакуумі, розводили няли в етанолі (ЕtOН) в 2л круглодонній колбі. При EtOAc і промивали розсолом. EtOAc сушили над швидкому перемішуванні додавали гліцин (0,5 безводним Na2SO4 і концентрували. Залишок молярних еквівалентів, 20,3г, 0,270моль) і потім, очищали хроматографічно. однією порцією, КОН (30,3г, 0,540моль). Головне Спосіб В: арилборну кислоту (0,934ммоль), додати увесь КОН одразу. Таким чином, коли проарилбромід (2,34ммоль) і Cs 2CO3 (2,80ммоль) суводиться реакція у великому об'ємі повинна викоспендували в суміші толуолу (4мл), н-бутанолу ристовуватись льодяна баня для контролювання (4мл), і Н2О (2мл). Суміш промивали при кімнатній екзотермії. Після додавання КОН, мутна суспензія температурі N2 після чого додавали Pd(PPh3)4 стає жовтою і гомогенною. Через приблизно 15 (0,280ммоль). Суміш промивали N2 протягом ще 5 хвилин, починає утворюватись тонкий білий осад. хвилин і потім нагрівали до 75°С. Через 12 годин, Суміш перемішували протягом 12 годин при кімнасуміш охолоджували до кімнатної температури і тній температурі під N2. Додавали достатню для концентрували у вакуумі. Залишок розділяли між зміни рН розчину на червоний кількість 2N водного Н2О (75мл) і EtOAc (75мл). EtOAc шар промивали НСІ (~400мл). Суміш потім перемішували приблирозсолом (2x50мл), сушили над безводним зно при 60°С до одержання знову гомогенного жоNa2SO4, і концентрували у вакуумі. Залишок очивтого розчину. ЕtOН видаляли у вакуумі одержующали хроматографічно. чи водну суспензію білого осаду. Осад фільтрували і водний розчин, що залишився, три рази промивали EtOAc. Водний розчин потім підлуговували до приблизно рН9 концентрованим водним NH3 і надлишок аміаку видаляли у вакуумі. Після видалення NH3, продукт, 6, починав утворюВ 80мл метанолу розчиняли 8,13г (32,0ммоль) ватись. Упарювали розчин до однієї-четвертої об'хлорамфеніколової основи як N-ацетат, одержуєму. Коли починав утворюватись осад. Продукт вали за літературними методами [Rebstock, М.С, 37 78026 38 потім збирали вакуумним фільтруванням і сушили у вакуумі до постійної ваги (51,3г). Якщо ЯМР показує присутність небажаного транс стереоізомеру, його можна видалити за допомогою перекристалізації з Н 2О/ЕtOН). 1Н ЯМР (300МГц, CD3OD): d 3,64 (д, 1Н, J=3,6), 5,25 (д, 1Н, J=3,6), 7,41 (д, 2Н, Сполуку 4 (1,0г, 3,5ммоль) розчиняли в 10% J=8,4), 7,53 (д, 2Н, J=8,4). водній H2SO4 (10% о/о, загалом 15мл) і розчин кип'ятили протягом 10г. Реакційну суміш підлуговували 3М водним NaOH і екстрагували EtOAc (3x50мл). Об'єднані EtOAc фракції сушили над безводним Na2SO4 і концентрували у вакуумі одержуючи 710мг (2,9ммоль) 4, яку використовували Сполуку 6 (32,60г, 12,53ммоль) розчиняли в без подальшого очищення. 1Н Я МР (300 МГц, 10% водному К2СО3 (10% в/о; 500мл). Ди-третCD3OD): d 2,80-2,90 (ш м, 1Н), 3,30-3,39 (ш м, 1Н), бутилдікарбонат (34,2г, 157ммоль) розчиняли в 3,40-3,50 (ш м, 1Н), 4,52-4,58 (м, 1Н), 7,30 (д, 2Н, 1,4-діоксані (500мл) і додавали до водного розчиJ=8,1), 7,49 (д, 2Н, J=8,1). ну, після чого суміш перемішували при кімнатній температурі протягом 72 годин. Суміш концентрували у вакуумі і переносили в 100мл 1N водного NaOH і промивали Et2O (2x100мл). Водний шар підкислювали 1N водним НСІ і продукт екстрагували в EtOAc (3 x200мл). Об'єднані EtOAc екстракти сушили над безводним Na2SO4, фільтр ували, і Сполуку 8 (4,31г, 12,4ммоль) розчиняли в концентрували у вакуумі. Продукт (26,7г, трифтороцтовій кислоті (ТФО, 40мл). Суміш пере74,0ммоль) виділяли і використовували без подамішували протягом 3 годин при кімнатній темперальшого очищення. 1Н ЯМР (300МГц, CD3OD): д турі і концентрували у вакуумі. ТФО сіль розділяли 1,32 (с, 9Н), 4,37 (д, 1Н, J=2,7), 5,23 (д, 1Н, J=2,7), між 50мл 2N водної NaOH і еквівалентного об'єму 7,32 (д, 2Н, 8,4), 7,46 (д, 2Н, J=8,4). EtOAc. Шари розділяли і водний шар промивали EtOAc (50мл). Об'єднані EtOAc фракції промивали розсолом, сушили над безводним Na2SO4 і концентрували у вакуумі одержуючи воскоподібну тверду речовину (2,72г, 11,1ммоль), яку використовували без подальшого очищення. 1Н ЯМР (300МГц, Сполуку 7 (5,29г, 14,7ммоль) і NCD3OD): d 2,83-2,90 (м, 1Н), 3,30-3,35 (м, 1Н), 3,46 гідроксисукцинімід (1,69г, 14,7моль) розчиняли в (дд, 1Н, J=10,8, 4,8), 4,56 (д, 1Н, J=6,6), 7,29 (д, 2Н, EtOAc (200мл) і суміш охолоджували до 0°С. ДоJ=8,6), 7,49 (д, 2Н, J=8,6). давали Н,Н'-дициклогексилкарбодіімід (3,04г, 14,7ммоль) і суміш перемішували протягом 30 хвилин, нагрівали до кімнатної температури і перемішували протягом ще 30 хвилин. Потім охолоджували до 0°С і фільтрували видаляючи осаджену Н,Н'-дициклогексилсечовину. Фільтрат концентрували у вакуумі і залишок розчиняли в ТГФ (100мл). Розчин охолоджували до 0°С, додаСполуку 9 (710мг, 2,89ммоль), гідрохлорид вали NaBH4 (5,6г, 150ммоль) і суміш перемішували етилбензімідату (533мг, 2,89ммоль) і триетиламін протягом двох хвилин. Потім до суміші по краплям (Et3N, 0,40мл, 2,89ммоль) об'єднували в 25мл 1,2додавали воду до припинення виділення газу, подихлоретану. Суміш кип'ятили при перемішуванні тім протягом 30 хвилин додавали об'єм води еквіпід N2 протягом 16 годин після чого ТШХ показала валентний об'єму ТГФ, після чого суміш нагрівали один основний продукт. Після охолодження до до кімнатної температури і перемішували протякімнатної температури, суміш розводили EtOAc, гом 5 годин. Діоксан видаляли у вакуумі і додавадвічі промивали насиченим водним NH4CI, двічі ли EtOAc (200мл), після чого поступово підкислюнасиченим водним NaHCO3 і потім сушили над вали водний шар використовуючи 1N водну НСІ. безводним Na2SO4. Розчин фільтрували і EtOAc EtOAc шар промивали розсолом і сушили над безвидаляли у вакуумі одержуючи 885мг (2,66ммоль) водним Na2SO4. Фільтрування з наступним конце10, яку використовували без подальшого очищеннтруванням у вакуумі давало 4,31г (12,4ммоль) 8, ня. 1Н ЯМР (300МГц, CD3OD): d 3,74-3,89 (м, 2Н), яку використовували без подальшого очищення. 1 4,13-4,18 (м, 1Н), 5,59 (д, 1Н, J=6,6), 7,30 (д, 2Н, Н ЯМР (300МГц, CD3OD): d 1,32 (с, 9Н), 3,46-3,51 J=8,4), 7,46-7,57 (м, 5Н), 7,99-8,02 (м, 2Н). (м, 1Н), 3,63-3,73 (м, 2Н), 4,88 (ш с, 1Н), 7,29 (д, 2Н, J=8,3), 7,45 (д, 2Н, J=8,3). 39 78026 40 хвилин, всі тверді речовини розчинялись. Підкислення продовжували ще 10 хвилин після чого суміш ставала гомогенною, рН лакмусового паперу МеОН розчину був дуже червоним. Апарат опоряджували висушуючою пробіркою і реакційну суміш кип'ятили протягом 8 годин після чого перемішували при кімнатній температурі протягом 12 годин. Суміш концентрували у вакуумі і потім суспендуСполуку 10 (885мг, 2,66ммоль) суспендували в вали в суміші 300мл EtOAC і 100мл води. При СН2СІ2 (15мл) і охолоджували до -78°С. Через швидкому перемішуванні, дуже повільно додавали шприць додавали трифторид діетиламіносірки 3N NaOH до розчинення суспендованого матеріа(DAST, 0,53мл, 4,00ммоль), суміш нагрівали пролу. Основу додавали до досягнення рН позначки тягом 1 години до кімнатної температури і потім 10. Шари розділяли і EtOAc фракцію промивали перемішували протягом 16 годин під N2. Надлишок розсолом (2х) і сушили над безводним Na2SO4. DAST гасили повільно додаючи Н 2О після чого Концентрували у вакуумі одержуючи 13 як білий суміш розводили ще СН 2СІ2. Органічний шар пропорошок (15,3г), яку використовували без подальмивали Н2О і насиченим водним NaHCO3, сушили шого очищення. 1Н ЯМР (300МГц, CD3OD): d 3,59 над безводним Na2SO4 і концентрували у вакуумі. (д, 1Н, J=4,5), 3,66 (с, 3Н), 4,92 (д, 1Н, J=4,5), 7,29 Залишок (950мг) хроматографували на силікагелі, (д, 2Н, J=8,3), 7,49 (д, 2Н, J=8,3). використовуючи як елюент 15:85 EtOAc/гексани 1 одержуючи 11 як масло (420мг, 1,25ммоль). Н ЯМР (300МГц, CDCI3): d 4,23-4,35 (м, 1Н), 4,454,75 (м, 2Н), 5,43 (д, 1Н, J=6,9), 7,17(д, 2Н, 8,3), 7,36-7,47 (м, 5Н), 7,96 (д, 2Н, J=8,3). Сполуку 11 (807мг, 2,41ммоль, енантіочисту з хлорамфеніколу або рацемічну з (+/-)-трео-пбромфенілсерину), розчиняли в безводному ТГФ (10мл) у висушеній полум'ям круглодонній колбі і охолоджували до -78°С. При інтенсивному перемішуванні додавали H-BuLi (1,6М в гексанах, 3,02мл, 4,83ммоль). Через 10 хвилин, додавали триметиборат (0,55мл, 4,83ммоль), суміш нагрівали до кімнатної температури протягом 1 години і потім перемішували протягом 6 годин. Суміш гасили 1N водною НСІ і екстрагували три рази EtOAc. Об'єднані EtOAc фракції три рази промивали розсолом і сушили над безводним Na2SO4. EtOAc видаляли у вакуумі одержуючи 805мг матеріалу, який очищали за допомогою колонкової флеш хроматографії, спочатку елюювали 1:1 гексани/EtOAc до видалення домішок і потім елюювали 1:9 МеОН/СН2СІ2 до одержання продукту як масло (285мг, 0,953ммоль). 1Н ЯМР (300МГц, CD3OD): d 4,29-4,39 (м, 1Н), 4,69 (дд, 2Н, J=47,1, 4,2), 5,64 (д, 1Н, J=6,6), 7,37 (д, 2Н, J=8 ,1), 7,477,52 (м, 2Н), 7,56-7,62 (м, 1Н), 7,67 (д, 1Н, J=7,5) 7,74-7,82 (м, 1Н), 8,01 (д, 2Н, J=7,2). НРМС (ЕСl-) m/z: 298,0 (М-Н+ C16H14BFNO3 необхідно 298,1). Сполуку 6 (20,6г, 0,079моль) суспендували в 400мл безводного МеОН. С уміш швидко перемішували і охолоджували на бані з льодом до 0°С. Повільно барботували безводний НСІ. Через 10 1,1d'-Карбонілдіімідазол (23,6г, 0,146моль) розчиняли в 250мл безводного 1,2-дихлоретану при кімнатній температурі після чого додавали триетиламін (Et3N, 12,2г, 16,8мл). В окремій колбі, 13 (33,26г, 0,121моль) розчиняли в 125мл безводного тетрагідрофурану (ТГФ) і одному еквіваленті триетиламіну. ТГФ розчин розводили 125мл 1,2дихлоретану і потім додавали, під N2, протягом 2 годин до розчину 1,1'-карбонілдіімідазолу. Після завершення додавання, суміш перемішували протягом 2 годин під N2 при кімнатній температурі. Реакційну суміш концентрували у вакуумі і залишок розводили 300мл EtOAC, який промивали 5x200мл 2N НСІ, 3x300мл насиченого NаНСО3, і 2x200мл розсолу. EtOAc шар сушили над безводним Na2SO4, фільтрували і концентрували у вакуумі одержуючи 34,27г 14, 80-90% чистота за 1Н ЯМР. Сполуку 14 використовували без подальшого очищення. 1Н ЯМР (300МГц, CD3OD): d 3,83 (с, 3Н), 4,34 (д, 1Н, J=5,0), 5,65 (д, 1Н, J=5,0), 7,36 (д, 2Н, J 8,7), 7,60 (д, 2Н, J=8,7). Приклад 13: Сполука 15 Сполуку 14 (55,3г, 0,184ммоль) розчиняли в 375мл МеОН. Розчин охолоджували до 0°С і порціями додавали NaBH4 (2 еквіваленти, 13,9г, 0,369моль), недозволяючи температурі піднятися вище 20°С. Після додавання останньої порції, охолодження припиняли· і суміш перемішували протягом 2 годин. Повільно додавали льодяну оцтову кислоту до досягнення рН7. Суміш фільтрували крізь Целіт і концентрували у вакуумі. Залишок розділяли між EtOAc (375мл) і 2N НСІ (500мл). Органічний шар промивали 2N НСІ (2x300мл), насиченим водним NaHCO3 (2x250мл) і розсолом (250мл), сушили над безводним Na2SO4, 41 78026 фільтрували і концентрували у вакуумі. Продукт кристалізували з гексани/EtOAc одержуючи 26,3г 15.1Н ЯМР (300МГц, CD3OD): d 3,64-3,72 (м, 3Н), 5,38 (д, 1Н, J=5,1), 7,32 (д, 2Н, J=8,6), 7,57 (д, 2Н, J=8,6). Приклад 14: Сполука 16 Сполуку 15 (7,57г, 0,0278моль) суспендували в 275мл СН 2СІ2. Під N2 і швидкому перемішуванні біфазну суміш охолоджували до -78°С на бані сухий лід/ацетон. По краплям через шприць протягом 2-3 хвилин додавали DAST (5,51мл, 6,72г, 0,0417моль). Через 30 хвилин суміш переносили на баню з льодом і перемішували протягом 30 хвилин, і в цей час тверді речовини розчинялись. Додавали ще 1мл DAST для гарантування завершення реакції. Суміш перемішували протягом 20 хвилин при 0°С і потім нагрівали до кімнатної температури. Суміш перемішували при кімнатній температурі протягом 20 хвилин і потім охолоджували до 0°С. Надлишок DAST гасили додаючи по краплям при швидкому перемішуванні протягом 30 хвилин насичений водний NaHCO3. Після припинення виділення газу, водний шар трохи підлуговували (7
ДивитисяДодаткова інформація
Назва патенту англійськоюFlorfenikol antibiotics
Автори англійськоюHecker, Scott J., Glinka Tomasz W
Назва патенту російськоюАнтибиотики флорфениколового типа
Автори російськоюГлинка Томаш В.
МПК / Мітки
МПК: C07C 233/47, C07D 261/18, C07D 249/08, A61K 31/415, C07D 413/10, C07D 213/84, C07D 277/40, C07D 277/20, C07D 263/22, A61K 31/50, C07C 317/32, A61K 31/505, A61K 31/4178, A61K 31/165, C07D 213/75, A61K 31/426, C07D 263/06, C07D 237/20, A61K 31/53, A61K 31/4425, A61K 31/421, C07D 233/61, C07D 285/12, C07C 255/60, C07D 261/10, C07D 213/40, C07D 237/08, C07D 213/73, C07D 213/63, C07D 239/26, C07D 285/135, C07D 237/12, C07D 271/10, C07C 311/37, C07D 417/10, A61K 31/4409, C07C 233/18, A61K 31/36, C07D 261/14, C07C 311/46, A61K 31/4418, C07D 231/12, C07D 285/08, C07D 285/125, C07D 239/42, A61K 31/4245, C07D 277/28, C07D 253/00, C07D 317/58, C07C 233/31, A61K 31/433, A61P 31/04, A61K 31/42, C07D 333/20, C07D 261/08, A61K 31/4196, A61K 31/4406, A61K 31/4174, C07D 271/06, C07D 233/54, A61K 31/381, C07D 261/12, C07C 251/48, A61K 31/4965, C07D 275/00, C07D 263/14, C07D 241/12
Мітки: флорфеніколового, антибіотики, типу
Код посилання
<a href="https://ua.patents.su/40-78026-antibiotiki-florfenikolovogo-tipu.html" target="_blank" rel="follow" title="База патентів України">Антибіотики флорфеніколового типу</a>
Попередній патент: Похідні n-[феніл(піперидин-2-іл)метил]бензаміду, спосіб їх отримання та застосування у терапії
Випадковий патент: Горілка особлива "княгинин оригінальна. knjagynyn original"












