Епоксидна сполука, спосіб її одержання та спосіб одержання сполуки оксазолу
Номер патенту: 99455
Опубліковано: 27.08.2012
Автори: Уцумі Наото, Фудзіта Нобухіса, Таіра Шинічі, Аннака Кімійоші, Харагуті Йосікадзу, Цубоучі Хідецугу, Сінхама Коіті, Танада Йошіхіза, Фурута Такуйя, Хаякава Сатоші
Формула / Реферат
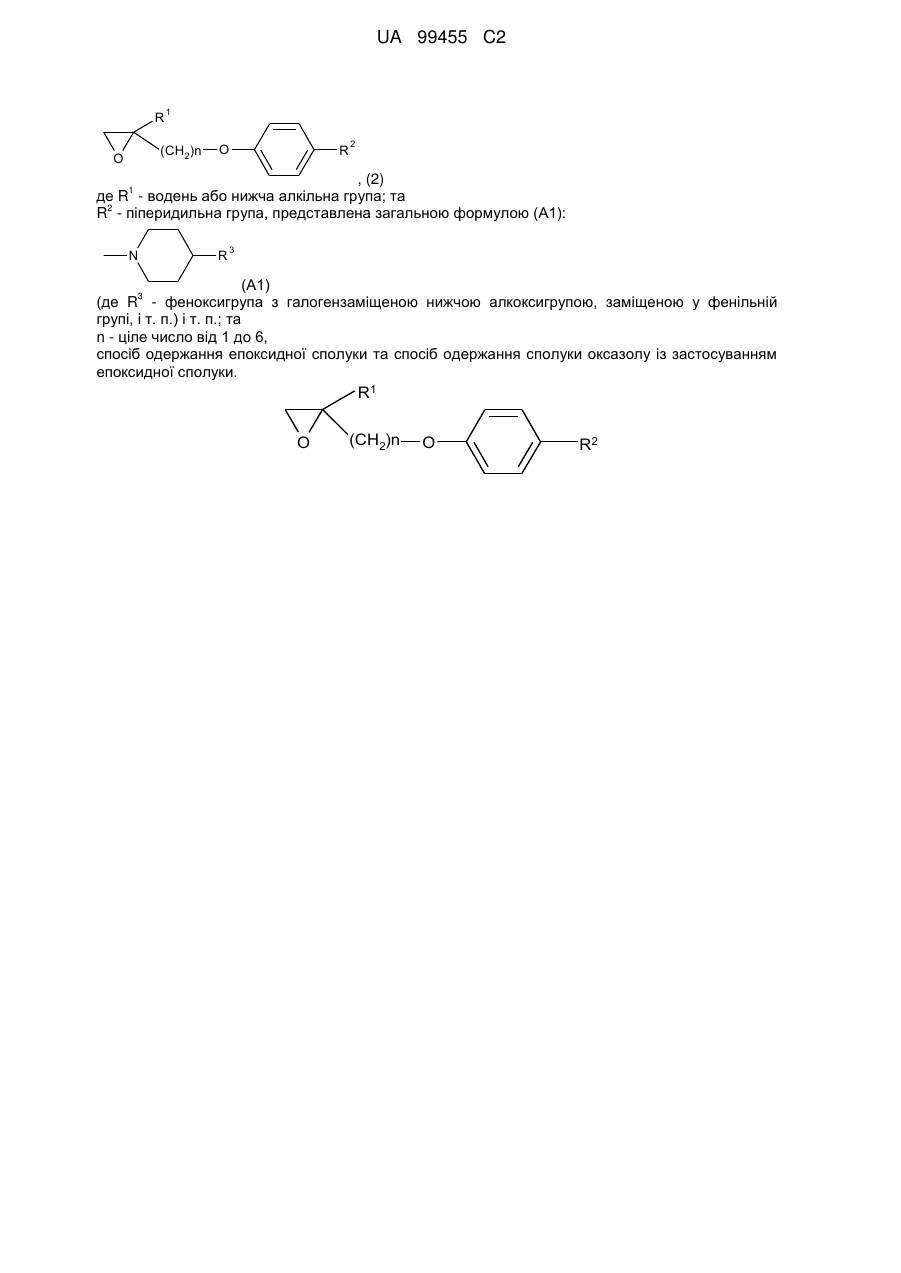
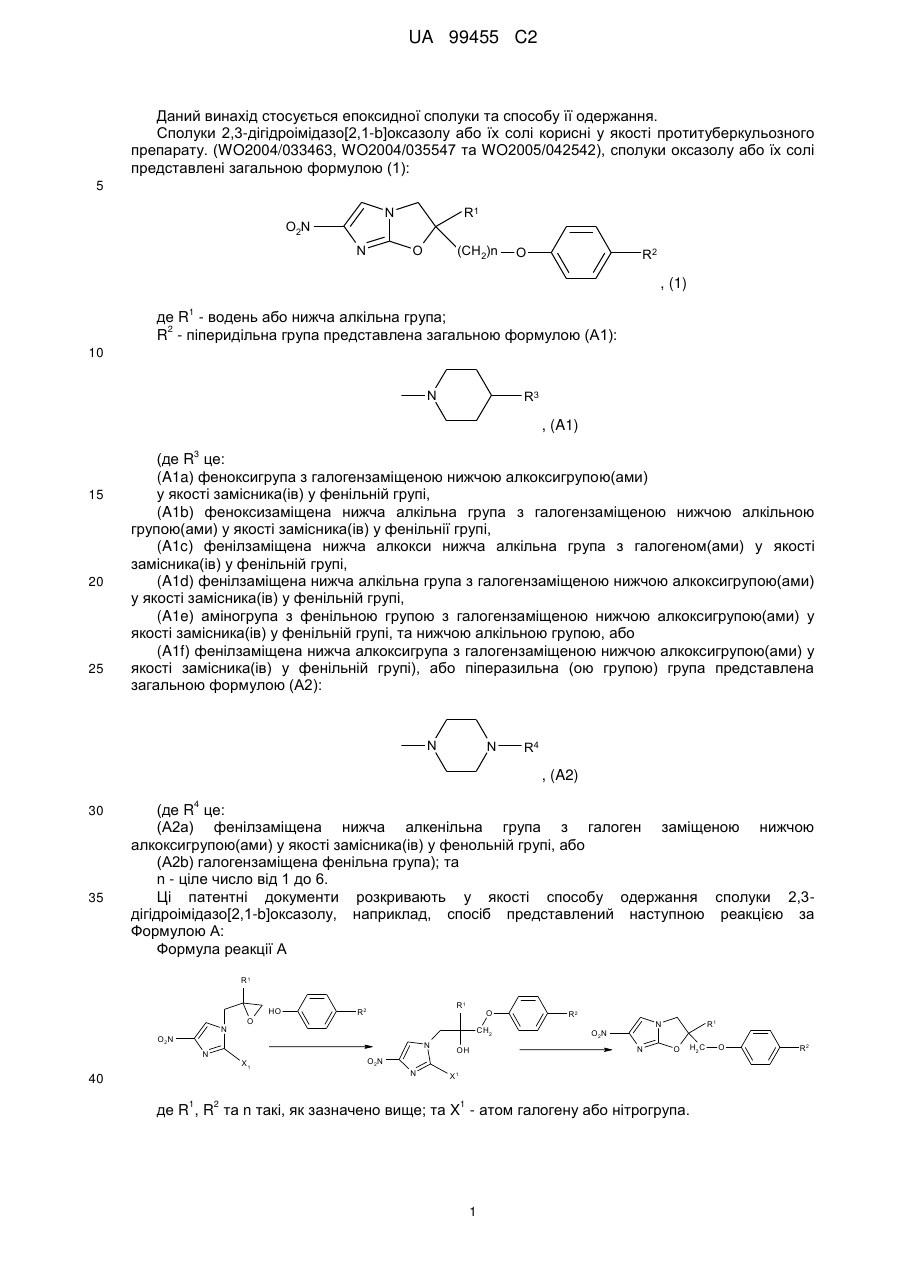
1. Епоксидна сполука або її солі, представлена загальною формулою (2):
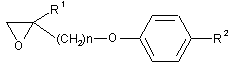 , (2)
, (2)
де R1 - це водень або нижча алкільна група;
R2 - піперидильна група, представлена загальною формулою (А1):
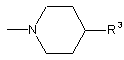 (А1)
(А1)
(де R3 - це:
(A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі,
(A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) як замісником(ами) у фенільній групі,
(A1с) фенілзаміщена нижча алкоксинижча алкільна група з галогеном(ами) як замісником(ами) у фенільній групі,
(A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі,
(A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі та нижча алкільна група, або
(A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі), або піперазильна група, представлена загальною формулою (А2):
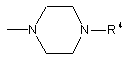 (A2)
(A2)
(де R4 - це:
(А2а) фенілзаміщена нижча алкенільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, або
(А2b) галогензаміщена фенільна група); та
n - ціле число від 1 до 6.
2. Епоксидна сполука або її солі, вибрані з групи, що складається з:
1) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидину;
2) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксифенокси)піперидину;
3) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидину;
4) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидину;
5) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2-пропеніл]піперазину;
6) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2-пропеніл]піперазину;
7) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епокси-2-метилпропокси)феніл]піперидину;
8) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епоксипропокси)феніл]піперидину;
9) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензил)піперидину;
10) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксибензил)піперидину;
11) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[N-метил-N-(4-трифторометоксифеніл)]амінопіперидину;
12) (R)-4-[N-метил-N-(4-трифторометоксифеніл)]аміно-1-[4-(2,3-епоксипропокси)феніл]піперидину;
13) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епокси-2-метилпропокси)феніл]піперазину;
14) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епоксипропокси)феніл]піперазину;
15) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензилокси)піперидину та
16) (R)-1-(4-(оксиранілметокси)феніл)-4-(4-(трифторометокси)бензилокси)піперидину.
3. Спосіб одержання епоксидної сполуки або її солі, представленої загальною формулою (2):
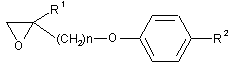 , (2)
, (2)
де R1, R2 та n такі, як зазначено нижче, шляхом реакції сполуки або її солі, представленої загальною формулою (3):
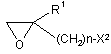 , (3)
, (3)
де R1 - водень або нижча алкільна група;
n - ціле число від 1 до 6; а
Х2 - галоген або група, що спричиняє реакцію заміщення, подібну до реакції галогену, зі сполукою або її сіллю, представленою загальною формулою (4):
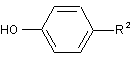 , (4)
, (4)
де R2 - піперидильна група, представлена загальною формулою (А1):
 (А1)
(А1)
(де R3 - це:
(A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі,
(A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) як замісником(ами) у фенільній групі,
(A1c) фенілзаміщена нижча алкоксинижча алкільна група з галогеном(ами) як замісником(ами) у фенільній групі,
(A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі,
(A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі та нижча алкільна група, або
(A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі), або піперазильна група, представлена загальною формулою (А2):
 (A2)
(A2)
(де R4 - це:
(А2а) фенілзаміщена нижча алкенільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, або
(А2b) галогензаміщена фенільна група).
4. Спосіб одержання сполуки оксазолу або її солі, представленої загальною формулою (1):
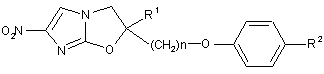 , (1)
, (1)
де R1, R2 та n такі, як зазначено нижче, реакцією сполуки, представленої загальною формулою (5):
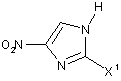 , (5)
, (5)
або її солі,
де X1 - атом галогену, зі сполукою або її сіллю, представленою загальною формулою (2):
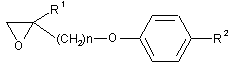 , (2)
, (2)
де R1 - водень або нижча алкільна група;
R2 - піперидильна група, представлена загальною формулою (А1):
 (А1)
(А1)
(де R3 - це:
(A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі,
(A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) як замісником(ами) у фенільній групі,
(A1c) фенілзаміщена нижча алкоксинижча алкільна група з галогеном(ами) як замісником(ами) у фенільній групі,
(A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі,
(A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі та нижча алкільна група, або
(A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі), або піперазильна група, представлена загальною формулою (А2):
 (A2)
(A2)
(де R4 - це:
(А2а) фенілзаміщена нижча алкенільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, або
(А2b) галогензаміщена фенільна група); а
n - ціле число від 1 до 6.
Текст
УКРАЇНА (19) UA (11) 99455 (13) C2 (51) МПК C07D 407/12 (2006.01) C07D 498/04 (2006.01) ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (21) Номер заявки: a 2009 11599 Дата подання заявки: 07.05.2008 (22) (24) Дата, з якої є чинними 27.08.2012 права на винахід: (31) Номер попередньої 2007-123097 (32) Дата подання 08.05.2007 заявки відповідно до Паризької конвенції: попередньої заявки відповідно до Паризької конвенції: (33) Код держави-учасниці JP Паризької конвенції, до якої подано попередню заявку: (41) Публікація відомостей 11.01.2010, Бюл.№ 1 про заявку: (46) Публікація відомостей 27.08.2012, Бюл.№ 16 про видачу патенту: (86) Номер та дата подання міжнародної заявки, поданої відповідно до Договору PCT PCT/JP2008/058798, 07.05.2008 (72) Винахідник(и): Цубоучі Хідецугу (JP/JP), Харагуті Йосікадзу (JP/JP), Хаякава Сатоші (JP/JP), Уцумі Наото (JP/JP), Таіра Шинічі (JP/JP), Танада Йошіхіза (JP/JP), Фудзіта Нобухіса (JP/JP), Сінхама Коіті (JP/JP), Аннака Кімійоші (JP/JP), Фурута Такуйя (JP/JP) (73) Власник(и): ОЦУКА ФАРМАС'ЮТІКЕЛ КО., ЛТД., 9, Kanda-Tsukasamachi 2-chome, Chiyodaku, Tokyo 1018535, Japan (JP) (74) Представник: Шевеля Микола Васильович, реєстр. №20 (56) Перелік документів, взятих до уваги експертизою: DRABCZYNSKA A ET AL: "Tricyclic oxazolo[2,3-f]purinediones: potency as adenosine receptor ligands and anticonvulsants" BIOORGANIC & MEDICINAL CHEMISTRY, ELSEVIER SCIENCE LTD, GB, vol. 12, no. 18, 15 September 2004 (2004-0915), pages 4895-4908, XP004542846 ISSN: 0968-0896 REN-HUA JIN ET AL.: "Reaction between 8chlorotheophylline and epoxides" TETRAHEDRON LETTERS, vol. 33, no. 42, 1992, pages 6307-6308, XP002492852 SEHGAL RAJ K ET AL: "Potential radiosensitizing agents. 2. Synthesis and biological activity of derivatives of dinitroimidazole with oxiranes" JOURNAL OF MEDICINAL CHEMISTRY, US AMERICAN CHEMICAL SOCIETY. WASHINGTON, vol. 24, no. 5, 1 January 1981 (1981-01-01), pages 601-604, XP002974846 ISSN: 0022-2623 NAGARAJAN K ET AL: "NITROIMIDAZOLES XXI** 2,3-DIHYDRO-6-NITROIMIDAZO U2,1B 3/4 OXAZOLES WITH ANTITUBERCULAR ACTIVITY" EUROPEAN JOURNAL OF MEDICINAL CHEMISTRY, EDITIONS SCIENTIFIQUE ELSEVIER, PARIS, FR, vol. 24, 1 January 1989 (1989-01-01), pages 631633, XP002071373 ISSN: 0223-5234 (54) ЕПОКСИДНА СПОЛУКА, СПОСІБ ЇЇ ОДЕРЖАННЯ ТА СПОСІБ ОДЕРЖАННЯ СПОЛУКИ ОКСАЗОЛУ (57) Реферат: Даний винахід стосується проміжної сполуки для одержання 2,3-дигідроімідазо[2,1-b]оксазолу з високим виходом та високою чистотою та способу одержання проміжної сполуки. Даний винахід представляє епоксидну сполуку, представлену загальною формулою (2): UA 99455 C2 (12) UA 99455 C2 R 1 (CH2)n O O R 2 , (2) 1 де R - водень або нижча алкільна група; та 2 R - піперидильна група, представлена загальною формулою (А1): N R 3 (А1) 3 (де R - феноксигрупа з галогензаміщеною нижчою алкоксигрупою, заміщеною у фенільній групі, і т. п.) і т. п.; та n - ціле число від 1 до 6, спосіб одержання епоксидної сполуки та спосіб одержання сполуки оксазолу із застосуванням епоксидної сполуки. R1 O (CH2)n O R2 UA 99455 C2 Даний винахід стосується епоксидної сполуки та способу її одержання. Сполуки 2,3-дігідроімідазо[2,1-b]оксазолу або їх солі корисні у якості протитуберкульозного препарату. (WO2004/033463, WO2004/035547 та WO2005/042542), сполуки оксазолу або їх солі представлені загальною формулою (1): 5 N O2N N R1 (CH2)n O O R2 , (1) 1 де R - водень або нижча алкільна група; 2 R - піперидільна група представлена загальною формулою (А1): 10 N R3 , (A1) 3 15 20 25 (де R це: (A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі, (A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) у якості замісника(ів) у фенільнії групі, (A1c) фенілзаміщена нижча алкокси нижча алкільна група з галогеном(ами) у якості замісника(ів) у фенільній групі, (A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі, (A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі, та нижчою алкільною групою, або (A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі), або піперазильна (ою групою) група представлена загальною формулою (А2): N N R4 , (A2) 30 35 4 (де R це: (А2а) фенілзаміщена нижча алкенільна група з галоген заміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенольній групі, або (А2b) галогензаміщена фенільна група); та n - ціле число від 1 до 6. Ці патентні документи розкривають у якості способу одержання сполуки 2,3дігідроімідазо[2,1-b]оксазолу, наприклад, спосіб представлений наступною реакцією за Формулою А: Формула реакції А R1 N O2N HO R1 R2 X1 40 2 O CH2 N N 1 O OH R2 N O2N N R1 O H2C O2N N X1 1 де R , R та n такі, як зазначено вище; та X - атом галогену або нітрогрупа. 1 O R2 UA 99455 C2 5 10 15 Зазначена сполука оксазолу важлива при використанні у якості протитуберкульозного препарату, і дуже бажано розробляти нові способи промислового та прибуткового одержання цієї сполуки. Об'єктом даного винаходу є створення нового проміжного продукту для виробництва сполуки 2,3-дігідроімідазо[2,1-b]оксазолу представленої загальною формулою (1) з високим виходом та високою та способу виробництва проміжного продукту. В результаті ретельних досліджень способу виробництва сполуки 2,3-дігідроімідазо[2,1b]оксазолу представленого загальною формулою (1), автори цього винаходу встановили, що використання епоксидної сполуки, представленої загальною формулою (2), зазначеною нижче у якості вихідної сировини дозволяє виробляти сполуку 2,3-дігідроімідазо[2,1-b]оксазолу представлену загальною формулою (1), що є активною складовою протитуберкульозного препарату з високим виходом та з високою чистотою. Це відкриття призвело до створення цього винаходу. Даний винахід передбачає епоксидну сполуку або її солі, показані нижче у Пункті 1 та Пункті 2. Пункт 1: Передбачає епоксидну сполуку або її солі представлену загальною формулою (2): R1 O (CH2)n O R2 , (2) 20 1 де R - водень або нижча алкільна група; 2 R - піперидільна група представлена загальною формулою (A1): N R3 , (A1) 25 30 35 3 (де R це: (A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі, (A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) у якості замісника(ів) у фенільній групі, (A1c) фенілзаміщена нижча алкокси нижча алкільна група з галогеном(ами) у якості замісника(ів) у фенільній групі, (A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі, (A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі, та нижчою алкільною групою, або (A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенольній групі), або піперазильною групою представлена загальною формулою (А2): 40 N N R4 , (A2) 4 45 50 (де R це: (А2а) фенілзаміщена нижча алкенільна група з галоген заміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенольній групі, або (А2b) галогензаміщена фенільна група; та n - ціле число від 1 до 6. Пункт 2: Передбачає епоксидну сполуку або її солі, обрану з групи, що складається з: 1) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидину; 2 UA 99455 C2 5 10 15 20 25 2) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксифенокси)піперидину; 3) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4трифторометилфеноксиметил)піперидину; 4) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидину; 5) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2пропеніл]піперазин; 6) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2пропеніл]піперазину; 7) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епокси-2-метилпропокси)феніл]піперидину; 8) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епоксипропокси)феніл]піперидину; 9) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензил)піперидину; 10) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксибензил)піперидину; 11) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[N-метил-N-(4трифторометоксифеніл)]амінопіперидину; 12) (R)-4-[N-метил-N-(4-трифторометоксифеніл)]аміно-1-[4-(2,3епоксипропокси)феніл]піперидину; 13) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епокси-2-метилпропокси)феніл]піперазину; 14) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епоксипропокси)феніл]піперазину; 15) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4трифторометоксибензилокси)піперидину; та 16) (R)-1-(4-(оксиранилметокси)феніл)-4-(4-(трифторометокси)бензилокси)піперидину. Даний винахід також передбачає спосіб одержання епоксидної сполуки або її солі, як зазначено нижче у Пункті 3. Пункт 3: Передбачає спосіб одержання епоксидної сполуки або її солі представленої загальною формулою (2): R1 O (CH2)n O R2 , (2) 30 1 2 де R , R та n такі, як зазначено вище, за допомогою реакції сполуки або її солі представленої загальною формулою (3): R1 O 35 (CH2)n-X2 , (3) 1 де R та n такі, як зазначено вище; та 2 X - галоген або група(и), що спричиняє реакцію заміщення подібну до реакції галогену, зі сполукою або її сіллю, що представлена загальною формулою (4): HO R2 , (4) 40 45 2 де R такий, як зазначено вище. Даний винахід також передбачає спосіб одержання сполуки оксазолу або її солі, як показано нижче у Пункті 4. Пункт 4: Передбачає спосіб одержання сполуки оксазолу або її солі представленої загальною формулою (1): 3 UA 99455 C2 N O2N N R1 O (CH2)n O R2 , (1) 1 2 де R , R та n такі, як зазначено вище, за допомогою реакції сполуки або її солі представленої загальною формулою (5): 5 H N O2N N X1 , (5) 1 де X - атом галогену, з епоксидною сполукою або її сіллю представленою загальною формулою (2): 10 R1 O (CH2)n O R2 , (2) 1 15 20 25 30 35 40 45 2 де R , R та n такі, як зазначено вище. Епоксидна сполука або її солі за загальною формулою (2), відповідно до даного винаходу, це нова сполука, яка не описана у жодному документі. Епоксидна сполука або її солі за загальною формулою (2) відповідно до даного винаходу корисні у якості проміжної сполуки для одержання сполуки оксазолу або її солей представленої загальною формулою (1), що важлива у якості синтезованої проміжної сполуки для лікарських засобів та агріхімікатів, а особливо у якості протитуберкульозного препарату. Епоксидна сполука представлена зазначеною вище формулою (2) це переважно сполука або її солі обрана з групи, що складається з: 1) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидину; 2) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксифенокси)піперидину; 3) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4трифторометилфеноксиметил)піперидину; 4) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидину; 5) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2пропеніл]піперазину; 6) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2пропеніл]піперазину; 7) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епокси-2-метилпропокси)феніл]піперидину; 8) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епоксипропокси)феніл]піперидину; 9) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензил)піперидину; 10) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксибензил)піперидину; 11) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[N-метил-N-(4трифторометоксифеніл)]амінопіперидину; 12) (R)-4-[N-метил-N-(4-трифторометоксифеніл)]аміно-1-[4-(2,3епоксипропокси)феніл]піперидину; 13) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епокси-2-метилпропокси)феніл]піперазину; 14) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епоксипропокси)феніл]піперазину; 15) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4трифторометоксибензилокси)піперидину; та 16) (R)-1-(4-(оксиранилметокси)феніл)-4-(4-(трифторометокси)бензилокси)піперидину. Кожна група, зазначениа в даному описі, характеризується наступним чином. Атоми галогену включають атом фтору, атом хлору, атом брому та атом йоду. Нижчі алкоксигрупи включають, наприклад, лінійні або розгалужені алкоксигрупи, що мають від 1 до 6 атомів вуглецю (переважно від 1 до 4 атомів вуглецю). Більш конкретно, вони містять 4 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 метокси, етокси, n-пропокси, ізопропокси, n-бутокси, ізобутокси, трет-бутокси, сек-бутокси, nпентилокси, 1-етилпропокси, ізопентилокси, неопентилокси, n-гексилокси, 1,2,2триметилпропокси, 3,3-диметилбутокси, 2-етилбутокси, ізогексилокси та 3-метилпентилокси групи. Галогензаміщені нижчі алкоксигрупи включають нижчі алкоксигрупи, як зазначено вище, з від 1 до 7, переважно від 1 до 3, атомів галогену у якості замісника(ів). Більш точно, вони включають фторометокси, дифторометокси, трифторометокси, хлорометокси, дихлорометокси, трихлорометокси, бромометокси, дибромометокси, дихлорофторометокси, 2,2,2трифтороетокси, пентафтороетокси, 2-хлороетокси, 3,3,3-трифторопропокси, гептафторопропокси, гептафтороізопропокси, 3-хлоропропокси, 2-хлоропропокси, 3бромопропокси, 4,4,4-трифторобутокси, 4,4,4,3,3-пентафторобутокси, 4-хлоробутокси, 4бромобутокси, 2-хлоробутокси, 5,5,5-трифторопентилокси, 5-хлоропентилокси, 6,6,6трифторогексилокси та 6-хлорогексилокси групи. Феноксигрупи з галогензаміщеною нижчою алкоксигрупою у фенільній групі у якості замісника(ів) включають, наприклад, феноксигрупи з від 1 до 3 (переважно 1) галогензаміщених нижчих алкоксигруп, як зазначено вище, у фенольній групі у якості замісника(ів). Нижчі алкільні групи включають лінійні або розгалужені алкільні групи з від 1 до 6 атомів вуглецю (переважно від 1 до 4 атомів вуглецю). Більш переважно, вони включають метильну, етильну, n-пропільну, ізопропільну, n-бутильну, ізобутильну, трет-бутильну, сек-бутильну, nпентильну, 1-етилпропільну, ізопентильну, неопентильну, n-гексильну, 1,2,2-триметилпропільну, 3,3-диметилбутильну, 2-етилбутильну, ізогексильну та 3-метилпентильну групи. Галогензаміщені нижчі алкільні групи включають нижчі алкільні групи, як зазначено вище, мають від 1 до 7, переважно від 1 до 3, атомів галогену у якості замісника(ів). Більш переважно, вони включають фторометильну, дифторометильну, трифторометильну, хлорометильну, дихлорометильну, трихлорометильну, бромометильну, дибромометильну, дихлорофторометильну, 2,2-дифтороетильну, 2,2,2-трифтороетильну, пентафтороетильну, 2фтороетильну, 2-хлороетильну, 3,3,3-трифторопропільну, гептафторопропільну, 2,2,3,3,3пентафторопропільну, гептафтороізопропільну, 3-хлоропропільну, 2-хлоропропільну, 3бромопропільну, 4,4,4-трифторобутильну, 4,4,4,3,3-пентафторобутильну, 4-хлоробутильну, 4бромобутильну, 2-хлоробутильну,5,5,5-трифторопентильну, 5-хлоропентильну, 6,6,6трифторогексильну та 6-хлорогексильну групи. Прикладами феноксизаміщених нижчих алкільних груп можуть бути нижчі алкільні групи, як зазначено вище, з однією феноксигрупою у якості замісника. Та більш точно, вони включають феноксиметильну, 2-феноксиетильну, 1-феноксиетильну, 2-феноксиетильну, 2-фенокси-1метилетильну, 2-фенокси-1-етилетильну, 3-феноксипропільну та 4-феноксибутильну групи. Феноксизаміщені нижчі алкільні групи з галогензаміщеною нижчою алкільною групою(ами) у якості замісника(ів) у фенільній групі включають, наприклад, феноксизаміщені нижчі алкільні групи, як зазначено вище, що містяь від 1 до 3 (переважно 1) галогензаміщені нижчі алкільні групи, як зазначено вище, у якості замісника(ів) у фенільній групі. Прикладами нижчи алкокси нижчих алкільних груп є нижчі алкільні групи, як зазначено вище, з однією нижчою алкоксигрупою, як зазначено вище, у якості замісника. Більш точно, вони включають метоксиметильну, 2-метоксиетильну, 1-етоксиетильну, 2-етоксиетильну, 2ізобутоксиетильну, 2,2-диметоксиетильну, 2-метокси-1-метилетильну, 2-метокси-1-етилетильну, 3-метоксипропільну, 3-етоксипропільну, 3-ізобутоксипропільну, 3-n-бутоксипропільну, 4-nпропоксибутильну, 1-метил-3-ізобутоксипропільну, 1,1-диметил-2-n-пентилоксиетильну, 5-nгексилоксипентильну, 6-метоксигексильну, 1-етоксиізопропільну та 2-метил-3-метоксипропільну групи. Прикладом фенілзаміщених нижчих алкокси нижчих алкільних груп є нижчі алкокси нижчі алкільні групи, як зазначено вище, з однією фенільною групою у якості замісника у нижчій алкоксигрупі. Більш точно, вони включають бензилоксиметильні, (2-фенілетокси)метильні, (1фенілетокси)метильні, 3-(3-фенілпропокси)пропільні, 4-(4-фенілбутокси)бутильні, 5-(5фенілпентилокси)пентильні, 6-(6-фенілгексилокси)гексильні, 1,1-диметил-(2фенілетокси)етильні, 2-метил-3-(3-фенілпропокси)пропільні, 2-бензилоксиетильні, 1бензилоксиетильні, 3-бензилоксипропільні, 4-бензилоксибутильні, 5-бензилоксипентильні та 6бензилоксигексильні групи. Фенілзаміщені нижчі алкокси нижчі алкільні групи з галогеном(ами) у якості замісника(ів) у фенільній групі включають, наприклад, фенілзаміщені нижчі алкокси нижчі алкільні групи, як зазначено вище, що містять від 1 до 7, більш переважно, від 1 до 3, атомів галогену у якості замісника(ів) у фенільній групі. 5 UA 99455 C2 5 10 15 20 25 30 35 40 Прикладами фенілзаміщених нижчих алкільних груп є нижчі алкільні групи, як зазначено вище, що містять одну фенільну групу у якості замісника. Більш точно, вони включають бензильні, 1-фенілетильні, 2-фенілетильні, 1-метил-1-фенілетильні, 1,1-диметил-2фенілетильні, 1,1-диметил-3-фенілпропільні, 3-фенілпропільні та 4-фенілбутильні групи. Фенілзаміщені нижчі алкільні групи з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі включають, наприклад, Фенілзаміщені нижчі алкільні групи, як зазначено вище, що містять від 1 до 3 (переважно 1) галогензаміщені нижчі алкоксигрупи, як зазначено вище, у якості замісника(ів) у фенільній групі. Фенільні групи з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі включають, наприклад, фенільні групи що містять від 1 до 3 (переважно 1) галогензаміщені нижчі алкоксигрупи у якості замісника(ів) у фенільній групі. Аміногрупи з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі та нижчою алкільною групою у якості замісника включають, наприклад, аміногрупи, що мають у аміногрупі одну фенільну групу, як зазначено вище, з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі та одну нижчу алкільну групу. Прикладом фенілзаміщених нижчих алкоксигруп є нижчі алкільні групи, як зазначено вище, з однією фенільною групою у якості замісника. Більш точно, вони включають бензилокси, 1фенілетокси, 2-фенілетокси, 1-метил-1-фенілетокси, 1,1-диметил-2-фенілетокси, 1,1-диметил-3фенілпропокси, 3-фенілпропокси та 4-фенілбутокси групи. Фeнілзаміщені нижчі алкоксигрупи з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі включають, наприклад, Фенілзаміщені нижчі алкоксигрупи, що містять від 1 до 3 (переважно 1) галогeнзаміщені нижчі алкоксигрупи, як зазначено вище, у якості замісника(ів) у фенільній групі. Нижчі алкенільні групи включають лінійні або розгалужені алкенільні групи, що містять від 1 до 3 подвійних зв'язків та містить від 2 до 6 атомів вуглецю, та включає як транс форми, так і цис форми. Більш точно, they включає вінільну, 1-пропенільну, 2-пропенільну, 1-метил-1пропенільну, 2-метил-1-пропенільну, 2-метил-2-пропенільну, 2-пропенільну, 2-бутенільну, 1бутенільну, 3-бутенільну, 2-пентенильну та 1-пентенильну групи. Прикладами фенілзаміщених нижчих алкенільних груп є нижчі алкенільні групи, як зазначено вище, з обнією фенільною групою у якості замісника. Більш точно, вони включають 2фенільнувінільну, 3-фенільну-1-пропенільну, 3-фенільну-2-пропенільну, 3-фенільну-1-метильну1-пропенільну, 3-фенільну-2-метильну-1-пропенільну, 3-фенільну-2-метильну-2-пропенільну, 4фенільну-2-бутенільну, 4-фенільну-1-бутенільну, 4-фенільну-3-бутенільну, 5-фенільну-2пентенильну та 5-фенільну-1-пентенильну групи. Фенілзаміщені нижчі алкенільні групи з галогензаміщеною нижчою алкоксигрупою(ами) у якості замісника(ів) у фенільній групі включають, наприклад, фенілзаміщені нижчі алкенільні групи, як зазначено вище, що містять від 1 до 3 (переважно 1) галогензаміщених нижчих алкоксигруп, як зазначено вище, у якості замісника(ів) у фенільній групі. Галогeнзаміщені фенільні групи включають, наприклад, фенільну групу (и), як зазначено вище, що містить від 1 до 7, переважно від 1 до 3, атомів галогену у якості замісника(ів). Спосіб одержання епоксидної сполуки за загальною формулою (2) відповідно до даного винаходу буде описаний далі. [Формула реакції-1] R1 HO R2 R1 (CH2)n-X2 O (4) O (3) O R2 (2) 45 1 50 (CH2)n 2 [де, R , X та n такі, як зазначено вище.] 2 Групи, що спричиняють реакцію заміщення, подібні до атому галогену представленого X , наприклад, нижча алкансульфонілокси групи, арилсульфонілокси групи та аралкілсульфонілокси групи. Прикладом нижчих алкансульфонілокси груп можуть бути лінійні або розгалужені алкансульфонілокси групи, що мають від 1 до 6 атомів вуглецю, такі як метансульфонілокси, етансульфонілокси, n-пропансульфонілокси, ізопропансульфонілокси, n-бутансульфонілокси, трет-бутансульфонілокси, n-пентансульфонілокси та n-гексансульфонілокси групи. 6 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 Арилсульфонілокси групи включають, наприклад, фенілсульфонілокси та нафтилсульфонілокси групи, що можуть мати від 1 до 3 груп обраних з групи, що складається з лінійних або розгалужених алкільних груп, що містять від 1 до 6 атомів вуглецю, лінійних або розгалужених алкоксигруп, що містять від 1 до 6 атомів вуглецю, нітрогруп та атомів галогену у якості замісника(ів) у фенільному кільці. Прикладом фенілсульфонілокси груп, що можуть мати замісники можуть бути фенілсульфонілокси, 4-мeтилфенілсульфонілокси, 2метилфенілсульфонілокси, 4-нітрофенілсульфонілокси, 4-метоксифенілсульфонілокси, 2нітрофенілсульфонілокси та 3-хлорофенілсульфонілокси групи. Прикладом нафтилсульфонілокси груп можуть бути -нафтилсульфонілокси та -нафтилсульфонілокси групи. Аралкілсульфонілокси групи включають, наприклад, лінійні або розгалужені алкансульфонілокси групи з фенільною групою(ами) у якості замісника(ів) та містять від 1 до 6 атомів вуглецю або лінійні або розгалужені алкансульфонілокси групи з нафтильними групами у якості замісника(ів) та містять від 1 до 6 атомів вуглецю, що можуть містити від 1 до 3 груп обраних з групи, що складається з лінійних або розгалужених алкільних груп, що мають від 1 до 6 атомів вуглецю, лінійні або розгалужені алкоксигрупи, що міють від 1 до 6 атомів вуглецю, нітрогрупи та атоми галогену у якості замісника(ів) у фенільному кільці. Алкансульфонілокси групами з заміщеною фенільною групою можуть бути, наприклад, бензилсульфонілокси, 2фенілетилсульфонілокси, 4-фенілбутилсульфонілокси, 4-метилбензилсульфонілокси, 2метилбензилсульфонілокси, 4-нітробензилсульфонілокси, 4-метоксибензилсульфонілокси та 3хлоробензилсульфонілокси групи. Алкансульфонілокси групи з заміщеною нафтильною групою можуть бути представлені, наприклад, -нафтилметилсульфонілокси та нафтилметилсульфонілокси групами. Сполука представлена загальною формулою (2) одержується реакцією сполуки представленої загальною формулою (3) зі сполукою представленою загальною формулою (4). Реакція сполуки представленої загальною формулою (3) зі сполукою представленою загальною формулою (4) здійснюється без розчинника або у інертному розчиннику та у присутності основної сполуки або без неї. Інертні розчинники включають, наприклад, воду; ефірні розчинники, такі як діоксан, тетрагідрофуран, диметиловий ефір, діетиловий ефір, діетилен гліколево диметиловий ефір та етилен гліколево диметиловий ефір; ароматичні вуглуводнeві розчинники, такі як бензол, толуол та ксилол; нижчі спиртові розчинники, такі як метанол, етанол та ізопропанол; кетонові розчинники, такі як ацетон та метил етил кетон; та полярні розчинники, такі як N, Nдиметилформамід (DMF), диметилацетамід, диметилсульфоксид (DMSO), гексаметилфосфорна кислота триамід та ацетонітрил. У якості основних сполук, велика кількість відомих сполук може бути використана, що включає, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію та гідроксид літію; карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію та карбонат літію; гідрогенкарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію та гідрокарбонат калію; лужні метали, такі як натрій та калій; неорганічні основи, такі як амід натрію, гідрид натрію та гідрид калію; нижчі алкоксиди лужних металів, такі як натрію метоксид, натрію етоксид, калію метоксид та калію етоксид; та органічні основи, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, Nетилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, N-метилморфолін, 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) та 1,4діазабіцикло[2.2.2]октан (DABCO). Ці основні сполуки використовуються окрумо у суміші двох або більше сполук. Використовувана кількість основної сполуки звичайно становить 0.5 до 10 молів, переважно 0.5 до 6 раз моль по відношенню до сполуки за загальною формулою (3). Зазначена вище реакція може бути здійснена, за необхідності, додаванням йодиду лужного металу, такого як йодид калію або йодид натрію, у якості прискорювача реакції. Відношення використовуваної кількості сполуки за загальною формулою (3) до сполуки за загальною формулою (4) у зазначеній Формулі Реакції-1 звичайно 1 моль першого до принаймні 0.5 моль, переважно біля 0.5 до 5 моль другого. Зазначена реакція звичайно проводиться при температурних умовах від кімнатної температури до 200 °C, переважно від кімнатної температури до 150 °C, та завершується, як правило, через приблизно від 1 до 30 годин. Зазначена реакція може бути проведена з присутністю каталізатору фазового переносу. Придатний до використання каталізатор фазового переносу включає четвертинні солі амонію (четвертинні солі амонію заміщені групами обраними з групи, що складається з лінійних або 7 UA 99455 C2 5 10 15 20 25 30 розгалужених алкільних груп, що мають від 1 до 18 атомів вуглецю, Фенілзаміщених нижчих алкільних груп та фенільних груп, таких як тетрабутиламоній хлорид, тетрабутиламоній бромід, тетрабутиламоній фторид, тетрабутиламоній йодид, тетрабутиламоній гідроксид, тетрабутиламоній водень сульфат, трибутилметиламоній хлорид, трибутилбензиламоній хлорид, тетрапентиламоній хлорид, тетрапентиламоній бромід, тетрагексиламоній хлорид, бензилдиметилоктиламоній хлорид, метилтригексиламоній хлорид, октадецилтриметиламоній хлорид, бензилдиметилоктадеканиламоній хлорид, метилтридеканиламоній хлорид, бензилтрипропіламоній хлорид, бензилтриетиламоній хлорид, фенілтриетиламоній хлорид, тетраетиламоній хлорид та тетраметиламоній хлорид); лінійні або розгалужені солі піридину, що мають від 1 до 18 атомів вуглецю, такі як 1-хлорид додеканилпіридину; та солі фосфонію (солі фосфонію заміщені лінійною або розгалуженою алкільною групою(ами), що має від 1 до 18 атомів вуглецю та/або фенілзаміщені нижчі алкільні групи, такі як тетрабутилфосфоній хлорид). У такому разі, реакція переважно проводиться у воді, або у змішаному розчині з органічним розчинником не змішуваним з водою (бензол, толуол, ксилол, метилен хлорид, 1,2дихлороетан, і т. д.). Відношення використовуваної кількості сполуки представлене загальною формулою (4) до каталізатору фазового переносу звичайно один моль першого на 0.01-0.5 моль, переважно 0.20.3 моль другого. Коли зазначена реакція проводиться у присутності каталізатору фазового переносу, відношення використаної кількості сполуки представленої загальною формулою (3) до сполуки представленої загальною формулою (4) складає один моль попереднього на 0.7-1.5 моль, переважно 0.8-1.0 моль пізнішого. Сполука представлена загальною формулою (4) при використанні у якості вихідної сировини у зазначеній реакції переважно має форму солі літію. Сіль літію сполуки представленої загальною формулою (4) має перевагу являючись стабільною та простою у використанні. Більш того, сіль літію сполуки представленої загальною формулою (4) легко синтезується у відповідному розчиннику із сполуки представленої загальною формулою (4) та гідроксиду літію. Таким чином, сіль літію при використанні як сполуки представленої загальною формулою (4) повинна бути ізольованою, та може бути отримана розчиненням сполуки представленої загальною формулою (4) та гідроксиду літію у воді. Сполуки представлені загальними формулами (3) та (4), що використовуються у якості вихідної сировини у реакції відповідно до даного винаходу добре відомі. Способ одержання сполук оксазолу відповідно до даного винаходу буде описаний нижче. [Формула Реакції-2] 35 R1 H O N (CH2)n R1 O R2 (CH2)n N (2) O2N N R2 O OH O2N X1 N (5) X1 (6) N R1 O2N N (CH2)n O O R2 (1) 1 40 45 2 1 [де, R , R та n такі, як зазначено вище. X - атом галогену.] Відповідно до Формули Реакції-2, сполука представлена загальною формулою (1) одержується реакцією сполуки 4-нітроімідазолу представленої загальною формулою (5) з епоксидною сполукою, представленою загальною формулою (2) у присутності основної сполуки або за її відсутності із отриманням сполуки представленої загальною формулою (6), та піддаванням отриманої сполуки представленої загальною формулою (6) реакції замикання кільця. 8 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відношення використовуваної кількості сполуки за загальною формулою (5) до сполуки за загальною формулою (2) звичайно становить один моль першого на 0.5-5 моль, переважно 0.53 моль другого. У якості основних сполук може бути використана велика кількість відомих сполук, що включає, наприклад, неорганічні основи, такі як гідриди металу, нижчі алкоксиди лужних металів, гідроксиди, карбонати та гідрогенкарбонати, та органічні основи такі як ацетати. Особливими прикладами гідридів металів можуть бути гідрид натрію та гідрид калію. Особливими прикладами нижчих алкоксидів лужних металів можуть бути натрію метоксид, натрію етоксид та калію трет-бутоксид. Особливими прикладами гідроксидів можуть бути гідроксид натрію та гідроксид калію. Особливими прикладами карбонатів можуть бути карбонат натрію та калію карбонат. Особливими прикладами гідроген карбонатів можуть бути натрію гідрокарбонат та калію гідрокарбонат. Неорганічні основи також включають аміди натрію на додаток до зазначеного вище. Особливими прикладами ацетатів можуть бути натрію ацетат та калію ацетат. Особливими прикладами органічних солей на додаток до зазначеного вище можуть бути триетиламін, триметиламін, діізопропілетиламін, піридин, диметиланілін, 1-метилпірролідин, Nметилморфолін, 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) та 1,4-діазабіцикло[2.2.2]октан (DABCO). Такі основні сполуки звичайно використовують у кількості 0.1-2 моль, переважно 0.1-1 моль, більш переважно 0.1-0.5 моль на один моль сполуки за загальною формулою (5). Реакція сполуки за загальною формулою (5) та сполуки за загальною формулою (2) звичайно проводиться у відповідному розчиннику. У якості розчинників, може використовуватись велика кількість відомих розчинників, до тих пір, поки вони не інгібують реакцію, та включає, наприклад, апротонні поялрні розчинники, такі як диметилформамід (DMF), диметилсульфоксид (DMSO) та ацетонітрил; кетонні розчинники, такі як ацетон та метилeтилкетон; вуглеводні розчинники, такі як бензол, толуол, ксилол, тетралін та рідкий парафін; алкогольні розчинники такі як метанол, етанол, ізопропанол, nбутанол та трет-бутанол; ефірні розчинники такі як тетрагідрофуран (THF), діоксан, дипропіл ефір, діетил ефір та диглім; ефірні розчинники, такі як етил ацетат та метил ацетат; та їх суміші. Такі розчинники можуть містити воду. Реакція сполуки за загальною формулою (5) зі сполукою за загальною формулою (2) проводиться, наприклад, розчиненням сполуки за загальною формулою (5) у розчиннику реакції, з додаванням основної сполуки до розчину при температурі від температури кригоутворення до кімнатної температури (30 °C) перемішуючи, перемішуючи суміш при кімнатній температурі від 80 °C до 30 хвилин до 1 години, потім додаючи сполуку за загальною формулою (2), та продовжуючи перемішування суміші нормально при кімнатній температурі до 100 °C, переважно при від 50 до 80 °C протягом від 30 хвилин до 60 годин, переважно протягом 1-50 годин. Сполука (5), що використовується у якості сировини - це добре відома сполука. Сполука за даним винаходом представлена загальною формулою (1) одержується піддаванням сполуки представленої загальною формулою (6) реакції замикання кільця. Реакція замикання кільця представлена розчиненням отриманої раніше сполуки представленої загальною формулою (6) у розчиннику реакції, та додаванням туди основної сполуки та перемішуванням суміші. У якості розчинників реакції та основних сполук, можуть бути використані розчинники реакції та основні сполуки за загальною формулою (5) та сполука за загальною формулою (2) як описано вище. Використовувана кількість основної сполуки звичайно від 1 до необмеженої кількості моль, переважно 1-5 моль, більш переважно 1-2 моль на один моль сполуки за загальною формулою (6). Температура реакції замикання кільця звичайно становить від 0 до 150 °C, переважно це температура від кімнатної до 120 °C, більш переважно від 50 до 100 °C. Час реакції звичайно становить від 30 хвилин до 48 годин, переважно 1-24 години, більш переважно 1-12 годин. У даному винаході, реакційне змішування сполуки за загальною формулою (5) та сполуки за загальною формулою (2) може бути проведене із реакцією замикання кільця без відділення сполуки за загальною формулою (6) отриманої такою реакцією. Цільова сполука представлена загальною формулою (1) може також бути одержана, наприклад, реакцією сполуки за загальною формулою (5) зі сполукою за загальною формулою (2) при температурі від кімнатної до 80 °C, наступним додаванням основної сполуки до реакційної суміші, та наступним перемішуванням суміші при 50-100 °C, або реакцією сполуки за загальною формулою (5) зі 9 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполукою за загальною формулою (2) при температурі від кімнатної до 80 °C, а потім конденсації реакційної суміші, розчинення осаду у розчиннику в точці найвищого кипіння, додавання основної сполуки до отриманого розчину, та наступного перемішування розчину при 50-100 °C. Цільова сполука представлена загальною формулою (1) може також бути одержана за допомогою використання 0.9-2 моль основної сполуки на один моль сполуки за загальною формулою (5) у реакції сполуки за загальною формулою (5) та сполуки за загальною формулою (2), та перемішуванні реакційної суміші при 50-100 °C та реагують сполука за загальною формулою (5) та сполука за загальною формулою (2) у єдиному процесі. Сполуки представлені загальною формулою (5), що використовуються у якості вихідної сировини у реакції відповідно до даного винаходу добре відомі. Сполуками сировини, що використовуються у кожній формулі реакції описаній вище можуть бути відповідні солі, та цільові сполуки отримані у кожній реакції можуть утворювати відповідні солі. Такі відповідні солі - це фармакологічно прийнятні солі, що включають солі неорганічних основ, органічних основ, неорганічних кислот та органічних кислот. Солі неорганічних основ включають, наприклад, солі металів, такі як солі лужних металів (наприклад, солі літію, солі натрію та солі калію) та алкалінові лужноземельні солі (наприклад, солі кальцію та солі магнію), солі амонію, карбонати лужних металів (наприклад, літію карбонат, калію карбонат, карбонат натрію та цезію карбонат), лужний метал гідрогенкарбонати (наприклад, гідрокарбонат літію, гідрокарбонат натрію та гідрокарбонат калію), та гідроксиди лужних металів (наприклад, гідроксид літію, гідроксид натрію, гідроксид калію та гідроксид цезію). Солі органічних основ включають, наприклад, три(нижчий)алкіламін (наприклад, триметиламін, триетиламін та N-етилдіізопропіламін), піридин, хінолін, піперидин, імідазол, піколін, диметиламінопіридин, диметиланілін, N-(нижчий)алкілморфолін (наприклад, Nметилморфолін), 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU), та 1,4-діазабіцикло[2.2.2]октан (DABCO). Солі неорганічних кислот включає, наприклад, гідрохлориди, гідроброміди, гідройодиди, сульфати, нітрати та фосфати. Солі органічних кислот включають, наприклад, такі як формати, ацетати, пропіонати, оксалати, малонати, цукцинати, фумарати, малеати, лактати, малати, цитрати, тартрати, цитрати, карбонати, пікрати, метансульфонати, етансульфонати, р-толуолсульфонати та глутамати. Сполуки, що мають форми, у яких сольвати (наприклад, гідрати та етанолати) додаються до сировини та цільових сполук зазначені у кожній Формулі Реакції включені у кожну загальну формулу. Переважно сольвати включають гідрати. Кожна цільова сполука отримана зазначеною вище Формулою Реакції може бути відокремлена та очищена від реакційної суміші, наприклад, розділенням неочищених продуктів реакції операціями розділення, такими як фільтрація, конденсація та екстракція після охолодження реакційної суміші, та піддавання відокремлених продуктів реакції операціям по згальному очищенню, таким як колонкова хроматографія та рекристалізація. Сполуки представлені загальною формулою (1) відповідно до даного винаходу природньо включають ізомери, такі як геометричні ізомери, стереоізомери та оптичні ізомери. У випадку коли сполука 2,3-дігідроімідазо[2,1-b]оксазолу представлена загальною формулою (1) або її сіллю, що являє собою активну складову туберкулостатичності, одержується реакцією епоксидної сполуки або її солі за даним винаходом представленої загальною формулою (2) зі сполукою представленою загальною формулою (5), дуже незначна кількість субпродуктів отримується із цією реакцією. Відповідно, використовуючи епоксидну сполуку за даним винаходом представлену загальною формулою (2) або її сіллю дозволяє одержувати сполуку 2,3-дігідроімідазо[2,1-b]оксазолу представлену загальною формулою (1) з більшим виходом та більшою чистотою. Епоксидна сполука за даним винаходом представлена загальною формулою (2) або її сіллю це сполука, що легко кристалізується. Таким чином, епоксидна сполука за даним винаходом представлена загальною формулою (2) або її солі може бути одержана з високою чистотою за допомогою операції простої кристалізації після реакції сполуки представленої загальною формулою (3) або її солей зі сполукою представленою загальною формулою (4). Переважний варіант здійснення винаходу У подальшому, даний винахід буде уточнений за допомогою Посилальні приклади та Приклади. Посилальний приклад 1 10 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 1-етоксикарбонил-4-метилоксипіперидин 1-етоксикарбонил-4-гідроксипіперидин (30.3 g) та триетиламін (23 g) були розчинені у етилацетаті (182 mL) та отримана суміш була охолодженв до 3 °C. Метансульфоніл хлорид (22.05 g) був доданий підчас перемішування уважно слідкуючи за тим, щоб температура не перевищувала 20 °C, та суміш постійно перемішувалася при кригоутвоернні протягом 1 години. Отирмана реакційна суміш промивалася водою (90 mL X 3). Органічний шар був відокремлений та згущений до отримання цільової сполуки у вигляді жовтуватої масляної субстанції. Вихід становить 43.09 g (98 %). 1 H-NMR (СDСl3` 300 MHz); 1.27 (3Н, t, J=7.1 Hz), 1.8-1.9 (2H, m), 1.9-2.05 (2H, m), 3.05 (3H, s), 3.3-3.45 (2H, m), 3.69-3.8 (2H, m), 4.14 (2H, q` J=7.1 Hz), 4.86-4.94 (1H, m). Посилальний приклад 2 1-етоксикарбонил-4-(4-трифторометоксифенокси)піперидин 1-етоксикарбонил-4-мезилоксипіперидин (13.6 g), трифторометоксифенол (4.0 g), тетрабутиламоній хлорид (1.2 g) та карбонат калію (7.72 g) були суспендовані у воді (20 mL) та суспензія відтікала протягом 3 годин. Реакційний розчин був охолоджений до кімнатної температури, та потім продукт реакції екстрагувався толуолом (24 mL). Екстракт промивався водою (20 mL х 2), та потім розчинник концентрувався під зниженим тиском до отримання цільової сполуки у вигляді жовтуватої масляної субстанції. Вихід становив 12.03 g (%). Отримана цільова сполука використовувалась для наступної реакції без очищення. 1 H-NMR (CDCl3`300 Hz); 1.27 (3Н, t` J=7.1 Hz), 1.7-1.8 (2Н, m), 1.89-2.0 (2H, m), 3.3-3.46 (2H, m), 3.68-3.77 (2H, m), 4.14 (2H, q` J=7.1 Hz), 4.43-4.47 (1H, m), 6.89 (2H, d, J=9.1 Hz), 7.13 (2H, d, J=9.1 Hz). Посилальний приклад 3 4-(4-трифторометоксифенокси)піперидин Гідроксид калію (10.7 g) нагрівався до 100 °C, та розчинявся у ізобутанолі (15 mL). Ізобутаноловий (25 mL) розчин 1-етоксикарбонил-4-(4-трифторометоксифенокси)піперидину (12.03 g) додавався по краплям до тих пір, поки не стане помітно генерування газу діоксину карбону. Після покрапленого додавання, суміш нагрівалася та перемішувалася при 100 °C протягом 2 годин; потім розчинник концентрувався; та толуол (40 mL) додавався до отриманого осаду. Розчин толуолу промивався водою (40 mL х 2), та потім розчинник концентрувався під зниженим тиском до отримання цільової сполуки у вигляді легко оранжевої твердої субстанції. Вихід становив 5.73 g (98 % оснований на трифторометоксифенолі). 1 H-NMR (CDCl3`300 Hz); 1.59-1.71 (2H, m), 1,95-2,05 (2H, m), 2.68-2.77 (2H, m), 3.11-3.18 (2H, m), 4.29-4.37 (1H, m), 6.90 (2H, d, J=9.1 Hz), 7.13 (2H, d, J=9.1 Hz). Посилальний приклад 4 сіль 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенол-паратолуолсульфонової кислоти 4-(4-трифторометоксифенокси)піперидин (4.0 g), 1,4-циклогександіон (2.575 g) та триетиламін (2.16 mL) були розчинені в етанолі (60 mL), та отримана суміш нагрівалася at 50 to 60 °C, та реагувала протягом 6 годин із застосуванням барботування. Після реакції, розчинник був здистильований під зниженим тиском; етилацетат (20 mL) та моногідрат паратолуолсульфонової кислоти (4.37 g) додавалися до отримання осаду; отримана суміш охолоджувалась, та перемішувалась протягом 1 години. Осаджений кристал фільтрувався, та промивався невеликою кількістю етилацетату, та потім висушувався при кімнатній температурі до отримання цільової сполуки у вигляді жовтуватих порошкоподібних кристалів. Вихід становив 4.4 65 g (55.5 %). Точка топлення: 211-214 °C (розклад) Чистота (HPLC): 82.52 % Колонка HPLC: COSMOSIL5C8-MS (4.6 x 250 mm); довжина хвилі детектування: 275 nm; елюентні умови 1: метанол/0.1 М амоній ацетат водний розчин=50/50 (40 °C); елюентні умови 2: метанол/0.1 М водний розчин ацетату амонію = 800/200; чистота = 100 - (повна сума включеннь виявлених при елюентних умовах 1 та 2) 1 H-NMR (DMSO-d6 температура вимірювання 70 °C); 2.05 (2Н, m), 2.23 (2Н, m), 2.28 (3H, s), 3.48 (2H, m), 3.59 (2Н, m), 4.71 (1Н, m), 6.87 (2Н, m), 7.09 (2Н, m), 7.13 (2Н, m), 7.28 (2Н, m), 7.38 (2Н, m), 7.50 (2Н, m) -1 IR(KBr, cm ); 2714,150 6,1288,1217,1033,813 Така сполука може бути в подальшому очищена рекристалізацією із змішаного розчину етил ацетату у об'ємі десяти частин та води у об'ємі двох частин, та висушування при 60 °C. Форма: безбарвний лускоподібний кристал Чистота (HPLC): 99.8 % (HPLC умови були такими, як зазначено вище) 11 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 Точка топлення її чистого продукту: 218.1 to 219.3 °C (розклад) Посилальний приклад 5 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенол Калію карбонат (19.3 kg) був розчинений у воді (245 L), та поки отриманий розчин перемішувався при 20-30 °C, сіль 4-[4-(4-трифторометоксифенокси)піперидин-1іл]фенолпаратолуолсульфонової кислоти (49 kg) додавалася до розчину. Суміш безперервно перемішувaлася, протягом 1 години; та потім кристал фільтрувався, та промивався водою (245 L) (поки промиваюча рідина проявляла нейтральність). Отриманий кристал висушувався при приблизно 60 °C протягом 42 годин. Вихід становив 31.87 kg (вихід: 96.74 %). Коричневатий порошок, Точка топлення: 114-115 °C 1 H-NMR; (300 MHz; DMSO-d6) 1.71-1.78 (2H, m), 2.0-2.05 (2H, m), 2.81-2.89 (2H, m), 3.2-3.3 (2H, m), 4.50-4.51 (1H, m), 6.64 (2H, dd, J=3 Hz, J=9 Hz), 6.80 (2H, dd, J=3 Hz, J=9 Hz), 7.06 (2H, dd, J=3 Hz, J=9 Hz), 7.27 (2H, d, J=9 Hz), 8.82 (1H, s). Посилальний приклад 6 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенолат літію сіль 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенолпаратолуолсульфонової кислоти (105 g) та карбонат калію (41.5 g) додавалися у воду (525 mL), та отримана суміш перемішувалася при кімнатній температурі протягом 2 годин. Осаджений кристал фільтрувався, та розчинювався у ізопропіловому спирті (525 mL); та розчин, у якому моногідрат гідроксиду літію (8.0 g) був розчинений у воді (45 mL) додавався до кристалічного розчину. Отримана суміш перемішувався при кімнатній температурі протягом 2 годин; реакційний розчин концентрувався до 3/5 під зниженим тиском; осаджена рідина додавалася з толуолом, та концентрувалася під зниженим тиском поки кількість рідини не становила біля 1/4. Осад додавався з толуолом (200 mL); та кристал фільтрувався, висушувався при 40-50 °C всю ніч до отримання цільової солі літію у вигляді коричневатого кристалу. Вихід становив 66.6 g (93 %). 1 H-NMR (300 MHz, DMSO-d6) 8; 1.6-1.8 (2H, m), 1.9-2.1 (2H, m), 2.6-2.8 (2H, m), 3.0-3.2 (2H, m), 4.3-4.5 (1H, m), 6.1-6.4 (2H, br), 6.57 (2H, d, J=8 Hz), 7.07 (2H, d, 9 Hz), 7.27 (2H, d, J=9 Hz). Посилальний приклад 7 Приготування 4-[4-(трифторометокси)фенокси]піридин-N-оксиду 4-нітропіридин-N-оксид (84.00 g), 4-Трифторометоксифенол (107.8 g), К2СО3 (165.7 g) та DMF (420 mL) поміщався у посудину та перемішувався при 80-90 °C протягом 4.5 годин. Реакційна суміш потім охолоджувалася до кімнатної температури та додавалися вода (2500 mL) та етилацетат (2500 mL). Органічний матеріали поглиналися у етилацетаті та потім водний шар екстагувався етилацетатом (1000 mL). Всі органічні екстракти промивалися три рази водою (1000 mL X 3). Та потім органічні екстракти конденсувалися під зниженим тиском до отримання неочищених рподуктів (150.7 g). Неочищені продукти (150.7 g) та n-гексан (1500 mL) поміщалися у посудину та перемішувалися при 60 °C протягом 0.5 годин та потім суміші давали охолонути до 10 °C протягом 1 hr. Суміш потім фільтрували та кристалічний порошок промивали nгексаном (168 mL) та висушували при 50 °C протягом 17 годин до отримання 139.4 g (85.73 % вихід) коричневої кристалічної цільової сполуки. Мр 108.5-109.5 °C 1 H-NMR (300 MHz, CDCl3) =6.86-6.89 (m, 2H), 7.11-7.14 (m, 2H), 7.29-7.32 (m, 2H), 8.15-8.18 (m, 2H) Посилальний приклад 8 Приготування 4-[4-(трифторометокси)фенокси]піридину 4-Хлоропіридин гідрохлорид (17.3 g), 4Трифторометоксифенол (24.6 g), К2СО3 (35.1 g) та DMF (173 mL) поміщалися у посудину та перемішувалися при 28-40 °C протягом 1.5 годин. Та потім перемішувалися при 75-84 °C протягом 6 годин. Та потім перемішувалися при 139-146 °C протягом 34.5 годин. Реакційна суміш потім охолоджувалася до кімнатної температури та вода (256 mL), невелика кількість NaCl та етилацетат (256 mL) додавалися. Органічний матеріал поглинався у етилацетаті. Органічний шар промивався водою (256 mL) та невеликою кількістю NaCl. Та потім органічний шар екстагувався три рази з 10 v/v%HCl (256 mL X 3). Органічний матеріал поглинався у 10 v/v%HCl. Та потім водний шар був перетворений на основу до рН 9 за допомогою NaOH та екстагувався етилацетатом (256 mL). Органічний матеріал поглинався у етилацетаті. Органічний шар промивався водою (256 mL) та невеликій кількості NaCl. Органічний шар конденсувався під зниженим тиском до отримання 15.3 g (52.0 % вихід) коричневої масляної цільової сполуки. 12 UA 99455 C2 H-NMR (300 MHz, CDCl3) =6.84-6.87 (m, 2H), 7.11-7.15 (m, 2H), 7.26-7.30 (m, 2H), 8.49-8.53 (m, 2H) Посилальний приклад 9 Приготування 4-[4-(Трифторометокси)фенокси]піридину Після того, як 4-[4-(Трифторометокси)фенокси] піридин-N-оксид (130.0 g) був розчинений у етанолі (500 mL) та (50 % вологості) додавали паладій на вуглеці 5 в/в% (6.5 g). Отримана суміш перемішувалася при 3-х атмосферах в атмосфері водню при 27-49 °C протягом 6.5 годин. Реакційна суміш фільтрувалася для видалення каталізатора та потім концентрувалася у вакуумі до отримання кількісного виходу (122.9 g) блідно жовтого масляного неочищеного продукту. Очищення за допомогою випарювальної колонкової хроматографії (600 g Сіліка Гелю 60, сферичний, етилацетат) надало отримання продукту чистої цільової сполуки у вигляді безбарвного масла (86.74 g, 70.91 % вихід). 1 H-NMR (300 MHz, CDCl3) =6.84-6.86 (m, 2H), 7.11-7.15 (m, 2H), 7.27-7.30 (m, 2H), 8.47-8.51 (m, 2H) Посилальний приклад 10 Приготування 4-[4-(Трифторометокси)фенокси]піридину Після того, як 4-[4-(Трифторометокси)фенокси]піридин-N-оксид (50 mg) був розчинений у етанолі (1.8 mL) та додавався паладій на вуглеці 10 в/в% (4 mg). Потім додавався формат амонію (120 mg). Отримана суміш перемішувалася при 20 °C протягом 6 годин. Реакційна суміш фільтрувалася до видалення каталізатора із наступною концентрацією у вакуумі до отримання осадженої субстанції. Осаджену субстанцію екстагували дихлорометаном. Екстракт конденсувався під зниженим тиском до отримання 46 mg (98 % вихід) безбарвної масляної цільової сполуки. 1 H-NMR (300 MHz, CDCI3) =6.84-6.88 (m, 2H), 7.11-7.15 (m, 2H), 7.26-7.31 (m, 2H), 8.49-8.51 (m, 2H) Посилальний приклад 11 Приготування 4-[4-(Трифторометокси)фенокси]піперидину Після того, як 4-[4-(Трифторометокси)фенокси] піридин (2.00 g) був розчинений в уксусній кислоті (20 mL) додавався оксид платини (IV) (200 mg). Отримана суміш перемішувалася при 4х атмосферах в атмосфері водню при 23-30 °C протягом 12 годин. Реакційна суміш фільтрувалася до видалення каталізатора із наступною концентрацією у вакуумі до отримання 3.32 g жовтого масляного неочищеного продукту. Неочищений продукт був розчинений у толуолі (100 mL) та промивався три рази із 10w/v% NaOHaq (50 mL X 3) та потім промивався три рази водою (50 mL X 3). Органічний шар конденсувався під зниженим тиском до отримання 675 mg (33.0 % вихід) блідо жовтої кристалічної цільової сполуки. 1 H-NMR (300 MHz, CDCl3) =1.50-1.60 (bs, 1Н), 1.60-1.68 (m, 2H), 1.98-2.03 (m, 2H), 2.68-2.76 (m, 2H), 3.10-3.18 (m, 2H), 4.28-4.36 (m, 1H), 6.83-6.92 (m, 2H), 7.09-7.15 (m, 2H) Посилальний приклад 12 Приготування 4-[4-(Трифторометокси)фенокси]піперидину Після того, як 4-[4-(Трифторометокси)фенокси] піридин (2.00 g) був розчинений у уксусній кислоті (20 mL) додавався оксид платини (І\/) (200 mg). Отримана суміш перемішувався при 50 atms атмосферах водню при 24-26 °C протягом 7 годин 40 хвилин. Реакційна суміш фільтрувався до видалення каталізатору із наступною концентрацією у вакуумі до отримання 3.89 g безбарвного масляного неочищеного продукту. Неочищений продукт був розчинений у толуолі (100 mL) та промивався три рази із 10 w/v% NaOHaq (50 mL X 3) та потім промивався три рази водою (50 mL X 3). Органічний шар конденсувався під зниженим тиском до отримання 772 mg (37.7 % вихід) блідо жовтої кристалічної цільової сполуки. 1 H-NMR (300 MHz, CDCI3) =1.50-1.60 (bs, 1Н), 1.60-1.67 (m, 2H), 1.97-2.03 (m, 2H), 2.68-2.76 (m, 2H), 3.10-3.17 (m, 2H), 4.28-4.37 (m, 1H), 6.86-6.92 (m, 2H), 7.09-7.15 (m, 2H) Посилальний приклад 13 Приготування 1-(4-Бензилоксифеніл)-4-[4-(Трифторометокси)фенокси]піперидину 4-[4-(Трифторометокси)фенокси]піперидин (26.1 g), бензил 4-бромофеніл ефір (26.3 g), паладій (II) ацетат (22.4 mg), Три-трет-бутил фосфоній тетрафеніл борат (52.3 mg), натрію третбутоксид (10.6 g) та толуол (130 mL) були поміщені у посудину та нагрівалися до температури флегми протягом 4 hr під Аr. Реакційна суміш потім охолоджувалася до кімнатної температури та додавалися вода (260 mL) та етил ацетат (260 mL). Органічний матеріал поглинався у етилацетаті. Органічний шар промивався двічи водою (260 mL X 2). Органічний шар фільтрувався до видалення смоли та потім органічний шар конденсувався під зниженим тиском до отримання 43.34 g (97.82 % неочищений вихід, 97.34 % HPLC чистота) блідо жовтого продукту. Неочищений продукт (43.3 g) та етанол (433 mL) поміщалися у посудину та 1 5 10 15 20 25 30 35 40 45 50 55 60 13 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 нагрівалися до розчинення та потім суміші давали охолонути до 0 °C протагом 1 години. Суміш потім фільтрували та кристалічний порошок промивали охолодженим етанолом (43 mL) та потім висушували при 40 °C протягом 15 годин до отримання 39.7 g (91.7 % вихід) блідо жовтої кристалічної цільової сполуки. Повний вихід 89.7 % HPLC чистота 100 % 1 H-NMR (300 MHz, CDCl3) =1.93-2.00 (m, 2H), 2.07-2.11 (m, 2H), 2.94-3.02 (m, 2H), 3.33-3.40 (m, 2H), 4.37-4.41 (m, 1H), 5.02 (s, 2H), 6.89-6.92 (m, 2H), 7.11-7.15 (m, 2H), 7.31-7.44 (m, 5H) Посилальний приклад 14 Приготування 1-(4-Бензилоксифеніл)-4-[4-(Трифторометокси)фенокси]піперидину 4-[4-(Трифторометокси)фенокси]піперидин (2.61 g), бензил 4-бромофеніл ефір (2.63 g), паладій (II) ацетат (0.67 mg), Три-трет-бутил фосфоній тетрафеніл борат (1.57 mg), натрію третбутоксид (1.06 g) та толуол (13 mL) були поміщені у посудину та нагрівалися до температури флегми протягом 6 годин під Аr. Реакційна суміш потім охолоджувалася до кімнатної температури та додавалися вода (100 mL) та етил ацетат (100 mL). Органічний матеріал поглинався у етилацетаті. Органічний шар промивався три рази водою (100 mL X 3). Органічний шар фільтрувався до видалення смоли та потім органічний шар конденсувався під зниженим тиском до отримання 4.36 g (98.4 % вихід) блідо жовтої кристалічної цільової сполуки. 1 H-NMR (300 MHz, CDCl3) =1.93-1.99 (m, 2H), 2.07-2.11 (m, 2H), 2.93-3.01 (m, 2H), 3.32-3.39 (m, 2H), 4.38-4.40 (m, 1H), 5.02 (s, 2H), 6.89-6.91 (m, 2H), 7.11-7.15 (m, 2H), 7.30-7.41 (m, 5H) Посилальний приклад 15 Приготування 1-(4-Гідроксифеніл)-4-[4-(Трифторометокси)фенокси]піперидин Після того, як 1-(4-Бензилоксифеніл)-4-[4-(Трифторометокси)фенокси]піперидин (20.0 g) та етиловий спирт (200 mL) були перемішані та потім додавався (50 % вологості) паладій на вуглеці 5 в/в% (1 g). Отримана суміш перемішувався при 4 атмосферах в атмосфері водню при 60-61 °C протягом 3 годин. Реакційна суміш потім охолоджувалася до кімнатної температури та фільтрувалася до видалення каталізатору із наступною концентрацією у вакуумі до отримання 16.2 g (99.5 % вихід) кристалічної цільової сполуки кольору слонової кістки. HPLC чистота 99.67 % 1 H-NMR (300 MHz, CDCl3) =1.93-2.00 (m, 2H), 2.08-2.13 (m, 2H), 2.93-3.01 (m, 2H), 3.30-3.38 (m, 2H), 4.38-4.43 (m, 1H), 5.1 (bs, 1H), 6.72-6.75 (m, 2H), 6.87-6.92 (m, 4H), 7.12-7.15 (m, 2H) Посилальний приклад 16 Синтез трет-бутилу 4-(4-трифторометоксибенэилокси)піперидин-1-карбоксилату 10.00 kg трет-бутил 4-гідроксипіперидин-1-карбоксилату, 40 L диметоксиетану та 9.55 kg трет-бутоксид натрію були перемішані, та збовтані при 2-17 °C протягом 30 хвилин. Суміш була змішана з 13.31 kg 4-бромометил-1-трифторомeтоксибензолу та 10 L диметоксиетану при 1214 °C, та збовтана при 21-23 °C протягом 3 годин. Реакційна суміш була розбавлена 100 L води; екстрагована за допомогою 100 L of етилацетату; та органічний шар промивався за допомогою 100 L 1 % водного розчину NaCl двічи. Органічний шар концентрувався під зниженим тиском до кількісного отримання 19.21 kg жовтої масляної цільової субстанції. Вихід: 103 % 1 H-NMR (300 MHz, CDCl3) =1.46 (s, 9H), 1.50-1.67 (m, 2H), 1.80-1.97 (m, 2H), 3.07-3.23 (m, 2H), 3.50-3.60 (m, 1H), 3.70-3.90 (m, 2H), 4.54 (s, 2H), 7.19 (d, 2H, 8.7 Hz), 7.37 (d, 2H, 8.7 Hz) Посилальний приклад 17 Синтез 4-(4-трифторометоксибензилокси)піперидину 19.21 kg трет-бутил 4-(4-трифторометоксибензилокси)піперидин-1-карбоксилату та 50 L етанолу були змішані, та збовтані при 60 °C. Суміш була змішана з 8.28 L концентрованої соляної кислоти, збовтана при 60 °C протягом 2 годин, та концентрована під зниженим тиском. 80 L толуолу додавалося до осаду; суміш екстагувалася із 150 L води; та потім водний шар промивався 40 L толуолу. 15.5 L 25 % водного розчину NaOH додавалося до водного шару; суміш екстагувалася двічи з 80 L та 40 L толуолу; органічні шари були зкомбіновані та органічний шар двічи промивався 80 L води; органічний шар концентрувався під зниженим тиском; потім, 20 L етанолу додавалося осаду; та суміш концентрувалася під зниженим тиском до отримання 10.40 kg жовтої масляної цільової субстанції. Вихід: 76.04 % 1 H-NMR (300 MHz, CDCl3) =1.42-1.62 (m, 2H), 1.90-2.05 (m, 2H), 2.57-2.73 (m, 2H), 3.04-3.20 (m, 2H), 3.42-3.58 (m, 1H), 4.55 (s, 2H), 7.18 (d, 2H, 8.7 Hz), 7.38 (d, 2H, 8.7 Hz) Посилальний приклад 18 Синтез 1-(4-гідроксифеніл)-4-(4-трифторометоксибензилокси)піперидин 4метилбензолсульфонової кислоти 14 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 30.0 g 4-(4-трифторометоксибензилокси)піперидину, 18.3 g 1,4-циклогександіону, 11.04 g триетиламін та 150 mL етанолу були змішані. Після перемішування при 55 °C протягом 7.5 годин при продуванні повітрям (310 mL/min), суміш концентрувалася під зниженим тиском. Осад був змішаний з 60 mL етилацетату; суміш концентрувалася під зниженим тиском; 150 mL етилацетату та 31.2 g 4-метилбензолсульфонової кислоти додавалися до суміші; суміш перемішувалася при 10 °C або менше протягом 3 годин; потім, кристал фільтрувався, та висушувався при 60 °C цілу ніч до отримання 42.5 g кристалічної цільової сполуки кольору слонової кістки. Вихід: 72.3 % HPLC чистота: 92.2 % 1 H-NMR (300 MHz, DMSO-d6) =1.70-2.40 (m, 4H), 2.29 (s, 3H), 3.30-4.10 (m, 5Н), 4.61 (s, 2H), 6.88 (d, 2H, 8.6 Hz), 7.1 1(d, 2H, 8.4 Hz), 7.37 (d, 2H, 7.9 Hz), 7.40-7.80 (m, 6H) Приклад 1 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенол (21.20 kg) був розчинений в ацетоні (164 L) із перемішуванням, та охолоджений до 10 °C або менше. Натрію t-бутоксид (6.34 kg) додавався із перемішуванням уважно слідкуючи, щоб температура змішаної рідини не перевищувала 25 °C. Змішана рідина охолоджувалась до 10 °C або менше; до неї додавався (R)-2-метилгліцидил паранітробензолсульфонат (16.40 kg); та потім отримана суміш нагрівалася до 40 °C, та збовтувалася протягом 4 хвилин. Реакційна рідина додавалася з водою (164 L), охолодженою до 10 °C або менше; та отримана суміш перемішувалася протягом 1 години. Осаджений кристал фільтрувався, та промивався водою (82 L). Отриманий кристал висушувався при біля 50 °C протягом 20 годин до отримання цільової субстанції у вигляді сірожовтого кристалічного порошока. Вихід складав 23.61 kg (92.91 %). Такий кристал використовувався у наступній реакції без очищення. Частина кристалу була рекристалізована з етанолу. Точка топлення: 85.8 to 86.5 °C Чистота: 89.76 % HPLC), колонка HPLC: InertsilC8 (4.6 х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.025 М фосфатний буферний водний розчин/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 96.1 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), композиція мобільної фази: n-гексан/етанол/діетиламін=900:100:1 1 H-NMR (300 MHz, CDCl3) : 1.48 (3H, s), 1.9-2.1 (4H, m), 2.72 (1H, d, J=5 Hz), 2.86 (1H, d, J=5 Hz), 2.9-3.1 (2H, m), 3.3-3.5 (2H, m), 3.91 (1H, d, J=10 Hz), 3.98 (1H, d, J=10JHz), 4.3-4.5 (1H, m), 6.8-7.0 (6H, m), 7.14 (2H, d, J=9 Hz). Приклад 2 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенолат літію (66.6 g), (R)-2-метилгліцидил паранітробензолсульфонат (49.1 g) та тетрабутиламоній хлорид (15.5 g) були додані до змішаної рідини толуолу (200 mL) та вода (333 mL), суміш перемішувалася при 60 °C протягом 6 годин. Реакційна рідина охолоджувалась до кімнатної температури; потім шар толуол відокремлювався, та промивався водою; потім розчинник був здистильований з під зниженим тиском. Ізопропіловий спирт (140 mL) та вода (60 mL) додавалися до осаду, та отримана суміш перемішувалася при 60 °C протягом 30 хвилин. Збовтана суміш охолоджувалась; потім осаджений кристал фільтрувався, та промивався невеликою кількістю гідратованого ізопропілового спирту, та сушився при 50 °C цілу ніч до отримання цільової субстанції у вигляді оранжевого кристалу. Вихід становив 63.5 g (78 %). Кристал був рекристалізований із ізопропілового спирту до отримання безбарвного голчастого кристалу 84-85 °C у точці топлення. Чистота: 94.6 % (HPLC), колонка HPLC: InertsilC8 (4.6 х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.025 М фосфат буферний водний розчин/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 90 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), композиція мобільної фази: n-гексан/етанол/діетиламін=900:100:1 1 H-NMR (300 MHz, CDCl3) : 1.48 (3H, s), 1. 9-2.1 (4H, m), 2.72 (1H, d, J=5 Hz), 2.86 (1H, d, J=5 Hz), 2.9-3.1 (2H, m), 3.3-3.5 (2H, m), 3.91 (1H, d, J=10 Hz), 3.98 (1H, d, J=10 JHz), 4.3-4.5 (1H, m), 6.8-7.0 (6H, m), 7.14 (2H, d, J=9 Hz). Приклад 3 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин 15 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 Сіль 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенолпаратолуолсульфонової кислоти (5.0 g) та моногідрат гідроксиду літію (0.9 g) додавалися до змішаної рідини толуолу (5 mL) та води (20 mL), отримана суміш перемішувалася при 4 0-50 °C протягом 1 години. Реакціна рідина охолоджувалась до 30-40 °C; потім водний розчин (5 mL) (R)-2-метилгліцидил паранітробензолсульфонату (2.86 g) та хлориду тетрабутиламонію (0.52 g), та толуол (5 mL) додавалися до Реакцііної рідини; суміш перемішувалася при 80 °C протягом 2 годин. Після того, як суміш охолоджувалась, шар толуолу відокремлювався, та промивався водою; та розчинник був здистильований. Метанол (25 mL) додавався до осаду; суміш нагрівалася та розчинялася; потім розчин перемішувався при кригоутворенні протягом біля 30-60 хвилин; вода (10 mL) повільно додавалася вода коли кристал осаджувався, суміш перемішувалася протягом 15 хвилин. Осаджений кристал фільтрувався, та промивався невеликою кількістю гідратованого метанолу, та висушувався при 50 °C цілу ніч до отримання цільової субстанції у вигляді жовтого кристалу. Вихід становив 3.89 g (84 %). Її чистота: 83 % (HPLC), колонка HPLC: InertsilC8 (4.6 х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.025 М фосфат буферний водний розчин/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 85 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), композиція мобільної фази: n-гексан/етанол/діетиламін=900:100:1 1 H-NMR (300 MHz, CDCl3) : 1.48 (3H, s), 1.9-2.1 (4H, m), 2.72 (1H, d, J=5 Hz), 2.86 (1H, d, J=5 Hz), 2.9-3.1 (2H, m), 3.3-3.5 (2H, m), 3.91 (1H, d, J=10 Hz), 3.98 (1H, d, J=10JHz), 4.3-4.5 (1H, m), 6.8-7.0 (6H, m), 7.14 (2H, d, J=9 Hz). Приклад 4 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин Ацетонний (100 ml) розчин 4-[4-(4-трифторометоксифенокси)піперидин-1-іл]фенолу (12.93 g) був охолоджений при 5 °C, також був доданий t-бутоксид натрію (3.87 g). Суміш, що генерувала теплоту до приблизно 10 °C, перемішувалася протягом 30 хвилин, включаючи час охолодження до 5 °C; потім відразу додали (R)-2-метилгліцидил паранітробензол сульфонат (10 д) до суміші при 5 °C. Суміш перемішувалася при 35-40 °C. Реакція супроводжувалась HPLC, а коли реакція перестала ровиватися, реакцію завершили за 6 годин. Воду (100 mL) додали до реакційної посудини; та реакційна суміш перемішувалася при 10 °C або менше протягом 30 хвилин. Реакційна суміш фільтрувалася, та промивалася водою (100 mL) до отримання цільової сполуки 18.63 g у вигляді вологих кристалів (неочищений вихід: 120.2 %). Вміст води складав 24.4 % (метод Карла Фішера). Вихід був визначений умовами при HPLC; зменшений вихід складав 83.50 %, a HPLC чистота складала 86.33 %. Умови проведення реакції HPLC: TSK ODS-80Ts (4.6 × 150 mm), 20 mM Na2SO4 aq/CH3CN/THF (3:3:3), UV 254 nm, 1 ml/min, rt. Приклад 5 (R)-1-[4-(2,3-елоксипропокси)феніл]-4-(4-трифторометоксифенокси)піперидин Цільова сполука одержуваласьяк у Прикладі 1, із використанням 4-[4-(4трифторометоксифенокси)піперидин-1-іл]фенолу та (R)-гліцидилнозилату у якості вихідної сировини. Точка топлення: 67.5 to 68.7 °C 1 H-NMR (250 MHz, CDCl3) : 1.83-2.17 (4H, m), 2.67-2.75 (1Н, m), 2.83-3.02 (3H, m), 3.25-3.40 (3H, m), 3.93 (1H, dd, J=5.6 Hz, J=11.1 Hz), 4.17 (1H, dd, J=3.3 Hz, J=11.1Hz), 4.31-4.45 (1H, m), 6.79-6.93 (6H, m), 7.14 (2H, d, J=8.8 Hz). Сполуки за Прикладами 6-18 описані нижче були одержані як у Прикладах 1-5, із використанням відповідної вихідної сировини. Приклад 6 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидин Точка топлення: 129.0 to 129.4 °C 1 H-NMR (250 MHz, CDCl3) : 1.46 (3H, s), 1.51-1.70 (2H, m), 1.84-2.09 (3H, m), 2.58-2.78 (3H, m), 2.85 (1H, d, J=4.9 Hz), 3.52 (2H, d, J=11.9 Hz), 3.79-4.03 (4H, m), 6.77-7.04 (6H, m), 7.54 (2H, d, J=8.6 Hz). Приклад 7 (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидин Точка топлення: 131 to 131 °C 1 H-NMR (250 MHz, CDCl3) : 1.45-1.64 (2H, m), 1.83-2.02 (3H, m), 2.62-2.75 (3H, m), 2.80-2.88 (1H, m), 3.26-3.43 (1H, m), 3.50-3.64 (2H, m), 3.81-3.93 (3H, m), 4.17 (1H, dd, J=3.3 Hz, J=11.0 Hz), 6.78-7.00 (6H, m), 7.54 (2H, d, J=8.7 Hz). Приклад 8 16 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2пропеніл]піперазин Точка топлення: 106.2 to 106.7 °C 1 H-NMR (250 MHz, CDCl3) : 1.47 (3H, s), 2.56-2.76 (5H, m), 2.85 (1H, d, J=4.8 Hz), 3.02-3.30 (6H, m), 3.83-4.01 (2H, m), 6.18-6.36 (1H, m), 6.52 (1H, d, J=15.9 Hz), 6.79-6.94 (4H, m), 7.16 (2H, d, J=8.2 Hz), 7.33-7.46 (2H, m). Приклад 9 (R)-1-[4-(2,3-епокси пропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2-пропеніл]піперазин Точка топлення: 88.2 to 89.5 °C 1 H-NMR (250 MHz, CDCl3) : 2.60-2.79 (5H, m), 2.81-2.93 (1H, m), 3.05-3.36 (7H, m), 3.92 (1H, dd, J=5.6 Hz, J=11.1 Hz), 4.16 (1H, dd, J=3.3 Hz, J=11.1 Hz), 6.82 (1H, dt` J=6.7 Hz, 15.9 Hz), 6.55 (1H, d, J=15.9 Hz), 6.81-6.93 (4H, m), 7.16 (2H, d, J=8.1 Hz), 7.40 (2H, d, J=8.1 Hz). Приклад 10 (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епокси-2-метилпропокси)феніл]піперидин 1 H-NMR (250 MHz, CDCl3) : 1. 29-1.54 (5H, m), 1.63-1.98 (3Н, m), 2.51-2.69 (2H, m), 2.73 (1H, d, J=4.8 Hz), 2.86 (1H, d, J=4.8 Hz), 3.34 (2H, d, J=6.3 Hz), 3.53 (2H, d, J=12.0 Hz), 3.93(2H, dd, J=10.5 Hz, J=15.4 Hz), 4.47 (2H, s), 6.72-6.95 (4H, m), 7.18-7.37 (4H, m). Приклад 11 (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епоксипропокси)феніл]піперидин Точка топлення: 49 to 50 °C 1 H-NMR (250 MHz, CDCl3) : 1.29-1.50 (2H, m), 1.64-1.93 (3H, m), 2.62 (2H, dt` J=2.4 Hz, 12.0 Hz), 2.69-2.75 (1H, m), 2.82-2.90 (1H, m), 3.25-3.40 (3H, m), 3.43-3.59 (2H, m), 3.92 (1H, dd, J=5.5 Hz, J=11.0 Hz), 4.15 (1H, dd, J=3.3 Hz, J=11.0 Hz), 4.48 (2H, s), 6.79-6.93 (4H, m), 7.21-7.63 (4H, m). Приклад 12 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензил)піперидин 1 H-NMR (250 MHz, CDCl3) : 1.31-1.84 (8H, m), 2.43-2.67 (4H, m), 2.72 (1H, d, J=4.8 Hz), 2.85 (1H, d, J=4.8 Hz), 3.47 (2H, d, J=12.1 Hz), 3.91 (2H, dd, J=10.5 Hz, J=15.9 Hz), 6.7 5-6.97 (4H, m), 7.07-7.24 (4H, m). Приклад 13 (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксибензил)піперидин Точка топлення: 62.5 to 63.9 °C 1 H-NMR (250 MHz, CDCl3) : 1.31-1.49 (2H, m), 1.52-1.78 (3H, m), 2.45-2.63 (4H, m), 2.67-2.76 (1H, m), 2.78-2.88 (1H, m), 3.26-3.38 (1H, m), 3.43-3.57 (2H, m), 3.92 (1H, d, J=5.5 Hz, 11.1 Hz), 4.15 (1H, d, J=3.3 Hz, 11.1 Hz), 6.76-6.90 (4H, m), 7.05-7.26 (4H, m). Приклад 14 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[N-метил-N-(4трифторометоксифеніл)]амінопіперидин Точка топлення: 74.0 to 74.7 °C 1 H-NMR (250 MHz, CDCl3) : 1.47 (3H, s), 1.69-2.11 (4Н, m), 2.61-2.90 (7H, m), 3.43-3.75 (3H, m), 3.92 (2H, dd, J=10.5 Hz, J=17.8 Hz), 6.64-6.82 (2H, m), 6.84-6.99 (4H, m), 7.01-7.17 (2H, d, J=8.5 Hz). Приклад 15 (R)-4-[N-метил-N-(4-трифторометоксифеніл)]аміно-1-[4-(2,3-епоксипропокси)феніл]піперидин Точка топлення: 92 to 93 °C 1 H-NMR (250 MHz, CDCl3) : 1.75-2.02 (4H, m), 2.64-2.93 (7H, m), 3.26-3.40 (1H, m), 3.55-3.75 (3H, m), 3.93 (1H, dd, J=5.6 Hz, J=11.0 Hz), 4.17 (1H, dd, J=3.3 Hz, J=11.0 Hz), 6.77 (2H, d, J=8.5 Hz), 6.81-6.95 (4H, m), 7.09 (2H, d, J=8.5 Hz). Приклад 16 (R)-1-(4-хлорофеніл)-4-[4-(2,3-епокси-2-метилпропокси)феніл]піперазин Точка топлення: 169.9 to 170.6 °C 1 H-NMR (250 MHz, CDCl3) : 1.48 (3H, s), 2.73 (1Н, d, J=4.8 Hz), 2.86 (1H, d, J=4.8 Hz), 3.073.41 (8H, m), 3.93(2H, dd, J=10.5 Hz, J=18.9 Hz), 6.83-6.99 (6H, m), 7.14-7.32 (2H, m). Приклад 17 (R)-1-(4-хлорофеніл)-4-[4-(2,3-епоксипропокси)феніл]піперазин Точка топлення: 177.5 to 178.5 °C 1 H-NMR (250 MHz, CDCl3) : 2.69-2.79 (1Н, m), 2.83-2.92 (1Н, m), 3.17-3.38 (9H, m), 3.94 (1H, dd, J=5.6 Hz, J=11.0 Hz), 4.18 (1H, dd, J=3.2 Hz, J=11.0 Hz), 6.81-6.98 (6H, m), 7.23 (2H, d, J=9.0 Hz). Приклад 18 17 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензилокси)піперидин Точка топлення: 97.6 to 97.9 °C 1 H-NMR (250 MHz, CDCl3) : 1.47 (3H, s), 1.71-1.93 (2H, m), 1.96-2.16 (2H, m), 2.70 (1H, d, J=4.8 Hz), 2.76-2.93 (3H, m), 3.31-3.64 (3H, m), 3.93 (2H, dd, J=10.5 Hz, J=16.5 Hz), 4.57 (2H, s), 6.75-6.96 (4H, m), 7.18 (2H, d, J=8.6 Hz), 7.39 (2H, d, J=8.6 Hz). Приклад 19 (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-b]оксазол (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин (8.04 g), 2-бромо-4-нітроімідазол (4.53 g) та натрію ацетат (387 mg) були змішані, та збовтані при 110 °C протягом 2 годин. Диметилформамід (20 ml) додавався до реакційної рідини, та після того, як складники були розчинені, реакційна рідина охолоджувалась льодом. Потім додавався диметилформамід (70 ml) та реакційна рідина охолоджувалась до -5 °C. t-бутоксид натрію (2.949 g) потроху додавали до реакційної рідини таким чином, щоб температура не перевищувала 0 °C. Після приблизно 3 годин, вода (200 mL) та етил ацетат (10 mL) додавалися до реакційної суміші, та збовтувалися при 60 °C протягом 1 години. Реакційна рідина охолоджувалась до 30 °C, осаджений кристал фільтрувався, та промивався водою (45 mL) та метанолом (20 mL). Кристал суспендували у змішаній рідині етилацетату (25 mL) та метанолу (25 mL), та знову збовтували при 60 °C протягом 1 години. Суспензія охолоджувалась до 5 °C, та осаджений кристал фільтрувався, та потім висушувався (при 60 °C цілу ніч) до отримання цільової сполуки. Вихід становив 7.258 g (71.5 %); та чистота становила 99.49 % (HPLC). Колонка HPLC: ODS-0TS (4.6ɸ х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.02 М натрію сульфат/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 99.6 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: nгексан/етанол/діетиламін=300/700/1 1 H-NMR (300 MHz, CDCI3); 1.77 (3H, s), 1.8-2.2 (4H, m), 2.9-3.1 (2H, m), 3.2-3.4 (2H, m), 3.9-4.1 (2H, m), 4.02 (1H, d, J=10 Hz), 4.04 (1H, d, J=10 Hz), 4.18 (1H, d, J=10 Hz), 4.4-4.5 (1H, m), 4.50 (1H, d, J=10 Hz), 6.78 (2H, d, J=9 Hz), 6.8-7.0 (4H, m), 7.14 (2H, d, J=9 Hz), 7.56 (1H, s). Приклад 20 (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-b]оксазол (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин (2.0 g) та 2-бромо-4-нітроімідазол (1.0 g) були розчинені у t-бутил ацетаті (2 mL); також додавали ацетат натрію (77.5 mg); та суміш перемішувалася при 95-100 °C протягом 3 годин. Амід N, Nдиметил оцтової кислоти (18 mL) та моногідрат гідроксиду літію (238 mg) додавалися до отриманого розчину, і суміш перемішувалася при 80 °C протягом 4 годин. Реакційна рідина охолоджувалась, потім доповнювалася водою (35 mL) та збовтувалася; осаджений кристал фільтрувався. Отриманий кристал був рекристалізований із змішаної рідини метанолу (20 mL) та етил ацетату (4 mL), та висушений при 60 °C протягом ночі до дтримання цільової субстанції у вигляді жовтуватого кристалу. Вихід становив 1.79 g (вихід: 71 %). Чистота: 100 % (HPLC), колонка HPLC: ODS-0TS (4.6ɸ х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.02 М натрію сульфат/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 93.7 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6ɸ х 250 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: nгексан/етанол/діетиламін=300/700/1 1 H-NMR (300 MHz, CDCI3); 1.77 (3H, s), 1.8-2.2 (4H, m), 2.9-3.1 (2H, m), 3.2-3.4 (2H, m), 3.9-4.1 (2H, m), 4.02 (1H, d, J=10 Hz), 4.04 (1H, d, J=10 Hz), 4.18 (1H, d, J=10 Hz), 4.4-4.5 (1H, m), 4.50 (1H, d, J=10 Hz), 6.78 (2H, d, J=9 Hz), 6.6-7.0 (4H, m), 7.14 (2H, d, J=9 Hz), 7.56 (1H, s). Приклад 21 (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-b]оксазол (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифєнокси)піперидин (2.0 g, чистота: 86 %) та 2-бромо-4-нітроімідазол (1.0 g) були розчинені у t-бутил ацетаті (2 mL); натрію ацетат (0.2 g) також додавався; та суміш перемішувалася при 95-100 °C протягом 3 годин. Метанол (5.5 mL) додавався до отриманого розчину; та потім розчин метанолу (2.1 mL) 28 % метилату натрію додавався по краплям до розчину при -100 °C. Отримана суміш перемішувалася при 0 °C протягом 30 хвилин; вода (15 mL) добавлялася по краплям до суміші; 18 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 та потім додавався етилацетат (1.1 mL). Після того, отримана суміш нагрівалася при 45-55 °C, збовтувалась протягом 1 години, а потім осаджений кристал фільтрувався. Отриманий кристал був рекристалізований із змішаної рідини метанолу (13 mL) та етилацетату (13 mL), та висушений при 60 °C протягом ночі до отримання цільової субстанції у вигляді білого кристалу. Вихід становив 1.31 g (чистота-зменшений вихід: 60 %). Чистота: 99.7 % (HPLC), колонка HPLC: ODS-0TS (4.6ɸ х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.02 М натрію сульфат/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 99.5 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: nгексан/етанол/діетиламін=300/700/1 1 H-NMR (300 MHz, CDCI3); 1.77 (3H, s), 1.8-2.2 (4H, m), 2.9-3.1 (2H, m), 3.2-3.4 (2H, m), 3.9-4.1 (2H, m), 4.02 (1H, d, J=10 Hz), 4.04 (1H, d, J=10 Hz), 4.18 (1H, d, J=10 Hz), 4.4-4.5 (1H, m), 4.50 (1H, d, J=10 Hz), 6.78 (2H, d, J=9 Hz), 6.8-7.0 (4H, m), 7.14 (2H, d, J=9 Hz), 7.56 (1H, s). Приклад 22 (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-и]оксазол (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піпєридин (23.66 g, чистота: 86 %) та 2-бромо-4-нітроімідазол (10.90 g) були розчинені у t-бутил ацетаті (20 mL); ацетат натрію (775 mg) також додавався; суміш перемішувалася при 95-100 °C протягом 3 годин. Метанол (60 mL) додавався до отриманого розчину; а потім цей розчин додавався по краплям до розчину, у якому гідроксид натрію (5.0 g) був розчинений у метанолі (40 mL) при 100 °C. Отримана суміш перемішувався при 0 °C протягом 1 години та 30 хвилин; потім вода (100 mL) добавлялася по краплям до суміші; а потім додавався етилацетат (11 mL). Після того, отримана суміш нагрівалася при 45-55 °C, збовтувалася протягом 1 години, а потім осаджений кристал фільтрувався. Отриманий кристал був рекристалізований із змішаної рідини метанолу (160 mL) та етилацетату (160 mL), та висушений при 60 °C протягом ночі до отримання цільової субстанції у вигляді жовтуватого кристалу. Вихід становив 17.05 g (чистота-зменшений вихід: 67.5 %). Чистота: 99.9 % (HPLC), колонка HPLC: ODS-0TS (4.6 х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.02 M натрію сульфат/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 98.9 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: nгексан/етанол/діетиламін=300/700/1 1 H-NMR (300 MHz, CDCl3); 1.77 (3H, s), 1.8-2.2 (4H, m), 2.9-3.1 (2H, m), 3.2-3.4 (2H, m), 3.9-4.1 (2H, m), 4.02 (1H, d, J=10 Hz), 4.04 (1H, d, J=10 Hz), 4.18 (1H, d, J=10 Hz), 4.4-4.5 (1H, m), 4.50 (1H, d, J=10 Hz), 6.78 (2H, d, J=9 Hz), 6.8-7.0 (4H, m), 7.14 (2H, d, J=9 Hz), 7.56 (1H, s). Приклад 23 (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-b]оксазол (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидин (23.66 g, чистота: 84.5 %) та 2-бромо-4-нітроімідазол (10.9 g) були розчинені у t-бутил ацетаті (20 mL); натрію ацетат (775 mg) також додавався; та суміш перемішувалася при 95-100 °C протягом 3 годин. Метанол (100 mL) додавався до отриманоо розчину; потім 25 % водний розчин гідроксиду натрію (20.00 g) додавався по краплям до розчину при температурі від -10 до 0 °C. Суміш перемішувалася при 0 °C протягом 2 годин; потім вода (84 mL) додавалася по краплям до суміші; а потім додавався етилацетат (11 mL). Після того, суміш нагрівалася при 45-55 °C, збовтувалася протягом 1 години, та потім осаджений кристал фільтрувався. Отриманий кристал був рекристалізований із змішаної рідини метанолу (160 mL) та етилацетату (160 mL), та висушений при 60 °C протягом ночі до отримання цільової субстанції у еигляді жовтуватого кристалу. Вихід становив 16.80 g (чистота-зменшений вихід: 66.5 %). Чистота: 99.8 % (HPLC), колонка HPLC: ODS-0TS (4.6 х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.02 М натрію сульфат/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 99.1 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6ɸ х 250 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: nгексан/етанол/діетиламін=300/700/1 19 UA 99455 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-NMR (300 MHz, CDCl3); 1.77 (3H, s), 1.8-2.2 (4H, m), 2.9-3.1 (2H, m), 3.2-3.4 (2H, m), 3.9-4.1 (2H, m), 4.02 (1H, d, J=10 Hz), 4.04 (1H, d, J=10 Hz), 4.18 (1H, d, J=10 Hz), 4.4-4.5 (1H, m), 4.50 (1H, d, J=10 Hz), 6.78 (2H, d, J=9 Hz), 6.8-7.0(4H, m), 7.14 (2H, d, J=9 Hz), 7.56 (1H, s). Приклад 24 (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-b]оксазол (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1-іл]феноксиметил}-2,3дігідроімідазо[2,1-b]оксазол, отриманий у Прикладах 19-23, мав значно високу чистоту, що може бути підвищена в подальшому, наприклад, за допомогою наступної операції. Суміш of the (R)-2-метил-6-нітро-2-{4-[4-(4-трифторометоксифенокси)піперидин-1іл]феноксиметил}-2,3-дігідроімідазо[2,1-b]оксазол, отриманий у Прикладі 19, (7.0 g), активований водень (0.7 g) та ацетон (70 mL) були збовтані при дефлегмації протягом 30 хвилин, активований водень піддавався гарячій фільтрації, та промитий невеликою кількістю ацетону. Активований водень (0.7 g) додавався до маточної рідини, і така операція знову повторювалась. Маточна рідина. Отримана таким чином, концентрувалася під зниженим тиском поки маточна рідина не висушувалась. Осад був тепло-розчинений у змішаному розчині етанолу (38.5 mL) та ацетону (38.5 mL), потім збовтаний при кімнатній температурі протягом 1 години, а потім охолоджений до 10 °C або менше; осаджений кристал фільтрувався. Кристал був висушений продуванням повітрям протягом ночі до отримання цільової сполуки 5.746 g (82.09 %). Чистота: 99.96 % (HPLC) Колонка HPLC: ODS-0TS (4.6 х 150 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: 0.02 М натрію сульфат/тетрагідрофуран/ацетонітрил=400/300/300, температура вимірювання: 40 °C Оптична чистота: 99.97 %ее (HPLC), колонка HPLC: CHIRALPACK AD-H (4.6 х 250 mm), довжина хвилі детектування: 254 nm, композиція мобільної фази: nгексан/етанол/діетиламін=300/700/1 1 H-NMR (300 MHz, CDCI3); 1.77 (3H, s), 1.8-2.2 (4H, m), 2.9-3.1 (2H, m), 3.2-3.4 (2H, m), 3.9-4.1 (2H, m), 4.02 (1H, d, J=10 Hz), 4.04 (1H, d, J=10 Hz), 4.18 (1H, d, J=10 Hz), 4.4-4.5 (1H, m), 4.50 (1H, d, J=10 Hz), 6.78 (2H, d, J=9 Hz), 6.8-7.0 (4H, m), 7.14 (2H, d, J=9 Hz), 7.56 (1H, s) -1 IR(KBr/cm ); 3133, 1609, 1513, 1340, 1038, 826 Порошок X-ray (2): 5.26°, 7.88°, 10.52°, 15.76°, 21.06° Продукт, подрібнений на струминному млині (середній діаметр часток: 2.2 m) Порошок Х-rау (2): 5.22°, 10.46°, 17.28°, 20.94°, 28.16° Приклад 25 Синтез (R)-1-(4-оксиранилметокси)феніл-4-(4-трифторометоксибензилокси)піперидину 31.26 kg 1-(4-гідроксифеніл)-4-(4-трифторометоксибензилокси)піперидин 4метилбензолсульфонової кислоти, 125 L N, N-диметилацетаміду та 8.03 kg гідроксиду калію були перемішані, та збовтані при кімнатній температурі. Суміш була перемішана з 15.77 kg (R)оксиранилметил 3-нітробензолсульфонату, збовтана при 19-20 °C протягом 2.5 годин, та охолоджена до 10 °C або менше. Суміш була змішана з 0.904 kg дігідрогенфосфат дігідрату натрію та 313 L води, збовтана при 50-60 °C протягом 0.5 годин; потім, кристал фільтрувався, промивався 156 L води, та висушувався при 60 °C протягом 16 годин до отримання 24.06 kg кристалічних цільових субстанцій кольору слонової кістки. Вихід: 98.09 % HPLC чистота: 94.7 % Оптична чистота: 99.5 %ее (R-ізомер) 1 H-NMR (300 MHz, CDCl3)=1.70-1.90 (m, 2H), 1.98-2.12 (m, 2H), 2.70-2.77 (m, 1H), 2.80-2.95 (m, 3H), 3.28-3.35 (m, 1H), 3.35-3.50 (m, 2H), 3.50-3.65 (m, 1H), 3.88-3.94 (m, 1H), 4.12-4.18 (m, 1H), 4.56 (s, 2H), 6.80-6.95 (m, 4H), 7.19 (d, 2H, 8.7 Hz), 7.38 (d, 2H, 8.8 Hz) Приклад 26 Синтез (R)-1-(4-оксиранилметокси)феніл-4-(4-трифторометоксибензилокси)піперидину 69.7 g 1-(4-гідроксифеніл)-4-(4- трифторометоксибензилокси)піперидин 4-метилбензолсульфонової кислоти, 279 mL N, N-диметилацетаміду, 17.9 g гідроксиду калію (порошок) та 31.0 g (R)оксиранилметил 4-метилбензолсульфонату були змішані. Після перемішування при 15-21 °C протягом 21 годин, суміш перемішувалася з 2.01 g дігідрогенфосфат дігідрату натрію та 697 mL of води. Після перемішування при 35-4 5 °C протягом ще 1 години, кристал фільтрувався, промивався 349 mL води, та висушувався при 50 °C протягом 48 годин до отримання 53.65 g кристалічної цільової субстанції кольору слонової кістки. Вихід: 98.1 % 20 UA 99455 C2 5 10 15 20 25 30 35 40 45 50 55 60 HPLC чистота: 97.9 % Оптична чистота: 84.6 %ее (R-ізомер) Приклад 27 Синтез (R)-1-(4-оксигапеуіметокси)феніл-4-(4-трифторометоксибензилокси)піперидину 8.23 g 1-(4-гідроксифеніл)-4-(4-трифторометоксибензилокси)піперидин 4-метилбензолсульфонової кислоти, 49.4 mL N-метилпірролідону, 2.44 g гідроксиду натрію, 24.7 mL води, 8.28 g тетрабутиламоній воденьсульфату та 2.82 g (S)-епіхлоргідрину були перемішані. Після перемішування при 10 °C протягом 48 годин, кристал фільтрувався, промивався 148 mL охолодженої води, розподілявся у 49 mL охолодженої води, та фільтрувався. Кристал промивався 100 mL охолодженої води, та висушувався при 50 °C протягом 18 годин до отримання 5.15 g цільової субстанції. Вихід: 79.8 % HPLC чистота: 93.1 % Оптична чистота: 96.2 %ее (R-ізомер) Приклад 28 Синтез неочищеного продукту (R)-6-нітро-2-((4-(4-(4трифторометокси)бензилокси)піперидин-1-ілфенокси)метил)-2,3-дігідроімідазо[2,1-b]оксазолу 16.37 kg (R)-1-(4-оксиранилметокси)феніл-4-(4-трифторометоксибензилокси)піперидину, 7.42 kg 2-бромо-4-нітро-1Н-імідазолу, 16 L N, N-диметилацетаміду та 630 g ацетату натрію були перемішані, та збовтані при 65-71 °C протягом 8 годин; суміш була змішана з 131 L N, Nдиметилацетаміду. Суміш охолоджувалась до -6 °C, змішувалась з 3.25 kg гідроксиду калію, та збовтувалась при температурі від -7 до -4 °C протягом 6 годин. Суміш перемішувалася з 255 L води та 13 L етил ацетату, та збовтувалась, та потім залишалася стояти протягом ночі. Суміш перемішувалася при 35-38 °C протягом 0.5 годин, та потім охолоджувалася до 24 °C; кристал фільтрувався, та промивався 82 L води до отримання 32.44 kg вологого кристалу. 32.44 kg вологого кристалу, 166 L етил ацетату та 158 L метанолу були змішані, збовтані та розчинені із нагріванням та дефлегмацією. Розчин перемішувався при 40-42 °C протягом 0.5 годин, та потім збовтувався при 10-4 °C протягом 1 години; потім, кристал фільтрувався, промивався сумішшю рідини 8 L етилацетату та 8 L метанолу, та висушувався при 60 °C протягом 7.5 годин до отримання 7,650 g завихреного кристалу цільової субстанції. Вихід: 37.02 % HPLC чистота: 99.9 % Оптична чистота: 99.9 %ее (R-ізомер) 1 H-NMR (300 MHz, CDCl3) =1.73-1.90 (m, 2Н), 1.98-2.12 (m, 2Н), 2.80-2.95 (m, 2Н), 3.30-3.50 (m, 2Н), 3.50-3.65 (m, 1Н), 4.20-4.35 (m, 2Н), 4.30-4.50 (m, 2Н), 4.5 7(s, 2H), 5.50-5.65 (m, 1Н), 6.79 (d, 2H, 9.2 Hz), 6.89 (d, 2H, 9.2 Hz), 7.19 (d, 2Н, 9.4 Hz), 7.38 (d, 2H, 8.7 Hz), 7.57 (s, 1H) Приклад 29 Синтез неочищеного продукту (R)-6-нітро-2-((4-(4-(4трифторометокси)бензилокси)піперидин-1-ілфенокси)метил)-2,3-дігідроімідазо[2,1-b]оксазолу 20.4 g (R)-1-(4-оксиранилметокси)феніл-4-(4-трифторометоксибензилокси)піперидину, 7.13 g 2хлоро-4-нітро-1Н-імідазолу, 20.4 mL диметоксиетану та 3.08 g фосфату калію були перемішані, збовтані при дефлегмації протягом 2.5 годин; потім, суміш була перемішана з 163.2 mL N, Nдиметиласеtоаміду. Суміш охолоджувалась до 0 °C, змішувалась з 11.6 g 25 % водним розчином гідроксиду натрію, та збовтувалась при 0 °C протягом 2.5 годин. Суміш змішувалась з 7.52 g натрію дігідрогенфосфат дігідрату та 367 mL води, та збовтувалась при 35-4 0 °C протягом 1 години; потім, кристал фільтрувався, змішувався з 163 mL метанолу та 41 mL води, та збовтувався при 50 °C протягом 0.5 годин; потім, кристал фільтрувався до отримання вологого кристалу. Вологий кристал, 153 mL етилацетату та 153 mL метанолу перемішувалися, та збовтувалися та розчинялися при нагріванні та дефлегмації. Розчин перемішувався при 50 °C протягом 1 години, та потім збовтувався при 0 °C протягом 1 години; потім кристал фільтрувався, та висушувався при 60 °C протягом ночі до отримання 9.11 g цільової субстанції. Вихід: 35.4 % HPLC чистота: 99.9 % Оптична чистота: 99.9 %ее (R-ізомер) Приклад 30 Очищення (R)-6-нітро-2-((4-(4-(4-трифторометокси)бензилокси)піперидин-1ілфенокси)метил)-2,3-дігідроімідазо[2,1-b]оксазолу 7.64 kg неочищеного продукту (R)-6-нітро-2-((4-(4-(4трифторометокси)бензилокси)піперидин-1-ілфенокси)метил)-2,3-дігідроімідазо[2,1-b]оксазолу та 306 L ацетону були змішані, збовтані при 15 °C протягом 10 хвилин, змішані з 380 g 21 UA 99455 C2 5 10 активованого водню, збовтані при 15 °C протягом 15 хвилин, та потім профільтровані. Фільтрат був змішаний з 380 g активованого водню та 8 L ацетону, та збовтаний при 15 °C протягом 15 хвилин. Відфільтрований фільтрат концентрувався під звичайним тиском для дистиляції 237 L ацетону; потім, 140 L етанолу та 15 L ацетону додавалися до осаду, та осад був розчинений при дефлегмації; потім, розчин перемішувався при 45-55 °C протягом 1 години, збовтаний при 10 °C або менше; потім кристал був відокремлений, та висушений при 60 °C протягом 18 годин до отримання 6.329 kg жовтуватої кристалічної цільової субстанції Вихід: 82.82 % HPLC чистота: 100 % Оптична чистота: 99.97 %ее (R-ізомер) ФОРМУЛА ВИНАХОДУ 1. Епоксидна сполука або її солі, представлена загальною формулою (2): R (CH2)n O 15 1 25 30 40 45 50 2 R 3 (А1) 3 (де R - це: (A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, (A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) як замісником(ами) у фенільній групі, (A1с) фенілзаміщена нижча алкоксинижча алкільна група з галогеном(ами) як замісником(ами) у фенільній групі, (A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, (A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі та нижча алкільна група, або (A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі), або піперазильна група, представлена загальною формулою (А2): N 35 R , (2) 1 де R - це водень або нижча алкільна група; 2 R - піперидильна група, представлена загальною формулою (А1): N 20 O N R 4 (A2) 4 (де R - це: (А2а) фенілзаміщена нижча алкенільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, або (А2b) галогензаміщена фенільна група); та n - ціле число від 1 до 6. 2. Епоксидна сполука або її солі, вибрані з групи, що складається з: 1) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксифенокси)піперидину; 2) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксифенокси)піперидину; 3) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидину; 4) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометилфеноксиметил)піперидину; 5) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2пропеніл]піперазину; 6) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-[3-(4-трифторометоксифеніл)-2-пропеніл]піперазину; 7) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епокси-2-метилпропокси)феніл]піперидину; 8) (R)-4-(4-хлоробензилоксиметил)-1-[4-(2,3-епоксипропокси)феніл]піперидину; 9) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензил)піперидину; 10) (R)-1-[4-(2,3-епоксипропокси)феніл]-4-(4-трифторометоксибензил)піперидину; 22 UA 99455 C2 5 10 11) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[N-метил-N-(4трифторометоксифеніл)]амінопіперидину; 12) (R)-4-[N-метил-N-(4-трифторометоксифеніл)]аміно-1-[4-(2,3епоксипропокси)феніл]піперидину; 13) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епокси-2-метилпропокси)феніл]піперазину; 14) (R)-1-(4-хлорофеніл)-4-[4-(2,3-епоксипропокси)феніл]піперазину; 15) (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-(4-трифторометоксибензилокси)піперидину та 16) (R)-1-(4-(оксиранілметокси)феніл)-4-(4-(трифторометокси)бензилокси)піперидину. 3. Спосіб одержання епоксидної сполуки або її солі, представленої загальною формулою (2): R 1 (CH2)n O O R 2 , (2) 1 2 де R , R та n такі, як зазначено нижче, шляхом реакції сполуки або її солі, представленої загальною формулою (3): R (CH2)n-X2 O 15 1 , (3) 1 де R - водень або нижча алкільна група; n - ціле число від 1 до 6; а 2 Х - галоген або група, що спричиняє реакцію заміщення, подібну до реакції галогену, зі сполукою або її сіллю, представленою загальною формулою (4): HO 20 R , (4) 2 де R - піперидильна група, представлена загальною формулою (А1): N 25 30 35 R 3 (А1) 3 (де R - це: (A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, (A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) як замісником(ами) у фенільній групі, (A1c) фенілзаміщена нижча алкоксинижча алкільна група з галогеном(ами) як замісником(ами) у фенільній групі, (A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, (A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі та нижча алкільна група, або (A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі), або піперазильна група, представлена загальною формулою (А2): N 40 2 N R 4 (A2) 4 (де R - це: (А2а) фенілзаміщена нижча алкенільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, або (А2b) галогензаміщена фенільна група). 4. Спосіб одержання сполуки оксазолу або її солі, представленої загальною формулою (1): 23 UA 99455 C2 N R O2N (CH2)n O N 1 O R 2 , (1) 1 2 де R , R та n такі, як зазначено нижче, реакцією сполуки, представленої загальною формулою (5): H N O2 N N 5 1 X , (5) або її солі, 1 де X - атом галогену, зі сполукою або її сіллю, представленою загальною формулою (2): R 1 (CH2)n O O R 2 , (2) 1 де R - водень або нижча алкільна група; 2 R - піперидильна група, представлена загальною формулою (А1): N 10 15 20 30 3 (А1) 3 (де R - це: (A1a) феноксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, (A1b) феноксизаміщена нижча алкільна група з галогензаміщеною нижчою алкільною групою(ами) як замісником(ами) у фенільній групі, (A1c) фенілзаміщена нижча алкоксинижча алкільна група з галогеном(ами) як замісником(ами) у фенільній групі, (A1d) фенілзаміщена нижча алкільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, (A1e) аміногрупа з фенільною групою з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі та нижча алкільна група, або (A1f) фенілзаміщена нижча алкоксигрупа з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі), або піперазильна група, представлена загальною формулою (А2): N 25 R N R 4 (A2) 4 (де R - це: (А2а) фенілзаміщена нижча алкенільна група з галогензаміщеною нижчою алкоксигрупою(ами) як замісником(ами) у фенільній групі, або (А2b) галогензаміщена фенільна група); а n - ціле число від 1 до 6. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюEpoxy compound, process for the preparation thereof and process for the preparation of oxazole compound
Автори англійськоюTsubouchi, Hidetsugu, Haraguchi, Yoshikazu, Hayakawa, Satoshi, Utsumi, Naoto, Taira, Shinichi, Tanada, Yoshihisa, Fujita, Nobuhisa, Shinhama, Koichi, Annaka, Kimiyoshi, Furuta, Takuya
Назва патенту російськоюЭпоксидное соединение, способ его получения и способ получения соединения оксазола
Автори російськоюЦубоучи Хидецугу, Харагути Йосикадзу, Хаякава Сатоши, Уцуми Наото, Таира Шиничи, Танада Йошихиза, Фудзита Нобухиса, Синхама Коити, Аннака Кимийоши, Фурута Такуйя
МПК / Мітки
МПК: C07D 407/12, C07D 498/04
Мітки: спосіб, епоксидна, оксазолу, одержання, сполуки, сполука
Код посилання
<a href="https://ua.patents.su/26-99455-epoksidna-spoluka-sposib-oderzhannya-ta-sposib-oderzhannya-spoluki-oksazolu.html" target="_blank" rel="follow" title="База патентів України">Епоксидна сполука, спосіб її одержання та спосіб одержання сполуки оксазолу</a>
Попередній патент: Спосіб лікування з використанням глікопегильованого g-csf (варіанти)
Наступний патент: Спосіб виготовлення тканини і одержувана при цьому тканина
Випадковий патент: Пристрій для приготування теплоносія ситеми опалення