Трансгенна рослина, яка продукує білок сry34ab1, білок сry35ab1 і інсектицидний білок сry3ba1, для запобігання розвитку стійкості в кукурудзяних кореневих жуків (diabrotica spp.)
Номер патенту: 112516
Опубліковано: 26.09.2016
Автори: Вуслі Ерон Т., Гей Тимоті Д., Фенсил Кристин Дж., Мід Томас, Олсон Моніка Брит, Лі Хуажун, Нарва Кенет Е.
Формула / Реферат
1. Трансгенна рослина, яка продукує білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1, причому білок Cry35Ab1 і інсектицидний білок Cry3Ba1 зв'язуються з різними рецепторними сайтами зв'язування в кишечнику кукурудзяного кореневого жука.
2. Трансгенна рослина за п. 1, причому вказана рослина додатково продукує четвертий інсектицидний білок, вибраний із групи, яка складається з Cry3Aa і Cry6Aa.
3. Насінина трансгенної рослини за п. 1 або 2, де вказана насінина містить ДНК, яка кодує білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1.
4. Множина рослин, яка містить множину трансгенних рослин за п. 1 або 2.
5. Множина рослин за п. 4, де вказана множина рослин додатково містить резервні рослини, які не містять Bt-білки, де вказані резервні рослини складають менше ніж 40 % усіх культур у вказаній множині рослин.
6. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 30 % усіх культур у вказаній множині рослин.
7. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 20 % усіх культур у вказаній множині рослин.
8. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 10 % усіх культур у вказаній множині рослин.
9. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 5% усіх культур у вказаній множині рослин.
10. Множина рослин за п. 4, де у вказаній множині рослин відсутні резервні рослини.
11. Множина рослин за п. 5, де вказані резервні рослини розташовані блоками або смугами.
12. Суміш насіння, яка відтворює трансгенні рослини, що мають стійкість до кукурудзяного кореневого жука, яка містить резервне насіння від резервних рослин, які не містять Bt-білки, і множину насіння за п. 3, де вказане резервне насіння складає менше ніж 40 % усього насіння у суміші.
13. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 30 % усього насіння у суміші.
14. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 20 % усього насіння у суміші.
15. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 10 % усього насіння у суміші.
16. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 5 % усього насіння у суміші.
17. Множина насіння за п. 3, яка міститься у мішку або контейнері, причому вказаний мішок або контейнер не містить резервного насіння.
18. Спосіб боротьби з розвитком стійкості до Cry-білка в комахи, згідно з яким висівають насіння за будь-яким з пп. 3 або 12-16 для одержання множини рослин за будь-яким з пп. 4-11, і контактують вказану комаху із вказаною множиною рослин.
19. Множина рослин за будь-яким з пп. 4-11, де вказані рослини займають більше ніж 10 акрів (40,5 га).
20. Трансгенна рослина за п. 1 або 2, де вказана рослина являє собою рослину маїсу.
21. Рослинна клітина трансгенної рослини за п. 1, де вказаний білок Cry35Ab1 щонайменше на 95 % ідентичний послідовності, вибраній з групи, яка складається з SEQ ID NO:1 і SEQ ID NO:2, вказаний інсектицидний білок Cry3Ba1 щонайменше на 95 % ідентичний послідовності, вибраній з групи, яка складається з SEQ ID NO:3 і SEQ ID NO:4, і вказаний білок Cry34Ab1 щонайменше на 95 % ідентичний SEQ ID NO:5.
22. Трансгенна рослина за п. 1, де вказаний білок Cry35Ab1 містить послідовність, вибрану з групи, яка складається з SEQ ID NO:1 і SEQ ID NO:2, вказаний інсектицидний білок Cry3Ba1 містить послідовність, вибрану з групи, яка складається з SEQ ID NO:3 і SEQ ID NO:4, і вказаний білок Cry34Ab1 містить SEQ ID NO:5.
23. Спосіб одержання рослинної клітини за п. 21, за яким клітину трансформують ДНК, що кодує білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1.
24. Спосіб боротьби з кукурудзяним кореневим жуком, за яким приводять у контакт вказану комаху з білком Cry34Ab1, білком Cry35Ab1 і інсектицидним білком Cry3Ba1, причому білок Cry35Ab1 і інсектицидний білок Cry3Ba1 зв'язуються з різними рецепторними сайтами зв'язування в кишечнику кукурудзяного кореневого жука.
Текст
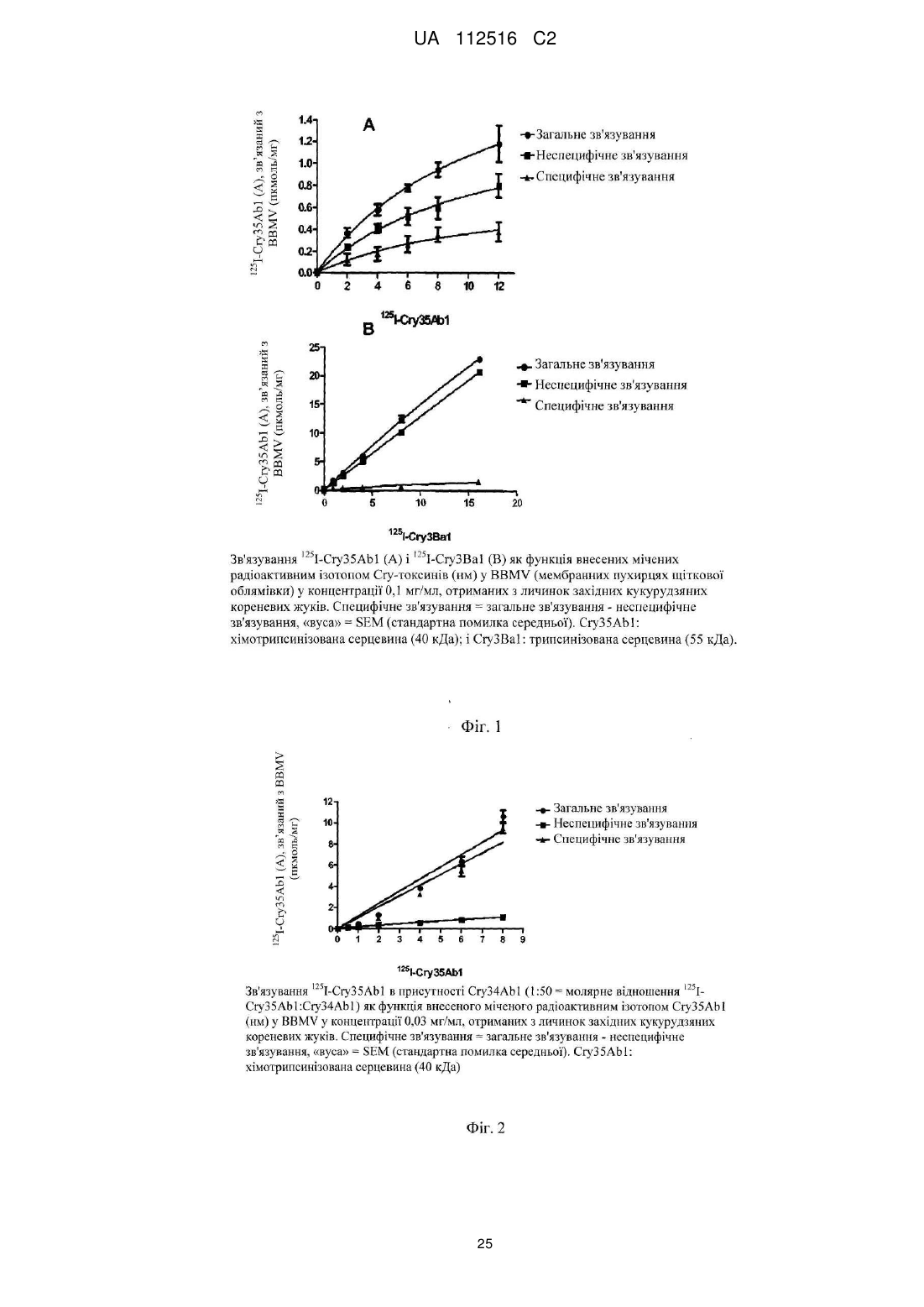
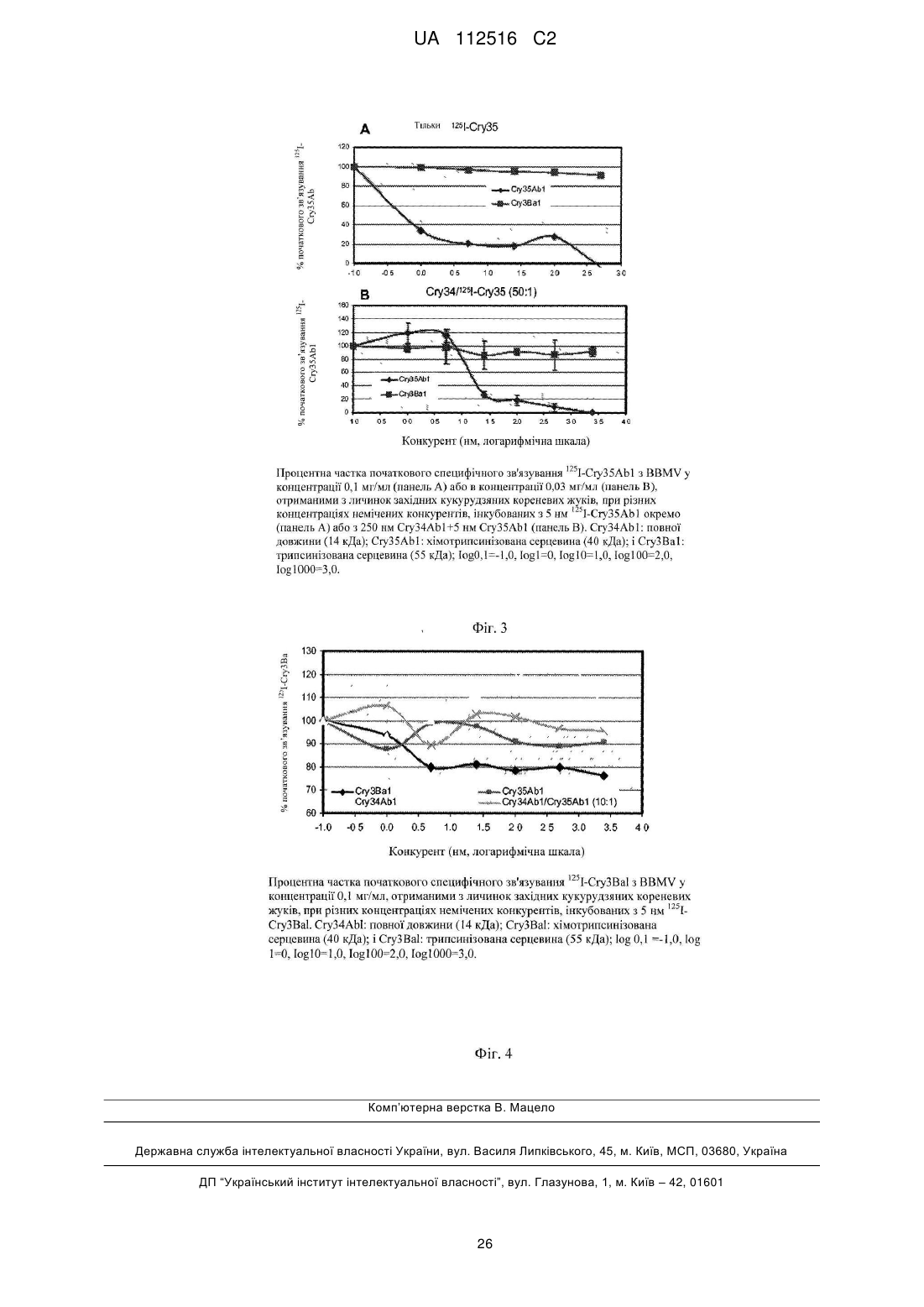
Реферат: UA 112516 C2 (12) UA 112516 C2 Даний винахід стосується трансгенних рослин, які продукують білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1. Білок Cry35Ab1 і інсектицидний білок Cry3Ba1 зв'язуються з різними рецепторними сайтами зв'язування в кишечнику кукурудзяного кореневого жука (Diabrotica spp.). Дану властивість використано для запобігання розвитку популяції кукурудзяного кореневого жука, яка може бути стійкою до будь-якого з цих інсектицидних білків окремо. Таким чином, рослини (і посівна площа, засіяна такими рослинами), які продукують білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1, включені в обсяг даного винаходу. UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 Опис Передумови створення винаходу Люди вирощують кукурудзу для застосування в їжу і як джерело енергії. Кукурудза являє собою важливу сільськогосподарську культуру. Вона є важливим джерелом їжі, харчових продуктів і корму для тварин у багатьох регіонах світу. Комахи вживають у їжу й ушкоджують рослини і, таким чином, підривають ці зусилля людей. Щорічно мільярди доларів витрачаються для боротьби з комахами-шкідниками, і ще мільярди втрачаються внаслідок заподіюваного ними збитку. Шкода, нанесена комахами-шкідниками, є основним чинником втрати врожаїв кукурудзи в усьому світі, незважаючи на використання захисних мір, таких як хімічні пестициди. У зв'язку з цим, у сільськогосподарські культури, такі як кукурудза, методами генної інженерії були введені гени стійкості до комах для боротьби зі збитком, нанесеним комахами, і для зниження потреби в традиційних хімічних пестицидах. Щорічно, більше 10 мільйонів акрів (більше 4050000 га) кукурудзяних полів у США заражаються комплексом видів кукурудзяного кореневого жука. Комплекс видів кукурудзяного кореневого жука включає північного кукурудзяного кореневого жука (Diabrotica barberi), південного кукурудзяного кореневого жука (D. undecimpunctata howardi) і західного кукурудзяного кореневого жука (D. virgifera virgifera). (Інші види включають Diabrotica virgifera zeae (Мексиканський кукурудзяний кореневий жук), Diabrotica balteata (Бразильський кукурудзяний кореневий жук), і комплекс Бразильського кукурудзяного кореневого жука (Diabrotica viridula і Diabrotica speciosa). Личинки цих видів Diabrotica, які живуть у ґрунті, харчуються корінням рослин кукурудзи, викликаючи полягання. Полягання, у кінцевому рахунку, знижує врожайність і часто приводить до загибелі рослини. Споживаючи в їжу маточкові колонки кукурудзи, дорослі жуки зменшують запилення і, тому, згубно впливають на зерно кукурудзяної рослини. Крім того, дорослі особини і личинки роду Diabrotica атакують гарбузові культури (огірки, дині, гарбузи і т.д.) і багато овочевих і польових культур у промисловому рослинництві, а також такі, які вирощуються на присадибних ділянках. Синтетичні органічні хімічні інсектициди були першочерговими інструментами, використовуваними для боротьби з комахами-шкідниками, але біологічні інсектициди, такі як інсектицидні білки, отримані з Bacillus thuringiensis (Bt), відігравали важливу роль у деяких регіонах. Здатність одержання стійких до комах рослин за допомогою трансформації генами інсектицидного білка Bt радикально змінила сучасне сільське господарство і підвищила значення і цінність інсектицидних білків і їхніх генів. Інсектицидні кристалічні білки з деяких штамів Bacillus thuringiensis (B.t.) добре відомі в даній галузі техніки. Див., наприклад, Hofte et al, Microbial Reviews, Vol. 53, No. 2, pp. 242-255 (1989). Ці білки звичайно продукуються бактеріями у вигляді протоксинів з молекулярною масою приблизно 130 кДа, які потім розщеплюються протеазами в середній кишці комах після потрапляння в травну систему комахи для продукції корового токсину з молекулярною масою приблизно 60 кДа. Ці білки відомі як кристалічні білки, тому що в деяких штамах B.t. можуть спостерігатися виразні кристалічні включення із суперечками. Ці кристалічні включення часто складені з декількох різних білків. Однією групою генів, які використовувалися для одержання трансгенних, стійких до комах культур, є дельта-ендотоксини з Bacillus thuringiensis (B.t.). Дельта-ендотоксини були успішно експресовані в таких сільськогосподарських культурах як бавовна, картопля, рис, соняшник, а також кукурудза, і, як виявилося, забезпечують чудовий контроль над комахами-шкідниками. (Perlak, F.J et al. (1990) Bio/Technology 8, 939-943; Perlak, F.J. et al. (1993) Plant Mol. Biol. 22: 313321; Fujimoto H. et al. (1993) Bio/Technology 11: 1151-1155; Tu et al. (2000) Nature Biotechnology 18: 1101-1104; PCT публікація міжнародної патентної заявки WO 01/13731; і Bing J W et al. th (2000) Efficacy of Cry IF Transgenic Maize, 14 Biennial International Plant Resistance to Insects Workshop, Fort Collins, Colo.). Декілька білків Bt використовувалися для створення стійких до комах трансгенних рослин, які були успішно зареєстровані і в даний час запущені в серійне виробництво. Вони включають Cry1Ab, Cry1Ac, Cry1F, Cry3Aa і Cry3Bb у кукурудзі, Cry1Ac і Cry2Ab у бавовні і Cry3A у картоплі. Є також SMART STAX у кукурудзі, який містить Cry1A.105 і Cry2Ab. Продукти, які випускаються в промисловому масштабі, експресуючі ці білки, експресують один білок, за винятком випадків, де бажаний комбінований інсектицидний спектр із 2 білків (наприклад, Cry1Ab і Cry3Bb у кукурудзі, комбіновані для забезпечення стійкості до лускокрилих шкідників і блішки довговусої? відповідно), або де незалежна дія білків робить їх корисними як інструмент для затримки розвитку стійкості в популяцій сприйнятливих комах (наприклад, 1 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 Cry1Ac і Cry2Ab у бавовні, комбіновані для забезпечення керування стійкістю у відношенні тютюнової совки). Деякі з якостей стійких до комах трансгенних рослин, які привели до швидкого і широко розповсюдженому прийняттю цієї технології, також викликають заклопотаність, що в популяцій шкідників розвинеться стійкість до інсектицидних білків, продукованих цими рослинами. Було запропоновано декілька стратегій для збереження корисності ознак стійкості до комах на основі Bt, які включають розміщення білків у високій дозі в комбінації з резерватом, чергування з різними токсинами або спільне розміщення з ними (McGaughey et al. (1998), "B.t. Resistance Management, " Nature Biotechnol. 16: 144-146). Білки, вибрані для використання в пакеті Керування стійкості до комах (IRM) повинні бути активними для того, щоб стійкість, яка розвилася до одного білка, не додавала стійкість до другого білка (тобто перехресна стійкість до білків відсутня). Якщо, наприклад, популяція шкідників, вибрана для стійкості до "білка A", чуттєва до "білка B", то можна зробити висновок, що немає перехресної стійкості, і що комбінація білка A і білка B буде ефективною в затримці стійкості до одного білка A. Під час відсутності стійких до комах популяцій, оцінки можуть здійснюватися на підставі інших характеристик, які вважаються зв'язаними з потенціалом перехресної стійкості. При ідентифікації інсектицидних білків з імовірністю відсутності прояву перехресної стійкості було запропоноване використання рецепторно опосередкованого зв'язування (van Mellaert et al. 1999). Ключовим прогностичним показником відсутності перехресної стійкості, властивому цьому підходу, є те, що інсектицидні білки не конкурують за рецептори в чуттєвого виду комах. У випадку, коли токсини Bt конкурують за той самий рецептор, то якщо цей рецептор мутує у цій комасі, так що один з токсинів більше не зв'язується з цим рецептором і, таким чином, більше не є інсектицидним проти комахи, то в цьому випадку, комаха буде також стійкою до другого токсину (який конкурентно зв'язаний з тим же рецептором). Тобто, комаха вважається перехресно стійкою до обох токсинів Bt. Однак якщо два токсини зв'язуються з двома різними рецепторами, то це може бути показником того, що комаха не буде одночасно стійкою до цих двох токсинів. Відносно більш нова система інсектицидного білка була виявлена в Bacillus thuringiensis, як описано в міжнародному патенті WO 97/40162. Ця система містить два білки - один масою приблизно 15 кДа, і інший масою приблизно 45 кДа. Див. також патенти США 6083499 і 6127180. Тепер ці білки були віднесені до їх власного класу і, відповідно, одержали позначення Cry відповідно Cry34 і Cry35. Див. Crickmore et al. сайт інтернету (biols.susx.ac.uk/home/Neil_Crickmore/Bt/). В даний час виявлені багато інших споріднених білків цього типу системи. Див., наприклад, патент США 6372480; міжнародні патенти WO 01/14417 і WO 00/66742. Були також описані оптимізовані для рослин гени, які кодують такі білки, де гени створені методами генної інженерії для використання кодонів для оптимізованої експресії в рослин. Див. наприклад патент США 6218188. Точний тип дії системи Cry34/35 ще має бути визначеним, але вважають, що вона утворює пори в мембранах клітин кишечнику комах. Див. Moellenbeck et al, Nature Biotechnology, vol. 19, p. 668 (July 2001); Masson et al., Biochemistry, 43 (12349-12357) (2004). Точний механізм дії залишається незрозумілим, незважаючи на тривимірні атомарні координати і структури кристалів, відомі для білка Cry34 і Cry35. Див. патенти США 7524810 і 7309785. Наприклад, незрозуміло, один або обидва з цих білків зв'язуються з конкретним видом рецептора, такого як лужна фосфатаза або аміопептидаза. Крім того, через те, що існують різні механізми, за допомогою яких у комахи може розвинутися стійкість до білка Cry (такі як зміненим глікозилуванням рецептора [див. JuratFuentes et al. (2002) 68 AEM 5711-5717], видаленням рецепторного білка [див. Lee et al. (1995) 61 AEM 3836-3842], мутацією рецептора або іншими механізмами [див. Heckel et al., J. Inv. Pathol. 95 (2007) 192-197]), було неможливо свідомо прогнозувати, чи буде існувати перехресна стійкість між Cry34/35 і іншими білками Cry. Прогнозування конкурентного зв'язування для системи Cry34/35 також додатково ускладнюється тим, що два білки втягнені в бінарну систему Cry34/35. Крім того, незрозуміло, чи зв'язуються і наскільки ефективно зв'язуються ці білки з кишечником/клітинами кишечнику, і чи взаємодіють вони і як взаємодіють або зв'язуються один з одним. Інші варіанти для боротьби з твердокрилими комахами включають наступні білки: Cry3Bb, Cry3C, Cry6B, ET29, ET33 з ET34, TIC407, TIC435, TIC417, TIC901, TIC1201, ET29 з TIC810, ET70, ET76 з ET80, TIC851 і інші. Були також запропоновані підходи РНКі (інтерференції РНК). Див. наприклад, Baum et al., Nature Biotechnology, vol. 25, no. 11 (Nov. 2007) pp. 1322-1326. Короткий опис суті винаходу 2 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується частково Cry34Ab/35Ab у комбінації з Cry3Ba. Даний винахід стосується частково дивного відкриття, що Cry34Ab/Cry35Ab і Cry3Ba можуть використовуватися для запобігання розвитку стійкості (до будь-якої системи інсектицидного білка окремо) у популяції кукурудзяного кореневого жука (Diabrotica spp.). Як буде зрозуміло фахівцю в даній галузі після ознайомлення зі сприятливими аспектами розкритого в даному описі винаходу, рослини, продукуючі ці інсектицидні Cry-білки, можуть використовуватися для зменшення побоювань того, що може розвитися популяція кукурудзяного кореневого жука, який може бути стійким до кожної з цих систем інсектицидного білка окремо. Даний винахід частково підтверджується виявленням того, що компоненти цих систем білка Cry не конкурують один з одним за зв'язування з рецепторами кишечнику кукурудзяного кореневого жука. Даний винахід також частково стосується потрійних пакетів або "пірамід" із трьох (або більше) систем токсинів, причому парою основ є Cry34Ab/Cry35Ab і Cry3Ba. Таким чином, рослини (і посівна площа, засаджена такими рослинами), які продукують ці дві системи інсектицидних білків, включені в обсяг даного винаходу. Короткий опис фігур Докладний опис фігур зокрема стосується супровідних фігур, на яких: 125 Фіг. 1A. Зв'язування I-Cry35Ab1 як функція внесених мічених радіоактивним ізотопом Cryтоксинів у BBMV (мембранних пухирцях щіткової облямівки), отриманих з личинок західних кукурудзяних кореневих жуків. Специфічне зв'язування=загальне зв'язування-неспецифічне зв'язування, "вуса»=SEM (стандартна помилка середньої). 125 Фіг. 1B. Зв'язування I-Cry35Ba1 як функція внесених мічених радіоактивним ізотопом Cryтоксинів у BBMV, отриманих з личинок західних кукурудзяних кореневих жуків. Специфічне зв'язування=загальне зв'язування-неспецифічне зв'язування, "вуса»=SEM (стандартна помилка середньої). 125 Фіг. 2. Зв'язування I-Cry35Ab1 з BBMV, отриманими з личинок західних кукурудзяних кореневих жуків, при різних концентраціях неміченого конкурента (log 0,1=-1,0, log 10=1,0, log100=2,0, log1000=3,0). 125 Фіг. 3A. Зв'язування у відсотках I-Cry35Ab1 з BBMV, отриманими з личинок західних кукурудзяних кореневих жуків, під час відсутності Cry34Ab1. 125 Фіг. 3B. Зв'язування у відсотках I-Cry35Ab1 з BBMV, отриманими з личинок західних кукурудзяних кореневих жуків, у присутності Cry34Ab1. 125 Фіг. 4. Зв'язування у відсотках I-Cry3Ba1 з BBMV, отриманими з личинок західних кукурудзяних кореневих жуків, у присутності різних концентрацій немічених конкурентів, які варіюються. Короткий опис послідовностей SEQ ID NO:1: Повна послідовність нативного білка Cry35Ab1. SEQ ID NO:2: Зрізана хімотрипсином послідовність корового білка Cry35Ab1. SEQ ID NO:3: Повна послідовність нативного білка Cry3Ba1. SEQ ID NO:4: Послідовність корового білка Cry3Ba1 трипсину. SEQ ID NO:5: Повна послідовність нативного білка Cry34Ab1. Докладний опис Послідовності білка Cry34Ab/35Ab можуть бути отримані, наприклад, з ізоляту Bacillus thuringiensis PS149B1. Інші гени, білкові послідовності і ізоляти-джерела для використання стосовно даного винаходу описані, наприклад, Crickmore et al. на сайті інтернету (lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/intro.html). Даний винахід включає використання інсектицидних білків Cry34Ab/35Ab у комбінації з токсином Cry3Ba для захисту кукурудзи від ушкодження і втрати врожайності, викликаних поїданням кукурудзяним кореневим жуком, популяціями кукурудзяних листоїдів, у яких може розвитися стійкість до кожної з цих систем білків Cry окремо (без іншого). Таким чином, у даному винаході мова йде про пакети Керування стійкості комах (IRM) для запобігання розвитку в кукурудзяного кореневого жука стійкості до Cry3Ba і/або Cry34Ab/35Ab. Даний винахід стосується композицій для боротьби зі шкідниками-кореневими жуками, яка містить клітини, які продукують білок токсину Cry3Ba і систему токсину Cry34Ab/35Ab. Винахід додатково включає хазяїна, трансформованого для продукції і білка Cry3Ba, і бінарного токсину Cry34Ab/35Ab, де вказаний хазяїн являє собою мікроорганізм або рослинну клітину. Додатково передбачається, що винахід стосується способу боротьби зі шкідникамикореневими жуками, який включає приведення в контакт вказаних шкідників або середовища 3 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 проживання вказаних шкідників з ефективною кількістю композиції, яка містить білок Cry3Ba, і додатково містить бінарний токсин Cry34Ab/35Ab. Варіант здійснення винаходу включає маїс, який містить експресований рослиною ген, який кодує бінарний токсин Cry34Ab/35Ab, і експресований рослиною ген, який кодує білок Cry3Ba, і насіння такої рослини. Додатковий варіант здійснення винаходу включає маїс, де експресований рослиною ген, який кодує бінарний токсин Cry34Ab/35Ab, і експресований рослиною ген, який кодує білок Cry3Ba, були інтрогресовані в вказаний маїс, і насіння такої рослини. Як описано в розділі "Приклади", дослідження конкурентного зв'язування з рецепторами з використанням міченого радіоактивним ізотопом корового токсинного білка Cry35Ab показують, що коровий токсинний білок Cry3Ba не конкурує за зв'язування в зразках тканини комах CRW (кукурудзяних кореневих жуків), з якими зв'язується Cry35Ab. Див. Фіг. 2. Ці результати вказують на те, що комбінація білків Cry3Ba і Cry34Ab/35Ab являє собою ефективний засіб для зменшення розвитку стійкості в популяцій CRW до будь-якої білкової системи окремо. Таким чином, частково на підставі даних, описаних вище, і в інших місцях даного опису, білки Cry34Ab/35Ab і Cry3Ba можуть використовуватися для одержання комбінацій IRM для запобігання і зменшення розвитку стійкості в CRW. Інші білки можуть додаватися до цієї комбінації, наприклад, для розширення спектра боротьби з комахами. Розглянута комбінація (білків Cry34Ab/35Ab і Cry3Ba) може також використовуватися в деяких переважних "потрійних пакетах" або "пірамідах" у комбінації з ще одним білком для боротьби з кореневими жуками, таким як Cry3Aa і/або Cry6Aa; отже, такі додаткові комбінації будуть забезпечувати множинні типи дії проти кореневого жука. РНКі проти кореневих жуків являє собою ще один варіант. Див., наприклад, Baum et al., Nature Biotechnology, vol. 25, no. 11 (Nov. 2007) pp. 1322-1326. У світлі опису заявки USSN 61/327240 (поданої 23 квітня 2010 р.), яка стосується комбінацій білків Cry34Ab/35Ab і Cry3Aa, USSN 61/388273 (поданої 30 вересня 2010 р.), яка стосується комбінацій білків Cry34Ab/35Ab і Cry6Aa, і USSN 61/477447 (поданої 20 вересня 2011 р.), яка стосується комбінацій білків Cry3Aa і Cry6Aa, деякі переважні "потрійні пакети" або "множинні типи пакетів дії" даного винаходу включають білок Cry3Ba у комбінації з білками Cry34Ab/35Ab, разом з білком Cry6Aa і/або білком Cry3Ba. Трансгені рослини, включаючи кукурудзу, які містять ген cry3Ba, гени cry34Ab/35Ab і третю або четверту систему токсинів (наприклад, ген(и) cry3Aa і/або cry6Aa), включені в обсяг даного винаходу. Таким чином, такі варіанти здійснення націлені на комаху щонайменше трьома типами дії. Варіанти розміщення за даним винаходом включають використання білків Cry3Ba і Cry34Ab/35Ab у місцях вирощування кукурудзи, де Diabrotica spp. є проблематичними. Іншим варіантом розміщення може бути використання одного або обох білків Cry3Ba і Cry34Ab/35Ab у комбінації з іншими ознаками. Фахівцю в даній галузі буде зрозуміло, що токсини Bt, навіть у межах визначеного класу, такі як Cry3Ba і Cry34Ab/35Ab, можуть до деякої міри варіюватися. Гени і токсини. Термін "ізольований" стосується полінуклеотиду який не зустрічається в природних умовах конструкту або до білка в очищеному або іншим способом не зустрічається в природних умовах стану. Гени і токсини, використовувані стосовно даного винаходу, включають не тільки повні описані послідовності, але також фрагменти цих послідовностей, варіанти, мутанти і злиті білки, які зберігають характерну пестицидну активність токсинів, конкретно проілюстрованих у даному описі. Використовувані в даному описі терміни "варіанти" або "зміни" генів стосуються нуклеотидних послідовностей, які кодують ті ж токсини, або які кодують еквівалентні токсини, які володіють пестицидною активністю. Використовуваний у даному описі термін "еквівалентні токсини" стосується токсинів, які мають таку ж або власне кажучи володіють такою ж біологічною активністю проти шкідників-мішеней як заявлені токсини. Це стосується Cry3 і Cry34/35, а також Cry6 (при використанні в потрійних/множинних пакетах) стосовно даного винаходу. Домени/субдомени цих білків можуть бути замінені для одержання химерних білків. Див. наприклад, патенти США 7309785 і 7524810 у відношенні білків Cry34/35. У патенті '785 мова також йде про зрізані білки Cry35. Зрізані токсини також проілюстровані в даному описі. Використовуваний у даному описі термін "кордони" представляє ідентичність послідовностей приблизно 95 % (Cry3Ba і Cry34Ab і Cry35Ab), 78 % (Cry3B і Cry 34A і Cry35A) і 45 % (Cry6 і Cry34 і Cry35) стосовно "Revision of Nomenclature for Bacillus thuringiensis Pesticidal Crystal Proteins" N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, і D.H. Dean. Microbiology і Molecular Biology Reviews (1998) Vol 62: 807-813. Те ж стосується Cry3A і/або Cry6 при використанні в потрійних пакетах/множинних пакетах, наприклад, стосовно даного винаходу. 4 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 Для фахівця в даній галузі буде очевидно, що гени, які кодують активні токсини, можуть бути ідентифіковані й отримані декількома способами. Визначені гени або частини генів, проілюстровані в даному описі, можуть бути отримані з ізолятів, депонованих у депозитарії культур. Ці гени або їхні частини або варіанти, також можуть бути конструйовані синтетично, наприклад, шляхом використання генного синтезатора. Варіанти генів можуть бути легко сконструйовані з використанням стандартних технологій одержання крапкових мутацій. Також, фрагменти цих генів можуть бути отримані з використанням комерційно доступних екзонуклеаз або ендонуклеаз, відповідно до стандартних методик. Наприклад, ферменти, такі як Bal31, або сайт-направлений мутагенез можуть використовуватися для систематичного відсічення нуклеотидів від кінців цих генів. Гени, які кодують активні фрагменти, можуть також бути отримані з використанням різноманітних рестрикційних ферментів. Протеази можуть використовуватися для безпосереднього одержання активних фрагментів білкових токсинів. Фрагменти й еквіваленти, які зберігають пестицидну активність ілюстративних токсинів, будуть входити в обсяг даного винаходу. Також, через надмірність генетичного коду, розмаїтість різних послідовностей ДНК може кодувати амінокислотні послідовності, розкриті в даному описі. Фахівець у даній галузі повністю може створити ці альтернативні послідовності ДНК, які кодують однакові або власне кажучи однакові токсини. Ці варіантні послідовності ДНК входять в обсяг даного винаходу. Використовуване в даному описі посилання на "власне кажучи однакову" послідовність стосується послідовностей, які мають амінокислотні заміщення, делеції, або додавання вставки, які істотно не впливають на пестицидну активність. Фрагменти генів, які кодують білки, які зберігають пестицидну активність, також включені в це визначення. Фрагменти генів, які кодують білки, які зберігають пестицидну активність, також включені в даний винахід. Додатковий спосіб ідентифікації генів, які кодують токсини, і частин генів, використовуваних стосовно даного винаходу, здійснюють шляхом використання олігонуклеотидних зондів. Ці зонди являють собою детектовані нуклеотидні послідовності. Ці послідовності можуть бути детектовані за допомогою відповідної мітки або можуть бути отримані ендогенно флуоресцентними, як описано в міжнародній патентній заявці № WO 93/16094. Як добре відомо в даній галузі, молекула зонда і зразок нуклеїнової кислоти гібридизуються з утворенням міцного зв'язку між двома молекулами, то можна резонно припустити, що зонд і зразок мають істотну гомологію. Переважно, гібридизацію проводять у жорстких умовах методиками, добре відомими в даній галузі, як описано, наприклад, у публікації Keller, G.H., M.M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Деякі приклади сольових концентрацій і температурних комбінацій наступні (у порядку збільшення твердості умов): 2X SSPE або SSC при кімнатній температурі; 1X SSPE або SSC при 42C; 0,1X SSPE або SSC при 42C; 0,1X SSPE або SSC при 65C. Виявлення зонда забезпечує засіб для визначення відомим чином, чи відбулася гібридизація. Такий зондовий аналіз забезпечує швидкий спосіб ідентифікації генів даного винаходу, які кодують токсин. Нуклеотидні сегменти, які використовуються як зонди стосовно винаходу, можуть бути синтезовані з використанням синтезатора ДНК і стандартних методик. Ці нуклеотидні послідовності можуть також використовуватися як затравки ПЛР для ампліфікації генів за даним винаходом. Варіантні токсини. У даному описі були спеціально проілюстровані визначені токсини за даним винаходом. Оскільки ці токсини просто ілюструють токсини за даним винаходом, то повинно бути повністю очевидно, що даний винахід включає варіантні або еквівалентні токсини (і нуклеотидні послідовності, які кодують еквівалентні токсини), які володіють такою ж або подібною пестицидною активністю як ілюстрований токсин. Еквівалентні токсини мають гомологію амінокислот з ілюстрованим токсином. Ця амінокислотна ідентичність звичайно складає більше ніж 75 %, або, переважно, більше ніж 85 %, переважно, більше ніж 90 %, переважно, більше ніж 95 %, переважно, більше ніж 96 %, переважно, більше ніж 97 %, переважно, більше ніж 98 %, або в деяких варіантах здійснення, переважно, більше ніж 99 %. Амінокислотна ідентичність звичайно найвища в критичних ділянках токсину, які відповідають за біологічну активність або беруть участь у визначенні тривимірної конфігурації, яка, у кінцевому рахунку, відповідальна за біологічну активність. У цьому відношенні, прийнятні і можуть очікуватися деякі амінокислотні заміщення, якщо ці заміщення відбуваються в ділянках, які не мають вирішального значення для активності або являють собою консервативні амінокислотні заміщення, які не впливають на тривимірну конфігурацію молекули. Наприклад, амінокислоти можуть бути розміщені в наступні класи: неполярні, незаряджені полярні, основні і кислотні. Консервативні заміщення, за допомогою яких амінокислота одного класу заміщається іншою амінокислотою того ж типу, входять в обсяг даного винаходу, поки заміщення істотно не змінює 5 UA 112516 C2 біологічну активність сполуки. У таблиці 1 представлений список прикладів амінокислот, які стосуються кожного класу. Таблиця 1 Класи амінокислот із прикладами амінокислот, які стосуються кожного класу Клас амінокислот Неполярні Незаряджені полярні Кислотні Основні 5 10 15 20 25 30 35 40 45 50 Приклади амінокислот Ala, Val, Leu, Ile, Pro Met, Phe, Trp Gly, Ser, Thr, Cys, Tyr, Asn, Gln Asp, Glu Lys, Arg, His У деяких випадках можуть також здійснюватися неконсервативні заміщення. Вирішальним фактором є те, що ці заміщення не повинні значно знижувати біологічну активність токсину. Рекомбінантні хазяї. Гени, які кодують токсини даного винаходу, можуть бути введені в широку розмаїтість мікробних або рослинних хазяїнів. Експресія гена токсину приводить, або прямо побічно, до внутрішньоклітинної продукції і підтримки пестициду. Кон'югальне перенесення і рекомбінантне перенесення можна використовувати для створення штаму Bt, який експресують обидва токсини даного винаходу. Інші організми хазяїнів можуть також трансформуватися одним або більше генами токсину, використовуваним потім для надання синергічного ефекту. З придатними мікробними хазяїнами, наприклад, Pseudomonas, мікроби можуть наноситися на місцезнаходження шкідника, де вони проліферують і вживаються в їжу. Результатом є контроль над шкідником. Альтернативно, мікроб, який несе ген токсину, може бути підданим обробці в умовах, які продовжують активність токсину і стабілізують клітину. Оброблена клітина, яка зберігає токсичну активність, потім може вноситися в середовище проживання шкідника-мішені. У предмет даного винаходу включені нерегенеровані/нетотипотентні рослинні клітини з рослини за даним винаходом (утримуючі, щонайменше, один з розглянутих генів IRM). Трансформація рослини. Переважним варіантом здійснення даного винаходу є трансформація рослин генами, які кодують розглянутий інсектицидний білок або його варіанти. Трансформовані рослини стійкі до атаки цільовою комахою-шкідником за рахунок присутності контролюючих кількостей розглянутого інсектицидного білка або його варіантів у клітинах трансформованої рослини. При включенні генетичного матеріалу, який кодує інсектицидні властивості інсектицидних токсинів B.t., у геном рослини, вживаного в їжу визначеним комахоюшкідником, дорослі особини або личинки загинуть після вживання в їжу рослини. Були трансформовані численні члени односім'ядольних і двочасткових класифікацій. Трансгенні агрономічні культури, а також фрукти й овочі становлять промисловий інтерес. Такі культури включають, але без обмеження, маїс, рис, сою, канолу, соняшник, люцерну, сорго, пшеницю, бавовну, арахіс, томати, картоплю тощо. Існує декілька технологій введення стороннього генетичного матеріалу в клітини рослин і для одержання рослин, які стабільно підтримують і експресують введений ген. Такі технології включають акселерацію генетичного матеріалу, нанесеного на мікрочастинки, безпосередньо в клітини (патент США 4945050 і патент США 5141131). Рослини можуть бути трансформовані з використанням технології Agrobacterium, див. патент США 5177010, патент США 5104310, Європейську патентну заявку № 0131624B1, Європейську патентну заявку № 120516, Європейську патентну заявку № 159418B1, Європейську патентну заявку № 176112, патент США 5149645, патент США 5469976, патент США 5464763, патент США 4940838, патент США 4693976, Європейську патентну заявку № 116718, Європейську патентну заявку № 290799, Європейськупатентну заявку № 320500, Європейську патентну заявку № 604662, Європейську патентну заявку № 627752, Європейську патентну заявку № 0267159, Європейську патентну заявку № 0292435, патент США 5231019, патент США 5463174, патент США 4762785, патент США 5004863 і патент США 5159135. Інша технологія трансформації включає технологію WHISKERS™, див. патент США 5302523 і патент США 5464765. Технологія електропорації також використовувалася для трансформації рослин, див. Міжнародний патент WO 87/06614, патент США 5472869, патент США 5384253, Міжнародний патент WO 9209696 і Міжнародний патент WO 9321335. Усі ці патенти і публікації, які стосуються трансформації, включені в даний опис за допомогою посилання. На додаток до численних технологій трансформації рослин, тип тканини, яка контактує зі сторонніми генами, також може змінюватися. Така тканина включає, але не обмежується ними, ембріогенну тканину, I і II типи калюсної тканини, гіпокотиль, меристему тощо. Майже всі рослинні тканини 6 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть бути трансформовані під час дедиференціаціі з використанням відповідних технологій у межах кваліфікації фахівця в даній галузі. Гени, які кодують кожен з розглянутих токсинів, можуть бути вставлені в клітини рослини з використанням різноманітних способів, які добре відомі в даній галузі, як описано вище. Наприклад, доступно велике число векторів клонування, які містять маркер, який забезпечує можливість добору трансформованих мікробних клітин, і реплікаційна система, функціональна в Escherichia coli, для одержання і модифікації сторонніх генів для вставки у вищі рослини. Такі маніпуляції можуть включати, наприклад, введення мутацій, усікань, або додавань заміщень, як бажано для передбачуваного використання. Вектори включають, наприклад, pBR322, групу pUC, групу M13mp, pACYC184 і т.д. Відповідно, послідовність, яка кодує Cry-білок або варіанти, може бути вставлена у вектор у придатний сайт рестрикції. Отримана плазміда використовується для трансформації клітин E. coli, клітини яких культивують у придатному поживному середовищі потім збирають і лізують для того, щоб була витягнута придатна для обробки кількість плазміди. Аналіз послідовності, аналіз фрагментів рестрикції, електрофорез і інші біохімічні-молекулярно-біологічні способи в цілому проводять як способи аналізу. Після кожної маніпуляції, використовувана послідовність ДНК може бути розщеплена і з'єднана з наступною послідовністю ДНК. Кожна піддана маніпулюванню послідовність ДНК може бути клонована в ту саму або інші плазміду. Використання утримуючих T-ДНК векторів для трансформації клітин рослин інтенсивно досліджувалося і досить описане в Європейському патенті EP 120516; публікаціях Lee і Gelvin (2008), Fraley et al. (1986), і An et al. (1985), і досить встановлено в даній галузі. Як тільки вставлена ДНК інтегрується в ген рослини, вона стає стійкою у всіх наступних поколіннях. Вектор, використовуваний для трансформації клітини рослини, звичайно містить вибраний маркерний ген, який кодує білок, який додає трансформованим клітинам рослин стійкість до гербіциду або антибіотику, такому як, поряд з іншими, біалафос, канаміцин, G418, блеоміцин або гігроміцин. Відповідно, окремо використовуваний вибраний маркерний ген повинен забезпечити можливість вибору трансформованих клітин, у той час як ріст клітин, які не містять вставлену ДНК, придушується селекційною сполукою. Доступне велике число способів вставки ДНК у клітину рослини-хазяїна. Ці способи включають трансформацію T-DNA, доставлену Agrobacterium tumefaciens або Agrobacterium rhizogenes як агента трансформації. Додатково, можна використовувати злиття протопластів рослини з ліпосомами, які містять підлягаючу доставці ДНК, пряму ін'єкцію ДНК, трансформацію біологічною балістикою (бомбардуванням мікрочастинками) або електропорацію, а також інші можливі способи. У переважному варіанті здійснення даного винаходу рослини трансформуються генами, де використання кодона ділянки, яка кодує білок, було оптимізовано для рослин. Див., наприклад, патент США 5380831, який включений у даний опис за допомогою посилання. Також, переважно використовуються рослини, які кодують зрізаний токсин. Зрізаний токсин звичайно кодує приблизно від 55 % до приблизно 80 % токсину повної довжини. Способи створення синтетичних генів B.t. для використання в рослинах відомі в даній галузі (Stewart, 2007). Незалежно від методики трансформації, ген переважно включають у вектор переносу гена, адаптований для експресування генів інсектицидного токсину B.t, і варіанти в рослинної клітини включенням у вектор рослинного промотору. На додаток до рослинних промоторів, у рослинних клітинах для експресування чужорідних генів можна ефективно використовувати промотори з різноманітних джерел. Наприклад, можливе використання промоторів бактеріального походження, таких як промотор октопінсинтази, промотор нопалінсинтази і промотор манопінсинтази. У деяких переважних варіантах здійснення можуть використовуватися промотори, не зв'язані з Bacillus thuringiensis. Можуть використовуватися промотори, які виходять з рослинних вірусів, наприклад, промотори 35S і 19S вірусу мозаїки кольорової капусти, промотор з вірусу мозаїки жилок касаві тощо. Рослинні промотори включають, але без обмеження, малу субодиницю (ssu), промотор бета-конгліциніну, промотор фазеоліну, промотор ADH (алкогольдегідрогенази), промотори теплового шоку, промотор ADF (деполімеризації актину), промотор убіквітину, промотор актину і тканиноспецифічні промотори. Промотори можуть також містити визначені енхансерні елементи послідовності, які можуть підвищити ефективність транскрипції. Конкретні енхансери включають, але без обмеження, ADH1-інтрон 1 і ADH1-інтрон 6. Можуть використовуватися конститутивні промотори. Конститутивні промотори направляють безупинну генну експресію майже у всіх типах клітин і майже в будь-який час (наприклад, актину, убіквітину, CaMV 35S). Тканиноспецифічні промотори відповідальні за генну експресію у визначених типах або клітин тканини, таких як листи або насіння (наприклад, промотори зеїну, олеозину, напіну, ACP (ацил білка-носія)), і ці промотори також можуть 7 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 використовуватися. Можуть також використовуватися промотори, які активні під час визначеної стадії розвитку рослин, а також активні у визначених тканинах і органах рослин. Приклади таких промоторів включають, але без обмеження, промотори, які є специфічними для коренів, специфічними для пилка, специфічними для зародків, специфічними для "шовку" кукурудзи, специфічними для бавовняних волокон, специфічними для ендосперми насіння, специфічними для флоеми, тощо. У визначених умовах може бути бажаним використання індукованого промотору. Індукований промотор відповідальний за експресію генів у відповідь на специфічний сигнал, такий як фізичний стимул (наприклад, гени теплового шоку); світло (наприклад, RUBP карбоксилазу); гормон (наприклад, глюкокортикоїд); антибіотик (наприклад, тетрациклін); метаболіти; і стрес (наприклад, посуху). Можуть використовуватися інші бажані транскрипційні і трансляційні елементи, які функціонують у рослинах, такі як 5' нетрансльовані лідерні послідовності, РНК послідовності транскрипції термінації і сигнальні послідовності додавання поліаденілату. У даній галузі відомі численні специфічні для рослин вектори переносу генів. Трансгенні культури, які містять ознаки стійкості до комах (IR), є переважними в рослинах кукурудзи і бавовни по всій Північній Америці, і використання цих ознак поширюється по усьому світі. Промислові трансгенні культури, які комбінують ознаки IR і стійкість до гербіцидів (HT), були розроблені множиною насінних компаній. Вони включають комбінації ознак IR, доданих інсектицидними білками B.t. і ознак HT, таких як стійкість до інгібіторів ацетолактатсинтази (ALS), таких як сульфонілсечовини, імідазолінони, триазолпіримідин, сульфонаніліди тощо, інгібіторів глутамінсинтетази (GS), таких як біалафос, глюфосинат тощо, інгібіторів 4гідроксифенілпіруватдіоксігенази (HPPD), таких як мезотрион, ізоксафлутол тощо, інгібіторів 5енолпірувілшикімат-3-фосфатсинтази (EPSPS), таких як гліфосат тощо, інгібіторів ацетилкоензим-A-карбоксилази (ACCase), таких як галоксифоп, квілазофоп, діклофоп тощо. Відомі інші приклади, у яких трансгенно отримані білки забезпечують стійкість рослин до хімічних класів гербіцидів, таким як гербіциди на основі феноксікислот і гербіциди на основі ауксинпірідилоксіацетатів (див. міжнародну патентну заявку WO 2007/053482 A2), або гербіциди на основі феноксікислот і гербіциди на основі арилоксіфеноксіпропіонатів (див. міжнародну патентну заявку 2005107437 A2, A3). Здатність контролювати множинні зв'язані зі шкідниками проблеми за допомогою ознак IR являє собою цінну концепцію промислового продукту, і зручність цієї продуктової концепції підвищується, якщо ознаки, які забезпечують контроль над комахами, і ознаки, які забезпечують контроль над бур'янами, комбінуються в одній рослині. Додатково, підвищена значимість може бути отримана за допомогою комбінацій в одній рослині ознак IR, наданих інсектицидним білком B.t., таким як інсектицидний білок за даним винаходом, з однією або більше додатковими ознаками HT, такими як вказано вище, плюс одна або більше додаткових ознак, які вводяться (наприклад, стійкість до інших комах, яка походить з B.t. або з інших інсектицидних білків, стійкості до комах, доданої такими механізмами як РНКі тощо, стійкості до нематодів, стійкості до захворювань, стійкості до стресу, поліпшеної утилізації азоту і тому подібних), або продуктивні ознаки (наприклад, високий вміст олій, корисна для здоров'я сполука, поліпшення поживної цінності тощо). Такі комбінації можуть бути отримані або звичайною селекцією (селекційний пакет), або спільно у вигляді нового явища трансформації, яке включає одночасне введення множинних генів (молекулярний пакет). Сприятливі ефекти включають здатність справлятися зі шкідниками і поліпшеною боротьбою з бур'янами культур рослин, які забезпечують вторинні переваги для виробника і/або споживача. Таким чином, винахід може бути використаний в комбінації з іншими ознаками для забезпечення повного агрономічного пакета поліпшеної якості культури зі здатністю гнучко й економічно рентабельно регулювати будь-яке число агрономічних питань. Трансформовані клітини ростуть всередині рослин звичайним чином. Вони можуть утворювати зародкові клітини і передавати трансформовану ознаку(и) популяції рослин. Такі рослини можна вирощувати звичайним чином і схрещувати з рослинами, які мають такі ж трансформовані спадкоємні фактори або інші спадкоємні фактори. Отримані гібридні індивіди мають відповідні фенотипічні властивості. У переважному варіанті здійснення даного винаходу рослини трансформуються генами, де використання кодона було оптимізоване для рослин. Див., наприклад, патент США 5380831. Крім того, способи створення синтетичних генів Bt для використання в рослинах відомі в даній галузі (Stewart і Burgin, 2007). Одним необмежувальним прикладом кращої трансформованої рослини є фертильна рослина маїсу, яка містить експресований рослиною ген, який кодує білок Cry3Ba, і додатково утримуючий другий експресований рослиною ген, який кодує білок Cry34Ab/35Ab. 8 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перенос (або інтрогресія) обумовленого(их) білками Cry3Aa і Cry34Ab/35Ab ознаки(ознак) в інбредні лінії маїсу може бути досягнута рекурентним селекційним розведенням, наприклад, зворотним схрещуванням. У цьому випадку, бажаного рекурентного батька спочатку схрещують з інбредним донором (нерекурентним батьком), який несе відповідний(ні) ген(и) для обумовлених Cry ознак. Потім потомство цього однократного схрещування знову спаровують з рекурентним батьком з наступною селекцією в отриманому потомстві для переносу бажаної ознаки(ознак) від нерекурентного батька. Після трьох, переважно, чотирьох, більше переважно, п'яти або більше поколінь зворотного схрещування з рекурентним батьком із селекцією бажаної ознаки(ознак), потомство буде гетерозиготним у відношенні локусів, які контролюють стерпну(ні) ознаку(ки), але буде як рекурентний батько у відношенні або більшості майже всіх інших генів (див., наприклад, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory і Technique, 360-376). Стратегії керування стійкістю до комах (IRM). Roush et al., наприклад, описують "двотоксинні" стратегії, також називані "побудовою піраміди" або "пакетуванням", для керування інсектицидними трансгенними культурами. (Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786). Агентство США по захисту навколишнього середовища на своєму сайті в інтернеті (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) публікує наступні вимоги до забезпечення не трансгенних (тобто не-B.t.) резервних культур (блоку не-Bt культур/кукурудзи) для використання з трансгенними культурами, продукуючими один білок Bt, активний проти шкідників-мішеней. "Специфічні структуровані вимоги до захищеного від кукурудзяного метелика Bt (Cry1Ab або Cry1F) кукурудзяним продуктам наступні: Структуровані резервати: 20 % нелускокрилий Bt кукурудзяний резерват у Кукурудзяній смузі; 50 % нелускокрилий Bt резерват у Бавовняній смузі. Блоки Внутрішній (тобто, у межах поля Bt); Зовнішній (тобто, окремі поля в межах ½ милі (804 м) (якщо можливо, 1/4 милі (402 м)) від поля Bt для максимізації випадкового спарювання). Смуги всередині поля Смуги повинні бути шириною, щонайменше, 4 ряди (переважно, 6 рядів) для зменшення ефектів пересування личинок". Крім того, Національна Асоціація фермерів, які вирощують кукурудзу на своєму сайті інтернету: (ncga.com/insect-resistance-management-fact-sheet-bt-corn) також публікує аналогічне керівництво у відношенні вимог до резервату. Наприклад: "Вимоги до IRM у відношенні кукурудзяного метелика: - Засійте щонайменше 20 % вашого кукурудзяного поля гібридами резервного насіння. - В ділянках, продукуючих бавовну, резерват повинен складати 50 %. - Повинні бути засіяні в межах 1/2 милі (804 м) від гібридів резервної культури. - Резервне насіння можуть засівати у вигляді смуг у межах поля Bt; смуги резервної культури повинні мати ширину щонайменше 4 ряди. - Резервна культура може оброблятися звичайними пестицидами, тільки якщо для комахимішені досягаються економічні пороги. - Інсектициди, які розпорошуються, на основі Bt не можуть використовуватися на резервній кукурудзі. - Відповідні резервні культури повинні висіватися на кожній фермі з Bt кукурудзою". Як вказано Roush et al. (наприклад, на стор. 1780 і 1784 у правому стовпчику), пакетування або "пірамідування" із двох різних білків, кожного ефективного проти шкідників-мішеней і з невеликою або відсутньою перехресною стійкістю може забезпечити можливість використання меншого резервату. Roush припускає, що для успішного пакета, розмір резервату менше ніж 10 % може забезпечити керування стійкістю, порівняне приблизно з 50 % резерватом для однієї (не "пірамідованої") ознаки. Для доступних у даний час "пірамідованих" Bt кукурудзяних продуктів, Агентство США по захисту навколишнього середовища вимагає засіву значно меншого (у цілому, 5 %) структурованого резервату, не утримуючі білки Bt кукурудзи, ніж для продуктів з однією ознакою (у цілому, 20 %). Існують різні шляхи забезпечення ефектів IRM резервату, включаючи різні геометричні типи посіву на полях (як вказано вище) і суміші насіння у мішку, як додатково обговорюється Roush et al. (див. вище), і в патенті США 6551962. 9 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вказані вище процентні частки або подібні співвідношення резервату можуть використовуватися для розглянутих подвійних або потрійних пакетів або пірамід. Через те, що даний винахід забезпечує множинні, неконкурентні типи дії проти комахи-мішені кореневого жука, даний винахід може забезпечити "нульовий резерв", тобто поле, позбавлене резервних рослин (тому що вони не вимагаються). Звичайно потрібен дозвіл для засівання полів розміром більше приблизно 10 акрів (40,5 га) конкретними трансгенними рослинами B.t. Таким чином, даний винахід включає поле розміром більше 10 акрів (40,5 га) або більше з "нульовим резервом" або рослин, які не містять білки Bt; поля такого розміру раніше забажали б значного резерву, який не містить білки Bt. Усі патенти, патентні заявки, тимчасові заявки і публікації, приведені у виді посилання або процитовані в даному описі, повністю включені за допомогою посилання в тій степені, у якій вони не суперечать визначеним положенням даного опису. Нижче приведені приклади, які ілюструють методи здійснення винаходу. Ці приклади не слід розглядати як обмежуючі. Якщо не вказане інше, усі процентні частки представлені за масою, і всі пропорції сумішей у розчиннику представлені за об'ємом. Усі величини температури представлені в градусах Цельсія. Якщо спеціально не вказане інше або не є на увазі інше, одиничне число означає використовуваний у даному описі термін "щонайменше один". ПРИКЛАДИ Приклад 1 - Конструювання експресійних плазмід, які кодують токсини повної довжини Cry34Ab1, Cry35Ab1 і Cry3Ba1 Стандартні способи клонування використовували при конструюванні експресійних плазмід Pseudomonas fluorescens (Pf), сконструйовані для продукції відповідно Cry-білків Cry34Ab1, Cry35Ab1 і Cry3Ba1. Рестрикційні ендонуклеази з біологічних лабораторій Нової Англії (NEB; Ipswich, MA) використовували для переварювання ДНК, і T4 ДНК лігазу від компанії Invitrogen використовували для лігування ДНК. Плазміди одержували з використанням набору Plasmid Midi (Qiagen), дотримуючись інструкцій постачальника. Фрагменти ДНК очищали, ® використовуючи картридж Millipore Ultrafree -DA (Billerica, MA) після гель-електрофорезу в агарозному гелі з тріс-ацетатним буфером. Основна стратегія клонування передбачала субклонування послідовностей, які кодують, (CDS) білків Cry34Ab1 і Cry35Ab1 повної довжини в pMYC1803 у рестрикційні сайти Spe і Xho (або Xba) і CDS білка Cry3Ba1 повні довжини в pMYC1050 у рестрикційні сайти Kpn і Xba, відповідно, за допомогою чого їх поміщали під контроль експресії відповідно промотору Ptac і термінатора rrnBT1T2 із плазміди pKK223-3 (PL Pharmacia, Milwaukee, WI). pMYC1803 являє собою середню копію плазміди з походженням реплікації з RSF1010, гена стійкості до тетрацикліну, і сайтом зв'язування рибосоми, який передує сайти розпізнавання рестрикційного ферменту, у які можуть бути внесені фрагменти ДНК, які містять білок ділянки, яку кодують, (заявка на патент США 2008/0193974). Експресійну плазміду трансформували електропорацією у штам MB214 P. fluorescens, витягнутий у середовищі SOC-соєвий гідролізат і висівали на чашки з лізогенним бульйонним середовищем Luria (LB), який містить 20 мкг/мл тетрацикліну. Подробиці мікробіологічних маніпуляцій доступні в заявці на патент США № 2006/0008877, заявці на патент США № 2008/0193974, і заявці на патент США № 2008/0058262, включених у даний опис за допомогою посилання. Проводили скринінг колоній рестрикційним переварюванням міні-препарату плазмідної ДНК. Послідовність плазмідної ДНК вибраних клонів, які містять вставки, визначали за контрактом з комерційною організацією, яка проводить визначення послідовностей, такої як MWG Biotech (Huntsville, AL). Дані послідовностей збирали й аналізували, використовуючи програмне забезпечення Sequencher™ (Gene Codes Corp., Ann Arbor, MI). Приклад 2 - Ріст і експресія Аналіз росту й експресії у струшуваних посудинах, і продукцію токсинів Cry34Ab1, Cry35Ab1 і Cry3Ba1 для характеристики, включаючи зв'язування рецептора Bt і біологічний аналіз комах, здійснювали штамами P. Fluorescens, що містять експресійні конструкти, вирощеними у струшуваних посудинах (наприклад, клону pMYC2593 для Cry34Ab1, pMYC3122 для Cry35Ab1, і pMYC1177 для Cry3Ba1). Культури, які висіваються, вирощені в середовищі LB з добавкою 20 мкг/мл тетрацикліну, використовували для інокуляції 200 мл того ж середовища з 20 мкг/мл тетрацикліну. Експресію токсинів Cry34Ab1, Cry35Ab1 і Cry3Ba1 за допомогою промотору Ptac індукували додаванням ізопропіл-β-D-1-тіогалактопіранозіду (IPTG) після початкової інкубації протягом 24 годин при 30C при струшуванні. Зразки культури брали під час індукції й у різні часові точки після індукції. Густину клітин вимірювали за оптичною густиною при 600 нм (OD 600). Приклад 3 - Фракціонування клітин і аналіз SDS-PAGE (електрофорезом у поліакриламідному гелі з додецилсульфатом натрію) зразків зі струшуваних колб 10 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 У кожну часову точку взяття проб густину клітин зразків доводили до OD 600=20 і аліквоти об'ємом по 1 мл центрифугували при 14000g протягом 5 хвилин. Клітинні осади після центрифугування заморожували при -80C. Розчинні і нерозчинні фракції з заморожених зразків клітинних осадів після центрифугування зі струшуваних колб генерували з використанням розчину для екстракції бактеріального білка EasyLyse™ (EPICENTRE® Biotechnologies, Madison, WI). Кожен клітинний осад ресуспендували в 1 мл розчину EasyLyse™ і додатково розбавляли 1:4 у літичному буфері і інкубували зі струшуванням при кімнатній температурі протягом 30 хвилин. Лізат центрифугували при 14000 об/хв протягом 20 хвилин при 4C, і супернатант витягали у вигляді розчинної фракції. Потім осад після центрифугування (нерозчинну фракцію) ресуспендували в рівному об'ємі забуференого фосфатом сольового розчину (PBS; 11,9 мМ Na2HPO4, 137 мМ NaCl, 2,7 мМ KCl, pН 7,4). Зразки змішували в співвідношенні 1:1 буфером зразка 2X Laemmli, який містить β-меркаптоетанол, і кип'ятили протягом 5 хвилин перед завантаженням на гелі NuPAGE Novex 4-20 % Bis-Tris (Invitrogen, Carlsbad, CA). Електрофорез виконували в буфері, який рекомендується, XT MOPS. Гелі фарбували безпечною фарбою SimplyBlue™ Safe Stain стосовно протоколу виробника (Invitrogen) і візуалізували з використанням візуалізуючої системи Typhoon (GE Healthcare Life Sciences, Pittsburgh, PA). Приклад 4 - Отримання тілець включення Препарати тілець включення (IB) білка Cry отримували на клітинах у результаті ферментації P. Fluorescens, що забезпечувало продукцію інсектицидного білка B.t., як було продемонстровано SDS-PAGE і MALDI-MS (лазерною десорбцією при сприянні матриці/іонізаційною мас-спектрометрією). Ферментаційні осади P. fluorescens відморожували на водяній бані при 37C. Клітини ресуспендували до 25 % мас./об. у літичному буфері [50 мМ Тріс, pН 7,5, 200 мМ NaCl, 20 мМ динатріевої солі EDTA (етилендиамінтетраоцтової кислоти), 1 % Triton X-100 і 5 мМ дитіотреїтолу (DTT)]; безпосередньо перед використанням додавали 5 мл/л коктейлю інгібітору бактеріальної протеази (P8465 Sigma-Aldrich, St. Louis, MO). Клітини суспендували, використовуючи гомогенізатор при установці на найнижчий режим (Tissue Tearor, BioSpec Products, Inc., Bartlesville, OK). До клітинної суспензії додавали лізоцим (25 мг Sigma L7651 з білка курячого яйця) змішуванням металевим шпателем і суспензію інкубували при кімнатній температурі протягом однієї години. Суспензію прохолоджували на льоді протягом 15 хвилин, потім обробляли ультразвуком, використовуючи ультразвуковий генератор Branson Sonifier 250 (два 1-хвилинних сеанси, при 50 % робочому циклі, продуктивність 30 %). Лізис клітин перевіряли мікроскопією. При необхідності, додавали додаткові 25 мг лізоциму й інкубацію й обробку ультразвуком повторювали. Коли лізис клітин підтверджувався мікроскопією, лізат центрифугували при 11500×g протягом 25 хвилин (4 °C) з утворенням осаду IB, і супернатант видаляли. Осад IB ресуспендували 100 мл літичного буфера, гомогенізували ручною мішалкою і центрифугували, як вказано вище. Осад IB повторно промивали ресуспендуванням (у 50 мл літичного буфера), гомогенізацією, обробкою ультразвуком і центрифугуванням доти, доки супернатант не ставав безбарвним, і осад IB ставав щільним і не зовсім білим за кольором. Для кінцевого промивання, осад IB ресуспендували в підданій стерилізаційній фільтрації (через фільтр із розміром пор 0,22 мкм) дистильованій воді, яка містить 2 мМ EDTA, і центрифугували. Кінцевий осад ресуспендували в підданій стерилізаційній фільтрації дистильованій воді, яка містить 2 мМ EDTA, і зберігали в 1 мл аліквотах при -80C. Приклад 5 - Аналіз SDS-PAGE і кількісне визначення Аналіз SDS-PAGE і кількісне визначення білка в препаратах IB проводили відтаванням 1 мл аліквоти осаду IB і розведенням 1:20 підданій стерилізаційній фільтрації дистильованою водою. Потім розведений зразок кип'ятили з 4X буфера зразка, який відновлює, [250 мм Тріс, pН 6,8, 40 % гліцерол (об./об.), 0,4 % бромфенол синій (мас./об.), 8 % SDS (мас./об.) і 8 % β® меркаптоетанол (об./об.)] і завантажували на Novex 4-20 % Тріс-гліцин, 12+2-ямковий гель (Invitrogen), який працює з буфером IX Тріс/гліцин/SDS (Invitrogen). Гель задіяли протягом приблизно 60 хв при 200 вольтах, потім фарбували і знебарвлювали наступними процедурами з використанням безпечного барвника SimplyBlue™ Safe Stain (Invitrogen). Кількісне визначення цільових смуг проводили порівнянням денситометричних величин для смуг, у порівнянні зі зразками бичачого сироваткового альбуміну (BSA), обробленими на тім же гелі, для побудови стандартної кривої, використовуючи програмне забезпечення Bio-Rad Quantity One. Приклад 6 - Солюбілізація тілець включення 10 мл суспензій тілець включення з клонів P. fluorescens MR1253, MR1636 і MR832 (які містять 50-70 мг/мл білків Cry34Ab1, Cry35Ab1 і Cry3Ba1, відповідно) центрифугували при установці на найвищий режим мікроцентрифуги Eppendorf моделі 5415C (приблизно 14000g) для осадження включень. Супернатант буфера для збереження видаляли і заміняли 25 мл 100 мм буфера ацетату натрію, pН 3,0, і відповідно для Cry34Ab1, і для Cry35Ab1, і 100 мм буфера 11 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 карбонату натрію, pН 11, для Cry3Ba1, у конічній пробірці ємністю 50 мл. Включення ресуспендували, використовуючи піпетку, і перемішували у вихровій мішалці для ретельного змішування. Пробірки поміщали на повільно обертову платформу при 4C протягом ночі для екстракції білків Cry34Ab1, Cry35Ab1 і Cry3Ba1 повні довжини. Екстракти центрифугували при 30000g протягом 30 хв при 4C і зберігали отримані супернатанти (які містять солюбілізовані Cry-білки повної довжини). Приклад 7 - Усікання протоксинів повної довжини Білки Cry35Ab1 і Cry3Ba1 повної довжини були зрізані або розщеплені хімотрипсином або трипсином для отримання хімотрипсинових або трипсинових фрагментів їхньої серцевини, які являють собою активну форму білків. Зокрема, солюбілізований білок Cry35Ab1 повної довжини інкубували з хімотрипсином (з бичачої підшлункової залози) (Sigma, St. MO) при (50:1=Cryбілок:фермент, мас./мас.) у 100 мМ буфера ацетату натрію, pН 3,0 (приклад 6), при 4 °C при обережному струшуванні протягом 2-3 днів, у той час як білок Cry3Ba1 повної довжини інкубували з трипсином (з бичачої підшлункової залози) (Sigma, St. MO) при (20:1=Cryбілок:фермент, мас./мас.) у 100 мМ буфера карбонату натрію, pН 11 (приклад 6), при кімнатній температурі протягом 1-3 годин. Повну протеолітичну переробку підтверджували аналізом SDSPAGE. Молекулярна маса Cry35Ab1 і Cry3Ba1 повної довжини дорівнює приблизно 44 і приблизно дорівнює 73 кДа, і їх хімотрипсинової або трипсинової серцевини дорівнює приблизно 40 і приблизно дорівнює 55 кДа, відповідно. Амінокислотні послідовності повної довжини і хімотрипсинової серцевини Cry35Ab1 представлена у виді SEQ ID NO:1 і SEQ ID NO:2, і амінокислотні послідовності повної довжини і трипсинової серцевини Cry3Ba1 представлені у виді SEQ ID NO:3 і SEQ ID NO:4. Ні хімотрипсинова, ні трипсинова серцевина не доступна для Cry34Ab1, і таким чином, для аналізів зв'язування використовували Cry34Ab1 повної довжини. Амінокислотна послідовність Cry34Ab1 повної довжини представлена у вигляді SEQ ID NO:5. Приклад 8 - Очищення зрізаних токсинів Очищали серцевинні фрагменти хімотрипсинізованого Cry35Ab1 і трипсинізованого Cry3Ba1. Зокрема, розщеплені матеріали центрифугували при 30000×g протягом 30 хв при 4 °C для видалення ліпідів, і отриманий супернатант концентрували в 5 разів, використовуючи пристрій з центрифуговим фільтром з регенерованої целюлози Amicon Ultra-15 (відсічення молекулярної маси 10000; Millipore). Потім буфери зразків заміняли буфером 20 мМ ацетату натрію, pН 3,5, як для Cry34Ab1, так і для Cry35Ab1, і 10 мм CAPS [3-(циклогексаміно)-1пропансульфонову кислоту], pН 10,5, для Cry3Ba1, використовуючи одноразові колонки PD-10 (GE Healthcare, Piscataway, NJ) або діаліз. Кінцеві об'єми доводили до 15 мл, використовуючи відповідний буфер для очищення з використанням системи рідинної хроматографії ATKA Explorer (Amersham Biosciences). Для Cry35Ab1, буфер A являв собою буфер у вигляді 20 мМ ацетату натрію, pН 3,5, і буфер B являв собою буфер A+1M NaCl, pН 3,5. Використовували колонку HiTrap SP (5 мл) (GE). Після того як колонка була повністю урівноважена з використанням буфера A, розчин Cry35Ab1 інжектували в колонку при швидкості потоку 5 мл/хв. Елюювання виконували з використанням градієнта 0-100 % буфера B при 5 мл/хв із 1 мл/фракцію. Для Cry3Ba1, буфер A являв собою буфер у вигляді 10 мм CAPS, pН 10,5, і буфер B являв собою буфер у вигляді 10 мм CAPS, pН 10,5+1M NaCl. Використовували колонку Capto Q, 5 мл (5 мл) (GE), і всі інші процедури були аналогічні процедурам для Cry35Ab1. Після аналізу SDS-PAGE вибраних фракцій для додаткового вибору фракцій, які містять білок-мішень найкращої якості, фракції об'єднували. Буфер для очищеної хімотрипсинової серцевини Cry35Ab1 заміняли 20 мМ Bist-Tris, pН 6,0, як описано вище. Для очищеної трипсинової серцевини Cry3Ba1, сіль видаляли, використовуючи одноразові колонки PD-10 (GE Healthcare, Piscataway, NJ) або діаліз. Зразки зберігали при 4C для пізніше проведеного аналізів зв'язування після кількісного визначення з використанням SDS-PAGE і аналізів системою візуалізації Typhoon (GE) з BSA як стандартом. Приклад 9 - Препарат BBMV Препарати пухирців мембрани щіткової облямівки (BBMV) середньої кишки комах широко використовуються для аналізів зв'язування Cry-токсину з рецептором. Препарати BBMV, використовувані в даному винаході, одержували з ізольованих середніх кишок третьої вікової стадії західного кукурудзяного кореневого жука (Diabrotica virgifera virgifera LeConte), використовуючи спосіб, описаний Wolferberger et al. (1987). Лейцинамінопептидазу використовували як маркер мембранних білків у препараті, і активність лейцинамінопептидази неочищеного гомогенату і препаратів BBMV визначали, як описано раніше (Li et al. 2004a). Концентрацію білка в препаратах BBMV вимірювали, використовуючи спосіб Bradford (1976). 125 Приклад 10 - Мічення I 12 UA 112516 C2 5 10 15 20 25 30 35 40 45 50 55 60 Очищений Cry34Ab1 повної довжини, хімотрипсинізований Cry35Ab1 і трипсинізований 125 Cry3Ba мітили, використовуючи I, для аналізів гомологічного і конкурентного зв'язування. Для впевнення в тому, мічення радіоактивним ізотопом не усуває біологічну активність Cry-токсинів, проводили йодування в холодному вигляді, використовуючи Na, стосовно інструкцій з ® використання гранул для йодування Pierce (Pierce Biotechnology, Thermo Scientific, Rockford IL). Результати біоаналізу показали, що йодована хімотрипсинова серцевина Cry35Ab1 залишалася активною проти личинок західного кукурудзяного кореневого жука, але йодування інактивувало 125 Cry34Ab1. Специфічне зв'язування міченого радіоактивним ізотопом I-Cry34Ab1 з BBMV комах було неможливо виявити і, таким чином, був потрібний інший спосіб мічення для оцінки зв'язування Cry34Ab1 з мембранними рецепторами. Оскільки трипсинізований Cry3Ba1 мав обмежену активність проти західного кукурудзяного кореневого жука, то, отже, вважалося, що біоаналізом з кукурудзяним кореневим жуком при використанні йодованої трипсинової серцевини Cry3Ba1 у холодному стані важко оцінити зміну активності. Крім того, специфічне 125 зв'язування I-Cry3Ba1 з BBMV виявляли, навіть хоча рівень був низьким. Йодування Cry3Ba1 125 у холодному стані й аналіз його токсичності ігнорували. Мічені радіоактивним ізотопом I125 ® Cry35Ab1 і I-Cry3Ba1 отримували за допомогою йодування гранулами для йодування Pierce 125 (Pierce) і Na I. Колонки для знесолення на вибір Zeba™ (Pierce) використовували для 125 видалення не включеного або вільного Na I з йодованого білка. Величини питомої радіоактивності йодованих Cry-білків знаходилися в діапазоні від 1 до 5 мкКі/мкг. Проводили множинні серії мічення й аналізів зв'язування. Приклад 11 - Аналізи насичувального зв'язування Аналізи специфічного або насичувального зв'язування виконували, використовуючи мічені 125 I Cry-токсини, як описано раніше (Li et al. 2004b). Для визначення специфічного зв'язування й оцінки афінності зв'язування (константи дисоціації, Kd) і концентрації сайтів зв'язування (Bmax) 125 125 Cry35Ab1 і Cry3Ba з BBMV комах, серії зростаючих концентрацій або I-Cry35Ab1, або ICry3Ba1 інкубували з даною концентрацією (0,1 мг/мл) BBMV комах відповідно в 150 мкл 20 мМ Bis-Tris, pН 6,0, 150 мМ KCl з додаванням 0,1 % BSA при кімнатній температурі протягом 1 години при обережному струшуванні. Токсин, зв'язаний з BBMV, відділяли від вільного токсину в суспензії центрифугуванням при 20000×g при кімнатній температурі протягом 8 хв. Осад після центрифугування двічі промивали 900 мкл (крижаного) такого ж буфера, який містить 0,1 % BSA. Радіоактивність, яка залишається в осаді після центрифугування, вимірювали автоматично гамма-лічильником COBRAII Auto-Gamma (Packard, Canberra company) і враховували загальне зв'язування. Паралельно проводили іншу серію реакцій зв'язування, і 500-1000-кратний надлишок неміченого відповідного токсину включали в кожну з реакцій зв'язування для того, щоб він повністю зайняв усі ділянки специфічного зв'язування неміченого відповідного токсину на BBMV, який використовували для визначення неспецифічного зв'язування. Специфічне зв'язування оцінювали вирахуванням неспецифічного зв'язування з загального зв'язування. Величини Kd і Bmax цих токсинів оцінювали, використовуючи специфічне зв'язування, у порівнянні з концентраціями міченого токсину, використовуючи програмне забезпечення GraphPad Prism 5.01 (GraphPad Software, San Diego, CA). Графіки складали з використанням програм або Microsoft Excel, або GraphPad Prism. Експерименти повторювали щонайменше чотири рази і результати наносили на графіки, показані на Фіг. 1A 125 125 (зв'язування I-Cry35Ab1 з BBMV) і Фіг. 1B (зв'язування I-Cry3Ba1 з BBMV). Ці експерименти 125 125 зв'язування продемонстрували, що як I-Cry35Ab1, так і I-Cry3Ba1 були здатні специфічно 125 125 зв'язуватися з BBMV (Фіг. 1A і 1B). I-Cry35Ab1 і I-Cry3Ba1 мали афінність зв'язування Kd=11,66±11,44, 7,35±3,81 (нМ), відповідно, і концентрацію сайтів зв'язування Bmax=0,78±0,46, 0,55±0,13 (пкмоль/мг BBMV), відповідно. 125 Специфічне зв'язування I-Cry35Ab1 проводили в присутності неміченого Cry34Ab1 125 (молярне відношення 1:50= I-Cry35Ab1:Cry34Ab1). Параметри зв'язування (Kd і Bmax) не були 125 отримані, тому що специфічне зв'язування I-Cry35Ab1 не було насичуваним (Фіг. 2). Однак на 125 специфічне зв'язування I-Cry35Ab1 приходилося приблизно 90 % загального зв'язування в присутності неміченого Cry34Ab1. Приклад 12 - Аналізи конкурентного зв'язування Аналізи конкурентного зв'язування проводили для визначення того, чи розділяють Cry34Ab1 і Cry35Ab1 окремо плюс їхня суміш як бінарний токсин той самий набір сайтів зв'язування з Cry3Ba1. Для аналізів гомологічного конкурентного зв'язування Cry3Ba1, який збільшуються 125 кількості (0-2500 нМ) неміченого Cry3Ba1 спочатку змішували з 5 нМ I-Cry3Ba1, і потім інкубували з BBMV комах у концентрації 0,1 мг/мл при кімнатній температурі протягом 1 години відповідно для забезпечення їх можливості конкурувати за передбачувані рецептор(и) на BBMV. 125 Аналогічним чином, гомологічну конкуренцію Cry35Ab1 завершували 5 нМ I-Cry35Ab1 під час 13 UA 112516 C2 125 5 10 15 20 25 30 35 40 45 відсутності або в присутності неміченого Cry35Ab1 (у молярному відношенні ICry35Ab1:Cry34Ab1 1:50) і з BBMV у концентрації 0,03 мг/мл, відповідно. Відсоткові частки 125 125 зв'язаного з I-Cry3Ba1 або I-Cry35Ab1 з BBMV визначали для кожної з реакцій, у порівнянні з висхідним загальним (або специфічним) зв'язуванням під час відсутності неміченого конкурента. 125 Аналізи гетерогенного конкурентного зв'язування між I-Cry35Ab1 і неміченим Cry3Ba1 проводили під час відсутності або в присутності неміченого Cry34Ab1 для ідентифікації того, чи розділяють вони той самий набір сайту(ів) зв'язування. Це було досягнуто збільшенням кількості 125 125 неміченого Cry3Ba1 як конкурента для конкуренції за зв'язування з одним I-Cry35Ab1 або I125 Cry35Ab1+Cry34Ab1 (молярне відношення I-Cry35Ab1:Cry34Ab1 1:50). Аналогічним чином, також проводили аналізи реципрокного гетерогенного конкурентного зв'язування, яке досягалося збільшенням кількості неміченого Cry35Ab1 і Cry34Ab1 або окремо суміші Cry35Ab1+Cry34Ab1 (молярне відношення Cry35Ab1:Cry34Ab1 1:50) у якості одного або двох конкурентів, включених у реакції, для конкуренції за зв'язування з міченим Cry3Ba1, відповідно. Експерименти повторювали щонайменше три рази, і результати наносили на графіки, показані 125 125 на Фіг. 3A (зв'язування у відсотках одного I-Cry35Ab) і Фіг. 3B (зв'язування у відсотках ICry35Ab1 у присутності Cry34Ab1). Результати експериментів продемонстрували, що Cry35Ab1 був здатний перевершити в 125 конкурентному специфічному зв'язуванні I-Cry35Ab1, незалежно від відсутності (Фіг. 3A) або присутності (Фіг. 3B) Cry34Ab1. Однак Cry3Ba1 був не здатний конкурувати за специфічне 125 зв'язування з I-Cry35Ab1 як під час відсутності, так і в присутності Cry34Ab1. В аналізах реципрокного конкурентного зв'язування Cry3Ba також був здатний зміститися вище 20 % загального зв'язування, яке відбиває те, що він повністю перевершив у конкуренції за його специфічне зв'язування, тому що специфічне зв'язування складає тільки невелику фракцію (див. Фіг. 1B). Однак ні Cry34Ab1, ні Cry35Ab1 окремо, ні суміш Cry35Ab1+Cry34Ab1 (1:10) не 125 була здатна витиснути I-Cry3Ba1. Ці дані вказують на те, що один Cry35Ab1 або суміш Cry35Ab1+Cry34Ab1 не розділяють рецепторний сайт зв'язування з Cry3Ba1. Посилання: Bradford, M.M. 1976. A rapid і sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Anal. Biochem. 72, 248-254. Li, H., Oppert, B., Higgins, R.A., Huang, F., Zhu, K.Y., Buschman, L.L., 2004a. Comparative analysis of proteinase activities of Bacillus thuringiensis-resistant and-susceptible Ostrinia nubilalis (Lepidoptera: Crambidae). Insect Biochem. Mol. Biol. 34, 753-762. Li, H., Oppert, B., Gonzalez-Cabrera, J., Ferre, J., Higgins, R…, Buschman, L.L. and Zhu, K.Y. і Huang, F. 2004b. Binding analysis of Cry1 Ab and Cry 1 Ac with membrane vesicles from Bacillus thuringiensis-resistant and-susceptible Ostrinia nubilalis (Lepidoptera: Crambidae). Biochem. Biophys. Res. Commun. 323, 52-57. Wolfersberger, M.G., Luthy, P., Maurer, A., Parenti, P., Sacchi, F., Giordana, B., Hanozet, G.M., 1987. Preparation and partial characterization of amino acid transporting brush border membranevesicles from the larval midgut of the cabbage butterfly (Pieris brassicae). Comp. Biochem. Physiol. 86A, 301-308. US Patent Application No. 20080193974. 2008. BACTERIAL LEADER SEQUENCES FOR INCREASED EXPRESSION US Patent Application No. 20060008877, 2006. Expression systems with sec-system secretion. US Patent Application No. 20080058262, 2008. rPA optimization. 14 UA 112516 C2 15 UA 112516 C2 16 UA 112516 C2 17 UA 112516 C2 18 UA 112516 C2 19 UA 112516 C2 20 UA 112516 C2 21 UA 112516 C2 22 UA 112516 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 1. Трансгенна рослина, яка продукує білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1, причому білок Cry35Ab1 і інсектицидний білок Cry3Ba1 зв'язуються з різними рецепторними сайтами зв'язування в кишечнику кукурудзяного кореневого жука. 2. Трансгенна рослина за п. 1, причому вказана рослина додатково продукує четвертий інсектицидний білок, вибраний із групи, яка складається з Cry3Aa і Cry6Aa. 3. Насінина трансгенної рослини за п. 1 або 2, де вказана насінина містить ДНК, яка кодує білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1. 4. Множина рослин, яка містить множину трансгенних рослин за п. 1 або 2. 5. Множина рослин за п. 4, де вказана множина рослин додатково містить резервні рослини, які не містять Bt-білки, де вказані резервні рослини складають менше ніж 40 % усіх культур у вказаній множині рослин. 23 UA 112516 C2 5 10 15 20 25 30 35 40 45 6. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 30 % усіх культур у вказаній множині рослин. 7. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 20 % усіх культур у вказаній множині рослин. 8. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 10 % усіх культур у вказаній множині рослин. 9. Множина рослин за п. 5, де вказані резервні рослини складають менше ніж 5% усіх культур у вказаній множині рослин. 10. Множина рослин за п. 4, де у вказаній множині рослин відсутні резервні рослини. 11. Множина рослин за п. 5, де вказані резервні рослини розташовані блоками або смугами. 12. Суміш насіння, яка відтворює трансгенні рослини, що мають стійкість до кукурудзяного кореневого жука, яка містить резервне насіння від резервних рослин, які не містять Bt-білки, і множину насіння за п. 3, де вказане резервне насіння складає менше ніж 40 % усього насіння у суміші. 13. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 30 % усього насіння у суміші. 14. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 20 % усього насіння у суміші. 15. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 10 % усього насіння у суміші. 16. Суміш насіння за п. 12, де вказане резервне насіння складає менше ніж 5 % усього насіння у суміші. 17. Множина насіння за п. 3, яка міститься у мішку або контейнері, причому вказаний мішок або контейнер не містить резервного насіння. 18. Спосіб боротьби з розвитком стійкості до Cry-білка в комахи, згідно з яким висівають насіння за будь-яким з пп. 3 або 12-16 для одержання множини рослин за будь-яким з пп. 4-11, і контактують вказану комаху із вказаною множиною рослин. 19. Множина рослин за будь-яким з пп. 4-11, де вказані рослини займають більше ніж 10 акрів (40,5 га). 20. Трансгенна рослина за п. 1 або 2, де вказана рослина являє собою рослину маїсу. 21. Рослинна клітина трансгенної рослини за п. 1, де вказаний білок Cry35Ab1 щонайменше на 95 % ідентичний послідовності, вибраній з групи, яка складається з SEQ ID NO:1 і SEQ ID NO:2, вказаний інсектицидний білок Cry3Ba1 щонайменше на 95 % ідентичний послідовності, вибраній з групи, яка складається з SEQ ID NO:3 і SEQ ID NO:4, і вказаний білок Cry34Ab1 щонайменше на 95 % ідентичний SEQ ID NO:5. 22. Трансгенна рослина за п. 1, де вказаний білок Cry35Ab1 містить послідовність, вибрану з групи, яка складається з SEQ ID NO:1 і SEQ ID NO:2, вказаний інсектицидний білок Cry3Ba1 містить послідовність, вибрану з групи, яка складається з SEQ ID NO:3 і SEQ ID NO:4, і вказаний білок Cry34Ab1 містить SEQ ID NO:5. 23. Спосіб одержання рослинної клітини за п. 21, за яким клітину трансформують ДНК, що кодує білок Cry34Ab1, білок Cry35Ab1 і інсектицидний білок Cry3Ba1. 24. Спосіб боротьби з кукурудзяним кореневим жуком, за яким приводять у контакт вказану комаху з білком Cry34Ab1, білком Cry35Ab1 і інсектицидним білком Cry3Ba1, причому білок Cry35Ab1 і інсектицидний білок Cry3Ba1 зв'язуються з різними рецепторними сайтами зв'язування в кишечнику кукурудзяного кореневого жука. 24 UA 112516 C2 25 UA 112516 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюCombinations including cry34ab/35ab and cry3ba proteins to prevent development of resistance corn rootworms (diabrotica spp.)
Автори англійськоюNarva, Kenneth, E., Meade, Thomas, Fencil, Kristin, J., Li, Huarong, Hey, Timothy, D., Woosley, Aaron, T., Olson, Monica, Britt
Автори російськоюНарва Кеннет Е., Мид Томас, Фенсил Кристин Дж., Ли Хуажун, Хей Тимоти Д., Вусли Аарон Т., Олсон Моника Бритт
МПК / Мітки
МПК: A01N 63/02, C07K 14/325, A01H 5/00, C12N 15/82, A01P 7/04, A01H 5/10
Мітки: кукурудзяних, рослина, інсектицидний, кореневих, жуків, сry3ba1, сry35ab1, розвитку, яка, стійкості, diabrotica, білок, трансгенна, продукує, сry34ab1, spp, запобігання
Код посилання
<a href="https://ua.patents.su/28-112516-transgenna-roslina-yaka-produkueh-bilok-sry34ab1-bilok-sry35ab1-i-insekticidnijj-bilok-sry3ba1-dlya-zapobigannya-rozvitku-stijjkosti-v-kukurudzyanikh-korenevikh-zhukiv-diabrotica-s.html" target="_blank" rel="follow" title="База патентів України">Трансгенна рослина, яка продукує білок сry34ab1, білок сry35ab1 і інсектицидний білок сry3ba1, для запобігання розвитку стійкості в кукурудзяних кореневих жуків (diabrotica spp.)</a>
Попередній патент: Спосіб виявлення присутності двох або більше білків, що становлять інтерес, в зразках рослинного походження
Наступний патент: Тетрагідропіридопіримідинові похідні
Випадковий патент: Фармацевтична композиція пептидів з низькою розчинністю у фізіологічному середовищі