Фармацевтична композиція пептидів з низькою розчинністю у фізіологічному середовищі
Формула / Реферат
1. Фармацевтична композиція, що містить:
а) пептид з низькою розчинністю у водному фізіологічному сольовому розчині як активний інгредієнт;
б) неіонну ароматичну гідротропну фармацевтично прийнятну речовину і
в) фізіологічний водний розчин.
2. Фармацевтична композиція за пунктом 1, в якій пептид (а) є аналогом ЛГРФ або пептидом ГРФ.
3. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій пептид (а) є антагоністом ЛГРФ.
4. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій пептид (а) є антидом або людським ГРФ.
5. Фармацевтична композиція за будь-яким з попередніх пунктів, яка містить неіонну ароматичну гідротропну речовину, вибрану з групи, що складається з нікотинаміду, нікотинової кислоти, бензойної кислоти, саліцилової кислоти, гентизинової кислоти, аскорбінової кислоти, гістидину, триптофану, фенілаланіну, тирозину, крезолу, фенолу, ксантинів, піридоксину, фолієвої кислоти, сахарину, а також їх неіонних похідних.
6. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій неіонна ароматична речовина є нікотинамідом.
7. Фармацевтична композиція за будь-яким з попередніх пунктів, яка ліофілізована і відтворена, і додатково містить одну або більше стабілізуючих речовин.
8. Фармацевтична композиція за будь-яким з попередніх пунктів, яка додатково містить пропіленгліколь.
9. Фармацевтична композиція за будь-яким з попередніх пунктів, яка придатна для парентерального, перорального, назального або інгаляційного введення.
10. Фармацевтична композиція за будь-яким з попередніх пунктів, що додатково містить один або більше фармацевтично прийнятних наповнювачів.
11. Фармацевтична композиція за будь-яким з попередніх пунктів, яка придатна для ін'єкцій.
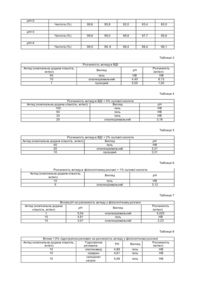
12. Фармацевтична композиція за пунктом 10, яка має наступні межі змін складу:
антид або ЛГРФ
0,1-20,0 мг
нікотинамід
10-300 мг
пропіленгліколь
0-800 мг
водна фаза, достатня кількість
до 1,0 мл.
Текст
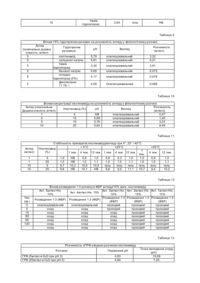
Даний винахід відноситься до фармацевтичної композиції, що включає: а) пептид, погано розчинний у водному фізіологічному сольовому розчині/ в якості активного інгредієнта; б) неіонна ароматична гідротропна фармацевтично прийнятна речовина і в) фізіологічний водний розчин. Відповідно до переважного здійснення даного винаходу пептид (а) є аналогом ЛГРФ або ГРФ пептидом. Передумови створення винаходу. Часто буває необхідно поліпшити розчинність лікарської речовини у фізіологічному середовищі, щоб досягнути клінічної ефективності ін'єкційних форм лікарських препаратів. Пептидні лікарські речовини часто погано розчинні у фізіологічному середовищі через наявність гідрофобних замісників. Проблеми розчинності можуть також приводити до поганого всмоктування при інших шля хах введення, і в деяких випадках відповідні солюбілізуючі речовини можуть допомогти всмоктуванню лікарських речовин при інших шляха х введення, наприклад, при пероральному або назальному. Прикладами пептидних лікарських речовин, які так погано розчинні у фізіологічному середовищі, є пептиди -аналоги ЛГРФ і рилізінг чинник гормону росту ГРФ. Рилізінг гормон лютеїнізуючого гормону (ЛГРФ або ГнРФ) являє собою декапептид, що секретується гіпоталамусом і здатний спричиняти виділення як ЛГ (лютеїнізуючого гормону), так і ФСГ (фолікулостимулюючого гормону). Він має наступну формулу: pyroGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gl y-NH 2. ЛГРФ може або стимулювати секрецію гонадотропіну або бути сильним інгібітором. При введенні шляхом точної пульсації ЛГРФ може підтримувати нормальну циклічну секрецію гонадотропіну. Пульсуюче введення ЛГРФ з використанням комп'ютеризованого насоса було використано з хорошими результатами для індукції овуляції у жінок з відсутністю овуляції, пов'язаною з дисфункцією гіпоталамуса. При постійному введенні ЛГРФ або його агоністи, як було доведено, є сильними інгібіторами секреції гонадотропіну, що дають тимчасову (повністю оборотну) гонадотропінову специфічну лікарську гіпофізектомію. До теперішнього часу синтезовані тисячі аналогів ЛГРФ, які можуть діяти або як агоністи або як антагоністи. Щоб отримати антагоністи ЛГРФ, які діють шляхом сполучення рецепторів, необхідно замінити декілька амінокислот в молекулі ЛГРФ. Для антагоністів також необхідні точні топологічні характеристики для досягнення високої спорідненості сполуки з рецепторами. Існує багато недавно синтезованих аналогів ЛГРФ, в яких амінокислоти містять ароматичні або інші функціональні групи, здатні до так званої гідротропної взаємодії. Використання антагоністів ЛГРФ з негайним придушенням ними виділення гонадотропіну може бути корисним в таких областях терапії, як контрацепція і при лікуванні гормонозалежних розладів. У випадку гормонозалежних пухлин специфічною перевагою може бути виключення вихідної стимуляційної фази, що створюється агоністами ЛГРФ. Відносно огляду по аналогах ЛГРФ див. Karten and Rivier, 1986. Антид, зокрема є сильним антагоністом ЛГРФ, формула, біологічна активність і отримання якого описані в патенті ЕР 377665. Внаслідок досліджень, проведених заявником, було встановлено, що антид володіє дуже поганою розчинністю в 0,9% розчині NaCl (розчинність 25мкг/мл) або іншому ізотонічному середовищі, такому як фосфа тно-буферний сольовий розчин (розчинність дорівнювала 16мкг/мл). Попередні водні лікувальні 4 форми антиду, як було показано, мають погану біодоступність і погане відтворення фармакокінетичних показників. Це пов'язане з тим, наприклад, що антид присутній в місці ін'єкції в концентраціях вище 25мкг/мл, що призводить до утворення осаду при контакті з фізіологічним середовищем. Цей осад може бути желеподібним за природою і володіє неблагоприємним впливом на всмоктуваність лікарської речовини, що показано проведеними заявником клінічними дослідженнями. Інші антагоністи рилізінг-гормону гонадотропіну у водних розчинах можуть утворювати гелеподібні структури і, крім того, як відомо, розчинність підвищується, коли pH розчину знижується, завдяки посиленню іонізації молекули (Cannon J.B., et al., 1995). ГРФ (також званий соматореліном) є пептидом, що секретується гіпоталамусом, який спричиняє виділення гормону росту з передньої частки гіпофіза. Він існує в природі у вигляді пептидів з 44, 40 і 37 амінокислот; форма з 44 амінокислот, можливо, може перетворюватися в форми меншого розміру, але, як повідомлено, всі вони активні, причому активність визначається першими 29 амінокислотними залишками. Пептид, відповідний амінокіслотній послідовності 1-29 людського ГРФ [hGRF(1-29)], [лГРФ(1-29)], також званий сермореліном, був отриманий шляхом технології рекомбінантних ДНК, як описано в європейському патенті ЕР 105759. Серморелін використали у вигляді ацетату для діагностики і лікування дефіциту гормону росту. ГРФ має терапевтичне значення для лікування деяких пов'язаних з гормоном росту розладів. Використання ГРФ для стимуляції виділення ГР є фізіологічним засобом індуціювання зростання довгих кісток або анаболізму білків. Добре відомо, що природна форма ГРФ може страждати від хімічної деградації у водному розчині, головним чином Asn в положенні 8, що приводить до зниження біологічної активності (Friedman et al., 1991; Bongers et al., 1992). Основні гідролітичні реакції, що відбуваються з ГРФ, чутливі до pH, і як повідомляється, являють собою: зміну Asp3 при pH 4-6,5; розщеплення зв'язку Asp3-Ala4 при pH 2,5-4,5; дезамідування і зміну Asn8 при pH вище за 7 (Felix A.M., 1991). Через сумісні шляхів деградації нестабілізовані водні розчини ГРФ найбільш стабільні в інтервалі pH 4-5. Bongers et al. (Bongers et al., 1992) показали, що реакція дезамідування у Asn8 швидко посилюється, коли pH підвищується вище pH 3. Різні дослідники отримали аналоги ГРФ шляхом заміни амінокислот в послідовності природного ГРФ для поліпшення хімічної стабільності (Serono Symposia USA, 1996; Friedman 1991). У той час як модифікація може бути ефективним засобом для поліпшення стабільності і збереження біоактивності, вона може бути небажаною через зміну імуногенності, яка могла б стати проблемою при хронічній терапії, такій як при дефіциті гормону росту. З літератури відомо, що в деяких випадках додавання ароматичних речовин до розчинів білків може викликати негативний вплив на розчинність, що приводить до випадіння осаду. Наприклад, коли ароматичні речовини приводили до контакту з рекомбінантним людським гормоном росту (рлГР), відбувались конформаційні зміни або денатурація, що приводять до утворення агрегатів рлГР. (Маа Y.F. and Hsu С.С, 1996). Крім того, щоб продемонструвати, що це не є загальним феноменом, було показано, що похідні ароматичних амінокислот давали поліпшену розчинність і підвищену абсорбцію гормону росту (Leone Bay А. et al., 1996). Нікотинамід, як повідомлялося, солюбілізує звичайні фармацевтичні сполуки (тобто непептиди з молекулярною вагою менше 1000 дальтон) шляхом комплексостворення з перенесенням заряду, так званою, гідротропною солюбілізіцєю. Цей процес може відбуватися внаслідок взаємодії ароматичних груп солюбілізувальої речовини і ароматичних або інших відповідних груп в молекулі лікарської речовини. Наприклад, див. Rasool et al., 1991. Однак було виявлено, і відповідні дані представлені в експериментальній частині, що інші молекули, які містять ароматичні групи, такі як бензоатні або саліцилатні, які могли б взаємодіяти шляхом гідротропного механізму (Jain N.K. and Patel V.V. 1986), дають тільки невеликі покращення розчинності аналогу ЛГРФ (антид) у фізіологічному розчині. В європейській патентній заявці 0649655 описана солюбілізація водорозчинного противиразкового лікарського препарату з використанням нікотинаміду для отримання ін'єкційної форми, яка застосовується. Заявлено багато потенційних похідних активної складової, однак, не представлені дані по експериментах in vi vo, що демонструє поліпшену ефективність. У заявці РСТ WO 96/10417 описане спільне введення людського інсуліну AspВ28 і нікотинаміду для досягнення швидкого початку вияву гіпоглікемічного ефекту. Заявлений інтервал концентрацій нікотинаміду становив 0,01-1 М (0,01-12% вага.), але переважно, від 0,05-0,5 М. Документ дає докази більш швидкого всмоктування під час дослідження in vivo у свиней, однак, механізм, шляхом якого здійснюється поліпшена абсорбція, не встановлений, і тому з цього документа не можна витягнути ніяких узагальнюючих вказівок. Опис винаходу. Було виявлено, що коли до водного розчину пептидного лікарського препарату, який звичайно погано розчининний у водному фізіологічному сольовому розчині, додають неіонну ароматичну гідротропну речовину, його розчинність підвищується, і до того ж отримані фармацевтичні композиції проявляють чудову стабільність. Зокрема було виявлено, що коли до розчину антиду у фізіологічному розчині (0,9% NaCl) додають нікотинамід, останній може сприяти розчинності цього лікарського препарату. Кінцева концентрація солюбілізуючого антиду залежить від концентрації доданого нікотинаміду і з підвищенням концентрації нікотинаміду збільшується експоненційно, як показано нижче. Як відомо, розчинність антагоністів рилізінг гормону гонадотропіну підвищується по мірі того, як знижується pH розчину, однак, представлені тут в експериментальній частині дані для антиду показують, що підвищена розчинність не пов'язана з ефектом pH. До того ж було виявлено, що нікотинамід може також підвищувати розчинність антиду у чисто водному середовищі. Тому основним об'єктом даного винаходу є отримання фармацевтичної композиції, що включає: а) пептид, погано розчинний у водному фізіологічному сольовому розчині, в якості активного інгредієнта; б) неіонна ароматична гідротропна фармацевтично прийнятна речовина; і в) фізіологічний водний розчин. Активним пептидним інгредієнтом може бути пептид-аналог ЛГРФ або рилізінг чинник гормону росту ГРФ. Переважно, аналог 9 ЛГРФ є антагоністом. Більш переважне те, що він є антидом, лГРФ або його ПЕГ-кон'югантами. За цим винаходом вираз "лГРФ" використовується для охоплення всіх людських пептидів ГРФ, з вказівкою, зокрема пептидів 1-44, 1-40, 1-29 і їх відповідних амідів (утримуючи х -NH2 на своєму кінці). Всі вони є в продажу. Переважним лГРФ є лГРФ(1-29)-NH2. Пептид ГРФ, який використовується в прикладах, є комерційним продуктом, якому даний опис в розділі "Матеріали". Також було відкрите те, що додавання нікотинаміду до водних розчинів лГРФ може знизити швидкість дезамідиювання Asn8 і додаткових продуктів деградації, не всі з яких були ідентифіковані до теперішнього часу. Відомо, що Asn8 може руйнуватися у водному розчині з виникненням наступних продуктів деградації: α-Asp8, β-Asp8 і сукцинімідил-Asn8. Також було встановлено, що ГРФ може розчинятися в неводних розчинниках і завдяки подальшому зниженню активності води у розчині запобігається дезамідиювання Asn8. Коли ГРФ розчиняли в пропіленгліколі (ПГ), було виявлено, що існують альтернативні (не повністю охарактеризовані) шляхи деградації. Також було виявлено, що шляхом включення нікотинаміду в неводний розчин, такий як ПГ, швидкість виникнення деяких з цих додаткових продуктів деградації знижується. Не обмежуючий перелік відповідних фармацевтично прийнятних неіонних ароматичних гідротропних речовин включає нікотинамід, нікотинову кислоту, бензойну кислоту, саліцилову кислоту, гентизинову кислоту, аскорбінову кислоту, гістидин, триптофан, фенілаланін, тирозин, крезол, фенол, ксантини, піридоксин, фолієву кислоту, сахарин. Неіонні похідні будь-яких з вище наведених сполук також можуть бути застосовані в цілях цього винаходу. Переважним є нікотинамід. Нікотинамід є звичайно джерелом вітаміну В, який використовується у фармацевтичних продуктах і вводиться головним чином пероральним шляхом, але також і шляхом ін'єкцій. Були рекомендовані дози до 500мг на добу (розділені на прийоми) , наприклад, див. Martindale. Фізіологічний водний розчин може бути ізотонічним сольовим розчином або фосфатно-буферним сольовим розчином, або будь-яким відповідним розчином, що містить неорганічні солі, з тією ж самою ізотонічністю, що і фізіологічне середовище. Композиції даного винаходу можуть бути придатними для будь-якого шляху введення, такого як пероральне, парентеральне, назальне або інгаляційне введення. Вони можуть бути в рідкій формі, а також в твердій формі у вигляді однорідної суміші (наприклад, після розпилювальної сушки, ліофілізації і т.п.). Вони можуть бути, наприклад (але не обмежуючись цим), в твердій дозованій формі, такій як желатинові капсули для перорального прийому, або виготовлені у формі для назальних або легеневих інгаляцій. Можуть використовуватися і інші фармацевтично допустимі дозовані форми, такі як суспензії, емульсії, мікро-емульсії, мікронізовані порошки, розчини, суппозиторії, песарії, мікросфери, наносфери, імплантанти і т.п., причому абсорбція або стабільність пептидного лікарського препарату поліпшується шляхом комбінації з неіонною гидротропною речовиною. Пероральні мікроемульсії є переважними формами для введення. Тому композиції даного винаходу можуть бути також ліофілізовані і знову розчинені, і вони можуть додатково включати одну або більш стабілізуючих речовин, а також однин або більше фармацевтично прийнятних наповнювачів. Прикладами інтервалів вмісту речовин в композиції для ін'єкцій є наступні: антид або лГРФ 0,1-2 0,0мг нікотинамід 10-300мг пропіленгліколь 0-800мг водна фаза, достатня до 1,0мл кількість Термін "пептид", як він використовується в цій заявці, означає будь-яку сполуку, утворену з двох або більше амінокислот. У ньому аміногрупа (NH2) однієї амінокислоти сполучається з карбоксильною групою (СООН) іншої, утворюючи пептидний зв'язок. Такі амінокислоти можуть бути такими, що 12 зустрічаються в природі, хімічно синтезованими або модифікованими. Пептиди за цим винаходом мають, звичайно, до 100 амінокислот, переважно, до 50, більш переважно, до 20. Вираження "погано розчинний у водному фізіологічному сольовому розчині", яке використане в даній заявці, означає, що в такому розчині при кімнатній температурі без додавання кислот або основ пептид виявляє розчинність 1мг/мл 0,9% NaCl 0,042мг/мл ФБР 0,032мг/мл Після зберігання при 40°С протягом одного тижня, спостерігалася наступна розчинність: 0,9% NaCl 0,097мг/мл 0,9% NaCl + 5% нікотинаміду 0,875мг/мл Розчини лГРФ (5 і 20мг/мл) готували у воді, pH якої доводили до pH 3,0, і додавали 5% або 20% нікотинаміду. Шляхом підвищення pH визначали точку преципітації лГРФ. Результати показують здатність нікотинаміду солюбілізувати лГРФ навіть при високому pH. Результати представлені в таблиці 13. Стабільність лГРФ у водних розчинах. Шляхом включення нікотинаміду у водні розчини лГРФ було відкрито, що речовина також володіє здатністю значно знижувати хімічне руйнування цього пептиду. ГРФ, як відомо, швидко руйнується у водному розчині шляхом дезамідіювання, швидкість якого підвищується при підвищенні pH вище області 45. Водні розчини лГРФ готували у воді, pH якої доводили до 7,5, що 25 містить або 0,5 або 20% нікотинаміду, і зберігали протягом терміну до 12 тижнів при 4°С і 40°С. Дані, представлені в таблицях 14 і 15, показують, що швидкість дезамідіювання істотно знижувалася в присутності нікотинаміду, зокрема швидкість дезамідіювання у аспарагіну в положенні 8 в лГРФ, причому розчини більш стабільні при більш низькій температурі. Оскільки дезамідіювання відбувається в розчині, активність води є важливим чинником управління швидкістю розкладання. Тому, оскільки лГРФ розчинний в пропіленгліколі, була вивчена стабільність лРГФ в розчині цього розчинника, щоб зрозуміти дію на реакції дезамідіювання. Дані, представлені в таблицях 16 і 17, показують, що розкладання шляхом дезамідіювання у аспарагіну в положенні 8 було знижене до дуже низького рівня в цьому розчині. Дані також показують, що лГРФ, розчинений в пропіленгліколі, виявляє істотне руйнування шляхами, які поки ще повністю не з'ясовані, з утворенням численних нових продуктів розкладання, що дають піки елюювання після основного піка для лГРФ при застосованих умовах хроматографії. За цими даними можна ясно побачити, що додавання нікотинаміду до розчину лГРФ в пропіленгліколі викликає істотне зниження рівня цих продуктів розкладання. На швидкість розкладання знову впливала температура розчинів, причому розчини при 4°С були більш стабільні, ніж при 40°С. Щоб оцінити дію поєднання обох, нікотинаміду і пропіленгліколю, у водному розчині лГРФ, 10мг лГРФ розчиняли в розчині, що містить 60% пропіленгліколю і 20% нікотинаміду, доведеного до pH 7,5. Дані, представлені в таблицях 18, 19 і 20, показують, що розкладання шляхом дезамідіювання у аспарагіну в положенні 8 знижувалося в цьому розчині до дуже низького рівня і при 4°С швидкість розкладання була досить низькою, щоб її враховувати при фармацевтичному застосуванні. Ці дані свідчать про стабілізацію водних розчинів лГРФ шляхом використання нікотинаміду і включення пропіленгліколю. Вважають, що для різного фармацевтичного застосування композиція може бути оптимізована, або що інші неводні розчинники можуть бути використані для зниження активності води. Однак для ефективної фармацевтичної дії необхідна стабілізуюча дія нікотинаміду. Таблиця 1 Стабільність розчинів антиду 0,1 мг/мл при pH 2, 3 і 4; темп. = +4°С і -20°С -20°С + 4°С Рецептура Випробування 5 тиж. 5 тиж. 12 тиж. Т=0 рН=2 Чистота (%) 99,60 87,50 98,80 98,20 Чистота (%) 99, 60 93, 50 99,40 99,10 Чистота(%) 99,50 99,30 99,20 99,20 рН=3 рН=4 Таблиця 2 Стабільність розчинів антиду 0,1мг/мл при pH 2, 3 і 4; темп. = +25°С і +40°С -25°С + 40°С Рецептура Випробування 5 тиж. Т=0 12 тиж. 5 тиж. 12 тиж. рН=2 Чистота (%) 99,6 95,8 92,0 83,4 65,0 Чистота (%) 99,6 99,0 98,8 97,7 95,6 Чистота (%) 99,5 99, 6 99,4 99,4 99,1 рН=3 рН=4 Таблиця 3 Розчинність антиду в ВДІ Антид (номінальна додана кількість, мг/мл) 50 10 1 Вигляд рН гель опалесціювальний прозорий НВ 4,40 5,00 Розчинність (мг/мл) НВ 8,13 1,00 Таблиця 4 Розчинність антиду в ВДІ + 4% оцтової кислоти Антид (номінальна додана кількість, мг/мл) Вигляд 100 гель 50 гель 33 гель 25 опалесціювальний pH НВ НВ НВ 3,18 Таблиця 5 Розчинність антиду в ВДІ + 2% оцтової кислоти Антид (номінальна додана кількість, мг/мл) Вигляд 40 гель 20 опалесціювальний 10 прозорий pH НВ 3,31 3,31 Таблиця 6 Розчинність антиду в фізіологічному розчині + 1% оцтової кислоти Антид (номінальна додана кількість, Вигляд мг/мл) 10 гель 5 опалесціювальний рН НВ 3,12 Таблиця 7 Вплив pH на розчинність антиду уфізіологічному розчині Антид (номінальна додана pH Вигляд кількість, мг/мл) 1 5,04 опалесціювальний 10 4,61 гель 10 3,01 опалесціювальний Розчинність (мг/мл) 0,025 НВ 2,23 Таблиця 8 Вплив 1,5% гідротропних речовин на розчинність Антид (номінальна додана кількість, Гідротропна мг/мл) речовина 10 нікотинамід 10 сахарин саліцилат 10 натрію антиду у фізіологічному розчині Розчинність РН Вигляд (мг/мл) 4,89 гель НВ 4,61 гель НВ 5,08 гель НВ тіамін гідрохлорид 10 3,94 гель НВ Таблиця 9 Вплив 15% гідротропних речовин на розчинність антиду у фізіологічному розчині Антид Гідротропна Розчинність pH Вигляд (номінальна додана речовина (мг/мл) кількість, мг/мл) 5 нікотинамід 5,79 опалесціювальний 3,32 5 саліцилат натрію 5,81 опалесціювальний 0,21 тіамін 5 3,30 опалесціювальний 3,01 гідрохлорид 5 бензоат натрію 6,69 опалесціювальний 0,072 гістидин 5 4,17 опалесціювальний 0,076 гідрохлорид (5%) фенілаланін 5 4,59 Опалесціювальний 0,066 11 79- \ Таблиця 10 Вплив концентрації нікотинаміду на розчинність Антид (номінальна Нікотинамід (%) pH Додана кількість мг/мл) 1 5 HB 5 10 5,68 5 15 5,76 10 20 5,64 антиду у фізіологічному розчині Розчинність Вигляд (мг/мл)) опалесціювальний 0,47 опалесціювальний 1,40 опалесціювальний 3,23 опалесціювальний 8,49 Таблиця 11 Антид (мг/мл) 1 1 10 10 Стабільність препаратів нікотинаміду/антиду при 4°, 25° і 40°С + 4°С +25°С Нікотинамід 1 (%) 1 тиж. 4 тиж. 12 тиж. 1 тиж. 4 тиж. 12 тиж. тиж. 5 1,0 НВ 0,9 1,0 0,9 0,3 1,0 1,0 25 1,0 НВ 1,0 1,1 1,0 1,0 1,1 1,0 5 9,7 10,3 10,0 10,5 гель гель гель гель 25 9,8 НВ 10,1 НВ 9,8 9,5 11,1 10,7 +40°С 4 тиж. 12 тиж. 0,9 1,0 гель 9,4 1,0 1,1 гель 10,2 Таблиця 12 Час (хв.) 0 5 15 ЗО 60 120 Вплив розведення 1:3 розчину в ФБР антиду/15% вага, нікотинаміду Ант. 5мг/мл Нік. Ант. 3мг/мл Нік. Ант. 2мг/мл Нік. Ант. 1мг/мл Нік. Ант. 4мг/мл Нік. 15% 15% 15% 15% 15% Розведення 1:3 Розведення 1:3 Розведення 1:3 Розведення 1:3 (ФБР) Розведення 1:3 (ФБР) (ФБР) (ФБР) (ФБР) опалесціювальний опалесціювальний прозорий прозорий прозорий осад осад прозорий прозорий прозорий осад осад осад прозорий прозорий осад осад осад прозорий прозорий осад осад осад прозорий прозорий осад осад осад прозорий прозорий осад осад осад прозорий прозорий Таблиця 13 Розчинність лГРФ у водних розчинах нікотинаміду Розчини ГРФ (5мг/мл в Н2О при pH 3) ГРФ (20мг/мл в Н2О при pH 3) Первинний pH 4,93 4,94 Точка випадання осаду (pH) 10,09 7,20 ГРФ (5мг/мл в Н2О при pH 3) + 5% нікотинаміду) ГРФ (20мг/мл в Н2О при pH 3) + 5% нікотинаміду) ГРФ (5мг/мл в Н2О при pH 3) + 20% нікотинаміду) ГРФ (20мг/мл в Н2О при pH 3) + 20% нікотинаміду) 5,65 5,30 6,76 5,52 12,28 10,10 12,01 12,38 Значення (для абревіатур в таблицях 1-13): НВ = не визначено; тиж. = тижні/ темп. = температура; ВДІ = вода для ін'єкцій, Ант. = антид; нік. = нікотинамід Таблиця 14 Стабільність при +40°С розчинів ГРФ (2мг/мл) + нікотинамід, доведених до pH 7,5 1 тиждень Площі хроматографічних піків (%). У порядку елюювання % нікотинаміду вчв=0,76 β-Asp8 β-Asp3 SUCC-N8,? ГРФ1-29 Succ-D3+Asp 8 0 0,8 16,7 3,8 0,3 68,0 нп 5,2 5 0,5 13,4 3,5 0,3 73,9 0,9 3,9 20 0,5 11,5 3,6 0,3 77,1 0,9 3,1 4 тижні Площі хроматографічних піків (%). SUCC% нікотинаміду вчв=0,76 β-Asp8 β-Asp3 N8? ГРФ1-29 Succ-DST+Asp 8 0 6,2 37,8 5,7 2,7 22,2 2,9 10,4 5 4,9 33,3 6,4 1,9 31,5 2,4 9,0 20 4,2 28, 6 7,5 2,1 39,5 2,6 7,6 Таблиця 15 Стабільність при +4°С розчинів лГРФ (2мг/мл) + нікотинамід, доведених до pH 7,5 Площі хроматографічних піків (%). У порядку елюювання % нікотинаміду 4-29? β-Asp8 β-Asp3 Succ-N8? ГРФ1-29 Succ-D3?+Asp 8 Час 0 0,1 0,2 0 0,3 97,6 нп 0, 6 4 тижні 0 0 1,4 0,1 0,1 95,4 нп 0,8 5 0 0,9 0/1 0 96,8 нп 0,6 20 0 0,8 0,1 0 97,4 нп 0,6 8 тижнів 0 0 2,4 0,2 0,1 93,2 нп 1/1 5 0 1/5 0,2 0,1 95,8 нп 0,9 20 0 1/4 0,2 0,1 96,3 нп 0,8 12 тижнів 0 1,06 3,39 0,27 0,07 89, 9 нп 1,29 5 0,28 2,12 0,26 0,11 94,0 нп 0,97 20 0,15 1, 95 0,26 0,10 95,1 нп 0,97 Значення (для абревіатур в таблицях 14-15): НП = немає пояснення. Succ-D3 + Asp d може елююватись у вигляді перекриваючого піка; ? = необхідне подальше визначення властивостей для підтвердження ідентифікації піка; вчв = відношення часу втримання. Таблиця 16 Стабільність при +4°С розчинів лГРФ (5 мг/мл) в пропіленгліколь + нікотинамід, доведених до pH 7,5 1 тиждень 4 ° С Площі хроматографічних піків (%). У порядку елюювання % нікотинаміду Met-Ox P-Asp 8 Succ-NS 1-290Н ГРФ1-29 Succ-DS+Asp 8 Вчв 1,07 Партія 1299201 0,04 0 0,6 0,3 97,7 0,4 0,4 0 0 0,2 0 0,2 0,4 95,4 0,5 1,0 20 0,3 0 0,4 0,4 97,5 0,4 0,7 1 тиждень 4°С Площі хроматографічних піків (%). У порядку елюювання (Продовження) вчв 1,08 вчв 1,11 вчв 1,13 вчв 1,17 вчв 1,18 вчв 1,20 вчв 1,23 вчв 1,39 0 0,2 0,2 0,4 — — 0,9 0,4 од 20 — — — 0,3 0,2 — 0,2 4 тижні 4°С Площі хроматографічних піків (%). У порядку елюювання % нікотинаміду Met-Ox P-Asp 8 Succ-NS 1-290Н ГРФ1-29 Succ-03+Asp 8 вчв 1,07 0 од 0 0,2 0,3 95,0 0,4 0,9 0,4 20 0,4 про 0,3 0,3 97,1 0,4 1,0 0,1 4 тижні 4°С Площі хроматографічних піків (%). У порядку елюювання (Продовження) вчв 1,08 вчв 1,11 вчв 1,13 вчв 1,17 вчв 1,18 вчв 1,20 вчв 1,23 вчв 1,36 0 20 8 тижнів 4°С % нікотинаміду 0 20 8 тижнів 4°С (Продовження) 0 20 0,2 0,1 Met-Ox 0,3 0,5 вчв 1,10 0,5 0,1 0, 6 — 1,6 0,3 — 0,1 — 0,1 — — Площі хроматографічних піків (%). У порядку елююювання P-Asp 8 Succ-NS 1-290Н ГРФ1-29 Succ-DS+Asp 8 0 0,2 0,3 92,2 1,2 нп 0 0,3 0,3 95,7 1,8 нп Площі хроматографічних піків (%). Упорядку елюювання вчв 1,11 вчв 1,13 вчв 1,17 вчв 1,18 вчв 1,20 вчв 1,23 0,9 2,6 — 0,5 — 0,1 0,1 — 0,2 — 0,1 — 0,1 0,1 Вчв 1,07 0,7 0,1 вчв 1,36 — 0,1 Таблиця 17 Стабільність при +40°С лГРФ (5мг/мл) в розчинах проліленгліколю + нікотинаміду, доведених до pH 7,5 1 тиждень 40° С Площі хроматографічних піків (%). У порядку елюювання % нікотинаміду Met-Ox P-Asp8 SUCC-N8 1-290Н ГРФ1-29 Бисс-БЗ+АБр 0 Вчв 1,07 0 0,3 0 0 0,1 82,9 1,1 1,2 — 20 1,6 0 0,3 0,2 88,0 1,3 1,6 1 тиждень 40°С Площі хроматографічних піків (%). У порядку елюювання (Продовження) вчв 1,08 вчв 1,11 вчв 1,13 вчв 1,17 вчв 1,18 вчв 1,20 вчв 1,23 вчв 1,39 0 0,5 3,2 1,4 0,3 3,9 2,6 1,37 0,3 20 0,3 1,4 0,4 0 1,8 1,0 1,2 0 4 тижні 40°С Площі хроматографічних піків (%). У порядку елюювання % нікотинаміду Met-Ox P-Asp 8 SUCC-N8 1-290Н ГРФ1-29 SUCC-D3+ASP8 вчв 1,07 0 0,5 0 0 0 44, б 1,7 1,5 15,1 20 10, 9 0,9 0 0,4 43,1 1,3 4,2 10,3 4 тижні 40°С Площі хроматографічних піків (%). У порядку елюювання (Продовження) вчв 1,08 вчв 1,11 вчв 1,13 вчв 1,17 вчв 1,18 вчв 1,20 вчв 1,23 інші 0 15,3 8,4 1,4 3,4 1,4 2,1 1,2 3,4 (n=8) 20 8,9 4,3 2,5 2,0 2,0 0,9 8,4 (n=7) n = число додаткових піків, присутніх на хроматограмі. Таблиця 18 Стабільність при +4°3 лГРФ (10мг/мл) в 60% пропіленгліколю + 20% нікотинаміду, 20% НгО, доведених до pH 7,5 Площі хроматографічних піків (%) Піки ГРФ 1-29 4-29? β-Asp8 β-Asp3 SUCC-N8 Succ-DS+Asp 8 окислення (%) Відношення RT 0,65-0,67 0,87 0,89 0,96 0,98 1,06 Т=0 98,17 0,07-0,07 — 0,04 0,38 0,60 4 тижні 97,97 0,06-0,07 0,03 0,03 0,03 0,28 0,84 8 тижнів 97,97 0,07-0,11 0,03 0,04 0,03 0,21 0,93 12 тижнів 97,62 0,07-0,07 0,08 0,06 0,09 0,16 0,93 Таблиця 19 Стабільність при +25°С лГРФ (10мг/мл) в 60% пропіленгліколю + 20% нікотинаміду, 20% Н2О, доведених до pH 7,5 Площі хроматографічних піків (%) Піки ГРФ 1-29 4-29? P-Asp8 P-Asp3 Succ-N8 Succ-DS+AspS окислення (%) Відношення RT 0,65-0,67 0, 87 0,89 0,96 0,98 1,06 Т=0 98,17 0,07-0,07 — 0,04 — 0,38 0,60 4 тижні 96,28 0,08-0,09 0,03 0,27 0,85 0,15 1,34 8 тижнів 93,69 0,12-0,15 0,03 0,47 2,34 0,08 1,57 12 тижнів 90,94 0, 12-0,14 0,10 0,60 3,54 0,10 1,73 Таблиця 20 Стабільність при +40°С лГРФ (10мг/мл) в 60% пропіленгліколю + 20% нікотинаміду, 20% Н2О, доведених до pH 7,5Таблиця 20 Площі хроматографічних піків (%) ГРФ 1-29 Т=0 4 тижні 98,17 84,06 Списа окислення (%) 0,07-0,07 0,15-0,16 Rtr=0,76 P-Asp8 P-Asp3 Succ-N8 Succ-DS+Asp 8 0, 22 0,04 1,75 — 8,59 0,38 0,10 0,60 2,18 Література Bongers, J., et al. Int. J. Peptide. Protein Res. 39, -364-374, 1992; Cannon I.E., J. Pharm. Sei., 84, 953-958, 1995; Felix A.M. et al., Peptides, editors: Giralt E. and Andreu D., pp 732-733, Escom Publishers 1991; Friedman, A.R. et al. Int. J. Peptide. Protein Res. 37, 14-20, 1991; Golightly L., et al., Med To xicol., З, 128-165, 1988; Graham C.W. et al., Anaesthesia & Analgesia, 56, 409-13, 1977; Jain N.K. et al. The Eastern Pharmacist, November, 51-54, 1986 Physicians Desk Reference, Librium monograph, 47 th Edition, 1993; Leone Bay A, et al., J. Meg Chem., 39(13), 2571-2578, 1996; Maa Y.F. et al.. Int. J. Pharm., 140(2): 155-168, 1996; Rasool et al., J. Pharm. Sсi., 80(4), 387-393, 1991; Sasaki H., Biol. Pharm. Bull. (Japan), 18/1, 169-171, 1995; Serono Symposia USA, Growth hormone secretagogues, Chapter 3, editors, B.B. Bereu & R.F. Walker, Springer-Verlag, New York, 1996; Spiegel A.J. et al., J. Pharm. Sei., 52, 917-927, 1963; Wang Y-C.J. et al., J. Parenter. Drug Assoc., 34, 452-462, 1980; Yalkowsky S.H. et al., Drug Int. Clin. Pharm., 11, 417-419, 1977; Yalkowsky S.H. et al., J. Pharm. Sсi., 74, 416-412, 1986.
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions of peptides poorly soluble in physiological saline solution
Назва патенту російськоюФармацевтические композиции пептидов с низкой растворимостью в физиологической среде
МПК / Мітки
МПК: A61K 38/25, A61K 38/09, A61K 47/22
Мітки: розчинністю, фармацевтична, низькою, композиція, фізіологічному, пептидів, середовищі
Код посилання
<a href="https://ua.patents.su/11-62969-farmacevtichna-kompoziciya-peptidiv-z-nizkoyu-rozchinnistyu-u-fiziologichnomu-seredovishhi.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція пептидів з низькою розчинністю у фізіологічному середовищі</a>
Попередній патент: Спосіб електрохімічного рафінування міді
Наступний патент: Покриття зварювальних електродів
Випадковий патент: Спосіб розвантаження сипучих матеріалів з залізничного вагона