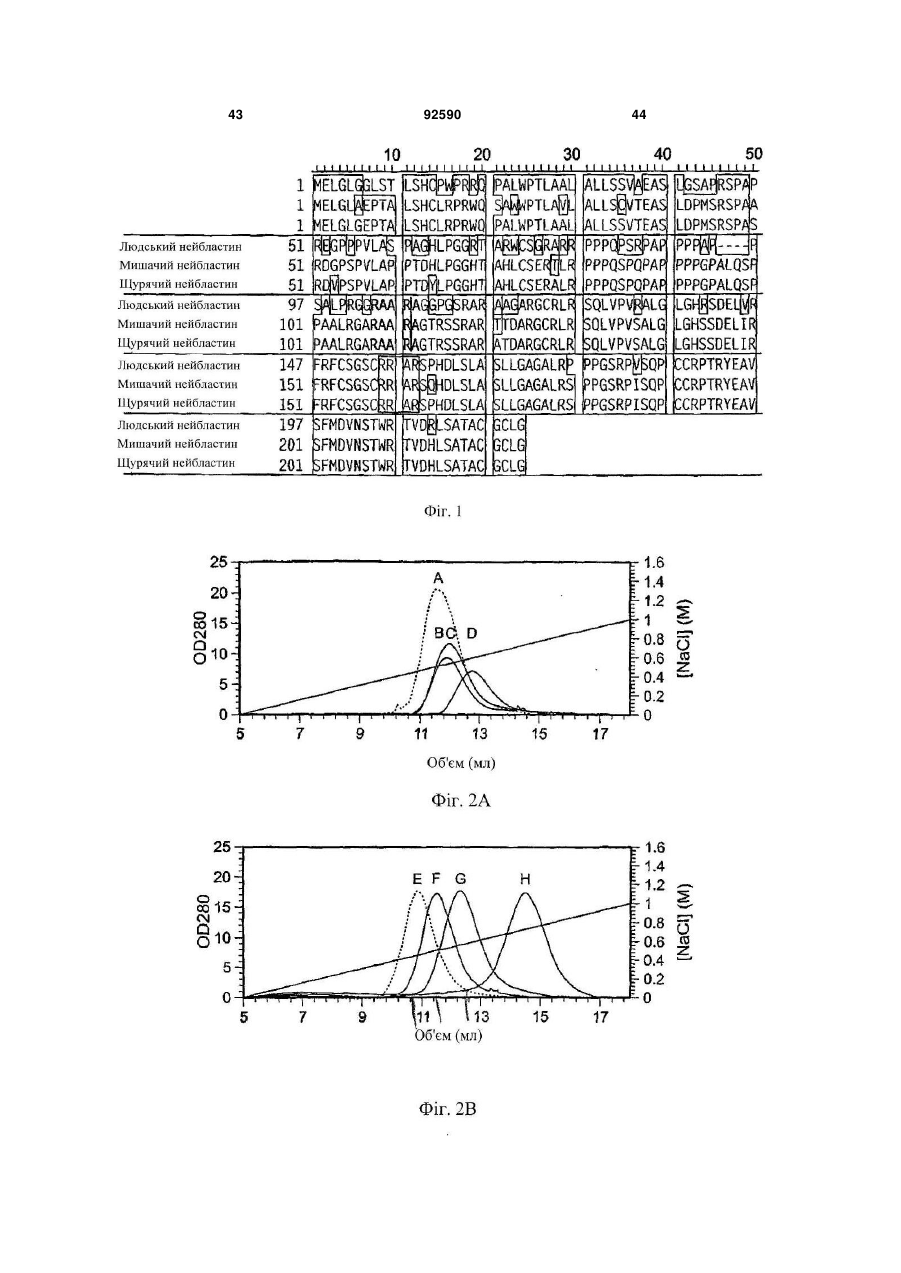
Варіанти нейбластину
Номер патенту: 92590
Опубліковано: 25.11.2010
Автори: Сільвіан Лаура, Пепінскі Р. Блейк, Россомандо Ентоні
Формула / Реферат
1. Поліпептид, що містить амінокислотну послідовність, принаймні на 80 % ідентичну амінокислотам 15-113 в послідовності SEQ ID NO:1, де амінокислотна послідовність містить заміщену амінокислоту, відмінну від аргініну в положенні, відповідному позиції 48, і в положенні, відповідному позиції 49 в SEQ ID NO:1,
де поліпептид після димеризації зв'язується з комплексом, що містить GFRalpha3 і RET і де поліпептид має знижену здатність зв'язувати гепарин в порівнянні з поліпептидом нейбластином дикого типу з амінокислотною послідовністю SEQ ID NO:1.
2. Поліпептид за п. 1, де залишок аргініну в позиції 48 і залишок аргініну в позиції 49 в SEQ ID NO:1 заміщені на неконсервативні амінокислотні залишки.
3. Поліпептид за п. 1, де залишок аргініну в позиції 48 і залишок аргініну в позиції 49 в SEQ ID NO:1 заміщені на глутамінову кислоту.
4. Поліпептид за пп. 1-3, де амінокислотна послідовність принаймні на 90 % ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1.
5. Поліпептид за будь-яким з пп. 1-3, де амінокислотна послідовність принаймні на 95 % ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1.
6. Поліпептид за будь-яким з пп. 1-3, де амінокислотна послідовність принаймні на 98 % ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1.
7. Поліпептид, що містить амінокислоти 15-113 послідовності SEQ ID NO:5.
8. Поліпептид, що містить амінокислоти 10-113 послідовності SEQ ID NO:5.
9. Поліпептид, що містить амінокислотну послідовність SEQ ID NO:5.
10. Поліпептид, що складається з амінокислот 15-113 послідовності SEQ ID NO:5.
11. Поліпептид, що складається з амінокислот 10-113 послідовності SEQ ID NO:5.
12. Поліпептид, що складається з амінокислотної послідовності SEQ ID NO:5 або SEQ ID NO:7.
13. Димер, який містить два будь-яких поліпептиди за будь-яким з пп. 1-12.
14. Кон'югат, який містить поліпептид за будь-яким з пп. 1-12, який зв'язаний з неприродним полімером.
15. Кон'югат за п. 14, в якому неприродний полімер являє собою поліалкіленгліколь.
16. Кон'югат за п. 14, в якому поліалкіленгліколь являє собою поліетиленгліколь.
17. Кон'югат за будь-яким з пп. 14-16, в якому неприродний полімер зв'язаний з поліпептидом на його амінокінці.
18. Кон'югат за будь-яким з пп. 14-16, в якому неприродний полімер зв'язаний з варіантом поліпептиду нейбластину за внутрішнім сайтом для кон'югування полімеру.
19. Злитий білок, який містить поліпептид за будь-яким з пп. 1-12 і гетерологічну амінокислотну послідовність.
20. Фармацевтична композиція, яка містить поліпептид за будь-яким з пп. 1-12, димер за п. 13, кон'югат за будь-яким з пп. 14-18 або злитий білок за п. 19, а також фармацевтично прийнятний носій або ексципієнт.
21. Нуклеїнова кислота, яка містить послідовність, що кодує поліпептид за будь-яким з пп. 1-12.
22. Експресуючий вектор, який містить нуклеїнову кислоту за п. 21.
23. Клітина, яка містить експресуючий вектор за п. 22.
24. Спосіб одержання поліпептиду, де спосіб включає:
одержання клітини за п. 23, і
культивування клітини в умовах, які сприяють експресії нуклеїнової кислоти.
25. Спосіб лікування або запобігання порушенню нервової системи у ссавця, де спосіб включає введення ссавцеві терапевтично ефективної кількості поліпептиду за будь-яким з пп. 1-12, димеру за п. 13, кон'югата за будь-яким з пп. 14-18 або злитого білка за п. 19.
26. Спосіб лікування нейропатичного болю у ссавця, де спосіб включає введення ссавцеві терапевтично ефективної кількості поліпептиду за будь-яким з пп. 1-12, димеру за п. 13, кон'югата за будь-яким з пп. 14-18 або злитого білка за п. 19.
27. Спосіб активації рецептора RET у ссавця, де спосіб включає введення ссавцеві ефективної кількості поліпептиду за будь-яким з пп. 1-12, димеру за п. 13, кон'югата за будь-яким з пп. 14-18 або злитого білка за п. 19.
28. Спосіб за будь-яким з пп. 25-27, в якому ссавцем є людина.
Текст
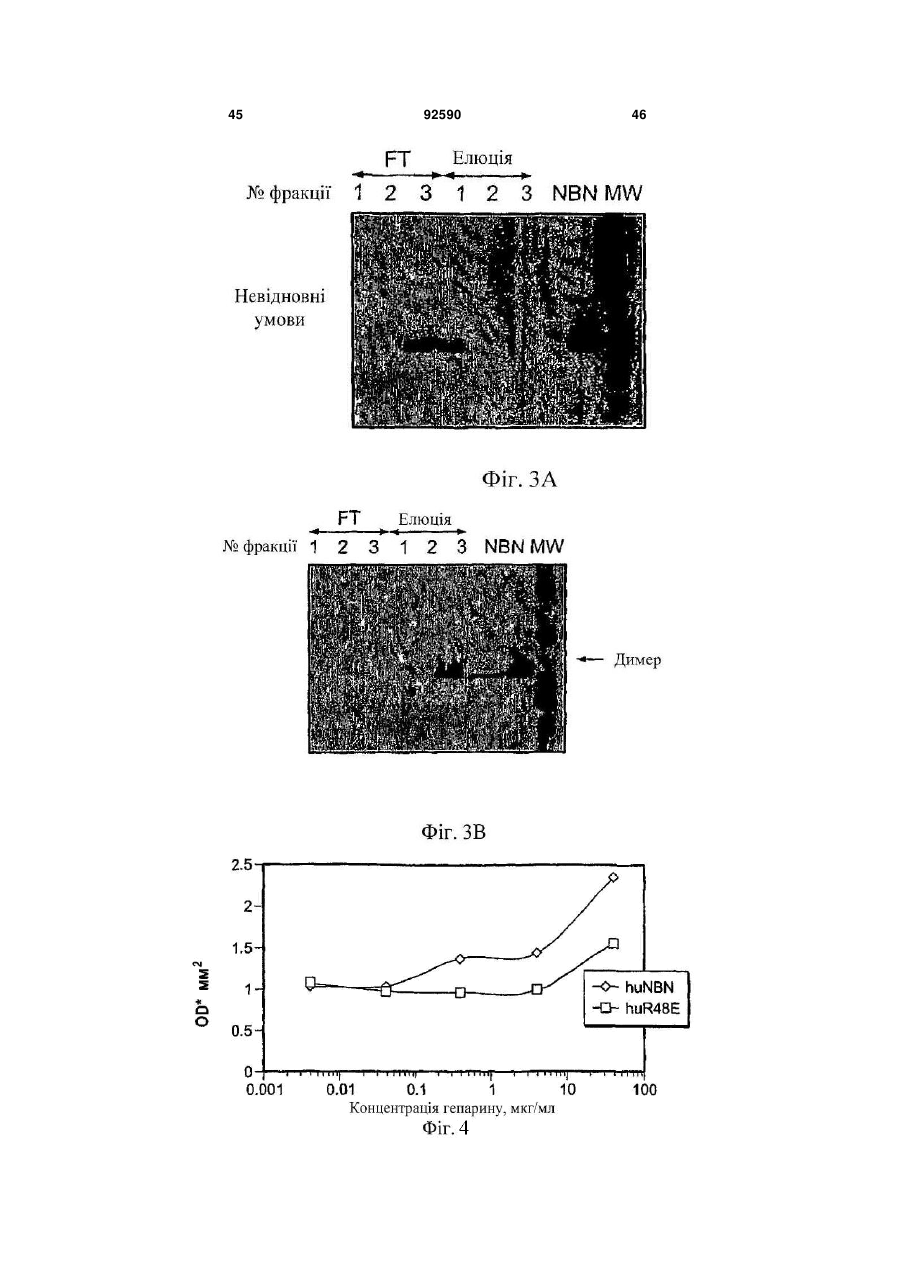
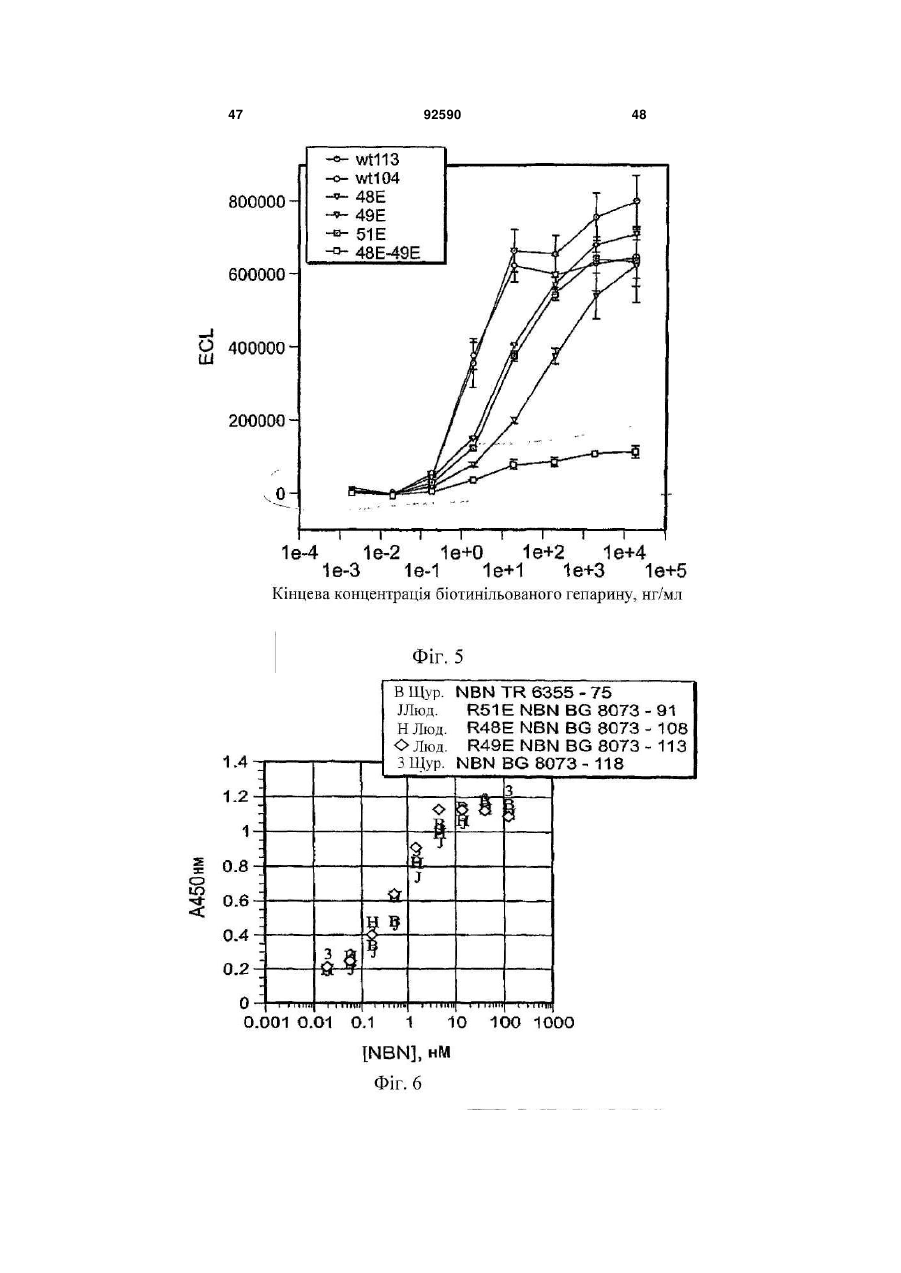
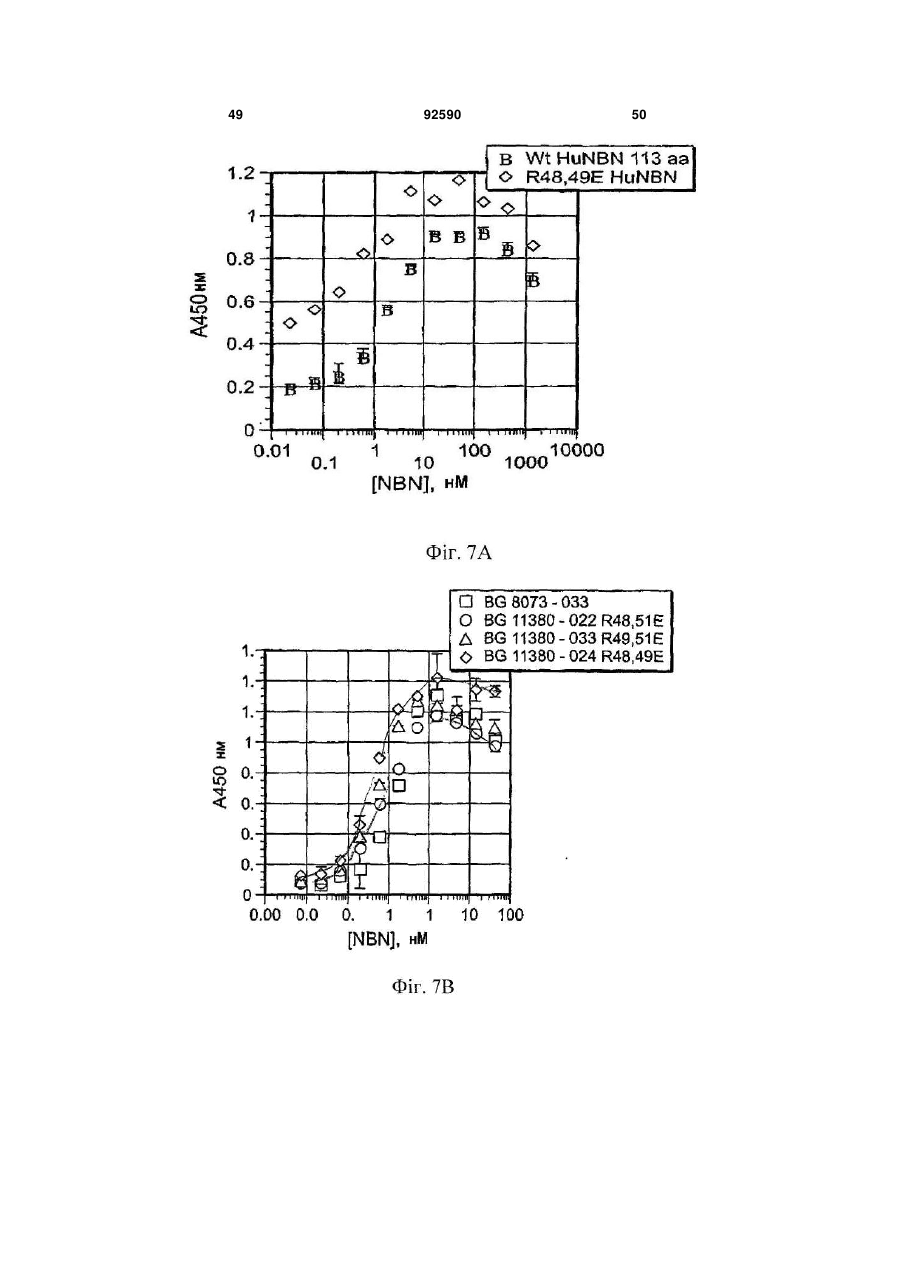
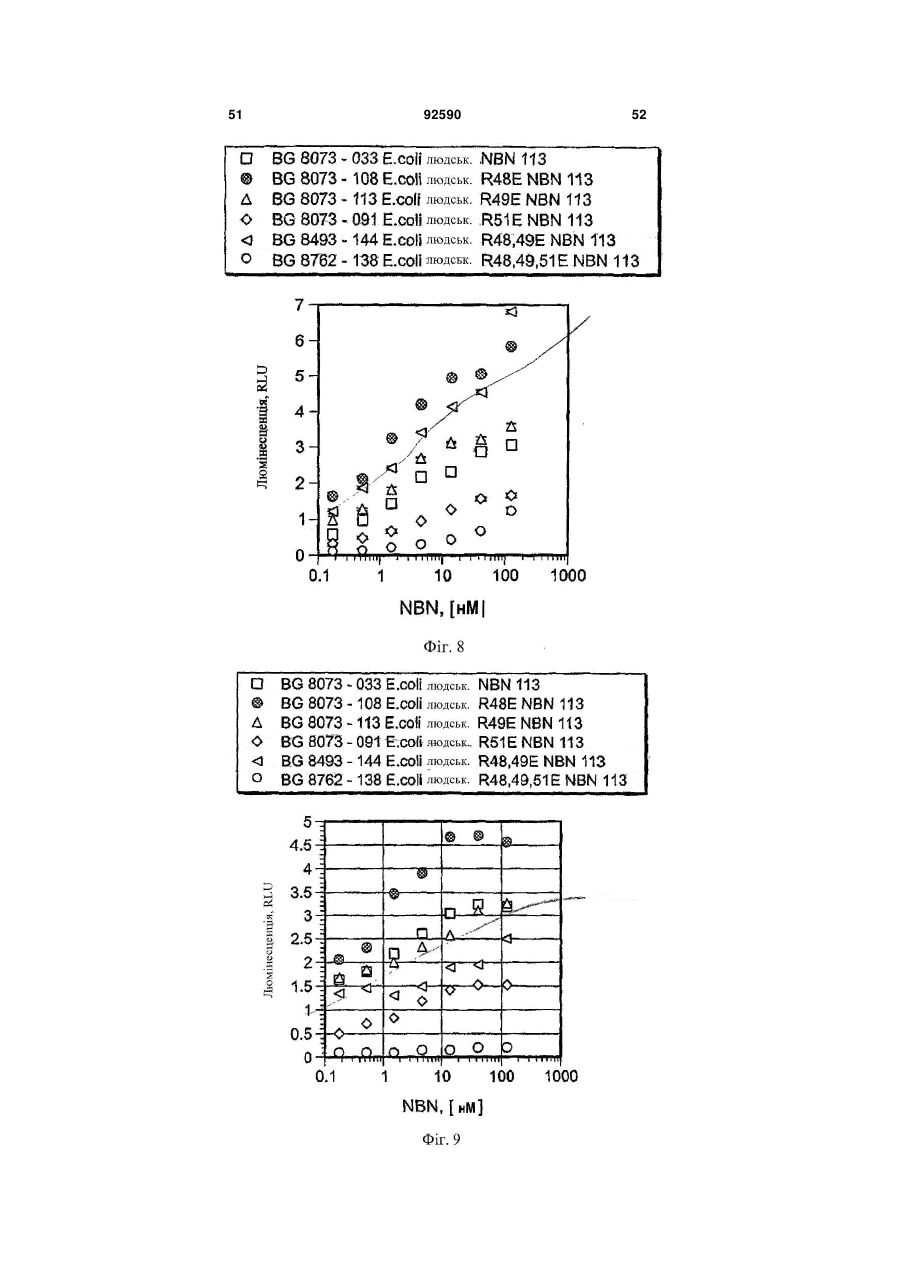
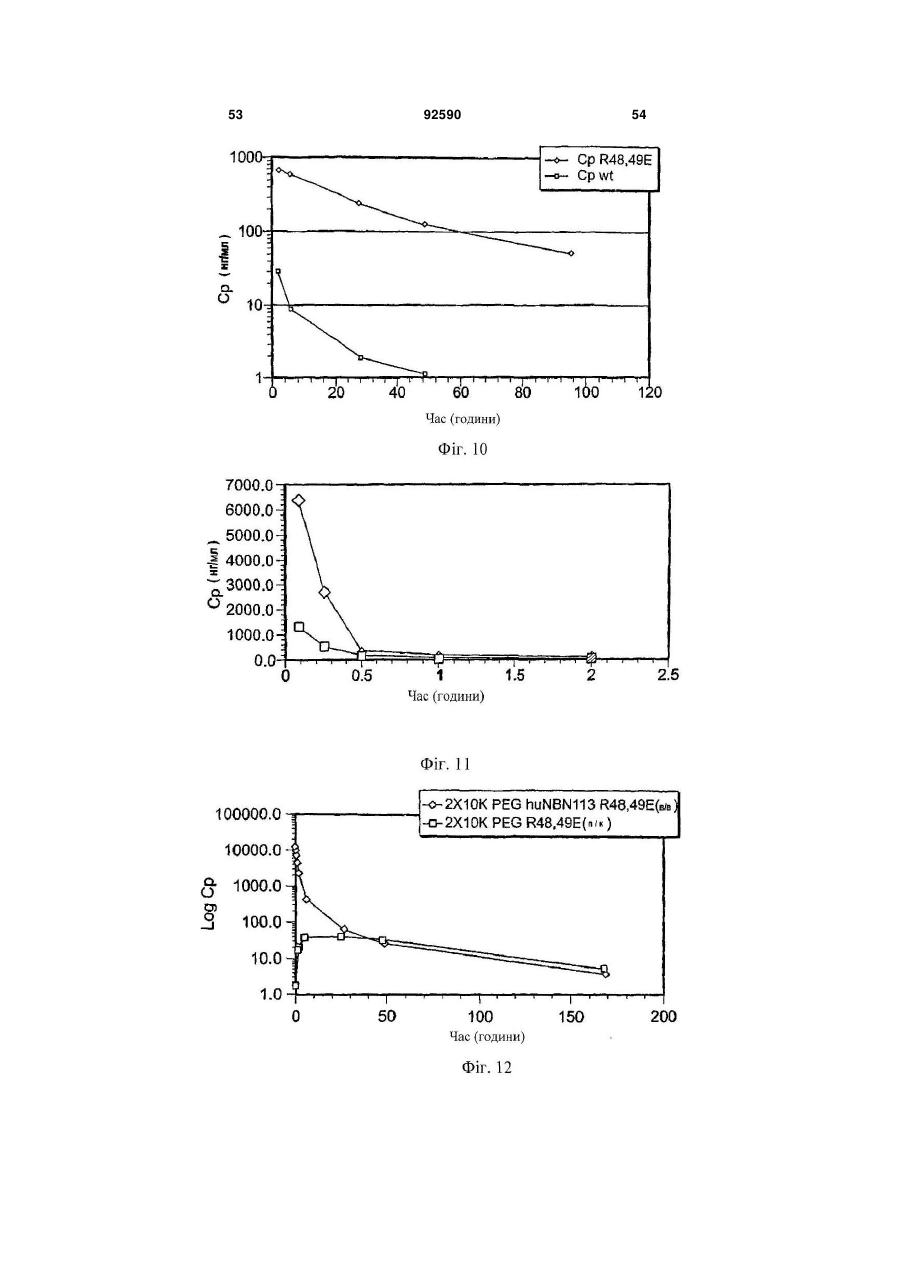
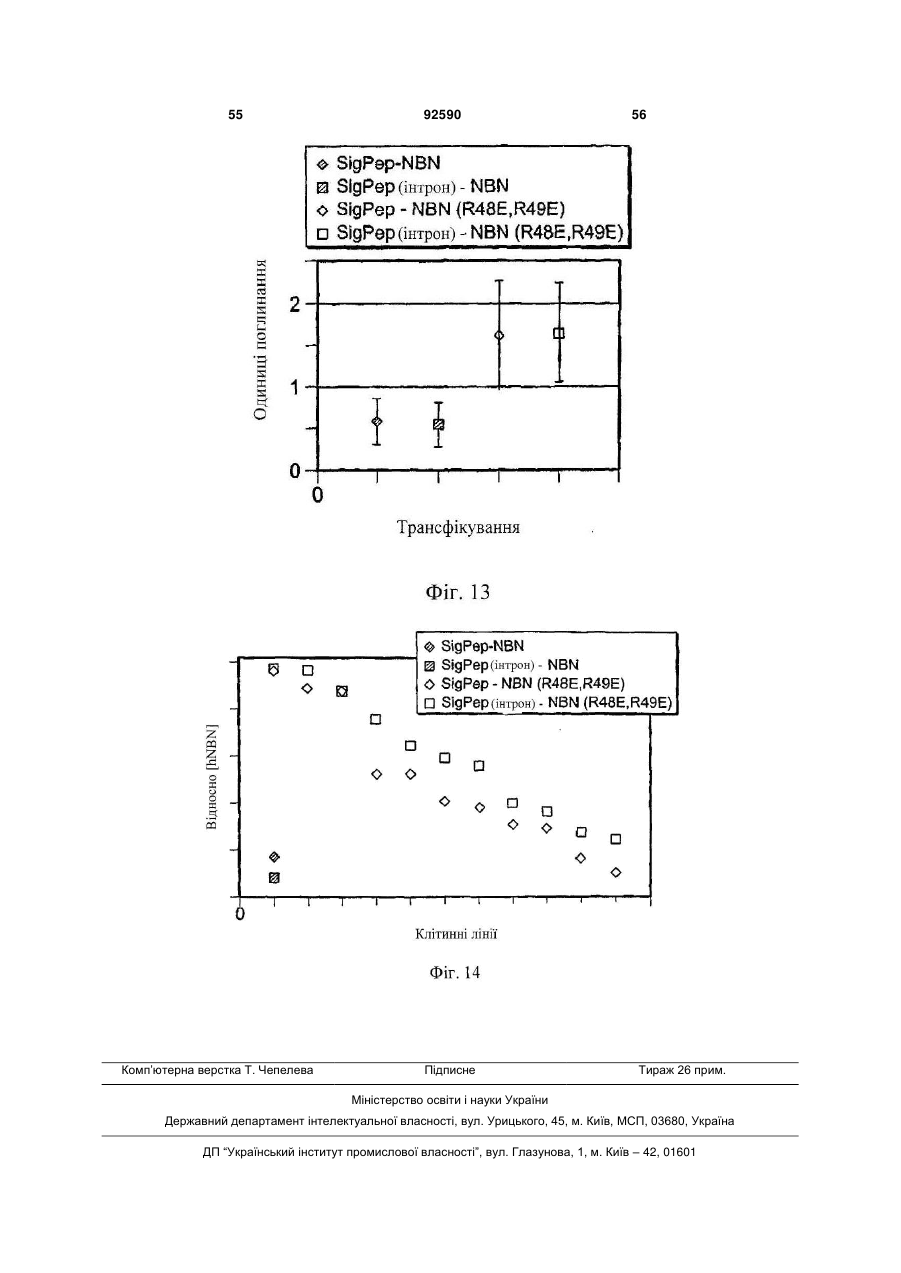
1. Поліпептид, що містить амінокислотну послідовність, принаймні на 80% ідентичну амінокислотам 15-113 в послідовності SEQ ID NO:1, де амінокислотна послідовність містить заміщену амінокислоту, відмінну від аргініну в положенні, відповідному позиції 48, і в положенні, відповідному позиції 49 в SEQ ID NO:1, де поліпептид після димеризації зв'язується з комплексом, що містить GFRalpha3 і RET і де поліпептид має знижену здатність зв'язувати гепарин в порівнянні з поліпептидом нейбластином дикого типу з амінокислотною послідовністю SEQ ID NO:1. 2. Поліпептид за п.1, де залишок аргініну в позиції 48 і залишок аргініну в позиції 49 в SEQ ID NO:1 заміщені на неконсервативні амінокислотні залишки. 3. Поліпептид за п.1, де залишок аргініну в позиції 48 і залишок аргініну в позиції 49 в SEQ ID NO:1 заміщені на глутамінову кислоту. 4. Поліпептид за пп.1-3, де амінокислотна послідовність принаймні на 90% ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1. 5. Поліпептид за будь-яким з пп.1-3, де амінокислотна послідовність принаймні на 95% ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1. 2 (19) 1 3 92590 4 23. Клітина, яка містить експресуючий вектор за п.22. 24. Спосіб одержання поліпептиду, де спосіб включає: одержання клітини за п.23, і культивування клітини в умовах, які сприяють експресії нуклеїнової кислоти. 25. Спосіб лікування або запобігання порушенню нервової системи у ссавця, де спосіб включає введення ссавцеві терапевтично ефективної кількості поліпептиду за будь-яким з пп.1-12, димеру за п.13, кон'югата за будь-яким з пп.14-18 або злитого білка за п.19. 26. Спосіб лікування нейропатичного болю у ссавця, де спосіб включає введення ссавцеві терапевтично ефективної кількості поліпептиду за будьяким з пп.1-12, димеру за п.13, кон'югата за будьяким з пп.14-18 або злитого білка за п.19. 27. Спосіб активації рецептора RET у ссавця, де спосіб включає введення ссавцеві ефективної кількості поліпептиду за будь-яким з пп.1-12, димеру за п.13, кон'югата за будь-яким з пп.14-18 або злитого білка за п.19. 28. Спосіб за будь-яким з пп.25-27, в якому ссавцем є людина. Дана заявка запитує пріоритет попередньої заявки номер 60/602825, зареєстрованої 19 серпня 2004p., і попередньої заявки номер 60/694067, зареєстрованої 24 червня 2005р. Зміст кожної з вищезгаданих попередніх заявок включений в дану заявку за допомогою посилання у всій своїй повноті. Винахід належить до хімії білків, молекулярної біології і нейробіології. Нейбластин, також відомий як артемій і еновін, являє собою гомодимерний секретований білок масою 24кДа, що забезпечує виживання нейронів периферичної і центральної нервової системи, таких як допамінергічні нейрони (Baudet et al., 2000, Development, 127:4335; Rosenblad et al., 2000, Моl. Cell Neurosci., 15(2): 199; GenBank AF120274). Ген, що кодує нейбластин, був проклонований і відсеквенований (Roseblad et al., 2000, Моl. Cell Neurosci., 15(2): 199; Baloh et al, Neuron, 21:1291). Нейбластин є членом сімейства лігандів, одержаного з гліальної клітинної лінії нейротрофічного фактора (GDNF). На клітинному рівні, члени сімейства GDNF активують рецепторну тирозинкіназу RET. RET асоціюється з корецептором рецептором сімейства GDNF-альфа (GFRalpha) зв'язаним з глікозилфосфатидилінозитолом (GPI) мембранним білком, що забезпечує лігандну специфічність для RET. Відомі чотири рецептори GFRalpha (GFRalpha 1-4). Нейбластин зв'язується з GFRalpha3 і RET, формуючи трикомпонентний сигнальний комплекс (Baudet et al., 2000, Development, 127:4335; Baloh et al., 1998, Neuron, 21:1291), що локалізується переважно на ноцицептивних сенсорних нейронах (Orozco et al., 2001, Eur. J. Neurosci., 13(11):2177). Дані нейрони детектують біль і пошкодження. Таким чином, нейбластин потенційно може бути застосований для лікування нейропатії, особливо для лікування нейропатичного болю. Нейбластин і інші члени сімейства GDNF входять в суперсімейство трансформуючого фактора росту бета (TGF beta), і таким чином, характеризуються наявністю семи консервативних залишків цистеїну зі схожим розташуванням, що формують структуру цистеїнового вузла (Saarma, 1999, Microsc. Res. Tech., 45:292). Кожний мономер міс тить два дисульфідні зв'язки, що формують закриту петлеву структуру, що охоплює третій дисульфідний зв'язок і таким чином формує структуру тугого вузла. Сьомий цистеїн в кожному з мономерів формує міжмолекулярний дисульфідний зв'язок, ковалентно зв'язуючи мономери і формуючи кінцевий димерний продукт (Rattenholl et al 2000, Biol, 305:523). Члени сімейства TGF бета синтезуються у вигляді пропробілків, секретованих у вигляді зрілого гомодимеру після відщеплення сигнального пептиду і продомену (див., наприклад, Rattenholl et al., 2000, J. Моl. Biol, 305:523; Fairlie et al., 2001, J. Biol. Chem., 276(20): 16911). Як сигнальний пептид, так і продомен забезпечують правильну секрецію членів сімейства TGF бета (Rattenholl et al., 2000, J. Моl. Biol, 305:523; Rattenholl et al., 2001, Eur. J. Biochem., 268:3296). Винахід заснований, принаймні частково, на відкритті зв'язування нейбластину з сульфатом гепарину, і певні амінокислотні залишки поліпептиду нейбластину забезпечують дане зв'язування. Заміщення певних амінокислотних залишків приводило до зниження зв'язування одержаного модифікованого нейбластину з гепарином, а також до збільшення біоактивності і біодоступності модифікованих поліпептидів. У одному з аспектів, даний винахід належить до поліпептиду, що містить амінокислотну послідовність, принаймні на 80% ідентичну амінокислотам 15-113 в послідовності SEQ ID NO:1, де амінокислотна послідовність містить принаймні одну амінокислотну заміну в порівнянні з SEQ ID NO:1, вибрану з групи, що складається з: (і) амінокислоти, відмінної від аргініну в положенні, відповідному позиції 48 в SEQ ID NO:1 (наприклад, аргінін заміщується на неконсервативний амінокислотний залишок, такий як глутамінова кислота); (іі) амінокислоти, відмінної від аргініну в положенні, відповідному позиції 49 в SEQ ID NO:1 (наприклад, аргінін заміщується на неконсервативний амінокислотний залишок, такий як глутамінова кислота); і (ііі) амінокислоти, відмінної від аргініну в положенні, відповідному позиції 51 в SEQ ID NO:1 (наприклад, аргінін заміщується на неконсервативний амінокислотний залишок, 5 такий як глутамінова кислота). Після димеризації поліпептид зв'язується з комплексом, що містить GFRalpha3 і RET. У деяких втіленнях, амінокислотна послідовність містить амінокислоти, відмінні від аргініну в позиціях 48 і 49 в SEQ ID NO:1. Наприклад, залишки аргініну в позиціях 48 і 49 в SEQ ID NO:1 можуть бути заміщені на неконсервативні амінокислотні залишки (наприклад, глутамінову кислоту). У деяких втіленнях, амінокислотна послідовність принаймні на 90%, принаймні на 95% або принаймні на 98% ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1. Також розкривається поліпептид, що містить амінокислоти 15-113 в послідовності SEQ ID NO:2, амінокислоти 15-113 в послідовності SEQ ID NO:3, амінокислоти 15-113 в послідовності SEQ ID NO:4, амінокислоти 15-113 в послідовності SEQ ID NO:5, амінокислоти 15-113 в послідовності SEQ ID NO:8 або амінокислоти 15-113 в послідовності SEQ ID NO:9. У деяких втіленнях, поліпептид містить амінокислоти 10-113 в послідовності SEQ ID NO:2, амінокислоти 10-113 в послідовності SEQ ID NO:3, амінокислоти 10-113 в послідовності SEQ ID NO:4, амінокислоти 10-113 в послідовності SEQ ID NO:5, амінокислоти 10-113 в послідовності SEQ ID NO:8, амінокислоти 10-113 в послідовності SEQ ID NO:9. У деяких втіленнях, поліпептид містить амінокислотну послідовність, наведену в SEQ ID NO:2, амінокислотну послідовність, наведену в SEQ ID NO:3, амінокислотну послідовність, наведену в SEQ ID NO:4, амінокислотну послідовність, наведену в SEQ ID NO:5, амінокислотну послідовність, наведену в SEQ ID NO:8 або амінокислотну послідовність, наведену в SEQ ID NO:9. Також розкривається поліпептид, що містить амінокислотну послідовність, принаймні на 80% ідентичну амінокислотам 15-113 в послідовності SEQ ID NO:1, де амінокислотна послідовність містить принаймні одну амінокислотну заміну в порівнянні з SEQ ID NO:1, вибрану з групи, яка складається з: (і) амінокислоти, відмінної від серину в положенні, відповідному позиції 20 в SEQ ID NO:1 (наприклад, серин заміщується на неконсервативний амінокислотний залишок); (іі) амінокислоти, відмінної від глутаміну в положенні, відповідному позиції 21 в SEQ ID NO:1 (наприклад, глутамін заміщується на неконсервативний амінокислотний залишок); (ііі) амінокислоти, відмінної від гістидину в положенні, відповідному позиції 32 в SEQ ID NO:1 (наприклад, гістидин заміщується на неконсервативний амінокислотний залишок); (iv) амінокислоти, відмінної від аргініну в положенні, відповідному позиції 33 в SEQ ID NO:1 (наприклад, аргінін заміщується на неконсервативний амінокислотний залишок); (ν) амінокислоти, відмінної від аргініну в положенні, відповідному позиції 39 в SEQ ID NO:1 (наприклад, аргінін заміщується на неконсервативний амінокислотний залишок); (vi) амінокислоти, відмінної від серину в положенні, відповідному позиції 46 в SEQ ID NO:1 (наприклад, серин заміщується на неконсервативний амінокислотний залишок); (vii) амінокислоти, відмінної від аргініну в положенні, відповідному позиції 68 в SEQ ID NO:1 (наприклад, аргінін заміщується на 92590 6 неконсервативний амінокислотний залишок); (viii) амінокислоти, відмінної від гліцину в положенні, відповідному позиції 72 в SEQ ID NO:1 (наприклад, гліцин заміщується на неконсервативний амінокислотний залишок); (іх) амінокислоти, відмінної від серину в положенні, відповідному позиції 73 в SEQ ID NO:1 (наприклад, серин заміщується на неконсервативний амінокислотний залишок); і (х) амінокислоти, відмінної від валіну в положенні, відповідному позиції 94 в SEQ ID NO:1 (наприклад, валін заміщується на неконсервативний амінокислотний залишок). Після димеризації поліпептид зв'язується з комплексом, що містить GFRalpha3 і RET. У деяких втіленнях, амінокислотна послідовність принаймні на 90%, принаймні на 95% або принаймні на 98% ідентична амінокислотам 15-113 в послідовності SEQ ID NO:1. Винахід також належить до кон'югатів, які містять описаний в даному тексті поліпептид, кон'югований з неприродним полімером. Прикладом подібного полімеру може служити водорозчинний синтетичний полімер, такий як поліалкіленгліколь (наприклад, поліетиленгліколь). Винахід також належить до злитих білків, які містять описаний в даному тексті поліпептид і гетерологічну амінокислотну послідовність. Винахід також належить до димеру, який містить два поліпептиди, кон'югати або злитих білка, описаних в даному тексті. Винахід також належить до фармацевтичної композиції, яка містить описаний в даному тексті поліпептид, димер, кон'югат або злитий білок і фармацевтично прийнятний носій або ексципієнт. Також розкривається нуклеїнова кислота, яка містить послідовність, що кодує описаний в даному тексті поліпептид, який містить нуклеїнову кислоту, експресійний вектор і клітину, що містить експресійний вектор. Також розкривається спосіб одержання поліпептиду, який включає в себе наступні етапи: (і) підготовка клітини, яка містить експресійний вектор, який в свою чергу містить нуклеїнову кислоту, що кодує описаний в даному тексті поліпептид, і (іі) культивування клітини в умовах, що сприяють експресії нуклеїнової кислоти. Винахід також належить до способу лікування або профілактики захворювання нервової системи у ссавців, який передбачає введення ссавцеві терапевтично ефективних кількостей описаних в даному тексті поліпептиду, димеру, кон'югата, злитого білка або фармацевтичної композиції. Винахід також належить до способу лікування нейропатичного болю у ссавців, який передбачає введення ссавцеві терапевтично ефективних кількостей описаних в даному тексті поліпептиду, димеру, кон'югата, злитого білка або фармацевтичної композиції. Винахід також належить до способу активації рецептора RET у ссавців, який передбачає введення ссавцеві ефективних кількостей описаних в даному тексті поліпептиду, димеру, кон'югата, злитого білка або фармацевтичної композиції. Перевага описаних в даному тексті вибраних варіантів поліпептиду нейбластину полягає в зниженій в порівнянні з нейбластином дикого типу 7 здатності зв'язувати гепарин. Зниження зв'язування з гепарином приводить до зниження кліренсу модифікованих поліпептидів in vivo. Несподівано було знайдено, що варіант поліпептиду нейбластину, який має заміщені амінокислотні залишки в позиціях 48 і 49, має значно меншу здатність зв'язувати гепарин і значно більшу ефективність і біодоступність в порівнянні з мутантними поліпептидами, які несуть одну амінокислотну заміну, і/або нейбластином дикого типу. Наприклад, було знайдено, що подвійний мутант демонструє приблизно 185-кратне збільшення сироваткової експозиції (serum exposure) в порівнянні з нейбластином дикого типу. Крім цього, було знайдено, що даний подвійний мутант демонструє більше ніж 5-кратне підвищення рівня експресії in vitro в порівнянні з нейбластином дикого типу, за рахунок чого полегшується одержання білка у великих кількостях. Переваги і несподівані можливості нейбластину дозволяють використовувати його для лікування індивідів з використанням менших доз білка і/або подовженими інтервалами між введеннями (в порівнянні з білком дикого типу). Всі технічні і наукові терміни, що зустрічаються в даному тексті, використовуються в тих значеннях, в яких вони звичайно розуміються фахівцями в даній галузі, якщо не вказане інше. Хоч матеріали і методи, схожі або еквівалентні описаним в даному тексті, можуть бути використані в практичній реалізації або тестуванні даного винаходу, що пояснюють матеріали і методи наведені нижче. Всі публікації, патентні заявки, патенти і інші згадані в даному тексті посилання повністю включені в даний текст за допомогою посилань. У випадку конфлікту, буде використовуватися даний опис, включаючи визначення. Матеріали, методи і приклади носять тільки ілюстративний характер і не є обмежувальними. Інші особливості і переваги даного винаходу стануть очевидні з нижченаведеного детального опису і формули винаходу. На Фіг.1 зображено вирівнювання препрополіпептидів нейбластину дикого типу людини (SEQ ID NO:10), миші (SEQ ID NO:11) і щура (SEQ ID NO:12). Ліва і права вертикальні лінії означають старт зрілих амінокислотних форм довжиною в 113 і 104 амінокислоти, відповідно. Гепаринзв'язвальний домен RRXR взятий в рамку. На Фіг.2А зображений катіонний елюційний профіль нейбластину дикого типу (пік D) і трьох мутантів із заміщенням Arg на Glu (піки А, В і С) (похила лінія являє собою теоретичну концентрацію хлориду натрію для кожного з елюйованих з колонки об'ємів). Дані представлені у вигляді показників OD280 для різних проб. На Фіг.2В зображений елюційний профіль (колонка з гепаринсефарозою) нейбластину дикого типу (пік Н) і трьох мутантів із заміщенням Arg на Glu (піки Е, F і G) (похила лінія являє собою теоретичну концентрацію хлориду натрію для кожного з елюйованих з колонки об'ємів). Дані представлені у вигляді показників OD280 для різних проб. На Фіг.3А-3В зображені фотографії SDS/PAGE-електрофоретичнийх гелів нейбласти 92590 8 ну дикого типу після аніонної хроматографії в присутності (2А) і за відсутності (2В) гепарину. На Фіг.4 зображена діаграма, яка описує результати аналізу зв'язування на клітинах СНО. Після SDS-PAGE-електрофорезу і денситометрії, значення OD нейбластину дикого типу і Arg48Eмyтантa були співвіднесені з концентраціями гепарину в кожній пробі. На Фіг.5 наведена діаграма, яка описує результати ELISA-тесту на зв'язування гепарину з використанням людського NBN113 дикого типу, людського NBN140 дикого типу, а також мутантів Arg48E, Arg49E, Arg51E і Arg48,49E. На Фіг.6 наведена діаграма, яка описує результати KIRA-аналізу щурячого NBN113 дикого типу, Arg51E, Arg48E, Arg49E і щурячого NBN113. На Фіг.7А наведена діаграма, яка описує результати KIRA-аналізу людського нейбластину дикого типу, а також мутантного людського нейбластину (113-амінокислотна форма) Arg48,49E. На Фіг.7В наведена діаграма, яка описує результати KIRA-аналізу людського нейбластину дикого типу, а також мутантних форм людського нейбластину: Arg48,49E (104-амінокислотна форма), Arg48,51E (113-амінокислотна форма) і Arg49,51E (113-амінокислотна форма). На Фіг.8 наведена діаграма, яка описує результати аналізу потрійного комплексу, проведеного з використанням людського нейбластину дикого типу, а також мутантних форм нейбластину: Arg48E, Arg49E, Arg51E, Arg48, 49E і Arg48,49,51E. На Фіг.9 наведена діаграма, яка описує результати аналізу потрійного комплексу, проведеного з використанням нейбластину дикого типу, а також мутантних форм нейбластину: Arg48E, Arg49E, Arg51E, Arg48,49E i Arg48,49,51E. На Фіг.10 наведена діаграма, яка описує результати фармакокінетичного аналізу нейбластину дикого типу і Arg48,49E після однієї підшкірної болюсної ін'єкції в кількості 7мг/кг (концентрації нейбластину в плазмі визначали за допомогою ELISAтесту для детекції нейбластину). На Фіг.11 наведена діаграма, яка описує результати фармакокінетичного аналізу нейбластину дикого типу і Arg48,49E після однієї внутрішньовенної болюсної ін'єкції в кількості 1мг/кг (концентрації нейбластину в плазмі визначали за допомогою ELISA-тесту для детекції нейбластину). На Фіг.12 наведена діаграма, яка описує результати фармакокінетичного аналізу 2X10К ПЕГильованого Arg48,49E після однієї підшкірної болюсної ін'єкції в кількості 7мг/кг (наведені дані екстрапольовані на 1мг/кг), а також після внутрішньовенного введення 1мг/кг (концентрації нейбластину в плазмі визначали за допомогою ELISAтесту для детекції нейбластину). На Фіг.13 наведена діаграма відносних рівнів експресії нейбластину в СНО-клітинах, трансфікованих плазмідами, що кодують нейбластин дикого типу або Arg48,49E. На Фіг.14 наведена діаграма відносних рівнів експресії нейбластину в лідируючих лініях СНОклітин, трансфікованих подвійними мутантами Arg48,49E або нейбластином дикого типу. 9 Даний винахід належить до варіантів поліпептиду нейбластину, які містять амінокислотні заміни у визначених позиціях. Згідно з розкритим в супровідних Прикладах, було знайдено, що певні залишки поліпептиду нейбластину дикого типу важливі для зв'язування з гепарином. Оскільки вважається, що зв'язування з гепарином впливає на кліренс нейбластину in vivo, автори очікували, що заміна одного або декількох подібних залишків приведе до зниження зв'язування з гепарином і відповідно до цього до збільшення сироваткової експозиції модифікованого поліпептиду. Поліпептиди модифікованого нейбластину Зрілий людський нейбластин дикого типу складається з 113 амінокислот і має наступну амінокислотну послідовність: AGGPGSRARAAGARGCRLRSQLVPVRAL?GLGHRSDELVRFRFCSGSCRRARSP HDLSLASLLGAGALRPPPGSRPVSQPCCRPTRYEA VSFMDVNSTWRTVDRLSATAC GCLG(SEQIDNO:1). У даному винаході розкриті поліпептиди із заміщенням одного або більше визначених амінокислотних залишків в поліпептиді нейбластину. Автори очікували, що мутації одного або більше з подібних амінокислотних залишків повинно привести до зниження або повної відсутності зв'язування одержаних варіантів поліпептиду нейбластиніну з гепарином (в порівнянні з нейбластином дикого типу). У порівнянні з SEQ ID NO:1, варіант поліпептиду нейбластину містить заміну (і) залишку аргініну в одній або більше з наступних позицій: 48, 49 або 51, і/або (іі) одного або більше залишків Ser 46, Ser 73, Gly 72, Arg 39, Gin 21, Ser 20, Arg 68, Arg 33, His 32, Val 94, Arg 7, Arg 9 або Arg 14. У даному тексті, будь-яка згадка номера амінокислотної позиції в послідовності нейбластину належить до нумерації амінокислотних залишків в послідовності SEQ ID NO:1, якщо не вказане інше. Амінокислотний залишок в послідовності нейбластину, призначений для заміщення (наприклад, залишок аргініну в позиції 48, 49 і/або 51), може бути заміщений неконсервативним амінокислотним залишком (наприклад, глутаміновою кислотою) або консервативним амінокислотним залишком. Згідно з деталізованим в супровідних прикладах, заміщення Arg48, Arg 49 і/або Arg 51 на неконсервативну амінокислоту може привести до одержання варіанта поліпептиду нейбластину зі зниженою гепаринзв'язувальною активністю, однак збереженою (або навіть підвищеною) біологічною активністю нейбластину. Приклади амінокислот, які можуть бути використані для заміни ідентифікованих амінокислотних залишків (наприклад, залишку аргініну в позиції 48, 49 і/або 51), включають в себе глутамінову кислоту, аспарагінову кислоту і аланін. Після димеризації, біологічно активний варіант поліпептиду нейбластину зв'язується з трикомпонентним комплексом, який містить GFRalpha3 і RET. Будь-який метод детекції зв'язування цього комплексу може бути використаний для вивчення біологічної активності варіанта поліпептиду нейбластину. Приклади аналітичних методів детекції здатності варіантів поліпептиду нейбластину зв'я 92590 10 зувати трикомпонентний комплекс описані в WO 00/01815 і Прикладі 7. Варіант поліпептиду нейбластину також може бути проаналізований на здатність до запуску нейбластинового сигнального каскаду. Наприклад, аналіз активації рецепторної кінази (KIRA), описаний в Прикладі 6, може бути використаний для аналізу здатності варіанта поліпептиду нейбластину індукувати аутофосфорилування RET (див. також Sadick et al., 1996, Anal. Biochem., 235(2):207). Крім ідентифікованих специфічних амінокислотних замін, варіант поліпептиду нейбластину також може містити одну або більше додаткових амінокислот, одну або більше амінокислотних замін і/або делецій в інших амінокислотних позиціях, відповідно до описаного в нижченаведених розділах. Крім однієї або більше амінокислотних замін, описаних в даному тексті, варіанти поліпептиду нейбластину можуть мати різну довжину. Незважаючи на те, що зрілий поліпептид людського нейбластину складається з 113 С-кінцевих амінокислот пре-пронейбластину, не всі з 113 амінокислот необхідні для досягнення достатньої біологічної активності. Можливе кінцеве укорочення. Таким чином, модифікований поліпептид нейбластину може містити одну або більше з описаних в даному тексті амінокислотних замін в контексті 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 або 113 С-кінцевих амінокислот в послідовності SEQ ID NO:1 (тобто довжина поліпептиду становить 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111,112 або 113 амінокислот). Крім однієї або більше амінокислотних замін, описаних в даному тексті (і необов'язково описаного вище укорочення), варіанти поліпептиду нейбластину можуть відрізнятися по амінокислотній послідовності. Зокрема, деякі амінокислотні заміни можуть бути введені в послідовність нейбластину без скільки-небудь значущої втрати біологічної активності нейбластину. У типових втіленнях, поліпептид (і) містить одну або більше з описаних в даному тексті амінокислотних замін, і (іі) принаймні на 70%, 80%, 85%, 90%, 95%, 98% або 99% ідентичний послідовності SEQ ID NO:1 (або на 70%, 80%, 85%, 90%, 95%, 98% або 99% ідентичний амінокислотам 15-113 в послідовності SEQ ID NO:1). Варіант поліпептиду нейбластину, послідовність якого відрізняється від SEQ ID NO:1 (або відрізняється від амінокислот 15-113 в SEQ ID NO:1), може містити одну або більше замін консервативних амінокислот, одну або більше замін неконсервативних амінокислот і/або одну або більше делецій або інсерцій. На Фіг.1 зображено вирівнювання послідовностей пре-прополіпептиду нейбластину людини, миші і щура. Вертикальні лінії на Фіг.1 означають старт зрілої 113-амінокислотної форми (ліва вертикальна лінія) і 104-амінокислотної форми (права вертикальна лінія) нейбластину. Гепаринзв'язувальний мотив RRXR взятий в рамку. Дане вирівнювання природних біоактивних форм нейбластину виявляє специфічні типові залишки (тобто некон 11 сервативні у людини, миші і щура), які можуть бути заміщені без елімінування біоактивності. Процент ідентичності між амінокислотними послідовностями може бути розрахований за допомогою програми BLAST 2.0. Порівняння послідовностей може бути проведене за допомогою безрозривного вирівнювання з параметрами за замовченням (матриця - Blossom 62, оцінка значущості розриву в гомології =11, оцінка значущості розриву в гомології на один залишок =1 і співвідношення лямбда =0,85). Математичний алгоритм, що використовується в програмі BLAST, описаний в публікації Altschul et al., 1997, Nucleic Acids Research 25:3389-3402. Консервативна заміна являє собою заміну однієї амінокислоти на іншу зі схожими характеристиками. Консервативні заміни включають в себе заміни, здійснені в межах наступних груп: валін, аланін і гліцин; лейцин, валін і ізолейцин; аспарагінова і глутамінова кислоти; аспарагін і глутамін; серин, цистеїн і треонін; лізин і аргінін; фенілаланін і тирозин. Неполярні гідрофобні амінокислоти включають в себе аланін, лейцин, ізолейцин, валін, пролін, фенілаланін, триптофан і метіонін. Полярні нейтральні амінокислоти включають в себе гліцин, серин, треонін, цистеїн, тирозин, аспарагін і глутамін. Позитивно заряджені (основні амінокислоти) включають в себе аргінін, лізин і гістидин. Негативно заряджені (кислі) амінокислоти 92590 12 включають в себе аспарагінову і глутамінову кислоти. Будь-яка заміна однієї амінокислоти з вищеперелічених груп полярних, основних або кислих амінокислот на іншу амінокислоту з тієї ж групи може розглядатися як консервативна. Неконсервативні заміни включають в себе заміни, при яких (і) залишок, який має електропозитивний бічний ланцюг (наприклад, Arg, His або Lys), заміщує або заміщується на електронегативний залишок (наприклад, Glu або Asp), (ii) гідрофільний залишок (наприклад, Ser або Thr) заміщує або заміщується на гідрофобний залишок (наприклад, Ala, Leu, He, Phe або Val), (iii) цистеїн або пролін заміщує або заміщується на будь-який інший залишок, або (iv) залишок з об'ємним гідрофобним або ароматичним бічним ланцюгом (наприклад, Val, He, Phe або Тrр) заміщує або заміщується на залишок з меншим бічним ланцюгом (наприклад, Ala, Ser) або без такого (наприклад, Gly). Приклади поліпептидів модифікованого нейбластину розкриті в таблиці 1. Амінокислотні залишки поліпептидів модифікованого нейбластину, мутовані по відношенню до відповідної позиції в поліпептиді дикого типу, виділені жирним шрифтом і підкреслені. Крім цього, в таблиці 1 продемонстровані поліпептиди нейбластину (довжиною 113, 99 і 104 амінокислоти), використані як основи для амінокислотних замін. 13 Варіанти поліпептиду нейбластину можуть бути необов'язково зв'язані з полімером (наприклад, з поліалкіленгліколем, таким як поліетиленгліколь). У деяких втіленнях, полімер зв'язаний з поліпептидом по сайту, відповідному N-кінцю поліпептиду нейбластину. У деяких втіленнях, варіант поліпептиду нейбластину містить принаймні одну амінокислотну заміну в порівнянні з послідовністю SEQ ID NO:1 (або в порівнянні з амінокислотами 15-113 в послідовності SEQ ID NO:1), що надає одержаному поліпептиду внутрішній сайт для кон'югування полімеру. У деяких втіленнях, полімер зв'язаний з варіантом поліпептиду нейбластину по залишку в позиції (нумерація відповідно до послідовності SEQ ID NO:1), вибраній з групи, що містить позицію 14, позицію 39, позицію 68 і позицію 95. Приклади модифікацій уейбластину, що містять внутрішній сайт для кон'югації з полімером, описані в WO02/060929 і WO04/069176 (зміст яких включений в дану заявку за допомогою посилання). Крім вищеописаних амінокислотних замін у варіанті поліпептиду нейбластину, поліпептид також може необов'язково містити гетерологічні амінокислотні послідовності. Термін «гетерологічна» відносно амінокислотної послідовності належить до послідовності, що походить з джерела, відмінного від даної конкретної клітини-хазяїна, або у випадку походження цієї клітини, є модифікованою по відношенню до первісної форми. Приклади гетерологічних послідовностей включають в себе гетерологічні сигнальні послідовності (наприклад, сигнальна послідовність нативного щурячого альбуміну, модифікована щуряча сигнальна послідовність або сигнальна послідовність людського гормону росту), або послідовності, які використовуються для очищення варіанта поліпептиду нейбластину (наприклад, гістидиновий тег). Поліпептиди уейбластину можуть бути виділені за допомогою відомих в даній галузі способів. Природні поліпептиди нейбластину можуть бути виділені з клітинних або тканинних джерел за допомогою стандартних методів очищення білків. Альтернативно, мутовані поліпептиди нейбластину можуть бути синтезовані за допомогою стандартних методів пептидного синтезу. Синтез коротких амінокислотних послідовностей широко відомий в даній галузі. Див., наприклад, Stewart, et al., Solid Phase Peptide Synthesis (2d ed., 1984). У деяких втіленнях, варіанти поліпептиду уейбластину можуть бути одержані за допомогою технології рекомбінантної ДНК. Наприклад, молекула нуклеїнової кислоти, яка кодує варіант поліпептиду нейбластину, може бути вставлена у вектор, на 92590 14 приклад, експресійний вектор, і нуклеїнова кислота може бути введена в клітину. Відповідні клітини включають в себе клітини ссавців (такі як людські клітини або клітини СНО), клітини грибів, дріжджів, комах або бактерій. У випадку експресії в рекомбінантній клітині, клітина переважно культивується в умовах, сприяючих експресії варіанта поліпептиду нейбластину. Варіант поліпептиду нейбластину може бути при необхідності одержаний з клітинної суспензії. Використовуваний в даному тексті термін «одержаний» означає, що мутантний поліпептид очищається від компонентів клітин або культурального середовища, в яких він знаходився до процесу виділення. Процес одержання може включати в себе один або більше етапів рефолдингу або очищення. Варіанти поліпипептиду нейбластину можуть бути сконструйовані будь-якими відомими в даній галузі методами. Одним з подібних методів є сайтнаправлений мутагенез, при якому визначений нуклеотид (або при бажанні невелике число визначених нуклеотидів) заміщується з метою зміни відповідної амінокислоти (або при бажанні невеликого числа відповідних амінокислотних залишків) в кодованому поліпептиді модифікованого уейбластину. Множина наборів для сайтнаправленого мутагенезу є комерційно доступними. Один з подібних наборів - "Transformer Site Directed Mutagenesis Kit" (Clontech Laboratories, Palo Alto, CA). Фармацевтичні композиції Варіанти поліпептиду нейбластину можуть бути включені в фармацевтичну композицію, яка містить терапевтично ефективну кількість поліпептиду і один або більше ад'ювантів, наповнювачів, носіїв і/або розріджувачів. Прийнятні розріджувачі, носії і наповнювачі звичайно не створюють негативних ефектів на гомеостаз реципієнта (наприклад, на електролітний баланс). Прийнятні носії включають в себе біосумісні, інертні або біоабсорбовані солі, буферні агенти, оліго- або полісахариди, полімери, агенти, що збільшують в'язкість, консерванти і т. д. Прикладом носія може служити фізіологічний розчин солі (0,15Μ NaCl, pH7,0-7,4). Інші приклади носія фармацевтичних композицій можуть бути знайдені, наприклад, в книзі «REMINGTON'S PHARMACEUTICAL SCIENCES» (Maack Publishing Co., Easton, Pa.). Введення фармацевтичної композиції, яка містить варіант поліпептиду нейбластину, може бути системним або місцевим. Фармацевтичні композиції можуть бути приготовані таким чином, щоб бути застосовними для парентерального і/або непарентерального введення. Характерні способи введен 15 ня включають в себе підшкірне, внутрішньовенне, внутрішньом'язове, черезшкірне внутрішньочеревинне, інтратекальне, пероральне, ректальне, букальне, топічне, інтраназальне, офтальмічне, внутрішньосуглобове, внутрішньоартеріальне, субарахноїдальне, лімфатичне, вагінальне і внутрішньоуретальне введення. Композиції, придатні для парентерального введення, містять стерильний водний препарат варіанта поліпептиду нейбластину, переважно ізотонічний з кров'ю реципієнта (наприклад, фізіологічний розчин солі). Композиції можуть бути приготовані у вигляді форм для однократного або багаторазового введення. Типова композиція згідно з даним винаходом містить описаний в даному тексті варіант поліпептиду нейбластину і наступні буферні компоненти: сукцинат натрію (наприклад, 10мМ); NaCl (наприклад, 75мМ) і L-аргінін (наприклад, 100мМ). Композиції, придатні для перорального введення, можуть бути приготовані у вигляді дискретних дозувальних одиниць, таких як капсули, крохмальні капсули, таблетки або пастилки, що містять задану кількість варіанта поліпептиду нейбластину; або подібні композиції можуть бути приготовані у вигляді суспензії у водній або неводній рідині - у вигляді сиропу, еліксиру, емульсії або інших рідких ліків. Терапевтично ефективні кількості фармацевтичної композиції можуть бути введені індивіду, потребуючому подібного лікування, в дозувальному режимі, встановленому фахівцем в даній галузі. Наприклад, композиція може бути введена індивіду, наприклад, системно, в дозуванні від 0,01мкг/кг до 1000мкг/кг маси тіла індивіда з розрахунку на одну дозу. У іншому прикладі, дозування складає від 1мкг/кг до 1000мкг/кг маси тіла індивіда з розрахунку на одну дозу. У іншому прикладі, дозування складає від 1мкг/кг до 30мкг/кг маси тіла індивіда з розрахунку на одну дозу, наприклад, від 3мкг/кг до 10мкг/кг маси тіла індивіда з розрахунку на одну дозу. Для оптимізації терапевтичної ефективності, спочатку варіант поліпетиду нейбластину вводиться в різних дозувальних режимах. Одиниця і режим дозування залежать від факторів, що включають в себе, наприклад, вид ссавця, імунний статус і масу тіла ссавця. У типовому випадку, рівні білка в тканинах піддаються моніторингу за допомогою відповідних скринінгових методів в рамках процедури клінічного тестування, наприклад, визначення ефективності режиму лікування. Визначення частоти введення варіанта поліпептиду нейбластину знаходиться в рамках компетенції і клінічної експертизи лікарів-клініцистів. У типовому випадку режим введення визначається в клінічних випробуваннях, що визначають оптимальні параметри введення. Проте, в реальній практиці допустимо варіювання певних режимів відповідно до віку, здоров'я, ваги, статі і медичного статусу індивіда. Частота введення також може варіюватися в залежності від типу нейропатії - гострої або хронічної. Крім цього, частота введення також може варіюватися в залежності від мети введення - профілактичної або терапевтичної. 92590 16 Способи лікування Варіанти поліпептиду нейбластину застосовні для регулювання метаболізму, диференціювання і виживання нерва або нейрональної клітини. Зокрема, варіанти поліпептиду нейбластину можуть бути застосовані для лікування або часткового полегшення симптомів порушення/розладу або захворювання живої істоти, наприклад, людини, у випадку, якщо дане порушення/розлад або захворювання відповідає на лікування нейротрофічним агентом. Розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані в лікуванні порушень, які характеризуються пошкодженням сенсорних нейронів або гангліозних клітин сітківки, в тому числі гангліозних нейронів заднього корінця спинного мозку, або нейронів будь-якої з нижченаведених тканин: колінчастий, кам'янистий і нодозний ганглій; вестибуло-акустичний комплекс восьмого черепно-мозкового нерва; вентролатеральний полюс щелепної частки трійчастого ганглія, трійчасте мезенцефалічне ядро. У деяких втіленнях, вплив може здійснюватися на сенсорні нейрони і/або нейрони автономної нервової системи. Зокрема, може бути здійснений вплив на ноцицептивні і механорецептивні нейрони, зокрема - на Α-дельта волокна, С-волокна і Αбета волокна. Крім цього, вплив може здійснюватися на симпатичні і парасимпатичні нейрони автономної нервової системи. У деяких втіленнях, лікувальний вплив може виявлятися при захворюваннях моторних нейронів, таких як бічний аміотрофічний склероз (БАС) і спінальна мускульна атрофія. У інших втіленнях, варіанти поліпептиду нейбластину можуть бути використані для поліпшення відновлення нервів після пошкодження внаслідок травми. Альтернативно, або крім цього, може бути використаний «канал напряму нерва» з матрицею, що містить кон'юговані з полімером варіанти поліпептиду нейбластину, або злиті продукти або кон'югати варіантів поліпептиду нейбластину. Подібні канали напряму нервів розкриті, наприклад, в патенті США No.5834029. У деяких втіленнях, варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані для лікування різних захворювань ока, в тому числі, що характеризуються втратою фоторецепторів сітківки у пацієнтів, які страждають на дистрофію жовтої плями, пігментний ретиніт, глаукому і інші подібні захворювання. У деяких втіленнях, варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані для лікування: нейропатичного болю, тактильної алодинії, втрати больової чутливості, асоційованої з нейропатією, вірусних інфекцій і вірус-асоційованої нейропатії, болю, асоційованого з діабетичною нейропатією, і захворювань нервової системи. Дані способи лікування детально описані в нижченаведених підрозділах. 1. Лікування нейропатичного болю 17 Розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані в способах лікування нейропатичного болю у індивіда, які включають в себевведення індивіду ефективної кількості варіанта поліпептиду нейбластину у вигляді монотерапії, або разом з ефективною кількістю знеболюючого препарату, вибраного з групи, яка складається з опіатів, антиаритмічних препаратів, топічних анальгетиків, місцевих анальгетиків, антиконвульсантів, антидепресантів, кортикостероїдів і нестероїдних протизапальних препаратів (НСПЗП). У одному з втілень, знеболюючим препаратом є антиконвульсант. У іншому втіленні, знеболюючим препаратом є габапентин (1амінометил)циклогексаноцтова кислота або прегабалін S-(+)-4-аміно-3-(2-метилпропіл)бутанова кислота. Розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані в лікуванні нейропатичного болю, асоційованого з периферичними нейропатіями. Серед периферичних нейропатій, в лікуванні яких можуть застосовуватися варіанти поліпептиду нейбластину, можна відмітити нейропатії, асоційовані з травмою, наприклад, викликані фізичним пошкодженням або хворобливим станом, фізичні пошкодження головного або спинного мозку, інсульт, асоційований з пошкодженням головного мозку, і неврологічні порушення, пов'язані з нейродегенерацією. Розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані в лікуванні множини нейропатій, які включають в себе: (а) нейропатії, індуковані травмою, (b) нейропатії, індуковані хіміотерапією, (с) токсин-індуковані нейропатії (що включають в себе але не обмежені нейропатіями, індукованими інтоксикацією алкоголем, вітаміном В6, гексакарбоновою інтоксикацією, інтоксикацією аміодароном, хлорамфеніколом, дисульфірамом, ізоніазидом, золотом, літієм, метронідазолом, мізонідазолом, нітрофурантоїном), (d) нейропатії, в тому числі нейропатичний біль, індуковані лікарськими препаратами (такими як протипухлинні агенти, особливо вибраними з групи, що складається з таксолу, таксотеру, цисплатину, нокодазолу, вінкристину, віндезину і вінбластину; а також такими як противірусні препарати, особливо вибрані з групи, що складається з ddl, DDC, d4T, фоскарнету, дапзону, метронідазолу і ізоніазиду), (e) нейропатії, індуковані дефіцитом вітамінів (включаючи, без обмежень, дефіцит вітаміну В12, дефіцит вітаміну В6, дефіцит вітаміну Е), (f) ідіопатичні нейропатії, (g) діабетичні нейропатії, (h) патогеніндуковані пошкодження нервів, (і) запальні пошкодження нервів, (j) нейродегенерації, (k) природжені нейропатії (що включають, без обмежень, атаксію Фрідрейха, сімейну амілоїдну полінейропатію, хворобу Танжье, хворобу Фабрі), (l) метаболічні порушення (що включають, без обмежень, ниркову недостатність і гіпотиреоз), (m) інфекційні і вірусні нейропатії (що включають, без обмежень, нейропатії, асоційовані з лепрою, хворобою Лайма, нейропатичні болі, асоційовані з вірусною ін 92590 18 фекцією, зокрема - з інфікуванням вірусом, вибраним з групи, що містить герпесвірус (наприклад, herpes zoster, інфекція якого може приводити до постгерпетичної невралгії), вірус імунодефіциту людини (ВІЛ) і папіломавірус), (n) автоімунні нейропатії (що включають, без обмежень, синдром Гійєна-Барре, хронічну запальну демієлінізуючу нейропатію, моноклональну гаммапатію невідомої. етіології і полінейропатію, (о) невралгію трійчастого нерва і синдроми защемлення (що включають, без обмеження, синдром зап'ястного каналу), і (р) інші синдроми, що супроводжуються нейропатичним болем, в тому числі посттравматичну невралгію, фантомні болі в ампутованих кінцівках, болі при неуважному склерозі, комплексні синдроми регіонального болю (що включають, без обмежень, рефлекторну симпатичну дистрофію, каузалгію), болі при онкологічних захворюваннях, нейропатії при васкуліті/ангіопатії, ішіалгію. Нейропатичний біль може виявлятися у вигляді алодинії, гіперальгезії, у вигляді спонтанних або фантомних болів. 2. Лікування тактильної алодинії Розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані при лікуванні тактильної алодинії у індивіда. У типовому випадку термін «тактильна алодинія» належить до стану індивіда, при якому біль провокується стимуляцією шкіри (наприклад, дотиком), що в нормі не викликає болю. У деяких втіленнях, тактильна алодинія може лікуватися шляхом введення індивіду фармацевтично ефективних кількостей варіанта поліпептиду нейбластину. У родинному втіленні, тактильна алодинія може лікуватися шляхом введення індивіду фармацевтично ефективних кількостей варіанта поліпептиду нейбластину у вигляді монотерапії або разом з ефективною кількістю знеболюючого препарату, вибраного з групи, що складається з опіатів, антиаритмічних препаратів, топічних анальгетиків, місцевих анальгетиків, антиконвульсантів, антидепресантів, кортикостероїдів і нестероїдних протизапальних препаратів (НСПЗП). У одному з втілень, знеболюючим препаратом є антиконвульсант. У іншому втіленні, знеболюючим препаратом є габапентин (1амінометил)циклогексаноцтова кислота або прегабалін S-(+)-4-аміно-3-(2-метилпропіл)бутанова кислота. У деяких втіленнях, варіант поліпептиду нейбластину вводиться спільно з терапевтичним агентом, що включає, без обмежень, протипухлинний препарат або противірусний агент. Протиракові агенти включають в себе, без обмежень, таксол, таксотер, цисплатин, нокодазол, вінкристин, віндезин і вінбластин. Противірусні агенти включають в себе, без обмежень, ddl, DDC, d4T, фоскарнет, дапзон, метронідазол і ізоніазид. 3. Лікування зниження втрати больової чутливості У іншому втіленні, розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані в способах лікування втрати больової чутливості у 19 індивіда, страждаючого нейропатією. У одному втіленні, нейропатією є діабетична нейропатія. У деяких втіленнях, втрата больової чутливості являє собою втрату температурної больової чутливості. Дані способи включають в себе як профілактичне, так і терапевтичне лікування. При профілактичному лікуванні, варіант поліпептиду нейбластину вводиться індивіду, що входить до групи високого ризику з розвитку втрати больової чутливості (відносно подібного індивіда очікується, що у останнього - рання стадія нейропатії). У цьому випадку лікування варіантом поліпептиду нейбластину служить як превентивне лікування у пацієнтів високого ризику. При терапевтичному лікуванні, варіант поліпептиду нейбластину вводиться індивіду, страждаючому втратою больової чутливості в результаті нейропатії (відносно подібного індивіда очікується, що у останнього - пізня стадія нейропатії). У цьому випадку лікування варіантом поліпептиду нейбластину служить для відновлення у індивіда адекватної больової чутливості. 4. Лікування вірусних інфекцій і вірусасоційованих нефропатій Розглянуте профілактичне лікування інфекційних і вірусних нейропатій Профілактичне лікування показане у випадку діагностованої вірусної інфекції до появи нейропатичного болю. У ході лікування, варіант поліпептиду нейбластину вводиться для запобігання появі нейропатичного болю, в тому числі, без обмежень, нейропатичного болю, асоційованого з лепрою, хворобою Лайма, нейропатичного болю, асоційованого з вірусною інфекцією, зокрема з вірусом, вибраним з групи, що містить герпесвірус (і більш конкретно, herpes zoster, інфекція, яка може приводити до постгерпетичної невралгії), вірус імунодефіциту людини (ВІЛ) і папіломавірус. У альтернативному втіленні, варіант поліпептиду нейбластину вводиться для зменшення нейропатичного болю у випадку його появи. Симптоми гострої вірусної інфекції часто включають в себе появу висипу. Інші симптоми включають в себе, наприклад, розвиток персистуючого болю в ураженій ділянці тіла, що є поширеним наслідком інфекції вірусом herpes zoster (оперізувальний лишай). Постгерпетична невралгія може тривати декілька місяців і більше, а також може з'явитися через декілька місяців після зникнення висипу і інших подібних симптомів. 5. Лікування болю при діабетичній нейропатії Розглянуте профілактичне лікування болю при діабетичній нейропатії. Профілактичне лікування діабетичних нейропатій повинно бути призначене після первинного діагнозу діабету або асоційованих з діабетом симптомів і до появи нейропатичного болю. Профілактичне лікування болю при діабетичній нейропатії може бути також призначене після віднесення індивіда до групи ризику з розвитку діабету або асоційованих з діабетом симптомів. У ході лікування, варіант поліпептиду нейбластину вводиться для запобігання появі нейропатичного болю. У альтернативному втіленні, варіант поліпептиду нейбластину вводиться для зменшення нейропатичного болю у випадку його появи. 92590 20 6. Лікування порушень нервової системи Розкриті в даному тексті варіанти поліпептиду нейбластину (і фармацевтичні композиції, що їх містять) можуть бути використані для лікування або запобігання порушенню нервової системи у індивіда (такого як людина), шляхом введення індивіду, потребуючому подібного лікування, терапевтично ефективної кількості варіанта поліпептиду нейбластину, фармацевтичної композиції, що містить варіант поліпептиду нейбластину, або комплексу, що включає стабільний, водорозчинний кон'югат варіанта поліпептиду нейбластину, зв'язаного з поліалкіленовим фрагментом, таким як ПЕГ. Порушенням нервової системи може бути порушення периферичної нервової системи, таке як периферична нейропатія або нейропатичний больовий синдром. Людина є переважними суб'єктом для проведення лікування. Варіант поліпептиду нейбластину може бути застосований для лікування нейронального дефекту, включаючи, без обмежень, пошкодження і травми нейронів. Периферичні нерви, що зазнають травми, включають, без обмежень, нерви спинного мозку. Варіанти поліпептиду нейбластину можуть бути використані для лікування нейродегенеративних захворювань, наприклад ішемічних уражень нейронів кори головного мозку; нейропатій, наприклад, периферичної нейропатії, хвороби Альцгеймера, хвороби Хантінгтона, хвороби Паркінсона, бічного аміотрофічного склерозу (БАС). Подібні варіанти поліпептиду нейбластину можуть бути використані для лікування порушень пам'яті, наприклад, асоційованих з деменцією. Нижче наведені приклади практичних втілень винаходу. Дані приклади не повинні бути інтерпретовані як яким-небудь чином обмежуючі спектр практичних втілень винаходу. Приклади Приклад 1: Конструювання і синтез варіантів поліпептиду нейбластину Людський нейбластин був одержаний у вигляді кристала, і аналіз його структури виявив тріаду сульфат-іонів, що зв'язуються з наступними чотирма амінокислотними залишками нейбластину в тісній близькості один до одного: Arg14, Arg48, Arg49 і Arg51. На основі їх взаємного розташування, а також на основі присутності даної тріади, було передбачено, що даний регіон нейбластину може бути потенційним гепаринзв'язувальним сайтом. Далі, вирішена раніше структура гепаринсульфату була протестована in silico на зв'язування з нейбластином в області сульфатної тріади останнього. Гепаринсульфат зв'язувався точно в області сульфатної тріади нейбластину, що говорить про потенційну гепаринзв'язувальну функцію даного регіону нейбластину. Дані, одержані внаслідок аналізу кристалічної структури нейбластину, також виявили наявність наступних амінокислотних залишків, що надають додаткові сайти зв'язування для тріади сульфатіонів, або для одного або більше з трьох інших сульфат-іонів, що зв'язуються з нейбластином: Ser 46, Ser 73, Gly 72, Arg 39, Gln 21, Ser 20, Arg 68, Arg 33, His 32 і Val 94. Крім сульфатзв'язувальних 21 сайтів нейбластину, виявлених в ході аналізу кристалічної структури, нейбластин також містить консенсусну послідовність гепаринсульфатзв'язувального сайта (GPGSRAR) з 3 по 9 амінокислотний залишок на N-кінці. У кристалічній структурі даний регіон був неструктурований, однак він може бути структурований в результаті зв'язування з глікозаміногліканами. Даний регіон, ймовірно, просторово близький до трисульфатного кластера, що спостерігається в кристалі (Arg 14 належить до гепаринзв'язувального сайта, локалізованого головним чином в шарнірній ділянці білка). Для вивчення біологічної значущості потенційного гепаринзв'язувального домену, було виконане заміщення трьох індивідуальних амінокислотних залишків в зрілому 113-амінокислотному нейбластині людини (SEQ ID NO:1). Залишки аргініну в кожній з позицій 48 (модифікація "Arg48E"; SEQ ID NO:2), 49 (модифікація "Arg49E"; SEQ ID NO:3) і 51 (модифікація "Arg51E"; SEQ ID NO:4) були заміщені на глутамат (тобто були одержані три різних модифікованих конструкта з однією амінокислотною заміною кожний) з метою заміни залишку, зарядженого таким чином, що він притягує сульфат-іон, на залишок, заряджений таким чином, що він відштовхує сульфат-іон, а також з метою потенційної стабілізації навколишніх залишків аргініну. Білки були піддані рефолдингу і виділені з тілець включення Е. соlі (див. патент WO 04/069176). Кожний з варіантів нейбластину був підданий аналізу для верифікації структурної цілісності і наявності правильної амінокислотної заміни. Всі три мутанти були структурно порівнянні з людським нейбластином дикого типу. Приклад 2. Катіонна хроматографія і хроматографія на гепаринсефарозі Варіанти поліпептиду нейбластину були піддані подальшому біохімічному аналізу для з'ясування впливу кожної з мутацій на зв'язування з гепарином. Були використані катіонна хроматографія і хроматографія на гепаринсефарозі. Оскільки людський нейбластин дикого типу є основним білком зі спостережуваною рl 11,31, нейбластин ефективно зв'язується з катіонними смолами. Одинична заміна аргініну на глутамат приводила до зниження спостережуваної рl до 10,88. Однак, автори не чекали від подібного зниження рl значного впливу ні на зв'язування з катіонною смолою, ні на елюційний профіль мутантів в порівнянні з контролем дикого типу. Кожний з мутантів (разом з контрольним Нейбластином дикого типу) був підданий катіонній хроматографії. Проби були вміщені на смолу в буфері, що містить 5мМ фосфату, рН6,5 і 150мМ хлориду натрію, після чого була проведена елюція лінійним градієнтом солі починаючи зі 150мМ і закінчуючи 1М хлориду натрію. Нейбластин дикого типу елюювався при ~800мМ хлориду натрію (Фіг.2А; пік D), в той час як кожний з мутантів елюювався при концентрації солі близько 500мМ, що відображає їх знижене значення pl. Arg49E і Arg51E (Фіг.2А; піки В і С) елюювалися при трохи більш високій концентрації солі, ніж була необхідна для елюції Arg48E (Фіг.2А; пік А) (520мМ проти 490мМ, відповідно). Дана відмінність може відо 92590 22 бражати більш доступну поверхню Arg48 і її більший внесок в катіонне зв'язування в порівнянні з іншими залишками аргініну, заміщеними в інших мутантах. Для з'ясування ефекту замін Arg на Glu на зв'язування з гепарином, кожний з трьох мутантів (разом з контрольним нейбластином дикого типу) був підданий хроматографії на гепаринсефарозі (Фіг.2В). Умови зв'язування зі смолою і елюції були аналогічні таким для катіонної хроматографії. Однак елюційний профіль значно відрізнявся від такого, одержаного при катіонній хроматографії. Нейбластин дикого типу елюювався при концентрації хлориду натрію близько 720мМ (Фіг.2В; пік Н), в той час як Arg51E, Arg49E і Arg48E елюювалися при 570мМ (Фіг.2В; пік G), 510мМ (Фіг.2В; пік F) і 570мМ (Фіг.2В; пік Е) хлориду натрію, відповідно. Заміна Arg48E впливала особливо сильно на зв'язування з гепарином. Загалом, дані хроматографічні профілі вказують на те, що кожна з мутацій знижує спостережувану афінність зв'язування Нейбластину з гепарином. Приклад 3. Аніонна хроматографія. При стандартних умовах - рН6,5 і концентрації хлориду натрію 150мМ, нейбластин не зв'язується з аніонними смолами. Навпаки, гепаринсульфат в даних умовах зв'язується з аніонними смолами. У випадку, коли нейбластин був змішаний з 16кДа-гепаринсульфатом в молярному співвідношенні 1:1 і поміщений на аніонний матрикс при вищезгаданих умовах, нейбластин зв'язувався і елюювався 600мМ хлоридом натрію (Фіг.3В, доріжки "FT"), що вказує на те, що нейбластин зв'язується з аніонним матриксом опосередковано за рахунок зв'язування з гепаринсульфатом. За відсутності гепарину, нейбластин не зв'язувався з аніонною смолою (Фіг.3А, доріжки "FT"), і нейбластин не детектувався у фракції, елюйованій 600мМ хлоридом натрію (Фіг.3А, доріжки "Елюція"). Одержані дані надають ще один доказ здатності нейбластину зв'язувати гепарин. Приклад 4. Дослідження зв'язування клітин яєчника китайського хом'ячка Раніше було показано, що нейбластин неспецифічно зв'язується з поверхнею клітин яєчників китайського хом'ячка (СНО-клітини). Аналіз зв'язування нейбластину з СНО-клітинами проводився з метою визначення, чи є це зв'язування опосередкованим, принаймні частково, зв'язуванням нейбластину з молекулами гепаринсульфату на поверхні клітин. Людський нейбластин дикого типу (40мкг) або Arg48E-мутант змішували з СНО-клітинами (106 клітин) при щільності останніх, що забезпечує повне зв'язування обох форм гепарину, разом з збільшуваними кількостями 16кДа-гепаринсульфату і інкубували при 37°С 4 години. Після інкубації, клітини осаджували центрифугуванням, і Нейбластин, що не зв'язався, в супернатанті визначали SDS/PAGE-аналізом. Після денситометричної кількісної оцінки смуги білка, одержані значення оптичної щільності співвідносили з відповідними концентраціями гепаринсульфату в кожній з проб (Фіг.4). 23 При двох найменших концентраціях гепарину, кількості ідентифікованих в супернатантах мутантного нейбластину і нейбластину дикого типу були рівні. Однак, при збільшенні концентрації гепарину до 0,5мкг/мл і вище, кількість ідентифікованого в супернатанті нейбластину дикого типу була вищою, ніж така Arg48E-мутантa. Дане спостереження вказує на те, що гепарин в супернатанті може конкурувати з гепарином, зв'язаним з клітинною поверхнею, за зв'язування з нейбластином дикого типу (тобто зв'язування гепарину в супернатанті з нейбластином приводить до видалення останнього з клітинної поверхні), в той час як гепарин не може так само легко конкурувати за зв'язування з Arg48E-мутантoм. При найбільшій концентрації гепарину (50мкг/мл), Arg48E-мутант починає елююватися з клітинної поверхні, що вказує на те, що іонні взаємодії між гепарином і Arg48E-мутантом можуть бути причиною явища, що лежить в основі даного спостереження. Приклад 5. Зв'язування нейбластину дикого типу і варіантів поліпептиду нейбластину з гепарином З метою подальшого вивчення ролі ідентифікованої аргінінової тріади як гепаринзв'язувального сайта нейбластину, був розроблений заснований на методі ELISA тест на зв'язування з гепарином. Короткий опис: моноклональні антитіла до нейбластину іммобілізували в ямках 96-ямкових планшет, після чого планшети промивали і додавали одну з форм нейбластину. Після цього додавали біотинільований гепарин, знову промивали, і комплекси гепарину з нейбластином детектували за допомогою кон'югата стрептавідину з пероксидазою хрону і хемілюмінесцентного субстрату. Даний ELISA-тест на зв'язування з гепарином використовували для порівняння 113-амінокислотної форми (SEQ ID NO:1) і 104-амінокислотної форми (амінокислоти 10-113 в послідовності SEQ ID NO:1) людського нейбластину дикого типу з варіантами поліпептиду нейбластину, що містять одиничні амінокислотні заміни (Arg48E, Arg49E і Arg51E; SEQ ID NOs:2-4), а також з поліпептидом, що містить подвійну заміну (Arg48,49E; SEQ ID NO:5). Обидві форми нейбластину дикого типу зв'язувалися з гепарином з ЕС50~1нг/мл гепарину (Фіг.5). Arg49E і Arg51E зв'язувалися менш ефективно, з ЕС50~10нг/мл, що спостерігається, однак максимальне зв'язування залишалося таким же (Фіг.5). Серед трьох одиничних точкових мутацій, Arg48E здійснювала найбільш яскравий ефект на зв'язування з гепарином, зі спостережуваною ЕС50~100нг/мл, однак максимальне зв'язування з гепарином все ще досягало значень, ідентичних таким для немодифікованих форм нейбластину (Фіг.5). Таким чином, Arg48E-мутант зв'язував гепарин в 100 разів менш ефективно в порівнянні з немодифікованими формами нейбластину і в 10 разів менш ефективно в порівнянні з іншими мутантами з одиничними замінами. У випадку подвійного заміщення Arg48 і Arg49 на глутамат, гепаринзв'язувальна активність виявлялася майже повністю елімінованою, з семикратним зниженням максимального зв'язування з гепарином, однак 92590 24 значення ЕС50 залишалося в межах, характерних для мутантів з одиничними замінами. Дані результати вказують на те, що Arg48 грає важливу роль в зв'язуванні гепарину, можливо внаслідок центральної локалізації передбачуваного гепаринзв'язувального сайта. Приклад 6. Аналіз активації кіназного рецептора нейбластином дикого типу і варіантами поліпептиду нейбластину з мутаціями в гепаринзв'язувальному сайті Для визначення впливу мутацій в гепаринзв'язувальному сайті на сигнальний шлях через рецептор нейбластину в клітинному аналізі, мутантні форми нейбластину і нейбластин дикого типу були досліджені за допомогою аналізу активації кіназного рецептора (KIRA-аналізу). Всі мутанти з одиничним заміщенням Arg на Glu в даному аналізі демонстрували ідентичну немодифікованому контролю KIRA-активність, що вказує на структурну схожість з поліпептидом дикого типу і здатність активувати рецептор нейбластину і асоційований сигнальний каскад (Фіг.6). Більше того, одержані дані вказують на те, що для активації рецептора не потрібне зв'язування з гепарином. Подвійний мутант Arg48,49E (SEQ ID NO:5; 113-амінокислотна форма) в KIRA-аналізі демонстрував зсув ЕС50, що спостерігається приблизно на порядок ліворуч з підвищенням максимальної активації рецептора в порівнянні з контрольним людським нейбластином дикого типу (Фіг.7А). Подібний же ефект підвищення активності в порівнянні з контрольним людським нейбластином дикого типу демонстрував подвійний мутант Arg48,49E (SEQ ID NO:7; 104-амінокислотна форма) (Фіг.7В). Кожний з подвійних мутантів Arg48,51E і Arg49,51E (SEQ ID NO:9 і SEQ ID NO:8, відповідно; 113-амінокислотні форми) демонстрував KIRA-активність, схожу з немодифікованим контрольним Нейбластином. Приклад 7. Аналіз потрійного комплексу Людський нейбластин дикого типу і кожний з мутантів в гепаринзв'язувальному сайті були проаналізовані за допомогою двох протоколів, що трохи розрізнюються. У першому протоколі компоненти рецептора нейбластину (GFRalpha3 і RET) комбінували з нейбластином в єдиний пул і додавали в ямки планшети для ELISA з іммобілізованими антитілами (Фіг.8). У другому протоколі дані компоненти послідовно додавали в ямки планшети для ELISA в наступній послідовності: GFRalpha3, нейбластин і RET (Фіг.9). У експерименті за протоколом, що передбачає пулування реагентів, максимальне зв'язування було досягнуте як з Arg48E, так і з Arg48,49E, що вказує на те, що дані форми нейбластину мають найвищу афінність до свого рецептора. Нейбластин дикого типу зв'язувався з афінністю, схожою з такою Arg49E-мутантa, в той час як Arg51E і потрійний мутант (із заміщеними на глутамат амінокислотними залишками Arg48, 49 і 51) демонстрували найгірше зв'язування з рецептором. У експерименті за протоколом, що передбачає послідовне додавання компонентів, найкраще зв'язування з рецептором демонстрував Arg48E. У 25 той же час, при даних умовах подвійний мутант зв'язувався з рецептором слабо, з афінністю, близькою до такої Arg51E-мутантa. Arg49E і нейбластин дикого типу демонстрували афiнність до рецептора, проміжну між спостережуваними максимумом і мінімумом зв'язування. Потрійний мутант в даних умовах не зв'язувався. Загалом, одержані дані вказують на те, що Arg48 здійснює найбільший вплив на афінність зв'язування нейбластину з його рецептором. Приклад 8. Дослідження кругового дихроїзму в ближньому і дальньому УФ-діапазонах Для подальшого вивчення ефектів подвійного мутування на вторинну і третинну структури, були вивчені спектри кругового дихроїзму подвійного Arg48,49-мутантa в ближньому і дальньому УФдіапазонах. Хоч незначні відмінності у вторинній і третинній структурах цих поліпептидів були детектовані, конформація подвійного мутанта була дуже близька до такої нейбластину дикого типу. Приклад 9. Фармакокінетичний аналіз Ащ48,49Е-подвійного мутанта людського нейбластину Людський нейбластин демонструє незадовільну фармакокінетику (ФК) при введенні щурам внутрішньовенно (в/в) або підшкірно (п/ш), із загальної біодоступністю менше 1%. Кліренс за рахунок зв'язування з гепарином може бути однією з причин такої низької біодоступності. Для відповіді на питання, чи є кліренс за рахунок зв'язування з гепарином учасником швидкого процесу виведення людського нейбластину з організму щура, Аrg48,49Е-подвійний мутант (разом з контролем дикого типу) були вивчені в ФК-аналізі. Обидві форми вводили окремо щурам в дозуванні 7мг/кг п/ш. Проби сироваток крові збирали починаючи з 1 години і закінчуючи 96-тою, і аналізували на нейбластин (Фіг.10). Спостережувана площа під кривою (AUC) для нейбластину дикого типу становила ~109, в той час як спостережувана площа під кривою (AUC) для подвійного мутанта становила 20145. Це відповідає 185-кратному збільшенню AUC подвійного мутанта (в порівнянні з нейбластином дикого типу) і значне збільшення сироваткової експозиції. Нейбластин дикого типу і подвійний мутант нейбластину також були вивчені в ФК-аналізі в умовах в/в введення (1мг/кг). Початкова концентрація подвійного мутанта в плазмі була приблизно в 6 разів вище (ромби) такої контролю дикого типу (квадрати) через 5 хвилин після ін'єкції, однак протягом однієї години швидко порівнювалася з концентрацією поліпептиду дикого типу (Фіг.11). Одержані дані вказують на те, що подвійне мутування збільшує сироваткову експозицію, однак не дає ефекту на загальну швидкість виведення. Разом з результатами ФК-аналізу в умовах п/ш введення, одержані дані вказують на те, що зв'язування з гепарином особливо релевантне в умовах підшкірного введення, що, можливо, приводить до подібності ефекту депо. Як тільки нейбластин поступає в циркуляцію, швидкість виведення молекул дикого типу і подвійного мутанта приблизно однакові. 92590 26 Для вивчення швидкості виведення нейбластину з циркуляції в організмі щура, подвійна мутантна форма нейбластину, а також нейбластин дикого типу були піддані ПЕГилюванню 10кДа ПЕГ з використанням кон'югаційної хімії, що заснована на SPA. Оскільки нейбластин являє собою гомодимер без нативних залишків лізину, 10кДа фрагменти специфічно мітять N-кінець кожного з мономерів. 2X10К ПЕГильований людський нейбластин з подвійним мутуванням був обчищений до гомогенності і проаналізований з використанням структурних і біологічних методів до ФК-аналізу. 2X10К ПЕГильований Аrg48,49Е-подвійний мутант вводили щурам в/в (1мг/кг) або п/ш (7мг/кг), і в різні часові точки збирали сироватку для аналізу. Після в/в введення, концентрація 2X10К ПЕГильованого подвійного мутанта досягала теоретичної Сmах =10мкг/мл (ромби) з типовими альфа- і бетафазами (Фіг.12). П/ш введення ПЕГильованого подвійного мутанта демонструвало Сmах =40мкг/мл через 24 години після ін'єкції (Фіг.12). Після надходження препарату в циркуляцію, спостережувана швидкість кліренсу відповідала такій при в/в введенні. Біодоступність даного конструкта становила приблизно 10% в порівнянні з менше ніж 1% не-ПЕГильованого або ПЕГильованого людського нейбластину дикого типу. Приклад 10. Експресія мутантного нейбластину зі зниженою гепаринзв'язувальною активністю в клітинах яєчника китайського хом'ячка Плазмідні конструкти, що кодують людський мутантний нейбластин і нейбластин дикого типу, експресували в СНО-клітинах і кількості секретованого розчинного білка вимірювали методом ELISA. Використані в даних експериментах плазмідні конструкти кодують злитий білок, що містить сигнальну послідовність людського гормону росту (SigPep) (з включенням інтрону в плазміду або без нього), сполучену з (і) 104 С-кінцевими амінокислотами людського нейбластину дикого типу, або (іі) Аeg48,49Е-подвійним мутантом double mutant (104-амінокислотна форма). Нижче наведені послідовності злитих білків нейбластину, використаних в даних експериментах. Послідовності нейбластину надруковані великими буквами (верхній регістр). Послідовності сигнального пептиду людського гормону росту надруковані малими буквами (нижній регістр). З'єднання послідовностей сигнального пептиду і нейбластину відмічено значком «^». Амінокислоти в позиціях 48 і 49 підкреслені. SigPep-NBN (дикий тип): matgsrtslllafgllclswlqegsa^AAGARGCRLRSQLVPV RALGLGHRSDELVRFRFCSGSCRRARSPHDLSLAS LLGAGALRPPPGSRPVSQPCCR PTRYEAVSFMDVNSWRTVDRLSATACGCLG (SEQ ID NO:13). SigPep-NBN (Arg48,49E): matgsrtslUafgllclswlqegsa^AAGARGCRLRSQLVP VRALGLGHRSDELVRFRFCSGSCEEARSPHDLSLA SLLGAGALRPPPGSRPVSQPCC RPTRYEAVSFMDVNSTWRTVDRLSATACGCLG (SEQ ID NO:14). СНО-клітини трансфікували плазмідами, які кодують кожну з вищезазначених форм нейблас 27 тину, і культивували в 384-ямкових планшетах. Через декілька тижнів, зростаючі клітини пересаджували в свіжі 96-ямкові планшети. Для визначення титру розчинного нейбластину, культуральне середовище аналізували методом ELISA і визначали дані кумулятивного поглинання (середнє значення і величину помилки, відповідну одному стандартному відхиленню), відповідні кожній з протестованих плазмід. У порівнянні з плазмідами, що кодують нейбластин дикого типу, трансфекція СНО-клітин плазмідами, які кодують Аrg48,49Е-подвійний мутант, приводила до значного збільшення числа клітинних ліній, що демонструють високу експресію рекомбінантного білка (Фіг.13). Лідируючі клітинні лінії з кожної трансфекції додатково підрощували. Фіксоване число клітин 92590 28 культивували протягом трьох днів, після чого визначали загальне число клітин, їх життєздатність і титр нейбластину. Титри нейбластину, експресованого в лідируючих клітинних лініях, які містять Аrg48,49Е-подвійний мутант, були приблизно в п'ять разів вище таких в лідируючих клітинних лініях, експресуючих нейбластин дикого типу. Інші втілення Хоч винахід був описаний в комплексі з його деталізованим описом, вищезазначений опис носить ілюстративний характер і не передбачає обмеження об'єму даного винаходу, який визначений об'ємом прикладеної формули винаходу. Інші аспекти, переваги і модифікації включені в об'єм домагань нижченаведеної формули винаходу. 29 92590 30 31 92590 32 33 92590 34 35 92590 36 37 92590 38 39 92590 40 41 92590 42 43 92590 44 45 92590 46 47 92590 48 49 92590 50 51 92590 52 53 92590 54 55 Комп’ютерна верстка Т. Чепелева 92590 Підписне 56 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNeublastin variants
Автори англійськоюRossomando Anthony, Silvian Laura, Pepinsky R. Blake
Назва патенту російськоюВарианты нейбластина
Автори російськоюРоссомандо Энтони, Сильвиан Лаура, Пепински Р. Блейк
МПК / Мітки
МПК: A61P 25/02, C07K 14/475, A61K 38/17, C12N 15/18
Мітки: варіанти, нейбластину
Код посилання
<a href="https://ua.patents.su/28-92590-varianti-nejjblastinu.html" target="_blank" rel="follow" title="База патентів України">Варіанти нейбластину</a>
Попередній патент: Електропровідне трикотажне полотно
Випадковий патент: Спосіб одержання 6-метил-2-(4-метилфеніл)імідазоло[1,2-a]-піридин-3-(n,n-диметилацетаміду) і проміжних сполук