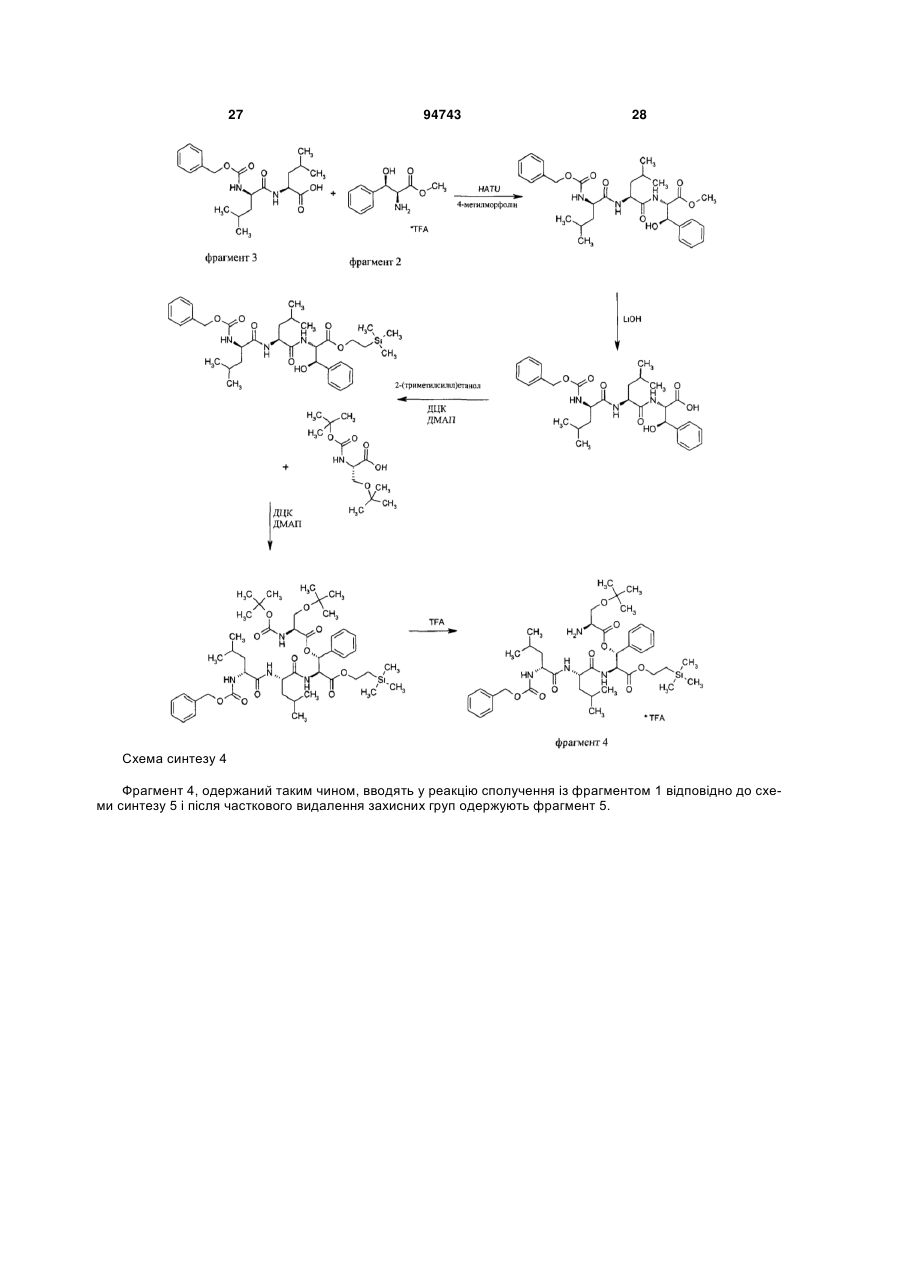
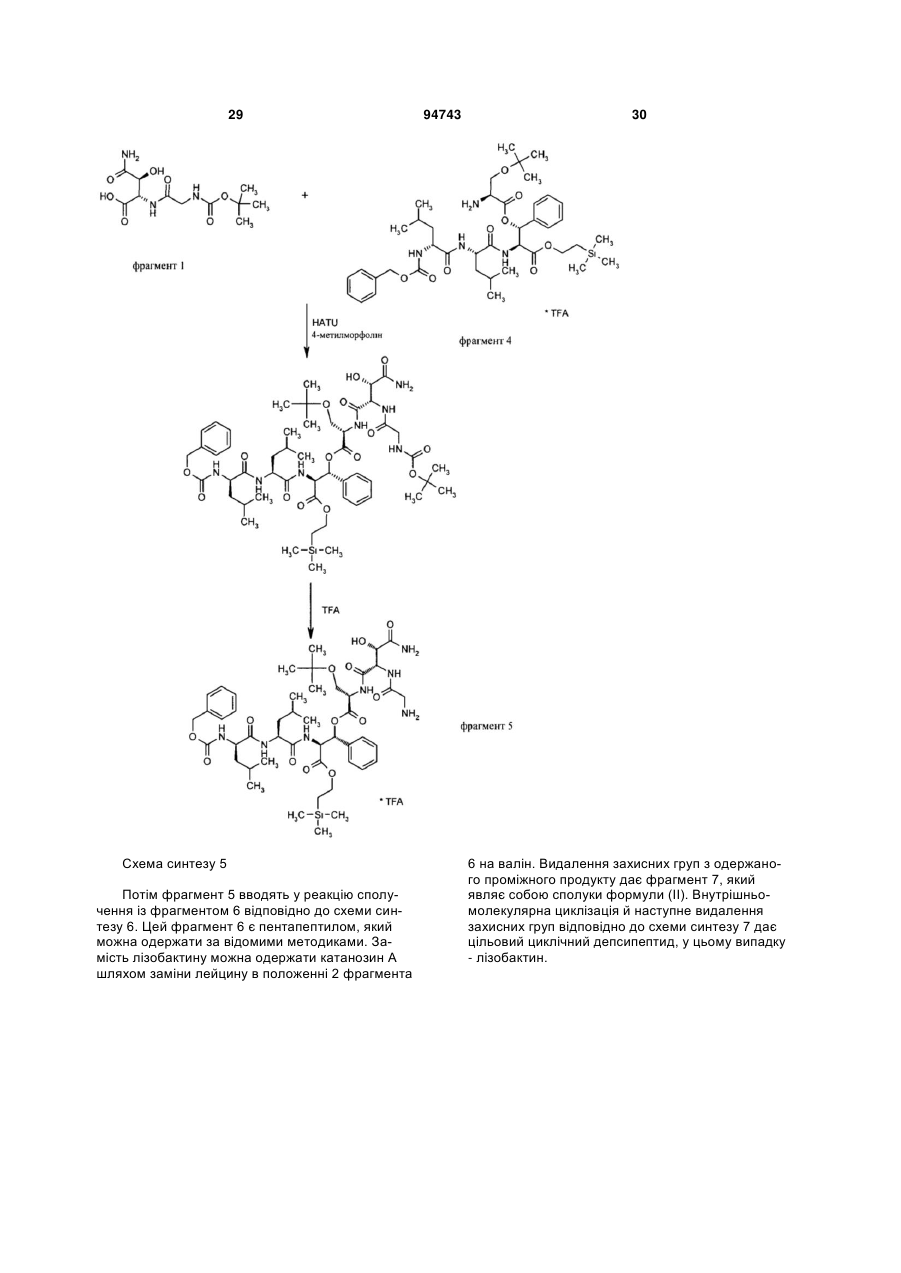
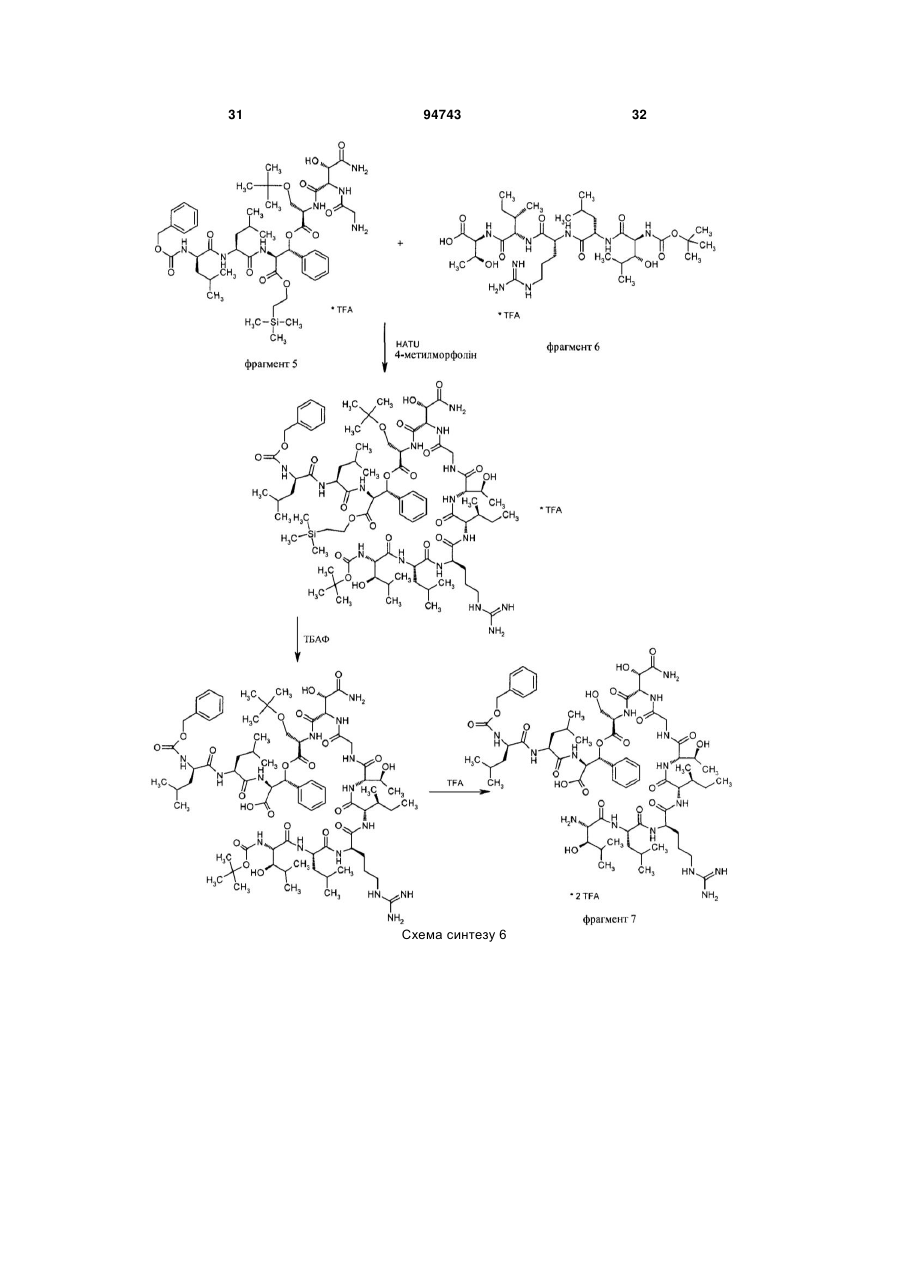
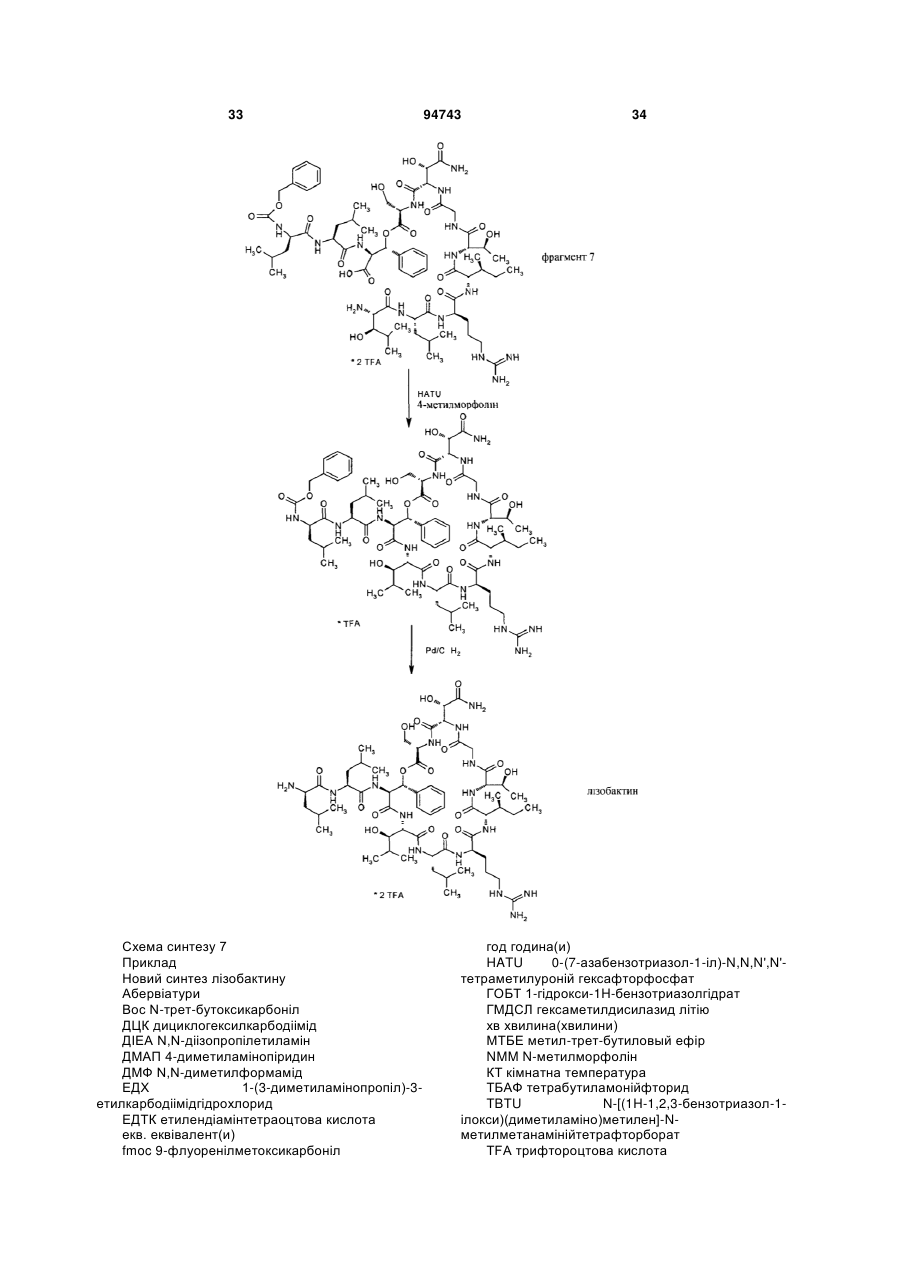
Спосіб одержання похідних лізобактину
Номер патенту: 94743
Опубліковано: 10.06.2011
Автори: Кьобберлінг Йоханнес, Хебіх Дітер, Анлауф Соня, Тельсер Йоахім, фон Нуссбаум Франц
Формула / Реферат
1. Спосіб одержання циклічних депсипептидів наступної формули (І)
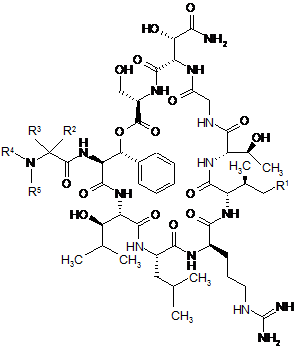 , (I)
, (I)
у якій R1 означає Н або СН3,
у якій R2 означає водень, С3-С6-циклоалкіл, С5-С6-циклоалкеніл, С3-С6-циклоалкілметил, 5-7-членний гетероциклілметил, метил, етил, н-пропіл, ізопропіл, 1-метилпроп-1-іл, 2-метилпроп-1-іл, 2,2-диметилпроп-1-іл, 1,1-диметилпроп-1-іл, 1-етилпроп-1-іл, 1-етил-1-метилпроп-1-іл, н-бутил, 2-метилбут-1-ил, 3-метилбут-1-ил, 1-етилбут-1-ил, трет-бутил, 4-метилпент-1-ил, н-гексил, алкеніл або арил,
у якій R2 можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, триметилсиліл, алкіл, алкоксигрупу, бензилоксигрупу, С3-С6-циклоалкіл, арил, 5-10-членний гетероарил, алкіламіногрупу, ариламіногрупу, алкілкарбоніламіногрупу, арилкарбоніламіногрупу, алкілкарбоніл, алкоксикарбоніл, арилкарбоніл і бензилоксикарбоніламіногрупу,
де арил і гетероарил, у свою чергу, можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, нітрогрупу, алкіл, алкоксигрупу і феніл,
у якій R3 означає водень або С1-С4-алкіл,
або
у якій R2 і R3 разом з атомом вуглецю, з яким вони зв'язані, утворюють С3-С6-циклоалкільне кільце або 5-7-членне гетероциклільне кільце, де циклоалкільне кільце й гетероциклільне кільце можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає трифторметил, алкіл, алкоксигрупу та алкілкарбоніл,
у якій R4 означає алкіл, С3-С6-циклоалкіл, 5-7-членний гетероцикліл, арил, 5- або 6-членний гетероарил, алкілкарбоніл, алкоксикарбоніл, С3-С6-циклоалкілкарбоніл, 5-7-членний гетероциклілкарбоніл, арилкарбоніл, 5- або 6-членний гетероарилкарбоніл або алкіламінокарбоніл,
у якій алкіл, циклоалкіл, гетероцикліл, арил, гетероарил, алкоксикарбоніл, циклоалкілкарбоніл, гетероциклілкарбоніл, арилкарбоніл, гетероарилкарбоніл і алкіламінокарбоніл можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, алкіламіногрупу і феніл,
та
у якій алкілкарбоніл заміщений аміногрупою або алкіламіногрупою,
та
у якій алкілкарбоніл може містити ще 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, триметилсиліл, алкоксигрупу, алкілтіогрупу, бензилоксигрупу, С3-С6-циклоалкіл, феніл, нафтил, 5-10-членний гетероарил, алкілкарбоніламіногрупу, алкоксикарбоніламіногрупу, арилкарбоніламіногрупу, арилкарбонілоксигрупу, бензилоксикарбоніл і бензилоксикарбоніламіногрупу,
у якій феніл і гетероарил, у свою чергу, можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, нітрогрупу, алкіл, алкоксигрупу і феніл,
або два замісники одного атома вуглецю в алкілкарбонілі разом з атомом вуглецю, з яким вони зв'язані, утворюють С3-С6-циклоалкільне кільце або 5-7-членне гетероциклільне кільце,
у якій циклоалкільне кільце та гетероциклільне кільце можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає трифторметил, алкіл і алкоксигрупу,
або
у якій циклоалкільне кільце може бути сконденсоване з бензольним кільцем,
у якій R5 означає водень, С1-С4-алкіл, циклопропіл або циклопропілметил,
або
у якій R4 і R5 разом з атомом азоту, з яким вони зв'язані, утворюють 5-7-членне гетероциклільне кільце, де гетероциклільне кільце може містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, алкіл, алкоксигрупу й алкіламіногрупу,
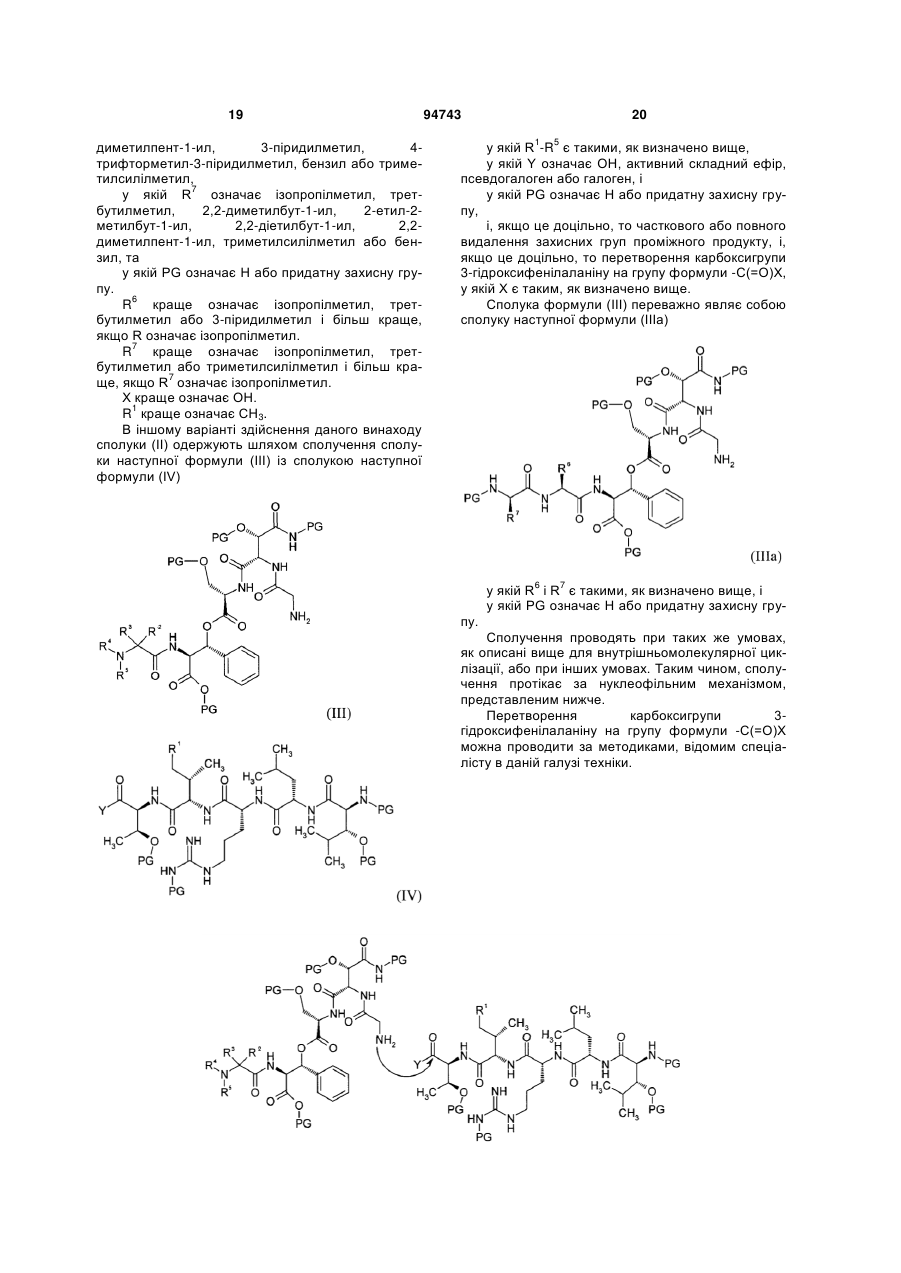
в якому здійснюють внутрішньомолекулярну циклізацію сполуки наступної формули (II)
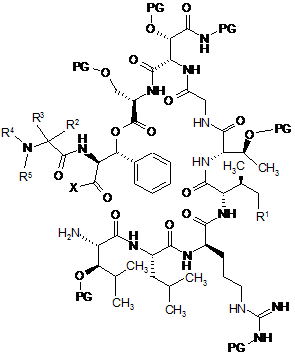 , (II)
, (II)
у якій R1-R5 є такими, як визначено вище,
у якій X означає ОН, активний складний ефір, псевдогалоген або галоген, і
у якій PG означає Н або придатну захисну групу,
і з наступним видаленням захисних груп циклічного проміжного продукту з утворенням циклічного депсипептиду формули (І).
2. Спосіб за п. 1, який відрізняється тим, що сполука формули (II) являє собою сполуку наступної формули (IIа)
 , (IIа)
, (IIа)
у якій X і R1 є такими, як визначено в п. 1,
у якій R6 означає ізопропілметил, трет-бутилметил, 2,2-диметилбут-1-ил, 2-етил-2-метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2-диметилпент-1-ил, 3-піридилметил, 4-трифторметил-3-піридилметил, бензил або триметилсилілметил,
у якій R7 означає ізопропілметил, трет-бутилметил, 2,2-диметилбут-1-ил, 2-етил-2-метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2-диметилпент-1-ил, триметилсилілметил або бензил, та
у якій PG означає Н або придатну захисну групу.
3. Спосіб за п. 2, який відрізняється тим, що
R6 означає ізопропілметил, трет-бутилметил або 3-піридилметил, і
R7 означає ізопропілметил, трет-бутилметил або триметилсилілметил.
4. Спосіб за п. 3, який відрізняється тим, що R6=R7 і означає ізопропілметил.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що X означає ОН.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що R1 означає СН3.
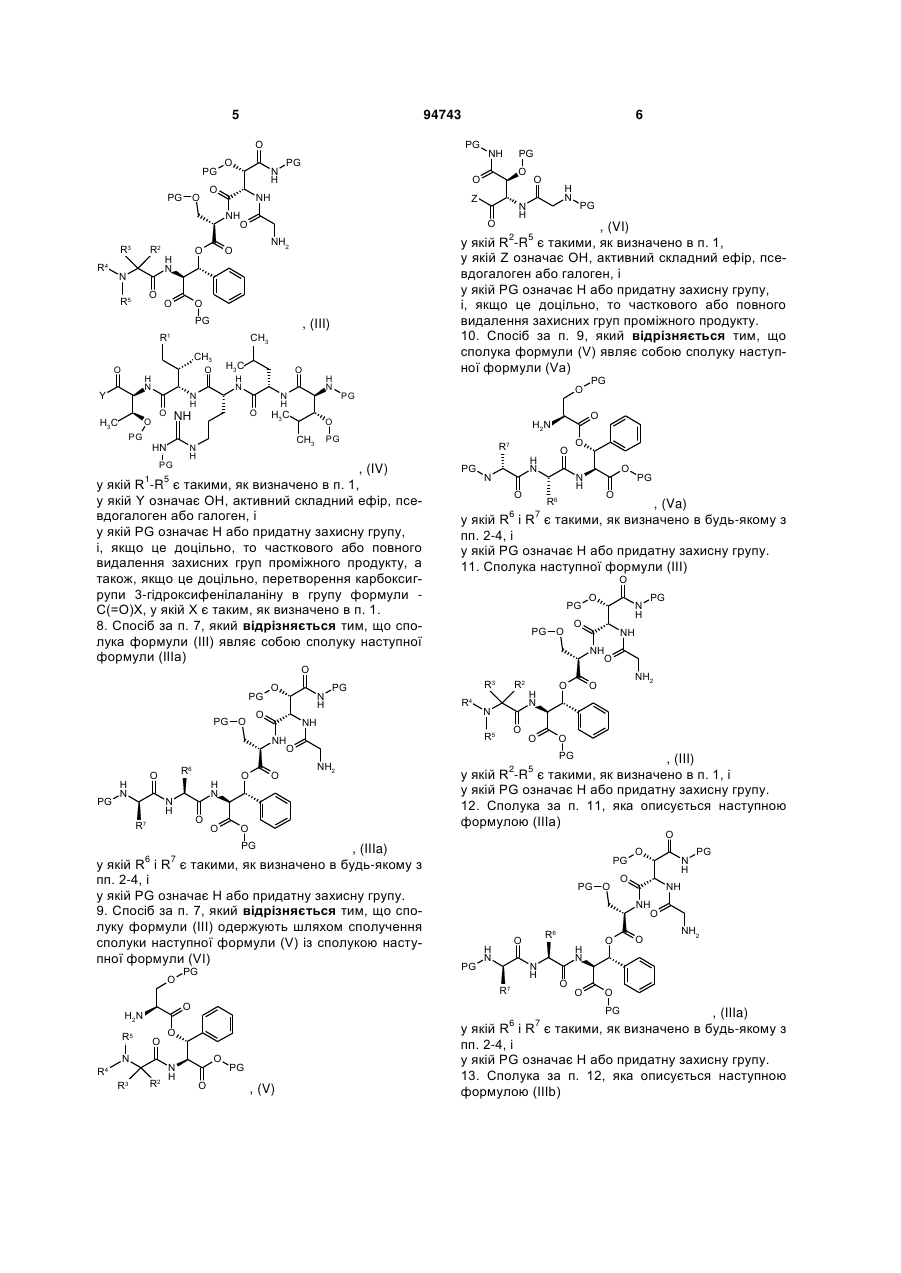
7. Спосіб за п. 1, який відрізняється тим, що сполуку формули (II) одержують шляхом сполучення сполуки наступної формули (III) із сполукою наступної формули (IV)
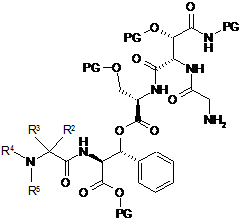 , (III)
, (III)
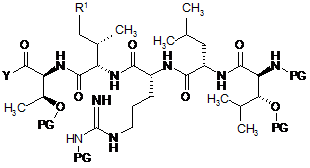 , (IV)
, (IV)
у якій R1-R5 є такими, як визначено в п. 1,
у якій Y означає ОН, активний складний ефір, псевдогалоген або галоген, і
у якій PG означає Н або придатну захисну групу,
і, якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту, а також, якщо це доцільно, перетворення карбоксигрупи 3-гідроксифенілаланіну в групу формули -С(=О)Х, у якій X є таким, як визначено в п. 1.
8. Спосіб за п. 7, який відрізняється тим, що сполука формули (III) являє собою сполуку наступної формули (IIIа)
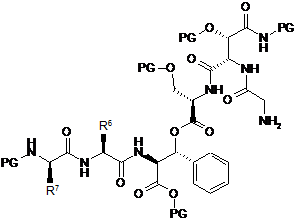 , (IIIa)
, (IIIa)
у якій R6 і R7 є такими, як визначено в будь-якому з пп. 2-4, і
у якій PG означає Н або придатну захисну групу.
9. Спосіб за п. 7, який відрізняється тим, що сполуку формули (III) одержують шляхом сполучення сполуки наступної формули (V) із сполукою наступної формули (VI)
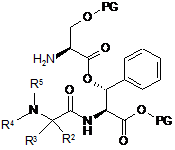 , (V)
, (V) 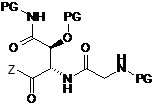 , (VI)
, (VI)
у якій R2-R5 є такими, як визначено в п. 1,
у якій Z означає ОН, активний складний ефір, псевдогалоген або галоген, і
у якій PG означає Н або придатну захисну групу,
і, якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту.
10. Спосіб за п. 9, який відрізняється тим, що сполука формули (V) являє собою сполуку наступної формули (Va)
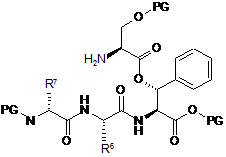 , (Va)
, (Va)
у якій R6 і R7 є такими, як визначено в будь-якому з пп. 2-4, і
у якій PG означає Н або придатну захисну групу.
11. Сполука наступної формули (III)
 , (III)
, (III)
у якій R2-R5 є такими, як визначено в п. 1, і
у якій PG означає Н або придатну захисну групу.
12. Сполука за п. 11, яка описується наступною формулою (IIIа)
 , (IIIa)
, (IIIa)
у якій R6 і R7 є такими, як визначено в будь-якому з пп. 2-4, і
у якій PG означає Н або придатну захисну групу.
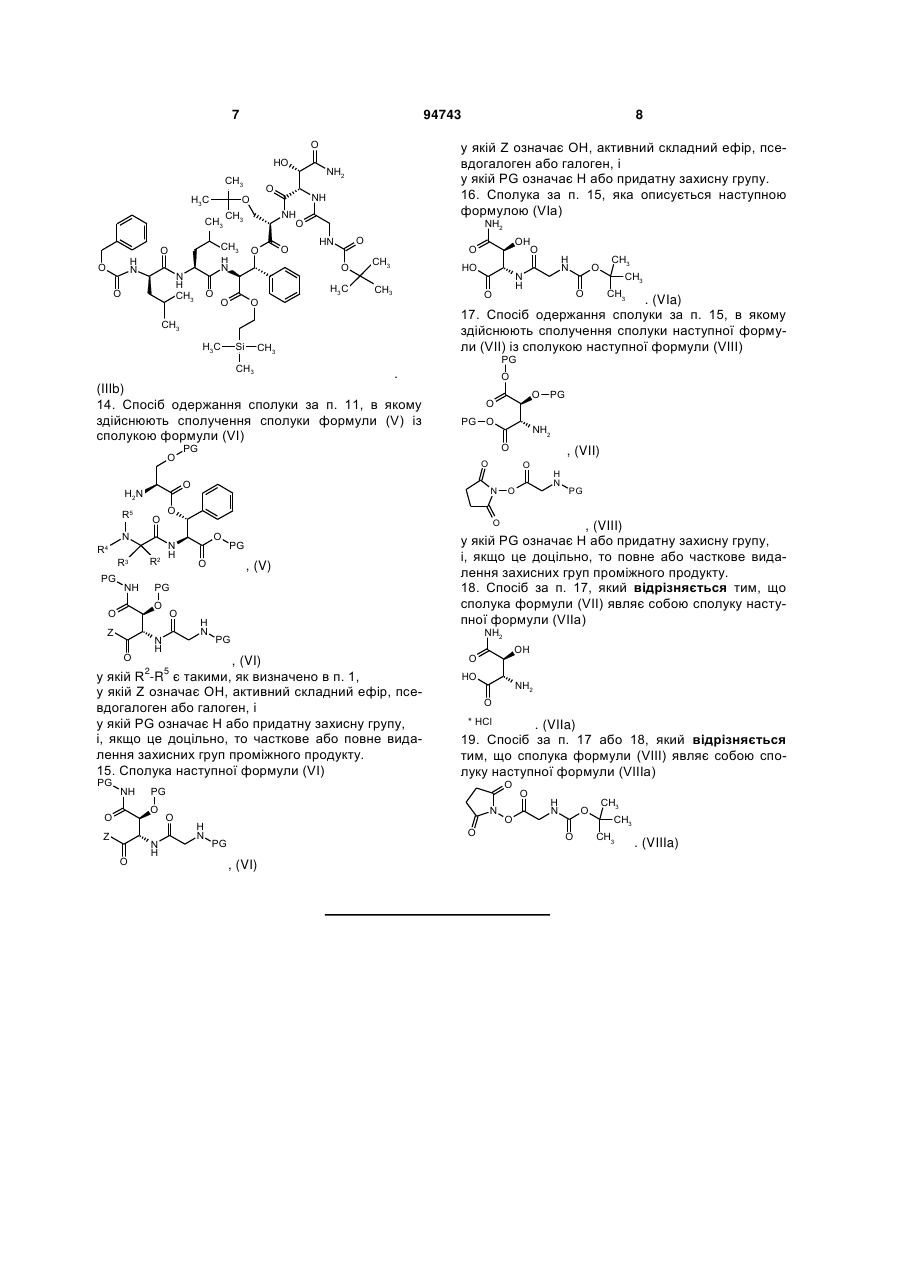
13. Сполука за п. 12, яка описується наступною формулою (IIIb)
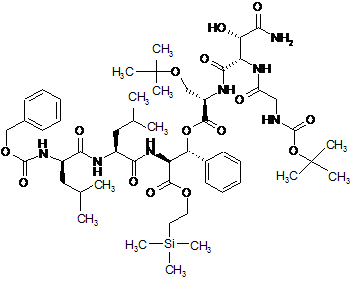 . (IIIb)
. (IIIb)
14. Спосіб одержання сполуки за п. 11, в якому здійснюють сполучення сполуки формули (V) із сполукою формули (VI)
 , (V)
, (V)  , (VI)
, (VI)
у якій R2-R5 є такими, як визначено в п. 1,
у якій Z означає ОН, активний складний ефір, псевдогалоген або галоген, і
у якій PG означає Н або придатну захисну групу,
і, якщо це доцільно, то часткове або повне видалення захисних груп проміжного продукту.
15. Сполука наступної формули (VI)
 , (VI)
, (VI)
у якій Z означає ОН, активний складний ефір, псевдогалоген або галоген, і
у якій PG означає Н або придатну захисну групу.
16. Сполука за п. 15, яка описується наступною формулою (VIa)
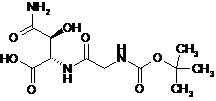 . (VIa)
. (VIa)
17. Спосіб одержання сполуки за п. 15, в якому здійснюють сполучення сполуки наступної формули (VII) із сполукою наступної формули (VIII)
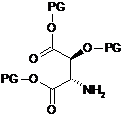 , (VII)
, (VII) 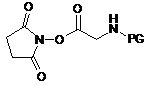 , (VIII)
, (VIII)
у якій PG означає Н або придатну захисну групу,
і, якщо це доцільно, то повне або часткове видалення захисних груп проміжного продукту.
18. Спосіб за п. 17, який відрізняється тим, що сполука формули (VII) являє собою сполуку наступної формули (VIIa)
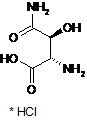 . (VIIa)
. (VIIa)
19. Спосіб за п. 17 або 18, який відрізняється тим, що сполука формули (VIII) являє собою сполуку наступної формули (VIIIa)
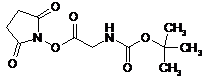 . (VIIIa)
. (VIIIa)
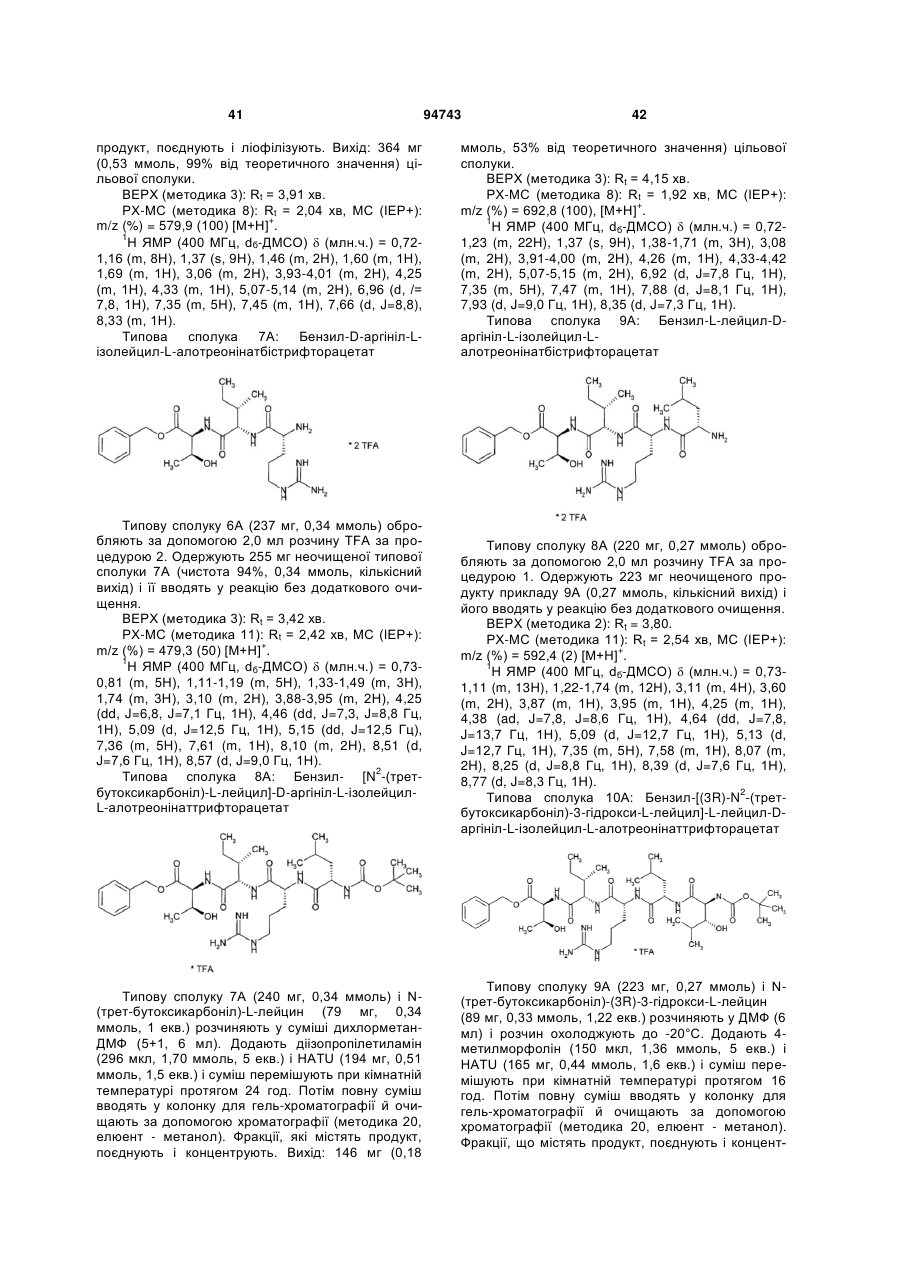
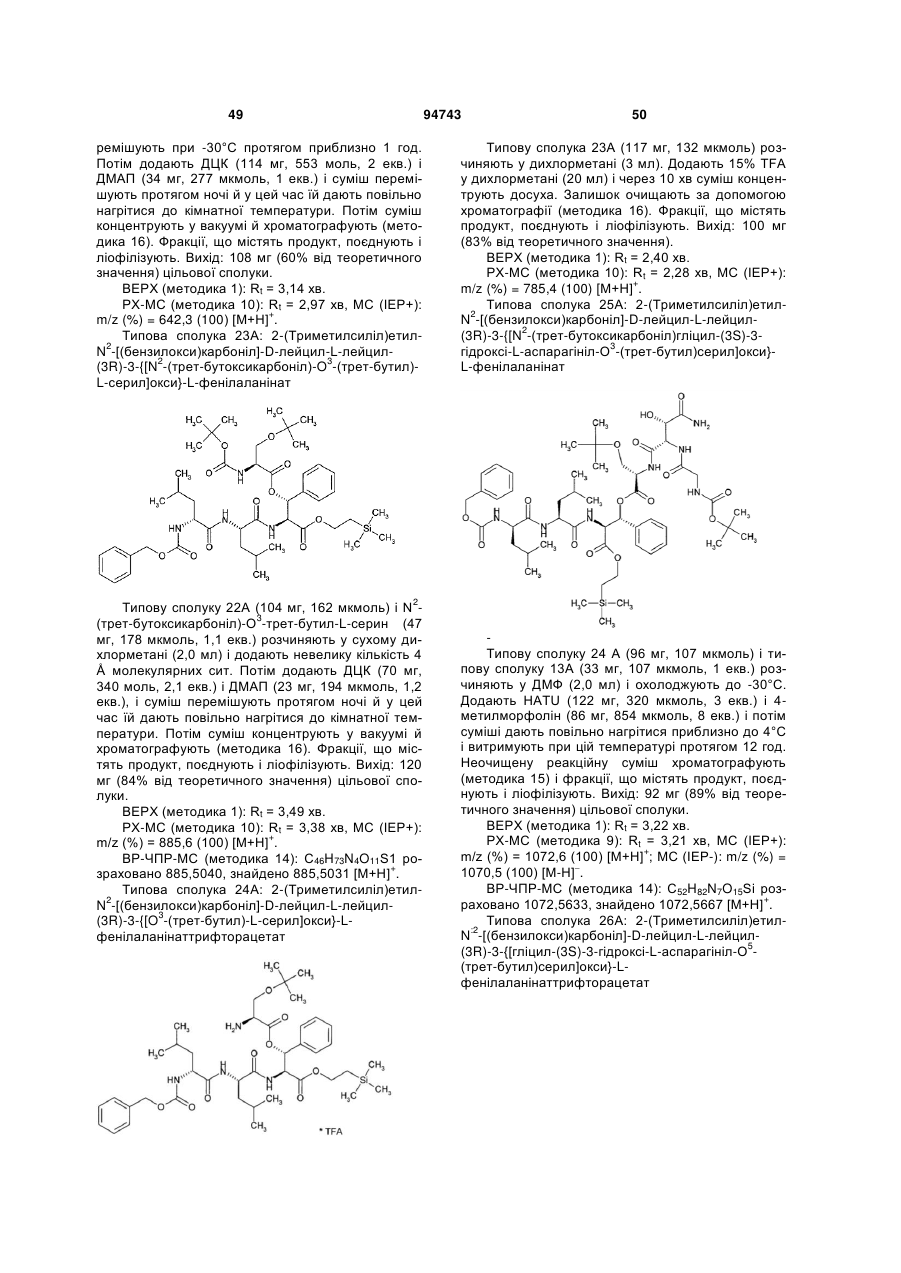
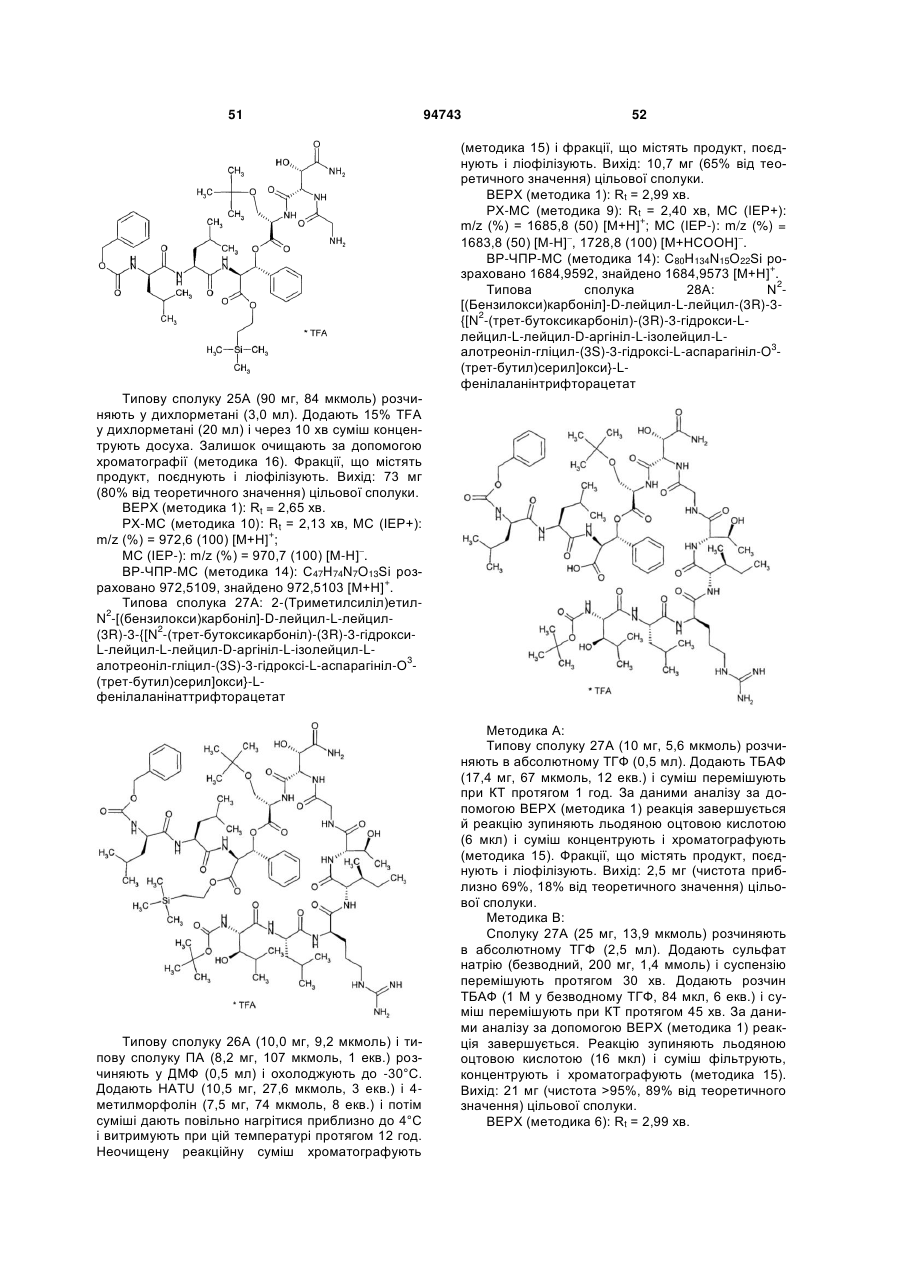
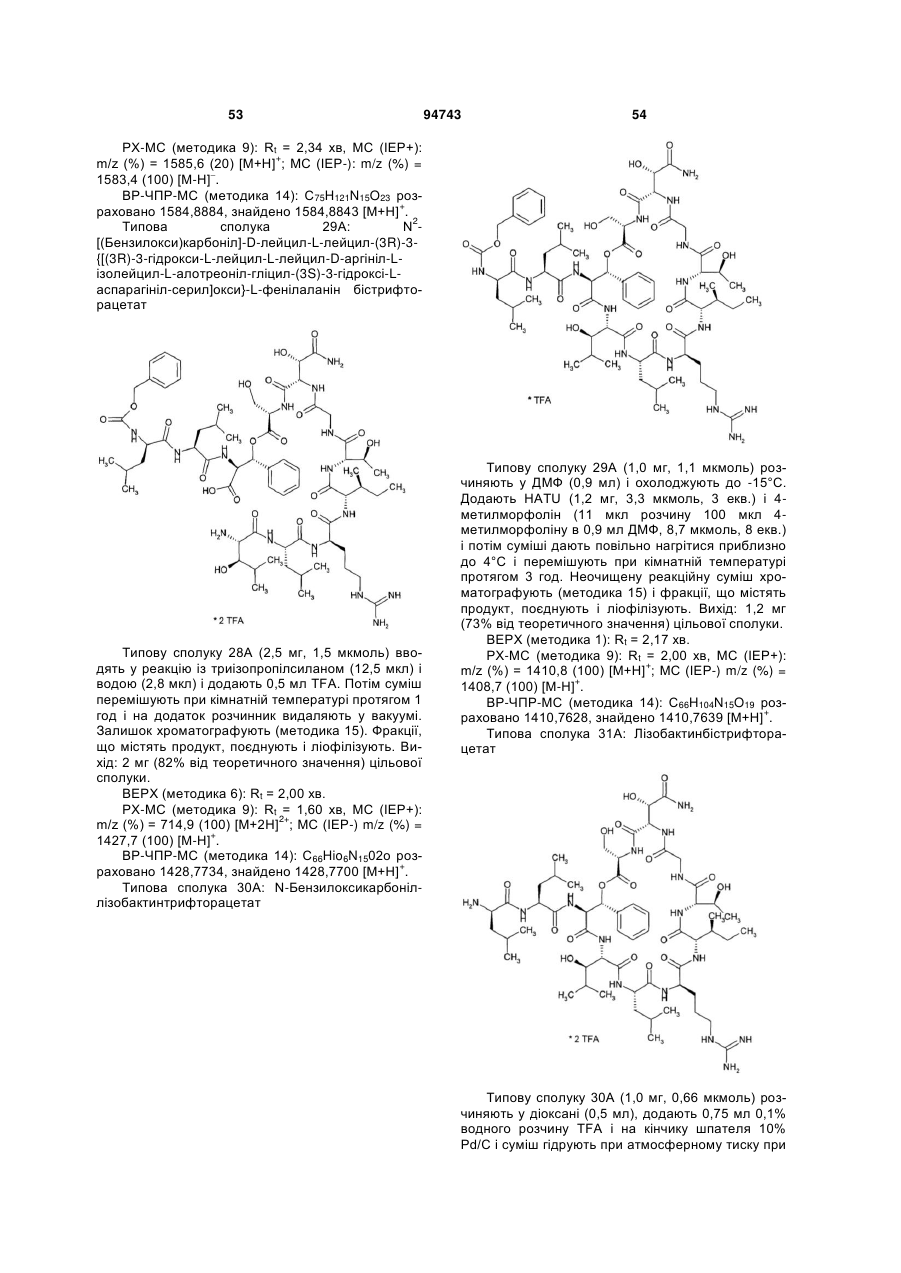
Текст
1. Спосіб одержання циклічних депсипептидів наступної формули (І) C2 2 (19) 1 3 94743 у якій алкілкарбоніл заміщений аміногрупою або алкіламіногрупою, та у якій алкілкарбоніл може містити ще 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, триметилсиліл, алкоксигрупу, алкілтіогрупу, бензилоксигрупу, С3-С6-циклоалкіл, феніл, нафтил, 5-10членний гетероарил, алкілкарбоніламіногрупу, алкоксикарбоніламіногрупу, арилкарбоніламіногрупу, арилкарбонілоксигрупу, бензилоксикарбоніл і бензилоксикарбоніламіногрупу, у якій феніл і гетероарил, у свою чергу, можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, нітрогрупу, алкіл, алкоксигрупу і феніл, або два замісники одного атома вуглецю в алкілкарбонілі разом з атомом вуглецю, з яким вони зв'язані, утворюють С3-С6-циклоалкільне кільце або 5-7-членне гетероциклільне кільце, у якій циклоалкільне кільце та гетероциклільне кільце можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає трифторметил, алкіл і алкоксигрупу, або у якій циклоалкільне кільце може бути сконденсоване з бензольним кільцем, 5 у якій R означає водень, С1-С4-алкіл, циклопропіл або циклопропілметил, або 4 5 у якій R і R разом з атомом азоту, з яким вони зв'язані, утворюють 5-7-членне гетероциклільне кільце, де гетероциклільне кільце може містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, алкіл, алкоксигрупу й алкіламіногрупу, в якому здійснюють внутрішньомолекулярну циклізацію сполуки наступної формули (II) PG O O N H O PG O PG NH NH O R3 R2 H N R4 N HN O O HN R5 O X O PG H3C PG CH3 O O O H2N O O H N CH3 CH3 O O NH R1 N H CH3 CH3 NH HN PG NH , (II) у якій R -R є такими, як визначено вище, у якій X означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Н або придатну захисну групу, 1 5 4 і з наступним видаленням захисних груп циклічного проміжного продукту з утворенням циклічного депсипептиду формули (І). 2. Спосіб за п. 1, який відрізняється тим, що сполука формули (II) являє собою сполуку наступної формули (IIа) PG O O O PG O H PG N R7 N H PG NH NH O O R6 H N N H HN O O HN O X H2 N O PG O O PG H3C CH3 NH R1 O O O H N CH3 CH3 O O N H CH3 CH3 NH HN PG NH , (IIа) 1 у якій X і R є такими, як визначено в п. 1, 6 у якій R означає ізопропілметил, третбутилметил, 2,2-диметилбут-1-ил, 2-етил-2метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2диметилпент-1-ил, 3-піридилметил, 4трифторметил-3-піридилметил, бензил або триметилсилілметил, 7 у якій R означає ізопропілметил, третбутилметил, 2,2-диметилбут-1-ил, 2-етил-2метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2диметилпент-1-ил, триметилсилілметил або бензил, та у якій PG означає Н або придатну захисну групу. 3. Спосіб за п. 2, який відрізняється тим, що 6 R означає ізопропілметил, трет-бутилметил або 3-піридилметил, і 7 R означає ізопропілметил, трет-бутилметил або триметилсилілметил. 4. Спосіб за п. 3, який відрізняється тим, що 6 7 R =R і означає ізопропілметил. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що X означає ОН. 6. Спосіб за будь-яким з пп. 1-5, який відрізняєть1 ся тим, що R означає СН3. 7. Спосіб за п. 1, який відрізняється тим, що сполуку формули (II) одержують шляхом сполучення сполуки наступної формули (III) із сполукою наступної формули (IV) 5 94743 O PG PG O O PG N H O PG R4 R2 N O R5 O Z O PG O , (III) CH3 CH3 O H N Y N H O O H3 C H3C H N O O NH PG H N N H PG O PG O PG , (IV) 1 5 у якій R -R є такими, як визначено в п. 1, у якій Y означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Н або придатну захисну групу, і, якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту, а також, якщо це доцільно, перетворення карбоксигрупи 3-гідроксифенілаланіну в групу формули С(=О)Х, у якій X є таким, як визначено в п. 1. 8. Спосіб за п. 7, який відрізняється тим, що сполука формули (III) являє собою сполуку наступної формули (IIIа) R7 PG O H N N O PG PG O O N H O PG R6 O O PG PG O H N H N N H O R7 O R3 R4 R2 N O R5 NH2 O O N H O NH O NH2 O O H N O PG , (III) 2 5 у якій R -R є такими, як визначено в п. 1, і у якій PG означає Н або придатну захисну групу. 12. Сполука за п. 11, яка описується наступною формулою (IIIа) O PG , (IIIa) 6 7 у якій R і R є такими, як визначено в будь-якому з пп. 2-4, і у якій PG означає Н або придатну захисну групу. 9. Спосіб за п. 7, який відрізняється тим, що сполуку формули (III) одержують шляхом сполучення сполуки наступної формули (V) із сполукою наступної формули (VI) O R5 O N R4 R3 PG R2 O N H PG PG O O O PG , (V) O O N H PG NH NH O PG R6 O H N N H R7 O H2 N PG NH O NH O O PG O R6 , (Va) 6 7 у якій R і R є такими, як визначено в будь-якому з пп. 2-4, і у якій PG означає Н або придатну захисну групу. 11. Сполука наступної формули (III) PG NH O O N H O O PG O H2N PG CH3 N H HN H N N H H3 C O , (VI) 2 5 у якій R -R є такими, як визначено в п. 1, у якій Z означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Н або придатну захисну групу, і, якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту. 10. Спосіб за п. 9, який відрізняється тим, що сполука формули (V) являє собою сполуку наступної формули (Va) NH2 R1 PG O O O O H N NH O NH NH O R3 6 H N O O O O NH2 O PG , (IIIa) 6 7 у якій R і R є такими, як визначено в будь-якому з пп. 2-4, і у якій PG означає Н або придатну захисну групу. 13. Сполука за п. 12, яка описується наступною формулою (IIIb) 7 94743 O HO CH3 H3 C CH3 O N H CH3 O O у якій Z означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Н або придатну захисну групу. 16. Сполука за п. 15, яка описується наступною формулою (VIa) NH2 NH NH O CH3 CH3 H N O H N O O O O NH2 O HN O CH3 HO CH3 CH3 R5 N H R2 NH O Z O N H O NH O Z O O N O O PG O , (V) H N PG NH2 OH O HO NH2 O * HCl . (VIIa) 19. Спосіб за п. 17 або 18, який відрізняється тим, що сполука формули (VIII) являє собою сполуку наступної формули (VIIIa) O PG N H H N , (VIII) у якій PG означає Н або придатну захисну групу, і, якщо це доцільно, то повне або часткове видалення захисних груп проміжного продукту. 18. Спосіб за п. 17, який відрізняється тим, що сполука формули (VII) являє собою сполуку наступної формули (VIIa) PG 5 O , (VII) O , (VI) у якій R -R є такими, як визначено в п. 1, у якій Z означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Н або придатну захисну групу, і, якщо це доцільно, то часткове або повне видалення захисних груп проміжного продукту. 15. Сполука наступної формули (VI) 2 NH2 O PG PG O PG PG O O R4 PG O PG O O O N R3 CH3 CH3 O O O H2 N CH3 PG . (IIIb) 14. Спосіб одержання сполуки за п. 11, в якому здійснюють сполучення сполуки формули (V) із сполукою формули (VI) O O . (VIa) 17. Спосіб одержання сполуки за п. 15, в якому здійснюють сполучення сполуки наступної формули (VII) із сполукою наступної формули (VIII) CH3 Si H N N H O O H3 C OH O O CH3 H3 C O 8 O N H N O PG , (VI) O O H N O O CH3 CH3 CH3 . (VIIIa) 9 Даний винахід стосується способу одержання циклічних депсипептидів наступної формули (І) 1 у якій R означає Η або СН3, 2 у якій R означає водень, С3-С6-циклоалкіл, С5С6-циклоалкеніл, С3-С6-циклоалкілметил, 5- - 7членний гетероциклілметил, метил, етил, н-пропіл, ізопропіл, 1-метилпроп-1-іл, 2-метилпроп-1-іл, 2,2диметилпроп-1-іл, 1,1-диметилпроп-1-іл, 1етилпроп-1-іл, 1-етил-1-метилпроп-1-іл, н-бутил, 2метилбут-1-ил, 3-метилбут-1-ил, 1-етилбут-1-ил, трет-бутил, 4-метилпент-1-ил, н-гексил, алкеніл або арил, 2 у якій R можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, триметилсиліл, алкіл, алкоксигрупу, бензилоксигрупу, С3-С6-циклоалкіл, арил, 5- - 10членний гетероарил, алкіламіногрупу, ариламіногрупу, алкілкарбоніламіногрупу, арилкарбоніламіногрупу, алкілкарбоніл, алкоксикарбоніл, арилкарбоніл і бензилоксикарбоніламіногрупу, де арил і гетероарил, у свою чергу, можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, нітрогрупу, алкіл, алкоксиг3 рупу і феніл, у якій R означає водень або С1-С4алкіл, або 2 3 у якій R і R разом з атомом вуглецю, з яким вони зв'язані, утворюють С3-С6-циклоалкільне кільце або 5- - 7-членне гетероциклільне кільце, де циклоалкільне кільце та гетероциклільне кільце можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає трифторметил, алкіл, алкоксигрупу та алкілкарбоніл, 4 у якій R означає алкіл, С3-С6-циклоалкіл, 5- 7-членний гетероцикліл, арил, 5- або 6-членний гетероарил, алкілкарбоніл, алкоксикарбоніл, С3-С6циклоалкілкарбоніл, 5- - 7-членний гетероциклілкарбоніл, арилкарбоніл, 5- або 6-членний гетероа 94743 10 рилкарбоніл або алкіламінокарбоніл, у якій алкіл, циклоалкіл, гетероцикліл, арил, гетероарил, алкоксикарбоніл, циклоалкілкарбоніл, гетероциклілкарбоніл, арилкарбоніл, гетероарилкарбоніл і алкіламінокарбоніл можуть містити 0, 1, 2 або 3 замісники, незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, алкіламіногрупу і феніл, та у якій алкілкарбоніл заміщений аміногрупою або алкіламіногрупою, та у якій алкілкарбоніл може містити ще 0, 1,2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає галоген, гідроксигрупу, триметилсиліл, алкоксигрупу, алкілтіогрупу, бензилоксигрупу, С3-С6-циклоалкіл, феніл, нафтил, 5- 10-членний гетероарил, алкілкарбоніламіногрупу, алкоксикарбоніламіногрупу, арилкарбоніламіногрупу, арилкарбонілоксигрупу, бензилоксикарбоніл і бензилоксикарбоніламіногрупу, у якій феніл і гетероарил, у свою чергу, можуть містити 0,1,2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає галоген, гідроксигрупу, нітрогрупу, алкіл, алкоксигрупу і феніл, або два замісники одного атома вуглецю в алкілкарбонілі разом з атомом вуглецю, з яким вони зв'язані, утворюють С3-С6-циклоалкільне кільце або 5- - 7-членне гетероциклільне кільце, у якій циклоалкільне кільце та гетероциклільне кільце можуть містити 0,1,2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає трифторметил, алкіл і алкоксигрупу, або у якій циклоалкільне кільце може бути сконденсоване з бензольним кільцем, 5 у якій R означає водень, С1-С4-алкіл, циклопропіл або циклопропілметил, або 4 5 у якій R і R разом з атомом азоту, з яким вони зв'язані, утворюють 5- - 7-членне гетероциклільне кільце, де гетероциклільне кільце може містити 0, 1, 2 або 3 замісники, незалежно один від одного вибраних із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, алкіл, алкоксигрупу й алкіламіногрупу, а також сполук, застосовних у цьому способі. Циклічні депсипептиди, представлені вище, зокрема, включають два натуральних продукти, представлених нижче, які називаються лізобактин і катанозин А. Ці речовини є інгібіторами біосинтезу стінок клітин бактерій і тому мають антибактеріальну активність. 11 94743 12 лізобактин, R=СН3 катанозин A, R = Η Стінки клітин бактерій синтезуються за допомогою ряду ферментів (біосинтез стінки клітини) і вони важливі для забезпечення життєздатності та розмноження мікроорганізмів. Структура цієї макромолекули, а також білки та проміжні продукти ("попередники"), які приймають участь у її синтезі, зберігаються в бактерії незмінними. Внаслідок його важливості та однорідності, біосинтез стінок клітин є ідеальним об'єктом впливу нових антибіотиків. Ванкоміцин і пеніциліни є інгібіторами біосинтезу стінок клітин бактерій і являють собою гарні приклади антибіотичної активності для такого впливу. Їх протягом декількох десятиліть використовували в клінічних умовах для боротьби з бактеріальними інфекціями, особливо із грампозитивними патогенами. Внаслідок все зростаючого поширення резистентних мікробів, наприклад, резистентних до метициліну стафілококів, резистентних до пеніциліну пневмококів і резистентних до ванкоміцину ентерококів, а також недавно вперше виявлених резистентних до ванкоміцину стафілококів, ці речовини все більшою мірою втрачають свою терапевтичну ефективність. До цього часу лізобактин одержували шляхом ферментації з використанням, наприклад, Lysobacter sp. SC 14067. З WO 2004/099239 Α1 також відома методика, яка включає видалення двох лейцинових фрагментів, які утворюють лінійний сегмент, і їх заміну іншими групами. У цей час відсутній спосіб одержання лізобактину, катанозину А або їх похідних, які містять зміни в лінійних сегментах, шляхом повного синтезу. Тому задачею даного винаходу є розробка способу одержання циклічних депсипептидів зазначеної вище формули (І). Ця задача вирішена за допомогою способу одержання циклічних депсипептидів формули (І) за допомогою внутрішньомолекулярної циклізації сполуки наступної формули (II) 1 5 у якій R -R є такими, як визначено вище, у якій X означає ОН, активний складний ефір, псевдогалоген (наприклад, азид) або галоген, і у якій PG означає Н або придатну захисну групу, і з наступним видаленням захисних груп циклічного проміжного продукту з утворенням циклічного депсипептиду формули (І). Цей спосіб характеризується тим, що гідрокси--амінокислоту (у цьому випадку фенілсерин = -гідроксифенілаланін), етерифіко3 вану за атомом О , на стадії циклізації хімічно активують і потім вона стає донором ацильної групи. Циклізацію проводять шляхом утворення амідної групи (утворення лактаму), а не за реакцією етерифікації (утворення лактону). Спосіб також характеризується тим, що циклічний сегмент петлеподібної депсипептидної структури одержують циклізацією за містковою амінокислотою (у цьому випадку за гідроксифенілаланіном). Для задач даного винаходу замісники, якщо не зазначено інше, мають наступні значення: Алкіл сам по собі й "алкіл" в алкоксигрупі, алкіламіногрупі, алкілкарбонілі, алкоксикарбонілі, алкіламінокарбонілі та алкілкарбоніламіногрупі означає лінійний або розгалужений алкільний радикал, який звичайно містить від 1 до 6, краще від 1 до 4, особливо краще - від 1 до З атомів вуглецю, наприклад і краще - метил, етил, н-пропіл, ізопропіл, трет-бутил, н-пентил і н-гексил. Алкоксигрупа наприклад і краще означає метоксигрупу, етоксигрупу, н-пропоксигрупу, ізопропоксигрупу, трет-бутоксигрупу, н-пентоксигрупу або н-гексоксигрупу. Алкеніл означає алкенільньїй радикал, який має лінійний або розгалужений ланцюг, який містить від 2 до 6 атомів вуглецю. Перевагу надають алкенільному радикалу, який має лінійний або розгалужений ланцюг, що містить від 2 до 4, особливо 13 краще - який містить від 2 до 3 атомів вуглецю. Прикладами, які переважно можна відзначити, є: вініл, аліл, н-проп-1-ен-1-іл, н-бут-2-ен-1-іл, 2метилпроп-1-ен-1-іл і 2-метилпроп-2-ен-1-іл. Алкіламіногрупа означає алкіламіновий радикал, який містить 1 або 2 алкільних замісники (вибраних незалежно один від одного), наприклад і краще -метиламіногрупу, етиламіногрупу, нпропіламіногрупу, ізопропіламіногрупу, трет-бутил аміногрупу, н-пентиламіногрупу, н-гексил аміногрупу, Ν,Ν-диметиламіногрупу, Ν,Νдієтиламіногрупу, N-етил-N-метиламіногрупу, Nметил-N-н-пропіламіногрупу, N-ізопропіл-N-нпропіламіногрупу, N-трет-бутил-Nметиламіногрупу, N-етил-N-н-пентиламіногрупу або N-н-гексил-N-метиламіногрупу. Ариламіногрупа означає ариламіновий радикал, який містить один арильний замісник і необов'язково додатковий замісник, такий як, наприклад, арил або алкіл, наприклад і краще - феніламіногрупу, нафтиламіногрупу, фенілметиламіногрупу або дифеніламіногрупу. Алкілкарбоніл означає алкілкарбонільний радикал, який містить один алкільний замісник, наприклад і краще - метилкарбоніл, етилкарбоніл, нпропілкарбоніл, ізопропілкарбоніл, третбутилкарбоніл, н-пентилкарбоніл або нгексилкарбоніл. Алкоксикарбоніл означає алкоксикарбонільний радикал, який містить один алкоксильний замісник, наприклад і краще - метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл, трет-бутоксикарбоніл, н-пентоксикарбоніл або нгексоксикарбоніл. Циклоалкілкарбоніл означає циклоалкілкарбонільний радикал, який містить один циклоалкільний замісник, наприклад і краще циклопропілкарбоніл, циклобутилкарбоніл, циклопентилкарбоніл або циклогексилкарбоніл. Гетероциклілкарбоніл означає гетероциклілкарбонільний радикал, який містить один гетероциклільний замісник, наприклад і краще - тетрагідрофуран-2-ілкарбоніл, піролідин-2-ілкарбоніл, піролідин-3-ілкарбоніл, піролінілкарбоніл, піперидинілкарбоніл, морфолінілкарбоніл або пергідроазепінілкарбоніл. Арилкарбоніл означає арилкарбонільний радикал, який містить один арильний замісник, наприклад і краще - фенілкарбоніл, нафтилкарбоніл або фенантреніл карбоніл. Гетероарилкарбоніл означає гетероарилкарбонільний радикал, який містить один гетероарильний замісник, наприклад і краще - тієнілкарбоніл, фурилкарбоніл, піролілкарбоніл, тіазолілкарбоніл, оксазолілкарбоніл, імідазолілкарбоніл, піридилкарбоніл, піримідилкарбоніл, піридазинілкарбоніл, індолілкарбоніл, індазолілкарбоніл, бензофуранілкарбоніл, бензотіофенілкарбоніл, хінолінілкарбоніл або ізохінолінілкарбоніл. Алкілкарбоніламіногрупа означає алкілкарбоніламіновий радикал, який містить один алкільний замісник, наприклад і краще - метилкарбоніламіногрупу, етилкарбоніламіногрупу, нпропілкарбоніламіногрупу, ізопропілкарбоніламіно 94743 14 групу, трет-бутилкарбоніламіногрупу, нпентилкарбоніламіногрупу або нгексилкарбоніламіногрупу. Арилкарбоніламіногрупа означає арилкарбоніламіновий радикал, який містить один арильний замісник, наприклад і краще - фенілкарбоніламіногрупу, нафтилкарбоніламіногрупу або фенантренілкарбоніламіногрупу. Алкіламінокарбоніл означає алкіламінокарбонільний радикал, який містить 1 або 2 алкільних замісни ки (вибраних незалежно один від одного), наприклад і краще - метиламінокарбоніл, етиламінокарбоніл, н-пропіламінокарбоніл, ізопропіламінокарбоніл, трет-бутиламінокарбоніл, нпентиламінокарбоніл, н-гексиламінокарбоніл, Ν,Νдиметиламінокарбоніл, Ν,Ν-діетиламінокарбоніл, N-етил-N-метиламінокарбоніл, N-мeтил-N-нпропіламінокарбоніл, N-ізопропіл-N-нпропіламінокарбоніл, N-трет-бутил-Nметиламінокарбоніл, N-етил-N-нпентиламінокарбоніл або N-н-гексил-Nметиламінокарбоніл. Циклоалкіл означає циклоалкільну групу, яка звичайно містить від 3 до 6 атомів вуглецю, наприклад і краще - циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. Циклоалкеніл означає циклоалкенільну групу, яка звичайно містить від 5 до 6 атомів вуглецю один або два подвійних зв'язки, наприклад і краще - циклопент-1-ен-1-іл, циклопент-2-ен-1-іл, циклопент-3-ен-1-іл, циклогекс-1-ен-1-іл, циклогекс-2-ен1-іл і циклогекс-3-ен-1-іл. Арил означає моно- - трициклічний ароматичний карбоциклічний радикал, який звичайно містить від 6 до 14 атомів вуглецю; наприклад і краще - феніл, нафтил або фенантреніл. Гетероцикліл означає моноциклічний гетероциклічний радикал, який містить від 5 до 7 кільцевих атомів і до 3, переважно - до 2 гетероатомів і/або гетероатомних груп, вибраних із групи, яка включає N, О, S, SO, SO2. Гетероциклільні радикали можуть бути насиченими або частково ненасиченими. Перевагу надають 5- - 7-членним моноциклічним насиченим гетероциклільним радикалам, які містять до 2 гетероатомів, вибраних із групи, яка включає О, N і S, таких як, наприклад і краще - тетрагідрофуран-2-іл, піролідин-2-іл, піролідин-3-іл, піролініл, піперидиніл, морфолініл або пергідроазепініл. Гетроарил означає ароматичний моноциклічний радикал, який звичайно містить від 5 до 10, краще - від 5 до 6 кільцевих атомів і до 5, краще до 4 гетероатомів, вибраних із групи, яка включає S, О і N, наприклад і краще - тієніл, фурил, піроліл, тіазоліл, оксазоліл, імідазоліл, піридил, піримідил, піридазиніл, індоліл, індазоліл, бензофураніл, бензотіофеніл, хінолініл або ізохінолініл. Приєднана за карбонільною групою амінокислота означає амінокислоту, яка приєднана за карбонільною групою амінокислоти. У зв'язку із цим перевагу надають α-амінокислотам в L- або в Dконфігурації, переважно природним аамінокислотам, таким як, наприклад, гліцин, Lаланін, L-валін, L-лейцин, L-ізолейцин, L-пролін, Lфенілаланін, L-триптофан або природним ос 15 амінокислотам у D-конфігурації, яка не зустрічається в природі, таким як, наприклад, D-аланін, Dвалін, D-лейцин, D-ізолейцин, D-пролін, Dфенілаланін, D-триптофан або амінокислотам, які не зустрічається в природі та містять бічну групу, зв'язану з -атомом вуглецю амінокислоти, таку як, наприклад, С3-С6-циклоалкілметил, С3-С6циклоалкіл, етил, н-пропіл, 2,2-диметилпропіл, трет-бутил, 3-метилбутил, н-гексил або аліл, або бічну групу, яка утворює кільце з а-атомом вуглецю амінокислоти таку як, наприклад, циклопропіл (амінокислота: 1-аміно-1-циклопропанкарбонова кислота), циклобутил, циклопентил або циклогексил, або -амінокислотам (номенклатуру див. в публікації: D. Seebach, Μ. Overhand, F. N. Μ. Kühnle, Β. Martinoni, L. Oberer, U. Hommel, H. Widmer, Helv. Chim. Acta 1996, 79, 913-941), таким як, наприклад, -аланін, -фенілаланін, -Aib (метилаланін) або похідні 2,3-діамінопропіонової кислоти (наприклад, 2,3-діаміно-3фенілпропіонова кислота). Галоген означає фтор, хлор, бром або йод, краще - фтор або хлор. Термін "активний складний ефір" включає всі активні складні ефіри, відомі спеціалісту в даній галузі техніки. Приклади активних складних ефірів, кращих для даного винаходу, включають ціанометилові ефіри, п-нітрофенілові ефіри, онітрофенілові ефіри, 2,4-динітрофенілові ефіри, 2,4,5-трихлорфенілові ефіри, пентахлорфенілові ефіри, пентафторфенілові ефіри (Pfp), Nгідроксифталімідні ефіри, N-гідроксисукцинімідні ефіри (O-Su), 1-гідроксипіперидинові ефіри, 5хлор-8-гідроксихінолінові ефіри. Внутрішньомолекулярна циклізація включає утворення амідного зв'язку, що, в принципі, можна виконати за будь-якою методикою, відомою спеціалісту в даній галузі техніки. Циклізація протікає за нуклеофільним механізмом, представленим нижче. 94743 16 Якщо X означає активний складний ефір, псевдогалоген або галоген, то реакцію звичайно проводять в інертних розчинниках, якщо це доцільно, то в присутності основи, переважно - при температурі в діапазоні від -30 до 50°С при атмосферному тиску. Прикладами інертних розчинників є тетрагідрофуран, метиленхлорид, піридин, діоксан, хлороформ, діетиловий ефір, трет-бутилметиловий ефір, етилацетат і диметилформамід і кращими є метиленхлорид і диметилформамід. Прикладами основ є триетиламін, триізопропілетиламін і N-метилморфолін і кращим є триізопропілетиламін. Якщо X означає ОН, то реакцію на першій стадії звичайно проводять в інертних розчинниках, у присутності дегідратуючого реагенту, якщо це доцільно, то в присутності основи, переважно - при температурі в діапазоні від -30 до 50°С при атмосферному тиску. Прикладами інертних розчинників є галогеновані вуглеводні, такі як дихлорметан і трихлорметан, вуглеводні, такі як бензол, нітрометан, діоксан, диметилформамід і ацетонітрил. Також можна використовувати суміші розчинників. Особливо кращими розчинниками є дихлорметан і диметилформамід. Прикладами придатних дегідратуючих реагентів є карбодііміди, такі як, наприклад, Ν,Ν'-діетил-, Ν,Ν-дипропіл-, Ν,Ν-діізопропіл-, Ν,Νдициклогексилкарбодіімід, N-(3диметиламіноізопропіл)-N'етилкарбодіімідгідрохлорид (ЕДХ), Nциклогексилкарбодіімід-N'пропілоксиметилполістирол (ПС-карбодіімід), і карбонільні сполуки, такі як карбонілдіімідазол, і 1,2-оксазолієві сполуки, такі як 2-етил-5-феніл-1,2оксазолій-3-сульфат або 2-трет-бутил-5метилізоксазолійперхлорат, або ациламінові сполуки, такі як 2-етокси-1-етоксикарбоніл-1,2дигідрохінолін, і пропанфосфоновий ангідрид, або ізобутилхлорформіат, або біс(2-оксо-3оксазолідиніл)фосфорилхлорид або бензотриазолілокситри(диметиламіно)фосфонійгексафторфосфат, або О-(бензотриазол-1-іл)-Ν,Ν,Ν',Ν'тетраметилуронійгексафторфосфат (HBTU), 2-(2оксо-1-(2Н)-піридил)-1,1,3,3тетраметилуронійтетрафторборат (TPTU) або О(1-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронійгексафторфосфат (HATU) або 1гідроксибензотриазол (HOBt) або бензотриазол-1ілокситрис(диметиламіно)фосфонійгексафторфосфат (ВОР) або бензотриазол-1ілокситрис(піролідино)фосфонійгексафторфосфат (РуВОР) або N-гідроксисукцинімід або їх суміші з основами. Прикладами основ є карбонати лужних металів, такі як, наприклад, карбонат і бікарбонат натрію або калію, або органічні основи, такі як триалкіламіни, наприклад, триетиламін, Nметилморфолін, N-метилпіперидин, 4диметиламінопіридин або діізопропілетиламін. 17 Реакцію переважно проводять із використанням HATU у присутності 4-метилморфоліну. Сполуки формули (II) містять захисні групи, якщо це є доцільним, так що перед проведенням внутрішньомолекулярної циклізації циклізацією сполуки формули (II) захисні групи слід видалити за методиками, відомими спеціалісту в даній галузі техніки. Термін "придатна захисна група" при використанні в даному винаході включає всі захисні групи, які відомі спеціалісту в даній галузі техніки і які можна використовувати для захисту конкретної функціональної групи й потім повторно видалити без внесення додаткових змін у молекулу, з якої видаляються захисні групи. Наприклад, первинні або вторинні гідроксигрупи можна захистити шляхом утворення простих ефірів, які розщеплюються, переважно - з утворенням метоксиметилового, бензилоксиметилового, п-метоксибензилоксиметилового, бензилового, трет-бутилового, тетрагідропіранілового, алілового, п-хлорфенілового, п-нітрофенілового або трифенілметилового ефіру. Іншою можливістю захисту гідроксигруп є утворення силілових ефірів, наприклад, триметилсилілового (TMS), третбутилдиметилсилілового (TBDMS), триізопропілсилілового (TIPS), трет-бутилдифенілсилілового (TBDPS) або трифенілсилілового ефіру. Гідроксигрупи також можна захистити шляхом утворення складних ефірів, наприклад, ацетилового, бензоїлового, пропіонілового, хлорацетилового, трихлорацетилового, трифторацетилового або кротилового ефіру. Крім того, для захисту спиртів також є придатним утворення карбонатів, таких як, наприклад, метилкарбонат, алілкарбонат, бензилкарбонат. Крім того, для захисту спиртів можна використовувати утворення складних ефірів із сірчаною кислотою або сульфоновими кислотами, наприклад, утворення сульфату, алілсульфонату, птолуолсульфонату (тозилату) або метилсульфонату. Кращими методиками захисту гідроксигруп є утворення трет-бутилових або силілових ефірів, переважно - трет-бутилдиметилсилілових ефірів. Захисні групи, придатні для гуанідинових груп, в принципі, є тими ж, що й для гідроксигруп, і в цьому випадку кращою є (2,2,5,7,8-пентаметил3,4-дигідро-2H-хромен-6-іл)сульфонільна група (РМС група). Карбоксигрупи можна захистити шляхом утворення їх алкілових, силілових, арилалкілових або арилових ефірів, наприклад, метилового, етилового, трет-бутилового, триметилсилілового, третбутилдиметилсилілового, бензилового, піколілового, трихлоретилового або триметилсилілового ефіру. Карбоксигрупи також можна захистити шляхом утворення різних амідів, анілідів або гідразидів, наприклад, Ν,Ν-диметиламіду, піролідиніламіду, піперидиніламід, о-нітроаніліду, N-7нітроіндоліламіду або N-фенілгідразиду. Крім цього, їх також можна захистити шляхом утворення складних ортоефірів, наприклад, триметилових ортоефірів. Карбонові кислоти переважно захищають шляхом утворення ефірів, переважно - метилових або триметилсилілетилових ефірів. 94743 18 Групами, які особливо придатні для захисту аміногруп, є такі, які утворюють карбамати, що розщеплюються, наприклад, метоксикарбонільна, трет-бутоксикарбонільна (Вос), бензилоксикарбонільна (CBz або Z), алілоксикарбонільна (alloc), 9флуоренілметоксикарбонільна (Fmoc), 2триметилсилілетилкарбонільна, 1адамантилкарбонільна, м-нітрофенільна групи. Аміногрупи також можна захистити шляхом утворення амідів або імідов, які легко розщеплюються, наприклад, формаміду, хлорацетаміду, трихлорацетаміду, трифторацетаміду, бензоїламіду, онітрофенілацетаміду, фталіміду, тетрахлорфталіміду або нітрофталіміду. Іншою можливістю захисту аміногруп є утворення амінів, які розщеплюються, з деякими алкільними групами, такими як, наприклад, трет-бутильна група, метильна група, трифенілметильна група, фероценілметильна група або алільна група або з арильними групами, такими як, наприклад, 2,4-динітрофенільна група. Карбаматні групи переважно використовують для захисту аміногруп і з них кращими є третбутоксикарбонільна (Вос), бензилоксикарбонільна (CBz або Z) або 9-флуоренілметоксикарбонільна група (Fmoc). Захисні групи, перераховані в даному описі, в основному є прикладами й не утворюють вичерпний перелік всіх можливостей. Більш повний опис методик наведений, зокрема, у публікації Т. W. Greene, P. G. M. Wuts Protective Groups in Organic rd Synthesis, 3 Edition, John Wiley & Sons Inc. 1999. Групи, позначені за допомогою PG, при використанні в даному винаході в одній молекулі можуть бути однаковими або різними придатними захисними групами або комбінаціями однакових або різних захисних груп з Η або позначати тільки Н. Сполуки формули (II) переважно являє собою сполуки наступної формули (IIа) 1 у якій X і R є такими, як визначено вище, 6 у якій R означає ізопропілметил, третбутилметил, 2,2-диметилбут-1-ил, 2-етил-2метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2 19 диметилпент-1-ил, 3-піридилметил, 4трифторметил-3-піридилметил, бензил або триметилсилілметил, 7 у якій R означає ізопропілметил, третбутилметил, 2,2-диметилбут-1-ил, 2-етил-2метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2диметилпент-1-ил, триметилсилілметил або бензил, та у якій PG означає Η або придатну захисну групу. 6 R краще означає ізопропілметил, третбутилметил або 3-піридилметил і більш краще, якщо R означає ізопропілметил. 7 R краще означає ізопропілметил, третбутилметил або триметилсилілметил і більш кра7 ще, якщо R означає ізопропілметил. X краще означає ОН. 1 R краще означає СН3. В іншому варіанті здійснення даного винаходу сполуки (II) одержують шляхом сполучення сполуки наступної формули (III) із сполукою наступної формули (IV) 94743 20 1 5 у якій R -R є такими, як визначено вище, у якій Υ означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Η або придатну захисну групу, і, якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту, і, якщо це доцільно, то перетворення карбоксигрупи 3-гідроксифенілаланіну на групу формули -С(=О)Х, у якій X є таким, як визначено вище. Сполука формули (III) переважно являє собою сполуку наступної формули (IIІа) 6 7 у якій R і R є такими, як визначено вище, і у якій PG означає Η або придатну захисну групу. Сполучення проводять при таких же умовах, як описані вище для внутрішньомолекулярної циклізації, або при інших умовах. Таким чином, сполучення протікає за нуклеофільним механізмом, представленим нижче. Перетворення карбоксигрупи 3гідроксифенілаланіну на групу формули -С(=О)Х можна проводити за методиками, відомим спеціалісту в даній галузі техніки. 21 Захисні групи, які містяться в проміжному продукті, можуть повністю або частково бути або не бути такими, які необхідні для цільового продукту. При необхідності їх можна видалити, замінити або приєднати за методиками, відомим спеціалісту в даній галузі техніки. В іншому варіанті здійснення даного винаходу сполуку формули (III) одержують шляхом сполучення сполуки наступної формули (V) із сполукою наступної формули (VI) 2 94743 приєднати за методиками, відомими спеціалісту в даній галузі техніки. Даний винахід також стосується сполуки наступної формули (III) 2 пу, переважно - сполуки наступної формули (IIIа) 6 6 7 у якій R і R є такими, як визначено вище, і у якій PG означає Η або придатну захисну групу. Сполучення можна проводити при таких же умовах, як описані вище для зазначеного вище сполучення або внутрішньомолекулярної циклізації, або при інших умовах. Таким чином, сполучення протікає за нуклеофільним механізмом, представленим нижче. Захисні групи, які містяться в проміжному продукті, можуть повністю або частково бути або не бути такими, які необхідні для цільового продукту. При необхідності їх можна видалити, замінити або 5 у якій R -R є такими, як визначено вище, і у якій PG означає Η або придатну захисну гру 5 у якій R -R є такими, як визначено вище, у якій Ζ означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Η або придатну захисну групу, і, якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту. Таким чином, сполука (V) переважно являє собою сполуку наступної формули (Va) 22 7 у якій R і R є такими, як визначено вище, і у якій PG означає Η або придатну захисну групу, і більш краще - сполуки наступної формули (IIIb). Даний винахід також стосується способу одержання сполуки формули (III) шляхом сполучення сполуки формули (V) із сполукою формули (VI) і, 23 якщо це доцільно, то часткового або повного видалення захисних груп проміжного продукту. Даний винахід також стосується сполуки наступної формули (VI) у якій Ζ означає ОН, активний складний ефір, псевдогалоген або галоген, і у якій PG означає Η або придатну захисну групу, переважно - сполуки наступної формули (VIa). А також способу одержання сполуки формули (VI) шляхом сполучення сполуки наступної формули (VII) із сполукою наступної формули (VIII) у якій PG означає Н або придатну захисну гру 94743 24 і, якщо це доцільно, то повного або часткового видалення захисних груп проміжного продукту. Таким чином, сполуки формул (VII) і (VIII) переважно являють собою сполуки наступних формул (VIla) і (VIlla) відповідно. Способи одержання, пропоновані в даному винаході, і одержання сполук, пропонованих у даному винаході, більш докладно описані на наведених нижче схемах синтезу, які стосуються синтезу лізобактину. Спосіб заснований на модульному утворенні різних фрагментів, які потім комбінують і одержують сполуки формули (II). Потім сполуки формули (II) піддають внутрішньомолекулярній циклізації та, якщо це доцільно, видаляють захисну групу й одержують цільовий кінцевий продукт. У контексті даного винаходу несподівано було встановлено, що шляхом вибору фрагментів і послідовності, у якій вони поєднуються, можна одержати молекули з розкритими ланцюгами формули (II), які вже містять у своєму ланцюзі складноефірну групу. Також було встановлено, що ці сполуки з розкритими ланцюгами можна циклізувати у присутності складноефірної групи й одержати цільові циклічні депсипептиди. Відповідно до схеми синтезу 1, фрагмент 1 синтезують із використанням як вихідної речовини (2S,3S)-2-аміно-3-гідрокси-4-метоксі-4оксомасляної кислоти та ефіру Bос-гліцин-Nгідроксисукциніміду. пу, Схема синтезу 1 Фрагмент 2 одержують відповідно до схеми синтезу 2 з використанням як вихідної речовини 3гідроксифенілаланіну. 25 94743 Схема синтезу 2 Фрагмент 3 одержують відповідно до схеми синтезу 3 з використанням як вихідної речовини 2 N -(бензилоксикарбоніл)-D-лейцину та метил-Lлейцинатау відповідно до схеми синтезу 3. Сполу2 5 ки формули (І), які містять будь-які радикали R -R , можна одержати шляхом заміни цих двох похідних лейцину на цій стадії. 26 Потім фрагменти 2 і 3 вводять у реакцію сполучення відповідно до схеми синтезу 4, частково видаляють захисні групи й одержаний проміжний 2 продукт вводять у реакцію з N -(трет3 бутоксикарбоніл)-О -трет-бутил-L-серином і після додаткового видалення захисних груп одержують фрагмент 4 із частково вилученими захисними групами. Схема синтезу 3 27 94743 28 Схема синтезу 4 Фрагмент 4, одержаний таким чином, вводять у реакцію сполучення із фрагментом 1 відповідно до схеми синтезу 5 і після часткового видалення захисних груп одержують фрагмент 5. 29 Схема синтезу 5 Потім фрагмент 5 вводять у реакцію сполучення із фрагментом 6 відповідно до схеми синтезу 6. Цей фрагмент 6 є пентапептилом, який можна одержати за відомими методиками. Замість лізобактину можна одержати катанозин А шляхом заміни лейцину в положенні 2 фрагмента 94743 30 6 на валін. Видалення захисних груп з одержаного проміжного продукту дає фрагмент 7, який являє собою сполуки формули (II). Внутрішньомолекулярна циклізація й наступне видалення захисних груп відповідно до схеми синтезу 7 дає цільовий циклічний депсипептид, у цьому випадку - лізобактин. 31 94743 Схема синтезу 6 32 33 Схема синтезу 7 Приклад Новий синтез лізобактину Абервіатури Воc N-трет-бутоксикарбоніл ДЦК дициклогексилкарбодіімід ДІЕА Ν,Ν-діізопропілетиламін ДМАП 4-диметиламінопіридин ДМФ Ν,Ν-диметилформамід ЕДХ 1-(3-диметиламінопропіл)-3етилкарбодіімідгідрохлорид ЕДТК етилендіамінтетраоцтова кислота екв. еквівалент(и) fmoc 9-флуоренілметоксикарбоніл 94743 34 год година(и) HATU 0-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуроній гексафторфосфат ГОБТ 1-гідрокси-1H-бензотриазолгідрат ГМДСЛ гексаметилдисилазид літію хв хвилина(хвилини) МТБЕ метил-трет-бутиловый ефір NMM N-метилморфолін КТ кімнатна температура ТБАФ тетрабутиламонійфторид TBTU N-[(1H-1,2,3-бензотриазол-1ілокси)(диметиламіно)метилен]-Nметилметанамінійтетрафторборат TFA трифтороцтова кислота 35 ТГФ тетрагідрофуран ТМГ N,N,N,N-тетраметилгуанідин XPHOS дициклогексил(2',4',6'триізопропілбіфеніл-2-іл)фосфін Речовини та методики Методики аналізу - ВЕРХ/УФ (високоефективна рідинна хроматографія/детектування в ультрафіолетовій ділянці спектра) Методика 1 Тип приладу ВЕРХ: HP 1100 Series; УФ ДДМ (детектор з діодною матрицею); колонка: Phenomenex Synergi 2 мкм Hydro-RP Mercury 20 мм4 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрил + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв. 2 мл/хв; температура печі: 50°С; УФдетектування: 210 нм. Методика 2 Прилад: HP 1100 із ДДМ детектуванням; колонка: Kromasil 100 RP-18, 60 мм2,1 мм, 3,5 мкм; елюент: А = 5 мл НСlО4 (70%)/л Н2О, В = ACN; градієнтний режим: 0 хв 2%В, 0,5 хв 2%В, 4,5 хв 90%В, 9 хв 90%В, 9,2 хв. 2%В, 10 хв 2%В; швидкість потоку: 0,75 мл/хв; температура колонки: 30°С; детектування: УФ 210 нм. Методика 3 Прилад: Agilent 1100 із ДДМ (G1315B), дві помпи (G1312A), автоматичний пробовідбірник (G1313А), пристрій дегазування розчинника (G1379A) і термостат колонки (G1316A); колонка: Agilent Zorbax Eclipse XDB-C8 4,61505 мм; температура колонки: 30°С; елюент А: 0,05% 70% хлорна кислота у воді; елюент В: ацетонітрил; швидкість потоку: 2,00 мл/хв; градієнтний режим: 0-1 хв 10% В, лінійна зміна, 4-5 хв 90% В, лінійна зміна, 5,5 хв 10% В. Методика 4 Тип приладу ВЕРХ: HP 1050 Series; УФ ДДМ; колонка: Zorbax 300 mSB-С18 3,5 мкм, 4,6 мм150 мм; елюент А: 1 л води + 0,1% TFA, елюент В: 60% ацетонітрил у воді з додаванням 0,1% TFA; градієнтний режим: 0,0 хв 10%В, лінійна зміна, 18,0 хв 80%В, 20,0 хв 100%В, 25,0 хв 100%В. Швидкість потоку: 1 мл/хв; температура печі: 40°С; УФдетектування: 210 нм. Методика 5 Тип приладу ВЕРХ: HP 1050 Series; УФ ДДМ; колонка: Zorbax 300 mSB-С18 3,5 мкм, 4,6 мм150 мм; елюент А: 1 л води + 0,1% TFA, елюент В: 60% ацетонітрил у воді з додаванням 0,1% TFA; градієнтний режим: 0,0 хв 10%В, 2,00 хв 10% В, лінійна зміна, 50,0 хв 80%В, 52,0 хв 100%В, 55 хв 100% В. Швидкість потоку: 0,7 мл/хв; температура печі: 40°С; УФ-детектування: 210 нм. Методика 6 Agilent 1100 із ДДМ (G1315B), дві помпи (G1312A), автоматичний пробовідбірник (G1313A), пристрій дегазування (G1379A) і термостат колонки (G1316A); колонка: Phenomenex Gemini 5 мкм С-18, 502 мм; температура печі: 40°С; елюент А: вода + 0,1% мурашиної кислоти; елюент В: ацетонітрил; швидкість потоку: 2,00 мл/хв; градієнтний 94743 36 режим: 0-1 хв 0% В, лінійна зміна, 0-5 хв 100% В, 5,50 хв 100% В. Методика 7 Daicel Chiralpak AD-H 5 мм 250 мм2,0 мм, нгептан/етанол 95+5, швидкість потоку: 0,2 мл/хв, УФ-детектування при 220 нм. Методики аналізу ВЕРХ/МС (масспектроскопія), MALDI, ВР-МС (МС високої роздільної здатності) Методика 8 Тип приладу МС: Micromass ZQ; Тип приладу ВЕРХ: Waters Alliance 2795/HP 1100; колонка: Phenomenex Synergi 2 мкм Hydro-RP Mercury 20 мм4 мм; елюент A: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30 %А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; температура печі: 50°С; УФдетектування: 210 нм. Методика 9 Тип приладу МС: Micromass ZQ; Тип приладу ВЕРХ: Waters Alliance 2795/ΉΡ 1100; колонка: Phenomenex Gemini 3 мкм С-18 100 А, 30 мм3 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%A 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; температура печі: 50°С; УФдетектування: 210 нм. Методика 10 УФ-детектування: 210 нм. Тип приладу МС: Micromass ZQ; Тип приладу ВЕРХ: Waters Alliance 2795; колонка: Phenomenex Synergi 2 мкм HydroRP Mercury 20 мм4 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; температура печі: 50°С; УФ-детектування: 210 нм. Методика 11 Прилад: Micromass Platform LCZ з HPLC Agilent Series 1100; колонка: Thermo Hypersil GOLD 3 мкм 20 мм4 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 100%А 0,2 хв 100%А 2,9 хв 30 %А 3,1 хв 10%А 5,5 хв 10%А; температура печі: 50°С; швидкість потоку: 0,8 мл/хв; УФдетектування: 210 нм. Методика 12 Прилад: Micromass Platform LCZ з HPLC Agilent Series 1100; колонка: Thermo HyPURITY Aquastar 3 мкм 50 мм2,1 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 100%А 0,2 хв 100%А 2,9 хв 30%А 3,1 хв 10%А 5,5 хв 10%А; температура печі: 50°С; швидкість потоку: 0,8 мл/хв; УФдетектування: 210 нм. Методика 13 37 Прилад: Micromass LCT; іонізація: ІЕР (іонізація електророзпиленням) позитивна/негативна; HP 1100 із ДДМ, автоматичний пробовідбірник; температура печі: 40°С; колонка: Waters Symmetry С18, 502,1 мм, 3,5 мкм; елюент А: 0,1% мурашиної кислоти/ацетонітрил, елюент В: 0,1% мурашиної кислоти/вода; швидкість потоку: 0,5 мл/хв; градієнтний режим: 0-1 хв 0% А, 1-6 хв 90% А, 6-8 хв 100% А, 8-10 хв 100% А, 10-15 0% А. Методика 14 ЧПР-ВР-МС-ІЕР+ (ЧПР - часопролітна) спектри знімають на приладі Micromass LCT (напруга на капілярі: 3,2 кВ, напруга на конусі: 42 В, температура джерела: 120°С, температура десольватації: 280°С). Для введення зразка використовують шприцеву помпу (Harvard Apparatus). Лейциненкефалін (Tyr-Gly-Gly-Phe-Leu) використовують як стандарт. Методики препаративного розділення - ВЕРХ, гель-хроматографія Методика 15 Прилад: Gilson Abimed HPLC; система із двома помпами; колонка: Nucleodur С18 Gravity, Macherey-Nagel, 5 мкм; 25021 мм; елюент А: вода/0,05%-0,1% TFA, елюент В: ацетонітрил; градієнтний режим: 0-8 хв 5%В, 8-40 хв 5-60%В, 40-60 хв 60%В, 60-75 хв 60-100%В, 75-80 хв 100%В, і потім регенерація хроматографічної колонки; швидкість потоку: 7-15 мл/хв; УФ детектор 210 нм. Методика 16 Прилад: Gilson Abimed HPLC; система із двома помпами; колонка: Kromasil-100A С18, 5 мкм; 25030 мм; елюент А: вода/0,05-0,5% TFA, елюент В: ацетонітрил; градієнтний режим: 0-5 хв 5%В, 5,01-10 хв 10%В, 10,01-20 хв 40%В, 20,01-27 хв 50%В, 27,01-40 хв 60%В, 40,01-45 хв 90%В, 45,0160 хв 100%В; швидкість потоку: 15-60 мл/хв; УФ детектор 210 нм. Методика 17 Прилад: Gilson Abimed HPLC; УФ детектор 210 нм; колонка: Kromasil RP-18 5 мкм, 100 А, 25020 мм; елюент А: вода + 0,05% TFA, елюент В: ацетонітрил + 0,05% TFA: швидкість потоку: 10 мл/хв; 0-3 хв 5% В, лінійна зміна, 35 хв 90% В. Методика 18 Прилад: Gilson Abimed HPLC; У Φ детектор 210 нм; колонка: Gromsil ODS-4HE 10 мкм, 25040 мм; елюент А: вода + 0,05% TFA, елюент В: ацетонітрил + 0,05% TFA: швидкість потоку: 20 мл/хв; 0-3 хв 10% В, лінійна зміна, 30-35 хв 90% В, 35-40 хв 90% В. Методика 19 Прилад: Gilson Abimed HPLC; УФ детектор 210 нм; колонка: Waters Symmetry-Prep C-18, 7 мкм, 30019 мм; елюент А: вода + 0,05% TFA, елюент В: ацетонітрил + 0,05% TFA: швидкість потоку: 10 мл/хв; 0-3 хв 10% В, лінійна зміна, 30-38 хв 90% В, 38-45 хв 10% В. Методика 20 Гель-хроматографію проводять без подачі тиску на Sephadex LH-20 (Pharmacia). Фракції відбирають за даними УΦ детектування (УΦ детектор при 254 нм, Knauer) (пристрій збирання фракцій ISCO Foxy 200). Розміри колонки: 327 см (1000100 мкмоль); 304 см (100-10 мкмоль); 252 см 94743 38 (10-1 мкмоль). Як елюент використовують метанол. Методика 21 Прилад: Gilson Abimed HPLC; УФ детектор 210 нм; колонка: Biotage Flash40 RP-18 або сумісний модуль Varian Metaflash С18 40М, 35 мкм, 15040 мм; елюент А: вода + 0,05% TFA, елюент В: ацетонітрил + 0,05% TFA: швидкість потоку: 40 мл/хв; 0-3 хв 10% В, лінійна зміна, 30-38 хв 90% В, 38-45 хв 10% В. Загальні робочі методики Процедура 1 Вихідну речовину розчиняють в 30% TFA (розчин у дихлорметані) і перемішують при кімнатній температурі протягом 30 хв. Потім розчинник відганяють у вакуумі й у цей час температура бані не повинна перевищувати 30°С. Потім продукт сушать до постійної маси у вакуумі, який створюється масляною помпою. А. Одержання сполук 2 Типова сполука 1А: N -(трет-бутоксикарбоніл)L-алотреонін L-ало-Треонін (3,15 г, 26,44 ммоль) розчиняють у суміші вода-діоксан (1+2,75 мл), додають дитрет-бутилдикарбонат (6,35 г, 29,09 ммоль, 1,1 екв.) і триетиламін (4,79 мл, 34,38 ммоль, 1,3 екв.) і суміш перемішують при кімнатній температурі протягом ночі. Потім розчинник видаляють у вакуумі. Залишок розчиняють в етилацетаті й екстрагують 1 Μ лимонною кислотою. Водну фазу екстрагують ще декілька разів етилацетатом, поки в ній не перестає виявлятися продукт (ВЕРХ, методика 3). Потім об'єднані органічні екстракти сушать над сульфатом натрію, концентрують і сушать у вакуумі, який створюється масляною помпою, до постійної маси. Продукт вводять у наступну реакцію без додаткового очищення. Вихід: 6,5 г неочищеного продукту. ВЕРХ (методика 3): Rt = 3,23 хв. РХ-МС (РХ рідинна хроматографія, методика 11): Rt = 2,51 хв, МС (ІЕР-): m/z (%) = 217,8 (100) [М-Н]. 1 Н ЯМP (400 МГц, dб-ДМСО - диметилсульфоксид) (млн.ч.) = 1,08 (d, J=5,4 Гц, 3Н), 1,38 (s, 9Н), 3,72-3,84 (m, 2Н), 6,77 (d, J=7,4 Гц, 1Н). 2 Типова сполука 2А: Бензил N -(третбутоксикарбоніл)-L-алотреонінат 39 Методику виконують за аналогією з наступною літературою: S. В. Cohen, R. Halcomb, J. Am. Chem. Soc 2004, 124, 2534-2543. W. Jiang, J. Wanner, R. J. Lee, P.-Y. Bounaud, D. L. Boger, J. Am. Chem. Soc 2003,125, 1877-1887. Сполуку прикладу 22А (6,8 г неочищеного продукту, 26,44 ммоль) розчиняють у метанолі (177 мл), додають карбонат цезію (5,56 г, 17,06 ммоль, 0,63 екв.) і суміш перемішують до повного розчинення. Потім розчинник видаляють за допомогою перегонки, додають ДМФ (42 мл) і потім бензилбромід (4,06 мл, 34,12 ммоль, 1,26 екв.). Суміш перемішують протягом 16 год і потім ДМФ в основному видаляють у вакуумі. Залишок розчиняють у воді й екстрагують 3 порціями дихлорметану. Об'єднані органічні фази сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Неочищений продукт очищають на колонці Biotage RP18-Flash (вода-ацетонітрил, градієнтний режим: 0-5 хв. 10% ацетонітрил, 3-30 хв. 1090% ацетонітрил, 30-35 хв. 90% ацетонітрил; швидкість потоку: 20 мл/хв.). Вихід: 5,00 г (16,16 ммоль, 52% від теоретичного виходу). ВЕРХ (методика 3): Rt = 4,36 хв. РХ-МС (методика 8): Rt = 2,39 хв, МС (ІЕР+): + m/z (%) = 332,6 (25) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 1,09 (d, J=6,4, 3Н), 1,37 (s, 9H), 3,82 (m, 1Н), 3,95 (dd, J=6,4, .J=8,1 Гц), 4,98 (d, J=5,4 Гц, 1Н), 5,09 (d, J=12,7 Гц, 1H), 5,16 (d, J=12,7 Гц, 1H), 7,10 (d, J=8,1 Гц, 1H), 7,31-7,37 (m, 5H). Типова сполука 3А: Бензил-Lалотреонінаттрифторацетат 530 мг Типової сполуки 2А вводять у реакцію з 8,0 мл розчину TFA за процедурою 1. Неочищений продукт (589 мг, кількісний вихід) вводять у наступну реакцію без додаткового очищення. ВЕРХ (методика 3): Rt = 3,18 хв. РХ-МС (методика 11): Rt = 2,24 хв, МС (ІЕР+): + m/z (%) - 210,0 (100) [М+Н] . 1 H ЯМР (400 МГц, dб-ДМСО) (млн.ч.) = 1,15 (d, J=6,6 Гц, 3Н), 4,09-4,10 (m, 2Н), 5,26 (s, 2H), 7,36-7,44 (m, 5H), 8,34 (br. S, 2H). 2 Типова сполука 4А: Бензил-[N -(третбутоксикарбоніл)-L-ізолейцил]-L-алотреонінат Типову сполуку 3А (2,30 г, 7,12 ммоль) і N(трет-бутоксикарбоніл)-L-ізолейцин (2,14 г, 9,25 ммоль, 1,3 екв.) розчиняють у ДМФ (21,0 мл). Додають 4-метилморфолін (1,3 мл, 12,02 ммоль, 1,7 екв.) і HATU (3,52 г, 9,25 ммоль, 1,3 екв.) і суміш перемішують при кімнатній температурі протягом 94743 40 16 год. Потім повну суміш очищають за допомогою хроматографії спочатку за методикою 20 і потім за методикою 21. Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 1,75 г (4,14 ммоль, 58% від теоретичного виходу) у вигляді блідобежевої аморфної твердої речовини. ВЕРХ (методика 3): Rt = 4,59 хв. РХ-МС (методика 8): Rt = 2,56 хв, МС (ІЕР+): + m/z (%) = 423,8 (70) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,740,78 (m, 6Н), 1,01-1,07 (m, 2Н), 1,10 (d, J=6,3 Гц, 3Н), 1,37 (s, 9Н), 1,64-1,66 (m, 1Н), 3,86-3,94 (m, 1Н), 4,28 (dd, J=7,3, J=7,3 Гц, 1Н), 5,05 (d, J=5,6 Гц), 5,09 (d, J=12,7 Гц, 1Н), 5,13 (d, J=12,7 Гц, 1Н), 6,70 (d, J=9,0 Гц, 1H), 7,31-7,36 (m, 5H), 8,11 (d, J=8,1 Гц). ВР-ЧПР-МС (методика 14): C22H35N2O6 розра+ ховано 423,2490, знайдено 423,2489 [М+Н] . Типова сполука 5А: Бензил-L-ізолейцил-Lалотреонінаттрифторацетат Типову сполуку 4А (224 мг, 0,53 ммоль) обробляють за допомогою 8,0 мл розчину TFA за процедурою 1. Одержують 253 мг неочищеного продукту прикладу 5А (чистота приблизно 91%, 0,53 ммоль, кількісний вихід) і його вводять у реакцію без додаткового очищення. ВЕРХ (методика 3): Rt = 3,51 хв. РХ-МС (методика 8): Rt = 1,58 хв, МС (ІЕР+): + m/z (%) = 323,6 (100) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,770,86 (m, 6Н), 1,02 (m, 1Н), 1,15 (d, J=6,4 Гц, 3Н), 1,45 (m, 1Н), 1,77 (m, 1Н), 3,97 (m, 1H), 4,34 (m, 1H), 5,11 (d, J=12,5 Гц, 1H), 5,16 (d, J=12,5 Гц, 1H), 7,37-7,39 (m, 5H), 7,47 (m, 1H), 8,07-8,08 (m, 3H), 8,69 (d, J=7,3 Гц, 1Н). 2 Типова сполука 6А: Бензил-[N -(третбутоксикарбоніл)-D-аргініл]-L-ізолейцил-Lалотреонінат Типову сполуку 5А (253 мг, чистота 91%, 0,53 2 ммоль) і N -(трет-бутоксикарбоніл)-D-аргінін (145 мг, 0,53 ммоль, 1 екв.) розчиняють у ДМФ (3,0 мл). Додають 4-метилморфолін (76 мкл, 0,70 ммоль, 1,3 екв.) і HATU (221 мг, 0,58 ммоль, 1,1 екв.) і суміш перемішують при кімнатній температурі протягом 16 год. Потім повну суміш завантажують у колонку ВЕРХ і очищають за допомогою хроматографії (методика 18). Фракції, що містять 41 продукт, поєднують і ліофілізують. Вихід: 364 мг (0,53 ммоль, 99% від теоретичного значення) цільової сполуки. ВЕРХ (методика 3): Rt = 3,91 хв. РХ-МС (методика 8): Rt = 2,04 хв, МС (ІЕР+): + m/z (%) = 579,9 (100) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,721,16 (m, 8Н), 1,37 (s, 9H), 1,46 (m, 2Н), 1,60 (m, 1Н), 1,69 (m, 1Н), 3,06 (m, 2Н), 3,93-4,01 (m, 2Н), 4,25 (m, 1Н), 4,33 (m, 1Н), 5,07-5,14 (m, 2Н), 6,96 (d, /= 7,8, 1Н), 7,35 (m, 5Н), 7,45 (m, 1Н), 7,66 (d, J=8,8), 8,33 (m, 1Н). Типова сполука 7А: Бензил-D-аргініл-Lізолейцил-L-алотреонінатбістрифторацетат Типову сполуку 6А (237 мг, 0,34 ммоль) обробляють за допомогою 2,0 мл розчину TFA за процедурою 2. Одержують 255 мг неочищеної типової сполуки 7А (чистота 94%, 0,34 ммоль, кількісний вихід) і її вводять у реакцію без додаткового очищення. ВЕРХ (методика 3): Rt = 3,42 хв. РХ-МС (методика 11): Rt = 2,42 хв, МС (ІЕР+): + m/z (%) = 479,3 (50) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,730,81 (m, 5Н), 1,11-1,19 (m, 5Н), 1,33-1,49 (m, 3Н), 1,74 (m, 3Н), 3,10 (m, 2Н), 3,88-3,95 (m, 2Н), 4,25 (dd, J=6,8, J=7,1 Гц, 1Н), 4,46 (dd, J=7,3, J=8,8 Гц, 1Н), 5,09 (d, J=12,5 Гц, 1Н), 5,15 (dd, J=12,5 Гц), 7,36 (m, 5H), 7,61 (m, 1H), 8,10 (m, 2H), 8,51 (d, J=7,6 Гц, 1Н), 8,57 (d, J=9,0 Гц, 1Н). 2 Типова сполука 8А: Бензил- [N -(третбутоксикарбоніл)-L-лейцил]-D-аргініл-L-ізолейцилL-алотреонінаттрифторацетат Типову сполуку 7А (240 мг, 0,34 ммоль) і N(трет-бутоксикарбоніл)-L-лейцин (79 мг, 0,34 ммоль, 1 екв.) розчиняють у суміші дихлорметанДМФ (5+1, 6 мл). Додають діізопропілетиламін (296 мкл, 1,70 ммоль, 5 екв.) і HATU (194 мг, 0,51 ммоль, 1,5 екв.) і суміш перемішують при кімнатній температурі протягом 24 год. Потім повну суміш вводять у колонку для гель-хроматографії й очищають за допомогою хроматографії (методика 20, елюент - метанол). Фракції, які містять продукт, поєднують і концентрують. Вихід: 146 мг (0,18 94743 42 ммоль, 53% від теоретичного значення) цільової сполуки. ВЕРХ (методика 3): Rt = 4,15 хв. РХ-МС (методика 8): Rt = 1,92 хв, МС (ІЕР+): + m/z (%) = 692,8 (100), [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,721,23 (m, 22H), 1,37 (s, 9H), 1,38-1,71 (m, 3Н), 3,08 (m, 2Н), 3,91-4,00 (m, 2Н), 4,26 (m, 1Н), 4,33-4,42 (m, 2Н), 5,07-5,15 (m, 2Н), 6,92 (d, J=7,8 Гц, 1Н), 7,35 (m, 5Н), 7,47 (m, 1Н), 7,88 (d, J=8,1 Гц, 1Н), 7,93 (d, J=9,0 Гц, 1Н), 8,35 (d, J=7,3 Гц, 1Н). Типова сполука 9А: Бензил-L-лейцил-Dаргініл-L-ізолейцил-Lалотреонінатбістрифторацетат Типову сполуку 8А (220 мг, 0,27 ммоль) обробляють за допомогою 2,0 мл розчину TFA за процедурою 1. Одержують 223 мг неочищеного продукту прикладу 9А (0,27 ммоль, кількісний вихід) і його вводять у реакцію без додаткового очищення. ВЕРХ (методика 2): Rt = 3,80. РХ-МС (методика 11): Rt = 2,54 хв, МС (ІЕР+): + m/z (%) = 592,4 (2) [М+Н] . 1 Н ЯМР (400 МГц, dб-ДМСО) (млн.ч.) = 0,731,11 (m, 13H), 1,22-1,74 (m, 12H), 3,11 (m, 4Н), 3,60 (m, 2Н), 3,87 (m, 1Н), 3,95 (m, 1Н), 4,25 (m, 1H), 4,38 (ad, J=7,8, J=8,6 Гц, 1Н), 4,64 (dd, J=7,8, J=13,7 Гц, 1Н), 5,09 (d, J=12,7 Гц, 1Н), 5,13 (d, J=12,7 Гц, 1Н), 7,35 (m, 5H), 7,58 (m, 1Н), 8,07 (m, 2H), 8,25 (d, J=8,8 Гц, 1Н), 8,39 (d, J=7,6 Гц, 1Н), 8,77 (d, J=8,3 Гц, 1Н). 2 Типова сполука 10А: Бензил-[(3R)-N -(третбутоксикарбоніл)-3-гідрокси-L-лейцил]-L-лейцил-Dаргініл-L-ізолейцил-L-алотреонінаттрифторацетат Типову сполуку 9А (223 мг, 0,27 ммоль) і N(трет-бутоксикарбоніл)-(3R)-3-гідрокси-L-лейцин (89 мг, 0,33 ммоль, 1,22 екв.) розчиняють у ДМФ (6 мл) і розчин охолоджують до -20°С. Додають 4метилморфолін (150 мкл, 1,36 ммоль, 5 екв.) і HATU (165 мг, 0,44 ммоль, 1,6 екв.) і суміш перемішують при кімнатній температурі протягом 16 год. Потім повну суміш вводять у колонку для гель-хроматографії й очищають за допомогою хроматографії (методика 20, елюент - метанол). Фракції, що містять продукт, поєднують і концент 43 рують. Вихід: 188 мг (0,20 ммоль, 74% від теоретичного значення) цільової сполуки. ВЕРХ (методика 3): Rt = 4,24 хв. РХ-МС (методика 9): Rt = 1,99 хв, МС (ІЕР+): + m/z (%) = 821,9 (100) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,710,90 (m, 15Н), 1,00 (m, 1Н), 1,10 (d, J=6,4 Гц, 3Н), 1,24-1,26 (m, 3Н), 1,38 (s, 9H), 1,42-1,71 (m, 6H), 3,06-3,17 (m, 3Н), 3,45 (m, 1Н), 3,61 (m, 1Н), 3,93 (m, 1H), 4,05 (m, 1H), 4,26 (m, 1H), 4,35 (m, 2H), 4,54 (d, J=7,8 Гц, 1H), 5,07-5,15 (m, 2H), 5,45 (d, J=9,0 Гц, 1Н), 7,35 (m, 5H), 7,46 (m, 1H), 7,85 (d, J=7,8 Гц, 1Н), 7,89 (d, J=8,8 Гц, 1Н), 7,97 (d,J=8,1 Гц, 1Н), 8,35 (d, J=7,6 Гц, 1Н). 2 Типова сполука 11А: [(3R)-N -(третБутоксикарбоніл)-3-гідрокси-L-лейцил]-L-лейцилD-аргініл-L-ізолейцил-L-алотреонінтрифторацетат Типову сполуку 10А (100 мг, 0,11 ммоль) розчиняють у льодяній оцтовій кислоті (4,3 мл), додають 10% паладій на активованому вугіллі (22 мг) і суміш гідрують при атмосферному тиску при кімнатній температурі протягом 2 год. Каталізатор видаляють фільтруванням і фільтрат ліофілізують. Неочищений продукт очищають за допомогою хроматографії (методика 17). Фракції, що містять продукт, поєднують і ліофілізують. Одержують 58 мг (60 мкмоль, 55% від теоретичного виходу) цільової сполуки. ВЕРХ (методика 3): Rt = 3,75 хв. РХ-МС (методика 9): Rt = 1,80 хв, МС (ІЕР+): + m/z (%) = 731,8 (100) [М+Н] . 2 Типова сполука 12А: [N -(трет4 Бутоксикарбоніл)-гліцил]-(3S)-3-гідрокси-O -метилL-аспарагінова кислота (3S)-3-Гідроксіаспарагінову кислоту одержують за методикою, наведеною в публікації G. Cardillo, L. Gentilucci, A. Tolomelli, C. Tomasini, Synlett 1999, 1727-1730, і за аналогією з публікацією P. G. Mattingly, Μ. J. Miller, J. Org. Chem. 1983, 48, 35563559, за допомогою мікрохвильового випромінювання в закритому реакторі перетворюють на гідрохлорид (2S,3S)-2-аміно-3-гідрокси-4-метоксі-4оксомасляної кислоти. Гідрохлорид (2S,3S)-2аміно-3-гідрокси-4-метоксі-4-оксомасляної кислоти (447 мг, 2,24 ммоль) розчиняють у ДМФ (9 мл). 94743 44 Розчин охолоджують до 0°С, додають ефір Восгліцин-N-гідроксисукциніміду (763 мг, 2,91 ммоль, 1,3 екв.), ДМАП (14 мг, 0,11 ммоль, 0,05 екв.) і на закінчення ДІПЕА (Ν,Ν,Ν-діізопропілетиламін) (1170 мкл, 6,72 ммоль, 3 екв.). Суміші дають повільно нагрітися до кімнатної температури й потім перемішують протягом 2 год. Суміш підкисляють льодяною оцтовою кислотою, змішують із ацетонітрилом і хроматографують на Sephadex LH 20 (методика 20). Фракції, що містять продукт, поєднують, концентрують і повторно хроматографують (методика 21). Одержаний продукт (761 мг, кількісний вихід) вводять у наступну реакцію без додаткового очищення. Для аналітичних цілей чистий зразок одержують за допомогою ВЕРХ (методика 19). ВЕРХ (методика 3): Rt = 3,15 хв. РХ-МС (методика 8): Rt = 1,17 хв, МС (ІЕР+) = + 321,2 [М+Н] . 20 [] Na = + 39° (с = 0,55, МеОН). 1 Н ЯМP (300 МГц, dб-ДМСО) (млн.ч.) = 1,40 (s, 9Н), 3,49-3,60 (m, 2Н), 3,61 (s, 3Н), 4,29 (m, 1Н), 4,73 (d, J=6,6 Гц, 1Н), 7,01 (m, 1H), 7,49 (d, J=6,99 Гц, 1Н). 13 С-ЯМР (d6-ацетон, 126 МГц, DEPT) (млн.ч.) = 28,5 (CH3), 42,2 (CH2), 51,8 (СН3), 53,7 (СН), 56,0 (СН), 79,2 (четвертинний), 169,6 (четвертинний), 169,7 (четвертинний), 172,8 (четвертинний), 173,8 (четвертинний). ВР-ЧПР-МС (методика 14): C12H22N2O8 + [M+H] розраховано: 321,1298, знайдено: 321,1299. 2 Типова сполука 13А: [N -(третБутоксикарбоніл)-гліцил]-(3S)-3-гідроксі-Lаспарагін Типову сполуку 12А (353 мг, 1,10 ммоль) розчиняють в 25% водному розчині аміаку (1,70 мл) і суміш перемішують при КТ протягом приблизно 2 год. Після завершення реакції (визначення за допомогою ВЕРХ, методика 3), суміш концентрують досуха у вакуумі, який створюється масляною помпою, і залишок очищають за допомогою ВЕРХ (методика 17). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 172 мг (51% від теоретичного значення) цільової сполуки у вигляді безбарвної твердої речовини. ВЕРХ (методика 3): Rt = 2,70 хв. РХ-МС (методика 11): Rt = 2,21 хв, МС (ІЕР+): + m/z (%) = 306 (70) [М+Н] . Типова сполука 14А: (3R)-3Гідроксифенілаланін 45 Цю типову сполуку синтезують за методикою, наведеною в публікації Belokon (Y. N. Belokon, K. A. Kochetkov, N. S. Ikonnikov, Т. V. Strelkova, S. R. Harutyunyan, A. S. Saghiyan, Tetrahedron: Asymmetry 2001, 12, 481-485). РХ-МС (методика 12): Rt = 0,41 хв, МС (ІЕР+): + m/z (%) =182,1 (100) [M+H] . 20 [] Na = -21° (c = 0,1, MeOH). Література (D. Alker, G. Hamblett, L. M. Harwood, S. M. Robertson, D. J. Watkin, С. Е. Williams, Tetrahedron 1998, 54, 6089-6098): 22 [] Na = -20° (c = 0,8, MeOH). 1 Н ЯМP (400 МГц, D2O) (млн.ч.) = 3,84 (d, J=4,5 Гц, 1Н), 4,64 (d, J=4,5 Гц, 1H), 7,30-7,36 (m, 5H). Типова сполука 15А: N-Бутоксикарбоніл-(3R)3-гідроксифенілаланін Типову сполуку 14А (0,5 г, 2,76 ммоль) розчиняють у суміші 1,4-діоксан-вода (2+1, 9 мл) і додають триетиламін (500 мкл, 3,59 ммоль, 1,3 екв.) і ди-трет-бутилдикарбонат (660 мг, 3,04 ммоль, 1,3 екв.). Суміш перемішують при кімнатній температурі протягом 16 год і потім реакцію зупиняють за допомогою 1М лимонної кислоти. Суміш екстрагують декількома порціями етилацетату, поки у водній фазі не перестає виявлятися продукт ВЕРХ (методика 3). Об'єднані органічні фази сушать над сульфатом натрію й концентрують. 759 мг (2,70 ммоль, 98% від теоретичного значення) цільової сполуки одержують у вигляді безбарвного масла в залишку. ВЕРХ (методика 3): Rt = 3,89 хв. РХ-МС (методика 8): Rt = 1,87 хв, МС (ІЕР+): + m/z (%) = 282,3 (40) [М+Н] . 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 1,27 (s, 9Н, СОС(СH3)3), 4,21 (m, 1Н), 5,09 (s, 1Н), 6,30 (d, J=9,8 Гц), 7,22-7,34 (m, 5Н). Хіральна ВЕРХ (методика 7): енантіомерний надлишок 94,1%. Типова сполука 16А: Метил-Nбутоксикарбоніл-(3R)-3-гідроксифенілаланінат Типову сполуку 16А (331 мг, 1,11 ммоль) розчиняють у суміші дихлорметан-метанол (5+1, 12 мл), охолоджують до 0°С і по краплях додають триметилсилілдіазометан (2 Μ у ТГФ, 1,66 мл, 3,32 ммоль, 3 екв.). Суміш перемішують при 0°С протя 94743 46 гом ще 30 хв і потім додають декілька крапель TFA до знебарвлення. Розчинник відганяють і в залишку одержують цільову сполуку (345 мг, чистота за даними ВЕРХ 95%) з кількісним виходом у вигляді жовтуватого масла. ВЕРХ (методика 3): Rt = 4,26 хв. РХ-МС (методика 8): Rt = 2,11 хв, МС (ІЕР+): + m/z (%) - 296,3 (50) [М+Н] . 1 Н ЯМР (300 МГц, dб-ДМСО) (млн.ч.) = 1,27 (s, 9Н, СОС(СH3)3), 3,60 (s, 3Н, ОСH3), 4,31 (dd, J=3,8, J=9,3 Гц, 1Н), 5,03 (d, J=3,4 Гц, 1Н), 5,68 (br s, 1H), 6,62 (d, J=9,1 Гц, 1H), 7,23-7,34 (m, 5H). Типова сполука 17А: Метил-(3R)-3-гідроксифенілаланінаттрифторацетат Типову сполуку 16А (345 мг, 1,17 ммоль) розчиняють в 30% TFA у дихлорметані (10 мл) і перемішують при КТ протягом 15 хв. Потім розчинник відганяють. Залишок сушать до постійної маси у вакуумі, який створюється масляною помпою. Вихід: 401 мг (кількісний вихід) у вигляді жовтого масла, яке використовують на наступній стадії без додаткового очищення. ВЕРХ (методика 3): Rt = 2,51 хв. РХ-МС (методика 8): Rt = 0,30 хв, МС (ІЕР+): + m/z (%) = 196,1 (20) [М+Н] . 2 Типова сполука 18А: Метил-[N (бензилоксикарбоніл)-D-лейцил]-L-лейцинат 2 N -(Бензилоксикарбоніл)-D-лейцин (ВАСНЕМ Cat No zl3351.) (6,37 г, 24 ммоль) і метил Lлейцинат (3,49 г, 24 ммоль, 1 екв.) розчиняють у ДМФ (75 мл) при 0°С і потім додають NMM (5,28 мл, 48 ммоль, 2 екв.) і HATU (13,69 г, 36 ммоль, 1,5 екв.). Суміш перемішують при кімнатній температурі протягом 3 год. Додають МТБЕ й насичений розчин бікарбонату натрію й проводять екстракцію. Водну фазу піддають зворотній екстракції другою порцією МТБЕ й потім об'єднані органічні фази промивають 1 Μ лимонною кислотою, а також повторно насиченим розчином бікарбонату натрію, сушать над сульфатом натрію й концентрують у вакуумі. Залишок очищають за допомогою хроматографії двома порціями (Biotage 40M, циклогексан/етилацетат 3+1). Вихід: 7,85 г (80% від теоретичного виходу). ВЕРХ (методика 3): Rt = 4,82 хв. РХ-МС (методика 8): Rt = 2,65 хв; МС (IEP+.): + m/z (%) = 393 (100) [М+Н] . 20 [] Na = -5,2° (с = 0,52, МеОН). 1 Н ЯМP (400 МГц, dб-ДМСО) (млн.ч.) = 0,770,92 (m, 12Н), 1,31-1,66 (m, 6Н), 3,60 (s, 3Н), 4,10 47 (m, 1Н), 4,28 (m, 1Н), 5,02 (s, 2Н), 7,25-7,38 (m, 6Н), 8,23 (d, 1H). 13 С-ЯМР (126 МГц, dб-ДМСО) (млн.ч.) = 21,1 (СН3), 21,5 (СН3), 22,8 (СН3), 22,9 (СН3), 24,2 (СН), 41,0 (СН2), 50,0 (СН), 51,8 (СН3, ОСН3), 52,9 (СН), 65,3 (СН2, OCH2Ph), 127,6 (СН, ar-С), 127,7 (СН, arС), 128,3 (СН, ar-С), 137,1 (С четвертинний, ar-С), 155,8 (С четвертинний, NCOC(CH3)3), 172,4 (С четвертинний, С=О), 172,9 (С четвертинний, С=О). 2 Типова сполука 19А: [N (Бензилокеикарбоніл)-D-лейцил]-L-лейцин Типову сполуку 18А (7,70 г, 19,62 ммоль) розчиняють в 200 мл суміші ТГФ/вода (3+1), охолоджують до 0°С і додають моногідрат гідроксиду літію (1,65 г, 39,24 ммоль, 2 екв.). Суміш перемішують при 0°С, поки за даними моніторингу реакції за допомогою ВЕРХ вона не завершиться (приблизно 45 хв). Більшу частину ТГФ відганяють у вакуумі, потім значення рН доводять приблизно до 4 шляхом додавання лимонної кислоти й суміш екстрагують 2 порціями етилацетату. Об'єднані органічні фази сушать над сульфатом натрію, фільтрують і концентрують. Продукт одержують у вигляді безбарвної аморфної речовини з виходом 6,87 г (89% від теоретичного виходу). ВЕРХ (методика 3): Rt = 4,45 хв. РХ-МС (методика 8): Rt = 2,39 хв, МС (ІЕР+) + + m/z (%) = 379 (100) [М+Н] , 757 (40) [2М+Н] . 20 [] Na = +4,7° (с = 0,50, МеОН). 1 Н ЯМР (300 МГц, dб-ДМСО) (млн.ч.) = 0,770,92 (m, 12Н), 1,34-1,68 (m, 6Н), 4,04-4,26 (m, 2Н), 5,02 (s, 2Н), 7,25-7,38 (m, 6Н), 8,12 (d, 1Н), 12,50 (br. s, 1Н). + ВР-ЧПР-МС (методика 14): C20H31N2O5[M+H] розраховане 379,2228, знайдено 379,2216. 2 Типова сполука 20А: Метил-[N (бензилоксикарбоніл)-D-лейцил]-L-лейцил-(3R)-3гідроксифенілаланінат Типову сполуку 19А (550 мг, 1,45 ммоль) і типову сполуку 17А (449 мг, 1,45 ммоль, 1 екв.) розчиняють у ДМФ (12 мл) при 0°С. Потім додають 4метилморфолін (320 мкл, 2,9 ммоль, 2 екв.) і HATU (663 мг, 1,74 ммоль, 1,2 екв.) і суміш перемішують при 0°С протягом 15 хв. Потім додають додаткову кількість 4-метилморфоліну (160 мкл, 1,45 ммоль, 1 екв.) і суміш перемішують при КТ протягом 16 94743 48 год. Потім суміш піддають розподіленню між етилацетатом і концентрованим розчином бікарбонату натрію, і органічну фазу промивають 0,5М лимонною кислотою й повторно концентрованим розчином бікарбонату натрію, сушать над сульфатом натрію й концентрують. Залишок очищають за допомогою хроматографії (методика 17). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 626 мг (1,13 ммоль, 78% від теоретичного значення) цільової сполуки. ВЕРХ (методика 3): Rt = 4,69 хв. РХ-МС (методика 8): Rt = 2,58 хв, МС (ІЕР+): + m/z (%) = 556,5 (100) [М+Н] . 1 Н ЯМP (300 МГц, dб-ДМСО) (млн.ч.) = 0,760,88 (m, 12Н), 1,23-1,60 (m, 6H), 3,54 (s, 3Н, ОСH3), 4,06-4,11 (пі, 1Н), 4,43 (dd, J=8,3, J=14,9 Гц, 1Н), 4,52 (dd, J=4,1, J=7,7 Гц, 1Н), 5,02-5,06 (m, 3Н), 5,87 (d, J=4,5 Гц, 1Н), 7,20-7,40 (m, 11H), 8,01 (d, J=8,7 Гц, 1Н), 8,08 (d, J=8,5 Гц, 1Н). 2 Типова сполука 21Α: [N (Бензилокси)карбонїл-D-лейцил]-L-лейцил-(3R)-3гідроксифенілаланін Типову сполуку 20А (650 мг, 1,17 ммоль) розчиняють в атмосфері аргону в суміші ТГФ-вода (2+1, 30 мл). При 0°С по краплях додають водний розчин гідроксиду літію (57 мг, 2,40 ммоль, 4 екв. в 8,65 мл води). Реакція завершується через 45 хв (ВЕРХ, методика 1). Додають льодяну оцтову кислоту й суміш концентрують. Неочищений продукт очищають за допомогою хроматографії (методика 16). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 618 мг (98% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 2,44 хв. РХ-МС (методика 13) Rt = 6,04; МС (ІЕР+) m/z + + (%) = 542,5 (100) [М+Н] , 183,8 (80) [2М+Н] ; МС (ІЕР-) m/z (%) = 540,4 (40) [М-Н] ; 1081,70 (100) [2М-Н]. Типова сполука 22А: 2-(Триметилсиліл)етил2 N -[бензилоксикарбоніл-D-лейцил]-L-лейцил-(3R)3-гідрокси-L-фенілаланінат Типову сполуку 21А (150 мг, 277 мкмоль) і 2(триметилсиліл)етанол (790 мкл, 5,54 ммоль, 20 екв.) і невелику кількість 4 Å молекулярних сит розчиняють у сухому дихлорметані (3,0 мл) і пе 49 94743 ремішують при -30°С протягом приблизно 1 год. Потім додають ДЦК (114 мг, 553 моль, 2 екв.) і ДМАП (34 мг, 277 мкмоль, 1 екв.) і суміш перемішують протягом ночі й у цей час їй дають повільно нагрітися до кімнатної температури. Потім суміш концентрують у вакуумі й хроматографують (методика 16). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 108 мг (60% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 3,14 хв. РХ-МС (методика 10): Rt = 2,97 хв, МС (ІЕР+): + m/z (%) = 642,3 (100) [М+Н] . Типова сполука 23А: 2-(Триметилсиліл)етил2 N -[(бензилокси)карбоніл]-D-лейцил-L-лейцил2 3 (3R)-3-{[N -(трет-бутоксикарбоніл)-O -(трет-бутил)L-серил]окси}-L-фенілаланінат 50 Типову сполука 23А (117 мг, 132 мкмоль) розчиняють у дихлорметані (3 мл). Додають 15% TFA у дихлорметані (20 мл) і через 10 хв суміш концентрують досуха. Залишок очищають за допомогою хроматографії (методика 16). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 100 мг (83% від теоретичного значення). ВЕРХ (методика 1): Rt = 2,40 хв. РХ-МС (методика 10): Rt = 2,28 хв, МС (ІЕР+): + m/z (%) = 785,4 (100) [М+Н] . Типова сполука 25А: 2-(Триметилсиліл)етил2 N -[(бензилокси)карбоніл]-D-лейцил-L-лейцил2 (3R)-3-{[N -(трет-бутоксикарбоніл)гліцил-(3S)-33 гідроксі-L-аспарагініл-О -(трет-бутил)серил]окси}L-фенілаланінат 2 Типову сполуку 22А (104 мг, 162 мкмоль) і N 3 (трет-бутоксикарбоніл)-О -трет-бутил-L-серин (47 мг, 178 мкмоль, 1,1 екв.) розчиняють у сухому дихлорметані (2,0 мл) і додають невелику кількість 4 Å молекулярних сит. Потім додають ДЦК (70 мг, 340 моль, 2,1 екв.) і ДМАП (23 мг, 194 мкмоль, 1,2 екв.), і суміш перемішують протягом ночі й у цей час їй дають повільно нагрітися до кімнатної температури. Потім суміш концентрують у вакуумі й хроматографують (методика 16). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 120 мг (84% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 3,49 хв. РХ-МС (методика 10): Rt = 3,38 хв, МС (ІЕР+): + m/z (%) = 885,6 (100) [М+Н] . ВР-ЧПР-МС (методика 14): C46H73N4O11S1 ро+ зраховано 885,5040, знайдено 885,5031 [М+Н] . Типова сполука 24А: 2-(Триметилсиліл)етил2 N -[(бензилокси)карбоніл]-D-лейцил-L-лейцил3 (3R)-3-{[O -(трет-бутил)-L-серил]окси}-Lфенілаланінаттрифторацетат Типову сполуку 24 А (96 мг, 107 мкмоль) і типову сполуку 13А (33 мг, 107 мкмоль, 1 екв.) розчиняють у ДМФ (2,0 мл) і охолоджують до -30°С. Додають HATU (122 мг, 320 мкмоль, 3 екв.) і 4метилморфолін (86 мг, 854 мкмоль, 8 екв.) і потім суміші дають повільно нагрітися приблизно до 4°С і витримують при цій температурі протягом 12 год. Неочищену реакційну суміш хроматографують (методика 15) і фракції, що містять продукт, поєднують і ліофілізують. Вихід: 92 мг (89% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 3,22 хв. РХ-МС (методика 9): Rt = 3,21 хв, МС (ІЕР+): + m/z (%) = 1072,6 (100) [М+Н] ; МС (ІЕР-): m/z (%) = 1070,5 (100) [М-Н] . ВР-ЧПР-МС (методика 14): C52H82N7O15Si роз+ раховано 1072,5633, знайдено 1072,5667 [М+Н] . Типова сполука 26А: 2-(Триметилсиліл)етил:2 N -[(бензилокси)карбоніл]-D-лейцил-L-лейцил5 (3R)-3-{[глiцил-(3S)-3-гідроксi-L-аспарагініл-О (трет-бутил)серил]окси}-Lфенілаланінаттрифторацетат 51 Типову сполуку 25А (90 мг, 84 мкмоль) розчиняють у дихлорметані (3,0 мл). Додають 15% TFA у дихлорметані (20 мл) і через 10 хв суміш концентрують досуха. Залишок очищають за допомогою хроматографії (методика 16). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 73 мг (80% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 2,65 хв. РХ-МС (методика 10): Rt = 2,13 хв, МС (ІЕР+): + m/z (%) = 972,6 (100) [М+Н] ; МС (ІЕР-): m/z (%) = 970,7 (100) [М-Н]. ВР-ЧПР-МС (методика 14): C47H74N7O13Si роз+ раховано 972,5109, знайдено 972,5103 [М+Н] . Типова сполука 27А: 2-(Триметилсиліл)етил2 N -[(бензилокси)карбоніл]-D-лейцил-L-лейцил2 (3R)-3-{[N -(трет-бутоксикарбоніл)-(3R)-3-гідроксиL-лейцил-L-лейцил-D-аргініл-L-ізолейцил-L3 алотреоніл-гліцил-(3S)-3-гідроксі-L-аспарагініл-О (трет-бутил)серил]окси}-Lфенілаланінаттрифторацетат Типову сполуку 26А (10,0 мг, 9,2 мкмоль) і типову сполуку ПА (8,2 мг, 107 мкмоль, 1 екв.) розчиняють у ДМФ (0,5 мл) і охолоджують до -30°С. Додають HATU (10,5 мг, 27,6 мкмоль, 3 екв.) і 4метилморфолін (7,5 мг, 74 мкмоль, 8 екв.) і потім суміші дають повільно нагрітися приблизно до 4°С і витримують при цій температурі протягом 12 год. Неочищену реакційну суміш хроматографують 94743 52 (методика 15) і фракції, що містять продукт, поєднують і ліофілізують. Вихід: 10,7 мг (65% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 2,99 хв. РХ-МС (методика 9): Rt = 2,40 хв, МС (ІЕР+): + m/z (%) = 1685,8 (50) [М+Н] ; МС (ІЕР-): m/z (%) = 1683,8 (50) [М-Н], 1728,8 (100) [М+НСООН]. ВР-ЧПР-МС (методика 14): C80H134N15O22Si ро+ зраховано 1684,9592, знайдено 1684,9573 [М+Н] . 2 Типова сполука 28А: N[(Бензилокси)карбоніл]-D-лейцил-L-лейцил-(3R)-32 {[N -(трет-бутоксикарбоніл)-(3R)-3-гідрокси-Lлейцил-L-лейцил-D-аргініл-L-ізолейцил-L3 алотреоніл-гліцил-(3S)-3-гідроксі-L-аспарагініл-O (трет-бутил)серил]окси}-Lфенілаланінтрифторацетат Методика А: Типову сполуку 27А (10 мг, 5,6 мкмоль) розчиняють в абсолютному ТГФ (0,5 мл). Додають ТБАФ (17,4 мг, 67 мкмоль, 12 екв.) і суміш перемішують при КТ протягом 1 год. За даними аналізу за допомогою ВЕРХ (методика 1) реакція завершується й реакцію зупиняють льодяною оцтовою кислотою (6 мкл) і суміш концентрують і хроматографують (методика 15). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 2,5 мг (чистота приблизно 69%, 18% від теоретичного значення) цільової сполуки. Методика В: Сполуку 27А (25 мг, 13,9 мкмоль) розчиняють в абсолютному ТГФ (2,5 мл). Додають сульфат натрію (безводний, 200 мг, 1,4 ммоль) і суспензію перемішують протягом 30 хв. Додають розчин ТБАФ (1 Μ у безводному ТГФ, 84 мкл, 6 екв.) і суміш перемішують при КТ протягом 45 хв. За даними аналізу за допомогою ВЕРХ (методика 1) реакція завершується. Реакцію зупиняють льодяною оцтовою кислотою (16 мкл) і суміш фільтрують, концентрують і хроматографують (методика 15). Вихід: 21 мг (чистота >95%, 89% від теоретичного значення) цільової сполуки. ВЕРХ (методика 6): Rt = 2,99 хв. 53 94743 54 РХ-МС (методика 9): Rt = 2,34 хв, МС (ІЕР+): + m/z (%) = 1585,6 (20) [М+Н] ; МС (ІЕР-): m/z (%) = 1583,4 (100) [М-Н] . ВР-ЧПР-МС (методика 14): C75H121N15O23 роз+ раховано 1584,8884, знайдено 1584,8843 [М+Н] . 2 Типова сполука 29А: N[(Бензилокси)карбоніл]-D-лейцил-L-лейцил-(3R)-3{[(3R)-3-гідрокси-L-лейцил-L-лейцил-D-аргініл-Lізолейцил-L-алотреоніл-гліцил-(3S)-3-гідроксі-Lаспарагініл-серил]окси}-L-фенілаланін бістрифторацетат Типову сполуку 28А (2,5 мг, 1,5 мкмоль) вводять у реакцію із триізопропілсиланом (12,5 мкл) і водою (2,8 мкл) і додають 0,5 мл TFA. Потім суміш перемішують при кімнатній температурі протягом 1 год і на додаток розчинник видаляють у вакуумі. Залишок хроматографують (методика 15). Фракції, що містять продукт, поєднують і ліофілізують. Вихід: 2 мг (82% від теоретичного значення) цільової сполуки. ВЕРХ (методика 6): Rt = 2,00 хв. РХ-МС (методика 9): Rt = 1,60 хв, МС (ІЕР+): 2+ m/z (%) = 714,9 (100) [М+2Н] ; МС (ІЕР-) m/z (%) = + 1427,7 (100) [М-Н] . ВР-ЧПР-МС (методика 14): C66Hio6N1502o роз+ раховано 1428,7734, знайдено 1428,7700 [М+Н] . Типова сполука 30А: N-Бензилоксикарбоніллізобактинтрифторацетат Типову сполуку 29А (1,0 мг, 1,1 мкмоль) розчиняють у ДМФ (0,9 мл) і охолоджують до -15°С. Додають HATU (1,2 мг, 3,3 мкмоль, 3 екв.) і 4метилморфолін (11 мкл розчину 100 мкл 4метилморфоліну в 0,9 мл ДМФ, 8,7 мкмоль, 8 екв.) і потім суміші дають повільно нагрітися приблизно до 4°С і перемішують при кімнатній температурі протягом 3 год. Неочищену реакційну суміш хроматографують (методика 15) і фракції, що містять продукт, поєднують і ліофілізують. Вихід: 1,2 мг (73% від теоретичного значення) цільової сполуки. ВЕРХ (методика 1): Rt = 2,17 хв. РХ-МС (методика 9): Rt = 2,00 хв, МС (ІЕР+): + m/z (%) = 1410,8 (100) [М+Н] ; МС (ІЕР-) m/z (%) = + 1408,7 (100) [М-Н] . ВР-ЧПР-МС (методика 14): C66H104N15O19 роз+ раховано 1410,7628, знайдено 1410,7639 [М+Н] . Типова сполука 31Α: Лізобактинбістрифторацетат Типову сполуку 30А (1,0 мг, 0,66 мкмоль) розчиняють у діоксані (0,5 мл), додають 0,75 мл 0,1% водного розчину TFA і на кінчику шпателя 10% Pd/C і суміш гідрують при атмосферному тиску при 55 94743 КТ протягом 15 хв. Продукт фільтрують для видалення каталізатора, концентрують і очищають за допомогою хроматографії (методика 15). Вихід: 0,6 мг (61% від теоретичного значення) цільової сполуки. ВЕРХ (методика 4): Rt = 16,31 хв. Ідентичність синтезованого продукту 31А підтверджують шляхом спільного інжектування з аутентичним лізобактином (одержаний за методикою, описаною в WO 2004/099239 (А1)). ВЕРХ (методика 5) Rt = 38,10 хв. Ідентичність синтезованого продукту 31А підтверджують шляхом спільного інжектування з аутентичним лізобактином (одержаний за методикою, описаною в WO 2004/099239 (А1)). РХ-МС (методика 9): Rt = 1,40 хв, МС (ІЕР+): 2+ + m/z (%) = 638,9 (100) [М+2Н] , 1276,8 (5) [М+Н] ; 2 МС (ІЕР-): m/z (%) = 637,0 (100) [М-2Н] , 1274,7 (40) [М-Н]. ВР-ЧПР-МС (методика 14): C58H98N15O17 роз+ раховано 1276,7260, знайдено 1276,7264 [М+Н] . В. Дослідження фізіологічної активності Вплив in vitro сполук, пропонованих у даному винаході, можна продемонструвати за допомогою описаного нижче дослідження: Комп’ютерна верстка О. Гапоненко 56 Визначення мінімальної інгібуючої концентрації (МІК): МІК визначають у дослідженні шляхом розведення в рідкому стані відповідно до керівництва NCCLS. Протягом ночі культури Staphylococcus aureus 133, Enterococcus faecalis 27159, Ε. faecium 4147 і Streptococcus pneumoniae G9a інкубують з описаними досліджуваними сполуками при серійному розведенні в співвідношенні 1:2. Визначення 5 МІК проводять при концентрації 10 мікробів/мл у середовищі Isosensitest (Difco, Irvine/USA), за винятком S. pneumoniae, які досліджують у бульйоні СМЕ (бульйон із серцево-мозковим екстрактом) (Difco, Irvine/USA) з 10% бичачої сироватки при 6 концентрації 10 мікробів/мл. Культури інкубують при 37°С протягом 18-24 год, S. pneumoniae - у присутності 10% СО2. МІК визначається, як найменша концентрація кожної речовини, при якій більше не відбувається помітний ріст бактерій. Значення МІК приводять у мкг/мл. Не виявлено значних розходжень активності лізобактину, одержаного повним синтезом, і лізобактину, одержаного за допомогою ферментації. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюprocess for the manufacture of lysobactin derivatives
Автори англійськоюvon Nussbaum Franz, Anlauf Sonja, Koebberling Johannes, Telser Joachim, Haebich Dieter
Назва патенту російськоюСпособ получения производных лизобактина
Автори російськоюфон Нуссбаум Франц, Анлауф Соня, Кьобберлинг Йоханнес, Тельсер Йоахим, Хебих Дитер
МПК / Мітки
МПК: C07K 1/02, C07K 7/64, C07K 5/06, C07K 5/08
Мітки: одержання, лізобактину, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/28-94743-sposib-oderzhannya-pokhidnikh-lizobaktinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних лізобактину</a>