Способи одержання титану
Формула / Реферат
1. Спосіб одержання металічного титану з матеріалу, який містить титан, що включає стадії:
одержання розчину МIITiF6 з матеріалу, що містить титан,
селективного осадження (NH4)2TiF6 з одержаного розчину шляхом додавання (NH4)aXb,
де МII позначає катіон такого типу, що утворює гексафтортитанат,
X позначає аніон, обраний з галогеніду, сульфату, нітриту, ацетату та нітрату, і "а" й "b" рівні 1 або 2 і
застосування селективно осадженого (NH4)2TiF6 для одержання титану.
2. Спосіб за п. 1, який відрізняється тим, що МII вибирають із Fe2+, Mn2+, Zn2+, Mg2+, Cu2+, Ca2+, Sr2+, Ва2+, Со2+ та Ni2+.
3. Спосіб за п. 1, який відрізняється тим, що МIITiF6 являє собою FeTiF6 і (NH4)aXb вибирають з NH4Cl та (NH4)2SO4.
4. Спосіб за п. 1, який відрізняється тим, що матеріал, що містить титан, вибирають із ільменіту, рутилу, анатазу, перовскіту, брукіту, псевдобрукіту, сфену, лейкоксену і титанозалізистих шлаків.
5. Спосіб за п. 4, який відрізняється тим, що МIITiF6 являє собою FeTiF6 і розчин FeTiF6 одержують шляхом виварення матеріалу, що містить титан, в присутності водного розчину HF.
6. Спосіб за п. 5, який відрізняється тим, що концентрація HF становить величину між приблизно 5 мас. % і 60 мас. %.
7. Спосіб за п. 6, який відрізняється тим, що концентрація HF перебуває між приблизно 20 мас. % і 24 мас. %.
8. Спосіб за будь-яким з пп. 5-7, який відрізняється тим, що він додатково включає стадію додавання відновлюючого агента до розчину, одержаного на стадії виварення, для відновлення щонайменше деякої кількості Fe (III), що є в розчині, з одержанням Fe (II).
9. Спосіб за п. 1, який відрізняється тим, що він включає додаткову стадію очищення МIITiF6 шляхом перекристалізації.
10. Спосіб за будь-яким з пп. 1-9, що відрізняється тим, що він включає стадію відновлення (NH4)2TiF6, на якій титан перебуває в стадії окислювання IV для одержання продукту на основі титану - III, розкладання продукту на основі титану - III з одержанням TiF3 і відновлення TiF3 до титану.
11. Спосіб за п. 10, який відрізняється тим, що (NH4)2TiF6 відновлюють до продукту на основі Ті (III) відновлюючим агентом, вибраним з алюмінію, марганцю, цинку, заліза і магнію.
12. Спосіб за п. 10, який відрізняється тим, що (NH4)2TiF6 піддають електролітичному відновленню з одержанням продукту на основі Ті (III).
13. Спосіб одержання металічного титану з матеріалу, який містить ТіО2, що включає стадії:
одержання водного розчину фтористоводневої кислоти, що містить МII,
виварення матеріалу, що містить ТіО2, в цьому розчині з одержанням розчину, що містить МIITiF6,
селективного осадження (NH4)2TiF6 з розчину шляхом додавання (NH4)aXb,
де МII позначає катіон такого типу, що утворює гексафтортитанат;
X позначає аніон, вибраний з галогеніду, сульфату, нітриту, ацетату та нітрату, і "а" та "b" рівні 1 або 2, і
застосування селективно осадженого (NH4)2TiF6 для одержання титана.
14. Спосіб за п. 13, який відрізняється тим, що матеріал, який містить ТіО2, вибирають із рутилу, анатазу, брукіту, лейкоксену і титанозалізистого шлаку.
15. Спосіб за п. 13 або п. 14, що відрізняється тим, що водний розчин фтористоводневої кислоти, що містить МII, одержують шляхом розчинення основної солі МII у водному розчині фтористоводневої кислоти.
16. Спосіб виділення титану з ільменіту, що включає стадії:
виварення ільменіту у водному розчині HF для одержання FeTiF6 і видалення нерозчинного продукту,
селективного осадження (NH4)2TiF6 шляхом додавання солі амонію,
відновлення (NH4)2TiF6 до NH4TiF4 алюмінієм, активованим ртуттю,
піролізу NH4TiF4 з одержанням TiF3,
відновлення TiF3 до металічного титану алюмінієм з одержанням порошку Ті і видалення маси AlF3 шляхом сублімації.
17. Спосіб за п. 16, який відрізняється тим, що після селективного осадження (NH4)2TiF6 проводять очищення осадженого (NH4)2TiF6.
18. Спосіб виділення титану з матеріалу, що містить ТіО2, який включає стадії одержання водного розчину фтористоводневої кислоти, що містить МII, де МII позначає катіон такого типу, що утворить гексафтортитанат,
виварення матеріалу, що містить ТіО2, в цьому розчині з одержанням розчину, що
містить МIITiF6, і видалення нерозчинного продукту,
селективного осадження (NH4)2TiF6 шляхом додавання солі амонію,
відновлення (NH4)2TiF6 до NH4TiF4 алюмінієм, активованим ртуттю,
піролізу NH4TiF4 з одержанням TiF3,
відновлення TiF3 до металічного титану.
19. Спосіб за п. 18, який відрізняється тим, що після селективного осадження (NH4)2TiF6 проводять очищення осадженого (NH4)2TiF6.
20. Спосіб за п. 18, який відрізняється тим, що матеріал, що містить ТіО2, вибирають з анатазу, рутилу, брукіту, лейкоксену і титанозалізистого шлаку.
Текст
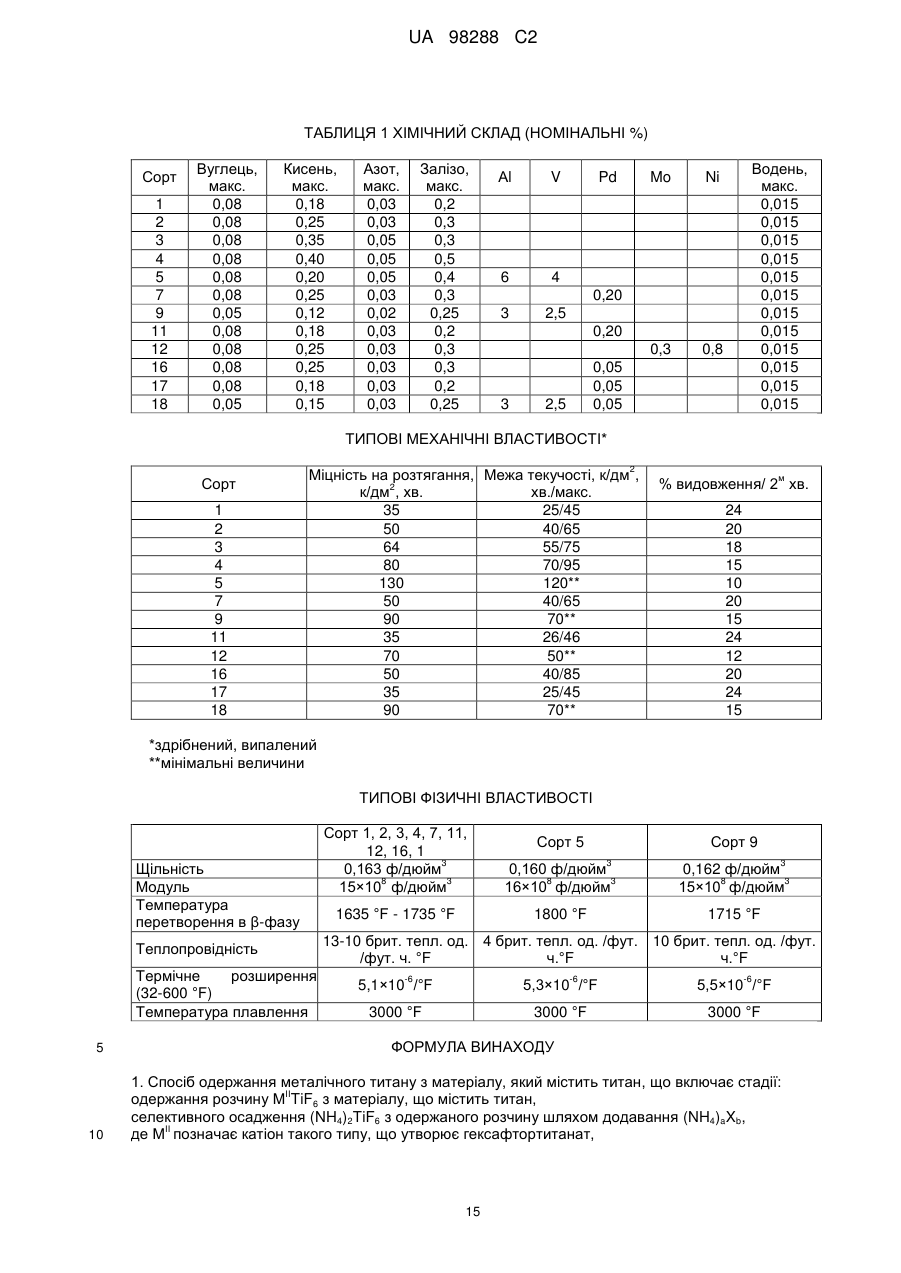
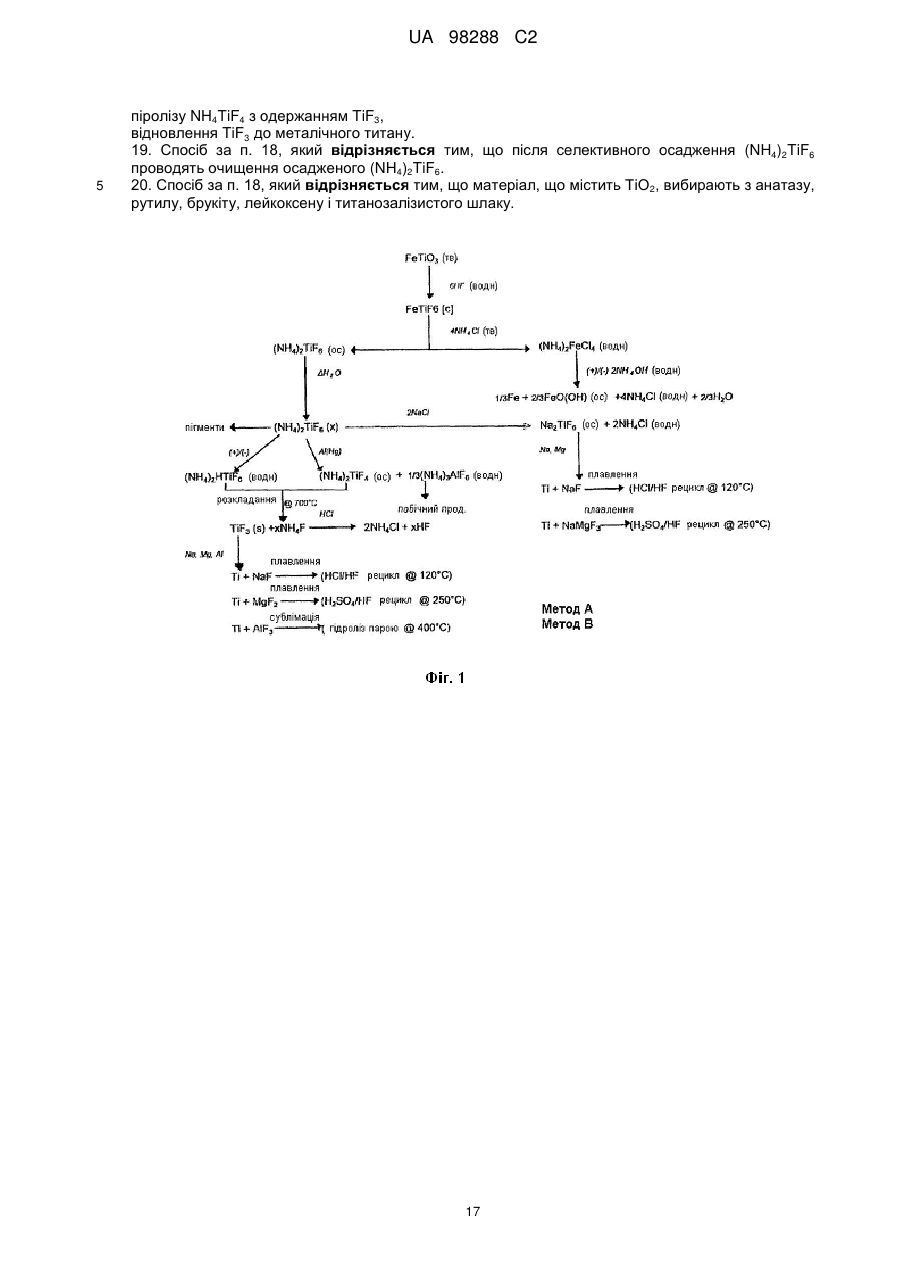
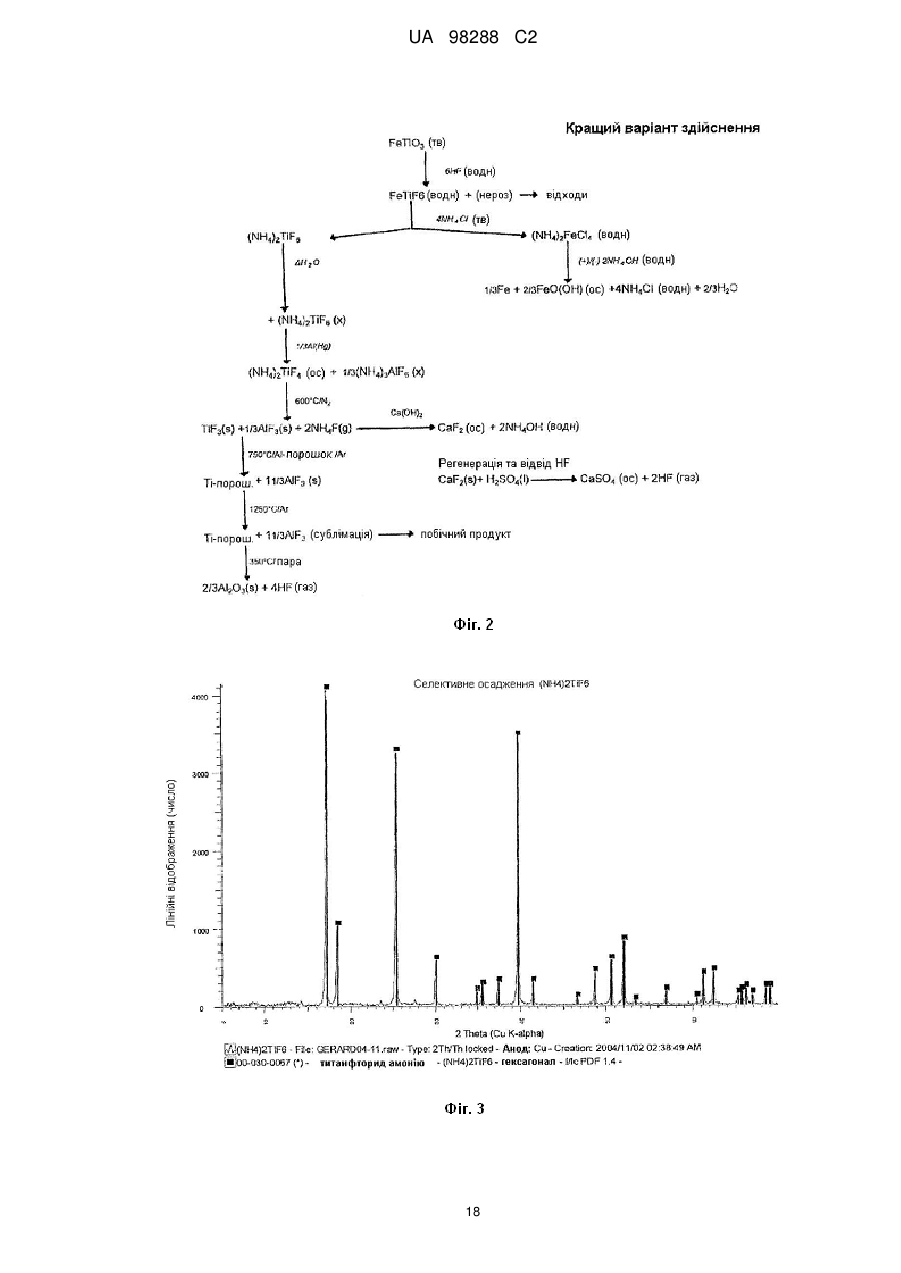
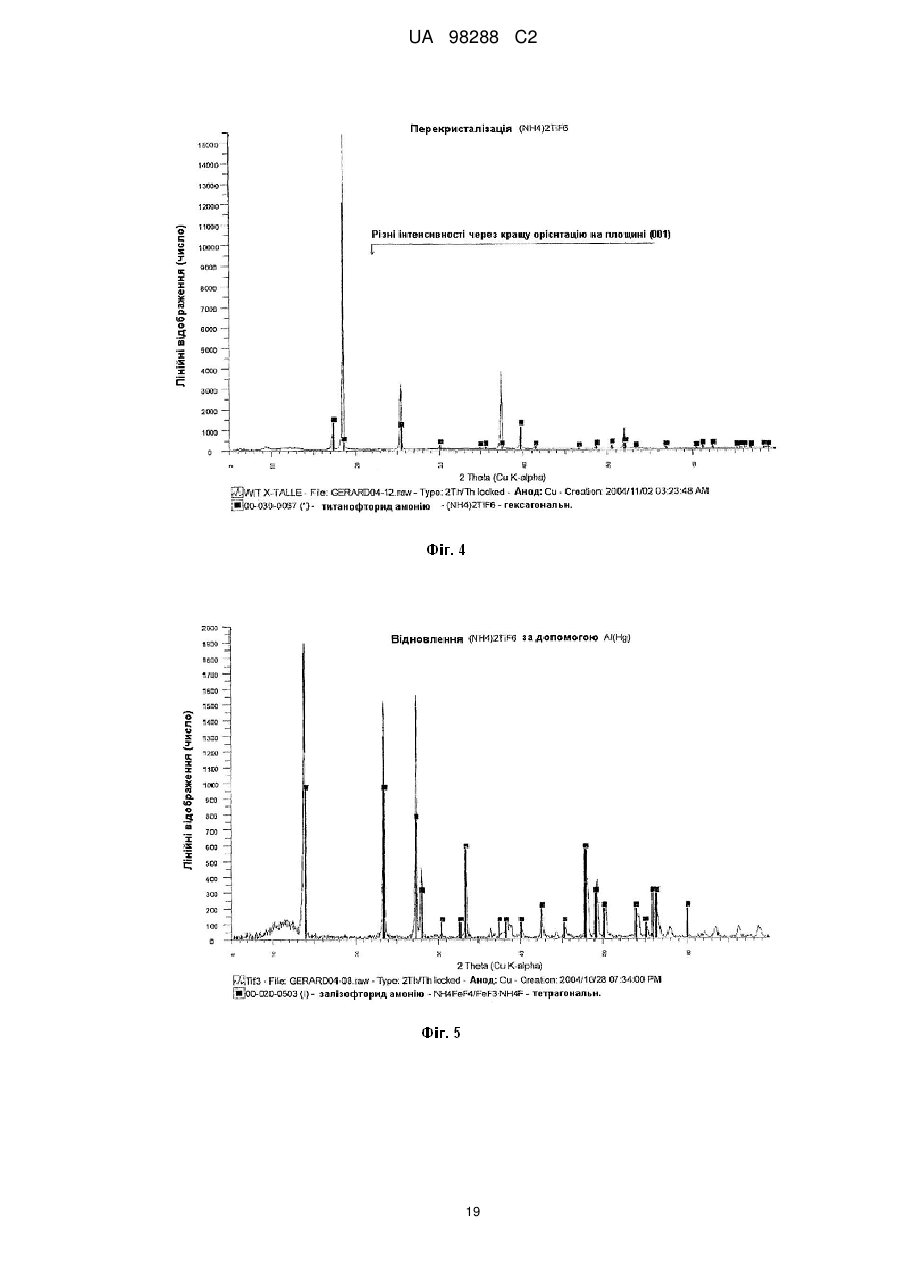
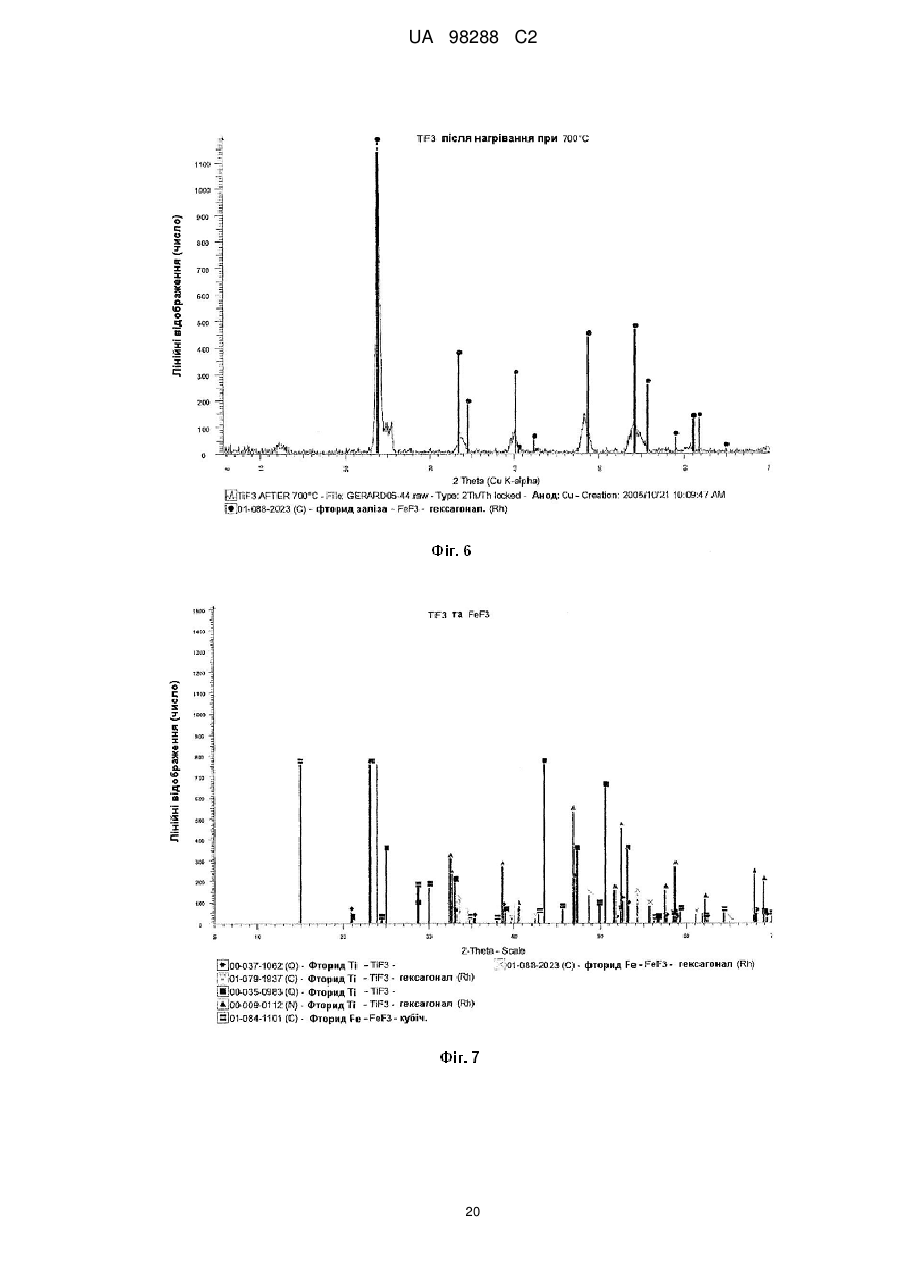
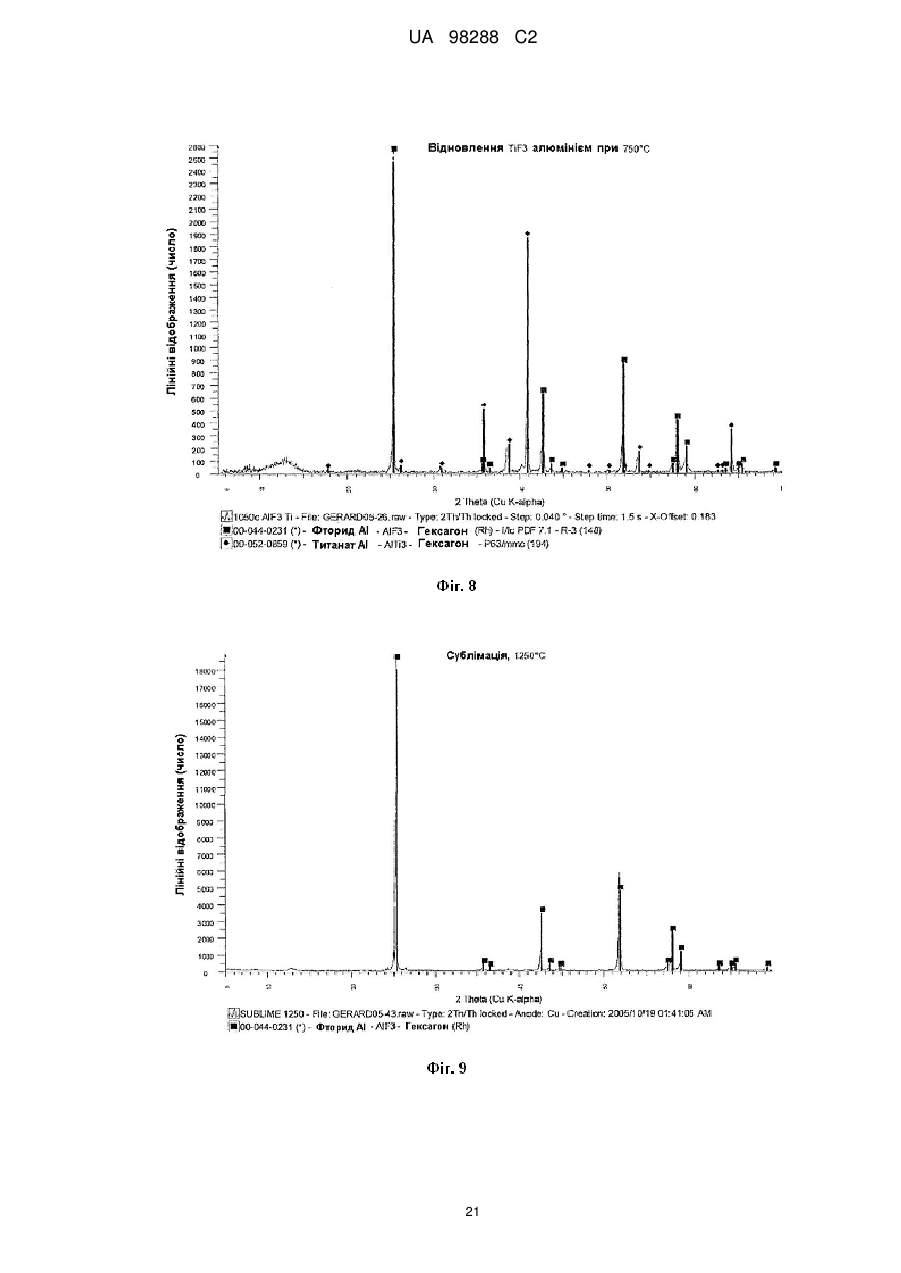
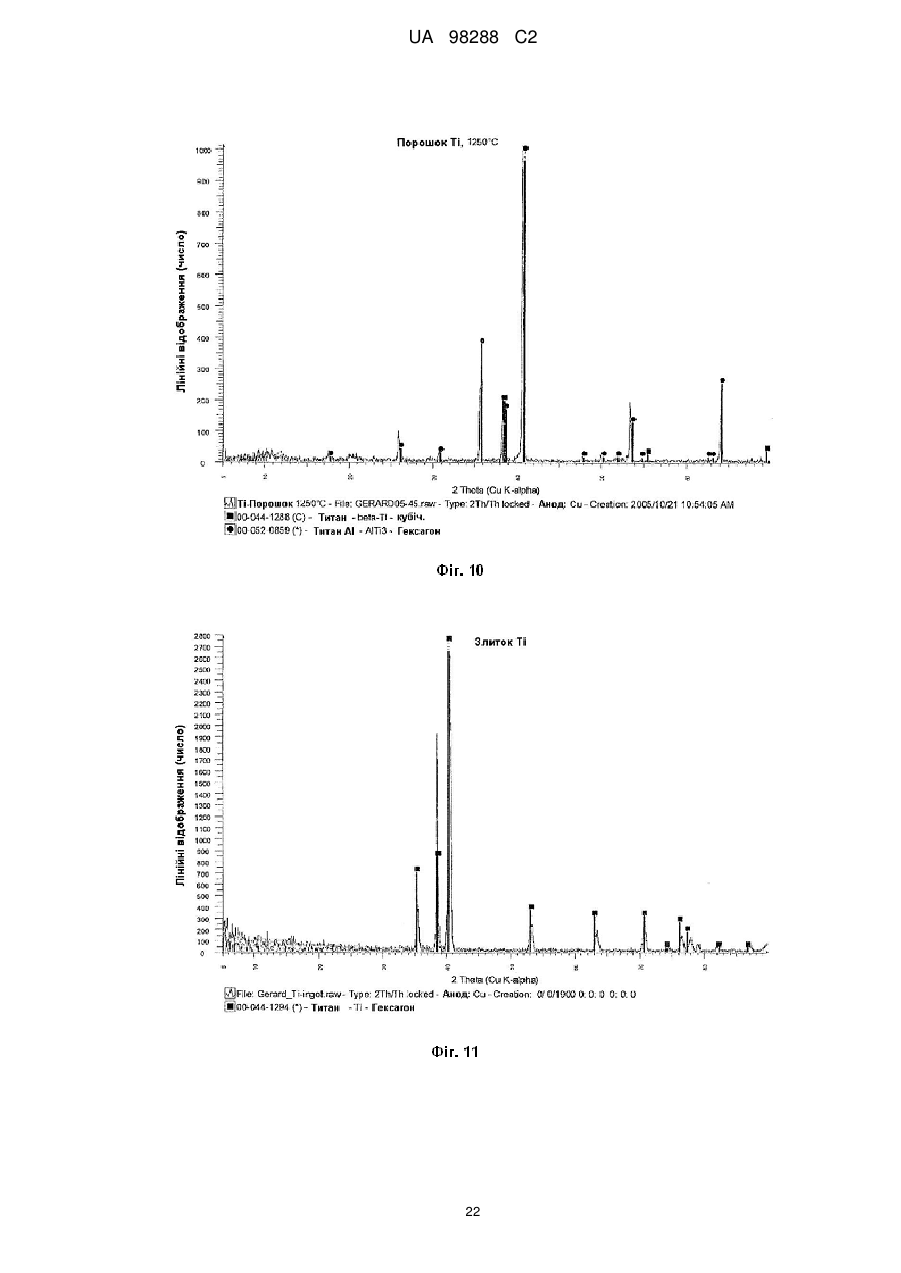
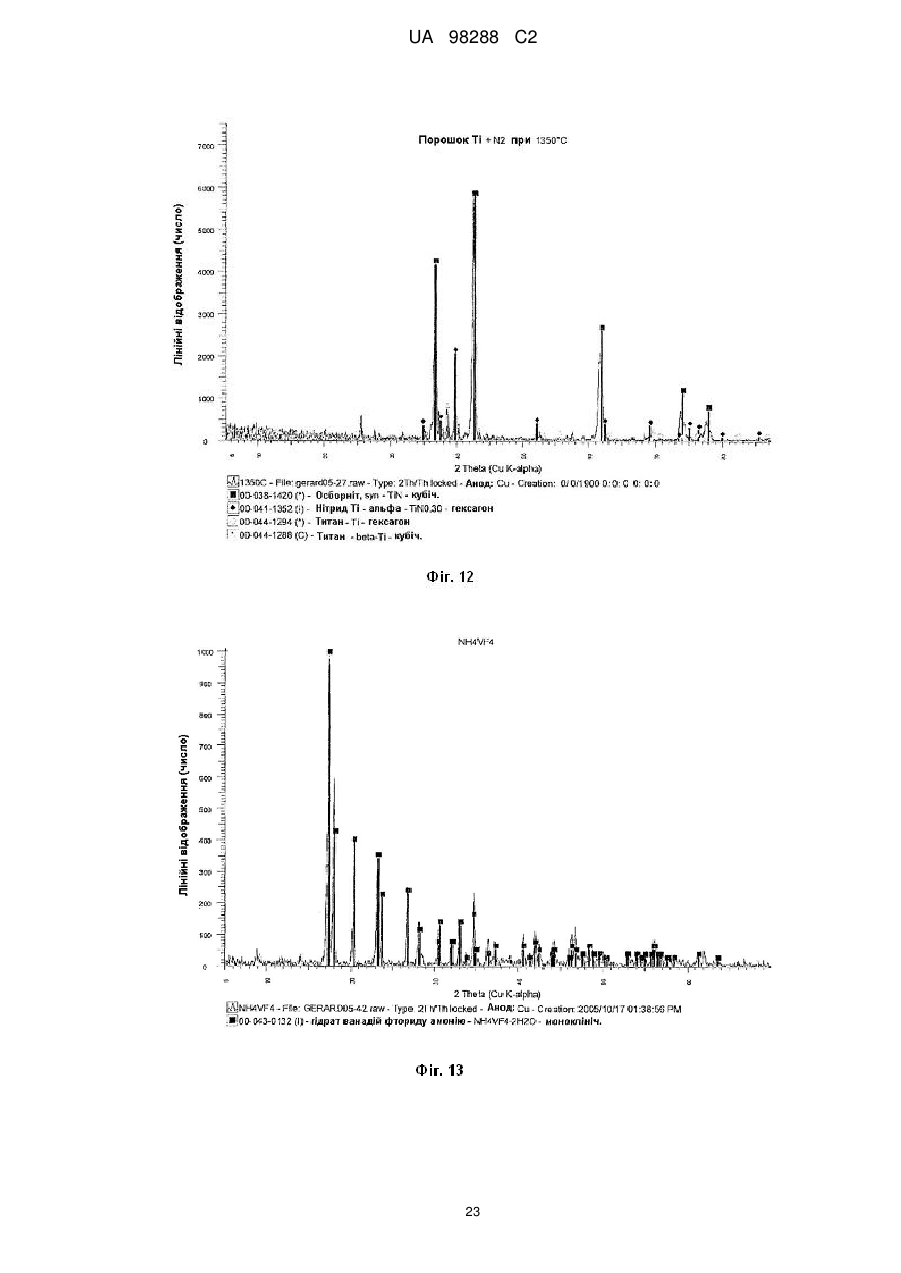
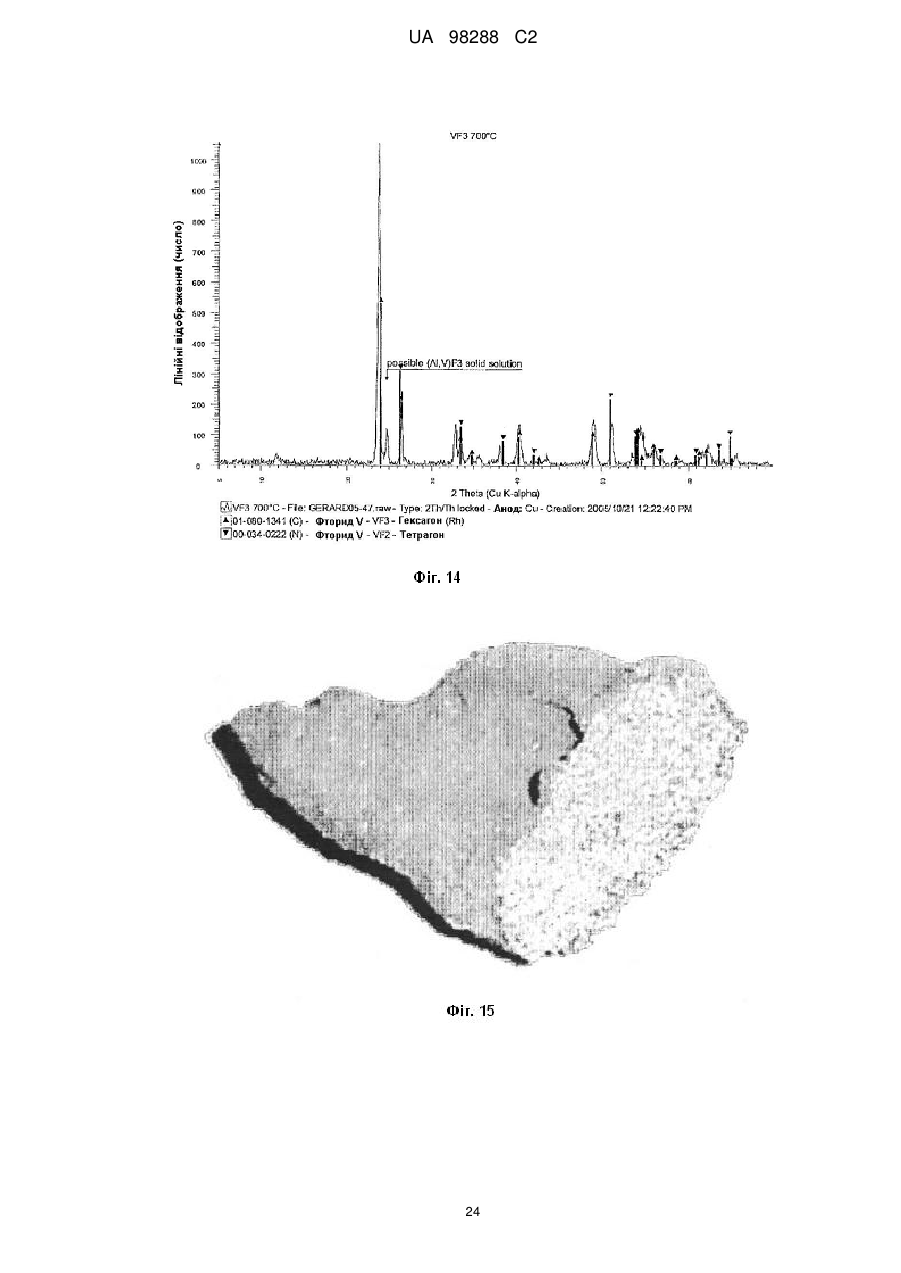
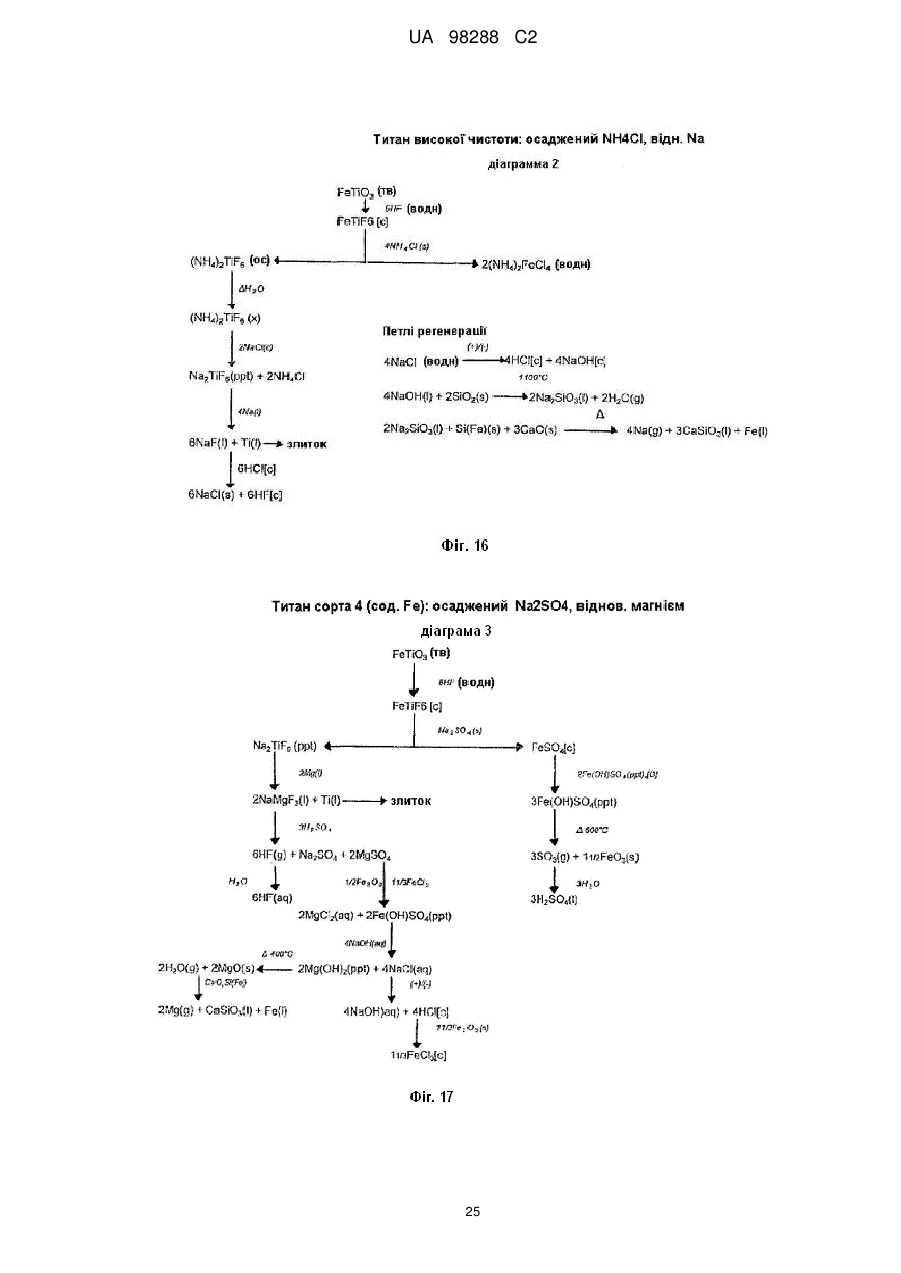
Реферат: Спосіб одержання металічного титану з матеріалу, що містить титан, включає стадії одержання II I розчину М TiF6 з матеріалу, що містить титан, селективне осадження М 2TiF6 з розчину шляхом I I II додавання (М )аХb і застосування селективно осадженого М 2TiF6 для одержання титану. М I позначає катіон такого типу, що утворює гексафтортитанат, М вибраний з катіонів амонію і лужних металів, X позначає аніон, вибраний з галогену, сульфату, нітриту, ацетату і нітрату і "а" та "b" дорівнюють 1 або 2. UA 98288 C2 (12) UA 98288 C2 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується способів одержання металічного титану, сплавів на основі титану та сполук титану. У промисловості титан звичайно одержують з тетрахлориду титану (TiCl4) за способами Хантера (Hunter) або Кроля (Kroll). Ці способи включають стадію відновлення натрію або магнію. Титан одержували також шляхом відновлення гексафтортитанату калію (K2TiF6) натрієм, шляхом електролітичного відновлення двоокису титану (TiO2) і шляхом відновлення ТіО2 магнієм або кальцієм. Титан також може бути отриманий з різних титанвмісних попередників із застосуванням різних відновлюючих агентів. Щільність металічного титану становить близько 45 % від щільності сталі, однак титан є таким же міцним як сталь і має чудову хімічну стійкість. Титан є також дев'ятим за поширеністю в земній корі елементом, але незважаючи на його поширеність і чудові властивості продаж титану становить тільки 1 % від продажу алюмінію і тільки 0,1 % від продажу нержавіючої сталі. Причиною цього є його вартість. Тільки обмежена кількість галузей, таких як військова галузь, аерокосмічна галузь і медицина, можуть дозволити собі застосовувати титан. Основні причини такої високої вартості металічного титану полягають у тому, що попередники, які застосовуються у виробництві титану, є дорогими і під час плавлення, лиття, і кування завдяки окислюванню відбуваються великі втрати. Даний винахід передбачає ефективний і недорогий спосіб одержання титану, його сплавів і його сполук. Відповідно до першого аспекту даного винаходу передбачений спосіб одержання металічного титану з титанвмісного матеріалу, причому цей спосіб включає стадії: II одержання розчину M TiF6 з матеріалу, що містить титан, I I селективного осадження M 2TiF6 з розчину при додаванні (М )аХb, II де М позначає катіон такого типу, що утворює гексафтортитанат, I М вибраний з катіонів амонію та лужних металів, X позначає аніон, вибраний з аніону галоїдної сполуки, сульфату, нітриту, ацетату та нітрату, і "а" та "b" дорівнюють 1 або 2; I і застосування селективно осадженого M 2TiF6 для одержання титану. II У випадку нітрату М буде знаходитися у стані найбільшого окислювання. II 2+ 2+ 2+ 2+ 2+ 2+ 2 2+ 2+ 2+ М може бути вибраний з F2 , Mn , Zn , Mg , Cu , Ca , Sr *, Ва ; Со та Ni . II Лужний метал може бути вибраний з літію, натрію та калію. В кращому варіанті M TiF6 являє I собою FeTiF6 і (М )аХb являв собою NH4Cl. Матеріал, що містить титан, може бути вибраний з ільменіту, рутилу, анатазу, перовскіту, брукіту, псевдо-брукіту, сфену, лейкоксену та титанозалізистих шлаків. Ільменіт має формулу FeTiO3. Рутил, анатаз, брукіт та лейкоксен всі є мінералами природного походження, які містять Ті. Титанозалізистий шлак являє собою матеріал, що містить Ті, отриманий в основному при сплавленні ільменіту. Сфен є CaTiSiO6, а перовскіт являє собою СаТіО3. II Коли застосовують руди, що відрізняються від ільменіту або перовскіту, відношення Ті: М II становить 1:1 чи вище, так що мольна кількість М щонайменше дорівнює мольній кількості Ті II або більше. Це може бути досягнуто або шляхом додавання Ті, або шляхом додавання М . II Таким чином, Мn Ті6 може бути FeTiF6, і розчин FeTiF6 може бути отриманий шляхом виварювання ільменіту за допомогою водного HF. Ільменіт може бути використаний у надлишку. Концентрація HF може становити від приблизно 5 до 60 %. В кращому варіанті вона лежить в межах між приблизно 20 та 24 %. Спосіб може включати стадію додавання відновлюючого агента до розчину, отриманого на стадії виварювання для відновлення щонайменше частини будь-якого Fe (III), що знаходиться в розчині, до Fe (II). Відновлюючий агент може бути відновлювачем - металом. Метал може бути вибраний з Fe, наприклад, у вигляді залізної насадки або сталевої вати. Al, Zn, Cu, Mn та Mg. I Спосіб може включати додавання (М )аХb у твердому стані до розчину, отриманого на стадії виварювання. II Спосіб може також включати стадію очищення M TiF6 шляхом перекристалізації. I Коли Мn Ті6 являє собою (NH4)2TiF6, спосіб може включати розчинення (NH4)TiF6 у воді з одержанням розчину та осадження Li2TiF6, Na2TiF6 або K2TiF6 при додаванні солі літію, натрію або калію до розчину. Сіль може бути вибрана із хлоридів лужних металів і сульфатів лужних металів, але природно, що може бути застосована будь-яка інша придатна сіль лужного металу. В кращому варіанті така сіль являє собою хлорид натрію або сульфат натрію. Спосіб може потім включати стадію відновлення Li2TiF6, Na2TiF6 або K2TiF6 з одержанням титану. Цей метод нижче позначений як Метод А. Відновлення можна проводити за допомогою 1 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 відновлюючого агента, вибраного з натрію, магнію, калію та кальцію. У цьому випадку спосіб може включати перед стадією відновлення стадію змішування Na2TiF6 із заданою кількістю щонайменше однієї іншої солі металу, з тим, щоб титан, отриманий на стадії відновлення, перебував у вигляді сплаву титану, що містить щонайменше один інший метал. Іншою сіллю металу може бути, наприклад, Na3AlF6 або Na2VF7 або їхнє сполучення, тоді отриманий сплав титану буде містити алюміній або ванадій або обидва цих метали. Спосіб може включати, наприклад, додавання достатньої кількості Na3AlF6, і Na2VF7 для одержання титану сорту 5, який містить близько 6 % алюмінію та близько 4 % ванадію. Природно, що можуть бути використані фторидні солі інших металів, таких як AlF3, VF5, VF4 або VF3 і їхня кількість може змінюватися, при цьому виходять різні сплави. Якщо матеріал, що містить титан, являє собою матеріал, що включає ТіО2, такий як рутил, анатаз, брукіт, лейкоксен або титанозалізистий шлак, у якому знаходиться невелика кількість II II М , спосіб може включати стадії первісного одержання водного розчину HF солі М і потім II виварення матеріалу, що містить титан, в кислому розчині солі М з одержанням розчину MnTiF6. За кращим методом він може включати стадії відновлення (NH4)TiF6, у якому титан перебуває в стані окислювання IV, з одержанням продукту, що містить титан - III, розкладання продукту, що містить титан - III, з одержанням TiF3 і відновлення TiF3 до титану. Цей спосіб нижче позначений як Метод В. (NH4)2TiF6 може бути відновлений до продукту, що містить титан - III, за допомогою відновлюючого агента, вибраного з алюмінію, марганцю, цинку, заліза та магнію. Замість цього може бути проведене електролітичне відновлення (NH4)2TiF6 з одержанням продукту, що містить Ті (III). Продукт, що містить Ті (III) може являти собою (NH4)2TiF6, (NH4)2TiF5, NH4TiF4 Всі ці сполуки розкладаються між приблизно 400 та 700 °C з утворенням TiF3. TiF3 може бути відновлений з одержанням титану шляхом відновлення відновлюючим агентом, вибраним з натрію, магнію та алюмінію. Винахід належить також до TiF3, отриманого шляхом піролітичного розкладання NH4TiF4. Даний винахід належить також до TiF3, що має параметри дифракційної решітки, показані на Фіг. 6. Крім того, даний винахід належить до способу одержання металічного титану і матеріалу, що містить ТіО2, причому цей спосіб включає стадії: II одержання водного розчину фтористоводневої кислоти, що містить М , II виварювання матеріалу, який містить ТіО2, в розчині з одержанням розчину, що містить М TiF6, I I селективного осадження M 2TiF6 з розчину при додаванні (М )аХb, де II М позначає катіон такого типу, що утворює гексафтортитанат, I М вибраний з катіонів амонію та лужних металів, X позначає аніон, вибраний з галоїду, сульфату, нітриту, ацетату та нітрату і "а" та "b" дорівнюють 1 або 2; і I застосування селективно осадженого M 2TiF6 для одержання титану. Матеріал, що містить ТіO2, може бути вибраний з рутилу, анатозу, брукіту, лейкоксену та титанозалізистого шлаку. Однак може бути використаний будь-який інший придатний матеріал, який містить ТіO2. II Водний розчин фтористоводневої кислоти, що містить М , може бути отриманий шляхом II розчинення основної солі М у водному розчині HF. Основною сіллю може бути, наприклад, II оксид, гідроксид або карбонат М . i + Відповідно до кращого варіанта М може являти собою NH4 і спосіб буде включати відновлення можливо очищеного (NH4)2TiF6 до NH4Ti4 ; піроліз NH4TiF4 з одержанням Ті3 і відновлення TiF3 до металічного титану. Відповідно до іншого аспекту даного винаходу передбачений спосіб одержання металевого сплаву, причому цей спосіб включає стадії: з'єднання заданої кількості здатної до відновлення фторидної солі першого металу із заданою кількістю щонайменше однієї здатної до відновлення солі іншого металу з одержанням суміші солей та відновлення суміші фторидних солей з одержанням суміші металів або сплаву. Цей спосіб може включати з'єднання фторидної солі першого металу з двома чи трьома здатними до відновлення солями інших металів для того, щоб виходив сплав, що містить три або більше металів. 2 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 Здатна до відновлення фторидна сіль першого металу може являти собою здатну до відновлення сіль титану. Здатна до відновлення сіль іншого металу може бути здатною до відновлення сіллю металів, вибраних з ванадію, алюмінію, паладію, молібдену та нікелю. Здатна до відновлення сіль першого металу може являти собою, зокрема, M2TiF6, і здатна до відновлення сіль іншого металу може бути вибрана з M3AlF6, M2VF7 та їхніх комбінацій, при цьому М позначає лужний метал. Зокрема, М може являти собою натрій. Цей спосіб може також включати стадію розплавлювання суміші для одержання сплаву. Відповідно до іншого аспекту винаходу передбачена сіль, що являє собою NH4TiF4. Даний винахід охоплює NH4TiF4, параметри дифракційної решітки якого представлені на Фіг. 5. Згідно зі ще одним аспектом даного винаходу передбачений спосіб одержання NH4TiF4, при цьому спосіб включає стадію відновлення (NH4)2TiF6. Відновлюючий агент може являти собою металічний відновлювач. Він може бути, наприклад, алюмінієм, амальгамованим алюмінієм, ртуттю з покриттям на основі алюмінію, наприклад, Al(Hg) або карбідом алюмінію. Відповідно до іншого аспекту даного винаходу передбачений спосіб одержання порошку металічного титану, причому цей спосіб включає стадію відновлення TiF3 алюмінієм з метою одержання продукту відновлення, що являє собою порошок металічного титану та AlF3. Цей спосіб може також включати стадію нагрівання продукту відновлення до такої температури і протягом такого проміжку часу, які достатні для сублімації більшої частини AlF3 і в той же час для утримування достатньої кількості AlF3 на поверхні для зниження реакційної здатності порошку металічного титану. Цей спосіб може включати нагрівання продукту відновлення доти, поки кількість AlF3 на поверхні порошку металічного титану не складе від приблизно 0,005 до 40 % від маси матеріалу, в кращому варіанті від приблизно 0,05 до 10 % і більше, ще краще від приблизно 0,1 до 5,0 %. Залишкова кількість AlF3 викликає утворення інертного шару, що переважно є моношаром достатньої товщини для того, щоб утворитися на поверхні порошку титану. Це істотно підвищує температуру, при якій спонтанне згоряння порошку титану відбувається на повітрі, від величини, що становить приблизно 250 °C до температури вище 600 °C. Відповідно, цей порошок безпечніше застосовувати та перевозити, ніж відомі порошки титану. Винахід охоплює також дезактивований порошок титану, що містить поверхневий шар AlF3, при цьому кількість AlF3 становить величину, що перебуває між приблизно 0,05 та 10 % від маси матеріалу і краще між приблизно 0,1 та 5 % AlF3. Даний винахід стосується також способу одержання порошку металічного титану, при цьому спосіб включає стадії: відновлення TiF3 алюмінієм з одержанням продукту відновлення, що містить порошок металічного титану та AlF3 і нагрівання продукту відновлення для сублімації AlF3 з метою одержання порошку металічного титану, що практично не містить алюмінію у вигляді металу або сплаву. Відповідно до ще одного аспекту даного винаходу в способі одержання штучного титану (титанового "артефакту") з попередника металічного титану, що включає стадії нагрівання попередника металічного титану з метою одержання проміжного металічного титану та обробку цього проміжного продукту на одній або більше стадіях для одержання титану, передбачене вдосконалення при проведенні стадії нагрівання в атмосфері, що містить летучу фторидну сіль. Проміжний продукт, що одержується у такий спосіб, містить захисний шар фторидної солі. Атмосфера, у якій проводять нагрівання, переважно являє собою інертну атмосферу, таку як аргон або гелій. Попередник металічного титану може бути порошком дезактивованого титану, описаним вище. Летуча фторидна сіль може бути вибрана з AlF3, MgF2 та NaF. Природно, що може бути використана будь-яка інша придатна фторидна сіль. Стадію нагрівання можна проводити шляхом випалу або нагрівання в печі, із застосуванням, наприклад, вакуумних печей, печей з інертною атмосферою, печей, обладнаних мікрохвильовим нагріванням, печей з радіочастотним нагріванням, індукційних печей або печей із зонним рафінуванням. Стадії цього процесу можуть бути стандартними, типу, який використовується при одержанні титану, такого як одноосьове пресування, холодне ізостатичне пресування, ізостатичне пресування з нагріванням, холодна прокатка, гаряча прокатка тощо. На цих стадіях може проводитися додавання зв'язуючих, таких як воски та полімери. 3 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 60 Штучний титан (титановий "артефакт") може бути твердим матеріалом або пористим матеріалом. Це може бути сплав титану і він може бути у вигляді прутків, брусків, дроту, аркушів тощо. Штучний титан (титановий "артефакт") може містити сліди фториду. Під "слідами" мають на увазі кількості, які не впливають на основні властивості титану. Конструкція печі та цикл нагрівання повинні бути такими, щоб під час стадії нагрівання титан завжди був оточений захисною атмосферою, що містить фторидну сіль, для того, щоб він був захищений від реакції з киснем, азотом, вуглецем, воднем тощо. Згідно зі ще одним аспектом винаходу передбачений спосіб виділення титану з ільменіту, при цьому спосіб включає стадії: виварювання ільменіту у водному розчині HF з одержанням FeTiF6 і видалення нерозчинного матеріалу; селективного осадження (NH4)2TiF6 при додаванні солі амонію; можливого очищення осадженого (NH4)2TiF6; відновлення можливо очищеного (NH4)2TiF6 до одержання NH4TiF4 алюмінієм, активованим ртуттю; піролізу NH4TiF4 з одержанням TiF3 і відновлення TiF3 до металічного титану. Згідно зі ще одним аспектом даного винаходу передбачений спосіб виділення титану з матеріалу, що містить ТіО2, який включає стадії: II приготування водного розчину фтористоводневої кислоти, що містить М , II виварення матеріалу, що містить ТО2 в розчині з одержанням розчину, що містить M TiF6 і видалення нерозчинного матеріалу; селективного осадження (NH4)2TiF6 при додаванні солі амонію; можливого очищення осадженого (NH4)2TiF6; відновлення можливо очищеного (NH4)2TiF6 до одержання NH4TiF4 алюмінієм, активованим ртуттю; піролізу NH4TiF4 з одержанням TiF3 і відновлення TiF3 до металічного титану. Матеріал, що містить ТіО2 може бути вибраний з анатазу, рутилу, брукіту, лейкоксену та титанозалізистого шлаку. Згідно до ще одного аспекту даного винаходу передбачений спосіб одержання сполуки титану, вибраної з нітриду титану, карбіду титану, бориду титану, гідриду титану, силіциду титану, фосфіду титану та сульфіду титану, при цьому спосіб включає стадію нагрівання дезактивованого порошку, описаного вище, з джерелом азоту, вуглецю, бору, водню, кремнію, фосфору або сірки. Джерело азоту, вуглецю, водню, кремнію або сірки може являти собою відповідні елементи, наприклад, азот і водень у вигляді газу, вуглець у вигляді порошку або коксу, кремній у вигляді порошку кремнію та сірку у вигляді порошкоподібної сірки. Джерелом бору може бути диборан. Джерелом фосфору може бути фосфін. Нітрид титану може мати параметри дифракційних решіток, показані на Фіг. 12. Детальний опис винаходу. Відомі з рівня техніки способи виварення ільменіту використовували або сірчану кислоту, або хлор і кокс при високих температурах. Відомо також, що ільменіт можна виварювати в розведеному розчині HF з виділенням тепла за наступною реакцією: FeTiO3+6HF=FeTiF6+3Н2О. Ступінь розведення HF підтримувалася рівною 20-24 % для того, щоб виходив насичений розчин FeTiF6, що може бути відфільтрований для видалення нерозчинного матеріалу. Було встановлено, що вихід і ступінь чистоти попередника FeTiF6, отриманого на стадії селективного осадження, можуть бути підвищені, якщо все залізо в розчині перебуває в стані окислювання (II) 3+ (тобто немає Fе ) і якщо немає вільної HF. Цього досягали шляхом застосування надлишку ільменіту, що потім може бути повернутий у цикл, і шляхом додавання металевого заліза в розчин після здійснення виварювання. Додавання залізного наповнювача приводило до 3+ 2+ 0 3+ 2+ відновлення Fe до Fe відповідно до рівняння: Fe +2Fe =3Fe . 4+ 3+ Якщо додавали занадто багато заліза, відбувалося відновлення Ті до Ті і це впливало на вихід. Було встановлено, що мідний наповнювач може бути спочатку доданий до невеликої 3+ 2+ 4+ частини лугу для відновлення Fe до Fe без відновлення Ті , і тоді може бути розрахована точна кількість металевого заліза. I (М )аХb переважно додавали у вигляді сухої солі. Наприклад, якщо насичений розчин II II 2+ 2+ 2+ 2+ 2+ I M TiF6·6Н2О, де М позначає Fe , Mn , Zn , Mg , Cu або т.п., змішують із сухою сіллю М С1, 1 + + + + 1 де М позначає Li , Na , K , або NH4 проміжний M 2TiF6 осаджується майже кількісно з розчину, 4 UA 98288 C2 II 5 10 15 20 25 30 35 40 45 50 55 60 у той час як М Cl2, що також утворюється під час реакції, залишається в розчині. Це не є несподіваним результатом у випадку K2TiF6, який має низьку розчинність, але таке майже кількісне осадження у відношенні Li2TiF6 та (NH4)2TiF6, які обидва добре розчиняються у воді, є несподіваним. II Було також установлено, що для кількісного осадження (NH4)2TiF6 до 1 моля M TiF6 повинні бути додані 4 молі NH4Cl. Це може бути пояснено супутнім утворенням подвійних солей II (NH4)2M Cl4. Цього також можна чекати у випадку калію, однак, через його низьку розчинність II K2TiF6 осаджується більшою мірою, ніж утворюється подвійна сіль K2М . Відповідно, для того, щоб майже кількісно осадити K2TiF6, потрібні тільки 2 молі KСl або 1 моль K2SO4. Те ж саме + + II належить до Li та Na , які не утворюють подвійних солей з М . Хлорид переважніше 2використовують в порівнянні з SO4 , тому що він краще розчиняється і легше повертається в 2цикл. Інші аніони, такі як СН3СОО , NO2 і т.п., можуть також застосовуватися для селективного 2+ 2+ осадження, але NO3. не підходить через те, що він викликає окислювання Fe або Мn . II Селективне осадження призводить до видалення основної маси М , так що після II фільтрування і промивання в кристалічному осаді залишаються тільки невеликі кількості М . Цим способом одержували порівняно чистий попередник титану з високим виходом (>90 %). I Якщо відбувалося пряме відновлення M 2TiF6, кількість заліза, що знаходиться в титані, що утворюється, відповідала вмісту заліза в титані сорту 4 (хоча вміст кисню, азоту, вуглецю та водню був дуже низьким). Для того, щоб знизити вміст заліза в титані для одержання металу зі вмістом заліза, що відповідає його вмісту в титані сорту 1, або менше, було необхідно підвищити ступінь чистоти попередників. Через низьку розчинність K2TiF6 та Na2TiF6, перекристалізація є неефективною і ці солі очищали шляхом екстракції розчинником із застосуванням метилізобутилкетону (МІВК) і НСl. Практичніше було осаджувати селективно високорозчинні солі Li2TiF6, або (NH4)2TiF6, тому що ці солі можна легко перекристалізовувати. Було також встановлено, що киплячі насичені розчини (NH4)2TiF6, не призводять до гідролізу солі (що незвичайно для водорозчинних солей титану) і. відповідно, може бути отримана висока концентрація, що забезпечує максимальний вихід кристалічного продукту при охолодженні. Цим шляхом можуть бути отримані дуже чисті попередники титану, вони були досить чистими для того, щоб їх використовувати як попередників при одержанні пігментів ТіО 2. Металічний титан, отриманий при відновленні очищеного (NH4)2TiF6, був чистіший за промисловий титан 1 сорту. Після того, як (NH4)2TiF6 був очищений методом перекристалізації, були намічені два підходи до одержання металічного титану. Перший підхід (Метод А) включає відновлення Na2TiF6 або K2TiF6, отриманих з (NH4)2TiF6. Через різницю в розчинності між (NH4)2TiF6, і Na2TiF6 (або відповідної солі калію) Na2TiF6 може бути осаджений з насиченого розчину (NH4)2TiF6 шляхом додавання хлориду натрію. NH4Cl, отриманий як побічний продукт, можна потім відфільтрувати від осаду та перекристалізувати для повторного застосування на стадії селективного осадження. Після сушіння Na2TiF6 (температура плавлення 700 °C) може бути відновлений в атмосфері аргону. Відновлення є екзотермічним при точці плавлення солі. Як відновлюючий агент звичайно застосовують натрій або магній (10 %-ний стехіометричний надлишок), але можна також використовувати калій або кальцій. Після відновлення надлишок натрію або магнію видаляють при 900 °C або 1100 °C, відповідно. Одержують, відповідно, 6NaF(Ti) або 2NaMgF3(Ti). Фтортитанова суміш потім подається в розташований вертикально подовжений трубчастий металоприймач для двоокису цирконію або молібдену в атмосфері аргону. Верхня частина металоприймача нагрівається до 1300 °C, а нижня частина нагрівається до 1700 °C. Основна розплавлена маса 6NaF (температура плавлення 990 °C) або 2NaMgF3 (температура плавлення 1030 °C) випускається з металоприймача над розплавленим титаном, і інша частина розплавленого фториду виконує роль ковдри на розплавленому титані (температура плавлення 1670 °C) для захисту його від дії кисню та азоту. Розплавлений титан потім відливається у вигляді злитків або інших продуктів в розплавленій евтектиці фториду, що складається, наприклад, з 40 мол. % NaF й 60 мол. % UF (температура плавлення 652 °C), що дозволяє здійснити випал титану при 700 °C. При цьому титан усе ще залишається захищеним від окислювання та нітрифікування під час випалу. Другий підхід до одержання титану (Метод В) включає попереднє відновлення (NH4)2TiF6 до 3+ 3+ Ті , конверсію Ті з одержанням TiF3 і відновлення TiF3 до металічного титану. Наприклад, (NH4)2TiF6, отриманий на стадії селективного осадження, може бути відновлений Аl (активованим Hg) або Mn без додавання кислоти. Типовими продуктами відновлення є NH4TiF4 та (NH4)3AlF6 або (NH4)2TiF5 й MnF2. У випадку відновлення алюмінієм (NH4)2AlF6 є більш розчинним і може бути видаленим з майже 5 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 60 нерозчинного осаду NH4TiF4 шляхом фільтрування в кислому середовищі. Цей продукт потім можна піддати розкладанню при температурі 700 °C з одержанням NH4F (газ) і TiF3 (твердий продукт). З розведеного (NН4)2АІF6 може бути осаджений Na3AlF6 (кріоліт) як побічний продукт за допомогою NaCl і отриману сіль амонію можна повернути в цикл. При додаванні кислоти (звичайно HF) можуть бути застосовані інші відновлюючі агенти, такі як Zn, Al, Mn, Fe або Mg. Типовим продуктом є (NH4)2HTiF6. який легко розчиняється в кислоті (рН 1-2), у той час як фториди відновлюючого агента, набагато гірше розчиняються й можуть бути відділені від (NH4)2HTiF6, шляхом фільтрування. Підвищення рН за допомогою NH4OH (рН 6) призводить до осадження (NH4)3TiF6. Після фільтрації й сушіння продукт можна піддати розкладанню при 700 °C з одержанням 3NH4F (газ) і TiF3 (твердий продукт). Однак, альтернативним способом є електролітичне відновлення (NH4)2TiF6. Для відділення анода від катода використовують мембрану, таку як мембрана із лляної тканини. Звичайно застосовують свинцевий анод і графітовий катод. Стінка анода заповнена 0,1 N розчином HF, а стінка катода заповнена насиченим розчином (NH4)2TiF6, підкисленим HF до рН 1. При електролізі протікають наступні реакції: + Анод: Н2О=1/2 О2 (газ)+2Н (вода)+2е 4+ 3+ Катод: 2Ті (води) + 2е =2Ті (води). Після електролізу рН розчину фіолетових кольорів (NH4)2HTiF6 підвищують до 6 шляхом додавання NH4OH з метою одержання (NH4)2TiF6. Після фільтрації й сушіння продукт можна 3+ піддати розкладанню при 700 °C з одержанням 3NH4F (газ) і TiF3 (твердий продукт). Ті потім відновлюють з одержанням металічного титану. TiF3 можна відновити Na, Mg або АІ з одержанням 3NaF(Ti), I½MgF(Ti) або AlF(Ti), відповідно. Процес відновлення TiF3 є менш екзотермічним, ніж процес відновлення (Na, K)2Ті6 і відбувається при температурі вище 700 °C. Як описано вище, Na або MgF2 може бути виплавлений з титану, у той час як AlF3 сублімується при температурі 1300 °C. Для того, щоб домогтися відсутності вільної HF після стадії виварювання, при здійсненні цієї стадії підтримується 30±10 % - ний надлишок ільменіту. Через наявність крупних зерен і високої щільності надлишок ільменіту осаджується з лугу та світлого нерозчинного осаду після виварювання. Осад на фільтрі потім знову суспендують і просівають на ситі 45 мкм. Верхня фракція (ільменіт) повертається в цикл в апарат для виварення, у той час як нижня фракція (в основному нерозчинна в кислоті) відкидається. Таким шляхом досягається ступінь виварення більше 90 %. За методом А, що здійснюють шляхом відновлення Na2TiF6, вибір відновлюючого агента визначає вибір солі, який використовується для селективного осадження. Натрій сприяє осадженню хлориду, у той час як магній сприяє осадженню сульфату. Петлі рециклу показані на Фіг. 16 та 17, які показують одержання титану з високим ступенем чистоти та титану сорту 4, відповідно. 4+ 3+ За методом В, що здійснюють шляхом проміжного відновлення Ті до Т , рецикл здійснюється практично так само, як і у випадку методу А, як показано на Фіг. 1. Якщо 4+ 3+ електролітичне попереднє відновлення (Ті до Ті ) не застосовується, фторидні солі відновлюючих агентів будуть являти собою побічні продукти. Якщо на стадії вторинного 4+ 3+ відновлення (Ті до Ті ) застосовують алюміній, сублімований AlF3 може бути проданий як побічний продукт або фториди можуть бути виділені шляхом парового гідролізу при температурі 400 °C за наступним рівнянням: 2AlF3+3Н2О=Аl2О3+6HF. Al2О3 є при цьому побічним продуктом. Fe2O3 є основним побічним продуктом способу за винаходом. Якщо як відновлюючий агент застосовують магній, що не регенерується, побічними продуктами будуть також Mg(ОН)2 або MgSO4. Далі винахід описаний у прикладах, показаний на рисунках і у Таблиці 1, при цьому: Фіг. 1 представляє загальну діаграму способу за винаходом; Фіг. 2 відображає діаграму кращого способу; На Фіг. 3 представлена рентгенограма дифракційних смуг селективно осадженого (NH4)2TiF6; На Фіг. 4 представлена рентгенограма дифракційних смуг (NH4)2TiF6, показаного на Фіг. 3, після перекристалізації; На Фіг. 5 показана рентгенограма дифракційних смуг NH4TiF4, отриманого відновленням (NH4)2TiF6 за допомогою АІ(Hg); Фіг. 6 відображає рентгенограму дифракційних смуг TiF3, отриманого шляхом розкладання NH4TiF4, показаного на Фіг. 5; 6 UA 98288 C2 5 10 15 20 25 30 На Фіг. 7 показані накладені одна на одну рентгенограми дифракційних смуг стандартних зразків TiF3 й FeF3, На Фіг. 8 представлена рентгенограма дифракційних смуг продукту відновлення TiF3 за допомогою алюмінію при 750 °C; На Фіг. 9 показана рентгенограма дифракційних смуг AlF3, сублімованого при температурі 1250 °C; На Фіг. 10 показана рентгенограма дифракційних смуг продукту, показаного на Фіг. 8. після сублімації AlF3; Фіг. 11 відображає рентгенограму дифракційних смуг металічного титану, отриманого з порошку, показаного на Фіг. 10; Фіг. 12 відображає рентгенограму дифракційних смуг нітриду титану, що утворився при дії на порошок титану за Фіг. 10 азоту при температурі 1350 °C; На Фіг. 13 показана рентгенограма дифракційних смуг NH4VF4, отриманого шляхом відновлення (NH4)2VF6 за допомогою АІ(Hg); На Фіг. 14 показана рентгенограма дифракційних смуг VF3; отриманого шляхом розкладання NH4VF4, показаного на Фіг. 13; На Фіг. 15 показаний порошок титану за Фіг. 10 після м'якого спікання при температурі 1250 °C; Фіг. 16 відображає діаграму способу відновлення за допомогою натрію і На Фіг. 17 показана діаграма способу відновлення за допомогою магнію; та в таблиці 1 показані хімічний склад, механічні властивості й фізичні властивості різних сортів титану. Як показано на Фіг. 1, спосіб за винаходом можна розділити на п'ять стадій. Ці стадії являють собою виварення ільменіту, селективне осадження попередника титану, отриманого на стадії виварення, відновлення попередника, плавлення відновленого титанового продукту з одержанням злитків і повернення в цикл реагентів, використаних при проведенні процесу. ПРИКЛАД 1. Одержання титану з ільменіту методом відновлення (NH4)2TiF6 зa допомогою Аl(Hg) Стадія 1: Виварення ільменіту в розведеній HF. Вихідна сировина. Як вихідну сировину на стадії виварення застосовували концентрат ільменіту. Матеріал містив приблизно 89,5 % ільменіту, 6 % гематиту, 2,5 % кварцу й 2 % окислів інших металів. Розмір частинок був однорідним і приблизно 98 % сировини характеризувалися розміром часток між +45 мкм й - 106 мкм. Вихідний матеріал мав наступний хімічний склад: 35 Аl 0,35 % 40 45 50 55 Са 0,1 % Fe 37,2 % Mg 0,27 % Mn 0,95 % Si 1,18 % Ті 28,3 % V 0,5 % Стехіометрія: Кількість HF, необхідна для 500 г ільменіту. Використовуваний ільменіт складався з FeTiO3 (89,5 %), Fe2O3 (6,0 %), SiO2 (2,5 %) і інших компонентів (2 %). Це відповідало FeTiO3 (447,5 г; 2,95 мол.), Fe2O3 (30 г; 0,19 мол.) і SiO2 (12,5 г; 0,21 мол.) в 500 г. FeTiO3, Fe2O3 та SiO2 кожна вимагають 6 мол HF на моль для конверсії, відповідно, в FeTiF6, FeF3 та H2SiF6. Отже, загальна кількість, що вимагається HF, становила (2,95+0,19+0,21)×6=20,1 мол. для 98 % - ної вихідної сировини. Однак для досягнення повного виварення на цій стадії застосовували 20 % - ний надлишок ільменіту. Після виварення близько 94 % від надлишку ільменіту могло бути регенеровано завдяки його високій щільності та грубим частинкам. Шихту готовили в такий спосіб. У поліпропіленову посудину об'ємом 2 л додавали ільменіт (600 г) у водопровідній воді (500 мол, 20 °C). При енергійному перемішуванні додавали HF (900 мл, 40 %) і посудину закривали незакріпленою важкою кришкою із пластику. Реакція була дуже екзотермічною і приблизно через 10 хв. суспензія досягала точки кипіння і кипіла протягом приблизно 5 хв. Через 2 год. до розчину додавали Fe (12 г, сталева вата) і суміш перемішували протягом 1 ч для відновлення всього розчинного Fe (III) до Fe (II). Потім суспензію фільтрували і промивали водопровідною водою (2×50 мол). Одержували на фільтрі близько 200 г вологого осаду. Цей матеріал знову суспендували для виділення більшої частини надлишку ільменіту і одержували 1375 мл лугу, що містить FeTiF6. Вихід при екстракції. Концентрація Ті у лузі становила приблизно 100 г/л, що відповідало 137,5 г титану. Вихід при екстракції визначали в такий спосіб: 7 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Стехіометрія: 141,5 г Ті (завантаження 500 г) = 97 % - 20 % - ний надлишок: 169,8 г Ті (завантаження 600 г) = 81 % - 94 % - на регенерація надлишку: 144 г Ті (завантаження 505 г) = 95,5 %. Стадія 2: Селективне осадження. Луг (1,375 л) містив Ті (137,5 г, 2,865 мол). Для цього був потрібний NH4C1 (4×2,865=11,46 мол, 613,11 г). NH4Cl (613 г) повільно додавали до лугу, що містить FeTiF6 зі стадії 1 (1,375 л), при енергійному перемішуванні. Температура знижувалася до величини нижче 10 °C і її підвищували до 15 °C на теплій бані. Потім суспензію перемішували при 15 °C протягом 1 год. Отриманий кристалічний (NH4)2TiF6 відфільтровували при 15-20 °C та пресували в головці фільтра для видалення як можна більшого надлишку рідини. Потім відключали вакуум і додавали до продукту крижану воду (184 мол., 5 °C). Вакуум можна було включити тільки після того, як вода проникнула в осад на фільтрі (приблизно через 2 хв.), кристалічний (NH4)2TiF6 мав вигляд цукрової глазурі. Кристалічний продукт відсмоктували й пресували досуха, як тільки це було можливо. Потім кристалічний (NH4)2TiF6 піддавали сушінню при 60 °C. Вихід дорівнював 522 г. Рентгенограма дифракційних смуг цього продукту показана на Фіг. 3. Вихід при осадженні. В розрахунку на (NH4)2TiF6 кристалічний продукт має ступінь чистоти рівну 100 % (522 г=2,631 мол. Ті), вихід Ті дорівнює 92 %. Концентрація Fe у кристалічному продукті звичайно дорівнювала приблизно 0,5+0,4 %. Були присутні також інші домішки, такі як Si та Аl. Однак ці домішки можуть бути вилучені попередньою обробкою сировини перед виваренням (наприклад, шляхом вилужування каустичною содою) або шляхом осадження цих елементів після проведення виварення. Наприклад, після відновлення Fe можна додати NaCl для осадження Na2SiF6 та Na3AlF6. Перекристалізація. (NH4)2Ti6 (400 г), отриманий як було описано вище, і висушений при 60 °C, додавали у воду (500 мол) у посудині об'ємом 2 л. Було встановлено, що безводний (NH4)2TiF6 має більшу розчинність, ніж гідратований або вологий (NH4)2TiF6 x Н2О. До цієї суспензії додавали невеликий шматок смужки Аl (приблизно 100 мм ×25 мм). Для запобігання гідролізу та ініціювання відновлення невеликої кількості Ті (IV) алюмінієм при перемішуванні додавали HF (0,5 мл, 40 %). Суспензію нагрівали до температури кипіння (приблизно 100 °C). Піна, що утворюється на поверхні розчину, згодом зменшувалася і змішувалася з розчином. Колір розчину ставав блідо-фіолетовим, що вказувало на наявність Ті (III). Це також свідчило про те, що все наявне залізо було у вигляді Fe (II). Коли розчин кипів, шар фіолетового TiF3 отруював смужку Аl і відновлення припинялося. Утворення невеликої кількості (NH4)2AlF6, через додавання смужки алюмінію не становило ніякої проблеми, тому що цей продукт утворюється як побічний на наступній стадії (Стадія 3). Після кипіння розчину протягом приблизно 1 хв. його видаляли від джерела нагрівання і давали йому остудитися. Потім видаляли смужку Аl і знову використовували її (без очищення) у наступному циклі. Посудину прохолоджували до температури, рівної близько 40 °C, холодною водою і потім лід та холодну воду застосовували для охолодження посудини до 10 °C при перемішуванні кристалічного (NH4)2TiF6, що утворюється. Потім кристалічний продукт фільтрували та пресували в головці фільтра для якнайповнішого видалення надлишку рідини. Потім відключали вакуум і до кристалічного продукту додавали крижану воду (50 мл, 5 °C). Вакуум можна було включити тільки після того, як вода проникнула в осад на фільтрі (приблизно через 2 хв.), кристалічний (NH4)2TiF6 мав вигляд цукрової глазурі. Кристалічний продукт відсмоктували й пресували досуха, як тільки це було можливо. Отриманий кристалічний (NH4)2TiF6 сушили при 60 °C. Звичайно вихід становив 70 % від вихідного кристалічного продукту без випару додаткової води. Рентгенограма дифракційних смуг цього продукту показана на Фіг. 4. Недопрацьований, але надійний метод визначення ступеня чистоти висушеного кристалічного (NH4)2TiF6 полягав у додаванні цього продукту (приблизно 5 г) до хімічно чистого НСl (приблизно 25 мл, 32 %) у скляній склянці об'ємом 50 мл. Після витримки протягом приблизно 5 хв. НСl ставала жовтою або жовтогарячою, якщо наявною була якась кількість заліза. Концентрована НСl є дуже чутливою до заліза, і інтенсивність жовтого або жовтогарячого забарвлення прямо пропорційна концентрації заліза при величинах концентрації 8 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 60 між 1 % та 0,01 % Fe. Це визначення проводили із застосуванням вихідного кристалічного продукту, перекристалізованого продукту та еталонного (NH4)2TiF6. Стадія 3: Відновлення (NH4)2TiF6 за допомогою АlHg. Активація Аl ртуттю. Алюмінієву крупку (діаметр близько 10-15 мм, товщина 1-3 мм, 150 г) занурювали в 1N розчин NaOH у склянці об'ємом 500 мл із пластику та додавали ртуть (приблизно 50 мл). Крупку перемішували пластмасовою мішалкою й занурювали у ртуть. Приблизно через 5 хв. крупка була повністю покрита ртуттю. Гідроокис натрію видаляли шляхом промивання крупки сильним потоком водопровідної води в склянці протягом приблизно 1 хв. Потім зливали надлишок ртуті із крупки, покритою ртуттю, через сито (500 мкм) і відразу ж на крупку виливали ацетон. Після витримки в ацетоні протягом приблизно 1-2 г із крупки продовжувала капати ртуть, після чого на крупці залишився тільки мікрошар ртуті. Готову до використання крупку Al(Hg) просівали через сито (500 мкм) з ацетону та вільної Hg і відразу ж крупицями додавали в розчин (NH4)2TiF6, описаний вище. Відновлення. У посудині об'ємом 2 л перекристалізований (NH4)2TiF6 зі стадії 2 (500 г) розчиняли у водопровідній воді (1,5 л). Температуру підвищували до 30 °C, утворювався прозорий розчин. Крупку Al(Hg), отриману як було описано вище, додавали до розчину (NH4)2TiF6 при перемішуванні (без завихрень). Реакція була екзотермічною і температура підвищувалася від 30° до 70 °C у плин 75 хв. Через 15 хв. нагрівання при 70 °C суспензію охолоджували до температури нижче 30 °C та відфільтровували. Крупка Al(Hg) промивалася водою і зберігалася в ацетоні. Фіолетовий осад відфільтровували, відсмоктували рідину досуха та промивали водою (2×50 мл). Фіолетовий осад висушували при температурі 60 °C (вихід склав 475 г). Продукт, отриманий при цьому, складався зNH4TiF4 та (NH4)3AlF6 У ваговому відношенні, рівному приблизно 75 %; 25 %. NH4TiF4 має низьку розчинність у розведеній HF і навіть ще більш низьку розчинність у концентрованій HF. Таким чином, якщо необхідно, (NH4)3AlF6 (і інші домішки) може бути видалений з продукту при промиванні. Рентгенограма дифракційних смуг цього чистого продукту наведена на Фіг. 5. Було також встановлено, що, якщо замість чистого (NH4)2TiF6 використати сирий продукт, Fe (II), що знаходиться в розчині, покривав крупку Al(Hg) і отруював її. Однак це відбувалося тільки після того, як весь Ті (IV) відновлювався до Ті (III). Заявник вважає, що цей метод може бути застосований для видалення Fe до того ступеня, коли перекристалізація (NH4)2TiF6 перестане бути необхідною. Після відновлення отруєна крупка Al(Hg) може бути знову активована за допомогою розведеного лугу НСl з метою видалення заліза. Стадія 4: розкладання NH4TiF4 та (NH4)3AlF6. Продукт відновлення, отриманий на стадії 3, що складається із суміші NH4TiF4 та (NH4)3AlF6, піддавали розкладанню при температурі 600 °C в атмосфері азоту або аргону в м'яких умовах в апараті, що обертається. Через 2-4 год. намочування світло-коричневий продукт, що складається з TiF3 та AlF3 зовсім не містив NH4F, який випарувався. Продукт, що випарувався, конденсували і збирали. Було знайдено, що, якщо залишалися сліди NH4F. то під час відновлення алюмінієм при 750 °C утворювався TiN. В залежності від відношення між NH4TiF4 та (NH4)3AlF6, вихід продукту, отриманого на стадії розкладання, звичайно дорівнював від 60 до 70 % від вихідної сировини. Рентгенограма дифракційних смуг чистого TiF3, отриманого із чистого NH4TiF4, отриманого як було описано вище, показана на Фіг. 6. Дотепер сіль NH4TiF4 була невідомою і, відповідно, немає даних, з якими можна було б порівняти рентгенограму дифракційних смуг NH4T1F4, показану на Фіг. 5. Найбільш придатною для порівняння з рентгенограмою цієї солі є рентгенограма дифракційних смуг NH4FeF4 Тому не є несподіваним той факт, що продукт розкладання NH4TiF4, що являє собою TiF3, краще порівнювати з FeF3 (їхні рентгенограми). Рентгенограми дифракційних смуг стандартних зразків FeF3 та TiF3 показані на Фіг. 7. Стадія 5: відновлення TiF3 алюмінієм і сублімація AlF3. Після визначення відношення між TiF3 та AlF3 у продукті, отриманому на стадії (4) порошок АІ ( 99,9 %) під шлаком NaF. Повернення NaF у цикл проводили в окремому досліді. У склянку об'ємом 250 мл з незакріпленою кришкою поміщали NaF (42 г, - 500 мкм) і концентровану НСl (100 мл, 32 %) і перемішували при кімнатній температурі протягом 2 год. з метою одержання водного розчину HF. Дрібнокристалічний NaCl (57 г після сушіння при 120 °C; >98 %) відфільтровували з розчину (96 л). HF випарювали до об'єму рівного 84 мол з одержанням 20 % - ного розчину HF (що свідчить про вихід, рівний приблизно 95 %). Після селективного осадження (NH4)2TiF6, з FeTiF6 за допомогою NH4C1 фільтрат містив подвійну сіль (NH4)2FeCl6 і деякі сліди елементів, які поводяться як залізо. NH4Cl регенерували як описано у прикладі 3. НСl і NaOH регенерували шляхом електролізу насиченого розчину NaCl. Це добре відомий промисловий спосіб, що застосовують, наприклад, на установці Chloorkop у Південній Африці, що робить кілотонни продуктів. Силікат натрію виділяли з гідроокису натрію і двоокису кремнію, як це добре відомо, наприклад, у скляній промисловості і перетворювали силікат натрію в натрій за допомогою Si(Fe) за відомими методами. ПРИКЛАД 9. Одержання титану з ільменіту шляхом відновлення Na2TiF6 магнієм. Як видно на Фіг. 17, ільменіт (800 г) піддавали виваренню 20 %-ним водним розчином HF з одержанням лугу, як описано в прикладі 1. До отриманого продукту (438 мл) додавали сульфат натрію (149 г, 5 % - ний надлишок) і перемішували розчин протягом 1 год. при температурі 20 °C. Отриману суспензію фільтрували з одержанням вологого білого кристалічного продукту, що промивали мінімальною кількістю насиченого розчину Na2SO4 (приблизно 3×25 мл) і сушили при температурі 60 °C з одержанням кристалічного Na2TiF6 (195 г, що свідчить при вихід, рівний 94 %, ступінь чистоти дорівнював приблизно 99 %). Висушений кристалічний Na2TiF6 (195 г) додавали до магнієвої насадки (57 г, 20 %-ний надлишок) у приймачі з нержавіючої сталі об'ємом 750 мл з незакріпленою кришкою в атмосфері аргону. Приймач поміщали в муфельну піч (усе ще в атмосфері аргону) і нагрівали 13 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 до температури близько 700 °C. При цій температурі відбувалася екзотермічна реакція і температура спонтанно підвищувалася до приблизно 900 °C. Потім температуру підвищували до приблизно 1100 °C і витримували при цій температурі протягом приблизно 30 хв. для того, щоб переконатися в тому, що весь надлишок магнію випарувався, потім давали охолодитися. Після того, як приймач остудився до кімнатної температури, припиняли подачу аргону, а продукт, що складається із суміші NaMgF3 і титану вивантажували із приймача. Через те, що в попереднику знаходилося залізо, одержували титан тільки сорту 4 шляхом плавлення продукту при температурі 1700 °C. Петлі рециклу, показані на Фіг. 17, є добре відомими комерційними способами. ПРИКЛАД 10. Одержання нітриду титану, карбіду, бориду, гідриду, силіциду, фосфіду і сульфіду титану. Дезактивований порошок титану за прикладом 1 нагрівали в присутності, відповідно, газоподібного азоту, вуглецю у вигляді вуглецевого порошку або коксу, диборану, газоподібного водню, порошкоподібного кремнію, фосфіну та порошкоподібної сірки з метою одержання нітриду титану, карбіду титану, бориду титану, гідриду титану, силіциду титану, фосфіду титану та сульфіду титану, відповідно. Переваги. Спосіб відповідно до даного винаходу має кілька явних переваг у порівнянні з відомими з рівня техніки способами. (1) По-перше, у способі за винаходом застосовуються недорогі вихідні матеріали, такі як ільменіт, що доступний у великих кількостях. (2) Побічні продукти, що виходять при здійсненні цього способу, усі повертаються в цикл і, відповідно, має місце дуже невелике надлишкове споживання реагентів. (3) Спосіб за винаходом дозволяє також одержувати титан, що містить захисне фторидне покриття, як описано вище. (4) Подальшою перевагою способу за винаходом є те, що замість попередника титану, такого як ТіСl4 застосовується проміжний продукт (NH4)2TiF6, що не був раніше комерційно доступний. Сіль (NH4)2TiF6 стабільна на повітрі й у воді, вона не викликає корозії й може бути легко отримана у водному середовищі при кімнатній температурі. З іншого боку, ТіСІ 4 є дуже токсичною рідиною, що швидко розкладається на повітрі й у воді і викликає сильну корозію, її важко одержати, тому що потрібні температури порядку 1000 °C і вона перебуває у вигляді газу під час стадії відновлення. Титан, отриманий з ТіСl4 є дорогим і піддається забрудненню О, N, Н і Сl внаслідок відсутності фторидного покриття, характерного для даного винаходу. (5) Подальшою важливою перевагою є той факт, що титан, отриманий способом відповідно до даного винаходу, має вартість, яку можна порівняти з вартістю високоякісної нержавіючої сталі. (6) Ще одна перевага полягає в тому, що алюміній, який є істотно дешевшим, ніж натрій або магній (які використовуються у відомих способах), застосовується на стадії відновлення, і кінцевий продукт не містить сплавів алюмінію. (7) Далі, спосіб відповідно до даного винаходу призводить до одержання порошку титану при температурі, що значно нижче температури плавлення титану. Це призводить до значно більш дешевих пірометалургічних операцій. Цей порошок може бути потім застосований у класичній порошковій металургії для одержання майже чистих формованих виробів. Це призводить до утворення набагато меншої кількості відходів у порівнянні з відомими способами, що передбачають застосування титанових злитків. Однак, якщо потрібні титанові злитки, порошок може бути легко розплавлений на єдиній стадії одержання розплаву, наприклад, в індукційній печі, тому що він захищений покриттям на основі AlF3. AlF3 додатково діє як флюс під час плавлення порошку. (8) Особливо важливою перевагою даного винаходу є те, що при одержанні сплавів титану, як описано в прикладі 2, фторидна сіль або солі інших металів легко можуть бути рівномірно змішані з TiF3 з одержанням гомогенної дисперсії іншого металу або інших металів у сплаві. Відомі способи одержання гомогенних сплавів шляхом змішання розплавлених металів практично важко здійснити. (9) Ще одна перевага даного винаходу полягає в тому, що процес можна здійснити із застосуванням водної технічної HF, що значно дешевше, ніж хімічно чиста водна HF. У Таблиці 1 з метою порівняння наведені типовий хімічний склад, механічні властивості й фізичні властивості комерційно доступних корозійностійких сплавів титану. 14 UA 98288 C2 ТАБЛИЦЯ 1 ХІМІЧНИЙ СКЛАД (НОМІНАЛЬНІ %) Сорт 1 2 3 4 5 7 9 11 12 16 17 18 Вуглець, макс. 0,08 0,08 0,08 0,08 0,08 0,08 0,05 0,08 0,08 0,08 0,08 0,05 Кисень, макс. 0,18 0,25 0,35 0,40 0,20 0,25 0,12 0,18 0,25 0,25 0,18 0,15 Азот, макс. 0,03 0,03 0,05 0,05 0,05 0,03 0,02 0,03 0,03 0,03 0,03 0,03 Залізо, макс. 0,2 0,3 0,3 0,5 0,4 0,3 0,25 0,2 0,3 0,3 0,2 0,25 Аl V 6 3 Водень, макс. 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0,015 4 2,5 Pd Mo Ni 0,3 0,8 0,20 0,20 3 0,05 0,05 0,05 2,5 ТИПОВІ МЕХАНІЧНІ ВЛАСТИВОСТІ* 2 Сорт 1 2 3 4 5 7 9 11 12 16 17 18 Міцність на розтягання, Межа текучості, к/дм , 2 к/дм , хв. хв./макс. 35 25/45 50 40/65 64 55/75 80 70/95 130 120** 50 40/65 90 70** 35 26/46 70 50** 50 40/85 35 25/45 90 70** м % видовження/ 2 хв. 24 20 18 15 10 20 15 24 12 20 24 15 *здрібнений, випалений **мінімальні величини ТИПОВІ ФІЗИЧНІ ВЛАСТИВОСТІ Щільність Модуль Температура перетворення в β-фазу Теплопровідність Термічне розширення (32-600 °F) Температура плавлення 5 10 Сорт 1, 2, 3, 4, 7, 11, 12, 16, 1 3 0,163 ф/дюйм 8 3 15×10 ф/дюйм 0,160 ф/дюйм 8 3 16×10 ф/дюйм 0,162 ф/дюйм 8 3 15×10 ф/дюйм 1635 °F - 1735 °F 1800 °F 1715 °F Сорт 5 Сорт 9 3 3 13-10 брит. тепл. од. 4 брит. тепл. од. /фут. 10 брит. тепл. од. /фут. /фут. ч. °F ч.°F ч.°F -6 -6 -6 5,1×10 /°F 5,3×10 /°F 5,5×10 /°F 3000 °F 3000 °F 3000 °F ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання металічного титану з матеріалу, який містить титан, що включає стадії: II одержання розчину М TiF6 з матеріалу, що містить титан, селективного осадження (NH4)2TiF6 з одержаного розчину шляхом додавання (NH4)aXb, II де М позначає катіон такого типу, що утворює гексафтортитанат, 15 UA 98288 C2 5 10 15 20 25 30 35 40 45 50 55 60 X позначає аніон, обраний з галогеніду, сульфату, нітриту, ацетату та нітрату, і "а" й "b" рівні 1 або 2 і застосування селективно осадженого (NH4)2TiF6 для одержання титану. II 2+ 2+ 2+ 2+ 2+ 2+ 2. Спосіб за п. 1, який відрізняється тим, що М вибирають із Fe , Mn , Zn , Mg , Cu , Ca , 2+ 2+ 2+ 2+ Sr , Ва , Со та Ni . II 3. Спосіб за п. 1, який відрізняється тим, що М TiF6 являє собою FeTiF6 і (NH4)aXb вибирають з NH4Cl та (NH4)2SO4. 4. Спосіб за п. 1, який відрізняється тим, що матеріал, що містить титан, вибирають із ільменіту, рутилу, анатазу, перовскіту, брукіту, псевдобрукіту, сфену, лейкоксену і титанозалізистих шлаків. II 5. Спосіб за п. 4, який відрізняється тим, що М TiF6 являє собою FeTiF6 і розчин FeTiF6 одержують шляхом виварення матеріалу, що містить титан, в присутності водного розчину HF. 6. Спосіб за п. 5, який відрізняється тим, що концентрація HF становить величину між приблизно 5 мас. % і 60 мас. %. 7. Спосіб за п. 6, який відрізняється тим, що концентрація HF перебуває між приблизно 20 мас. % і 24 мас. %. 8. Спосіб за будь-яким з пп. 5-7, який відрізняється тим, що він додатково включає стадію додавання відновлюючого агента до розчину, одержаного на стадії виварення, для відновлення щонайменше деякої кількості Fe (III), що є в розчині, з одержанням Fe (II). II 9. Спосіб за п. 1, який відрізняється тим, що він включає додаткову стадію очищення М TiF6 шляхом перекристалізації. 10. Спосіб за будь-яким з пп. 1-9, що відрізняється тим, що він включає стадію відновлення (NH4)2TiF6, на якій титан перебуває в стадії окислювання IV для одержання продукту на основі титану - III, розкладання продукту на основі титану - III з одержанням TiF3 і відновлення TiF3 до титану. 11. Спосіб за п. 10, який відрізняється тим, що (NH4)2TiF6 відновлюють до продукту на основі Ті (III) відновлюючим агентом, вибраним з алюмінію, марганцю, цинку, заліза і магнію. 12. Спосіб за п. 10, який відрізняється тим, що (NH4)2TiF6 піддають електролітичному відновленню з одержанням продукту на основі Ті (III). 13. Спосіб одержання металічного титану з матеріалу, який містить ТіО 2, що включає стадії: II одержання водного розчину фтористоводневої кислоти, що містить М , виварення матеріалу, що містить ТіО2, в цьому розчині з одержанням розчину, що містить II М TiF6, селективного осадження (NH4)2TiF6 з розчину шляхом додавання (NH4)aXb, II де М позначає катіон такого типу, що утворює гексафтортитанат; X позначає аніон, вибраний з галогеніду, сульфату, нітриту, ацетату та нітрату, і "а" та "b" рівні 1 або 2, і застосування селективно осадженого (NH4)2TiF6 для одержання титана. 14. Спосіб за п. 13, який відрізняється тим, що матеріал, який містить ТіО2, вибирають із рутилу, анатазу, брукіту, лейкоксену і титанозалізистого шлаку. 15. Спосіб за п. 13 або п. 14, що відрізняється тим, що водний розчин фтористоводневої II II кислоти, що містить М , одержують шляхом розчинення основної солі М у водному розчині фтористоводневої кислоти. 16. Спосіб виділення титану з ільменіту, що включає стадії: виварення ільменіту у водному розчині HF для одержання FeTiF6 і видалення нерозчинного продукту, селективного осадження (NH4)2TiF6 шляхом додавання солі амонію, відновлення (NH4)2TiF6 до NH4TiF4 алюмінієм, активованим ртуттю, піролізу NH4TiF4 з одержанням TiF3, відновлення TiF3 до металічного титану алюмінієм з одержанням порошку Ті і видалення маси AlF3 шляхом сублімації. 17. Спосіб за п. 16, який відрізняється тим, що після селективного осадження (NH4)2TiF6 проводять очищення осадженого (NH4)2TiF6. 18. Спосіб виділення титану з матеріалу, що містить ТіО 2, який включає стадії одержання II II водного розчину фтористоводневої кислоти, що містить М , де М позначає катіон такого типу, що утворить гексафтортитанат, виварення матеріалу, що містить ТіО2, в цьому розчині з одержанням розчину, що II містить М TiF6, і видалення нерозчинного продукту, селективного осадження (NH4)2TiF6 шляхом додавання солі амонію, відновлення (NH4)2TiF6 до NH4TiF4 алюмінієм, активованим ртуттю, 16 UA 98288 C2 5 піролізу NH4TiF4 з одержанням TiF3, відновлення TiF3 до металічного титану. 19. Спосіб за п. 18, який відрізняється тим, що після селективного осадження (NH4)2TiF6 проводять очищення осадженого (NH4)2TiF6. 20. Спосіб за п. 18, який відрізняється тим, що матеріал, що містить ТіО2, вибирають з анатазу, рутилу, брукіту, лейкоксену і титанозалізистого шлаку. 17 UA 98288 C2 18 UA 98288 C2 19 UA 98288 C2 20 UA 98288 C2 21 UA 98288 C2 22 UA 98288 C2 23 UA 98288 C2 24 UA 98288 C2 25 UA 98288 C2 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of titanium
Автори англійськоюPretorius Gerard
Назва патенту російськоюСпособ получения титана
Автори російськоюПреториус, Герард
МПК / Мітки
МПК: C22B 34/12, C22C 1/00, C01G 23/00
Мітки: способи, одержання, титану
Код посилання
<a href="https://ua.patents.su/28-98288-sposobi-oderzhannya-titanu.html" target="_blank" rel="follow" title="База патентів України">Способи одержання титану</a>
Попередній патент: Спосіб охолодження екструдованої гофрованої полімерної труби
Наступний патент: Ливарний сплав системи al-mg
Випадковий патент: Спосіб прогнозування розвитку синдрому поліорганної дисфункції