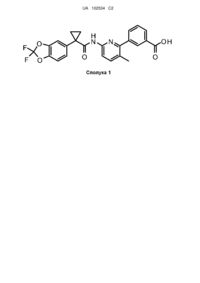
Тверда форма 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти (варіанти)
Номер патенту: 102534
Опубліковано: 25.07.2013
Автори: Чжан Бейлі, Кравец Маріуш, Кесхаварз-Схокрі Алі
Формула / Реферат
1. 3-(6-(1-(2,2-Дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота, охарактеризована у вигляді Форми 1, яка характеризується одним або більше піками при 15,2-15,6 градусах, 16,1-16,5 градусах, 14,3-14,7 градусах, 14,6-15,0 градусах і 17,6-18,0 градусах на порошковій рентгенограмі, одержаній з використанням СuКa випромінювання.
2. Форма 1 за п. 1, яка характеризується одним або більше піками при 15,4, 16,3 і 14,5 градусах.
3. Форма 1 за п. 1, яка додатково характеризується піком при 14,8 градусах.
4. Форма 1 за п. 1, яка додатково характеризується піком при 17,8 градусах.
5. Форма 1 за п. 1, яка додатково характеризується піком при 16,4-16,8 градусах.
6. Форма 1 за п. 5, яка додатково характеризується піком при 16,4-16,8 градусах.
7. Форма 1 за п. 6, яка додатково характеризується піком при 16,6 градусах.
8. Форма 1 за п. 6, яка додатково характеризується піком при 7,6-8,0 градусах.
9. Форма 1 за п. 8, яка додатково характеризується піком при 7,8 градусах.
10. Форма 1 за п. 8, яка додатково характеризується піком при 25,8-26,2 градусах.
11. Форма 1 за п. 10, яка додатково характеризується піком при 26,0 градусах.
12. Форма 1 за п. 10, яка додатково характеризується піком при 21,4-21,8 градусах.
13. Форма 1 за п. 12, яка додатково характеризується піком при 21,6 градусах.
14. Форма 1 за п. 12, яка додатково характеризується піком при 23,1-23,5 градусах.
15. Форма 1 за п. 14, яка додатково характеризується піком при 23,3 градусах.
16. Форма 1 за п. 1, яка характеризується картиною дифракції, по суті подібною картині на Фіг. 1.
17. Форма 1 за п. 1, яка характеризується картиною дифракції, по суті подібною картині на Фіг. 2.
18. Форма 1 за п. 1, в якій розподіл частинок за розмірами D90 становить приблизно 82 мкм або менше.
19. Форма 1 за п. 1, в якій розподіл частинок за розмірами D50 становить приблизно 30 мкм або менше.
20. Фармацевтична композиція, що містить Форму 1 за п. 1 і фармацевтично прийнятний носій.
21. Спосіб лікування муковісцидозу у ссавця, який включає введення ссавцеві ефективної кількості Форми 1 за п. 1.
22. Спосіб за п. 21, який включає введення додаткового терапевтичного засобу.
23. Набір, який включає Форму 1 за п. 1 і інструкцію по її застосуванню.
24. Спосіб одержання Форми 1 за п. 1, який включає суспендування або розчинення НСl-солі 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти у придатному розчиннику протягом ефективного періоду часу.
25. Спосіб за п. 24, в якому придатним розчинником є вода або 50% суміш метанол/вода.
26. Спосіб за п. 24, в якому придатним розчинником є вода.
27. Спосіб за п. 24, в якому ефективний період часу становить 2-24 години.
28. Спосіб за п. 24, в якому ефективний період часу становить 2-6 годин.
29. Кристалічна форма 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти, що має моноклінну кристалічну систему, просторову групу Р21/n і наступні розміри елементарної комірки:
a=4,9626(7) Å; a=90°;
b= 12,2994(18) Å; β=93,938(9)°;
c=33,075(4) Å; γ=90°.
Текст
Реферат: Винахід стосується по суті кристалічної форми вільної твердої речовини, 3-(6-(1-(2,2дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти (Форма 1) формули 1, фармацевтичних композицій, що містять дану речовину, і її застосування в способах лікування. UA 102534 C2 (12) UA 102534 C2 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Перехресне посилання на споріднену заявку Ця заявка вимагає пріоритет згідно з § 11935 U.S.C. по Попередній Заявці на патент Сполучених Штатів № 61/012162, поданій 7 грудня 2007, вміст якої в повному обсязі включений в даний опис шляхом посилання. Галузь техніки Даний винахід стосується твердих форм, наприклад кристалічних форм, 3-(6-(1-(2,2дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти, фармацевтичних композицій на їх основі і способів їх одержання. Рівень техніки Трансмембранний регулятор муковісцидозу (ТРМ) (cystic fibrosis transmembrane regulator, CFTR) є аніонним каналом, опосередкованим цАМФ/АТФ, який експресується у множині типів клітин, включаючи абсорбційні і секреторні клітини епітелію, де він регулює потік аніонів через мембрану, так само як активність інших іонних каналів і білків. У клітинах епітелію нормальне функціонування ТРМ є важливим для підтримання транспорту електролітів у всьому організмі, включаючи дихальну і травну тканину. ТРМ складається з приблизно 1480 амінокислот, які кодують білок, що складається з тандемного повтору трансмембранних доменів, кожний з яких містить шість трансмембранних спіралей і нуклеотидзв'язувальний домен. Ці два трансмембранних домени зв'язані великим, полярним, регуляторним (R)-доменом з численними ділянками фосфорилування, які регулюють активність каналу і клітинну міграцію. Ген, що кодує ТРМ, був ідентифікований і секвенований (див. Gregory R. J., et al., (1990) Nature, 347: 382-386; Rich D. P., et al., (1990) Nature, 347: 358-362, Riordan, J. R., et al., (1989) Science, 245: 1066-1073). Дефект в цьому гені викликає мутації в ТРМ, які приводять до муковісцидозу, найпоширенішому смертельному генетичному захворюванню у людей. Муковісцидозом уражене приблизно одне з кожних 2500 немовлят в Сполучених Штатах. З всього населення Сполучених Штатів до 10 мільйонів чоловік несуть єдину копію дефектного гена без очевидного виявлення захворювання. Навпаки, люди з двома копіями гена, пов'язаного з муковісцидозом, страждають від ослаблення і фатальних ефектів муковісцидозу, включаючи хронічне захворювання легень. У хворих муковісцидозом, мутації в ТРМ, ендогенно експресовані в дихальному епітелії, приводять до зниженої секреції апікальних аніонів, викликаючи нестабільність транспорту іонів і флюїду. Виникаюче зниження транспорту аніонів додає внесок в підвищене накопичення слизу в легенях і супутні мікробні інфекції, які, зрештою, викликають смерть хворих муковісцидозом. На доповнення до респіраторних захворювань хворі муковісцидозом звичайно страждають від шлунково-кишкових проблем і панкреатичної недостатності, яка, якщо її не лікувати, закінчується смертю. Крім того, більшість чоловіків з муковісцидозом безплідні, а плідність серед жінок з муковісцидозом знижується. На відміну від важких ефектів двох копій гена, пов'язаного з муковісцидозом, люди з єдиною копією гена, пов'язаного з муковісцидозом, демонструють підвищену стійкість до холери і дегідратації, що відбувається через пронос, що можливо пояснюється відносно високою частотою гена муковісцидозу в межах популяції. Секвенування гена ТРМ хромосом муковісцидозу показало наявність множини мутацій, що викликають захворювання (Cutting, G.R., et al., (1990) Nature 346: 366-369; Dean, M., et al., (1990) Cell 61: 863-870; Kerem, B-S. et al., (1989) Science 245:1073-1080; and Kerem, B-S., et al., (1990) Proc. Natl. Acad. Science 87: 8447-8451). До цього часу було ідентифіковано більше 1000 мутацій в гені муковісцидозу, які викликають захворювання, (http://www.genet.sickkids.on.ca/cftr/). Найпоширенішою мутацією є усунення фенілаланіну в положенні 508 послідовності амінокислот ТРМ, і вона звичайно згадується як ΔF508-ТРМ. Ця мутація зустрічається приблизно у 70 % випадків муковісцидозу і пов'язана з важким захворюванням. Видалення залишку 508 в ΔF508-ТРМ перешкоджає тому, щоб білок, що формується, склався правильно. Це приводить до нездатності білка-мутанта до виходу з ендоплазматичної мережі (ЕМ) і руху до плазматичної мембрани. В результаті кількість каналів, присутніх в мембрані, набагато менше, ніж спостерігається в клітинах, експресуючих дикий тип ТРМ. На доповнення до ослабленої міграції мутація приводить до дефекту ворітного механізму іонних каналів. Разом з тим, скорочена кількість каналів в мембрані і дефектний ворітний механізм іонних каналів приводять до зниженого транспорту аніонів через епітелій, що приводить до дефектного іонного і рідинного транспорту іонів і флюїду. (Quinton, P. M. (1990) FASEB J. 4: 2709-2727). Дослідження показали, однак, що знижена кількість ΔF508-ТРМ в мембрані функціональне, хоч і менше, ніж ТРМ дикого типу (Dalemans et al., (1991) Nature Lond. 354: 526528; Denning et al., Supra; Pasyk і Foskett (1995), J. Cell. Biochem., 270: 12347-50). На доповнення до ΔF508-ТРМ, інші мутації в ТРМ, що викликають захворювання, які приводять до дефектної 1 UA 102534 C2 5 10 15 20 25 30 35 40 міграції, синтезу, і (або) ворітного механізму, могли з підвищенням або пониженням регулюватися так, щоб змінити секрецію аніона і перебіг захворювання і (або) його тяжкість. Хоч ТРМ транспортує множину молекул на доповнення до аніонів, ясно, що ця роль (транспорт аніонів) представляє один елемент у важливому механізмі транспортування іонів і + + - + води через епітелій. Інші елементи включають епітеліальний Na канал, ENaC, Na /2Cl /K + + + співтранспортер, насос Na -K -АТФази і базолатеральні мембранні K канали, які відповідальні за накопичення хлориду в клітині. Ці елементи працюють разом, щоб досягнути направленого транспорту через епітелій шляхом їх селективної експресії і локалізації в межах клітини. Поглинання хлориду має місце за + рахунок скоординованої активності ENaC і ТРМ, присутніх на апікальній мембрані, і насоса Na + K -АТФази і каналів Cl , експресованих на базолатеральній поверхні клітини. Вторинний активний транспорт хлориду від сторони просвіту приводить до накопичення внутрішньоклітинного хлориду, який може потім пасивно залишити клітину через Cl канали, + - + + приводячи до векторного транспорту. Розташування Na /2Cl /K співтранспортера, насоса Na + + K -АТФази і базолатеральних мембранних K каналів на базолатеральній поверхні і ТРМ на стороні просвіту координують секрецію хлориду за допомогою ТРМ на стороні просвіту. Оскільки вода, ймовірно, активно ніколи не транспортується сама по собі, її потік через епітелій залежить від крихітних трансепітеліальних осмотичних градієнтів, вироблених об'ємним потоком натрію і хлориду. Як обговорено вище, вважається, що делеція залишку 508 в ΔF508-ТРМ перешкоджає тому, щоб білок, що формується, склався правильно, що приводить до нездатності цього білкамутанта вийти з ендоплазматичного ретикулума (ЕР) і рухатися до плазматичної мембрани. В результаті недостатня кількість зрілого білка присутня біля плазматичної мембрани, і транспорт хлориду в межах епітеліальних тканин значно знижується. Фактично, як показано, це клітинне явище дефектного ЕР, що оброблює ABC-транспортери механізмом ЕР, є основою не тільки муковісцидозу, але і широкого кола інших ізольованих і спадкових хвороб. Два шляхи, по яких механізм ЕР може не спрацьовувати, є або втратою зв'язку з відведенням ЕР білків, що приводить до розкладання, або накопиченням ЕР цих дефектних/неправильно складених білків [Aridor М., et al., Nature Med., 5(7), 745-751 (1999); Shastry, B.S., et al., Neurochem. International, 43, 1-7 (2003); Rutishauser, J., et al., Swiss Med. Wkly, 132, 211-222 (2002); Morello, J.P., et al., TIPS, 21, 466-469 (2000); Bross Р., et al., Human Mut., 14, 186-198 (1999)]. 3-(6-(1-(2,2-Дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота у формі солі розкрита в міжнародній публікації РСТ WO 2007056341 (вказана публікація включається тут посиланням повністю) як модулятор активності ТРМ і, таким чином, корисна в лікуванні ТРМ-опосередкованих хвороб, таких як муковісцидоз. Однак, є потреба в стійких твердих формах вказаної сполуки, які можуть легко використовуватися в фармацевтичних композиціях, придатних для використання як терапевтичні засоби. Суть винаходу Даний винахід стосується твердих форм 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти (надалі "Сполука 1"), яка має нижченаведену структуру: . 45 50 Сполука 1 і її фармацевтично прийнятні композиції корисні для лікування або зменшення тяжкості муковісцидозу. У одному аспекті Сполука 1 знаходиться в по суті кристалічній і несольовій формі, називаній Форма 1, як описано і характеризовано тут. Процеси, описані тут, можуть використовуватися, щоб одержати композиції за цим винаходом, які включають Форму 1. Кількість і особливості компонентів, використовуваних в процесах, будуть такими, як описані тут. Короткий опис креслень Фіг. 1 є спектром дифракції рентгенівських променів, розрахованим зі структури монокристала Сполуки 1 у Формі 1. Фіг. 2 є реальним спектром дифракції рентгенівських променів Сполуки 1 у Формі 1. 2 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 3 є накладенням спектра дифракції рентгенівських променів, розрахованого зі структури монокристала Сполуки 1 у Формі 1, і реального спектра дифракції рентгенівських променів Сполуки 1 у Формі 1. Фіг. 4 є кривою диференціальної скануючої калориметрії (ДСК) Сполуки 1 у Формі 1. Фіг. 5 є конформаційною картиною Сполуки 1 у Формі 1 на основі рентгенографічного аналізу монокристала. Фіг. 6 є конформаційною картиною Сполуки 1 у Формі 1 на основі рентгенографічного аналізу монокристала димеру, що утворився за допомогою карбоксильної групи. Фіг. 7 є конформаційною картиною Сполуки 1 у Формі 1 на основі рентгенографічного аналізу монокристала, який показує, що молекули складаються купкою один над одним. Фіг. 8 є конформаційною картиною Сполуки 1 у Формі 1 на основі рентгенографічного аналізу монокристала, що показує інший вигляд (вниз по (а)). 1 Фіг. 9 є H ЯМР спектром Сполуки 1 у Формі 1 в 50 мг/мл суспензії 0,5 метилцелюлози полісорбату 80 при Т(0). 1 Фіг. 10 є H ЯМР спектром Сполуки 1 у Формі 1 в 50 мг/мл суспензії 0,5 метилцелюлози полісорбату 80 після зберігання при кімнатній температурі протягом 24 год. 1 Фіг. 11 є H ЯМР спектром Сполуки 1 × HCl стандарт. Докладний опис винаходу Визначення Як використовується тут, наступні визначення повинні застосовуватися, якщо інакше не зазначено. Термін "ТРМ", як використовується тут, означає трансмембранний регулятор муковісцидозу або його мутацію, здатну виявляти активність регулятора, включаючи, але не обмежуючись ними, ΔF508-ТРМ і G551D ТРМ (див., наприклад, http://www.genet.sickkids.on.ca/cftr/, для мутацій ТРМ). Як використовується тут, "кристалічний" стосується сполук або складів, де структурні одиниці організовані в фіксовані геометричні структури або решітки так, що кристалічні тверді тіла мають твердий дальній порядок діапазону. Структурні одиниці, які складають кристалічну структуру, можуть бути атомами, молекулами або іонами. Кристалічні тверді речовини показують певну температуру плавлення. Термін "модулюючий", як використовується тут, означає збільшення або зменшення, наприклад, активності, у вимірній кількості. У одному аспекті винахід має форму 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти, що характеризується як Форма 1. У іншому варіанті здійснення Форма 1 характеризується одним або більше піками при 15,215,6 градусах, 16,1-16,5 градусах і 14,3-14,7 градусах на порошковій рентгенограмі, одержаній з використанням CuKα-випромінювання. У іншому варіанті здійснення Форма 1 характеризується одним або більше піками при 15,4, 16,3 і 14,5 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 14,6-15,0 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 14,8 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 17,6-18,0 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 17,8 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 16,4-16,8 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 16,6 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 7,6 8,0 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 7,8 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 25,8-26,2 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 26,0 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 21,4-21,8 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 21,6 градусах. У іншому варіанті здійснення Форма 1 додатково характеризується піком при 23,1-23,5 градусах. 3 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому варіанті здійснення Форма 1 додатково характеризується піком при 23,3 градусах. У деяких варіантах здійснення Форма 1 характеризується дифракційною картиною, подібною картині за Фіг. 1. У деяких варіантах здійснення Форма 1 характеризується дифракційною картиною, подібною картині за Фіг. 2. У деяких варіантах здійснення гранулометричний склад D90 становить приблизно 82 мкм або менше для Форми 1. У деяких варіантах здійснення гранулометричний склад D50 становить приблизно 30 мкм або менше для Форми 1. У одному аспекті винахід представляє фармацевтичну композицію, яка включає Форму 1 і фармацевтично прийнятний носій. У одному аспекті даний винахід представляє спосіб лікування хвороб, опосередковуваних ТРМ, який включає введення людині ефективної кількості Форми 1. У деяких варіантах здійснення спосіб включає застосування додаткового терапевтичного засобу. У деяких варіантах здійснення захворювання вибирають з наступного: муковісцидоз, спадкова емфізема, спадковий гемохроматоз, недостатність коагуляції-фібринолізу, така як дефіцит білка С, спадковий ангіоневротичний набряк типу 1, недостатності переробки ліпідів, такі як сімейна гіперхолестеринемія, хіломікронемія типу 1, абеталіпопротеїнемія, лізосомні захворювання накопичення, такі як хвороба I-клітин (муколіпідоз II типу)/муколіпідоз III типу, мукополісахаридоз, хвороба Сандгофа/Тея-Сакс, хвороба Кріглера-Найяра типу II, поліендокринопатія/гіперінсулінемія, цукровий діабет, карликовість Ларона, дефіцит мієлопероксидази, первинний гіпопаратиреоз, меланома, гліканоз (синдром вуглевододефіцитних глікопротеїнів) (glycanosis CDG типу 1), спадкові емфіземи, природжений гіпертиреоз, неповний остеогенез, спадкова гіпофібриногенемія, дефіцит АСТ, нецукровий діабет (НД), нейрофізичний НД, нейрогенний НД, синдром Шарко-Мері-Тута, хвороба ПерлізоМерцбахера, нейродегенеративні захворювання, такі як хвороба Альцгеймера, хвороба Паркінсона, аміотрофічний бічний склероз, прогресуючий супрануклеарний параліч (plasy), синдром Піка, декілька поліглутамінних неврологічних порушень, таких як хвороба Хантінгтона, спінально-церебелярна атаксія типу 1, спінальна і бульбарна м'язова атрофія, дентато-рубропалідо-льюїсова (dentatorubal pallidoluysian) атрофія і міотонічна дистрофія, так само як губчасті енцефалопатії, такі як спадкова хвороба Крейтцфельда-Якоба, хвороба Фабрі, синдром Штрауслера-Шайнкера, ХОХЛ, хвороба сухих очей і хвороба Сьоргрена. У одному варіанті здійснення даний винахід забезпечує спосіб лікування муковісцидозу у людей, який включає введення людині ефективної кількості Форми 1. У одному аспекті даний винахід передбачає набір, що включає Форму 1 і інструкцію по її застосуванню. У одному аспекті даний винахід передбачає спосіб одержання Форми 1, який включає диспергування або розчинення HCl солі 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти у придатному розчиннику протягом ефективного періоду часу. У одному варіанті здійснення даний винахід передбачає спосіб одержання Форми 1, який включає диспергування HCl солі 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти у придатному розчиннику протягом ефективного періоду часу. У деяких варіантах здійснення придатним розчинником є вода або суміш спирт/вода. У деяких варіантах здійснення придатним розчинником є вода або 50 % суміш метанол/вода. У деяких варіантах здійснення придатним розчинником є вода. У деяких варіантах здійснення придатним розчинником є суміш 50 % метанолу і 50 % води. У деяких варіантах здійснення ефективна кількість часу складає від приблизно 2 годин до приблизно дня. У деяких варіантах здійснення ефективна кількість часу складає від приблизно 2 до приблизно 18 годин. У деяких варіантах здійснення ефективна кількість часу складає від приблизно 2 до приблизно 12 годин. У деяких варіантах здійснення ефективна кількість часу складає від приблизно 2 до приблизно 6 годин. У одному аспекті винахід показує кристалічну форму 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти, що має моноклінну кристалічну систему, просторову групу P21/n і наступні розміри елементарної комірки: а=4,9626(7) А, b=12,2994(18) А, с=33,075(4) А, α=90°, β=93,938(9)° і γ=90°. Способи одержання Форми 1. 4 UA 102534 C2 5 10 15 У одному варіанті здійснення Форму 1 одержують з дисперсії або розчину сольової форми, такої як гідрохлорид 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3метилпіридин-2-іл)бензойної кислоти, у придатному розчиннику протягом ефективного періоду часу. У іншому варіанті здійснення Форму 1 одержують з дисперсії сольової форми, такої як гідрохлорид 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3метилпіридин-2-іл)бензойної кислоти, у придатному розчиннику протягом ефективного періоду часу. У іншому варіанті здійснення Форму 1 утворюють безпосередньо з 3-(6-(1-(2,2дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)-третбутилбензоату і відповідної кислоти, такої як мурашина кислота. У одному варіанті здійснення сольова форма гідрохлориду 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти є вихідною точкою і в одному варіанті може бути одержана поєднанням фрагмента хлорангідриду кислоти з фрагментом аміну згідно зі Схемами 1-3. Схема 1. Синтез хлорангідриду кислоти Схема 2. Синтез фрагмента аміну 20 Схема 3. Утворення кислотної солі 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти 5 UA 102534 C2 5 10 15 20 25 30 35 40 45 Використовуючи гідрохлорид (HCl), наприклад, як сольову форму 3-(6-(1-(2,2дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти як вихідну речовину, Форма 1 може бути одержана з високим виходом диспергуванням або розчиненням сольової форми гідрохлориду 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти у придатному розчиннику протягом ефективного періоду часу. Як інші сольові форми 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти можна використовувати, наприклад, сольові форми з іншими неорганічними або органічними кислотами. Інші сольові форми виникають при гідролізі трет-бутилового ефіру відповідної кислоти. Інші кислоти/сольові форми включають азотну, сірчану, фосфорну, борну, оцтову, бензойну, малонову і інші кислоти. Сольова форма 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти може бути або може не бути розчинна залежно від застосовуваного розчинника, але відсутність розчинності не перешкоджає утворенню Форми 1. Наприклад, в одному варіанті здійснення, придатним розчинником може бути вода або суміш спирт/вода, така як 50 % суміш метанол/вода, навіть при тому, що сольова форма гідрохлориду 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкар-боксамідо)-3-метилпіридин-2-іл)бензойної кислоти є тільки помірно розчинною у воді. У одному варіанті здійснення придатним розчинником є вода. Ефективним періодом часу для формування Форми 1 з сольової форми 3-(6-(1-(2,2дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти може бути будь-який час між 2 і 24 годинами або більше. Звичайно, більше ніж 24 години не потрібно, щоб одержати високі виходи (приблизно 98 %), але певні розчинники можуть потребувати більшої кількості часу. Також зрозуміло, що необхідна кількість часу зворотно пропорційна температурі. Таким чином, чим вище температура, тим менше часу потрібно, щоб викликати дисоціацію кислоти з одержанням Форми 1. Коли розчинником є вода, перемішування дисперсії протягом приблизно 24 годин при кімнатній температурі дає Форму 1 приблизно з 98 % виходом. Якщо розчин сольової форми 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти бажаний, то підвищена температура може використовуватися для цілей процесу. Після перемішування розчину протягом ефективної кількості часу при підвищеній температурі, перекристалізація після охолоджування дає по суті чисті форми Форми 1. У одному варіанті здійснення термін по суті чисті стосується більше ніж приблизно 90 % чистоти. У іншому варіанті здійснення термін по суті чисті стосується більше ніж приблизно 95 % чистоти. У іншому варіанті здійснення термін по суті чисті стосується більше ніж приблизно 98 % чистоти. У іншому варіанті здійснення термін по суті чисті стосується більше ніж приблизно 99 % чистоти. Вибрана температура залежить частково від використовуваного розчинника і в межах здібностей фахівця в технології визначити її. У одному варіанті здійснення температура знаходиться між кімнатною температурою і приблизно 80 °C. У іншому варіанті здійснення температура знаходиться між кімнатною температурою і приблизно 40 °C. У іншому варіанті здійснення температура знаходиться між приблизно 40 °C і приблизно 60 °C. У іншому варіанті здійснення температура знаходиться між приблизно 60 °C і приблизно 80 °C. У деяких варіантах здійснення Форма 1 може бути додатково очищена перекристалізацією з органічного розчинника. Приклади органічних розчинників включають, але не обмежуються ними, толуол, кумол, анізол, 1-бутанол, ізопропілацетат, бутилацетат, ізобутилацетат, метилтрет-бутиловий ефір, метилізобутилкетон або суміш 1-пропанол/вода (в різних відношеннях). Температура може використовуватися, як описано вище. Наприклад, в одному варіанті 6 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення Форму 1 розчиняють в 1-бутанолі при 75 °C, поки вона повністю не розчиниться. Охолоджування розчину до 10 °C зі швидкістю 0,2 °C/хв. дає кристали Форми 1, які можуть бути відділені фільтруванням. Застосування, композиція і введення Фармацевтично прийнятні композиції У іншому аспекті даного винаходу забезпечують фармацевтично прийнятні композиції, причому ці композиції включають Форму 1, як описано тут, і необов'язково включають фармацевтично прийнятний носій, допоміжний засіб або транспортний засіб. У певних варіантах здійснення ці композиції необов'язково додатково включають один або більше додаткових терапевтичних засобів. Як описано вище, фармацевтично прийнятні композиції за даним винаходом додатково включають фармацевтично прийнятний носій, допоміжний засіб або наповнювач, які, як використовується тут, включають будь-який з розчинників, розріджувачів або інший рідкий наповнювач, дисперсійні або суспендувальні допоміжні речовини, поверхнево-активні засоби, ізотонічні засоби, загущувальні засоби або емульгатори, консерванти і тверді зв'язуючі компоненти, мастила і т. д., придатні для певної бажаної лікарської форми. Довідник Remington Pharmaceutical Sciences, Sixteenth Edition, E.W. Martin (Mack Publishing Co., Easton Pa., 1980) розкриває різні носії, використовувані в складанні фармацевтично прийнятних композицій, і відомі методики для їх одержання. Крім того, за винятком випадків, коли звичайне середовище носія несумісне із сполуками за винаходом, оскільки виконує яку-небудь небажану біологічну дію або інакше взаємодіє шкідливим чином з будь-яким іншим компонентом фармацевтично прийнятної композиції, вважають, що використання цього носія знаходиться в рамках цього винаходу. Деякі приклади матеріалів, які можуть служити фармацевтично прийнятними носіями, включають, але не обмежуються ними, іонообмінні речовини, оксид алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як людський сироватковий альбумін, буферні речовини, такі як фосфати, гліцин, сорбінова кислота або сорбат калію, суміші неповних гліцеридів насичених рослинних жирних кислот, вода, солі або електроліти, така як сульфат протаміну, динатрійгідрофосфат, калійгідрофосфат, хлорид натрію, солі цинку, колоїдний оксид кремнію, трисилікат магнію, полівінілпіролідон, поліакрилати, воски, блок-полімери поліетиленполіоксипропілену, ланолін, цукри, такі як лактоза, глюкоза і сахароза; крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль; целюлоза і її похідні, такі як натрійкарбоксиметилцелюлоза, етилцелюлоза і ацетатцелюлоза; порошковий трагакант; солод; желатин; тальк; інертні наповнювачі, такі як масло какао і віск супозиторіїв; олії, такі як арахісова олія, бавовняна олія; сафлорова олія; кунжутна олія; оливкова олія; кукурудзяна олія і соєва олія; гліколі, такі пропіленгліколь або поліетиленгліколь; складні ефіри, такі як етилолеат і етиллаурат; агар-агар; буферні засоби, такі як гідроксид магнію і гідроксид алюмінію; альгінова кислота; апірогенна вода; ізотонічний сольовий розчин, розчин Рінгера; етиловий спирт і фосфатні буферні розчини, так само як інші нетоксичні сумісні мастильні речовини, такі як натрійлаурилсульфат і стеарат магнію, так само як пігменти, вивільняючі засоби, покривні засоби, підсолоджувальні засоби, ароматичні засоби і віддушки, консервувальні засоби і антиоксиданти можуть також бути присутніми в складі, згідно з думкою фармацевта. Застосування сполук і фармацевтично прийнятних композицій У ще одному аспекті даний винахід забезпечує спосіб лікування стану, захворювання або порушення з участю ТРМ. У певних варіантах здійснення даний винахід забезпечує спосіб лікування стану, захворювання або порушення, викликаного недостатністю активності ТРМ, який включає введення композиції, що включає форму твердого стану Форми 1, описаної тут, суб'єкту, переважно ссавцю, потребуючому цього. Термін "ТРМ-опосередковане захворювання" як використовується тут, є захворюванням, вибраним з групи: муковісцидоз, спадкова емфізема, спадковий гемохроматоз, недостатність коагуляції-фібринолізу, така як дефіцит білка С, спадковий ангіоневротичний набряк типу 1, недостатності переробки ліпідів, такі як сімейна гіперхолестеринемія, хіломікронемія типу 1, абеталіпопротеїнемія, лізосомні захворювання накопичення, такі як хвороба I-клітин (муколіпідоз II типу)/муколіпідоз III типу, мукополісахаридоз, хвороба Сандгофа/Тея-Сакс, хвороба Кріглера-Найяра типу II, поліендокринопатія/гіперінсулінемія, цукровий діабет, карликовість Ларона, дефіцит мієлопероксидази, первинний гіпопаратиреоз, меланома, гліканоз (синдром вуглевододефіцитних глікопротеїнів) (glycanosis CDG типу 1), спадкові емфіземи, природжений гіпертиреоз, неповний остеогенез, спадкова гіпофібриногенемія, дефіцит АСТ, нецукровий діабет (НД), нейрофізичний НД, нейрогенний НД, синдром Шарко-Мері-Тута, хвороба Перлізо-Мерцбахера, нейродегенеративні захворювання, такі як хвороба Альцгеймера, хвороба Паркінсона, аміотрофічний бічний склероз, прогресуючий супрануклеарний параліч 7 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 (plasy), синдром Піка, декілька поліглутамінних неврологічних порушень, таких як хвороба Хантінгтона, спінально-церебелярна атаксія типу 1, спінальна і бульбарна м'язова атрофія, дентато-рубро-палідо-льюїсова (dentatorubal pallidoluysian) атрофія і міотонічна дистрофія, так само як губчасті енцефалопатії, такі як спадкова хвороба Крейтцфельда-Якоба, хвороба Фабрі, синдром Штрауслера-Шайнкера, ХОХЛ, хвороба сухих очей і хвороба Сьоргрена. У певних варіантах здійснення даний винахід забезпечує спосіб лікування ТРМопосередкованого захворювання людини, який включає стадію введення вказаній людині ефективної кількості композиції, що включає Форму 1, описану тут. Згідно з альтернативним переважним варіантом здійснення даний винахід забезпечує спосіб лікування муковісцидозу людини, який включає стадію введення вказаній людині композиції, що включає Форму 1, описану тут. Згідно з винаходом "ефективна кількість" Форми 1 або її фармацевтично прийнятної композиції є кількістю, ефективною для лікування або зменшення серйозності будь-якої з хвороб, цитованих вище. Форма 1 або її фармацевтично прийнятна композиція можуть бути введені, використовуючи будь-яку кількість і будь-який шлях введення, ефективний для лікування або зменшення серйозності одного або більше захворювань, цитованих вище. У певних варіантах здійснення Форма 1, описана тут, або її фармацевтично прийнятна композиція корисні для лікування або зменшення тяжкості муковісцидозу у хворих, які показують залишкову активність ТРМ в апікальній мембрані дихального і недихального епітелію. Наявність залишкової активності ТРМ на епітеліальній поверхні може бути легко виявлена, використовуючи методи, відомі в технології, наприклад, стандартні електрофізіологічні, біохімічні або гістохімічні методики. Такі методи визначають активність ТРМ, що використовує in vivo або ex vivo електрофізіологічні методики, вимірювання концентрації Cl в поту або слині, або ex vivo біохімічні або гістохімічні методики, щоб контролювати густину поверхні клітини. Використовуючи такі методи, залишкова активність ТРМ може бути легко виявлена у хворих, гетерозиготних або гомозиготних відносно множини різних мутацій, включаючи хворих, гомозиготних або гетерозиготних по найбільш загальній мутації, ΔF508. У одному варіанті здійснення Форма 1, описана тут, або її фармацевтично прийнятна композиція корисні для лікування або зменшення тяжкості муковісцидозу у хворих в межах певних генотипів, що показують залишкову активність ТРМ, наприклад, клас III мутацій (ослаблене регулювання або ворітний механізм), клас IV мутацій (змінена провідність) або клас V мутацій (знижений синтез) (Lee R. Choo Kang, Pamela L., Zeitlin, Type I, II, III, IV і V Cystic Fibrosis Transmembrane Conductance Regulator Defects and Opportunities of Terapy (Дефекти I, II, III, IV і V типу трансмембранного регулятора провідності муковісцидозу і можливості терапії), Current Opinion in Pulmonary Medicine 6: 521-529, 2000). Інші генотипи хворих, які показують залишкову активність ТРМ, включають хворих, гомозиготних по одному з цих класів або гетерозиготних по будь-якому іншому класу мутацій, включаючи клас I мутацій, клас II мутацій, або мутацію, яка не має класифікації. У одному варіанті здійснення Форма 1, описана тут, або її фармацевтично прийнятна композиція корисні для лікування або зменшення тяжкості муковісцидозу у хворих в межах певних клінічних фенотипів, наприклад, від помірного до м'якого клінічного фенотипу, який звичайно корелює з кількістю залишкової активності ТРМ в апікальній мембрані епітелію. Такі фенотипи включають хворих, що показують панкреатичну недостатність, або пацієнтів, діагностованих з ідіопатичним панкреатитом і природженою двосторонньою відсутністю сім'явиносного протоку або захворюванням легень середньої тяжкості. Точна необхідна кількість буде змінюватися від суб'єкта до суб'єкта залежно від різновиду, віку і загального стану суб'єкта, серйозності інфекції, конкретного засобу, способу його введення і т. д. Сполуки за винаходом переважно складають в стандартній лікарській формі для простоти введення і однорідності дозування. Вираз "стандартна форма одиниці дозування", як використовується тут, стосується фізично дискретної одиниці засобу, відповідної хворому, що підлягає лікуванню. Розуміють, однак, що повне щоденне використання сполук і композицій за даним винаходом буде вирішуватися лікуючим спеціалістом в рамках розумної медичної думки. Конкретний ефективний рівень дози для будь-якого конкретного хворого або організму буде залежати від множини факторів, включаючи порушення, що підлягає лікуванню, серйозність порушення; активність конкретної використовуваної сполуки; конкретну застосовувану композицію; вік, вагу тіла, загальне здоров'я, стать і дієту хворого; час призначення, спосіб введення і швидкість виділення конкретної використовуваної сполуки; тривалість лікування; композиції, які використовуються в комбінації або збігаються з конкретною використовуваною 8 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполукою, і інших факторів, відомих в медичних технологіях. Термін "пацієнт", як використовується тут, означає тварину, переважно ссавця і найбільш переважно людину. Фармацевтично прийнятні композиції за винаходом можуть бути введені людям і іншим тваринам перорально, ректально, парентерально, інтрацистернально, інтравагінально, інтраперитонеально, місцево (як порошки, мазі або краплі), букально, як ротовий або назальний спрей або подібним чином, залежно від серйозності інфекції, що підлягає лікуванню. У певних варіантах здійснення сполуки за винаходом можуть бути введені перорально або парентерально при рівнях дозування від приблизно 0,01 мг/кг до приблизно 50 мг/кг і переважно від приблизно 1 мг/кг до приблизно 25 мг/кг ваги тіла на добу, один або більше разів на день, щоб одержати бажаний терапевтичний ефект. У певних варіантах здійснення дозована кількість Форми 1 в стандартній лікарській формі складає від 100 мг до 1000 мг. У іншому варіанті здійснення дозована кількість Форми 1 складає від 200 мг до 900 мг. У іншому варіанті здійснення дозована кількість Форми 1 складає від 300 мг до 800 мг. У іншому варіанті здійснення дозована кількість Форми 1 складає від 400 мг до 700 мг. У іншому варіанті здійснення дозована кількість Форми 1 складає від 500 мг до 600 мг. Ін'єктовані композиції, наприклад стерильні водні або масляні суспензії, можуть бути складені згідно з відомою технологією, використовуючи придатні диспергувальні або змочувальні речовини і суспендувальні засоби. Стерильною ін'єктованою композицією може також бути стерильний ін'єктований розчин, суспензія або емульсія в нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад розчин в 1,3-бутандіолі. Прийнятними наповнювачами і розчинниками, які можуть використовуватися, є вода, розчин Рінгера і ізотонічний розчин хлориду натрію. Крім того, стерильні, нелеткі масла звичайно використовуються як розчинник або суспендувальне середовище. З цією метою будь-яке м'яке нелетке масло може використовуватися, включаючи синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, використовуються в композиціях для ін'єкції. Ін'єктовані склади можуть бути стерилізовані, наприклад, фільтрацією через фільтр, затримуючий бактерії, або включенням стерилізуючих засобів у формі стерильних твердих складів, які можуть бути розчинені або дисперговані в стерилізованій воді або іншому стерилізованому ін'єктованому середовищі перед використанням. Композиціями для ректального або вагінального призначення є переважно свічки, які можуть бути одержані змішуванням сполук за цим винаходом з придатними неподразнювальними інертними наповнювачами або носіями, такими як масло какао, поліетиленгліколь або віск для свічок, які є твердими при температурі навколишнього середовища, але рідкими при температурі тіла і, отже, плавляться в прямій кишці або вагінальній порожнині і виділяють активну сполуку. Тверді лікарські форми для перорального прийому включають капсули, таблетки, пілюлі, порошки і гранули. У таких твердих формах дозування активну сполуку змішують з щонайменше одним інертним, фармацевтично прийнятним наповнювачем або носієм, таким як цитрат натрію або дикальційфосфат і (або) a) наповнювачі, такі як крохмалі, лактоза, сахароза, глюкоза, маніт і кремнієвої кислота, b) зв'язуючі компоненти, такі як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідинон, сахароза і акація, с) зволожувачі, такі як гліцерин, d) дезінтегруючі засоби, такі як агар-агар, карбонат кальцію, картопляний крохмаль або крохмаль тапіоки, альгінова кислота, визначені силікати і карбонат натрію, е) інгібітори розчинення, такі як парафіни, f) прискорювачі поглинання, такі як четвертинні амонієві сполуки, g) змочувальні речовини, такі як, наприклад, цетиловий спирт і моностеарат гліцерину, h) абсорбенти, такі як глини каолін і бентоніт, і i) мастильні речовини, такі як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, натрійлаурилсульфат і їх суміші. У випадку капсул, таблеток і пілюль, лікарська форма може також включати буферні засоби. Тверді склади подібного типу можуть також використовуватися як наповнювачі в м'яких і твердих наповнених капсулах желатину, використовуючи таку інертну наповнювачі, як лактоза або молочний цукор, так само як високомолекулярні поліетиленгліколі і т. д. Тверді лікарські форми, такі як таблетки, драже, капсули, пілюлі і гранули, можуть бути одержані з покриттями і оболонками, такими як кишковорозчинні покриття і інші покриття, відомі в фармацевтичній технології композицій. Вони можуть необов'язково містити рентгеноконтрастні засоби і можуть також бути композицією, яка виділяє активний інгредієнт тільки, або переважно, в певній частині кишечнику, необов'язково, відстроченим чином. Приклади інкапсулюючих композицій, які можуть використовуватися, включають полімерні речовини і віск. Тверді композиції подібного типу можуть також використовуватися як наповнювачі в м'яких і твердих наповнених капсулах желатину, що використовують такі інертні наповнювачі як лактозу або молочний цукор, так само як високомолекулярні поліетиленгліколі і т. д. 9 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 55 60 Активні сполуки можуть також бути в мікрокапсульній формі з одним або більше інертними наповнювачами, як відмічено вище. Тверді лікарські форми, таблетки, драже, капсули, пілюлі і гранули, можуть бути приготовані з покриттями і оболонками, такими як кишковорозчинні покриття, покриття для регульованого виділення і інші покриття, відомі в фармацевтичній технології складів. У таких твердих формах дозування активний склад може бути змішаний з щонайменше одним інертним розріджувачем, таким як сахароза, лактоза або крохмаль. Такі лікарські форми можуть також включати, як і відбувається в нормальній практиці, додаткові речовини, відмінні від інертних розріджувачів, наприклад таблетувальні мастильні речовини і інші таблетувальні допоміжні речовини, такі як стеарат магнію і мікрокристалічна целюлоза. У випадку капсул, таблеток і пілюль, лікарські форми можуть також включати буферні засоби. Вони можуть необов'язково містити рентгеноконтрастні засоби і можуть також бути композиціями, які виділяють активний інгредієнт тільки, або вибірно, в певній частині кишечнику, необов'язково, відстроченим чином. Приклади включних композицій, які можуть використовуватися, включають полімерні речовини і віск. Є важливим, що Форма 1, описана тут, або її фармацевтично прийнятна композиція, може використовуватися в комбінованих методах лікування, тобто Форма 1 може застосовуватися одночасно, до або після однієї або більше інших бажаних терапій або медичних процедур. Конкретна комбінація методів лікування (терапія або процедури), щоб використовуватися в комбінованому режимі, бере до уваги сумісність бажаної терапії і (або) процедур і бажаного терапевтичного ефекту, який буде досягнутий. Також цінно, що використовувані методи лікування можуть досягати бажаного ефекту для того ж самого порушення (наприклад, сполука за винаходом може застосовуватися одночасно з іншим засобом, використовуваним, щоб лікувати те ж саме порушення) або вони можуть досягати різних ефектів (наприклад, контроль будь-яких несприятливих ефектів). Як використовуються тут, додаткові терапевтичні засоби, які звичайно застосовуються, щоб лікувати або запобігти конкретному захворюванню або стану, відомі як "адекватні захворюванню або стану, що підлягає лікуванню". У одному варіанті здійснення додатковий засіб вибирають з муколітичного засобу, бронхорозширювального засобу, антибіотика, протиінфекційного засобу, протизапального засобу, модулятора ТРМ, відмінного від сполуки за даним винаходом, або харчового засобу. У іншому варіанті здійснення додатковий засіб є сполукою, такою як гентаміцин, куркумін, циклофосфамід, 4-фенілбутират, миглустат, фелодипін, німодипін, Філоксин В, геніестеїн, Апігенін, модулятори цАМФ/цГМФ, такі як роліпрам, силденафіл, мілринон, тадалафіл, амринон, ізопротеренол, албутерол і алметерол, деоксиспергуалін, інгібітори HSP 90, інгібітори HSP 70, інгібітори протеосом, такі як епоксоміцин, лактацистин і т. д. У іншому варіанті здійснення додатковим засобом є сполука, розкрита в патентах WO 2004028480, WO 2004110352, WO 2005094374, WO 2005120497 або WO 2006101740. У іншому варіанті здійснення додатковим засобом є похідне бензо(с)хінолізинію, яке показує активність модуляції ТРМ, або похідне бензопірану, яке показує активність модуляції ТРМ. У іншому варіанті здійснення додатковим засобом є сполука, розкрита в патентах US 7202262, US 6992096, US 20060148864, US 20060148863, US 20060035943, US 20050164973, WO 2006110483, WO 2006044456, WO 2006044682, WO 2006044505, WO 2006044503, WO 2006044502 або WO 2004091502. У іншому варіанті здійснення додатковим засобом є сполука, розкрита в патентах WO 2004080972, WO 2004111014, WO 2005035514, WO 2005049018, WO 2006002421, WO 2006099256, WO 2006127588 або WO 2007044560. У іншому варіанті здійснення додатковий засіб вибирають із сполук, розкритих в американській заявці на патент серійний № 11/165818, опублікованій як американська заявка на патент № 2006/0074075, подана 24 червня 2005, і, тим самим, включена посиланням повністю. У іншому варіанті здійснення додатковим засобом є N-(5-гідрокси-2,4-ди-трет-бутилфеніл)-4оксо-1H-хінолін-3-карбоксамід. Ці комбінації корисні для лікування хвороб, описаних тут, включаючи муковісцидоз. Ці комбінації також корисні в комплекті, описаному тут. Кількість додаткового терапевтичного засобу, присутнього в композиціях за винаходом, буде не більшою, ніж кількість, яка звичайно застосовувалася б в композиції, що включає цей терапевтичний засіб, як єдиний активний засіб. Переважно, кількість додаткового терапевтичного засобу, присутнього в розкритих композиціях, змінюється від приблизно 50 до 100 % від кількості, звичайно присутньої в композиції, що включає цей засіб, як єдиний терапевтично активний засіб. Форма 1, описана тут, або її фармацевтично прийнятна композиція може також бути включена в композиції для покриття імплантованого медичного пристрою, такого як протез, штучні клапани, судинні графти, стенти і зонди. Відповідно, даний винахід, в іншому аспекті, 10 UA 102534 C2 5 10 15 20 25 30 35 40 45 50 включає композицію для покриття імплантованого пристрою, що включає Форму 1, описану тут, або її фармацевтично прийнятну композицію, і в класах і підкласах тут, і носій, придатний для покриття вказаного імплантованого пристрою. У іншому аспекті даний винахід включає імплантований пристрій, покритий складом, що включає Форму 1, описану тут, або її фармацевтично прийнятну композицію і носій, придатний для покриття вказаного імплантованого пристрою. Придатні покриття і загальне приготування покритих імплантованих пристроїв описані в Патентах США 6099562; 5886026; і 5304121. Покриття є звичайно біологічно сумісними полімерними матеріалами, такими як полімер гідрогелю, поліметилдисилоксан, полікапролактон, поліетиленгліколь, полімолочна кислота, співполімер етилен-вінілацетат і їх суміші. Покриття можуть необов'язково бути додатково покриті придатним поверхневим покриттям, таким як фторсилікон, полісахариди, поліетиленгліколь, фосфоліпіди або їх комбінації, щоб надати характеристики регульованого виділення композиціям. Щоб винахід, описаний тут, міг бути більш повно зрозумілий, представлені наступні приклади. Потрібно розуміти, що ці приклади представлені тільки в ілюстративних цілях і не повинні бути розглянуті як такі, що обмежують цей винахід будь-яким чином. ПРИКЛАДИ Методи і матеріали Диференціальна скануюча калориметрія (ДСК) Дані диференціальної скануючої калориметрії (ДСК) Форми 1 одержували, використовуючи прилад DSC Q100 V9.6 Build 290 (Instrument TA, New Castle, DE). Температуру калібрували за допомогою індію, і теплоємність калібрували за допомогою сапфіру. Зразки 3-6 мг зважували в алюмінієвих посудинах, які закривають гвинтовою кришкою з 1 голчатим отвором. Зразки сканували від 25 °C до 350 °C при швидкості нагрівання 1,0 °C/хв., і з дуттям газу азоту 50 мл/хв. Дані одержували за допомогою програмного забезпечення Thermal Advantage Q Series TM version 2.2.0.248 і аналізували за допомогою програмного забезпечення Universal Analysis version 4.1D (Instrument TA, New Castle, DE). Наведені цифри представляють єдине дослідження. ПДРП (Порошкова дифракція рентгенівських променів) Дані дифракції рентгенівських променів (ДРП) Форми 1 одержували на порошковому дифрактометрі Bruker D8 DISCOVER з 2-розмірним детектором HI-STAR і плоским графітовим монохроматором. Герметична мідна трубка з Kα-випромінюванням використовувалася при 40 кВ, 35 мА. Зразки поміщали на силіконові пластинки з нульовим фоном при 25 °C. Для кожного зразка два кадри даних збирали за 120 секунд, кожний під 2 різними кутами θ 2: 8° і 26°. Дані інтегрували програмним забезпеченням GADDS і об'єднували програмним забезпеченням plus DIFFRACT EVA. Невизначеність положень наведених піків, ± 0,2 градуса. Vitride® (натрій біс(2-метоксіетоксі)алюміній гідрид) [або NaAlH2(OCH2CH2OCH3)2], 65 ваг. % розчин в толуолі) придбавали в Aldrich Chemicals. 2,2-Дифтор-1,3-бензодіоксол-5-карбонова кислота була придбана в Saltigo (філіал Lanxess Corporation). У даному винаході, якщо назва сполуки, можливо, не точно описує структуру сполуки, структура має перевагу перед назвою і визначає будову сполуки. Синтез гідрохлориду 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти Хлорангідридний фрагмент кислоти Синтез 2,2-дифторбензо-1,3-бензодіоксол-5-іл)метанолу Комерційно доступну 2,2-дифторбензо-1,3-бензодіоксол-5-карбонову кислоту (1,0 екв.) суспендують в толуолі (10 об'ємів). Вітрид (2 екв.) додають через краплинну лійку з такою швидкістю, щоб підтримувати температуру 15-25 °C. Наприкінці додавання температуру підіймають до 40 °C протягом 2 годин, потім обережно додають 10 % (по вазі) водний розчин NaOH (4,0 екв.) через краплинну лійку, підтримуючи температуру 40-50 °C. Після перемішування протягом додаткових 30 хвилин шари розділяють при 40 °C. Органічну фазу охолоджують до 20 °C, потім промивають водою (2×1,5 об'єму), сушать (Na 2SО4), фільтрують і 11 UA 102534 C2 концентрують з одержанням сирого 2,2-дифтор-1,3-бензодіоксол-5-іл)метанолу, безпосередньо використовують на наступній стадії. Синтез 5-хлорметил-2,2-дифтор-1,3-бенздіоксолу 5 10 який 2,2-Дифтор-1,3-бензодіоксол-5-іл)метанол (1,0 екв.) розчиняли в МТБЕ (5 об'ємів). Додають каталітичну кількість ДМАП (1 мол. %) і додають SOCl2 (1,2 екв.) з краплинної лійки з такою швидкістю, щоб підтримувати температуру 15-25 °C. Температуру підвищують до 30 °C протягом 1 години, потім охолоджують до 20 °C і додають воду (4 об'єми) з краплинної лійки, підтримуючи температуру менше 30 °C. Після перемішування протягом додаткових 30 хвилин шари розділяють. Органічний шар перемішують і додають 10 % (маса до об'єму) водний розчин NaOH (4,4 об'єму). Після перемішування протягом 15-20 хвилин шари розділяють. Органічну фазу сушать (Na2SО4), фільтрують і концентрують з одержанням сирого 5-хлорметил-2,2дифтор-1,3-бензодіоксолу, який безпосередньо використовують на наступній стадії. Синтез (2,2-дифтор-1,3-бензодіоксол-5-іл)ацетонітрилу 15 20 25 30 Розчин 5-хлорметил-2,2-дифтор-1,3-бензодіоксолу (1 екв.) в ДМСО (1,25 об'єму) додають до суспензії NaCN (1,4 екв.) в ДМСО (3 об'єми), підтримуючи температуру між 30 і 40 °C. Суміш перемішують протягом 1 години, потім додають воду (6 об'ємів) і МТБЕ (4 об'єми). Після перемішування протягом 30 хвилин шари розділяють. Водний шар екстрагують МТБЕ (1,8 об'єму). Об'єднані органічні шари промивають водою (1,8 об'єму), сушать (Na 2SО4), фільтрують і концентрують з одержанням сирого (неочищеного) (2,2-дифтор-1,3-бензодіоксол-5іл)ацетонітрилу (95 %), який безпосередньо використовують на наступній стадії. Синтез (2,2-дифтор-1,3-бензодіоксол-5-іл)-циклопропанкарбонітрилу Суміш (2,2-дифтор-1,3-бензодіоксол-5-іл)ацетонітрилу (1,0 екв.), 50 ваг. % водного KOH (5,0 екв.), 1-бром-2-хлоретан (1,5 екв.) і Oct4NBr (0,02 екв.) нагрівають при 70 °C протягом 1 години. Реакційну суміш охолоджують, потім обробляють МТБЕ і водою. Органічну фазу промивають водою і насиченим розчином солі, потім розчинник видаляють з одержанням (2,2-дифтор-[1,3]бензодіоксол-5-іл)циклопропанкарбонітрилу. Синтез 1-(2,2-дифтор-1,3-бензодіоксол-5-іл)-циклопропанкарбонової кислоти (2,2-Дифтор-1,3-бензодіоксол-5-іл)циклопропанкарбонітрил гідролізують, використовуючи 6М NaOH (8 екв.) в етанолі (5 об'ємів) при 80 °C протягом ночі. Суміш охолоджують до кімнатної 12 UA 102534 C2 5 10 15 20 25 30 35 40 температури і етанол випаровують під вакуумом. Залишок обробляють водою і МТБЕ, додають 1М HCl і шари розділяють. Шар МТБЕ потім обробляють дициклогексиламіном (ДЦГА) (0,97 екв.). Суспензію охолоджують до 0 °C, фільтрують і промивають гептаном з одержанням відповідної солі з ДЦГА. Сіль обробляють МТБЕ і 10 % лимонною кислотою і перемішують доти, поки всі тверді частинки не розчиняться. Шари розділяють і шар МТБЕ промивають водою і насиченим розчином солі. Розчинник замінюють на гептан, подальша фільтрація дає 1-(2,2дифтор-1,3-бензодіоксол-5-іл)циклопропанкарбонову кислоту після сушіння у вакуумній сушильній шафі при 50 °C протягом ночі. Синтез 1-(2,2-дифтор-1,3-бензодіоксол-5-іл)-циклопропанкарбонілхлориду 1-(2,2-Дифтор-1,3-бензодіоксол-5-іл)циклопропанкарбонову кислоту (1,2 екв.) суспендують в толуолі (2,5 об'єму) і суміш нагрівають до 60 °C. SOCl2 (1,4 екв.) додають з краплинної лійки. Толуол і SOCl2 відганяють з реакційної суміші через 30 хвилин. Додатковий толуол (2,5 об'єму) додають і відганяють знов. Амінний фрагмент Синтез трет-бутил-3-(3-метилпіридин-2-іл)бензоату 2-Бром-3-метилпіридин (1,0 екв.) розчиняють в толуолі (12 об'ємів), додають K 2CО3 (4,8 екв.), потім воду (3,5 об'єму) і суміш нагрівають до 65 °C в потоці азоту протягом 1 години. Потім додають 3-(трет-бутоксикарбоніл)фенілборонову кислоту (1,05 екв.) і Pd(dppf)Cl 2·CH2Cl2 (0,015 екв.) і суміш нагрівають до 80 °C. Через 2 години нагрівання припиняють, додають воду (3,5 об'єму) і шари розділяють. Органічну фазу потім промивають водою (3,5 об'єму) і екстрагують 10 % водною метансульфокислотою (2 екв. MsOH, 7,7 об'єму). Водну фазу роблять основною, додаючи 50 % водний NaOH (2 екв.), і екстрагують EtOAc (8 об'ємів). Органічний шар концентрують з одержанням сирого (неочищеного) трет-бутил-3-(3-метилпіридин-2-іл)бензоату (82 %), який безпосередньо використовують на наступній стадії. Синтез 2-(3-(трет-бутоксикарбоніл)феніл)-3-метилпіридин-1-оксиду Трет-бутил-3-(3-метилпіридин-2-іл)бензоат (1,0 екв.) розчиняють в EtOAc (6 об'ємів). Додають воду (0,3 об'єму) потім сечовину-пероксид водню (3 екв.). Фталевий ангідрид (3 екв.) додають порціями як тверду речовину так, щоб підтримувати температуру в реакторі нижче 45 °C. Після завершення додавання фталевого ангідриду суміш нагрівають до 45 °C. Після перемішування протягом додаткових 4 годин нагрівання припиняють. Водний розчин Na 2SО3 (10 ваг. %, 1,5 екв.) додають з краплинної лійки. Після завершення додавання Na 2SО3 суміш перемішують протягом додаткових 30 хвилин і шари розділяють. Органічний шар перемішують і додають водний розчин Na2СО3 (10 ваг. %, 2 екв.). Після перемішування протягом 30 хвилин шари розділяють. Органічну фазу промивають 13 % (маса до об'єму) водним розчином NaCl. Органічну фазу потім фільтрують і концентрують з одержанням сирого 2-(3-(третбутоксикарбоніл)феніл)-3-метилпіридин-1-оксиду (95 %), який безпосередньо застосовують на наступній стадії. Синтез трет-бутил-3-(6-аміно-3-метилпіридин-2-іл)бензоату 13 UA 102534 C2 5 10 15 20 25 30 Розчин 2-(3-(трет-бутоксикарбоніл)феніл)-3-метилпіридин-1-оксиду (1 екв.) і піридину (4 екв.) в MeCN (8 об'ємів) нагрівають до 70 °C. Розчин ангідриду метансульфокислоти (1,5 екв.) в MeCN (2 об'єми) додають за 50 хвилин з краплинної лійки, підтримуючи температуру нижче 75 °C. Суміш перемішують протягом додаткового 0,5 години після завершення додавання. Суміші потім дозволяють охолодитися до навколишньої температури. Етаноламін (10 екв.) додають з краплинної лійки. Після перемішування протягом 2 годин додають воду (6 об'ємів), і суміш охолоджують до 10 °C. Після перемішування протягом не менше ніж 3 годин тверду речовину збирають фільтруванням і промивають водою (3 об'єми), 2:1 MeCN/вода (3 об'єми) і MeCN (2×1,5 об'єму). Речовину висушують до постійної ваги (різниця
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid forms of 3-(6-(1-(2,2-difluorobenzo[d][1,3]-dioxol-5-yl) cyclopropanecarboxamido)-3-methylpyridin-2-yl) benzoic acid
Автори англійськоюKeshavarz-Shokri, Ali, Zhang, Beili, Krawiec, Mariusz
Назва патенту російськоюТвердая форма 3-(6-(1-(2,2-дифторбензо[d][1,3]-диоксол-5-ил)-циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойной кислоты (варианты)
Автори російськоюКесхаварз-Схокри Али, Чжан Бейли, Кравец Мариуш
МПК / Мітки
МПК: A61K 31/443, A61P 11/00, C07D 405/12
Мітки: варіанти, форма, 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної, кислоти, тверда
Код посилання
<a href="https://ua.patents.su/29-102534-tverda-forma-3-6-1-22-diftorbenzod13-dioksol-5-il-ciklopropankarboksamido-3-metilpiridin-2-ilbenzojjno-kisloti-varianti.html" target="_blank" rel="follow" title="База патентів України">Тверда форма 3-(6-(1-(2,2-дифторбензо[d][1,3]-діоксол-5-іл)-циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти (варіанти)</a>
Попередній патент: Соєвий білковий продукт, що має змінені характеристики
Наступний патент: Електрод для ємнісної деіонізації
Випадковий патент: Штам бактерій azospirillum brasilense для інокуляції насіння тритикале ярого