Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-бензойної кислоти
Номер патенту: 99600
Опубліковано: 10.09.2012
Автори: Моон Йоунг-чоон, Хванг Пітер Сеонгвоо, Альмстед Ніл Г.
Формула / Реферат
1. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується щонайменше однією з наступних умов:
(а) параметри eлементарної комірки, виміряні при 150 К: а=24,220 Å; b=3,74640 Å; с=27,4678 Å; α=90°; β=92,9938°; γ=90°; V=2489,38(17) Å3; Z=8; розрахована густина (dcalc., г·см-3) складає 1,517 г·см-3; і просторова група складає P2l/n (№ 14);
(b) рентгенівська порошкова дифрактограма, яка містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, яка складається з:
4,69, 6,39, 10,10, 11,54, 12,62, 12,81, 13,92, 14,16, 14,55, 14,88, 15,07, 15,58, 16,27, 16,61, 18,74, 18,94, 19,28, 19,94, 20,27, 20,74, 20,97, 21,22, 21,93, 22,58, 22,80, 23,00, 23,79, 24,14, 24,46, 25,44, 25,64, 26,07, 26,34, 26,74, 27,06, 27,79, 28,42, 29,09 і 30,48;
(c) втрата маси на термограмі, отриманій методом термогравіметричного аналізу, складає менше ніж 1% загальної маси зразка після нагрівання від 33 ºС до 205 ºС;
(d) термограма диференціальної сканувальної калориметрії містить ендотерму з піком у області температури на рівні 244 °С; і
(е) функціональні координати атомів, дорівнюють представленим координатам:
Atom
х
у
z
U(Å2)
F(122)
0,43198(12)
0,7655(8)
-0,17546(10)
0,0487(10)
F(222)
-0,20343(15)
0,7129(10)
0,06378(14)
0,0781(14)
O(13)
0,42977(13)
0,4875(8)
-0,08927(11)
0,0324(10)
O(23)
-0,12941(13)
0,4507(9)
0,12653(12)
0,0402(10)
O(151)
0,25519(13)
0,4795(9)
0,10765(12)
0,0382(10)
O(152)
0,29215(13)
0,2155(9)
0,17515(12)
0,0403(10)
O(251)
0,16226(13)
0,4813(9)
0,15012(12)
0,0385(10)
O(252)
0,19645(13)
0,1939(9)
0,21659(12)
0,0393(10)
N(11)
0,35817(15)
0,5856(9)
-0,04386(14)
0,0279(10)
N(14)
0,44373(16)
0,3409(10)
-0,04263(14)
0,0327(12)
N(21)
-0,04134(16)
0,5165(9)
0,11065(14)
0,0305(12)
N(24)
-0,09772(17)
0,3201(11)
0,16787(15)
0,0388(14)
C(12)
0,37827(18)
0,6256(11)
-0,08637(17)
0,0266(14)
C(15)
0,40019(19)
0,4091(11)
-0,01823(17)
0,0261(14)
C(22)
-0,0926(2)
0,5601(12)
0,09502(18)
0,0319(15)
C(25)
-0,0471(2)
0,3690(11)
0,15580(17)
0,0302(15)
C(121)
0,35225(19)
0,7961(11)
-0,12930(17)
0,0291(14)
C(122)
0,3784(2)
0,8567(12)
-0.17244(18)
0,0345(15)
C(123)
0,3519(2)
1,0117(12)
-0,21257(19)
0,0407(17)
C(124)
0,2973(2)
1,1101(13)
-0,21014(19)
0,0416(17)
C(125)
0,2694(2)
1,0543(12)
-0,1677(2)
0,0409(17)
C(126)
0,2966(2)
0,8996(12)
-0,12784(18)
0,0349(15)
C(151)
0,39702(19)
0,3013(11)
0,03319(16)
0,0260(14)
C(152)
0,34897(19)
0,3623(11)
0,05704(16)
0,0261(15)
C(153)
0,34631(18)
0,2594(11)
0,10554(16)
0,0253(14)
C(154)
0,39150(19)
0,0970(11)
0,13029(17)
0,0279(14)
C(155)
0,43977(19)
0,0412(11)
0,10614(17)
0,0291(15)
C(156)
0,44250(19)
0,1421(11)
0,05765(17)
0,0292(15)
C(157)
0,2955(2)
0,3188(12)
0,13209(18)
0,0312(15)
C(221)
-0,1109(2)
0,7083(12)
0,04727(19)
0,0388(17)
C(222)
-0,1643(3)
0,7823(15)
0,0331(2)
0,053(2)
C(223)
-0,1825(3)
0,9272(15)
-0,0122(3)
0,064(2)
C(224)
-0,1415(4)
0,9930(16)
-0,0433(3)
0,068(3)
C(225)
-0,0870(3)
0,9202(15)
-0,0316(2)
0,066(2)
C(226)
-0,0678(3)
0,7766(12)
0,01365(17)
0,0543(19)
C(251)
0,00110(19)
0,2695(11)
0,18877(17)
0,0300(15)
C(252)
0,05426(19)
0,3352(11)
0,17481(17)
0,0289(15)
C(253)
0,09949(19)
0,2449(11)
0,20524(17)
0,0277(15)
C(254)
0,0919(2)
0,0940(11)
0,25087(17)
0,0296(15)
C(255)
0,0389(2)
0,0335(11)
0,26491(17)
0,0300(15)
C(256)
-0,0064(2)
0,1185(12)
0,23430(17)
0,0322(15)
C(257)
0,1559(2)
0,3165(12)
0,18902(17)
0,0305(15)
H(123)
0,371
1,050
-0,241
0,048
H(124)
0,278
1,217
-0,238
0,050
H(125)
0,232
1,123
-0,166
0,049
H(126)
0,278
0,862
-0,099
0,042
H(151)
0,227
0,491
0,125
0,057
H(152)
0,318
0,473
0,041
0,031
H(154)
0,389
0,025
0,163
0,033
H(155)
0,471
-0,066
0,123
0,035
Н(156)
0,475
0,103
0,041
0,035
Н(223)
-0,220
0,975
-0,020
0,077
Н(224)
-0,151
1,094
-0,074
0,082
Н(225)
-0,061
0,969
-0,055
0,080
H(226)
-0,030
0,729
0,021
0,065
Н(252)
0,226
0,213
0,202
0,059
Н(254)
0,123
0,034
0,272
0,035
Н(255)
0,033
-0,068
0,296
0,036
Н(256)
-0,043
0,074
0,244
0,039
Н(25А)
0,060
0,443
0,144
0,035.
2. Кристалічна форма за п. 1, яка має наступні параметри eлементарної комірки, виміряні при 150 К: а=24,220 Å; b=3,74640 Å; с=27,4678 Å; α=90°; β=92,9938°; γ=90°; V=2489,38(17) Å3; Z=8; розрахована густина (dcalc., г·см-3) складає 1,517 г·см-3; і просторова група складає P2l/n (№ 14).
3. Кристалічна форма за п. 1, рентгенівська порошкова дифрактограма якої містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, що складається з:
4,96, 6,39, 10,10, 11,54, 12,62, 12,81, 13,92, 14,16, 14,55, 14,88, 15,07, 15,58, 16,27, 16,61, 18,74, 18,94, 19,28, 19,94, 20,27, 20,74, 20,97, 21,22, 21,93, 22,58, 22,80, 23,00, 23,79, 24,14, 24,46, 25,44, 25,64, 26,07, 26,34, 26,74, 27,06, 27,79, 28,42, 29,09 і 30,48.
4. Кристалічна форма за п. 3, рентгенівська порошкова дифрактограма якої містить щонайменше один пік (°2θ±0,2) при вимірюванні з використанням Cu-Кα випромінювання, вибраний з групи, яка складається з піків в області 10,10, 11,54, 14,55, 14,88 і 15,07.
5. Кристалічна форма за п. 1, яка характеризується 13С ЯМР сигналами CP/MAS в твердому стані, що локалізуються в одному або більше з наступних положень: 172,6, 167,0, 131,3, 128,4 і 117,1 м.ч. при зовнішньому порівнянні з гліцином при 176,5 м.ч.
6. Кристалічна форма за будь-яким з пп. 1-5, яка має термограму диференціальної сканувальної калориметрії, що містить ендотерму з піком в області температури на рівні 244 °С.
7. Кристалічна форма за будь-яким з пп. 1-5, яка має термограму, отриману методом термогравіметричного аналізу, згідно з якою втрата маси складає менше ніж 1% загальної маси зразка після нагрівання від 33 °С до 205 °С.
8. Кристалічна форма за будь-яким з пп. 1-5, яка є негігроскопічною.
9. Кристалічна форма за будь-яким з пп. 1-5, яка є чистою.
10. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується щонайменше однією з наступних умов:
(а) рентгенівська порошкова дифрактограма містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибраних з групи, що складається з:
6,14, 6,39, 6,96, 7,92, 10,78, 12,44, 12,61, 12,88, 13,52, 13,78, 13,97, 14,30, 15,46, 15,68, 15,89, 16,33, 16,76, 17,03, 20,10, 21,03, 23,34, 23,86, 24,18, 24,42, 24,64, 26,62, 26,96, 27,29, 27,64, 27,96, 28,81, 31,05, 32,38, 32,58, 36,23, 37,81, 38,28, 38,44 і 39,16;
(b) втрата маси на термограмі диференціальної сканувальної калориметрії складає менше ніж 5% загальної маси зразка після нагрівання від 25 °С до 165 °С;
(с) термограма диференціальної сканувальної калориметрії містить ендотерму з піком у області температури на рівні 243 °С.
11. Кристалічна форма за п. 10, яка містить розчинник в кристалічній решітці.
12. Кристалічна форма за п. 10, яка містить воду в кристалічній решітці.
13.Кристалічна форма за п. 12, яка містить 1 молярний еквівалент води в кристалічній решітці на моль 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти.
14. Фармацевтична композиція, яка містить кристалічну форму 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, охарактеризовану в будь-якому з пп. 1-9, і один або декілька носіїв, ексципієнтів або разріджувачів.
15. Фармацевтична композиція за п. 14, призначена для орального введення, введення через слизові оболонки, парентерального, трансдермального або місцевого введення.
16. Фармацевтична композиція за п. 14 або 15, яка являє собою одиничну стандартну лікарську форму.
17. Застосування кристалічної форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, охарактеризованої в будь-якому з пп. 1-13, для модуляції супресії передчасного термінуючого кодону в клітині шляхом контактування клітини з кристалічною формою.
18. Застосування кристалічної форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, охарактеризованої в будь-якому з пп. 1-13, для приготування лікарського засобу для лікування або попередження захворювання або розладу, пов’язаного з передчасним термінуючим кодоном, у пацієнта, який цього потребує.
19. Застосування за п. 18, де захворювання або розлади, пов'язані з передчасним термінуючим кодоном, являють собою множинну ендокринну неоплазію (типу 1, 2 і 3), амілоїдоз, мукополісахаридоз (типу I і III), уроджену гіпоплазію надниркових залоз, аденоматозний поліпоз товстої кишки, хворобу фон Гіппеля-Ландау, синдром Менкеса, гемофілію А, гемофілію В, колаген VII, синдром Аладжилла, синдром Таунса-Брокса, рабдоїдну пухлину, пухирчастий епідермоліз, синдром Харлера, синдром Коффіна-Лоурі, аніридію, хворобу Шарко-Маріа-Туса, міотубулярну міопатію, Х-зчеплену міотубулярну міопатію, Х-зчеплену хондроплазію, Х-зчеплену а-гамма-глобулінемію, полікістозне ниркове захворювання, спінальну м’язову атрофію, сімейний аденоматозний поліпоз, недостатність піруватдегідрогенази, фенілкетонурію, нейрофіброматоз 1, нейрофіброматоз 2, хворобу Альцгеймера, хворобу Тея-Сакса, синдром Ретта, синдром Германського-Пудлака, синдром ектодермальної дисплазії/крихкості шкіри, дисхондростеоз Лері-Вейла, рахіт, гіпофосфатемію, адренолейкодистрофію, атрофію звивин кори головного мозку, атеросклероз, нейросенсорну глухоту, дистонію, хворобу Дента, гостру переміжну порфірію, хворобу Коудена, бульозний епідермоліз Херліца, хворобу Уїлсона, синдром Тричера-Колінза, недостатність піруваткінази, гігантизм, карликовість, гіпотиреоз, гіпертиреоз, старіння, ожиріння, хворобу Паркінсона, хворобу С Неймана-Піка, кістозний фіброз, дистрофію жовтої плями, серцеве захворювання, нирковокам’яне захворювання, атаксію-телангіектазію, сімейну гіперхолестеринемію, пігментоз сітківки, хворобу лізосомального накопичення, туберозний склероз, м’язову дистрофію Дюшена і синдром Марфана.
20. Застосування за п. 18, де захворювання або розлади, пов'язані з передчасним термінуючим кодоном, являють собою хворобу лізосомального накопичення, серцево-судинне захворювання, легеневе захворювання, захворювання серця, аутоімунне захворювання, захворювання крові, колагенове захворювання, захворювання нирок, пігментоз сітківки, амілоїдоз, старіння, ожиріння, гігантизм, карликовість, гіпотиреоз, гіпертиреоз, діабет, запальне захворювання, захворювання центральної нервової системи, м'язову дистрофію і рак.
21. Застосування за п. 20, де рак являє собою рак голови і шиї, очей, шкіри, ротової порожнини, горла, стравоходу, грудної клітки, кісток, легенів, ободової кишки, сигмоподібної кишки, прямої кишки, шлунка, передміхурової залози, молочних залоз, яєчників, нирок, печінки, підшлункової залози, мозку, кишечнику, серця або надниркових залоз, і де рак являє собою солідну пухлину, вибрану з саркоми, карциноми, фібросаркоми, міксосаркоми, ліпосаркоми, хондросаркоми, остеогенної саркоми, хордоми, ангіосаркоми, ендотеліосаркоми, лімфангіосаркоми, лімфангіоендотеліосаркоми, синовіоми, мезотеліоми, пухлини Евінга, лейоміосаркоми, рабдоміосаркоми, плоскоклітинної карциноми, базальноклітинної карциноми, аденокарциноми, карциноми потових залоз, карциноми сальних залоз, папілярної карциноми, папілярної аденокарциноми, цистаденокарциноми, медулярної карциноми, бронхогенної карциноми, нирковоклітинної карциноми, гепатоми, карциноми жовчних проток, хоріокарциноми, семіноми, ембріональної карциноми, пухлини Вільмса, раку шийки матки, пухлини сім’яників, карциноми легенів, дрібноклітинної карциноми легенів, карциноми сечового міхура, епітеліальної карциноми, гліоми, астроцитоми, медулобластоми, краніофарингіоми, епендимоми, саркоми Капоші, пінеаломи, гемангіобластоми, нейроми слухового нерва, олігодендрогліоми, менінгіоми, меланоми, нейробластоми, ретинобластоми, пухлини клітин крові, гострого лімфобластичного лейкозу, гострого лімфобластичного В-клітинного лейкозу, гострого лімфобластичного Т-клітинного лейкозу, гострого мієлобластичного лейкозу, гострого промієлоцитарного лейкозу, гострого монобластичного лейкозу, гострого еритролейкемічного лейкозу, гострого мегакаріобластичного лейкозу, гострого мієломоноцитарного лейкозу, гострого нелімфоцитарного лейкозу, гострого недиференційованого лейкозу, хронічного мієлоцитарного лейкозу, хронічного лімфоцитарного лейкозу, волосатоклітинного лейкозу або множинної мієломи.
22. Застосування за п. 20, де рак пов’язаний з передчасним термінуючим кодоном в гені-супресорі пухлини.
23. Застосування за п. 22, де ген-супресор пухлини включає APC, ATM, BRAC1, BRAC2, MSH1, pTEN, Rb або p53.
24. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується рентгенівською порошковою дифрактограмою, що містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, яка складається з: 6,42, 7,00, 7,89, 10,85, 12,61, 12,92, 13,47, 13,97, 15,81, 16,45, 17,12, 20,05, 21,05, 23,92, 24,28, 27,00, 27,39, 27,84, 28,04, 28,94, 31,10, 32,58, 36,11, 37,71, 38,15 і 38,61.
25. Кристалічна форма за п. 24, яка містить розчинник в кристалічній решітці, де вказаний розчинник являє собою 1-бутилацетат.
26. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується рентгенівською порошковою дифрактограмою, яка містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, яка складається з: 6,10, 6,38, 6,54, 7,10, 8,02, 10,91, 12,71, 13,50, 13,62, 13,86, 14,10, 15,56, 15,70, 15,91, 16,55, 16,96, 17,22, 17,50, 19,82, 20,08, 20,34, 21,15, 23,78, 23,93, 24,38, 24,56, 26,88, 27,16, 27,48, 27,88, 28,04, 28,78, 29,02, 32,71, 36,01, 38,10, 38,56 і 39,38.
27. Кристалічна форма за п. 26, яка містить розчинник в кристалічній решітці, де вказаний розчинник являє собою суміш 1:1 тетрагідрофурану і гептану.
28. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується рентгенівською порошковою дифрактограмою, що містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, яка складається з: 1,79, 2,30, 2,57, 2,78, 3,29, 3,59, 3,89, 4,07, 4,34, 4,49, 4,76, 5,06, 6,47, 6,91, 7,96, 10,89, 12,87, 13,58, 13,99, 15,97, 16,48, 17,10, 20,00, 20,36, 21,04, 23,40, 24,29, 24,89, 26,87, 27,49, 27,80, 28,07, 29,08 і 38,61.
29. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується рентгенівською порошковою дифрактограмою, що містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, яка складається з: 6,22, 6,51, 7,13, 8,17, 10,91, 12,87, 13,80, 14,12, 14,28, 15,78, 16,23, 16,54, 17,15, 20,33, 21,22, 21,36, 23,94, 24,30, 27,30, 27,58, 28,00, 28,74, 28,96, 32,70, 36,74, 38,18, 38,38, 38,52 і 39,31.
30. Кристалічна форма за п. 29, яка містить розчинник в кристалічній решітці, де вказаний розчинник являє собою диметоксіефір.
31. Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка характеризується рентгенівською порошковою дифрактограмою, що містить щонайменше три піки (°2θ±0,2), отримані при вимірюванні з використанням Cu-Кα випромінювання, вибрані з групи, яка складається з: 6,04, 6,49, 7,91, 10,92, 12,61, 12,92, 13,10, 13,42, 13,82, 13,99, 15,40, 15,76, 16,51, 17,15, 19,92, 20,04, 21,01, 23,92, 24,28, 24,48, 26,77, 27,14, 27,40, 27,74, 28,09, 28,82, 28,99, 31,03, 32,58, 35,64, 35,85, 37,48, 37,66 і 38,62.
32. Кристалічна форма за будь-яким з пп. 10, 24, 26, 28, 29 або 31, яка містить в кристалічній решітці менше ніж 6 молярних еквівалентів розчинника на моль 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти.
33. Кристалічна форма за будь-яким з пп. 10, 24, 26, 28, 29 або 31, де сполука частково перетворюється в кристалічну форму, яка негігроскопічна.
34. Кристалічна форма за будь-яким з пп. 10, 24, 26, 28, 29 або 31, де сполука перетворюється в кристалічну форму, яка негігроскопічна.
35. Кристалічна форма за будь-яким з пп. 10, 24, 26, 28, 29 або 31, де сполука частково перетворюється в кристалічну форму за будь-яким з пп. 1-9.
36. Кристалічна форма за будь-яким з пп. 10, 24, 26, 28, 29 або 31, де сполука перетворюється в кристалічну форму за будь-яким з пп. 1-9.
37. Спосіб одержання кристалічної форми за будь-яким з пп. 1-9, в якому здійснюють: (1) подрібнення кристалічної форми за будь-яким з пп. 10, 24, 26, 28, 29 або 31 при температурі навколишнього середовища або температурі, нижчій температури навколишнього середовища, (2) суспендування кристалічної форми за будь-яким з пп. 10, 24, 26, 28, 29 або 31 в розчиннику або системі розчинників, (3) нагрівання кристалічної форми за будь-яким з пп. 10, 24, 26, 28, 29 або 31, (4) кристалізацію кристалічної форми за будь-яким з пп. 1-9 з розчинника або системи розчинників, (5) випарювання розчинника або системи розчинників, що містять 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту, при температурі в діапазоні від 50 ºC до 60 ºC, або (6) випарювання розчинника або системи розчинників, що містять 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту, при температурі в діапазоні від 50 ºC до 81 ºC.
38. Спосіб за п. 37, де кристалічну форму за будь-яким з пп. 10, 24, 26, 28, 29 або 31 суспендують в розчиннику або системі розчинників, вибраних з групи, що складається з ізобутилкетону або суміші 1:1 діоксану і води.
39. Спосіб за п. 37, де кристалічну форму за будь-яким з пп. 10, 24, 26, 28, 29 або 31 сублімують після нагрівання при температурі в діапазоні від 160 °C до 208 °C в вакуумі, або після нагрівання при температурі 220 °C, або після нагрівання при температурі 255 °C.
40. Спосіб за п. 37, де кристалічну форму за будь-яким з пп. 1-9 кристалізують з розчинника або системи розчинників, вибраних з групи, що складається з: метанолу, трет-бутилового спирту, 1-бутилового спирту, ацетонітрилу, ізопропілового спирту, простого ізопропілового ефіру, диметилформаміду, гептану, ізопропілацетату, толуолу, води або їх сумішей.
41. Спосіб за п. 37, де розчинник або систему розчинників, які випарюють при температурі в діапазоні від 50 ºC до 60 ºC, вибирають з групи, яка складається з: ацетонітрилу, трет-бутилового спирту, ізопропілового спирту, простого ізопропілового ефіру, води або їх сумішей.
42. Спосіб за п. 37, де розчинник або систему розчинників, які випарюють при температурі в діапазоні від 50 ºC до 81 ºC, вибирають з групи, що складається з: метанолу, 1-бутилового спирту, трет-бутилового спирту, диметилформаміду, диметоксіефіру, простого ізопропілового ефіру, води або їх сумішей, необов’язково у поєднанні з хлоридом натрію.
43. Спосіб за п. 42, де систему розчинників, які випарюють при температурі в діапазоні від 50 ºC до 81 ºC, вибирають з групи, яка складається з: диметилформамід:вода і системи, яка містить трет-бутиловый спирт:вода (3:2) і метанол:хлорид натрію (1:1).
44. Спосіб одержання кристалічної форми за п. 10, в якому здійснюють: (1) кристалізацію 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти з розчинника, вибраного з групи, яка складається з тетрагідрофурану, гексану, ізопропілового спирту, етилацетату, оцтової кислоти, 1-бутилацетату, ацетону, простого диметилового ефіру, простого діетилового ефіру, діоксану, метилізобутилкетону, метилетилкетону, нітрометану, води і їх сумішей, (2) випарювання розчинника, який містить 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту і вибраний з групи, яка складається з ацетону, простого диметилового ефіру і метилетилкетону, при температурі в діапазоні від 50 ºC до 60 ºC, (3) випарювання розчинника або системи розчинників, що містить 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту і вибраний з групи, яка складається з ацетону, оцтової кислоти, 1-бутилацетату, простого диметилового ефіру, тетрагідрофурану і простого діетилового ефіру; діоксану; метилетилкетону; нітрометану; метилізобутилкетону; тетрагідрофурану:гексану (2,5:1) і діоксану:води (3:2), при підвищеній температурі, (4) суспендування кристалічної форми за будь-яким з пп. 1-9 в розчиннику, вибраному з групи, яка складається з оцтової кислоти, 1-бутилацетату і нитромерану, або (5) нагрівання кристалічної форми за будь-яким з пп. 1-9 в 1-пропанолі при 60 °C протягом одного дня у вібраторі.
45. Спосіб одержання кристалічної форми за п. 24, в якому здійснюють суспендування 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти у вібраторі в 1-бутилацетаті при кімнатній температурі протягом трьох днів.
46. Спосіб одержання кристалічної форми за п. 26, в якому здійснюють суспендування кристалічної форми за будь-яким з пп. 1-9 в суміші тетрагідрофуран:гептан (1:1) при температурі навколишнього середовища протягом одного дня, внесення як затравки, перший раз, суміші кристалічної форми за будь-яким з пп. 1-9 і кристалічної форми за п. 10 і суспендування протягом ще одного дня, внесення як затравки, другий раз, кристалічної форми за будь-яким з пп. 1-9 і суспендування протягом семи днів, і внесення як затравки, третій раз, кристалічної форми за будь-яким з пп. 1-9 і суспендування протягом одного дня при температурі 50 °C.
47. Спосіб одержання кристалічної форми за п. 28, в якому здійснюють витримування кристалічної форми за п. 10 в умовах відносної вологості 75 % при температурі 40 °C протягом шести днів.
48. Спосіб одержання кристалічної форми за п. 29, в якому здійснюють випарювання розчинника диметоксіефіру або системи розчинників, що містять 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту.
49. Кристалічна форма за будь-яким з пп. 1-9 або кристалічна форма, одержана способом за п. 37, де отримана кристалічна форма є фізично стійкою: (1) при зберіганні протягом 6 днів при впливі однієї або більше з наступних умов відносної вологості: відносна вологість 53 % при 40 °С; відносна вологість 75 % при 40 °С; відносна вологість 50 % при 60 °С або відносна вологість 79 % при 60 °С, (2) при помелі при температурі навколишнього середовища або температурі, нижчій температури навколишнього середовища, (3) при суспендуванні при одній або більше наступних умов: в 1-бутанолі (1-BuOH) протягом 4 днів при температурі навколишнього середовища, в хлороформі протягом 2 днів при температурі 50 °С або в дихлорметані протягом 2 днів при температурі 50 °С.
50. Кристалічна форма за п. 10 або кристалічна форма, отримана способом за п. 44, де отримана кристалічна форма є фізично стійкою: (1) при зберіганні протягом 6 днів при впливі однієї або більше з наступних умов відносної вологості: відносна вологість 53 % при 40 °С; відносна вологість 75 % при 40 °С або відносна вологість 50 % при 60 °С; (2) при стисненні окремо; (3) при стисненні в присутності суміші 1:1 трет-бутилового спирту (трет-BuOH) і води, або (4) при суспендуванні протягом 1 дня при температурі навколишнього середовища в суміші 1:1 тетрагідрофурану (THF) і гептану.
Текст
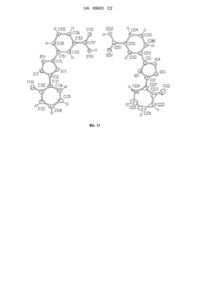
Реферат: Даний винахід стосується кристалічних форм 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти (формула І), фармацевтичних композиції і лікарських форм, що містять кристалічні форми, способів одержання кристалічних форм і способів їх застосування для лікування, попередження або менеджменту захворювань, які полегшуються модуляцією передчасного припинення трансляції або нонсенс-опосередкованим розпадом мРНК. F N O N CO2 H (I) UA 99600 C2 (12) UA 99600 C2 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 За даною заявкою вимагається пріоритет на основі тимчасової заявки на патент США № 60/847326, поданої 25 вересня 2006 р., яка повністю включена до даного опису за допомогою посилання. 1. Галузь техніки Даний винахід стосується кристалічних форм 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти, фармацевтичних лікарських форм і композицій, що містять кристалічні форми, способів одержання кристалічних форм і способів їх застосовування для лікування, попередження і менеджменту захворювань, що полегшуються модуляцією передчасного припинення трансляції або нонсенс-опосередкованим розпадом мРНК. 2. Попередній рівень техніки 1,2,4-оксадіазольні сполуки, застосовувані для лікування, попередження або менеджменту захворювань, які полегшуються модуляцією передчасного припинення трансляції або нонсенсопосередкованим розпадом мРНК, описані в патенті США № 6992096 В2, виданому 31 січня 2006 р., який повністю включений до даного опису за допомогою посилання. Одна така сполука являє собою 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту. У фармацевтичній галузі відомо, що тверді форми, такі як солі, кристалічні форми, наприклад, поліморфні форми сполуки, впливають, наприклад, на розчинність, стійкість, текучість, ламкість і стисливість сполуки, а також безпеку і ефективність лікарських продуктів на основі сполуки (див., наприклад, Knapman, K. Modern Drug Discoveries, 2000: 53). Потенційні впливи твердих форм в одному лікарському продукті на безпеку і ефективність відповідного лікарського продукту настільки значні, що Адміністрація харчових продуктів і лікарських засобів США вимагає ідентифікації і контролю за твердими формами, наприклад, кристалічними формами кожної сполуки, використовуваної в кожному лікарському продукті, що надходить в продаж в США. Відповідно, нові кристалічні форми 1,2,4-оксадіазолбензойних кислот можуть сприяти розробці складу для лікування, попередження або менеджменту захворювань, які полегшуються модуляцією передчасного припинення трансляції або нонсенс-опосередкованим розпадом мРНК. Даний винахід стосується нових кристалічних форм, наприклад, кристалічних форм 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. Посилання, приведені в розділі 2 даної заявки, не треба розглядати як припущення того, що таке посилання передбачає дану заявку. 3. Короткий опис суті винаходу Винахід стосується нових кристалічних форм, наприклад, кристалічних форм 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, які мають наступну хімічну структуру (I): Зокрема кристалічні форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти застосовуються для лікування, попередження або менеджменту захворювань, які полегшуються модуляцією передчасного припинення трансляції або нонсенс-опосередкованим розпадом мРНК, як описано в патенті США № 6992096 В2, виданому 31 січня 2006 р., який повністю включений до даного опису за допомогою посилання. Крім того, даний винахід стосується кристалічної форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яка є по суті чистою, тобто ступінь її чистоти становить більш ніж приблизно 90 %. Деякі варіанти здійснення винаходу належать до фармацевтичних лікарських форм і композицій, що містять кристалічну форму 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти і фармацевтично прийнятний розріджувач, ексципієнт або носій. Винахід, крім того, стосується способів їх застосування для лікування, попередження або менеджменту захворювань, які полегшуються модуляцією передчасного припинення трансляції або нонсенсопосередкованим розпадом мРНК. У деяких варіантах здійснення винахід стосується способів одержання, виділення і/або характеристик кристалічних форм за винаходом. Кристалічні форми за винаходом можна застосовувати як активні фармацевтичні інгредієнти для одержання складів для застосування у тварин або людей. Таким чином, даний винахід охоплює застосування цих кристалічних форм як кінцевого лікарського продукту. Кристалічні форми і кінцеві лікарські продукти за винаходом можна застосовувати, наприклад, для лікування, попередження або менеджменту захворювань, описаних в даній заявці. 1 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 Детальний опис винаходу 4.1. Короткий опис креслень На фіг. 1 показана рентгенівська порошкова дифрактограма (XRPD) зразка форми А 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. На фіг. 2 показані термограми, одержані методом диференціальної сканувальної калориметрії (DSC) і термогравіметричного аналізу (TGA) зразка форми А 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]бензойної кислоти. На фіг. 3 показана ізотерма динамічної сорбції пари (DVS) зразка форми А 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. 13 На фіг. 4 показаний С ЯМР спектр зразка форми А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти. На фіг. 5 показана XRPD зразка форми В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. На фіг. 6 показані термограми DSC і TGA зразка форми В 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]бензойної кислоти. На фіг. 7 показана ізотерма DVS зразка форми В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти. На фіг. 8 представлене перекривання експериментальних XRPD, що показує характерний набір піків форми А (верхня частина) відносно декількох зразків форми В (друга зверху вниз) 3[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, яке ілюструє зсув піка серед деяких зразків форми В. На фіг. 9 показана упаковка кристалічної структури форми А 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]бензойної кислоти в проекції по кристалографічній осі b і контур елементарної комірки. На фіг. 10 показана XRPD форми А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, імітована по кристалічній структурі, одержана методом дифракції рентгенівських променів на монокристалі. На фіг. 11 показаний графік ORTEP асиметричної елементарної комірки форми А 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаний методом дифракції рентгенівських променів на монокристалі. Атоми представлені 50 % імовірністю анізотропних термічних еліпсоїдів. 4.2. Термінологія Кристалічні форми, еквівалентні кристалічним формам, описаним нижче і заявленим в даній заявці, можуть демонструвати аналогічні, але не ідентичні аналітичні характеристики в межах допустимого діапазону помилки, в залежності від умов тесту, чистоти, обладнання і інших звичайних змінних величин, відомих фахівцям в даній галузі або приведених в літературі. Термін "кристалічний" і пов'язані з ним терміни, використовувані в даному описі, при використанні для опису речовини, компонента продукту, означає, що речовина, компонент продукту є по суті кристалічним, за даними визначення дифракції рентгенівських променів, мікроскопією, поляризованою мікроскопією або іншою відомою аналітичною процедурою, th відомою фахівцям в даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, 18 ed., rd Mack Publishing, Easton PA, 173 (1990); The United States Pharmacopeia, 23 ed., 1843-1844 (1995). Відповідно, для фахівців в даній галузі буде очевидно, що в даний винахід можуть бути внесені різні модифікації і зміни без відступу від обсягу і суті винаходу. Інші варіанти здійснення винаходу будуть очевидні для фахівців в даній галузі з розгляду опису і описаних в ньому варіантів здійснення винаходу. Заявники передбачають, що опис і приклади повинні розглядатися як ілюстративні, а не такі, що обмежують обсяг винаходу. Кристалічні форми за даним винаходом можна характеризувати, використовуючи методи дифракції рентгенівських променів на монокристалах, порошкової дифракції рентгенівських променів (PXRD), диференціальної сканувальної калориметрії (DSC) і термогравіметричного аналізу (TGA). Потрібно розуміти, що описані і заявлені в даному описі числові величини є приблизними. Варіації в межах величин, нарівні з іншими чинниками, можуть бути віднесені на рахунок калібрування обладнання, помилок обладнання, чистоти матеріалів, розміру кристалів і розміру зразка. Крім того, можливі варіації при одержанні такого ж результату. Наприклад, величини дифракції рентгенівських променів, які загалом є точними і знаходяться в межах ±0,2° і величин інтенсивності (включаючи величини відносної інтенсивності), тип дифракції рентгенівських променів може коливатися в залежності від використовуваних умов вимірювання. Аналогічним чином, результати DSC є звичайно точними і знаходяться в межах приблизно 2 °C. Отже, потрібно розуміти, що кристалічні форми за даним винаходом не 2 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмежуються кристалічними формами, які забезпечують характеристичні спектри (тобто один або більше з PXRD, DSC і TGA), повністю ідентичні характеристичним спектрам, зображеним на супроводжувальних кресленнях, зображених в даному описі. Будь-які кристалічні форми, які забезпечують характеристичні спектри, по суті такі ж, як ті, що описані в супроводжувальних кресленнях, входять в обсяг даного винаходу. Середній фахівець в даній галузі здатний встановити по суті однакові характеристичні спектри. Представлені в даному описі варіанти здійснення можна повніше зрозуміти за допомогою посилання на наступний детальний опис і ілюстративні приклади, які призначені для ілюстрації необмежувальних варіантів здійснення. Способи одержання 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти описані в патенті США № 6992096 В2, виданому 31 січня 2006 р., і в заявці на патент США № 11/899813, поданій 9 вересня 2007 р., які повністю включені до даного опису за допомогою посилання. 4.3. Форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти В одному варіанті здійснення даний винахід стосується форми А кристалічної форми 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. У деяких варіантах здійснення форму А можна одержати кристалізацією з різних розчинників, включаючи, без обмеження, метанол, трет-бутиловий спирт (t-BuOH), 1-бутиловий спирт (1-BuOH), ацетонітрил, ізопропіловий спирт (IPA), простий ізопропіловий ефір, диметилформамід, гептан, ізопропілацетат (IPOAc), толуол і/або воду. Репрезентативний тип XRPD форми А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти показаний на фіг. 1. У деяких варіантах здійснення форма А 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти має тип XRPD, який по суті аналогічний типу, зображеному на фіг. 1. Репрезентативні термічні характеристики форми А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти показані на фіг. 2. Репрезентативна DSC термограма, подана на фіг. 2, виявляє ендотермічне явище з піком температури на рівні приблизно 244 °C. Репрезентативна TGA термограма, також подана на фіг. 2, виявляє втрату маси менше ніж приблизно 1 % загальної маси зразка після нагрівання від приблизно 33 °C до приблизно 205 °C. Ці термічні дані вказують на те, що форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти не містить істотних кількостей або води, або розчинника в кристалічній решітці. У деяких варіантах здійснення форма А виявляє явище втрати маси, що починається приблизно при 212 °C, яке відповідає сублімації перед плавленням. Кристалічна структура одиночного кристала форми А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти була одержана методом дифракції рентгенівських променів на монокристалі. При використанні даних, зібраних приблизно при 150 К, були одержані наступні параметри елементарної комірки: а=24,2240(10) Å; b=3,74640(10) Å; с=27,4678(13) Å; α=90°; 3 β=92,9938(15)°; γ=90°; V=2489,38(17) Å . На фіг. 9 показане креслення упаковки кристала по структурі XPD одиночного кристала форми А в проекції по кристалографічній осі b. Імітований спектр XPRD був генерований для опромінення Cu з використанням (PowderCell for Windows Version 2.3 Kraus, W.; Nolze, G. Federal Institute for Materials Research and Testing, Berlin Germany, EU, 1999) і атомних координат, просторової групи і параметрів елементарної комірки за даними одиночного кристала. Імітований спектр XPRD форми А 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]бензойної кислоти поданий на фіг. 10. У деяких варіантах здійснення форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти характеризується фізичною стійкістю при впливі певних умов обробки. У деяких варіантах здійснення форма А є фізично стійкою при зберіганні протягом 6 днів при впливі одного або більше з наступних умов відносної вологості (RH): RH 53 % при 40 °C; RH 75 % при 40 °C; RH 50 % при 60 °C; і RH 79 % при 60 °C. В інших варіантах здійснення форма А є фізично стійкою при помелі при навколишній температурі або температурі, нижче навколишньої. В інших варіантах здійснення форма А є фізично стійкою за однією або більше з наступних умов: в 1BuOH протягом 4 днів при навколишній температурі; в хлороформі протягом 2 днів при 50 °C; і в дихлорметані протягом 2 днів при 50 °C. Форму А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти оцінювали на гігроскопічність. Аналіз динамічної сорбції пари (DVS) захоплення вологи і вивільнення вологи як функцію відносної вологості (RH) одержували після циклічної зміни RH від 5 % до 95 %. Максимальне захоплення приблизно 0,06 % загальної маси зразка, як продемонстровано в репрезентативній ізотермі DVS форми А на фіг. 3. Відповідно, у деяких варіантах здійснення форма А є не гігроскопічною. 13 На фіг. 4 показаний репрезентативний С ЯМР спектр в твердому стані 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]бензойної кислоти. У деяких варіантах здійснення форма А 3-[5-(213 фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти характеризується С ЯМР сигналами 3 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 CP/MAS в твердому стані, локалізованих в одному або більше з наступних приблизних положень: 172,6, 167,0, 131,3, 128,4 і 117,1 м. ч. при зовнішньому в порівнянні з гліцином при 176,5 м. ч. У деяких варіантах здійснення форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти виявляє бажані характеристики для переробки і/або одержання лікарського продукту, що містить форму А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. Наприклад, у деяких варіантах здійснення форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти має відносно високу точку плавлення, яка являє собою важливу характеристику, нарівні з іншими аспектами, для обробки і виготовлення. Крім того, було виявлено, що у деяких варіантах здійснення форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти є по суті не гігроскопічною. Негігроскопічна тверда форма бажана за різними причинами, включаючи, наприклад, проблеми переробки і зберігання. Крім того, було виявлено, що у деяких варіантах здійснення форма А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти є фізично і хімічно стійкою після мікронізації, способу зменшення розміру частинок. Фізична стійкість є важливою властивістю фармацевтичних матеріалів під час одержання, переробки і зберігання. 4.4. Форма В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти В одному варіанті здійснення даний винахід стосується форми В кристалічної форми 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. У деяких варіантах здійснення форму В можна одержати кристалізацією з різних розчинників, включаючи, без обмеження, тетрагідрофуран (THF), гексан, ізопропіловий спирт (IPA), етилацетат (EtOAc), оцтову кислоту, 1-бутилацетат, ацетон, простий диметиловий ефір, простий діетиловий ефір, діоксан, воду, метилізобутилкетон (MIBK), метилетилкетон (MEK), нітрометан і/або воду. У деяких варіантах здійснення форма В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти включає розчинник в кристалічній решітці в кількості, яка залежить від однієї або декількох умов, таких як, без обмеження, кристалізація, обробка, переробка, виготовляння, одержання або зберігання. У деяких варіантах здійснення винаходу форма В включає розчинник в кристалічній решітці. У деяких варіантах здійснення форма В по суті не містить розчинник в кристалічній решітці. У деяких варіантах здійснення максимальні комбіновані молярні еквіваленти розчинника на моль 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти в зразку форми В складають менше ніж 6, менше ніж 5, менше ніж 4, менше ніж 3, менше ніж 2, менше ніж 1,5, менше ніж 1, менше ніж 0,75, менше ніж 0,5 або менше ніж 0,25 молярних еквівалентів. Без наміру бути обмеженими теорією, вважають, що характерна варіабельність вмісту розчинника форми В виникає з існування каналу решітки, який може приймати різні типи і/або кількості розчинника і який забезпечує можливість додання і/або видалення розчинників в залежності від конкретних умов. У деяких варіантах здійснення структура форми В представляє основу для ізоструктурного сімейства кристалічних форм. У деяких варіантах здійснення форма В являє собою позбавлену сольвату сольватну кристалічну форму. Репрезентативний спектр XRPD форми В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти показаний на фіг. 5. У деяких варіантах здійснення форма В 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти характеризується піками XRPD, що локалізуються в одному або більше з наступних положень: приблизно 6,4, приблизно 8,0, приблизно 14,1, приблизно 15,9, приблизно 17,2 і приблизно 20,1°2θ. Фахівцеві в даній галузі зрозуміло, що коли розчинники і/або вода додаються або видаляються з решітки кристала, решітка злегка розшириться або скоротиться, приводячи до невеликих зсувів в положенні піків XRPD. У деяких варіантах здійснення форма В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти характеризується спектром XRPD, по суті аналогічним спектру, зображеному на фіг. 5. У деяких варіантах здійснення форма В виявляє спектр XRPD, по суті аналогічний спектру, зображеному на фіг. 5, але виявляє невеликі зсуви положень піків, які виникають в результаті присутності або відсутності певних розчинників або води в кристалічній решітці. Певні репрезентативні спектри XRPD форми В (друга зверху вниз) порівнюються з формою А (верхня) 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти на фіг. 8. У деяких варіантах здійснення форма В має спектр XRPD, по суті аналогічний одному або більше спектрам XRPD, зображених на фіг. 8. Термічні характеристики зразка форми В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, кристалізованої з суміші 2,5:1 THF:гексану, показані на фіг. 6. Термограма TGA цього зразка форми В, поданого на фіг. 6, виявляє два явища втрати маси: одне явище втрати маси приблизно 5 % всієї маси зразка після нагрівання від приблизно 25 °C до приблизно 165 °C, і друге явище втрати маси, що починається приблизно при 220 °C. Високотемпературна мікроскопія виявила, що перше явище втрати маси виникло в результаті втрати розчинника 4 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 і/або води з кристалічної решітки, а друге явище втрати маси виникло в результаті сублімації форми В. Аналіз XRPD одержаного сублімату показав, що утворювалася форма А 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти. Термограма DSC цього зразка форми В, подана на фіг. 6, виявляє різке ендотермічне явище з піком температури приблизно при 243 °C, яке відповідає плавленню сублімату форми А. DSC цього зразка форми В також виявляє щонайменше одне інше явище при температурі нижче приблизно 220 °C. Ці термічні дані вказують на те, що цей зразок форми В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти містив воду і/або розчинник в кристалічній решітці. За рахунок варіабельного вмісту води і/або води в деяких зразках форми В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти в деяких варіантах здійснення винаходу термічні характеристики форми В виявлять певну зміну. Наприклад, в певних варіантах здійснення винаходу зразки форми В, які по суті позбавлені води і розчинника, не виявляють істотної втрати маси, за даними TGA, або термічного явища, за даними DSC, нижче температури приблизно 220 °C. Оскільки форма В сублімується і кристалізується як форма А, то на фіг. 6 тепло злиття для ендотерми знаходиться після того, як зразок перетворився у форму А. В одному варіанті здійснення винаходу зразок форми В, який кристалізувався з IPA, мав приблизно 0,1 молярних еквівалентів IPA і приблизно 1 молярний еквівалент води на моль 3-[5(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, на основі аналізу з використанням TGA і 1 Н ЯМР. У певних варіантах здійснення зразок форми В, який має приблизно 1 молярний еквівалент води на молярний еквівалент 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, називається моногідратом. В іншому варіанті здійснення винаходу зразок форми В, який був оброблений вакуумним сушінням при 105 °C протягом 10 хв, виявив загальну втрату маси 2 % мас. зразка при подальшому аналізі TGA приблизно від 25 до приблизно 185 °C. У деяких варіантах здійснення характеристики форми В, які залежать від кількості і/або ідентичності розчинника і/або води в кристалічній решітці (наприклад, втрати маси після нагрівання або сушіння), виявлять зміну відносно загальної кількості або ідентичності розчинника і/або води в кристалічній решітці. У деяких варіантах здійснення незалежно від кількості і/або ідентичності розчинника і/або води в кристалічній решітці, спектр XRPD форми В містить піки, характерні для форми В, як описано вище, але з невеликим зсувом піка, виникаючим в результаті відмінностей кількості і/або ідентичності розчинника і/або води в кристалічній решітці форми В. Репрезентативні спектри XRPD, що ілюструють зсув піка серед певних зразків форми В, накладені на фіг. 8 (друга зверху вниз). У деяких варіантах здійснення винаходу після подрібнення при навколишній температурі або температурі, нижче навколишньої, спостерігається перетворення з форми В у форму А. В інших варіантах здійснення винаходу форма В фізично стійка після зберігання протягом 6 днів при одній з наступних величин відносно вологості (RH): RH 53 % при 40 °C, 75 % RH при 40 °C і RH 50 % при 60 °C. В інших варіантах здійснення винаходу форма В є по суті не гігроскопічною, як ілюструється ізотермою DVS репрезентативної форми В на фіг. 7. В інших варіантах здійснення винаходу форма В виявляє часткове перетворення у форму А після зберігання протягом 6 днів в умовах RH 79 % при 60 °C. В інших варіантах здійснення винаходу форма В є фізично стійкою при стисненні окремо і при стисненні в присутності суміші 1:1 трет-BuOH і води. В інших варіантах здійснення винаходу форма В є фізично стійкою при суспендуванні при навколишній температурі в суміші 1:1 THF і гептану. В інших варіантах здійснення перетворення форми В у форму А спостерігається після суспендування форми В або в метилізобутилкетоні, або в суміші 1:1 діоксану і води. 4.5. Способи застосування У даному описі представлені способи лікування, попередження і менеджменту захворювань або розладів, які полегшуються придушенням передчасного припинення трансляції і/або нонсенс-опосередкованим розпадом мРНК у пацієнта, які включають введення його пацієнту, що потребує ефективної кількості твердої форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]бензойної кислоти. В одному варіанті здійснення даний винахід стосується способів лікування, попередження або менеджменту будь-якого захворювання, яке пов'язане з геном, що виявляє передчасне припинення трансляції і/або нонсенс-опосередкований розпад мРНК. В одному варіанті здійснення захворювання частково викликане відсутністю експресії гену в результаті передчасного термінуючого кодона. Певні приклади генів, які можуть виявляти передчасне припинення трансляції і/або нонсенс-опосередкований розпад мРНК, і захворювань, пов'язаних з передчасним припиненням трансляції і/або нонсенс-опосередкованим розпадом мРНК, можна знайти в заявці на патент США № 2005-0233327, із заголовком "Способи ідентифікації дрібних 5 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекул, які модулюють передчасне припинення трансляції і/або нонсенс-опосередкований розпад мРНК", яка повністю включена до даного опису за допомогою посилання. Захворювання або розлади, пов'язані з придушенням передчасного припинення трансляції і/або нонсенс-опосередкованим розпадом мРНК, включають, без обмеження, генетичне захворювання, рак, аутоімунне захворювання, захворювання крові, колагенове захворювання, діабет, нейродегенеративне захворювання, проліферативне захворювання, серцево-судинне захворювання, легеневе захворювання, запальне захворювання або захворювання центральної нервової системи. Певні генетичні захворювання в межах обсягу способів за винаходом включають, без обмеження, множинну ендокринну неоплазію (типу 1, 2 і 3), амілоїдоз, мукополісахаридоз (типу I і III), природжену гіпоплазію наднирковиків, аденоматозний поліпоз товстої кишки, хвороба фон Гіпеля-Ландау, синдром Менкеса, гемофілію А, гемофілію В, колаген VII, синдром Аладжіла, синдром Таунса-Брокса, рабдоїдну пухлину, пузирчастий епідермоліз, синдром Харлера, синдром Кофіна-Лоурі, аніридію, хворобу Шарко-Маріа-Туса, міотубулярну міопатію, Х-зчеплену міотубулярну міопатію, Х-зчеплену хондроплазію, Х-зчеплену а-гама-глобулінемію, полікістозне ниркоподібне захворювання, спінальну м'язову атрофію, сімейний аденоматозний поліпоз, недостатність піруватдегідрогенази, фенілкетонурію, нейрофіброматоз 1, нейрофіброматоз 2, хворобу Альцгеймера, хворобу Тея-Сакса, синдром Ретта, синдром Пудлака, синдром екстодермальної дисплазії/крихкість шкіри, дисхондростеоз Лері-Вейла, рахіт, гіпофосфатемію, адренолейкодистрофію, атрофію звивини кори головного мозку, атеросклероз, нейросенсорну глухоту, дистонію, хворобу Дента, гостру переміжну порфірію, , хворобу Коудена, бульозний епідермоліз Херліца, хворобу Уїлсона, синдром Тричера-Колінза, недостатність піруваткінази, гігантизм, карликовість, гіпотиреоз, гіпертиреоз, старіння, ожиріння, хвороба Паркінсона, хвороба С Неймана-Піка, кістозний фіброз, дистрофію жовтої плями, серцеве захворювання, нирковокам'яне захворювання, атаксію-телангіектазію, сімейну гіперхолестеринемію, пігментоз сітківки, хвороба лізосомального накопичення, туберозний склероз, м'язову дистрофію Дюшена и синдром Марфана. В іншому варіанті здійснення генетичне захворювання являє собою аутоімунне захворювання. У переважному варіанті здійснення аутоімунне захворювання являє собою ревматоїдний артрит або хворобу трансплантат проти хазяїна. В іншому варіанті здійснення генетичне захворювання являє собою захворювання крові. У певному варіанті здійснення захворювання крові являє собою гемофілію А, хворобу фон Вілебранда (типу 3), атаксію-телангіектазію, b-таласемію або нирковокам'яне захворювання. В іншому варіанті здійснення генетичне захворювання являє собою колагенове захворювання. У певному варіанті здійснення колагенове захворювання являє собою незавершений остеогенез або цироз. В іншому варіанті здійснення генетичне захворювання являє собою діабет. В іншому варіанті здійснення генетичне захворювання являє собою запальне захворювання. У певному варіанті здійснення запальне захворювання являє собою артрит. В іншому варіанті здійснення генетичне захворювання являє собою захворювання центральної нервової системи. В одному варіанті здійснення захворювання центральної нервової системи являє собою нейродегенеративне захворювання. У певному варіанті здійснення захворювання центральної нервової системи являє собою розсіяний склероз, м'язову дистрофію, м'язову дистрофію Дюшена, хворобу Альцгеймера, хворобу Тея-Сакса, пізній нейронний цероїдний ліпофусциноз дітей раннього віку (LINCL) або хворобу Паркінсона. В іншому варіанті здійснення генетичне захворювання являє собою рак. У певному варіанті здійснення рак являє собою рак голови і шиї, очей, шкіри, ротової порожнини, горла, стравоходу, грудної клітки, кісток, легенів, ободової кишки, сигмоподібної кишки, прямої кишки, шлунка, передміхурової залози, молочних залоз, яєчників, нирок, печінки, підшлункової залози, мозку, кишечника, серця або наднирковиків. Рак може бути первинним або метастатичним. Ракові пухлини включають солідні пухлини, гематологічні злоякісні захворювання й інші новоутворення. В іншому певному варіанті здійснення рак пов'язаний з генами-супресорами пухлин (див., наприклад, Garinis et al. 2002, Hum Gen 111: 115-117; Meyers et al. 1998, Proc. Natl. Acad. Sci. USA, 95: 15587-15591; Kung et al. 2000, Nature Medicine 6(12): 1335-1340). Такі гени-супресори пухлин включають, без обмеження, APC, ATM, BRAC1, BRAC2, MSH1, pTEN, Rb, CDKN2, NF1, NF2, WT1 і p53. У певному переважному варіанті здійснення ген-супресор пухлини являє собою ген р53. Нонсенс-мутації були ідентифіковані в гені р53 і були залучені до процесу при раку. Були ідентифіковані декілька нонсенс-мутацій в гені р53 (див., наприклад, Masuda et al., 2000, Tokai J. 6 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 Exp. Clin. Med. 25(2): 69-77; Oh et al., 2000, Mol. Cells 10(3): 275-80; Li et al., 2000, Lab. Invest. 80(4): 493-9; Yang et al., 1999, Zhonghua Zhong Liu Za Zhi 21(2): 114-8; Finkelstein et al., 1998, Mol. Diagn. 3(1): 37-41; Kajiyama et al., 1998, Dis Esophagus. 11(4): 279-83; Kawamura et al., 1999, Leuk Res. 23(2): 115-26; Radig et al, 1998, Hum. Pathol. 29(11): 1310-6; Schuyer et al., 1998, Int. J. Cancer 76(3): 299-303; Wang-Gohrke et al., 1998, Oncol. Rep. 5(1): 65-8; Fulop et al., 1998, J. Reprod. Med. 43(2): 119-27; Ninomiya et al., 1997, J. Dermatol. Sci. 14(3): 173-8; Hsieh et al., 1996, Cancer Lett. 100(1-2): 107-13; Rail et al., 1996, Pancreas. 12(1): 10-7; Fukutomi et al., 1995, Nippon Rinsho. 53(11): 2764-8; Frebourg et al., 1995, Am. J. Hum. Genet. 56(3): 608-15; Dove et al., 1995, Cancer Surv. 25: 335-55; Adamson et al., 1995, Br. J. Haematol. 89(l): 61-6; Grayson et al., 1994, Am. J. Pediatr. Hematol. Oncol. 16(4): 341-7; Lepelley et al., 1994, Leukemia. 8(8): 1342-9; McIntyre et al., 1994, J. Clin. Oncol. 12(5): 925-30; Horio et al., 1994, Oncogene. 9(4): 1231-5; Nakamura et al., 1992, Jpn. J. Cancer Res. 83(12): 1293-8; Davidoff et al., 1992, Oncogene. 7(l): 127-33; і Ishioka et al., 1991, Biochem. Biophys. Res. Commun. 177(3): 901-6; описи яких повністю включені до даного опису за допомогою посилання). В інших варіантах здійснення захворювання, які підлягають лікуванню, профілактиці або менеджменту шляхом введення потребуючому лікування пацієнту ефективної кількості твердої форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, включають, без обмеження, солідну пухлину, саркому, карциноми, фібросаркому, міксосаркому, ліпосаркому, хондросаркому, остеогенну саркому, хордому, ангіосаркому, ендотеліосаркому, лімфангіосаркому, лімфангіоендотеліосаркому, синовіому, мезотеліому, пухлину Евінга, лейоміосаркому, рабдоміосаркому, карциному ободової кишки, рак підшлункової залози, рак молочної залози, рак яєчників, рак передміхурової залози, плоскоклітинну карциному, базальноклітинну карциному, аденокарциному, карциному потових залоз, карциному сальних залоз, папілярну карциному, папілярні аденокарциноми, цистаденокарциному, медулярну карциному, бронхогенну карциному, нирковоклітинну карциному, гепатому, карциному жовчних протоків, хоріокарциному, семіному, ембріональну карциному, пухлину Вільмса, рак шийки матки, пухлину сіменників, карциному легенів, мілкоклітинну карциному легенів, карциному сечового пузиря, епітеліальну карциному, гліому, астроцитому, медулобластому, краніофарингіому, епендимому, саркому Капоши, пінеалому, гемангіобластому, нейрому слухового нерва, олігодендрогліому, менінгіому, меланому, нейробластому, ретинобластому, пухлину клітин крові, гострий лімфобластичний лейкоз, гострий лімфобластичний В-клітинний лейкоз, гострий лімфобластичний Т-клітинний лейкоз, гострий мієлобластичний лейкоз, гострий промієлоцитарний лейкоз, гострий монобластичний лейкоз, гострий еритролейкемічний лейкоз, гострий мегакаріобластичний лейкоз, гострий мієломоноцитарний лейкоз, гострий нелімфоцитарний лейкоз, гострий недиференційований лейкоз, хронічний мієлоцитарний лейкоз, хронічний лімфоцитарний лейкоз, волосатоклітинний лейкоз або множинну мієлому. Див., наприклад, Harrison's Principles of Internal Medicine, Eugene Braunwald et al., eds., pp. 491th 762 (15 ed. 2001). 4.6 Фармацевтичні композиції Фармацевтичні композиції і одиничні стандартні лікарські форми, що містять сполуку за винаходом, або її фармацевтично прийнятний поліморф, проліки, сіль, сольват, гідрат або клатрат також охоплюються винаходом. Окремі лікарські форми за винаходом можуть підходити для орального введення, введення через слизові оболонки (включаючи сублінгвальне, букальне, ректальне, назальне або вагінальне), парентерального (включаючи підшкірну, внутрішньом'язову, болюсну ін'єкцію, внутрішньоартеріальне або внутрішньовенне введення), трансдермального або місцевого введення. Одиничні стандартні лікарські форми за винаходом підходять для орального введення, введення через слизові оболонки (наприклад, назального, сублінгвального, вагінального, букального або ректального), парентерального (наприклад підшкірного, внутрішньовенного, болюсної ін'єкції, внутрішньом'язового або внутрішньоартеріального введення), або трансдермального введення пацієнту. Склад, форма і тип лікарських форм за винаходом звичайно будуть варіюватися в залежності від їх застосування. Ці й інші ознаки, за якими певні лікарські форми, охоплювані даним винаходом, будуть відрізнятися одна від одної, будуть повністю очевидні для фахівців в th даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, 18 ed., Mack Publishing, Easton PA (1995). Типові фармацевтичні композиції і лікарські форми включають один або декілька носіїв, ексципієнтів або розріджувачів. Прийнятні ексципієнти добре відомі фахівцям в галузі фармації, і не обмежуючі приклади прийнятних ексципієнтів представлені в даному описі. Те, чи підходить певний ексципієнт для включення в фармацевтичну композицію і лікарську форму, залежить від 7 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 різноманітних чинників, добре відомих в даній галузі, включаючи, без обмеження, шлях, яким лікарська форма буде вводитися пацієнту. Наприклад, оральні лікарські форми, такі як таблетки, можуть містити ексципієнти, не прийнятні для застосування в парентеральних лікарських формах. Придатність визначеного ексципієнта може також залежати від певних активних інгредієнтів в лікарській формі. Приклади 5.1. Синтез твердих лікарських форм 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти Продукт 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаний в результаті описаного вище синтезу, може бути кристалізований або перекристалізований різними способами для одержання твердих форм за винаходом. Нижче приведені декілька необмежувальних прикладів. 5.1.1 Синтез форми А 5.1.1.1 Повільне випаровування Продукт 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаний як описано в даній заявці, кристалізували у вигляді форми А способом повільного випаровування з кожного з наступних розчинників: ацетонітрил; трет-бутанол; ізопропіловий спирт і простий ізопропіловий ефір. Розчин 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти одержували у вказаному розчиннику і обробляли ультразвуком між додаваннями аліквотних кількостей для сприяння розчиненню. Після досягнення повного розчинення суміші, про що судили візуальним спостереженням, розчин фільтрували через фільтр з розміром пор 0,2 мкм. Фільтрованому розчину давали можливість випаруватися при температурі 60 °C (50 °C у випадку трет-бутанолу) у флакончику, покритому алюмінієвою фольгою, що містить найдрібніший отвір(и). Тверді речовини, що утворилися виділяли і характеризували XRPD як форму А. 5.1.1.2 Швидке випаровування Продукт 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаний як описано в даній заявці, кристалізували у вигляді форми А способом швидкого випаровування з кожного з наступних розчинників або систем розчинників: 1- бутанол; диметоксіефір; трет-бутанол; суміш диметилформаміду і води; простий ізопропіловий ефір і суміш трет-бутанол:вода (у співвідношенні 3:2), 1 молярний еквівалент метанолу і 1 молярний еквівалент хлориду натрію. Розчини одержували у вказаному розчиннику або системі розчинників і обробляли ультразвуком між додаваннями аліквотних кількостей для сприяння розчиненню. Після досягнення повного розчинення суміші, про що судили візуальним спостереженням, розчин фільтрували через фільтр з розміром пор 0,2 мкм. Фільтрованому розчину давали можливість випаруватися при температурі 60 °C (50 °C у випадках трет-бутанолу і простого ізопропілового ефіру; 81 °C у випадку системи трет-бутанол/вода/метанол/NaCl) у відкритому флакончику. Тверді речовини, що утворилися виділяли і характеризували XRPD як форму А. 5.1.1.3 Перетворення в суспензію Форму В вільної кислоти 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержану як описано в даній заявці, перетворювали у форму А способом суспендування в системі розчинників 1:1 діоксан:вода. Суспензію одержували доданням достатньої кількості твердих речовин форми В до даного розчинника з тим, щоб був присутній надлишок твердих речовин. Потім суміш перемішували в закупореному флаконі при температурі 60 °C. Через 2 дні тверді речовини виділяли вакуумною фільтрацією і характеризували XRPD як форму А з невеликою кількістю форми В. 5.1.1.4 Сублімація і нагрівання Форму В 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаної як описано в даній заявці, перетворювали у форму А способами сублімації і нагрівання. В одному експерименті форму В сублімували при 160-208 °C у вакуумі протягом 35 хв для одержання білих голок, які характеризували XRPD як форму А. В іншому експерименті форму В плавили при 255 °C, за яким йшло безпосереднє приміщення в рідкий азот для одержання кристалічного матеріалу, який характеризувався XRPD як форма А. В іншому експерименті форму В плавили при 255 °C і потім повільно охолоджували для одержання кристалічного матеріалу, який характеризувався XRPD як форма А. 5.1.2 Синтез форми В 5.1.2.1 Повільне випаровування Продукт 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаний як В способом повільного випаровування з кожного з наступних розчинників: ацетон; простий диметиловий ефір і метилетилкетон. Розчин 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної 8 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоти одержували у вказаному розчиннику і обробляли ультразвуком між додаваннями аліквотних кількостей для сприяння розчиненню. Після досягнення повного розчинення суміші, про що судили візуальним спостереженням, розчин фільтрували через фільтр з розміром пор 0,2 мкм. Фільтрованому розчину давали можливість випаруватися при температурі 50 °C (60 °C у випадку метилетилкетону) у флакончику, покритому алюмінієвою фольгою, що містить найдрібніший отвір(и). В одному варіанті здійснення 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти розчиняли в диметоксіефірі. Розчин виливали в чистий флакончик. Вміст флакончика фільтрували через фільтр з розміром пор 0,2 мкм, покритий алюмінієвою фольгою, перфорованою найдрібнішим отвором(ами), і розчиннику давали можливість випаруватися. Тверді речовини, що утворилися виділяли і характеризували XRPD як форму В. Аналіз XRPD ілюструється в таблиці 8 (Р. О.) 5.1.2.2 Швидке випаровування Продукт 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержаний як описано в даній заявці, кристалізували у вигляді форми В способом швидкого випаровування з кожного з наступних розчинників або систем розчинників: ацетон, оцтова кислота, 1-бутилацетат; простий диметиловий ефір; THF і простий діетиловий ефір; діоксан; метилетилкетон; нітрометан; метилізобутилкетон; THF:гексан (2,5:1) і діоксан:вода (3:2). Розчини одержували у вказаному розчиннику або системі розчинників і обробляли ультразвуком між додаваннями аліквотних кількостей для сприяння розчиненню. Після досягнення сумішшю повного розчинення, про що судили візуальним спостереженням, розчин фільтрували через фільтр з розміром пор 0,2 мкм. Фільтрованому розчину давали можливість випаруватися при підвищеній температурі у відкритому флакончику. Тверді речовини, що утворилися виділяли і характеризували XRPD як форму В. 5.1.2.3 Перетворення в суспензію Форму А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержану як описано в даній заявці, перетворювали у форму В способом суспендування в кожному з наступних розчинників: оцтова кислота; 1-бутилацетат і нітрометан. В одному варіанті здійснення 3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту суспендували на орбітальному шейкері в 1бутилацетаті (13 мл) при кімнатній температурі протягом 3 днів. Через 3 дні розчинник видаляли піпеткою, сушили і характеризували XRPD як форму В (таблиця 5). 5.1.2.4 Перетворення в орбітальному вібраторі Форму А 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти, одержану як описано в даній заявці, перетворювали у форму В нагріванням на орбітальному шейкері в 1-пропанолі (10 мл) при 60 °C протягом 1 дня. Одержаний розчин фільтрували через фільтр з розміром пор 0,2 мкм в чистий флакончик. Через 1 день розчинник видаляли і зразок сушили в атмосфері азоту. Аналіз XRPD як форми В ілюструється в таблиці 4. 5.1.2.5 Інші варіанти здійснення 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту (20 мг, форма В) суспендували в суміші тетрагідрофурану/гептану 1/1 (2 мл) при температурі навколишнього середовища протягом 1 дня. Через 1 день в суспензію вносили запал форми А (10 мг) і форми В (9 мг) і суспендували ще протягом одного дня, після чого додавали додаткову кількість форми А (30 мг). Після суспендування зразка всього протягом 7 днів додавали додаткову кількість форми А (30 мг) і температуру збільшували до 50 °C. Тверді речовини збирали після суспендування при 50 °C протягом одного дня. Тверді речовини, що утворилися виділяли і характеризували XRPD як форму В. Аналіз XRPD ілюструється в таблиці 6. 3-[5-(2- фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойну кислоту (НЕВИМІРЯНА КІЛЬКІСТЬ, ФОРМА В) приводили в напружений стан в умовах відносної вологості 75 % при 40 °C протягом 6 днів. Тверді речовини, що утворилися виділяли і характеризували XRPD як форму В. Аналіз XRPD ілюструється в таблиці 7. 5.2 Аналітичні процедури Наступні способи аналізу в твердому стані надають приклади того, як можна характеризувати тверді форми 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]бензойної кислоти за даним винаходом. Певні способи, описані нижче, використовували для одержання описаних тут даних, що характеризують твердий стан. 5.2.1 Порошкова дифракція рентгенівських променів (XRPD) Певні види аналізу XRPD виконували з використанням порошкового дифрактометра рентгенівських променів Shimatzu XRD-6000, застосовуючи Cu-Кα випромінювання. Прилад обладнаний довгофокусною високо точною рентгенівською трубкою. Напругу і ампераж встановлювали відповідно на 40 кВ і 40 мА. Щілини відхилення і розсіювання були встановлені 9 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 на 1°, а приймальна щілина була встановлена на 0,15 мм. Піддане дифракції випромінювання виявляли сцинтиляційним детектором NaI. Використовували безперервне сканування θ-2θ при 3°/хв (крок 0,4 с/0,02°) від 2,5 до 40° 2θ. Силіконовий стандарт аналізували для перевірки поєднання приладу. Дані одержували і аналізували з використанням XRD-6100/7000 v.5.0. Зразки одержували для аналізу шляхом поміщення їх в тримач зразка. Деякі аналізи XRPD виконували з використанням дифрактометра XRG-3000, обладнаного детектором CPS (чутливим до зігненого положення) з діапазоном 2θ 120°. Дані в реальному масштабі часу одержували, використовуючи Cu-Кα випромінювання при дозволі 0,03° 2θ. Напругу і ампераж встановлювали відповідно на 40 кВ і 30 мА. Щілина монохроматора була встановлена на 5 мм по 160 мкм. Тип представлений з 2,5-40° 2θ. Використовували тримач алюмінієвого зразка із силіконовим вкладишем /або/ Зразки одержували для аналізу упаковуванням їх в тонкостінні скляні капіляри. Кожний капіляр встановлювали на головку гоніометра, яка приводилася в рух для забезпечення можливості обертання капіляра під час збору даних. Зразки аналізували протягом 300 с. Калібрування приладу виконували з використанням силіконового еталонного стандарту. Деякі види XRPD одержували дифрактометрами Brucker D-8 Dicover і пристроями виявлення загальної зони дифракції Bruker's General Area Diffraction Detection System (GADDS, v.4.1.20). Падаючий промінь Cu-Кα випромінювання одержували з використанням точнофокусної трубки (40 кВ, 40 мА), дзеркала Göbel і коліматора з подвійним найдрібнішим отвором 0,5 мм. Зразок проби упаковували в капіляр і фіксували в переміщуваній підставці. Відеокамеру і лазер використовували для розташування області з перерізом падаючим променем, яка представляє інтерес, в трансмісійній геометрії. Падаючий промінь сканували для оптимізації статистики орієнтації. Зупинку променя використовували для мінімізації розсіювання падаючого променя в повітрі при низьких кутах. Спектри дифракції одержували з використанням детектора області Hi-Star, розташованого в 15 см від зразка, і оброблювали, використовуючи GADDS. Інтенсивність на зображенні GADDS спектра дифракції інтегрували, використовуючи розмір кроку 0,04° 2θ. Інтегровані спектри виявляють інтенсивність дифракції як функцію 2θ. Перед аналізом силіконовий стандарт аналізували для верифікації положення піка Si 111. Деякі файли XRPD, одержані приладами Intel XRPD, перетворювали в файл Shimadzu.raw, використовуючи версію 3.0.4 File Monkey. Файл Shimadzu.raw оброблювали за допомогою програмного забезпечення версії 2.6 Shimadzu XRD-6000 для автоматичного пошуку положень піків. "Положення піка" означає максимальну інтенсивність профілю максимальної інтенсивності. Параметри, використовувані при виборі піків, показані в нижній половині кожного набору параметра даних. Наступні процеси використовували із застосуванням алгоритму програмного забезпечення версії 2.6 Shimadzu XRD-6000 "Basic Process": - Згладжування проводилося за всіма спектрами. - Фон віднімався для знаходження точної, відносної інтенсивності піків. - Пік з довжини хвиль Cu K альфа2 (1,5444 Å) віднімали з піка, генерованого Cu K альфа1 (1,5406 Å) при 50 % інтенсивності для всіх спектрів. 5.2.2 Диференціальна скануюча калориметрія (DSC) Диференціальну сканувальну калориметрію (DSC) виконували, використовуючи диференціальний сканувальний калориметр TA Instruments 2920. Зразок вміщували в алюмінієвий чан DSC і точно реєстрували масу. Чан покривали кришкою і потім складали. Комірку для зразка врівноважували при 25 °C і нагрівали при продуванні азотом зі швидкістю 10 °C/хв до кінцевої температури 350 °C. Металевий індій використовували як калібрувальний стандарт. Відмічені температури знаходяться на максимальних рівнях переходу. 5.2.3 Термогравіметричний аналіз (TGA) Термогравіметричні (TGA) аналізи виконували, використовуючи термогравіметричний аналізатор TA Instruments 2950. Кожний зразок вміщували в алюмінієвий чан для зразків і вставляли в піч TG. Піч (спочатку калібрували при 35 °C, потім) нагрівали в атмосфері азоту зі TM швидкістю 10 °C/хв до кінцевої температури 350 °C. Нікель і Alumel використовували як калібрувальні стандарти. 5.2.4 Динамічна сорбція/десорбція пари (DVS) Дані сорбції/десорбції вологи збирали на аналізаторі сорбції пари VTI SGA-100 Vapor Sorption Analyzer. Дані сорбції і десорбції збирали в діапазоні відносної вологості (RH) від 5 % до 95 % через інтервали RH 10 % при продуванні азотом. Зразки не сушили перед аналізом. Критерії рівноваги, використовувані для аналізу, склали менше ніж 0,0100 % мас. через 5 хв при максимальному часі рівноваги 3 год. у разі невідповідності критерію за масою. Дані не коректували на первинний вміст вологи в зразках. Як калібрувальні стандарти використовували NaCl і PVP (полівінілпіролідон). 10 UA 99600 C2 5 10 15 20 25 30 35 40 45 50 55 60 5.2.5 Аналіз Карла Фішера Калориметричний аналіз Карла Фішера (KF) для визначення води виконували з використанням титратора Mettler Toledo DL39 Karl Fischer. Приблизно 21 мг зразка вміщували в титрувальну судину KF, що містить Hydranal-Coulomat AD і змішували протягом 42-50 с для забезпечення розчинення. Потім зразок титрували електродом генератора, який продукує йод електрохімічним окисненням: 2I- => I2+2e. Для забезпечення відтворюваності одержували три повторення. 5.2.6 Високотемпературна мікроскопія Високотемпературну мікроскопію виконували, використовуючи високотемпературний мікроскоп Linkam FTIR 600 з регулятором TMS93, встановленим на мікроскопі Leica DM LP, обладнаному кольоровою камерою Spot Insight, для одержання зображень. Поки не відмічене інше, зображення одержували, використовуючи версію 4.5.9 програмного забезпечення Spot Advance, дата створення 9 червня 2005 р. Перед використанням камера була збалансована в білому кольорі. Зразки оглядали і їх зображення одержували, використовуючи об'єктив з довгою робочою відстанню 20×0,40 N.A. з перехрещеними полюсами і компенсатором червоного кольору першого порядку. Зразки вміщували на покривну стрічку. Кожний зразок оглядали візуально при нагріванні стадії. Гарячу стадію калібрували, використовуючи стандарти точок плавлення за Фармакопеєю США. 13 5.2.7 С ядерна магнітно-резонансна спектроскопія в твердому стані з перехресно13 поляризованим обертанням під "магічним" кутом ( С CP/MAS ssNMR) Зразки одержували для ЯМР спектроскопії в твердому стані упаковуванням їх в цирконієві ротори типу PENCIL розміром 4 мм. Сканування збирали при навколишній температурі із затримкою релаксації 120,000 с, шириною імпульсу 2,2 мкс (90,0°), час обробки даних 0,030 с і спектральною шириною 44994,4 Гц (447,520 м. ч.). Разом було зібрано 100 сканувань. 13 1 Перехресної поляризації досягали використанням С як спостережуваного ядра і Н як розщепленого ядра з часом контакту 10,0 мс. Використовували швидкість обертання під "магічним" кутом 12000 Гц. Спектри порівнюються із зовнішнім еталоном гліцину при 176,5 м. ч. Фахівцям в даній галузі буде зрозуміло чи зможуть вони встановити з використанням не більш ніж звичайного експериментування багато які еквіваленти специфічних варіантів здійснення описаного в даній заявці винаходу. Такі еквіваленти призначені для охвату наступною формулою винаходу. Всі публікації, патенти і патентні заявки, згадані в даному описі, включені в опис за допомогою посилання в такій же мірі, як якби кожна окрема публікація, патент або патентна заявка була визначено і окремо вказана як включена до даного опису за допомогою посилання. 5.2.8 Дифракція рентгенівських променів на монокристалі Кристали, використані для визначення структури форми А, одержували сублімацією форми А. Кристали видаляли з холодного пальця після нагрівання зразка до температури від 155 до 206 °C протягом приблизно 90 хв (експериментальна таблиця 3). Збір даних Безбарвну голку C15H9FN2O3, що має приблизні розміри 0,44×0,13×0,03 мм, встановлювали на скляний палець у випадковій орієнтації. Попереднє дослідження і збір даних виконували опроміненням Mo Kα (λ=0,71073 Å) на дифрактометрі Nonius KappaCCD. Уточнення виконували на персональному комп'ютері LINUX PC з використанням програми SHELX97 (Sheldrick, G. M. SHELX97, А Program for Crystal Structure Refinement, University of Gottingen, Germany, 1997). Константи комірки і матрицю орієнтації для збору даних одержували за мінімальним квадратичним уточненням з використанням кутів установки 13862 відбивань в діапазоні 2°
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline forms of 3-[5-(2-fhjorophenyl)-[1,2,4]oxadiazol-3-yl]-benzoic acid
Автори англійськоюAlmstead, Neil, G., Hwang, Peter, Seongwoo, Moon, Young-Choon
Назва патенту російськоюКристаллическая форма 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]-бензойной кислоты
Автори російськоюАльмстед Нил Г., Хванг Питер Сеонгвоо, Моон Йоунг-Чоон
МПК / Мітки
МПК: C07D 271/06, A61K 31/4245
Мітки: 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-бензойної, кристалічна, кислоти, форма
Код посилання
<a href="https://ua.patents.su/36-99600-kristalichna-forma-3-5-2-ftorfenil-124oksadiazol-3-il-benzojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-бензойної кислоти</a>
Попередній патент: Імпрегноване кислотою активоване вугілля і способи його одержання та використання
Наступний патент: Застосування антитіла до cd151 для лікування первинних пухлин
Випадковий патент: Спосіб корекції похибки вимірювального каналу електроенергії