Похідні антибіотику а 40926 та способи їх одержання
Номер патенту: 41283
Опубліковано: 17.09.2001
Автори: Панцоне Жанбатіста, Маразі Алесандра Марія, Малабарба Адріано, Чабаті Ромео
Формула / Реферат
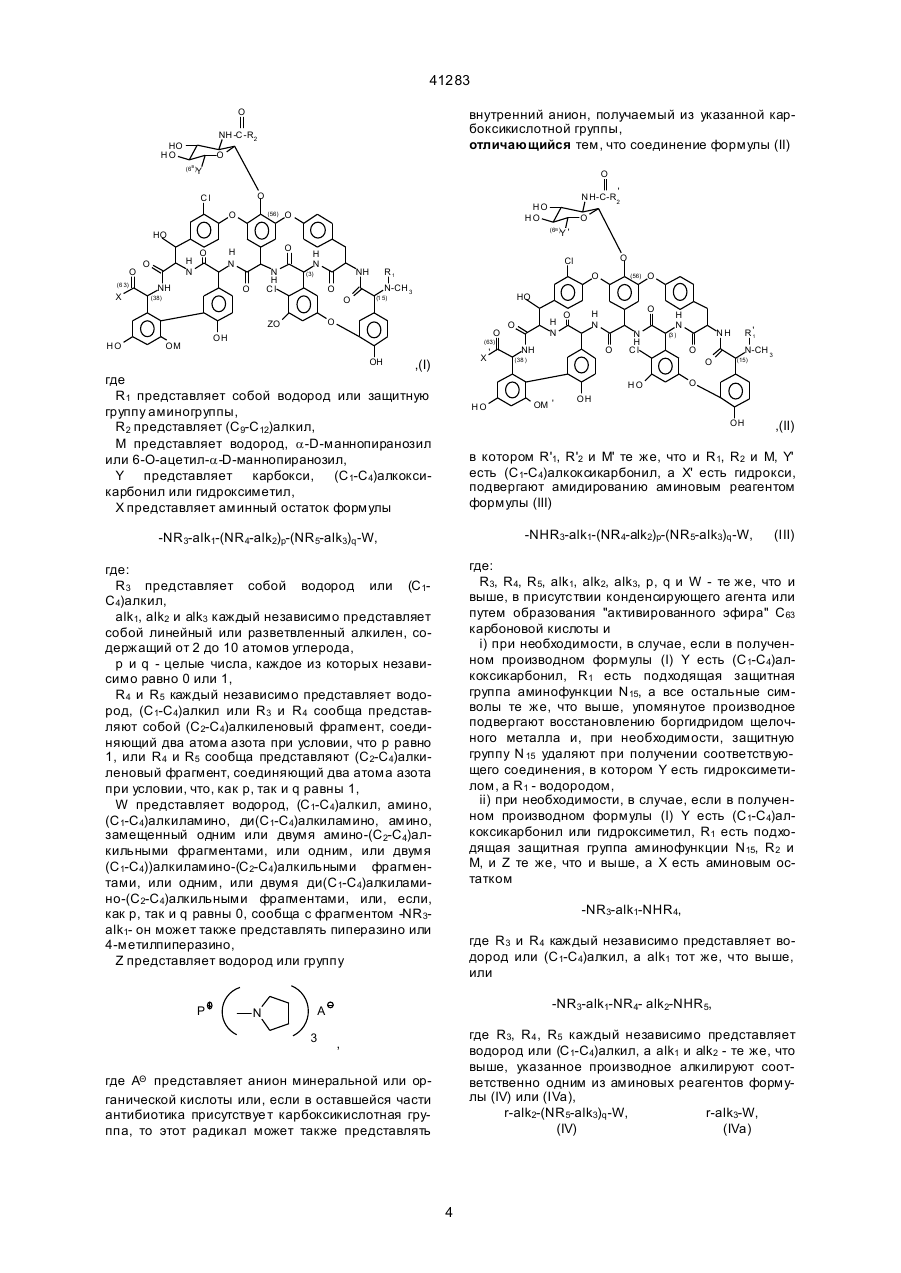
1. Производное антибиотика А 40926 формулы (I):
где
r1 представляет собой водород или защитную группу аминогруппы,
r2 представляет (С9-С12)алкил,
М представляет собой водород, α-D-маннопиранозил или 6-О-ацетил-α-D-маннопиранозил,
Y представляет собой карбокси, (С1-С4)алкоксикарбонил, аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1-С4)алкиламино и ди(С1-С4)алкиламино или гидроксиметила,
Х представляет собой гидрокси или аминный остаток формулы
где
r3 представляет собой водород или (С1-С4)алкил,
alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода,
р и q - целые числа, каждое из которых независимо равно 0 или 1,
R4 и R5 каждый независимо представляет собой водород, (С1-С4)алкил или r3 и R4 вместе представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 вместе представляют (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что и р и q равны 1,
W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1- С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, если и р, и q равны 0, то вместе с фрагментом –NR3-alk1- этот радикал может также представлять собой пиперазино или 4-метилпиперазино,
при условии: когда Х представляет собой гидрокси, Y представляет собой гидроксиметил,
Z представляет собой водород или группу формулы:
где А Ō представляет собой анион минеральной или органической кислоты или, когда в оставшейся части антибиотика присутствует карбоксикислотная группа, этот радикал может также представлять внутренний анион, получаемый из указанной карбоксикислотной группы, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
2. Производное антибиотика А 40926 по п. 1, отличающееся тем, что R1 представляет собой водород или защитную группу аминогруппы, R2 представляет собой (С9-С12)алкил,
М представляет собой водород, α-D-маннопиранозил или 6-0-ацетил-α-D-маннопиранозил,
Y представляет собой карбокси, (С1-С4)алкоксикарбонил, амино-карбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1-С4)алкиламино и ди(С1-С4)алкиламино или гидроксиметила,
Х представляет собой гидрокси или аминный остаток формулы
где r3 , R4 и r5 представляют собой водород,
alk1, alk2 и alk3 независимо представляют собой линейный или разветвленный алкилен, содержащие 2-4 атома углерода,
р и q - целые числа, каждое из которых независимо равно 0 или 1,
W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С1-С4)алкиламино-(С2-С4)алкильньіми фрагментами, или, если оба р и q равны 0, то вместе с фрагментом -NR3-alk1- этот радикал может также представлять собой пиперазино или 4-метилпиперазино,
при условии: когда Х представляет собой гидрокси, Y представляет собой гидроксиметил,
Z представляет собой водород или группу формулы:
где А Ō представляет собой анион минеральной или органической кислоты или, когда в оставшейся части антибиотика присутствует карбоксикислотная группа, этот радикал может также представлять внутренний анион, получаемый из указанной карбоксикислотной группы, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
3. Производное антибиотика А 40926 по п. 1 отличающееся тем, что R2 представляет собой (С10-С11)алкил,
М представляет собой α-D-маннопиранозил и R1, X, Y и Z имеют значения по п. 1,
и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения кислот.
4. Производное антибиотика А 40926 по п. 1, отличающееся тем, что R1 представляет собой водород или защитную группу аминогруппы,
R2 представляет собой 7-метилоктил, nп-нонил, 8-метилнонил, n-децил, 9-метилдецил, n-ундецил или n-додецил,
М представляет собой водород или α-D-маннопиранозил,
Y представляет собой карбокси, (С1-С4)алкоксикарбонил, амино-карбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1-С4)алкиламино и ди(С1-С4)алкиламино или гидроксиметил,
Х представляет собой аминный остаток формулы:
-NR3-alk1-(NH-alk2)p-(NH-alk3)q-W,
где r3 представляет собой водород,
alk1, alk2 и alk3 каждый независимо представляет собой линейный алкилен, содержащие 2-4 атома углерода,
р и q каждый независимо равны 0 или 1,
W представляет собой амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными фрагментами или, когда оба р и q равны 0, то вместе с фрагментом –NR3-alk1-данный радикал может также представлять собой пиперазино или 4-метилпиперазино,
Z представляет собой водород
и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
5. Производное антибиотика А 40926 по п. 1, отличающееся тем, что R1 представляет собой водород,
r2 представляет собой 7-метилоктил, n-нонил, 8-метилнонил, n-децил, 9-метилдецил, n-ундецил или n-додецил,
М представляет собой α-D-маннопиранозил,
Y представляет собой карбокси, метоксикарбонил, аминокарбонил, метиламинокарбонил, диметиламинокарбонил, (диметиламоно)этил-аминокарбонил или гидроксиметил,
Х представляет собой аминный остаток, выбираемый из
Z представляет собой водород, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
6. Производное антибиотика А 40926 по п. 5, отличающееся тем, что R2 представляет собой n-децил, 8-метилнонил, 9-метилдецил или n-ундецил,
r1, М, Y, Х и Z имеют значения по п. 5 и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
7. Производное антибиотика А 40926 по п. 5, отличающееся тем, что R2 представляет собой 9-метилдецил,
r1, M, Y, X и Z имеют значения по п. 5 и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
8. Производное антибиотика А 40926 по п. 5, отличающееся тем, что Y представляет собой метоксикарбонил или гидроксиметил,
Х представляет собой -NН-(СН2)3-N(СН3)2,
r1, r2, М и Z имеют значения, указанные в п. 5, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
9. Производное антибиотика А 40926 формулы (I):
где
r1 представляет собой водород или защитную группу аминогруппы,
r2 представляет (С10-С11 )алкил,
М представляет собой водород, α-D-маннопиранозил или 6-0-ацетил-α-D-маннопиранозил,
Y представляет собой (С1-С4)алкоксикарбонил или гидроксиметил,
Х представляет собой гидрокси или соединение формулы
где:
r3 представляет собой водород или (С1-С4)алкил,
alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода,
р и q - целые числа, каждое из которых независимо равно 0 или 1,
R4 и r5 независимо представляют собой водород, (С1-С4)алкил или r3 и R4 вместе представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 вместе представляют (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что и р, и q равны 1,
W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино(С2-С4)алкильными фрагментами, или одним, или двумя амино(С2-С4)алкильными фрагментами, или одним, или двумя (С1- С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(Сі-С4)алкиламино-(С2-С4)алкильньіми фрагментами, при условии: когда Х представляет собой гидрокси, Y представляет собой гидроксиметил, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
10. Антибиотическое вещество по п. 9, отличающееся тем, что
r1 представляет собой водород или защитную группу аминогруппы,
R2 представляет (С 10-С11 )алкил,
М представляет собой водород, α-D-маннопиранозил или 6-0-ацетил-α-D-маннопиранозил,
Y представляет собой (С1-С4)алкоксикарбонил или гидроксиметил,
Х представляет собой гидрокси или соединение формулы
где R3, R4 и R5 представляют собой водород,
аlk1, аlk2 и аlk3 каждый независимо представляет собой линейный или ветвленный алкилен, содержащие 2-4 атома углерода,
р и q - целые числа, каждое из которых независимо равно 0 или 1,
W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)-алкиламино, ди(С1-С4)алкиламино или аминогруппу, замещенную одним г двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами,
при условии: когда Х представляет собой гидрокси,
Y представляет ой гидроксиметил, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения.
11. Антибиотическое вещество по п. 9, отличающееся тем, что
r2 представляет собой 9-метилдецил,
М представляет собой α-D-маннопиранозил и R1, Х и Y имеют значения, указанные в п. 9.
12. Антибиотическое вещество по п. 9, отличающееся тем, что
r2 представляет собой (С10-С11)алкил, предпочтительно 9-илдецил,
Y представляет собой (С1-С4)алкоксикарбонил, предпочтительно, оксиметил или гидроксиметил и
Х выбирают из
13. Способ получения производного антибиотика А 40926 формулы (I)
где
r1 представляет собой водород или защитную группу аминогруппы,
R2 представляет (С9-С12)алкил,
М представляет водород, αoc-D-маннопиранозил или 6-О-ацетил-α-D-маннопиранозил,
Y представляет карбокси, (С1-С4)алкоксикарбонил или гидроксиметил,
Х представляет аминный остаток формулы
где:
R3 представляет собой водород или (С1-С4)алкил, alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода,
р и q - целые числа, каждое из которых независимо равно 0 или 1,
R4 и R5 каждый независимо представляет водород, (С1-С4)алкил или R3 и R4 сообща представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 сообща представляют (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что, как р, так и q равны 1,
W представляет водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, амино, замещенный одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4))алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, если, как р, так и q равны 0, сообща с фрагментом -NR3-alk1- он может также представлять пиперазино или 4-метилпиперазино,
Z представляет водород или группу
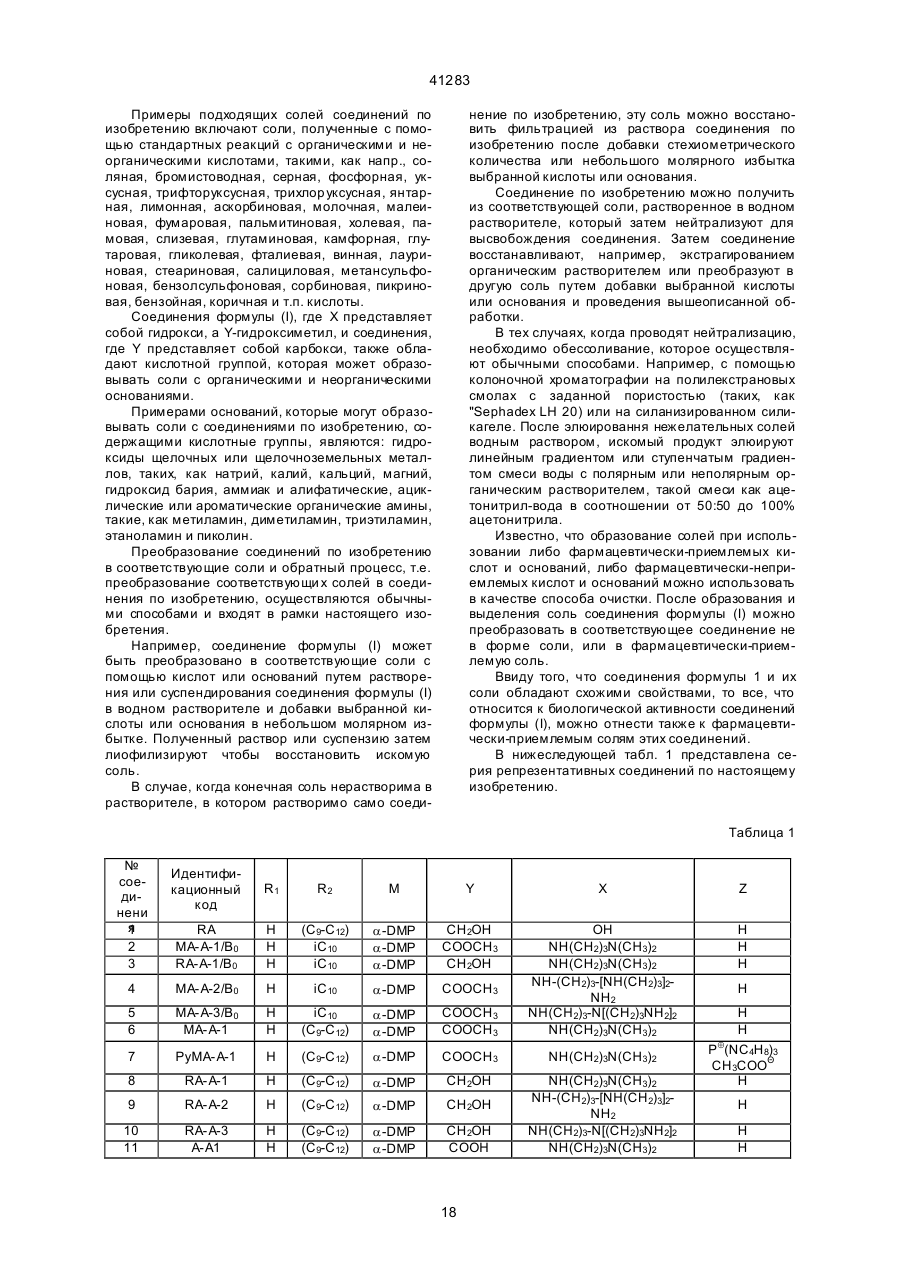
где А Ō представляет анион минеральной или органической кислоты или, если в оставшейся части антибиотика присутствует карбоксикислотная группа, то этот радикал может также представлять внутренний анион, получаемый из указанной карбоксикислотной группы, отличающийся тем, что соединение формулы(II)
в котором R'1, R'2 и М' те же, что и r1, R2 и М, Y' есть (C1-С4)алкоксикарбонил, а X' есть гидрокси, подвергают амидированию аминовым реагентом формулы (III)
где: R3, R4, R5, alk1, alk2, alk3, p, q и W- те же, что и выше, в присутствии конденсирующего агента или путем образования «активированного эфира» С63 карбоновой кислоты и
і) при необходимости, в случае, если в полученном производном формулы (I) Y есть (С1-С4)алкоксикарбонил, R1 есть подходящая защитная группа аминофункции N15, а все остальные символы те же, что выше, упомянутое производное подвергают восстановлению боргидридом щелочного металла; и, при необходимости, защитную группу N15 удаляют при получении соответствующего соединения, в котором Y есть гидроксиметилом, a R1 - водородом,
ii) при необходимости, в случае, если в полученном производном формулы (I) Y есть (С1-С4)алкоксикарбонил или гидроксиметил R1 есть подходящая защитная группа аминофункции N15, R2 и М, и Z те же, что и выше, а Х есть аминовым остатком
-NR3-alk1-NHR4, где R3 и R4 каждый независимо представляет водород или (С1-С4)алкил, a alk1 тот же,что выше,
или
где R3, R4, R5 каждый независимо представляет водород или (С1-С4)алкил, а alk1 и alk2 - те же, что выше, указанное производное алкилируют соответственно одним из аминовых реагентов формулм(1У) или (IVa),
где символы R5, alk2, alk3 и W - те же , что выше, q есть 0 или 1, а r представляет гало, метансульфонил или тозил, в присутствии кислотного акцептора в инертном растворителе, и при необходимости, удаляют защитную группу M15,
ііі) при необходимости, в случае, если в полученном производном формулы (I), в котором Y есть (С1-С4)алкоксикарбонил, а все остальные символы, как выше, указанное производное обрабатывают водным гидроксидом щелочного металла с получением соответствующего соединения, в котором Y есть карбокси,
iv) при необходимости, в случае, если в полученном производном формулы (I), в котором М есть α-D-маннопиранозил или 6-0-ацетил-α-D-маннопиранозил, а все остальные символы - такие же, как выше, указанное производное подвергают кислотному гидролизу с получением соответствующего соединения, в котором М есть водород,
14. Способ получения производного антибиотика А 40926 формулы (I)
где
r1 представляет собой водород или защитную группу аминогруппы,
R2 представляет (С9-С 12)алкил,
М представляет водород, α-D-маннопиранозил или 6-0-ацетил-α-D-маннопиранозил,
Y представляет гидроксиметил,
Х представляет гидрокси или аминный остаток формулы
где:
R3 представляет собой водород или (С1-С4)алкил,
Alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода,
р и q - целые числа, каждое из которых независимо равно 0 или 1,
R4 и R5 каждый независимо представляет собой водород, (С1-С4)алкил или R3 и R4 сообща представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 сообща представляют (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что, как р так и q равны 1,
W представляет водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, амино, замещенный одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, если, как р, так и q равны 0, сообща с фрагментом –NR3-alk1- он может также представлять пиперазино или 4-метилпиперазино,
Z представляет водород, отличающийся тем, что соединение формулы (II), в котором R'1 есть подходящей защитной группой амино функции N15, R'2 тот же, что и R2, Y' есть (С1-С4)алкоксикарбонилом, а X' есть гидрокси, подвергают восстановлению боргидридом щелочного металла и, при необходимости, удаляют защитную группу N15 с получением соответствующего соединения, в котором R1 есть водород, ..и
і) при необходимости, в случае, если в полученном соединении формулы (I) Y есть гидроксиметилом, Х - гидрокси, а все остальные символы - те же, что выше, указанное соединение подвергают амидированию аминовым реагентом формулы (III)
где R3, R4, R5, alk1, alk2, alk3, p, q и W- те же, что и выше, в присутствии конденсирующего агента или путем образования «активированного эфира» С63 карбоновой кислоты в инертном органическом растворителе.
15. Способ по п. 13 или 14, отличающийся тем, что амидирование проводят в инертном органическом растворителе в присутствии конденсирующего агента, выбираемого из (С1-С4)алкила, фенила, гетероциклических фосфоразидатов и бензотриазолилокси-трис-(пирролидино)фосфоний-гексафторфосфата при температуре от 0 до 20°С.
16. Способ по п. 13 или 14, отличающийся тем, что амидирование проводят путем конвертирования исходного карбоксилитового материала формулы (II) в соответствующий активированный эфир, предпочтительно защищенный на N15 аминогруппе, а активированный эфир вводят в реакцию с молярным избытком амина формулы (III) в присутствии полярного органического растворителя при температуре от 5 до 60°С, предпочтительно от 10 до 30°С.
17. Способ по п. 16, отличающийся тем, что активированным эфиром является цианометиловый эфир, и молярное отношение этого эфира к амину составляет от 1 : 5 до 1 : 30.
18. Способ по п. 17, отличающийся тем, что цианометиловый эфир получают путем взаимодействия исходной карбоновой кислоты формулы (II), предпочтительно защищенной на N15-аминогруппе, с 20-30-кратным молярным избытком хлорацетонитрила в присутствии инертного органического растворителя и основания, которое не вступает в реакцию при температуре от 5 до 60°С, предпочтительно от 10 до 30°С.
19. Способ по п. 13 или 14, отличающийся тем, что молярное отношение между боргидридом щелочного металла и соединением формулы (II) составляет от 50 до 300, реакцию проводят при температуре от 0 до 40°С, предпочтительно при комнатной температуре. ,
20. Способ по п. 15, отличающийся тем, что инертный органический растворитель выбирают из диметилформамида, диметоксиэтапан-гексаметилфосфорамида, диметилсульфоксида и их смесей.
21. Способ по п. 16, отличающийся тем, что полярный органический растворитель выбирают из низших алканолов, диметилформамида, гексаметилфосфорамида, 1,3-диметил-3,4,5,6-тетрагидро-2-(1Н)-пиримидона, диметилсульфоксида и диметоксиэтана.
22. Способ по п. 19, отличающийся тем, что боргидрид щелочного металла выбирают из боргидрида натрия, боргидрида калия и цианоборгидрида натрия, а реакционный растворитель представляет собой смесь воды и водорастворимого или частично растворимого низшего алканола, в которую в качестве противовспенивающего агента может быть добавлен диэтиловый эфир.
23. Способ по п. 13 или 14, отличающийся тем, что защитной группой N15 является трет-бутоксикарбонильная или карбобензилоксильная группа, и указанная защитная группа, при необходимости, подлежит удалению в конце реакции амидирования.
24. Способ по п. 13 или 14, отличающийся тем, что в одну или более аминогрупп амина формулы (III), которые не участвуют в образовании амидной связи, вводят защитную группу (группы) перед тем, как указанный амин вступает в реакцию амидирования, и после завершения этой реакции эту защитную группу (группы) удаляют.
25. Способ получения антибиотика по п.9 в виде соединения формулы (I), в котором Y есть гидроксиметил, Х есть гидрокси, a R1, R2 и М те же, что и в п.9, отличающийся тем, что соединение формулы (II)
в котором X' есть гидрокси, Y есть (С1-С4)алкоксикарбонил, a R'1 есть подходящей защитной группой аминовой функции, подвергают восстановлению боргидридом щелочного металла, предпочтительно выбираемого из боргидрида натрия, боргидрида калия и цианборгидрида натрия при температуре от 0 до 40°С в водной или гидроалкогольной среде, и при необходимости удаляют защитную группу.
26. Способ получения антибиотика по п.9 в виде соединения формулы (I), в котором Х представляет фрагмент -NR3-alk1-(NR4-alk2)p-(NR5-alk3)q-W, a Y, R1, r2, R3, R4, R5, alk1, alk2, p, q и М те же, что в п.9, отличающийся тем, что
і) карбоксилитное соединение формулы (II), в котором X' есть гидрокси, Y' есть (С1-С4)алкилоксикарбонил, a R'1 есть подходящая защитная группа аминовой функции, или карбоксилитное соединение формулы (І), в котором r2 и М те же, что выше, Y есть гидроксиметил, X есть гидрокси, a R2 - подходящая защитная группа аминовой функции, конденсируют при избытке подходящего амина формулы (III)
где R3, R4, R5, alk1, alk2, p, q и W имеют те же значения, что и выше, в инертном органическом растворителе в присутствии конденсирующего агента, выбираемого из (С1-С4)алкил, фенил и гетероциклических фосфороазидатов при температуре в пределах от 0 до 20°С,
іі) или тем, что вышеобозначенное карбоксилитное соединение формулы (II) или (I) конвертируют в соответствующем ему активированном эфире и реагируют указанный активированный эфир с указанным амином (III) в присутствии полярного органического растворителя при температуре между 5 - и 60°С, предпочтительно между 10 и 30°С, и при необходимости удаляют защитную группу аминовой функции.
Текст
1. Производное антибиотика А 40926 формулы (I): C2 (54) ПОХІДНІ АНТИБІОТИКА А 40926 ТА СПОСОБИ ЇХ ОД ЕРЖАННЯ 41283 М представляет собой водород, a-D-маннопиранозил или 6-О-ацетил-a-D-маннопиранозил, Y представляет собой карбокси, (С1-С4)алкоксикарбонил, аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1-С4)алкиламино и ди(С1-С4)алкиламино или гидроксиметила, Х представляет собой гидрокси или аминный остаток формулы Y представляет собой карбокси, (С1-С4)алкоксикарбонил, аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1-С4)-алкиламино и ди(С1-С4)алкиламино или гидроксиметил, Х представляет собой аминный остаток формулы: -NR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, где R3 представляет собой водород, alk1, alk2 и alk3 каждый независимо представляет собой линейный алкилен, содержащие 2-4 атома углерода, р и q каждый независимо равны 0 или 1, W представляет собой амино, (С1С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2С4)алкильными фрагментами или, когда оба р и q равны 0, то вместе с фрагментом -NR3-alk1- данный радикал может также представлять собой пиперазино или 4-метилпиперазино, Z представляет собой водород, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 5. Производное антибиотика А 40926 по п. 1, отличающееся тем, что R1 представляет собой водород, R2 представляет собой 7-метилоктил, n-нонил, 8метилнонил, n-децил, 9-метилдецил, n-ундецил или n-додецил, М представляет собой a-D-маннопиранозил, Y представляет собой карбокси, метоксикарбонил, аминокарбонил, метиламинокарбонил, диметиламинокарбонил, (диметиламоно)этиламинокарбонил или гидроксиметил, Х представляет собой аминный остаток, выбираемый из -NR3-alk1-(NH-alk2)p-(NH-alk3)q -W, где R3, R4 и R5 представляют собой водород, alk1, alk2 и alk3 независимо представляют собой линейный или разветвленный алкилен, содержащие 2-4 атома углерода, р и q - целые числа, каждое из которых независимо равно 0 или 1, W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С 1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, если оба р и q равны 0, то вместе с фрагментом -NR3-alk1- этот радикал может также представлять собой пиперазино или 4-метилпиперазино, при условии: когда Х представляет собой гидрокси, Y представляет собой гидроксиметил, Z представляет собой водород или группу формулы: P N A 3 где АΘ представляет собой анион минеральной или органической кислоты или, когда в оставшейся части антибиотика присутствует карбоксикислотная группа, этот радикал может также представлять внутренний анион, получаемый из указанной карбоксикислотной группы, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 3. Производное антибиотика А 40926 по п. 1 отличающееся тем, что R2 представляет собой (С10С11)алкил, М представляет собой a-D-маннопиранозил и R1, X, Y и Z имеют значения по п. 1, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения кислот. 4. Производное антибиотика А 40926 по п. 1, отличающееся тем, что R1 представляет собой водород или защитную группу аминогруппы, R2 представляет собой 7-метилоктил, n-нонил, 8метилнонил, n-децил, 9-метилдецил, n-ундецил или n-додецил, М представляет собой водород или a-D-маннопиранозил, -NH-(CH2)3-N(CH3)2, -NH(CH2)3-[NH(CH2)3]2-NH2, -NH-(CH2)3-N[(CH2)3NH2]2 и N N CH3 , Z представляет собой водород, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 6. Производное антибиотика А 40926 по п. 5, отличающееся тем, что R2 представляет собой nдецил, 8-метилнонил, 9-метилдецил или n-ундецил, R1, М, Y, Х и Z имеют значения по п. 5, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 7. Производное антибиотика А 40926 по п. 5, отличающееся тем, что R2 представляет собой 9метилдецил, R1, M, Y, X и Z имеют значения по п. 5, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 2 41283 8. Производное антибиотика А 40926 по п. 5, отличающееся тем, что Y представляет собой метоксикарбонил или гидроксиметил, Х представляет собой -NН-(СН2)3-N(СН3)2, R1, R2, М и Z имеют значения, указанные в п. 5, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 9. Производное антибиотика А 40926 формулы (I): 10. Антибиотическое вещество по п. 9, отличающееся тем, что R1 представляет собой водород или защитную группу аминогруппы, R2 представляет (С10-С11 )алкил, М представляет собой водород, a-D-маннопиранозил или 6-О-ацетил-a-D-маннопиранозил, Y представляет собой (С1-С4)алкоксикарбонил или гидроксиметил, Х представляет собой гидрокси или соединение формулы O NH-C-R 2 HO HO O (6B ) Y -NR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, O Cl O (56 ) где R3, R4 и R5 представляют собой водород, аlk1, аlk2 и аlk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащие 2-4 атома углерода, р и q - целые числа, каждое из которых независимо равно 0 или 1, W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино или аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С 1-С4)алкиламино-(С2-С4)алкильными фрагментами, при условии: когда Х представляет собой гидрокси, Y представляет собой гидроксиметил, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. 11. Антибиотическое вещество по п. 9, отличающееся тем, что R2 представляет собой 9-метилдецил, М представляет собой a-D-маннопиранозил и R1, Х и Y имеют значения, указанные в п. 9. 12. Антибиотическое вещество по п. 9, отличающееся тем, что R2 представляет собой (С10-С11)алкил, предпочтительно 9-метилдецил, Y представляет собой (С1-С4)алкоксикарбонил, предпочтительно, метоксиметил или гидроксиметил и Х выбирают из O HO O X (6 3) H N O O O H N NH O N H Cl NH OM R1 O O HO HO H N N-CH 3 (15) O OH OH , (I) где R1 представляет собой водород или защитную группу аминогруппы, R2 представляет (С10-С11 )алкил, М представляет собой водород, a-D-маннопиранозил или 6-О-ацетил-a-D-маннопиранозил, Y представляет собой (С1-С4)алкоксикарбонил или гидроксиметил, Х представляет собой гидрокси или соединение формулы -NR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, где: R3 представляет собой водород или (С1С4)алкил, alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода, р и q - целые числа, каждое из которых независимо равно 0 или 1, R4 и R5 независимо представляют собой водород, (С1-С4)алкил или R3 и R4 вместе представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 вместе представляют (С2С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что и р, и q равны 1, W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино(С2-С4)алкильными фрагментами, или одним, или двумя амино(С 2-С4)алкильными фрагментами, или одним, или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С1-С4)алкиламино-(С2-С4)алкильными фрагментами, при условии: когда Х представляет собой гидрокси, Y представляет собой гидроксиметил, и фармацевтически приемлемые соли этого соединения, являющиеся продуктами присоединения. -NH-(CH2)3-N(CH3)2, -NH-(CH2)3-[NH(CH2)3]2-NH2 и -NH-(CH2)3-N[(CH2)3NH2]2. 13. Способ получения производного антибиотика А 40926 формулы (I) 3 41283 O внутренний анион, получаемый из указанной карбоксикислотной группы, отличающийся тем, что соединение формулы (II) NH-C-R2 HO HO O (6B ) Y O O (56) HO HO O O (6 3) X Y' H N O O H N NH N H Cl O (38) H N O O R1 O N-CH 3 O O (63) OH X ,(I) где R1 представляет собой водород или защитную группу аминогруппы, R2 представляет (С9-С12)алкил, М представляет водород, a-D-маннопиранозил или 6-О-ацетил-a-D-маннопиранозил, Y представляет карбокси, (С1-С4)алкоксикарбонил или гидроксиметил, Х представляет аминный остаток формулы HO O O H N NH O N H Cl H N NH (3 ) O O (38 ) OM ' R '1 N-CH 3 (15) O OH ,(II) в котором R'1, R'2 и М' те же, что и R1, R2 и М, Y' есть (C1-С4)алкоксикарбонил, а X' есть гидрокси, подвергают амидированию аминовым реагентом формулы (III) -NHR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, (III) где: R3, R4, R5, alk1, alk2, alk3, p, q и W - те же, что и выше, в присутствии конденсирующего агента или путем образования "активированного эфира" С63 карбоновой кислоты и і) при необходимости, в случае, если в полученном производном формулы (I) Y есть (С1-С4)алкоксикарбонил, R1 есть подходящая защитная группа аминофункции N15, а все остальные символы те же, что выше, упомянутое производное подвергают восстановлению боргидридом щелочного металла и, при необходимости, защитную группу N 15 удаляют при получении соответствующего соединения, в котором Y есть гидроксиметилом, a R1 - водородом, ii) при необходимости, в случае, если в полученном производном формулы (I) Y есть (С1-С4)алкоксикарбонил или гидроксиметил, R1 есть подходящая защитная группа аминофункции N15, R2 и М, и Z те же, что и выше, а Х есть аминовым остатком -NR3-alk1-NHR4, где R3 и R4 каждый независимо представляет водород или (С1-С4)алкил, a alk1 тот же, что выше, или -NR3-alk1-NR4- alk2-NHR5, A 3 ' H N O OH где: R3 представляет собой водород или (С1С4)алкил, alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода, р и q - целые числа, каждое из которых независимо равно 0 или 1, R4 и R5 каждый независимо представляет водород, (С1-С4)алкил или R3 и R4 сообща представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 сообща представляют (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что, как р, так и q равны 1, W представляет водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, амино, замещенный одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4))алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С 1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, если, как р, так и q равны 0, сообща с фрагментом -NR3alk1- он может также представлять пиперазино или 4-метилпиперазино, Z представляет водород или группу N O HO -NR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, P (56) HO (1 5) OH OM O Cl NH (3) ZO HO O (6B ) HO O ' NH-C-R2 O Cl где R3, R4 , R5 каждый независимо представляет водород или (С1-С4)алкил, а alk1 и alk2 - те же, что выше, указанное производное алкилируют соответственно одним из аминовых реагентов формулы (IV) или (IVa), r-alk2-(NR5-alk3)q -W, r-alk3-W, (IV) (IVa) , где АΘ представляет анион минеральной или органической кислоты или, если в оставшейся части антибиотика присутствуе т карбоксикислотная группа, то этот радикал может также представлять 4 41283 где символы R5, alk2, alk3 и W - те же , что выше, q есть 0 или 1, а r представляет гало, метансульфонил или тозил, в присутствии кислотного акцептора в инертном растворителе, и, при необходимости, удаляют защитн ую группу M15 , ііі) при необходимости, в случае, если в полученном производном формулы (I), в котором Y есть (С1-С4)алкоксикарбонил, а все остальные символы, как выше, указанное производное обрабатывают водным гидроксидом щелочного металла с получением соответствующего соединения, в котором Y есть карбокси, iv) при необходимости, в случае, если в полученном производном формулы (I), в котором М есть a-D-маннопиранозил или 6-O-ацетил-a-Dманнопиранозил, а все остальные символы - такие же, как выше, указанное производное подвергают кислотному гидролизу с получением соответствующего соединения, в котором М есть водород. 14. Способ получения производного антибиотика А 40926 формулы (I) W представляет водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, амино, замещенный одним или двумя амино-(С2-С4)алкильными фрагментами, или одним, или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или одним, или двумя ди(С 1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, если, как р, так и q равны 0, сообща с фрагментом -NR3-alk1- он может также представлять пиперазино или 4-метилпиперазино, Z представляет водород, отличающийся тем, что соединение формулы (II), в котором R'1 есть подходящей защитной группой амино функции N15, R'2 тот же, что и R2, Y' есть (С1-С4)алкоксикарбонилом, а X' есть гидрокси, подвергают восстановлению боргидридом щелочного металла и, при необходимости, удаляют защитн ую гр уппу N15 с получением соответствующего соединения, в котором R1 есть водород, и i) при необходимости, в случае, если в полученном соединении формулы (I) Y есть гидроксиметилом, Х - гидрокси, а все остальные символы - те же, что выше, указанное соединение подвергают амидированию аминовым реагентом формулы (III) O NH-C-R2 HO HO O -NHR3-alk1-(NH4-alk2)p-(NH5-alk3)q -W, (6B) Y где R3, R4, R5, alk1, alk2, alk3, p, q и W - те же, что и выше, в присутствии конденсирующего агента или путем образования "активированного эфира" С63 карбоновой кислоты в инертном органическом растворителе. 15. Способ по п. 13 или 14, отличающийся тем, что амидирование проводят в инертном органическом растворителе в присутствии конденсирующего агента, выбираемого из (С1-С4)алкила, фенила, гетероциклических фосфоразидатов и бензотриазолилокси-трис-(пирролидино)фосфоний-гексафтор фосфата при температуре от 0 до 20°С. 16. Способ по п. 13 или 14, отличающийся тем, что амидирование проводят путем конвертирования исходного карбоксилитового материала формулы (II) в соответствующий активированный эфир, предпочтительно защищенный на N15 аминогруппе, а активированный эфир вводят в реакцию с молярным избытком амина формулы (III) в присутствии полярного органического растворителя при температуре от 5 до 60°С, предпочтительно от 10 до 30°С. 17. Способ по п. 16, отличающийся тем, что активированным эфиром является цианометиловый эфир, и молярное отношение этого эфира к амину составляет от 1:5 до 1:30. 18. Способ по п. 17, отличающийся тем, что цианометиловый эфир получают путем взаимодействия исходной карбоновой кислоты формулы (II), предпочтительно защищенной на N15-аминогруппе, с 20-30-кратным молярным избытком хлорацетонитрила в присутствии инертного органического растворителя и основания, которое не вступает в реакцию при температуре от 5 до 60°С, предпочтительно от 10 до 30°С. 19. Способ по п. 13 или 14, отличающийся тем, что молярное отношение между боргидридом щелочного металла и соединением формулы (II) составляет от 50 до 300, реакцию проводят при тем O Cl O (56) O HO O (63) X H N O O O H N NH O N H Cl NH O OM R1 O (38) ZO HO H N (3) N-CH 3 (1 5) O OH OH ,(I) где R1 представляет собой водород или защитную группу аминогруппы, R2 представляет (С9-С12)алкил, М представляет водород, a-D-маннопиранозил или 6-O-ацетил-a-D-маннопиранозил, Y представляет гидроксиметил, Х представляет гидрокси или аминный остаток формулы -NHR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, где: R3 представляет собой водород или (С1С4)алкил, alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен, содержащий от 2 до 10 атомов углерода, р и q - целые числа, каждое из которых независимо равно 0 или 1, R4 и R5 каждый независимо представляет собой водород, (С1-С4)алкил или R3 и R4 сообща представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что р равно 1, или R4 и R5 сообща представляют (С2С4)алкиленовый фрагмент, соединяющий два атома азота при условии, что, как р, так и q равны 1, 5 41283 пературе от 0 до 40°С, предпочтительно при комнатной температуре. 20. Способ по п. 15, отличающийся тем, что инертный органический растворитель выбирают из диметилформамида, диметоксиэтапангексаметилфосфорамида, диметилсульфоксида и их смесей. 21. Способ по п. 16, отличающийся тем, что полярный органический растворитель выбирают из низших алканолов, диметилформамида, гексаметилфосфорамида, 1,3-диметил-3,4,5,6-тетрагидро2-(1Н)-пиримидона, диметилсульфоксида и диметоксиэтана. 22. Способ по п. 19, отличающийся тем, что боргидрид щелочного металла выбирают из боргидрида натрия, боргидрида калия и цианоборгидрида натрия, а реакционный растворитель представляет собой смесь воды и водорастворимого или частично растворимого низшего алканола, в которую в качестве противовспенивающего агента может быть добавлен диэтиловый эфир. 23. Способ по п. 13 или 14, отличающийся тем, что защитной гр уппой N15 является трет-бутоксикарбонильная или карбобензилоксильная группа, и указанная защитная группа, при необходимости, подлежит удалению в конце реакции амидирования. 24. Способ по п. 13 или 14, отличающийся тем, что в одну или более аминогрупп амина формулы (III), которые не участвуют в образовании амидной связи, вводят защитн ую группу (гр уппы) перед тем, как указанный амин вступает в реакцию амидирования, и после завершения этой реакции эту защитную группу (гр уппы) удаляют. 25. Способ получения антибиотика по п. 9 в виде соединения формулы (I), в котором Y есть гидроксиметил, Х есть гидрокси, а R1, R2 и М те же, что и в п. 9, отличающийся тем, что соединение формулы (II) в котором X' есть гидрокси, Y есть (С1-С4)алкоксикарбонил, a R'1 есть подходящей защитной группой аминовой функции, подвергают восстановлению боргидридом щелочного металла, предпочтительно выбираемого из боргидрида натрия, боргидрида калия и цианборгидрида натрия при температуре от 0 до 40°С в водной или гидроалкогольной среде, и при необходимости удаляют защитн ую гр уппу. 26. Способ получения антибиотика по п. 9 в виде соединения формулы (I), в котором Х представляет фрагмент -NR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, a Y, R1 , R2, R3 , R4, R5, alk1, alk2, p, q и М те же, что в п. 9, отличающийся тем, что і) карбоксилитное соединение формулы (II), в котором X' есть гидрокси, Y' есть (С1-С4)алкилоксикарбонил, a R'1 есть подходящая защитная группа аминовой функции, или карбоксилитное соединение формулы (І), в котором R2 и М те же, что выше, Y есть гидроксиметил, X есть гидрокси, a R2 подходящая защитная группа аминовой функции, конденсируют при избытке подходящего амина формулы (III) -NHR3-alk1-(NR4-alk2)p-(NR5-alk3)q -W, где R3, R4, R5 , alk1, alk2, p, q и W имеют те же значения, что и выше, в инертном органическом растворителе в присутствии конденсирующего агента, выбираемого из (С1-С4)алкил, фенил и гетероциклических фосфороазидатов при температуре в пределах от 0 до 20°С, іі) или тем, что вышеобозначенное карбоксилитное соединение формулы (II) или (I) конвертируют в соответствующем ему активированном эфире и реагируют указанный активированный эфир с указанным амином (III) в присутствии полярного органического растворителя при температуре между 5 и 60°С, предпочтительно между 10 и 30°С, и при необходимости удаляют защитную гр уппу аминовой функции. O ' NH-C-R2 HO HO O Y' (6B ) O Cl O (56) O HO O (63) X ' H N O O O H N NH O N H Cl NH O (38 ) HO HO H N (3 ) OM ' O R '1 N-CH 3 (15) O OH OH (III) ,(II) Настоящее изобретение описывает производные антибиотика А 40326 формулы (I): 6 41283 O P NH-C-R 2 HO HO A N O 3 (6B)Y где АΘ представляет собой анион минеральной или органической кислоты, или, когда присутствует карбоксикислотная группа в оставшейся части антибиотика, этот радикал может также представлять собой внутренний анион, получаемый из этой карбоксикислотной группы; а также фармацевтически-приемлемые соли этих производных, являющиеся продуктами присоединения. Цифры в скобках в вышеприведенной формуле (I) и в последующих формула х означают обычную н умерацию соответствующи х а томов углерода в молекулярной структуре антибиотика А-40926 и его производных. Антибиотик А 40926 представляют собой гликопептидный антибиотический комплекс, выделенный из культуры Actinomadura, под названием Actinomadura sp. АТСС 39727 в культуральной среде, содержащей ассимилируемые источники углерода, азота и неорганических солей (см. ЕР177682). Согласно процедуре, описанной в вышеуказанном патенте, в процессе выделения антибиотического комплекса, основные факторы которого получили названия фактор А, фактор В, фактор В0, фактор В1, фактор РА и фактор РВ, культуральные жидкости, после фильтрации или после предварительной очистки подвергали аффинной хроматографии на неподвижном D-аланил-Dаланине. Идентифицированные к настоящему времени факторы антибиотика А 40926 можно описать формулой (II) ниже, где R¢1 представляет собой водород, X¢ - гидрокси. Y¢ - карбокси, R¢2 представляет собой (С9-С12)алкильную гр уппу, а М¢ представляет собой a-D-маннопиранозил или 6-0ацетил-a-D-маннопиранозильную группу: O Cl O (5 6) O HO O (63) X H N O O O H N NH O (38) N H Cl ZO HO OM H N NH (3) O O R1 N-CH 3 (15) O OH OH ,(I) где: R1 представляет собой водород или защитную группу аминогруппы; R2 представляет собой (С9-С12)алкил; М представляет собой водород, a-D-ма-ннопиранозил или 6-0-ацетил-a-D маннопиранозил; Y представляет собой карбокси, (С1-С4)алкоксикарбонил, аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1-С4)-алкиламино или гидроксиметила; Х представляет собой гидрокси или аминный остаток формулы: -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, где: R3 представляет собой водород или (С1-С4)алкил; alk1, alk2 и alk3 каждый независимо представляет собой линейный или разветвленный алкилен с 210 атомами углерода; р и q являются целыми числами, которые независимо друг от друга могут иметь значения 0 или 1; R4 и R5 независимо представляют собой водород, (С1-С4)алкил, или R3 и R4 вместе представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота, при условии, что р равно 1; или R4 и R5 вместе представляют собой (С2С4)алкиленовый фрагмент, соединяющий два атома азота, при условии, что р и q равны 1; W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)-алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными заместителями или одним или двумя (С1-С4)алкиламино(С 2-С4)алкильными заместителями, или же одним или двумя ди(С 1С4)алкиламино-(С2-С4)алкильными заместителями, или если и р, и q имеют значение 0, то вместе с группой -NH3-alk1 - этот радикал может также представлять собой пиперазино или 4-метилпилеразино, при условии, что когда Х представляет собой гидрокси, Y представляет собой гидроксиметил; Z представляет собой водород или группу формулы: O ' NH-C-R2 HO HO O (6B )Y ' O Cl O (56) O HO O (63 ) X ' H N O O O H N NH O N H Cl NH O (38) HO HO H N (3) OM ' O R '1 N-CH 3 (15) O OH OH , (II) Конкретно, факторы А антибиотика А 40926 является соединением вышеуказанной формулы (II), где R¢1 - водород, X¢ - гидрокси, Y¢ - карбокси, R¢2 представляет собой n-децил, а М¢ представляет собой a-D маннопиранозил. Согласно самым последним исследованиям, вещество, идентифицированное как антибиотик А 40926 в вышеуказанном патенте ЕР-177882 в действительности 7 41283 состоит из двух близких компонентов. Фактор В0 антибиотика А 40926 в действительности является основным компонентом фактора В и соответствует соединению вышеуказанной формулы (II), где R¢1 - водород, X¢ - гидрокси, Y¢ - карбокси, R¢2 представляет собой 9-мотилдецил, а М¢ представляет собой a-D-маннопиранозил. Второстепенный компонент фактора В называется фактором В1 и отличается от фактора В0 только тем, что R¢2 представляет собой n-ундецил (см. Е. Рива и др., "Cromatographia", том 24, с. 295, 1987). Фактор PA и фактор РВ антибиотика А 40926 отличаются от соответствующих фактора А и В тем, что маннознаягруппа у них замещена на 6-0ацетил-a-D маннопиранозную группу. Факторы РА и РВ антибиотика А 40926 по меньшей мере при определенных условиях ферментации, являются основными антибиотическими продуктами микроорганизма, продуцирующего А 40926. Факторы А и В антибиотика А 40926 в основном являются продуктами трансформации факторов РА и РВ антибиотика А 40926, соответственно, и часто уже присутствуют в культуральных средах. Все сахарные фрагменты соединены с ядром антибиотика А 40926 посредством 0-гликозидных связей. Обнаружено, что фактор РА антибиотика А 40926 можно трансформировать в фактор А антибиотика А 40926, а фактор РВ антибиотика А 40926 можно трансформировать в фактор В антибиотика А 40926 в щелочной среде, где происходит удаление ацетильной группы маннозного фрагмента без смещения ацильной группы на аминоглюкуронильном фрагменте. В результате, если культуральную среду или антибиотик А 40926 содержащий ее экстракт, оставить на некоторое время при щелочных условиях (напр., в водном растворе нуклеофильного основания при рН>9 в течение ночи), то можно получить антибиотик A 40926, насыщенный фактором А и фактором В антибиотика А 40926. Фактор А антибиотика А 40926 можно получить из комплекса А 40926 путем хроматографического разделения с помощью способа, описанного в ЕР-177882. Чистый фактор В0, который в вышеописанных условиях (согласно патенту ЕР177882) составляет около 90% фактора А, можно получить путем дальнейшей очистки фактора В, например, несколько раз проведя хроматографию с обращенной фазой. Новейшие исследования (Л. Зерилли и др., "Rapid Communications mass Spectrometry", том 6, с. 109, 1992) показали, что в антибиотическом комплексе А 40926 присутствуют также некоторые второстепенные факторы, которые идентифицируют с акронимами А1, RS-1, RS-2 и RS-3, соответственно. Эти второстепенные факторы разделили с помощью ВЭЖХ, а стр уктуры этих факторов определили с помощью газовой хроматографии/масс-спектрометрического анализа метанолизатов комплекса А-40926. Все вышеуказанные второстепенные факторы имели структуры, соответствующие стр уктурам основных факторов А, В0 и В1, за исключением того, что остатки жирных ки слот были связаны с аминоглюкуронильным фрагментом. В частности, со ссылкой на формулу (II) радикалы R¢1, X¢ и Y¢ имеют выше указанные значения, а R¢2 представляет собой 8-метилнонил в факторе А1, 7-метилоктил в факторе RS-1, nнонил в факторе RS-2 и n-додецил в факторе RS-3. Несмотря на то, что в препаратах антибиотического комплекса А 40926, полученных с использованием условий, описанных в ЕР 177882, сильно преобладают факторы, где R¢2, представляет собой (С10-С11)алкил, можно изменить условия ферментации с тем, чтобы повысить содержание второстепенных компонентов, в которых R¢2 представляет собой C9 или С 12алкил. В процессе обычной очистки антибиотического комплекса А 40926 факторы РА и РВ обычно преобразуются в факторы А и В. Кроме того было обнаружено, что можно трансформировать антибиотический комплекс А 40926, отдельные его факторы или смесь этих факторов в любой пропорции в соответствующий N-ациламиноглюкуронилагликоновый комплекс АВ, -ациламиноглюкуронилагликоновый фактор А, N-ациламиноглюкуронилагликоновый фактор В и маннозилагликон антибиотика А 40926 путем контролируемого кислотного гидролиза одного из сахарных фрагментов исходного материала (см. ЕРА-240609 и EP-A-228015). Предпочитаемые условия гидролиза для получения N-ациламиноглюкуронилагликонов предполагают использование смеси диметил-сульфоксид/концентрированная соляная кислота в соотношении от 8:2 до 9,5:0,5 при температуре от 40°C до 80°C. N-ациламиноглюкуронилагликоны антибиотика А 40926 выражаются вышеуказанной формулой (II), где R¢1 и М¢ представляют собой атомы водорода, X¢ - гидрокси, Y¢ - карбокси, a R¢2 представляет собой (С9-С12)алкил. Полное отщепление всех сахарных фрагментов антибиотика А 40926 дает агликон. Этот процесс гидролиза описан в ЕР-А-240609. Антибиотический комплекс A 40926, его факторы, соответствующие N-ациламиноглюкуронилагликоны, маннозилагликоны, агликон и их смеси в любой пропорции проявляют основную активность против грамположительных бактерий и Neisseriae. В заявке на международный патент № РСТ/ЕР92/00374 заявлен приоритет, согласно ЕР сер. № 91104857, на эфирные производные антибиотика А 40926 (эстерифицированные в положении 6B, т.е. карбоксильная группа присутствует на N-ациламиноглюкуронильном фрагменте) и описан N-ациламиноглюкуронилагликон этого антибиотика; напр., соединения формулы (II), где X¢ является ОН, Y¢ является (С1-С4)алкоксикарбонил, а R¢1, R¢2 и М¢ имеют те же значения, что и радикалы R1, R2 и М, описанные выше. Эти эфирные производные получают путем взаимодействия аминного субстрата А 40926, имеющего защитн ую группу в N15 (в настоящем описании термин "N15" относится к атому азота в аминогруппе, присоединенному к атому углерода молекулы А 40926, который обычно обозначается 8 41283 номером 15) или не имеющего такой группы N15, или деманнозильного производного этого вещества (т.е. N-ациламиноглюкуронилагликона) с алканолом в кислой среде, или производного А 40926 с защитной группой в N15, или его деманнозильного аналога, с алкилгалогенидом (предпочтительно, бромидом, хлоридом или иодидом), возможно, в присутствии акцептора галогеноводородной кислоты, в частности, при избытке выбранного алканола в присутствии концентрированной минеральной кислоты при температуре от 0°С до комнатной. Эти эфирные производные антибиотика А 40926, полученные вышеупомянутым способом, используются в качестве исходных материалов для получения производных формулы (I) антибиотика А 40926. Контролируемая эстерификация, используемая для получения эфирных производных антибиотика А 40926 и эфирных производных деманнозильного антибиотика А 40926, которые являются исходными материалами для получения соединений по изобретению, включает реакции эстерификации, в ходе которых субстрат А 40926 соединяют с избытком выбранного алканола в присутствии концентрированной минеральной кислоты при температуре от 0°C до комнатной в течение периода времени, длительность которого зависит от стерической сложности группы, которую предстоит ввести. В некоторых случаях удобно ввести защитн ую группу в аминогруппу в положении 15 предшественника А 40926 с тем, чтобы по возможности избежать нежелательных побочных реакций. Это можно осуществить известными способами, например способами, описанными в таких справочниках, как Т.У. Грин "Protective Groups Organic Syntgesis", изд-во "Джон Уили энд Санз", НьюЙорк, 1981 и М. Макоми "Protecting Groups in Organic Chemistry", изд-во "Пленум Пресс", НьюЙорк, 1973. Эти защитные группы должны проявлять стабильность в условиях реакционных процессов, они не должны мешать протеканию основной реакции и должны обладать такими свойствами, которые позволяют легко удалить эти группы в конце основной реакции. В числе подходящих аминозащиных групп такие группы, как трет-бутоксикарбонил (t-BOC), карбобензилокси (CBz) и арилалкил. Бензилирование с возможно замещенными бензилгалогенидами в присутствии основания протекает гладко с количественным выходом и приводит исключительно к образованию соответствующего N15бензильного производного без сопутствующего образования бензилового эфира карбоксильных групп. Селективную защиту аминогруппы в положении 15 можно осуществить посредством взаимодействия с бензилбромидом в присутствии акцептора галоидоводорода (т.е. третичного амина) без сопутствующей эстерификации двух карбоксильных гр упп. Удаление защитных гр упп в N15 производят одним из известных способов удаления аминозащитных гр упп, но предварительно необходимо оценить химическую активность других групп, присутствующи х в молекуле. Исходное эфирное соединение формулы (II), где М¢ представляет собой a-D-маннопиранозил или 6-0-ацетил-a-D маннопиранозил, а Y¢ представляет собой С(С 1-С4)алкоксикарбонил, можно преобразовать в соответствующее соединение, в котором М¢ - водород, посредством селективного кислотного гидролиза. Как описано в ЕР-А-240609, для проведения гидролиза для получения деманнозильных производных антибиотика А 40926 (напр., N-ациламиноглюкуронилагликона) предпочтительно использовать смесь диметилсульфоксида с концентрированной соляной кислотой в соотношении от 8:2 (%) до 9,5:0,5 (%) при температуре от 40 до 80°С. Соответственно, деманнозильные производные эфиров А 40926 можно получить в смеси с соответствующим агликоном и разделить посредством препаративной ВЭЖХ. Условия проведения гидролиза можно изменять с тем, чтобы получать различные соотношения продуктов реакции. Например, если в качестве исходного материала использовать А 40926, эстерифицированный в положении 6В, увеличить соотношение растворитель/соляная кислота до 78:1, поддержать температуру реакции ниже 60°С и увеличить время протекание реакции до около 7 дней, то отношение искомых деманнозильных производных А 40926, эстерифицированного в положении 6В к нежелательному агликону А 40926 будет приблизительно составлять 1,4:1,0. Ход реакции контролируют с применением ВЭЖХ с помощью одного из известных способов. На основе результатов этих анализов специалист может дать оценку ходу реакции и решить, когда следует остановить реакцию и приступить к обработке реакционной смеси известными способами, включающими, например, экстрагирование растворителями, осаждение нерастворившихся компонентов, последующее разделение и очистку с применением хроматографии. Эфирные производные, используемые в качестве исходных материалов для получения соединений формулы (I) могут представлять собой индивидуальные соединения, соответствующие каждому из нескольких факторов предшественника антибиотического комплекса А 40926, или смеси из двух или более компонентов в любой пропорции соответствующи х различным факторам предшественника А 40926. Указанные смеси эфирных производных можно получить при использовании комплекса А-40926, или смеси факторов предшественника комплекса А 40926 в процессе получения эфира в 6В, или с помощью особых условий выделения/очистки полученного эфирного продукта (изменение этих условий может изменять начальные пропорции, факторов, характерные для предшественника комплекса А 40926), или же посредством смешивания в нужных пропорциях чистых эфирных продуктов, выделенных хроматографией с обращенной фазой или полученных при использовании чистых факторов А 40926 в качестве предшественников. В настоящем описании и формуле изобретения термин "алкил", взятый отдельно или в комбинации с другими заместителями, включает углероводородные группы с прямой и разветвленной цепью; более конкретно, термин "(С1-С4)алкил" 9 41283 обозначает алифатический углеводород с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода, такой, как метил, этил, пропил, 1-метил-этил, бутил, 1-метилпропил, 1,1-диметилэтил и 2-метилпропил. В настоящем тексте термины "alk1", "alk2", "alk3" обозначают алкилен с прямой или разветвленной цепью, содержащий 2-10 атомов углерода, такой, как, например: согласно вышеприведенному определению: -NH-(CH2)2-NH2 -NH-(CH2)3-NH2 -NH-(CH2)4-NH2 -NH-(CH2)5-NH2 -NH-(CH2)2-N(CH3)2 -NH-(CH2)3-N(CH3)2 -NH-(CH2)2-N(C2H5)2 -NH-(CH2)7-N(CH3)2 -NH-(CH2)2-N(C4H9)2 -NH-(CH2)3-N(C2H5)2 -NH-(CH2)3-N(C4H9)2 -N(CH3)-(CH2)2-NH2 -N(CH3)-(CH2)3-NH2 -N(CH3)-(CH2)2-N(CH3)2 -N(CH3)-(CH2)3-N(CH3)2 -NH-(CH2)2-NH-(CH2)2-NH2 -NH-(CH2)2-NH-(CH2)3-NH2 -NH-(CH2)2-NH-(CH2)4-NH2 -NH-(CH2)4-NH-(CH2)2-NH2 -NH-(CH2)3-NH-(CH2)4-NH2 -NH-(CH2)2-NH-(CH2)3-NH-(CH2)2-NH2 -NH-(CH2)2-NH-(CH2)4-NH-(CH2)2-NH2 -NH-(CH2)3-NH-(CH2)3-NH-(CH2)3-NH2 -NH-(CH2)3-NH-(CH2)4-NH-(CH2)3-NH2 -NH-(CH2)2-NH-(CH2)3-NH-(CH2)4-NH2 -NH-(CH2)4-NH-(CH2)3-NH-(CH2)4-NH2 -NH-(CH2)3-NH-(CH2)9-NH-(CH2)3-NH2 -NH-(CH2)3-NH-(CH2)10-NH-(CH2)3-NH2 -NH-(CH2)2-[NH(CH2)2]2-NH2 -NH-(CH2)3-[NH(CH2)3]3-NH2 -NH-(CH2)2-N[(CH2)2NH2]2 -NH-(CH2)3-N[(CH2)2NH2]2 -NH-(CH2)2-N[(CH2)3NH2]2 -NH-(CH2)2-N[(CH2)4NH2]2 -NH-(CH2)3-N[(CH2)3NH2]2 -NH-(CH2)4-N[(CH2)2NH2]2 -NH-(CH2)4-N[(CH2)3NH2]2 -NH-(CH2)2-N[(CH2)2N(CH3)2]2 -NH-(CH2)2-N[(CH2)3N(CH3)2]2 -NH-(CH2)3-N[(CH2)2N(CH3)2]2 -NH-(CH2)3-N[(CH2)3N(CH3)2]2 -NH-(CH2)2-N[(CH2)2N(C2H5)2]2 -N(CH3)(CH2)2-N[(CH2)2NH2]2 -СН2-СН2-, -СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-, -СH2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-, -СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2 -NH-(CH2)n-CH3 n=0, 1, 2, 3, 4 or 5 Термины "(С2-С4)алкильные фрагменты" и "(С2-С4)алкиленовые фрагменты" в настоящем тексте обозначают алифатические фрагменты с прямой или разветвленной цепью, содержащей 24 атома углерода. Примеры таких фрагментов содержатся в вышеприведенном списке. Выражение "(С1-С4)алкоксикарбонил" включает алкоксикарбонильные группы с прямой и разветвленной цепью, такие, как, напр., метоксикарбонил, этоксикарбонил, пропиксикарбонил, изопропилоксикарбонил, бутоксикарбонил, изобутоксикарбонил и трет-бутоксикарбонил. Ниже представлены некоторые примеры аминных остатков: n=0, 1, 2, 3, 4 or 5 m=0, 1, 2 or 3 n=0, 1, 2 or 3 n=0, 1, 2 или 3 -NH-(CH2)n-NHCH3 n=2, 3 или 4 -NH-(CH2)n-NHiC3H7 -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, 10 41283 n=2, 3 или 4 N n=1, 2 или 3 N NH CH2 CH (CH2 )2 N(CH3)2 CH3 NH(CH2)3N n=1, 2 или 3 -NH(CH3)-(CH2)n-NHCH3 n=2, 3 или 4 -N(CH2)n-NHC2H5 n=2, 3 или 4. -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W идентифицирует следующие гр уппы: N CH3 NH(CH2) 2N NH(CH2) 2N N(CH2) 2NH2 NH(CH2) 3N NH(CH2) 2N N(CH2) 2NH2 N(CH2) 3NH2 NH(CH2) 3N N N N (CH2)2 N N CH3 N N (CH2)3 N (CH2)4 N CH3 CH3 NH2 CH3 CH3 N N C2H5 N(CH2)3N CH3 CH3 где R3, R4 и R5 представляют собой водород; аlk1, alk2, и аlk3 каждый независимо представляет собой, линейный или разветвленный алкилен с 2-4 атомами углерода; р и q являются целыми числами, которые независимо друг от др уга равны нулю или 1; W представляет собой водород, (С1-С4)алкил, амино, (С1-С4)алкиламино, ди(С1-С4)алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)алкильными фрагментами или одним или двумя (С1-С4)алкиламино-(С2-С4)алкильными фрагментами, или же одним или двумя ди(С 1-С4)алкиламино-(С2-С4)алкильными фрагментами, или, когда оба р и q равны 0, то вместе с фрагментом –NR3-alk1- этот радикал может представлять собой пиперазино или 4-метилпиперазино, при условии, что когда Х представляет собой гидрокcи, Y представляет собой гидроксиметил; CH3 (CH2)3 C2H5 -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, N(CH2) 3NH2 N N NH NCH3 NH(CH2)2N (CH2) 4 NH Настоящее изобретение охватывает отдельные соединения формулы (I), получаемые из отдельных факторов, предшественника антибиотического комплекса А 40926, а также смеси соединений формулы (I), полученных из самого комплекса А 40926 или из смеси двух или более факторов в любой пропорции. Соответственно, варианты пропорциональных соотношений компонентов смесей соединений формулы (I), соответствующи х факторам комплекса А 40926, получают в результате использования различных условий ферментации, восстановления, выделения и очистки предшественника антибиотического комплекса А 40926, или в результате смешивания отдельных выделенных факторов исходных эфиров формулы (II) в нужных пропорциях до их преобразования в соединения формулы (I), или же в результате смешения чистых индивидуальных факторов соединений по изобретению формулы (I) в нужных пропорциях. Предпочитаемыми соединениями по изобретению являются соединения формулы (I), где: R1 представляет собой водород или защитную группу аминного фрагмента; R2 представляет собой (С9-С12)алкил; M представляет собой водород,a-D маннопиранозил или 6-0-ацетил-a-D маннопиранозил; Y представляет собой карбокси, (С1-C4)алкoкcикарбoнил, аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбранный из гидрокси, амино, (С1-С4)алкиламино и ди(С1-С4)алкиламино или гидроксиметила; Х представляет собой гидрокси или аминный остаток формулы: Когда R3 и R4 (или R4 и R5) вместе представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота, то насыщенный гетероциклический фрагмент, образованный в комбинации с частями alk1 (или аlk2) и двумя соседними атомами азота, предпочтительно, представляет собой пиперазиновое кольцо. Например, когда R3 и R4 (или R4 и R5) вместе представляют собой (С2-С4)алкиленовый фрагмент, соединяющий два атома азота, или когда оба р и q равны 0, W вместе с фрагментом –NR3 -alk1- представляет собой пиперазино или 4-метилпиперазино, то аминный остаток формулы: N N NH 11 41283 Z представляет собой водород или группу формулы: ют выше указанные значения, а Х представляет собой аминный остаток формулы: -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, P A N где: R3, R4, R5, alk1, alk2, alk3 p, d и W имеют значения, приведенные в начале описания, получают посредством амидирования соответствующи х производных формулы (II) выше, где R¢1 , R¢2 и М¢ имеют те же значения, что и R 1, R2 и М, X¢ представляет собой гидрокси, а Y¢ является (С1-С4)алкоксикарбонилом. Эти исходные материалы формулы (II) получают вышеописанным способом, а некоторые примеры этих соединений описаны в упомянутой заявке на международный патент № РСТ/ ЕР92/00374. Процесс амидирования включает конденсацию указанных исходных материалов формулы (II) соответствующим амином формулы (III): 3 где АΘ представляет собой анион минеральной или органической кислоты ми когда присутствует карбоксикислотная группа в оставшейся части антибиотика, этот радикал может представлять собой внутренний анион, получаемый из указанной карбоксикислотной группы; и фармацевтическиприемлемые соли этих соединений. Другая предпочитаемая группа соединений по изобретению включает те производные формулы (I), где R2 представляет собой (С10-С11)алкил, М представляет собой a-D-маннопиранозил, а R1, X, Y и Z имеют вышеприведенные значения, и фармацевтически-приемлемые соли этих соединений. Следующая предпочитаемая группа соединений по изобретению охватывает те соединения формулы (I), где: R1 представляет собой водород или защитную группу аминогруппы, предпочтительно водород; R2 представляет собой 7-метилоктил, n-нонил, 8метилнонил, n-децил, 9-метилдецил, n-ундецил, или n-додецил, предпочтительно, n-децил, 9-метилдецил или n-ундецил, лучше всего - 9-ме-тилдецил; М представляет собой водород или a-D-маннопиранозил, предпочтительно a-D-маннопиранозил; Y представляет собой карбокси, (С1-С4)алкоксикарбонил, аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может быть заместитель, выбираемый из гидрокси, амино, (С1-С4)алкиламино или ди(С1-С4)алкиламино или гидроксиметила, предпочтительно, карбокси, метоксикарбонил, аминокарбонил, метиламинокарбонил, диметиламинокарбонил, (диметиламино)этиламинокарбонил или гидроксиметил; Х является aминным остатком -NR3-alk1-(NHalk2)P-(NH-alk3)q -W, где R3 является водородом; alk1, alk2 и аlk3 независимо представляют собой линейный алкилен с 2-4 атомами углерода; р и q, каждый независимо равны 0 или 1; W представляет собой амино, (С1-С4)алкиламино, ди(С1-С4)-алкиламино, аминогруппу, замещенную одним или двумя амино-(С2-С4)-алкильными фрагментами или, когда р и q равны 0, то вместе с фрагментом –NR3-alk1- этот радикал может представлять собой пиперазино или 4-метилпилеразино; лучше всего, чтобы Х представлял собой аминный остаток, выбираемый из: N -NHR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, (III) где: R3, R4, alk1, alk2, alk3, p и q и W вышеуказанные значения, в присутствии конденсирующего агента, или через образование "активированного эфира" указанной исходной С 63 карбоновой кислоты формулы (II) в инертном органическом растворителе. Для реакции амидирования используют те инертные органические апротонные растворители, которые не оказывают неблагоприятного действия на ход реакции и по меньшей мере частично растворяют исходные материалы. Примеры таких инертных органических растворителей включают органические амиды, эфиры гликолей и полиолов, фосфорамиды и сульфоксиды. Предпочтительными органическими растворителями являются, например, диметилформамид, диметоксиэтан, гексанметилфосфорамид, диметилсульфоксид и их смеси. Конденсирующим агентом в процессе по изобретению является агент, подходящий для образования амидных связей в органических соединениях, и, в частности, в синтезе пептидов. В числе примеров конденсирующих агентов диизопропилкарбодиимид (DIC), дициклогексилкарбодиимид (DCC) в присутствии гидроксибензотриазола (НВТ), бензотриазолилокси-трис-(диметиламино)фосфонийгексафторфосфа т, бензотриазолилокси-трис-(пирролидино)фосфоний-гексафторфосфат и (С1-С4)алкил, фенил или гетероциклические фосфоразидаты, такие, как дифенилфосфоразидат, диэтилфосфоразидат, ди-(4ниьрофенил)фосфоразидат, димофолилфосфоразидат и дифенилфосфорохлорат. Предпочитаемыми конденсирующими агентами являются дифенилфосфоразидат, т.е. ди фенилэфиразид фосфорной кислоты (DPPA), бензотриазолилокситрис-(диметиламидо)фосфоний-гексафторфосфа т (ВОР) и бензотриазолалокси-трис(пирролидино)фосфиний-гексафторфосфа т (РуВОР). Из двух последних конденсирующи х агентов РуВОР является наиболее предпочтительным, поскольку получаемый побочный продукт, пирролидин, обладает меньшей токсичностью, чем диметиламин. N CH3 Z представляет собой водород; и фармацевтически-приемлемые соли этих соединений. Соединения формулы (I), где Y представляет собой (С1-С4)-алкоксикарбонил, R1, R2, М и Z име 12 41283 В процессе амидирования по изобретению, аминный реактив обычно используется в мольном избытке, хотя в некоторых случаях реакцию можно проводить, получая хороший выход, и при использовании аминного реактива в эквимолярном соотношении или при слабом молярном избытке, в частности, если в качестве конденсирующи х. а гентов используются ВОР или РуВОР. В общем, если аминный реактив достаточно недорогой или легкодоступен, используют 2-х-10тикратный избыток амина (III), хотя предпочтительным является 3-х-4-хкратный избыток. Для амидирования вышеуказанного исходного материала формулы (II) амином (III) в присутствии конденсирующего агента, необходимо, чтобы аминный реактив был способен образовывать соль с карбоксильной группой (Х¢=гидрокси ) исходного материала. В том случае, когда аминный реактив недостаточно сильный для образования такой соли в реакционной среде, необходимо добавить солеобразующее основание (напр., третичный алифатический или гетероциклический амин, такой, так триэтиламин, N-метилпирролидин или Т-метилпиперазин, который не может образовывать амидную связь с карбоксильной группой), солеобразующее основание добавляют в, по меньшей мере, эквимолярном количестве по отношению к исходному материалу. Использование аминного реактива в низкомолекулярном избыточном количестве с добавлением солеобразующего основания наиболее целесообразно в те х случаях, когда аминный реактив очень дорого стоит или его трудно достать. В числе примеров вышеуказанных солеобразующи х оснований третичные органические алифатические и гетероциклические амины, такие, как триметиламин, триэтиламин, N-метил-пирролидин или пиколин и т.п. Конденсирующий агент обычно используется в эквимолярном количестве или при слабом молярном избытке, например, от 1,1 до 1,7 раз, предпочтительно в 1,2-1,5 раз по отношению к исходному соединению А 40926. В частности, отмечено, что при использовании исходных материалов формулы (II), где Y¢ представляет собой (С1С4)алкоксикарбонил, и РуВОР в качестве конденсирующего агента в большом избытке (напр., в 3хкратном молярном избытке) и при большом избытке аминного реактива (напр., 6-ти-10кратном молярном избытке), конечные амидные продукты формулы (I), где Z представляет собой: P третичный алифатический или- гетероциклический амин, который не способен образовывать амидную связь с карбоксильной группой, в отличии от други х вышеперечисленных оснований. Фактически использование солей амина, с последующим высвобождением амина на месте при помощи указанного основания является предпочтительным способом, особенно в тех случаях, когда соль является более стабильной, чем соответствующий свободный амин. Температура реакции может быть различной в зависимости от типа исходных материалов и условий протекания реакции. В целом предпочтительно проводить реакцию при температурах от 0 до 30°С. Время протекания реакции тоже может быть различным и зависит от типа конденсирующего агента и других параметров реакции. Обычно реакция конденсации завершается в течение периода времени составляющего от одного часа до 2448 часов. В любом случае ход реакции контролируют с помощью тонкослойной хроматографии или, предпочтительно, ВЭЖХ с использованием любого известного способа. На основе результатов хроматографических анализов специалист может оценить ход реакции и решить, когда следует остановить реакцию и приступить к обработке реакционной смеси по любому известному способу, например, такой способ может включать экстрагирование растворителями, осаждение путем добавки осадителей и т.п., с последующим разделением и очисткой, напр., с применением колоночной хроматографии. Обычно при использовании конденсирующи х агентов типа тех, которые перечислены выше, отпадает необходимость в защите аминогруппы в N15 исходного эфира формулы (II). Однако, иногда желательно использовать исходные эфиры, имеющие соответствующую защитную гр уппу, в частности в тех случаях, когда эти эфиры получены непосредственно на предыдущем этапе реакций, в ходе которого эфиры получают из предшественника антибиотика A 40926. Более того, могут быть и другие случаи, когда условия реакции амидирования требуют, или по меньшей мере предполагают защиту аминогруппы в N15 исходного эфира формулы (II). В указанных случаях введение защитной группы в положение N15 аминогруппы производят одним из известных способов, которые описаны в справочниках и упомянуты в настоящем описании в связи с защитой предшественника А 40926 для получения эфиров формулы (II), где Y¢ представляет собой (С1-С4)алкоксикарбонил. N-защитные группы должны проявлять стабильность в условиях реакции, они не должны оказывать неблагоприятного действия на протекание реакции амидирования, они должны обладать такими свойствами, которые позволят легко удалить эти группы из реакционной среды в конце реакции, не вызывая изменений в новообразованной амидной связи и в общей структуре соединений, напр., сахарных фрагментах. Примерами N-защитных групп, которые можно с успе хом использовать в процессе по изобретению для защиты первичных аминогрупп в положе A N 3 где АΘ имеет вышеуказанное значение, получают почти количественные выходы. Аминный реактив можно ввести в реакционную среду и в виде соответствующей кислой соли, например, гидрохлорида. В этом случае аминный реактив добавляют по меньшей мере в двойной молярной пропорции, а сильное основание, способное высвобождать амин из соли, добавляют при 2-х-4хкратном молярном избытке. В этом случае подходящим основанием является обычно 13 41283 нии N15 исходных эфиров и, при необходимости для защиты любых други х аминогрупп, которые не должны вступать в реакцию амидирования, являются карбамат-образующие реактивы, характеризующиеся следующими оксикарбонильными группами: 1,1-днметилпропилилоксикарбонил, третбутилоксикарбонил, винил-оксикарбонил, циннамилоксикарбонил, бензилоксикарбонил, р-нитробензилоксикарбонил, 3,4-диметокси-6-нитробензилоксикарбонил, 2,4-дихлорбензилоксикарбонил, 5-бензизоксазолилметилоксикарбонил, 9-антранилметилоксикарбонил, дифенилметилоксикарбонил, изоникотиноилоксикарбонил, дифенилметилоксикарбонил, S-бензилоксикарбонил и т.п. Обычно эти защитные группы можно удалить после завершения реакции амидирования посредством обработки сильными органическими кислотами, такими, как трифторуксусная кислота (ТFА) или разбавленными минеральными кислотами. Чтобы избежать опасности гидролиза сахарных фрагментов, присоединенных к ядру молекулы антибиотика, можно также производить удаление некоторых защитных гр упп в различных условиях, таких, как каталитическое гидрирование, используя, например, палладий на углероде в качестве катализатора. Иначе можно удалить аминозащитные группы из числа вышеуказанных групп путем контролируемого подкисления, напр., при низких температурах и/или сокращенном времени взаимодействия. Когда реакцию амидирования осуществляют через промежуточное образование "активированного эфира" исходного соединения формулы (II), такой "активированный эфир" обычно образуется на место или, в альтернативном варианте, такой эфир сначала выделяют, а затем взаимодействуют с амином формулы (III). При этом в аминогруппу в положении N15 исходного материала формулы (II) сначала вводят защитную гр уппу, чтобы избежать какого-либо взаимодействия между реактивом, активирующим образование эфира, и аминогруппой в N15. Защиту аминогруппы можно обеспечить любым из известных способов, которые описаны выше. Образование "активированных эфиров" карбоновых кислот в общи х черта х описано в работе Физер и Физер, "Reagent for organicsynthesis" изд. "Джон Уили энд Санз", стр. 129-130 (1967). Примеры указанных реактивов, образующи х активированные эфиры, которые могут быть использованы в процессе по изобретению, приведены в работе Р. Швизер и др. "Helv. Chim. Acta", 1955, 38, 69-70 и включает те эфирные производные формулы (II), где X¢ представляет собой CH2CN, CH2COOC2H5, СН2(СООС 2H5) 2,СН2СОСН3: CH 2 ClCH2 NO2 , ClCH2 CH2 N(C2H5)2, соответственно, в присутствии акцепторов кислоты в растворителе. Предпочитаемым реактивом этого типа является хлоацетонитрил. В этом случае сам хлорацетонитрил, диметилформамид, (ДМF) или диметилсульфоксид (DMSO) используют в качестве предпочитаемых растворителей. Обычно для образования "активированных эфиров" используют инертные органические апротонные растворители, которые не оказывают нежелательного действия на ход реакции и способны, по меньшей мере частично, растворять карбоновые кислоты, являющиеся исходным материалом. Примеры таких инертных органических растворителей включают органические амиды, эфиры гликолей и полиолов, фосфорамиды, сульфоксиды и ароматические соединения. Предпочтительными органическими растворителями являются деметилформамид, диметоксиэтан, гексаметилфосфорамид, диметилсульфоксид, бензол, толуол и их смеси. Более предпочтительными растворителями являются ацетонитрил, диметилсульфоксид, диметилформамид. Получение активированного эфира обычно осуществляют в присутствии основания, которое не вступает в реакцию, такого, как триалкиламин, напр., триэтиламин, карбонат или бикарбонат натрия или калия. Обычно основание применяют в 2х-6тикратной молярной пропорции к исходному материалу и, предпочтительно оно используется приблизительно в трехкратном молярном избытке. Предпочитаемым основанием является триэтиламин. Реактив, образующий "активированный эфир", используется в большом избытке по отношению к исходному материалу формулы (II), содержащему карбоновую кислоту в С 63. Обычно этот реактив используется в 5-35 молярной пропорции, предпочтительно в 20-30 кратном молярном избытке. Реакций проводят при температуре от 10 до 60°C, предпочтительно при 15-30°С. Как обычно, время протекания реакции зависит от других параметров реакции и может варьироваться от 3 до 48 часов. Ход протекания реакции контролируют с помощью ВЭЖХ или тонкослойной хроматографии, чтобы определить момент завершения реакции и приступить к восстановлению искомого промежуточного соединения. Промежуточный "активированный эфир" можно непосредственно использовать в той же реакционной среде, где он был получен, однако обычно его выделяют осаждением с применением осадителей или путем экстрагирования растворителями, после чего полученный "активированный эфир" используют на следующих этапах без последующей очистки. Однако, при желании эфир можно подвергнуть очистке с помощью колоночной флэш-хроматографий или колоночной хроматографии с обращенной фазой. Затем полученный промежуточный "активированный эфир" взаимодействуют с аминным производным формулы (III) (в молярном избытке) в присутствии органического полярного растворителя NO2 , CH2 CH2 N(C2 H5)2, которые могут быть получены из исходных материалов формулы (II), где R¢1 представляет собой соответствующую защитн ую группу, а X¢ представляет собой гидрокси, посредством взаимодействия с СlСН 2СN, ВrСН2СООС2H5, ВrСН (СООС 2H5)2, СlСН2СОСН3: 14 41283 ную группу для аминогруппы в N15. Получение указанного исходного соединения описано в Заявке на международный патент № PCT/EP92/00374 и проводится в соответствии с общим способом получения исходного эфира формулы (II), как описано выше. Обычно водо-спиртовая среда, используемая в восстановительных реакциях, упомянутых выше, представляет собой смесь воды и водорастворимого или частично смешиваемого с водой низшего алканола, причем отношение вода/низший алканол варьируется от 40/60 до 90/10 (%), предпочтительно, от 60/40 до 68/32 (%), лучше всего 65/35 (%). Хотя в некоторых случаях реакция происходит и при меньших количествах воды, напр., в смеси вода/низший, аканол 30/70 или20/80, обычно скорость протекания реакции очень низкая при соотношении вода/низший алканол ниже, чем 40/60. Предпочитаемыми низшими алканолами являются (С1-С4)алкильные спирты с линейной или разветвленной цепью, среди которых наиболее предпочтительны n-бутанол, этанол и метанол. Иногда в отдельных случаях добавляют небольшие количества полярного сорастворителя для того, чтобы полностью растворить исходный материал в ходе реакции, напр., N,N-диметилформамида, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)пиримидона (DMPU), диметилсульфоксида. Иногда добавляют также различные количества диэтилового эфира, чтобы избежать ценообразования. Наиболее предпочтительным из числа боргидридов щелочных металлов является боргидрид натрия. Количество боргидрида щелочного металла может быть различным в зависимости от типа используемого растворителя и температуры, но рекомендуется использовать боргидрид щелочного металла в большом избытке по отношению к стехиометрическим требованиям так, чтобы рН реакционной смеси была нейтральным или щелочным, предпочтительно рН от 7 до 10. В общем мольное отношение между боргидридом щелочного металла и исходным материалом для антибиотика составляет от 50 до 300. Температура реакции может существенно варьироваться в зависимости от типа исходного материала и условий проведения реакции. В общем предпочтительно проводить реакцию при температуре от 0 до 40°С, лучше всего - при комнатной температуре. Время протекания реакции также может быть различным в зависимости от других параметров реакции, тем не менее время реакции необходимо тща тельно контролировать. Обычно реакция завершается приблизительно через 1-4 часа. Если продолжать реакцию в течение свыше 4-х часов, то могут произойти нежелательные побочные реакции, которые приводят к разрыву пептидных связей в ядре молекулы. В любом случае, за ходом реакции наблюдают при помощи тонкослойной хроматографии, предпочтительно, ВЭЖХ, используя известные способы. На основе результатов хроматографических анализов любой специалист в состоянии оценить ход реакции и решить, когда ее следует прекратить и приступить к обработке реакционной массы при температуре от 5 до 60°С, предпочтительно, от 10 до 30°С. В этом случае органический полярный растворитель может быть полярным протонным или апротонным растворителем. Предпочитаемыми органическими полярными протонными растворителями являются низшие (С2-С4)алканолы, такие, как этанол, n-пропанол, изопропанол, n-бутанол и т.п., или их смеси, предпочтительно используемые в сухом виде. Предпочитаемыми органическими полярными апротонными растворителями являются N,N-диметилформамид (ДМФ), гексаметилфосфорамид (НМРА) или их смеси, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидон (DMPU) диметилсульфоксид (DMSO) или диметоксиэтан (DME). Реакцию "активированного эфира" с выбранным амином формулы (III) можно проводить при температуре от 5 до 60°C, но предпочтительно, при температуре от 10 до 30°С, лучше всего при 20-25°C, а предпочтительным молярным соотношением между промежуточным "активированным эфиром" и амином (III) является соотношение от 1:5 до 1:30, более предпочтительно от 1:10 до 1:20. Ход реакции как обычно контролируют с применением тонкослойной хроматографии или ВЭЖХ. В случае, если аминным реактивом является полиамин формулы (III), то одна или более из аминных групп этого соединения, которые не участвуют в образовании амидной связи, могут быть защищены. В эти х случаях подходящие защитные группы следует выбирать из групп, перечисленных для положения N15. Соответственно, полученные амидные производные, содержащие защитные группы в N63 затем подвергаются обработке с целью удалить эти защитные группы, удаление защитных групп производят в те х же условия х, которые описаны выше в отношении удаления защитных групп в положении 15. Соединения формулы (I), где Y представляет собой гидроксиметил, R1, R2, M, Х и Z имеют значения, приведенные в начале описания, можно получить путем восстановления соответствующих производных формулы (I), где R2 , M, X и Z имеют вышеуказанные значения, Y представляет собой (С1-С4)алкоксикарбонил, а R1 представляет собой подходящую защитн ую гр уппу для аминогруппы в N, с помощью боргидрида щелочного металла, предпочтительно, выбираемого из группы: боргидрид натрия, боргидрид калия и цианоборгидрид натрия, при температуре от 0 до 40°С в водной или водно-спиртовой среде. Удаление защитной группы аминогруппы N15 можно осуществить в вы шеописанных условиях. Использование этого способа необходимо при получении соединений формулы (I), где Y представляет собой гидроксиметил, X-гидрокси, R1, R2 и М имеют значения, приведенные в начале описания, а Z является водородом. В этом случае исходным материалом, который подвергают восстановлению в вышеописанных условия х является соединение формулы (II), где Y¢ представляет собой (С1-С4)алкоксикарбонил, X¢-гидрокcи R¢2 и М¢ имеют те же значения, что R2 и М, соответственно, а R¢1 представляет собой подходящую защит 15 41283 одним из известных способов, который включает, например, экстрагирование растворителями, осаждение путем добавки создателей и т.п., а также, при необходимости, разделение и очистку колоночной хроматографией. После завершения реакции избыток боргидрида щелочного металла удаляют путем добавки соответствующего количества кислоты, напр., (С1С4)алкил-органической кислоты, (С1-С6)алкилсульфокислоты, арилсульфокислоты и т.п., растворенной в полярном протонном растворителе, таком, как, напр., (С1-С4)алкиловый спирт. В другом варианте соединения формулы (I), где Y представляет собой гидроксиметил, R1, R2 и М имеют значения, указанные в начале описания, Х представляет собой аминный остаток: имеют вышеуказанные значения, а Х представляет собой аминный остаток формулы: -NR3-alk1-NHR4, где: R3, R4 и аlk1 имеют выше указанные значения, или: -NR3-alk1-NR4-alk2-NHR5, где: R3, R4, R5, аlk1 и alk2 имеют вышеуказанные значения, с аминным реактивом формулы (IV) или (IVa), соответственно: r-alk2-(NR5-alk3)q -W (IV) r-alk3-W , (IVa) -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, где: R5, alk2, alk3 и W имеют вышеуказанные значения, q равно 0, или 1, r представляет собой галоген, метансульфнил или тозил, в присутствии акцептора кислоты в инертном растворителе. Производные амида N63 с защитной гр уппой в N15 получают в соответствии с общим способом получения соединений формулы (I) по изобретению. Удаление защитной группы в N15-аминогруппы производят вышеописанным способом. В этом же случае алкилирование желательно или необходимо применять для того, чтобы ввести защитную гр уппу в аминогруппу (группы) помимо N15-аминогруппы амидного производного N63 формулы (I) и/или аминного реактива (IV) или (IVa), которые не участвуют в реакции алкилирования. Защитн ую группу амидов N63 можно удалить вышеописанным способом. Защитные группы, которые можно использовать во всех выше указанных реакциях, уже перечислены выше. Однако, особое внимание следует уделить удалению защитной группы из производного формулы (I), где Y является гидроксиметилом. Для этих соединений, когда защитная группа в 15 положении удаляется под воздействием кислоты, этап удаления защитной группы очень важен, поскольку происходит относительно быстрое замещение соответствующего ацилглюкозаминного фрагмента в 56 при обработке, напр., сухой трифтор уксусной кислотой (ТFА). В любом случае эти нежелательные побочные реакции можно легко свести к минимуму. Например, когда в качестве защитной группы используют трет-бутилоксикарбонил (t-BОС) можно использовать следующий способ: обработку сухой TFA в течение одной минуты при комнатной температуре или в течение 10-30 мин. при температуре от 0 до 5°С, с последующим быстрым осаждением продукта реакции диэтиловым эфиром или смесью метанол/диэтиловый эфир при 0-5°С. Наоборот, в отношении соединений формулы (I), где Y представляет собой карбокси или метоксикарбонил, замечено, что фрагмент ациламиноглюкуроновой кислоты в 56 является значительно более устойчивым к TFA. Фактически образование следов соответствующих деклюкуронильных псевдоагликонов отмечалось только через 1 час течения реакции. Однако, в данном случае удаление защитной группы t-ВОС осуществляется в течение 30 мин. где R3, R4, R5, alk1, alk2, alk3, p, q и W имеют значения, указанные в начале описания, а Z представляет собой водород, получают посредством амидирования, которое было описано выше, взаимодействуя соответствующее соединение формулы (I), где Y представляет собой гидроксиметил, Хгидрокси, R1, R2 и М имеют вышеуказанные значения, а Z представляет собой водород, с амином формулы (III), как описано выше. В этом случае реакцию амидирования можно проводить с использованием соответствующего конденсирующего агента или через промежуточное образование "активированного эфира", как описано выше в отношении получения соединений формулы (I), где Y представляет собой (С1С4)алкоксикарбонил. В целом, амидирование производных формулы (I), где Y представляет собой гидроксиметил, Х-гидрокси и Z-водород, при использовании РуВОР в качестве конденсирующего агента, дает соединения формулы (I), где Z представляет собой водород, даже в тех случая х, когда РуBОР используют в большом молярном избытке по отношению к исходной карбоновой кислоте. Когда реакцию амидирования проводят путем образования "активированного эфира" соединения формулы (I), где Х-гидрокси, Y-гидроксиметил, а Z-водород, предпочтительно ввести одну из вышеописанных защитных групп в положение N15 аминогруппы указанного соединения. Далее процесс получения соединения формулы (I), где Y представляет собой (С1-С4)алкоксикарбонил или гидроксиметил, R1, R2, М и Z имеют значения, указанные в начале описания, Х представляет собой аминный остаток: -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, где R3, R4 , R5 каждый независимо представляет собой водород или (С1-С4)алкил, alk1, alk2, alk3 и W имеют значения, указанные в начале описания р равно 1 и q равно 1 или 0, состоит в том, что производное амида N63, имеющее защитную гр уппу в N15 (в настоящем описании термин "N63" относится к атому азота в карбоксиамидной группе, которая связана с атомом углерода в молекуле А 40926 под номером 63) формулы (I), где Y, R2 , М и Z 16 41283 Другой подходящий способ удаления защитной группы t-BОС без существенного воздействия на другие части молекулы состоит в обработке сухой ТFА в дихлорметане при 0-10°С в течение 1-2 часов, с последующим осаждением продукта реакции осадителем. Соединения формулы (I), где R1, R2, М, Х и Z имеют значения, указанные в начале описания, а Y представляет собой карбокси, получают из соответствующи х соединений формулы (I), где Y представляет собой (С1-С4)алкоксикарбонил, предпочтительно, метоксикарбонил, а все другие радикалы имеют вышеуказанные значения, посредством обработки водным раствором гидроксидов щелочных металлов (напр. NаOН или КОН) при температуре от 0 до 30°С (более высокие температуры недопустимы поскольку может произойти эпимеризация на атоме углерода в 3 положении молекулы), в инертном органическом растворителе, напр., ди-(низший алкил)эфире этиленгликоля или тетрагидрофуране. Соединения формулы (I), где R1, R2, М, Х и Z имеют значения, указанные в начале описания, а Y представляет собой аминокарбонил, (С1-С4)алкиламинокарбонил, ди(С1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из гидрокси, амино, (С1С4)алкиламино и ди(С 1-С4)алкиламино, можно получить следующим способом: i) получение производных, где радикал Y и фрагмент СОХ в С63 представляют одну и ту же группу (С1-С4)алкиламинокарбонил или ди(С 1-С4)алкиламинокарбонил, где алкильный фрагмент может иметь заместитель, выбираемый из амино, (С1-С4)алкиламино и ди(С 1-С4)-алкиламино; а) амидирование антибиотического комплекса А 40926, его деманнозильного производного или его фактора (формулы (II), X¢=гидрокси , Y¢= кар-бокси, R¢1, R¢2 и М¢ имеют те же значения, что R1, R2 и М) большим избытком соответствующего амина формулы (III), где радикалы R3, R4, R5, alk1, alk2, alk3, p, q и W имеют значения, совместимые с вышеуказанными карбоксиамидными остатками Y и СОХ. Эту реакцию амидирования осуществляют в тех же условиях, которые описаны выше; ii) Получение производных, где радикал Y и фрагмент СОХ в С63 представляют собой различные карбоксамидные остатки, значение Y выбирают из аминокарбонила, (С1-С4)акиламинокарбонила, ди(С1-С4)-алкиламинокарбонила, причем алкильный фрагмент может иметь заместитель, выбираемый из амино, гидрокси, (С1-С4)алкиламино и ди(С 1-С4)алкиламино, а Х представляет собой аминный остаток, описанный в начале описания. Способ А: Амидирование соответствующего соединения формулы (I) где R1, R2, M и Z имеют значения, указанные в начале описания, Х представляет собой аминный остаток формулы: го агента (напр., РуBОР или DPPA) при вышеописанных условиях. Способ В: а) в исходное соединение (такое же, как в способе А) вводят защитную группу в положение N15 аминогруппы (например, группу tВОС или CBz); в) получают "активированный эфир" карбоксильной группы в положении 6B (напр., путем взаимодействия с хлорацетонитрилом); с) взаимодействуют фрагмент "активированного эфира" указанного соединения с соответствующим амином до получения вышеуказанного карбоксамидного остатка Y в вышеописанных условиях; d) при желании удаляют защитную группу в N15 вышеописанным способом (напр., ацидолизом или гидрогенолизом). Соединения формулы (I), где М представляет собой водород, получают вышеописанным способом при использовании соответствующи х исходных молекул формулы (II), где М¢ представляет собой водород. Кроме того, альтернативный способ получения соединения формулы (I), где М представляет собой водород, состоит в преобразовании соединения формулы (I), где М представляет собой a-Dманнопиранозил или 6-0-ацетил-a-D-маннопиранозил, в соответствующее соединение, где М представляет собой водород, путем селективного кислотного гидролиза в соответствии с условиями, описанными в ЕР-А-240609. Как описано выше, соединения формулы (I) могут состоять из отдельных соединений, соответствующих индивидуальным факторам предшественника антибиотика А 40926 или их смеси в различных пропорциях. Поскольку во многих случаях биологическая активность смесей аналогична биологической активности индивидуальных факторов, нет смысла отделять индивидуальные компоненты после получения смеси. Однако, в тех случаях, когда нужны чистые факторы формулы (I), их можно отделить из смесей с помощью колоночной хроматографии с обращенной фазой по способу, описанному в ЕР 177882. В другом варианте, их можно получить, используя исходные материалы формулы (II), содержащие отдельные соединения, соответствующие индивидуальным факторами, антибиотического комплекса. Согласно общему способу и условиям протекания описанных здесь реакций можно использовать предшественник комплекса А 40926, содержащий один из индивидуальных факторов (напр., фактор B0) в преобладающей пропорции к остальным компонентам смеси (напр., 60% по ВЭЖХ). Соответственно, соединения формулы (I), получаемые из такого предшественника посредством процесса по изобретению, если эти соединения не подвергают вышеописанному разделению, то они состоят из смесей, преобладающий компонент которых соответствуе т тому фактору, который преобладал в указанием предшественнике комплекса А 40926. Способ получения комплекса А 40926, насыщенного факторами А и/или B0, или РА и/или РB, описан, например, в ЕР-А-259781. Соединения по изобретению, обладающие щелочными свойствами могут образовывать соли с органическими и неорганическими кислотами обычными способами. -NR3-alk1-(NR4-alk2)P-(NR5-alk3)q -W, где все радикалы имеют значения, указанные в начале описания, а Y представляет собой карбокси, посредством реакции с соответствующим амином до образования вышеуказанного карбоксамидного остатка Y в присутствии конденсирующе 17 41283 Примеры подходящих солей соединений по изобретению включают соли, полученные с помощью стандартных реакций с органическими и неорганическими кислотами, такими, как напр., соляная, бромистоводная, серная, фосфорная, уксусная, трифторуксусная, трихлор уксусная, янтарная, лимонная, аскорбиновая, молочная, малеиновая, фумаровая, пальмитиновая, холевая, памовая, слизевая, глутаминовая, камфорная, глутаровая, гликолевая, фталиевая, винная, лауриновая, стеариновая, салициловая, метансульфоновая, бензолсульфоновая, сорбиновая, пикриновая, бензойная, коричная и т.п. кислоты. Соединения формулы (I), где Х представляет собой гидрокси, а Y-гидроксиметил, и соединения, где Y представляет собой карбокси, также обладают кислотной группой, которая может образовывать соли с органическими и неорганическими основаниями. Примерами оснований, которые могут образовывать соли с соединениями по изобретению, содержащими кислотные группы, являются: гидроксиды щелочных или щелочноземельных металлов, таких, как натрий, калий, кальций, магний, гидроксид бария, аммиак и алифатические, ациклические или ароматические органические амины, такие, как метиламин, диметиламин, триэтиламин, этаноламин и пиколин. Преобразование соединений по изобретению в соответствующие соли и обратный процесс, т.е. преобразование соответствующи х солей в соединения по изобретению, осуществляются обычными способами и входят в рамки настоящего изобретения. Например, соединение формулы (I) может быть преобразовано в соответствующие соли с помощью кислот или оснований путем растворения или суспендирования соединения формулы (I) в водном растворителе и добавки выбранной кислоты или основания в небольшом молярном избытке. Полученный раствор или суспензию затем лиофилизируют чтобы восстановить искомую соль. В случае, когда конечная соль нерастворима в растворителе, в котором растворимо само соеди нение по изобретению, эту соль можно восстановить фильтрацией из раствора соединения по изобретению после добавки стехиометрического количества или небольшого молярного избытка выбранной кислоты или основания. Соединение по изобретению можно получить из соответствующей соли, растворенное в водном растворителе, который затем нейтрализуют для высвобождения соединения. Затем соединение восстанавливают, например, экстрагированием органическим растворителем или преобразуют в другую соль путем добавки выбранной кислоты или основания и проведения вышеописанной обработки. В тех случаях, когда проводят нейтрализацию, необходимо обессоливание, которое осуществляют обычными способами. Например, с помощью колоночной хроматографии на полилекстрановых смолах с заданной пористостью (таких, как "Sephadex LH 20) или на силанизированном силикагеле. После элюировання нежелательных солей водным раствором, искомый продукт элюируют линейным градиентом или ступенчатым градиентом смеси воды с полярным или неполярным органическим растворителем, такой смеси как ацетонитрил-вода в соотношении от 50:50 до 100% ацетонитрила. Известно, что образование солей при использовании либо фармацевтически-приемлемых кислот и оснований, либо фармацевтически-неприемлемых кислот и оснований можно использовать в качестве способа очистки. После образования и выделения соль соединения формулы (I) можно преобразовать в соответствующее соединение не в форме соли, или в фармацевтически-приемлемую соль. Ввиду того, что соединения формулы 1 и их соли обладают схожими свойствами, то все, что относится к биологической активности соединений формулы (I), можно отнести также к фармацевтически-приемлемым солям этих соединений. В нижеследующей табл. 1 представлена серия репрезентативных соединений по настоящему изобретению. Таблица 1 № соединени я 1 2 3 Идентификационный код R1 R2 M Y X Z RA MA-A-1/B0 RA-A-1/B0 H H H (C9-C12) iC10 iC10 a-DMP a-DMP a-DMP CH2OH COOCH3 CH2OH H H H 4 MA-A-2/B0 H iC10 a-DMP COOCH3 5 6 MA-A-3/B0 MA-A-1 H H iC10 (C9-C12) a-DMP a-DMP COOCH3 COOCH3 OH NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH-(CH2)3-[NH(CH2)3]2NH2 NH(CH2)3-N[(CH2)3NH2]2 NH(CH2)3N(CH3)2 7 PyMA-A-1 H (C9-C12) a-DMP COOCH3 NH(CH2)3N(CH3)2 8 RA-A-1 H (C9-C12) a-DMP CH2OH 9 RA-A-2 H (C9-C12) a-DMP CH2OH 10 11 RA-A-3 A-A1 H H (C9-C12) (C9-C12) a-DMP a-DMP CH2OH COOH NH(CH2)3N(CH3)2 NH-(CH2)3-[NH(CH2)3]2NH2 NH(CH2)3-N[(CH2)3NH2]2 NH(CH2)3N(CH3)2 18 H H H PÅ(NC4H8)3 CH3COOΘ H H H H 41283 COOΘ COOH CONHCH3 CONH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH(CH2)3-N[(CH2)3NH2]2 NH(CH2)3N(CH3)2 PÅ(NC4H8)3 H H NH(CH2)3N(CH3)2 H a-DMP CH2OH NH(CH2)3N(CH3)2 PÅ(NC4H8)3 CH3COOΘ (C9-C12) a-DMP COOH H H (C9-C12) (C9-C12) a-DMP a-DMP CONH2 CON(CH3)2 AA-A-2/B0 H iC10 a-DMP CONH2 21 AA-A-3 H (C9-C12) a-DMP CONH2 NH-(CH2)3-[NH(CH2)3]2NH2 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH-(CH2)3-[NH(CH2)3]2NH2 NH(CH2)3-N[(CH2)3NH2]2 22 PyA-A-3 H (C9-C12) a-DMP COOH NH(CH2)3-N[(CH2)3NH2]2 23 PyAA-A-1 H (C9-C12) a-DMP CONH2 NH(CH2)3N(CH3)2 12 13 14 PyA-A-1 A-A-3/B0 ABA-A-1 H H H (C9-C12) iC10 (C9-C12) a-DMP a-DMP a-DMP 15 AD A-A-1 H (C9-C12) a-DMP 16 PyR A-A-1 H (C9-C12) 17 A-A-2 H 18 19 AA-A-1 AC A-A-1 20 H H H H H PÅ(NC4H8)3 ClΘ Å P (NC4H8)3 ClΘ Продолжение табл. 1 № соединени я 24 Идентификационный код R1 R2 M Y RA-A-4 H (C9-C12) a-DMP CH2OH 25 MA-A-4 H (C9-C12) a-DMP COOCH3 26 DM-RA-A-1 DM-RA-A1/B0 DM-MA-A-1 RA-A-1/B MA-A-1/B RA-A-1/A MA-A-1/A RA-A-1/B1 MA-A-1/B1 H (C 9-C12) H CH2OH NH(CH2)3N(CH3)2 H H iC10 H CH2OH NH(CH2)3N(CH3)2 H H H H H H H H (C 9-C12) iC10/nC11 iC10/nC11 NC10 NC10 NC11 NC11 H a-DMP a-DMP a-DMP a-DMP a-DMP a-DMP COOCH3 CH2OH COOCH3 CH2OH COOCH3 CH2OH COOCH3 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 NH(CH2)3N(CH3)2 H H H H H H H 27 28 29 30 31 32 33 34 X Z N N CH3 H N N CH3 H (NCH4H8)3=(пироллидино)3; a-DMP=a-D маннопиранозил; iC10=9-метилдецил (соответствующий фактору В0 антибиотика А 40926); nC10=n-децил (соответствующий фактору А антибиотика А 40926); nC11=n-ундецил (соответствующий фактору В 11 антибиотика А 40926); iC10/nC11=9-метилдецил и –ундецил (соответствующий фактору В антибиотика А 40926); (С9-С12)=С9-С12 алкил (соответствующий всем факторам комплекса А 40926). Производные антибиотика А 40926 проявляют активность главным образом против грамположительных бактерий. В частности, соединения по изобретению проявляют высокую активность против устойчивых к гликопептидам энтерококков и стафилококков. Антимикробная активность производных формулы (1) антибиотика А 40926, выражаемая минимальной ингибирующей концентрацией (МIС), против выбранных штаммов грамположительных бактерий была сопоставлена с антимикробной, активностью тейкопланина и антибиотического ком плекса А 40926. Для этого использовали способ разбавления микрокультуральной среды в бульоне Мюллера-Хинтона в присутствии 0,01% (м/о) сыворотки бычьего альбумина (фракция V сигма). Конечный инокулят составлял около 105 колониеобразующи х единиц/мл, а минимальная ингибирующая концентрация (MIC) была на самом низком уровне (мкг/мл), что говорило об отсутствии видимого роста через 18-24 часов инкубации при 37°C. 19 41283 На нижеследующей табл. 2 спектр антимикробной активности серии репрезентативных соединений по изобретению. Таблица 2 Минимальная ингибирующая концентрация (мкг/мл) L Организм Тейкопланин* No. Штамм (1) 165 Staph. aureus 0,25 561 Staph. aureus 8 Staph. 147 4 epidermidis Staph. 533 8 epidermidis Staph. 602 32 haemolyticus Комплекс* А/40926 Соединение 1 Соединение 2 Соединение 3 Соединение 4 RA MA-A-1/B0 RA-A-1/B0 MA-A-2/B0 0,13 8 0,13 4 0,13 1 0,13 0,13 0,25 0,5 4 4 0,25 0,13 0,13 8 4 0,13 0,06 0,25 16 8 0,5 0,13 0,25 Продолжение табл. 2 L No. (1) Организм Штамм 49 Staph. pyogenes Staph. pneumoniae Entero. faecalis Entero. faecalis Neisseria gonorrh. Esch. coli Pseudomonas aerug. Proteus vulgaris 44 149 562 997 47 4 79 Тейкопланин* Комплекс* А/40926 Соединение 1 Соединение 2 Соединение 3 Соединение 4 RA MA-A-1/B0 RA-A-1/B0 MA-A-2/B0 0,13 0,13 0,13 0,13 0,06 0,13 0,06 0,06 0,03 0,03 0,01 0,13 0,13 0,13 0,13 0,13 0,06 0,25 >128 64 16 8 8 16 32 1 2 8 16 32 >128 >128 128 >128 >128 >128 >128 128 >128 128 128 64 >128 64 >128 32 128 64 (1) Номер кода штамма в международной коллекции * Соединение для сравнения Продолжение табл. 2 L No. (1) 165 561 147 533 602 49 44 149 562 997 47 Соединение 5 Соединение 6 Соединение 7 Соединение 8 Соединение 9 Соединение 10 MA-A-3/B0 MA-A-1 PyMA-A-1 RA-A-1 RA-A-2 RA-A-3 Staph. aureus 0,06 0,13 1 0,13 0,06 0,06 Staph. aureus 0,5 1 16 0,13 0,25 0,13 Staph. 0,13 0,25 8 0,13 0,13 0,06 epidermidis Staph. 0,13 0,13 4 0,06 0,25 0,06 epidermidis Staph. 0,06 0,5 8 0,13 0,13 0,13 haemolyticus Staph. 0,03 0,13 0,13 0,06 0,06 0,03 pyogenes Staph. 0,03 0,03 0,06 0,01 0,06 0,01 pneumoniae Entero. 0,13 0,13 0,5 0,13 0,13 0,13 faecalis Entero. 8 8 8 8 8 8 faecalis Neisseria 32 8 >128 16 64 32 gonorrh. Esch. coli >128 >128 >128 >128 >128 >128 Организм Штамм 20 41283 4 79 Pseudomonas aerug. Proteus vulgaris 64 128 >128 128 64 16 64 32 >128 >128 >128 >128 (1) Номер кода штамма в международной коллекции Продолжение табл. 2 L No. (1) 165 561 147 533 602 Соедине- Соедине- Соедине- Соедине- Соедине- Соедине- Соедине- Соединение 11 ние 12 ние 13 ние 14 ние 15 ние 16 ние 24 ние 25 A-A-1 PyA-A-1 A-A-3/B0 ABA-A-1 AD A-A-1 PyR A-A-1 RA-A-4 MA-A-4 Staph. aureus 0,13 0,25 0,06 0,13 0,13 1 0,06 0,13 Staph. aureus 0,5 4 0,13 16 1 16 2 4 Staph. 0,25 2 0,13 8 0,13 4 0,25 1 epidermidis Staph. 0,13 1 0,06 32 0,13 4 0,13 2 epidermidis Staph. 0,13 2 0,06 16 0,25 8 0,5 2 haemolyticus Организм Штамм Продолжение табл. 2 L No. (1) Организм Штамм Соедине- Соедине- Соедине- Соедине- Соедине- Соедине- Соедине- Соединение 11 ние 12 ние 13 ние 14 ние 15 ние 16 ние 24 ние 25 A-A-1 PyA-A-1 A-A-3/B0 ABA-A-1 AD A-A-1 PyR A-A-1 RA-A-4 MA-A-4 Staph. pyogenes Staph. 44 pneumoniae Entero. 149 faecalis Entero. 562 faecalis Neisseria 997 gonorrh. 47 Esch. coli 4 Pseudomonas aerug. Proteus 79 vulgaris 49 0,03 0,06 0,03 0,06 0,06 0,06 0,03 0,06 0,06 0,06 0,03 0,01 0,06 0,06 0,03 0,06 0,13 0,5 0,13 0,13 0,06 1 0,06 0,13 16 4 16 8 8 8 8 8 1 128 8 >128 16 >128 16 16 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 (1) Номер кода штамма в международной коллекции В нижеследующей табл. 3 представлены данные по активности in vitro некоторых репрезентативных соединений по настоящему изобретению в сравнении с тейкопланином и ванкоми цином, показывающие, что соединения по изобретению проявляют активность in vitro против штаммов энтерококков, обладающих высокой устойчивостью к гликопептидам в обычной терапии. Таблица 3 Минимальная ингибирующая концентрация (мкг/мл) Организм Штамм (1) Enterococcus faecalis L 560 L 562 L 563 Enterococcus faecium L 564 L 565 L 569 L 1650 L 1652 L 1666 Соединение 6 MA-A-1 Соединение 8 RA-A-1 Тейкопланин Ванкомицин 32 8 16 32 8 16 >128 >128 >128 >128 >128 >128 8 8 16 64 8 32 8 8 16 32 8 32 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 >128 21 41283 L 1680 L 1681 L 1683 L 1686 8 8 4 4 8 8 8 4 >128 >128 >128 >128 >128 >128 >128 >128 (1): № Международного кода В нижеследующей табл. 4 показаны результаты экспериментального использования некоторых репрезентативных соединений по изобретению против стрептококкового сепсиса мышеи. Эксперименты проводились по методике, описанной в работе В. Ариоли и др., "Journal of Antibiotics" 29, 511 (1976). Таблица 4 Инфецирующий организм Strep. Pyogenes C 203 Назначение ED50) Отношение (mg/kg) 0,16 0,35 0,08 0,03 0,03 0,13 0,04 0,03 0,11 0,03 0,03 0,04 0,05 0,05 0,06 Соединение N Тейкопланин А 40926 комплекс Соединение 1 RA Соединение 2 MA-A-1/B 0 Соединение 3 RA-A-1/B 0 Соединение 4 MA-A-2/B 0 Соединение 5 MA-A-3/B 0 Соединение 6 MA-A-1 Соединение 7 PyMA-A-1 Соединение 8 RA-A-1 Соединение 11 A-A-1 Соединение 12 PyA-A-1 Соединение 13 A-A-3/B 0 Соединение 15 ADA-A-1 Соединение 16 PyRA-A-1 Вышеприведенные данные показывают, что несмотря на то, что соединения по изобретению в целом менее активны против Neisseria gonorrheae, чем предшественник А 40926, эти соединения обладают более высокой активностью против культур Staphylococci и Enterococci, по сравнению С другими соединениями. В частности, эти соединения: a) проявляют заметно более высокую активность in vitro, чем тейкопланин и А 40926, против стафилококков, являющихся интермедиатами гликопептидов или обладающих устойчивостью к гликопептидам; b) проявляют активность in vitro против энтерококков, обладающих устойчивостью к гликопептидам, которые обладают также высокой устойчивостью к тейкопланину и ванкомицину и проявляют некоторую устойчивость к А-40926 (МIС 64 ³ мкг/мл); c) проявляют большую эффективность in vitro, чем тейкопланин и А 40926, при стрептококковом сепсисе мышей. Благодаря такой антимикробной активности соединения по изобретению можно эффективно применять в качестве активных ингредиентов ан тимикробных препаратов, используемых для лечения людей и в ветеринарной практике для предотвращения и лечения инфекционных заболеваний, вызываемых патогенными бактериями, в частности, для лечения инфекционных заболеваний, вызываемых энтерококками, стрептококками и стафилококками, которые обладают низкой чувствительностью к гликопептидным антибиотикам. Соединения по настоящему изобретению могут назначаться перорально, местно или парентерально, парентеральное введение является предпочтительным. В зависимости от способа введения соединения по изобретению входят в состав препаратов в различных дозах. Препараты для перорального приема могут быть изготовлены в виде капсул, таблеток, жидких растворов или суспензий. Согласно обычной практике, капсулы и таблетки могут содержать помимо активного ингредиента, обычные носители, такие, как разбавители, напр., лактозу, фосфа т кальция, сорбит и т.п., смазывающие вещества, напр., стеарат магния, тальк, полиэтиленгликоль, связующие вещества, напр., поливинилпирролидон, желатин, сорбит, трагакант, акацию, ароматизаторы и приемлемые рас 22 41283 представляет собой a-D-маннопиранозил, а Z является -Н). Этап а: получение N15-(t-ВОС)-МА. При перемешивании в раствор 1,8 г соединения из примера 1 (МA) и 1 г бикарбоната натрия в 50 мл смеси диоксан/вода 1/1, добавляют раствор 0,25 г ди-трет-бутил-дикарбоната в 5 мл диоксана при 5°С, добавку производят по капле в течение 15 мин. Через 1 час при комнатной температуре рН реакционной смеси доводят до 4 с помощью 1Н НСl. После этого добавляют 150 мл воды и полученную смесь экстрагируют n-бутанолом (2х100 мл). Органический слой отделяют, промывают 100 мл воды и затем концентрируют до малого объема (около 25 мл) при 40°С под пониженным давлением. Осадок, выпавший после добавки диэтилового эфира (100 мл) собирают и высушивают под вакуумом при комнатной температуре в течение ночи до получения 1,6 г искомого соединения N15-(t-BOC)-MA, достаточно чистого для использования на последующем этапе. Этап b: получение N15-(t-BOC)-RA При перемешивании в суспензию 0,9 г соединения, полученного на этапе а, в 50 мл воды добавляют 30 мл смеси n-бутанол/диэтиловый эфир 1/1, после чего добавляют 0,9 г боргидрида натрия. В течение 30 мин. при комнатной температуре производят добавку восстановителя (порциями), затем реакционную смесь перемешивают при комнатной температуре в течение 1 часа. После этого реакционную смесь охлаждают до 5°С и добавляют 1,5 мл ледяной уксусной кислоты, а затем 50 мл воды. Полученную смесь экстрагируют н-бутанолом (100 мл) и органический слой обрабатывают вышеописанным способом до получения 0,8 г искомого соединения N15-(t-BOC)-RA, достаточно чистого для использования на последующем заключительном этапе. Этап с: Раствор 0,5 соединения N15-(t-BOC)RA, полученного на этапе b выше, в 5 мл сухой трифтор уксусной кислоты (TFA) перемешивают при комнатной температуре в течение 1 минуты (или, по другому варианту, при 0-5°С в течение 2030 мин.), затем выливают в 10 мл смеси метанол/диэтиловый эфир 1/4 при 0-5°С. Искомое соединение RА собирают фильтрацией до получения,(после промывки диэтиловым эфиром, и высушивания при комнатной температуре под вакуумом в течение ночи) 0,35 г продукта. Образец в 0,15 г чистого соединения RА получают с помощью колоночной хроматографии с обращенной фазой на силанизированном силикагеле, соединив все фракции, содержащие чистые индивидуальные факторы, как описано ниже. Пример 3 Получение соединения 2 (МА-А-1/В0) и соединения 6 (МА-А-1) (соединение формулы (I), где Y представляет собой –СООСН3, Х представляет собой -NH-(CH2)3-N(CH3)2, R1 является -H, R2 представляет собой 9-метилдецил (МА-А-1/В 0) или (С9-С12)-алкил, соответствующий факторам комплекса А 40926 (МА-А-1), М представляет собой aD-маннопиранозил, и Z является -Н). Способ А. Этап а: получение N15-(t-BOC) -MA-A-1 При перемешивании в раствор 1,3 г N15-(tBOC)-MA- в 30 мл диметилсульфоксида (полученный на этапе а в примере 2 выше), добавили 0,2 щепляющие и смачивающие агенты. Жидкие препараты, обычно в виде водных или масляных растворов или суспензий, могут содержать обычные добавки, такие, как суспендирующие агенты. Для местного применения соединения по изобретению вводят в состав препаратов, пригодных для поглощения через слизистые носоглотки или бронхиальные ткани, такие препараты обычно изготавливают в виде жидких аэрозолей или ингаляционных препарате таблеток или препаратов, предназначенных для смазывания горла. Для лечения заболеваний глаз или уха препараты могут иметь жидкую или полужидкую форму. Для местного применения препараты изготавливают на гидрофобных или гидрофильных основах, таких, как мази, кремы, лосьоны, или порошки. Для ректального применения соединения по изобретению назначают в виде свечей, содержащи х обычные носители, такие, как напр., кокосовое масло, воск, спермацеты или полиэтиленгликоли и их производные. Композиции для инъекций могут иметь вид суспензий, растворов или эмульсий в масляных или водных носителях, и могут содержать дополнительные агенты, такие, как суспендирующие, стабилизирующие и/или диспергирующие агенты. В другом варианте, активный ингредиент может быть в виде порошка, который перед инъекцией смешивают с подходящим носителем, напр., водой. Количество активного ингредиента, подлежащего введению, зависит от различных факторов, таких, как масса и состояние пациента, способ и периодичность введения, тип возбудителя болезни. Соединения по изобретению обычно эффективны в дозах от около 1 до около 40 мг активного ингредиента на 1 кг массы тела пациента. В зависимости от характеристик конкретного соединения, типа инфекции и состояния пациента эффективную доз у вводят один раз в день или делят ее на 2-4 приема в день. Предпочтительными являются композиции, приготовленные в виде отдельных доз по 30-500 мг на дозу. Пример 1 Получение исходного материала (МА) (соединения формулы (II), где Y¢ представляет собой –СООСН3, X¢ представляет собой -ОН, R¢1 является -Н, R¢2 является (С9-С12)алкил, соответствующий факторам комплекса А 40926, М¢ является aD-маннопиранозилом и Z является -Н). Антибиотический комплекс А 40926 (150 мг, 0,0866 ммоль) полученный способом, описанным в ЕР-А-177882, растворяют в метаноле (30 мл) и с помощью концентрированной серной кислоты доводят рН до 2. Смесь перемешивают при комнатной температуре в течение 26 часов. В тот момент, когда рН доводят до 6 с помощью 0,15 мл триэтиламина (TEA), появляется осадок. После добавки диэтилового эфира осадок собирают, тща тельно промывают диэтиловым эфиром и высушивают. Выход: 150 мг (99%). Пример 2 Получение соединения 1 (RА) (соединения формулы (I), где Y является –СН2ОН, Х является -ОН, R1 является -Н, R2 является (С9-С12)алкилом, соответствующим факторам комплекса А 40926, М 23 41283 ния N15-(t-BOC)-RA-1 получили 0,22 г чистого соединения RA-A-1. Фактор RА-А-1/В 0 получили используя указанный способ, за исключением того, что очистку хроматографией с обращенной фазой производили в отношении только тех фракций, которые содержали чистый искомый индивидуальный фактор (объединяя эти фракции). Способ В При перемешивании в раствор 50 г (около 27 ммоль) соединения из примера 2 (RА) в 200 мл диметилформамида добавили 11 мл (около 90 ммоль) 3,3-(N,N-диметиламино)-1-пропиламина и 18 г (около 35 ммоль) РуВОР, добавку производили при комнатной температуре. После перемешивания в течение 15 минут добавили 1 литр этилацетата и выпавший осадок (около 63 г) собрали и подвергли, очистке колоночной хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы), получив 25 г соединения RA-А-1. Пример 6: получение соединения 4 (МА-А2/В0) (Соединение формулы (I), где Y является –COOCH3, X является -NH-(СН2)3-[NH-(СН2)3-] -NH2), R1 является -Н, R2 представляет собой 9метилдецил, М представляет собой a-D-маннопиранозил и Z является -Н). Этап а: получение N15-(t-BOC)-MA, цианометилового эфира Раствор 2,5 г соединения из примера 2, этап a (N15-(t-BOC)-МА), 0,25 мл TEA, и 2,5 мл хлорацетонитрила в 10 мл диметилсульфоксида (DMSO) перемешивают при комнатной температуре в течение 4 часов. После этого добавляют 90 мл этилацетата и выпавший осадок собирают, получая 2,8 г неочищенного искомого соединения N15-(tBOC)-MA, цианометиловый эфир. Этап b: получение N15-(t-BOC)-MA-A-2 Вышеописанный цианометиловый эфир (неочищенный) растворяют в 30 мл DMSO. В полученный раствор добавляют 2,8 мл N,N¢-бис-(3аминопропил)-1,3-пропандиамина и перемешивают реакционную смесь при комнатной температуре в течение 4 часов. После этого добавляют 200 мл этилацетата и выпавший твердый осадок собирают, получая 3 г неочищенного искомого соединения N15-(t-ВОC)-МА-А-2. Этап с: Вышеуказанное неочищенное соединение обрабатывают TFA, как описано выше в примере 3, способ А, этап b, до получения (после колоночной хроматографии с обращенной фазой (соединяя только фракции, содержащие чистый искомый индивидуальный фактор)) 0,45 г чистого соединения МА-А-2/В0. Пример 7: получение соединения 5 (МА-А3/В0) (соединение формулы (I), где Y является –СООН 3, Х является -NH-(CH2)3-N[-(CH2)3-NH2]2, R1 является -Н, R2 представляет собой 9-метилдецил, М представляет собой a-D-маннопиранозил и Z является -Н). Этап а: получение N¢,N¢¢-ди(t-ВОС)-трис(3аминопропил)амина N¢,N¢¢-защищенный полиамин получают способом, описанным в заявке на международный патент № WO90/11300. Этап b: конденсация МA с помощью N¢,N¢¢ди(t-ВОС)-трис(3-аминопропил)-амина мл 3,3-диметиламино-1-пропиламина и 0,3 мл дифенилфосфоразидата (DPPA). Через 4 часа перемешивания при комнатной температуре добавили еще 0,15 мл DPPA и продолжали перемешивание при комнатной температуре еще в течение 20 часов. Твердый осадок, выпавший после добавки 170 мл диэтилового эфира, собрали до получения 1,3 г искомого соединения N15-(t-BOC) -MA-A-1. Этап b: продукт вышеописанной реакции растворяли в 10 мл ТFA. Полученный раствор перемешивали при комнатной температуре в течение 20 мин., затем добавили 90 мл диэтилового эфира. Выпавший осадок собрали, дважды промыли 60 мл диэтилового эфира, а затем высушивали при комнатной температуре под вакуумом в течение ночи, получив 0,9 г сырого неочищенного искомого соединения (МА-А-1), которое подвергли хроматографии с обращенной фазой на колонке с силанизированным силикагелем (соединяя фракции, содержащие чистый искомый фактор) до получения 0,15 г чистого МА-А-1/В 0. Способ В При перемешивании в раствор 1,8 г (около 1 ммоль) соединения из примера 1 (MA) в 30 мл диметилформамида добавили 0,14 мл (около 1,15 ммоль) 3,3-диметиламино-1-пропиламина и 600 мг (около 1,2 моль) РуВОР, добавку производили при комнатной температуре. После перемешивания при 20-25°С в течение 3 часов добавили 150 мл диэтилового эфира. Выпавший осадок собрали и очистили колоночной хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы), получив 1,15 г соединения МА-А-1. Пример 4: получение соединения 7 (РуМА-А1) (соединение формулы (I), где Y представляет собой –СООСН3, Х является -NH-(CH2)3-N(CH3)2, R1 является -Н, R2 представляет собой (С9-С12)алкил, соответствующий факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является РÅ(NС4Н8)3 СН3СООq). При перемешивании в раствор 1,8 г (около 2 ммоль) соединения MA (полученного в примере 1) в 40 мл диметилформамида добавили 2 мл (около 16 ммоль) 3,3-диметиламино-1-пропиламина и 3,12 г (около 6 ммоль) РуВОР, добавку производили при комнатной температуре. Спустя 30 мин. реакционную смесь подвергли обработке, описанной в примере 3, способ В, получив 1,5 г искомого соединения РуМА-А-1. Пример 5: получение соединения 3 (RА-А1/В0) и 8 (R А-А-1) (соединение формулы (I), где Y является –СН2ОН, Х является -NH-(СН2)3-N(СН3)2, R1 является -Н, R2 представляет собой 9-метилдецил (RА-А-1В0) или (С9-С12)алкил, соответствующий факторам комплекса А 40926 (RA-A-1), М представляет собой a-D-маннопиранозил и Z является -Н). Способ А Этап а: получение N15-(t-BOC)-RA-A-1 Используя способ по примеру 3, способ А, этап а, из 2 г N15-(t-BOC)-RA (пример 2, этап b) получили 1,7 г искомого соединения N15-(t-BOC) -RA-A-1. Этап b: используя способ, описанный в примере 2, этап с, из 1,7 г вышеуказанного соедине 24 41283 Раствор 18 г (около 10 ммоль) соединения из примера 1 (МА), 14 г (около 36 ммоль) защищенного амина, 3 мл (около 22 ммоль) ТЕR и 6 мл (около 28 ммоль) DPPA в 150 мл DMSO перемешивают при комнатной температуре в течение 2 часов, затем добавляют 500 мл этилацетата. Выпавшее в осадок твердое вещество собирают (около 22 г) и используют на следующем этапе без дальнейшей очистки. Этап с: удаление защитных гр упп t-BOC Неочищенный продукт реакции этапа с растворяют в 150 мл сухого TFA, предварительно охлажденного до 0°С и полученный раствор перемешивают при 0-5°C в течение 20 минут. Затем добавляют 150 мл метанола и 300 мл диэтилового эфира. Выпавший осадок собирают, несколько раз промывают диэтиловым эфиром, затем очищают колоночной хроматографией с обращенной фазой (соединяя толькo фракции, содержащие чистый искомый индивидуальный фактор) до, получения 9 г соединения MA-A-3/B 0. Пример 8: получение соединения 9 (RА-A-2) (соединения формулы (I), где Y является –СН2ОН, X является -NH-(СН2)3-[NH(CH2)3]2-NH2, R 1 является -Н, R2 представляет собой (С9-С12)алкил, соответствующий факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является -Н). Этап а: получение N15-(t-BOC)-RA, цианометилового эфира Раствор 8 г (около 4 ммоль) соединения из примера 2, этап b, (N15-(t-BOC)-RA), 0,75 мл (около 5,5 моль) ТЕА и 8 мл хлорацетонитрила в 40 мл DMSO перемешивают при комнатной температуре в течение 5 часов. Затем добавляют 200 мл этилацетата и выпавший твердый осадок собирают, получая 6,2 искомого неочищенного цианометилового эфира. Этапы b и с: Конденсация с помощью N¢,N¢¢бис-(3-аминопропил)-1,3-пропандиамина и ацидолиз защитной группы t-BOC Неочищенный цианометиловый эфир из этапа а растворяют в 80 мл DMSO и добавляют 9 г N,N¢бис(3-аминопропил)-1,3-пропандиамина. После перемешивания при комнатной температуре в течение 20 часов добавляют этилацетат. Выпавший твердый осадок собирает и повторно растворяют в 70 мл ледяного сухого TFА. Полученный раствор перемешивают при 0°С в течение 10 минут, затем добавляют 230 мл охлажденного диэтилового эфира. Выпавший твердый осадок собирают и быстро повторно растворяют в 200 мл воды. рН раствора доводят до 5,5 с помощью 1H NаОН и очищают хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы), получая 1,3 чистого искомого соединения RA-A-2. Примep 9: получение соединения 10 (RA-A-3) (соединение формулы (I), где Y является –CH2OH, Х является -NH-(CH 2)3-N[(CH2)3NH2]2 R1 является Н, R2 представляет собой (С9-С12)алкил, соответствующий факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является –H). При перемешивании в раствор 9 г (около 5 ммоль) соединения по примеру 2 (PA) в 100 мл DMSO добавили 7 г (около 18 ммоль) N¢,N¢¢-ди(t BOC)-трис-(3-аминопропил)амина (пример 7, этап а) 1,5 мл ТEА и 3 мл DPPA при 10°С. После перемешивания при 10°С в течение 1 часа и при комнатной температуре в течение 4 часов добавили 400 мл этилацетата. Выпавший твердый осадок (около 12 г) повторно растворили в 80 мл ледяного TFA и полученный раствор перемешивали при 0-5°С в течение 10 минут. Затем добавили смесь метанол/диэтиловый эфир 1/1 (около 300 мл), предварительно охлажденную до -10°C. Твердый осадок собрали и быстро повторно растворили в 200 мл воды. рН полученного раствора довели до 4 с помощью 1Н NaOH и провели очистку хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы) до получения 1,8 г чистого искомого соединения RA-A-3. Пример 10: получение соединения 11 (А-А-1) (соединение формулы (I), где Y является -СООН, Х является –NH-(CH2)3-N(CH3)2, R1 является -Н, R2 представляет собой (С9-С12)алкил, соответствующей факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является –Н). При перемешивании в суспензию 5 г (около 2,5 ммоль) соединения 6 (МА-А-1), полученного как описано в примере 3, способ B, в 60 мл тетрагидрофурана (ТHF) добавили 10 мл воды и 20 мл 1Н NаОH при комнатной температуре. Спустя 30 мин. рН полученного раствора довели до 7 с помощью 1Н НСl, добавили 150 мл n-бутана и концентрировали смесь до малого объема (около 20 мл) при 40°С под пониженным давлением. Твердый осадок, выпавший после добавки диэтилового эфира (около 200 мл) собрали (5,2 г) и очищали хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы), получив 2,1 искомого соединения А-А-1. Пример 11: получение соединений 12 (РуА-А1) (соединение формула (I), где Y является -COOq, Х является -NH-(CH 2)3-N(CH3)2, R1 является -H, R2 представляет собой (С9-С12)алкил, соответствующий факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является РÅ (NC4H8)3). Соединение 12 (РуА-А-1) получают из соединения 7 (РуМА-А-1) из примера 4 способом, описанным в примере 10 для получения соединения 11 (А-А-1) из соединения 6 (МА-А-1), выход - 35%. Пример 12: получение соединения 13 (A-A3/B0) (соединение формулы (I), где Y является ССОН, Х является –NH-(CH2)3-N[(CH2)3NH2]2 , R1 является -H, R2 представляет собой 9-метилдецил, М представляет собой a-D-маннопиранозил и Z является –Н). Соединение 13 (А-А-3/B 0) получают из соединения (MA-A-3/B 0) из примера 7 способом, описанным в примере 10 для получения соединения 11 (А-А-1) из соединения 6 (МА-А-1), выход – 41%. Пример 13: получение соединения 14 (ABA-A1) (соединение формулы (I), где Y является – CONHCH3, X является –NH-(CH 2)-N(CH3)2, R1 является -H, R2 представляет собой (С9-С12)алкил, соответствующий факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является –Н). Этап а: получение N15-(t-BOC)-A-A-1, 6B-цианометиловый эфир. 25 41283 При перемешивании в раствор 22 г (около 11 ммоль) соединения 11 (А-А-1) из примера 10 и 3 г NаНСО3 в 220 мл смеси вода/диоксан 1/1 добавили раствор 5 г ди-трет-бутил-дикарбоната в 20 мл сухого диоксана, добавку производили по капле при комнатной температуре в течение 10 мин. После перемешивания в течение 2 часов при комнатной температуре добавили 200 мл воды, затем рН полученного раствора довели до 3 с помощью 1H HCI и экстрагировали раствор 300 мл n-бутанола. Органический слой отделяли и концентрировали при З5°С под пониженным давлением до малого объема (около 45 мл). Твердый осадок, выпавший после добавки диэтилового эфира (около 250 мл) собрали (около 20 г неочищенного N15-(t-BOC)-A-A-1) и повторно растворили в 150 мл DMSO. После добавки 3 мл TЕА и 20 мл хлорацетонитрила полученной раствор перемешивали при комнатной температуре в течение 5 часов, затем добавили 500 мл этилацетата. Выпавший твердый осадок (около 18 г цианометилового эфира) был достаточно чистым для использования на следующем этапе. Этап b: Взаимодействие полученного выше 6B-цианометилового эфира с метиламином и удаление защитной группы t-BОС. Раствор 5 г выше указанного продукта в 75 мл 250 (м/о) метиламина в этаноле перемешивали при комнатной температуре в течение 3 часов, затем добавляли 300 мл диэтилового эфира. Выпавший твердый осадок (около 5,1 г) собирали и повторно растворяли в 35 мл TFА при 0°С. Полученный раствор перемешивали при 0°С в течение 15 мин., затем добавляли 50 мл смеси метанол/диэтиловый эфир 1/1 до выпадения в осадок 4,5 г неочищенного продукта, которой очищала колоночной хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы) до получения 1,7 г исходного соединения 14 ¢¢АВА-А-1). Пример 14: получение соединения 15 (ADA-A1) (соединение формулы (I), где Y является -CONH-(CH2)3-N(CH3)2, X является N-H-(CH 2)3N(CH3)2, R1 является -Н, R2 представляет собой (С9-С12)-алкил, соответствующий факторам комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является –H). Раствор 7 г (около 4 ммоль) антибиотического комплекса. А 4096, 2,5 мл (около 20 ммоль) 3,3диметиламино-1-пропиламина и 5,2 г (около 10 ммоль) РуВОР в 70 мл DMF перемешивали при комнатной температуре в течение 1 часа, затем добавляли 400 мл этилацетата. Выпавший твердый осадок собирали и очищали хроматографией с обращенной фазой (соединяя все фракции, содержащие чистке индивидуальные факторы), получая 2,1 г искомого соединения 15 (ADA-A-1). Пример 15: получение соединения 16 (РуРАА-1) (соединение формулы (1), где Y является –CH2OH, X является –H-(CH2)3-(CH3)2, R1 является –Н, R2 является (С9-С12)алкил, соответствующий факторам комплекса A 40926, M представляет собой a-D-маннопиранозил и Z является РÅ (C4H8(CН3СООq). При перемешивании в раствор 400 мг (около 0,2 моль) соединения 7 (PyМA-A-1), полученного способом, описанным в примере 4, в 20 мл воды добавили 4 мл n-бутанола и 200 мг аВН 4, добавку производили при комнатной температуре. После перемешивания при комнатной температуре в течение ночи рН реакционной смеси доводили до pН 4,5 с помощью ледяной уксусной кислоты и экстрагировали смесь 50 мл n-бутанола. Органический слой отделяли и растворитель выпаривали при 45°C под пониженным давлением. Твердый осадок очищали хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальные факторы) до получения 175 мг чистого искомого соединения 16 (PyRA-A-1). Пример 16: получение соединения 25 (МА-АА) (соединение формулы (I); где Y является –COOCH3, X представляет собой: N N CH3 R1 является -Н, R2 представляет собой (C9-C12)алкил, соответствующий факторам комплекса A 40926, М является a-D маннопиранозилом и Z является –Н). При перемешивании в раствор 5 г соединения из примера 1 (МА) в 60 мл смеси DMF/D MSO 5/1, добавили 0,3 мл N-метил-пиперазина и 1,7 г РуВОР, добавку производили при комнатной температуре. Через 1 час протекания реакции добавляли 140 мл этилацетата и выпавший твердый осадок собрали и очистили колоночной хроматографией с обращенной фазой (соединяя все фракции, содержащие чистые индивидуальное компоненты), получив 1,9 г искомого соединения МА-А-4. Пример 17: получение соединения 24 (RA-A-4) (соединение формулы (I), где Y является –CH2OH, X представляет собой: N N CH3 R1 является -H, R2 представляет собой (С9С12)алкил, соответствующий фактором комплекса А 40926, М представляет собой a-D-маннопиранозил и Z является –Н). Применив способ, описанный в примере 16 выше и в тех же условиях, из 5 г РА получили 2,7 г чистого искомого соединения RA-A-4. Колоночная хроматография с обращенной фазой Чистые образцы вышеуказанных соединений получали с помощью колоночной хроматографии с обращенной фазой на силанизированном силикагеле (0,063-0,2 мм; "Merck"). Неочищенный продукт (напр., 0,5 г) растворяли в минимальном количестве смеси ацетонитрил/вода 1/1, затем рН раствора доводили до 7 с помощью 1Н NaOH и разбавляли раствор водой до образования мутного раствора. После этого добавляли несколько капель ацетонитрила при энергичное перемешивании. Как только раствор становился прозрачным, его помещали на колонку силанизированного силикагеля (100 г) в воде. Элюирование проводили линейным градиентом с 10% до 60% ацетонирила в 0,1Н уксусной кислоты в течение 10 часов при 26 41283 скорости потока в около 250 мл/час, при этом собирая 20 мл фракции, которые подвергали ВЭЖХ анализу. Фракции, содержавшие чистые соединения формулы (I) выбирали и, в те х случаях, когда искомым соединением были соединения формулы (I), где R2 представляло собой (С9-С12)-алкил, соответствующий фракциям комплекса А 40926, то все фракции, содержащие чистые факторы, соединяли и растворители выпаривали при 40°С под пониженным давлением в присутствии n-бутанола для того, чтобы избежать пенообразования. В тех случаях, когда процесс получения соединения формулы (I) антибиотического комплекса A 40926 использовался для получения предшественника и исковым соединением являлся индивидуальный фактор амидного соединения формулы (I), где R2 соотве тствуе т одному из значений, характеризующи х индивидуальные фактора комплекса А 40926 (напр., R2=9-метилдецил), то соединяли и подвергали вышеописанной обработке только те фракции, которое, согласно ВЭЖХ, содержали искомый чистый фактор. Идентичность и структур у каждого отдельного фактора соединений по изобретению определяли, проводя ВЭЖХ анализ каждого продукта реакции. Соответственно, предварительную идентификацию искового фактора производили путем сравнения отпечатков ВЭЖХ комплекса А 40926 с отпечатками неочищенных продуктов реакции (см., напр., спектрограммы в работе Л.Ф. Церилли и др. "Rapid Communications in Mass Spectrometry", том 6, 109,1922) (в этой работе фактор В0 комплекса А 40926 названфактором В). ВЭЖХ-анализ проводили на колонке "Hibar" (125 x 4 мм; "Меrck"), предварительно насажанной реактивом "Li-Chrospher RP-8" (5 мкм), используя жидкостной хроматограф "Varian Model 5500", оснащенный переменным УФ-детектором. Хроматограммы записывали в 254 нм. Элюирование производили с помощью линейного ступенчатого градиента от 20% до 60% ацетонитрила в 0,2% водном формиате аммония в течение 30 мин., при скорости потока в 1,5 мл/мин. Поскольку в целом все комплексные соединения по изобретению дают типичные отпечатки ВЭЖХ, аналогичные отпечатку соответствующего предшественника комплекса A 40926, индивидуальные факторы соединения по изобретению, соответствующие факторами предшественника комплекса А 40926, можно легко идентифицировать посредством корреляции двух спектрограмм ВЭЖХ. Элюированные фракции хроматограм с обращенной фазой, которые содержат указанные чистые факторы, можно отделить и подвергнуть обработке, как описано выше. Чтобы подтвердить идентичность (С9-С12)аликильных цепей, образец каждой фракции можно выпарить вышеописанным способом до получения продукта, который можно подвергнуть газ-хроматографии/массспектрометрическому анализу согласно способу, описанному в работе Л.Ф. Церилли и др., упомянутой выше. В табл. 5 приведены значения времени удерживания (tR) чистого фактора каждого из соединений формулы (I) по изобретению, где R2 представляет собой 9-метилдецил (т.е. соответствующего фактору В0 комплекса А 40926), (эти значе ния использовались в ходе очистки с помощью хроматографии с обращенной фазой). В таблице приведены также значения tр фактора В0 предшественника комплекса А 40926 и соответствующе го эфирного исходного материала (МА), полученные в вышеописанных условиях. Таблица 5 Анализ ВЭЖХ Соединение Время удержания, tR (минуты) Предшественник А 9,7 40926 Исходный материал 11,3 (МА) Соединение 1 10,2 Соединение 2 13,7 Соединение 3 15,3 Соединение 4 15,5 Соединение 5 15,3 Соединение 6 13,7 Соединение 7 20,5 Соединение 8 15,3 Соединение 9 12,9 Соединение 10 14,8 Соединение 11 12,1 Соединение 12 17,4 Соединение 13 12,2 Соединение 14 14,7 Соединение 15 16,4 Соединение 16 19,2 Соединение 24 13,4 Соединение 25 14,8 1 Н- и 31Р-Я МР-спектры 1 Н-ЯМР-спектры при 500 МГц получали при температурах от 20 до 30°С на спектрометре "Bruker AM 500" в D MSO-D6 с тетраметилсиланом (ТMS) в качестве вн утренней ссылки (дельта=0,00 ммд). В табл. 6 показан наиболее значительный химический сдвиг (дельта ммд) у некоторых репрезентативных соединений. Таблица 6 Соединение 1 (RA): 0,85 1,13 1,42 1,98 (ацильная цепь); 3,72 (CН2OН), 4,05-6,22 (пептидные CН); 6,43-8,52 (ароматические протоны и пептидные NН). Соединение 2 (МА-А-1/В 0): 0,83 1,14 1,38 1,99 (ацильная цепь), 1,83 2,83 (CН2-боковая цепь), 2,73 (N(CH3)2); 4,11-6,10 (пептидные CH); 6,48-9,50 (ароматические протоны и пептидные NН). Соединение 3 (RA-A-1/B 0): 0,84 1,14 1,38 1,92 (ацильная цепь); 1,72 2,75 (СН2-боковая цепь); 2,53 (N(CH3)2); 3,69, (СН2-ОН); 4,09-6,11 (пептидные СН); 6,41-9,18 (ароматические протоны и пептидные Н). Соединение 4 (МA-A-В 0): 0,84 1,15 1,39 1,98 (ацильная цепь); 1,96 2,86 (СН2-боковая цепь); 4,08-6,15 (пептидные СН); 6,42-9,61 (ароматические протоны и NН). Соединение 5 (MA-A-3/B 0): 27 41283 0,85 1,13 1,42 2,02 (ацильная цепь); 1,73 2,82 (алкиламинные цепи); 2,42 (-N-CH 3); 3,63, (СООСН3); 2,10-3,80 (сахара); 4,10-6,10 (пептидные СН); 6,41-8,52 (ароматические протоны и пептидные NН). Соединение 7 (РуMA-A-1): 0,84 1,13 1,42 2,01 (ацильные цепи); 1,83 2,16 (диметилпропиламид); 2,32 (NН-CH3); 1,70 2,23 (пирролидин), 3,10-3,80 (сахара); 4,10-6,20 (пептидные СН); 6,38-8,40 (ароматические протоны и пептидные NН). Соединение 9 (RA-A-2): 0,84 1,13 1,39 1,98 (ацильные цепи); 1,88 2,91 (алкиламинные цепи); 2,41 (NН-CH3); 3,10-3,80 (сахара); 4,10-6,10 (пептидные СН); 6,38-8,49 (ароматические протоны и пептидные NН. Соединение 10 (RA-A-3): 0,84 1,13 1,39 1,98 (ацильные цепи); 1,73 2,82 (алкиламинные цепи); 2,47 (NН-CH3); 3,10-3,80 (сахара); 4,10-6,10 (пептидные СН); 6,37-8,70 (ароматические протоны и пептидные NН); 9,2-10,4 (фенольные ОН). Соединение 11 (A-A-1): 0,84 1,13 1,39 2,00 (ацильные цепи); 1,74-2,79 (алкиламинные цепи); 2,37 (NН-CH3); 3,10-3,80 (сахара); 4,10-6,10 (пептидные СН); 6,39-8,50 (ароматические протоны и пептидные NН). Соединение 12 (РуA-A-1): 0,84 1,13 1,42 2,02 (ацильные цепи); 1,87 2,73 3,00 (диметилпропиламид); 2,48 (NН-CH3); 1,71 2,30 (пирролидин); 3,10-3,80 (сахара); 4,10-6,25 (пептидные СН); 6,38-8,55 (ароматические протоны и пептидные NН). Соединение 13 (A-A-3/В 0): 0,84 1,13 1,42 2,02 (ацильные цепи); 2,33 (NНCH3) 1,71 2,80 (алкиламинные цепи); 3,10-3,80 (сахара); 4,10-6,10 (пептидные СН); 6,37-8,50 (ароматические протоны и пептидные NН). Соединение 14 (АВA-A-1): 0,84 1,13 1,42 1,96 (ацильные цепи); 2,35 [(СНNН)-CH3)] 1,78 2,70 (алкиламинные цепи); 3,103,80 (сахара); 4,10-6,10 (пептидные СН); 6,37-8,50 (ароматические протоны и пептидные NН). Соединение 15 (АDA-A-1): 0,82 1,13 1,40 1,98 (ацильные цепи); 1,72 1,85 2,73 3,00 (алкиламинные цепи); 2,50 (NН-CH3); 3,10-3,80 (сахара); 4,10-6,10 (пептидные СН); 6,408,55 (ароматические протоны и пептидные NН). Соединение 16 (PyRA-A-1): 0,84 1,13 1,41 2,00 (ацильные цепи); 2,33 (NНCH3); 1,82 2,16 (диметилпропиламид); 1,71 3,23 (пирролидин); 3,10-3,80 (сахара); 4,10-6,20 (пептидные СН); 6,38-8,40 (ароматические протоны и пептидные NН). Соединение 24 (RA-A-4): 0,84 1,13 1,40 1,97 (ацильные цепи); 2,10 (пиперазин СН3); 2,38 (NН-CH3); 3,10-3,80 (сахара); 4,05-6,07 (пептидные СН); 6,38-8,49 (ароматические протоны и пептидные NН). Соединение 25 (МA-A-4): 0,84 1,13 1,40 2,00 (ацильные цепи); 2,13 (пиперазин СН3); 2,43 (NН-CH3); 3,10-3,80 (сахара); 3,63 (СООСН 3); 4,05-6,09 (пептидные СН); 6,388,49 (ароматические протоны и пептидные NН). 31 Р-Я МР-спектры брали при 161,98 МГц (соединение 12) или при 202,46 МГц (соединения 7 и 16) в DMSO d6 (растворе) с 85% H3PO4 в качестве внутренней справки. Соединение 7 (РуMA-A-1) (31Р): один сигнал при дельта 24,12 ммд. Соединение 12 (РуA-A-1) ( 31Р): один сигнал при дельта 23,50 ммд. Соединение 16 (РуRA-A-1) (31Р): один сигнал при дельта 24,11 ммд. 28 41283 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 29
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07K 14/195, C07K 14/41, C07K 1/113, C07K 9/00, A61K 38/00, A61P 31/04
Мітки: похідні, антибіотику, одержання, способи, 40926
Код посилання
<a href="https://ua.patents.su/29-41283-pokhidni-antibiotiku-a-40926-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні антибіотику а 40926 та способи їх одержання</a>
Попередній патент: Клапан вібраційного насоса
Наступний патент: Електростанція з сонячним басейном
Випадковий патент: Спосіб пластичного закриття антре-орального сполучення верхньощелепної пазухи