Інсектицидні (дигалопропеніл)фенілалкілзаміщені похідні дигідробензофурану і дигідробензопірану та спосіб боротьби з комахами
Номер патенту: 82875
Опубліковано: 26.05.2008
Автори: Ліга Джон В., Чжан І. Ларрі, Дін Пін, Теодорідіс Джордж, Коен Деніел Х., Суарес Домінік П., Беррон Єдвард Дж., Донован Стефен Ф., Рауш Девід М., Завацкі Френк Дж., Йіджер Уолтер Х.
Формула / Реферат
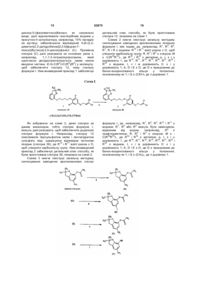
1. Сполука формули І:
 , (I)
, (I)
де
- R і R3 незалежно вибирають з водню або галогену;
- R1 є воднем або галогеном;
- R2 є воднем;
- R4 є воднем;
- R5 є галогеном;
- Е являє собою О;
- G являє собою СН2;
- х дорівнює 1,
- А являє собою О;
- В є місточковою групою, яка являє собою *-(CR16RI7)q-(CRl8R19)r-(CR20R21)s-Lt-(CR22R23)u-(CR24R25)v-(CR26R27)w-, причому зірочка позначає приєднання біля A;
q, r, s, u, v і w є цілими числами, незалежно вибраними з 0, 1 і 2;
і
коли q, r, s, u, v або w дорівнюють 1 або 2,
з R16 до R19 включно і з R21 до R27 включно є воднем;
R20 вибирають з водню або (С1-С3)алкілу;
t є цілим числом, вибраним з 0 або 1; і
коли t дорівнює 1,
L вибирають з О або NHC(=O);
- у являє собою 1;
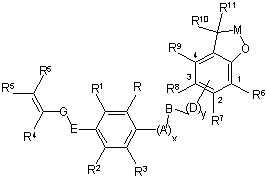
- D вибирають з О і NR15, де R15 вибирають з водню, (С2-С4)алкеніл(С1-С3)алкілу і гало(С2-С4)алкеніл(С1-С3)алкілу, a D є приєднаним до частини бензоконденсованого кільця, вказаного у формулі І, у будь-якому одному з положень, позначених 1-, 2-, 3- або 4-,
 ,
,
- R6 є воднем;
- R7 є воднем, галогеном або нітро;
- R8 є воднем, галогеном, ціано, нітро, алкілкарбоніламіно або арилкарбоніламіно;
- R9 є воднем, галогеном або (С1-С4)алкілом;
- R10 і R11 незалежно є алкілом; або
R10 і R11, взяті разом, є О, утворюючи карбонільну групу;
- М являє собою *C(R32R33), де зірочка позначає приєднання до О, і де з R32 до R35 вибирають з галогену і (С1-С4)алкілу;
та
її сільськогосподарсько прийнятні солі.
2. Сполука за п. 1, де R і R3 незалежно вибирають з галогену і (С1-С3)алкілу;
R1, R2 i R4є вoднeм;
R5 незалежно вибирають з хлору, брому і фтору;
Е являє собою О;
G являє собою (СН2)n, де n дорівнює 1;
х дорівнює 1, і
А є О;
і
коли q, r, s, u, v і w дорівнюють 1 або 2, з R16 до R27, включно, є воднем;
t дорівнює 0 або 1,
і
коли t дорівнює 1,
L вибирають з О або NHC(=O)
y дорівнює 1,
і
D являє собою О або NR15, де R15 вибирають з водню, (С2-С4)алкеніл(С1-С3)алкілу і гало(С2-С4)алкеніл(С1-С3)алкілу, де D є приєднаним до бензоконденсованої частини, вказаної у формулі І, у положенні, позначеному 1 або 4;
R6 є воднем;
R7 і R8 незалежно вибирають з водню, галогену або нітро;
R9 є воднем або галогеном;
R10 і R11 взяті разом є О, утворюючи карбонільну групу;
і
М є C(R32R33), де R32 і R33 є незалежно (С1-С4)алкілом.
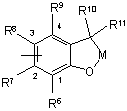
3. Сполука формули II
 , (II)
, (II)
де
- R1 і R2 є воднем;
- R і R3 є галогеном;
- R5 є галогеном;
- R7 і R8 є воднем, галогеном або нітро;
- R9 є воднем або галогеном;
- R10 і R11 взяті разом утворюють =O;
- В являє собою (СH2)n, де n є цілим числом від 2 до 6; і
- М є C(R32R33), де R32 і R33 є галогеном або (С1-С4)алкілом.
4. Сполука за п. 3, де
- R32 і R33 є (С1-С4)алкілом.
5. Сполука за п. 3, де R32 і R33 є метилом.
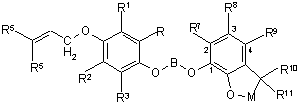
6. Сполука:
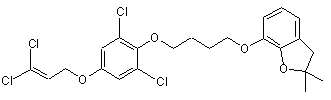 ,
,
а саме 5-(3,3-дихлорпроп-2-енілокси)-2-[4-(2,2-диметил(2,3-дигідробензо[2,3-b]фуран-7-ілокси))бутокси]-1,3-дихлорбензол.
7. Композиція, що містить інсектицидно ефективну кількість сполуки за п. 1 і принаймні один прийнятний у галузі сільського господарства наповнювач або допоміжну речовину.
8. Інсектицидна композиція за п. 7, яка додаткова містить одну або більшу кількість других сполук, вибраних з групи, що складається з пестицидів, регуляторів росту рослин, добрив і покращувачів ґрунту.
9. Спосіб боротьби з комахами, що включає застосування інсектицидно ефективної кількості композиції за п. 7 до місцеположення, де комахи присутні або, як очікують, будуть присутніми.
10. Спосіб боротьби з комахами, що включає застосування інсектицидно ефективної кількості композиції за п. 8 до місцеположення, де комахи присутні або, як очікують, будуть присутніми.
Текст
УКРАЇНА (19) UA (11) 82875 (13) C2 (51) МПК (2006) C07D 307/80 (2008.01) A01N 43/02 A01P 7/04 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ІНСЕКТИЦИДНІ (ДИГАЛОПРОПЕНІЛ)ФЕНІЛАЛКІЛЗАМІЩЕНІ ПОХІДНІ ДИГІДРОБЕНЗОФУРАНУ І ДИГІДРОБЕНЗОПІРАНУ ТА СПОСІБ БОРОТЬБИ З КОМАХАМИ - В є місточковою групою, яка являє собою *(CR16RI7)q-(CRl8R19)r-(CR20R21)s-Lt-(CR22R23)u(CR24R25)v-(CR26R27)w-, причому зірочка позначає приєднання біля A; q, r, s, u, v і w є цілими числами, незалежно вибраними з 0, 1 і 2; і коли q, r, s, u, v або w дорівнюють 1 або 2, з R16 до R19 включно і з R21 до R27 включно є воднем; R20 вибирають з водню або (С1-С3)алкілу; t є цілим числом, вибраним з 0 або 1; і коли t дорівнює 1, L вибирають з О або NHC(=O); - у являє собою 1; - D вибирають з О і NR15, де R15 вибирають з водню, (С2-С4)алкеніл(С1-С3)алкілу і гало(С2С4)алкеніл(С1-С3)алкілу, a D є приєднаним до частини бензоконденсованого кільця, вказаного у формулі І, у будь-якому одному з положень, позначених 1-, 2-, 3- або 4-, R1 R R4 3 R8 B G E O (A) x (D) y 1 2 R6 R7 , (I) де - R і R3 незалежно вибирають з водню або галогену; - R1 є воднем або галогеном; - R2 є воднем; - R4 є воднем; - R5 є галогеном; - Е являє собою О; - G являє собою СН2; - х дорівнює 1, - А являє собою О; R2 R3 2 1 O R6 , - R6 є воднем; - R7 є воднем, галогеном або нітро; - R8 є воднем, галогеном, ціано, нітро, алкілкарбоніламіно або арилкарбоніламіно; - R9 є воднем, галогеном або (С1-С4)алкілом; - R10 і R11 незалежно є алкілом; або R10 і R11, взяті разом, є О, утворюючи карбонільну групу; - М являє собою *C(R32R33), де зірочка позначає приєднання до О, і де з R32 до R35 вибирають з галогену і (С1-С4)алкілу; та її сільськогосподарсько прийнятні солі. 2. Сполука за п. 1, де R і R3 незалежно вибирають з галогену і (С1-С3)алкілу; R1, R2 i R4є вoднeм; R5 незалежно вибирають з хлору, брому і фтору; Е являє собою О; 82875 R5 R5 R7 M 4 R 11 (11) R9 R10 4 M R11 R10 3 UA R9 R8 (19) (21) a200509922 (22) 27.04.2004 (24) 26.05.2008 (86) PCT/US2004/012886, 27.04.2004 (31) 60/466,674 (32) 30.04.2003 (33) US (46) 26.05.2008, Бюл.№ 10, 2008 р. (72) ТЕОДОРІДІС ДЖОРДЖ, БЕРРОН ЄДВАРД ДЖ., СУАРЕС ДОМІНІК П., ЧЖАН І. ЛАРРІ, ДІН ПІН, РАУШ ДЕВІД М., ДОНОВАН СТЕФЕН Ф., ЗАВАЦКІ ФРЕНК ДЖ., ЙІДЖЕР УОЛТЕР Х., ЛІГА ДЖОН В., КОЕН ДЕНІЕЛ Х. (73) БАЙЄР КРОПСАЙЄНС АГ (56) US 5 360 919, A, 01.11.1994 US 6 407 243, B1, 18.06.2002 US 5 922 880, A, 13.07.1999 WO 0144154, A1, 21.06.2001 EP 0 648 729, A1, 19.04.1995 US 5 952 386, A, 14.09.1999 US 5 872 137, A, 16.02.1999 WO 9633160, A1, 24.10.1996 US 3 474 170, A, 21.10.1969 (57) 1. Сполука формули І: C2 2 (13) 1 3 82875 G являє собою (СН2)n, де n дорівнює 1; х дорівнює 1, і А є О; і коли q, r, s, u, v і w дорівнюють 1 або 2, з R16 до R27, включно, є воднем; t дорівнює 0 або 1, і коли t дорівнює 1, L вибирають з О або NHC(=O) y дорівнює 1, і D являє собою О або NR15, де R15 вибирають з водню, (С2-С4)алкеніл(С1-С3)алкілу і гало(С2С4)алкеніл(С1-С3)алкілу, де D є приєднаним до бензоконденсованої частини, вказаної у формулі І, у положенні, позначеному 1 або 4; R6 є воднем; R7 і R8 незалежно вибирають з водню, галогену або нітро; R9 є воднем або галогеном; R10 і R11 взяті разом є О, утворюючи карбонільну групу; і М є C(R32R33), де R32 і R33 є незалежно (С1С4)алкілом. 3. Сполука формули II R1 R5 R5 C H2 R8 O R7 R 3 2 O R2 R3 де - R1 і R2 є воднем; - R і R3 є галогеном; - R5 є галогеном; B O R9 4 R10 1 O M R11 , (II) Дана заявка вимагає пріоритет згідно з попередньою заявкою США №60/466 674, поданої 30 квітня 2003р. Даний винахід стосується нових сполук та їхнього використання у боротьбі з комахами і кліщами. Зокрема, це стосується (дигалопропеніл)фенілалкіл-заміщених похідних дигідробензофурану і дигідробензопірану та їхніх прийнятних у галузі сільського господарства солей, композицій, що їх містять, та способів їхнього використання у боротьбі з комахами і кліщами. відомо, що комахи можуть завдавати Добре значної шкоди не лише культурам, вирощуваним у сільському господарстві, таким як пшениця, кукурудза, соя, картопля і бавовник, але також, наприклад, спорудам і дерену, де шкоди завдають ґрунтові комахи, такі як терміти і личинки хрущів. Таке пошкодження може призводити до втрати мільйонів доларів вартості, пов'язаної із даною культурою, дереном або спорудами. Інсектициди та акарициди є корисними для боротьби з такими комахами і кліщами. Ряд патентів і публікацій розкривають різноманітні дигалопропенові сполуки, які, як повідомляють, є інсектицидно та акарицидно 4 - R7 і R8 є воднем, галогеном або нітро; - R9 є воднем або галогеном; - R10 і R11 взяті разом утворюють =O; - В являє собою (СH2)n, де n є цілим числом від 2 до 6; і - М є C(R32R33), де R32 і R33 є галогеном або (С1С4)алкілом. 4. Сполука за п. 3, де - R32 і R33 є (С1-С4)алкілом. 5. Сполука за п. 3, де R32 і R33 є метилом. 6. Сполука: Cl O Cl Cl O O O Cl , а саме 5-(3,3-дихлорпроп-2-енілокси)-2-[4-(2,2диметил(2,3-дигідробензо[2,3-b]фуран-7ілокси))бутокси]-1,3-дихлорбензол. 7. Композиція, що містить інсектицидно ефективну кількість сполуки за п. 1 і принаймні один прийнятний у галузі сільського господарства наповнювач або допоміжну речовину. 8. Інсектицидна композиція за п. 7, яка додаткова містить одну або більшу кількість других сполук, вибраних з групи, що складається з пестицидів, регуляторів росту рослин, добрив і покращувачів ґрунту. 9. Спосіб боротьби з комахами, що включає застосування інсектицидно ефективної кількості композиції за п. 7 до місцеположення, де комахи присутні або, як очікують, будуть присутніми. 10. Спосіб боротьби з комахами, що включає застосування інсектицидно ефективної кількості композиції за п. 8 до місцеположення, де комахи присутні або, як очікують, будуть присутніми. активними. [Наприклад, патент США №5922880] розкриває деякі дигалопропенові сполуки, що містять необов'язково заміщені групи гетероциклічного кільця, для використання як інсектициди та акарициди. Прикладами гетероциклічного кільця у необов'язково заміщеній групі гетероциклічного кільця є ізоксазол, тіазол, 1,3,4-тіадіазол, пірол, фуран, тіофен, піразол, імідазол, 1,2,3-триазол, 1,2,4-триазол, 1,2,3,4тетрзол, піридин, піридазин, піримідин, піразин, 1,2,4-триазин, 1,3,5-триазин, індол, бензофуран, тіанафталін, індазол. бензімідазол, бензотриазол, бензізоксазол, бензоксазол, бензотіазол, хінолін, ізохінолін, хіноксалін, хіназол, піперидин, піперазин, тетрагідрофуран, тетрагідропіран, піразолін, фталімід, діоксан, діоксолан і бензодіоксолан (стовпчик 3, рядки 15-25). Також відомими у даній галузі є інсектициди, що містять дигідробензофуранілові замісники. У цьому відношенні, [дивіться патенти США №№3474170 і 3474171], які розкривають дигідробензофуранілові ефіри карбамінових кислот. додаток до активності проти цільових На шкідників, життєздатний з комерційної точки зору пестицид повинен задовольняти ряд додаткових 5 критеріїв, включаючи, серед іншого, собівартість, вплив на навколишнє середовище, токсичність для ссавців, відсутність несприятливих впливів на цільові сільськогосподарські культури і певні фізичні характеристики. Бажані фізичні характеристики для сполуки, яка може застосовуватися у зовнішніх польових умовах, включають, серед іншого, фотохімічну стабільність у польових умовах. Фотостабільні інсектициди та акарициди, тобто ті, які не руйнуються або не деградують під впливом сонячного світла, є корисними в тому, що вони забезпечують довготривалу інсектицидну та акарицидну активність, яка підвищує ефективність активної сполуки. Проблеми ефективності, пов'язані з пестицидами, що мають обмежену фотостабільність, є добре відомими. [Наприклад, Clough et al. (Fungicidal (3-Methoxyacrylates; Synthesis and Chemistry of Agrochemicals, ACS Symposium Series 504, Chapter 34 (1992))] описує зникнення фунгіцидної активності деяких сполук при тестуванні на світлі і спроби синтезувати фунгіциди з більшою фотостабільністю. У ще одному прикладі [Shiokawa et al. (Chloronicotinyl Insecticides: Development of Imidacloprid; Eighth International Congress of Pesticide ChemistryOptions 2000, ACS Publication 1995)] описує довжину хвиль сонячного світла, що досягає земної поверхні, яка може викликати фотодеградацію певних сполук, таких як нітрометиленові інсектициди та інші сполуки. нових Таким чином, існує постійна потреба у інсектицидах та акарицидах, що є безпечними, більш ефективними, наприклад, більш фотостабільними, і менш дорогими для приготування у промисловому масштабі. Відповідно до даного винаходу, зараз було виявлено, що деякі дигалопропенілфенілалкільні сполуки, які містять заміщений бензоконденсований гетероцикл, де гетероцикл є насиченим 5- або 6-членним кільцем, що містить один атом кисню (тобто дигідробензофураном або дигідробензопіраном), є активними у боротьбі з комахами і кліщами. Крім того, ці сполуки є несподівано фотохімічно стабільними. Нові сполуки представлені нижченаведеною загальною формулою І: де - R і R3 незалежно вибирають з водню, галогену, гідроксигрупи, (С1-С3)алкілу, (С3С6)циклоалкілу, (С2-С5)алкенілу, (С2-С5)алкінілу, гало(С1-С3)алкілу, (С1-С3)алкокси, гало(С1С3)алкокси, (С1-С3)алкілтіо, гало(С1-С3)алкілтіо, 82875 6 (С1-С3)алкілсульфонілу, гало(С1С3)алкілсульфонілу, ціаногрупи, нітрогрупи; необов'язково заміщеної аміногрупи, де необов'язковий замісник вибирають з (С1С4)алкілу, (С1-С3)алкілкарбонілу і (С1С3)алкоксикарбонілу; необов'язково заміщеного імідазолілу, необов'язково заміщеного імідазолінілу, необов'язково заміщеного оксазолінілу, необов'язково заміщеного оксазолілу, необов'язково заміщеного оксадіазолілу, необов'язково заміщеного тіазолілу, необов'язково заміщеного піразолілу, необов'язково заміщеного триазолілу, необов'язково заміщеного фуранілу, необов'язково заміщеного тетрагідрофуранілу, необов'язково заміщеного діоксоланілу, необов'язково заміщеного діоксанілу, -C(=J)-K і -C(R12)-Q-R13, де необов'язковий замісник вибирають з (С1С4)алкілу, гало(С1-С4)алкілу, (С1-С4)алкокси, (С1С4)алкокси(С1-С4)алкілу, (С3-С6)циклоалкілу, (С2С5)алкенілу, (С2-С5)алкінілу, ціаногрупи, нітрогрупи і арилу; де J вибирають з О, S, NR14 і NOR14, де R14 є воднем, (С1-С4)алкілом, гало(С1-С4)алкілом, арилом і арил(С1-С4)алкілом; К вибирають з водню, (С1-С3)алкілу, гало(С1-С3)алкілу, (С1-С3)алкокси, (С1-С3)алкіламіно і ді(С 1С3)алкіламіногрупи; Q вибирають з О, S і NR14, де R14 є таким, як описано раніше; R12 і R13 незалежно вибирають з водню, (С1С4)алкілу і гало(С1-С4)алкілу, і R12 та R13 можуть бути взяті разом з -T(CHR14)m-, де m є цілим числом від 2 до 4; Т вибирають з О, S і NR14, де R14 є таким, як описано раніше; - R1 і R2 незалежно вибирають з водню, галогену і (С1-С3)алкілу; - R4 є воднем; - R5 незалежно вибирають з галогену; - Е вибирають з СН2, О, S і NR15, де R15 вибирають з водню, (С1-С3)алкілу, (С1С3)алкокси(С1-С3)алкілу, арил(С1-С3)алкілу, (С2С4)алкеніл(С1-С3)алкілу, гало(С2-С4)алкеніл(С1С3)алкілу, ді(С1-С3)алкілфосфонату, формілу, (С1С3)алкілкарбонілу, гало(С1-С3)алкілкарбонілу, (С1С3)алкокси(С1-С3)алкілкарбонілу, арилкарбонілу і (С1-С3)алкілсульфонілу; - G вибирають з О, S, СН2О* і (СН2)n , де зірочка позначає приєднання до Е, і n є цілим числом, вибраним з 1 і 2, за умови, що Е і G не є одночасно О або S, - х є цілим числом, вибраним з 0 або 1; і коли х дорівнює 1, - А вибирають з О, S(O)p і -NR15, де р є цілим числом, вибраним з 0, 1 і 2, і R15 є таким, як описано раніше; - В є містковою групою, *-(CR16R17)q-(CR18R19)r-(CR20R21)s-Lt-(CR22R23)u(CR24R25)v-(CR26R27)w-, де зірочка позначає приєднання біля A; q, r, s, u, v і w є цілими числами, незалежно вибраними з 0, 1 і 2; і 7 коли q, r, s, u, v або w дорівнюють 1 або 2, R16 до R27, включно, незалежно вибирають з водню, (С1-С3)алкілу, гало(С1-С3)алкілу, (С1С3)алкокси(С1-С3)алкілу і (С3-С6)циклоалкілу; t є цілим числом, вибраним з 0 або 1; і коли t дорівнює 1, L вибирають з СН = Н; О, S(O)p; OS(O)2, С S(O)2O, NR28; N(oксид)R28; NR28SO2; NR28C(=O)NR29; Si(CH3)2; C(O), OC(=O), NHC(=O); ON=CH; HC=NO; C(=O)O; C(=O)NH; C(=NOR 14) і [CR30R31]z, де р є таким, як описано раніше, R28 і R29 незалежно вибирають з водню, (С1-С3)алкілу, (С1-С3)алкілсульфонілу, (С1-С3)алкілкарбонілу, (С2С5)алкенілу і (С2-С5)алкінілу; z є цілим числом, вибраним з 1 або 2; і R30 та R31 незалежно вибирають з водню і (С1-С3)алкілу; - у є цілим числом, вибраним з 0 або 1; і коли у дорівнює 1, - D вибирають з О; S(O)p; і NR15, де р і R15 є такими, як описано раніше, де D є приєднаним до частини бензо-конденсованого кільця, поясненої у формулі І, у будь-якому одному з положень, позначених 1-, 2-, 3- або 4-: - R6, R7, R8 і R9 незалежно вибирають з водню, галогену, (С1-С4)алкілу, (С3-С6)циклоалкілу, (С2С5)алкенілу, (С2-С5)алкінілу, гало(С1-С4)алкілу, (С1С4)алкокси, гало(С1-С4)алкокси, (С1-С4)алкілтіо, гало(С1-С4)алкілтіо, (С1-С4)алкілсульфонілу, гало(С1-С4)алкілсульфонілу, ціаногрупи, нітрогрупи, арилу, алкілкарбоніламіно, арилкарбоніламіно і (С1С4)алкоксикарбоніламіногрупи; - R10 і R11 незалежно вибирають з водню, галогену, гідроксилу, алкілу, галоалкілу, алкокси, або R10 і R11, взяті разом, є =0, що утворює карбонільну групу; або -ОСН2СН2О-або SCH2CH2S-, що утворює кетальну або тіокетальну групу; або NOR15, що утворює оксим, де R15 є таким, як описано раніше; М вибирають з *C(R32R33) і 32 33 34 35 *C(R R )C(R R ), де зірочка позначає приєднання до О, і де R32 до R35 вибирають з галогену, (С1-С4)алкілу, (С1-С4)алкокси(С1С4)алкілу і гало(С1-С4)алкілу; і їхні прийнятні у галузі сільського господарства солі. Переважні сполуки є заміщеними похідними дигідробензофурану, тобто тими, де М є *C(R32R33), і де R32 та R33 є однаковими і є вибраними з алкілу, особливо метилу, і галогену, особливо фтору. Даний винахід також включає композиції, що містять інсектицидно ефективну кількість принаймні однієї сполуки формули І, і, необов'язково, ефективну кількість принаймні однієї додаткової сполуки, з принаймні одним інсектицидно сумісним носієм. 82875 8 Даний винахід також включає способи боротьби з комахами у районі, де контроль є бажаним, які включають застосування інсектицидно ефективної кількості вищезазначеної композиції до місцеположення сільськогосподарських культур, або інших районах, де комахи присутні або, як очікують, будуть присутніми. Даний винахід стосується деяких нових і корисних інсектицидних та акарицидних сполук, а саме (дигалопропеніл)фенілалкілзаміщених дигідробензофуранів або дигідробензопіранів (у подальшому іменованих "сполуками формули І"), як описані загальною формулою І: де - R і R3 незалежно вибирають з водню, галогену, гідроксигрупи, (С1-С3)алкілу, (С3С6)циклоалкілу, (С2-С5)алкенілу, (С2-С5)алкінілу, гало(С1-С3)алкілу, (С1-С3)алкокси, гало(С1С3)алкокси, (С1-С3)алкілтіо, гало(С1-С3)алкілтіо, (С1-С3)алкілсульфонілу, гало(С1С3)алкілсульфонілу, ціаногрупи, нітрогрупи; необов'язково заміщеної аміногрупи, де необов'язковий замісник вибирають з (С1С4)алкілу, (С1-С3)алкілкарбонілу і (С1С3)алкоксикарбонілу; необов'язково заміщеного імідазолілу, необов'язково заміщеного імідазолінілу, необов'язково заміщеного оксазолінілу, необов'язково заміщеного оксазолілу, необов'язково заміщеного оксадіазолілу, необов'язково заміщеного тіазолілу, необов'язково заміщеного піразолілу, необов'язково заміщеного триазолілу, необов'язково заміщеного фуранілу, необов'язково заміщеного тетрагідрофуранілу, необов'язково заміщеного діоксоланілу, необов'язково заміщеного діоксанілу, -C(=J)-K, і -C(R12)-Q-R13, де необов'язковий замісник вибирають з (С1С4)алкілу, гало(С1-С4)алкілу, (С1-С4)алкокси, (С1С4)алкокси(С1-С4)алкілу, (С3-С6)циклоалкілу, (С2С5)алкенілу, (С2-С5)алкінілу, ціаногрупи, нітрогрупи де і арилу; J вибирають з О, S, NR14 і NOR14, де R14 є воднем, (С1-С4)алкілом, гало(С1-С4)алкілом, арилом і арил(С1-С4)алкілом; К вибирають з водню, (С1-С3)алкілу, гало(С1С3)алкілу, (С1-С3)алкокси, (С1-С3)алкіламіно і ді(С1С3)алкіламіногрупи; Q вибирають з О, S і NR14, де R14 є таким, як описано раніше; R12 і R13 незалежно вибирають з водню, (С1С4)алкілу і гало(С1-С4)алкілу, і R12 та R13 можуть бути взяті разом з -T(CHR14)m-, де m є цілим числом від 2 до 4; Т вибирають з О, S і NR14, де R14 є таким, як описано раніше; 9 - R1 і R2 незалежно вибирають з водню, галогену і (С1-С3)алкілу; - R4 є воднем; - R5 незалежно вибирають з галогену; - Е вибирають з СН2, О, S і NR15, де R15 вибирають з водню, (С1-С3)алкілу, (С1С3)алкокси(С1-С3)алкілу, арил(С1-С3)алкілу, (С2С4)алкеніл(С1-С3)алкілу, гало(С2-С4)алкеніл(С1С3)алкілу, ді(С1-С3)алкілфосфонату, формілу, (С1С3)алкілкарбонілу, гало(С1-С3)алкілкарбонілу, (С1С3)алкокси(С1-С3)алкілкарбонілу, арилкарбонілу і (С1-С3)алкілсульфонілу; - G вибирають з О, S, СН2О* і (СН2 )n, де зірочка позначає приєднання до Е, і n є цілим числом, вибраним з 1 і 2, за умови, що Е і G не є одночасно О або S, - х є цілим числом, вибраним з 0 або 1; і коли х дорівнює 1, - А вибирають з О, S(O)p і -NR15, де р є цілим числом, вибраним з 0, 1 і 2, і R15 є таким, як описано раніше; - В є містковою групою, *-(CR16R17)q-(CR18R19)r20 21 (CR R )s-Lr(CR22R23)u-(CR24R25)v-(CR26R27)w-, де зірочка позначає приєднання біля A; q, r, s, u, v і w є цілими числами, незалежно вибраними з 0, 1 і 2; і коли q, r, s, u, v або w дорівнюють 1 або 2, R16 до R27, включно, незалежно вибирають з водню, (С1-С3)алкілу, гало(С1-С3)алкілу, (С1С3)алкокси(С1-С3)алкілу і (С3-С6)циклоалкілу; t є цілим числом, вибраним з 0 або 1; і коли t дорівнює 1, L вибирають з СН = Н; О, S(O)P; OS(O)2, С S(O)2O, NR28; N(оксид)R28; NR28SO2; 28 29 NR C(=O)NR ; Si(CH3)2; C(=O), OC(=O), NHC(=O); ON=CH; HONO; C(=O)O; C(=O)NH; C(=NOR14) і [CR30R31]Z, де р є таким, як описано раніше, R28 і R29 незалежно вибирають з водню, (С1-С3)алкілу, (С1-С3)алкілсульфонілу, (С1-С3)алкілкарбонілу, (С2С5)алкенілу і (С2-С5)алкінілу; z є цілим числом, вибраним з 1 або 2; і R30 та R31 незалежно вибирають з водню і (С1-С3)алкілу; - у є цілим числом, вибраним з 0 або 1; і коли у дорівнює 1, - D вибирають з О; S(O)p; і NR15, де р і R15 є такими, як описано раніше, де D є приєднаним до частини бензо-конденсованого кільця, поясненої у формулі І, у будь-якому одному з положень, позначених 1-, 2-, 3- або 4-: - R6, R7, R8 і R9 незалежно вибирають з водню, галогену, (С1-С4)алкілу, (С3-С6)циклоалкілу, (С2С5)алкенілу, (С2-С5)алкінілу, гало(С1-С4)алкілу, (С1С4)алкокси, гало(С1-С4)алкокси, (С1-С4)алкілтіо, гало(С1-С4)алкілтіо, (С1-С4)алкілсульфонілу, гало(С1-С4)алкілсульфонілу, ціаногрупи, нітрогрупи, арилу, алкілкарбоніламіно, 82875 10 арилкарбоніламіно і (С1С4)алкоксикарбоніламіногрупи; - R10 і R11 незалежно вибирають з водню, галогену, гідроксилу, алкілу, алкокси, або R10 і R11, взяті разом, є =0, що утворює карбонільну групу; ОСН2СН2О або SCH2CH2S, що утворює кетальну або тіокетальну групу; або NOR15, що утворює оксим, де R15 є таким, як описано раніше; М вибирають з *C(R32R33) і 32 33 34 35 *C(R R )C(R R ), де зірочка позначає приєднання до О, і де R32 до R35 вибирають з галогену, (С1-С4)алкілу, (С1-С4)алкокси(С1С4)алкілу і гало(С1-С4)алкілу, і їхніх прийнятних у галузі сільського господарства солей. Переважними сполуками формули І є ті, де R і R3 незалежно вибирають з галогену і (С1С3)алкілу; R1, R2 і R4 є воднем; R5 незалежно вибирають з хлору, брому і фтору; Е є О; G є (СН2)n, де n дорівнює 1; х дорівнює 1, і А є О; і коли q, r, s, u, v і w дорівнюють 1 або 2, R16 до 27 R , включно, є воднем; t дорівнює 0 або 1, і коли t дорівнює 1, L вибирають з О, OС(=O), NHC(=O), ON=CH і CH=NO; у дорівнює 1, і D вибирають з О; S(O)p; і NR15, де р дорівнює 0, і R15 вибирають з водню, (С1-С3)алкілу, арил(С1С3)алкілу, (С2-С4)алкеніл(С 1-С3)алкілу і гало(С2С4)алкеніл(С1-С3)алкілу, де D є приєднаним до бензо-конденсованої частини, поясненої у формулі І, у положенні, позначеному 1 або 4; R6, R7, R8 і R9 незалежно вибирають з водню, галогену, гало(С1-С4)алкілу і нітрогрупи; R10 і R11 є воднем, або R10 і R11, взяті разом, є =0, що утворює карбонільну групу; і М є C(R32R33), де R32 і R33 є незалежно (С1С4)алкілом. Особливо переважними сполуками є сполуки формули II де: - R1 і R2 є воднем; - R і R3 вибирають з галогену, особливо хлору, і (С1-С3)алкілу, особливо метилу; 11 - R5 є галогеном, особливо хлором або бромом; 7ЯQ - R , R і R є воднем, галогеном, галоалкілом або нітрогрупою, особливо воднем; - R10 і R11 є воднем, або, взяті разом, є =0, особливо воднем; - В є (СH2)n, де n є цілим числом від 2 to 6; і - М є C(R32R33), де R32R33 є галогеном або (С1С4)алкілом, особливо (С1-С4)алкілом і найбільш особливо, метилом. Більш особливо переважними сполуками формули II є ті, де R, R3 і R5 є хлором; п дорівнює 3 або 4 і R32 та R33 є (С1-С4)алкілом. Особливо переважною сполукою є та, що має структуру формули III нижче: а саме, 5-(3,3-дихлорпроп-2-енілокси)-2-[4(2,2-диметил(2,3-дигідробензо[2,3-b]фуран-7ілокси))бутокси]-1,3-дихлорбензол. Крім того, у деяких випадках сполуки за даним винаходом можуть мати центри асиметрії, які можуть давати початок оптичним енантіоморфним модифікаціям і діастереоізомерам. Ці сполуки можуть існувати у двох або більшій кількості форм, тобто поліморфних модифікацій, які суттєво відрізняються за фізичними і хімічними властивостями. Сполуки за даним винаходом можуть також існувати як таутомери, в яких переміщення атома водню всередині молекули призводить до двох або більшої кількості структур, які знаходяться у рівновазі. Сполуки за даним винаходом можуть також мати кислотні або основні частини, які можуть передбачати утворення прийнятних у галузі сільського господарства солей або прийнятних у галузі сільського господарства комплексних сполук металів. Даний винахід включає використання таких енантіоморфних модифікацій, поліморфних модифікацій, таутомерів, солей і комплексних сполук металів. Прийнятні у галузі сільського господарства солі і комплексні сполуки металів включають, без обмеження, наприклад, солі амонію, солі органічних і неорганічних кислот, таких як хлористоводнева кислота, сульфонова кислота, етансульфонова кислота, трифтороцтова кислота, метилбензолсульфонова кислота, фосфорна кислота, глюконова кислота, памова кислота, та солі інших кислот, і комплексні сполуки лужного металу і лужноземельного металу з, наприклад, натрієм, калієм, літієм, магнієм, кальцієм та іншими металами. Способи за даним винаходом включають спричинення того, щоб інсектицидно ефективна кількість сполуки формули І була застосована до комах для того, щоб знищити або контролювати комах. Переважними інсектицидно ефективними кількостями є ті, що достатні, щоб вбити комаху. В межах обсягу даного винаходу знаходиться спричинення присутності сполуки формули І 82875 12 всередині комах шляхом контактування комах із похідним цієї сполуки, яке перетворюється всередині комахи на сполуку формули І. Даний винахід включає використання таких сполук, які називають про-інсектицидами. Ще один аспект даного винаходу стосується композицій, що містять інсектицидно ефективну кількість принаймні однієї сполуки формули І. Ще один аспект даного винаходу стосується композицій, що містять інсектицидно ефективну кількість принаймні однієї сполуки формули І, та ефективну кількість принаймні однієї додаткової сполуки. Ще один аспект даного винаходу стосується способів боротьби з комахами шляхом застосування інсектицидно ефективної кількості композиції, як зазначена вище, до місцеположення сільськогосподарських культур, таких як, без обмеження, зернові культури, бавовник, овочі і фрукти, або інших районів, де комахи присутні або, як очікують, будуть присутніми. Даний винахід також включає використання сполук і композицій, зазначених тут, для боротьби з видами комах, що не мають стосунку до сільського господарства, наприклад, калотермітидами і ринотермітидами; а також для використання як фармацевтичні речовини. У галузі ветеринарної медицини сполуки за даним винаходом, як очікують, будуть ефективними проти деяких ендо-та ектопаразитів, таких як комахи і глисти, які паразитують на тваринах. Приклади таких паразитів тварин включають, без обмеження, Gastrophilus spp., Stomoxys spp., Trichodectes spp., Rhodnius spp., Ctenocephalides canis тавжито у цьому описі винаходу, і якщо не Як інші види. вказане інше, терміни для замісників "алкіл" та "алкокси", вжиті окремо або як частина більшої структури, включають прямі або розгалужені ланцюги з принаймні одного або двох атомів вуглецю, як підходить для замісника, і переважно, до дванадцяти атомів вуглецю, більш переважно, до десяти атомів вуглецю, найбільш переважно, до семи атомів вуглецю. Терміни "алкеніл" та "алкініл", вжиті окремо абояк частина більшої структури, включають прямі або розгалужені ланцюги з принаймні двох атомів вуглецю, що містять принаймні один вуглець-вуглецевий подвійний або потрійний зв'язок, і переважно, до дванадцяти атомів вуглецю, більш переважно, до десяти атомів вуглецю, найбільш переважно, до семи атомів вуглецю. Термін "арил" стосується ароматичної кільцевої структури, включаючи конденсовані кільця, що має від шести до десяти атомів вуглецю, наприклад, феніл або нафтил. Термін "гетероарил" стосується ароматичної кільцевої структури, включаючи конденсовані кільця, в якій принаймні один з атомів є відмінним від вуглецю, наприклад, є, без обмеження, сіркою, киснем або азотом. Термін "ГХ аналіз" стосується газохроматографічного аналізу, у той час як термін "ТШХ аналіз" стосується аналізу, наприклад, реакційної суміші методом тонкошарової хроматографії. Термін "РХВТ" стосується рідинної хроматографії високого тиску, як це стосується, наприклад, способу розділення компонентів 13 82875 14 реакційної суміші. Термін "ДМФ" стосується N,Nдиметилформаміду. Термін "ТГФ" стосується тетрагідрофурану. Термін "галоген" або "'гало" стосується фтору, брому, йоду або хлору. Термін "температура навколишнього середовища" або "кімнатна температура", часто скорочений як "КТ", наприклад, по відношенню до температури хімічної реакційної суміші, стосується температури у діапазоні від 20°С до 30°С. Терміни "інсектицидний" або "акарицидний", "інсектицид" або "акарицид" стосуються сполуки за даним винаходом, або однієї, або у суміші з принаймні однією додатковою сполукою, або з принаймні одним сумісним носієм, яка спричиняє знищення або інгібування дії комах або кліщів. Термін "незалежно вибраний з", як зазначено вище і в розділі формули винаходу даного патентного опису, стосується можливості того, що частини молекули, наприклад, R5, можуть бути однаковими, або вони можуть бути різними в межах групи, де роблять вибір. Заміщені похідні арилалкену формули І можуть бути синтезовані способами, що індивідуально відомі фахівцеві у даній галузі, з доступних проміжних сполук. Схема 1 нижче ілюструє загальну методику синтезування заміщених арилалкенових сполук формули І, між іншим, де, наприклад, R1, R2, R4, R7, R8, R9, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, де D є приєднаним до бензо-конденсованого кільця у положенні, позначеному як 1; і G є (СН2)П , де п дорівнює 1. а) К2СО3/ДМФ/КТ b) К2СО3/ДМФ/80°С c) H2/10%Pd на вуглеці/ЕtOН d) К2СО3/ДМФ/80°С На першому етапі, як зображено на схемі 1, відповідно заміщений фенол, наприклад, відома сполука 2,6-дихлор-4-фенілметоксифенол, реагував за основних умов із похідним галогеналкану з бажаною довжиною вуглецевого ланцюга, наприклад, 1-бром-4-хлорбутаном, щоб приєднати місткову групу В, таким чином утворюючи відповідний 1,3-дихлор-2-(4 хлорбутокси)-5-(фенілметокси)бензол (А). Проміжна сполука (А) далі реагувала за основних умов із, наприклад, відомою сполукою 2,2диметил-2,3-дигідробензо[b]фуран-7-олом, щоб приєднати частину D, а також бензо-конденсоване кільце, утворюючи відповідний 2-[4-(2,2-диметил(2,3-дигідробензо[2,3-b]фуран-7-ілокси))бутокси]1,3-дихлор-5-(фенілметокси)-бензол (В). Проміжну сполуку (В), наприклад, 2-[4-(2,2-диметил-(2,3дигідробензо[2,3-b]фуран-7-ілокси))бутокси]-1,3 15 82875 16 дихлор-5-(фенілметокси)бензол, як зазначено вище, далі відновлювали газоподібним воднем у присутності каталізатора, наприклад, 10% паладію на вуглеці, забезпечуючи відповідний 4-[4-(2,2диметил(2,3-дигідробензо[2,3-b]фуран-7ілокси))бутокси]-3,5-дихлорфенол (С). Проміжна сполука (С) далі реагувала за основних умов з, наприклад, 1,1,1,3-тетрахлорпропаном, який одночасно дегідрогалогенізується, таким чином вводячи частину -E-G-C(R4)=C(R5)(R5) у молекулу, щоб забезпечити сполуку 12, нову сполуку формули І. Нижченаведений приклад 1 забезпечує детальний опис способу, як була приготована сполука 12, показана на схемі 1. Схема 2 нижче ілюструє загальну методику синтезування заміщених арилалкенових похідних формули І, між іншим, де, наприклад, R1, R2, R4, R7, R і R є воднем; R10 і R11 взяті разом з О, щоб утворити карбонільну групу; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, де D є приєднаним до бензо-конденсованого кільця у положенні, позначеному як 1; і G є (СКУп, де п дорівнює 1. Як зображено на схемі 2, деякі сполуки за даним винаходом, тобто сполуки формули І, можуть далі реагувати, щоб забезпечити додаткові сполуки формули І. Наприклад, сполуку 12 окислювали персульфатом калію і пентагідратом сульфату міді, одержуючи відповідне кетонове похідне (сполука 36), де R10 і R11 взяті разом з О, щоб утворити карбонільну групу. Нижченаведений приклад 2 забезпечує детальний опис способу, як була приготована сполука 36, показана на схемі 2. Схема 3 нижче ілюструє загальну методику синтезування заміщених арилалкенових сполук формули І, де, наприклад, R1, R2, R4, R10 і R11 є воднем; R7, R8 або R9 можуть бути замісником, відмінним від водню, наприклад, R8 є 3 3 трифторметилом; R, R і R є хлором; М є C(R32R33)-, де R32 і R33 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; x і у дорівнюють 1; A, D і Е є О, де D є приєднаним до бензо-конденсованого кільця у положенні, позначеному як 1; і G є (СН2)n , де n дорівнює 1. 17 f) H2/10% Pd на C/EtOH g) I 2/тpeтBuONO/CH3CN/0°C до КТ h) FSO2CF2CO2CH3/CuI/ДMФ/80°C i) NaOH/H2O/CH3OH/40°C j) К2СО3/ДМФ/80°С k) H2/10% Pd на C/EtOH 1) К2СО3/ДМФ/80°С m) (Ph)3P/CBr4/CH2Cl2 n) К2СО3/ДМФ/КТ Схема 3, як зображена, пропонує альтернативний шлях для сполук за даним винаходом, який відрізняється від шляху, що наведений на схемі 1. Шлях за схемою 3 є особливо корисним для додавання замісника до бензольної частини компонента бензоконденсованого кільця. Відповідно, у першій послідовності етапів відому сполуку 2,2-диметил5-нітро-2,3-дигідробензо[2,3-b]фуран-7-іл ацетат відновлювали шляхом гідрогенізації за каталітичних умов, одержуючи відповідну 5-аміно проміжну сполуку (D). Проміжну сполуку (D) далі обробляли трет-бутилнітритом, потім галогенізували, наприклад, атомарним йодом, одержуючи у результаті відповідний 5-йод-2,2диметил-2,3-дигідробензо[2,3-b]фуран-7-іл ацетат (Е). Проміжну сполуку (Е), у свою чергу, галогеналкілували 2,2-дифтор-2-фторсульфоніл ацетатом і йодидом міді, забезпечуючи відповідний 2,2-диметил-5-(трифторметил)-2,3дигідробензо[2,3-b]фуран-7-іл ацетат (F), який, у свою чергу, позбавляли захисних груп шляхом оброблення його сильною основою, одержуючи відповідний 2,2-диметил-5-(трифторметил)-2,3дигідробензо[2,3-b]фуран-7-ол (G). 2,6-дихлор-4У другій послідовності етапів фенілметоксифенол (відома сполука) реагував за 82875 18 основних умов з, наприклад, 4-хлорбутан-1-олом, як засобом приєднання місткової групи В, даючи у результаті відповідну проміжну сполуку 4-[2,6дихлор-4-(фенілметокси)фенокси]бутан-1-ол (Н). Проміжну сполуку (Н) далі позбавляли захисних груп шляхом відщеплення фенілметильної частини, використовуючи гідрогенізацію за каталітичних умов, і одержували відповідну фенольну проміжну сполуку (J), яка, у свою чергу, реагувала з, наприклад, 1,1,1,3тетрахлорпропаном за основних умов, даючи відповідну бутанольну проміжну сполуку (К). Проміжну сполуку (К) потім бромували, наприклад, чотирибромистим вуглецем і трифенілфосфіном, забезпечуючи відповідну бромбутанову проміжну сполуку (L). Проміжна сполука (L), у свою чергу, реагувала з проміжною сполукою (G) за основних умов, даючи сполуку формули І, де, наприклад, R8 є трифторметилом (сполука 20). Нижченаведений приклад 3 забезпечує детальний опис способу, як була приготована сполука 20, показана на схемі 3. Схема 4 нижче ілюструє загальну методику синтезування заміщених арилалкенових сполук формули І, де, наприклад, R1, R2, R4, R7, R8, R9, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і t дорівнюють 1, де R16, R17, R18, R19, R20 і R21 є воднем і L є NHC(=O), u, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, де D є приєднаним до бензо-конденсованого кільця у положенні, позначеному 1; і G є (СН2)n, де n дорівнює 1. 19 о) СН2С12/КТ р) К2СО3/ДМФ q) Н2/10% Pd на C/1:1 EtOAc-C2H5OH/KT r) К2СО3/ДМФ/КТ-80°С s) 2н. НСl в Et2O t) Et3N/CH2Cl2/CH3CN Схема 4, як зображена, забезпечує шлях для сполук за даним винаходом, де, між іншим, t дорівнює 1 і L є, наприклад, такою частиною, як NHC(=O). Відповідно, як перший етап, готували 2,2-диметил-2,3-дигідробензо[2,3-b]фуран-7-іл імідазолкарбоксилат (М), захищаючи гідроксильну групу 2,2-диметил-2,3-дигідробензо[2,3-b]фуран-7олу шляхом її реакції з 1,1¢-карбонілдіімідазолом. У ще одній послідовності реакцій 2,6-дихлор-4фенілметоксифенол спочатку реагував із, наприклад, (трет-бутокси)-N-(3бромпропіл)карбоксамідом за основних умов, забезпечуючи N-{3-[2,6-дихлор-4(фенілметокси)фенокси]пропіл}(третбутокси)карбоксамід (N). Проміжну сполуку (N) 82875 20 далі позбавляли захисних груп шляхом відщеплення фенілметильної частини, використовуючи гідрогенізацію за каталітичних умов, і одержували відповідну фенольну проміжну сполуку (О), яка, у свою чергу, реагувала з, наприклад, 1,1,1,3-тетрахлорпропаном за основних умов, даючи відповідну карбоксамідну проміжну сполука (Р). Відщеплення третбутоксикарбонільної частини від проміжної сполуки (Р) за кислотних умов давало у результаті, наприклад, амінгідрохлоридну сіль проміжної сполуки (Q), яка потім реагувала з проміжною сполукою (М) за основних умов, даючи сполуку формули І, де, наприклад, L є NHC(=O) (сполука 53). Нижченаведений приклад 4 забезпечує детальний опис способу, як була приготована сполука 53, показана на схемі 4. 21 Фахівець у даній галузі буде, звичайно, усвідомлювати, що препаративна форма і спосіб застосування токсичної речовини можуть впливати на активність матеріалу у даному застосуванні. Так, для сільськогосподарського використання дані інсектицидні сполуки можуть бути сформульовані як гранульовані з відносно великим розміром частинок (наприклад, 8/16 або 4/8 меш США), як водорозчинні або вододисперговані гранули, як дрібний пил, як змочувальні порошки, як концентрати емульсій, як водні емульсії, як розчини, або як будь-який інший відомий тип корисних у галузі сільського господарства препаративних форм, у залежності від бажаного способу застосування. Слід розуміти, що кількості, визначені у цьому описі винаходу, призначені бути лише приблизними, так якби перед зазначеними кількостями було поміщене слово "приблизно". Ці інсектицидні композиції можуть бути застосовані або як водорозчинні аерозолі, або як пилоподібні препарати, або як гранули, на ділянках, де бажаним є знищення комах. Ці препаративні форми можуть містити від такої малої кількості, як 0,1%, 0,2% або 0,5%, до такої великої кількості, як 95% або більше, за масою, діючої речовини. препарати є сипкими сумішами Пилоподібні діючої речовини з тонко подрібненими твердими речовинами, такими як тальк, природні глини, кізельгур, дрібні порошки, такі як шкаралупа волоських горіхів і борошно з насіння бавовнику, та інші органічні і неорганічні тверді речовини, які діють як диспергатори і носії для токсичної речовини; ці тонко подрібнені тверді речовини мають середній розмір частинок менший ніж приблизно 50 мікронів. Типовою пилоподібною препаративною формою, корисною тут, є така, що містить 1,0 частину або менше інсектицидної сполуки і 99,0 частин тальку. Змочувальні порошки, також корисні препаративні форми для інсектицидів, знаходяться у формі тонко подрібнених частинок, що легко диспергуються у воді або іншому диспергаторі. Змочувальний порошок у кінцевому підсумку застосовують до місцеположення, де необхідно контролювати комах, або у вигляді сухого пилу, або як емульсію у воді або іншій рідині. Типові носії для змочувальних порошків включають фуллерову землю, каолінові глини, кремнеземи та інші добре абсорбуючі, легко змочувані неорганічні розріджувачі. Звичайно готують змочувальні порошки, які містять приблизно 5-80% діючої речовини, в залежності від поглинаючої здатності носія, і звичайно містять також невелику кількість змочувальної, диспергувальної або емульгувальної речовини, щоб сприяти диспергуванню. Наприклад, корисна препаративна форма змочувального порошку містить 80,0 частин інсектицидної сполуки, 17,9 частин глини пальметто і 1,0 частину лігносульфонату натрію та 0,3 частини сульфонованого аліфатичного поліефіру як змочувальні речовини. Додаткову змочувальну речовину і/або масло часто додаватимуть до бакової суміші для того, щоб полегшити диспергування на листі рослини. 82875 22 Іншими корисними препаративними формами для інсектицидних застосувань є концентрати емульсій, які є гомогенними рідкими композиціями, диспергованими у воді або іншому диспергаторі, і можуть складатися повністю з інсектицидної сполуки і рідкої або твердої емульгувальної речовини, або можуть також містити рідкий носій, такий як ксилол, важкі ароматичні бензиноволігроїнові фракції, ізофорон або інші нелеткі органічні розчинники. Для інсектицидного застосування ці концентрати диспергують у воді або іншому рідкому носієві і звичайно застосовують як розпилюваний розчин на ділянці, яка має бути оброблена. Відсоток за масою основної діючої речовини може змінюватися відповідно до способу, у який має бути застосована композиція, але загалом складає від 0,5% до 95% діючої речовини, за масою інсектицидної композиції. Плинні препаративні форми є подібними до концентратів емульсій, за винятком того, що діючу речовину суспендують у рідкому носієві, як правило, воді. Плинні препаративні форми, подібно до концентратів емульсій, можуть включати невелику кількість поверхнево-активної речовини, і будуть типово містити діючі речовини у діапазоні від 0,5% до 95%, часто від 10% до 50%, за масою композиції. Для застосування плинні препаративні форми можуть бути розведені у воді або іншому рідкому розчиннику і звичайно застосовані як розпилюваний розчин на ділянці, яка має бути оброблена. Типові змочувальні, диспергувальні або емульгувальні речовини, використовувані у сільськогосподарських препаративних формах, включають, але не обмежуються ними, алкіл- і алкіларилсульфонати і сульфати та їхні натрієві солі; алкіларилполіефірні спирти; сульфатовані вищі спирти; поліетиленоксиди; сульфоновані тваринні жири і рослинні олії; сульфоновані мінеральні масла; складні ефіри жирних кислот з багатоатомними спиртами і продукти приєднання етиленоксиду до таких складних ефірів; і продукт приєднання довголанцюгових меркаптанів і етиленоксиду. Багато інших типів корисних поверхнево-активних речовин доступні у торговій практиці. Поверхнево-активні речовини, коли їх використовують, звичайно складають від 1% до 15%, за масою композиції. Інші корисні препаративні форми включають суспензії діючої речовини у відносно нелеткому розчиннику, такому як вода, кукурудзяна олія, гас, пропіленгліколь, або інших придатних розчинниках. Ще інші корисні препаративні форми для інсектицидних застосувань включають істинні розчини діючої речовини у розчиннику, в якому вона повністю розчинна при бажаній концентрації, такому як ацетон, алкіловані нафталіни, ксилол або інші органічні розчинники. Гранульовані препаративні форми, де токсична речовина нанесена на відносно великі частинки, є особливо корисними для розподілу повітряним шляхом або для проникнення крізь покрив покривних культур. Також можуть бути використані розпилювані розчини, що знаходяться під тиском, типово, аерозолі, де діюча речовина диспергована у тонко 23 подрібненій формі в результаті випаровування низькокиплячого диспергувального розчинниканосія. Водорозчинні або вододисперговані гранули є сипкими, такими, що не пилять, і легко розчинними у воді або змішуваними з водою. При використанні фермером на полі, гранульовані препаративні форми, концентрати емульсій, плинні концентрати, водні емульсії, розчини і т.д., можуть бути розведені водою, щоб одержати концентрацію діючої речовини у діапазоні від приблизно 0,1% або 0,2% до 1,5% або 2%. Активні інсектицидні сполуки за даним винаходом можуть бути сформульовані і/або застосовані з однією або більшою кількістю додаткових сполук. Такі поєднання можуть забезпечити певні переваги, такі як, без обмеження, прояв синергетичних ефектів для більшого контролю комах-шкідників, зменшення норм витрати інсектициду, і, таким чином, мінімізація будь-якого впливу на навколишнє середовище і на безпеку працюючих, контроль ширшого спектра комах-шкідників, збереження хлібних злаків від фітотоксичності і поліпшення толерантності нецільових видів, таких як ссавці і риба. Додаткові сполуки включають, без обмеження, інші пестициди, регулятори росту, добрива, структуроутворювачі ґрунту, або інші сільськогосподарські хімічні речовини. При використанні активної сполуки за даним винаходом, сформульованої або як сама по собі, або з іншими сільськогосподарськими хімічними речовинами, звичайно, застосовують ефективну кількість і концентрацію активної сполуки; ця кількість може варіювати у діапазоні, наприклад, від приблизно 0,001 до приблизно 3кг/га, переважно, від приблизно 0,03 до приблизно 1кг/га. Для польового використання, де існують втрати інсектициду, можуть бути застосовані вищі норми витрат (наприклад, у чотири рази у порівнянніактивні інсектицидні згаданимиза даним Коли з нормами витрати, сполуки вище). винаходом використовують у поєднанні з однією або більшою кількістю додаткових сполук, наприклад, з іншими пестицидами, такими як гербіциди, ці гербіциди включають, без обмеження, наприклад: Н-(фосфонометил)гліцин ("гліфосат"); арилоксіалканові кислоти, такі як (2,4дихлорфенокси)оцтова кислота ("2,4-D"), (4-хлор2-метилфенокси)оцтова кислота ("МСРА"), (+/-)-2(4-хлор-2-метилфенокси)-пропіонова кислота ("МСРР"); сечовини, такі як N,N-диметил-N'-[4-(1метилетил)феніл]сечовина ("ізопротурон"); імідазолінони, такі як 2-[4,5-дигідро-4-метил-4-(1метилетил)-5-оксо-1Н-імідазол-2-іл]-3піридинкарбонова кислота ("імазапір"), продукт реакції, що містить (+/-)-2-[4,5-дигідро-4-метил-4(1-метилетил)-5-оксо-1Н-імідазол-2-іл]-4метилбензойну кислоту і (+/-)-2-[4,5-дигідро-4метил-4-(1-метилетил)-5-оксо-1Н-імідазол-2-іл]-5метилбензойну кислоту ("імазаметабенз"), (+/-)-2[4,5-дигідро-4-метил-4-(1-метилетил)-5-оксо-1Німідазол-2-іл]-5-етил-3-піридинкарбонова кислота ("імазетапір") і (+/-)-2-[4,5-дигідро-4-метил-4-(1метилетил)-5-оксо-1Н-імідазол-2-іл]-3хінолінкарбонова кислота ("імазахін"); дифенілові ефіри, такі як 5-[2-хлор-4 82875 24 (трифторметил)фенокси]-2-нітробензойна кислота ("ацифлуорфен"), метил 5-(2,4-дихлорфенокси)-2нітробензоат ("біфенокс") і 5-[2-хлор-4(трифторметил)-фенокси]-М-(метилсульфоніл)-2нітробензамід ("фомасафен"); гідроксибензонітрили, такі як 4-гідрокси-3,5дийодбензонітрил ("іоксоніл") і 3,5-дибром-4гідроксибензонітрил ("бромоксоніл"); сульфонілсечовини, такі як 2-[[[[(4-хлор-6-метокси2піримідиніл)аміно]карбоніл]аміно]сульфоніл]бензо йна кислота ("хлоримурон"), 2-хлор-Н-[[(4-метокси6-метил-1,3,5-триазин-2-іл)аміно]карбоніл]бензолсульфонамід ("ахлорсульфурон"), 2-[[[[[(4,6диметокси-2-піримідиніл)аміно]карбоніл]аміно]сульфоніл]метил]бензойна кислота ("бенсульфурон"), 2-[[[[(4,6-диметокси-2піримідиніл)аміно]карбоніл]аміно]сульфоніл]-1метил-1Н-піразол-4-карбонова кислота ("піразосульфурон"), 3-[[[[(4-метокси-6-метил-1,3,5триазин-2-іл)аміно]карбоніл]аміно]сульфоніл]-2тіофенкарбонова кислота ("тифенсульфурон") і 2-(2-хлоретокси)-N[[(4метокси-6-метил-1,3,5-триазин-2іл)аміно]карбоніл]бензолсульфонамід ("триасульфурон"); 2-(4-арилокси-фенокси)алканові кислоти, такі як (+/-)-2-[4-[(6-хлор-2бензоксазоліл)окси]фенокси]-пропіонова кислота ("феноксапроп"), (+/-)-2-[4[[5-(трифторметил)-2піридиніл]окси]фенокси]пропіонова кислота ("флуазифоп"), (+/-)-2-[4-(6-хлор-2хіноксалініл)окси]фенокси]пропіонова кислота ("хізалофоп") і (+/-)-2-[(2,4дихлорфенокси)фенокси]пропіонова кислота ("диклофоп"); бензотіадіазинони, такі як 3-(1метилетил)-1Н-1,2,3-бензотіадіазин-4(3Н)-оне-2,2діоксид ("бентазон"); 2-хлорацетаніліди, такі як N(бутоксиметил)-2-хлор-N-(2,6діетилфеніл)ацетамід ("бутахлор"), 2-хлор-N-(2етил-6-метилфеніл)-N-(2-метокси-1метилетил)ацетамід ("метолахлор"), 2-хлор-N(етоксиметил)-N-(2-етил-6-метилфеніл)ацетамід ("ацетохлор") і (RS)-2-хлор-N-(2,4-диметил-3тієніл)-N-(2-метокси-1-метил етил)-ацетамід ("диметенамід"); аренкарбонові кислоти, такі як 3,6-дихлор-2-метоксибензойна кислота ("дикамба"); піридилоксіоцтові кислоти, такі як [(4аміно-3,5-дихлор-6-фтор-2-піридиніл)оксі]оцтова кислота ("флуроксипір"), та інші гербіциди. Коли активні інсектицидні сполуки за даним винаходом використовують у поєднанні з однією або більшою кількістю додаткових сполук, наприклад, з іншими пестицидами, такими як інші інсектициди, ці інші інсектициди включають, наприклад: фосфорорганічні інсектициди, такі як хлорпірифос, діазинон, диметоат, малатіон, паратіон-метил і тербуфос; піретроїдні інсектициди, такі як фенвалерат, дельтаметрин, фенпропатрин, цифлутрин, флуцитринат, альфациперметрин, біфентрин, циперметрин, розділений цигалотрин, етофенпрокс, есфенвалерат, тралометрин, тефлутрин, циклопротрин, бетацифлутрин і акринатрин; карбаматні інсектициди, такі як альдекарб, карбарил, карбофуран і метоміл; хлорорганічні 25 інсектициди, такі як ендосульфан, ендрин, гептахлор і ліндан; інсектициди -похідні бензоїлсечовини, такі як дифлубенурон, трифлумурон, тефлубензурон, хлорфлуазурон, флуциклоксурон, гексафлумурон, флуфеноксурон і люфенурон; та інші інсектициди, такі як амітраз, клофентезін, фенпіроксимат, гекситіазокс, спіносад та імідаклоприд. Коли активні інсектицидні сполуки за даним винаходом використовують у поєднанні з однією або більшою кількістю додаткових сполук, наприклад, з іншими пестицидами, такими як фунгіциди, ці фунгіциди включають, наприклад: бензімідазольні фунгіциди, такі як беноміл, карбендазим, тіабендазол і тіофанат-метил; 1,2,4триазольні фунгіциди, такі як епоксиконазол, ципроконазол, флузилазол, флутриафол, пропіконазол, тебуконазол, триадимефон і триадименол; заміщені анілідні фунгіциди, такі як металаксил, оксадиксил, процимідон і вінклозолін; фосфорорганічні фунгіциди, такі як фосетил, іпробенфос, піразофос, едифенфос і толклофосметил; морфолінові фунгіциди, такі як фенпропіморф, тридеморф і додеморф; інші системні фунгіциди, такі як фенаримол, імазаліл, прохлораз, трициклазол і трифорин; дитіокарбаматні фунгіциди, такі як манкоцеб, манеб, пропінеб, цинеб і цирам; несистемні фунгіциди, такі як хлороталоніл, дихлофлуанід, дитіанон та іпродіон, каптан, динокап, додин, флуазинам, глуазатин, пентахлорнітробензол, пенцикурон, хінтозен, трициламід і валідаміцин; неорганічні фунгіциди, такі як препарати міді і сірки, та інші фунгіциди. Коли активні інсектицидні сполуки за даним винаходом використовують у поєднанні з однією або більшою кількістю додаткових сполук, наприклад, з іншими пестицидами, такими як нематоциди, ці нематоциди включають, наприклад: карбофуран, карбосульфан, тербуфос, альдикарб, етопроп, фенамфос, оксаміл, ізазофос, кадусафос та інші нематоциди. Коли активні інсектицидні сполуки за даним винаходом використовують у поєднанніз однією або більшою кількістю додаткових сполук, наприклад, з іншими матеріалами, такими як регулятори росту рослин, ці регулятори росту рослин включають, наприклад: гідразид малеїнової кислоти, хлормекват, етефон, гіберелін, мепікват, тідіазон, інабенфід, триафентенол, паклобутразол, унаконазол, DCPA (дихлор-2-піридинкарбонова кислота), прогексадіон, тринекзапак-етил та інші регулятори росту рослин. Структуроутворювачі ґрунту є матеріалами, які при додаванні до ґрунту сприяють різноманітним перевагам для ефективного росту рослин. Структуроутворювачі ґрунту використовують для того, щоб зменшити ущільнення ґрунту, підтримувати і підвищувати ефективність дренажу, поліпшувати водопроникність ґрунту, сприяти оптимальному вмісту у ґрунті рослинних поживних речовин і сприяти кращому включенню пестицидів і добрив. Коли активні інсектицидні сполуки за даним винаходом використовують у поєднанні з однією або більшою кількістю додаткових сполук, наприклад, з іншими матеріалами, такими як 82875 26 структуроутворювачі ґрунту, ці структуроутворювачі ґрунту включають органічну речовину, таку як гумус, яка сприяє утримуванню катіонів поживних речовин для рослин у ґрунті; суміші катіонів поживних речовин, таких як комплексні сполуки кальцію, магнію, калію, натрію і водню; або склад мікроорганізмів, які підтримують у ґрунті умови, сприятливі для росту рослин. Такий склад мікроорганізмів включає, наприклад, bacillus, pseudomonas, azotobacter, azospirillum, rhizobium і ґрунтові cyanobacteria. Добрива є харчовими добавками для рослин, які звичайно містять азот, фосфор і калій. Коли активні інсектицидні сполуки за даним винаходом використовують у поєднанні з однією або більшою кількістю додаткових сполук, наприклад, з іншими матеріалами, такими як добрива, ці добрива включають азотні добрива, такі як сульфат амонію, нітрат амонію і кісткове борошно; фосфатні добрива, такі як суперфосфат, подвійний суперфосфат, сульфат амонію і сульфат диамонію; і калієві добрива, такі як хлорид калію, сульфат калію і нітрат калію, та інші добрива. Нижченаведені приклади далі ілюструють даний винахід, але, звичайно, їх не слід тлумачити як такі, що у будь-який спосіб обмежують його обсяг. Приклади організовані так, щоб представити протоколи для синтезу сполук формули І за даним винаходом, сформулювати перелік таких синтезованих видів молекул, і викласти певні біологічні дані, що вказують на ефективність1таких сполук. Приклад Цей приклад ілюструє приготування 5-(3,3дихлорпроп-2-енілокси)-2-[4-(2,2-диметил(2,3дигідробензо[2,3-b]фуран-7-ілокси))бутокси]-1,3дихлорбензолу (сполука 12 у таблиці нижче). Етап А. Синтез 1,3-дихлор-2-(4-хлорбутокси)5-(фенілметокси)бензолу як проміжної сполуки Розчин, що перемішується, 7,5г (0,028моль) 2,6-дихлор-4-фенілметоксифенолу (відома сполука) і 3мл (0,030моль) 1-бром-4-хлорбутану у 225мл ДМФ охолоджували на льодяній бані, і додавали 5,8г (0,042моль) карбонату калію. Після закінчення додавання реакційній суміші давали змогу нагрітися до температури навколишнього середовища, оскільки її перемішували протягом приблизно 18 годин. Потім реакційну суміш виливали у 1000мл насиченого водного розчину хлориду натрію. Суміш екстрагували чотирма порціями по 150мл діетилового ефіру, і об'єднані екстракти промивали 50мл води. Органічний шар сушили сульфатом натрію, фільтрували і концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш дихлорметан-гексан (1:3). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 6,7г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався 2-[4-(2,2-диметил(2,3Етап В. Синтез із запропонованою дигідробензо[2,3-b]фуран-7-ілокси))бутокси]-1,3структурою. дихпор-5-(фенілметокси)бензолу як проміжної сполуки Розчин, що перемішується, 1,0г (0,0028моль) 1,3-дихлор-2-(4-хлорбутокси)-5(фенілметокси)бензолу, 0,6г (0,0034моль) 2,2 27 диметил-2,3-дигідробензо[b]-фуран-7-олу (відома сполука) і 0,6г (0,0043моль) карбонату калію у 25мл ДМФ нагрівали при 80°С протягом приблизно 18 годин. Через цей час реакційну суміш охолоджували і додавали 50мл води. Потім суміш екстрагували трьома порціями по 25мл діетилового ефіру. Об'єднані екстракти промивали 25мл насиченого водного розчину хлориду натрію. Органічний шар сушили сульфатом натрію, фільтрували і концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюенти суміші дихлорметан-гексан (1:3) і дихлорметангексан (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 0,87г зазначеної у заголовкусполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап С. Синтез 4-[4-(2,2-диметил(2,3дигідробензо[2,3-b]фуран-7-ілокси))бутокси]-3,5дихлорфенолу як проміжної сполуки Суміш 0,67г (0,0014моль) 2-[4-(2,2диметил(2,3-дигідробензо[2,3-b]фуран-7ілокси))бутокси]-1,3-дихлор-5(фенілметокси)бензолу і 0,01г (каталізатор) 10% паладію на вуглеці в 75мл метанолу піддавали умовам каталітичної гідрогенізації, використовуючи гідрогенізатор Парра, одержуючи 0,55г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап D. Синтез сполуки 12 Розчин, що перемішується, 0,44г (0,0011моль) 4-[4-(2,2-диметил(2,3-дигідробензо[2,3-b]фуран-7ілокси))бутокси]-3,5-дихлорфенолу, 0,3г (0,0015моль) of 1,1,1,3-тетрахлорпропану і 0,3г (0,0022моль) карбонату калію у 25мл ДМФ нагрівали при 80°С протягом приблизно 18 годин. Через цей час реакційну суміш охолоджували і потім її виливали у 50мл води. Суміш насичували твердим хлоридом натрію та екстрагували трьома порціями по 25мл діетилового ефіру. Об'єднані екстракти промивали 25мл води і сушили сульфатом натрію. Суміш відфільтровували, і фільтрат концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш дихлорметан-гексан (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 0,39г сполуки 15. Спектр ЯМР узгоджувався із запропонованою структурою. Приклад 2 Цей приклад ілюструє приготування 7-{4-[4(3,3-дихлорпроп-2-енілокси)-2,6дихлорфенокси]бутокси}2,2-диметил-2гідробензо[b]фуран-3-ону (сполука 36 у таблиці нижче). Суміш 0,20г (0,0004моль) сполуки 12 (приготованої у прикладі 1), 0,26г (0,0010моль) персульфату калію і 0,10г (0,0004моль) пентагідрату сульфату міді в 15мл ацетонітрилу і 15мл води перемішували при 80°С протягом однієї години. Через цей час реакційній суміші давали змогу охолонути до температури навколишнього середовища, потім її екстрагували двома порціями по 15мл діетилового ефіру. Об'єднані екстракти промивали однією порцією 15мл води, сушили 82875 28 сульфатом натрію і фільтрували. Фільтрат концентрували під вакуумом до напівтвердого залишку. Напівтверду речовину очищали хроматографією на колонці з силікагелем, використовуючи як елюент дихлорметан. Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 0,03г сполуки 36. Спектр ЯМР узгоджувався із запропонованою структурою. Приклад 3 Цей приклад ілюструє приготування 5-(3,3дихлорпроп-2-енілокси)-2-{4-[2,2-диметил-5(трифторметил)(2,3-дигідробензо[2,3-b]фуран-7ілокси)]-бутокси}1,3-дихлорбензолу (сполука 20 у таблиці нижче). Етап А. Синтез 5-аміно-2,2-диметил-2,3дигідробензо[2,3-b]фуран-7-ілу ацетату як проміжної сполуки Суміш 3,5г (0,014моль) 2,2-диметил-5-нітро2,3-дигідробензо[2,3-b]фуран-7-ілу ацетату (відома сполука) і каталітичної кількості 10% паладію на вуглеці в 125мл етанолу піддавали умовам каталітичної гідрогенізації, використовуючи гідрогенізатор Парра. Після завершення поглинання теоретичної кількості водню реакційну суміш фільтрували і концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюенти дихлорметан, супроводжуваний 5% метанолом у дихлорметані. Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 2,7г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап В. Синтез 5-йод-2,2-диметил-2,3дигідробензо[2,3-b]фуран-7-ілу ацетату як проміжної сполуки Розчин, що перемішується, 1,0г (0,0045моль) 5-аміно-2,2-диметил-2,3-дигідробензо[2,3-b]фуран7-ілу ацетату в 40мл ацетонітрилу охолоджували на льодяній бані і додавали 0,55мл (0,0045моль) трет-бутилнітриту. Після закінчення додавання реакційну суміш перемішували протягом додаткових 15 хвилин, продовжуючи охолодження. Через цей час додавали 1,2г (0,0045моль) йоду, двома порціями протягом п'ятихвилинного періоду. Після закінчення додавання реакційну суміш перемішували протягом додаткової однієї години, продовжуючи охолодження, давали змогу нагрітися до температури навколишнього середовища, коли її перемішували протягом трьох годин, і далі її нагрівали зі зворотним холодильником, під час перемішування протягом 30 хвилин. Через цей час реакційну суміш охолоджували і виливали у 50мл 10% водного розчину хлороводневої кислоти, і суміш екстрагували двома порціями по 25 мл дихлорметану. Об'єднані екстракти промивали однією порцією 25мл насиченого водного розчину хлориду натрію, сушили сульфатом натрію і фільтрували. Фільтрат концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюент дихлорметан. Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 0,78г зазначеної у заголовку 29 сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Реакцію повторювали, щоб одержати додаткову проміжну сполуку. Етап С. Синтез 2,2-диметил-5(трифторметил)-2,3-дигідро[2,3-b]фуран-7-ілу ацетиглу як проміжної сполуки Суміш, що перемішується, 1,2г (0,0037моль) 5йод-2,2-диметил-2,3-дигідробензо[2,3-b]фуран-7ілу ацетату, 1,5г (0,0074моль) метил-2,2-дифтор-2фторсульфонілу ацетату і 0,2г (0,001моль) йодиду міді в 50мл ДМФ нагрівали при 80°С протягом шестигодинного періоду. ГХ аналіз реакційної суміші через цей час показав, що реакція була приблизно на 70% завершеною. До реакційної суміші додавали додаткові 0,5г метил-2,2-дифтор2-фторсульфонілу ацетату і 0,1г йодиду міді, і нагрівання при 80°С продовжували протягом додаткового 18-годинного періоду. Реакційній суміші давали змогу охолонути до температури навколишнього середовища, і потім її виливали у 75мл води та екстрагували трьома порціями по 25мл діетилового ефіру. Об'єднані екстракти промивали двома порціями по 25мл води, сушили сульфатом натрію і фільтрували. Фільтрат концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш дихлорметан-гексан (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 0,60г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. D. Етап Синтез 2,2-диметил-5(трифторметил)-2,3-дигідро[2,3-b]фуран-7-олу як проміжної сполуки Перемішували розчин 0,6г (0,0022моль) 2,2диметил-5-(трифторметил)-2,3-дигідро[2,3b]фуран-7-ілу ацетату в 5мл метанолу і додавали розчин 0,9 г (0,0220 моль) гідроксиду натрію у 15мл води. Після закінчення додавання реакційну суміш нагрівали до 40°С, коли її перемішували протягом двох годин. Через цей час реакційній суміші давали змогу охолонути до температури навколишнього середовища, оскільки її перемішували протягом 18-годинного періоду. Потім реакційну суміш підкислювали до рН 6, використовуючи концентровану хлороводневу кислоту, і далі її екстрагували трьома порціями по 25мл діетилового ефіру. Об'єднані екстракти промивали однією порцією 25мл води, сушили сульфатом натрію і фільтрували. Фільтрат концентрували під вакуумом, одержуючи 0,4г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап Е. Синтез 4-[2,6-дихлор-4(фенілметокси)фенокси]бутан-1-олу як проміжної сполуки Розчин 33,9г (0,126моль) 2,6-дихлор-4фенілметоксифенолу (відома сполука), 16,4г (0,151моль) 4-хлорбутан-1-олу і 20,9г (0,151моль) карбонату калію у 300мл ДМФ нагрівали до 80°С, коли її перемішували протягом 18-годинного періоду. Через цей час реакційну суміш концентрували під вакуумом до залишку. До залишку додавали воду і суміш екстрагували 82875 30 етилацетатом. Екстракт промивали водою і потім насиченим водним розчином хлориду натрію. Органічний шар сушили сульфатом магнію і фільтрували, і фільтрат концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш етилацетатгексан (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 12,2г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап F. Синтез 3,5-дихлор-4-(4гідроксибутокси)фенолу як проміжної сполуки Цю сполуку готували у спосіб, аналогічний до способу, викладеного на етапі А цього прикладу, використовуючи 12,2г (0,036моль) 4-[2,6-дихлор-4(фенілметокси)фенокси]бутан-1-олу і 0,5г (каталізатор) 10% паладію на вуглеці, і теоретичну кількість газоподібного водню у гідрогенізаторі Парра. Вихід зазначеної у заголовку сполуки становив 9,3г. Спектр ЯМР узгоджувався із запропонованою структурою. Етап G. Синтез 4-[4-(3,3-дихлорпроп-2енілокси)-2,6-дихлорфенокси]-бутан-1-олу як проміжної сполуки Цю сполуку готували у спосіб, аналогічний до способу, викладеного на етапі D прикладу 1, використовуючи 9,3г (0,036моль) 3,5-дихлор-4-(4гідроксибутокси)фенолу, 7,7г (0,042моль) 1,1,1,3тетрахлорпропану і 11,7г (0,080 моль) карбонату калію у 300мл ДМФ. Сирий продукт очищали хроматографією на колонці з силікагелем, використовуючи як елюенти суміші етилацетатгексан (1:4) і (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 8,0г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап Н. Синтез 1-[4-(3,3-дихлорпроп-2енілокси)-2,6-дихлорфенокси]-4-бромбутану як проміжної сполуки Розчин, що перемішується, 7,3г (0,020моль) 4[4-(3,3-дихлорпроп-2-енілокси)-2,6дихлорфенокси]бутан-1-олу в 400мл дихлорметану охолоджували на льодяній бані і, у свою чергу, додавали 5,5г (0,021моль) трифенілфосфіну і 6,9г (0,021моль) чотирибромистого вуглецю. Після закінчення додавання реакційну суміш перемішували, продовжуючи охолодження протягом однієї години, потім їй давали змогу нагрітися до температури навколишнього середовища, коли її перемішували протягом 18-годинного періоду. Через цей час реакційну суміш концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюент гексан і суміш дихлорметан-гептан (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 12,2г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою Етап І. Синтез сполуки 20 структурою. В атмосфері азоту перемішували розчин 0,18г (0,0004)моль 1-[4-(3,3-дихлорпроп-2-енілокси)-2,6дихлорфенокси]-4-бромбутану, 0,10г (0,0004 моль) 2,2-диметил-5-(трифторметил)-2,3-дигідро[2,3b]фуран-7-олу (приготованого на етапі D цього 31 прикладу) і 0,09г (0,0007моль) карбонату калію у 15мл ДМФ при температурі навколишнього середовища протягом 18-годинного періоду. Через цей час реакційну суміш перемішували з 25мл води і насичували твердим хлоридом натрію. Потім суміш екстрагували двома порціями по 25 мл діетилового ефіру; і об'єднані екстракти промивали однією порцією 25мл води, сушили сульфатом натрію, фільтрували і концентрували під вакуумом до залишку. Залишок очищали хроматографією на колонці з силікагелем, використовуючи як елюенти гексан і суміш дихлорметан-гексан (1:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 0,19г сполуки 20. Спектр ЯМР узгоджувався із запропонованою структурою. Приклад 4 Цей приклад ілюструє приготування N-{3-[4(3,3-дихлорпроп-2-енілокси)-2,6дихлорфенокси]пропіл}(2,2-диметил(2,3дигідробензо[2,3-b]фуран-7-ілокси))-карбоксаміду (сполука 53 у таблиці нижче) Етап А. Синтез 2,2-диметил-2,3дигідробензо[2,3-b]бензофуран-7-ілу імідазолкарбоксилату як проміжної сполуки Перемішували розчин 1,64г (0,010моль) 2,2диметил-2,3-дигідробензо[b]фуран-7-олу (відома сполука) в 30мл дихлорметану, і додавали однією порцією 1,62г (0,010моль) 1,1¢-карбонілдіімідазолу. Після закінчення додавання реакційну суміш перемішували при температурі навколишнього середовища протягом 20 хвилин. Через цей час реакційну суміш концентрували під вакуумом до залишку. Залишок розчиняли у суміші дихлорметан-гексани (1:1) і очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш гексанетилацетат (7:4). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 1,96г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап В. Синтез N-{3-[2,6-дихлор-4(фенілметокси)фенокси]пропіл}(третбутокси)карбоксаміду як проміжної сполуки Розчин 2,69г (0,010моль) 2,6-дихлор-4фенілметоксифенолу (відома сполука), 2,38г (0,010моль) (трет-бутокси)-N-(3бромпропіл)карбоксаміду (наявний у продажу) і 1,52г (0,011моль) карбонату калію у 40мл ДМФ перемішували при температурі навколишнього середовища протягом чотириденного періоду. Через цей час реакційну суміш струшували у діетиловому ефірі і воді, і відділений органічний шар промивали однією порцією води і однією порцією насиченого водного розчину хлориду натрію. Органічний шар сушили сульфатом натрію і фільтрували. Фільтрат концентрували під вакуумом, одержуючи 4,15г зазначеної у заголовку сполуки. Етап С. Синтез N-[3-(2,6-дихлор-4гідроксифенокси)пропіл](третбутокси)карбоксаміду як проміжної сполуки Цю сполуку готували у спосіб, аналогічний до способу, викладеного на етапі А прикладу 3, використовуючи 4,1г (0,0096моль) N-{3-[2,6дихлор-4-(фенілметокси)фенокси]пропіл}(трет 82875 32 бутокси)карбоксамід, каталітичну кількість 10% паладію на вуглеці і теоретичну кількість газоподібного водню у 60мл суміші етанолетилацетат (1:1) у гідрогенізаторі Парра. Вихід зазначеної у заголовку сполуки становив 3,5г. Етап D. Синтез N-{3-[4-(3,3-дихлорпроп-2енілокси)-2,6-дихлорфенокси]-пропіл}(третбутокси)карбоксаміду як проміжної сполуки Цю сполуку готували у спосіб, аналогічний до способу, викладеного на етапі D прикладу 1, використовуючи 3,5г (0,0104моль) N-[3-(2,6дихлор-4-гідроксифенокси)пропіл](третбутокси)карбоксаміду, 2,3г (0,0125моль) 1,1,1,3тетрахлорпропану і 3,4г (0,0250моль) карбонату калію у ДМФ. Сирий продукт очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш гександихлорметан (1:3). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 2,6 г зазначеної у заголовку сполуки. Спектр ЯМР узгоджувався із запропонованою структурою. Етап Е. Синтез 3-[4-(3,3-дихлорпроп-2енілокси)-2,6-дихлорфенокси]-пропіламіну гідрохлориду як проміжної сполуки Розчин, що перемішується, 2,6г (0,0058моль) N-[-{3-[4-(3,3-дихлорпроп-2-енілокси)-2,6дихлорфенокси]пропіл}(трет-бутокси)карбоксаміду в 10мл безводного діетилового ефіру охолоджували до 0°С і за допомогою шприца додавали 2н. розчин хлороводню в діетиловому ефірі. Після закінчення додавання реакційній суміші давали змогу нагрітися до температури навколишнього середовища, коли її перемішували протягом 18-годинного періоду. Одержаний у результаті твердий осад збирали за допомогою фільтрування, одержуючи після висушування 1,25г зазначеної у заголовку сполуки. Фільтрат збирали у гексани, і йому давали змогу постояти протягом 18-годинного періоду, протягом цього часу з фільтрату осаджували .другу порцію зазначеної у заголовку сполуки. Осад збирали за допомогою фільтрування і висушували, одержуючи додаткові 0,83г зазначеної у заголовку сполуки. Етап F. Синтез сполуки 53 Розчин 82мг (0,318ммоль) 2,2-диметил-2,3дигідробензо[2,3-b]бензофуран-7-ілу імідазолкарбоксилату (приготованого на етапі А цього прикладу), 100мг (0,262ммоль) 3-[4-(3,3дихлорпроп-2-енілокси)-2,6дихлорфенокси]пропіламіну гідрохлориду і 73мкл (0,524ммоль) триетиламіну в 5мл дихлорметану перемішували при температурі навколишнього середовища протягом 18-годинного періоду. Через цей час ТШХ аналіз реакційної суміші показав, що реакція не відбулася. Реакційну суміш концентрували під вакуумом, щоб видалити дихлорметан, і додавали 5мл ацетонітрилу. Потім реакційну суміш нагрівали зі зворотним холодильником протягом 18-годинного періоду, після чого ТШХ аналіз показав, що реакція відбулася, хоча і не повністю. Далі реакційну суміш концентрували під вакуумом до залишку. Залишок розчиняли у суміші дихлорметан-гексани (1:1) і очищали хроматографією на колонці з силікагелем, використовуючи як елюент суміш 33 гексан-етилацетат (4:1). Відповідні фракції об'єднували і концентрували під вакуумом, одержуючи 45мг сполуки 53. Спектр ЯМР узгоджувався із запропонованою структурою. Середньому фахівцеві у даній галузі добре відомо, що сполуки, подібні до сполук формули І даного винаходу, можуть містити оптично активні і рацемічні форми. Також добре відомо у даній галузі, що сполуки, подібні до сполук формули І, можуть містити стереоізомерні форми, таутомерні форми і/або виявляти поліморфізм. Має бути 82875 34 зрозумілим, що даний винахід охоплює будь-яку рацемічну, оптично активну, поліморфну, таутомерну або стереоізомерну форму, або їхні суміші. Слід зазначити, що у даній галузі добре відомо, як приготувати оптично активні форми, наприклад, шляхом розділення рацемічної суміші, або за допомогою синтезу з оптично активних проміжних сполук. Наступна таблиця пояснює приклади сполук формули І: Таблиця 1 Інсектицидні (дигалопропеніл)фенілалкілзаміщені похідні дигідробензофурану і дигідробеюопірану де В є містковою групою формули: -(CR16R17)q-(CR18R19)r-(CR20R21)s-Lt-(CR22R23)u24 25 (CR R )v-(CR26R27)w-, де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q і г дорівнюють 1, де R16, R17, R18 і R19 є воднем; s, t, u, v i w дорівнюють 0; x і у дорівнюють 1; A, D і Е є О, і G є (CR2)n, де n дорівнює 1; забезпечуючи сполуки формули ІА, як викладені нижче: де R1, R2, R4, R10 і R" є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r і s дорівнюють 1, де R16, R17, R18, R19 і R21 є воднем, і, якщо не вказане інше, R20 є воднем; t, u, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (CR2)n, де n дорівнює 1; забезпечуючи сполуки формули IB, як викладені нижче: 37 82875 38 де R2, R4, R10 і R11 є воднем; R і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, г, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули 1С, як викладені нижче: де R1, R2, R4 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули ID, як викладені нижче: де R1, R2, R4, R10 і R" є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; А і Е є О, D є NR15 і G є (СН2)n, де п дорівнює 1; забезпечуючи сполуки формули IE, як викладені нижче: 39 82875 40 де R1, R2 і R4 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-; q, r, s i u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; x і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули IF, як викладені нижче: де R1, R2 і R4 є воднем; R, R3 і R5 є хлором; R10 і R взяті разом з -SCH2CH2S-, щоб утворити тіокеталь; М є -C(R32 R33)-, де R32 і R33 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули IG, як викладені нижче: де R1, R2 і R4 є воднем; R, R3 і R5 є хлором; R10 і R11 взяті разом з О, щоб утворити карбонільну групу; М є -C(R32R33)-, де R32 і R33 є метилом; q, r і s дорівнюють 1, де R16, R17, R18, R19 і R21 є воднем; t і w дорівнюють 0; х і у дорівнюють 1; u і v дорівнюють 0 або 1, і коли u і v дорівнюють 1, R22, R23, R24 і R25 є воднем; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; і бензо-конденсоване кільце є приєднаним у положенні 1, забезпечуючи сполуки формули ІН, як викладені нижче: !1 41 82875 42 де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s, u і v дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22, R23, R24 і R25 є воднем, t і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули II, як викладені нижче: де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s, u і v дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22, R23, R24 і R25 є воднем, t і w дорівнюють 0; x і у дорівнюють 1; А і Е є О, і G є (СН2)n, де n дорівнює 1; і D є NR15, забезпечуючи сполуки формули IJ, як викладені нижче: 43 82875 44 де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, u і v дорівнюють 1, де R16, R17, R18, R19, R22, R23, R24 і R25 є воднем, t дорівнює 1; s і w дорівнюють 0; х і у дорівнюють 1; A, D, Е і L є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули ІК, як викладені нижче: де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s, u, v і w дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22, R23, R24, R25, R26 і R27 є воднем, t дорівнює 0; x і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули IL, як викладені нижче: де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і t дорівнюють 1, де R16, R17, R18, R19, R20 і R21 є воднем і L є ОС(=О), u, v і w дорівнюють 0; х і у дорівнюють 1; А і Е є О; D є NR15, де R15 є воднем; і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули ЇМ, як викладені нижче: 45 82875 46 де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)-, де R32 і R33 є метилом; q, r, s і t дорівнюють 1, де R16, R17, R18, R19, R20 і R21 є воднем і L є NHC(=O), u, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули IN, як викладені нижче: де R1, R2, R4, R10 і R11 є воднем; R, R3 і R5 є хлором; М є -C(R32R33)C(R34R35)-, де Rj2 і R33 є воднем, і R34 та R35 є метилом; q, r, s і u дорівнюють 1, де R16, R17, R18, R19, R20, R21, R22 і R23 є воднем, t, v і w дорівнюють 0; х і у дорівнюють 1; A, D і Е є О, і G є (СН2)n, де n дорівнює 1; забезпечуючи сполуки формули 10, як викладені нижче: 47 82875 48 Продовження таблиці 2 Випробування корму, обробленого на поверхні проти совки Сполуки оцінювали на активність проти совки {Heliothis virescens [Fabricius]) у випробуванні корму, обробленого на поверхні. У цьому випробуванні 1мл розплавленого (6570°С) штучного корму на основі зародків пшениці піпетували у кожну ямку (4´6, 24 ямки) багатоямкового планшета (ID #430345, діаметр 15,5мм´глибина17,6мм; Corning Costar Corp., One Alewife Center, Cambridge, MA 02140, США). Корму давали змогу охолонути до температури навколишнього середовища перед обробленням інсектицидом-кандидатом. Для визначення інсектицидної активності готували для випробування розчини інсектицидівкандидатів, використовуючи робототехнічну систему Packard 204DT Multiprobe® (Packard Instrument Company, 800 Research Parkway, Meriden, CT 06450, США), в якій робот спочатку розбавляв стандартний розчин інсектицидукандидата у ДМСО з концентрацією 50ммоль/л розчином вода-ацетон (1:1, за об'ємом) у співвідношенні 1:7 (вихідний розчин/розчин водаацетон). Пізніше робот піпетував 40мкл приготованого таким чином розчину на поверхню корму в кожній з трьох ямок у 24-ямковому планшеті. Процес повторювали з розчинами семи інших інсектицидів-кандидатів. Після одноразового оброблення вмісту багатоямкового планшета давали змогу висохнути, залишаючи 0,25ммоль інсектициду-кандидата на поверхні корму, або концентрацію 0,25ммоль/л. У це випробування бути також включені відповідні необроблені контрольні зразки, які містили на поверхні корму лише ДМСО. Для оцінки інсектицидної активності інсектициду-кандидата при різних нормах витрати було встановлене випробування, як описано вище, з використанням розведень стандартного розчину інсектициду-кандидата у ДМСО з концентрацією 50ммоль/л. Наприклад, стандартний розчин з концентрацією 50ммоль/л розбавляли, за допомогою робота, ДМСО, одержуючи розчини інсектициду-кандидата з концентраціями 5, 0,5, 0,05, 0,005, 0,0005ммоль/л, або більш розведені розчини. У цих випробуваннях було шість повторностей для кожної норми витрати, поміщених на поверхню корму у 24-ямковому планшеті, всього для чотирьох норм витрат інсектициду-кандидата в кожному планшеті. У кожну ямку експериментального планшета вміщували по одній личинці совки другої вікової стадії, кожна масою приблизно 5 мг. Після того, як личинки були поміщені в кожну ямку, планшет герметично закривали прозорою клейкою стрічкою з поліетиленової плівки. Стрічку над кожною ямкою перфорували, щоб забезпечити достатнє підведення повітря. Далі планшети тримали у ростовій камері при 25°С і відносній вологості 60% протягом 5 діб (освітлення 14 годин/добу). Після п'ятиденного експозиційного періоду інсектицидну активність для кожної норми витрати інсектициду-кандидата оцінювали як відсоток 49 82875 пригнічення маси комах по відношенню до маси комах з необробленого контролю, і відсоток смертності у порівнянні із загальним числом заражених комах. Як показано у вищезазначеній таблиці 3, всі досліджені сполуки забезпечували інсектицидну активність, і майже всі забезпечували 100% смертність і 100% пригнічення росту совки. З метою порівняння сполуку 12 за даним винаходом досліджували у паралельних випробуваннях із деякими аналогічними сполуками-похідними бензофуранілу, де досліджувані сполуки наносили на листя досліджуваних рослин. Сполука 12 та аналогічні сполуки у цих дослідженнях мали таку структуру: (D)g-----гетероцикл 50 Дані щодо інсектицидної активності при вибраних нормах витрати за цим випробуванням наведені у таблиці 3. Досліджувані сполуки формули І ідентифіковані за номерами, які відповідають номерам у таблиці 1. де гетероциклом є: А бензофураніл В метил-заміщений бензофураніл 51 82875 С де у дорівнює 1: диметил-заміщений 2,3дигідробензофураніл 52 53 Номер сполуки 12 W X Y Z 82875 D Гетероцикл O O O CH2 O С А В А А Положення приєднання гетероцикл 1 1 1 6 4 Сполуки 12, W, X і Y випробовували на інсектицидну активність в оцінюванні на листі проти совки {Heliothis virescens [Fabricius]), совки ні {Trichoplusia пі [Hubner]) і капустяної молі {Plutella xylostella), використовуючи такі способи: Випробування листя, обробленого проти совки і совки ні У дев'яти-десятиденних рослин нуту баранячого (Cicer arietinum) обприскували до стікання при тиску 15 фунтів/дюйм2 як верхню, так і нижню поверхню листя розчинами досліджуваної сполуки, щоб забезпечити норми витрати до 1000ррm досліджуваної хімічної речовини. Розчинником, використаним для приготування розчинів досліджуваної сполуки, був 10% ацетон або метанол (за об'ємом) і 0,1% розчин поверхнево-активної речовини октилфеноксиполіетоксіетанолу у дистильованій воді. Були обприскані чотири повторності, кожна з яких містила одну рослину нуту баранячого, для кожної норми витрати досліджуваної сполуки. Оброблені рослини переносили під ковпак, де їх тримали до висихання розпиленого розчину.кожної Чотири рослини нуту баранячого для повторності, оброблені досліджуваною сполукою як описано вище, видаляли з їхніх вегетаційних посудин, зрізаючи стебла відразу над рівнем ґрунту. Зрізане листя і стебла з чотирьох рослин у кожній повторності поміщали в окремі паперові стаканчики місткістю 237мл (8 унцій), які містили зволожений фільтрувальний папір. У кожний стаканчик відраховували п'ять личинок совки або совки ні другої вікової стадії (7-денного віку), звертаючи увагу, щоб не викликати їх пошкодження. На кожний стаканчик поміщали непрозору пластикову кришку, стаканчики потім витримували у ростовій камері протягом 96 годин періоду експозиції при 25°С, відносній вологості 50% і фотоперіоді 12 годин світла, 12 годин темряви. Наприкінці 96-годинного періоду експозиції стаканчики відкривали і підраховували кількість мертвих, вмираючих і живих комах. Використовуючи підрахунки комах, ефективність досліджуваної сполуки виражали у відсотках контролю. Відсоток контролю одержували із загальної кількості мертвих комах (ЗКМК) плюс загальна кількість вмираючих комах (ЗКВК) у 54 порівнянні із загальною кількістю комах (ЗКК) у випробуванні: % контролю = ЗКМК + ЗКВК ´ 100 ЗКК Експериментальні рослини також спостерігали на наявність фітотоксичності і на зменшення пошкоджень, викликаних об'їданням, у порівнянні з необробленим контролем. Личинки класифікували як "вмираючі", якщо вони не могли швидко повернутися у правильне положення після їхнього перевертання, але виявляли рухомість, або якщо вони значно зменшилися за розміром і не виглядали такими, що їдять. Результати цих випробувань проти совки і совки ні наведені нижче у таблиці 4. Випробування листя, обробленого проти капустяної молі З листя шеститижневої капусти були вирізані диски діаметром 2,5см, які занурювали у розчини досліджуваної хімічної речовини з різними концентраціями,щоб забезпечити норми витрати до 1000ррm досліджуваної сполуки. Розчинником, використаним для приготування розчинів досліджуваної сполуки, був 10% ацетон або метанол (за об'ємом) і 0,1% розчин поверхневоактивної речовини октилфеноксиполіетоксіетанолу у дистильованій воді. Проводили занурення у чотирьох повторностях, кожна з яких містила один диск з листя капусти, для кожної норми витрати досліджуваної сполуки. Чотири диски з листя капусти для кожної обробленої повторності занурювали на п'ять секунд у розчин досліджуваної сполуки, як описано вище. Далі кожен диск поміщали в окремі чашки Петрі діаметром 50мм, що містили фільтрувальний папір діаметром 42,5мм, який був зволожений 100мкл води. Незакриті чашки Петрі далі відставляли до висихання дисків з листя. Через цей час на кожний диск з листя обережно поміщали дві личинки капустяної молі третьої вікової стадії (10-14-денного віку). Далі на кожну чашку Петрі поміщали щільно підігнану кришку, і чашки потім витримували у ростовій камері протягом 96 годин періоду експозиції при 25°С, відносній вологості 50% і фотоперіоді 12 годин світла, 12 годин темряви. Наприкінці 96-годинного періоду експозиції чашки Петрі відкривали і підраховували кількість мертвих, вмираючих і живих комах. Використовуючи підрахунки комах, ефективність досліджуваної сполуки виражали у відсотках контролю за допомогою методів, зазначених вище у випробуваннях проти совки і совки ні. Результати цих випробувань проти капустяної молі наведені нижче у таблиці 4. 55 Аналіз результатів вищезгаданих випробувань ясно показує, що, незважаючи на відсутність суттєвої різниці між сполукою 12 і сполукою X у контролі совки і капустяної молі, сполука 12 є більш активною проти совки ні, ніж сполука X. Сполука 12 є також більш активною проти всіх трьох видів комах, ніж сполуки W, Y і Z. Таким чином, якщо порівнювати з деякими аналогічними сполуками-похідними бензофуранілу, сполука 12 за даним винаходом забезпечує принаймні ідентичний або несподівано кращий контроль ширшого спектра видів комах, ніж вищезгадані похідні бензофурану. Випробування листя цілої рослини, обробленого проти совки ні Для кожної норми витрати досліджуваної сполуки готували аліквоту 15мл досліджуваного розчину. Достатню кількість досліджуваної сполуки розчиняли у 1,5мл ацетону, щоб забезпечити норму витрати до 1000г/га. Далі кожний розчин додавали до 13,5мл води, що містила 300ррm поверхнево-активної речовини. Для кожної норми витрати досліджуваної сполуки було використано чотири повторності, і всі випробування включали відомий стандарт хімічної речовини, а також стандарт води і поверхнево-активної речовини та контроль без оброблення. Максимум 14 рослин капусти відповідного розміру для кожної норми витрати та повторності були розміщені у пластиковій широкій неглибокій корзині на 28 посудин, і їх обприскували 15мл зразка досліджуваної сполуки, використовуючи пересувний штанговий обприскувач, обладнаний конусоподібним наконечником розпилювача, при нормі 30 галонів/акр (280л/га) під тиском 40-44 фунтів/квадратний дюйм (2,81-3,09кг/см2). Спочатку обприскували необроблений контроль, супроводжуючи досліджуваними сполуками і стандартами, всі у порядку від найнижчих до найвищих норм витрати. Як тільки обприскування було закінчене, експериментальним рослинам давали змогу висохнути на повітрі на транспортері, на якому їх обприскували. Для кожної норми витрати і повторності достатню кількість чашок Петрі розміром 50´9мм обкладали дисками з фільтрувального паперу, і кожен зволожували 0,5мл дистильованої води. У кожній повторності з рослини капусти вирізали принаймні три 2,5см диски. Далі кожен диск з листя поміщали в окремі чашки Петрі нижньою частиною листка догори. Після розміщення дисків 82875 56 з листя на кожен диск поміщали по дві новонароджені личинки совки ні. Після завершення зараження кожну чашку Петрі накривали і витримували у ростовій камері протягом 96 годин періоду експозиції при 25°С, відносній вологості 40%-60% і фотоперіоді 12 годин світла і 12 годин темряви. Наприкінці 96годинного періоду експозиції чашки Петрі відкривали і підраховували кількість мертвих, вмираючих і живих комах. Використовуючи підрахунки комах, ефективність досліджуваної сполуки виражали у відсотках контролю. Відсоток контролю одержували із загальної кількості мертвих комах (ЗКМК) плюс загальна кількість вмираючих комах (ЗКВК) у порівнянні із загальною кількістю комах (ЗКК) у випробуванні: % контролю = ЗКМК + ЗКВК ´ 100 ЗКК Експериментальні рослини також спостерігали на наявність фітотоксичності і на зменшення пошкоджень, викликаних об'їданням, у порівнянні з необробленим контролем. Личинки класифікували як "вмираючі", якщо вони не могли швидко повернутися у правильне положення після їхнього перевертання, але виявляли рухомість, або якщо вони значно зменшилися за розміром і не виглядали такими, що їдять. Результати цих випробувань наведені нижче у таблиці 5. Ці результати ясно показують, що сполука 12 є більш активною проти совки ні, сполука X. Фотостабільність Знову, з метою порівняння сполуку 12 за даним винаходом досліджували у паралельних випробуваннях з аналогічними сполукамипохідними бензофуранілу, позначеними як сполуки W, X, Y і Z, як зазначені вище, щоб визначити їхню фотохімічну стабільність, тобто їхню швидкість фотолізу. Ці випробування проводили у такий спосіб: 57 82875 58 Для кожної досліджуваної сполуки на три скляні покривні скельця мікроскопа (діаметром 12мм) для кожного періоду освітлення (1, 3, 6, 12 і 24 години) наносили по 10мкл розчину досліджуваної сполуки з концентрацією 1 мг/мл в ацетонітрилі або метанолі. На три покривні скельця також наносили досліджувану сполуку, і їх не освітлювали. Матеріал на цих не освітлюваних покривних скельцях аналізували наприкінці експерименту, як описано нижче, щоб визначити стабільність досліджуваної сполуки на склі. Розчинникам в кожних 10мкл розчину на кожному покривному скельці давали змогу випаруватися, залишаючи тонку плівку досліджуваної сполуки на кожному покривному скельці. Три покривні скельця, що представляли нульовий період освітлення, далі поміщали у сцинтиляційний флакон місткістю 20мл. У флакон додавали 1 мл ацетонітрилу, який екстрагував досліджувану хімічну речовину з покривного скельця. Потім розчин переносили до 2-драхмового флакона для аналізу методом ВЕРХ (високоефективної рідинної хроматографії). Середня площа хроматографічного піка, який давав цей зразок, визначала початковий рівень досліджуваної сполуки. Покривні скельця, що залишилися, далі поміщали у камеру з водяним охолодженням експозиційної платформи освітлювача Suntest CPS (Heraeus Instruments GmbH; Bereich Original Hanau, Hersaeusstrasse R-14, Postfach 1563, D6450 Hanau 1). Експозиційну платформу покривали кварцовою пластиною і витримували при приблизно 25°С протягом тривалості випробування. Освітлювач Suntest CPS використовує фільтровану ксенонову лампу, яка забезпечує освітлення, подібне за спектром та інтенсивністю до сонячного світла. Три покривні скельця для кожної сполуки видаляли з освітлювача через 1, 3, 6, 12 і 24 години постійного освітлення. Приблизно 8 годин освітлення еквівалентні одному літньому дню на 40° північної широти. Три покривні скельця з кожного періоду освітлення обробляли, як описано вище, та аналізували методом ВЕРХ. Середня площа хроматографічного піка для кожного з цих періодів освітлення показувала зменшену кількість досліджуваної сполуки у порівнянні з початковим рівнем досліджуваної сполуки, який було визначено із зразка з нульовим освітленням. Відсотки досліджуваної сполуки, що залишилася з кожного з цих періодів освітлення, використовували, щоб побудувати криву розпаду, з якої був визначений період напіврозпаду у годинах для кожної досліджуваної сполуки. Потім були розраховані відносні періоди напіврозпаду для кожної сполуки у порівнянні зі сполукою 12, як відсоток напіврозпаду сполуки 12. Результати цих випробувань наведені нижче у таблиці 6: Аналіз результатів вищезгаданих випробувань ясно показує, що сполука 12 є більш фотостабільною, ніж будь-яке з похідних бензофуранілу. Сполука W, найбільш фотостабільна з випробуваних похідних бензофуранілу, лише трохи більше ніж наполовину (58%) така ж фотостабільна, як сполука 12. У той час, як даний винахід був описаний з наголосом на переважні втілення, середньому фахівцеві у даній галузі має бути зрозумілим, що можуть бути використані відхилення від переважних втілень, і що це припускає, що винахід може бути здійснений в інший спосіб, ніж той, що конкретно описаний тут. Відповідно, даний винахід включає всі модифікації, що містяться в межах суті та обсягу винаходу, як визначено нижченаведеними пунктами формули винаходу. Комп’ютерна верстка Н. Лисенко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюInsecticidal (dihalopropenyl) phenylalkyl substituted dihydrobenzofuran and dihydrobenzopyran derivatives and method for controlling insects
Автори англійськоюTheodoridis Georges, Barron Edward L., Suarez Dominic P., Zhang Y. Larry, Ding Ping, Roush David M., Donovan Stephen F., Zawacki Frank J., Yeager Walter H., Lyga John W., Cohen Daniel H.
Назва патенту російськоюИнсектицидные (дигалопропенил)фенилалкилзамещенные производные дигидробензофурана и дигидробензопирана и способ борьбы с насекомыми
Автори російськоюТеодоридис Джордж, Беррон Эдвард Дж., Суарес Доминик П., Чжан И. Ларри, Дин Пин, Рауш Девид М., Донован Стефен Ф., Завацки Френк Дж., Йиджер Уолтер Х., Лига Джон В., Коен Дениэл Х.
МПК / Мітки
МПК: A01N 43/02, C07D 307/80, A01P 7/04
Мітки: боротьби, похідні, дигідробензофурану, інсектицидні, спосіб, дигідробензопірану, дигалопропеніл)фенілалкілзаміщені, комахами
Код посилання
<a href="https://ua.patents.su/29-82875-insekticidni-digalopropenilfenilalkilzamishheni-pokhidni-digidrobenzofuranu-i-digidrobenzopiranu-ta-sposib-borotbi-z-komakhami.html" target="_blank" rel="follow" title="База патентів України">Інсектицидні (дигалопропеніл)фенілалкілзаміщені похідні дигідробензофурану і дигідробензопірану та спосіб боротьби з комахами</a>
Попередній патент: Спосіб одержання іонообмінного каталізатора
Наступний патент: Гідроксамати, фармацевтична композиція та спосіб лікування раку (варіанти)
Випадковий патент: Спосіб автоматизованого вимірювання вольт-амперних характеристик напівпровідникових приладів