Застосування вірусу міксоми для лікування раку
Формула / Реферат
1. Спосіб пригнічення ракової клітини ссавця, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон, який включає введення у клітину ефективної кількості вірусу міксоми.
2. Спосіб за п. 1, який відрізняється тим, що клітиною є людська ракова клітина.
3. Спосіб за п. 1 або 2, який відрізняється тим, що вірусом міксоми є вірус дикого типу.
4. Спосіб за п. 1 або 2, який відрізняється тим, що вірус міксоми є генетично модифікованим.
5. Спосіб за п. 4, який відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гена.
6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що клітиною є клітина раку легень, клітина меланоми, клітина раку яєчника, клітина раку передміхурової залози, клітина раку нирок, клітина гліоми або клітина астроцитоми.
7. Спосіб лікування хворобливого стану, що являє собою рак і характеризується наявністю клітин, що мають недостатню вроджену противірусну реакцію і не реагують на інтерферон, який включає введення хворому, що потребує цього, ефективної кількості вірусу міксоми.
8. Спосіб за п. 7, який відрізняється тим, що раком є солідна пухлина.
9. Спосіб за п. 7 або 8, який відрізняється тим, що раком є рак гемопоетичних клітин, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, плоскоклітинний рак, рак передміхурової залози, рак молочної залози, рак шийки матки, рак анастомозу ободової та прямої кишок або меланома.
10. Спосіб за п. 9, який відрізняється тим, що раком гемопоетичних клітин є лейкемія або лімфома.
11. Спосіб за п. 7 або 8, який відрізняється тим, що раком є рак легень, меланома, рак яєчника, рак передміхурової залози, рак нирок, гліома або астроцитома.
12. Спосіб за будь-яким з пп. 7-11, який відрізняється тим, що хворим є людина.
13. Спосіб за будь-яким з пп. 7-12, який відрізняється тим, що вірусом міксоми є вірус дикого типу.
14. Спосіб за будь-яким з пп. 7-13, який відрізняється тим, що вірус міксоми є генетично модифікованим.
15. Спосіб за будь-яким з пп. 7-14, який відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гена.
16. Спосіб за будь-яким з пп. 7-15, який відрізняється тим, що вірус вводять до ділянки раку шляхом ін'єкції.
17. Спосіб за будь-яким з пп. 7-16, який відрізняється тим, що вірус вводять системно.
18. Спосіб за будь-яким з пп. 7-17, який відрізняється тим, що вводять менше за 109 бляшкотвірних одиниць вірусу.
19. Спосіб за п. 18, який відрізняється тим, що вводять приблизно 102-109 бляшкотвірних одиниць вірусу.
20. Застосування вірусу міксоми для виготовлення лікарського засобу для пригнічення ракової клітини ссавця, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон.
21. Застосування за п. 20, яке відрізняється тим, що клітиною є людська ракова клітина.
22. Застосування за п. 20 або 21, яке відрізняється тим, що клітиною є клітина раку легень, клітина меланоми, клітина раку нирок, клітина гліоми або клітина астроцитоми.
23. Застосування за будь-яким із пп. 20-22, яке відрізняється тим, що вірусом міксоми є вірус дикого типу.
24. Застосування за будь-яким із пп. 20-22, яке відрізняється тим, що вірус міксоми є генетично модифікованим.
25. Застосування за п. 24, яке відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гену.
26. Застосування вірусу міксоми для виготовлення лікарського засобу для лікування хворобливого стану, який є раком і який характеризується наявністю клітин, що мають недостатню вроджену противірусну реакцію та не реагують на інтерферон.
27. Застосування за п. 26, яке відрізняється тим, що раком є солідна пухлина.
28. Застосування за п. 26 або 27, яке відрізняється тим, що раком є рак гемопоетичних клітин, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, плоскоклітинна карцинома, рак передміхурової залози, рак молочної залози, рак шийки матки, рак анастомозу ободової та прямої кишок або меланома.
29. Застосування за п. 28, яке відрізняється тим, що раком гемопоетичних клітин є лейкемія або лімфома.
30. Застосування за п. 26 або 27, яке відрізняється тим, що раком є рак легень, меланома, рак яєчника, рак передміхурової залози, рак нирок, гліома або астроцитома.
31. Застосування за будь-яким із пп. 26-30 для виготовлення лікарського засобу для лікування хворобливого стану в людини.
32. Застосування за будь-яким із пп. 26-31, яке відрізняється тим, що вірусом міксоми є вірус дикого типу.
33. Застосування за будь-яким із пп. 26-31, яке відрізняється тим, що вірус міксоми є генетично модифікованим.
34. Застосування за п. 33, яке відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гена.
35. Фармацевтична композиція, яка містить вірус міксоми і фармацевтично прийнятний носій, для застосування при лікуванні хворобливого стану, який є раком і характеризується наявністю клітин, що мають недостатню врождлену противірусну реакцію та не реагують на інтерферон.
36. Фармацевтична композиція за п. 35, яка відрізняється тим, що раком є солідна пухлина.
37. Фармацевтична композиція за п. 35 або 36, яка відрізняється тим, що раком є рак гемопоетичних клітин, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, плоскоклітинна карцинома, рак передміхурової залози, рак молочної залози, рак шийки матки, рак анастомозу ободової та прямої кишок або меланома.
38. Фармацевтична композиція за п. 37, яка відрізняється тим, що раком гемопоетичних клітин є лейкемія або лімфома.
39. Фармацевтична композиція за п. 35 або 36, яка відрізняється тим, що раком є рак легень, меланома, рак яєчника, рак передміхурової залози, рак нирок, гліома або астроцитома.
40. Фармацевтична композиція за будь-яким із пп. 35-39, яка відрізняється тим, що містить додатковий лікарський засіб.
41. Фармацевтична композиція за п. 40, яка відрізняється тим, що додатковим лікарським засобом є хіміотерапевтичний засіб.
42. Фармацевтична композиція за будь-яким із пп. 35-41, яка відрізняється тим, що вона є придатною для ін'єкції у ділянку пухлини.
43. Набір, до складу якого входять вірус міксоми та інструкція для пригнічення ракової клітини ссавця, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон.
44. Набір, до складу якого входять вірус міксоми та інструкція для лікування раку, що не реагує на інтерферон, у пацієнта, який цього потребує.
45. Спосіб виявлення у пацієнта клітини, що має недостатню вроджену противірусну реакцію, який включає введення пацієнту вірусу міксоми, модифікованого для експресії виявного маркера; надання вірусу можливості інфікувати клітину пацієнта, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон; і виявлення у пацієнта клітини, яка експресує виявний маркер.
Текст
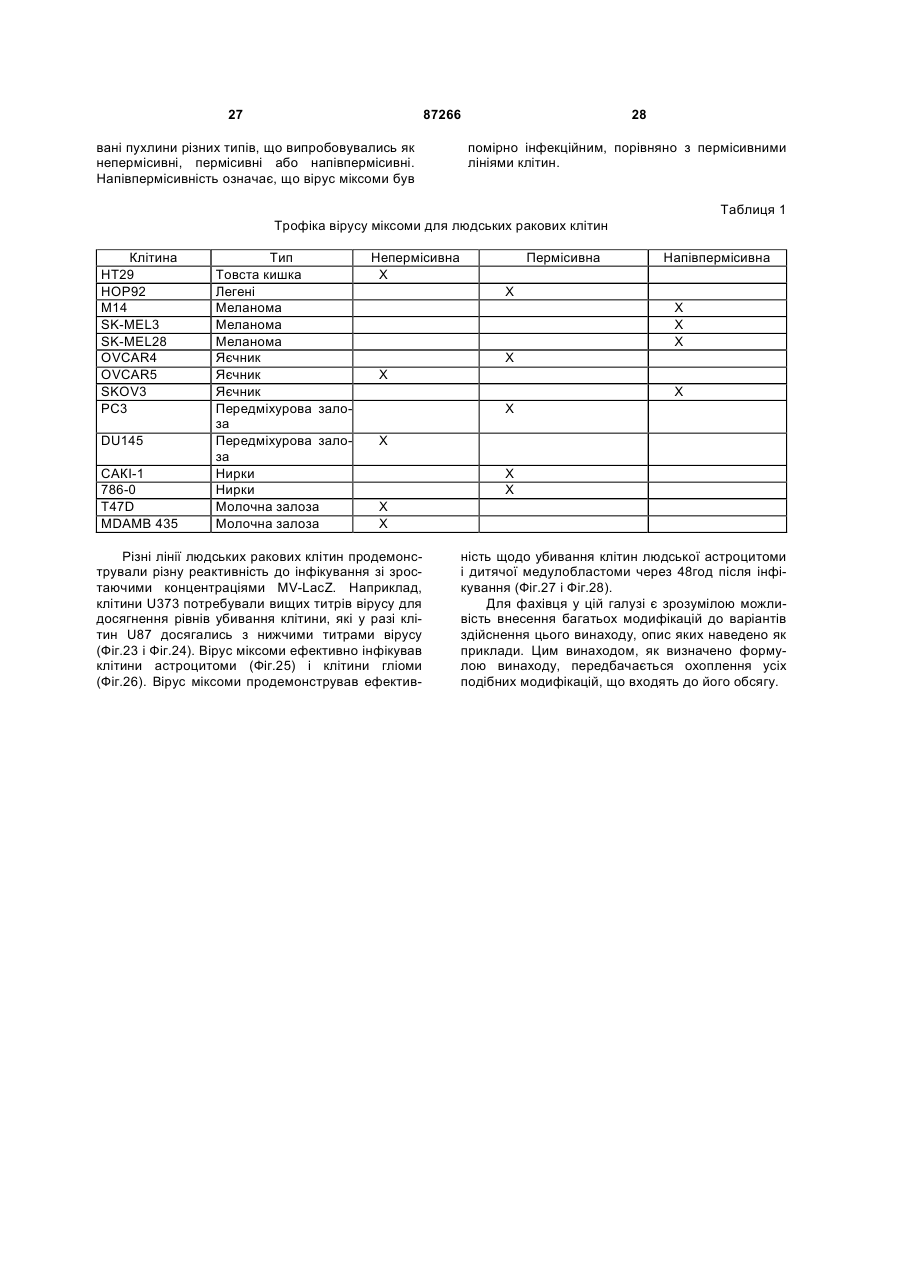
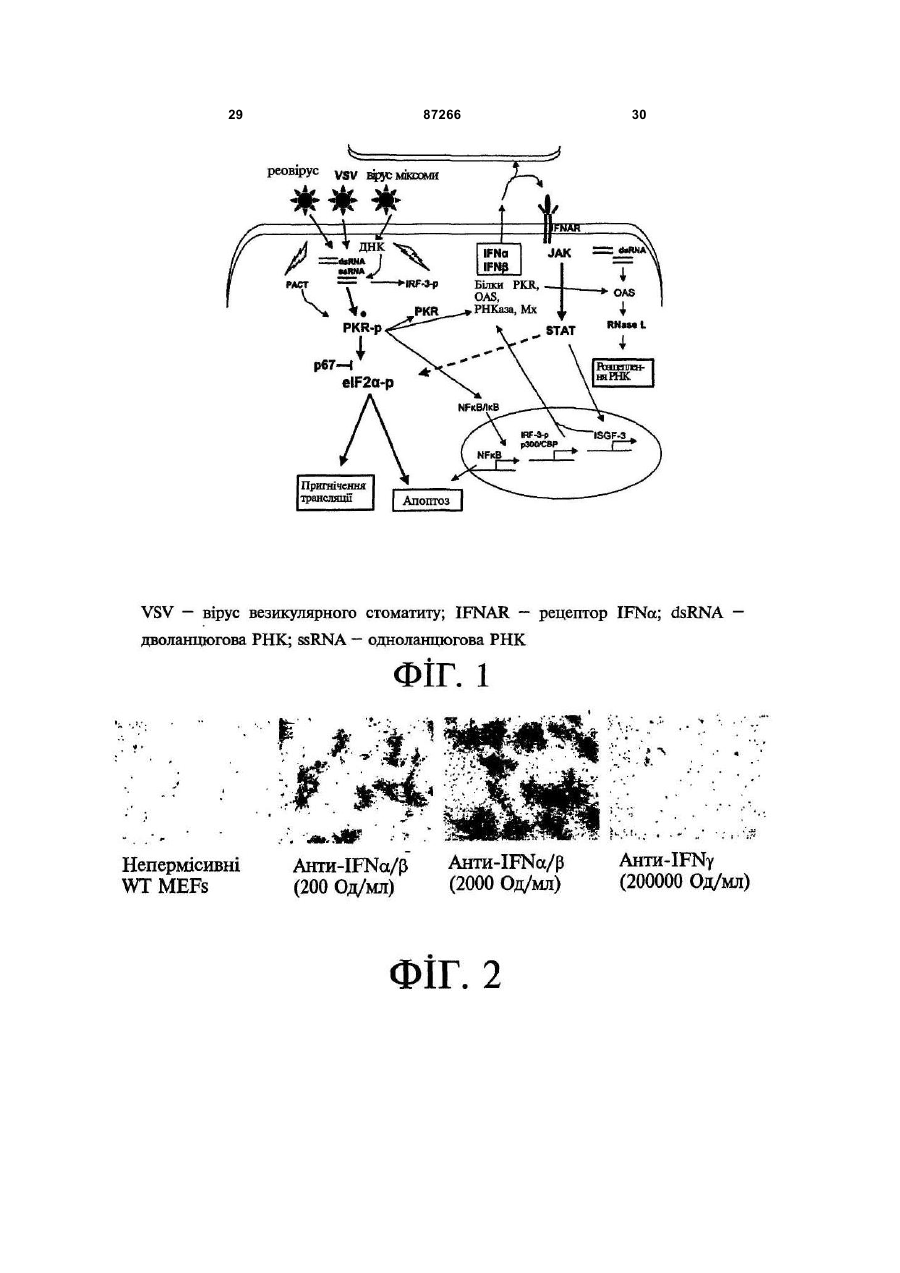
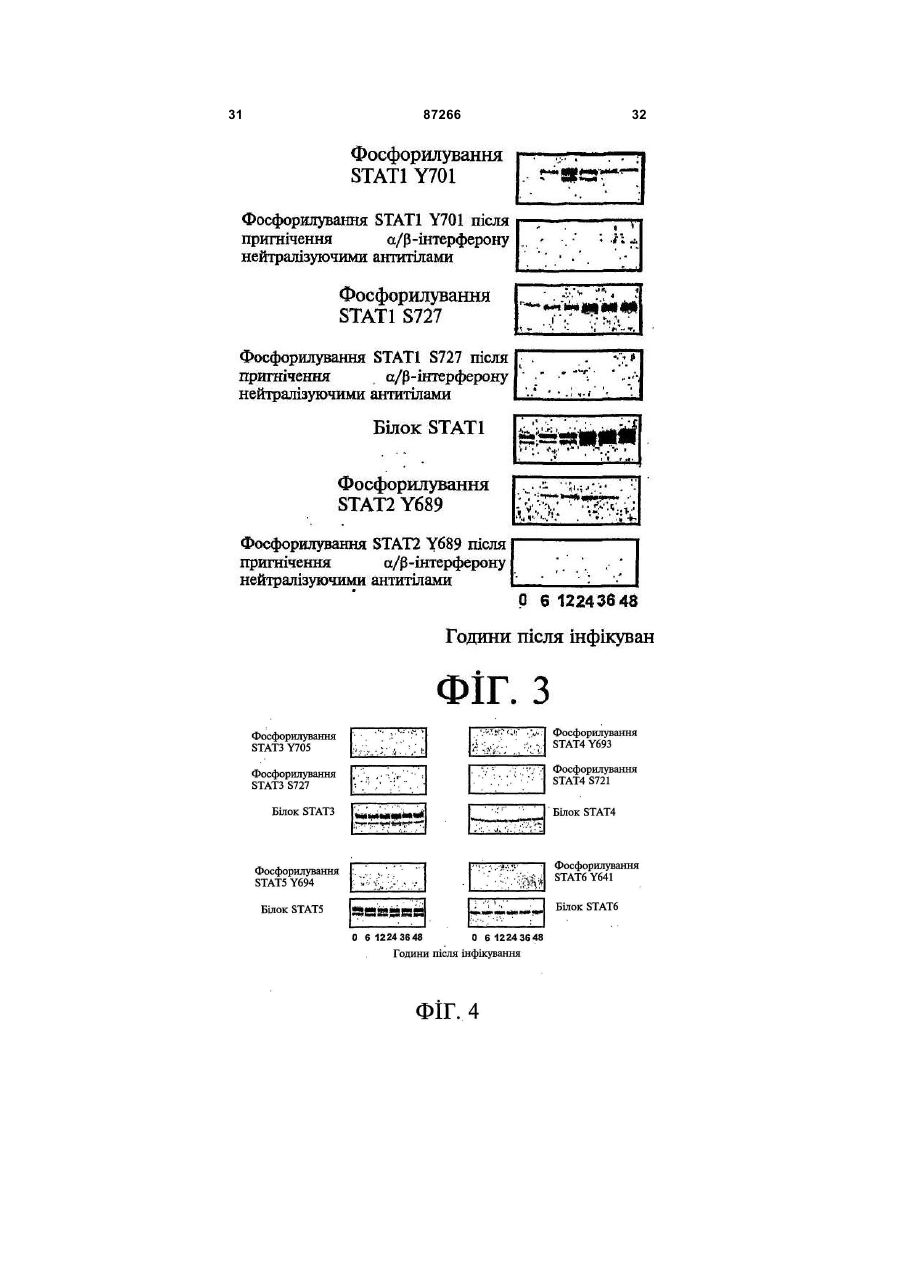
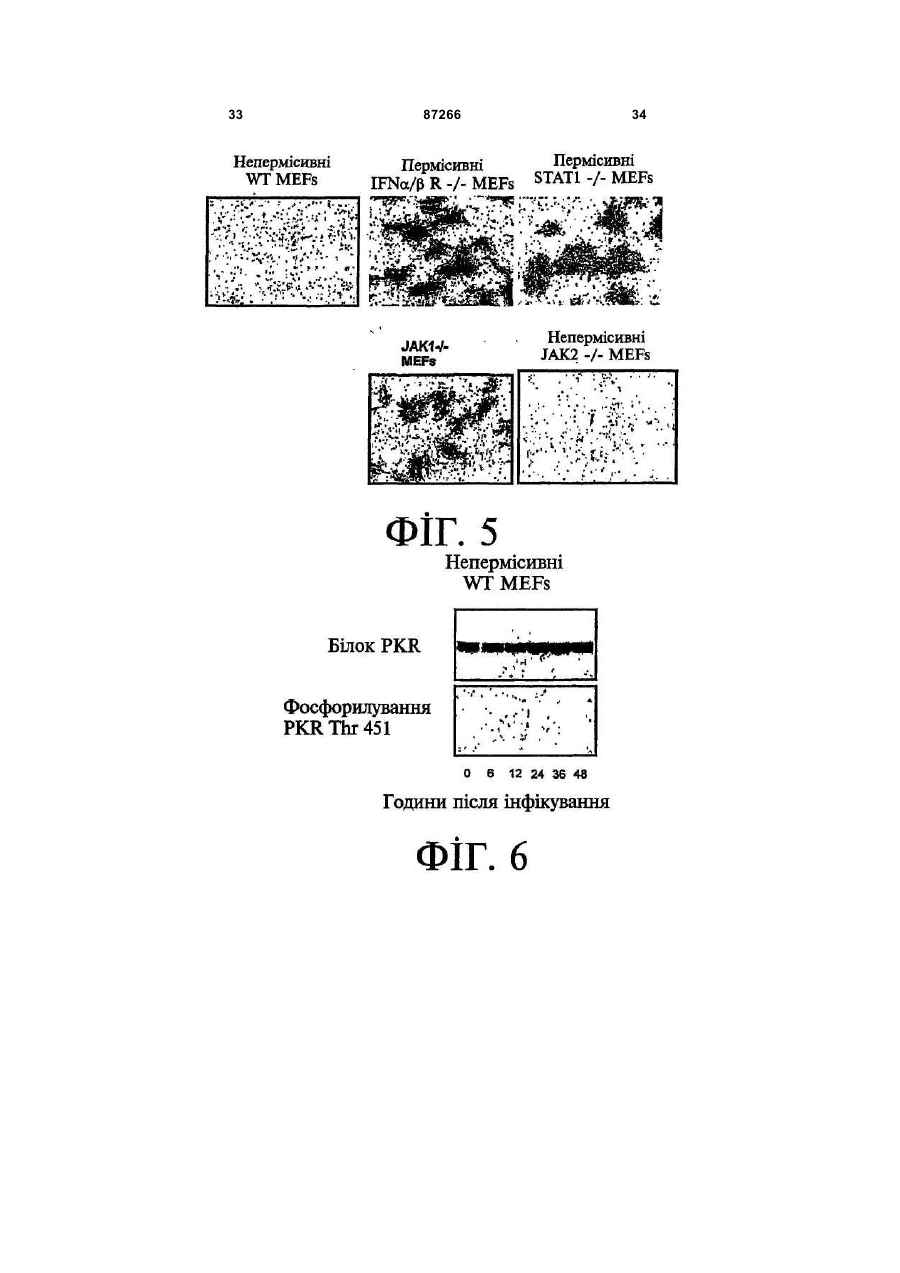
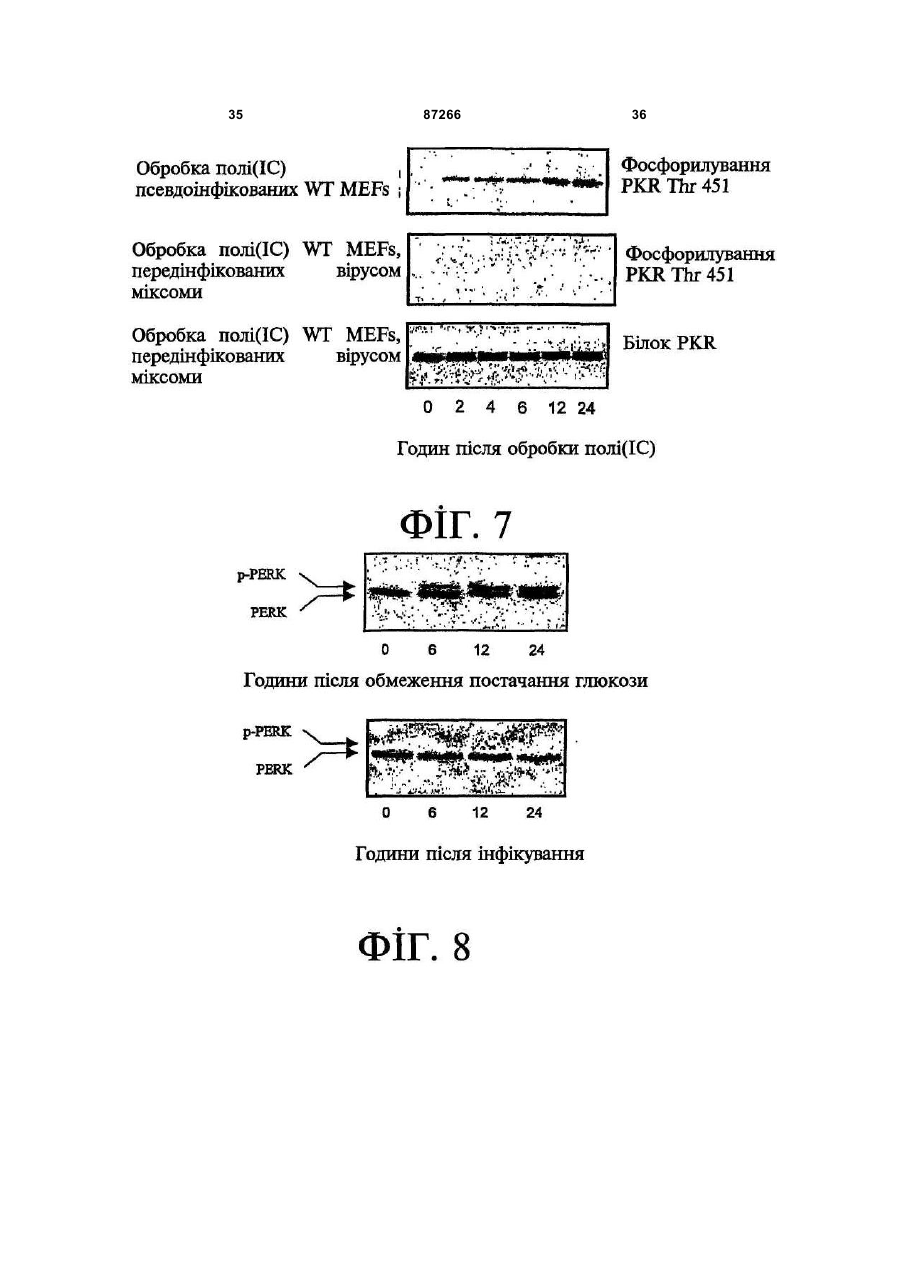
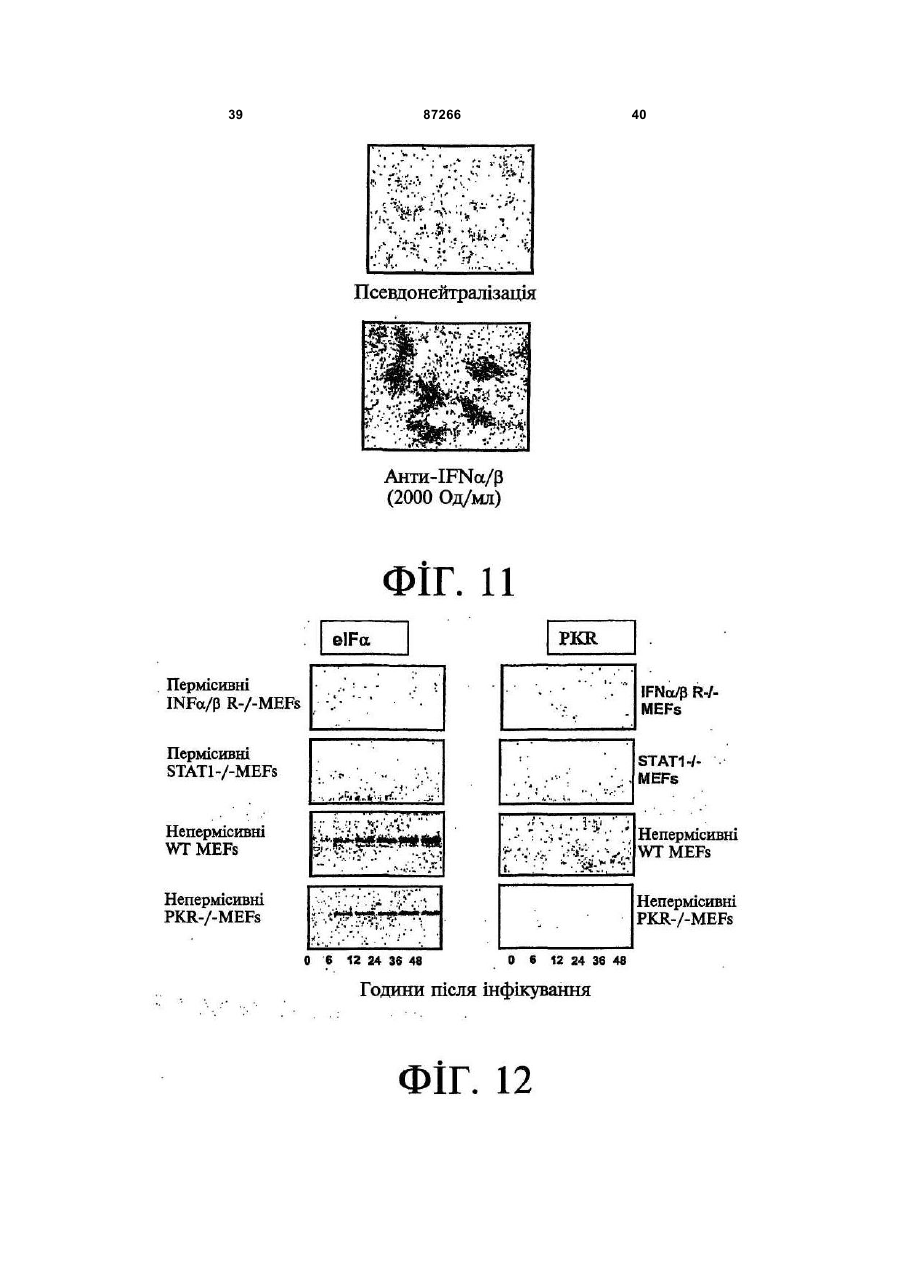
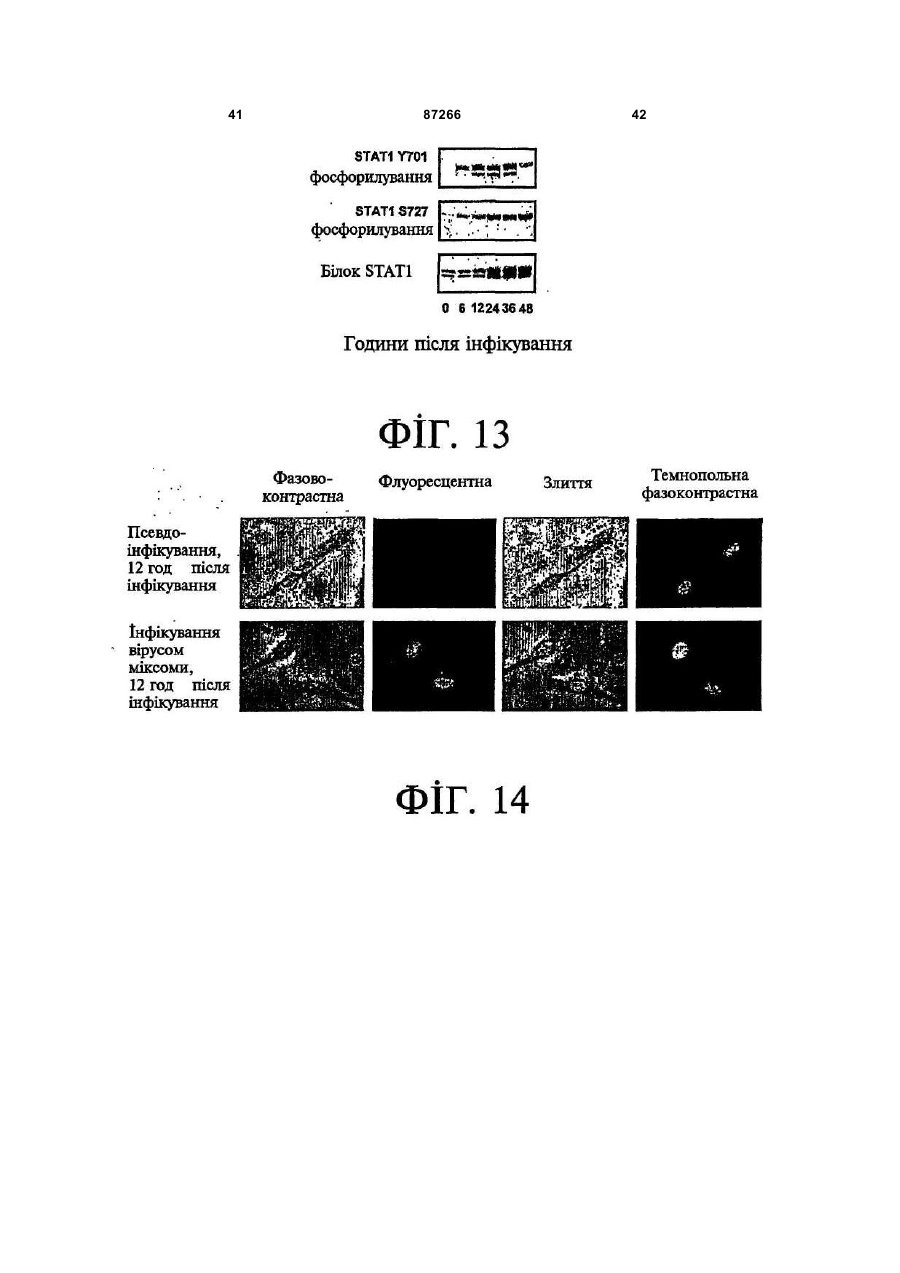
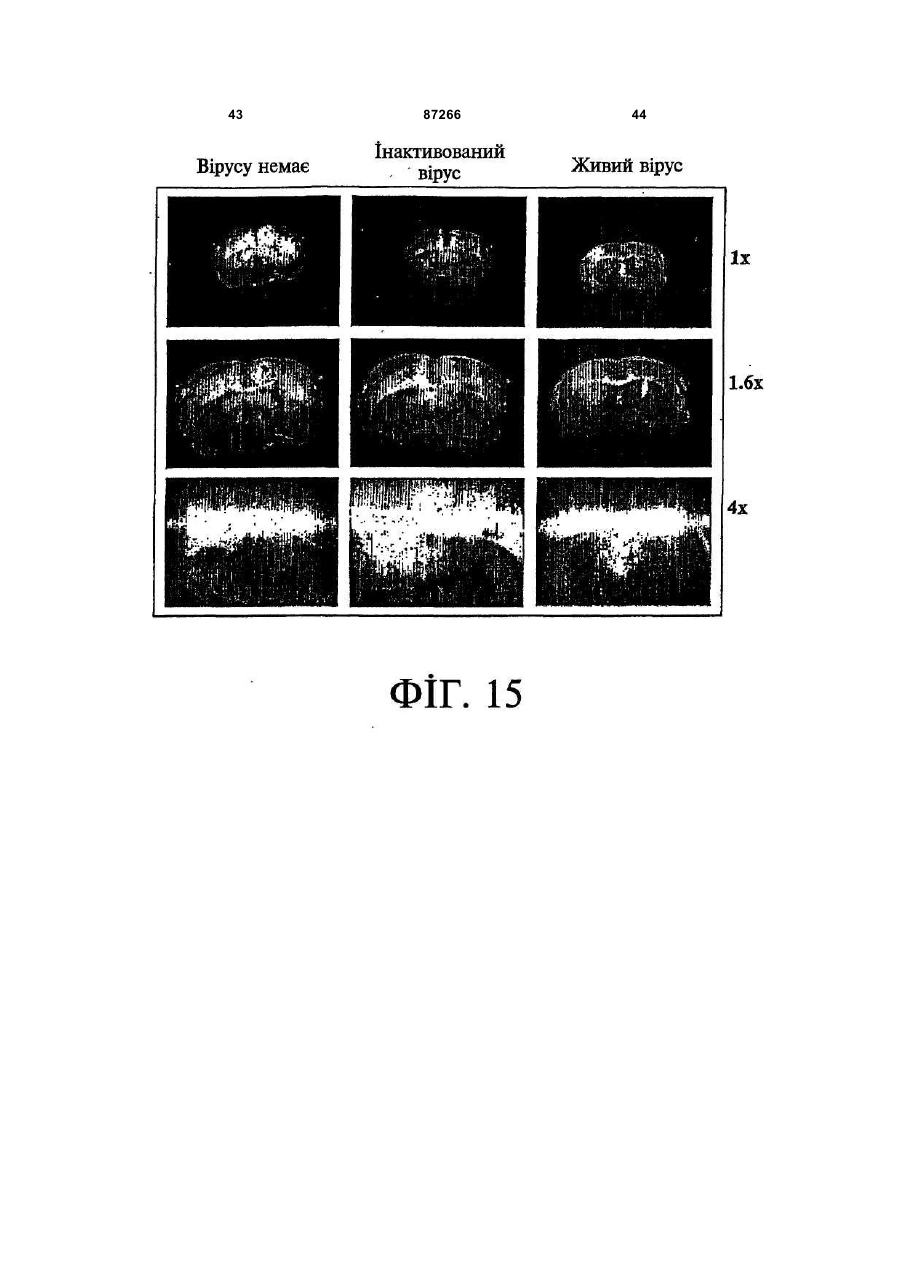
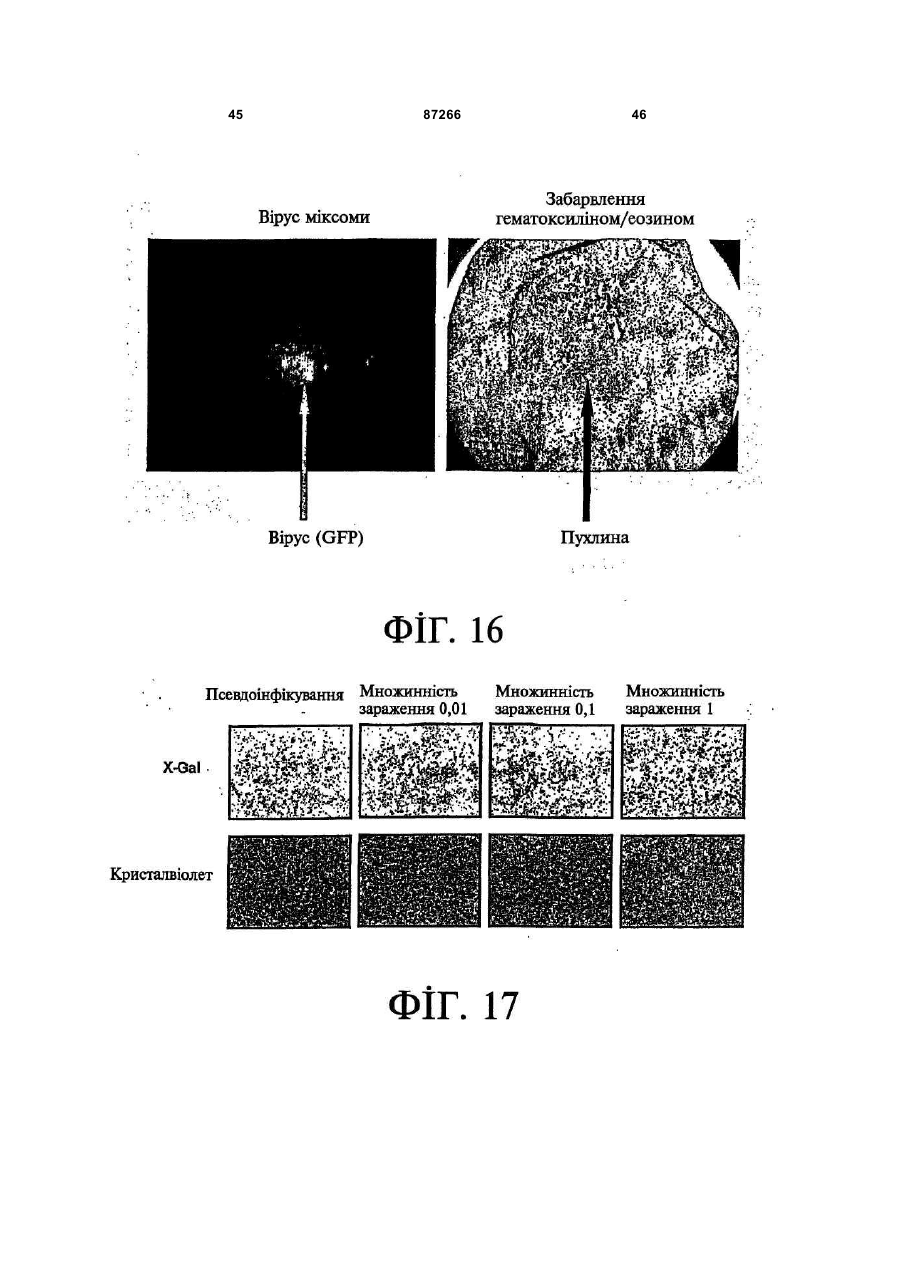
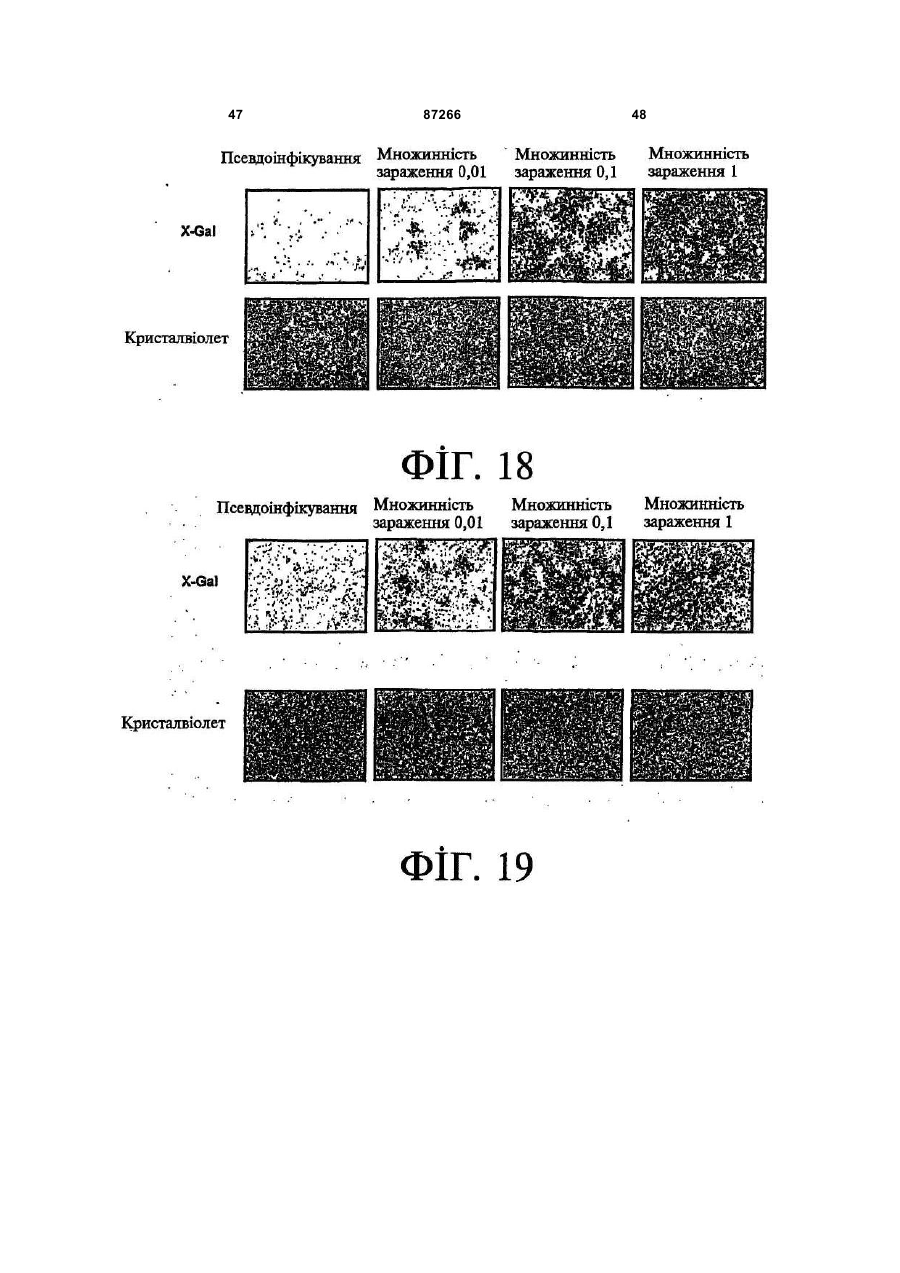
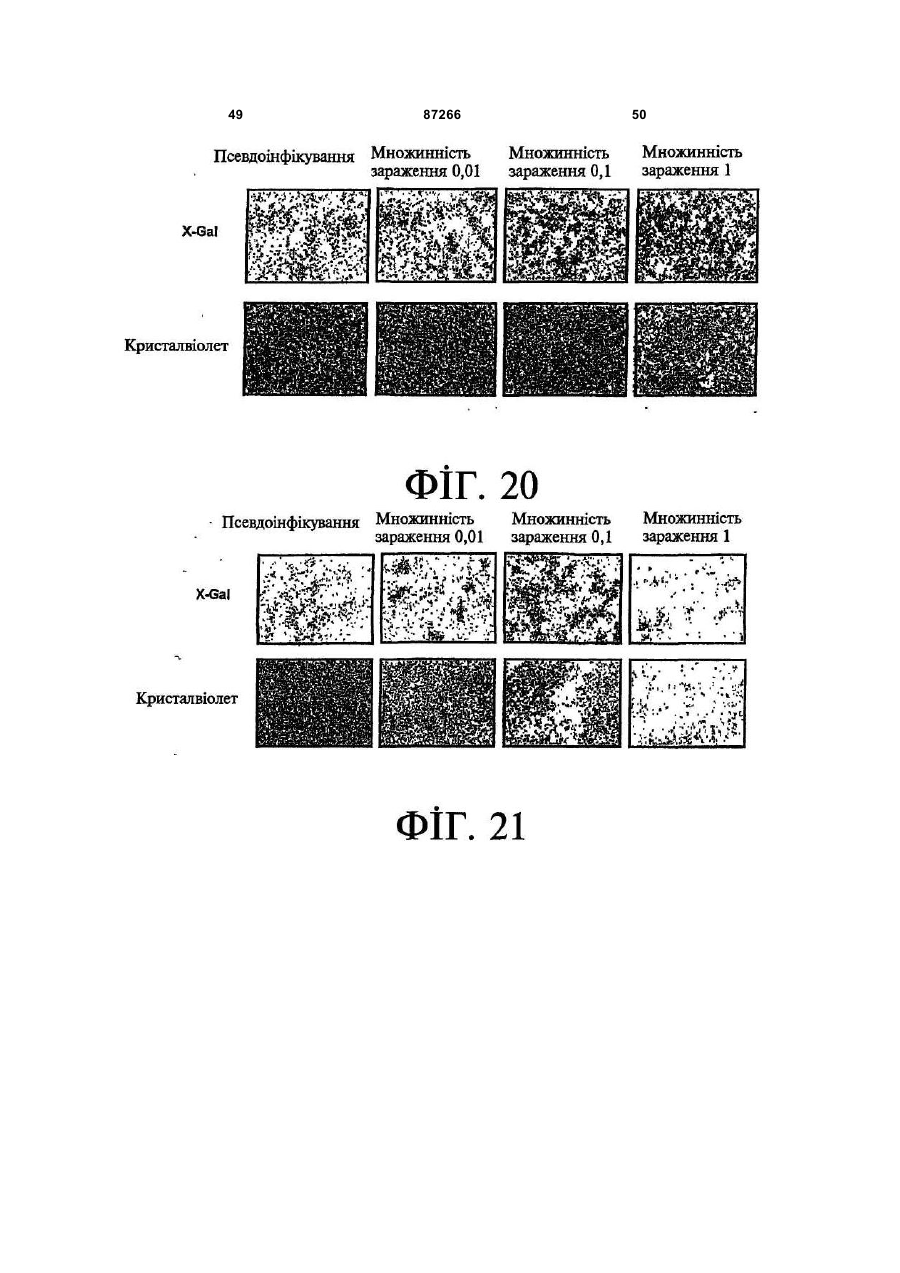
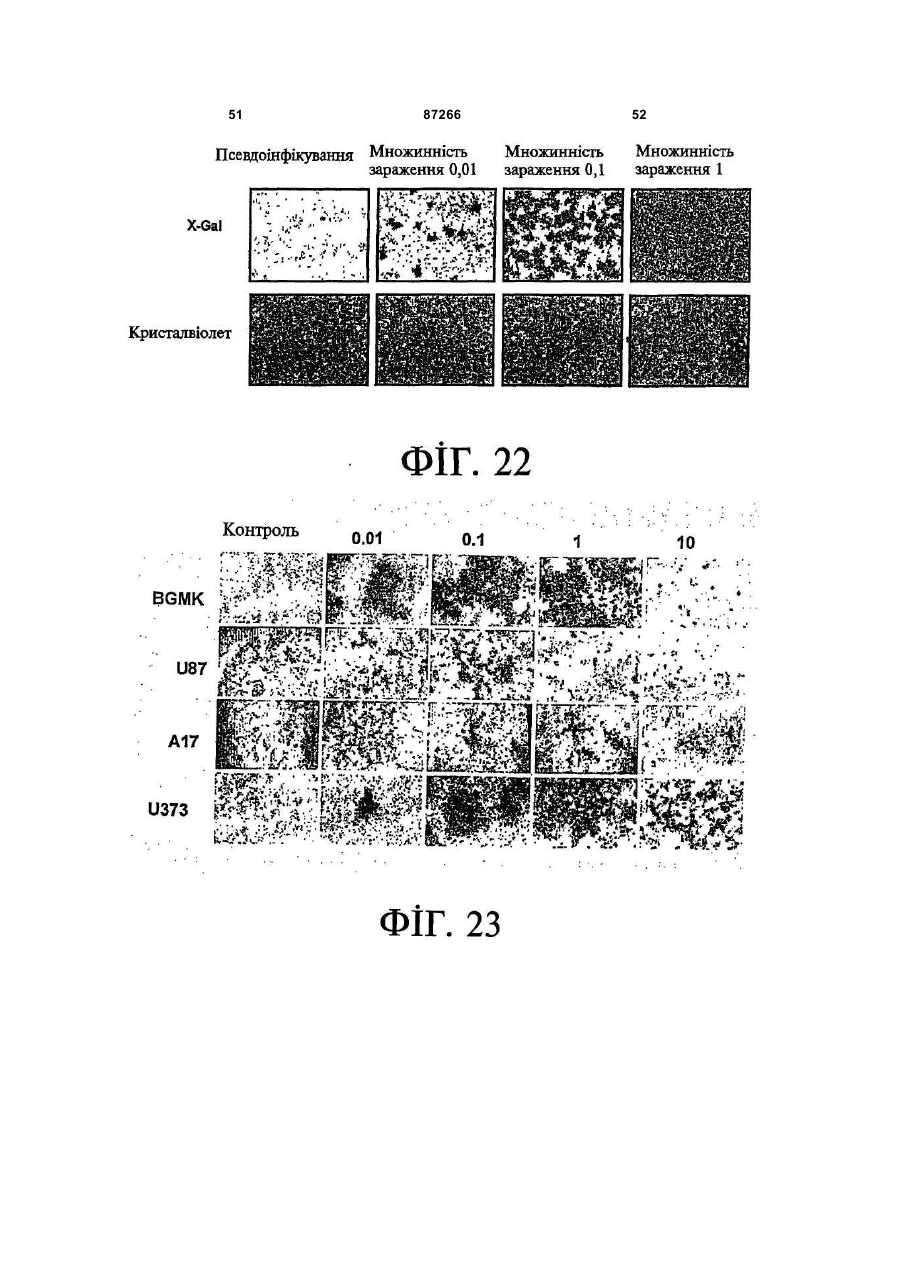
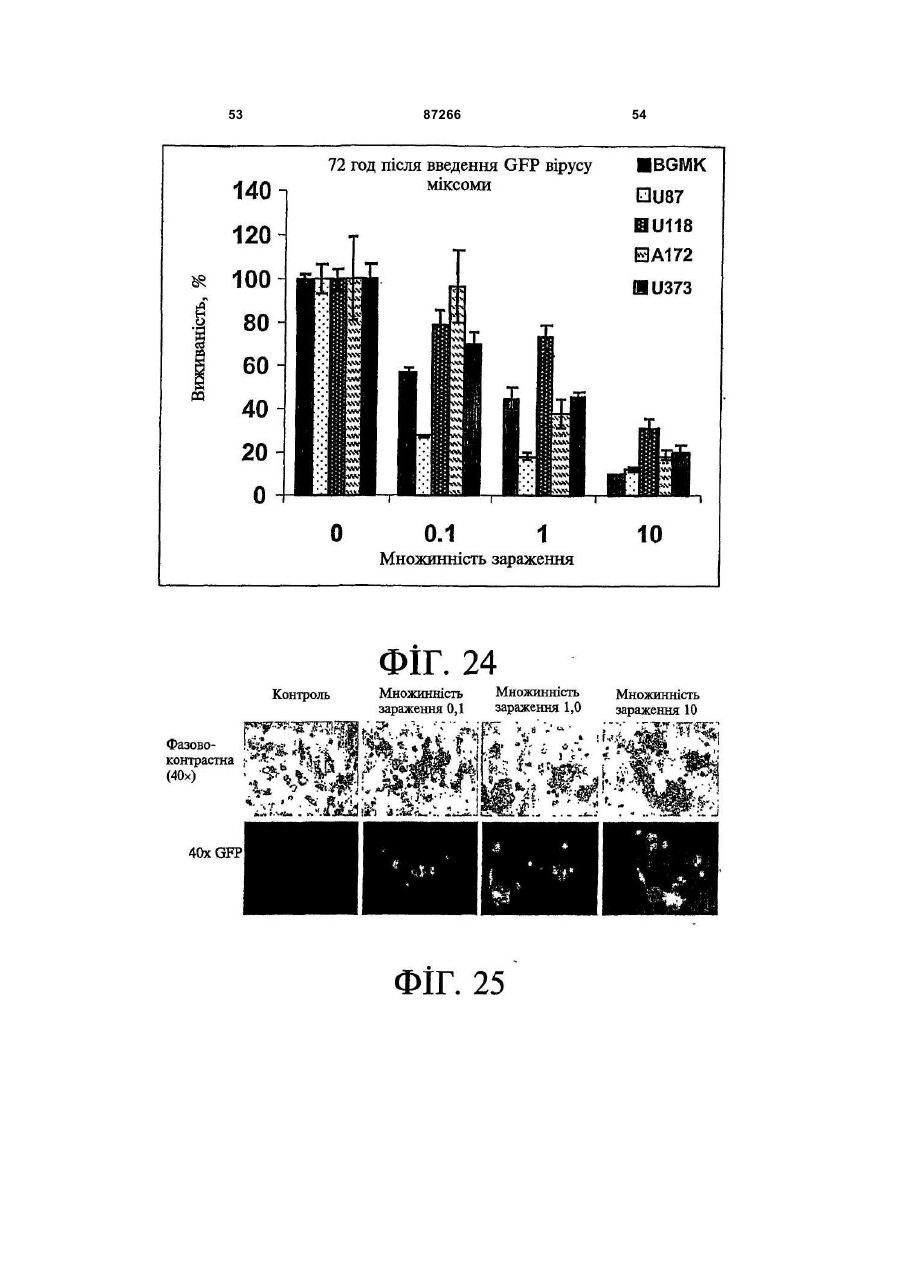
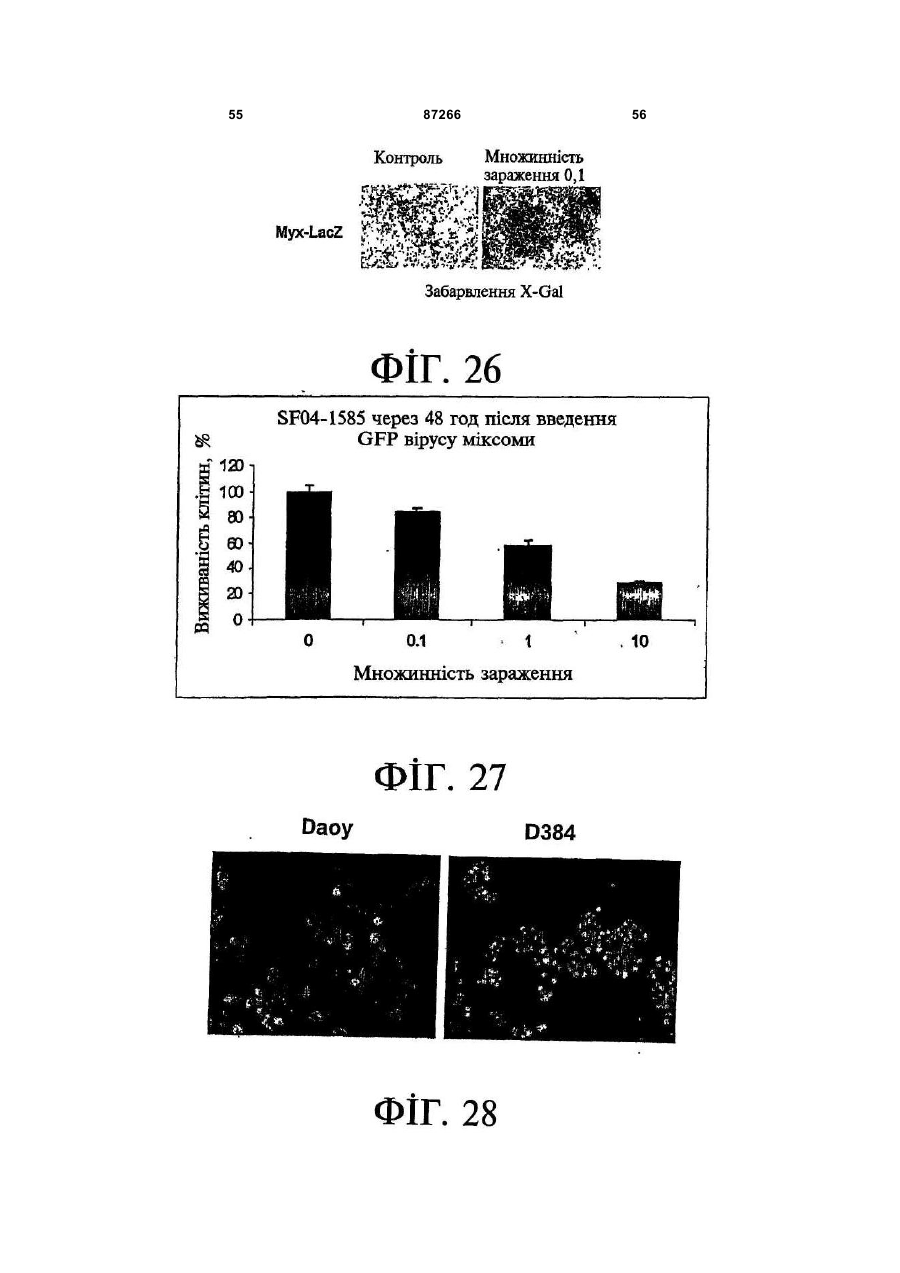
1. Спосіб пригнічення ракової клітини ссавця, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон, який включає введення у клітину ефективної кількості вірусу міксоми. 2. Спосіб за п. 1, який відрізняється тим, що клітиною є людська ракова клітина. 3. Спосіб за п. 1 або 2, який відрізняється тим, що вірусом міксоми є вірус дикого типу. 4. Спосіб за п. 1 або 2, який відрізняється тим, що вірус міксоми є генетично модифікованим. 5. Спосіб за п. 4, який відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гена. 6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що клітиною є клітина раку легень, клітина меланоми, клітина раку яєчника, клітина раку передміхурової залози, клітина раку нирок, клітина гліоми або клітина астроцитоми. 7. Спосіб лікування хворобливого стану, що являє собою рак і характеризується наявністю клітин, що мають недостатню вроджену противірусну реакцію і не реагують на інтерферон, який включає введення хворому, що потребує цього, ефективної кількості вірусу міксоми. 8. Спосіб за п. 7, який відрізняється тим, що раком є солідна пухлина. 9. Спосіб за п. 7 або 8, який відрізняється тим, що раком є рак гемопоетичних клітин, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, пло 2 (19) 1 3 87266 4 25. Застосування за п. 24, яке відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гену. 26. Застосування вірусу міксоми для виготовлення лікарського засобу для лікування хворобливого стану, який є раком і який характеризується наявністю клітин, що мають недостатню вроджену противірусну реакцію та не реагують на інтерферон. 27. Застосування за п. 26, яке відрізняється тим, що раком є солідна пухлина. 28. Застосування за п. 26 або 27, яке відрізняється тим, що раком є рак гемопоетичних клітин, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, плоскоклітинна карцинома, рак передміхурової залози, рак молочної залози, рак шийки матки, рак анастомозу ободової та прямої кишок або меланома. 29. Застосування за п. 28, яке відрізняється тим, що раком гемопоетичних клітин є лейкемія або лімфома. 30. Застосування за п. 26 або 27, яке відрізняється тим, що раком є рак легень, меланома, рак яєчника, рак передміхурової залози, рак нирок, гліома або астроцитома. 31. Застосування за будь-яким із пп. 26-30 для виготовлення лікарського засобу для лікування хворобливого стану в людини. 32. Застосування за будь-яким із пп. 26-31, яке відрізняється тим, що вірусом міксоми є вірус дикого типу. 33. Застосування за будь-яким із пп. 26-31, яке відрізняється тим, що вірус міксоми є генетично модифікованим. 34. Застосування за п. 33, яке відрізняється тим, що вірус міксоми є генетично модифікованим для експресії терапевтичного гена. 35. Фармацевтична композиція, яка містить вірус міксоми і фармацевтично прийнятний носій, для застосування при лікуванні хворобливого стану, який є раком і характеризується наявністю клітин, що мають недостатню врождлену противірусну реакцію та не реагують на інтерферон. 36. Фармацевтична композиція за п. 35, яка відрізняється тим, що раком є солідна пухлина. 37. Фармацевтична композиція за п. 35 або 36, яка відрізняється тим, що раком є рак гемопоетичних клітин, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, плоскоклітинна карцинома, рак передміхурової залози, рак молочної залози, рак шийки матки, рак анастомозу ободової та прямої кишок або меланома. 38. Фармацевтична композиція за п. 37, яка відрізняється тим, що раком гемопоетичних клітин є лейкемія або лімфома. 39. Фармацевтична композиція за п. 35 або 36, яка відрізняється тим, що раком є рак легень, меланома, рак яєчника, рак передміхурової залози, рак нирок, гліома або астроцитома. 40. Фармацевтична композиція за будь-яким із пп. 35-39, яка відрізняється тим, що містить додатковий лікарський засіб. 41. Фармацевтична композиція за п. 40, яка відрізняється тим, що додатковим лікарським засобом є хіміотерапевтичний засіб. 42. Фармацевтична композиція за будь-яким із пп. 35-41, яка відрізняється тим, що вона є придатною для ін'єкції у ділянку пухлини. 43. Набір, до складу якого входять вірус міксоми та інструкція для пригнічення ракової клітини ссавця, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон. 44. Набір, до складу якого входять вірус міксоми та інструкція для лікування раку, що не реагує на інтерферон, у пацієнта, який цього потребує. 45. Спосіб виявлення у пацієнта клітини, що має недостатню вроджену противірусну реакцію, який включає введення пацієнту вірусу міксоми, модифікованого для експресії виявного маркера; надання вірусу можливості інфікувати клітину пацієнта, яка має недостатню вроджену противірусну реакцію та не реагує на інтерферон; і виявлення у пацієнта клітини, яка експресує виявний маркер. Галузь, до якої належить винахід Цей винахід, взагалі, має відношення до терапевтичного застосування вірусу міксоми. Передумови створення винаходу У сучасних методах лікування, що застосовуються для терапії раку різних типів, вдаються до отруєння або убивання злоякісної клітини. На жаль, методи лікування, токсичні для ракових клітин, є, як правило, токсичними також і для здорових клітин. Окрім того, неоднорідна природа пухлин є однією з головних причин того, що ефективні методи лікування раку залишаються важкодосяжними. Сучасні головні методи лікування, наприклад, хіміотерапія і радіотерапія, застосовуються у вузькому терапевтичному діапазоні токсичності. Методи лікування цих типів вважаються недосконалими засобами, що мають обмежене застосування унаслідок різноманітності ракових клітин і обмеженого діапазону, у якому ці методи лікування можуть бути застосовані. Сучасні протиракові методи лікування, що розробляються, спрямовуються на селективне ураження ракових клітин із намаганням бути менш токсичними для здорових клітин, щоб завдяки цьому з більшою ймовірністю залишати здорові клітини неураженими. Онколітична вірусна терапія є одним із варіантів підходу, спрямованим на використання цитологічних різниць між злоякісними та нормальними клітинами. У цьому терапевтичному методі роль протиракових засобів відіграють реплікаційнокомпетентні, пухлиноселективні вектори на основі вірусного геному. Онколітичний вірус або специфічно і цілеспрямовано інфікує ракові клітини, 5 або є більш придатним для ефективної реплікації у ракових клітинах, порівняно зі здоровими клітинами. Ці реплікаційнокомпетентні, онколітичні віруси є або природними, або їх одержують засобами рекомбінантних ДНК, завдяки чому вони перетворюються на високоселективні та високоефективні засоби цілеспрямованої доставки до гетерогенної популяції пухлин. Оскільки у нормальних клітинах ефективної реплікації реплікаційноселективного онколітичного вірусу не відбувається, токсичність для пацієнта повинна бути низькою, зокрема, порівняно з традиційними методами лікування, наприклад, променевою терапією або хіміотерапією. Численними дослідженнями надані відомості про онколітичну активність різноманітних вірусних штамів, причому найперспективнішими онколітичними вірусами є природні або генетично модифіковані варіанти аденовірусу, вірусу простого герпесу 1 ("HSV1"), реовірусу, вірусу коров'ячої віспи, вірусу везикулярного стоматиту ("VSV") або вірусу поліомієліту. До модифікованих онколітичних вірусів, які на сучасному етапі піддають дослідженням, як протиракові засоби, належать HSV, аденовірус, вірус хвороби Ньюкасла ("NDV"), реовірус і вірус коров'ячої віспи, вірус кору, VSV і вірус поліомієліту. Різні онколітичні віруси піддають клінічним випробуванням Фази І і Фази II, причому деякі з них демонструють тривалу ефективність. Невідомо, однак, які віруси найкращим чином забезпечать досягнення онколітичних цілей, якими є тривала реплікація, специфічність та ефективна літична активність. Абсолютно ефективним "кандидатом" на роль онколітичного вектора на основі вірусного геному міг би бути такий, що має короткий життєвий цикл, швидко утворює зрілі віріони, ефективно розповсюджується з клітини на клітину і має великий геном, готовий до введення вставок. Дані також свідчать про те, що для ефективності онколітичної терапії важливим є пригнічення ранньої вродженої імунної реакції і уповільнення розвитку Th1-клітинних імунних реакцій. Зрозуміло, що людські віруси є високоімуногенними, про що свідчить інтенсивна гуморальна імунна відповідь та Т-клітинна імунна реакція, що спостерігаються у населення у цілому на численні віруси, що розглядаються як претенденти на розробку онколітичних вірусів. Клінічні дослідження показали, що сучасні онколітичні віруси є дійсно безпечними, але недостатньо сильнодіючими як монотерапевтичні засоби для того, щоб бути повністю клінічно ефективними. Оскільки, як правило, спостерігається недостатній або неефективний рівень інфікування ракових клітин, суттєву складову сучасних зусиль становить піддання вірусів-"кандидатів" обробці методами генної інженерії для того, щоб вони експресували терапевтичний трансген для підвищення їх ефективності. Більшість із вищезгаданих онколітичних вірусів також піддається випробуванням у поєднанні з іншими традиційними методами онколітичної терапії. Аденовірус легко піддається генетичному маніпулюванню і має добре відому функцію до 87266 6 мішкового вірусного білка. На додаток до цього, він асоціюється із захворюванням із дуже легким перебігом. Людський аденовірус ONYX-015 (фірма Onyx Pharmaceuticals Inc.) є одним з онколітичних вірусів, оптимізованих для клінічного застосування, що піддається найекстенсивнішим випробуванням. Вважають, що цей вірус переважно розмножується у р53-негативних пухлинах і демонструє потенціал у клінічних випробуваннях на пацієнтах, що страждають на пухлини на голові та шиї. Повідомлення, однак, показують, що ONYX-015 викликав об'єктивну клінічну реакцію лише у 14% хворих, що були піддані лікуванню (Немунаітіс Дж. (Nemunaitis J.), Курі Ф. (Khuri F.), Ганлі І. (Ganly І.), Арсено Дж. (Arseneau J.), Познер Μ. (Posner M.), Вокс Е. (Vokes E.), Кун Дж. (Kuhn J.), Маккарті Т. (McCarty Т.), Ландерс С. (Landers S.), Блекберн A. (Blackburn Α.), Ромел Л. (Romel L), Рандлев Б. (Randlev В.), Кей С. (Кауе S.), Кірн Д. (Kirn D.) J. Clin. Oncol. 2001 Jan. 15; 19(2):289-98). WO 96/03997 і WO 97/26904 описують мутантний онколітичний HSV, що інгібує ріст ракових клітин і є специфічним відносно нервових клітин. Додаткові переваги полягають у тому, що HSV може з легкістю піддаватись генетичному модифікуванню, і існують лікарські засоби, що припиняють будь-яку небажану реплікацію вірусу. Однак застосування такого розповсюдженого людського патогену є обмеженим, оскільки ймовірним є те, що населення у цілому піддавалось дії цього вірусу і набуло імунної реакції до нього, що може послабити літичний ефект цього вірусу. HSV може також викликати серйозні побічні ефекти або потенційно смертельне захворювання. Реовірус типу III пов'язується із захворюванням із відносно м'яким перебігом, і функція його вірусного гену є відносно добре зрозумілою. Реовірус типу III зараз розробляється фірмою Oncolytic Biotech як протираковий лікарський засіб, що демонструє посилені реплікаційні властивості у клітинах, що експресують мутантний онкоген ras, і переважно росте у PKR (протеїнкіназа R) -/- клітинах (Стронг Дж.Е. (Strong J.E.), П.У. Лі (P.W. Lee), J. Virology, 1996, 70:612-616). Однак реовірус важко піддається генетичному маніпулюванню, і його реплікація не може бути легко припинена. VSV пов'язується із захворюванням із відносно м'яким перебігом і також має добре відому функцію вірусного гена. WO 99/04026 розкриває застосування VSV як вектора у генній терапії для забезпечення широких можливостей лікування різноманітних розладів. Однак VSV страждає на ті самі проблеми, що і реовірус, а саме: він важко піддається генетичному маніпулюванню, і його реплікація не може бути легко припинена. Іншими онколітичними вірусами"кандидатами", описаними у цій галузі, є вірус коров'ячої віспи та вірус поліомієліту, однак вони пов'язуються з серйозною або потенційно смертельною хворобою. Патент США №4,806,347 розкриває застосування гамма-інтерферону і фрагмента IFNg (gінтерферон) проти людських ракових клітин. WO 7 99/18799 розкриває спосіб лікування захворювання у ссавця, при якому хворобливі клітини мають порушення інтерферон-опосередкованої противірусної реакції, що включає введення ссавцю терапевтично ефективної кількості чутливого до інтерферону, реплікаційнокомпетентного клонального вірусу. Тут безпосередньо розкривається, що частинки VSV мають токсичну активність проти ракових клітин, однак послаблення цитотоксичності VSV для нормальних клітин спостерігається у присутності інтерферону. WO 99/18799 також розкриває, що NDV-індукована чутливість спостерігалась у ракових клітин, що були піддані обробці інтерфероном, але додання інтерферону до нормальних клітин робить ці клітини стійкими до NDV. Мета цього способу полягає у тому, щоб зробити клітини чутливими до інтерферону шляхом інфікування їх інтерферон-чутливими вірусами. Короткий виклад суті винаходу За одним зі своїх аспектів, цей винахід пропонує спосіб пригнічення клітини, яка має недостатню вроджену противірусну реакцію, що включає введення до згаданої клітини ефективної кількості вірусу міксоми. За одним зі своїх аспектів, цей винахід пропонує спосіб лікування хворобливого стану, який відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію, що включає введення хворому, який цього потребує, ефективної кількості вірусу міксоми. Цей винахід додатково пропонує застосування ефективної кількості вірусу міксоми для пригнічення клітини, яка має недостатню вроджену противірусну реакцію, і для виготовлення лікарського засобу для пригнічення клітини, яка має недостатню вроджену противірусну реакцію. Цей винахід додатково пропонує застосування ефективної кількості вірусу міксоми для лікування хворобливого стану у хворого, де згаданий хворобливий стан відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію, і для виготовлення лікарського засобу для лікування такого хворобливого стану у хворого. За іншим аспектом, цей винахід пропонує фармацевтичну композицію, до складу якої входить вірус міксоми і фармацевтично прийнятний носій, для застосування з метою пригнічення клітини, що має недостатню вроджену противірусну реакцію, і для застосування при лікуванні хворобливого стану, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію. За іншим аспектом, цей винахід пропонує набір, що містить вірус міксоми і інструкції для пригнічення клітини, що має недостатню вроджену противірусну реакцію, або для лікування хворобливого стану, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію. Згадані хворобливі стани включають рак і хронічну вірусну інфекцію. Цей винахід додатково пропонує спосіб виявлення у хворого клітини, що має недостатню вроджену противірусну реакцію, що включає вве 87266 8 дення згаданому хворому вірусу міксоми, модифікованого для експресії маркера, що піддається виявленню; надання можливості вірусу інфікувати у хворого клітину, що має недостатню вроджену противірусну реакцію; і виявлення у хворого клітини, яка експресує виявний маркер. Цей винахід додатково пропонує спосіб виявлення у зразку клітини, яка має недостатню вроджену противірусну реакцію, що включає культивування клітини, піддання культивованих клітин дії вірусу міксоми; і визначення інфективності клітин вірусом міксоми. Основу цього винаходу становить неочікуване відкриття того, що вірус кролячої міксоми може селективно інфікувати клітини, у тому числі людські ракові клітини, що мають недостатню вроджену противірусну реакцію, у тому числі клітини, що не реагують на інтерферон. Термін "вроджена", що застосовується у цьому контексті, описує неантигенну специфічну імунну реакцію. Оскільки вірус міксоми у нормальних людських клітинах ефективно не розмножується, він, таким чином, може застосовуватись як лікарський засіб для різних розладів та станів, що відрізняються присутністю клітин, що мають недостатню вроджену противірусну реакцію, у тому числі клітин, що не реагують на інтерферон, наприклад, як онколітичний терапевтичний засіб для лікування раку. Цей вірус може також застосовуватись для ідентифікації клітин, що мають недостатню вроджену противірусну реакцію, і для візуалізації цих клітин in vivo. Інші аспекти і особливості цього винаходу стануть очевидними пересічним фахівцям у цій галузі після розгляду наведеного нижче опису конкретних варіантів здійснення цього винаходу у поєднанні із фігурами, що додаються. Слід розуміти, однак, що докладний опис і конкретні приклади, які пояснюють варіанти здійснення цього винаходу, яким віддають перевагу, наведені лише з ілюстративними цілями, оскільки фахівцям у цій галузі з цього докладного опису стануть зрозумілими різні зміни та модифікації у межах обсягу та суті цього винаходу. Короткий опис фігур На фігурах, які ілюструють, лише як приклад, варіанти здійснення цього винаходу, Фіг.1 - принципова схема передачі інтерферонопосередкованого противірусного сигналу, індукованого у разі вірусної інфекції клітини; Фіг.2 - фазово-контрастна мікрофотографія непермісивних фібробластів мишачих зародків ("MEFs") дикого типу (WT) після піддання дії вірусу міксоми, які показують, що MEFs стають пермісивними після пригнічення α/β-інтерферону нейтралізуючими антитілами; Фіг.3 - вестерн-блот, який показує стани фосфоритування (активації) STAT1 і STAT2 після інфікування вірусом міксоми з демонстрацією того, що непермісивні інфекції клітин MEF пов'язані з активацією STAT1 і STAT2; Фіг.4 - вестерн-блот, який показує стани фосфоритування (інактивації) STAT3, STAT4, STAT5 і STAT6 після інфікування вірусом міксоми з де 9 монстрацією того,що непермісивні інфекції клітин MEF не активують жоден із цих видів; Фіг.5 - фазово-контрастна мікрофотографія IFNa/β R -/- MEFs і STAT1 -/- MEFs, IFNa/β R -/MEFs і STAT1 -/- MEFs після інфікування вірусом міксоми, яка показує, що клітини стають пермісивними для інфікування вірусом міксоми унаслідок інактивації передачі сигналу IFN/STAT/JAK; Фіг.6 - вестерн-блот, що показує стани фосфорилування PKR у непермісивних MEFs дикого типу після інфікування вірусом міксоми з демонстрацією того, що PKR не активується інфікуванням вірусом міксоми; Фіг.7 - вестерн-блот, що показує стани фосфорилування PKR у MEFs дикого типу, псевдоінфікованих або передінфікованих вірусом міксоми, з демонстрацією того, що вірус міксоми блокує активацію PKR в клітинах MEF; Фіг.8 - вестерн-блот, що показує стани фосфорилування PERK у MEFs дикого типу після інфікування вірусом міксоми, з демонстрацією того, що вірус міксоми блокує активацію PERK у клітинах MEF; Фіг.9 - фазово-контрастна мікрофотографія потрійного блокування PKR -/-, РНКази-L -/- і Мх1 -/- після піддання дії вірусу міксоми, що показує, що противірусний стан клітин MEF опосередковується різними шляхами; Фіг.10 - фазово-контрастна мікрофотографія потрійного блокування PKR -/-, РНКази-L -/- і Мх1 -/- після піддання дії вірусу міксоми; Фіг.11 - фазово-контрастна мікрофотографія потрійного блокування PKR -/-, РНКази-L -/- і Мх1 -/- після обробки IFNa/β-нейтралізуючими антитілами і після піддання дії вірусу міксоми; Фіг.12 - вестерн-блот, що показує рівні фосфорилування eIF-2a і PKR у непермісивних MEFs після обробки IFNa/β-нейтралізуючими антитілами і після піддання дії вірусу міксоми з демонстрацією того, що фосфорилування eIF2a у непермісивних клітин каталізується PKRнезалежним шляхом; Фіг.13 - вестерн-блот, що показує стани фосфорилування STAT1 у разі потрійного блокування PKR-/-, РНКази-L-/- і Мх1-/- після інфікування вірусом міксоми з демонстрацією нормальних реакцій передачі IFN-індукованого сигналу; Фіг.14 - фазово-контрастна мікрофотографія, що ілюструє субклітинну локалізацію тирозинфосфорилованого STAT1 у непермісивних PKR-/+ РНКаза-L-/- + Мх1-/- клітин через 12год після інфікування з демонстрацією того, що активований STAT локалізується у ядрі, як прогнозувалось для нормальних реакцій передачі сигналу IFN/STAT; Фіг.15 - флуоресцентне зображення головного мозку "голих" мишей з інтракраніальним псевдоінфікуванням гліомою або інфікованих інактивованим або живим вірусом міксоми, що експресує GFP, що демонструє цілеспрямовану доставку вірусу міксоми до клітин гліоми; Фіг.16 - флуоресцентне зображення і фотографія тонких зрізів мишачої гліоми, інфікованої вірусом міксоми, що експресує GFP, на яких по 87266 10 казано, що реплікація вірусу міксоми відбувається лише у ракових клітинах; Фіг.17 - фазово-контрастна мікрофотографія людських ракових клітин НТ29, забарвлених XGal або кристалвіолетом, після інфікування вірусом міксоми, на якій показано приклад непермісивної інфекції людських клітин; Фіг.18 - фазово-контрастна мікрофотографія людських ракових клітин НОР92, забарвлених XGal або кристалвіолетом, після інфікування вірусом міксоми, на якій показано приклад пермісивної інфекції людських клітин; Фіг.19 - фазово-контрастна мікрофотографія людських ракових клітин OVCAR4, забарвлених X-Gal або кристалвіолетом, після інфікування вірусом міксоми, на якій показано приклад пермісивної інфекції людських клітин; Фіг.20 - фазово-контрастна мікрофотографія людських ракових клітин SK-MEL3, забарвлених X-Gal або кристалвіолетом, після інфікування вірусом міксоми, на якій показано приклад пермісивної інфекції людських клітин; Фіг.21 - фазово-контрастна мікрофотографія людських ракових клітин SK-MEL28, забарвлених X-Gal або кристалвіолетом, після інфікування вірусом міксоми, на якій показано приклад напівпермісивної інфекції людських ракових клітин; Фіг.22 - фазово-контрастна мікрофотографія клітин BGMK, забарвлених X-Gal або кристалвіолетом, після інфікування вірусом міксоми, на якій показана типова пермісивна контрольна інфекція; Фіг.23 - фазово-контрастна мікрофотографія позитивних контрольних клітин BGMK і ліній людських ракових клітин U87, А172 і U373, інфікованих зростаючими концентраціями вірусу міксоми, що експресує білок LacZ, забарвлених X-Gal, на якій показано, що усі ці клітини людської гліоми були пермісивними для реплікації вірусу міксоми; Фіг.24 - діаграма, що показує коефіцієнт виживаності клітин BGMK, U87, ΑΙ72 і U373, інфікованих вірусом міксоми, через 72год після інфікування зростаючими концентраціями вірусу з демонстрацією здатності вірусу міксоми до убивання усіх цих клітин; Фіг.25 - фазово-контрастна мікрофотографія і флуоресцентна мікрофотографія клітин астроцитоми SF04 1585, інфікованих MV GFP, що показує інфекцію клітин первинної людської гліоми; Фіг.26 - фазово-контрастна мікрофотографія клітин гліоми U373, інфікованих вірусом міксоми, що експресує білок LacZ, забарвлених X-Gal, що показує інфекцію цих людських ракових клітин; Фіг.27 - діаграма, що показує коефіцієнт виживаності клітин SF04 1585, інфікованих MV GFP, через 48год після інфікування, що показує убивання цих інфікованих людських ракових клітин; Фіг.28 - флуоресцентна мікрофотографія ліній клітин Daoy і D384 медулобластоми, інфікованих вірусом міксоми, що експресує GFP, що показує інфекцію цих людських ракових клітин. Докладний опис Винахідники відкрили, що вірус міксоми, вірус, який за нормальних умов інфікує кроликів, може селективно інфікувати і убивати клітини, у тому числі людські клітини, що мають недостатню 11 вроджену противірусну реакцію, наприклад, клітини, що не реагують на інтерферон. Вірус міксоми, з іншого боку, у нормальних людських клітинах ефективно не розмножується. Оскільки багато захворювань або станів відрізняються присутністю клітин, що мають недостатню вроджену противірусну реакцію, у тому числі клітин, що не реагують на інтерферон, наприклад, рак, вірус міксоми може застосовуватись для лікування таких захворювань і станів, у тому числі раку, з низькою токсичністю для нормальних здорових клітин. Вірус міксоми може також застосовуватись для лікування хронічно інфікованих клітин, оскільки такі клітини мають недостатню вроджену противірусну реакцію. Багато вірусів, наприклад, кодують генні продукти, функція яких полягає у пригніченні антивірусної, інтерферонової реакції клітин. Вірус міксоми може селективно інфікувати ці клітини. Вірус міксоми ("MV") є збудником міксоматозу у кроликів. MV належить до роду Leporipoxvirus сімейства Poxviridae, найбільших ДНК-вмісних вірусів. MV викликає доброякісне захворювання у свого природного хазяїна, американського кролика (Sylvilagus), у Північній та Південній Америці. Це, однак, є вірулентний і хазяїноспецифічний поксвірус, що викликає смертельне захворювання у європейських диких кроликів, яке відрізняється системними ураженнями, зокрема, довкола слизових ділянок. (Камерон К. (Cameron С.), Хота-Мітчелл С. (Hota-Mitchell S.), Чен Л. (Chen L.), Барретт Дж. (Barrett J.), Као Дж.Кс. (Cao J.X.), Маколей К. (Macaulay С.), Уіллер Д. (Willer D.), Еванс Д. (Evans D.), Макфадден Г. (McFadden G.) Virology 1999, 264(2):298-318; Керр П. (Kerr P.), Макфадден Г. (McFadden G.) Viral Immunology 2002, 15(2):229-246). MV є великим вірусом із двонитковою геномною ДНК (163т.п.н.), що реплікується у цитоплазмі інфікованих клітин (Б.Н. Філдс (B.N. Fields), Д.М. Кнайп (D.M. Кnіре), П.М. Хаули (P.M. Howley), Eds., Virology Lippincott Raven Press, New York, 2nd ed., 1996). Відомо, що MV кодує різноманітні клітино-асоційовані і секретовані білки, що є причетними до регуляції за типом зворотного зв'язку імунних та запальних реакцій хазяїна та пригнічення апоптозу вірусінфікованих клітин. MV може поглинатись усіма людськими соматичними клітинами. Однак, у разі нормальних соматичних кролячих клітин, якщо клітини мають нормальну вроджену противірусну реакцію, вірус виявиться нездатним до продуктивного інфікування клітини, що означає те, що вірус буде нездатним до реплікації та спричинення загибелі клітини. Інтерферони (IFNs) являють собою сімейство цитокінів, що секретуються у відповідь на різноманітні стимули. Інтерферони зв'язуються з мембранними рецепторами клітин з активацією послідовності реакцій передачі сигналу, наслідком чого є численні клітинні реакції, у тому числі противірусна реакція та індукування сигналів пригнічення росту та/або апоптозу. Інтерферони підрозділяються на два типи: тип І або тип II. До інтерферонів (IFN) типу І на 87266 12 лежать IFN -α, IFN -β, IFN -t і IFN-ω, усі з яких є мономерами; лише інтерферон типу II, IFN-g, є димером. Дванадцять різних підтипів IFN-a продукуються 14 генами, але усі інші інтерферони контролюються одним геном (Ардіні (Arduini) та інші, 1999). Інтерферони здійснюють безпосередню протипухлинну активність шляхом модулювання експресії онкогену. Наслідком надекспресії онкогенів, що стимулюють ріст або втрати онкогенів-супресорів пухлин може бути злоякісна трансформація. Деякими онкогенами, які, як припускають, є причетними до виникнення раку є р53, Rb, PC, NF1, WT1, DCC. Вірус міксоми, як і інші онколітичні віруси, наприклад, реовірус і VSV, повинен обходити противірусний захист, який існує у нормальних здорових клітинах, для того, щоб мати змогу до реплікації у межах клітин. MV та інші онколітичні віруси індукують продукування інтерферону і є, як правило, чутливими до противірусного ефекту реакцій продукування інтерферону. До відповідних білків, що індукуються IFN противірусною реакцією і які, головним чином, впливають на розмноження вірусу, належать PKR, OASсинтетаза і РНКаза-L-нуклеаза. PRK активує eIF2a, наслідком чого є пригнічення трансляції та індукція апоптозу. На Фіг.1 схематично зображена реакція продукування інтерферону. У нормальних клітинах MV знаходиться під безпосереднім впливом PKR та eIF2a. У ракових клітин послідовність противірусних реакцій часто є зруйнованою. Наприклад, знижена або недостатня реакція на інтерферон є генетичним дефектом, що часто виникає під час процесу трансформації та розвитку пухлини. Більше 80% ліній ракових клітин не реагують або демонструють ослаблені реакції на інтерферон. (Стойдл (Stojdl) та інші, Cancer Cell (2003) 4:263275 та посилання, що згадуються у цій роботі; Вонг (Wong) та інші J. Вiol. Chem. (1997) 272(45):28779-28785; Сан (Sun) та інші Blood. (1998) 91(2):570-576; Мейтін (Matin) та інші Cancer Res. (2001) 61(5):2261-2266; Балачандран (Balachandran) та інші Cancer Cell (2004) 5(1):5165). Винахідники з подивом відкрили, що MV може інфікувати і убивати ракові клітини, у тому числі людські ракові клітини. Не обмежуючись жодною конкретною теорією, гадають, що MV може інфікувати ці клітини тому, що вони мають недостатню вроджену противірусну реакцію. Дані дозволяють припустити, що пригнічення ранньої вродженої імунної реакції та уповільнення розвитку Th1-клітинних імунних реакцій є важливим моментом для ефективності онколітичної терапії. Незважаючи на те, що вірус міксоми є вірулентним вірусом, він є хазяїноспецифічним і має дуже обмежений діапазон хазяїв; він не інфікує людей або мишей. Не обмежуючись жодною конкретною теорією, гадають, що, оскільки вірус міксоми не є людським вірусом, у людей він не повинен зустрічатись із передіснуючим імунологічним розпізнаванням. Таким чином, його потенціал як онколітичного вірусу буде погіршеним меншою мірою, і вірус міксоми повинен забезпечити більш активне інфікування пермісивних ракових 13 клітин, аніж нативні людські віруси, унаслідок чого він може забезпечити ефективне онколітичне лікування раку. Таким чином, за одним із варіантів здійснення винаходу, пропонується спосіб пригнічення клітини, що має недостатню вроджену противірусну реакцію, що включає введення клітині ефективної кількості вірусу міксоми. За одним із варіантів здійснення винаходу, згадана клітина не реагує на інтерферон. За конкретними варіантами здійснення винаходу, згаданою клітиною є ракова клітина ссавця. За одним із варіантів здійснення винаходу, згаданою клітиною є людська ракова клітина, у тому числі клітина людської солідної пухлини. За іншим варіантом здійснення винаходу, згадана клітина є хронічно інфікованою вірусом. Термін "клітина, що має недостатню вроджену противірусну реакцію", що застосовується у цьому описі, означає клітину, яка, у разі піддання дії вірусу або у разі проникнення вірусу, не індукує противірусних захисних механізмів, що включають пригнічення реплікації вірусу, продукування інтерферону, індукування реакції на інтерферон та апоптоз, який може або може не опосередковуватись інтерфероном, і, таким чином, піддається інфікуванню MV. Згаданий термін означає клітину, що має знижену або ослаблену вроджену противірусну реакцію у разі піддання дії або інфікування вірусом, у порівнянні з нормальною клітиною, наприклад, не інфікованою або не раковою клітиною. Цей термін означає клітину, що не реагує на інтерферон, і клітину, що має знижену або ослаблену апоптозну реакцію або індукцію каскаду апоптозних реакцій. Недостатність може викликатись різними причинами, у тому числі інфекцією, генетичним дефектом або екологічним стресом. Слід, однак, розуміти, що у разі, коли недостатність спричинюється передіснуючою інфекцією, суперінфекція MV може бути виключена, і досвідчений фахівець може легко визначити такі випадки. Досвідчений фахівець може легко визначити без зайвого експериментування, чи має клітина будь-якого даного типу недостатню вроджену противірусну реакцію і, таким чином, може інфікуватись вірусом міксоми. Для визначення противірусної реакції клітини, наприклад, традиційно застосовують VSV. Для визначення того, чи клітина даного типу, наприклад, ракова клітина даного типу, має недостатню вроджену противірусну реакцію, досвідчений фахівець може відібрати експлантат, культивувати декілька клітин in vitro і визначити здатність до зараження VSV або, за альтернативним варіантом, вірусом міксоми. Термін "клітина, що не реагує на інтерферон", що застосовується у цьому описі, означає клітину, що не реагує на активність інтерферону, наприклад, противірусну або протипухлинну активність інтерферону, або має атипову реакцію на інтерферон, наприклад, знижену або неефективну реакцію на інтерферон, або атипову передачу сигналу інтерферону, що визначається, наприклад, фосфорилуванням або активацією молекул, що передають сигнал, наприклад, фак 87266 14 торів транскрипції, наприклад, STAT1. Наприклад, без обмеження, згадана клітина може не піддаватись пригніченню проліферації або її не можна убити у разі піддання дії рівнів інтерферону, достатніх для індукування такої реакції у клітини, що реагує на інтерферон. Клітина, що не реагує на інтерферон, може мати дефект внутрішньоклітинного шляху або шляхів передачі сигналу, які, за нормальних умов, активуються у реагуючих клітин. Як правило, чутливість до інфікування VSV вказує на відсутність реагування на інтерферон, і досвідчений фахівець може легко визначити, що конкретна клітина не реагує на інтерферон за її здатністю (або відсутністю такої здатності) пригнічувати інфікування VSV у присутності інтерферона або із застосуванням інших маркерів активності інтерферону, відомих у цій галузі, наприклад, рівня експресії IFNстимульованих генів, наприклад, PKR, STAT, OAS, MX. Термін "реплікаційнокомпетентний", що застосовується у цьому описі, означає вірус, здатний до інфікування і реплікації у межах конкретної клітини-хазяїна. Термін "клітина", що застосовується у цьому описі, означає одну клітину, а також множину або популяцію клітин. Введення засобу до клітини означає введення як in vitro, так і in vivo. Термін "ефективна кількість", що застосовується у цьому описі, означає кількість, ефективну у дозах та впродовж необхідних періодів часу, для досягнення бажаного результату. Термін "тварина", що застосовується у цьому описі, означає усіх членів царства тварин, у тому числі людей. Термін "пригнічення" клітини, що має недостатню вроджену противірусну реакцію, означає загибель клітини унаслідок лізису або апоптозу чи інших механізмів загибелі клітини, окрім позбавлення клітини здатності до росту або поділу. Вірусом міксоми може бути будь-який вірус, що належить до виду Leporipoxvirus поксвірусів, що є реплікаційнокомпетентним. Вірусом міксоми може бути штам вірусу міксоми дикого типу або це може бути генетично модифікований штам вірусу міксоми. Геном вірусу міксоми може бути легко модифікованим для експресії одного або декількох терапевтичних трансгенів із застосуванням стандартних методів молекулярної біології, відомих досвідченому фахівцю і описаних, наприклад, у довіднику Сембрук (Sambrook) та інші ((2001) Molecular Cloning: a Laboratory Manual, 3rd ed., Cold Spring Harbour Laboratory Press). Досвідчений фахівець може легко визначити, які частини геному вірусу міксоми можуть бути видалені таким чином, щоб вірус все ще залишався здатним до продуктивного інфікування. Наприклад, несуттєві ділянки вірусного геному, які можуть бути видалені, можуть бути визначені шляхом порівняння опублікованої послідовності вірусного геному з геномами інших добре вивчених вірусів (дивись, наприклад, К. Камерон (С. Cameron), С. Хота-Мітчелл (S. Hota-Mitchell), Л. Чен (L. Chen), Дж. Барретт (J. Barrett), Дж.Кс. Kao (J.-X. Сао), К. 15 Маколей (С. Macaulay), Д. Уіллер (D. Wilier), Д. Еванс (D. Evans), Г. Макфадден (G. McFadden), Virology 1999, 264:298-318). Термін "терапевтичний ген" або "терапевтичні трансгени", що застосовується у цьому описі, означає, у широкому значенні, будь-який ген, експресія якого забезпечує одержання бажаного результату, наприклад, протиракового ефекту. Наприклад, вірус може бути модифікований для перенесення гену, що підсилить протираковий ефект лікування вірусом. Таким геном може бути ген, що є залученим до запуску механізму апоптозу або є залученим до цілеспрямованої доставки до інфікованої клітини для імунного руйнування, наприклад, ген, що відновлює відсутність реакції на інтерферон або який забезпечує експресію мембранного маркера клітини, що стимулює гуморальну імунну відповідь, наприклад, мембранний антиген бактеріальної клітини. Вірус може також бути модифікованим для експресії генів, залучених до припинення проліферації та росту неопластичних або ракових клітин, із перешкоджанням, тим самим, поділу клітин. Вірус може також модифікуватись таким чином, щоб включати терапевтичні гени, наприклад, гени, залучені до синтезу хіміотерапевтичних речовин або він може модифікуватись таким чином, щоб мати підвищені рівні реплікації у клітинах конкретних видів, з яких одержують клітини для пригнічення або убивання, наприклад, людських клітинах. Конкретними прикладами генів, які можуть бути введені до вірусу міксоми дляпідвищення його протиракового ефекту, є людський ген білка TRAK або ген аденовірусу, що кодує поліпептид Е4 orf4, причому обидва згадані білки є залучені до убивання людських ракових клітин. Буде зрозуміло, що терапевтичний ефект вірусу міксоми може досягатись лізисом клітин згаданим вірусом або доставкою терапевтичних продуктів. Вірус можна одержати за допомогою стандартних методів, відомих у цій галузі. Вірус, наприклад, можна одержати шляхом інфікування культивованих клітин кролика штамом вірусу міксоми, призначеним для застосування, з подальшим забезпеченням можливості прогресування інфекції таким чином, щоб вірус розмножувався у культивованих клітинах і міг бути виділеним за допомогою стандартних методів, відомих у цій галузі, шляхом руйнування клітинної мембрани і, тим самим, виділення вірусних частинок для збирання. Після збирання, титр вірусу може визначатись шляхом інфікування конфлюентного газону кролячих клітин і здійснення аналізу бляшкоутворення (дивись Моссман (Mossman) та інші (1996) Virology 215:17-30). За одним із варіантів здійснення винаходу, пропонується спосіб лікування хворобливого стану, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію, у хворого, що потребує такого лікування, що включає введення згаданому хворому ефективної кількості вірусу міксоми. Згаданим хворим може бути будь-яка тварина, у тому числі ссавець, у тому числі людина. 87266 16 Словосполучення "хворобливий стан, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію", що застосовується у цьому описі, означає будь-яке захворювання, розлад або стан, що асоціюється з, відноситься до або характерним для якого є присутність клітин, що мають недостатню вроджену противірусну реакцію, і згадані захворювання, розлад, стан або їхні симптоми можуть лікуватись шляхом убивання цих клітин. Хворобливим станом може бути, наприклад, рак. Хворобливий стан може також включати хронічну вірусну інфекцію Лікування" хворобливого стану означає підхід для одержання благотворних або бажаних результатів, у тому числі клінічних результатів. Благотворними або бажаними клінічними результатами можуть бути, але ними не обмежуватись, полегшення або поліпшення одного або декількох симптомів або станів, зменшення обсягу захворювання, стабілізація стану захворювання, запобігання розвитку захворювання, запобігання поширенню захворювання, припинення або уповільнення прогресування захворювання, припинення або уповільнення початку захворювання, поліпшення або полегшення хворобливого стану і ремісія (часткова або повна), що виявляється або виявленню не піддається. "Лікування" може також означати продовження виживання хворого за межі періоду часу, очікуваного за відсутності лікування. "Лікування" може також означати пригнічення прогресування захворювання, тимчасове уповільнення прогресування захворювання, хоча за варіантом, якому віддають більшу перевагу, цей термін включає постійне припинення прогресування захворювання. Як буде зрозуміло досвідченому фахівцю, результати можуть не бути благотворними або бажаними, якщо, з поліпшенням конкретного хворобливого стану, наслідком лікування будуть негативні ефекти для хворого, що піддається лікуванню, які переважають будьякі благотворні ефекти, забезпечені лікуванням. За одним із варіантів здійснення винаходу, хворобливим станом є рак. Згаданим раком може бути рак будь-якого типу, де щонайменше деякі клітини, хоча не обов'язково усі клітини, мають недостатню вроджену противірусну реакцію. За одним із варіантів здійснення винаходу, згаданим раком може бути рак, де щонайменше деякі клітини не реагують на інтерферон. Терміни "пухлина", "злоякісні клітини", "рак" і "ракові клітини" (що застосовуються взаємозамінно) означають клітини, що демонструють патологічний ріст, відрізняються значною втратою контролю над проліферацією клітин або клітини, що були іморталізовані. Термін "рак" або "пухлина" включає метастатичний, а також неметастатичний рак або пухлини. Термін "неопластичний" або "новоутворення", що застосовується у цьому описі, у широкому значенні означає клітину або клітини, що проліферують без нормальних механізмів пригнічення росту і, таким чином, включає доброякісні пухлини, окрім раку, а також диспластичні або гіперпластичні клітини. 17 Рак може діагностуватись за загальноприйнятими у цій галузі критеріями, у тому числі за присутністю злоякісної пухлини. До типів раку, що можуть лікуватись за цим винаходом, належать, але ними не обмежуються, раки гемопоетичних клітин, у тому числі лейкемії та лімфоми, рак товстої кишки, рак легень, рак нирок, рак підшлункової залози, рак ендометрія, рак щитовидної залози, рак ротової порожнини, рак яєчника, рак гортані, гепатоцелюлярний рак, рак жовчних протоків, плоскоклітинна карцинома, рак передміхурової залози, рак молочної залози, рак шийки матки, рак анастомозу ободової та прямої кишок, меланоми і будь-які інші пухлини. До солідних пухлин, наприклад, сарком і карцином, належать, але ними не обмежуються, фібросаркома, міксосаркома, ліпосаркома, хондросаркома, остеогенна саркома та інші саркоми, синовіома, мезотеліома, омобластома, лейоміосаркома, рабдоміосаркома, рак товстої кишки, лімфолейкоз, рак підшлункової залози, рак молочної залози, рак легень, рак яєчника, рак передміхурової залози, злоякісна гепатома, плоскоклітинна карцинома, базально-клітинний рак, аденокарцинома, рак потових залоз, рак сальних залоз, папілокарцинома, папілярна аденокарцинома, медулярний рак, бронхогенний рак, рак нирок, гепатома, рак жовчних протоків, хоріокарцинома, пухлина Вільмса, рак шийки матки, тестикулярний рак, карцинома сечового міхура і пухлини центральної нервової системи (наприклад, гліома, астроцитома, медулобластома, краніофарингіома, епендимома, пінеалома, гемангіобластома, акустична неврінома, олігодендрогліома, менангіома, меланома, нейробластома і ретинобластома). За іншим варіантом здійснення винаходу, хворобливим станом є хронічна вірусна інфекція. Хронічно інфікуючим вірусом може бути будьякий вірус, що інфікує або розмножується у клітинах тварини персистентним чином впродовж тривалого періоду часу з спричиненням патологічного стану. Хронічно інфікуючим вірусом може бути вірус, що асоціюється або взаємозв'язується з розвитком раку. Хронічна інфекція вірусом може діагностуватись за допомогою стандартних методів, відомих у цій галузі. Наприклад, хронічна вірусна інфекція може бути виявлена за присутністю противірусних антитіл у хворого або позитивним результатом перевірки на присутність вірусної РНК або ДНК у клітинах хворого. Вірус може бути введений хворому за допомогою стандартних методів введення. За одним із варіантів здійснення винаходу, вірус вводять системно. За іншим варіантом здійснення винаходу, вірус вводять шляхом ін'єкції у хворобливу ділянку. За конкретним варіантом здійснення винаходу, хворобливим станом є солідна пухлина і вірус вводять шляхом ін'єкції у ділянку пухлини. За різними варіантами здійснення винаходу, вірус можуть вводити перорально або парентерально, або за будь-яким стандартним методом, відомим у цій галузі. 87266 18 У разі введення хворому, ефективною кількістю вірусу є кількість, необхідна у дозах і впродовж достатнього часового періоду, для полегшення, поліпшення, заспокоєння, пом'якшення, стабілізування, запобігання поширенню, уповільнення або припинення розвитку або лікування захворювання. Наприклад, це може бути кількість, достатня для досягнення ефекту зменшення кількості або знищення ракових клітин або неопластичних клітин, або зменшення кількості чи знищення клітин, хронічно інфікованих вірусом, або пригнічення росту та/або проліферації таких клітин. Ефективна кількість, призначена для введення хворому, може змінюватись у залежності від багатьох факторів, наприклад, фармакодинамічних властивостей вірусу, способу введення, віку, стану здоров'я та ваги хворого, природи та поширення хворобливого стану, частоти лікування і типу сумісного лікування, у разі його проведення, вірулентності та титру вірусу. Фахівець у цій галузі може визначити відповідну кількість, виходячи з вищезгаданих факторів. Вірус початково може вводитись у відповідній кількості, що може регулюватись за потребою у залежності від клінічної реакції пацієнта. Ефективна кількість вірусу може бути визначена емпіричним шляхом і залежати від максимальної кількості вірусу, що може вводитись безпечно, а також мінімальної кількості вірусу, що дає бажаний результат. Для одержання такого самого клінічного ефекту у разі введення вірусу системним шляхом, як і той, що досягається у разі ін'єкції вірусу у хворобливу ділянку, може знадобитися введення значно більших кількостей вірусу. Однак відповідним рівнем дози повинна бути мінімальна кількість, що забезпечила б досягнення бажаного результату. Концентрація вірусу, призначеного для введення, буде змінюватись у залежності від вірулентності конкретного штаму вірусу міксоми, що повинен вводитись, а також від природи клітин, до яких він спрямовується. За одним із варіантів здійснення винаходу, хворому-людині вводять дозу меншу за приблизно 109 бляшкотвірних одиниць ("pfu"). За різними варіантами здійснення цього винаходу, одноразовою дозою може вводитись від приблизно 102 pfu до приблизно 109 pfu, від приблизно 102 pfu до приблизно 107 pfu, від приблизно 103 pfu до приблизно 106 pfu або від приблизно 104 pfu до приблизно 105 pfu. Ефективні кількості вірусу можуть вводитись повторно, у залежності від ефекту початкової схеми лікування. Введення, як правило, здійснюють періодично з моніторингом будь-якої реакції. Досвідченому фахівцю буде зрозуміло, що відповідно до обраних схем та шляхів, можуть вводитись менші або більші дози, аніж зазначені вище. Вірус може вводитись самостійно або у поєднанні з проведенням інших терапевтичних заходів, у тому числі хіміотерапії, променевої терапії або інших противірусних терапевтичних заходів. Наприклад, вірус може вводитись перед або після хірургічного видалення первинної пухлини або 19 перед, одночасно чи після лікування, наприклад, проведення радіотерапії або введення традиційних хіміотерапевтичних лікарських засобів. За одним із варіантів здійснення винаходу, вірус може вводитись у поєднанні з або послідовно з іншими онколітичними вірусами, що можуть демонструвати специфічність до ракових клітин різних типів. Для полегшення введення, вірус може включатись як інгредієнт до фармацевтичної композиції. Таким чином, за додатковим варіантом здійснення винаходу, пропонується фармацевтична композиція, до складу якої входять вірус міксоми і фармацевтично прийнятний розріджувач. Цей винахід, таким чином, за одним зі своїх аспектів, пропонує також такі фармацевтичні композиції для застосування з метою пригнічення клітини, що має недостатню вроджену противірусну реакцію, або лікування хворобливого стану, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію. До складу згаданих композицій можуть, як правило, входити сіль, буферні речовини, консерванти і різні сумісні носії у фармацевтично прийнятних концентраціях. Для усіх форм доставки рекомбінантний вірус може вводитись до фізіологічного розчину. Фармацевтичні композиції можуть додатково містити інші терапевтичні засоби, наприклад, протиракові засоби. За одним із варіантів здійснення винаходу, композиції включають хіміотерапевтичний засіб. Хіміотерапевтичним засобом, наприклад, може бути по суті будь-який засіб, що демонструє онколітичний ефект проти ракових клітин або неопластичних клітин хворого і який не пригнічує або не зменшує онколітичного ефекту вірусу. Хіміотерапевтичним засобом може бути, наприклад, без обмеження, антрациклін, алкілувальний агент, алкілсульфонат, азирідин, етиленімін, метилмеламін, азотистий іприт, нітрозосечовина, антибіотик, антиметаболіт, аналог фолієвої кислоти, аналог пурину, аналог піримідину, фермент, подофілотоксин, платиновмісний засіб або цитокін. За варіантом, якому віддають перевагу, хіміотерапевтичним засобом може бути засіб, який, як відомо, є ефективним проти клітини конкретного типу, що є раковою або неопластичною. Пропорція і природа фармацевтично прийнятного розріджувача визначається обраним шляхом введення, сумісністю з живим вірусом і стандартною фармацевтичною практикою. Взагалі, до складу фармацевтичної композиції будуть входити компоненти, які не будуть суттєво погіршувати біологічних властивостей живого вірусу. Фармацевтична композиція може одержуватись за відомими методами одержання фармацевтично прийнятних композицій, придатних для введення хворим, таким чином, що ефективна кількість активної речовини об'єднується у суміші з фармацевтично прийнятним носієм. Придатні носії описуються, наприклад, у довіднику Remington's Pharmaceutical Sciences (Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., USA 1985). Ha цій основі композиції включають, але без обмежень, розчи 87266 20 ни вірусу у поєднанні з одним або декількома фармацевтично прийнятними носіями або розріджувачами і містяться у буферних розчинах, що мають відповідний рН і є ізоосмотичними з фізіологічними рідинами. Фармацевтична композиція може вводитись хворому у різноманітних формах у залежності від обраного шляху введення, що буде зрозумілим для фахівців у цій галузі. Композиція за цим винаходом може вводитись пероральним або парентеральним шляхами. Парентеральне введення включає внутрішньовенний, внутрішньоочеревинний, підшкірний, внутрішньом'язовий, черезшкірний, інтраназальний, внутрішньолегеневий, підоболонковий, ректальний і місцевий шляхи введення. Парентеральне введення може здійснюватись шляхом безперервного вливання впродовж обраного періоду часу. Фармацевтична композиція може вводитись перорально, наприклад, з інертним розріджувачем або із засвоюваним носієм, або вона може вміщуватись до твердих або м'яких желатинових капсул, або може пресуватись у таблетки. Для перорального терапевтичного введення, вірус може об'єднуватись із наповнювачем і застосовуватись у формі таблеток для приймання усередину, защічних таблеток, пастилок, капсул, еліксирів, суспензій, сиропів, облаток тощо. Розчини вірусу можуть одержуватись у фізіологічно прийнятному буфері. За звичайних умов зберігання та застосування, ці препарати включають консервант для запобігання росту мікроорганізмів, однак це не буде інактивувати живий вірус. Досвідченому фахівцю у цій галузі відомо, яким чином одержувати придатні композиції. Традиційні методи і інгредієнти для вибору та одержання відповідних композицій описуються, наприклад у довіднику Remington's Pharmaceutical Sciences та у Фармакопеї США: Книга рецептурних формул, що випускається Американською фармацевтичною асоціацією (USP 24 NF19), опублікованій у 1999 році. За різними варіантами здійснення винаходу, композиція вводиться шляхом ін'єкції (підшкірно, внутрішньовенно, внутрішньом'язово тощо) безпосередньо до хворобливої ділянки, наприклад, ділянки пухлини, або шляхом перорального введення, за альтернативним варіантом, шляхом черезшкірного введення. Формами фармацевтичної композиції, придатними для ін'єкції, є стерильні водні розчини або дисперсія і стерильні порошки для одержання стерильних розчинів або дисперсій для ін'єкції, що готуються для негайного застосування, де термін стерильний не розповсюджується на сам живий вірус міксоми, що підлягає введенню. В усіх випадках, лікарська форма повинна бути стерильною і повинна бути рідкою до такої міри, що забезпечувала б легке введення за допомогою шприца. Доза фармацевтичної композиції, що повинна застосовуватись, залежить від конкретного стану, який піддають лікуванню, тяжкості стану, індивідуальних параметрів хворого, що включають вік, фізичний стан, розміри і масу, тривалість 21 лікування, природу сумісного лікування (у разі проведення), конкретний шлях введення та інші подібні фактори, які знаходяться у межах обсягу знань та досвіду практикуючого лікаря. Ці фактори є відомими фахівцям у цій галузі, і до них можна звертатись з мінімальним звичайним експериментуванням. Вірус міксоми або фармацевтичні композиції, що містять вірус міксоми, можуть також пакуватись як набір, що включає інструкції із застосування вірусу, у тому числі застосування вірусу міксоми для пригнічення клітини, що має недостатню вроджену противірусну реакцію, або застосування вірусу міксоми для лікування хворобливого стану, що відрізняється присутністю клітини, що має недостатню вроджену противірусну реакцію у хворого, який цього потребує. Хворобливим станом може бути рак, або це може бути хронічна вірусна інфекція. Цим винаходом передбачається також застосування вірусу міксоми для пригнічення клітини, що має недостатню вроджену противірусну реакцію. За одним із варіантів здійснення винаходу, згадана клітина не реагує на інтерферон. Додатково пропонується застосування вірусу міксоми для лікування хворобливого стану, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію, у хворого, який цього потребує. За одним із варіантів здійснення винаходу, хворобливим станом є рак. Пропонується також застосування вірусу міксоми для виготовлення лікарського засобу для пригнічення клітини, що має недостатню вроджену противірусну реакцію, або для лікування хворобливого стану, що відрізняється присутністю клітин, що мають недостатню вроджену противірусну реакцію, у хворого, який цього потребує. Здатність MV до селективного інфікування клітин, що мають недостатню вроджену противірусну реакцію, у тварин, окрім його природного хазяїна, надає можливість застосування MV для виявлення клітин у тварини, що мають недостатню вроджену противірусну реакцію, у тому числі клітин, що не реагують на інтерферон. Такі клітини, в противному разі, на превелику силу піддаються виявленню, наприклад, певні ракові клітини, які ще не досягли стадії пухлини, що піддається пальпуванню, або ще не викликали помітних симптомів у тварини. Таким чином, за одним із варіантів здійснення винаходу, пропонується спосіб виявлення у хворого клітин, що мають недостатню вроджену противірусну реакцію, що включає введення хворому вірусу міксоми, модифікованого таким чином, що він експресує виявлений маркер; надання можливості вірусу інфікувати у хворого клітину, що має недостатню вроджену противірусну реакцію; і виявлення у хворого клітини, яка експресує виявлений маркер. Інфіковані клітини можуть виявлятись за допомогою будь-якого традиційного методу візуалізації діагностичних зображень. Метод виявлення буде залежати від конкретного застосованого маркера, що піддається виявленню. Наприклад, клітини, інфіковані вірусом міксоми, генетично 87266 22 модифікованим для експресії флуоресцентного білка, можуть виявлятись за допомогою флуоресцентної мікроскопії з цифровим зображенням. Іншими методами є комп'ютерна томографія (СТ), повне сканування тіла, наприклад, позитронна емісійна томографія (PET), ЯМРтомографія (MRI) і ультразвукова ехографія. Досвідчені фахівці зможуть визначити відповідний метод для виявлення конкретного маркеру, що піддається виявленню. Маркером, що піддається виявленню, є (але ним не обмежується) будь-який маркер, гени для експресії або синтезу якого можуть вводитись у геном вірусу міксоми таким чином, щоб забезпечувалась експресія або синтез згаданого маркера у межах клітин, які є інфіковані модифікованим вірусом. Наприклад, за одним із варіантів здійснення винаходу, маркером, що піддається виявленню, може бути флуоресцентний білок. Інфіковані клітини можуть виявлятись через відповідний проміжок часу після введення хворому модифікованого вірусу для того, щоб надати вірусу можливість інфікувати будь-які клітини, що мають недостатню вроджену противірусну реакцію, та експресувати виявлений маркер, в таких клітинах на рівнях, які б надавали можливість виявлення. Виявлення, наприклад, може відбуватись у межах приблизно 2-20 днів після введення хворому вірусу, генетично модифікованого для експресії флуоресцентного білка. Метод виявлення може повторно бути застосований до хворого через проміжки часу для моніторингу у цього хворого присутності клітин, що мають недостатню вроджену противірусну реакцію. Наприклад, метод виявлення таких клітин із використанням вірусу міксоми може бути застосований до хворого з проміжками у 6 міс, 1 рік або 2 роки, за потребою, у залежності від природи клітин, що мають недостатню вроджену противірусну реакцію, і природи будь-якого хворобливого стану, що є наслідком присутності таких клітин у хворого. Повторне застосування згаданого методу через певний період часу надає можливість моніторингу розвитку або ремісії хворобливого стану або поширення хвороби у межах організму хворого. Вірус міксоми є здатним до селективного інфікування клітин, що мають недостатню вроджену противірусну реакцію, і може застосовуватись як індикатор такої недостатності у клітин. Так, клітини, видалені у пацієнта, можуть перевірятись на недостатню вроджену противірусну реакцію із застосуванням методів за цим винаходом. Таке визначення може вказати, у разі поєднання з іншими індикаторами, що хворий може страждати на конкретний хворобливий стан, наприклад, рак. Таким чином, за одним із варіантів здійснення винаходу, пропонується спосіб виявлення у зразку клітини, що має недостатню вроджену противірусну реакцію, який включає культивування клітин, піддання культивованих клітин дії вірусу міксоми і визначення інфективності клітин вірусом міксоми. 23 Клітини можуть видалятись з суб'єкта, у тому числі людини, за допомогою відомих методів біопсії. Метод біопсії буде залежати від знаходження та типу клітини, яка повинна піддаватись випробуванню. Клітини культивуються за відомими методами культивування і піддаються дії MV шляхом додання живого вірусу до культурального середовища. Множинність зараження ("МОІ") може змінюватись для визначення оптимальної МОІ для клітин даного типу, густини та методу культивування із застосуванням позитивної контрольної культури клітин, яка, як відомо, інфікується у разі піддання дії MV. Інфективність культивованих клітин MV може визначатись різними методами, відомими досвідченому фахівцю, у тому числі за здатністю MV викликати некроз клітин. Сюди може долучатись також додання реактивів до культури клітин для завершення ферментативної або хімічної реакції з продуктом вірусної експресії. Продукт вірусної експресії може експресуватись репортерним геном, який був введений до геному MV. За одним із варіантів здійснення винаходу, MV може модифікуватись для підвищення легкості виявлення стану інфікованості. Наприклад, MV може генетично модифікуватись для експресії маркера, який може легко виявлятись фазовоконтрастною мікроскопією, флуоресцентною мікроскопією або сцинтиграфією. Згаданим маркером може бути експресований флуоресцентний білок або експресований фермент, який може бути залученим до колориметричної реакції або реакції з радіоізотопною міткою. За іншим варіантом здійснення винаходу, згаданим маркером може бути генний продукт, який руйнує або пригнічує конкретну функцію клітин, що піддаються випробуванню. Усі посилання, згадані у цьому описі, включаються до нього у повному обсязі шляхом посилання. Приклади Вірусні штами Були застосовані такі вірусні штами: штам MV дикого типу, MV, модифікований для експресії білка з флуоресценцією зеленого кольору ("GFP") або β-галактозидази ("LacZ") і убитий ("інактивований") MV. Вірус одержували і титрували із застосуванням стандартних методів. Клітинні штами Експерименти на мишах здійснювали із застосуванням фібробластів мишачих зародків ("MEFs"), які одержали від мишей лінії дикого типу, а також наведених нижче мишачих препаратів, одержаних шляхом блокування: гомозиготне блокування рецепторів IFNa/β; гомозиготне блокування STAT1; гетерозиготне блокування PKR; гетерозиготне блокування РНКази-L; гетерозиготне блокування Мх1; потрійне гомозиготне блокування PKR/PHKази-L/Mx1. Експерименти з людськими препаратами здійснювали на контрольній лінії клітин BGMK та лініях людських ракових клітин НТ29, НОР92, OVCAR4, OVCAR5, SK-MEL3, SK-MEL28, М14, SKOV3, РС3, DU145, САКІ-1, 786-0, T47D, 87266 24 MDAMB 435, SF04, U87, А172, U373, Daoy та D384, як описано у Стойдл (Stojdl) та інші, Cancer Cell (2003) 4:263-275. Методи Взагалі, аналізи та експерименти здійснювали, як описано у Лалані (Lalani) та інші, Virology (1999) 256:233-245 та Джонстон (Johnston) та інші, J. Virology (2003) 77(13):7682-7688. Для проведення досліджень на мишах in vivo, "голим" мишам інтракраніально імплантували людські гліоми U87. Через 15 днів після імплантування мишам внутрішньопухлинно вводили GFP живого або інактивованого MV (титр 5´106) або здійснювали псевдоінфікування. Через 72год після інфікування тварин забивали, видаляли головний мозок, заливали ОСТ (сполука для одержання зрізів при оптимальній температурі) і заморожені зрізи використовували для одержання гістологічних препаратів. GFP вірусу міксоми візуалізували на гістологічних зрізах головного мозку засобами флуоресцентної мікроскопії. Для візуалізації пухлини зрізи фіксували і забарвлювали Н&Е (гематоксилін/еозин). Для дослідження людських ракових пухлин, пухлини піддавали трипсинізації, висівали негайно після хірургічного видалення і наступного дня інфікували з МОІ 0,1, 1,0 або 10. Через 24год і 48год після інфікування засобами фазовоконтрастної та флуоресцентної мікроскопії збирали дані щодо цитотоксичності та вірусної експресії. Через 48год, 72год або 96год після інфікування здійснювали аналіз із застосуванням жовтої солі тетразолію МТТ для кількісного визначення відсотка виживаності клітин (як відсоток клітин, що вижили після псевдоінфікування). Лінії клітин дитячої медулобластоми, Daoy і D384, інфікували GFP вірусу міксоми з МОІ 10. Через 72год після інфікування життєздатність клітин визначали із застосуванням МТТ. Інфікування ліній мишачих клітин Попереднє дослідження показало, що деякі клони мишачих клітин ЗТЗ, трансфіковані хемокінними рецепторами, інфікувались вірусом міксоми, у той час як з іншими клонами подібного не відбувалось. Для дослідження того, чи залежить тропізм вірусу міксоми у інших мишачих клітин від будь-яких конкретних рецепторів, ми піддали дослідженням первинні фібробласти мишачих зародків (MEFs) від мишей дикого типу (WT) з блокуванням різних генів. Оскільки фібробласти мишачих зародків (IFNs) відіграють ключову роль у підтримці противірусних реакцій, ми висунули гіпотезу про те, що рестриктивний фенотип пов'язувався з "противірусним станом", опосередкованим інтерфероном (IFN). Руйнування ланцюга IFN реакцій системи, нейтралізація циркулюючих IFN антитілами або одержання мишей, позбавлених рецепторів IFN чи мишей з видаленими генами на внутрішньоклітинному шляху передачі сигналу, тяжко пошкоджує стійкість хазяїна до вірусу міксоми, який, як правило, не інфікує нормальні мишачі клітини. Для перевірки цієї гіпотези нам було необхідно продемонструвати, що неінфективність вірусу 25 міксоми для непермісивних клітин обумовлювалась противірусною дією інтерферонів. Клітини MEF різного типу з блокуванням одного або декількох білків, залучених до внутрішньоклітинної реакції з передачі сигналу IFN, перевіряли на ефект інфекції MV на шляху IFN. Експерименти, здійснені з первинними MEFs, показали, що MEFs дикого типу ("WT") не інфікуються вірусом міксоми. MEFS повністю інфікуються вірусом міксоми у тому разі, коли шлях IFN блокується нейтралізацією антитіл до IFNa/β (Фіг.2). Однак MEFs, піддані дії антитіл, що нейтралізують IFNg, залишались непермісивними. Це висвітлило важливість IFNa/β, але не IFNg, для створення пермісивного середовища для інфікування MEFs вірусом міксоми in vitro. В літературних джерелах визначені різні внутрішньоклітинні шляхи передачі сигналу IFNa/β та IFNg. Ймовірно, однак, що як IFNa/β, так і IFNg відіграють важливу роль у інфікованих хазяїв, на відміну від культивованих фібробластів. Ми передбачаємо, що людські пухлини, дефіцитні за шляхом IFNa/β та/або IFNg, будуть сприйнятливими до інфікування вірусом міксоми in vivo. Ми досліджували активність STAT1 і STAT2 у непермісивних WT MEFs, інфікованих MV. Результати, наведені на Фіг.3, свідчать про активацію STAT1 і STAT2. Додаткове дослідження показало, що STAT3, STAT4 і STAT5 не активуються (Фіг.4). Для підтвердження важливості внутрішньоклітинного шляху IFNa/β для підтримки непермісивного стану MEFs були здійснені дослідження з генетичної делеції для введення пошкоджень до рецепторів IFNa/β та до внутрішньоклітинного каскаду реакцій. Була здійснена генетична делеція рецепторів IFN, JAK1 або STAT1. MV застосовували для інфікування WT MEFs, IFNa/β R-/MEFs і STAT1 -/- MEFs. IFNa/β R-/- MEFs i STAT1 -/-MEFs були пермісивними до MV, що було свідченням того, що каскади реакцій передачі сигналів IFNa/β та STAT1 є критичними для інфікування MV (Фіг.5). Протеїнкіназа R (PKR) є ферментом, що індукується IFNa/β у найрізноманітніших клітинах. Ця кіназа, у присутності дволанцюгової РНК, піддається автофосфорилуванню, після чого фосфорилує декілька клітинних білків, у тому числі фактор ініціації синтезу еукаріотного білка (eIF-2a), фосфорилування якого може індукувати пригнічення трансляції білків та апоптоз. PKR також приймає участь у активації РНКази-L. Ми дослідили активацію PKR у непермісивних MEFs після інфікування MV. PKR не фосфорилується у непермісивних MEFs, противірусний стан яких є добре визначеним (Фіг.6). Більше того, інфікування MV пригнічує фосфорилування PKR (Фіг.7). На додаток до цього, PERK (PKR-подібна ER-кіназа) не фосфорилується у первинних WT MEFs після інфікування вірусом міксоми (Фіг.8). MV застосовували для інфікування MEFs з блокуванням одиночних генів PKR, РНКази-L або Мх1 (Фіг.9). Було встановлено, що PKR, РНКаза-L і Мх1 є несуттєвими для підтримки непермісивно 87266 26 сті для інфікування вірусом міксоми. Для додаткового підтвердження несуттєвої ролі PKR, РНКази-L та Mx1, було здійснено потрійне блокування PKR-/-, РНКази-L-/- та Мх1-/- у MEFs. Потрійне блокування PKR-/-, РНКази-L-/- і Мх1-/- не підтримує інфікування вірусом міксоми (Фіг.10), хоча MEFs із потрійним блокуванням PKR, РНКази-L і Мх1, оброблені антитілом, нейтралізуючим IFNa/β, стають пермісивними до інфікування вірусом міксоми (порівняй Фіг.10 і Фіг.11). Ці експерименти показують, що PKR, РНКаза-L і Мх1 не відіграють суттєвої ролі при опосередковуванні непермісивності MEFs для MV. Були здійснені додаткові дослідження для перевірки активації eIF-2a і PKR у непермісивних MEFs дикого типу і пермісивних IFNa/β R-/- MEFs та STAT1-/- MEFs після інфікування MV. Після інфікування MV, eIF-2a фосфорилується у непермісивних і пермісивних MEFs, у той час як PKR у жодному разі не фосфорилується (Фіг.12). Це демонструє, що без залучення PKR і PERK, противірусний стан опосередковується іншим шляхом, який спричинює фосфорилування eIF-2a. [00132] STAT1 у непермісивних MEFs, які були піддані потрійному блокуванню PKR, РНКази-L і Мх 1, після інфікування вірусом міксоми піддається фосфоритуванню як серину, так і тирозину (Фіг.13). Показана також субклітинна локалізація тирозин-фосфорилованого STAT1 у непермісивних PKR-/-+PHKa3a-L-/-+Mxl-/- MEFs після інфікування вірусом міксоми (Фіг.14). Підсумовуючи, ці результати показують, що критичним для поксвірусного тропізму є паралельний PKR/PERK-незалежний противірусний шлях, що залучає IFN/STAT1. Більше того, фосфорилування eIF-2a є найкращим маркером противірусної дії IFN. Дослідження людських пухлин Ми досліджували здатність MV до інфікування людських ракових клітин у системі in vivo. "Голим" мишам ін'єкційним шляхом вводили клітини людської гліоми з подальшим розвитком інтракраніальних гліом. Живий вірус був здатним інфікувати ці людські ракові клітини, але не інфікував навколишні клітини (Фіг.15). Локалізація флуоресцентного сигналу GFP у пухлині зображена на Фіг.16. Приймаючи до уваги, що багато людських пухлин не реагують на інтерферон, і що ракові клітини не мають нормальних послідовностей реакцій з передачі сигналу IFN, порівняно з тими, що знаходяться у нормальних людських клітин, були проведені дослідження з вивчення ефекту вірусу міксоми на людські пухлини. Результати узагальнені нижче. Початково, для дослідження інфективності та цитолітичних ефектів на різні контрольні та людські лінії ракових пухлин (BGMK, HT29, НОР92, OVCAR4, SK-MEL3 і SK-MEL28) застосовували вірус міксоми. MV демонстрував різні ступені інфективності та цитолітичні результати: НТ29 (Фіг.17), НОР92 (Фіг.18), OVCAR4 (Фіг.19), SKMEL3 (Фіг.20), SK-MEL28 (Фіг.21) і BGMK (Фіг.22). Випробуванням були піддані додаткові ракові клітини, і у наведеній нижче таблиці 1 класифіко 27 87266 вані пухлини різних типів, що випробовувались як непермісивні, пермісивні або напівпермісивні. Напівпермісивність означає, що вірус міксоми був 28 помірно інфекційним, порівняно з пермісивними лініями клітин. Таблиця 1 Трофіка вірусу міксоми для людських ракових клітин Клітина НТ29 НОР92 М14 SK-MEL3 SK-MEL28 OVCAR4 OVCAR5 SKOV3 РС3 DU145 САКІ-1 786-0 T47D MDAMB 435 Тип Товста кишка Легені Меланома Меланома Меланома Яєчник Яєчник Яєчник Передміхурова залоза Передміхурова залоза Нирки Нирки Молочна залоза Молочна залоза Непермісивна X Пермісивна Напівпермісивна X X X X X X X X X X X X X Різні лінії людських ракових клітин продемонстрували різну реактивність до інфікування зі зростаючими концентраціями MV-LacZ. Наприклад, клітини U373 потребували вищих титрів вірусу для досягнення рівнів убивання клітини, які у разі клітин U87 досягались з нижчими титрами вірусу (Фіг.23 і Фіг.24). Вірус міксоми ефективно інфікував клітини астроцитоми (Фіг.25) і клітини гліоми (Фіг.26). Вірус міксоми продемонстрував ефектив ність щодо убивання клітин людської астроцитоми і дитячої медулобластоми через 48год після інфікування (Фіг.27 і Фіг.28). Для фахівця у цій галузі є зрозумілою можливість внесення багатьох модифікацій до варіантів здійснення цього винаходу, опис яких наведено як приклади. Цим винаходом, як визначено формулою винаходу, передбачається охоплення усіх подібних модифікацій, що входять до його обсягу. 29 87266 30 31 87266 32 33 87266 34 35 87266 36 37 87266 38 39 87266 40 41 87266 42 43 87266 44 45 87266 46 47 87266 48 49 87266 50 51 87266 52 53 87266 54 55 87266 56 57 Комп’ютерна верстка Л. Литвиненко 87266 Підписне 58 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of myxoma virus for treating cancer
Автори англійськоюMcFadden Grant, Bell John K.
Назва патенту російськоюПрименение вируса миксомы для лечения рака
Автори російськоюМакфадден Грант, Белл Джон К.
МПК / Мітки
МПК: A61P 35/00, A61K 39/275
Мітки: лікування, застосування, міксоми, раку, вірусу
Код посилання
<a href="https://ua.patents.su/29-87266-zastosuvannya-virusu-miksomi-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Застосування вірусу міксоми для лікування раку</a>
Попередній патент: Спосіб одержання харчових гомогенних, твердих, вільних від розчинника гранул, що містять каротиноїди
Наступний патент: Спосіб виготовлення виробу з титанової металічної композиції, що містить дисперговані частинки бориду титану
Випадковий патент: Спосіб управління тепловим режимом доменної плавки