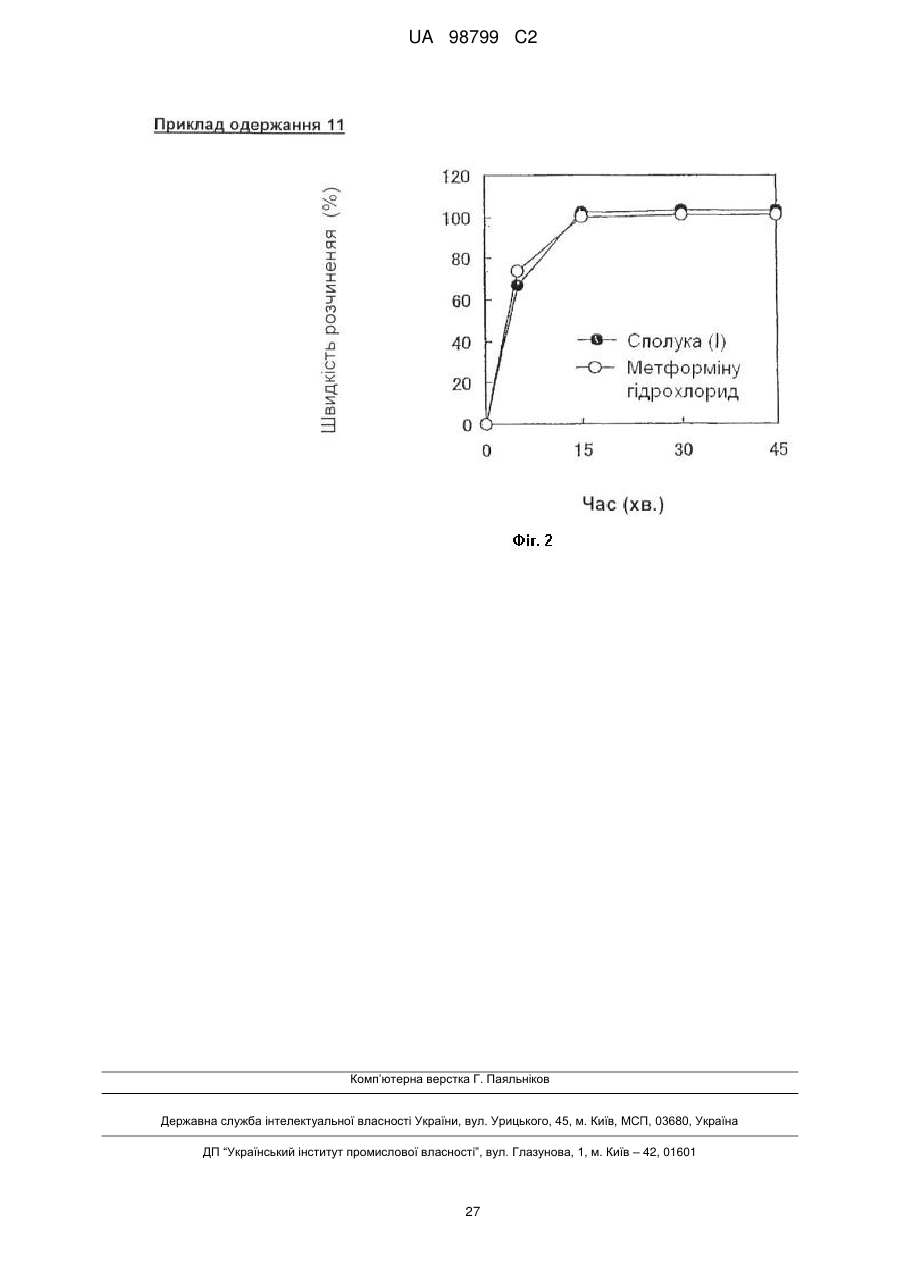
Твердий препарат, що включає алогліптин і гідрохлорид метформіну
Формула / Реферат
1. Твердий препарат, що містить наступну першу частину і другу частину;
перша частина: частина, що містить 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і до 3 мас. частин гідрохлориду метформіну, відносно 100 мас. частин першої частини;
друга частина: частина, що містить гідрохлорид метформіну і до 0,5 мас. частин 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі, відносно 100 мас. частин другої частини.
2. Твердий препарат за пунктом 1, що додатково включає добавку.
3. Твердий препарат за пунктом 2, що містить приблизно 0,5-200 мг 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі і приблизно 0,1-2 г гідрохлориду метформіну.
4. Твердий препарат за пунктом 2, що містить першу частину з найкоротшим діаметром не менше ніж приблизно 100 мкм в принаймні одній частині, і другу частину із найкоротшим діаметром не менше ніж приблизно 100 мкм в принаймні одній частині; або першу частину з середнім розміром частинок не менше ніж приблизно 75 мкм, і другу частину із середнім розміром частинок не менше ніж приблизно 75 мкм.
5. Твердий препарат за пунктом 2, в якому 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилом або його сіллю є бензоат 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу.
6. Твердий препарат за пунктом 2, що є таблеткою або який включає першу частину і другу частину, що є гранулами або таблетками, який є переважно капсулою, що містить згадану гранулу або згадану таблетку.
7. Твердий препарат за пунктом 2, де вагове співвідношення 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1 (2Н)-піримідиніл]метил]бензонітрилу або його солі, що міститься в першій частин, та гідрохлориду метформіну, що міститься у другій частині, становить 1:5-1:400.
8. Твердий препарат за пунктом 2, в якому добавкою є целюлоза.
9. Твердий препарат, одержаний компресійним формуванням суміші першої гранули і другої гранули:
перша гранула: гранула, що містить 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і до 3 мас. частин гідрохлориду метформіну, відносно 100 мас. частин першої гранули;
друга гранула: гранула, що містить гідрохлорид метформіну і до 0,5 мас. частин 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі, відносно 100 мас. частин другої гранули.
10. Твердий препарат за пунктом 9, в якому частина вмісту першої гранули з розміром частинок менше ніж 150 мкм, відносно загальної кількості першої гранули, становить не менше ніж приблизно 20 ваг. %, частина вмісту першої гранули з розміром частинок не менше ніж 250 мкм, відносно загальної кількості першої гранули, становить не більше ніж приблизно 50 ваг. %, частина вмісту другої гранули з розміром частинок менше ніж 150 мкм, відносно загальної кількості другої гранули, становить не менше ніж приблизно 20 ваг. %, і частина вмісту другої гранули з розміром частинок не менше ніж 250 мкм, відносно загальної кількості другої гранули, становить не більше ніж приблизно 50 ваг. %.
11. Твердий препарат за пунктом 10, в якому вагове співвідношення 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі, що міститься в першій гранулі, та гідрохлориду метформіну, що міститься у другій гранулі, становить 1:5-1:400.
12. Твердий препарат, що містить ядро і шар:
ядро: ядро, що містить гідрохлорид метформіну і до 0,5 мас. частин 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі, відносно 100 мас. частин всього ядра; і
шар: шар, що містить 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і до 3 мас. частин гідрохлориду метформіну, відносно 100 мас. частин всього шару; або
ядро: ядро, що містить 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і до 3 мас. частин гідрохлориду метформіну, відносно 100 мас. частин всього ядра; і
шар: шар, що містить гідрохлорид метформіну і до 0,5 мас. частин 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі, відносно 100 мас. частин всього шару.
13. Твердий препарат за пунктом 12, в якому проміжний шар утворений між згаданим ядром і згаданим шаром або в якому згаданий шар утворений розпиленням покриття, або в якому згаданий шар утворений пресуванням.
14. Твердий препарат, що містить наступні перший шар і другий шар:
перший шар: шар, що містить 2-[[6-[(3R)-3-aмiнo-1-піпepидинiл]-3,4-дигідpo-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і до 3 мас. частин гідрохлориду метформіну, відносно 100 мас. частин всього першого шару;
другий шар: шар, що містить гідрохлорид метформіну і до 0,5 мас. частин 2-[[6-[(3R)-3-aмінo-1-пiпepидиніл]-3,4-дигiдpo-3-мeтил-2,4-дioкco-1(2H)-піримідиніл]метил]бензонітрилу або його солі, відносно 100 мас. частин всього другого шару.
15. Твердий препарат за пунктом 14, що додатково включає проміжний шар між згаданим першим шаром і згаданим другим шаром.
16. Твердий препарат, що містить 2-[[6-[(3R)-3-aмінo-1-піпepидиніл]-3,4-дигідpo-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і гідрохлорид метформіну, де 2-[[6-[(3R)-3-aмінo-1-піпepидиніл]-3,4-дигідpo-3-мeтил-2,4-діoкco-1(2H)-піримідиніл]метил]бензонітрил або його сіль є фізично відокремленим від гідрохлориду метформіну.
17. Твердий препарат за будь-яким з пунктів 1-16, що є профілактичним або терапевтичним препаратом при діабеті або ожирінні.
18. Спосіб стабілізування 2-[[6-[(3R)-3-aміно-1-піпepидиніл]-3,4-дигідpo-3-мeтил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі у твердому препараті, що містить 2-[[6-[(3R)-3-aмінo-1-піпepидиніл]-3,4-дигідpo-3-мeтил-2,4-діокco-1(2H)-піримідиніл]метил]бензонітрил або його сіль, гідрохлорид метформіну і добавку, який полягає у фізичному відокремленні 2-[[6-[(3R)-3-aмінo-1-піпepидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрилу або його солі від гідрохлориду метформіну добавкою.
19. Спосіб виробництва твердого препарату, що містить стадію змішування наступних – першої гранули, другої гранули і добавки та компресійне формування суміші:
перша гранула: гранула, що містить 2-[[6-[(3R)-3-aміно-1-піпepидиніл]-3,4-дигідpo-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил або його сіль і до 3 мас. частин гідрохлориду метформіну, відносно 100 мас. частин першої гранули;
друга гранула: гранула, що містить гідрохлорид метформіну і до 0,5 мас. частин 2-[[6-[(3R)-3-aмінo-1-піпepидиніл]-3,4-дигідpo-3-мeтил-2,4-діокco-1(2H)-піримідиніл]метил]бензонітрилу або його солі, відносно 100 мас. частин другої гранули.
Текст
Реферат: Винахід стосується твердого препарату поліпшеної стабільності при зберіганні, що містить 2-[[6[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2Н)-піримідиніл]метил]бензонітрил та гідрохлорид метформіну, які є фізично відокремленими один від одного. UA 98799 C2 (12) UA 98799 C2 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до твердого препарату поліпшеної стабільності при зберіганні, що включає 2-[[6-[(3R)-3-аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1(2H)піримідиніл]метил]бензонітрил (генерична назва: алогліптин; надалі іноді зазначений як сполука (I)), застосовуваний як терапевтичний препарат для діабету і т.п., або його сіль, і гідрохлорид метформіну, та способу його одержання, так само як способу стабілізування сполуки (I). Сполука (I) або її сіль, використовувана в представленому винаході, розкрита як інгібітор дипептидилпептидази (DPP-IV), що є ферментом, який розкладає глюкагоно-подібний пептид-1 (GLP-1), гормон, що підсилює секрецію інсуліну (WO2005/095381). Розкриття було описане як застосування сполуки (I) або її солі, використовувані в представленому винаході в комбінації з гідрохлоридом метформіну (WO2007/033266). Однак, препарат, що включає сполуку (I) або її сіль, і гідрохлорид метформіну, поліпшеної стабільності при зберіганні, не розкритий. Розкриття проблем винаходу, які вирішуються винаходом Сполука (I) або її сіль, яка є інгібітором DPP-IV, і гідрохлорид метформіну, є ефективними для лікування діабету і т.п., і представлені препаратом, що включає обидва як активні інгредієнти (комбінація лікарських речовин), має надзвичайно високу клінічну прийнятність. Тому, дані винахідники почали розробку твердого препарату, що включає сполуку (I) або її сіль, і гідрохлорид метформіну. У тесті сумісності сполуки (I) або її солі, і гідрохлориду метформіну проблеми не зустрічалися. Несподівано, однак, коли твердий препарат, що включає сполуку (I) або її сіль, і гідрохлорид метформіну, був фактично одержаний і підданий тестуванню на стабільність при зберіганні, були виявлені споріднені із сполукою (I) субстанції (продукти розкладання, одержані від сполуки (I)). Інакше кажучи, зменшення в стабільності при зберіганні сполуки (I) або її солі у твердому препараті було підтверджене. Тому для препарату, що включає сполуку (I) або її сіль, і гідрохлорид метформіну як активні інгредієнти, які будуть надані, необхідно запобігти зменшенню в стабільності при зберіганні сполуки (I) або її солі в препараті. Засоби рішення проблем Винахідники провели інтенсивні дослідження в спробі вирішити вищезгадані проблеми й знайшли, що твердий препарат, що включає сполуку (I) або її сіль, і гідрохлорид метформіну, які фізично відокремлені один від одного, мають поліпшену стабільність при зберіганні, і подальші дослідження привели до завершення представленого винаходу. Крім того, вони виявили, що твердий препарат представленого винаходу показує поліпшену розчинність сполуки (I), її солі й гідрохлориду метформіну. Відповідно, даний винахід охоплює [1] твердий препарат, що включає наступну першу частину й другу частину: перша частина: частина, що включає сполуку (I) або її сіль і по суті вільна від гідрохлориду метформіну; друга частина: частина, що включає гідрохлорид метформіну і по суті вільна від сполуки (I) і її солі; [2] вищезгаданий твердий препарат [1], що додатково включає ад'ювант; [3] вищезгаданий твердий препарат [2], що включає приблизно 0,5-200 мг сполуки (I) або її солі, і приблизно 0,1-2 г гідрохлориду метформіну; [4] вищезгаданий твердий препарат [2], що включає першу частину із найкоротшим діаметром не менше, ніж приблизно 100 мкм в принаймні одній частині, і другу частину із найкоротшим діаметром не менше, ніж приблизно 100 мкм в принаймні одній частині; [5] вищезгаданий твердий препарат [2], у якому перша частина має середній розмір частинок не менше, ніж приблизно 75 мкм, і друга частина має середній розмір частинок не менше, ніж приблизно 75 мкм; [6] вищезгаданий твердий препарат [2], де сполукою (I) або її сіллю є бензоат сполуки (I); [7] вищезгаданий твердий препарат [2], що є таблеткою; [8] вищезгаданий твердий препарат [2], у якому перша частина й друга частина є гранулами або таблетками; [9] вищезгаданий твердий препарат [8], що є капсулою, що включає вищезгадану гранулу або вищезгадану таблетку; [10] вищезгаданий твердий препарат [2], у якому вагове співвідношення сполуки (I) або її солі, що міститься в першій частині, та гідрохлориду метформіну, що міститься у другій частині, становить 1:5-1:400; [11] вищезгаданий твердий препарат [2], у якому ад'ювантом є целюлоза; [12] твердий препарат, одержаний компресійним формуванням суміші наступних першої гранули та другої гранули: 1 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 перша гранула: гранула, що включає сполуку (I) або її сіль й по суті вільна від гідрохлориду метформіну; друга гранула: гранула, що включає гідрохлорид метформіну й по суті вільна від сполуки (I) і її солі; [13] вищезгаданий твердий препарат [12], де частина вмісту першої гранули з розміром частинок менше, ніж 150 мкм відносно загальної кількості першої гранули, є не менше, ніж приблизно 20 ваг. %, частина вмісту першої гранули з розміром частинок не менше, ніж 250 мкм відносно загальної кількості першої гранули, є не більше, ніж приблизно 50 ваг. %, частина вмісту другої гранули з розміром частинок менше, ніж 150 мкм відносно загальної кількості другої гранули, є не менше, ніж приблизно 20 ваг. %, і частина вмісту другої гранули з розміром частинок не менше, ніж 250 мкм відносно загальної кількості другої гранули, є не більше, ніж приблизно 50 ваг. %; [14] вищезгаданий твердий препарат [12], де вагове співвідношення сполуки (I) або її солі, що міститься в першій гранулі, та гідрохлориду метформіну, що міститься у другій гранулі, становить 1:5-1:400; [15] твердий препарат, що включає наступні ядро та шар: ядро: ядро, що включає гідрохлорид метформіну і є по суті вільним від сполуки (I) і її солі; шар: шар, що включає сполуку (I) або її сіль і є по суті вільним від гідрохлориду метформіну; 16] твердий препарат, що включає наступні ядро й шар: ядро: ядро, що включає сполуку (I) або її сіль й по суті вільне від метформіну гідрохлориду; шар: шар, що включає гідрохлорид метформіну й по суті вільний від сполуки (I) і її солі; [17] вищезгаданий твердий препарат [15] або [16], що додатково включає проміжний шар між вищезгаданим ядром і вищезгаданим шаром; [18] вищезгаданий твердий препарат [15] або [16], де вищезгаданий шар утворений розпиленням покриття; [19] вищезгаданий твердий препарат [15] або [16], де вищезгаданий шар утворений пресуванням; [20] твердий препарат, що включає наступні перший шар і другий шар: перший шар: шар, що включає сполуку (I) або її сіль і є по суті вільним від гідрохлориду метформіну; другий шар: шар, що включає гідрохлорид метформіну і є по суті вільним від сполуки (I) і її солі; [21] вищезгаданий твердий препарат [20], що додатково включає проміжний шар між вищезгаданим першим шаром і вищезгаданим другим шаром; [22] твердий препарат, що включає сполуку (I) або її сіль і гідрохлорид метформіну, кожен з яких показує співвідношення площі піку визначених нижче споріднених субстанцій RS1 щодо RS6, не більше, ніж 0,5 %, визначене високо-ефективною рідинною хроматографією за наступних умов після одномісячного зберігання при температурі 40 °C; вологості 22 %ВВ, 33 %ВВ, 44 %ВВ або 57 %ВВ; відкритий стан: [умови високоефективної рідинної хроматографії] (1) колонка: Zorbax SB-CN, 5 мкм, внутрішній діаметр 4,6 мм х 25 см (виробник - Agilent) (2) мобільна фаза: мобільна фаза A: очищена вода/ацетонітрил/трифтороцтова кислота = 1900/100/1 (об'ємне співвідношення) мобільна фаза B: очищена вода/ацетонітрил/трифтороцтова кислота = 100/1900/1 (об'ємне співвідношення) (3) програма градієнтного елюювання: від 0 хвилин до 30 хвилин: 99/1 (мобільна фаза A/мобільна фаза B) до 75/25 (мобільна фаза A/мобільна фаза B) від 30 хвилин до 50 хвилин: 75/25 (мобільна фаза A/мобільна фаза B) до 10/90 (мобільна фаза A/мобільна фаза B) від 50 хвилин до 51 хвилин: 10/90 (мобільна фаза A/мобільна фаза B) до 99/1 (мобільна фаза A/мобільна фаза B) від 51 хвилини до 60 хвилин: 99/1 (мобільна фаза A/мобільна фаза B) (постійно) (4) швидкість потоку: 1 мл/хв. (5) детектор: УФ 278 нм (6) температура зразка: приблизно 3 °C - приблизно 10 °C (7) температура колонки: приблизно 20 °C - приблизно 30 °C 2 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 [споріднені субстанції RS1-RS6] споріднені субстанції RS1-RS6 - похідні сполуки (I) або її солі, показують відносний час елюювання 0,60±10 %, 1,08±10 %, 1,30±10 %, 1,49±10 %, 1,52±10 % й 1,62±10 %, відповідно, коли час елюювання сполуки (I) становить 1,00, при аналізі високо-ефективною рідинною хроматографією за вищезгаданих умов. [співвідношення площі піку] співвідношення площі піку показують співідношення кожної площі піку відносно площі піку при допустимому вмісті сполуки (I) як 100, при аналізі високо-ефективною рідинною хроматографією за вищезгаданих умов; [23] твердий препарат, що включає сполуку (I) або її сіль, і гідрохлорид метформіну, де сполука (I) або її сіль, фізично відокремлена від гідрохлориду метформіну; [24] твердий препарат за будь-яким з вищезгаданих [1] - [23], що є профілактичним або терапевтичним препаратом для діабету або ожиріння; [25] спосіб стабілізування сполуки (I) або її солі у твердому препараті, що включає сполуку (I) або її сіль, гідрохлорид метформіну і ад'ювант, який полягає у фізичному відокремленні сполуки (I) або її солі від гідрохлориду метформіну ад'ювантом; [26] спосіб виробництва твердого препарату, що включає стадію змішування наступних компонентів - першої гранули, другої гранули й ад'юванта та пресування суміші під тиском: перша гранула: гранула, що включає сполуку (I) або її сіль і є по суті вільною від гідрохлориду метформіну; друга гранула: гранула, що включає гідрохлорид метформіну і є по суті вільною від сполуки (I) та її солі; і т.п. Ефект винаходу Твердий препарат представленого винаходу є придатним як терапевтичний препарат для діабету й т.п., і має поліпшену стабільність при зберіганні й розчинність сполуки (I), її солі та гідрохлориду метформіну. Короткий опис малюнків Фіг. 1 - хроматограма ВЕРХ. Фіг. 2 - графік, що показує швидкість розчинення прикладу одержання 11. (Детальний Опис Винаходу) Твердий препарат представленого винаходу детально розкритий нижче. Перша й друга частини у твердому препараті представленого винаходу означають компоненти, кожен з яких може бути присутній як незалежна композиція. У твердому препараті представленого винаходу сполука (I) і її сіль кожні фізично відокремлені від гідрохлориду метформіну. В представленому винаході, "фізично відокремлені" означає, що перешкоджається контакт сполуки (I) та її солі з гідрохлоридом метформіну, і не обов'язково означає повне відокремлення одне від одного. Інакше кажучи, твердий препарат представленого винаходу містить наступні першу частину й другу частину: перша частина: частина, що включає сполуку (I) або її сіль і є по суті вільною від гідрохлориду метформіну; друга частина: частина, що включає гідрохлорид метформіну і є по суті вільною від сполуки (I) і її солі. (1) Перша частина. Перша частина в представленому винаході - частина (або фармацевтична композиція), що включає сполуку (I) або її сіль і є по суті вільною від гідрохлориду метформіну. Бути "по суті вільною від гідрохлориду метформіну" означає, що вміст гідрохлориду метформіну - 0-3 вагові частини, переважно 0-1 вагова частина, відносно 100 вагових частин загальної кількості першої частини в представленому винаході. Приклади солей сполуки (I) включають фармакологічно прийнятну сіль, таку як солі з мінеральними кислотами, солі з органічними кислотами, солі з основними або кислими амінокислотами й т.п. Приклади солей з мінеральними кислотами включають солі із соляною кислотою, бромводневою кислотою, азотною кислотою, сірчаною кислотою, фосфорною кислотою й т.п… Приклади солей з органічними кислотами включають солі з бензойною кислотою, мурашиною кислотою, оцтовою кислотою, трифтороцтовою кислотою, фумаровою кислотою, щавлевою кислотою, винною кислотою, малеїновою кислотою, лимонною кислотою, бурштиновою кислотою, яблучною кислотою, метансульфоновою кислотою, бензолсульфоновою кислотою, п-толуолсульфоновою кислотою й т.п… Приклади солей з основними амінокислотами включають солі з аргініном, лізином, орнітином й т.п., і приклади солей з кислими амінокислотами включають солі з аспарагіновою кислотою, глутаміновою кислотою й т.п. 3 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважні приклади солей сполуки (I) включають солі з бензойною кислотою, трифтороцтовою кислотою, п-толуолсульфоновою кислотою, і т.п., переважно - солі з бензойною кислотою. Сполука (I) або її сіль є переважно бензоатом сполуки (I), трифторацетатом сполуки (I), птолуолсульфонатом сполуки (I) або хлоргідратом сполуки (I), більш переважно - бензоатом сполуки (I) (іноді, скорочено - як сполука (IA) в представленому описі). Вміст сполуки (I) або її солі, як сполуки (I) (тобто, як вільної форми), переважно 0,1-90 вагових частин, більш переважно 0,5-80 вагових частин, усе ще більш переважно 1-70 вагових частин, особливо переважно 2-50 вагових частин відносно 100 вагових частин загальної кількості першої частини в представленому винаході. Вищезгадана перша частина може мати будь-яку форму або розмір, поки це може утворити твердий препарат разом з нижче згаданою другою частиною, і може призначатися (переважно перорально) суб'єктам. Крім того, у першої частини може бути будь-яка внутрішня структура, і внутрішня частина може бути однорідною або неоднорідною. Форма першої частини може бути, наприклад, частиною таблетки або фізично незалежною гранулою або таблеткою. З урахуванням стабільності при зберіганні, твердий препарат представленого винаходу переважно містить, в принаймні одній частині, першу частину, що має найкоротший діаметр не менше, ніж приблизно 100 мкм фізично відокремленої сполуки (I) і її солі від гідрохлориду метформіну. У той час як верхня межа найкоротшого діаметра особливо не обмежена, це взагалі не більше, чим приблизно 2 мм для пероральних дозованих форм. Найкоротший діаметр означає діаметр найкоротшої вісі. Коли першою частиною є гранула, наприклад, це означає діаметр найкоротшої вісі гранули. Діаметр короткої вісі може бути виміряний, використовуючи мікроскоп і т.п. Тільки мікроскоп повинен бути здатним виміряти розмір на рівні 100 мкм. Найкоротший діаметр першої частини означає найкоротший діаметр першої частини, що міститься у твердому препараті. Для легкості вимірювання це може бути найкоротший діаметр першої частини перед створенням твердого препарату. Для стабільності при зберіганні твердий препарат представленого винаходу переважно містить першу частину, що має середній розмір частинок не менше, ніж приблизно 75 мкм (переважно не менше, ніж приблизно 100 мкм) щодо фізично відокремленої сполуки (I) і її солі від гідрохлориду метформіну. У той час, як верхня межа середнього розміру частинок першої частини особливо не обмежена, - взагалі приблизно не більше, ніж 1,5 мм для пероральних дозованих форм. В представленому винаході розмір частинок вимірювали способом просіювання (PowderTheory and Application, стор. 475, 1979, Maruzen). Середній розмір частинок обчислювали, базуючись на середній апертурі відповідного сита й ваги розподілюваних частинок. Таким чином, середній розмір отримували арифметичним усередненням середньої й кожної ваги продукту. Тут, середній розмір частинок першої частини означає середній розмір частинок першої частини, що міститься у твердому препараті. Для легкості вимірювання це може бути середній розмір частинок першої частини перед створенням твердого препарату. Вищезгадана перша частина може містити ад'ювант, традиційно використовуваний в фармацевтичній галузі. Приклади ад'юванта включають інертні наповнювачі, дезінтегранти, зв'язувальні, змащувальні агенти, барвник, коригент рН, поверхнево-активну речовину, стабілізатор, підкислювальну речовину, ароматизатор, агенти сковзання, покриваючу основу, ад'ювант покриття й т.п… Якщо конкретно не вказано, ці ад'юванти використовуються в кількості, традиційно застосовуваній в фармацевтичній галузі. Вищезгадана перша частина може бути одержана способом, відомим, власне кажучи, відповідно до дозованої форми твердого препарату представленого винаходу. Переважні приклади ексціпієнтів включають цукор, такий як лактоза, сахароза, фруктоза й глюкоза; цукрові спирти, такі як еритрит, манніт, сорбіт, ксиліт, мальтит і т.п.; крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль, пшеничний крохмаль, рисовий крохмаль, частково пептизований крохмаль, пептизований крохмаль, пористий крохмаль і т.п.; целюлоза, така як кристалічна целюлоза (наприклад, мікрокристалічна целюлоза), здрібнена в порошок целюлоза, нижчезаміщена гідроксипропілцелюлоза і т.п.; безводний фосфат кальцію, осаджений карбонат кальцію, силікат кальцію і т.п… серед цих, манніт, кристалічна целюлоза й т.п. - переважні. Переважно використовувана кількість ексціпієнтів 1-95 вагових частин, більш переважно 590 вагових частин, відносно 100 вагових частин вищезгаданої першої частини. 4 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 Переважні приклади дезінтегрантів включають наступні: кросповідон, карбоксиметилцелюлоза, кальцій-карбоксиметилцелюлоза, натрій карбоксиметил крохмаль, натрій кроскармелоза, нижчезаміщена гідроксипропілцелюлоза, гідроксипропіл крохмаль і т.п… Коли використовуються дезінтегранти, їх переважна використовувана кількість 0,1-30 вагових частин, більш переважно 1-20 вагових частин, усе ще більш переважно 2-10 вагових частин, відносно 100 вагових частин вищезгаданої першої частини. Переважні приклади сполучного компонента включають кристалічну целюлозу (наприклад, кристалічна целюлоза), гідроксипропілцелюлозу [наприклад, марки: L, SL, SL-T, SSL (торговельна марка); Nippon Soda Co., Ltd.], гідроксипропілметилцелюлозу [наприклад, Metolose TC-5 (марки: МВТ, E, EW, R, RW) (торговельна марка); Shin-Etsu Chemical Co., Ltd.], полівінілпіролідон, аравійську камедь і т.п… серед них, кристалічна целюлоза, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, полівінілпіролідон і т.п. - переважні. Кількість сполучного компонента, що буде використовуватися, переважно 0,1-40 вагових частин, більш переважно 0,5-30 вагових частин, усе ще більш переважно 1-20 вагових частин, відносно 100 вагових частин вищезгаданої першої частини. Переважні приклади змащувачів включають стеарат магнію, стеарат кальцію, тальк, сахарозні естери жирних кислот, натрій стеарил фумарат і т.п… Коли використовуються змащувачі, їх переважна використовувана кількість 0,01-10 вагових частин, більш переважно 0,05-5 вагових частин, відносно 100 вагових частин вищезгаданої першої частини. Переважні приклади барвника включають харчові барвники, такі як Харчовий Барвник Жовтий № 5, Харчовий Барвник Червоний № 2, Харчовий Барвник Синій № 2 і т.п., харчові краплаки, оксид заліза, жовтий оксид заліза й т.п. Переважні приклади коригентів рН включають лимонну кислоту або її сіль, фосфорну кислоту або її сіль, карбонову кислоту або її сіль, винну кислоту або її сіль, фумарову кислоту або її сіль, оцтову кислоту або її сіль, амінокислоту або її сіль й т.п… Переважні приклади сурфактантів включають лаурил сульфат натрію, полісорбат 80, поліоксиетилен(160) поліоксипропілен (30) гліколь і т.п… Переважні приклади стабілізаторів включають токоферол, тетра едетат натрію, амід нікотинової кислоти, циклодекстрини й т.п… Переважні приклади підкислювачів включають аскорбінову кислоту, лимонну кислоту, винну кислоту, яблучну кислоту й т.п… Переважні приклади ароматизаторів включають ментол, м'ятне масло, лимонне масло, ванілін і т.п… Переважні приклади агентів сковзання включають злегка зневоднену кремнієву кислоту, гідратований діоксид кремнію і т.п… Переважні приклади покриваючої основи включають цукрову покриваючу основу, водну плівкову покриваючу основу, ентеральну плівкову покриваючу основу, плівкову покривну основу пролонгованого вивільнення і т.п. Як цукрова покриваюча основа, використовується сахароза. Крім того, один або більше видів, вибрані з наступних: тальк, осаджений карбонат кальцію, желатин, аравійська камедь, карнаубский віск і т.п., можуть використовуватися в комбінації. Приклади водної плівкової покриваючої основи включають полімери целюлози, такі як гідроксипропілцелюлоза [наприклад, марки: L, SL, SL-T, SSL (торговельна марка); Nippon Soda Co., Ltd.], гідроксипропілметилцелюлоза [наприклад, MetoloseTC-5 (марки: МВТ, E, EW, R, RW) (торговельна марка); Shin-Etsu Chemical Co., Ltd.]], оксиетилцеллюлоза, метилгідроксиетилцелюлоза і т.п.; синтетичні полімери, такі як полівінілацеталь діетиламіноацетат, аміноалкілметакрилатний співполімер E [Eudragit E (торговельна марка)], полівінілпіролідон і т.п.; поліози, такі як і т.п. Приклади ентеральної плівкової покриваючої основи включають полімери целюлози, такі як фталат гідроксипропілметилцелюлози, сукцинат ацетату гідроксипропілметилцелюлози, карбоксиметилетилцелюлоза, фталат ацетату целюлози й т.п.; полімери акрилової кислоти, такі як співполімер L метакрилової кислоти [Eudragit L (торговельна марка)], співполімер LD метакрилової кислоти [Eudragit L-30D55 (торговельна марка)], співполімер S метакрилової кислоти [S Eudragit (торговельна марка)] і т.п.; природні субстанції, такі як шелак і т.п.; і т.п. Приклади плівкової покриваючої основи пролонгованого вивільнення включають полімери целюлози, такі як етилцеллюлоза й т.п.; полімери акрилової кислоти, такі як аміноалкіл метакрилатний співполімер RS [RS Eudragit (торговельна марка)], метилетилакрилатна співполімерна суспензія метакрилової кислоти [NE Eudragit (торговельна марка)] і т.п.; і т.п. 5 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважні приклади ад'ювантів для покриття включають світлорозсіювальні агенти, і/або барвники, такі як діоксид титану, тальк, оксид заліза, жовтий оксид заліза й т.п.; пластифікатори, такі як поліетиленгліколь [наприклад, макроголь 6000 (торговельна марка)], триетилцитрат, касторове масло, полісорбати й т.п.; органічні кислоти, такі як лимонна кислота, винна кислота, яблучна кислота, аскорбінова кислота й т.п.; цукор і цукрові спирти, такі як лактоза, манніт і т.п.; і т.п. Вищезгадані ад'юванти можуть бути сумішшю двох або більше видів у прийнятному співвідношенні. Вищезгадана перша частина - переважно частина, що містить сполуку (I) або її сіль (переважно бензоат сполуки (I); ексціпієнт (переважно манніт, і целюлоза (більш переважно кристалічна целюлоза)); і сполучний компонент (переважно гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, полівінілпіролідон). (2) друга частина Друга частина в представленому винаході є частиною (фармацевтична композиція), що включає гідрохлорид метформіну і є по суті вільною від сполуки (I) і її солі. Будучи "по суті вільна від сполуки (I) або її солі" означає, що вміст сполуки (I) або її солі 0-1 вагових частин, переважно 0-0,5 вагових частин, більш переважно 0-0,1 вагових частин, відносно 100 вагових частин загальної кількості другої частини в представленому винаході. Вміст гідрохлориду метформіну переважно становить 10-99 вагових частин, більш переважно 20-98 вагових частин, усе ще більш переважно 30-95 вагових частин, відносно 100 вагових частин вищезгаданої другої частини. Вищезгадана друга частина може мати будь-яку форму або розмір, поки це може утворити твердий препарат разом з вищезгаданою першою частиною, і може призначатися (переважно перорально) суб'єктам. Форма другої частини може бути, наприклад, частиною таблетки, або фізично незалежною гранулою або таблеткою. Крім того, у другої частини може бути будь-яка внутрішня структура, і внутрішня частина може бути однорідною або неоднорідною. З урахуванням стабільності при зберіганні твердий препарат представленого винаходу переважно містить, в принаймні одній частині, другу частину, що має найкоротший діаметр не менше, ніж приблизно 100 мкм щодо фізично відокремленої сполуки (I) і її солі від гідрохлориду метформіну. У той час як верхня межа найкоротшого діаметра особливо не обмежена, це взагалі не більше, ніж приблизно 2 мм для пероральних дозованих форм. Найкоротший діаметр означає діаметр найкоротшої вісі. Коли друга частина - гранула, наприклад, це означає діаметр найкоротшої вісі гранули. Короткий осьовий діаметр може бути виміряний, використовуючи мікроскоп і т.п… Мікроскоп повинен бути здатним виміряти рівень розміру 100 мкм. Найкоротший діаметр другої частини означає найкоротший діаметр другої частини, що міститься у твердому препараті. Для легкості вимірювання це може бути найкоротший діаметр другої частини перед створенням твердого препарату. Для стабільності при зберіганні твердий препарат представленого винаходу переважно містить другу частину, що має середній розмір частинок не менше, ніж приблизно 75 мкм (переважно не менше, ніж приблизно 100 мкм) щодо фізично відокремленої сполуки (I) і її солі від гідрохлориду метформіну. У той час як верхня межа середнього розміру частинок другої частини особливо не обмежена, це взагалі приблизно не більше, чим 1,5 мм для пероральних дозованих форм. Обчислення розміру частинок другої частини й середнього розміру частинок здійснюють як визначено в першій частині. Тут, середній розмір частинок другої частини означає середній розмір частинок другої частини, що міститься у твердому препараті. Для легкості вимірювання це може бути середній розмір частинок другої частини перед створенням твердого препарату. Вищезгадана друга частина може містити ад'ювант, традиційно використовуваний в фармацевтичній галузі, і може бути одержана відповідно до відомого способу. Як ад'юванти, можуть бути згадані ті ж самі, що і для вищезгаданої першої частини. Якщо конкретно не вказано, ці ад'юванти використовуються в кількості, традиційно застосовуваній в фармацевтичній галузі. Вищезгадана друга частина може бути одержана способом, відомим, власне кажучи, відповідно до дозованої форми твердого препарату представленого винаходу. Кількість ексціпієнтів, що буде використовуватися як ад'ювант для другої частини, становить переважно 1-90 вагових частин, більш переважно 3-80 вагових частин, усе ще більш переважно 5-70 вагових частин, відносно 100 вагових частин вищезгаданої другої частини. 6 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 Коли використовуються дезінтегранти як ад'юванти для другої частини, їх переважна використовувана кількість становить 0,1-30 вагових частин, більш переважно 1-20 вагових частин, усе ще більш переважно 2-10 вагових частин, відносно 100 вагових частин вищезгаданої другої частини. Кількість сполучного компонента, що буде використовуватися як ад'ювант для другої частини, переважно становить 0,1-30 вагових частин, більш переважно 0,5-20 вагових частин, усе ще більш переважно 1-10 вагових частин, відносно 100 вагових частин вищезгаданої другої частини. Коли використовуються змащувачі як ад'юванти для другої частини, їх переважна використовувана кількість становить 0,01-10 вагових частин, більш переважно 0,05-5 вагових частин, відносно 100 вагових частин вищезгаданої другої частини. Кількість інших ад'ювантів, які будуть використовуватися в другій частині, є кількістю, традиційно використовуваною у фармацевтичній галузі. Вищезгадана друга частина - переважно частина, що містить гідрохлорид метформіну; ексціпієнт (переважно целюлоза (більш переважно кристалічна целюлоза)); і сполучний компонент (переважно полівінілпіролідон). Вміст вагового співвідношення (друга частина/перша частина) першої частини й другої частини у твердому препараті представленого винаходу становить переважно 0,01-100, більш переважно 0,5-80, усе ще більш переважно 2-40. Вміст вагового співвідношення сполуки (I) або її солі, що міститься в першій частині, і гідрохлориду метформіну, що міститься у другій частині (сполука (I) або сіль:гідрохлорид метформіну) у твердому препараті представленого винаходу становить переважно 1:5-1:400, більш переважно 1:15-1:300, усе ще більш переважно 1:25-1:200. Сполука (I) і метформін можуть бути сольватами (наприклад, гідратами) або несольватами (наприклад, негідратами). 3 14 35 125 Крім того, сполука (I) може бути маркована ізотопом (наприклад, H, C, S, I). 1 2 Крім того, це може бути дейтерієвий конвертер, в якому H перетворюється на H (D). Перша частина й друга частина можуть бути одержані відомим способом відповідно до їх форм або дозованої форми твердого препарату представленого винаходу. Крім того, у твердого препарату представленого винаходу може бути неактивний проміжний шар між першою частиною й другою частиною. Проміжний шар містить, наприклад, вищезгадану покриваючу основу й ад'ювант для покриття. Проміжний шар переважно містить гідросолюбільну плівкову покриваючу основу (переважно гідроксипропілметилцелюлозу) і світлорозсіювач, і/або барвник (переважно тальк). Коли у твердого препарату представленого винаходу є проміжний шар, він був утворений у співвідношенні переважно 0,1-500 вагових частин, більш переважно 1-100 вагових частин, усе ще більш переважно 10-50 вагових частин, відносно 100 вагових частин першої частини. Коли у твердого препарату представленого винаходу є такий проміжний шар, несприятливий вплив (зменшена стабільність при зберіганні або хімічна стабільність, така як розкладання активних інгредієнтів впродовж певного часу, зменшена активність і т.п., зменшена стабільність при розчиненні, така як тимчасова зміна в розчиності зразка активного інгредієнта й т.п., і т.п.) викликаний взаємодією активних інгредієнтів може бути пригнічена більш ефективно. Крім того, ад'ювант, традиційно використовуваний у фармацевтичній галузі, може бути додатково доданий після змішування першой частини й другої частини. Певні варіанти реалізації твердого препарату представленого винаходу включають наступні: [І] Таблетка [1] Твердий препарат, одержаний компресійним формуванням суміші наступних першої гранули й другої гранули (іноді, скорочено - як компресійно сформована таблетка в представленому описі): перша гранула: гранула, що включає сполуку (I) або її сіль і є по суті вільною від гідрохлориду метформіну; друга гранула: гранула, що включає гідрохлорид метформіну і є по суті вільною від сполуки (I) і її солі. Для легкості змішування переважно, що частина вмісту першої гранули з розміром частинок менше, ніж 150 мкм відносно загальної кількості першої гранули є не менше, ніж приблизно 20 ваг. %, частина вмісту першої гранули з розміром частинок не менше, ніж 250 мкм відносно загальної кількості першої гранули повинна бути не більше, чим приблизно 50 ваг. %, частина вмісту другої гранули з розміром частинок менше, ніж 150 мкм відносно загальної кількості другої гранули є не менше, ніж приблизно 20 ваг. %, і 7 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 частина вмісту другої гранули з розміром частинок не менше, ніж 250 мкм відносно загальної кількості другої гранули повинна бути не більше, чим приблизно 50 ваг. %. Вагове співвідношення сполуки (I) або її солі, що міститься в першій гранулі, та гідрохлориду метформіну, що міститься у другій гранулі (сполука (I) або сіль:гідрохлорид метформіну) переважно становить 1:5-1:400, більш переважно 1:15-1:250, усе ще більш переважно 1:251:125. Вагове співвідношення розміру кожної частинки може бути визначено просіюванням гранул (приблизно 50 г), використовуючи сита 30 меш (апертура 500 мкм), 42 меш (апертура 355 мкм), 60 меш (апертура 250 мкм), або 100 меш (апертура 150 мкм), і вимірюванням ваги гранул, що залишаються на кожному ситі, та ваги гранул, які проходили через сито 100 меш. [2] Твердий препарат, що включає наступні ядро й шар (іноді, скорочено як "вкрита таблетка (A)" в представленому описі): ядро: ядро, що включає гідрохлорид метформіну і є по суті вільним від сполуки (I) і її солі (іноді, скорочено як "внутрішнє ядро включає другу частину" в представленому описі); шар: шар, що включає сполуку (I) або її сіль і є по суті вільним від гідрохлориду метформіну (іноді, скорочено як "зовнішній шар включає першу частину" в представленому описі); [3] Твердий препарат, що включає наступні ядро й шар (іноді, скорочено як "вкрита таблетка (B)" в представленому описі): ядро: ядро, що включає сполуку (I) або її сіль і є по суті вільним від гідрохлориду метформіну (іноді, скорочено як "внутрішнє ядро включає першу частину" в представленому описі); шар: шар, що включає гідрохлорид метформіну і є по суті вільним від сполуки (I) і її солі (іноді, скорочено як "зовнішній шар включав другу частину" в представленому описі); [4] твердий препарат, що включає наступні перший шар і другий шар (іноді, скорочено як " багатошарова таблетка" представленого винаходу в представленому описі): перший шар: шар, що включає сполуку (I) або її сіль і є по суті вільним від гідрохлориду метформіну; другий шар: шар, що включає гідрохлорид метформіну і є по суті вільним від сполуки (I) і її солі; [II] Капсула, що включає першу частину й другу частину, кожна з яких є гранулою або таблеткою (іноді, скорочено як капсула представленого винаходу); [III] Порошковий пакет, що включає першу частину й другу частину, кожна з яких є гранулою або таблеткою (іноді, скорочено як порошковий пакет представленого винаходу) може бути наведений як приклад. Компресійно сформована таблетка представленого винаходу може бути одержана, наприклад, згідно з наступною стадією виробництва. (1) Сполуку (I) або її сіль гранулювали, при необхідності, з ад'ювантом і висушували, просіювали і т.п. у міру необхідності, щоб одержати першу гранулу. Ад'ювантом переважно є ексціпієнт (переважно манніт і целюлоза (більш переважно кристалічна целюлоза)); сполучний компонент (переважно полівінілпіролідон) і т.п. Перша гранула може бути переважно одержана згідно з наступною стадією виробництва. Сполуку (I) або її сіль (переважно бензоат сполуки (I), і ексціпієнт (переважно манніт і целюлозу (більш переважно, кристалічну целюлозу)) гранулювали, використовуючи дисперсійну рідину сполучного компонента (переважно полівінілпіролідон) у розчиннику (наприклад, вода, ацетон, етиловий спирт, пропіловий спирт, і їх суміш у прийнятному співвідношенні; переважно вода). Тут, дисперсійна рідина може бути будь-яким розчином або суспензією, і "дисперсійна рідина" у представленому описі включає й розчин і суспензію. (2) З іншого боку, гідрохлорид метформіну гранулювали з ад'ювантом в міру необхідності, і висушували, просіювали і т.п. у міру необхідності, щоб одержати другу гранулу. Ад'ювантом є переважно ексціпієнт (переважно целюлоза (більш переважно кристалічна целюлоза)); сполучний компонент (переважно полівінілпіролідон) і т.п… Друга гранула може бути переважно одержана згідно з наступною стадією виробництва. Гідрохлорид метформіну; і ексціпієнт (переважно целюлозу (більш переважно кристалічну целюлозу)) гранулювали, використовуючи дисперсійну рідину сполучного компонента (переважно полівінілпіролідон) у розчиннику (наприклад, воді, ацетоні, етиловому спирті, пропіловому спирті, і їх суміші у прийнятному співвідношенні; переважно, у воді). (3) Одержані першу й другу гранули змішували, за необхідності, з додатковим ад'ювантом. Згадуваним ад'ювантом переважно є ексціпієнт (переважно целюлоза (кристалічна целюлоза, здрібнена в порошок целюлоза, низькозаміщена гідроксипропілцелюлоза), більш переважно 8 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 кристалічна целюлоза [наприклад, CEOLUS KG 802, CEOLUS KG-1000, CEOLUS PH-F20 (торговельна марка); Asahi Корпорація Kasei]); і сполучний компонент (переважно полівінілпіролідон), дезінтегранти (переважно кросповідон [наприклад, Kollidon CL, Kollidon CLF, Kollidon CL-SF (торговельна марка); BASF]), і змащувачі (переважно стеарат магнію) і т.п… З урахуванням твердості таблетки й розчинності, ексціпієнтом переважно є CEOLUS KG1000, і дезінтегрантом переважно є Kollidon CL-F. (4) Одержану суміш формували під тиском. Вкрита таблетка (A) представленого винаходу може бути одержана, наприклад, згідно з наступними стадіями виробництва. Внутрішнє ядро із другої частини, може бути одержано, наприклад, гранулюючи гідрохлорид метформіну разом з ад'ювантом, де необхідно. Після гранулювання, операції, такі як висушування, калібрування, і т.п. можуть бути виконані в міру необхідності. Ад'ювантом переважно є ексціпієнт (переважно кристалічна целюлоза); сполучний компонент (переважно полівінілпіролідон), дезінтегранти (переважно кросповідон), змащувачі (переважно стеарат магнію) і т.п… Внутрішнє ядро, одержане з вищезгаданої другої частини, може бути переважно одержано згідно з наступними стадіями виробництва. (1) гідрохлорид метформіну; ексціпієнт (переважно, кристалічну целюлозу) гранулювали, використовуючи дисперсійну рідинусполучного компонента (переважно, полівінілпіролідон) у розчиннику (наприклад, воді, ацетоні, етиловому спирті, пропіловому спирті, і їх суміші у прийнятному співвідношенні; переважно, у воді). (2) Одержаний гранульований продукт висушували і просіювали, і одержану гранулу й ексціпієнт (переважно, кристалічну целюлозу), дезінтегранти (переважно, кросповідон) і змащувачі (переважно, стеарат магнію) змішували. (3) Одержану суміш формували під тиском. З іншого боку, зовнішній шар першої частини, може бути одержаний, наприклад, покриттям сполуки (I) або її солі (переважно, бензоату сполуки (I)) ад'ювантом, де необхідно, вищезгаданої першої частини. Покриття може бути здійснене, наприклад, пресуванням, покриттям і т.п. Ад'ювантом переважно є ексціпієнт (переважно манніт) і сполучний компонент (переважно гідроксипропілцелюлоза) і т.п… Вищезгаданий зовнішній шар першої частини, може бути переважно одержаний відповідно до наступних стадій виробництва. Внутрішнє ядро, одержане із другої частини, покривають дисперсійною рідиною сполуки (I) або її солі (переважно бензоату сполуки (I)), ексціпієнтом (переважно маннітом) і сполучним компонентом (переважно гідроксипропілцелюлозою) у розчиннику (наприклад, воді, ацетоні, етиловому спирті, пропіловому спирті, і їх суміші у прийнятному співвідношенні; переважно, у воді). Під час виробництва вкритої таблетки (A), перевага надається утворенню неактивного проміжного шару між внутрішнім ядром і зовнішнім шаром, щоб уникнути їх прямого контакту. Проміжний шар містить, наприклад, вищезгадану покриваючу основу та ад'ювант для покриття. Проміжний шар переважно містить водну плівкову покриваючу основу (переважно, гідроксипропілметилцелюлозу) і світлорозсіювач, і/або барвник (переважно тальк). У вищезгаданій покритій таблетці (A), зовнішній шар утворювали в пропорції переважно 0,1100 вагових частин, більш переважно 1-50 вагових частин, усе ще більш переважно 3-30 вагових частин, відносно 100 вагових частин внутрішнього ядра. У вищезгаданій покритій таблетці (A), крім того, проміжний шар утворювали в пропорції переважно 0,1-30 вагових частин, більш переважно 0,5-20 вагових частин, усе ще більш переважно 1-5 вагових частин, відносно 100 вагових частин внутрішнього ядра. Вищезгадана вкрита таблетка (B) може бути одержана тим же самим способом, як вкрита таблетка (A) за винятком того, що перша частина використовується як внутрішнє ядро, і друга частина використовується як зовнішній шар. У вищезгаданій покритій таблетці (B), зовнішній шар утворювали в пропорції переважно 1300 вагових частин, більш переважно 5-200 вагових частин, усе ще більш переважно 10-80 вагових частин, відносно 100 вагових частин внутрішнього ядра. Багатошарова таблетка представленого винаходу може бути одержана, наприклад, відповідно до наступних стадій виробництва. (a) Сполуку (I) або її сіль змішували, при необхідності, з вищезгаданим ад'ювантом і гранулювали з одержанням композиції для вищезгаданого першого шару. 9 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 (b) Гідрохлорид метформіну змішували, при необхідності, з вищезгаданим ад'ювантом і гранулювали з одержанням композиції для вищезгаданого другого шару. (c) Коли між першим шаром і другим шаром потрібно утворити неактивний проміжний шар, щоб уникнути прямого контакту кожного шару, вищезгадані ад'юванти, такі як ексціпієнт, зв'язувальні і т.п., при необхідності, змішували і далі при необхідності, гранулювали, щоб одержати композицію для проміжного шару. (d) Композицію для першого шару, композицію для проміжного шару, коли бажано, і композицію для другого шару ламінували і формували під тиском. У вищезгаданій багатошаровій таблетці, другий шар можна утворити в пропорції переважно 1-2000 вагових частин, більш переважно 5-1000 вагових частин, усе ще більш переважно 10-500 вагових частин, відносно 100 вагових частин першого шару. У вищезгаданій багатошаровій таблетці, крім того, проміжний шар можна утворити в пропорції переважно 0,1-1000 вагових частин, більш переважно 1-500 вагових частин, усе ще більш переважно 10-300 вагових частин, відносно 100 вагових частин першого шару. Капсула представленого винаходу може бути одержана, наприклад, наповненням капсули (наприклад, желатинової капсули) вищезгаданою сумішшю першої гранули й другої гранули, вищезгаданою компресійно сформованою таблеткою, вищезгаданою вкритою таблеткою (A) або (B), або вищезгаданою багатошаровою таблеткою. Особливо переважні приклади твердого препарату представленого винаходу включають вищезгадані компресійно сформовані таблетки. Крім того, вкриті плівкою препарати, одержані плівковим покриттям вищезгаданої компресійно сформованої таблетки, вищезгаданої покритої таблетки (A) або (B), і вищезгаданої багатошарової таблетки з вищезгаданою основою покриття й ад'ювантом покриття, також охоплюються об'єктом "твердий препарат" даного винаходу. Крім того, твердий препарат представленого винаходу може мати клеймо або тиснення з буквами для розрізнення, або має розділювальну лінію для того, щоб розділити таблетку. Виходячи з аспектів легкості введення, міцності препарату й т.п., твердий препарат представленого винаходу переважно покривають плівкою. Операції, такі як змішування, компресійне формування, покриття й т.п. у вищезгаданій стадії виробництва здійснюють відповідно до способу, традиційно використовуваному у фармацевтичній галузі. Змішування здійснюють, наприклад, використовуючи міксер, такий як V-подібний міксер, тумблерний міксер й т.п.; і гранулювальну машину, таку як високошвидкісний міксерний гранулятор, гранулювальна сушарка з псевдозрідженим шаром, екструзійний гранулятор, ролерний компактор й т.п… Компресійне формування здійснювали, наприклад, використовуючи таблетувальну машину з одним пуансоном, роторну таблетувальну машину і т.п… Коли використовували таблетувальну машину з одним пуансоном, роторну таблетувальну 2 2 машину і т.п., тиск таблетування взагалі 1-35 кН/см (переважно 5-35 кН/см ) переважно використовується. Крім того, щоб запобігти закупорюванню, переважно використовується клиноподібний пуансон. Покриття здійснюють, наприклад, використовуючи апарат для плівкового покриття й т.п… Твердий препарат представленого винаходу переважно містить приблизно 0,5-200 мг сполуки (I) або її солі, і приблизно 0,1-2 г гідрохлориду метформіну. Твердий препарат представленого винаходу більш переважно містить приблизно 1-100 мг сполуки (I) або її солі, і приблизно 0,5 - приблизно 1,5 г гідрохлориду метформіну. Твердий препарат представленого винаходу може безпечно призначатися перорально або перентерально ссавцеві (наприклад, миша, пацюк, кролик, кішка, собака, бик, кінь, мавпа, людина). Твердий препарат представленого винаходу й кожний активний інгредієнт, що міститься у твердому препараті, є корисним для профілактики або лікування, наступних захворювань, наприклад, діабет [наприклад, діабет 1 типу, діабет 2 типу, діабет 1,5 типу (ЛАДД (латентний аутоімунний діабет у дорослих)), гестаційний діабет, діабет з недостатньою секрецією інсуліну, діабет у осіб з ожирінням, порушена глюкозо-толерантість (IGT), IFG (недостатність глюкози натщесерце), IFG (дисглікемія натщесерце)], діабетичні ускладнення [наприклад, невропатія, нефропaтія, ретинопатія, катаракта, макроангіопатія артеріосклероз, остеопенія, гіперосмолярна діабетична кома, інфекції (наприклад, респіраторна інфекція, інфекція уринарного тракту, шлунково-кишкова інфекція, інфекції шкіри та м'яких тканин, інфекція нижніх кінцівок), діабетична гангрена, ксеростомія, гіпакузія, церебрально-васкулярний розлад, периферична дисциркуляція], ожиріння, гіперліпідемія (наприклад, гіпертригліцеридемія, 10 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 гіперхолестеринемія, гіпер-ЛПНЩ-холестеринемія, гіпо-ЛПВЩ-холестеринемія, постпрандіальна гіперліпідемія), артеріосклероз (наприклад, атеросклероз), гіпертонія, інфаркт міокарду, стенокардія, церебрально-васкулярний розлад (наприклад, інфаркт мозку, крововилив у мозок), інсуліно-резистентний синдром, синдром X, дисметаболічний синдром і т.п… Крім того, твердий препарат представленого винаходу також корисний для вторинної профілактики вищезгаданих різних захворювань (наприклад, вторинна профілактика кардіо-васкулярних захворювань, таких як інфаркт міокарду й т.п.) або пригнічення прогресування [наприклад, пригнічення прогресування від порушеної глюкозо-толерантності до діабету; пригнічення прогресування від діабету до діабетичних ускладнень (переважно діабетична невропатія, діабетична нефропaтія, діабетична ретинопатія, артеріосклероз)]. Доза твердого препарату представленого винаходу повинна бути ефективною кількістю сполуки (I) і метформіну, що міститься у твердому препараті. Тут, ефективна кількість сполуки (I) або її солі становить, наприклад, загалом 1-100 мг/день, переважно 3-50 мг/день, як сполуки (I) для дорослого (маса тіла 60 кг). У випадку гідрохлориду метформіну ефективна кількість становить загалом 50-5000 мг/день, переважно 250-2550 мг/день, для дорослого (маса тіла 60 кг). Частота введення твердого препарату представленого винаходу вищезгаданим ссавцям протягом одного дня становить переважно 1-3 рази в день, більш переважно два рази в день. Особливо переважні приклади твердого препарату представленого винаходу включають наступні: компресійно сформована таблетка, що містить 8,5 мг бензоату сполуки (I) і 1000 мг гідрохлориду метформіну на таблетку; компресійно сформована таблетка, що містить 8,5 мг бензоату сполуки (I) і 500 мг гідрохлориду метформіну на таблетку; компресійно сформована таблетка, що містить 17 мг бензоату сполуки (I) і 500 мг гідрохлориду метформіну на таблетку; і компресійно сформована таблетка, що містить 17 мг бензоату сполуки (I) і 1000 мг гідрохлориду метформіну на таблетку. Оскільки твердий препарат представленого винаходу має конструкцію, де сполука (I) або її сіль, і гідрохлорид метформіну фізично відокремлені один від одного, це надає поліпшену стабільність при зберіганні. Твердий препарат представленого винаходу переважно показує кожне співвідношення площі піку, визначених нижче споріднених речовин RS1 щодо RS6, визначене нижче не більше, чим 0,5 % (більш переважно не більше, чим 0,2 %) високоефективною рідинною хроматографією за наступних умов: після одномісячного зберігання при температурі 40 °C; вологості 22 %ВВ, 33 %ВВ, 44 %ВВ або 57 %ВВ; у відкритому стані. Аналіз може бути виконаний відповідно до способу, описаному в наступному Експериментальному Прикладі 1. [умови високоефективної рідинної хроматографії] (1) колонка: Zorbax SB-CN, 5 мкм, внутрішній діаметр 4,6 ммx25 см (виробник - Agilent) (2) мобільна фаза: мобільна фаза A: очищена вода/ацетонітрил/трифтороцтова кислота = 1900/100/1 (об'ємне співвідношення) мобільна фаза B: очищена вода/ацетонітрил/трифтороцтова кислота = 100/1900/1 (об'ємне співвідношення) (3) програма градієнтного елюювання: від 0 хвилин до 30 хвилин: 99/1 (мобільна фаза A/мобільна фаза B) до 75/25 (мобільна фаза A/мобільна фаза B) від 30 хвилин до 50 хвилин: 75/25 (мобільна фаза A/мобільна фаза В) до 10/90 (мобільна фаза A/мобільна фаза B) від 50 хвилин до 51 хвилини: 10/90 (мобільна фаза A/мобільна фаза B) до 99/1 (мобільна фаза A/мобільна фаза B) від 51 хвилини до 60 хвилин: 99/1 (мобільна фаза A/мобільна фаза B) (постійна) (4) швидкість потоку: 1 мл/хв. (5) детектор: УФ 278 нм (6) температура зразка: приблизно 3 °C - приблизно 10 °C (7) температура колонки: приблизно 20 °C - приблизно 30 °C [споріднені субстанції RS1-RS6] В представленому описі, споріднені субстанції RS1-RS6 - похідні сполуки (I) або її солі, показують відносний час елюювання 0,60±10 %, 1,08±10 %, 1,30±10 %, 1,49±10 %, 1,52±10 % й 1,62±10 %, відповідно, коли час елюювання сполуки (I) є 1,00, визначений високо-ефективною рідинною хроматографією за вищезгаданих умов. Піки цих речовин не помічені в тестах 11 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 зберігання твердих препаратів, що містять гідрохлорид метформіну і вільні від сполуки (I) і її солі. Використовуючи це, споріднені субстанції сполуки (I) можуть бути ідентифіковані. Тут, діапазон зміщення (±10 %), утворюється для кожного відносного часу елюювання споріднених речовин сполуки (I), оскільки час елюювання змінюється залежно від умов вимірювання, таких як температура колонки, розходження партій колонок, співвідношення мобільної фази й т.п… Коли отримана варіація відносного часу елюювання спорідненої субстанції, також отримані зміни у відносному часі елюювання інших споріднених речовин. Однак, порядок елюювання RS1-6 не змінюється. У аналізі високоефективної рідинної хроматографії за вищезгаданих умов споріднені субстанції RS-1-6 і сполука (I) елюювалися в порядку: споріднена субстанція RS-1, сполука (I), споріднена субстанція RS-2, споріднена субстанція RS-3, споріднена субстанція RS-4, споріднена субстанція RS-5 і споріднена субстанція RS-6. Фіг. 1 показує фактично проаналізований варіант реалізації хроматограми. На хроматограмі Фіг. 1, піки спорідненої субстанції RS 1, бензойної кислоти, сполуки (I), спорідненої субстанції RS-2, спорідненої субстанції RS-3, спорідненої субстанції RS-4, спорідненої субстанції RS-5 і спорідненої субстанції RS-6 можуть спостерігатися. [співвідношення площі піку] Співвідношення площі піку показують співідношення кожної площі піку відносно площі піку при допустимому вмісті сполуки (I) як 100, на хроматографі при високоефективній рідинній хроматографії за вищезгаданих умов. Тут, прийнятий вміст сполуки (I) означає вміст сполуки (I), допустимий виробником під час виробництва твердого препарату. Це - вміст сполуки (I) (а саме, вільна форма) обчислений від ваги сполуки (I) або її солі й ваги інших компонентів. Відповідний вміст кількості активного інгредієнта позначений на ярлику або вкладиші виробу. Твердий препарат представленого винаходу й кожний активний інгредієнт, що міститься у твердому препараті, можуть використовуватися в комбінації з одним або більше фармацевтичних агентів, вибраних із терапевтичного агента для діабету, терапевтичного агента для діабетичних ускладнень, терапевтичного агента для гіперліпідемії, антигіпертензивного агента, агента проти ожиріння, сечогінного засобу, антитромботичного агента і т.п. (надалі іноді, скорочено як комбінований препарат). Приклади терапевтичного агента для діабету включають препарати інсуліну (наприклад, препарати інсуліну тварин, екстраговані з бичачої або свинячої підшлункової залози; препарати людського інсуліну, синтезовані генною інженерією, використовуючи Escherichia coli або дріжджі; цинк-інсулін; протамін цинк-інсулін; фрагмент або похідна інсуліну (наприклад, INS-1), оральні препарати інсуліну), сенсибілізатори інсуліну (наприклад, піоглітазон або його сіль (переважно гідрохлорид), розиглітазон або його сіль (переважно малеат), тезаглітазар, рагаглітазар, мураглітазар, едаглітазон, метаглідасен, навеглітазар, AMG-131, THR-0921), інгібітори альфа-глюкозидази (наприклад, воглібоза, акарбоза, міглітол, еміглітат), бігуаніди (наприклад, буформін або його солі (наприклад, хлоргідрат, фумарат, сукцинат)), стимулятори секреції інсуліну [сульфонілсечовина (наприклад, толбутамід, глібенкламід, гліклазид, хлорпропамід, толазамід, ацетогексамід, гліклопірамід, глімепірид, гліпізид, глібузол), репаглінід, натеглінід, мітіглінід або гідрати їх кальцієвих солей], інгібітори дипептидил пептидази IV, крім сполуки (I) (наприклад, вілдагліптин, ситагліптин, саксагліптин, T-6666, TS021), β3 агоністи (наприклад, AJ-9677), агоністи GPR40, агоністи рецептора GLP-1 [наприклад, GLP-1, агент GLP-1MR, NN-2211, AC-2993 (ексендин-4), ВІМ-51077, Aib (8,35) hGLP-l (7,37) NH2, CJC-1131], агоністи аміліну (наприклад, прамлінтид), інгібітори фосфатази фосфотирозину (наприклад, ванадат натрію), інгібітори глюконеогенезу (наприклад, інгібітор фосфорилази глікогену, інгібітор глюкозо-6-фосфатази, антагоніст глюкагону), SGLUT (котранспортер натрійглюкоза) інгібітори (наприклад, T-1095), інгібітори 11β-гідроксистероїд дегідрогенази (наприклад, BVT-3498), адипонектин або його агоністи, інгібітори IKK (наприклад, AS-2868), препарати, що поліпшують резистентність до лептину, агоністи рецепторів соматостатину, активатори глюкокінази (наприклад, Ro-28-1675), GIP (глюкозо-залежний інсулінотропний пептид) і т.п… Приклади терапевтичних агентів для діабетичних ускладнень включають інгібітори альдозоредуктази (наприклад, толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, СТ-112), нейротропні фактори і їх стимулятори (наприклад, NGF, NT-3, BDNF, промотори продукування/секреції нейротрофіну, описані в WO 01/14372 (наприклад, 4-(4хлорфеніл)-2-(2-метил-1-імідазоліл)-5-[3-(2-метилфенокси)пропіл]оксазол)), промотори нервової регенерації (наприклад, Y-128), інгібітори PKC (наприклад, мезилат рубоксистаурину), інгібітори AGE (наприклад, ALT946, пімагедин, бромід N-фенацилтіазолію (ALT766), ALT-711, EXO-226, піридорин, піридоксамін), поглиначі активного кисню (наприклад, тіоктова кислота), церебральні 12 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 вазодилататори (наприклад, тіапурид, мексилетин), агоністи рецепторів соматостатину (наприклад, BIM23190), і апоптозно-сигнальні інгібітори регулювальної кінази-1 (ASK-1). Приклади терапевтичного агента для гіперліпідемії включають інгібітори HMG-CoА редуктази (наприклад, правастатин, симвaстатин, ловаaстатин, аторвастатин, флувастатин, пітавaстатин, розувaстатин або їх сіль (наприклад, натрієва сіль, кальцієва сіль)), інгібітори синтази сквалену (наприклад, сполука, описана у WO 97/10224, наприклад, N-[[(3R, 5S)-1-(3ацетокси-2,2-диметилпропіл)-7-хлор-5-(2,3-диметоксифеніл)-2-oксо-1,2,3,5-тетрагідро-4,1бензоксазепін-3-іл]ацетил]піперидин-4-оцтова кислота), фібрати (наприклад, безафібрат, клофібрат, симфібрат, клінофібрат), інгібітори ACAT (наприклад, авазиміб, ефлуциміб), аніонобмінні смоли (наприклад, холестирамін), пробукол, препарати нікотинової кислоти (наприклад, нікомол, ніцеритрол), етил ікозапентат, фітостерин (наприклад, сойстерол, γоризанол) і т.п… Приклади антигіпертензивного агента включають інгібітори ангіотензин-конвертуючого ферменту (наприклад, каптоприл, еналаприл, делаприл), антагоністи рецепторів ангиотензину II (наприклад, кандесартан цилексетил, лозартан, епрозартан, вальзартан, телмізартан, ірбесартан, тазозартан, 1-[[2 '-(2,5-дигідро-5-oксо-4H-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил]-2етокси-1H-бензімідазол-7-карбонова кислота), антагоністи кальцію (наприклад, манідипін, ніфедипін, амлодипін, ефонідипін, нікардипін), відкривачі калієвих каналів (наприклад, левкромакалім, L-27152, AL 0671, NIP-121), клонідин і т.п… Приклади агентів проти ожиріння включають речовини, що діють на центральну нервову систему (наприклад, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазиндол, фенілпропаноламін, клобензорекс; антагоністи рецепторів MCH (наприклад, SB-568849; SNAP-7941; сполуки, описані в WO 01/82925 й WO 01/87834); антагоністи нейропептиду Y (наприклад, CP 422935); антагоністи каннабіноїдних рецепторів (наприклад, SR-141716, SR-147778); антагоністи греліну, інгібітори панкреатичної ліпази (наприклад, орлістат, цетилістат), β3-агоністи (наприклад, AJ-9677), аноректичні пептиди (наприклад, лептин, CNTF (циліарний нейротрофічний фактор)), агоністи холецистокініну (наприклад, лінтітрипт, FPL-15849), інгібітори засвобвання (наприклад, P-57) і т.п… Приклади діуретиків включають похідні ксантину (наприклад, саліцилат теоброміну натрію, саліцилат теоброміну кальцію), тіазидні препарати (наприклад, етіазид, циклопентіазид, трихлорметіазид, гідрохлортіазид, гідрофлуметіазид, бензилгідрохлортіазид, пенфлутизид, політіазид, метиклотіазид), антиальдостеронові препарати (наприклад, спіронолактон, триамтерен), інгібітори карбоангідрази (наприклад, ацетазоламид), хлорбензолсульфонамідні агенти (наприклад, хлорталідон, мефрузид, індапамід), азосемід, ізосорбід, етакринова кислота, піретанід, буметанід, фуросемид і т.п… Приклади антитромботичного агента включають гепарини (наприклад, гепарин-натрій, гепарин-кальцій, далльтепарин натрій), варфарин (наприклад, варфарин калій), антитромбінові препарати (наприклад, арагатробан), тромболітичні агенти (наприклад, урокіназа, тизокіназа, альтеплаза, натеплаза, монтеплаза, памітеплаза), інгібітори агрегаціїї тромбоцитів (наприклад, гідрохлорид тиклодипіну, цилостазол, етил ікозапентат, берапрост натрій, гідрохлорид сарпогрелату) і т.п… З вищезгаданих комбінованих медикаментів, препарати інсуліну, інгібітори альфаглюкозидази (переважно воглібоза, акарбоза), бігуаніди (переважно гідрохлорид буформіну), сульфонілсечовина (переважно глімепірид) і т.п. переважні. Коли твердий препарат представленого винаходу й супутній препарат використовуються в комбінації, час їх призначення не обмежений, і твердий препарат представленого винаходу й комбінований препарат можуть призначатися суб'єкту одночасно або по черзі. Крім того, твердий препарат представленого винаходу й супутній препарат можна призначати як окремі препарати суб'єкту, або твердий препарат представленого винаходу й супутній препарат можна призначати суб'єкту як єдиний препарат, що включає твердий препарат представленого винаходу й супутній препарат. Доза супутнього препарату може бути відповідно визначена на основі клінічно використовуваної дози кожного препарату. Крім того, що співвідношення змішування твердого препарату представленого винаходу й супутнього препарату може бути прийнятно визначене відповідно до суб'єкта, шляху введення, цільового захворювання, стану, комбінації й т.п… Наприклад, коли суб'єкт - людина, супутній препарат може використовуватися в кількості 0,01100 вагових частин на 1 вагову частину твердого препарату представленого винаходу. Використання супутнього препарату таким способом забезпечує переважаючі ефекти такі, як: 1) підсилення активності твердого препарату представленого винаходу або супутнього препарату (синергический ефект дії фармацевтичних агентів), 2) зменшення дози твердого 13 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 препарату представленого винаходу або комбінованого препарату (ефект зменшення дози фармацевтичних агентів у порівнянні з однократним введенням препарату), 3) зменшення побічної дії твердого препарату представленого винаходу або супутнього препарату, і т.п… Приклади Даний винахід детально поянений нижче, посилаючись на Приклади одержання, Порівняльні приклади одержання, і Експериментальні приклади, які не повинні розглядатися як обмежувальні, і можуть бути модифіковані, в основному не відступаючи від суті представленого винаходу. Як ад'юванти препарату (наприклад, манніт, гідроксипропілметилцелюлоза, гідроксипропілцелюлоза, кросповідон, стеарат магнію, кристалічна целюлоза, полівінілпіролідон, тальк, оксид титану, оксид заліза, поліетиленгліколь) у наступних Прикладах одержання й Порівняльних одержання, використовуються ті, які відповідають Японській Фармакопеї 15-го Видання або Японським Фармацевтичним Ексціпієнтам 2003. Приклад одержання 1 Суміш бензоату (177,08 г) сполуки (I), манніту (262,5 г) і кристалічної целюлози (31,25 г) піддавали грануляції у псевдозрідженому шарі (корпорація Рowrex, модель: Lab-1), розпилюючи водний розчин (292 г) полівінілпіролідону (29,18 г), щоб одержати гранули, що містять сполуку (IA). Окремо, суміш гідрохлориду метформіну (4 63,0 г) і кристалічної целюлози (11,11 г) піддавали грануляції у псевдозрідженому шарі (корпорація POWREX, модель: Lab-1), розпилюючи водний розчин (259 г) полівінілпіролідону (25,93 г.), щоб одержати гранули, що містять гідрохлорид метформіну. Вищезгадані гранули (9,6 г.), що містять сполуку (IA), гранули (432,2 г.), що містять гідрохлорид метформіну і кристалічну целюлозу (CEOLUS KG-802, 25,1 г.), кросповідон (Kollidon CL-F, 24,63 г.) і стеарат магнію (1,48 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 17,5 кН/пуансон (18,5 мм * 10,0 мм, овальна форма), щоб одержати таблетки 1230 мг. Оксид титану (3,76 г.) і оксид заліза (0,043 г.) диспергували в очищеній воді (216 г.), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (60,01 г.), поліетиленгліколь (6 г.) і тальк (2,21 г.) розчиняли або диспергували в очищеній воді (432 г.), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить 8,5 мг бензоату сполуки (I) і гідрохлорид метформіну (1000 мг). Приклад одержання 2 Суміш бензоату (347,01 г.) сполуки (I), манніту (1428,6 г.) і кристалічної целюлози (122,48 г.) піддавали грануляції у псевдозрідженому шарі (корпорація POWREX, модель: FD-3S), розпилюючи водний розчин (1020 г) полівінілпіролідону (102,06 г.), щоб одержати гранули, що містять сполуку (IA). Окремо, суміш гідрохлориду метформіну (1851,9 г.) і кристалічної целюлози (44,44 г.) піддавали грануляції у псевдозрідженому шарі (корпорація POWREX, модель: FD-3S), розпилюючи водний розчин (1037 г.) полівінілпіролідону (103,7 г.), щоб одержати гранули, що містять гідрохлорид метформіну. Вищезгадані гранули (58,8 г.), що містять сполуку (IA), гранули (648 г.), що містять гідрохлорид метформіну і кристалічну целюлозу (CEOLUS KG-802, 39,6 г.), кросповідон (Kollidon CL-F, 39,6 г.) і стеарат магнію (2,4 г.), змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 11,2 кН/пуансон (16,3 мм * 8,1 мм, овальна форма), щоб одержати 660 мг таблетки. Оксид титану (9,65 г.) і оксид заліза (0,1 г.) диспергували в очищеній воді (210 г), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70 г) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600 г), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 18 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить 8,5 мг бензоату сполуки (I) і гідрохлорид метформіну (500 мг). Приклад одержання 3 14 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуку (IA) - вміст гранул (117,7 г.), одержаних у Прикладі Виробництва 2, гідрохлорид метформіну - вміст гранул (648 г.), одержаних у Прикладі Виробництва 2 і кристалічну целюлозу (CEOLUS KG-802, 43,1 г.), кросповідон (Kollidon CL-F, 43,1 г.) і стеарат магнію (2,65 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 13,5 кН/пуансон (16,3 мм * 8,1 мм, овальна форма), щоб одержати таблетки 714 мг. Оксид титану (9,65 г.) і оксид заліза (0,1 г.) диспергували в очищеній воді (210 г), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70 г) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600 г), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 й рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 18 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг). Приклад одержання 4 Сполуку (IA) - вміст гранул (49 г.), одержаних у Прикладі Виробництва 2, гідрохлорид метформіну - вміст гранул (1080 г), одержаних у Прикладі Виробництва 2 і кристалічну целюлозу (CEOLUS KG-802, 63,1 г.), кросповідон (Kollidon CL-F, 63,1 г.), і стеарат магнію (3,82 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 16,3 кН/пуансон (18,5 мм * 10,0 мм, овальна форма), щоб одержати 1204 мг таблетки. Оксид титану (9,65 г.) і оксид заліза (0,1 г.) диспергували в очищеній воді (210 г), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70 г) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600 г), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить бензоат (8,1 мг) сполуки (I) і гідрохлорид метформіну (950 мг). Приклад одержання 5 Сполуку (IA) - вміст гранул (98 г.), одержаних у Прикладі Виробництва 2, гідрохлорид метформіну - вміст гранул (1080,2 г.), одержаних у Прикладі Виробництва 2 і кристалічну целюлозу (CEOLUS KG-802, 66 г.), кросповідон (Kollidon CL-F, 66 г.), і стеарат магнію (4,01 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 16,6 кН/пуансон (18,5 мм * 10,0 мм, овальна форма), щоб одержати таблетки 1220 мг. Оксид титану (9,65 г.) і оксид заліза (0,1 г.) диспергували в очищеній воді (210 г), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70 г) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600 г), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить бензоат (15,8 мг) сполуки (I) і гідрохлорид метформіну (930 мг). Приклад одержання 6 Суміш бензоату (364,29 г.) сполуки (I), манніту (1411,8 г.) і кристалічної целюлози (122,5 г.) піддавали грануляції у псевдозрідженому шарі (корпорація POWREX, модель: FD-3S), розпилюючи водний розчин (1020 г) полівінілпіролідону (102,1 г.), щоб одержати гранули, що містять сполуку (IA). Окремо, суміш гідрохлориду метформіну (1851,2 г.) і кристалічної целюлози (44,4 г.) піддавали грануляції у псевдозрідженому шарі (корпорація POWREX, модель: FD-3S), розпилюючи водний розчин (1037 г.) полівінілпіролідону (103,8 г.), щоб одержати гранули, що містять гідрохлорид метформіну. Вагове співвідношення розміру кожної частинки визначали просіюванням гранул (приблизно 50 г), використовуючи сита 30 меш (апертура 500 мкм), 42 меш (апертура 355 мкм), 60 меш (апертура 250 мкм) і 100 меш (апертура 150 мкм), і вимірюванням ваги гранул, що залишаються на кожному ситі й гранул, які проходили через сито 100 меш. 15 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 Результати вимірювання, використовуючи приблизно 50 г гранул, що містять сполуку (IA), були - пасаж 30 меш (0,1 %), пасаж 42 меш (0,1 %), пасаж 60 меш (0,5 %), пасаж 100 меш (30,1 %) і пасаж 100 меш (69,2 %). Таким чином, частки з не менше, ніж 250 мкм - 0,7 %, і частки з менше, ніж 150 мкм становили 69,2 %. Результати вимірювання, використовуючи приблизно 50 г гранул, що містять гідрохлорид метформіну, були: пасаж 30 меш (1,8 %), пасаж 42 меш (0,8 %), пасаж 60 меш (1,0 %), пасаж 100 меш (32,2 %) і пасаж 100 меш (64,2 %). Таким чином, частки з не менше, ніж 250 мкм 3,6 %, і частки з менше, ніж 150 мкм становили 64,2 %. Вищезгадані гранули (39,23 г.), що містять сполуку (IA), гранули (431,9 г.), що містять гідрохлорид метформіну і кристалічну целюлозу (CEOLUS KG-1000, 26,42 г.), кросповідон (Kollidon CL-F, 26,41 г.) і стеарат магнію (1,59 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 15 кН/пуансон (14 мм * 9 мм, овальна форма), щоб одержати таблетки 657 мг. Оксид титану (9,69 г.) і оксид заліза (0,1 г.) диспергували в очищеній воді (209,8 г.), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70,02 г.) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600,2 г.), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище до збільшення ваги кожної таблетки до 18 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить 8,5 мг бензоату сполуки (I) і гідрохлорид метформіну (500 мг). Приклад одержання 7 Сполуку (IA) - вміст гранул (78,39 г.), одержаних у Прикладі Виробництва 6, гідрохлорид метформіну - вміст гранул (432 г.), одержаних у Прикладі Виробництва 6 і кристалічну целюлозу (CEOLUS KG-1000, 28,76 г.), кросповідон (Kollidon CL-F, 28,73 г.) і стеарат магнію (1,76 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 15 кН/пуансон (14 мм x 9 мм, овальна форма), щоб одержати таблетки 712 мг. Оксид титану (9,64 г.) і оксид заліза (0,099 г.) диспергували в очищеній воді (210,1 г.), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70,45 г.) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600,2 г.), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 18 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг). Приклад одержання 8 Сполуку (IA) - вміст гранул (22,13 г.), одержаних у Прикладі Виробництва 6, гідрохлорид метформіну - вміст гранул (485,9 г.), одержаних у Прикладі Виробництва 6 і кристалічну целюлозу (CEOLUS KG-1000, 28,39 г.), кросповідон (Kollidon CL-F, 28,37 г.) і стеарат магнію (1,71 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 20 кН/пуансон (18,5 мм * 11,5 мм, овальна форма), щоб одержати таблетки 1259 мг. Оксид титану (9,69 г.) і оксид заліза (0,1 г.) диспергували в очищеній воді (209,8 г.), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70,02 г.) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600,2 г.), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить 8,5 мг бензоату сполуки (I) і гідрохлорид метформіну (1000 мг). Приклад одержання 9 Сполуку (IA) - вміст гранул (4 4,12 г.), одержаних у Прикладі Виробництва 6, гідрохлорид метформіну - вміст гранул (486 г.), одержаних у Прикладі Виробництва 6 і кристалічну целюлозу (CEOLUS KG-1000, 29,7 г.), кросповідон (Kollidon CL-F, 29,71 г.) і стеарат магнію (1,8 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску 16 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 таблетування 20 кН/пуансон (18,5 мм * 11,5 мм, овальна форма), щоб одержати таблетки 1314 мг. Оксид титану (9,64 г.) і оксид заліза (0,099 г.) диспергували в очищеній воді (210,1 г.), щоб одержати рідку дисперсію 1. Гідроксипропілметилцелюлозу (70,45 г.) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600,2 г.), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: Hicoater-міні), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (1000 мг). Приклад одержання 10 Суміш гідрохлориду метформіну (1666 г.) і кристалічної целюлози (27,37 г.) піддавали грануляції у псевдозрідженому шарі (корпорація POWREX, модель: FD-3S), розпилюючи водний розчин (1000 г) полівінілпіролідону (100 г), щоб одержати гранули, що містять гідрохлорид метформіну. Гідрохлорид метформіну - вміст гранул (1435,2 г.), кристалічну целюлозу (80 г), кросповідон (80 г) і стеарат магнію (4,8 г.) змішували, щоб одержати порошкову суміш, що містить гідрохлорид метформіну. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 16,5 кН/пуансон (18,5 мм * 10 мм, овальна форма), щоб одержати 1200 мг таблетки гідрохлориду метформіну. Гідроксипропілцелюлозу (21,61 г.) і тальк (2,4 г.) розчиняли або диспергували в очищеній воді (275,9 г.), щоб одержати рідину для покриття проміжного шару. Крім того, гідроксипропілцелюлозу (3,21 г.), манніт (68,3 г.) і бензоат (8,52 г.) сполуки (I) розчиняли в очищеній воді (720 г), щоб одержати Сполуку (IA) - вміст рідини для покриття. Оксид титану (9,64 г.) і оксид заліза (0,099 г.) диспергували в очищеній воді (210 г), щоб одержати рідку дисперсію 1. Гідроксипропілцелюлозу (70 г) і тальк (10,25 г.) розчиняли або диспергували в очищеній воді (600 г), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття верхнього шару. Використовуючи машину для нанесення покриття (Корпорація Freund, модель:Міні-Hicoater), рідину для покриття проміжного шару висушували розпиленням на таблетки гідрохлориду метформіну, до збільшення ваги кожної таблетки до 24 мг, потім Сполуку (IA) - вміст рідини для покриття висушували розпиленням слідом за тим, до збільшення ваги кожної таблетки до 80 мг, і потім рідину для покриття верхнього шару, висушували розпиленням слідом за тим, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містила 8,5 мг бензоату сполуки (I) і гідрохлорид метформіну (1000 мг). Приклад одержання 11 Суміш бензоату (21,216 кг) сполуки (I), (84 кг) манніту і кристалічної целюлози (7,2 кг) піддавали грануляції у псевдозрідженому шарі (Glatt, модель: WSG120), розпилюючи водний розчин (60 кг) полівінілпіролідону (6 кг) і просіювали гранулювальним пристроєм (Quadro Engineering, модель: Comil 194 S), щоб одержати гранули, що містять сполуку (IA). Окремо, суміш гідрохлориду метформіну (100 кг) й кристалічної целюлози (2,4 кг) піддавали грануляції у псевдозрідженому шарі (Glatt, модель: WSG120), розпилюючи водний розчин (28 кг) полівінілпіролідону (5,6 кг) і просіювали гранулювальним пристроєм (Quadro Engineering, модель: Comil 194 S). Були одержані 2 партії у вищезгаданому масштабі виробництва й змішані, щоб одержати гранули, що містять гідрохлорид метформіну. Вищезгадані гранули (19,345 кг), що містять сполуку (IA), гранули (213,186 кг), що містять гідрохлорид метформіну і кристалічну целюлозу (CEOLUS KG-1000, 13,028 кг), кросповідон (Kollidon CL-F, 13,028 кг) і стеарат магнію (0,79 кг), змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (модель KIKUSUI SEISAKUSYO LTD: PEGA1024) при тиску таблетування 15 кН/пуансон (17,6 мм x 8,4 мм, довгаста форма), щоб одержати таблетки 657 мг. Оксид титану (1,235 кг) й червоний оксид заліза (12,8 г.) диспергували в очищеній воді (26,88 кг), щоб одержати рідку дисперсію 1. Гідроксипропілметилцелюлозу (8,96 кг) і тальк (1,312 кг) розчиняли або диспергували в очищеній воді (76,8 кг), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: AQC-170FS), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 18 мг, щоб одержати покриті таблетки, що містять сполуку (I) (6,25 мг, вільна форма) і гідрохлорид метформіну (500 мг) на таблетку. Приклад одержання 12 17 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуку (IA) - вміст гранул (38,727 кг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, гідрохлорид метформіну - вміст гранул (213,396 кг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, кристалічну целюлозу (CEOLUS KG-1000, 14,187 кг), кросповідон (Kollidon CL-F, 14,187 кг) і стеарат магнію (0,8 69 кг), змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (модель KIKUSUI SEISAKUSYO LTD: PEGA1024) при тиску таблетування 14,8 кН/пуансон (17,6 мм * 8,4 мм, довгаста форма), щоб одержати таблетки 712 мг. Оксид титану (1,235 кг) та жовтий оксид заліза (12,8 г.) диспергували в очищеній воді (26,88 кг), щоб одержати рідку дисперсію 1. Гідроксипропілметилцелюлозу (8,96 кг) і тальк (1,312 кг) розчиняли або диспергували в очищеній воді (76,8 кг), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: AQC-170FS), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 18 мг, щоб одержати покриті таблетки, що містять сполуку (I) (12,5 мг, вільна форма) і гідрохлорид метформіну (500 мг) на таблетку. Приклад Виробництва 13 Сполуку (IA) - вміст гранул (9,618 кг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, гідрохлорид метформіну - вміст гранул (211,98 кг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, кристалічну целюлозу (CEOLUS KG-1000, 12,385 кг), кросповідон (Kollidon CL-F, 12,385 кг) і стеарат магнію (0,74 6 кг), змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (модель KIKUSUI SEISAKUSYO LTD: PEGA1024) при тиску таблетування 19,2 кН/пуансон (22 мм * 10,5 мм, довгаста форма), щоб одержати таблетки 1259 мг. Оксид титану (1,235 кг) та жовтий оксид заліза (12,8 г.) диспергували в очищеній воді (26,88 кг), щоб одержати рідку дисперсію 1. Гідроксипропілметилцелюлозу (8,96 кг) і тальк (1,312 кг) розчиняли або диспергували в очищеній воді (76,8 кг), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: AQC-170FS), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки, що містять сполуку (I) (6,25 мг, вільна форма) і гідрохлорид метформіну (1000 мг) на таблетку. Приклад одержання 14 Сполуку (IA) - вміст гранул (19,311 кг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, гідрохлорид метформіну - вміст гранул (212,814 кг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, кристалічну целюлозу (CEOLUS KG-1000, 13,005 кг), кросповідон (Kollidon CL-F, 13,006 кг) і стеарат магнію (0,788 кг), змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (модель KIKUSUI SEISAKUSYO LTD: PEGA1024) при тиску таблетування 24,4 кН/пуансон (22 мм * 10,5 мм, довгаста форма), щоб одержати таблетки 1314 мг. Оксид титану (1,235 кг) та жовтий оксид заліза (12,8 г.) диспергували в очищеній воді (26,88 кг), щоб одержати рідку дисперсію 1. Гідроксипропілметилцелюлозу (8,96 кг) і тальк (1,312 кг) розчиняли або диспергували в очищеній воді (76,8 кг), щоб одержати рідку дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: AQC-170FS), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 36 мг, щоб одержати покриті таблетки, що містять сполуку (I) (12,5 мг, вільна форма) і гідрохлорид метформіну (1000 мг) на таблетку. Приклад одержання 15 Сполуку (IA) - вміст гранул (980,04 мг), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, кристалічну целюлозу (60,16 мг) (CEOLUS KG-1000), кросповідон (59,95 мг) (Kollidon CL-F) і стеарат магнію (5,06 мг) змішували, щоб одержати порошкову суміш, що містить сполуку (IA). Гідрохлорид метформіну - вміст гранул (5,40162 г.), одержаних виробництвом за тим же самим способом, як у Прикладі Виробництва 11, кристалічну целюлозу (CEOLUS KG-1000, 299,01 мг), кросповідон (Kollidon CL-F, 300,1 мг) і стеарат магнію (16,07 мг) змішували, щоб одержати порошкову суміш, що містить гідрохлорид метформіну. Використовуючи настільну портативну таблетувальну машину (ICHIHASHI SEIKI CO., LTD., HANDTAB200), гідрохлорид метформіну - вміст порошкової суміші (601,38 мг) таблетували 18 UA 98799 C2 5 10 15 20 25 30 35 40 45 50 55 60 перший раз при тиску 3 кН/пуансон (17,6 мм х 8,4 мм, довгаста форма), щоб утворити перший шар, і потім одержану сполуку (IA) - вміст порошкової суміші(109,72 мг) додавали, і суміш таблетували при тиску 14 кН/пуансон, щоб одержати двошарову таблетку. Двошарова таблетка шару містила бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг) на таблетку. Приклад одержання 16 Використовуючи настільну портативну таблетувальну машину, (ICHIHASHI SEIKI CO., LTD., HANDTAB200), гідрохлорид метформіну - вміст порошкової суміші (301,19 мг), одержаної в Прикладі Виробництва 15, таблетували при тиску 3 кН/пуансон (17,6 мм * 8,4 мм, довгаста форма), щоб утворити перший шар, потім сполуку (IA) - вміст порошкової суміші (109,34 мг), одержаної у Прикладі Виробництва 15, додавали, і суміш таблетували при тиску 4 кН/пуансон, щоб утворити другий шар, і гідрохлорид метформіну - вміст порошкової суміші (301,73 мг), одержаної в Прикладі Виробництва 15, додатково додавали, і суміш таблетували при тиску 14 кН/пуансон, щоб одержати тришарову таблетку. Тришарова таблетка містила бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг) на таблетку. Приклад одержання 17 Використовуючи настільну портативну таблетувальну машину, (ICHIHASHI SEIKI CO., LTD., HANDTAB200), сполуку (IA) - вміст порошкової суміші (109,2 мг), одержаної у Прикладі Виробництва 15, таблетували при тиску 5 кН/пуансон (7 мм діаметр, кругла форма), щоб одержати внутрішнє ядро таблетки, що містить сполуку (IA). Потім внутрішнє ядро таблетки, що містить сполуку (IA), поміщали в центр гідрохлориду метформіну - вміст порошкової суміші (602,83 мг), одержаної в Прикладі Виробництва 15, і таблетували при тиску 14 кН/пуансон (17,6 мм * 8,4 мм, довгаста форма), щоб одержати пресовану вкриту таблетку. Пресована вкрита таблетка містила бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг) на таблетку. Приклад одержання 18 По-перше, кристалічну целюлозу (CEOLUS KG-1000, 329,79 мг) і кросповідон (Kollidon CL-F, 331 мг) змішували, щоб одержати порошкову суміш для проміжного шару. Використовуючи настільну портативну таблетувальну машину (ICHIHASHI SEIKI CO., LTD., HANDTAB200), гідрохлорид метформіну - вміст порошкової суміші (601,07 мг), одержаної в Прикладі Виробництва 15, таблетували при тиску 3 кН/пуансон (17,6 мм * 8,4 мм, довгаста форма), щоб утворити перший шар, потім порошкову суміш (65,84 мг) для проміжного шару додавали, і суміш таблетували при тиску 3 кН/пуансон, щоб утворити другий шар, і сполуку (IA) - вміст порошкової суміші (110,47 мг), одержаної у Прикладі Виробництва 15, додатково додавали, і суміш таблетували при тиску 14 кН/пуансон, щоб одержати тришарову таблетку. Тришарова таблетка містила бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг) на таблетку. Приклад одержання 19 Використовуючи настільну портативну таблетувальну машину, (ICHIHASHI SEIKI CO., LTD., HANDTAB200), гідрохлорид метформіну - вміст порошкової суміші (301,13 мг), одержаної в Прикладі Виробництва 15, таблетували при тиску 3 кН/пуансон (17,6 мм * 8,4 мм, довгаста форма), щоб утворити перший шар, потім порошкову суміш (33,35 мг) для проміжного шару, одержану в Прикладі Виробництва 18, додавали, і суміш таблетували при тиску 3 кН/пуансон, щоб утворити другий шар, сполуку (IA) - вміст порошкової суміші (109,98 мг), одержаної у Прикладі Виробництва 15, додатково додавали, і суміш таблетували при тиску 3 кН/пуансон, щоб утворити третій шар, порошкову суміш (32,62 мг) для проміжного шару, одержану в Прикладі Виробництва 18, додавали, і суміш таблетували при тиску 3 кН/пуансон, щоб утворити четвертий шар, і потім гідрохлорид метформіну - вміст порошкової суміші (300,62 мг), одержаної в Прикладі Виробництва 15, додавали, і суміш таблетували при тиску 14 кН/пуансон, щоб одержати п'ятишарову таблетку. П'ятишарова таблетка містила бензоат (17 мг) сполуки (I) і гідрохлорид метформіну (500 мг) на таблетку. Порівняльний приклад одержання 1 Суміш бензоату (8,94 г.) сполуки (I), гідрохлорид метформіну (999,7 г.) і кристалічну целюлозу (43,17 г.), піддавали гранулюванню у псевдозрідженому шарі (корпорація POWREX, модель: FD-3S), розпилюючи водний розчин (610 г) полівінілпіролідону (61 г.), щоб одержати гранули, що містять сполуку (IA)/гідрохлорид метформіну. Гранули (1020,5 г.), кристалічну целюлозу (55,95 г.), Ac-Di-Sol (39,19 г.) і стеарат магнію (3,36 г.) змішували, щоб одержати порошкову суміш. Одержану порошкову суміш таблетували, використовуючи роторну таблетувальну машину (KIKUSUI SEISAKUSYO LTD) при тиску таблетування 2 6 кН/пуансон (18,5 мм * 10 мм, овальна форма), щоб одержати таблетки 1220 мг. Оксид титану (4 г.) і оксид заліза (0,4 г.) диспергували в очищеній воді (240,7 г.), щоб одержати рідку дисперсію 1. Гідроксипропілметилцелюлозу 2910 (59,7 г.), поліетиленгліколь (12,1 г.) і тальк (4 г.) розчиняли або диспергували в очищеній воді (480,3 г.), щоб одержати рідку 19 UA 98799 C2 5 10 15 20 25 30 35 40 дисперсію 2. Одержану рідку дисперсію 1 і рідку дисперсію 2 змішували, щоб одержати рідину для покриття. Використовуючи машину для нанесення покриття (Корпорація Freund, модель: міні-Hicoater), рідину для покриття розпилювали на таблетки, одержані вище, до збільшення ваги кожної таблетки до 40 мг, щоб одержати покриті таблетки. Кожна вкрита таблетка містить 8,5 мг бензоату сполуки (I) і гідрохлорид метформіну (1000 мг). Експериментальний приклад 1 Таблетки Прикладів одержання 1-5 і Прикладу одержання 10, і таблетки Порівняльного прикладу одержання 1 поміщали у скляні ємності й піддавали тестуванню на стабільність при зберіганні за умов зберігання, описаних в Таблицях 1-7. Кількість споріднених речовин RS1-6 після даного періоду зберігання показана у Таблицях 1-7. У Таблицях, W означає тиждень, М означає місяць і RT означає відносний час елюювання. Кількість споріднених речовин вимірювали високо-ефективною рідинною хроматографією за наступних умов. У Таблицях кількість споріднених речовин показана співвідношенням площі піку, визначеним вище, коли площа піку, що відповідає прийнятому вмісту сполуки (I) як визначено вище - 100. В Експериментальних прикладах прийнятий вміст сполуки (I) у препаратах Прикладів одержання 1, 2, 4, і 10, так само як Порівняльного прикладу одержання 1 становить 6,25 мг і у препаратах Прикладу одержання 3 і 5-12,5 мг. Виходячи з цих результатів, очевидно, що твердий препарат представленого винаходу має поліпшену стабільність. [Одержання зразка для високоефективної рідинної хроматографії] П'ять таблеток точно зважували й поміщали в мірну колбу на 500 мл. Додавали приблизно 400 мл 0,1 N HСL й, після струшування протягом 30 хвилин, суміш оцінювали з 1N HСL. Після повного змішування частину розчину (приблизно 10 мл) поміщали в скляну пробірку й центрифугували (3000 об./хв, 5 хвилин). Супернатант фільтрували через 0,45 мкм фільтр (GHP Acrodisc 25 мм 0,45 мкм, Japan Pall Corporation), щоб одержати зразок для ВЕРХ. [Умови високоефективної рідинної хроматографії] (1) колонка: Zorbax SB-CN, 5 мкм, внутрішній діаметр 4,6 ммx25 см (виробник - Agilent) (2) мобільна фаза: мобільна фаза A: очищена вода/ацетонітрил/трифтороцтова кислота = 1900/100/1 (об'ємне співвідношення) мобільна фаза B: очищена вода/ацетонітрил/трифтороцтова кислота = 100/1900/1 (об'ємне співвідношення) (3) Програма градієнтного елюювання від 0 хвилин до 30 хвилин: 99/1 (мобільна фаза A/мобільна фаза B) до 75/25 (мобільна фаза A/мобільна фаза B) від 30 хвилин до 50 хвилин: 75/25 (мобільна фаза A/мобільна фаза B) до 10/90 (мобільна фаза A/мобільна фаза B) від 50 хвилин до 51 хвилини: 10/90 (мобільна фаза A/мобільна фаза B) до 99/1 (мобільна фаза A/мобільна фаза B) від 51 хвилини до 60 хвилин: 99/1 (мобільна фаза A/мобільна фаза B) (постійно) (4) швидкість потоку: 1 мл/хв. (5) детектор: УФ 278 нм (6) температура зразка: приблизно 3 °C - приблизно 10 °C (7) температура колонки: приблизно 20 °C - приблизно 30 °C Таблиця 1 RS-1 Приклад одержання 1 ВЧЕ0,60 Початкова
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid preparation comprising alogliptin and metformin hydrochloride
Автори англійськоюYamamoto, Kazumichi, Koyama, Hiroyoshi
Назва патенту російськоюТвердый препарат, включающий алоглиптин и гидрохлорид метформина
Автори російськоюЯмамото Казумичи, Кояма Хиройоши
МПК / Мітки
МПК: A61K 31/155, A61P 3/10, A61K 31/513, A61K 9/24, A61K 9/26
Мітки: включає, препарат, метформіну, гідрохлорид, алогліптин, твердий
Код посилання
<a href="https://ua.patents.su/29-98799-tverdijj-preparat-shho-vklyuchaeh-alogliptin-i-gidrokhlorid-metforminu.html" target="_blank" rel="follow" title="База патентів України">Твердий препарат, що включає алогліптин і гідрохлорид метформіну</a>
Попередній патент: Гарячекатаний сталевий лист або деталь, спосіб їх виготовлення та застосування, зварене з’єднання із сталевого листа або деталі
Наступний патент: Сонячний колектор
Випадковий патент: Система наддування паливних баків космічного апарата