Спосіб одержання 5-арил-2-метил-4-r-3-фуранкарбонових кислот та їх естерів
Номер патенту: 42466
Опубліковано: 10.07.2009
Автори: Горак Юрій Ігорович, Матійчук Василь Степанович, Литвин Роман Зіновійович, Обушак Микола Дмитрович
Формула / Реферат
Спосіб одержання 5-арил-2-метил-4-R-3-фуранкарбонових кислот та їх естерів, що включає взаємодію заміщеного фурану з солями арендіазонію у водно-ацетоновому середовищі за присутності каталізатора - купрум(ІІ) хлориду протягом 2-3 год. при кімнатній температурі, який відрізняється тим, що як заміщені фурани використовують 2-метил-4-R-3-фуранкарбонові кислоти та їх естери, при цьому одержують сполуки загальної формули:
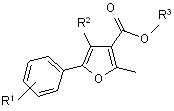 ,
,
де R1 = галоген, NO2, CF3;
R2 = Н, СН3;
R3 = Н, СН3.
Текст
Спосіб одержання 5-арил-2-метил-4-R-3фуранкарбонових кислот та їх естерів, що включає взаємодію заміщеного фурану з солями арендіазонію у водно-ацетоновому середовищі за присутності каталізатора - купрум(ІІ) хлориду протягом 23 год. при кімнатній температурі, який відрізняється тим, що як заміщені фурани використовують 2-метил-4-R-3-фуранкарбонові кислоти та їх естери, при цьому одержують сполуки загальної формули: O R3 R2 O Корисна модель стосується органічної хімії, а саме способів одержання корисних органічних сполук, які можуть бути використані у фармакології, як біологічно активні сполуки. Багато похідних фурану використовують у медицині [Машковский М.Д. Лекарственные средства (14 изд.). М., 2000.Т.1, 2]. Ведуться дослідження біологічної активності похідних арилфурану, зокрема амідів 5-арил-2фуранкарбонових кислот [Kort М.Е., Drizin І, Gregg R.J. et al. Discovery and Biological Evaluation of 5Aryl-2-furfuramides, Potent and Selective Вlockers of the Nav1.8 Sodium Channel with Efficacy in Models of Neuropathic and Inflammatory Pain //J. Med. Chem. 2008. Vol.51. №3. P.407-416; NIAID-Division of AIDS HIV/OI/TB Therapevtics Database, http://chemdb.niaid.nih.gov.] Відомий спосіб одержання 5-арил-2фуранкарбонових кислот, їх естерів, та амідів на їхній основі [Lee S., Yi K.-Y., Hwang S.-K., Lee В.-К, Yoo S.-E., Lee K. (5-Arylfuran-2ylcarbonyl)guanidines as Cardioprotectives through the Inhibition ofNa+/H+ Exchanger Isoform-1 //J. Med. Chem. 2005, Vol.48, P.2882-2890; Jiang W., Sui Z, Macielag M.J., Walsh S.P, Fiordeliso J.J., Lanter J.C., Guan J., Qiu Y., Kraft P., Bhattacharjee S., Craig E., Haynes-Johnson D., John T.M., Clancy J. Furoyl and Benzofuroyl Pyrroloquinolones as Potent and Selective PDE5 Inhibitors for Treatment of Erectile Dysfunction //J. Med. Chem. 2003, Vol.46, P.441444]. Одержують вищезгадані 5-арил-2фуранкарбонові кислоти та їх естери взаємодією естерів 5-бром-2-фуранкарбонової кислоти з арилборними кислотами за реакцією Сузукі у присутності каталізатора - Pd(PPh3)4. Недоліками даного способу є важкодоступність вихідних реагентів та їхня дороговизна. Відомий спосіб одержання 5-арил-2-метил-3фуранкарбонових кислот та їх естерів [Porretta G.С, Scalzo M., Chimenti F., Bolasco A., Biava M. Synthesis and antimicrobial activity of 2-methyl-5-aryl3-furoic acids and 2-methyl-3-imidazolilmethyl-5-aryl furans II Farmaco - 1987. - Vol.42. - P.629-639]. Як вихідні сполуки використовували натрійацетооцтовий естер та w-бромацетофенони, з яких, застосовуючи реакцію алкілювання, одержують ряд етил2-ацетил-4-оксо-4-арилбутанонів. При кип'ятінні останніх з Р2О5 у бензолі відбувається циклізація з утворенням етилових естерів 5-арил-2-метил-3фуранкарбонових кислот, з яких при лужному гідролізі одержують 5-арил-2-метил-3фуранкарбонові кислоти. Цим способом одержують лише деякі представники 5-арил-2-метил-3фуранкарбонових кислот. O (11) 42466 (13) U , UA де R1 = галоген, NO2, CF3; R2 = Н, СН3; R3 = Н, СН3. (19) R1 3 42466 4 Недоліками цього методу є обмеженість кола Поставлена задача досягається тим, що у реагентів, їх важкодоступність та трудомісткість способі одержання 5-арил-2-метил-4-R-3процесу (реагенти необхідно синтезувати окремо у фуранкарбонових кислот та їх естерів, який вклюкілька стадій). чає взаємодію заміщеного фурану з солями аренНайбільш близьким до запропонованого – діазонію у водно-ацетоновому середовищі за принайближчого аналога є спосіб одержання 5-арилсутності каталізатора - купрум(II) хлориду, як 2-фуранкарбонових кислот та їх естерів [Горак Ю., заміщені фурани використовують 2-метил-4-R-3Матійчук В., Литвин P., Обушак М. Арилювання фуранкарбонові кислоти та їх естери, при цьому фуран-2-карбонової кислоти та її естеру і застосуодержують сполуки загальної формули: вання одержаних сполук //Вісн. Львів, ун-ту. Сер. O R3 хім. 2006. Вип. 47. С.193-200], який полягає у взаR2 ємодії 2-фуранкарбонової кислоти або її метилO ового естеру з арендіазоній хлоридами (1:1) у водно-ацетоновому середовищі за присутності каталізатора - купрум(ІІ) хлориду при температурі O 20-40°С. 1 R Недоліком даного способу є низькі виходи де R1 = галоген, NO2, CF3; продуктів у випадку використання багатьох солей R2 = Н, СН3; арендіазонію. R3 - Н, СН3. В основу корисної моделі поставлено задачу Приклади сполук, одержаних запропонованим удосконалити спосіб одержання 5-арил-2-метил-4способом, зведено у таблиці, де виходи наведені R-3-фуранкарбонових кислот та їх естерів шляхом після перегонки у вакуумі або після перекристалівикористання взаємодії легкодоступних сполук зації. Дані спектроскопії ЯМР 1Н та елементного фуранового ряду з солями арендіазонію, що доаналізу підтверджують будову цих сполук. Спектри зволить одержати цільові продукти за значно прознімали на приладі Bruker DRX 500 (500 МГц) у стішою та дешевшою схемою перетворень. ДМСО-D6. Таблиця 5-Арил-2-метил-4-R2-3-фуранкарбонові кислоти та їх естери O R3 R2 O O R1 Номер сполуки R1 R2 R3 Т.пл., °С 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 2 4-NO2 2,4-Сl2 2,5-Сl2 2,6-Сl2 3,5-Сl2 2-Cl-4-NO2 2-NO2-4-Cl 3-NO2-4-CI 2-F 2-Сl 3-CF3 2-Cl-5-CF3 2,5-Сl2 3-NO2 4-NO2 2-NO2-4-Cl 2-NO2-4-OCH3 2,5-Сl2 3,5-Cl2 3,4-Cl2 2-Cl 4-Cl 3 Н Н Н Н H HH H H H H H H CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 СН3 4 Н Н Н H H H H H СН3 СН3 СН3 СН3 СН3 H H H H H H H H H 5 264-265 257-258 283-284 245-246 229-230 253-254 249-250 259-260 127-128 292-293 234-235 257-258 215-216 244-245 254-255 264-265 223-224 212-213 Т.кип., °С/мм рт. ст. 6 130-135/2 152-154/2 146-148/2 150-153/2 Вихід, % 7 42 55 58 50 55 59 59 52 50 45 55 52 31 45 48 44 43 80 76 78 85 82 5 42466 6 Продовження таблиці 1 23 24 25 26 27 28 29 З0 31 32 2 4-Br 2-CF3 2-CI-5-CF3 2-Cl 4-Cl 4-Br 2,5-Cl2 3,5-Cl2 3,4-Сl2 2-Cl-5-CF3 3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 СН3 CH3 CH3 4 Н H H СН3 CH3 СН3 CH3 CH3 CH3 CH3 5 217-218 178-179 207-208 6 136-141/2 145-150/2 159-164/2 155-160/2 168-173/2 167-172/2 145-150/2 7 80 78 81 44 32 37 47 40 35 56 Одержання сполук 1-32 можна проілюструвати наступними прикладами. O R2 + Na2 C R1 O + O де R1 = галоген, NO2, CF3; R2 = Н, СН3; R3 = Н, СН3. Приклад 1 У тришийкову колбу з мішалкою, крапельною лійкою і лічильником бульбашок вносили 12.6 г (0.1 моля) 2-метил-3-фуранкарбонової кислоти, 1 г купрум(ІІ) хлориду і 80 мл ацетону. До одержаного розчину при інтенсивному перемішуванні поступово додавали розчин 2-нітрофенілдіазоній хлориду, одержаний діазотуванням 15.2 г (0.11 моля) 2-нітроаніліну. Після закінчення виділення азоту (2-3 год.) продукт реакції відфільтровували, промивали на фільтрі 200 мл води та перекристалізовували з суміші розчинників спиртдиметилформамід. Вихід 11.9г (40%). Т. топл. 197-198°С. Спектр ЯМР 1Н, d, м.ч.: 2.58 (3Н, с, СН3); 6.92 (1Н, с, 4-Н фуран); 7.70 (1Н, т, J = 7.6, 5-Н С6Н4); 7.78-7.82 (2Н, м, 3,6-Н2 С6Н4); 12.55 (1Н, с, СООН). Сполуки 1-8, 13-25 одержували аналогічно. Приклад 2 У тришийкову колбу з мішалкою, крапельною лійкою і лічильником бульбашок вносили 15.4 г (0.1 моля) метилового естеру 2,4-диметил-3фуранкарбонової кислоти, 1 г купрум(II) хлориду і 80 мл ацетону. До одержаного розчину при інтен Комп’ютерна верстка В. Мацело Me R3 O R3 O R2 CuCl2 H 2O, ацетон O Me R1 сивному перемішуванні поступово додавали розчин 2-трифторметилфенілдіазоній хлориду, одержаний діазотуванням 17.7 г (0.11 моля) 2трифторметиланіліну. Після закінчення виділення азоту (2-3 год) реакційну суміш розводили водою (300 мл), екстрагували трьома порціями хлороформу по 30 мл, сушили сульфатом натрію (7 г). Хлороформ відганяли, залишок переганяли у вакуумі. Вихід 15.5 г (52%). Т. кип. 140-145°С (2 мм рт. ст), nD20 =1,5140. Спектр ЯМР 1Н, d, м.ч.: 2.10 (3Н, с, СН3); 2.59 (3Н, с, СН3); 3.81 (3Н, с, ОСН3); 7.68 (1Н, с, 6-Н феніл); 7.72-7.77 (2Н, м, 3,4-Н2 феніл). Сполуки 9-12, 26-32 одержували аналогічно. Запропонований спосіб дозволяє одержувати 5-арил-2-метил-4-ІІ-3-фуранкарбонові кислоти та їх естери за одну стадію, використовуючи дешеві та легкодоступні вихідні реагенти. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 5-aryl-2-methyl-4-r-furan-carboxylic acids and esters thereof
Автори англійськоюHorak Yurii Ihorovych, Obushak Mykola Dmytrovych, Matiichuk Vasyl Stepanovych, Lytvyn Roman Zinoviiovych
Назва патенту російськоюСпособ получения 5-арил-2-метил-4-r-3-фуранкарбоновых кислот и их эстеров
Автори російськоюГорак Юрий Игоревич, Обушак Николай Дмитриевич, Матийчук Василий Степанович, Литвин Роман Зиновьевич
МПК / Мітки
МПК: C07D 307/00
Мітки: одержання, 5-арил-2-метил-4-r-3-фуранкарбонових, спосіб, кислот, естерів
Код посилання
<a href="https://ua.patents.su/3-42466-sposib-oderzhannya-5-aril-2-metil-4-r-3-furankarbonovikh-kislot-ta-kh-esteriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-арил-2-метил-4-r-3-фуранкарбонових кислот та їх естерів</a>
Попередній патент: Спосіб профілактики променевої хвороби в експерименті
Наступний патент: Комплексний спосіб підвищення зносостійкості бурякорізальних ножів
Випадковий патент: Гідропристрій для вироблення електроенергії







