N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину гідрохлорид та спосіб його одержання
Номер патенту: 73329
Опубліковано: 15.07.2005
Автори: Бендер Ханс Маркус, Ладстеттер Бернард, БАУМГАРТ Манфред, Герік Рольф
Формула / Реферат
1. N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину гідрохлоридгідрат.
2. Спосіб одержання N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину гідрохлориду формули І
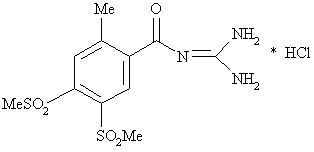 , I
, I
в якій Me є метилом, і гідрохлоридгідрату, який відрізняється тим, що
на першій стадії взаємодією вихідної сполуки формули II
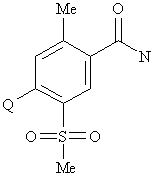 , II
, II
в якій Me - метил, a Q - фтор чи хлор,
з метансульфінатом вводять за допомогою одностадійної реакції нуклеофільною заміною на активованому ароматичному кільці 4-метансульфонільну групу,
потім, на другій стадії, сполуку формули III
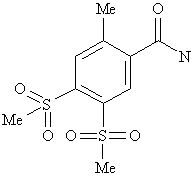 III
III
переводять у кислотний хлорид і піддають реакції з гуанідином з одержанням N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину,
і, на третій стадії, його переводять у гідрохлорид формули І і/або його гідрохлоридгідрат реакцією у водному НСl.
3. Спосіб за п. 2, який відрізняється тим, що на першій стадії застосовують метансульфінат натрію.
4. Спосіб за пп. 2 або 3, який відрізняється тим, що на першій стадії застосовують полярний розчинник.
5. Спосіб за будь-яким з пп. 2-4, який відрізняється тим, що на першій стадії температура реакції має значення між 80 та 140 °С.
Текст
Даний винахід відноситься до N-(4,5-бісметансульфоніл-2-метил-бензоїл)гуанідину гідрохлоридгідрату, а також до способу одержання N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину гідрохлориду і гідрохлоридгідрату. N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідин гідрохлоридгідрат є NHE-1селективним інгібітором Na+/H+ антипортеру. Сульфонілбензоїлгуанідини відомі й описані, наприклад, в ЕР 0758644 A1. Ці речовини є інгібіторами клітинного Na+/H+ антипортеру, тобто вони є активними інгредієнтами, що пригнічують механізм Na+/H+ обміну в клітинах [Dusing і ін., Med. Klin. 1992, 87, 367-384] і є відповідно добрими противоаритмиками, які придатні, зокрема, для лікування аритмії, яка зустрічається як наслідок дефіциту кисню. Ці речовини виявляють хорошу кардіозахисну дію й у такий спосіб особливо придатні для лікування гострого інфаркту міокарда, профілактики інфаркту, постінфарктного лікування, хронічної серцевої недостатності і для лікування стенокардії. Більш того, вони перешкоджають усім патологічним гіпоксичним та ішемічним ушкодженням, дозволяючи лікувати захворювання, вперше чи вдруге ними викликані. Ці активні інгредієнти в такий спосіб придатні і для профілактичного застосування. Завдяки захисній дії цих речовин при патологічних гіпоксичних чи ішемічних ситуаціях, з цього випливають подальші можливі застосування при хірургічних втручаннях для захисту органів з тимчасово зниженою подачею, при трансплантації органів для захисту вилучених органів, при ангіопластичних судинних чи серцевих втручаннях, при ішемії нервової системи, при терапії шокових станів і для запобігання есенціальної гіпертонії. Більш того, ці сполуки також можна застосовувати як терапевтики при захворюваннях, викликаних проліферацією клітин, таких як артеріосклероз, діабет і пізні ускладнення діабету, пухлинні захворювання, фібротичні захворювання, зокрема, гіпертрофія і гіперплазія легень, печінки і нирок. Додатково, сполуки придатні для діагностичного застосування для розпізнавання захворювань, які супроводжуються підвищеною активністю антипортеру Na+/H+, наприклад, еритроцитів, тромбоцитів чи лейкоцитів. Сполуки в такий спосіб можна застосовувати як активні інгредієнти лікувальних препаратів у людській і ветеринарній медицині. Їх, більш того, можна застосовувати як проміжні продукти при одержанні інших активних інгредієнтів лікувальних препаратів. Винахід мав за мету знайти нову високоактивну сполуку, яка характеризується дуже високою здатністю до оральної абсорбції. N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідин, гідрохлоридгідрат виявив себе як високо придатна і високоактивна речовина і відрізняється особливо високою здатністю до оральної абсорбції. N-(4,5бісметансульфоніл-2-метилбензоїл)гуанідин гідрохлоридгідрат таким чином переважно приймається в оральной формі. Абсорбцію зі шлунково-кишкового тракту після орального прийому можна обчислити, порівнюючи концентрації прийнятого активного інгредієнта, знайдені в плазмі крові після орального і інтравенного введення (дозстандартизований AUCpo/AUCiv) [AUC=площа під кривою]. У пацюків проявлявся рівень абсорбції 98% (прийнятої орально радіоактивно маркованої речовини). Біодоступності гідрохлоридгідрату в межах від 88% до 99% були виявлені в собак, а в 2 мавп - 75% і 96%. Так як рівень абсорбції щонайменше дорівнює чи більше, ніж визначена біодоступность, у цих видів тварин також була виявлена дуже хороша абсорбція. Винахід, таким чином, відноситься до N-(4,5-бісметансульфоніл-2-метил-бензоїл)гуанідину гідрохлоридгідрату. Цей винахід варто розглядати як вибірковий винахід стосовно ЕР 0758644. Оскільки ця речовина є дуже багатообіцяючою, її одержання становить особливий інтерес. Одержання вільної N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідинової основи і її аналогів було описано в ЕР 0758644 A1, згаданому вище. Однак, відомі синтези включають велику кількість окремих стадій, деякі з який мають незадовільні виходи продукту, і які також містять забруднюючі навколишнє середовище і небезпечні умови реакцій, такі як, наприклад, реакція з метилмеркаптамом чи окислювання тіоефіру з одержанням сульфону. Таким чином, становить великий інтерес виявлення удосконаленого способу одержання N-(4,5бісметансульфоілл-2-метилбензоїл)гуанідину, його гідрохлориду і гідрохлоридгідрату. Таким чином, метою дійсного винаходу було знайти новий варіант синтезу для Na+/H+ антипортеру, який коротший, а також більш ефективний у порівнянні зі звичайними методами. Винахід відноситься до способу одержання бензоїлгуанідинового похідного N-(4,5-бісметансульфоніл-2метилбензоїл)гуанідин гідрохлориду формули І: в якій Me являє собою метил, і гідрохлоридгідрату, який відрізняється тим, ще по-перше, реакцією вихідної сполуки формули II в якій Me є метильна група, a Q являє собою фтор чи хлор, з метансульфінатом нуклеофільною заміною на активованому метансульфонільную групу вводять за допомогою одностадійної реакції, потім, у другій стадії, сполуку формули III ароматичному кільці 4 переводять у кислотний хлорид і піддають реакції з гуанідином з одержанням N-(4,5бісметансульфоніл-2-метилбензоїл)гуанідину, і, на третій стадії, переводять у гідрохлорид формули І і/або його гідрохлоридгідрат реакцією у водному НС1. Вихідну сполуку формули II одержують, наприклад, виходячи з 2-бромо-5-хлоротолуоу за допомогою галоген-металевого обміну й обробки СО2 з одержанням 4-хлоро-2-метилбензойної кислоти, після чого йде реакція 4-хлоро-2-метилбензойної кислоти з хлоросульфоновою кислотою, сульфатом натрію і метилйодидом з одержанням 4-хлоро-2-метил-5-метилсульфонілбензойної кислоти або реакцією 2-бромо5-хлоротолуолу з метансульфоновою кислотою і тіонілхлоридом у реакції типу Фріделя-Крафтса (FriedelCrafts) у присутності каталізатора Фріделя-Крафтса з одержанням 4-хлоро-2-метил-4метилсульфонілфенилброміду, після чого здійснюють обмін брому на карбоксильную групу за допомогою каталізованої палладієм реакції карбонілювання в автоклаві при надатмосферному тиску і при підвищеній температурі з одержанням 4-хлоро-2-метил-5-метилсульфонілбензойної кислоти. Обрані умови реакції відомі з літератури [літ.: Houben-Weyl, Methoden der Organ. Chemie [Методи органічної хімії], Georg-ThiemeVerlag, Stuttgart]. Однак, також можливо застосовувати інші способи, що відомі з літератури, але не пояснюються тут більш детально, для одержання сполук формули II. Термін метансульфінат означає сіль лужного металу метансульфінової кислоти, зокрема, метансульфінат натрію чи метансульфінат калію, чи сіль метансульфінової кислоти і лужноземельного металу, зокрема, метансульфінат кальцію чи метансульфінат магнію. Особлива перевага віддається застосуванню метансульфінату натрію. Реакцію сполуки формули II з метансульфінатом, переважно метансульфінатом натрію, проводять аналогічно способу [A. Ulman і ін., J. Org. Chem. 1989, 54, 4691-4692]. Реакцію переважно проводять у полярному розчиннику і при температурах реакції між 10 і 200, переважно між 50 і 180, особливо переважно між 80 і 140. Особливо кращими розчинниками є диметилсульфоксид (DMSO), N,N-диметилформамід (DMF) чи 1-метил-2-пірролідон (NMP), особливо переважно DMF чи NMP. Метансульфінат звичайно застосовують у надлишку. При згаданих умовах реакції утвориться винятково 4,5-бісметансульфоніл-2метилбензойна кислота формули III. Гуадинування сполуки формули II на стадії 2 не обмежено методом кислотного хлориду, при якому, наприклад, сполуку формули III піддають реакції з тіонілхлоридом з одержанням кислотного хлориду, а далі з гуанідином. Існує велика кількість способів, відомих з літератури, що дають можливість введення гуанідинової групи [наприклад, із стандартних робіт, таких як Houben-Weyl, Methoden der organischen Chemie [Методи органічної хімії], Georg-Thieme-Verlag, Stuttgart]. Для гуанідинування на стадії 2 можливо, серед іншого, піддавати вільну кислоту формули III реакції з N(бензилоксикарбоніл)гуанідином, з наступним видаленням бензилоксикарбонільної захисної групи (скорочення=2), звільняючи гуанідинову групу, як описано в DE 19919349. Для одержання бензилоксикарбонілгуанідину, [див. М. Goodman і ін., РСТ Int. Заявка WO 9852917, 1998, К. Nowak, Rocz. Chem. 1969, 43, 231-232 чи R. Krug і К. Nowak, Rocz. Chem. 1967, 41, 1087-1091]. Зв'язування проводять за допомогою відомого способу Мікаями, [див. Т. Mukaiyama, Angew. Chem., hit. Ed. Engl. 1979, 18, 707-721]. Видалення Z-захисної групи за допомогою каталітичної гідрогенації можна проводити при загальних умовах для цього [літ.: T.W. Greene, P.G.M. Wuts, Protective Groups in Organic Chemistry, 2-і Изд., Wiley, New York 1991 чи P.J. Kocienski, Protecting Groups, 1-і Изд., Georg Thieme Veriag, Stuttgart - New York, 1994]. Основу N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідин, отриману відповідно до винаходу на стадіях 1 і 2 також можна перевести в сіль користуючись способами, відомими з літератури за допомогою кислот, відмінних від НСІ. Кислоти, які придатні для цієї мети описані в ЕР 0785644. У способі, описаному в ЕР 0758644 для одержання сульфонілбензоїлгуанідинів, сульфонільну групу в пара-позиції відносно карбоксильної групи вводять за допомогою нуклеофільного галоген-сірчаного алкильного обміну додатково до наступного окислення одержаного тіофенольного ефіру. Спосіб, що представляється зараз у даному винаході, вводить сульфонільну групу в пара-положення за допомогою одностадійної стадії реакції. Кількість стадій синтезу і витрати на одержання, зв'язані з ним, знижені. Більш того, реакція з метилмеркаптамом і окислення, що потребують застосування необхідних особливих заходів технічної безпеки при великому промисловому масштабі, завдяки можливості утворення перкислоти, відсутні. Таким чином, доступний ефективний спосіб одержання N-(4,5-бic-метансульфоніл-2метилбензоїл)гуанідину, гідрохлориду і його гідрохлоридгідрату, що істотно удосконалений у порівнянні зі способом, відомим дотепер, як у відношенні кількості стадій синтезу, так і у відношенні загального виходу продукту. Навіть без подальших коментарів, допускається, що фахівець у даній області техніки буде здатний використовувати вищенаведений опис у найширшому спектрі. Кращі здійснення способу, таким чином, ледь варто згадати як описове пояснення, що абсолютно не є обмежуючим ніяким чином. Повний зміст усіх заявок і публікацій, згаданих вище і нижче включений в дану заявку як посилання. Усі температури, наведені вище і нижче по тексту дані в °С. Приклад: 1. Синтез 4,5-бісметансульфоніл-2-метилбензойнїй кислоти 6кг 4-хлоро-2-метил-5(метилсульфоніл)бензойної кислоти розчиняють у 15л N,N-диметилформаміду (DMF) при кімнатній температурі (25°С), після чого нагрівають до 50°С. До цього розчину додають 3,6кг метансульфінату натрію. Внутрішню температуру потім піднімають до 120°С і перемішують при цій температурі протягом 2 днів, після чого, через 24 години, додають ще 3кг метансульфінату натрію. Після охолодження до 25°С, реакційну суміш вводять у 40л води, і додають 300г активованого вугілля і 1кг діатоміту. До фільтрату додають 5л льоду і по краплях додають 3,5л концентрованої соляної кислоти (рН=1). Рекристалізація з 2пропанолу дає 3,8кг 4,5-бісметансульфоніл-2-метилбензойної кислоти, т.пл. 234-235. 2. Синтез N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину 2.1. синтез кислотного хлориду 15л тіонілхлориду спочатку вводять при 40°С і додають 50мл DMF. Повільно при перемішуванні вводять 3,8кг 4,5-бісметансульфоніл-2-метилбензойної кислоти, і суміш потім перемішують при точці кипіння протягом 1 години. Після охолодження надлишок SOCІ 2 видаляють, а залишок переганяють кілька разів разом з 5л толуолу, одержуючи 4,5-бісметансульфоніл-2-метилбензоїлхлорид, який піддають подальшим реакціям у вигляді неочищеного продукту. 2.2. Синтез гуанідину 1,4кг натрію розчиняють у 15мл киплячого метанолу в захисному газі і розводять ще 10л метанолу. До розчину додають 5,9кг гідрохлориду гуанідину, охолоджують до 20-22°С, і суміш перемішують протягом 1 години. Хлорид натрію, який одержали, потім відфільтровують, а розчин випарюють. Залишок переганяють разом з толуолом, а потім відбирають у 10л DMF. 2.3. Синтез N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину Розчин 4,5-бісметансульфоніл-2-метилбензоїлхлориду, отриманого як описано в 2.1., у 5л DMF по краплях додають при 12°С розчин гуанідину, отриманого як описано в 2.2. Реакційну суміш перемішують при 20°С протягом 5 годин і повільно додають 45л холодної води (0-5°С). Кристали, що випали, відфільтровують і промивають крижаною водою, ацетонітрилом і діетиловим ефіром. Неочищені кристали розчиняють у 315л гарячої суміші ацетонітрил/вода (20:1). Розчин обробляють 200г активованого вугілля, фільтрують і охолоджують до 0°С, одержуючи N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідин у вигляді ацетонітрильного аддукту з виходом 64,8%; т.пл. 233-234°. 3.1. Синтез N-(4,5-бісметансульфоніл-2-метилбензогл)гуанідин гідрохлоридгідрату 2,7кг N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину суспендують в 25л води при 60°С, і додають 10,6л 1Н розчину НСІ. При нагріванні до 80°С одержують прозорий розчин. Розчину дають повільно остудитися, з початком кристалізації при 50°С одержуюють N-(4,5-бісметансульфоніл-2метилбензоїл)гуанідин гідрохлоридгідрат, з виходом 97%, т.пл. 181-188°. 3.2. Синтез N-(4,5-бісметансульфоніл-2-метилбензоіл)гуанідин гідрохлориду N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідин гідрохлоридгідрат, отриманий на стадії 3.1 сушать до постійної ваги при 120°С при зниженому тиску, одержуючи N-[-(4,5-бісметансульфоніл-2метилбензоїл)гуанідин гідрохлорид. 3.3. Синтез N-(4,5-бісметансульфоніл-2-метилбензоіл) гуанідин гідрохлориду суспендують у 25л води при 60°С, і додають 10,6л 1Н розчину НСІ. При нагріванні до 80°С одержують прозорий розчин. Розчину дають повільно остудитися, з початком кристалізації при 50°С. Отриманий N-(4,5-бісметансульфоніл-2метилбензоїл)гуанідин гідрохлорид потім сушать до постійної ваги при 60 С, одержуючи N-(4,5бісметансульфоніл-2-метилбензоїл)гуанідин гідрохлорид.
ДивитисяДодаткова інформація
Назва патенту англійськоюN-(4,5-bismethanesulfonyl-2-methylbenzoyl)guanidine hydrochloride and a method for the preparation thereof
Автори англійськоюBaumgarth Manfred
Назва патенту російськоюN-(4,5-бисметансульфонил-2-метилбензоил)гуанидина гидрохлорид и способ его получения
Автори російськоюБаумгарт Манфред
МПК / Мітки
МПК: C07C 315/00, A61P 9/10, A61P 43/00, A61P 9/04, A61K 31/155, A61P 9/06, C07C 317/44
Мітки: n-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину, спосіб, одержання, гідрохлорид
Код посилання
<a href="https://ua.patents.su/3-73329-n-45-bismetansulfonil-2-metilbenzolguanidinu-gidrokhlorid-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">N-(4,5-бісметансульфоніл-2-метилбензоїл)гуанідину гідрохлорид та спосіб його одержання</a>
Попередній патент: Електронний пристрій для розвитку графічних навичок писання з контролем натиску авторучки
Наступний патент: Спосіб біологічного очищення стічної води
Випадковий патент: Спосіб консервування печінки тварин







