3-алкіл-4-іміно-3,4-дигідро-1н-хіназолін-2-они та спосіб їх одержання
Формула / Реферат
1. 3-Алкіл-4-іміно-3,4-дигідро-1Н-хіназолін-2-они загальної формули:
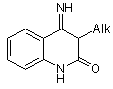 ,
,
де Alk = СН2СН2ОН, CH2CH2NMe2, 2-морфоліноетил, СН2СН2CH2ОН, CH2CH2CH2NMe2, H-C4H9, СН2СН2СН(СН3)2, Н-С6Н13, (1-етилпіролідин-2-іл)метил.
2. Спосіб одержання 3-алкіл-4-іміно-3,4-дигідро-1Н-хіназолін-2-онів, який відрізняється тим, що N-(2-ціанофеніл)-O-фенілкарбамат піддають взаємодії з алкіламінами при нагріванні при 80°С в органічному розчиннику з наступним виділенням цільових продуктів звичайними методами.
Текст
1. 3-Алкіл-4-іміно-3,4-дигідро-1Н-хіназолін-2они загальної формули: 2 3 82735 Задачею винаходу є пошук нових 3алкілзаміщених похідних 4-іміно-3,4-дигідро-1Нхіназолін-2-ону та спосіб їх одержання. Задача досягається 3-алкіл-4-іміно-3,4дигідро-1Н-хіназолін-2-онами, які отримуються модифікацією аміногрупи антранілонітрилу комерційне доступним фенілхлорформіатом з подальшою дією первинними алкіламінами (в тому числі і такими, які містять гідроксильні та аміногрупи в боковому ланцюгу), що відкриває шлях до сполук, які можуть знайти практичне використання як біологічно активні препарати, а також як вихідні речовини для отримання нових фармакологічно важливих похідних 2,4-діоксохіназоліну, зокрема, аналогів антигіпертензивних препаратів SGB-1534 [4,5] та кетансеріну [6,7]. Спосіб одержання сполук, які заявляються полягає в тому, що антраніло-нітрил піддають реакції з фенілхлорформіатом при нагріванні до 110°С в органічному розчиннику, наприклад, толуолі, з подальшою взаємодією утвореного практично з кількісним виходом N-(2-ціанофеніл)-O-фенілкарбамату з первинними алкіламінами при нагріванні до 80°С в органічному розчиннику, наприклад, ацетонітрилі. Проміжні і цільові продукти виділяють із реакційної суміші за допомогою операції фільтрування. Виходи цільових продуктів сягають 76-85%. NH CN PhOC(O)Cl CN NH 2 N H O AlkNH2 OPh N N H Alk O де Alk = СН2СН2OН, CH2CH2NMe2, 2морфоліноетил, СH2СH2CH2ОН, СН2СН2СН2НМe2, Н-С4Н9, СН2СН2СН(СН3)2, н-С6Н13, (1етилпіролідин-2-іл)метил. Отриманий результат відносно м'якої (80°С) циклоконденсації N-(2-ціанофеніл)-0фенілкарбамату з широким набором первинних амінів е є очікуваним, оскільки раніше було встановлено, що близький за будовою 4-(2,3,4,5тетрагідро-5-метил-3-оксо-6-піридазиніл)-N(етоксикарбоніл)акрило-нітрил [8] зазнає циклізації до відповідного 4-іміно-3-метил-7-(4-метил-6-оксо1,4,5,6-тетрагідропіридазин-3-іл)-3,4-дигідро-1Нхіназолін-2-ону при взаємодії з метиламіном тільки при нагріванні в розчині диметилсульфоксиду до 150°С, а 6-етоксикарбоніламінохінолін-5карбонітрил [9] перетворюється в 2-бензил-1-іміно3-оксо-1,2,3,4-тутрагідропіридо [3,2-і]хіназолін також при нагріванні з бензиламіном в розчині диметилформаміду при 150°С. Така відмінність в поведінці Н-(2-ціанофеніл)O-фенілкарбамату і його етильних аналогів, очевидно, обумовлена значним підвищенням електрофільності карбонільної групи карбаматного фрагмента, викликаного електро-ноакцепторним впливом фенільного замісника. Будова та склад всіх отриманих 3-алкіл-4іміно-3,4-дигідро-1Н-хіназолін-2-онів доказані даними елементного аналізу, ІЧ-спектрів ( поглинання зв'язків C = N, C = O, N - H) та спектрів ЯМР 1Н (наявність сигналів арильних, алкільних та N-H протонів). 4 Винахід ілюструється способом отримання N(2-ціанофеніл)-O-фенілкар-бамату, загальним способом одержання 3-алкіл-4-іміно-3,4-дигідро-1Нхіназолін-2-онів і наступними прикладами синтезу їх представників. Спосіб одержання N-(2-ціанофеніл)-Oфенілкарбамату. До суспензії 11.8г (10ммоль) антранілонітрилу в 60мл толуолу добавляють при перемішуванні і охолодженні крижаною водою розчин 17.2г (11ммоль) фенілхлорформіату в 20мл толуолу, а потім нагрівають при температурі кипіння протягом 2год. Осад, який утворився при охолодженні, відфільтровують, промивають 40 мл діетилового ефіру і сушать. Вихід 96%, т.топл. 141-142°С. Знайдено, %: С 70.78, Н 4.05, N 11.59. С14Н10О3. Вирахувано, %: С 70.58, Н 4.23, N 11.76. ІЧ-спектр (KBr) : 1720 (C = O), 2245 (C = N), 3330 ( N - H). Спектр ЯМР 1Н (ДМСО-d6): 7.19-7.42м (6Н аром), 7.64дд (2Н аром), 7.76с (1Н аром), 10.28с (1H,NH). Загальний спосіб одержання 3-алкіл-4-іміно3,4-дигідро-1Н-хіназолін-2-онів. Суміш 0.6г (0.25ммоль) N-(2-ціанофеніл)-Oфенілкарбамату і 0.25ммоль відповідного алкіламіну в 10мл ацетонітрилу кип'ятть протягом 3год. Осад, який утворився при охолодженні, відфільтровують, промивають 5 мл діетилового ефіру і сушать. Приклад 1 3-(2-Гідроксиетил)-4-іміно-3,4-дигідро-1Нхіназолін-2-он. Вихід 82%, т.топл. 195-196°С. Знайдено,%: С 58.31; Н 5.59; N 20.65. С10Н11N3О2. Вирахувано, %: С 58.53; Н 5.40; N 20.48.14 спектр (KBr) : 1700 (СО), 3320 (N-Н), 3490 (O-Н). Спектр ЯМР 1H (ДМСО-d6) : 3.58т (2Н, СН2), 4.11т (2Н, СН2), 4.48ш.с (1Н, O-Н), 7.03-7.08м (2Н аром), 7.44т (1Н аром), 8.02д ( 1Н аром), 8.89с (1Н, NH). Приклад 2 3-(2-Диметиламіноетил)-4-іміно-3,4-дигідро1Н-хіназолін-2-он. Вихід 80%, т.топл. 206-207°С. Знайдено, %: С 61.79, Н 7.03, N 24.24. С12Н16N4О. Вирахувано, %: С 62.05, Н 6.94, N 24.12.14 спектр (КВr): 1700 (C = O), 3340 (N-H). Спектр ЯМР 1H (ДМСО-d6): 2.58т (2Н, CH2), 4.13т (2Н, CH2), 7.017.12м (2Н аром), 7.42т (1Н аром), 8.03д (1Н аром), 8.92с (1Н, NH), 10.83 ш.с (1Н, NH). Приклад 3 4-Іміно-3-(2-морфоліноетил)-3,4-дигідро-1Нхіназолін-2-он. Вихід 85%, т.топл. 207-208°С. Знайдено, %: С 61.17, Н 6.70, N 20.20. С14Н18N4O2. Вирахувано, %: С 61.30, Н 6.61, N 20.42. 14 спектр (КВr) : 1695 (СО), 3330 (N - H). Спектр ЯМР 1Н (ДМСО-d6): 2.47-2.51м (4Н, 2СН2), 3.31-3.34м (2Н, СН2), 3.52-3.55м (4Н, CH2), 4.11-4.16м (2Н,СН2), 7.05-7.12м (2Н аром), 7.47т (1Н аром), 8.06д (1Н аром), 8.89с (1Н, NH), 10.73с (1Н, NH). Приклад 4 3-(3-Гідроксипропіл)-4-іміно-3,4-дигідро-1Нхіназолін-2-он. Вихід 85%, т. топл. 172-173°С. Знайдено, %: С 60.39, Н 6.09, 19.26. С11Н13N3O2. Вирахувано, %: С 60.26, Н 5.98, N 19.17. 14 спектр (КВr): 1695 (С = O), 3305, 3390 (N - H), 3530 (O - Н). Спектр ЯМР 1Н (ДМСО-d6): 1.74-1.78м (2Н, CH2), 3.42т (2Н, СН2), 4.08т (2Н, СН2), 7.05-7.10м (2Н 5 82735 аром), 7.44д (1Н аром), 8.03д (1Н аром), 8.86ш.с (1Н, NH), 10.76ш.с (1Н, NH). Приклад 5 3-(3-Диметиламінопропіл)-4-іміно-3,4-дигідро1Н-хіназолін-2-он. Вихід 83%, т. топл. 146-147°С. Знайдено, %: С 63.61, Н 7.25, N 22.91. С13Н18N4О. Вирахувано, %: С 63.39, Н 7.37, N 22.75. 14 спектр (КВr) : 1695 (С = O), 3295, 3360 (N - H). Спектр ЯМР 1H (ДМСО-d6): 1.72-1.77м (2Н, СН2), 2.19с (6Н, 2СН2), 2.31т (2Н, СН2), 3.99т (2Н, СН2), 7.017.08м (2Н аром), 7.41т (1Н аром), 8.03д (1Н аром), 8.82ш.с (1Н, NH), 10. 80ш.с (1Н, NH). Приклад 6 3-Бутил-4-іміно-3,4-дигідро-1Н-хіназолін-2-он. Вихід 78%. Т.топл 209-210°С. Знайдено, %: С 66.20, Н 6.88, N 19.47. C12H15N3O. Вирахуваного: С 66.34, Н 6.96, N 19.34. 14 спектр (KBr) : 1700 (C = O), 3295, 3310 (N - H). Спектр ЯМР 1Н (ДМСО-d6): 0.94т (3Н,СН3), 1.10-1.15м (2Н, CH2), 1.56-1.60м (2Н, CH2), 3.99т (2Н, CH2), 7.01-7.06м (2Н аром), 7.98д (1Н аром), 8.74ш.с (1Н, NH), 10.66ш.с (1Н, NH). Приклад 7 4-Іміно-3-(3-метилбутил)-3,4-дигідро-1Нхіназолін-2-он. Вихід 77%, т.топл. 204-205°С. Знайдено, %: С 67.77, Н 7.39, N 18.12. С13Н17N3О. Вирахувано, %: С 67.51, Н 7.41, N 18.17. 14 спектр (KBr) : 1700 (C = O), 3300 (N - H). Спектр ЯМР 1Н (ДМСО-d6): 0.96д (6Н, 2СН3), 1.49-1.63м (3Н, CH2 + СН), 4.01т (2Н, СН2), 7.02-7.06м (2Н аром), 7.42т (1Н аром), 8.00д (1Н аром), 8.74ш.с. (1Н, NH), 10.67ш.с. (1H,NH). Приклад 8 3-Гексил-4-іміно-3,4-дигідро-1Н-хіназолін-2-он. Вихід 75%, т.топл. 161-162°С. Знайдено, %: С 68.68, Н 7.64, N 16.98. С14Н19N3О. Вирахувано, %: С 67.51, Н 7.41, N 18.17. 14 спектр (KBr) : 1695 (CO), 3330 (N-H). Спектр ЯМР 1Н (ДМСО-d6): 0.86 т (3Н, СН3), 1.23-1.28м (6Н, 3СН2), 1.56-1.59м (2Н, СН2), 3.99т (2Н, СН2), 7.03-7.10м (2Н аром), 7.47т (1Н аром), 8.05д (1Н аром), 8.86с (1Н, NH), 10.71 с (1Y,NH). Приклад 9 4-Іміно-3-[(1-піролідин-2-іл)метил]-3,4-дигідро1Н-хіназолін-2-он. Вихід 83%, т.пл.217-218°С. Знайдено, %: С 66.37, Н 7.23, N 20.41. C15H20N4O. Вирахувано, %: С 66.15, Н 7.40, N 20.57.14 спектр (KBr) : 1690 (С = O), 3290 (N - H). Спектр ЯМР 1Н Комп’ютерна верстка В. Клюкін 6 (ДМСО-d6): 1.04м (3Н, СН3), 1.60-1.68м (4Н, 2СН3), 2.12-2.32м (2Н, 2СН), 2.92-3.03м (3Н, СН2+СН), 3.96-4.04м (2Н, 2СН), 7.04-7.12м (2Н аром), 7.407.45м (1Н аром), 8.03-8.07м (1Н аром), 8.74 ш.с (1Н, NH), 10.87 ш.с. (1Н, NH). Література: 1. ChernJ.-W., Tao P.-L., Yen M.-H., Lu G.-Y„ Shian C.-Y., Lai Y.-J., Chien S.-L., Chan C.-H. Studies on quinazolines. 5. 2,3-Dihydroimidazo[l,2c]quina-zoline derivatives : a novel class of potent and selective ai-adrenoceptor antagonists and antihypertensive agents // J.Med.Chem.- 1993.Vol.36.-P.2196-2207. 2. Kamal A., Sattur P.B. A novel enzymatic cyclization : synthesis ofimidazo-fused quinazolines by Baker's yeast // J.Chem Soc. Chem. Commun.1989.-P.835-836. 3. Kamal A., Sattur P.B. Catalase-mediated cyclization : synthesis of3-allyl-4-iminosubstotuted 2(lH)-quinazolinones and l,3-benzoxazine-3(2H)-ones // Tetrahedron Lett- 1989.- Vol.30 (9).- P.I 133-1134. 4. ЕР. 89,065 (СІ. C07D239/96) 21 Sep 1983. [(Phenylpiperazino)ethyl]qmnazo-linedione derivatives / Nagano H., Takadi M., Kubodera N., Isao M., Huta S., Uchida Y (Chugai Pharmaceutical Co.): Chem. Abstr.-1984,- Vol.100: 6547р. 5. Imagawa J., Sakai K. Further evaluation of the selectivity of a novel antihypertensive agent, SGB1534, for peripheral ai-adrenoceptors in the spinally anesthetized dog // Eur.J. Pharmacol.- 1986.Vol.131.- P.257-264. 6. FozardJ.R. Mechanizm of hypertensive effects ofketanserin // J. Cardiovasc.PharmakoL- 1982.Vol.4.- P.829-838. 7. Cohen M.L., Fuller R. W., Kurz K.D. Evedence thet blood preassure reduction by serotonin antagonist is related to a receptor blockade in spontaneously hypertensive rats // Hypertension (Dallas).- 1983.- Vol.5.- P.676-681. 8. Nomoto Y., Takai H., Ohno Т., Kubo K. Studies on cardiotonic agents. VII. Potent cardiotonic agent KF 15232 with myOfibrillar Ca{2+} sensitizing effect // Chem.Pharm.Bull.- 1991.-Vol.39 (4).- P.900-910. 9. Ohshira Т., Mizuoka M., Tomioka Y., Yamazaki M. Studies on aromatic nitro compounds. III. Reaction of2-nitronaphtalene and 6-nitroquinoline with malononitrile in the presence ofamine // Chem. Pharm. Bull.- 1981.- Vol. 29 (5).-P.1328-1334. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською3-alkyl-4-imino-3,4-dihydro-1h-quinazoline-2-ones and process for the preparation thereof
Автори англійськоюVovk Mykhailo Volodymyrovych
Назва патенту російською3-алкил-4-имино-3,4-дигидро-1н-хиназолин-2-оны и способ их получения
Автори російськоюВовк Михаил Владимирович
МПК / Мітки
МПК: C07D 239/72
Мітки: одержання, спосіб, 3-алкіл-4-іміно-3,4-дигідро-1н-хіназолін-2-они
Код посилання
<a href="https://ua.patents.su/3-82735-3-alkil-4-imino-34-digidro-1n-khinazolin-2-oni-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">3-алкіл-4-іміно-3,4-дигідро-1н-хіназолін-2-они та спосіб їх одержання</a>
Попередній патент: 5-алкіл-2-феніл-4,5-дигідро-2н-піразоло[4,3-с]хіноліни та спосіб їх одержання
Наступний патент: Спосіб визначення похибки кутомірної шкали
Випадковий патент: Опалювальний котел







