5-алкіл-2-феніл-4,5-дигідро-2н-піразоло[4,3-с]хіноліни та спосіб їх одержання
Номер патенту: 82734
Опубліковано: 12.05.2008
Автори: Братенко Михайло Калінікович, Чорноус Віталій Олександрович, Вовк Михайло Володимирович
Формула / Реферат
1. 5-Алкіл-2-феніл-4,5-дигідро-2Н-піразоло[4,3-с]хіноліни загальної формули:
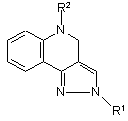 ,
,
де R1=Ph;
R2=Н-С4Н9, н-С6Н11, СН2СН2OН, СН2СН2СН2OН, CH2Ph.
2. Спосіб одержання 5-алкіл-2-феніл-4,5-дигідро-2Н-піразоло[4,3-с]-хінолінів, який відрізняється тим, що N-{[3-(2-хлорфеніл)-1-феніл-4-піразоліл]-метил}-N-алкіламіни піддають нагріванню в диметилформаміді при 150°С в присутності безводного карбонату калію з наступним виділенням цільових продуктів звичайними методами.
Текст
1. 5-Алкіл-2-феніл-4,5-дигідро-2Нпіразоло[4,3-с]хіноліни загальної формули: 2 O N Me S N R1 де R1 = Ph; R2 = Н-С4Н9, н-С6Н11, СН2СН2OН, СН2СН2СН2ОН, CH2Ph та до способу їх отримання. Сполуки даного типу можуть знайти застосування як біологічно активні речовини, а також як вихідні для нових фармацевтичних препаратів. R2 (19) N UA O N N R1 1 де R = Н, Ph, COMe; R2 = Н, 7-ОМе Встановлено, що такі похідні проявляють антиімплантаційну дію [1,2]. Їх синтез є багатостадійним і зводиться до утворення звичайними методами гетероциклічної хімії 2,3-дигідро-1-тозил 3 82734 4(1Н)хінолонів (3 стадії), які затим перетворюють в 3-гідроксиметиленпохідні до яких дією гідразинів апелюють піразольний цикл [1,3]. Одначе в зв'язку з низьким виходом проміжних 2,3-дигідро-1-тозил4(1Н)-хінолонів (до 36%) метод в цілому є не дуже ефективним. Задачею винаходу є пошук нових похідних 4,5дигідро-2Н-піразоло[4,3-с]хіноліну та спосіб їх одержання. Задача досягається 5-алкіл-2-феніл-4,5дигідро-2Н-піразоло[4,3-с]хінолінами, які отримуються внутрішньомолекулярним амінуванням орто-хлорзаміщеного фенільного ядра в N-алкіл-N{[3-(2-хлорфеніл)-4-піразоліл]метил} амінах, що відкриває шлях до сполук, які можуть знайти практичне застосування як фармацевтичні препарати, а також як вихідні речовини в синтезі раніше невідомих типів сполук. Спосіб отримання сполук, які заявляються, полягає в тому, що N-алкіл-{[3-(2-хлорфеніл)-4піразоліл]метил}аміни або їх гідрохлориди піддають нагріванню в диметилформаміді при 150°С в присутності безводного карбонату калію. Цільові продукти виділяють з реакційної суміші стандартними методами у вигляді вільних основ або їх гідрохлоридів. Виходи становлять 59-69%. H Cl N R N R ДМФА, K2CO 3, 1500 C N N Ph N N Ph де, R = Н-С4Н9, H-С6Н11, СН2СН2ОН, CH2CH2CH2OH, CH2Ph Такий результат є принципово новим, оскільки як в науковій, так і в патентній літературі відсутня інформація про можливість утворення піразоловмісних конденсованих гетероциклічних систем за рахунок взаємодії нуклеофільної функціональної групи в положенні 4 і ароматичного ядра в положенні 3 піразольного циклу. Самі N-алкіл-[3-(2-хлорфеніл)-4піразоліл]метиламіни були синтезовані із відповідного 3-(2-хлорфеніл)-1-феніл-4-формілпіразолу за методом [4]. Будова та склад всіх отриманих проміжних сполук та цільових продуктів доказані результатами елементного аналізу, IЧ- та ЯМР'Н спектроскопії і мас-спектроскопії. Винахід ілюструється загальними способами отримання N-алкіл-N-{[3-(2-хлорфеніл)-1-феніл-4піразоліл]метилен} амінів, N-алкіл-N-{[3-(2хлорфеніл)-1-феніл-4-піразоліл]метил}амінів і 5алкіл-2-феніл-4,5-дигідро-2Н-піразоло[4,3с]хінолінів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання N-алкіл-N-{[3-(2хлорфеніл)-1-феніл-4-піразоліл]метилен}амінів. До суміші 5.64г (20ммоль) 3-(2-хлорфеніл)-1феніл-4-формілпіразолу, 20ммоль відповідного аміну в 40мл толуолу додають 5 крапель льодяної оцтової кислоти і кип'ятять з насадкою Діна-Старка протягом 1год. Реакційну суміш охолоджують, осад, що утворився, відфільтровують і кристалізують із суміші бензол-гексан, 5:1. 4 Приклад 1 N-Бутил-N-{[3-(2-хлорфеніл)-1-феніл-4-піразоліл]метилен}амін. Вихід 87%, т.топл. 69-70°С. Знайдено, %: С 70.92; Н 6.08; N 12.28. С20Н20СlN3. Вирахувано, %: С 71.10; Н 5.97; N 12.44. IЧ спектр (КВr): 1665 (C=N). Спектр ЯМР1Н (ДМСО-d6): 0,89т (3Н, СНз), 1.32кв (2Н, СН2), 1.50-1.56м (2Н,СН2), 3.21т (2Н,СН2), 7.36-7.53м (7Н аром.), 7.92д (2Н аром.), 7.97с (1Н, CH=N), 8.87с (1Н, Н5Pyr). Приклад 2 N-Гексил-N-{[3-(2-хлорфеніл)-1-феніл-4-піразоліл]метилен}амін. Вихід 90%, т.топл. 72-74°С. Знайдено, %: С 72.12; Н 6.48; N 11.29. С22Н24СlN3. Вирахувано, %: С 72.22; Н 6.61; N 11.48. ІЧ спектр (КВr): 1660 (C=N). Спектр ЯМР1Н (ДМСО-d6): 0,87т (3Н, СН3), 1.17-1.27м (6Н, 3CH2), 1.53-1.58м (2Н,СН2), 3.45т (2Н,СН2), 7.32-7.55м (7Н аром.), 7.94д (2Н аром.), 7.97с (1Н, CH=N), 8.86с (1Н, Н5Pyr). Приклад 3 2-({[3-(2-Хлорфеніл)-1-феніл-4-піразоліл]метилен}аміно)етанол. Вихід 91%, т.топл. 145-147°С. Знайдено, %: С 66.10; Н 4.87; N 12.72. С13Н16СІN3О. Вирахувано, %: С 66.36; Н 4.95; N 12.90.14 спектр (КВr): 1660 (C=N), 3490 (ОН). Спектр ЯМР1Н (ДМСО-d6) : 3.613.70м (4Н, СН2), 4.49т (1Н, ОН), 7.33-7.54м (7Н аром.), 7.95д (2Н аром.), 7.98с (1Н, CH=N), 8.90с (1Н, Н5Pyr ). Приклад 4 3-({[3-(2-Хлорфеніл)-1-феніл-4-піразоліл]метилен}аміно)пропан-1-ол. Вихід 94%, т.топл. 142-144°С. Знайдено, %: С 66.90; Н 5.23; N 12.50. С19Ні8СlN3О. Вирахувано, %: С 67.16; Н 5.34; N 12.37.ІЧ спектр (КВr) : 1660 (C=N), 3485 (ОН). Спектр ЯМР1Н (ДМСО-d6): 2.512.56м (2Н, СН2), 3.38-3.42м (2Н, СН2), 3.56т (2Н, СН2), 4.29м (1Н, ОН), 7.27-7.53м (7Н аром.), 7.83д (2Н аром.), 8.00 с (1Н, CH=N), 8.43с (1Н, Н5Pyr). Приклад 5 N-Бензил-N-{[3-(2-хлорфеніл)-1-феніл-4-піразоліл]метилен}амін. Вихід 97%, т.топл. 81-83°С. Знайдено, %: С 73.97; Н 4.91; N 11.13. С23Н18СlN3. Вирахувано, %: С 74.29; Н 4.88; N 11.30. ІЧ спектр (КВr) : 1665 (C=N). Спектр ЯМР1Н (ДМСО-d6) : 4.66с (2Н, СН2), 7.26-7.55м (12Н аром.), 7.95д (2Н аром.), 8.16с (1Н, CH=N), 8.95с (1Н, Н5Pyr). Загальний спосіб одержання N-алкіл-N-{[3-(2хлорфеніл)-1-феніл-4-тразоліл]метил}амінів. До суспензії 10ммоль відповідного азометину в 20мл етанолу додають суспензію 1г (26ммоль) борогідриду натрію в 20мл етанолу, нагрівають до кипіння, охолоджують і залишають при кімнатній температурі на 2год, а потім додають 200мл води. Через 1год реакційну суміш екстрагують хлороформом (2х40мл), об'єднані екстракти випарюють у вакуумі. Продукт виділяють у вигляді олії яку обробляють, як вказано в конкретних прикладах. Приклад 6 Гідрохлорид N-Бутил-N-{[3-(2-хлорфеніл)-1феніл-4-піразоліл]метил} аміну. Олієподібний продукт, що утворився при відновленні азометину за загальною методикою, розчиняють в 25мл бензолу, насичують хлороводнем, 5 осад, що утворився, відфільтровують, промивають гексаном і сушать. Вихід 81%, т.топл. 145-147°С. Знайдено, %: С 63.63; Н 5.97; N 11.02. С20Н23С12N3. Вирахувано, %: С 63.83; Н 6.16; N 11.17. Спектр ЯМР1Н (ДМСО-d6) : 0,84 т (3Н, СН3), 1.22-1.26 м (2Н, СH2, 1.52-1.54 м (2Н, CH2, 2.73-2.77 м (2Н, CH2), 3.93 с (2Н, СН2), 7.37-7.6ІМ (7Н аром.), 7.79д (2Н аром.), 9.05с (1Н, Н5Pyr ), 9.52-9.56м (2Н, NH2+). Приклад 7 N-Гексил-N-{[3-(2-хлорфеніл)-1-феніл-4-піразоліл]метил}амін. Олієподібний продукт, що утворюються при відновленні азометину за загальною методикою, кристалізується при стоянні протягом 2-3 діб. Вихід 79%, т.топл. 49-51°С. Знайдено, %: С 72.09; Н 6.78; N 11.26. С22Н26СlN3. Вирахувано, %: С 72.22; Н 6.61; N 11.48. Спектр ЯМР1Н (ДМСО-d6) 0,86т (3Н, СН3), 1.12-1.38м (8Н, 4СН2), 2.45т (2Н, СН2), 3.55с (2Н, СН2), 7.27-7.57м (7Н аром.), 7.82д (2Н аром.), 8.42с (1Н, Н5Pyr), NH-протон знаходиться в обміні с протонами води, що міститься в розчиннику. Приклад 8 2-({[3-(2-Хлорфеніл)-1-феніл-4-піразоліл]метил}аміно)етанол. Олієподібний продукт, що утворюється при відновленні азометину за загальною методикою, кристалізується при стоянні протягом 2-3 діб. Вихід 86%, т.топл. 69-71°С. Знайдено, %: С 65.72; Н 5.45; N 12.63. C18H18ClN3O. Вирахувано, %: С 65.95; Н 5.53; N 12.82. Спектр ЯМР1Н (ДМСО-d6) : 2.60 т (2Н, СН2), 3.42-3.46 м (2Н, CH2), 3.60 с (2Н, CH2), 4.20-4.25 м (1Н, ОН), 7.30-7.49 м (7Н аром.), 7.85 д (2Н аром.), 8.40с (1Н, Н5Pyr), NH-протон знаходиться в обміні с протонами води, що міститься в розчиннику. Приклад 9 3-({[3-(2-Хлорфеніл)-1-феніл-4-піразоліл]метил}аміно)пропан-1-ол. Олієподібний продукт, що утворюється при відновленні азометину за загальною методикою, кристалізується при стоянні протягом 2-3 діб. Вихід 89 %, т.пл. 108-110°С. Знайдено, %: С 66.61; Н 5.77; N 12.14. С19Н20СІN3О. Вирахувано, %: С 66.76; Н 5.90; N 12.29. Спектр ЯМР1Н (ДМСО-d6) : 1.52 т (2Н, СН2), 2.56 т (2Н, СН2), 3.43т (2Н, СН2), 3.54 с (2Н, СН2), 7.26-7.54 м (7Н аром.), 7.82 д (2Н аром.), 8.41 с (1Н, Н5Pyr), ОН и NH-протони заходяться в обміні з протонами води, що міститься в розчиннику. Приклад 10 Гідрохлорид N-бензил-N-{[3-(2-хлорфеніл)-1феніл-4-піразоліл]-метил}аміну. Олієподібний продукт, що утворюється при відновленні азометину за загальною методикою, розчиняють в 25 мл бензолу, насичують хлороводнем, осад, що утворився, відфільтровують, промивають гексаном и сушать. Вихід 84%, т.топл. 195-196°С. Знайдено, %: С 67.11; Н 5.21; N 10.01. С23Н21Сl2N3. Вирахувано, %: С 67.32; Н 5.16; N 10.24. Спектр ЯМР1Н (ДМСО-d6) : 3.93 с ( 2Н, СН2), 4.06 с (2Н, СН2), 7.33-7.53 м ( 12Н аром), 7.78 д (2Н аром), 9.05 с ( 1Н, Н5Pyr), 9.97 ш. с (2Н, NH2+). 82734 6 Загальний спосіб одержання 5-алкіл-2-феніл4,5-дигідро-2Н-піразоло[4,3-с]хінолінів. Суміш 5ммоль відповідного аміну і 3,38г (25ммоль) карбонату калію в 25 мл ДМФА кип'ятять протягом 5 год. Реакційну суміш охолоджують і виливають в 100мл води. Продукт виділяють в вигляді осаду або олії і обробляють як вказано в конкретних прикладах. Приклад 11 Гідрохлорид 5-бутил-2-феніл-4,5-дигідро-2Нпіразоло[4,3-с]хіноліну. Олієподібний продукт, що утворився при нагріванні відповідного аміну за загальною методикою, екстрагують хлороформом (2х50 мл) екстракт сушать над безв. MgSO4, розчинник випаровують, залишок розчиняють в 30мл бензолу і насичують газоподібним хлороводнем. Осад, що утворився, відфільтровують, промивають гексаном і сушать. Вихід 61%, т.топл. 134-136°С. Знайдено, %: С 70.44; Н 6.43; N 12.30. М+ 339. С20Н22ClN3. Вирахувано, %: С 70.68; Н 6.52; N 12.36. М 339.87. Спектр ЯМР1Н (ДМСО-d6) : 0.81т (3Н, СН3), 1.25кв (2Н, СН2), 1.50-1.54 м (2Н, СН2), 2.77т (2Н, СН2), 3.94с (2Н, СН2), 7.34-7.62м (7Н аром.), 7.76д (2Н аром.), 9.05с (1Н, Н5Pyr), 9.53уш.с (1Н, NH+). Приклад 12 5-Гексил-2-феніл-4,5-дигідро-2Н-піразоло[4,3с]хінолін. Твердий продукт, що утворився при нагріванні відповідного аміну за загальною методикою, відфільтровують, промивають водою, сушать і кристалізують з етанолу. Вихід 64%, т.топл. 5051°С. Знайдено, %: С 79.55; Н 7.48; N 12.41. М+331. С22Н25N3. Вирахувано, %: С 79.72; Н 7.60; N 12.68. М 331.46. Спектр ЯМР1Н (ДМСО-d6): 0.86т (3Н, СН3), 1.14-1.36 м (8Н, 4СН2), 2.47т (2Н, СН2), 3.57с (2Н, СН2), 7.27-7.55м (7Н аром.), 7.82 д (2Н аром.), 8.43с (1Н, Н5Pyr). Приклад 13 2-(2-Феніл-2,4-дигідро-5Н-піразоло[4,3-с]хінолін-5-іл)етанол. Твердий продукт, що утворився при нагріванні відповідного аміну за загальною методикою, відфільтровують, промивають водою, сушать і кристалізують з етанолу. Вихід 69%, т.топл. 67-68°С. Знайдено, %: С 74.03; Н 5.71; N 14.50. М+291. C18H17N3O. Вирахувано, %: С 74.21; Н 5.88; N 14.42. М 291.36. Спектр ЯМР1Н (ДМСО-d6): 2.58 т (2Н, СН2), 3.43 т (2Н, СН2), 3.58 с (2Н, СН2), 4.304.34 м (1Н, ОН), 7.29-7.55 м (7Н аром.), 7.84д (2Н аром.), 8.45с (1Н, Н5Pyr). Приклад 14 3-(2-Феніл-2,4-дигідро-5Н-піразоло[4,3-с]хінолін-5-іл)пропан-1-ол. Твердий продукт, що утворився при нагріванні відповідного аміну за загальною методикою, відфільтровують, промивають водою, сушать і кристалізують з етанолу. Вихід 67%, т.топл. 106-107°С. Знайдено, %: С 74.48; Н 6.13; N 13.89. М+ 305. C19H19N3O. Вирахувано, %: С 74.73; Н 6.27; N 13.76. М 305.38. Спектр ЯМР1Н (ДМСО-d6): 1.52т (2Н, СН2), 2.56т (2Н, СH2), 3.43т (2Н, СН2), 3.53с (2Н, СН2), 7.27-7.55м (7Н аром.), 7.82д (2Наром.), 8.41с (1Н, Н5Pyr). ОН-протон заходиться в обміні з протонами води, що містяться в розчиннику. Приклад 15 7 82734 Гідрохлорид 5-бензил-2-феніл-4,5-дигідро-2Нтразоло[4)3-с]хіноліну. Олієподібний продукт, що утворився при нагріванні відповідного аміну за загальною методикою, екстрагують хлороформом (2х50мл), екстракт сушать над безв. MgSO4, розчинник випаровують, залишок розчиняють в 30мл бензолу і насичують газоподібним хлороводнем. Осад, що утворився, відфільтровують, промивають гексаном і сушать. Вихід 59%, т.топл. 191193°С. Знайдено, %: С 73.67; Н 5.24; N 11.03. М+ 373. С23Н20СlN3. Вирахувано, %: С 73.89; Н 5.39; N 11.24. М 373.89. Спектр ЯМР1Н (ДМСО-d6) : 3.97с (2Н, СН2), 4.11с (2Н, СН2), 7.36-7.62м (12Н аром.), 7.81д (2Н аром.), 9.09с (1Н, Н5Pyr), 9.91ш.с (1Н, NH+). Література: 1. Kelkar P.M., Sangwan N.K., Rastogi S.N., Anand N. Studies in antifertility agents: Part XXVII - Synthesis of 2-Acetyl-3-aryl-5-tosyl-7/8-H (or methoxy)3,3^4,5-tetrahydropyrazolo[4,3-c]qumolines // Ind. J. Chem. -1980. - Vol. 19B. - P.297-300. Комп’ютерна верстка В. Клюкін 8 2. Sangwan N.K., Rastogi S.N. Studies in antifertility agents. Part XXXII. Synthesis and stereochemistry of 3,3a-trans- and cis-2(H)-acetyl-3-aryl-3,3adihydropyrazolo[4,3-c]chromenes, pyrazolo[3,4a]benzocycloalk-l-enes and 3,3a-trans- and cis-(2H)acetyl-3-aryl-8-methoxy-5-tosyl-3,3a,4,5tetrahydropyrazolo[4,3-c]quinolines // Ind. J. Chem. 1981. - Vol. 20B. -P.135-139. 3. Sangwan N.K., Kelkar P.M., Rastogi S.N., Anand N. Antifertility agents: Part XLIII - Synthesis of 3Aryl-4?5-dihidro-2-substituted-5-tosyl-2Hpyrazolo[4,3-c]quinolines and 2,4-Dihydro-3-phenyl[ 1 ]benzopyrano[4,3-c]pyrazoles and Their Derivetives// Ind. J. Chem. - 1985. - Vol. 24B. -P.639-644. 4. Братенко М.К., Панимарчук О.И., Чорноус В.А., Вовк М.В. 4- Функционально замещенные 3гетерилпиразолы. XIV. N-Бензил-N-[3арил(гетерил)-4-пиразолил]метиламины и их производные // Журн. орган, химии.- 2005.- Т. 41(1).С.99-103. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською5-alkyl-2-phenyl-4,5-dihydro-2h-pyrazolo[4,3-c]-quinazolines and process for the preparation thereof
Автори англійськоюVovk Mykhailo Volodymyrovych, Bratenko Mykhailo Kalinikovych, Chornous Vitalii Oleksandrovych
Назва патенту російською5-алкил-2-фенил-4,5-дигидро-2н-пиразоло[4,3-с]хинолины и способ их получения
Автори російськоюВовк Михаил Владимирович, Братенко Михаил Калиникович, Черноус Виталий Александрович
МПК / Мітки
МПК: C07D 231/54, C07D 215/06
Мітки: спосіб, одержання, 5-алкіл-2-феніл-4,5-дигідро-2н-піразоло[4,3-с]хіноліни
Код посилання
<a href="https://ua.patents.su/4-82734-5-alkil-2-fenil-45-digidro-2n-pirazolo43-skhinolini-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">5-алкіл-2-феніл-4,5-дигідро-2н-піразоло[4,3-с]хіноліни та спосіб їх одержання</a>
Попередній патент: Пристрій для формування хвилеподібного профілю
Наступний патент: 3-алкіл-4-іміно-3,4-дигідро-1н-хіназолін-2-они та спосіб їх одержання
Випадковий патент: Джерело живлення








