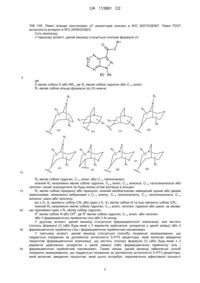
1-(1-метил-1н-піразол-4-іл)-n-((1r,5s,7s)-9-метил-3-окса-9-азабіцикло[3.3.1]-нонан-7-іл)-1н-індол-3-карбоксамід як антагоніст 5-ht3 рецептора
Номер патенту: 113991
Опубліковано: 10.04.2017
Автори: Моненшейн Хольгер, Кікучі Шота, Рейхард Холлі, Хопкінс Марія, Хічкок Стівен, Маклін Тодд, Сунь Хуейкай
Формула / Реферат
1. Сполука 1-(1-метил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]-нонан-7-іл)-1H-індол-3-карбоксамід або його фармацевтично прийнятна сіль.
2. Фармацевтична композиція, яка містить сполуку за пунктом 1 та фармацевтично прийнятний наповнювач.
3. Сполука за пунктом 1 для застосування як лікарського засобу.
Текст
Реферат: Даний винахід забезпечує антагоністи 5-НТЗ рецептора формули (І): R1 O X3 X2 Z X4 X5 X1 N R4 , (I) зокрема 1-(1-метил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]-нонан-7іл)-1H-індол-3-карбоксамід, для лікування захворювань, таких як блювання, біль, зловживання лікарськими засобами, нейродегенеративні й психіатричні розлади, і розлади шлунково UA 113991 C2 (12) UA 113991 C2 кишкового тракту. Також забезпечуються фармацевтичні композиції, які містять такі сполуки, і способи одержання таких сполук. UA 113991 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої належить винахід Даний винахід забезпечує сполуки, які є антагоністами 5-HT3 рецептора й, отже, придатні для лікування захворювань, які піддаються лікуванню шляхом інгібування 5-HT3 рецептора, таких як блювота, біль, зловживання лікарськими засобами, нейродегенеративні й психіатричні розлади, і розлади шлунково-кишкового тракту. Також забезпечуються фармацевтичні композиції, які містять такі сполуки й способи одержання таких сполук. Передумови створення винаходу Рецептори серотоніну типу 3 (5-HT3) є частиною серотонінергічної системи. На відміну від інших рецепторів цієї системи, які всі є рецепторами, зв’язаними з G-білком, 5-HT3 рецептори являють собою керовані лігандами іонні канали й належать до суперродини рецепторів Cysпетлі, яке включає рецептори нікотинового ацетилхоліну, γ-аміномасляної кислоти (GABA)A і гліцину й Zn+2 активованого катіонного каналу (див. Davies et al., 2003, J. Biol. Chem., 278, 712717; Connolly et al., 2004, Biochem Soc Trans 32, 529-534). 5-HT3 рецептори складаються з 5 субодиниць, вибудуваних навколо центральної іоно-провідної щілини, яка проникна для іонів натрію, калію й кальцію (див. Boess et al., 1995, J. Neurochem. 64, 1401-1405; Connolly et al., 2004, Biochem Soc Trans 32, 529-534). Зв'язування серотоніну з 5-HT3 рецепторами відкриває канал, що, у свою чергу, приводить до збудливої відповіді в нейронах. Функціональні дані, описані для 5-HT3 рецепторів, стосуються 5-HT3A або 5-HT3AB рецепторів, оскільки властивості цих підтипів рецепторів найбільш інтенсивно вивчалися останнім часом. Відомо, що 5-HT3 рецептори експресуються в центральній нервовій системі в ділянках, задіяних у блювотний рефлекс, обробку відчуття болю, розпізнавання й контроль тривожності й відіграють роль у патогенезі таких захворювань, як блювота, мігрень, зловживання лікарськими засобами, і нейродегенеративні й психіатричні розлади, такі як тривожність і депресія (див. Hewlett et al., 2003 J. Clin. Psychiatry 64, 1025-1030; Kelley et al., 2003a, Eur J. Pharmacol., 461, 19-25; Haus et al., 2000 Scand J Rheumatol Suppl 113, 55-58; і Faris et al., 2006 J affect Disorder 92, 79-90), розлади травлення (Hammer et al., 1990 Am J Physiol 259, R627-R636, і Jiang & Gietzen 1994 Pharmacol Biochem Behav 47, 59-63), шизофренія (див. Hermann et al. 1996 Biochem Biophys Res Commun 225, 957-960; Sirota et al., 2000 Am J Psychiatry 157, 287-289; Adler et al., 2005 Am J Psychiatry 162, 386-388; Koike et al., Levkovitz et al., 2005 Schizophr Res 76, 6772), порушення пізнавальних здатностей, зв’язані із шизофренією (див. Zhang et al., 2006 Schizophr Res 88, 102-110; Akhondzadeh et al., 2009 Schizophr Res 107, 206-212), порушення пізнавальних здатностей, зв’язані із хворобою Паркінсона, хореєю Хантінгтона, пресинільними деменціями й хворобою Альцгеймера (див. Costall і Naylor 2004 CNS Neurol Disord 3, 27-37) зловживаннями забороненими речовинами й наркоманією (див. Johnson et al., 2002 Psychopharmacology (Berl) 160, 408-413; Johnson, 2004 CNS Drugs 18, 1105-1118; Dawes et al., 2005 Addict Behav 30, 1630-1637, Johnson 2006 Drug Alcohol Depend 84, 256-263), розлади аутичного спектра (див. Anderson et al Neurogenetics 10, 209-216) і біль (див. Kayser et al., 2007 Pain 130, 235; Glaum et al., 1998 Neurosci Lett 95, 313-317; Schworer & Ramadori 1993 Clin Investig 71, 659; Thompson and Lummis 2007 Exp Opin Ther Targets, 11, 527-540). Крім того, 5-HT3 рецептори експресуються в шлунково-кишковому тракті й, отже, можуть бути задіяні в такі розлади шлунково-кишкового тракту, як диспепсія, шлунково-стравохідне рефлюксне захворювання й синдром подразненого кишечнику (див. Graeff 1997 Psychiatr Clin North Am 20, 723; Thompson and Lummis 2007 Exp Opin Ther Targets, 11, 527-540; Barnes et al. 2009 Neuropharmacology 56, 273). Експресія 5-HT3A субодиниці також була виявлена за межами нейронів в імунних клітинах, таких як моноцити, хондроцити, T-клітини, синовіальна тканина й тромбоцити (Fiebich et al., 2004 Scan J Rheumatol Suppl, 9-11, Stratz et al., 2008 Thromb Haemost 99, 784) і 5-HT3A, C-E у межах базальної мембрани в епітелії слизової оболонки травного тракту (Kapeller et al., J Comp Neuro., 2008; 509: 356-371), вказуючи на те, що вона може бути залучена в імунологічні й запальні захворювання, такі як атеросклероз, тендоміопатії й фіброміалгії. 5-HT3 антагоністи зараз дозволені тільки для лікування блювоти або синдрому подразненого кишечнику. Є бажаним відкрити 5-HT3 антагоністи, які можна використовувати для лікування інших захворювань, які піддаються лікуванню за допомогою 5-HT3 рецепторів, такі як шизофренія й порушення пізнавальної здатності, зв’язаної із шизофренією. Даний винахід може задовольнити цю й споріднені потреби. Є бажаним відкрити 5-HT3 антагоністи, які мають бажані фармакокінетичні й фармакодинамічні властивості, такі як селективність у порівнянні з нікотиновими-α7 рецепторами. Певні антагоністи 5-HT3 рецептора описані в US 4,789,763; US 4,803,199; US 4,886,808; US 4,910,193; US 5,334,831; EP 0 469 449; і EP 0 491 664. Певні інгібітори TGF-β описані в EP 1 156 045 і певне лікування нефриту описано в EP1 243 268. Певні антагоністи 5-HT4 описані в EP 0 1 UA 113991 C2 708 105. Певні ліганди нікотинових α7 рецепторів описані в WO 2007/038367. Певні P2X7 антагоністи розкриті в WO 2009/023623. Суть винаходу У першому аспекті, даний винахід стосується сполуки формули (I): 5 де: Z являє собою O або NRa, де Ra являє собою гідроген або C1-6 алкіл; R1 являє собою кільце формули (a)-(h) нижче: 10 15 20 25 30 R2 являє собою гідроген, C1-6 алкіл, або C1-6 галогеналкіл; кожний R3 незалежно являє собою гідроген, C1-6 алкіл, C1-6 алкокси, C1-6 галогеналкокси або галоген і може знаходитися на будь-якому атомі вуглецю в кільцях; R4 являє собою піридиніл або піразоліл, кожний необов’язково заміщений одним або двома замісниками, незалежно вибраними з C1-6 алкілу, C1-6 галогеналкілу, C1-6 галогеналкокси, C1-6 алкокси, ціано або галогену; всі з X1-X4 являють собою CR5 або один з X1-X4 являє собою N та інші являють собою CR5; кожний R5 незалежно являє собою гідроген, C1-6 алкіл, галоген, гідрокси або ціано, за умови, що принаймні один з R5 являє собою гідроген; 5 6 6 X являє собою N або CR , де R являє собою гідроген, C1-6 алкіл, або галоген; або її фармацевтично прийнятна сіль або її N-оксид. У другому аспекті, даний винахід стосується фармацевтичної композиції, яка містить сполуку формули (I) (або будь-який з її варіантів здійснення, розкритих у даній заявці) або її фармацевтично прийнятну сіль і фармацевтично прийнятний наповнювач. У третьому аспекті, даний винахід стосується способу лікування захворювання, що піддається лікуванню за допомогою антагоніста 5-HT3 рецептора, який включає введення пацієнтові фармацевтичної композиції, що містить сполуку формули (I) (або будь-який з її варіантів здійснення, розкритих у даній заявці) і/або фармацевтично прийнятну сіль і фармацевтично прийнятний наповнювач. Таким чином, даний винахід забезпечує спосіб лікування захворювання, що піддається лікуванню за допомогою антагоніста 5-HT3 рецептора, який включає: введення пацієнтові, який цього потребує, терапевтично ефективної кількості 2 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки формули (I) (або будь-якого з її варіантів здійснення, розкритих у даній заявці) або її фармацевтично прийнятної солі. В одному варіанті здійснення третього аспекту, захворювання, яке піддається лікуванню за допомогою антагоніста 5-HT3 рецептора, являє собою блювоту, мігрень, зловживання забороненими речовинами й наркоманію, нейродегенеративні й психіатричні розлади, такі як тривожність і депресія, розлади травлення, шизофренія, порушення пізнавальної функції, зв’язані із шизофренією, хвороба Паркінсона, хорея Хантінгтона, пресинільні деменції й хвороба Альцгеймера, і біль; розлади шлунково-кишкового тракту, такі як диспепсія, шлунковостравохідне рефлюксне захворювання, і синдром подразненого кишечнику; і імунологічні розлади й запалення, такі як атеросклероз, тендоміопатія й фіброміалгія. В іншому варіанті здійснення третього аспекту, захворювання, яке піддається лікуванню за допомогою антагоніста 5-HT3 рецептора, являє собою шизофренію або порушення пізнавальної функції, зв’язані із шизофренією. У четвертому аспекті, сполуку формули (I) (або будь-який з її варіантів здійснення, розкритих у даній заявці) або її фармацевтично прийнятну сіль вводять у комбінації з нейролептичним засобом. В одному варіанті здійснення четвертого аспекту, нейролептичний засіб являє собою AMG 747, бітопертин (RG1678), RG1578, AMG579, GSK1018921, арипіпразол, рисперідон, оланзапін, кветіапін, зипрасидон або клозапін. У п'ятому аспекті, винахід стосується застосування сполуки формули (I) (або будь-якого з її варіантів здійснення, розкритих у даній заявці) або її фармацевтично прийнятної солі як лікарського засобу. У шостому аспекті, винахід стосується сполуки формули (I) (або будь-якого з її варіантів здійснення, розкритих у даній заявці) або її фармацевтично прийнятної солі для застосування для лікування захворювання, яке піддається лікуванню за допомогою антагоніста 5-HT3 рецептора, як розкрито в даній заявці. В одному варіанті здійснення п'ятого й шостого аспектів, застосування призначене для лікування блювоти, мігрені, зловживання забороненими речовинами й наркоманії, нейродегенеративних і психіатричних розладів, таких як тривожність і депресія, розладівтравлення, шизофренії, порушень пізнавальної функції, зв’язаних із шизофренією, хвороби Паркінсона, хореї Хантінгтона, пресинільних деменцій і хвороби Альцгеймера, і болю; розладів шлунково-кишкового тракту, таких як диспепсія, шлунково-стравохідне рефлюксне захворювання, і синдром подразненого кишечнику; і імунологічних розладів і запалення, таких як атеросклероз, тендоміопатія й фіброміалгія. В іншому варіанті здійснення п'ятого й шостого аспектів застосування призначене для лікування шизофренії або порушень пізнавальної функції, зв’язаних із шизофренією, які відомі як порушення когнітивних функцій, зв’язані із шизофренією. У ще іншому варіанті здійснення п'ятого й шостого аспектів, і варіантах здійсненнях, які вони охоплюють, сполуку формули (I) вводять у комбінації з нейролептичним засобом. В одному варіанті здійснення, нейролептичний засіб являє собою AMG 747, бітопертин (RG1678), RG1578, AMG579, GSK1018921, арипіпразол, рисперідон, оланзапін, оланзапін кветіапін, або зипрасидон, клозапін. Докладний опис винаходу Визначення: Якщо спеціально не вказано інакше, наступні терміни, які використовуються в описі й пунктах формули, визначені для цілей даної заявки й мають наступні значення: “C1-6 алкіл” означає лінійний насичений моновалентний вуглеводневий радикал, що складається з одного - шести атомів вуглецю, або розгалужений насичений моновалентний вуглеводневий радикал, що складається із трьох - шести атомів вуглецю, наприклад, метил, етил, пропіл, 2-пропіл, бутил (включаючи всі ізомерні форми), пентил (включаючи всі ізомерні форми), та ін. “C1-6 алкокси” означає -OR радикал, де R являє собою C1-6 алкіл, як визначено вище, наприклад, метокси, етокси, пропокси, або 2-пропокси, н-, ізо-, або трет-бутокси, та ін. “C1-6 галогеналкіл” означає C1-6 алкільний радикал, як визначено вище, який заміщений одним або декількома атомами галогену, переважно одним - п'ятьма атомами галогену, переважно фтором або хлором, включаючи ті, які заміщені різними галогенами, наприклад, CH2Cl, -CF3, -CHF2, -CH2CF3, -CF2CF3, -CF(CH3)2, та ін. Якщо C1-6 алкіл заміщений тільки фтором, то він може позначатися в даній заявці як C1-6 фторалкіл. “C1-6 галогеналкокси” означає -OR радикал, де R являє собою C1-6 галогеналкіл, як визначено вище, наприклад, -OCF3, -OCHF2, та ін. Якщо R являє собою галогеналкіл, де C1-6 алкіл заміщений тільки фтором, то він може позначатися в даній заявці як C 1-6 фторалкокси. “Галоген” означає фтор, хлор, бром, або йод, переважно фтор або хлор. 3 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід також включає проліки сполук формули (I). Термін проліки призначений для позначення ковалентно зв'язаних носіїв, які здатні вивільняти активний компонент формули (I) відповідно, при введенні лікарського засобу ссавцеві. Вивільнення активного компонента відбувається in vivo. Проліки можуть бути приготовлені за допомогою методик, відомих кваліфікованому фахівцеві в даній галузі техніки. Ці методики звичайно модифікують підходящі функціональні групи в даній сполуці. Проте, ці модифіковані функціональні групи регенерують вихідні функціональні групи in vivo або за допомогою стандартних маніпуляцій. Проліки сполук формули (I) включають сполуки, де модифікована гідрокси, аміно, карбоксильна, або подібна група. Приклади проліків включають, але не обмежуючись тільки ними, естери (наприклад, ацетатні, форміатні, і бензоатні похідні), карбамати (наприклад, N,N-диметиламінокарбоніл) гідрокси або аміно функціональні групи в сполуках формули (I)), аміди (наприклад, трифторацетиламіно, ацетиламіно, та ін.), та ін. Проліки сполук формули (I) також охоплюються обсягом даного винаходу. Даний винахід також включає захищені похідні сполук формули (I). Наприклад, якщо сполуки формули (I) містять такі групи, як гідрокси, карбокси, тіол або будь-яку групу, що містить атом (и) нітрогену, ці групи можуть бути захищені підходящими захисними групами. Повний список підходящих захисних груп можна знайти в T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, Inc. (1999), розкриття якого повністю включене в дану заявку як посилання. Захищені похідні сполук формули (I) можуть бути приготовлені за допомогою способів, відомих у даній галузі техніки. “Фармацевтично прийнятна сіль” сполуки означає сіль, яка є фармацевтично прийнятною і яка має бажану фармакологічну активність вихідної сполуки. Такі солі включають: солі приєднання кислот, утворені з неорганічними кислотами, такими як хлоридна кислота, бромідна кислота, сірчана кислота, нітратна кислота, фосфорна кислота, та ін.; або утворені з органічними кислотами, такими як мурашина кислота, оцтова кислота, пропіонова кислота, капронова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, янтарна кислота, яблучна кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, 3-(4гідроксибензоїл)бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, 4-хлорбензолсульфонова кислота, 2нафталенсульфонова кислота, 4-толуенсульфонова кислота, камфорсульфонова кислота, глюкогептонова кислота, 4,4’-метиленбіс-(3-гідрокси-2-ен-1-карбонова кислота), 3фенілпропіонова кислота, триметилоцтова кислота, третинна бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота, та ін.; або солі, утворені, коли протон кислоти, присутній у вихідній сполуці, або замінений іоном металу, наприклад, іоном лужного металу, іоном лужноземельного металу, або іоном алюмінію; або координаційними сполуками з органічною основою, такою як етаноламін, діетаноламін, триетаноламін, трометамін, N-метилглюкамін, та ін. Мається на увазі, що фармацевтично прийнятні солі є нетоксичними. Додаткову інформацію щодо підходящих фармацевтично прийнятних солей можна знайти в Remington’s Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, яка включена в дану заявку як посилання. Сполуки згідно із даним винаходом можуть мати асиметричні центри. Сполуки згідно із даним винаходом, що містять асиметрично заміщений атом, можуть бути виділені в оптично активних або рацемічних формах. У даній галузі техніки добре відомо, як одержати оптично активні форми, наприклад, шляхом розділення речовин. Усі хіральні, діастереомерні, мезо, рацемічні форми охоплюються обсягом даного винаходу, якщо специфічна стереохімія або ізомерна форма специфічно не вказана. Додатково, як використовується в даній заявці, термін C1-6 алкіл і терміни, похідні від нього, включають усі можливі ізомерні форми вказаної C1-6 алкільної групи. Крім того, гетероарил включає всі позиційні ізомери. Також, усі поліморфні форми й гідрати сполуки формули (I) охоплюються обсягом даного винаходу. Терміни “сполука” і “сполука за винаходом” і “сполука згідно із даним винаходом” та ін., і їхні форми множини включають варіант здійснення формули (I) та інші більш кращі варіанти здійснення, охоплювані формулою (I), описані в даній заявці й проілюстровані сполуки, описані в даній заявці, або фармацевтично прийнятну сіль кожного із цих варіантів здійснення. Усі посилання на сполуки, включають усі ізотопи атомів, що містяться в них, включаючи ізотопномічені сполуки. 4 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 Сполуки згідно із даним винаходом існують у вигляді таутомерів. Усі таутомерні форми сполук згідно з винаходом підпадають під обсяг даного винаходу. “Необов'язковий” або “необов'язково” означає, що подія або обставина, описана далі, необов'язково може здійснюватися, і що опис включає приклади, у яких подія або обставина здійснюється, і приклади, у яких не здійснюється. “Фармацевтично прийнятний носій або наповнювач” означає носій або наповнювач, придатний для одержання фармацевтичної композиції, який в цілому безпечний, нетоксичний і не є небажаним біологічно або в інших аспектах, і включає носій або наповнювач, який прийнятний для ветеринарного застосування, а також для фармацевтичного застосування для людей. “Фармацевтично прийнятний носій /наповнювач”, як використовується в описі й у пунктах формули винаходу, включає як один, так і більше одного такого наповнювача. Фармацевтично прийнятні наповнювачі всі відомі в даній галузі, такі ті описані в Remington’s Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985. Терміни “стан,” “розлад,” і “захворювання” стосуються будь-якого патологічного або хворобливого стану. “Лікувати,” “терапія” або “лікування” захворювання включає: (1) запобігання захворювання, тобто запобігання розвитку клінічних симптомів захворювання в ссавця, який може бути підданий або схильний до захворювання, але ще не відчуваються або не проявляються симптоми захворювання; (2) інгібування захворювання, тобто зупинка, контролювання, уповільнення, зупинка, або зменшення розвитку захворювання або його клінічних симптомів; або (3) полегшення захворювання, тобто викликання регресії захворювання або його клінічних симптомів або поліпшення захворювання або його клінічних симптомів Терміни “лікувати,” “терапія,” і “лікування,” не обов'язково вказує на повну елімінацію будьякого або всіх симптомів або лікування захворювання. Як використовується в даній заявці, терміни “пацієнт” і “суб'єкт” включають людей і ссавців, що відрізняються від людей, наприклад, таких ссавців, як миші, щури, морські свинки, собаки, коти, кролики, корови, коні, вівці, кози, і свині. Термін також включає птахів, риб, рептилій, земноводних та ін. Мається на увазі, що більш кращим пацієнтом є людина. Також, більш кращими пацієнтами й суб'єктами є ссавці, що відрізняються від людини, такі як миші, щури й собаки. “Терапевтично ефективна кількість” означає кількість сполуки формули (I) або її фармацевтично прийнятної солі, якої, при введенні в однократній або багаторазових дозах, ссавцеві для лікування захворювання, достатньо для здійснення такого лікування захворювання. “Терапевтично ефективна кількість” буде змінюватися залежно від сполуки, захворювання і його тяжкості й віку, ваги і т.д., ссавця, що піддається лікуванню, ступеню або залучення або тяжкості стану, розладу, або захворювання, відповіді конкретного пацієнта; конкретної сполуки, що вводиться; способу введення; характеристик біодоступності препарату, що вводиться; вибраної схеми дозування; застосування супутніх лікарських препаратів; та інших значимих обставин. Термін “захворювання, яке піддається лікуванню за допомогою антагоніста 5-HT3 рецептора”, включає блювоту, мігрень, зловживання забороненими речовинами й наркоманію, нейродегенеративні й психіатричні розлади, такі як тривожність і депресія, розлади травлення, шизофренія, порушення пізнавальної функції, зв’язані із шизофренією, хвороба Паркінсона, хорея Хантінгтона, пресинільні деменції й хвороба Альцгеймера, і біль; розлади шлунковокишкового тракту, такі як диспепсія, шлунково-стравохідне рефлюксне захворювання, і синдром подразненого кишечнику; і імунологічні розлади й запалення, такі як атеросклероз, тендоміопатія й фіброміалгія. У кращому варіанті здійснення, захворювання являє собою порушення пізнавальної функції, зв’язані із шизофренією, також відомі як порушення когнітивних функцій, зв’язані із шизофренією. Характерні сполуки згідно з винаходом представлені в Таблиці I нижче: 5 UA 113991 C2 Таблиця I № спол. -Z-R 1 Сіль Назва Розр. ММ Спост. МС + (M+1) 1 (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1(піридин-4-іл)-1H-індол-3363,409 ТФО 364,3 карбоксилат, 2,2,2-трифтор7 ацетат 2 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)1-(піридин-3-іл)-1H-індол-3376,451 ТФО 377,2 карбоксамід, 2,2,2-трифтор6 ацетат 3 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)1-(піридин-2-іл)-1H-індол-3376,451 ТФО 377,3 карбоксамід, 2,2,2-трифтор6 ацетат 4 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)1-(піридин-4-іл)-1H-індол-3376,451 ТФО 377,2 карбоксамід, 2,2,26 трифторацетат 5 (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1(піридин-3-іл)-1H-індол-3363,409 ТФО 364,2 карбоксилат, 2,2,2-трифтор7 ацетат 6 N-((1R,5S,7S)-9-метил-d3-3окса-9-азабіцикло[3.3.1]нонан7-іл)-1-(піридин-3-іл)-1H-індолТФО 379,47 3-карбоксамід, 2,2,2-трифторацетат 6 380,3 UA 113991 C2 7 (1R,5S,7S)-9-метил-d3-3-окса9-азабіцикло[3.3.1]нонан-7-іл 1-(піридин-2-іл)-1H-індол-3ТФО карбоксилат, 2,2,2-трифторацетат 8 N-((1R,5S,7S)-9-метил-d3-3окса-9-азабіцикло[3.3.1]нонан7-іл)-1-(піридин-2-іл)-1H-індолТФО 379,47 3-карбоксамід, 2,2,2-трифторацетат 9 (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1(1-метил-1H-піразол-4-іл)-1HТФО 366,414 367,15 індол-3-карбоксилат, сіль 2,2,2-трифтороцтової кислоти 10 11 12 13 14 380,45 381,2 380,3 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)ТФО 1-(піридин-2-іл)-1H-піроло[2,3- 377,44 378,25 b]піридин-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)ТФО 1-(піридин-3-іл)-1H-піроло[2,3- 377,44 378,25 b]піридин-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 5-фтор-N-((1R,5S,7S)-9-метил3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1ТФО (піридин-2-іл)-1H-піроло[2,3395,43 396,30 b]піридин-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 5-фтор-N-((1R,5S,7S)-9-метил3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1ТФО 395,43 396,25 (піридин-3-іл)-1H-піроло[2,3b]піридин-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)ТФО 1-(піридин-2-іл)-1H-індазол-3- 377,44 378,30 карбоксамід, сіль 2,2,2трифтороцтової кислоти 7 UA 113991 C2 15 16 1-(1-метил-1H-піразол-4-іл)-N((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)ТФО 379,456 380,30 1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1ТФО (1-метил-1H-піразол-3-іл)-1H- 366,414 367,20 індол-3-карбоксилат, сіль 2,2,2-трифтороцтової кислоти 17 1-(1-метил-1H-піразол-3-іл)-N((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)ТФО 379,456 380,25 1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 18 (1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1(1-(2-фторетил)-1H-піразол-4ТФО іл)-1H-індол-3-карбоксилат, 412,457 413,30 сіль 2,2,2-трифтороцтової кислоти 19 (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1(2-ціанопіридин-4-іл)-1H-індолТФО 388,419 389,20 3-карбоксилат, сіль 2,2,2трифтороцтової кислоти 20 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)ТФО 1-(2-метилпіридин-3-іл)-1H390,478 391,30 індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 21 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)1-(4-метилпіридин-3-іл)-1HТФО 390,478 391,25 індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 22 (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1(1-метил-1H-піразол-5-іл)-1HТФО 366,414 367,25 індол-3-карбоксилат, сіль 2,2,2-трифтороцтової кислоти 8 UA 113991 C2 23 1-(1-метил-1H-піразол-5-іл)-N((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)ТФО 379,456 380,30 1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 24 N-((1R,5S,7S)-9-метил-3-окса9-азабіцикло[3.3.1]нонан-7-іл)1-(1H-піразол-4-іл)-1H-індол-3ТФО 365,429 366,20 карбоксамід, сіль 2,2,2трифтороцтової кислоти 25 26 27 28 29 1-(1-(дифторметил)-1Hпіразол-4-іл)-N-((1R,5S,7S)-9ТФО метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)1H-індол-3-карбоксамід 415,436 416,30 (1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1ТФО 380,440 381,25 (1-метил-1H-піразол-4-іл)-1Hіндол-3-карбоксилат N-((1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1ТФО 362,425 363,25 (піридин-3-іл)-1H-індол-3карбоксамід N-((1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1ТФО 365,429 366,25 (1-метил-1H-піразол-4-іл)-1Hіндол-3-карбоксамід (1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1ТФО 366,414 367,25 (1H-піразол-4-іл)-1H-індол-3карбоксилат 9 UA 113991 C2 30 31 32 5 10 N-((1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1ТФО 351,402 352,20 (1H-піразол-4-іл)-1H-індол-3карбоксамід N-((1R,5S,7S)-9-етил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1ТФО 393,482 394,35 (1-метил-1H-піразол-4-іл)-1Hіндол-3-карбоксамід 3-(3-(((1R,5S,7S)-9-метил-3окса-9-азабіцикло[3.3.1]нонанТФО 392,451 393,30 7-іл)карбамоїл)-1H-індол-1іл)піридин 1-оксид Варіанти здійснення: Варіант здійснення (A) В одному варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", де Z являє собою O. Варіант здійснення (B) В одному варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", де Z являє собою NR a. У цьому варіанті здійснення, в іншій групі сполук Ra являє собою гідроген. У цьому варіанті здійснення, в іншій групі сполук R a являє собою метил. Варіант здійснення (C) В іншому варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу" і варіантах здійснення (A) і (B) вище й групах, у них, що містяться, в одній групі сполук R1 являє собою кільце формули 15 10 UA 113991 C2 . (а) У групах у варіантах здійснення (C), в одній групі сполук R 1 являє собою кільце формули (a) або (d). В (a), в одному варіанті здійснення, R 1 являє собою кільце формули 5 10 15 (b) У групах у варіантах здійснення (C), в іншій групі сполук R 1 являє собою кільце формули (e), (f) або (g). В (b), в одній групі сполук R1 являє собою кільце формули (e). В (b), в одній групі сполук R1 являє собою кільце формули (f) або (g). В (b), в одній групі сполук R 1 являє собою кільце формули . (i) У групах у варіантах здійснення (C) і варіантах здійснення, які вони включають, тобто, (a) і (b) і групах, які вони включають, в одній групі сполук кожний R 3 незалежно являє собою гідроген або метил. У цих групах сполук в одній групі сполук кожний R3 являє собою гідроген. (ii) У групах у варіантах здійснення (C) і варіантах здійснення, які вони включають, тобто, (a) і (b) і групах, які вони включають, в одній групі сполук кожний R 3 незалежно являє собою гідроген або метил і R2 являє собою гідроген. У цих групах сполук в одній групі сполук R 2 являє собою гідроген і кожний R3 являє собою гідроген. (iii) У групах у варіантах здійснення (C) і варіантах здійснення, які вони включають, тобто, (a) і (b) і групах, які вони включають, в одній групі сполук кожний R3 незалежно являє собою 11 UA 113991 C2 5 10 15 20 25 30 35 40 45 гідроген або метил і R2 являє собою C1-6 алкіл. У цих групах сполук в одній групі сполук R 2 являє собою метил, етил, або пропіл і кожний R3 являє собою гідроген. У цих групах сполук в одній групі сполук R2 являє собою метил і кожний R3 являє собою гідроген. (iv) У групах у варіантах здійснення (C) і варіантах здійснення, які вони включають, тобто, (a) і (b) і групах, які вони включають, в одній групі сполук кожний R 3 незалежно являє собою гідроген або метил і R2 являє собою C1-6 галогеналкіл. У цих групах сполук в одній групі сполук кожний R2 являє собою трифторметил, 2-фторетил, або 2,2,2-трифторетил і кожний R3 являє собою гідроген. У цих групах сполук в одній групі сполук R 2 являє собою трифторметил і кожний R3 являє собою гідроген. (v) У групах у варіантах здійснення (C) і варіантах здійснення, які вони включають, тобто, (a) і (b) і групах, які вони включають, в одній групі сполук кожний R 3 незалежно являє собою гідроген або метил. Варіант здійснення (D) В іншому варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", і варіантах здійснення (A), і (B) вище й групах, які вони включають, в одній групі сполук, де R1 являє собою кільце формули (a1) У групах у варіантах здійснення (D), в одній групі сполук R 1 являє собою кільце формули (c) або (h). У цьому варіанті здійснення, в одній групі сполук стереохімія в хіральному вуглеці являє собою (R) або (S). 1 (b1) У групах у варіантах здійснення (D), в одній групі сполук R являє собою кільце формули (b). (vi) У групах у варіантах здійснення (D) і варіантах здійснення, які вони включають, тобто, (a1) і (b1) і групах, які вони включають, в одній групі сполук кожний R 3 незалежно являє собою гідроген або метил. У цих групах сполук в одній групі сполук кожний R 3 являє собою гідроген. Варіант здійснення (E) В одному варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", і варіантах здійснення (A), (B), (C), і (D) вище й варіантах здійснення, які вони включають, де R4 являє собою піридиніл, необов'язково заміщений одним або двома замісниками, незалежно вибраними з C 1-6 алкілу, C1-6 галогеналкілу, C1-6 галогеналкокси, C1-6 алкокси, ціано або галогену. У групах у варіанті здійснення (E), мається на увазі, що піридиніл представлений формулою нижче: Якщо один з X6-X8 являє собою N і один або два необов'язкові замісники, R7, незалежно вибирають із C1-6 алкілу, C1-6 галогеналкілу, C1-6 галогеналкокси, C1-6 алкокси, ціано або галогену й можуть знаходитися на будь-якому атомі вуглецю. У групах у варіанті здійснення (E), в іншій групі сполук X 6 являє собою N. У групах у варіанті здійснення (E), в іншій групі сполук X7 являє собою N. У групах у варіанті здійснення (E), в іншій групі сполук X8 являє собою N. Варіант здійснення (F) В одному варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", і варіантах здійснення (A), (B), (C), і (D) вище й варіантах здійснення, які вони включають, де R4 являє собою піразоліл, необов'язково 12 UA 113991 C2 заміщений одним або двома замісниками, незалежно вибраними з C 1-6 алкілу, C1-6 галогеналкілу, C1-6 галогеналкокси, C1-6 алкокси, ціано або галогену. У групах у варіанті здійснення (F), мається на увазі, що піразоліл представлений формулою нижче: 5 10 15 20 25 30 35 40 45 50 де R4 піразоліл може бути приєднаний за допомогою будь-якого кільцевого вуглецю й один або два необов'язкові замісники являють собою R7 і R8, де R7, незалежно вибирають із C1-6 алкілу, C1-6 галогеналкілу, C1-6 галогеналкокси, C1-6 алкокси, ціано, або галогену й можуть знаходитися на будь-якому атомі вуглецю й R8 являє собою гідроген або C1-6 алкіл. Варіант здійснення (G) В іншому варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", і варіантах здійснення (A), (B), (C), (D), (E), і (F), вище й групах, які вони включають, в одній групі сполук, кожний з X1, X2, X3, і X4 являє собою CR5. У цьому варіанті здійснення (G), в іншій групі сполук кожний R 5 являє собою гідроген. (c1) У групах у варіанті здійснення (G), в одній групі сполук, X 5 являє собою N. (d1) У групах у варіанті здійснення (G), в іншій групі сполук X5 являє собою CR6. У цій групі сполук, в одній групі R6 являє собою гідроген. У цьому варіанті здійснення (G), в іншій групі сполук кожний R 5 являє собою гідроген. У групах у варіанті здійснення (G), в іншій групі сполук один з R 5 являє собою фтор або ціано. У цій групі сполук, в іншій групі R5 ціано розташований в C-5 положенні, атом нітрогену, заміщений за допомогою R4, знаходиться в положенні 1. У цій групі сполук, в іншій групі сполук в 4 іншій групі R5 фтор розташований в C-5 положенні, атом нітрогену, заміщений за допомогою R , знаходиться в положенні 1. Варіант здійснення (H) В іншому варіанті здійснення, сполука формули (I) або її фармацевтична сіль має значення, як визначено в розділі "Суть винаходу", і варіантах здійснення (A), (B), (C), (D), (E), і (F) вище й групах, де один з X1, X2, X3, і X4 являє собою N. У цих групах сполук в одній групі сполук X 1 являє собою N. (e1) У групах у варіанті здійснення (H), в одній групі сполук X 5 являє собою N. (f1) У групах у варіанті здійснення (H), в іншій групі сполук X5 являє собою CR6 і R6 являє собою гідроген. У групах у варіанті здійснення (H), в одній групі сполук кожний R 5 являє собою гідроген. У групах у варіанті здійснення (H), (e1) і (f1), в іншій групі сполук один з R 5 являє собою фтор або ціано. У цій групі сполук, в іншій групі R 5 ціано розташований в C-5 положенні, атом нітрогену, заміщений за допомогою R4, знаходиться в положенні 1. У цій групі сполук, в іншій групі сполук в іншій групі R5 фтор розташований в C-5 положенні, атом нітрогену, заміщений за допомогою R4, знаходиться в положенні 1. Загальна схема синтезу Сполуки згідно із даним винаходом можуть бути отримані за допомогою методів, представлених на схемах реакцій нижче, та інших методів, відомих у даній галузі техніки. Вихідні речовини й реагенти, використовувані для одержання цих сполук, або є доступними від комерційних виробників, таких як Aldrich Chemical Co., (Milwaukee, Wis.), Bachem (Torrance, Calif.), або Sigma (St. Louis, Mo.) або їх одержують за допомогою методів, відомих кваліфікованим фахівцям у даній галузі техніки згідно із процедурами, викладеними в посиланнях, таких як Fieser and Fieser's Reagents for Organic Synthesis, Volumes 1-17 (John Wiley and Sons, 1991); Rodd's Chemistry of Carbon Compounds, Volumes 1-5 and Supplementals (Elsevier Science Publishers, 1989); Organic Reactions, Volumes 1-40 (John Wiley and Sons, 1991), March's Advanced Organic Chemistry, (John Wiley and Sons, 4th Edition) і Larock's Comprehensive Organic Transformations (VCH Publishers Inc., 1989). Ці схеми є тільки ілюстративними для деяких способів, за допомогою яких можуть бути синтезовані сполуки згідно із даним винаходом, і до цих схем можуть застосовуватися різні модифікації й для фахівця в даній галузі техніки вони будуть стосуватися даного розкриття. Вихідні речовини й проміжні сполуки, і кінцеві 13 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 продукти реакцій можуть бути виділені й очищені, якщо це є бажаним, за допомогою загальноприйнятих технік, включаючи, але не обмежуючись тільки ними, фільтрацію, дистиляцію, кристалізацію, хроматографію й ін. Такі матеріали можуть бути охарактеризовані за допомогою загальноприйнятих засобів, включаючи фізичні константи й спектральні дані. Якщо спеціально не вказано інакше, реакції, описані в даній заявці, здійснюють при атмосферному тиску при температурі в діапазоні від приблизно -78 °C до приблизно 150 °C, більш переважно від приблизно 0 °C до приблизно 12 °C і найбільш переважно приблизно при кімнатній температурі (або температурі навколишнього середовища), наприклад, приблизно при 20 °C. Сполуки формули (I) можуть бути отримані, як проілюстровано й описано на Схемі A нижче. Схема A Стадія 1 включає утворення C-N зв'язку між R4 і N-1 нітрогеном сполуки формули 1, де R являє собою захисну групу кислоти, таку як C 1-6 алкіл. Сполуки формули 1, R4LG, де LG являє собою групу, що вилучається, таку як сульфонат або галоген, і R 4B(OH)2, або її естер, або є комерційно доступними або вони можуть бути отримані за допомогою методів, добре відомих у даній галузі техніки. Наприклад, етиловий естер 5-фтор-2-метиліндол-3-карбонової кислоти, етиловий естер 4,5-дифтор-2-метиліндол-3-карбонової кислоти, 5-метокси-, метиловий естер 1H-індол-3-карбонової кислоти, метиловий естер 5-фтор-1H-індол-3-карбонової кислоти, етил 5метил-1H-індол-3-карбоксилат, етиловий естер 4,5-дифтор-2-метиліндол-3-карбонової кислоти, метиловий естер 5-ціано-2-метил-1H-індол-3-карбонової кислоти, 5-фтор-, метиловий естер 1Hпіразолo[3,4-b]піридин-3-карбонової кислоти, 5-метил-, метиловий естер 1H-піроло[2,3b]піридин-3-карбонової кислоти, 5-фтор-, метиловий естер 1H-піроло[2,3-b]піридин-3-карбонової кислоти, є комерційно доступними. Гідроліз естерної групи в лужних водних умовах забезпечує відповідну сполуку формули 2. Після цього сполуку 2 перетворюють у сполуку формули (I), де Z являє собою NRa або O або її нітроген-захищене похідне, шляхом утворення активованого похідного кислоти сполуки 2, з наступною реакцією з R1RaNH або R1OH, де R1 має значення, як визначено в розділі "Суть винаходу", або її нітроген-захищене похідне. Наприклад, активоване похідне кислоти може являти собою змішаний ангідрид, наприклад, із сумішшю TFAA і ТФО в толуені або CDI або Boc2O; або галогенангідрид, наприклад, з оксаліл хлоридом, тіоніл хлоридом; або згідно зі стандартом, використовуючи стандартні пептидні сполучні реагенти, такі як HATU, у присутності основи, такої як N,N-діізопропілетиламін, і розчиннику, такого як ДМФА й ін. Якщо використовують нітроген-захищене похідне R1RaNH або R1OH, то видалення захисної групи забезпечує сполуку формули (I). Аміни й спирти формули R1RaNH або R1OH або їх нітрогензахищене похідне або є комерційно доступними або можуть бути отримані за допомогою методів, відомих у даній галузі техніки, наприклад, (1S,5R,6S)-4-окса-1-азабіцикло[3.3.1]нонан-6ол може бути отриманий, як описано в Medicinal Chemistry, 1993, 36, 683-689. Альтернативно, сполука формули I може бути синтезована спочатку шляхом комбінації кислотної похідної сполуки 1 (R являє собою H) з R 1RaNH або R1OH, як описано вище, з наступним утворенням N-C зв'язку, як описано на Стадії 1 Схеми A вище. Докладні описи синтезу сполук формули (I) за допомогою вищевказаних процедур представлені в Демонстраційних прикладах нижче. Корисність Відомо, що 5-HT3 рецептори експресуються в центральній нервовій системі в ділянках, задіяних у блювотному рефлексі, відчуттях болю, контролю розпізнавання й тривоги й залучені в патогенез таких захворювання, як блювота, мігрень, зловживання лікарськими засобами, і нейродегенеративні й психіатричні розлади, такі як тривожність і депресія (див. Hewlett et al., 2003 J. Clin. Psychiatry 64, 1025-1030; Kelley et al., 2003a, Eur J. Pharmacol., 461, 19-25; Haus et al., 2000 Scand J Rheumatol Suppl 113, 55-58; і Faris et al., 2006 J affect Disorder 92, 79-90), розлади травлення (Hammer et al., 1990 Am J Physiol 259, R627-R636, і Jiang & Gietzen 1994 14 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 55 60 Pharmacol Biochem Behav 47, 59-63), шизофренія (див. Hermann et al. 1996 Biochem Biophys Res Commun 225, 957-960; Sirota et al., 2000 Am J Psychiatry 157, 287-289; Adler et al., 2005 Am J Psychiatry 162, 386-388; Koike et al., Levkovitz et al., 2005 Schizophr Res 76, 67-72), порушення пізнавальної функції, зв'язані із шизофренією (див. Zhang et al., 2006 Schizophr Res 88, 102-110; Akhondzadeh et al., 2009 Schizophr Res 107, 206-212), порушення пізнавальних здатностей, зв'язані із хворобою Паркінсона, хореєю Хантінгтона, пресинільними деменціями й хворобою Альцгеймера (див. Costall and Naylor 2004 CNS Neurol Disord 3, 27-37) зловживання забороненими речовинами й наркоманія (див. Johnson et al., 2002 Psycho-pharmacology (Berl) 160, 408-413; Johnson, 2004 CNS Drugs 18, 1105-1118; Dawes et al., 2005 Addict Behav 30, 16301637, Johnson 2006 Drug Alcohol Depend 84, 256-263), і біль (див. Kayser et al., 2007 Pain 130, 235; Glaum et al., 1998 Neurosci Lett 95, 313-317; Schworer & Ramadori 1993 Clin Investig 71, 659; Thompson and Lummis 2007 Exp Opin Ther Targets, 11, 527-540). Додатково, 5-HT3 рецептори експресуються в шлунково-кишковому тракті, отже, можуть бути задіяні в розладах шлунковокишкового тракту, таких як диспепсія, шлунково-стравохідне рефлюксне захворювання й синдром подразненого кишечнику (див. Graeff 1997 Psychiatr Clin North Am 20, 723; Thompson and Lummis 2007 Exp Opin Ther Targets, 11, 527-540; Barnes et al. 2009 Neuropharmacology 56, 273). Експресія 5-HT3A субодиниці також була виявлена за межами нейронів в імунних клітинах, таких як моноцити, хондроцити, T-клітини, синовіальна тканина й тромбоцити (Fiebich et al., 2004 Scan J Rheumatol Suppl, 9-11, Stratz et al., 2008 Thromb Haemost 99, 784) і 5-HT3A, C-E у базальній мембрані в епітелії слизової травного тракту (Kapeller et al., J Comp Neuro., 2008; 509: 356-371), вказуючи на те, що вони можуть бути залучені в імунологічні й запальні захворювання, такі як атеросклероз, тендоміопатія й фіброміалгія. Тестування 5-HT3 інгібуючу активність сполук згідно із даним винаходом можна тестувати з використанням in vitro аналізу й in vivo аналізу, описаних у Біологічних прикладах 1, 2, і 3 нижче. Введення й фармацевтична композиція У цілому, сполуки згідно із даним винаходом будуть вводитися в терапевтично ефективній кількості за допомогою будь-яких прийнятних способів введення для агентів, які мають подібну придатність. Терапевтично ефективні кількості сполук формули (I) можуть знаходитися в діапазоні від приблизно 0,01 до приблизно 75 мг на кг ваги пацієнта на добу, яка може вводитися в однократних або багаторазових дозах. Переважно, рівень дозування буде становити від приблизно 0,01 до приблизно 10 мг/кг у добу; більш переважно від приблизно 0,5 до приблизно 5 мг/кг у добу або 0,1-2 мг/кг/доба. Для перорального введення, композиції переважно забезпечуються у формі таблеток, що містять від приблизно 0,5 до приблизно 200 міліграм активного компонента, від приблизно 0,5, 1,0, 5,0, 10, 15, 20, 25, 50, 75, 100, 150 або 200 міліграм активного компонента. Фактична кількість сполуки згідно із даним винаходом, тобто активного компонента, буде залежати від різних факторів, таких як тяжкість захворювання, що піддається лікуванню, вік і відносний стан здоров'я суб'єкта, ефективність використовуваної сполуки, шляхи й форми введення, та інші фактори. Хоча ці дозування засновані на середньостатистичній людині, що має масу тіла від приблизно 60 кг до приблизно 70 кг, лікар зможе визначити підходящу дозу для пацієнта (наприклад, дитини), маса тіла якого знаходиться з межами цього вагового діапазону. У цілому, сполуки згідно із даним винаходом будуть вводитися у вигляді фармацевтичних композицій за допомогою будь-якого з наступних шляхів: перорального, системного (наприклад, трансдермального, інтраназального або за допомогою супозиторію), або парентерального (наприклад, внутрішньом'язового, внутрішньовенного або підшкірного) введення. Кращим способом введення є пероральний, використовуючи підходящу добову схему дозування, яку можна коректувати відповідно до ступеня захворювання. Композиції можуть бути представлені у формі таблеток, пігулок, капсул, напівтвердих препаратів, порошків, сполук з уповільненим вивільненням, розчинів, суспензій, еліксирів, аерозолів, або будь-яких інших підходящих композицій. Вибір препарату залежить від різних факторів, таких як спосіб введення лікарського засобу (наприклад, для перорального введення кращими є препарати у формі таблеток, пігулок або капсул) і біодоступність лікарської речовини. Останнім часом, були розроблені фармацевтичні препарати особливо для лікарських засобів, які проявляють погану біодоступність, засновані на тому принципі, що біодоступність може бути підвищена шляхом збільшення площі поверхні, тобто зменшення розміру частинки. Наприклад, у патенті США № 4,107,288 описаний фармацевтичний препарат, який має частинки розміром у діапазоні від 10 до 1000 нм, у якому активна речовина розташована на основі перехресно зшитого матриксу макромолекул. У патенті США № 5,145,684 описане одержання фармацевтичного препарату, у якому лікарська 15 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовина розпилена на наночастинках (середній розмір частинок 400 нм) у присутності модифікатора поверхні й потім диспергована в рідкому середовищі для одержання фармацевтичного препарату, який має значно підвищену біодоступність. Композиції містять, у цілому, сполуку формули (I) у комбінації із принаймні одним фармацевтично прийнятним наповнювачем. Прийнятні наповнювачі є нетоксичними, сприяють введенню й не виявляють несприятливого впливу на терапевтичну перевагу сполуки формули (I). Такий наповнювач може являти собою будь-який твердий, рідкий, напівтвердий або, у випадку аерозольної композиції, газоподібний наповнювач, який звичайно доступний для кваліфікованого фахівця в даній галузі техніки. Тверді фармацевтичні наповнювачі включають крохмаль, целюлозу, тальк, глюкозу, лактозу, сахарозу, желатин, солод, рис, борошно, крейду, силікагель, стеарат магнію, стеарат натрію, гліцерин моностеарат, хлорид натрію, сухе знежирене молоко й ін. Рідкі й напівтверді наповнювачі можуть бути вибрані із гліцерину, пропіленгліколю, води, етанолу й різних олій, включаючи олії нафтового, тваринного, рослинного або синтетичного походження, наприклад, арахісова олія, соєва олія, мінеральна олія, кунжутна олія й ін. Кращими рідкими носіями, особливо для розчинів для ін'єкцій, є вода, фізіологічний розчин, водна декстроза й гліколі. Стиснені гази можна використовувати для диспергування сполуки згідно із даним винаходом в аерозольну форму. Інертні гази, придатні для цієї мети, являють собою нітроген, вуглекислий газ і т.д. Інші підходящі фармацевтичні наповнювачі і їх препарати описані в Remington's Pharmaceutical Sciences, за редакцією E. W. Martin (Mack Publishing Company, 18th ed., 1990). Рівень сполуки в препараті може змінюватися кваліфікованим фахівцем у даній галузі техніки в межах повного використовуваного діапазону. Звичайно, препарат буде містити, виходячи з вагового процентного вмісту (мас. %), приблизно 0,01-99,99 мас. % сполуки формули (I), виходячи із загального препарату, у рівновазі з одним або декількома підходящими фармацевтичними наповнювачами. Переважно, сполука представлена на рівні приблизно 1-80 мас. %. Сполуки згідно із даним винаходом можна використовувати в комбінації з одним або декількома іншими лікарськими засобами для лікування захворювань або станів, при яких можуть бути корисними сполуки згідно із даним винаходом або інші лікарські засоби, де комбінація лікарських засобів спільно є безпечною або більш ефективною, ніж кожен з лікарських засобів окремо. Такий(і) інший(і) лікарський(і) засіб(засоби) можуть вводитися за допомогою способу й у кількості, які звичайно застосовують для них, одночасно або послідовно зі сполукою згідно із даним винаходом. Якщо сполука згідно із даним винаходом використовується одночасно з одним або декількома іншими лікарськими засобами, то можна використовувати фармацевтичну композицію в одиничній дозованій формі, що містить цей та інші лікарські засоби й сполуку згідно із даним винаходом. Проте, комбінована терапія також може включати терапії, при яких сполуку згідно із даним винаходом й одну або декілька інших лікарських засобів вводять у різних схемах, що перекриваються. Також передбачається, що при використанні в комбінації з одним або декількома іншими активними компонентами, сполуки згідно із даним винаходом й інші активні компоненти можна використовувати в більш низьких дозах, ніж кожен використовується окремо. Таким чином, фармацевтичні композиції згідно із даним винаходом також включають композиції, які містять один або декілька інших активних компонентів, додатково до сполуки згідно із даним винаходом. Вищеописані комбінації включають комбінації сполуки згідно із даним винаходом не тільки з однією іншою активною сполукою, але також і із двома або більше іншими активними сполуками. Подібним чином, сполуки згідно із даним винаходом можуть використовуватися в комбінації з іншими лікарськими засобами, які використовуються для запобігання, лікування, контролю, ослаблення, або зменшення ризику захворювань або станів, при яких корисні сполуки згідно із даним винаходом. Цей та інші лікарські засоби можуть вводитися, за допомогою способу й у кількості, які звичайно використовують для них, одночасно або послідовно зі сполукою згідно із даним винаходом. Таким чином, фармацевтичні композиції згідно із даним винаходом також включають ті композиції, які також містять один або декілька інших активних компонентів, додатково до сполуки згідно із даним винаходом. Вагове співвідношення сполуки згідно із даним винаходом до другого активного компонента може змінюватися й буде залежати від ефективної дози кожного компонента. Як правило, буде використовуватися ефективна доза кожного компонента. В одному варіанті здійснення, сполука згідно із даним винаходом може вводитися в комбінації із засобами для лікування хвороби Альцгеймера, інгібіторами бета-секретази, 16 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 55 інгібіторами гама-секретази, інгібіторами HMG-CoA редуктази, нестероїдними протизапальними лікарськими засобами, включаючи ібупрофен, вітаміном E, і протиамілоїдними антитілами. В іншому варіанті здійснення, сполука згідно із даним винаходом може вводитися в комбінації із седативними, снотворними, транквілізаторами, нейролептиками, анксіолітичними засобами, циклопіролонами, імідазопіридинами, піразолoпіримідинами, малими транквілізаторами, агоністами й антагоністами мелатоніну, мелатонінергічними агентами, бензодіазепінами, барбітуратами, агоністами mGlu2/3, антагоністами 5HT-2, антагоністами PDE10, інгібіторами Glyt1, та ін., такими як: адиназолам, алобарбітал, алонімід, алпразолам, амісульприд, амітриптилін, амобарбітал, амоксапін, арипіпразол, бентазепам, бензоктамін, бротизолам, бупропіон, буспріон, бутабарбітал, буталбітал, капурид, карбоклорал, хлорал бетаїн, хлорал гідрат, кломіпрамін, клоназепам, клоперидон, клопазепат, хлордіазепоксид, клоретат, хлорпромазин, клозапін, ципразепам, дезипрамін, декскламол, діазепам, дихлоралфеназон, дивалпроекс, дифенгідрамін, доксепін, естазолам, етхлорвінол, етомідат, фенобам, флунітразепам, флупентиксол, флуфеназин, флуразепам, флувоксамін, флуоксетин, фосазепам, глутетимід, галазепам, галоперідол, гідроксизин, іміпрамін, літій, лоразопам, лорметазепам, мапротилін, меклоквалон, мелатонін, мефобарбітал, мепробамат, метаквалон, мідафлур, мідазолам, нефазодон, нізобамат, нітразопам, нортриптилін, оланзапін, оксазепам, паральдегід, пароксетин, пентобарбітал, перлапін, перфеназин, фенелзин, фенобарбітал, празепам, прометазин, пропофол, протриптилін, квазепам, кветіапін, реклазепам, рисперідон, ролетамід, секобарбітал, сертралін, супроклон, темазопам, тіоридазин, тіотіксен, траказолат, канілципромаїн, тразодон, триазолам, трепіпам, трицетамід, триклофос, трифлуоперазин, триметозин, триміпрамін, ульдазепам, венлафаксин, залеплон, зипрасидон, золазепам, золпідем, [4-(3-фтор-5-трифторметилпіридин-2-іл)піперазин-1-іл][5-метансульфоніл-2-((S)-2,2,2трифтор-1-метилетокси)феніл]метанон (RG1678), Glyt1 інгібітори, описані в патенті США 7538114, Таблиця 1 у колонці 14, і їх солі, і їх комбінації. В іншому варіанті здійснення, сполука згідно із даним винаходом може вводитися в комбінації леводопою (з або без селективного інгібітору екстрацеребральної декарбоксилази, такого як карбідопа або бенсеразид), антихолінергічними засобами, такими як біпериден (необов'язково у вигляді його гідрохлоридної або лактатної солі) і тригексифенідил (тригексифенідил) гідрохлорид, інгібітори COMT, такі як ентакапон, інгібітори MOA-B, антиоксиданти, антагоністи рецептора A2a аденозину, холінергічні агоністи, антагоністи рецептора NMDA, антагоністи рецептора серотоніну й агоністи рецептора допаміну, такі як алентемол, бромокриптин, фенолдопам, лізурид, наксаголід, перголід і праміпексол. Слід прийняти до уваги, що агоніст допаміну може бути представлений у формі фармацевтично прийнятної солі, наприклад, алентемол гідробромід, бромокриптин мезилат, фенолдопам мезилат, наксаголід гідрохлорид і перголід мезилат. Лізурид і праміпексол звичайно використовуються в несольовій формі. В іншому варіанті здійснення, сполука згідно із даним винаходом може вводитися в комбінації зі сполукою з групи нейролептиків із класу фенотіазіну, тіоксантену, гетероциклічного дибензазепіну, бутирофенону, дифенілбутилпіперидину й індолону. Підходящі приклади фенотіазінів включають хлорпромазин, мезоридазин, тіоридазин, ацетофеназин, флуфеназин, перфеназин і трифлуоперазин. Підходящі приклади тіоксантенів включають хлорпротиксен і тіотиксен. Прикладом дибензазепіну є клозапін. Прикладом бутирофенону є галоперідол. Прикладом дифенілбутилпіперидину є пімозид. Прикладом індолону є моліндолон. Інші нейролептичні засоби включають локсапін, сульпірид і рисперідон. Слід прийняти до уваги, що нейролептичні засоби, при використанні в комбінації із заявленою сполукою, можуть бути представлені у формі фармацевтично прийнятної солі, наприклад, хлорпромазин гідрохлорид, мезоридазин безилат, тіоридазин гідрохлорид, ацетофеназин малеат, флуфеназин гідрохлорид, флурфеназин етанат, флуфеназин деканоат, трифлуоперазин гідрохлорид, тіотиксен гідрохлорид, галоперідол деканоат, локсапін сукцинат і моліндон гідрохлорид. Перфеназин, хлорпротиксен, клозапін, галоперідол, пімозид і рисперідон звичайно використовуються в несольовій формі. Таким чином, сполука згідно із даним винаходом може вводитися в комбінації з ацетофеназином, алентемолом, арипіпразолом, амісульпридом, тригексифенідилом, бромокриптином, біпериденом, хлорпромазином, хлорпротиксеном, клозапіном, діазепамом, фенолдопамом, флуфеназином, галоперідолом, леводопою, леводопою з бенсеразидом, леводопою з карбідопою, лізуридом, локсапіном, мезоридазином, моліндолоном, наксаголідом, оланзапіном, перголідом, перфеназином, пімозидом, праміпексолом, кветіапіном, рисперідоном, сульпіридом, тетрабеназином, тригексифенідилом, тіоридазином, тіотиксеном, трифлуоперазином або зипрасидоном. 17 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 В іншому варіанті здійснення, сполука згідно із даним винаходом може вводитися в комбінації з антидепресантом або анксіолітичним засобом, включаючи інгібітори зворотного захоплення норепінефрину (включаючи третинні амінові трицикли й вторинні амінові трицикли), селективні інгібітори зворотного захоплення серотоніну (SSRIs), інгібітори моноамін оксидази (MAOIs), оборотні інгібітори моноамін оксидази (RIMAs), інгібітори зворотного захоплення серотоніну й норадреналіну (SNRls), антагоністи кортикотропін-рилізинг фактора (CRF), антагоністи адренорецептора, антагоністи рецептора нейрокінін-1, атипові антидепресанти, бензодіазопіни, агоністи або антагоністи 5-HTA, особливо часткові агоністи 5-HTA, і антагоністи кортикотропін-рилізінг фактора (CRF). Специфічні агенти включають: амітриптилін, кломіпрамін, доксепін, іміпрамін і триміпрамін; амоксапін, дезипрамін, мапротилін, нортриптилін і протриптилін; флуоксетин, флувоксамін, пароксетин і сертралін; ізокарбоксазид, фенелзин, транілципромін і селегілін; моклобемід, венлафаксин; дулоксетин; апрепітант; бупропіон, літій, нефазодон, тразодон і вілоксазин; алпразолам, хлордіазепоксид, клоназопам, хлоразепат, діазопам, галазепам, лоразепам, оксазопам і празепам; буспірон, флесиноксан, гепірон і іпзапірон, і їх фармацевтично прийнятні солі. Приклади Представлені нижче приготування сполук формули (I) наведені для можливості більш чіткого розуміння фахівцями в даній галузі техніки й реалізації заявленого винаходу. Вони не повинні розглядатися як обмежуючі обсяг винаходу, а тільки як ілюстративні й репрезентативні. Процедури синтезу Порівняння 1 Синтез (1R,5S,7S)-трет-бутил 7-гідрокси-3-окса-9-азабіцикло[3.3.1]нонан-9-карбоксилату Борогідрид натрію (259 мг, 6,84 ммоль) порціями додавали до розчину (1R,5S)-трет-бутил 7оксо-3-окса-9-азабіцикло[3.3.1]нонан-9-карбоксилату (550 мг, 2,279 ммоль) в MeОН (4559 мкл) при 0 °C. Через 5 хвилин, реакційній суміші надавали можливість нагрітися до КТ, потім перемішували протягом 30 хвилин. Суміш концентрували при пониженому тиску, розчиняли в EtОАс і промивали насиченим сольовим розчином. Об'єднані органічні шари висушували над безводним Na2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини, яку використовували без додаткового очищення. Порівняння 2 Синтез (1R, 5S, 7S)-9-метил-d3-окса-9-азабіцикло[3.3.1]нонан-7-аміну Стадія 1: (1R,5S)-9-Метил-d3-окса-9-азабіцикло[3.3.1]нонан-7-он До розчину гідрату дигідрофосфату натрію (22,30 г, 162 ммоль) і 2-гідроксипропан-1,2,3трикарбонової кислоти (4,90 г, 25,5 ммоль) у воді (Об'єм: 506 мл) додавали по черзі гідрохлорид метил-d3-аміну (5 г, 70,9 ммоль) і 3-оксопентандіоєву кислоту (11,91 г, 82 ммоль). Значення pН доводили до 4,6 за допомогою 10 % водного розчину NaОН. Розчин 2,2’-оксидіацетальдегіду (3,62 г, 35,4 ммоль) в 8 мл MeОН додавали при КТ і отриману суміш перемішували при КТ протягом 3 днів. 10 % водний NaОН використовували для підлуговування реакційного розчину, і екстрагували за допомогою ДХМ (100 мл). Після очищення за допомогою колонкової хроматографії (SiО2; ДХМ/MeОН) одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія 2: (1R,5S)-9-метил-d3-3-окса-9-азабіцикло[3.3.1]нонан-7-он оксим Розчин (1R,5S)-9-мети-d3-окса-9-азабіцикло[3.3.1]нонан-7-ону (1,65 г, 10,43 ммоль), гідрохлориду гідроксиламіну (0,761 г, 10,95 ммоль) і піридину (0,843 мл, 10,43 ммоль) в EtОН (Об'єм: 52,1 мл) нагрівали при 75 °C протягом 3 годин. Після додавання до реакційного розчину 0,2 мл триетиламіну, розчинник видаляли. При очищенні за допомогою колонкової хроматографії (SiО2; ДХМ/MeОН) одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія 3: (1R,5S,7S)-9-Метил-d3-окса-9-азабіцикло[3.3.1]нонан-7-амін 18 UA 113991 C2 5 10 15 20 25 30 35 40 45 50 Сірчану кислоту (1,108 мл, 20,78 ммоль) додавали по краплях протягом 15 хвилин до розчину, що ретельно перемішується, літій алюміній (III) гідриду (1,0 M у ТГФ, 41,6 мл, 41,6 ммоль) у ТГФ (Об'єм: 41,6 мл) при 0 °C. Суміш перемішували додатково протягом години при 0 °C і після цього порціями додавали (1R,5S)-9-метил-d3-3-окса-9-азабіцикло[3.3.1]нонан-7-ону оксим (1,8 г, 10,39 ммоль) при 0 °C. Реакційну суміш нагрівали в колбі зі зворотним холодильником (80 °C) протягом 1,5 год. Після цього до ретельно перемішаної реакційної суміші додавали 1,58 мл води, 2,37 мл 10 M NaОН і 3,95 мл води при 0 °C. Отриману суспензію фільтрували через шар целіту й промивали за допомогою ТГФ. Об'єднану органічну фазу концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді світложовтої олії, яку використовували без додаткового очищення. Порівняння 3 Синтез (1R,5S,7S)-9-(трифторметил)-3-окса-9-азабіцикло[3.3.1]нонан-7-амін 2,2,2трифторацетату Стадія 1: Бензил (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-ілкарбамат Бензилхлорформіат (330 мкл, 2,319 ммоль) додавали до розчину (1R,5S,7S)-трет-бутил 7аміно-3-окса-9-азабіцикло[3.3.1]нонан-9-карбоксилат 2,2,2-трифторацетату (751,3 мг, 2,108 ммоль) і триетиламіну (619 мкл, 4,43 ммоль) у ДХМ (10 мл) при КТ. Через 14 год., до реакційної суміші додавали трифтороцтову кислоту (2,4 мл, 31,6 ммоль). Через 15 хвилин, суміш концентрували, розчиняли за допомогою ДМФА, фільтрували і очищали за допомогою ВЕРХ із наступною нейтралізацією (K2CO3), одержуючи вказану в заголовку сполуку у вигляді безбарвної олії. Стадія 2: Бензил ((1R,S,7S)-9-(трифторметил)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)карбамат Розчин бензил (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-ілкарбамату (27 мг, 0,098 ммоль) і дибромдифторметану (18,06 мкл, 0,195 ммоль) у ДМСО (489 мкл) обробляли за допомогою тетракіс(диметиламіно)етилену (50,1 мкл, 0,215 ммоль), по краплях при 0 °C. Суміш повільно нагрівали до КТ протягом ночі, після цього вливали в 1:1 суміш NaНСО 3 /Na2S2O3 і екстрагували два рази за допомогою Et2O. Об'єднані екстракти концентрували й очищали шляхом препаративної ТШХ, одержуючи вказану в заголовку сполуку у вигляді жовтої олії. Стадія 3: (1R,5S,7S)-9-(Трифторметил)-3-окса-9-азабіцикло[3.3.1]нонан-7-амін 2,2,2трифторацетат У посудину, що містить бензил ((1R,5S,7S)-9-(трифторметил)-3-окса-9азабіцикло[3.3.1]нонан-7-іл)карбамат (10 мг, 0,029 ммоль), паладій на вугіллі (10 мас. %, 1,020 мг, 9,58 мкмоль), і ТФО (4,47 мкл, 0,058 ммоль) в MeОН (Об'єм: 145 мкл) продували газоподібний водень і залишали в 1 атм. H2 протягом 2 годин. Фільтрували через шар целіту /MgSO4 (1:1), після цього кристалізували, одержуючи вказану в заголовку сполуку у вигляді безбарвної плівки, яку використовували без додаткового очищення. Порівняння 4 Синтез (1S,5R,6S)-4-окса-1-азабіцикло[3.3.1]нонан-6-олу; (1R,5S,6R)-4-окса-1азабіцикло[3.3.1]нонан-6-олу Стадія 1: Етил 4-(3-етокси-3-оксопропіл)морфолін-2-карбоксилат Суміш етил морфолін-2-карбоксилату (3 г, 18,85 ммоль) і етилакрилату (5 мл, 18,85 ммоль) нагрівали при 100 °C протягом 14 годин. Реакцію охолоджували до КТ, після цього розводили Et2O і екстрагували за допомогою водної 3M НСl. Об'єднані водні шари підлуговували твердим K2CO3 і екстрагували за допомогою ДХМ. Об'єднані органічні шари висушували над безводним Na2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді світло-жовтої олії, яку використовували без додаткового очищення. Стадія 2: (1S,5R)-4-Окса-1-азабіцикло[3.3.1]нонан-6-он (1R,5S)-4-Окса-1азабіцикло[3.3.1]нонан-6-он Розчин етил 4-(3-етокси-3-оксопропіл)морфолін-2-карбоксилату (3,07 г, 11,84 ммоль) у толуені (8 мл) додавали до суспензії 2-метилпропан-2-олату калію (3,65 г, 32,6 ммоль) у толуені (39,5 мл) при 120 °C. Після перемішування при 120 °C протягом 3 годин, реакційну суміш 19 UA 113991 C2 5 10 15 20 25 30 35 40 45 охолоджували до КТ і екстрагували водою (20 мл). Водний шар обробляли за допомогою конц НСl (20 мл, 240 ммоль), після цього нагрівали при 110 °C протягом 14 годин. Реакційну суміш охолоджували до КТ, потім концентрували при пониженому тиску. Отриману тверду речовину ресуспендували в насиченому водн K2CO3 і екстрагували за допомогою ДХМ. Об'єднані органічні шари висушували над безводним Na 2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказані в заголовку сполуки у вигляді коричневу олію, яку використовували без додаткового очищення. Стадія 3: (1S,5R,6S)-4-Окса-1-азабіцикло[3.3.1]нонан-6-ол; (1R,5S,6R)-4-Окса-1азабіцикло[3.3.1]нонан-6-ол Борогідрид натрію (53,6 мг, 1,417 ммоль) додавали до розчину (1S,5R)-4-окса-1азабіцикло[3.3.1]нонан-6-ону й (1R,5S)-4-окса-1-азабіцикло[3.3.1]нонан-6-ону (100 мг, 0,708 ммоль) в MeОН (3542 мкл) при 0 °C. Реакційну суміш перемішували при КТ протягом 30 хвилин, після цього концентрували при пониженому тиску. Залишок ресуспендували в EtОАс і промивали насиченим сольовим розчином. Органічний шар висушували над безводним Na2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказані в заголовку сполуки у вигляді жовтої олії, яку використовували без додаткового очищення. Порівняння 5 Синтез 1-(піридин-4-іл)-1H-індол-3-карбонової кислоти Стадія 1: Метил 1-(піридин-4-іл)-1H-індол-3-карбоксилат У посудину, що містить метил 1H-індол-3-карбоксилат (402 мг, 2,297 ммоль), піридин-4ілборонову кислоту (847 мг, 6,89 ммоль), ацетат купруму (II) (542 мг, 2,99 ммоль), 4 Ǻ молекулярні сита (4 г) і 1,10-фенантролін (828 мг, 4,59 ммоль) додавали ДХМ (9 мл) і триетиламін (0,320 мл, 2,297 ммоль). Суміш перемішували при КТ протягом 4 днів, потім фільтрували через шар целіту (промивали MeОН). При здійсненні упарювання й очищення за допомогою ВЕРХ (після розведення ДМФА й фільтрування) одержували вказану в заголовку сполуку у вигляді жовтої твердої речовини. Стадія 2:1-(Піридин-4-іл)-1H-індол-3-карбонова кислота До розчину метил 1-(піридин-4-іл)-1H-індол-3-карбоксилату (92 мг, 0,365 ммоль) у воді (365 мкл) і MeОН (365 мкл) додавали KOH (102 мг, 1,823 ммоль). Суміш нагрівали при 90 °C протягом 1 години, після цього MeОН видаляли при пониженому тиску. Водний шар, що залишився, нейтралізували за допомогою 1M НСl (рН = 6-7), після цього екстрагували EtОАс. Об'єднані органічні шари висушували над безводним MgSO 4, фільтрували, концентрували, одержуючи вказану в заголовку сполуку у вигляді жовтої твердої речовини, яку використовували без додаткового очищення. Здійснюючи методику, описану вище, одержували 1-(піридин-3-іл)-1H-індол-3-карбонову кислоту. Порівняння 6 Синтез 1-(піридин-2-іл)-1H-індол-3-карбонової кислоти Стадія 1: Метил 1-(піридин-2-іл)-1H-індол-3-карбоксилат Гідрид натрію (45,7 мг, 1,142 ммоль, 60 % дисперсія в мінеральній олії) додавали до розчину метил 1H-індол-3-карбоксилату (200 мг, 1,142 ммоль) у ДМФА (2283 мкл) при КТ. Через 30 хвилин, до суміші додавали 2-фторпіридин (99 мкл, 1,142 ммоль) і отриману суспензію нагрівали при 120 °C протягом 14 годин. Реакційну суміш розводили за допомогою ДМФА, 20 UA 113991 C2 5 10 15 20 25 30 35 40 45 фільтрували і очищали за допомогою ВЕРХ, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія 2:1-(Піридин-2-іл)-1H-індол-3-карбонова кислота Вказану в заголовку сполуку синтезували, використовуючи аналогічні умови, як описано в Порівнянні 5, Стадія 2. Порівняння 7 Синтез (1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1H-індол-3-карбоксилату До розчину 1H-індол-3-карбонової кислоти (250 мг, 1,551 ммоль) в PhMe (5171 мкл) додавали TFAA (219 мкл, 1,551 ммоль), після цього ТФО (1293 мкл). Суміш перемішували протягом 30 хвилин, потім додавали комерційно доступний (1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-ол (203 мг, 1,293 ммоль). Реакційну суміш перемішували при КТ протягом 1 години, після цього вливали у водн NaНСО 3 і перемішували до рН=7 і припинення виділення бульбашок. Реакційну суміш екстрагували за допомогою EtОАс і висушували над MgSO4. При здійсненні очищення за допомогою ISCO (0-20 % MeОН/ДХМ) одержували вказану в заголовку сполуку у вигляді рожевої твердої речовини. Порівняння 8 Синтез (1R,5S,7S)-трет-бутил 7-((1H-індол-3-карбоніл)окси)-3-окса-9-азабіцикло[3.3.1]нонан9-карбоксилату Стадія 1: (1R,5S,7S)-9-бензил-3-окса-9-азабіцикло[3.3.1]нонан-7-ол Борогідрид натрію (24,54 г, 649 ммоль) додавали порціями протягом 30 хвилин до суспензії (1R,5S)-9-бензил-3-окса-9-азабіцикло[3.3.1]нонан-7-ону (50 г, 216 ммоль) в MeОН (540 мл) і ТГФ (540 мл) при 0 °C. Суміші дозволяли поступово нагрітися до КТ протягом 1 години. Додатково через одну годину при КТ, суміш концентрували й білий залишок розподіляли між етилацетатом і сольовим розчином. Об'єднані органічні шари висушували над Na2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини, яку використовували без додаткового очищення. Стадія 2: (1R,5S,7S)-9-бензил-3-окса-9-азабіцикло[3.3.1]нонан-7-ол 2,2,2-Трифтороцтовий ангідрид (34,5 мл, 244 ммоль) і ТФО (123 мл) послідовно додавали до розчину 1H-індол-3-карбонової кислоти (39,4 г, 244 ммоль) у толуені (987 мл) при КТ. Через 30 хвилин, до суміші додавали (1R,5S,7S)-9-бензил-3-окса-9-азабіцикло[3.3.1]нонан-7-ол (51,8 г, 222 ммоль) однієї порцією при КТ. Через 2 години, суміш концентрували при пониженому тиску до половини вихідного об'єму. Після цього, додавали 800 мл 10 % Na2CO3 (водн.). Суміш концентрували при пониженому тиску доти, поки не видаляли більшість органічного розчинника. Продукт екстрагували етилацетатом і об'єднані органічні шари промивали насиченим сольовим розчином, висушували над Na2SO4, фільтрували й концентрували при пониженому тиску. Темно-фіолетову тверду речовину, що залишилася, розтирали в порошок з Et2O/EtОАс (4:1), одержуючи вказану в заголовку сполуку у вигляді блідо-рожевої твердої речовини Стадія 3: (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1H-індол-3-карбоксилат, гідрохлоридна сіль Суспензію (1R,5S,7S)-9-бензил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1H-індол-3карбоксилату (2 г, 5,31 ммоль) і паладій на вугіллі (200 мг, 1,879 ммоль, 10 мас. %) в EtОН (4,43 мл), ТГФ (4,43 мл) і 3 н НСl (4,43 мл) перемішували при КТ в атмосфері водню (балон) протягом 14 годин. Потім суміш фільтрували через шар целіту й фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді рожевої твердої речовини, яку використовували без додаткового очищення. 21 UA 113991 C2 5 10 15 20 25 30 35 40 45 Стадія 4: (1R,5S,7S)-трет-бутил 7-((1H-індол-3-карбоніл)окси)-3-окса-9азабіцикло[3.3.1]нонан-9-карбоксилат Ди-трет-бутил дикарбонат (1,275 г, 5,84 ммоль) додавали однією порцією до суспензії гідрохлориду (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1H-індол-3-карбоксилату (1,714 г, 5,31 ммоль) і триетиламіну (1,628 мл, 11,68 ммоль) у ТГФ (26,6 мл) при КТ. Через 1 годину, суміш розподіляли між нас NH4Cl (водн.) і етилацетатом. Водний шар екстрагували етилацетатом і об'єднані органічні шари промивали насиченим сольовим розчином, висушували над безводним Na2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді світло-коричневої олії, яку використовували без додаткового очищення. Порівняння 9 Синтез 1-(піридин-2-іл)-1H-піроло[2,3-b]піридин-3-карбонової кислоти Стадія 1: метил 1-(піридин-2-іл)-1H-піроло[2,3-b]піридин-3-карбоксилат Гідрид натрію (22,70 мг, 0,568 ммоль, 60 % суспензія в мінеральній олії) додавали до розчину метил 1H-піроло[2,3-b]піридин-3-карбоксилату (100 мг, 0,568 ммоль) у ДМФА (1419 мкл) при КТ. Через 10 хвилин, до суміші додавали 2-фторпіридин (48,8 мкл, 0,568 ммоль) і суміш нагрівали при 100 °C протягом 14 годин. Після охолодження до КТ, реакційну суміш відразу очищали за допомогою ВЕРХ із наступною нейтралізацією (водн NaНСО3), одержуючи вказану в заголовку сполуку у вигляді безбарвної плівки. Стадія 2:1-(піридин-2-іл)-1H-піроло[2,3-b]піридин-3-карбонова кислота Гідроксид калію (11,30 мг, 0,201 ммоль) додавали до розчину метил 1-(піридин-2-іл)-1Hпіроло[2,3-b]піридин-3-карбоксилату (10,2 мг, 0,040 ммоль) в MeОН (67,1 мкл) і воді (67,1 мкл) при КТ. Суміш нагрівали при 90 °C протягом 2 годин. Органічний шар екстрагували в етилацетаті після підкислення суміші 0,5 н лимонною кислотою. Об'єднані органічні шари промивали насиченим сольовим розчином, висушували над Na 2SO4, фільтрували й концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини, яку використовували без додаткового очищення . Наступні карбонові кислоти одержували за допомогою аналогічної методики: 5-фтор-1-(піридин-2-іл)-1H-піроло[2,3-b]піридин-3-карбонову кислоту й 1-(піридин-2-іл)-1Hіндазол-3-карбонову кислоту Приклад 1 Синтез (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1-(піридин-3-іл)-1H-індол-3карбоксилату біс(2,2,2-трифторацетат) Стадія 1: (1R,5S,7S)-трет-Бутил 7-((1-(піридин-3-іл)-1H-індол-3-карбоніл)окси)-3-окса-9азабіцикло[3.3.1]нонан-9-карбоксилат Йодид купруму (I) (21,99 мг, 0,115 ммоль) додавали до суспензії (1R,5S,7S)-трет-бутил 7((1H-індол-3-карбоніл)окси)-3-окса-9-азабіцикло[3.3.1]нонан-9-карбоксилату (163,6 мг, 0,423 ммоль), 3-бромпіридину (37,1 мкл, 0,385 ммоль), транс-N,N’-диметилциклогексан-1,2-діаміну (36,9 мкл, 0,231 ммоль) і фосфату калію (172 мг, 0,808 ммоль) у толуені (Об'єм: 770 мкл) при КТ. Суміш нагрівали при 110 °C протягом 14 годин. Після цього суміш концентрували й відразу очищали за допомогою колонкової хроматографії (SiО 2: EA/Нex), одержуючи вказану в заголовку сполуку у вигляді жовтої піни. Стадія 2 (1R,5S,7S)-3-Окса-9-азабіцикло[3.3.1]нонан-7-іл 1-(піридин-3-іл)-1H-індол-3 22 UA 113991 C2 5 10 15 20 25 30 35 карбоксилат біс(2,2,2-трифторацетат) ТФО (Об'єм: 356 мкл, Співвідношення: 1,000) додавали до розчину (1R,5S,7S)-трет-бутил 7((1-(піридин-3-іл)-1H-індол-3-карбоніл)окси)-3-окса-9-азабіцикло[3.3.1]нонан-9-карбоксилату (164,8 мг, 0,356 ммоль) у ДХМ (Об'єм: 356 мкл, Співвідношення: 1,000) при КТ. Через 15 хвилин, суміш розводили за допомогою ДМФА, фільтрували й очищали за допомогою ВЕРХ, одержуючи вказану в заголовку сполуку у вигляді світло-жовтої олії, одержуючи вказану в заголовку сполуку у вигляді жовтої олії MС (ЕСІ, поз. іон) m/z: 364,2 (M+1). Наступні сполуки одержували за допомогою аналогічної методики, де Boc групу видаляли або за допомогою ТФО або НСl: (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1-(1-метил-1Hпіразол-4-іл)-1H-індол-3-карбоксилат, сіль 2,2,2-трифтороцтової кислоти; (1R,5S,7S)-3-окса-9азабіцикло[3.3.1]нонан-7-іл 1-(1-метил-1H-піразол-3-іл)-1H-індол-3-карбоксилат, сіль 2,2,2трифтороцтової кислоти; і (1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1-(1-метил-1Hпіразол-5-іл)-1H-індол-3-карбоксилат, сіль 2,2,2-трифтороцтової кислоти. Приклад 2 Синтез 1-(1-метил-1H-піразол-3-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7іл)-1H-індол-3-карбоксаміду, сіль 2,2,2-трифтороцтової кислоти До суміші гідрохлориду 1-(1-метил-1H-піразол-3-іл)-1H-індол-3-карбонової кислоти (25 мг, 0,090 ммоль) у ДМФА (Об'єм: 900 мкл) додавали HATU (37,7 мг, 0,099 ммоль) і N-етил-Nізопропілпропан-2-амін (79 мкл, 0,450 ммоль). Після перемішування реакційної суміші при КТ протягом 15 хвилин, додавали (1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-амін 2,2,2трифторацетат (29,2 мг, 0,108 ммоль) і продовжували перемішувати протягом 2 год. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді білої твердої речовини MС (ЕСІ, поз. іон) m/z: 380,25 (M+1). Наступні сполуки одержували за допомогою аналогічної методики, або за допомогою комерційно доступних карбонових кислот або речовин, синтезованих відповідно до процедур для порівняльних сполук: 1-(1-метил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1Hіндол-3-карбоксамід, 1-(1-метил-1H-піразол-5-іл)-N-((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти; і 1-(1бензил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1H-індол-3карбоксамід 2,2,2-трифторацетат. Приклад 3 Синтез (1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1-(1-(2-фторетил)-1Hпіразол-4-іл)-1H-індол-3-карбоксилату, сіль 2,2,2-трифтороцтової кислоти Стадія 1:4-бром-1-(2-фторетил)-1H-піразол Гідрид натрію (24,22 мг, 0,606 ммоль, 60 % суспензія в мінеральній олії) додавали до розчину 4-бром-1H-піразолу (89 мг, 0,606 ммоль) у ДМФА (3028 мкл) при КТ. Через 15 хвилин, 23 UA 113991 C2 5 10 15 20 25 30 35 40 до суміші додавали 1-бром-2-фторетан (100 мг, 0,787 ммоль). Через 30 хвилин, суміш розводили за допомогою ДМФА й очищали за допомогою ВЕРХ, з наступною нейтралізацією (K2CO3), одержуючи вказану в заголовку сполуку у вигляді безбарвної олії. Стадія 2: (1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1-(1-(2-фторетил)-1Hпіразол-4-іл)-1H-індол-3-карбоксилат, сіль 2,2,2-трифтороцтової кислоти Суміш (1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл 1H-індол-3-карбоксилату (50 мг, 0,166 ммоль), 4-бром-1-(2-фторетил)-1H-піразолу (35,3 мг, 0,183 ммоль), йодиду купруму (I) (9,51 мг, 0,050 ммоль), N1,N1-диметилетан-1,2-діаміну (8,80 мг, 0,100 ммоль) і фосфату калію (74,2 мг, 0,350 ммоль) у толуені (333 мкл) нагрівали при 120 °C протягом 5 годин. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді світло-коричневої олії MС (ЕСІ, поз. іон) m/z: 413,30 (M+1). Приклад 4 Синтез N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(1H-піразол-4-іл)-1Hіндол-3-карбоксаміду, сіль 2,2,2-трифтороцтової кислоти Суміш 1-(1-бензил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7іл)-1H-індол-3-карбоксамід 2,2,2-трифторацетату (85 мг, 0,149 ммоль) і 10 % Pd-С (120 мг) в MeОН (1,0 мл) перемішували при КТ в атмосфері H2 протягом 2 днів. Фільтрували й концентрували, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини MС (ЕСІ, поз. іон) m/z: 366,20 (M+1). Приклад 5 Синтез 1-(1-метил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7іл)-1H-індол-3-карбоксаміду, сіль 2,2,2-трифтороцтової кислоти Стадія 1: метил 1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбоксилат, ТФО У запаяну трубку додавали йодид купруму (I) (65,2 мг, 0,342 ммоль), метил 1H-індол-3карбоксилат (200 мг, 1,142 ммоль) і фосфат калію (509 мг, 2,397 ммоль), потім реакційну посудину відкачували й продували азотом (3x). Потім, додавали 4-бром-1-метил-1H-піразол (184 мг, 1,142 ммоль) і (1R,2R)-N1,N2-диметилциклогексан-1,2-діамін (109 мкл, 0,685 ммоль), після цього толуен (1142 мкл). Реакційну трубку відкачували й продували азотом, після цього запечатували й нагрівали при 110 °C протягом 24 год. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді безбарвної олії. Стадія 2: гідрохлорид 1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбонової кислоти До розчину метил 1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбоксилату, ТФО (3,5 мг, 9,48 мкмоль) в MeОН (95 мкл) додавали розчин водн KOH (33,2 мкл, 0,066 ммоль, 2 M). Реакційну суміш перемішували при КТ протягом ночі, після цього підкисляли за допомогою 1 н НСl. Розчинник упарювали при пониженому тиску й залишок висушували у вакуумі протягом ночі. Вказану в заголовку сполуку використовували без додаткового очищення. Стадія 3:1-(1-метил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан7-іл)-1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти 24 UA 113991 C2 5 10 15 20 25 30 35 До суміші гідрохлориду 1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбонової кислоти (2,6 мг, 9,36 мкмоль) у ДМФА (187 мкл) додавали HATU (4,27 мг, 0,011 ммоль) і DIPEA (8,18 мкл, 0,047 ммоль). Після перемішування реакційної суміші при КТ протягом 15 хвилин, додавали (1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-амін, ТФО (3,04 мг, 0,011 ммоль) і продовжували перемішувати протягом 2 годин. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді білої твердої речовини MС (ЕСІ, поз. іон) m/z: 380,30 (M+1). Приклад 6 1-(1-(дифторметил)-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан7-іл)-1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти Стадія 1:1-(1-(бромдифторметил)-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти До розчину N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(1H-піразол-4-іл)1H-індол-3-карбоксаміду, сіль 2,2,2-трифтороцтової кислоти (30 мг, 0,063 ммоль) у ДМФА (Об'єм: 626 мкл) при 0 °C додавали гідрид натрію (7,51 мг, 0,188 ммоль) і бромід тетрабутиламонію (0,202 мг, 0,626 мкмоль). Після перемішування отриманого розчину протягом 1 год., додавали розчин дибромдифторметану (5,78 мкл, 0,063 ммоль) в 0,1 мл ДМФА. Реакційну суміш поступово нагрівали аж до КТ протягом 2 год. і перемішували при КТ протягом 2 год. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія 2:1-(1-(дифторметил)-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1H-індол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти Розчин 1-(1-(бромдифторметил)-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9азабіцикло[3.3.1]нонан-7-іл)-1H-індол-3-карбоксаміду, сіль 2,2,2-трифтороцтової кислоти (4 мг, 6,58 мкмоль) і TBAF (3,44 мг, 0,013 ммоль) у сульфолані (Об'єм: 32,9 мкл) повільно нагрівали до 170-180 °C. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді білої твердої плівки MС (ЕСІ, поз. іон) m/z: 416,30 (M+1). Приклад 7 N-((1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(1-метил-1H-піразол-4-іл)-1H-індол-3карбоксамід, сіль 2,2,2-трифтороцтової кислоти Стадія 1: трет-Бутил (1R,5S,7S)-7-(1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбоксамідо)-3окса-9-азабіцикло[3.3.1]нонан-9-карбоксилат До розчину гідрохлориду 1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбонової кислоти (25 мг, 0,090 ммоль) і HATU (37,7 мг, 0,099 ммоль) у ДМФА (Об'єм: 450 мкл) додавали N-етил-Nізопропілпропан-2-амін (62,9 мкл, 0,360 ммоль). Після перемішування реакційного розчину при КТ протягом 15 хвилин, додавали (1R,5S,7S)-трет-бутил 7-аміно-3-окса-9азабіцикло[3.3.1]нонан-9-карбоксилат (24,00 мг, 0,099 ммоль). Продовжували перемішувати 25 UA 113991 C2 5 10 15 20 25 30 35 40 протягом 1 години. За допомогою ВЕРХ очищення з наступним ISCO (0-20 % MeОН у ДХМ) очищенням одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія 2: N-((1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(1-метил-1H-піразол-4-іл)-1Hіндол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти Розчин трет-Бутил (1R,5S,7S)-7-(1-(1-метил-1H-піразол-4-іл)-1H-індол-3-карбоксамідо)-3окса-9-азабіцикло[3.3.1]нонан-9-карбоксилату (18,1 мг, 0,039 ммоль) у ТФО (Об'єм: 194 мкл, Співвідношення: 1) і ДХМ (Об'єм: 194 мкл, Співвідношення: 1) перемішували при КТ протягом 1 години. Після видалення розчинника одержували вказану в заголовку сполуку у вигляді білої твердої речовини MС (ЕСІ, поз. іон) m/z: 366,25 (M+1). Наступну сполуку одержували за допомогою аналогічної процедури: N-((1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(піридин-3-іл)-1H-індол-3-карбоксамід Приклад 8 N-((1R,5S,7S)-9-етил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(1-метил-1H-піразол-4-іл)-1Hіндол-3-карбоксамід, сіль 2,2,2-трифтороцтової кислоти Суміш N-((1R,5S,7S)-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(1H-піразол-4-іл)-1H-індол-3карбоксаміду, сіль 2,2,2-трифтороцтової кислоти (12 мг, 0,025 ммоль), триетиламін (5,13 мкл, 0,038 ммоль), і ацетальдегіду (2,120 мкл, 0,038 ммоль) в DCE (Об'єм: 250 мкл) перемішували протягом 10 хвилин при КТ. Після цього додавали триацетоксигідроборат натрію (10,61 мг, 0,050 ммоль) при КТ. Суміш перемішували протягом 16 годин і гасили задопомогою декількох крапель води. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді білої твердої речовини MС (ЕСІ, поз. іон) m/z: 394,35 (M+1). Приклад 9 3-(3-(((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)карбамоїл)-1H-індол-1іл)піридин 1-оксид, сіль 2,2,2-трифтороцтової кислоти Суміш N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]нонан-7-іл)-1-(піридин-3-іл)-1H-індол3-карбоксаміду (20 мг, 0,053 ммоль) і мета-хлорпероксибензойної кислоти (10,08 мг, 0,058 ммоль) у ДХМ (Об'єм: 0,8 мл) перемішували при КТ протягом 2 годин. За допомогою ВЕРХ очищення одержували вказану в заголовку сполуку у вигляді білої твердої речовини MС (ЕСІ, поз. іон) m/z: 393,30 (M+1). Біологічні приклади Біологічний приклад 1 Інгібування активності Ca потоку 5-HT3 в аналізі in vitro Антагоністичну 5-HT3 активність сполук згідно з винаходом визначали шляхом вимірювання здатності сполук інгібувати активність кальцієвого потоку 3HT3a рецептора, що експресується в HEK-293T клітинах. HEK-293T клітини трансфектували за допомогою конструкції, що експресує 5-HT3a, використовуючи Xtreme Gene 9 (Roche) у планшетах з 150 мм обробленою тканинною культурою й інкубували протягом 24 годин при 37 °C. Після цього клітини руйнували й висівали при щільності 60K клітин/лунку в покриті полі-лізином чорні планшети на 96 лунок із прозорим дном (BD Biosciences) і інкубували протягом ночі при 37 °C. Ростові середовища видаляли й клітини завантажували 200 мкл кальцій-індикаторного барвника в HBSS, що містить 20 мM 26 UA 113991 C2 5 10 15 HEPES (Calcium 5 Assay kit, Molecular Devices) і інкубували при 37° C протягом 1 години. Під час інгібування клітин, готовили планшети з 10X додаванням антагоніста й агоніста /антагоніста. Для планшета з 10X антагоністом: напівлогарифмічні серійні розведення (кінцеві концентрації з -7 -10 діапазоні від 10 до 10 з донною лункою негативного контролю без ліганду) готовили з тестованих сполук у ДМСО при 1000X концентрації й після цього розводили до 10X в HBSS/20 мM HEPES. Для додаткового планшета: 5HT розводили до 100X в HBSS/20 мM HEPES (кінцева концентрація в аналізі - 216 нM) і 15 мкл додавали в кожну лунку додаткового планшета, 15 мкл 10X сполуки також додавали в додатковий планшет, і на завершення 120 мкл HBSS/20 мM HEPES (для сумарно 150 мкл). Після цього клітини видаляли з інкубатора й урівноважували до кімнатної температури протягом 10 хвилин, після цього в планшети 22,5 мкл 10X тестованих сполук додавали в трьох повторах і інкубували при кімнатній температурі протягом 10 хвилин (Тропізетрон використовували як позитивний контроль в кожному аналізі). Тестований планшет і додатковий планшет завантажували на Flexstation III (Molecular Devices), і використовуючи струминну техніку, здійснювали додавання 22,5 мкл сполук (при t = ~17 секунд), і вимірювали флуоресценцію протягом 90 секунд, записуючи кожні 2,2 секунди. Сукупність даних аналізували у вигляді максимального мінус мінімальне, використовуючи Software Max Pro (Molecular Devices). Будували IC50 криві, використовуючи нелінійну регресію в Graphpad Prism. Приблизне IC50 значення вказаного номера сполук формули (I) у цьому аналізі представлено в Таблиці 2 нижче. 20 Таблиця 2 № спол з Таблиці I вище 1 4 7 10 13 16 19 22 26 29 32 25 30 35 40 45 IC50 [нM] № спол. з Таблиці I вище IC50 [нM] 0,95 0,69 2,86 0,65 0,72 2,5 3,68 0,65 1,20 0,462 1,36 2 5 8 11 14 17 20 23 27 30 0,51 0,62 0,81 0,60 1,34 0,75 1,5 1,01 1,44 0,745 № спол. з IC50 [нM] Таблиці I вище 3 0,96 6 1,1 9 0,68 12 0,8825 15 0,662 18 2,013 21 1,10 25 1,39 28 2,04 31 >1000 Додатково, у прямому порівняльному дослідженні, Сполука 15 з Таблиці 1, Приклад 5, має IC50 3,48 нМ у цьому аналізі, у той час як сполука прикладу Порівняння 7 вище має IC50 у цьому аналізі 89,1 нМ. Біологічний приклад 2 Аналіз розпізнавання нових об'єктів гризунами (NOR) у фенциклідин-індукованих порушеннях пізнавальних здатностей моделі шизофренії Завданням цього аналізу було дослідження здатності сполук згідно з винаходом поліпшувати субхронічне PCP-індуковане погіршення пам'яті розпізнавання, використовуючи NOR завдання в щурів, модель релевантності розпізнавання при шизофренії. В експериментах використовували дорослих самців щурів Sprague-Dawley (250-350 г; Harlan, USA). Тварин акліматизували до умов протягом 7 днів до проведення експериментів. Для експерименту використовували сім груп по 14 тварин на групу. Одній групі тварин вводили наповнювач (0,9 % фізіологічний розчин двічі на добу) і шість груп, що залишилися одержували, PCP (2,5 мг/кг, підшкірно двічі на добу) протягом 7 днів, з наступними 5 днями без лікарського засобу. У день тестування, тваринам надавали можливість акліматизуватися в кімнаті для тестування протягом 30 хвилин перед початком експериментів. Експерименти здійснювали в білих клітках з органічного скла, обладнаних у вигляді експериментальної арени Арену поміщали в темну експериментальну кімнату, яку освітлювали галогеновою лампою, забезпечуючи тьмяне освітлення арени. Тварин поміщали на арену на 5 хвилин для вільного вивчення тестованої камери при відсутності об'єктів (звикання). Після цього тварин повертали в їх домашні клітки відразу після завершення звикання протягом періоду 120 хвилин. Тестовану сполуку (0,1, 1, 10 мг/кг підшкірно), або наповнювач (нап., фізіологічний розчин) вводили за 120 хвилин до T1 і галантамін (5 мг/кг, внутрішньоочеревинно) вводили за 30 хвилин до T1. Тварин повертали на 27 UA 113991 C2 5 10 15 20 25 30 арену, яка містила два ідентичні об'єкти (пластмасові кульки), поміщені в одну ділянку арени (збір інформації, T1), і надавали можливість вивчення протягом періоду 5 хвилин. Записували час, витрачений на вивчення двох об'єктів. Тварин знову повертали в домашню клітку на період 120 хвилин (ITI). За ITI була фаза втримання (T2), де один з об'єктів, що були присутні у першому дослідженні, замінювали на новий об'єкт, і тваринам надавали можливість досліджувати додатково протягом періоду 5 хвилин Знову записували час, витрачений на вивчення двох об'єктів. Для фази втримання, аналізували відмінності між часом, витраченим на дослідження знайомого об'єкта й нового об'єкта. Усі сесії записували й оцінювали наосліп щодо часу вивчення об'єктів. Вивчення визначали як торкання об'єкта або наближення носа до об'єкта на відстань менше 2 см. Використовували мінімальний досліджуваний критерій, таким чином, що включали тільки тварин, які потратили більше 5 секунд на вивчення об'єкта. Порівняння між усіма лікованими групами здійснювали за допомогою однофакторного ANOVA з наступним тестом Бонфероні за отриманими результатами для множинних порівнянь. Біологічний приклад 3 Аналіз зв'язування нікотинового α-7 рецептора Оцінку зв'язування з нікотиновим α-7 рецептором здійснювали на Eurofins Pharma Services. Сполука 15 з Таблиці 1, Приклад 5, мала IC50 у цьому аналізі >10 мкМ, тоді як сполука Порівняння 7 вище мала IC50 у цьому аналізі 1,66 мкМ. Приклади рецептур Нижче представлені характерні фармацевтичні рецептури, що містять сполуку формули (I). Склад таблетки Наступні компоненти ретельно змішували й спресовували в таблетки з однією насічкою. Компонент Кількість на таблетку сполука згідно із даним винаходом 0,5-150 мг кукурудзяний крохмаль 50 мг натрій кроскармелоза 25 мг лактоза 120 мг стеарат магнію 5 мг Склад капсули Наступні компоненти ретельно змішували й завантажували в желатинову капсулу із твердою оболонкою. Компонент Кількість на капсулу сполука згідно із даним винаходом 0,5-150 мг висушена розпиленням лактоза 148 мг стеарат магнію 2 мг Склад для ін'єкції Сполука згідно з винаходом (наприклад, сполука 1) в 2 % HPMC, 1 % Tween 80 у деіонізованій воді, рН 2,2 з MSA, у достатній кількості (q.s.) до принаймні 20 мг/мл. ФОРМУЛА ВИНАХОДУ 35 1. Сполука 1-(1-метил-1H-піразол-4-іл)-N-((1R,5S,7S)-9-метил-3-окса-9-азабіцикло[3.3.1]-нонан7-іл)-1H-індол-3-карбоксамід або його фармацевтично прийнятна сіль. 2. Фармацевтична композиція, яка містить сполуку за пунктом 1 та фармацевтично прийнятний наповнювач. 3. Сполука за пунктом 1 для застосування як лікарського засобу. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійською5-ht3 receptor antagonists
Автори англійськоюHitchcock, Stephen, Monenschein, Holger, Reichard, Holly, Sun, Huikai, Kikuchi, Shota, Macklin, Todd, Hopkins, Maria
Автори російськоюХичкок Стивэн, Монэншэйн Хольгер, Рейхард Холли, Сунь Хуейкай, Кикучи Шота, Маклин Тодд, Хопкинс Мария
МПК / Мітки
МПК: A61K 31/5386, C07D 498/08
Мітки: 1-(1-метил-1н-піразол-4-іл)-n-((1r,5s,7s)-9-метил-3-окса-9-азабіцикло[3.3.1]-нонан-7-іл)-1н-індол-3-карбоксамід, рецептора, 5-ht3, антагоніст
Код посилання
<a href="https://ua.patents.su/30-113991-1-1-metil-1n-pirazol-4-il-n-1r5s7s-9-metil-3-oksa-9-azabiciklo331-nonan-7-il-1n-indol-3-karboksamid-yak-antagonist-5-ht3-receptora.html" target="_blank" rel="follow" title="База патентів України">1-(1-метил-1н-піразол-4-іл)-n-((1r,5s,7s)-9-метил-3-окса-9-азабіцикло[3.3.1]-нонан-7-іл)-1н-індол-3-карбоксамід як антагоніст 5-ht3 рецептора</a>
Попередній патент: Проліки ребаміпіду, спосіб їх одержання та застосування
Наступний патент: Залізничне колесо і відповідний амортизатор
Випадковий патент: Спосіб теплопровідного склеювання матеріалів з різними коефіцієнтами температурного розширення