2-тіозаміщені похідні імідазолу та їх застосування у фармацевтиці
Номер патенту: 80718
Опубліковано: 25.10.2007
Автори: Альбрехт Вольфганг, Толльманн Карола, Лауфер Стефан, Штрігель Ханс-Гюнтер
Формула / Реферат
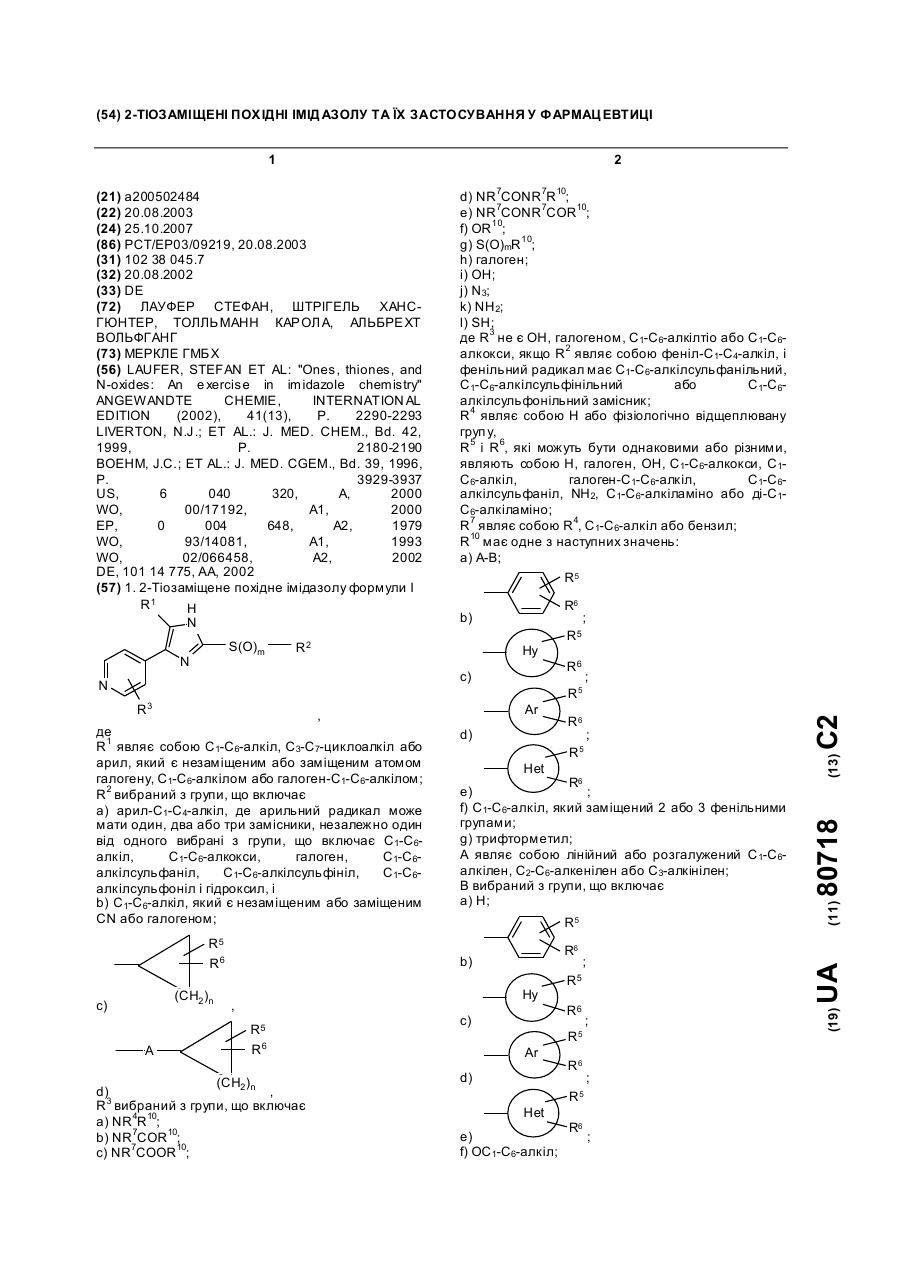
1. 2-Тіозаміщене похідне імідазолу формули I
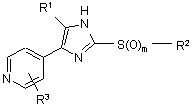 ,
,
де
R1 являє собою C1-C6-алкіл, С3-С7-циклоалкіл або арил, який є незаміщеним або заміщеним атомом галогену, C1-C6-алкілом або галоген-C1-C6-алкілом;
R2 вибраний з групи, що включає
а) арил-C1-C4-алкіл, де арильний радикал може мати один, два або три замісники, незалежно один від одного вибрані з групи, що включає C1-C6-алкіл, C1-C6-алкокси, галоген, C1-C6-алкілсульфаніл, C1-C6-алкілсульфініл, C1-C6-алкілсульфоніл і гідроксил, і
b) C1-C6-алкіл, який є незаміщеним або заміщеним CN або галогеном;
c) 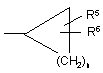 ,
,
d) 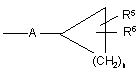 ,
,
R3 вибраний з групи, що включає
a) NR4R10;
b) NR7COR10;
c) NR7COOR10;
d) NR7CONR7R10;
e) NR7CONR7COR10;
f) OR10;
g) S(О)mR10;
h) галоген;
i) OH;
j) N3;
k) NH2;
l) SH;
де R3 не є ОН, галогеном, C1-C6-алкілтіо або C1-C6-алкокси, якщо R2 являє собою феніл-C1-C4-алкіл, і фенільний радикал має C1-C6-алкілсульфанільний, C1-C6-алкілсульфінільний або C1-C6-алкілсульфонільний замісник;
R4 являє собою Н або фізіологічно відщеплювану групу,
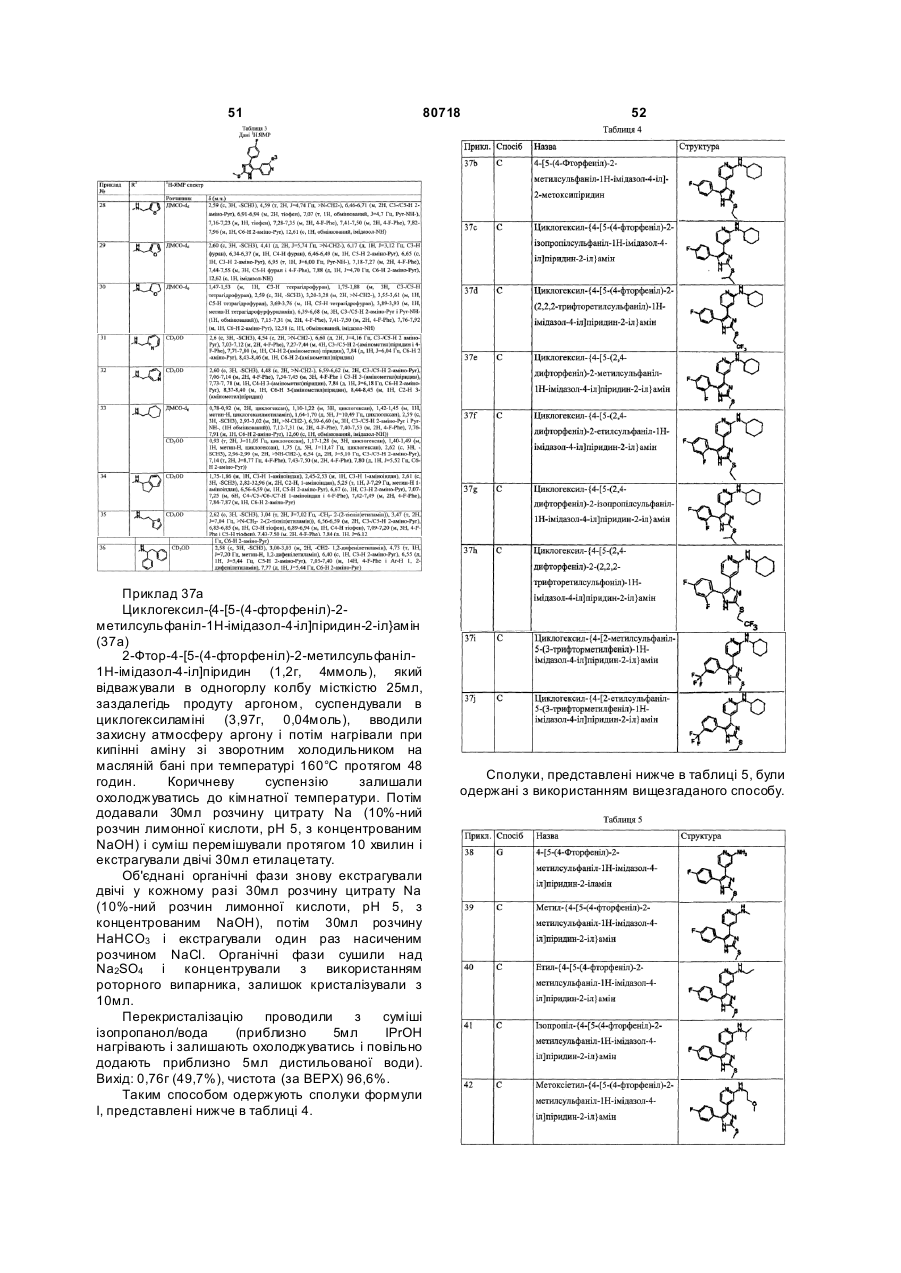
R5 і R6, які можуть бути однаковими або різними, являють собою Н, галоген, ОН, C1-C6-алкокси, C1-C6-алкіл, галоген-C1-C6-алкіл, C1-C6-алкілсульфаніл, NH2, C1-C6-алкіламіно або ді-C1-C6-алкіламіно;
R7 являє собою R4, C1-C6-алкіл або бензил;
R10 має одне з наступних значень:
а) A-B;
b) 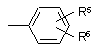 ;
;
с) ![]() ;
;
d) ![]() ;
;
e) ![]() ;
;
f) C1-C6-алкіл, який заміщений 2 або 3 фенільними групами;
g) трифторметил;
А являє собою лінійний або розгалужений C1-C6-алкілен, C2-C6-алкенілен або С3-алкінілен;
В вибраний з групи, що включає
а) H;
b)  ;
;
с) ![]() ;
;
d) ![]() ;
;
e) ![]() ;
;
f) OC1-C6-алкіл;
g) NR11R12;
h) OH;
i) галоген;
j) C1-C6-алкілсульфаніл;
R11 і R12, які можуть бути однаковими або різними, являють собою Н, C1-C6-алкіл або феніл;
Ну являє собою 3-10-членний неароматичний, моно-, бі- або трициклічний карбоцикл, який може бути або може не бути конденсований з бензольним кільцем;
Аr являє собою 5- або 6-членний ароматичний гетероцикл, який має 1, 2 або 3 гетероатоми, незалежно один від одного вибрані з групи, що складається з О, S і N, і який може бути або може не бути конденсований з бензольним кільцем;
Het являє собою 5- або 6-членний неароматичний гетероцикл, який має 1, 2 або 3 гетероатоми, незалежно один від одного вибрані з групи, що складається з О, S і N, який може бути або може не бути конденсований з бензольним кільцем, і який може бути або може не бути місточковим біциклічним або трициклічним;
m дорівнює 0, 1 або 2;
n дорівнює 1, 2, 3, 4 або 5.
або його таутомери, оптичні ізомери або фізіологічно прийнятні солі.
2. Сполука за п.1 формули I,
де
R1 являє собою C1-С6-алкіл, С3-С7-циклоалкіл або арил, який може бути незаміщеним або заміщеним атомом галогену;
R2 вибраний з групи, що включає
a) арил-C1-С4-алкіл, де арильний радикал може мати один, два або три замісники, незалежно один від одного вибрані з групи, що включає C1-С6-алкіл, C1-С6-алкокси, галоген, C1-С6-алкілсульфаніл, C1-С6-алкілсульфініл, C1-С6-алкілсульфоніл і гідроксил, і
b) C1-С6-алкіл, який є незаміщеним або заміщеним CN або галогеном;
c) C3-С7-циклоалкіл;
R3 вибраний з групи, що включає
a) NR4R10;
b) NR7COR10;
c) галоген;
d) C1-С6-алкокси;
e) C1-С6-алкілтіо;
де R3 не є ОН, галогеном, C1-С6-алкілтіо або C1-С6-алкокси, якщо R2 являє собою феніл-C1-С4алкіл, де фенільний радикал містить C1-С6-алкілсульфанільний, C1-С6-алкілсульфінільний або C1-С6-алкілсульфонільний замісник;
R4 являє собою Н;
R10 являє собою
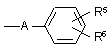 або
або  ,
,
або, якщо R3 являє собою NR7COR10, являє собою R8,
R5 і R6, які можуть бути однаковими або різними, являють собою Н, галоген, C1-С6-алкокси або C1-С6-алкіл;
R7 являє собою Н, C1-С6-алкіл або бензил;
R8 являє собою C1-С4-алкіл, C3-С6-циклоалкіл або феніл, де фенільна група може мати один або два замісники, незалежно один від одного вибрані з групи, що включає C1-С4-алкіл, C1-С4-алкокси і галоген;
А являє собою лінійний або розгалужений C1-С6-алкілен, C1-С6-алкінілен або С3-алкінілен, і
m дорівнює 0, 1 або 2,
або її таутомер, оптичний ізомер або фізіологічно прийнятна сіль.
3. Сполука за п.1 або п. 2 формули Іа
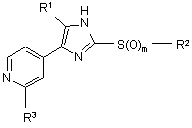 Ia,
Ia,
де R1, R2, R3 і m є такими, як визначено в п.1.
4. Сполука за п.1 або п. 2, де R3 являє собою
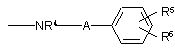 ,
,
де А, R5 і R6 є такими, як визначено в п.1.
5. Сполука за п.1, формули I, де R10 являє собою один з представлених нижче радикалів
a) ![]() ,
,
де Ar являє собою 5- або 6-членний ароматичний гетероцикл, який містить гетероатом, вибраний, з групи, що включає N, О і S; А являє собою C1-С3-алкілен, і R5 і R6 являють собою Н;
b) ![]() ,
,
де Het являє собою 5- або 6-членний неароматичний гетероцикл, який містить О або N гетероатом; А являє собою C1-С3-алкілен, і R5 і R6 являють собою Н;
c) ![]() ,
,
де А являє собою C1-С3-алкілен, і R5 і R6 являють собою Н, і Ну являє собою циклопентил або циклогексил;
d) циклопентил або циклогексил;
e) феніл-C1-С6-алкіл;
f) C2-С6-алкеніл, який заміщений фенілом і
d) C1-С6-алкіл, який заміщений двома фенільними групами.
6. Сполука за п.1, формули I, де R10 являє собою А-В, і В вибраний з групи, що складається з NR11R12, OC1-С6-алкілу і ОН, і А, R11 і R12 є такими, як визначено в п.1.
7. Сполука за п.1, формули I, де R3 являє собою NR7COR10; де R10 вибраний з групи, що включає -О-C1-С4-алкілфеніл, феніл і C2-С6-алкеніл, який заміщений фенілом.
8. Сполука за будь-яким з попередніх пунктів, де А являє собою C1-С2-алкілен.
9. Сполука за будь-яким з попередніх пунктів, де А являє собою етиліден.
10. Сполука за будь-яким з попередніх пунктів, де R5 і R6 являють собою Н.
11. Сполука за будь-яким з попередніх пунктів, де R1 являє собою галогензаміщений феніл, CF3-заміщений феніл або C1-С6-алкілзаміщений феніл.
12. Сполука за будь-яким з попередніх пунктів, де R2 являє собою бензил або C1-С6-алкіл.
13. Фармацевтична композиція, яка містить принаймні одну сполуку за будь-яким з пп.1-12, якщо це прийнятно, разом з одним або декількома фармацевтично прийнятними носіями і/або допоміжними домішками.
14. Застосування принаймні однієї сполуки за будь-яким з пп. 1-12 при одержанні фармацевтичної композиції для лікування порушень, пов'язаних з порушенням імунної системи.
15. Спосіб лікування порушень, пов'язаних з порушенням імунної системи, який відрізняється тим, що достатню для надання імуномодулюючої дії і/або для інгібування вивільнення цитокінів кількість сполуки формули I за будь-яким з пп. 1-12 вводять потребуючому такого лікування пацієнту.
Текст
1. 2-Тіозаміщене похідне імідазолу формули I R1 H N S(O)m N d) NR7CONR7R10; e) NR7CONR7COR10; f) OR10; g) S(О)mR10; h) галоген; i) OH; j) N 3; k) NH2; l) SH; де R3 не є ОН, галогеном, C1-C6-алкілтіо або C1-C6алкокси, якщо R2 являє собою феніл-C1-C4-алкіл, і фенільний радикал має C1-C6-алкілсульфанільний, C1-C6-алкілсульфінільний або C1-C6алкілсульфонільний замісник; R4 являє собою Н або фізіологічно відщеплювану груп у, R5 і R6, які можуть бути однаковими або різними, являють собою Н, галоген, ОН, C1-C6-алкокси, C1C6-алкіл, галоген-C1-C6-алкіл, C1-C6алкілсульфаніл, NH2, C1-C6-алкіламіно або ді-C1C6-алкіламіно; R7 являє собою R4, C1-C6-алкіл або бензил; R10 має одне з наступних значень: а) A-B; R5 R6 b) R2 Hу R6 с) N ; R5 ; R5 R6 (CH2 )n c) R5 R6 ; R5 R6 с) ; R5 R6 Ar d) R6 ; R5 Het e) f) OC1-C6-алкіл; R6 (13) R6 e) ; f) C1-C6-алкіл, який заміщений 2 або 3 фенільними групами; g) трифторметил; А являє собою лінійний або розгалужений C 1-C6алкілен, C2-C6-алкенілен або С3-алкінілен; В вибраний з групи, що включає а) H; 80718 Het Hу d) , R3 вибраний з групи, що включає a) NR4R10; b) NR7COR10; c) NR7COOR10; ; R5 , (CH2 )n R6 (11) d) b) R5 A Ar UA , де R1 являє собою C1-C6-алкіл, С3-С7-циклоалкіл або арил, який є незаміщеним або заміщеним атомом галогену, C1-C6-алкілом або галоген-C1-C6-алкілом; R2 вибраний з групи, що включає а) арил-C1-C4-алкіл, де арильний радикал може мати один, два або три замісники, незалежно один від одного вибрані з групи, що включає C 1-C6алкіл, C1-C6-алкокси, галоген, C1-C6алкілсульфаніл, C1-C6-алкілсульфініл, C1-C6алкілсульфоніл і гідроксил, і b) C1-C6-алкіл, який є незаміщеним або заміщеним CN або галогеном; ; (19) R3 C2 R5 3 80718 4 g) NR11R12; замісники, незалежно один від одного вибрані з h) OH; групи, що включає C1-С4-алкіл, C1-С4-алкокси і i) галоген; галоген; j) C 1-C6-алкілсульфаніл; А являє собою лінійний або розгалужений C 1-С6R11 і R12, які можуть бути однаковими або різними, алкілен, C1-С6-алкінілен або С3-алкінілен, і являють собою Н, C1-C6-алкіл або феніл; m дорівнює 0, 1 або 2, Ну являє собою 3-10-членний неароматичний, або її таутомер, оптичний ізомер або фізіологічно моно-, бі- або трициклічний карбоцикл, який може прийнятна сіль. бути або може не бути конденсований з 3. Сполука за п.1 або п. 2 формули Іа бензольним кільцем; R1 H Аr являє собою 5- або 6-членний ароматичний N гетероцикл, який має 1, 2 або 3 гетероатоми, S(O)m R2 незалежно один від одного вибрані з групи, що N складається з О, S і N, і який може бути або може не бути конденсований з бензольним кільцем; N Het являє собою 5- або 6-членний неароматичний гетероцикл, який має 1, 2 або 3 гетероатоми, незалежно один від одного вибрані з групи, що R3 Ia, складається з О, S і N, який може бути або може де R1, R2, R3 і m є такими, як визначено в п.1. не бути конденсований з бензольним кільцем, і 4. Сполука за п.1 або п. 2, де R 3 являє собою який може бути або може не бути місточковим R5 біциклічним або трициклічним; 4 NR A m дорівнює 0, 1 або 2; R6 n дорівнює 1, 2, 3, 4 або 5. , або його таутомери, оптичні ізомери або де А, R5 і R6 є такими, як визначено в п.1. фізіологічно прийнятні солі. 5. Сполука за п.1, формули I, де R10 являє собою 2. Сполука за п.1 формули I, один з представлених нижче радикалів де R5 1 R являє собою C1-С6-алкіл, С3-С7-циклоалкіл або A Ar арил, який може бути незаміщеним або заміщеним R6 атомом галогену; a) , R2 вибраний з групи, що включає де Ar являє собою 5- або 6-членний ароматичний a) арил-C1-С4-алкіл, де арильний радикал може гетероцикл, який містить гетероатом, вибраний, з мати один, два або три замісники, незалежно один групи, що включає N, О і S; А являє собою C 1-С3від одного вибрані з групи, що включає C 1-С6алкілен, і R5 і R6 являють собою Н; алкіл, C1-С6-алкокси, галоген, C1-С6R5 алкілсульфаніл, C1-С6-алкілсульфініл, C1-С6Het A алкілсульфоніл і гідроксил, і R6 b) , b) C1-С6-алкіл, який є незаміщеним або заміщеним де Het являє собою 5- або 6-членний CN або галогеном; неароматичний гетероцикл, який містить О або N c) C3-С7-циклоалкіл; гетероатом; А являє собою C1-С3-алкілен, і R5 і R6 R3 вибраний з групи, що включає являють собою Н; a) NR4R10; R5 b) NR7COR10; Hу c) галоген; A R6 d) C 1-С6-алкокси; c) , e) C 1-С6-алкілтіо; де А являє собою C1-С3-алкілен, і R5 і R6 являють 3 де R не є ОН, галогеном, C1-С6-алкілтіо або C1-С6собою Н, і Ну являє собою циклопентил або алкокси, якщо R2 являє собою феніл-C1-С4алкіл, циклогексил; де фенільний радикал містить C1-С6d) циклопентил або циклогексил; алкілсульфанільний, C1-С6-алкілсульфінільний або e) феніл-C1-С6-алкіл; C1-С6-алкілсульфонільний замісник; f) C2-С6-алкеніл, який заміщений фенілом і 4 R являє собою Н; d) C1-С6-алкіл, який заміщений двома фенільними 10 R являє собою групами. R5 A R6 R5 R6 або , або, якщо R3 являє собою NR7COR10, являє собою R8, R5 і R6, які можуть бути однаковими або різними, являють собою Н, галоген, C1-С6-алкокси або C1С6-алкіл; R7 являє собою Н, C1-С6-алкіл або бензил; R8 являє собою C1-С4-алкіл, C3-С6-циклоалкіл або феніл, де фенільна група може мати один або два 6. Сполука за п.1, формули I, де R10 являє собою А-В, і В вибраний з групи, що складається з NR11R12, OC1-С6-алкілу і ОН, і А, R11 і R12 є такими, як визначено в п.1. 7. Сполука за п.1, формули I, де R3 являє собою NR7COR10; де R10 вибраний з групи, що включає О-C1-С4-алкілфеніл, феніл і C2-С6-алкеніл, який заміщений фенілом. 8. Сполука за будь-яким з попередніх пунктів, де А являє собою C1-С2-алкілен. 9. Сполука за будь-яким з попередніх пунктів, де А являє собою етиліден. 5 80718 6 10. Сполука за будь-яким з попередніх пунктів, де 14. Застосування принаймні однієї сполуки за R5 і R6 являють собою Н. будь-яким з пп. 1-12 при одержанні 11. Сполука за будь-яким з попередніх пунктів, де фармацевтичної композиції для лікування R1 являє собою галогензаміщений феніл, CF3порушень, пов'язаних з порушенням імунної заміщений феніл або C1-С6-алкілзаміщений феніл. системи. 12. Сполука за будь-яким з попередніх пунктів, де 15. Спосіб лікування порушень, пов'язаних з R2 являє собою бензил або C1-С6-алкіл. порушенням імунної системи, який відрізняється 13. Фармацевтична композиція, яка містить тим, що доста тню для надання імуномодулюючої принаймні одну сполуку за будь-яким з пп.1-12, дії і/або для інгібування вивільнення цитокінів якщо це прийнятно, разом з одним або декількома кількість сполуки формули I за будь-яким з пп. 1-12 фармацевтично прийнятними носіями і/або вводять потребуючому такого лікування пацієнту. допоміжними домішками. Даний винахід відноситься до 2-тіозаміщених похідних імідазолу, що володіють імуномодулюючою та інгібуючою вивільнення цитокіну дією, до фармацевтичних композицій, що включають дані сполуки, і їх застосування у фармацевтиці. Фармакологічно активні сполуки імідазолу з протизапальною активністю вже відомі. Так, серед інших, сполуки, що мають 4,5ді(гетеро)арилімідазольні фрагменти, були досліджені більш детально і була описана їх різна фармацевтична дія. Також відомі сполуки, які є заміщеними у 2-положенні. У [патенті США 4585771] описані похідні 4,5-дифенілімідазолу, які заміщені у 2-положенні піролільним, індолільним, імідазолільним або тіазолільним радикалом, і які володіють протизапальною і протиалергічною активністю. У [патентах США 4461770, 4528298 і 4584310 (ЕР 004648А)] описані похідні 4-(5-арил)5-(4-гетероарил)імідазолу, які заміщені у 2положенні по тіо-, сульфінільній або сульфонільній групі заміщеним або незаміщеним аліфатичним вуглеводнем, і які, крім іншого, володіють протизапальною дією. Сполуки імідазолу, що володіють імуномодулюючою та інгібуючою вивільнення цитокіну дією, описані у [WO 02/066458, WO 02/076951 і DE 10222103]. Крім того, у [WO 96/03387, ЕР 005545 (US 4440776, 4355039, 4269847), ЕР 236628 (патент США 4686231), патенті Німеччини 3504678, патенті США 4190666, патенті США 44О2960 і патенті США 4585771] описані похідні імідазолу, що володіють протизапальною дією. У [патентах ЕР 372445 (патент США 5318984; патент США 5166214) і патенті США 5364875] описані сполуки імідазолу, що володіють антигіперхолестеринемічною активністю. [Патент WO 00/17-192 (патент Німеччини 19842833)] відноситься до похідних 4-гетероарил5-фенілімідазолу, які заміщені у 2-положенні фенілалкілтіо групою. Дані сполуки діють як протизапальні сполуки та інгібітори вивільнення цитокіну. У [WO 99/03837 і WO 93/14081] описані 2заміщені імідазоли, які інгібують синтез ряду запальних цитокінів. Сполуки, описані у [WO 93/14081], мають у 2-положенні приєднаний через атом сірки фосфоровмісний замісник або арильний або гетероарильний замісник. У [WO 91/10662 і WO 91/13876] описані похідні імідазолу, які інгібують трансферазу ацил-коензим А:холестерин О-ацил і зв'язування тромбоксану ТхА2. У [WO 95/00501] описані похідні імідазолу, які можна використати як інгібітори циклооксигенази. У [J.MecLCherru, 1996, 39, 3927-37], описані сполуки, що володіють 5-ліпоксигеназа- і циклооксгеназа-інгібуючою дією, 2-(4метилсульфінілфеніл)-4-(4-фторфеніл-5-(пірид-4ил)імідазол, також що володіє цитоксин-інгібуючою дією. Крім того, 2-тіозаміщені похідні імідазолу описані в [патенті Японії 01-040467, патенті Росії 1415725, Acta Chim,, 1969, 61-77, J. Pract. Chem., 1972, 314, 785-792 і патенті Німеччини 10114775, Indian J. Chem., Sect. В, 1983, 22B(3), 268-269, Bioorganic & Medical Chem. Lett., Vol.5, No. 2, 177180, 1995, Phosphorus Sulfur 1988, 35(1-2), 83-88, Arch. Biochem. Biophys., Vol. 297, 258-164, 1992, J. Med. Chem. 1995, 38, 1067-1083, Helv.Chim.Acta 82, 1999, 290-296, Helv. ChinuActa 81, 1998, 15851595]. Незважаючи на те, що відомі численні сполуки, все ще зберігається необхідність у сполуках, що володіють протизапальною дією, які інгібують вивільнення цитокіну. Задачею даного винаходу є розробка таких сполук. Несподівано було встановлено, що деякі 2заміщені похідні імідазолу володіють високою імуномодулюючою і/або інгібуючою вивільнення цитокіну активністю. Відповідно,даний винахід відноситься до 2тіозаміщених похідних імідазолу формули І , де R1 являє собою С 1-С6-алкіл, С3-С7-циклоалкіл або арил, який є незаміщеним або заміщеним атомом галогену, С1-С6-алкілом або галоген-С1-С6алкілом; R2 вибраний з групи, що включає a) арил-С1-С4-алкіл, де арильний радикал може мати один, два або три замісники, незалежно один від одного вибрані з групи, що 7 80718 8 складається з С 1-С6-алкілу, С1-С6-алкокси, g) трифторметил (зокрема, якщо R3 являє галогену, С1-С6-алкілсульфанілу, С1-С6собою один з радикалів b)-f)). алкілсульфінілу, С1-С6-алкілсульфонілу і А являє собою лінійний або розгалужений С 1гідроксилу, і С6-алкілен, С2-С6-алкенілен або С3-алкінілен; b) С1-С6-алкіл, який є незаміщеним або В вибраний з групи, що включає заміщеним CN або галогеном; R3 вибраний з групи, що включає a) NR4R10; b) NR7COR10; c) NR7COOR10; d) NR7CONR7R10; e) NR7CONR7COR10; f) OR10; q) S(O)mR10; h) галоген; і) ОН; j) N 3; k) NH2; l) SH; де R3 не є ОН, галогеном, С1-С6-алкілтіо або С1-С6-алкокси, якщо R2 являє собою феніл-С 1-С4алкіл, і фенільний радикал має С 1-С6алкілсульфанільний, С1-С6-алкілсульфінільний або С1-С6-алкілсульфонільний замісник; R4 являє собою Η або фізіологічно відщеплювану груп у, R5 і R6, які можуть бути однаковими або різними, являють собою Н, галоген, ОН, С1-С6алкокси, С1-С6-алкш, галоген-С1-С6-алкіл, С1-С6алкілсульфаніл, ΝΗ2, С1-С6-алкіламіно або ді-С 1С6-алкіламіно; R7 являє собою R4, С1-С6-алкіл або бензил; R10 має одне з наступних значень: f) С1-С6-алкіл, який фенільними групами; заміщений 2 або 3 f) ОС1-С6-алкіл; g) NR11R12; h) OH; і) галоген; j) С1-С6-алкілсульфаніл; R11 і R12, які можуть бути однаковими або різними, являють собою Н, С1-С6-алкіл або феніл; Ну являє собою 3-10-членний неароматичний, моно-, бі- або трициклічний карбоцикл, який може бути або може не бути конденсований з бензольним кільцем; Аr являє собою 5- або 6-членний ароматичний гетероцикл, який має 1, 2 або 3 гетероатоми, незалежно один від одного вибрані з групи, що складається з О, S і N, і який може бути або може не бути конденсований з бензольним кільцем; Het являє собою 5або 6-членний неароматичний гетероцикл, який має 1, 2 або 3 гетероатоми, незалежно один від одного вибрані з групи, що складається з О, S і М, який може бути або може не бути конденсований з бензольним кільцем, і який може бути або може не бути місточковим біциклічним або трициклічним; m дорівнює 0, 1 або 2; n дорівнює 1, 2, 3, 4 або 5 і їх та утомерів, оптичним ізомерів і фізіологічно прийнятних солей. Якщо сполуки згідно з винаходом мають центри асиметрії, в об'єм винаходу входять як рацемати, так і оптичні ізомери (енантіомери, діастереомери). Для сполук згідно з винаходом можливе існування наступної таутомерної рівноваги: 9 80718 10 Даний винахід охоплює обидві таутомерні атома азоту ароматичного радикалу. форми. Переважними є незаміщені радикали. Прикладами Винахід також охоплює фізіологічно прийнятні заміщених радикалів є хлортієніл, зокрема 5солі сполук формули І. В даному випадку вони хлорфур-2-ил, прикладами конденсованих зокрема являють собою кислотно-адитивні солі. радикалів є бензофураніл, бензотіазоліл і Для одержання кислотно-адитивних солей бензотіофен. використовують неорганічні кислоти, такі як Неароматичний 5- або 6-членний гетероцикл хлористоводнева кислота, сірчана кислота або може бути насиченим або ненасиченим. фосфорна кислота, або органічні кислоти, така як Переважно це незаміщений або заміщений винна кислота, лимонна кислота, малеїнова тетрагідрофураніл, тетрагідропіраніл, піролідиніл, кислота, фумарова кислота, яблучна кислота, N-метилпіролідиніл, N-етилпіролідиніл, мигдалева кислота, аскорбінова кислота, піперазиніл або морфолініл, де гетероцикл може глюконова кислота і тому подібні. бути приєднаний через гетероатом азоту або Термін «алкіл» (також в поєднанні з іншими кільцевий атом вуглецю, або може бути групами, такими як фенілалкіл, алкілсульфоніл, заміщеним. Переважними замісниками є один або алкокси і т.д.) охоплює лінійні і розгалужені два радикали, незалежно один від одного вибрані алкільні групи, що мають від 1 до 6 або від 1 до 4 з групи, що включає галоген, зокрема СІ, і С1-С6атомів вуглецю, такі як метил, етил, н- і ізопропіл, алкіл. Перевага віддається незаміщеним н-, ізо- і трет-бутил, втор-бутил, н-пентил, ізоаміл, радикалам. неопентил і н-гексил. Відповідно, це застосовується до терміну «С1-С6-алкілен». Термін «карбоцикл» охоплює насичені або ненасичені неароматичні моноциклічні, біциклічні і являє собою заміщений або трициклічні вуглеводні. Вугле водні можуть бути незаміщений циклопропіл, циклобутил, конденсовані з одним або двома бензольними циклогептил і, зокрема, циклопентил і цкклогексил. кільцями. Моноциклічні вуглеводні являють собою R5 і R6 переважно, незалежно один від одного, С3-С6-циклоалкіл, такі як циклопропіл, являють собою Н, галоген або С1-С6-алкіл. циклопентил, циклогексил. Прикладами бі- і Прикладами заміщених циклоалкільних груп є трициклічних вугле воднів і бензоконденсованих метилциклопропіл або метилциклогексил. карбоциклів є інданіл, декалініл, тетралініл, Перевага віддається незаміщеним радикалам. флуореніл, дигідроантрацніл, дибензосубереніл, Феніл-С 1-С4-алкіл являє собою, зокрема, норборніл або адамантил. Прикладами заміщених бензил, 1-фенілетил або 2-фенілетил. карбоциклів є метилциклопропіл або R1 переважно являє собою фенільний радикал метилциклогексил. Перевага віддається і, зокрема, галоген-, CF3- або С1-С6-алкілнезаміщеним радикалам. заміщений фенільний радикал, при цьому Термін «арил» охоплює ароматичні кільцеві особливо переважним є фторзаміщений системи, такі як феніл або нафтил. Термін фенільний радикал. Замісник переважно «галоген» означає атом фтору, хлор у, брому або знаходиться в 3- і, зокрема, в 4-положенні. йоду, зокрема, атом фтору або атом хлору. Прикладами заміщених фенільних радикалів є 4Термін «галоген-С1-С6-алкіл» охоплює моно- і фтор феніл, 2,4-дифторфеніл, 3-трифторметил, 3полігалогеновані лінійні і розгалужені алкільні толіл або 3-хлорфеніл. групи, що мають від 1 до 6 і, зокрема, від 1 до 4 R2 переважно являє собою бензильний, С3-С6атомів вуглецю. Переважно присутні 1, 2, 3, 4 або циклоалкільний, С4-С7-метилциклоалкільний або 5 атомів галогену. С1-С6-алкільний радикал, де фенільна група в Переважними атомами галогену є F і СІ. бензильному радикалі може бути заміщеною, як Прикладами галоген-С 1-С6-алкілу є -СН2Сl, указано вище. Переважними замісниками СН2СН2Сl, -СН2ССl3, -CF3, -CHF2, -CH2F, -CH2CF3 i фенільної групи в бензильному радикалі є С 1-С6CF2CF3. Переважним є CF3. алкілсульфаніл, С1-С6-алкілсульфініл і С 1-С6Фізіологічно відщеплювана група являє собою алкілсульфоніл. Прикладами R2 є СН3, СН3СН2, груп у, яка може відщеплюватись від залишку (СН3)2СН, CH2CN, CH2CF3, CF3 і циклопропіл. молекули при фізіологічних умовах, R3 переважно являє собою радикал формули 14 ферментативно або хімічно. Прикладами є -COR , - CO2R14, -CONH2, -CONHR14, -CHR16-OR14, CHR16-O-COR 14, -COC(R16)2-OH, -COR 15 , SO 2R15 і SO2R14 , де R14 являє собою С1-С6-алкіл або CF3, , R15 являє собою феніл або толіл (зокрема п-толіл), і R16 являє собою Η або С 1-С6-алкіл. де R4, R5 і R 6, а також А є такими, як визначено Ароматичний 5- або 6-членний гетероцикл вище. R5 і R6 переважно являють собою Н, метил, зокрема являє собою незаміщений (R5, R6=H) або метокси або хлор. Якщо фенільне кільце в даній заміщений 2-піридил, 3-піридил, 4-піридил, 2- або групі є заміщеним, радикали R5 і R6 переважно 3-тієніл, 2- або 3-фурил, тіазоліл, імідазоліл, розташовані в 3- і/або 4-положенні. оксазоліл, ізотіазоліл, триазоліл або піримідил. Крім того, R3 переважно являє собою Переважними замісниками є одна або дві групи, a) NR4R10, де R10 являє собою циклопропіл, незалежно одна від одної вибрані з групи, що циклопропілметил, циклопентил, циклогексил або включає галоген, зокрема СІ, і С1-С6-алкіл. циклогептил; Замісник(и) приєднані до атома вуглецю або 11 80718 12 b) NR4R10, де R10 являє собою С1-С6-алкіл, зокрема, метил, етил або ізопропіл, або являє собою 3,3-дифенілпропіл або 1,3-дифенілпроп-2, іл; 4 10 10 c) NR R , де R являє собою А-В, і В являє де A, R5, R 6 i собою ОН, С1-С6-алкокси, NR11R12 або феніл; d) NR7COR10, де R10 являє собою А-В, і В являє собою феніл; e) NR7COR10, де R10 являє собою С1-С6-алкіл. А переважно являє собою С 1-С6-алкілен і, є такими, як визначено в пункті e). зокрема, етиліден. g) NH-С1-С6-алкіл, який заміщений 2 або 3 Особливо переважним варіантом здійснення є фенільними групами, наприклад, 3,31 сполуки формули І, в якій R являє собою 4дифенілпропіламіно, 1,3-дифенілпроп-2-іламіно; фтор феніл, R2 являє собою С 1-С6-алкіл або h) бензил, де фенільна група в бензильному радикалі може бути заміщеною, як указано вище; R3 являє собою радикал формули , де А являє собою С 1-С2-алкілен, R5 і R6 являють собою Н, і де R4, R5 і R 6, а також А є такими, як визначено вище, і m дорівнює 0. Наступним переважним варіантом здійснення є сполуки формули І, в якій R2 являє собою С 1-С6алкіл, зокрема метил, і R1 являє собою галогенфеніл або галоген-С1-С6-алкілфеніл, зокрема, 4-фторфеніл, 2,4-дифторфеніл, 4трифторметилфеніл або 3-трифторметилфеніл. Далі R3 переважно являє собою групи, визначені нижче: a) галоген, зокрема F або СІ; b) ОН або ОС1-С6-алкіл, зокрема метокси і ізопропокси, c) феніламіно; d) феніл- або нафтил-С 1-С6-аміно, де фенільна група може бути заміщена 1 або 2 галогенами, зокрема F або СІ, С1-С6-алкокси або С1-С6-алкілом. Аміногрупа додатково може бути заміщена С 1-С6-алкілом. Прикладами таких радикалів є бензиламіно, 4-метоксибензиламіно, 4-метилбензиламіно, 4-хлорбензиламіно, 3,4дихлорбензиламіно, 2-фенілетиламіно, 1фенілетиламіно, 1-нафт-1-ил-аміно, 1-нафт-2иламіно; 1-фенілпроп-З-іламіно, 3фенілпропіламіно, 1-(4-ізобутилфеніл)етиламіно; e) , де А являє собою С 1-С2-алкілен, R5 і R6 являють собою Н, і являє собою тієніл, фурил, 2-, 3- або 4піридил, тіазоліл, оксазоліл, бензотіофеніл або бензофураніл, де гетероциклічні радикали можуть бути заміщені галогеном, зокрема F або СІ, або С 1-С6-алкілом. f) являє собою тетрагідрофураніл, тетрагідропіраніл, піролідин, N-метил або Nетилпіролідин; i) , де R5, R6 i є такими, як визначено в нункті h); j) -NHCOOR10, де R10 являє собою С 3-С6циклоалкіл; k) -NH-CO-NHR 10, де R10 являє собою С 3-С6циклоалкіл; l) NH-COR10, де R10 являє собою С3-С6циклоалкіл-С 1-С4-алкіл, наприклад, циклопентилметил, циклогексилметил; m) NHСОNНСОфеніл; n) -A-С3-С6-циклоалкіл, де А являє собою С 1С2-алкілен, наприклад, циклопентилметиламіно, циклогексилметиламіно. Сполуки згідно з винаходом можуть бути одержані відповідним чином згідно зі способами, описаними в даній галузі і вказаними на початку даного опису, зокрема, у [WO 00/17192]. Встановлено, що особливо відповідним є спосіб одержання згідно з наступним двостадійним способом. На першій стадії спочатку одержують заміщений імідазол-2-тіон формули II. На другій стадії його піддають взаємодії таким чином, що одержують 2-тіозаміщені похідні імідазолу формули І з введенням необхідного замісника R2. 13 80718 14 згідно зі схемою 2 через відповідні 2галогенпіридилзаміщені імідазолтіони (спосіб В). Одержання даних імідазолтіонів проілюстроване з використанням як прикладу 2-фторзаміщеної піридинової сполуки (R3=2-F), де R1=п-фторфеніл. Імідазолтіони, що містять в положенні 4 алкільний l) Одержання імідазол-2-тіону і циклоалкільний радикали (R1= С1-С4-алісіл, С3-С73 Імідазол-2-тіони, де R =H, галоген (Br, Cl, F), циклоалкіл) одержують аналогічним чином, О-алкіл або S-алкіл, одержують згідно зі виходячи з відповідним чином заміщених 2-фторспособами А або В. Як приклад, спосіб А у-піколін кетонів. проілюстрований для сполук, в яких R1 являє Схема 2 собою 4-фторфеніл, і R3 являє собою Н; спосіб В 1 проілюстрований для сполук, в яких R являє собою 4-фторфеніл, і R3 являє собою СІ, (25а), F (25b) або О-алкіл (25с, 25d). Номери в дужках відносяться до номерів прикладів. 2-Тіозаміщені похідні імідазолу, де R3=NR4R10 одержують не з відповідних імідазол-2-тіонів, де R3=NR4R10, а іншим чином згідно зі способом С. 2-Тіозаміщені похідні імідазолу, де R3О-алкіл або = S-алкіл, можуть бути одержані як згідно зі способом С, так і згідно зі способом В. Спосіб А Синтез заміщених імідазол-2-тіонів, де R3 являє собою Н, проводять відповідно до реакційного шляху за схемою 1 з використанням ізонікотинату і 4-фторфеніоацетонітрилу як вихідних речовин. Вихідні речовини перетворюють в процесі реакції конденсації за допомогою металевого натрію в спирті, наприклад, етанолі, в 2-ціано-2-(4фтор феніл)-1-(4-піридил)етанон (lllа). Ціаногрупу g-Піколін (R3=H) і галоген- (R3=F, СІ, Вr, І), потім видаляють гідролізом, наприклад, з метокси-(R3= ОСН3) і метилтіо-(24, R3=SСН3) використанням бромистоводневої кислоти, і заміщені g-піколіни піддають введенню літію за gдекарбоксилуванням, одержуючи 2-(4-фторфеніл)метильною групою за відсутності вологи в 1-(4-піридил)етанон (IVa). На наступній стадії IVa розчинниках, відповідних для цієї мети, таких як перетворюють обробкою сумішшю хлориду вуглеводні, прості ефіри і їх суміші (наприклад, амонію/ацетату натрію в спиртовому розчиннику, гексан, тетрагідрофуран, етиленгліколь, такому як метанол, в оксим (Va). Взаємодією з пдиметиловий ефір) з використанням толуолсульфонілхлоридом в піридині останній діізопропіламіду літію (LDA), а потім конденсують з перетворюють в тозилат (Vla). З тозилату придатними похідними карбонових кислот (R1одержують тіонову сполуку (llа) обробкою COOR, R 1-CONR2, R1-CN). Встановлено, що в етоксидом натрію і взаємодією проміжного цьому випадку особливо придатними є аміди Ν,Οазирену, що утворюється з тіоціанатом калію. диметилгідроксиламіну (R1-СОNСН3(ОСН3), 20). З Схема 1 використанням нітритів і основ, наприклад суміші Синтез тіонів згідно з винаходом згідно зі амілнітрит/метоксид натрію, або з використанням способом А нітриту лужного металу і кислоти, g-піколілкетони (IVb), що утворюються, нітрозують в g-піколільне положення. Встановлено, що особливо зручною є взаємодія g-піколілкетону, розчиненого в крижаній оцтовій кислоті, з водним розчином нітриту, натрію. В процесі реакції нітрозокетони повністю перетворюються в таутомерні оксими кетонів (Vllb). Оксими кетонів відновлюють в спиртовому розчині у присутності водню і мінеральних кислот, наприклад, НСI, з використанням паладію-навугіллі, одержуючи амонієві солі амінокетонів (VIIIb) (23b). Альтернативно, інші оксими кетонів можуть бути відновлені в спиртовому розчині у присутності мінеральних кислот, наприклад, Спосіб В H2SO4, з використанням цинкового пилу, з Одержання сполук згідно з винаходом, в яких одержанням відповідних амонієвих кетонів (23f). піридиновий радикал має галогеновий, ОДані амонієві кетони дають, після дії алкільний або S-алкільний замісник проводять тіоціанатів лужних металів, наприклад, тіоціанату 15 80718 16 калію, в сухому диметилформаміді (ДМФ) при кипінні зі зворотним холодильником, імідазолтіони формули llb, де R3=F, СІ, Вr, О-алкіл або S-алкіл, у вигляді жовтих тверди х речовин (24b). Одержання сполук згідно з винаходом, в яких піридиновий радикал містить або простий ефірний (R3=OR10), тіоефірний (R3=SR10), або аміно (R3=NR4R10) замісник, здійснюють згідно зі схемою 4 або схемою 5 через відповідні 2-галогенпіридилзаміщені імідазолтіони (спосіб С, див. нижче). 4.2. 4-(2-Арилоксипіридин-4-іл)-заміщені 2) Одержання 2-тіоімідазольних сполук тіоімідазоли Сполуки 2-імідазолтіону формули II, одержані згідно зі способом А або В шляхом заміщення атома сірки у 2-положенні, перетворюють в сполуки формули І згідно з винаходом. Заміщення, як ілюстративно показано для деяких сполук на схемі 3, проводять звичайним чином з використанням реакції нуклеофільного заміщення. У цьому випадку сполуки llа або llb піддають взаємодії з R2-X в інертному полярному розчиннику, такому як спирт. X являє собою групу, що легко заміняється, таку як Hal, зокрема СІ, Вr, І, 4.3. 4-(2-Арилтіопіридин-4-іл)-заміщені метилсульфоніл, тозил і т.д. Відповідні способи тіоімідазоли відомі фахівцеві в даній галузі і описані, наприклад, у [WO 00/17192, ЕР 0372445 і патенті США 4440776]. Сполуки R2-X є відомими або можуть бути одержані відомими способами, як описано, наприклад, у [WO 00/17192]. Схема 3 3. Заміщення сірки алкілгалогенідами і арилгалогенідами або спиртовими сульфонатами. 3.1. 2 2 4.4. 4-(2-Арилсульфонілпіридин-4-іл)-заміщені 2-тіоімідазоли Спосіб С Сполуки згідно з винаходом, в яких R3 являє собою аміно замісник (R3=NR4R10), одержують з 2тіоімідазолів з використанням 4(5)-(2галогенпіридин-4-іл) заміщення. Спосіб (спосіб С) проілюстрований на схемі 4 з використанням як прикладу 2-бензиламіно (R3=NH-CH2-Ph), де R1=пфтор феніл. Вихідні речовини (Іb) можуть бути одержані описаним вище способом. Схема 4 4.1. 4-(2-Амінопіридин-4-іл)-заміщені 2тіоімідазоли Доцільно проводити реакцію в аміні, що розглядається, який переважно використовують в кількості від 5 до 20 мольних еквівалентів на мольний еквівалент сполуки (Іb). Температура реакції звичайно коливається від 100 до 200°С. За бажанням, також можливе використання інертного розчинника, такого як діоксан, диметилформамід, діетилацетамід, тетраетилсечовина, метилпіролідон і т.д., і відповідних допоміжних домішок, таких як карбонати лужних металів або галогеніди одновалентної міді (для нейтралізації кількості кислоти, що вивільняється, або для каталізу елімінування галогену). Сполуки згідно з винаходом, в яких R3 являє собою алкоксильний замісник або алкілтіо замісник (R3=О-С1-С6-алкіл, S-С1-С6-алкіл), можуть бути одержані не тільки способом В (виходячи з відповідним чином заміщених піколінів), але і 17 80718 18 способом С, виходячи з 4(5)-(2-галогенпіридин-4перетворюють в аміногрупу способами іл)-заміщених 2-тіоімідазолів. відновлення, див. схему 6.3. Спосіб D Спосіб Η Сполуки згідно з винаходом, в яких R3 являє Даний цікавий варіант також відкриває доступ собою алкоксильний замісник (R3= О-С1-С6-алкіл), до алкілованих амінів з альдегідних або кетонних можуть бути одержані не тільки способом В або С, сполук-попередників. Якщо перетворення але також і способом D, виходячи з 4(5)-(2азидогрупи в аміногрупу проводити в умовах галогенпіридин-4-іл)-заміщених 2-тіоімідазолів. гідрування з використанням каталізатора Спосіб проілюстрований на схемі 5 з гідрування у присутності даних альдегідів і кетонів, використанням як приклад 2одержують алкіловані аміни, де R3=NH-CH2-B або 3 ізопропілоксипіридинових сполук (R =OCH(CH3)2), NHСН(алкіл)-В (спосіб Н, схема 6.4). Такий же де R1=п-фторфеніл. результат одержують, коли азид розщеплюють Вихідні речовини (ІB) можуть бути одержані фосфіном з одержанням фосфіміду, і дані іміди, описаним вище способом. одержані реакцією аза-Віттіга з альдегідом (або 4-(2-Алкоксипіридин-4-іл)-заміщені 2кетоном), відновлюють в аміни з використанням тіоімідазоли комплексних гідридів (спосіб Н, схема 6.5). Вихідні речовини (Іb) можуть бути одержані описаним вище способом. Схема 6 6.1. 4(2-Амідопіридин-4-іл)-заміщені 2тіоімідазоли Доцільно проводити реакцію в спирті, який переважно використовують в кількості від 5 до 20 мольних еквівалентів на мольний еквівалент сполуки (Іb), у випадку нижчих спиртів також аж до ста мольних еквівалентів, у присутності сильної кислоти, такої як НСl або трифтороцтова кислота, метансульфонова кислота і т.д. Температура реакції звичайно знаходиться в діапазоні температур кипіння нижчих спиртів, у випадку вищи х спиртів в діапазоні від 100 до 200°С. Було встановлено, що вигідним є, наприклад, насичення спирту газоподібним НСl або повторне насичення в процесі реакції. Альтернативно, заміщення фтору на алкоксильну гр упу у 2-положенні піридильного замісника може бути здійснене на більш ранній стадії синтезу, наприклад, на стадії оксимів кетонів або амінокетонів. У таких випадках реакції протікають в умовах, порівнянних з умовами, щойно описаними для проміжної сполуки Іb (22с). Способи Е, F і G Сполуки згідно з винаходом, в яких R3 являє собою амідний замісник (R3=NR7COR10), по-перше, одержують з 4(5)-(2-галогенпіридин-4-іл)заміщених 2-тіоімідазолів. Спосіб (спосіб Е) проілюстрований на схемі 6.1 з використанням як прикладу 2-бензоїламідо (R3=NHCOPh), R 1 п= фтор феніл, По-друге, після гідролізу амідів до аміно-заміщених (R3=NR7H, NHR10) 2-тіоімідазолів і їх повторного ацилювання або перетворення в аміди, сечовини і уретани, можуть бути одержані додаткові амідні замісники (спосіб F). Це проілюстровано на схемі 6.2. По-третє, 2амінопіридинові сполуки-попередники можуть бути одержані з 4(5)-(2-галогенпіридин-4-ільних) сполук через 4(5)-(2-азидопіридин-4-ільні) сполуки (спосіб G). У такому варіанті галоген нуклеофільно заміщують азидом лужного металу, і азидну групу Доцільно проводити реакцію в аміді, що розглядається, який, переважно, використовують в кількості від 5 до 20 мольних еквівалентів на мольний еквівалент сполуки (Іb). Температура реакції звичайно коливається від 100 до 200°С. За бажання, також можливе використання інертного розчинника, такого як діоксан, диметилформамід, діетилацетамід, тетраетилсечовина, метилпіролідон і т.д., і відповідних допоміжних домішок, таких як карбонати лужних металів або галогеніди одновалентної міді (для нейтралізації кількості кислоти, що вивільняється, або для каталізу елімінування галогену). 2-Амінопіридинові сполуки можуть бути одержані з 2-амідоацилпіридинів шляхом гідролізу (6.2) або, крім того, заміщенням на азид у 2фторзаміщених сполуках і подальшим відновленням 2-азидопіридинів (6.3), наприклад, гідруванням на паладії-на-вугіллі у спиртових розчинниках. 19 80718 Можливі подальші перетворення одержаних амінів (Ik, Id) за допомогою одержання похідних (спосіб F). При цьому використовуються реакції амінів Id і Ik як з ангідридами кислот, так і з хлорангідридами кислот з одержанням додаткових амідів, а також реакції з хлорформіатними складними ефірами з одержанням уретанів, з ізоціанатами з одержанням сечовин і з ацилізоціанатами з одержанням ацилсечовин. Утворення даних похідних проілюстроване на схемі 7. Схема 7 Перетворення амінів (Ik, Id) в аміди, уретани і сечовини 20 Сполуки згідно з винаходом демонструють імуномодулюючу та інгібуючу вивільнення цитокіну активність in vitro і in vivo. Цитокіни являють собою білки, такі як TNF-a і IL-b, які відіграють важливу роль в численних запальних захворюваннях. У світлі їх інгібуючої вивільнення цитокіну дії, сполуки згідно з винаходом є придатними для лікування порушень, які пов'язані з розладом імунної системи. Вони є придатними, наприклад, для лікування аутоімунних захворювань, рака, ревматоїдного артриту, подагри, септичного шоку, остеопорозу, невропатичного болю, поширення ВІЛ, недоумства при ВІЛ, вірусного міокардиту, інсулін-залежного діабету, перидонтальних порушень, рестенозу, алопеції, зменшення кількості Т-клітин, пов'язаного з ВІЛ-інфекцією або СНІДом, псоріазу, гострого панкреатиту, реакцій відторгнення алогенних трансплантатів, алергічної пневмонії, артеріосклерозу, розсіяного склерозу, кахексії, хвороби Альцгеймера, інсульту, приступів, виразкового коліту, хвороби Крона, запального захворювання кишечнику (ЗЗК), ішемії, застійної серцевої недостатності, легеневого фіброзу, гепатиту, гліобластоми, синдрому Гуйлайна-Барра, системного червоного вовчака, респіраторного дистрес-синдрому у дорослих (ARDS) і респіраторного дистрес-синдрому. Сполуки згідно з винаходом можна вводити або як індивідуальні терапевтично активні сполуки, або у вигляді суміші з іншими терапевтично активними сполуками. Сполуки можна вводити самі по собі; однак, звичайно, їх вводять до складу лікарського засобу і вводять у вигляді фармацевтичних композицій, тобто у вигляді сумішей активних сполук з відповідними фармацевтичними носіями або розріджувачами. Сполуки або композиції можна вводити перорально або парентерально; переважно їх вводять у вигляді пероральних препаративних лікарських форм. Тип фармацевтичної композиції або носія, або розріджувача залежить від бажаної форми введення. Пероральні композиції, наприклад, можуть бути представлені у вигляді таблеток або капсул і можуть включати в себе звичайні ексципієнти, такі як зв'язувальні речовини (наприклад, сироп, аравійська камедь, желатин, сорбіт, трагакант або полівінілпіролідон), наповнювачі (наприклад, лактоза, цукор, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцерин), гліданти (наприклад, стеарат 21 80718 22 магнію, тальк, поліетиленгліколь або діоксид гліцеринфосфату, 10мкг/мл БСА, 1мМ DTT, кремнію), розпушувальні речовини (наприклад, 100мкл АТФ, 100мкМ Na3VO4 , 10нг активованого крохмаль) або змочувальні агенти (наприклад, р38a) у присутності або за відсутності інгібітору, і лаурилсульфат натрію). Рідкі пероральні планшети інкубували при 37°С протягом 1 години. препарати можуть мати вигляд водних або Планшети промивали три рази і потім інкубували з масляних суспензій, розчинів, емульсій, сиропів, фосфор-ΑΝΡ-2 антитілом протягом однієї години. еліксирів або спреїв і тому подібне. Вони також Планшети ще раз тричі промивали і козячий IgG можуть являти собою сухий порошок, вологовміст проти антитіл кролика, мічений лужною якого відновлюють з використанням води або фосфа тазою, додавали при 37°С і залишали на іншого відповідного носія. Такі рідкі препарати одну годину (для фіксації комплексу антитіломожуть включати звичайні домішки, наприклад, фосфорильований білок/субстрат). Планшети суспендуючі агенти, смакові агенти, розріджувачі тричі промивали і розчин лужна або емульгатори. Для парентерального введення фосфа таза/субстрат (3мМ 4NPP, 50мМ NaHCO3, можливе застосування розчинів або суспензій зі 50мМ MgCl2, 100мкл/ямку) додавали при 37°С і звичайними фармацевтичними носіями. залишали на 1,5 години. Утворення 4Сполуки або композицій згідно з винаходом нітрофеноляту вимірювали при 405нМ з можна вводити ссавцям (людина або тварина) в використанням рідера для мікротитрувальних дозі від приблизно 0,5мг до 100мг на кг масу тіла планшетів. Розраховували величини ІС50 . на добу. їх можна вводити у вигляді однієї окремої Результати випробувань in vitro показані дози або у вигляді множини доз. Спектр активності нижче в таблиці 1. сполук як інгібіторів вивільнення цитокінів був досліджений з використанням наведеної нижче системи випробувань, як описано [C. Donat і S. Laufer в Arch. Pharm. Pharm. Med. Chem., 333, Результати випробувань suppl.1, 1-40, 2000]. Випробування in vivo з використанням цільної Сполука № IC50 (мкM) p 38 IC50 (мкM) TNF-a PBMC A IL-1b крові людини 25а 2,2 0,35 Речовину, що досліджується, додавали до 25b 3,8 2,8 0,30 зразків калій-EDTA цільної крові людини (по 25с 8,7 4,6 2,7 400мкл кожний) і зразки заздалегідь інкубували в 25d 1,9 0,15 інкубаторі з СО2 (5% СО2; 95% насичене вологою 25е 3,1 0,50 повітря) при 37°С протягом 15 хвилин. Зразки 25f 0,65 0,63 0,108 потім стимулювали 1мкг/мл LPS (Е.соіі 026:В6) при 25g 0,79 0,64 0,056 37°С в інкубаторі з СО2 (5% СО2; 95% насичене 25h 0,83 0,67 0,085 вологою повітря) протягом 4 годин. Реакцію 25і 0,95 0,50 0,15 зупиняли, вміщуючи зразки на лід, додаючи DPBS 25j 0,70 0,72 0,23 буфер і потім центрифугуючи при 1000g протягом 25k 0,13 0,34 0,030 15 хвилин. Потім з використанням ELISA 25l 0,24 0,35 0,031 визначали кількість IL-1b і TNF-a в супернатанті 25m 0,38 0,16 0,039 плазми. 25n 0,34 0,17 0,041 Тест in vitro з використанням PBMCs 25o 0,90 0,37 0,044 1) Моноядерні клітини (PBMCs) з калій-ЕДТА 26a 60,0 1,8 цільної крові людини, розведеної 1:3, виділяли 26b 4,2 40,5 2,9 градієнтним за щільністю центрифугуванням 26c 1,42 3,2 0,20 Ò (Histopaque -1.077). Клітини промивали двічі 26d 0,38 2,7 0,045 буфером DPBS, повторно суспендували в 26e 21,0 0,18 макрофаговому середовищі SFM і доводили до 27a 12,0 2,1 числа клітин 1x10бклітин/мл. 27b 9,3 6,9 2,45 Одержану суспензію PBMCs (зразок в кожному 27c 1,45 2,0 0,47 випадку 390мкл) і речовину, що досліджується 27d 0,27 0,91 0,040 заздалегідь інкубували при 37°С в інкубаторі з СО2 (5% СО2; 95% насичене вологою повітря) протягом Наведені нижче приклади ілюструють винахід, 15 хвилин. Зразки потім стимулювали в кожному не обмежуючи його. випадку 1мкг/мл LPS (Е.соіі 026:В6) при 37°С в Приклад 1 інкубаторі з СО2 (5% СО2; 95% насичене вологою а) 4-(4-Фторфеніл)-5-піридин-4-іл-1,3повітря) протягом 4 годин. Реакцію зупиняли, дигідроімідазол-2-тіон вміщуючи зразки на лід, додаючи DPBS буфер і 2-(4-фторфеніл)-3-гідрокси-3-піридин-4потім центрифугуючи при 15880 g протягом 12 ілакрилонітрил (а1) хвилин. Потім з використанням ELISA визначали Суміш етилізонікотинату (75,8г; 0,5моль) і 4кількість IL-1b і TNF-a в супернатанті плазми. фтор фенілацетонітрилу (67,6г; 0,5моль) додавали 2) Кіназний аналіз краплями до розчину металевого натрію (17,3г; При 37°С мікротитрувальні планшети 0,7моль) в абсолютному етанолі (250мл). покривали протягом однієї години 50мкл розчину Реакційну суміш перемішували при 100°С ATF2 (20мкг/мл). Планшети промивали три рази протягом 15 хвилин. Потім реакційну суміш водою і в ямки додавали 50мкл кіназної суміші охолоджували на крижаній бані і додавали 600мл (50мМ трис-НСІ, 10мМ MgCl2, 10мМ bдистильованої води. Коли суміш підкислювали 23 80718 24 1 концентрованою НСl (90мл), при рН 1 утворювався H-ЯМР (ДМСО-d6): d (м.ч.) 1,1 (м, 2Н, 4-F-Ph), жовтий осад гідрохлориду а1. Осад 7,3 (м, 2Н, 4-Руr), 7,5 (м, 2Н, 4-F-Ph), 8,5 (м, 2Н, 4відфільтровували, промивали Н2О і сушили при Руr), 12,7 (д, 2Н, що обмінюється, NH). зниженому тиску над Р2 О5. Т. пл. 226°С. Відповідним чином були одержані наступні 2-(4-Фторфеніл)-1 -піридин-4-ілетанон (а2) сполуки. Розчин а1 (40,6г; 0,15моль) в 48%-ній 1b: 3-(4-фторфеніл)-5-піридин-4-іл-1,3бромистоводневій кислоті (130мл) перемішували дигідроімідазол-2-тіон при кипінні зі зворотним холодильником протягом 1с: 4-(4-хлорфеніл)-5-піридин-4-іл-1,319 годин. Суміш охолоджували на крижаній бані і дигідроімідазол-2-тіон одержаний осад (4-фторфенілоцтової кислоти) 1d: 4-(4-бромфеніл)-5-піридин-4-іл-1,3відфільтровували і промивали Н 2О. Коли фільтрат дигідроімідазол-2-тіон нейтралізували водним аміаком (80мл), 1e: 4-феніл-5-піридин-4-іл-1,3-дигідроімідазолодержували а2 у вигляді темно-зеленого осаду, 2-тіон який відфільтровували, промивали Н 2О і сушили Приклад 2 при зниженому тиску над P2O5; світло1-Хлорметил-4-метилсульфанілбензол (2) сірий/бежевий порошок. Т. пл. 215°С. 4-Метилсульфанілбензиловий спирт (30,5г; Оксим 2-(4-фторфеніл)-1-піридин-4-ілетанону 0,2моль) розчиняли в дихлорметані (180мл). (а3) Розчин тіонілхлориду (23,8г; 0,2моль) в У суспензію а2 (21,5г; 0,1моль) в 50%-ному дихлорметані (120мл) додавали краплями до метанолі (350мл) вводили ацетат натрію (36,1г; первинної суміші, яку витримували при кипінні зі 0,44моль) і гідрохлорид гідроксиламіну (22,0г; зворотним холодильником. Реакційну суміш 0,32моль). Реакційну суміш перемішували при перемішували при кипінні зі зворотним кипінні зі зворотним холодильником протягом 1 холодильником додатково протягом 2 годин. години. Коли прохолодний розчин охолоджували Розчин охолоджували до кімнатної температури, на крижаній бані, а3 одержували у вигляді промивали Н 2О (2x250мл), сушили над Na2SO4 і бежевого осаду, який відфільтровували, концентрували. Маслянистий осад (6) очищали промивали Н2О і сушили при зниженому тиску над колонковою хроматографією (Аl2О 3, СН2Сl2). , 1 Р2О5 . H-ЯМР (CDCl3): d (м.ч.) 2,46 (с, 3Н, СН3), 4,5 Т. пл. 155°С. (с, 2Н, СН2), 7,2-7,3 (кв, 4Н, 4-MeC-Ph). О-[(4-Ме тилфеніл)сульфоніл]оксим 2-(4Приклад 3 фтор феніл)-1-піридин-4-ілетанону (а4) 1-Хлорметил-4-метансульфінілбензол (3) В атмосфері аргону а3 (10,1г; 0,04моль) Розчин 2 (17,3г; 0,1моль) в крижаній оцтовій розчиняли в абсолютному піридині (50мл). Розчин кислоті (150мл) охолоджували до 10°С. До охолоджували до 6°С і потроху з плином часу спочатку завантаженого розчину додавали додавали толуолсульфо хлорид (10,1г; 0,05моль). краплями розчин Н2О2 (35% розчин 35%-ної По закінченні додавання реакційну суміш концентрації; 13,1г; 0,13моль) в крижаній оцтовій перемішували при кімнатній температурі протягом кислоті. Реакційну суміш перемішували при 20 годин. Потім суміш виливали в 500мл крижаної кімнатній температурі протягом 2 годин. Суміш води. Осад (а4) відфільтровували, промивали охолоджували на крижаній бані, додавали лід холодної Н2О і сушили в сушильній камері при (200г) і суміш нейтралізували аміачною водою 50°С. Т. пл. 201°С. (290мл). Водну фазу екстрагували етилацетатом а) 4-(4-Фторфеніл)-5-піридин-4-іл-1,3(2x300мл). Органічну фазу промивали Н 2О дигідроімідазол-2-тіон (1а) (2x300мл), сушили над Na2SO4 і концентрували. В атмосфері аргону розчин а4 (10,0г; Розтиранням і охолоджуванням маслянистого 0,03моль) в абсолютному етанолі (56мл) осаду одержували 3 в кристалічному вигляді. 1 охолоджували до 5°С і додавали краплями H-ЯМР (CDCl3): d (м.ч.) 2,73 (3, 3Н, СН3), 4,6 свіжоприготований розчин металевого натрію (с, 2Н, СН2), 7,5 (д, 2Н, 4-MeC(O)-Ph), 7,6 (д, 2Н, 4(0,75г; 0,03моль) в абсолютному етанолі (30мл). MeC(O)-Ph). Реакційну суміш перемішували при 5°С протягом 5 Приклад 4 годин. Після додавання діетилового ефіру (500мл) 1-Хлорметил-4-метансульфонілбензол (4) перемішування продовжували протягом 30 хвилин. м-Хлорпербензойну кислоту (70%; 8,6г; Осад (TosOH) відфільтровували і промивали 0,04моль) вводили в розчин 3 (3,0г; 0,02моль) в діетиловим ефіром (4x50мл). Об'єднану ефірну хлороформі (50мл). Реакційну суміш фазу екстрагували 10% соляною кислотою перемішували при кипінні зі зворотним (3x90мл). Водний екстракт концентрували холодильником протягом 4 годин. Суміш приблизно до об'єму 40мл і додавали тіоціанат охолоджували до кімнатної температури і калію (5,0г; 0,05моль). Реакційну суміш фільтрували. Фільтрат промивали насиченим перемішували при кипінні зі зворотним розчином NaHCO3 (2x) і сушили над Na2SO4. Після холодильником протягом 1 години. Коли суміш концентрування органічної фази в залишку нейтралізували 5%-ним розчином бікарбонату одержували 4 у вигляді кристалічної білої твердої натрію (270мл), одержували а5 у вигляді бежевого речовини. Т. пл. 102°С. 1 осаду, який відфільтровували, промивали Н2О і H-ЯМР (CDCl3): d (м.ч.) 3,07 (с, 3Н, СН3), 4,6 сушили в сушильній камері при 60°С. Вихід 5,6г (с, 2Н, СН2), 7,6 (д, 2Н, 4-МеСО2-Рh), 7,9 (д, 2Н, 4(79%); т. пл. 382°С. MeCO2-Ph). Приклад 5 Метил-5-хлорсульфоніл-2-гідроксибензоат (5а) 25 80718 26 1 5а одержували з метилсаліцилату (10,0г; H-ЯМР (ДМСО-d 6): d (м.ч.) 2,47 (с, 3Н, СН3), 65,7ммоль) з використанням способу, описаного 7,33 (д, 1Н, 2,4Гц, С6-Н), 7,52 (д, 1Н, 2,4Гц, С4-Н), для синтезу 5с. фенол-ОН і СО2Н не видні. 1 H-ЯМР (CDCl3): d (м.ч.) 4,05 (с, 3Н, СН3), 7,18 4-Метокси-3-метилсульфанілбензойна кислота (д, 1Н, 8,9 Гц, С3-Н), 8,09 (дд, 1Н, 2,5/9,0Гц, С4-Н), (7с) 8,57 (д, 1Н, 2,5 Гц, С6-Н), 11,55 (с, 1Н, Трифенілфосфін (20,5г; 78,2ммоль) поступово обмінюваний, фенол-ОН). вводили в розчин 5с (5,1г; 18,3ммоль) в толуолі Метил 5-хлор-3-хлорсульфоніл-2(50мл). Реакційну суміш перемішували при гідроксибензоат (5b) кімнатній температурі протягом 4,5 годин. Осад 5b одержували з метил(5-хлор)саліцилату (трифенілфосфіноксид) відфільтровували і жовтий (16,0г; 85,7ммоль) з використанням способу, фільтрат екстрагували водний розчином описаного для синтезу 5с. гідроксиду натрію 10%-ної концентрації (4х). До 1 об'єднаного водного екстракту додавали H-ЯМР (CDCl3): d (м.ч.) 4,06 (с, 3Н, СН3), 8,11 диметилсульфат (2мл) і реакційну суміш (д, 1Н, 2,7 Гц, С6-Н), 8,19 (д, 1Н, 2,7Гц, С4-Н), 12,09 перемішували при кімнатній температурі протягом (с, 1Н, обмінюваний, фенол-ОН). 2 годин. Одержаний осад розчиняли шляхом Етил 3-хлорсульфоніл-4-метоксибензоат (5с) нагрівання до температури кипіння зі зворотним Розчин етил(4-метокси)бензоату (15,7г; холодильником. Прозорий розчин охолоджували і 87,2ммоль) в ССl4 (60мл) охолоджували до -15°С і доводили до рН 1 з використанням соляної додавали краплями протягом 15 хвилин кислоти 20%-ної концентрації. Осад (7с) хлорсуль фонову кислоту (17,5мл; 263ммоль), що відфільтровували, промивали Н2О і сушили при приводило до підвищення температури до -10°С. зниженому тиску над СаСl2. По закінченні додавання реакційну суміш 1 перемішували при кімнатній температурі протягом H-ЯМР (CD3OD): d (м.ч.) 2,43 (с, 3Н, S-CH3), 2 годин і потім нагрівали при 50°С доти, доки 3,93 (с, 3Н, О-СН 3), 6,98 (д, 1Н, 8,4Гц, С5-Н), 7,79вихідна речовина не переставала виявлятись за 7,86 (м, 2Н, С2-/С6-Н) даними тонкошарової хроматографії. При 4-Гідрокси-3-метилсульфанілбензойна кислота охолоджуванні льодом та інтенсивному (7d) перемішуванні реакційну суміш додавали до Суспензію 7с (0,5г, 2,5ммоль) в суміші крижана суспензії льоду (50г) в ССl4 (100мл). Суміш оцтова кислота/48%-на бромистоводнева кислота інтенсивно перемішували протягом 3 хвилин. (1+1,7мл) перемішували, нагріваючи при кипінні із Органічну фазу відділяли і водну фазу зворотним холодильником, протягом 6 годин. екстрагували СН 2Сl2 (3x100мл). Об'єднані Реакційну суміш о холоджували, додавали до Н 2О органічні екстракти промивали насиченим (20мл) і доводили до рН 2 з використанням розчином NaCl (3х), сушили над Na2SO4 і розчину Na2CO3 10%-ної концентрації. Водний концентрували. Розтирання маслянистого розчин екстрагували діетиловим ефіром (4x20мл). коричневого залишку з діетиловим ефіром Об'єднаний органічний екстракт промивали приводило до осадження 5с у вигляді кристалічної насиченим розчином NaCl (2x), сушили над білої речовини. Na2SO4 і концентрували. При зберіганні при 1 кімнатній температурі бруднувато-коричневий H-ЯМР (CDCl3): d (м.ч.) 1,41 (т, 3Н, 7,1Гц, маслянистий залишок (7d) кристалізувався. СН3), 4,14 (с, 3Н, СН3), 4,42 (кв, 2Н, 7,1Гц, СН2), Кристали розтирали з Н 2О, відфільтровували і 7,18 (д, 1Н, 8,8Гц, С5-Н), 8,37 (дд, 1Н, 2,1/8,8Гц, С6Н), 8,63 (д, 1Н, 2,1Гц, С2-Н). сушили. 1 Приклад 6 H-ЯМР (CDCl3): d (м.ч.) 2,38 (с, 3Н, СН3), 7,05 2-Гідрокси-5-меркаптобензойна кислота (6а) (д, 1Н, 8,5Гц, С5-Н), 8,02 (дд, 1Н, 2,2/8,5Гц, С6-Н), 6а одержували з 5а (0,50г; 2,0ммоль) з 8,29 (д, 1Н, 2,2Гц, С2-Н), фенол-ОН і СО2Н не використанням способу, описаного для синтезу 7с, видні. без алкілування диметилсульфатом. Приклад 8 1 2-Гідроксиметил-4-метилсульфанілфенол (8а) H-ЯМР (ДМСО-d6): d (м.ч.) 5,39 (ушир.с, 1Н, 8а одержують з 7а (1,5г; 8,1ммоль) з обмінюваний, карбоксил-ОН), 6,90 (д, 1Н, 8,7Гц, використанням способу, описаного для синтезу 8с. С3-Н), 7,45 (дд, 1Н, 2,5/8,6Гц, С4-Н), 7,75 (д, 1Н, 1 2,5Гц, С6-Н), фенольний-ОН не видний. H-ЯМР (CDCl3): d (м.ч.) 2,42 (с, 3Н, СН3), 4,79 Приклад 7 (с, 2Н, СН2), 6,81 (д, 1Н, 8,4Гц, С6-Н), 7,01 (д, 1Н, 2-Гідрокси-5-метилсульфанілбензойна кислота 2,1Гц, С3-Н), 7,17 (дд, 1Н, 2,3/8,4Гц, С3-Н), ОН не (7а) видний. 7а одержували з 5а (10,0г; 40,0ммоль) з 4-Хлор-2-гідроксиметил-6використанням способу, описаного для синтезу 7с. метилсульфанілфенол (8b) 1 8b одержують з 7b (2,2г; 10,1ммоль) з H-ЯМР (CDCl3): d (м.ч.) 2,48 (с, 3Н, СН3), 6,97 використанням способу, описаного для синтезу 8с. (д, 1Н, 8,7Гц, С3-Н), 7,51 (дд, 1Н, 2,5/8,7Гц, С4-Н), 1 6,97 (д, 1Н, 8,7Гц, С3-Н), 7,87 (д, 1Н, 2,4Гц, С6-Н), H-ЯМР (ДМСО-d 6): d (м.ч.) 2,38 (с, 3Н, СН3), 10,26 (ушир.с, 1Н, фенол-ОН), СО2Н не видний. 4,52 (с, 2Н, СН2), 5,3-5,5 (ушир.с, 1Н, обмінюваний, 5-Хлор-2-гідрокси-3-метилсульфанілбензойна гідроксил-ОН), 7,03 (д, 1Н, 2,6Гц, С5-Н), 7,11 (д, кислота (7b) 2,4Гц, С3-Н), 9,02 (ушир.с, 1Н, обмінюваний, 7b одержували з 5b (13,0г; 45,6ммоль) з фенол-ОН) використанням способу, описаного для синтезу 7с. 4-Гідроксиметил-2-метилсульфанілфенол (8с) При охолоджуванні льодом розчин 7d (1,37г; 7,4ммоль) в абсолютному тетрагідрофурані (ТГФ; 27 80718 28 15мл) додавали до суспензії LiAlH4 95%-ної Мас-спектр: m/z (%) 253 (90, М+), 217 (100, М+чистоти (0,55г; 14ммоль) в абсолютному ТГФ в СІ), 189 (35), 153 (97, М+-SO2Cl), 125 (94), 119 (65, тригорлій колбі (яка була висушена нагріванням і фенілпропілкарбеній+), 91(90), 77 (29, феніл+). продуванням аргоном) таким чином, що Приклад 11 відбувається тільки помірне виділення газу. По 1-(3-Хлоретил)-4-метилсульфанілбензол (11а) закінченні додавання охолоджування видаляли і Па одержували з 10а (12,0г; 0,05моль) з реакційну суміш перемішували при кімнатній використанням способу, описаного для синтезу температурі і при 55-65°С протягом наступної 21 11b. 1 години. При охолоджуванні льодом до реакційної H-ЯМР (CDCl3): d (м.ч.) 2,47 (с, 3Н, СН3), 3,02 суміші додавали крижану воду. Осад Аl(ОН)3 (т, 2Н, 7,4Гц, СН2), 3,68 (т, 2Н, 7,5Гц, СН2), 7,11розчиняли за допомогою додавання сірчаної 7,25 (м, 4Н, феніл). кислоти 10%-ної концентрації і кислий водний 1-(3-Хлорпропіл)-4-метилсульфанілбензол розчин (рН 1) екстрагували діетиловим ефіром (11b) (3x50мл). Об'єднані ефірні екстракти екстрагували При кімнатній температурі розчин 10b (12,7г; водним розчином гідроксиду натрію 10%-ної 5,0ммоль) в діетиловому ефірі (75мл) додавали концентрації (2x25мл). Об'єднаний розчин краплями протягом 2,5 годин до суспензії LiАІН4 гідроксиду натрію нейтралізували соляною (2,9г; 7,6ммоль) в діетиловому ефірі (50мл). По кислотою 20%-ної концентрації. Осад (8с) закінченні додавання реакційну суміш відфільтровували, промивали Н2О і сушили. перемішували при кімнатній температурі час від Додаткову порцію 8с одержували екстракцією часу додаючи LiAIH4 доти, доки вихідна речовина нейтрального водного розчину діетиловим ефіром. не перестане виявлятись з допомогою Ефірний екстракт промивали насиченим розчином тонкошарової хроматографії (2,5год.). При NaCl, сушили над Na2SO4 і концентрували, охолоджуванні льодом в реакційну суміш вводили одержуючи кристалічну білу тверду речовину. лід і водну фазу підкисляли 10% соляною 1 H-ЯМР (CDCl3): d (м.ч.) 2,34 (с, 3Н, СН3), 4,60 кислотою (рН 1). Органічну фазу видаляли і водну (с, 2Н, СН2), 6,97 (д, 1Н, 8,3Гц, С6-Н), 7,24 (дд, 1Н, фазу екстрагували діетиловим ефіром (3х). 2,0/8,4Гц, С5-Н), 7,50 (д, 1Н, 2,0Гц, С3-Н), ОН не Об'єднаний органічний екстракт промивали видний. водним розчином гідроксиду натрію 10%-ної Приклад 9 концентрації (4x50мл) доти, доки він не стане 2-Гідрокси-5-метилсульфанілбензальдегід (9а) візуально безбарвним. До об'єднаного розчину Вказану в заголовку сполуку одержували як гідроксиду натрію додавали диметилсульфат (9,0г; побічний продукт при синтезі 8а. 7,0ммоль) і суміш перемішували при кімнатній 1 температурі протягом 16,5 годин. Маслянистий H-ЯМР (CDCl3): d (м.ч.) 2,48 (с, 3Н, СН3), 6,96 осад вміщували в діетиловий ефір. Органічну фазу (д, 1Н, 9,8Гц, С3-Н), 7,48-7,54 (м, 2Н, С4-/С6-Н), відділяли і водну фазу знову екстрагували 9,87 (с, 1Η, обмінюваний, ОН), 10,91 (с, 1Н, Н), діетиловим ефіром (2х). Об'єднаний органічний Приклад 10 екстракт сушили над Na2SO4 і концентрували. 4-(3-Хлоретил)бензолсульфонілхлорид (10а) Коричневий маслянистий залишок піддавали При охолоджуванні льодом (2перегонці з використанням трубки з кульовим хлоретил)бензол (14,0г; 0,1моль) додавали розширенням (0,2мбар. 250°С). краплями протягом 40 хвилин до хлорсульфонової 1 кислоти (72г). Розчин коричневого кольору H-ЯМР (CDCl3): d (м.ч.) 2,01-2,11 (м, 2Н, СН2), перемішували при кімнатній температурі протягом 2,46 (с, 3Н, СН3), 2,73 (т, 2Η, 7,1Гц, СН2), 3,51 (т, 24 годин, охолоджували на крижаній бані і потроху 2Н, 6,5Гц, СН2), 7,09-7,25 (м, 4Н, феніл). додавали до льоду, де утворювалась в'язка Приклад 12 речовина, яку не вдається відфільтрувати. Водний 1-(2-Хлоретил)-4-метансульфінілибензол (12а)розчин екстрагували етилацетатом (3х). При охолоджуванні до розчину 11а (1,5г; Об'єднаний органічний екстракт промивали 8,0ммоль) в крижаній оцтовій кислоті (20мл) розчином NaHCO3 10%-ної концентрації, сушили додавали розчин Н 2О2 35%-ної концентрації (0,9г; над Na2SO4 і концентрували. Маслянистий 9,3ммоль). По закінченні додавання реакційну залишок вміщували в суміш трет-бутилметиловий суміш перемішували при кімнатній температурі ефір/петролейний ефір. Розчин потирали скляною протягом 2,5 годин, розбавляли при паличкою і охолоджували. Білі кристали охолоджуванні крижаною водою і доводили до рН відфільтровували і сушили. Додаткову кількість 8 з використанням аміачної води 25%-ної реакційного продукту одержували з маточного концентрації. Маслянистий білий осад вміщували розчину. Неочищений продукт використали без в діетиловий ефір і водну фазу екстрагували додаткового очищення для синтезу 11а. діетиловим ефіром (3х). Об'єднані органічні 1 екстракти сушили над Na2SO4 і концентрували. H-ЯМР (CDCl3): d (м.ч.) 3,20 (т, 2Н, 6,8Гц, 1 СН2), 3,79 (τ, 2Н, 6,8Гц, СН2), 7,46-7,53 (м, 2Н, H-ЯМР (CDCl3): d (м.ч.) 2,73 (с, 3Н, СН3), 3,14 феніл), 7,97-8,04 (м, 2Н, феніл). (т, 2Н, 7,1Гц, СН2), 3,76 (т, 2Н, 7,1Гц, СН2), 7,384-(3-Хлорпропіл)бензолсульфонілхлорид (10b) 7,42 (м, 2Н, феніл), 7,60-7,64 (м, 2Н, феніл) 10b одержували з (3-хлорпропіл)бензолу 1-(3-Хлорпропіл)-4-метансульфінілибензол (15,5г; 0,1моль) з використанням способу, (12b) описаного для синтезу 10а. Неочищений продукт 12b одержували з 11b (2,0г; 10,0ммоль) з використали без додаткового очищення для використанням способу, описаного при синтезі синтезу 11b. 12а. Т. пл. 46°С. 29 80718 30 Загальні способи одержання сполук формули З використанням загального способу А, І. вказану в заголовку сполуку одержували з 1b Одержання 2-арилалкілабо (0,42г; 1,5ммоль) і 2 (0,25г; 1,4ммоль) після алкілсульфанілімідазолів (загальний спосіб А) проведення реакції протягом 4,5 годин і Суспензію відповідного імідазол-2-тіону (1 розділення колонковою хроматографією (SiO2 60, еквівалент), відповідної основи (1,2 еквіваленту) і СН2Сl2/EtOH 9+1). відповідного арилалкіл- або алкілгалогеніду (1 Т. пл. 163°С. еквівалент) в суміші етанол/ТГФ (8+2) ІЧ (ATR) (затухаюче сумарне відображення): перемішували при кипінні зі зворотним 1505, 1493, 1222 (C-F), 837, 806 см-1. 1 холодильником доти, доки імідазол-2-тіон не H-ЯМР (ДМСО-d 6): d (м.ч.) 2,45 (с, 3Н, СН3), перестане виявлятися за даними тонкошарової 4,38 (с, 2Н, СН2), 7,19-7,49 (м, 10Н, 3-Руr, 4-F-Ph і хроматографії. Реакційну суміш охолоджували до 4-MeS-Ph), 7,78-7,82 (м, 1Н, 3-Руr), 8,45-8,47 (м, кімнатної температури і фільтрували. Фільтрат, 1Н, 3-Руr), 8,61 (с, 1Н, 3-Pyr), 12,71 (ушир.с, 1Н, який в більшості випадків мав червоне/оранжеве обмінюваний, NH). забарвлення, концентрували і залишок очищали 3-[5-(4-Фторфеніл)-2-(4колонковою хроматографією, перекристалізацією метансульфінілбензилсульфаніл)-3Н-імідазол-4або розтиранням. Таким чином одержували іл]піридин (13b) сполуки 13а-с, 14а-с і 17а-m. З використанням загального способу А, Одержання 2-бензилсульфанілімідазолів, що вказану в заголовку сполуку одержували з 1b містять фенольну функціональну групу в радикалі (0,42г; 1,5ммоль) і 3 (0,27г; 1,5ммоль) після R2 (загальний спосіб В). проведення реакції протягом 8 годин і розділення Додаючи соляну кислоту 10%-ної концентрації колонковою хроматографією (SiO2 60, СН2Сl2/EtOH (10-15 крапель), імідазол-2-тіон 1а (1 еквівалент) 9+1). розчиняли в крижаній оцтовій кислоті (5мл). До Т. пл. 127°С. первинної суміші, що має світло-жовте ІЧ (ATR): 1506, 1222 (C-F), 1027 (S=O), 1013, забарвлення, додавали відповідний бензиловий 838, 811 см -1. 1 спирт (1 еквівалент) і реакційну суміш H-ЯМР (ДМСО-d6): d (3,19 (с, 3Н, СН3), 4,46 (с, перемішували при відповідній температурі 2Н, СН2), 7,16-7,46 (м, 5Н, 3-Pyr і 4-F-Ph), 7,56-7,66 (температура/час) доти, доки 1а не перестане (м, 4Н, 4-MeS(O)-Ph), 7,72-7,81 (м, 1Н, 3-Pyr), 8,41виявлятись за даними тонкошарової 8,62 (м, 2Н, 3-Pyr), 12,77 (ушир.с, 1Н, хроматографії. У випадку сульфоксидів 18g-i обмінюваний, NH). додавали розчин Н2О2 35%-ної концентрації, і 3-[5-(4-Фторфеніл)-2-(4реакційну суміш перемішували при кімнатній метансульфонілбензилсульфаніл)-3Н-імідазол-4температурі додатково протягом 4 годин. іл]піридин (13с) Реакційну суміш розбавляли Н 2О (5мл) і доводили З використанням загального способу А, до рН 8 з використанням аміачної води 25%-ної вказану в заголовку сполуку одержували з 1b концентрації. Осад відфільтровували і промивали (0,42г; 1,5ммоль) і 4 (0,29г; 1,43ммоль) з водою. Неочищений продукт очищали колонковою додаванням Na2CO3 (0,43г; 4,1ммоль) після хроматографією, перекристалізацією або проведення реакції протягом 6,5 годин і розтиранням. Таким чином одержували імідазол-2розтирання з гарячим етилацетатом. ілсульфанілметилфеноли 18а-і. Т. пл. 129°С. Одержання N-заміщених 2-амінопіридинів ІЧ (ATR): 1506,1296 (SO2), 1222 (C-F), 1145 (загальний спосіб С) (SO2), 1089, 839, 812 см -1. 1 В атмосфері аргону відповідний 5-(2H-ЯМР (ДМСО-d 6): d (м.ч.) 3,19 (с, 3Н, СН3), галогенпіридин-4-іл)імідазол (1 еквівалент) 4,50 (с, 2Н, СН2), 7,17-7,45 (м, 5Н, 3-Pyr і 4-F-Ph), суспендували у відповідному аміні (приблизно 10 7,64-7,90 (м, 5Н, 3-Pyr і 4-MeSO 2-Ph), 8,43-8,61 (м, еквівалентів). Реакційну суміш перемішували при 2Н, 3-Pyr), 12,78 (ушир.с, Ш, обмінюваний, NH). відповідній температурі доти, доки вихідна Приклад 14 речовина більше не виявлялась тонкошаровою 4-[5-(4-Хлорфеніл)-2-(4хроматографією. Реакційну суміш охолоджували метилсульфанілбензилсульфаніл)-3Н-імідазол-4до кімнатної температури і вміщували в 10%-ну іл]піридин (14а) лимонну кислоту, яку заздалегідь доводили до рН З використанням загального способу А, 5 з використанням NaOH 20%-ної концентрації. вказану в заголовку сполуку одержували з 1с Водну емульсію екстрагували етилацетатом (3х). (0,26г; 0,9ммоль) і 6 (0,15г; 0,87ммоль) з Об'єднаний органічний екстракт промивали 10%додаванням Na2CO3 (дві порції на кінчику шпателя) ною лимонною кислотою/рН 5 (1х), розчином після проведення реакції протягом 6,5 годин і Na2CO3 10%-ної концентрації (2х), і насиченим розділення колонковою хроматографією (SiO2 60, розчином NaCl (1х), сушили над Na2SO4 і СН2Сl2/EtOH 9+1). концентрували. Маслянистий залишок розділяли Т. пл. 236°С. колонковою хроматографією. Амінопіридини 25f-p, ІЧ (ATR): 1600, 1492, 1094, 1005, 968, 829, 684 26c-d і 27c-d одержували таким чином. (С-Сl), 561 см -1. 1 Приклад 13 H-ЯМР (ДМСО-d 6): d (м.ч.) 2,44 (с, 3Н, СН3), 3-[5-(4-Фторфеніл)-2-(44,38 (с, 2Н, СН2), 7,18-7,56 (м, 10Н, 4-Pyr, 4-Cl-Ph і метилсульфанілбензилсульфаніл)-3Н-імідазол-44-MeS-Ph), 8,45-8,55 (м, 2Н, 4-Pyr), 12,86 (ушир.с, іл]піридин (13а) 1Н, обмінюваний, NH). 31 80718 32 4-[5-(4-Хгюрфеніл)-2-(44-[5-(4-Бромфеніл)-2-(4метансульфінілбензилсульфаніл)-3Н-імідазол-4метансульфонілбензилсульфаніл)-3Н-імідазол-4іл]піридин (14b) іл]піридин (15с) 3 використанням загального способу А З використанням загального способу А вказану в заголовку сполуку одержували з 1с вказану в заголовку сполуку одержували з 1d (0,26г; 0,9ммоль) і 3 (0,16г; 0,85ммоль) з (0,25г; 0,75ммоль) і 4 (0,15г; 0,72ммоль) після додаванням Na2CO3 після проведення реакції проведення реакції протягом 5 годин і розділення протягом 6,5 годин і розділення колонковою колонковою хроматографією (SiO2 60, хроматографією (SiO2 60, СН2Сl2/EtOH 9+1). СН2Сl12/EtOH 9+1). Т. пл. 224°С. Т. пл. 226°С. ІЧ (ATR): 1600, 1510, 1490, 1033 (S=O), 1001, ІЧ (ATR): 1605, 1318, 1303 (SO2), 1145 (SO2), 967, 829, 677 (C-Cl) см -1. 1003, 967, 957, 827, 822 см -1. 1 1 H-ЯМР (ДМСО-d 6): d (м.ч.) 2,70 (с, 3Н, СН3), H-ЯМР (ДМСО-d6): d (мл.) 3,18 (с, 3Н, СН3), 4,47 (с, 2Н, СН2), 7,31-7,65 (м, 10Н, 4-Pyr, 4-Cl-Ph і 4,50 (с, 2Н, СН2), 7,33-7,89 (м, ЮН, 4-Pyr, 4-Br-Ph і 4-MeS(O)-Ph), 8,44-8,54 (м, 2Н, 4-Pyr), 12,87 4-MeSO2-Ph), 8,45-8,54 (м, 2Н, 4-Pyr), 12,89 (ушир.с, 1Н, обмінюваний, NH). (ушир.с, 1Н, обмінюваний, NH). 4-[5-(4-Хлорфеніл)-2-(4Приклад 16 метансульфонілбензилсульфаніл)-3Н-імідазол-44-[2-(4-Метилсульфанілбензилсульфаніл)-5іл]піридин (14с) феніл-3Н-імідазол-4-іл]піридин (16а) З використанням загального способу А 3 використанням загального способу А вказану в заголовку сполуку одержували з 1с вказану в заголовку сполуку одержували з 1e (0,26г; 0,9ммоль) і 3 (0,16г; 0,85ммоль) з (0,38г; 1,5ммоль) і 2 (0,25г; 1,4ммоль) після додаванням Na2CO3 (дві порції на кінчику шпателя) проведення реакції протягом 5,75 годин і після проведення реакції протягом 6,5 годин і розділення колонковою хроматографією (SiO2 60, розділення колонковою хроматографією (SiO2 60, СН2Сl2/EtOH 9+1). СН2Сl2/EtOH 9+1). Т. пл. 213°С. Т. пл. 232°С. ІЧ (ATR): 1601, 1491, 1417, 1094, 1004, 967, ІЧ (ATR): 1603, 1490, 1300 (SO2), 1141 (SO2), 828, 771, 700 см -1. 1 1086, 1002, 952, 829, 681 (C-Cl), 550 см-1. H-ЯМР (ДМСО-d6): d (2,44 (с, 3Н, СН3), 4,38 (с, 1 H-ЯМР (ДМСО-d 6): d (м.ч.) 3,19 (с, 3Н, СН3), 2Н, СН2), 7,18-7,58 (м, 11Н, 4-Pyr, Ph і 4-MeS-Ph), 4,52 (с, 2Н, СН2), 7,32-7,58 (м, 6Н, 4-Pyr і 4-Cl-Ph), 8,44-8,47 (м, 2Н, 4-Pyr), 12,82 (ушир.с, 1Н, 1,61 (д, 2Н, 8,2 Гц, 4-MeSO2-Ph), 7,88 (д, 2Н, 8,3Гц, обмінюваний, NH). 4-MeSO2-Ph), 8,45-8,55 (м, 2Н, 4-Pyr), 12,89 4-[2-(4-Метансульфінілбензилсульфаніл)-5(ушир.с, 1Н, обмінюваний, NH). феніл-3Н-імідазол-4-іл]піридин (16b) Приклад 15 З використанням загального способу А 4-[5-(4-Бромфеніл)-2-(4вказану в заголовку сполуку одержували з 1е метилсульфанілбензилсульфаніл)-3Н-імідазол-4(0,38г; 1,5ммоль) і 3 (0,27г; 1,43ммоль) після іл]піридин (15а) проведення реакції протягом 5,5 годин і З використанням загального способу А розділення колонковою хроматографією (SiO2 60, вказану в заголовку сполуку одержували з 1d СН2Сl2/EtOH 9+1). (0,25г; 0,75ммоль) і 2 (0,13г; 0,72ммоль) після Т. пл. 189°С. проведення реакції протягом 5 годин і розділення ІЧ (ATR): 1603, 1494, 1051 (S=O), 1003, 833, колонковою хроматографією (SiO2 60, СН2Сl2/EtOH 701 см-1. 1 9+1). H-ЯМР (ДМСО-d 6): d (м.ч.) 2,71 (с, 3Н, СН3), ІЧ (ATR): 1600, 1517, 1490, 1089, 1069, 1003, 4,48 (с, 2Н, СН2), 7,32-7,52 (м, 7Н, 4-Pyr і Ph), 7,57968, 826 см -1. 7,67 (м, 4Н, 4-MeS(O)-Ph), 8,45-8,54 (м, 2Н, 4-Pyr), 1 12,84 (ушир.с, 1Н, обмінюваний, NH). H-ЯМР (ДМСО-d 6): d (м.ч.) 2,43 (с, 3Н, СН3), 4,36 (с, 2Н, СН2), 7,16-7,87 (м, 10Н, 4-Pyr, 4-Br-Ph і 4-[2-(4-Метансульфонілбензилсульфаніл)-54-MeS-Ph), 8,45-8,55 (м, 2Н, 4-Pyr), 12,90 (ушир.с, феніл-3Н-імідазол-4-іл]піридин (16с) 1Н, обмінюваний, NH). З використанням загального способу А 4-[5-(4-Бромфеніл)-2-(4вказану в заголовку сполуку одержували з 1е метансульфінілбензилсульфаніл)-3Н-імідазол-4(0,38г; 1,5ммоль) і 4 (0,29г; 1,43ммоль) після іл]піридин (15b) проведення реакції протягом 4,25 годин і 3 використанням загального способу А розділення колонковою хроматографією (SiO2 60, вказану в заголовку сполуку одержували з 1d СН2Сl2/EtOH 9+1). (0,25г; 0,75ммоль) і 3 (0,14г; 0,72ммоль) після Т. пл. 247°С. проведення реакції протягом 10 годин і розділення ІЧ (ATR): 1602, 1298 (SO2), 1145 (SO2), колонковою хроматографією (SiO2 60, СН2Сl2/EtOH 1006,953, 827, 775, 701 см-1. 1 9+1). H-ЯМР (ДМСО-d 6): d (м.ч.) 3,21 (с, 3Н, СН3), Т.пл.222°С. 4,54 (с, 2Н, СН2), 7,31-7,58 (м, 7Н, 4-Pyr і Ph), 7,70 ІЧ (ATR): 1604,1487, 1035 (S=O), 1010, 1000, (д, 2Н, 8,3Гц, 4-MeSO2-Ph), 7,91 (д, 2Н, 8,3Гц, 4966, 822 см -1. MeSO2-Ph), 8,45-8,59 (м, 2Н, 4-Pyr), 12,87 (ушир.с, 1 H-ЯМР (ДМСО-d 6): d (м.ч.) 2,71 (с, 3Н, СН3), 1Н, обмінюваний, NH). 4,48 (с, 2Н, СН2), 7,40-7,62 (м, 20Н, 4-Pyr, 4-Br-Ph і Приклад 17 4-MeS(O)-Ph), 8,49-8,57 (м, 2Н, 4-Pyr), 12,90 (ушир.с, 1Н, обмінюваний, NH). 33 80718 34 4-{5-(4-Фторфеніл)-2-[2-(4з додаванням Na2CO3 (1 порція на кінчику метансульфінілфеніл)етилсульфаніл]-1Н-імідазолшпателя) і каталітичної кількості Nal після 4-іл}піридин (17а) проведення реакції протягом 70 годин і розтирання З використанням загального способу А з EtOH. вказану в заголовку сполуку одержували з 1а Т. пл. 183°С. (0,25г; 0,9ммоль) і 12а (0,22г; 1,1ммоль) з ІЧ (ATR): 1226 см -1 (C-F). 1 додаванням Na2CO3 (1 порція на кінчику шпателя) H-ЯМР (ДМСО-d6): d (м.ч.) 1,90-2,04 (м, 2Н, і каталітичної кількості Nal, після проведення СН2), 2,72 (т, 2Η, 7,4Гц, СН2), 3,12 (т, 2Н, 7,0Гц, реакції протягом 50 годин і розділення колонковою СН2), 7,18-7,51 (м, 11Н, 4-Pyr, 4-F-Ph і Bz), 8,37хроматографією (SiO2 60, СН2Сl2/EtOH 9+1). 8,44 (м, 2Н, 4-Pyr), 12,82 (ушир.с, 1Н, Т. пл. 177°С. обмінюваний, NH). ІЧ (ATR): 1221 (C-F), 1032 (S=O) см -1. 4-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазол1 2-ілсулдьфаніл]ацетонітрил (17f) H-ЯМР (ДМСО-d 6): d (м.ч.) 2.71 (с, 3Н, СН3), 3,06-3,13 (м. 2Н, СН2), 3,42-3,49 (м, 2Н, СН2), 7,25З використанням загального способу А 7,65 (м, 10Н, 4-Pyr, 4-F-Ph і 4-MeS(O)-Ph), 8,40вказану в заголовку сполуку одержували з 1а (1,1г; 8,58 (м, 2Н, 4-Pyr), 12,80 (ушир.с, 1Н, 4,0ммоль) і хлорацетонітрилу (0,30г; 4,0ммоль) обмінюваний, NH). після проведення реакції протягом 18 годин і 4-{5-(4-Фторфеніл)-2-[2-(4очищення колонковою хроматографією (SiO2 60, метансульфінілфеніл)пропілсульфаніл]-1Нетилацетат). імідазол-4-іл}піридин(17b) Т. пл.219°С. З використанням загального способу А ІЧ (ATR): 2243 (CN), 1226 см-1 (C-F). 1 вказану в заголовку сполуку одержували з 1а H-ЯМР (ДМСО-d 6): d (м.ч.) 4,32 (с, 2Н, СН2), (0,25г; 0,9ммоль) і 12b (0,22г; 1,0ммоль) з 7,34-7,57 (м, 6Н, 4-Pyr і 4-F-Ph), 8,50-8,52 (м, 2Н, 4додаванням Na2CO3 (1 порція на кінчику шпателя) і Pyr), 13,20 (ушир.с, 1Н, обмінюваний, NH). каталітичної кількості Nal, після проведення 4-[5-(4-Фторфеніл)-2-(нафталін-1реакції протягом 40 годин і розділення колонковою ілметилсульфаніл)-1Н-імідазол-4-іл]піридин (17g) хроматографією (SiO2 60, СН2Сl2/EtOH 9+1). З використанням загального способу А Т. пл. 142°С. вказану в заголовку сполуку одержували з 1а ІЧ (ATR): 1222 (C-F), 1043 (S=O) см -1. (0,28г; 1,0ммоль) і 1-хлорметилнафтолу (0,18г; 1 H-ЯМР (ДМСО-d6): d (м.ч.) 1,95-2,09 (м, 2Н, 1,0ммоль) після проведення реакції протягом 6,5 СН2), 2,71 (с, 3Н, СН3), 2,82 (т, 2Н, 7,4Гц, СН2), годин і очищення колонковою хроматографією 3,15 (т, 2Η, 7,0Гц, СН2), 7,25-7,62 (м, 10Н, 4-Pyr, 4(SiO2 60, етилацетат). F-Ph і 4-MeS(O)-Ph), 8,46-8,49 (м, 2Н, 4-Pyr), 12,86 Т. пл. 364°С. (ушир.с, 1Н, обмінюваний, NH). ІЧ (ATR): 1225 см -1 (C-F), 1 4-[2-Бензилсульфаніл-5-(4-фторфеніл)-1НH-ЯМР (ДМСО-d6) d (м.ч.) 4,90 (с, 2Н, СН2), імідазол-4-іл]піридин (17с) 7,25-7,62 (м. 10Н, 4-Pyr, 4-F-Ph і на фтил), 7,80-7,98 З використанням загального способу А (м, 2Н, нафтил), 8,20-8,23 (м, 1Н, нафтил), 8,48вказану в заголовку сполуку одержували з 1а 8,52 (м, 2Н, 4-Pyr), 12 (ушир.с, 1Н, обмінюваний, (0,28г; 1,0ммоль) і 1-хлорметилбензолу (0,13г; NH). 1,0ммоль) після проведення реакції протягом 6 4-[2-2-Циклогексилметилсульфаніл-5-(4годин і розтирання з МеОН. фтор феніл)-1Н-імідазол-4-іл]піридин (17h) Т. пл. 223°С. З використанням загального способу А ІЧ (ATR): 1233 см -1 (C-F). вказану в заголовку сполуку одержували з 1а 1 H-ЯМР (ДМСО-d 6): d (м.ч.) 4 ,41 (с, 2Н, СН2), 7(0,25г; 0,9ммоль) і 1-хлорметилциклогексану 23-7,51 (м, 11Н, 4-Pyr, 4-F-Ph і Bz), 8,44-8,47 (м, (0,18г; 1,0ммоль) з . додаванням Na2CO3 (1 порція 2Н, 4-Pyr), 12,82 (ушир.с, 1Н, обмінюваний, NH). на кінчику шпателя) і каталітичної кількості Nal 4-[5-(4-Фторфеніл)-2-фенетилсульфаніл-1Нпісля проведення реакції протягом 47 годин і імідазол-4-іл]піридин (17d) розтирання з EtOH. З використанням загального способу А Т. пл. 235°С. вказану в заголовку сполуку одержували з 1а (0,5г; ІЧ (ATR): 2922,2852 (с-Нех), 1222 см-1 (C-F), 1 1,9ммоль) і 2-хлоретилбензолу (0,28г; 2,0ммоль) з H-ЯМР (ДМСО-d6): d (м.ч.) 0,95-1,23 (м, 5Н, додаванням Na2CO3 (1 порція на кінчику шпателя) цикло-Нех), 1,51-1,85 (м, 6Н, цикло-Нех), 3,06 (д, і каталітичної кількості Nal після проведення 2Н, 6,7Гц, СН2), 7,22-7,51 (м, 6Н, 4-Pyr і 4-F-Ph), реакції протягом 70 годин і розтирання з EtOH. 8,43-8,45 (м, 2H, 4-Pyr), 12,76 (ушир.с, 1Н, Т. пл. 257°С. обмінюваний, NH). ІЧ (ATR): 1223 см -1 (C-F). 4-[5-(4-Фторфеніл)-2-метилсульфаніл-1Н1 H-ЯМР (ДМСО-d6): d (м.ч.) 2,99 (т, 2Н, 7,4Гц, імідазол-4-іл]піридин (17і) СН2), 3,40 (т, 2Н, 7,5Гц, СН2), 7,17-7,53 (м, 11Н, 4З використанням загального способу А Pyr, 4-F-Ph і Bz), 8,44-8,46 (м, 2Н, 4-Pyr), NH не вказану в заголовку сполуку одержували з 1а видний. (0,41г; 1,5ммоль) і йодистого метилу (0,27г; 4-[5-(4-Фторфеніл)-2-(31,9ммоль) після проведення реакції протягом 8 фенілпропілсульфаніл)-1Н-імідазол-4-іл]піридин годин і розтирання з EtOH. (17е) Т. пл. 263°С. З використанням загального способу А ІЧ (ATR): 1226 см -1 (C-F). вказану в заголовку сполуку одержували з 1а (0,5г; 1,9ммоль) і 3-хлорпропілбензолу (0,28г; 2,0ммоль) 35 80718 36 (1+1) і напівтвердий залишок очищали колонковою H-ЯМР (ДМСО-d6): d (мл.) 2,61 (с, 3Н, СН3), хроматографією (RP-18, МеОН). 7,22-7,51 (м, 6Н, 4-Pyr і 4-F-Ph), 8,42-8,45 (м, 2Н, 4Pyr), NH не видний. Т. пл. 171°С. ІЧ (KBr): 1228 (C-F), 1019 см -1 (S=O). 4-[5-(4-Фторфеніл)-2-(21 метилсульфанілбензилсульфаніл)-1Н-імідазол-4H-ЯМР (CD3OD): d (м.ч.) 2,67 (с, 3Н, СН3), 4,37 іл]піридин (17j) (с, 2Н, СН2), 7,13-7,21 (м, 2Н, 4-F-Ph), 7,37-7,58 (м, З використанням загального способу А 8Н, 4-Pyr, 4-F-Ph і 3-MeS(O)-Ph), 8,40-8,43 (м, 2Н, вказану в заголовку сполуку одержували з 1а 4-Pyr). (0,28г; 1,0ммоль) і 1-хлорметил-2Приклад 18 метилсульфанілбензолу (0,17г; 1,0ммоль) після 2-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазолпроведення реакції протягом 5,5 годин і очищення 2-ілсульфанілметил]фенол (18а) колонковою хроматографією (SiO2 60, З використанням загального способу В (23 етилацетат). години, кімнатна температура) вказану в заголовку Т. пл. 223°С. сполуку одержували з 1а (0,20г; 0,7ммоль) і 2ІЧ (ATR): 1228 см -1 (C-F). гідроксиметилфенолу (0,10г; 0,8ммоль) після 1 розтирання з EtOH. H-ЯМР (CD3OD): d (м.ч.) 2,51 (с, 3Н, СН3), 4,44 Т. пл. 200°С (розкладання). (с, 2Н, СН2), 7,13-7,48 (м, 10Н, 4-Pyr, 4-F-Ph і 2ІЧ (ATR): 1266 (ОН вигин), 1222 (C-F), 1005 (СMeS-Ph), 8,43-8,46 (м, 2Н, 4-Pyr). О). 4-[5-(4-Фторфеніл)-2-(21 метансульфінілбензилсульфаніл)-1Н-імідазол-4H-ЯМР (ДМСО-d6): d (мл.) 4,37 (с, 2Н, СН2), іл]піридин (17k) 6,70-6,85 (м, 2Н, 2-HO-Ph), 7,05-7,14 (м, 1Н, 2-HOЗ використанням загального способу А Ph), 7,23-7,53 (м, 7Н, 4-Pyr, 4-F-Ph і 2-HO-Ph), 8,46вказану в заголовку сполуку одержували з 1а 8,49 (м, 2Н, 4-Pyr), 9,95 (ушир.с, 1Н, обмінюваний, (0,28г; 1,0ммоль) і 1-хлорметил-2ОН), 12,81 (ушир.с, 1Н, обмінюваний, NH). метансульфінілбензолу (0,18г; 1,0ммоль) після 3-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазолпроведення реакції протягом 4 годин і 2-ілсульфанілметил]фенол (18b) перекристалізації з суміші метанол/етилацетат З використанням загального способу В (9 (1+1). годин, нагрівання при кипінні із зворотним Т. пл. 205°С. холодильником) вказану в заголовку сполуку ІЧ (KBr): 1213 (C-F), 1033 см -1 (S=O). одержували з 1а (0,20г; 0,7ммоль) і 31 гідроксиметилфенолу (0,10г; 0,8ммоль) після H-ЯМР (CD3OD): d (м.ч.) 2,87 (с, 3Н, СН3), 4,50 (д, 1Н, 13,6Гц, СН2), 4,62 (д, 1Н, 13,6Гц, СН2), 7,24очищення колонковою хроматографією (SiO2 60, СН2СI2/EtOH 9+1). 7,33 (м, 2Н, 4-F-Ph), 7,47-7,62 (м, 5Н, 4-F-Ph, C4Т. пл. 230°С. /C5-/C6-H2-MeS(O)-Ph), 7,95 (д, 1Н, 7,2Гц, С3-Н 2ІЧ (ATR): 1287 (ОН вигин), 1241 (C-F), 1007 см MeS(O)-Ph), 7,99-8,03 (м, 2Н, 4-Pyr), 8,55-8,58 (м, 1 (С-О). 2Н, 4-Pyr). 1 4-[5-(4-Фторфеніл)-2-(3H-ЯМР (ДМСО-d 6): d (м.ч.) 4,34 (с, 2Н, СН2), метилсульфанілбензилсульфаніл)-1Н-імідазол-46,65 (дд, 1Н, 1,4/8,0Гц, 3-HO-Ph С4-Н), 6,79-6,82 (м, іл]піридин (17l) 2Н, 3-HO-Ph С2-/С6-Н), 7,07-7,15 (м, 1Н, 3-HO-Ph З використанням загального способу А С5-Н), 7,27-7,53 (м, 6Н, 4-Pyr і 4-F-Ph), 9,45 (с, 1Н, вказану в заголовку сполуку одержували з 1а (1,1г; обмінюваний, ОН), 12,83 (ушир.с, 1Н, 4,1ммоль) і 1-хлорметил-3обмінюваний, NH). метилсульфанілбензолу (0,7г; 4,1ммоль) після 4-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазолпроведення реакції протягом 11 годин і 2-ілсульфанілметил]фенол (18с) перекристалізації з EtOH. З використанням загального способу В (14 Т. пл.218°С. годин, кімнатна температура) вказану в заголовку ІЧ (KBr):1225 см -1 (С-F). сполуку одержували з 1а (0,20г; 0,7ммоль) і 31 гідроксиметилфенолу (0,10г; 0,8ммоль) після H-ЯМР (ДМСО-d 6): d (м.ч.) 2,40 (с, 3Н, СН3), очищення колонковою хроматографією (SiO2 60, 4,46 (с, 2Н, СН2), 7,16-7,43 (м, 6Н, 4-F-Ph і 3-MeSСН2Сl2/EtOH 9+1). Ph), 7,56-7,63 (м, 2Н, 4-F-Ph), 7,90-7,93 (м, 2Н, 4Т. пл. 250°С (розкладання). Pyr), 8,66-8,69 (м, 2Н, 4-Pyr), NH не видний. ІЧ (ATR): 1271 (ОН вигин), 1232 (C-F), 1004 см 4-[5-(4-Фторфеніл)-2-(31 (С-О). метансульфінілбензилсульфаніл)-1Н-імідазол-41 іл]піридин (17m) Н-ЯМР (ДМСО-d 6): d (м.ч.) 4,32 (с, 2Н, СН2), Розчин Н2О2 (0,13мл; 1,3ммоль) 35%-ної 6,69 (д, 2Н, 7,5Гц, 4-HO-Ph), 7,19 (д, 2Н, 7,9 Гц, 4концентрації додавали краплями до суспензії 17l HO-Ph), 7,27-7,51 (м, 6Н, 4-Pyr і 4-F-Ph), 8,43-8,53 (0,50г; 1,2ммоль) в крижаній оцтовій кислоті (7мл). (м, 2Н, 4-Pyr), 9,41 (с, 1Н, обмінюваний, ОН), 12,79 Реакційну суміш перемішували при кімнатній (ушир.с, 1Н, обмінюваний, NH). температурі протягом 20,5 годин, розбавляли Н2О 2-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазол(5мл), доводили до рН 9 з використанням аміачної 2-ілсульфанілметил]-4-метилсульфанілфенол води 25%-ної концентрації і екстрагували (18d) етилацетатом (3х). Об'єднаний органічний З використанням загального способу В (1 екстракт промивали насиченим розчином NaCl (3х) година, кімнатна температура) вказану в заголовку і сушили над Na2SO4. Маслянистий неочищений сполуку одержували з 1а (0,50г; 2,9ммоль) і 8а продукт, одержаний після видалення розчинника, (0,50г; 2,9ммоль) після розтирання з МеОН. розтирали з сумішшю діетиловий ефір/етилацетат Т. пл. 243°С. 1 37 80718 38 1 ІЧ (KBr): 1275 (ОН вигин), 1230 (C-F), 1005 см-1 H-ЯМР (CD3OD): d (м.ч.) 2,72 (с, 3Н, СН3), 4,39 (С-О). (с, 2Н, СН2), 7,14-7,23 (м, 2Н, 4-F-Ph), 7,39 (д, 1Н, 1 2,6Гц, 3-Cl-Ph С2-Н), 7,42-7,49 (м, 6Н, 4-Pyr, 4-F-Ph H-ЯМР (ДМФА-d7) : d (мл.) 2,36 (с, 3Н, СН3), 3 4,46 (с, 2Н, СН2), 6,90 (д, 1Н, 8,4Гц, 2-HO-Ph С -Н), і 3-Cl-Ph С4-Н), 8,43-8,46 (м, 2Н, 4-Pyr). 4 7,13 (дд, 1Н, 2,3/8,3Гц, 2-HO-Ph C -H), 7,27-7,35 (м, Приклад 19 3Н, 4-F-Ph і 2-HO-Ph С6-Н), 7,51-7,53 (м, 2Н, 4-Pyr), 4-[5-(4-Фторфеніл)-4-піридин-4-іл-1H-імідазол7,58-7,65 (м, 2Н, 4-F-Ph), 8,52-8,55 (м, 2Н, 4-Pyr), 2-ілсульфанілметил]-2-метансульфінілфенол (19) 10,30-10,70 (ушир.с, 1Н, обмінюваний, NH), ОН не З використанням загального способу В (2,5 видний. години, кімнатна температура) вказану в заголовку 4-Хлор-2-[5-(4-фторфеніл)-4-піридин-4-іл-1Нсполуку одержували з 1а (0,27г; 1,0ммоль) і 8с імідазол-2-ілсульфанілметил]-6(0,14г; 0,8ммоль) з додаванням розчину Н2О2 35%метилсульфанілфенол (18е) ної концентрації після розтирання з ацетоном. З використанням загального способу В (1,5 Т. пл. 185°С (розкладання). години, 75°С) вказану в заголовку сполуку ІЧ (KBr): 1296 (ОН вигин), 1230 (C-F), 1062 одержували з 1а (0,80г; 3,0ммоль) і 8b (0,60г; (S=O), 1013 см -1 (С-О). 1 3,0ммоль) після розтирання з МеОН. H-ЯМР (CD3OD): d (2,70 (с, 3Н, СН3), 4,28 (с, Т. пл. 220°С (розкладання). 2Н, СН2), 6,78 (д, 1Н, 8,3Гц, 4-HO-Ph С3-Н), 7,12ІЧ (KBr): 1259 (ОН вигин), 1225 (C-F), 1007 см-1 7,21 (м, 2Н, 4-F-Ph), 7,28 (дд, 1Н, 2,2/8,3Гц, 4-HO(С-О). Ph C2-H), 7,39-7,46 (м, 5Н, 4-Pyr, 4-F-Ph і 4-HO-Ph 1 H-ЯМР (ДМСО-d 6): d (м.ч.) 2,34 (с, 3Н, СН3), С6-Н), 8,40 (м, 2Н, 4-Pyr). 4,38 (с, 2Н, СН2), 6,97 (д, 1Н, 2,3Гц, 3-Cl-Ph С2-Н), Приклад 20 7,17 (д, 1Н, 2,3Гц, 3-Cl-Ph С4-Н), 7,23-7,51 (м, 6Н, 4-Фтор-N-метокси-N-метилбензамід (20) 4-Pyr і 4-F-Ph), 8,48-8,50 (м, 2Н, 4-Pyr), 12,74 Суспензію 4-фторбензойної кислоти (20г, (ушир.с, 1Н, обмінюваний, NH), ОН не видний. 143ммоль) в хлористому тіонілі (130г; 1,1моль) 4-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазолперемішували при кипінні зі зворотним 2-ілсульфанілметил]-4-метилсульфанілфенол холодильником протягом 6 годин; інтенсивне (18f) виділення газу, прозорий розчин приблизно через З використанням загального способу В (2 10 хвилин, поглиблення забарвлення з жовтого до години, кімнатна температура) вказану в заголовку оранжевого. Надлишок хлористого тіонілу сполуку одержували з 1а (0,20г; 0,7ммоль) і 8с видаляли перегонкою (спочатку атмосферний (0,14г; 0,8ммоль) після розтирання з МеОН. тиск/40°С, потім мембранний вакуумний Т. пл. 230°С (розкладання). насос/40°С). Перегонкою залишку 4ІЧ (KBr): 1227 (C-F), 1019 см -1 (С-О). фторбензоїлхлорид відганяли з використанням 1 мембранного вакуумного насосу при 90°С над H-ЯМР (CD3OD): d (м.ч.) 2,21 (с, 3Н, СН3), 4,17 короткою колоною. Продукт реакції (с, 2Н, СН2), 6,69 (д, 1Н, 8,0Гц, 4-HO-Ph С3-Н), кристалізувався при зберіганні в холодильнику 6,90-7,01 (м, 2Н, 4-HO-Ph С2-/С6-Н), 7,12-7,21 (м, 2Н, 4-F-Ph), 7,32-7,53 (м, 4Н, 4-Pyr і 4-F-Ph), 8,39(n20D 1,5315; т. пл. 9°С; ви хід 20г/89%). Свіжоперегнаний триетиламін (29мл) додавали до 8,43 (м, 2Н, 4-Pyr). суспензії гідрохлориду Ν,Ο-диметилгідроксиламіну 2-[5-(4-Фторфеніл)-4-піридин-4-іл-1Н-імідазол(9,0г; 92ммоль) в СН2СI2 (75мл). Реакційну суміш 2-ілсульфанілметил]-4-метансульфінілфенол (18g) перемішували при кімнатній температурі протягом З використанням загального способу В (1 година, кімнатна температура) вказану в заголовку 2 годин і потім охолоджували до -10°С. При охолоджуванні до первинного завантаження сполуку одержували з 1а (0,27г; 1,0ммоль) і 8а протягом 6 хвилин додавали краплями 4(0,17г; 1,0ммоль) з додаванням розчину Н2О2 35%фторбензоїлхлорид (13,5г; 85ммоль). По ної концентрації після перекристалізації з суміші закінченні додавання охолоджування видаляли і толуол/ТГФ (1+1). Т. пл. 216°С. реакційну суміш перемішували при кімнатній температурі протягом 1,5 годин. Світло-коричневу ІЧ (KBr): 1278 (ОН вигин), 1232 (C-F), 1031 суспензію виливали на Н 2О (100мл). Органічну (S=O), 1003 см -1 (С-О). 1 фазу видаляли і водну фазу екстрагували H-ЯМР (CD3OD): d (м.ч.) 2,60 (с, 3Н, СН3), 4,33 діетиловим ефіром (2х). Об'єднаний екстракт (с, 2Н, СН2), 6,96 (д, 1Н, 8,2Гц, 2-HO-Ph С3-Н), промивали насиченим розчином NaCl, сушили над 7,11-7,21 (м, 2Н, 4-F-Ph), 7,41-7,47 (м, 6Н, 4-Pyr, 4Na2SO4 і концентрували. Маслянистий коричневий F-Ph і 2-НО-Ph С4-/С6-Н), 8,39-8,42 (м, 2Н, 4-Pyr). залишок кристалізувався при охолоджуванні і 4-Хлор-2-[5-(4-фторфеніл)-4-піридин-4-іл-1Нпотиранні. Неочищений продукт сушили з імідазол-2-ілсульфанілметил]-6використанням масляного насосу (залишковий метансульфінілфенол (18h) триетиламін) і вводили в реакції без додаткового З використанням загального способу В (1,5 очищення. години, 75°С) вказану в заголовку сполуку 1 H-ЯМР (CDCl3): d (м.ч.) 3,37 (с, 3Н, NCH3), одержували з 1а (0,27г; 1,0ммоль) і 8b (0,21г; 3,54 (с, 3Н, ОСН3), 7,04-7,13 (м, 2Н, 4-F-Ph), 7,711,0ммоль) з додаванням розчину Н 2О2 35%-ної 7,78 (м, 2Н, 4-F-Ph). концентрації після очищення колонковою Приклад 21 хроматографією (SiO2 60, ацетон). 2-(2-Хлорпіридин-4-іл)-1-(4-фторфеніл)етанон Т. пл. 175°С (розкладання). (21а) ІЧ (KBr): 1265 (ОН вигин), 1236 (C-F), 1051 У двогорлу колбу, висушену нагріванням і (SO), 1005 см -1 (С-О). продуванням аргоном, додавали краплями n-BuLi 39 80718 40 (розчин 15%-ної концентрації в н-гексані, 45мл, годин. Світло-бежевий осад відфільтровували, 104ммоль) до охолодженого до -85°С розчину промивали водою і сушили при зниженому тиску діізопропіламіну (15мл, 106ммоль) в абс. ТГФ над СаСІ2. 1 (150мл), при цьому температура підвищувалась до H-ЯМР (ДМСО-d6): d (м.ч.) 7,34-7,52 (м, 4Н, 3 -50°С. По закінченні додавання світло-жовтий С -/С5-Н 2-Сl-Pyr і 4-F-Ph), 7,93-8,00 (м, 2Н, 4-Fрозчин перемішували при -85°С протягом 55хв. Ph), 8,47 (д, 1Н, 5,2Гц, С6-Н 2-Сl-Pyr), 12,71 При -85°С до первинної суміші додавали розчин 2(ушир.с, 1Н, обмінюваний, ОН). хлор-4-метилпіридину (2-хлор-у-піколін, 8,6г; 1-(2-Фторпіридин-4-іл)-2-(4-фторфеніл)етан68ммоль) в абс. ТГФ (75мл); температура 1,2-діон-1-оксим (22b) підвищувалась до -50°С, первинне забарвлення 22b одержували з 21b (10,0г; 43ммоль) з змінилось на пурпурне. По закінченні додавання використанням способу, описаного для синтезу реакційну суміш перемішували при -85°С протягом 22а. 1 1 години і протягом 3 хвилин при даній H-ЯМР (ДМСО-d6): d (м.ч.) 7,19-7,20 (м, 1Н, 3 температурі додавали розчин 20 (12,4г; 68ммоль) С -Н 2-F-Pyr), 7,35-7,47 (м, 3Н, С5-Н 2-F-Pyr і 4-Fв абс. ТГФ (75мл); при цьому температура Ph), 7,91-7,98 (м, 2Н, 4-F-Ph), 8,29 (д, 1Н, 5,3Гц, підвищувалась до -60°С. Реакційну суміш, що С6-Н 2-F-Pyr), 12,69 (ушир.)(с, 1Н, обмінюваний, являла собою пурпурну суспензію, перемішували ОН). при -85°С протягом 1 години і потім, протягом 1 1-(4-Фторфеніл)-2-(2-ізопропоксипіридин-4години, нагрівали до 0°С. Суміш виливали в іл)етан-1,2-діон-1-оксим (22с) насичений розчин NaCl (300мл), понад якого Розчин 22b (200мг; 0,76ммоль) в насиченому знаходився етилацетат (300мл). Органічну фазу НСl ізопропанолі (15мл) перемішували при кипінні видаляли і водну фазу екстрагували етилацетатом зі зворотним холодильником протягом 2,5 годин. (2x250мл), при цьому світло-жовтий пінистий осад Розчин концентрували і жовтувато-білий залишок 1,3-біс-(2-хлорпіридин-4-іл)-2-(4розтирали з невеликою кількістю етанолу, фтор феніл)пропан-2-олу відділявся на межі відфільтровували і сушили. 1 розділу фаз. Об'єднаний органічний екстракт H-ЯМР (ДМСО-d6): d (м.ч.) 1,24 (д, 6Н, 6,2Гц, промивали насиченим розчином NaCl, сушили над 2хСН3), 5,15-5,27 (м, 1Н, метин-Н), 6,54 (с, 1Н, С3Na2SO4 і концентрували. Маслянистий залишок Н 2-ізо-О-Pyr), 7,08 (дд, 1Н, 1,2/5,3Гц, С5-Н 2-ізо-Овміщували в невелику кількість третPyr), 7,36-7,49 (м, 2Н, 4-F-Ph), 7,88-7,97 (м, 2Н, 4бутилметилового ефіру і зберігали при 4°С F-Ph), 8,19 (д, 1Н, 5,4Гц, С6-Н 2-ізо-О-Pyr), 12,44 протягом ночі. Кристали відфільтровували і (ушир.с, 1Н, обмінюваний, ОН). сушили. 1-(2-Бромпіридин-4-іл)-2-(4-фторфеніл)етан1 H-ЯМР (CDCl3): d (м.ч.) 4,26 (с, 2Н, СН2), 7,111,2-діон-1-оксим (22d) 7,26 (м, 4Н, С3-/С5-Н 2-СI-Pyr і 4-F-Ph), 7,99-8,06 22d одержували з 21с (5,0г; 17ммоль) з (м, 2Н, 4-F-Ph), 8,35 (дд, 1Н, 0,6/5,1Гц, С6-Н 2-СIвикористанням способу, описаного для синтезу Pyr). 22а. 1 1-(4-Фторфеніл)-2-(2-фторпіридин-4-іл)етанон H-ЯМР (ДМСО-d6): d (м.ч.) 7,40-7,48 (м, 3Н, 3 (21b) С -Н 2-Br-Pyr і 4-F-Ph), 7,65 (д, 1Н, 0,8Гц, С5-Н 221b одержували з 2-фтор-4-метилпіридину Br-Pyr), 7,93-8,01 (м, 2Н, 4-F-Ph), 8,45 (д, 1Н, 5,2Гц, (13,9г; 125ммоль) з використанням способу, С6-Н 2-Br-Pyr), 12,72 (ушир.с, 1Н, обмінюваний, описаного для синтезу 21а. ОН). 1 H-ЯМР (CDCl3): d (м.ч.) 4,32 (с, 2Н, СН2), 6,85Приклад 23 6,86 (м, 1Н, С3-Н 2-F-Pyr), 7,08-7,19 (м, 3Н, С5-Н 2Гідрохлорид 2-аміно-2-(2-хлорпіридин-4-іл)-1F-Pyr і 4-F-Ph), 8,00-8,07 (м, 2Н, 4-F-Ph), 8,18 (д, (4-фторфеніл)етанону (23л) 6 1Н, 5,1Гц, С -Н 2-F-Pyr). При обережному нагріванні 22а (1,5г; 2-(2-Бромпіридин-4-іл)-1-(4-фторфеніл)етанон 45,4ммоль) розчиняли в метанолі (15мл). Розчин (21с) охолоджували до кімнатної температури, 21с одержували з 2-бром-4-метилпіридину додавали НСІ-вмісний метанол і суміш (9,6г; 56ммоль) з використанням способу, переносили в двогорлу колбу. Вводили в колбу з описаного для синтезу 21а. первинною сумішшю 10% Pd-C (15мг). Реакційну 1 H-ЯМР (CDCl3): d (м.ч.) 4,35 (с, 2Н, СН2), 7,17колбу вакуумували з використанням масляного 3 7,37 (м, 3Н, 2-Br-Pyr і 4-F-Ph), 7,50 (с, 1H, С -Н 2насосу і потім вводили Н 2 через капіляр для Вr-Pyr), 8,07-8,15 (м, 2Н, 4-F-Ph), 8,42 (д, 1Н, 5,1 введення газу (4х). При кімнатній температурі Гц, С6-Н 2-Br-Pyr). суспензію струшували в закритій тригорлій колбі в Приклад 22 атмосфері Н2 (240 ударів на хвилину) доти, доки 1-(2-Хлорпіридин-4-іл)-2-(4-фторфеніл)етанвихідна речовина не переставала виявлятись за 1,2-діон-1-оксим (22а) даними тонкошарової хроматографії (6 годин). При перемішуванні і охолоджуванні на водяній Суспензію фільтрували і каталізатор промивали бані (приблизно 10°С) розчин NaNO2 (0,85г; великою кількістю метанолу. Об'єднаний фільтрат 12,3ммоль) в Н2О (10мл) додавали краплями концентрували і твердий аморфний залишок протягом 2,5 хвилин до розчину 21а (3,0г; кольору гірчиці сушили з використанням 12ммоль) в крижаній оцтовій кислоті. По закінченні масляного насосу. Неочищений продукт додавання реакційну суміш перемішували при використали без додаткового очищення на кімнатній температурі протягом 0,5 години, наступній реакційній стадії. 1 додавали Н 2О (60мл) і перемішування при H-ЯМР (ДМСО-d6): d (м.ч.) 6,53 (ушир.с, 1Н, кімнатній температурі продовжували протягом 3 метин-Н), 7,35-7,45 (м, 2Н, 4-F-Ph), 7,59 (дд, 1Н, 41 80718 42 1,5/5,2Гц, С5-Н, 2-С1-Pyr), 7,85 (д, 1Н, 0,9Гц, С3-Н, 10°С протягом 30 хвилин і потім нагрівали до 2-Сl-Pyr), 8,17-8,25 (м, 2Н, 4-F-Ph), 8,49 (д, 1Н, кімнатної температури. Сіро-зелену суспензію 4,9Гц, С6-Н, 2-Сl-Pyr), 9,33 (ушир.с, 3Н, що фільтрували і білий залишок (ZnSO4) промивали обмінюється, NH3+). великою кількістю етанолу. Об'єднаний жовтий Гідрохлорид 2-аміно-2-(2-фторпіридин-4-іл)-1фільтрат концентрували і твердий жовтуватий (4-фторфеніл)етанону (23b) залишок сушили з використанням масляного При обережному нагріванні 22b (5,0г; насосу. 1 19ммоль) розчиняли в НСІ-вмісному ізопропанолі H-ЯМР (ДМСО-d6): d (м.ч.) 6,39 (ушир.с, 1Н, (IsOH/IsOH, насичений НСl, 1+1, 60мл). метин-Н), 7,35-7,44 (м, 2Н, 4-F-Ph), 7,56 (дд, 1Н, Жовтуватий розчин охолоджували до кімнатної 1,4/5,1Гц, С5-Н 2-Br-Pyr), 7,91 (с, 1Н, С3-Н2-Br-Pyr), температури і переносили в двогорлу колбу 8,12-8,19 (м, 2Н, 4-F-Ph), 8,46 (д, 1Н, 5,1Гц, Сй-Н2(100мл). Реакційну колбу вакуумували з Br-Pyr), 8,94 (ушир.с, 3Н, що обмінюється, ΝΗ3+). використанням масляного насосу і потім вводили Приклад 24 Н2 через капіляр для введення газу (4 х). При 4-(2-Хлорпіридин-4-іл)-5-(4-фторфеніл)-1,3кімнатній температурі суспензію струшували в дигідроімідазол-2-тіон (24а) закритій тригорлій колбі в атмосфері Н 2 (240 При обережному нагріванні 23а (2,9г; ударів на хвилину) доти, доки вихідна речовина не приблизно 9,6ммоль) розчиняли в абсолютному переставала виявлятись за даними тонкошарової ДМФ (75мл). У прозорий оранжево-червоний хроматографії (6,5 годин). Каталізатор розчин вводили тіоціанат калію (1,9г; 19,6ммоль), відфільтровували. Залишок після фільтрування при цьому відразу ж спостерігалась опалесценція і промивали великою кількістю метанолу забарвлення ставало більш світлим. Реакційну (приблизно 800мл). Об'єднані фільтрати суміш перемішували при кипінні зі зворотним концентрували і твердий аморфний залишок холодильником протягом 1,5 годин. Суспензію сушили на масляному насосі. Неочищений продукт охолоджували до кімнатної температури і, при використали без додаткового очищення на охолоджуванні Н 2О, розбавляли краплями Н 2О наступній реакційній стадії. (приблизно 140мл). Жовтий осад 1 H-ЯМР (ДМСО-d6): d (м.ч.) 6,58 (ушир.с, 1Н, відфільтровували, промивали Н2О і сушили при метин-Н), 7,33-7,41 (м, 2Н, 4-F-Ph), 7,54 (м, 2Н, С3зниженому тиску над СаСl2. 1 /С5-Н 2-F-Pyr), 8,14-8,25 (м, 2Н, 4-F-Ph), 8,30 (д, H-ЯМР (ДМСО-d6): d (мл.) 7,12-7,52 (м, 6Н, С35 1Н, 5,5Гц, С6-Н 2-F-Pyr), 9,40 (ушир.с, 3Н, що /С -Н 2-Сl-Pyr і 4-F-Ph), 8,27 (д, 1Н, 5,2Гц, С6-Н 2+ обмінюється, NH3 ). Сl-Pyr), 12,82 (ушир.с, 2Н, що обмінюється, 2xNH). Гідрохлорид 2-аміно-1-(4-фторфеніл)-2-(24-(4-Фторфеніл)-5-(2-фторпіридин-4-іл)-1,3ізопропоксипіридин-4-іл)етанону (23с) дигідроімідазол-2-тіон (24b) 23с одержували з 22с (2,0г; 7,6ммоль) з 24b одержували з 23b (6,1г; 20ммоль) з використанням способу, описаного для синтезу використанням способу, описаного для синтезу 23а. 24а. 1 1 H-ЯМР (ДМСО-d6): d (м.ч.) 1,23 (д, 6Н, 5,6Гц, H-ЯМР (ДМСО-d6): d (м.ч.) 7,12-7,16 (м, 2Н, 2хСН3), 5,09-5,22 (м, 1Н, метин-Н, СН(СН3)2), 6,38С3-/С5-Н 2-F-Pyr), 7,28-7,27 (м, 2Н, 4-F-Ph), 7,466,41 (ушир.с, 1Н, метин-Н, СН-NН3+), 7,00-7,08 (м, 7,55 (м, 2Н, 4-F-Ph), 8,13 (д, 1Н, 5,1Гц, С6-Н 2-F2Н, 2-ізо-O-Pyr), 7,33-7,46 (м, 2H, 4-f-Ph), 8,14-8,23 Pyr), 12,85 (ушир.с, 2Н, що обмінюється, 2xNH). (м, 3Н, 2-ізо-О-Pyr і 4-F-Ph), 9,21 (ушир.с, 3Н, що 4-(4-Фторфеніл)-5-(2-ізопропоксипіридин-4-іл)обмінюється, NH3+). 1,3-дигідроімідазол-2-тіон (24с) Гідрохлорид 2-аміно-1-(4-фторфеніл)-2-(224с одержували з 23с (2,5г; 7,6 моль) з метоксипіридин-4-іл)етанону (23d) 23d одержаний використанням способу, описаного для синтезу при обробці 22b (7,5г; 29ммоль) в умовах, 24а. 1 описаних для синтезу 23а. H-ЯМР (ДМСО-d6): d (м.ч.) 1,24 (д, 6Н, 6,2Гц, 1 H-ЯМР (ДМСО-d6): d (мл.) 3,83 (с, 3Н, СН3), 2хСН3), 5,10-5,19 (м, 1Н, метин-Н), 6,69-6,76 (м, 6,44 (ушир.с, 1Н, метин-Н), 7,13-7,16 (м, 2Н, С32Н, 2-ізо-О-Pyr), 7,24-7,32 (м, 2Н, 4-F-Ph), 7,42-7,49 /С5-Н 2-МеО-Pyr), 7,34-7,46 (м, 2Н, 4-F-Ph), 8,16(м, 2Н, 4-F-Ph), 8,02 (д, 1Н, 5,5Гц, Сб -Н 2-ізо-О6 8,25 (м, 3Н, С -Н 2-МеО-Pyr і 4-F-Ph), 9,29 (ушир.с, Pyr), 12,68 (ушир.с, 2Н, що обмінюється, 2xNH). 3Н, що обмінюється, NH3+). Гідрохлорид 2-аміно-14-(4-Фторфеніл)-5-(2-метоксипіридин-4-іл)-1,3(4-фторфеніл)-2-піридин-4-ілетанону (23е) 23е дигідроімідазол-2-тіон (24d) одержаний при обробці 22с (4,0г; 12,4ммоль) в Тіоціанат калію (2г, 20,6ммоль) вводили в умовах, описаних для синтезу 23b. розчин 23d (3,2г; 10,8ммоль) в соляній кислоті 1 H-ЯМР (ДМСО-d6): d (м.ч.) 6,78 (ушир.с., 1Н, 10%-ної концентрації (50мл). Реакційну суміш метин-Н), 7,32-7,38 (м, 2Н, 4-F-Ph), 8,07-8,13 (м, перемішували при кипінні зі зворотним 2Н, 4-Pyr), 8,17-8,27 (м, 2Н, 4-F-Ph), 8,92-8,95 (м, холодильником протягом 30 хвилин. Оранжевий 2Н, 4-Pyr), 9,43 (ушир.с, 3Н, що обмінюється, розчин охолоджували і нейтралізували з NH3+). використанням розчину NaHCO3 10%-ної Гідрохлорид 2-аміно-2-(2-бромпіридин-4-іл)-1концентрації. Осад відфільтровували, промивали (4-фторфеніл)етанону (23f) Розчин 22d (1,8г; Н2О і сушили при зниженому тиску над СаСl2. 5,6ммоль) в абсолютному етанолі (30мл) Неочищений продукт розтирали з етанолом і охолоджували до -10°С і додавали концентровану нерозчинні компоненти відфільтровували. При сірчану кислоту (1,3мл). При охолоджуванні до зберіганні 24d випадав в осад з етанольного первинної суміші додавали поступово цинковий фільтрату. пил (1,1г). Реакційну суміш перемішували при 43 80718 44 ІЧ (ATR): 2928, 1610, 1544, 1509, 1412, 1314, H-ЯМР (ДМСО-d6): d (м.ч.) 3,81 (с, 3Н, ОСН3), 1222 (C-F), 1104, 1005, 954, 865, 843,816 см -1. 6,79-6,82 (м, 2Н, С3=/С5-Н2-MeO=Pyr), 7,26=7,50 1 (м, 4Н, 4-F-Ph), 8,06 (д, IE, 5,3Гц, С6-Н 2-МеО-Pyr), H-ЯМР (ДМСО-d6): d (м.ч.) 1,28 (д, 6Н, 6,1Гц, 12,65 (ушир.с, 2Н, що обмінюється, 2xNH). 2хСН3), 2,63 (с, 3Н, SCH3), 5,08-5,14 (м, 1Н, метинПриклад 25 Н), 6,76 (с, 1Н, С3-Н 2-ізо-О-Pyr), 6,88 (дд, 1Н, 2-Хлор-4-[5-(4-фторфеніл)-2-метилсульфаніл1,4/5,4Гц, С5-Н 2-ізо-О-Pyr), 7,10-7,19 (м, 2Н, 4-F3Н-імідазол-4-іл]піридин (25а) Ph), 7,40-7,47 (м, 2Н, 4-F-Ph), 7,95 (дд, 1Н, З використанням загального способу А 0,7/5,4Гц, С6-Н 2-ізо-О-Pyr). вказану в заголовку сполуку одержували з 24а 4-[5-(4-Фторфеніл)-2-метилсульфаніл-3Н(0,5г; 1,6ммоль) і йодистого метилу (0,35г; імідазол-4-іл]-2-метоксипіридин (25d) 2,5ммоль) після проведення реакції протягом 12 Розчин 24d (1,0г; 3,3ммоль} і йодистого метилу годин і очищення колонковою хроматографією (5,6г; 39ммоль) в метанолі (50мл) перемішували (Аl2О 3, СН2Сl2/етилацетат 1+1). при кипінні із зворотним холодильником протягом Т. пл. 236°С. 3 годин. Реакційну суміш охолоджували і ІЧ (ATR): 3126, 3057, 2929, 1591, 1529, 1499, фільтрували. Фільтрат концентрували і залишок 1389, 1231 (C-F), 1159, 996, 976, 844,780 см -1. вміщували в етанол. Нерозчинні компоненти 1 відфільтровували і фільтрат концентрували. H-ЯМР (ДМСО-d6): d (мл.) 2,62. (с, 1Н, СН3), Залишок вміщували в СН 2Сl2/EtOH (9+1). 7,27-7,36 (м, 3Н, 2-Сl-Pyr і 4-F-Ph), 7,45-7,55 (м, Нерозчинні компоненти відфільтровували і 3Н, 2-Сl-Pyr і 4-F-Ph), 8,24 (д, 1Н, 5,1Гц, С6-Н 2-СІфільтрат розділяли колонковою хроматографією Pyr), 12,85 (ушир.с, 1Н, обмінюваний, NH). (SiO2 60, СН2Сl2/EtOH, 9+1). Т. пл. 158°С. 2-Фтор-4-[5-(4-фторфеніл)-2-метилсульфанілІЧ (ATR): 1618, 1608, 1497, 1391, 1222 (C-F), 3Н-імідазол-4-іл]піридин (25b) 1212, 1036, 835, 825 см -1. З використанням загального способу А 1 вказану в заголовку сполуку одержували з 24b H-ЯМР (ДМСО-d6): d (м.ч.) 2,67 (с, 3Н, SCH3), (1,4г; 9,9ммоль) і йодистого метилу (1,4г; 3,90 (с, 3Н, ОСН3), 6,87-6,89 (м, 1Н, С3-Н 2-МеО9,9ммоль) після проведення реакції протягом 40 Pyr), 6,98 (дд, 1Н, 1,5/5,5Гц, С5-Н2-МеО-Pyr), 7,16годин. Неочищений продукт кип'ятили з сумішшю 7,24 (м, 2Н, 4-F-Ph), 7,46-7,53 (м, 2Н, 4-F-Ph), 8,03 СН2Сl2/етилацетат (1+1). Об'єднаний органічний (дд, 1Н, 0,7/5,5Гц, С6-Н 2-МеО-Pyr). екстракт знебарвлювали з використанням Аl2О3 і 4-[5-(4-Фторфеніл)-2-метилсульфаніл-3Нодержаний після концентрування фільтрату імідазол-4-іл]-1Н-піридин-2-он (25е) залишок розтирали з невеликою кількістю EtOH. Т. При обробці 23d (8,8г; 31ммоль) тіоціанатом пл. 224°С. калію в киплячому ДМФ аналогічно способу, ІЧ (ATR): 3073, 1609, 1497, 1421, 1234 (C-F), описаному для 24а, 25 є був одержаний як єдиний 1159, 1002, 883, 851, 833, 815 см -1 і продукт реакції. Т. пл. 314°С (розкладання). Після 1 циклізації, що приводить до 1,3Н-ЯМР (ДМСО-d 6): d (м.ч.) 2,62 (с, 3Н, СН3), дигідроімідазолтіону, метильна група з 7,08 (с, 1Н, С3-Н 2-F-Pyr), 7,26-7,35 (м, 3Н, С5-Н 2F-Pyr і 4-F-Ph), 7,46-7,54 (м, 2Н, 4-F-Ph), 8,08 (д, метоксильного замісника переходить до нуклеофільного атома сірки тіону з утворенням, 1Н, 5,3Гц, С6-Н 2-F-Pyr), 12,85 (ушир.с, 1Н, по-перше, 2-метилсульфаніл-3Н-імідазолу і, пообмінюваний, NH). друге, 2-гідроксипіридин/1Н-піридин-2-ону. 4-[5-(4-Фторфеніл)-2-метилсульфаніл-3НІЧ (ATR): 1634 (піридон І), 1610, 1557 (піридон імідазол-4-іл]-2-ізопропоксипіридин (25с) NaH (55-65%; 1,0г; приблизно 23ммоль) II), 1493, 1220 (C-F), 968, 837, 800 см -1. 1 вводили в розчин 24с (4,0г; 13,8ммоль) в H-ЯМР (ДМСО-d6): d (м.ч.) 2,61 (с, 3Н, SCH3), абсолютному ТГФ (60мл). Цю первинну суміш 6,16 (ушир.с, 1Н, С3-Н піридон), 6,34 (с, 1Н, С5-Н перемішували при кімнатній температурі протягом піридон), 7,25-7,33 (м, 3Н, С6-піридон і 4-F-Ph), 5 хвилин і додавали краплями розчин йодистого 7,46-7,53 (м, 2Н, 4-F-Ph), 11,38 (ушир.с, 1Н, метилу (2,2г; 17,3ммоль) в абсолютному ТГФ (5мл) обмінюваний, піридон-NH), 12,71 (ушир.с, 1Н, при охолоджуванні Н2О. Реакційну суміш обмінюваний, імідазол-NH). перемішували при кімнатній температурі протягом Бензил-{4-[5-(4-фторфеніл)-2-метилсульфаніл1 години. Прозорий коричневий розчин 3Н-імідазол-4-іл]піридин-2-іл}амін (25f) концентрували і залишок вміщували в Н 2О. З використанням загального способу С, Водний розчин нейтралізували з використанням вказану в заголовку сполуку одержували з 25b соляної кислоти 10%-ної концентрації і (0,2г; 0,7ммоль) і бензиламіну (0,8г; 7,5ммоль) екстрагували етилацетатом (2х). Об'єднаний після проведення реакції протягом 5 годин при органічний екстракт промивали насиченим температурі 160°С і розділення колонковою розчином NaCI, сушили над Na2SO4 і хроматографією (Аl2О 3, СН2СІ2/е тилацетат 1+1). Т. концентрували. Напівтвердий залишок пл. 152°С (розкладання). екстрагували киплячим трет-бутилметиловим ІЧ (ATR): 3234 (NH), 3006, 2916, 1601, 1583, ефіром (2х) і фільтрували. Прозорий ефірний 1501, 1451, 1432, 1353, 1225 (С-F), 1074, 844, 813, фільтрат концентрували, і твердий залишок 729, 695 см -1. 1 розтирали з невеликою кількістю третH-ЯМР (CD3OD): d (м.ч.) 2,59 (с, 3Н, СН3), 4,37 бутилметилового ефіру, фільтрували і сушили. (с, 2Н, СН2), 6,56-6,59 (м, 2Н, С3-/С5-Н 2-аміно-Pyr), Додаткову кількість реакційного продукту 7,04-7,44 (м, 9Н, Ph і 4-F-Ph), 7,83 (д, 1Н, 5,6Гц, одержували розділенням маточного розчину С6-Н 2-аміно-Pyr). колонковою хроматографією (SiO2 60, СН2Сl2/етилацетат, 1+1). Т. пл. 141°С. 1 45 80718 46 (4-[5-(4-Фторфеніл)-2-метилсульфаніл-ЗНаміно-Pyr), 7,06-7,50 (м, 7Н, 3,4-ди-Сl-Р b і 4-F-Ph), імідазол-4-іл]піридин-2-іл}-(4-метоксибензил)амін 7,84 (д, 1Н, 5,5Гц, С6-Н 2-аміно-Pyr). (25g) {4-[5-(4-Фторфеніл)-2-метилсульфаніл-3НЗ використанням загального способу С, імідазол-4-іл]піридин-2-іл}-феніламін (25k) вказану в заголовку сполуку одержували з 25b З використанням загального способу С, (0,44 г; 1,5 ммоль) і 4-метоксибензиламіну (2,0г; вказану в заголовку сполуку одержували з 25b 14,6ммоль) після проведення реакції протягом 7 (0,2г; 0,7ммоль) і аніліну (0,65г; 7,0ммоль) після годин при температурі 160°С і розділення проведення реакції протягом 6 годин при кипінні зі колонковою хроматографією (SiO2, СН2Сl2/EtOH зворотним холодильником і розділення 9+1). Т. пл. 207°С. колонковою хроматографією (SiO2, СН2Сl2/EtOH ІЧ (ATR): 1598, 1558, 1510, 1244, 1217 (C-F), 9+1). Т. пл. 228°С. 846, 812 см -1. ІЧ (ATR): 3031, 1610, 1590, 1561, 1504, 1433, 1 1265, 1225 (C-F), 839, 827, 749, 695 см-1. H-ЯМР (CD3OD): d (м.ч.) 2,61 (с, 3Н, SCH3), 1 3,75 (с, 3Н, ОСН3), 4,30 (с, 2Н, CH2), 6,56-6,59 (м, H-ЯМР (ДМСО-d 6): d (м.ч.) 2,62 (с, 3Н, СН3), 3 5 2Н, С -/С -Н 2-аміно-Pyr), 6,81-7,30 (м, 6Н, 4-MeO5,95-6,13 (м, 2Н, С3-/С5-Н2-аміно-Pyr), 6,68-7,60 (м, Ph i 4-F-Ph), 7,39-7,46 (м, 2Н, 4-F-Ph), 7,84 (д, 1Н, 9Н, Ph і 4-F-Ph), 7,97-8,01 (м, 1Н, С6-Н, 2-аміно6 6,0Гц, C -H 2-аміно-Pyr). Pyr), 8,99 (ушир.с, 1Н, обмінюваний, аніліно-NH), {4-[5-(4-Фторфеніл)-2-метилсульфаніл-3Н12,68 (ушир.с, 1Н, обмінюваний, імідазол-NH). імідазол-4-іл]піридин-2-іл}-(4-метилбензил)амін {4-[5-(4-Фторфеніл)-2-метилсульфаніл-ЗН(25h) імідазол-4-іл]піридин-2-іл}фенетиламін (25l) З використанням загального способу С, З використанням загального способу С, вказану в заголовку сполуку одержували з 25b вказану в заголовку сполуку одержували з 25b (0,2г; 0,7ммоль) і 4-метилбензиламіну (0,85г; (0,2г; 0,7ммоль) і 2-фенілетиламіну (0,85г; 7,0ммоль) після проведення реакції протягом 6 7,0ммоль) після проведення реакції протягом 5,5 годин при 160°С і розділення колонковою годин при 160°С і розділення колонковою хроматографією (SiO2, СН2Сl2/EtOH 9+1). Т. пл. хроматографією (SiO2, СН2Сl2/EtOH 9+1). Т. пл. 185°С. 99°С. ІЧ (ATR): 1600, 1559,1502, 1427, 1218 (C-F), ІЧ (ATR): 3409, 1604, 1546, 1504, 1220 (C-F), 844, 809 см -1. 838, 813, 698 см -1. 1 1 H-ЯМР (CD3OD): d (м.ч.) 2,29 (с, 3Н, СН3), 2,60 H-ЯМР (CD3OD): d (м.ч.) 2,61 (с, 3Н, SCH3), (с, 3Н, SCH3), 4,32 (с, 2Н, СН2), 6,57-6,60 (м, 2Н, 2,81 (т, 2Η, 7,7Гц, NCH2), 3,41 (т, 2H, 7,7Гц, С3-/С5-Н 2-аміно-Pyr), 7,05-7,50 (м, 8Н, 4-Me-Ph і 4CH2Ph), 6,55-6,57 (м, 2Н, С3-/С5-Н 2-аміно-Pyr), F-Ph), 7,83 (д, 1Н, 5,3Гц, С6-Н2-аміно-Pyr). 7,08-7,26 (м, 7Н, Ph і 4-F-Ph), 7,42-7,49 (м, 2Н, 4-F(4-Хлорбензил)-{4-[5-(4-фторфеніл)-2Ph), 7,82 (д, 1Н, 6,1Гц, С6-Н 2-аміно-Pyr). метилсульфаніл-3Н-імідазол-4-іл]піридин-2-іл}амін (RS)-{4-[5-(4-Фторфеніл)-2-метилсульфаніл(25і) 3Н-імідазол-4-іл]піридин-2-іл}-(1-феніл етил)амін З використанням загального способу С, (25m) вказану в заголовку сполуку одержували з 25b З використанням загального способу С, (0,2г; 0,7ммоль) і 4-хлорбензиламіну (1,0г; вказану в заголовку сполуку одержували з 25b 7,0ммоль) після проведення реакції протягом 5,5 (0,2г; 0,7ммоль) і (RS)-1-фенілетиламіну (0,80г; годин при кипінні із зворотним холодильником і 6;6ммоль) після проведення реакції протягом 7 розділення колонковою хроматографією (SiO2, годин при 160°С і розділення колонковою CH2Cl2/EtOH 9+1). хроматографією (SiO2, СН2СI2/EtOH 9+1). Т. пл. Т. пл. 195°С. 117-119°С. ІЧ (ATR): 3409, 1597, 1549, 1502, 1489, 1422, ІЧ (ATR): 2926, 1607, 1547, 1502, 1434, 1221 1218 (C-F), 843, 814, 793 см-1. (C-F), 1157, 838, 814, 699 см -1. 1 1 H-ЯМР (CD3OD): d (м.д,) 2,60 (с, 3Н, SCH3), H-ЯМР (ДМСО-d6): d (м.ч.) 1,37 (д, 3Н, 5,5Гц, 4,38 (с, 2Н, СН2), 6,57-6,60 (м, 2Н, С3-/С5-Н 2СН3), 2,58 (с, 3Н, SCH3), 4,82-5,03 (м, 1Н, метин-Н), аміно-Pyr), 7,05-7,14 (м, 2Н, 4-F-Ph), 7,22-7,30 (м, 6,39-7,74 (м, 12Н, Ph, 2-аміно-Pyr і 4-F-Ph), 12,57 4Н, 4-Cl-Ph), 7,38-7,45 (м, 2Н, 4-F-Ph), 7,83 (д, 1Н, (ушир.с, 1Н, обмінюваний, NH). 5,7Гц, С6-Н 2-аміно-Pyr). (R)-{4-[5-(4-Фторфеніл)-2-метилсульфаніл-3Н(3,4-Дихлорбензил)-{4-[5-(4-фторфеніл)-2імідазол-4-іл]піридин-2-іл}-(1-фенілетил)амін (25n) метилсульфаніл-3Н-імідазол-4-іл]піридин-2-іл}амін З використанням загального способу С, (25j) вказану в заголовку сполуку одержували з 25b З використанням загального способу С, (0,2г; 0,7ммоль) і (R)-1-фенілетиламіну (0,80г; вказану в заголовку сполуку одержували з 25b 6,6ммоль) після проведення реакції протягом 7 (0,2г; 0,7ммоль) і 3,4-дихлорбензиламіну (1,2г; годин при 170°С і розділення колонковою 6,8ммоль) після проведення реакції протягом 7,5 хроматографією (SiO2, СН2СI2/етилацетат 1+1). Т. годин при 160°С і розділення колонковою пл. 117-119°С. хроматографією (SiO2, СН2Сl2/EtOH 9+1). Т. пл. ІЧ (ATR): 2926, 1607, 1547, 1502, 1434, 1221 212°С. (C-F), 1157, 838, 814, 699 см -1. 1 ІЧ (ATR): 3409,1600, 1552,1509, 1490, 1424, H-ЯМР (CD3OD): d (мл.) 1,44 (д, 3Н, 6,9Гц, 1225 (C-F), 842, 827, 813 см-1. СН3), 2,59 (с, 3Н, SCH3), 4,62-4,69 (м, 1H, метин-Н), 1 H-ЯМР (CD3OD): d (м.ч.) 2,60 (с, 3Н, SCH3), 6,47-6,57 (м, 2Н, С3-/С5-Н2-аміно-Pyr), 7,05-7,42 (м, 3 5 4,39 (с, 2Н, СН2), 6,56-6,62 (м, 2Н, С -/С -Н 29Н, Ph і 4-F-Ph), 7,80 (д, 1Н, 5,5Гц, С6-Н 2-аміноPyr). 47 80718 48 (S)-{4-[5-(4-Фторфеніл)-2-метилсульфаніл-3Німідазол-4-іл]піридин-2-іл}-(1-фенілетил)амін (25о) З використанням загального способу С, вказану в заголовку сполуку одержували з 25b (0,2г; 0,7ммоль) і (S)-1-фенілетиламіну (0,80г; 6,6ммоль) після проведення реакції протягом 13 годин при 170°С і розділення колонковою хроматографією (SiO2, СН2СI2/етилацетат 1+1). Т. пл. 117-119°С. ІЧ (ATR): 2926, 1607, 1547, 1502, 1434, 1221 Приклад 26 (C-F), 1157, 838, 814, 699 см -1. 4-[2-Бензилсульфаніл-5-(4-фторфеніл)-ЗН1 H-ЯМР (CD3OD): d (мл.) 1,44 (д, 3Н, 6,9Гц, імідазол-4-іл]-2-хлорпіридин(26а) СН3), 2,59 (с, 3Н, SCH3), 4,62-4,69 (м, 1Н, метин-Н), З використанням загального способу А 6,47-6,57 (м, 2Н, С3-/С5-Н2-аміно-Pyr), 7,05-7,42 (м, вказану в заголовку сполуку одержували з 24а 9Н, Ph і 4-F-Ph), 7,80 (дд, 1Н, 0,5/5,5Гц, С6-Н 2(0,3г; 1,0ммоль) і хлористого бензилу (0,12г; аміно-Pyr). 1,0ммоль) після проведення реакції протягом 6 Бензил-{4-[5-(4-фторфеніл)-2-метилсульфанілгодин і розділення колонковою хроматографією 3Н-імідазол-4-іл]піридин-2-іл} метиламін (25р) (SiO2 60, СН2СШ2/EtOH 9+1). Т. пл. 223°С. З використанням загального способу С, ІЧ (ATR): 2939, 1591, 1530,1505, 1233 (C-F), вказану в заголовку сполуку одержували з 25b 997, 838, 782, 700 см-1. 1 (0,2г; 0,7ммоль) і N-метилбензиламіну (0,85г; H-ЯМР (ДМСО-d 6): d (м.ч.) 4,43 (с, 2Н, СН2), 7,0ммоль) після проведення реакції протягом 7 7,27-7,47 (м, 11Н, 2-Cl-Pyr, Ph і 4-F-Ph), 8,26 (д, 1Н, годин при 180°С і двох розділень колонковою 5,2Гц, Сб -Н 2-СІ-Pyr), 12,94 (ушир.с, 1Н, хроматографією (SiO2, СН2СI2/етилацетат 1+1). Т. обмінюваний, NH). пл. 79°С. 4-[2-Бензилсульфаніл-5-(4-фторфеніл)-3НІЧ (ATR): 2924,1601, 1494, 1407, 1219 (C-F), імідазол-4-іл]-2-фторпіридин (26b) 837, 810, 730, 696 см-1. З використанням загального способу А 1 H-ЯМР (CD3OD): d (мл.) 2,60 (с, 3Н, SCH 3), вказану в заголовку сполуку одержували з 24b 2,97 (с, 3Н, NCH3), 4,64 (с, 2Н, СН2), 6,64-6,66 (м, (5,1г; 17,6 моль) і бромистого бензилу (9,2г; 2Н, С3-/С5-Н 2-аміно-Pyr), 7,02-7,45 (м, 9Н, Ph i 4-F54ммоль) після проведення реакції протягом 1,5 Ph), 7,96 (д, 1Н, 5,0Гц, С6-Н 2-аміно-Pyr). годин і розділення колонковою хроматографією (АШ2 О3 , СН2СШ2/етилацетат 1+1). Т. пл. 174°С. Сполуки, перераховані нижче в таблиці 2, були одержані з використанням вищезгаданого ІЧ (ATR): 3028, 2948, 1611, 1496, 1413,1228 (Cспособу. F), 1203, 1003, 879, 838, 698 см-1. 1 H-ЯМР (ДМСО-d 6): d (м.ч.) 4,43 (с, 2Н, СН2), 7,11 (с, 1Н, С3-Н 2-F-Pyr), 7,25-7,51 (м, 10Н, С5-Н 2F-Pyr, Ph і 4-F-Ph), 8,10 (д, 1Н, 5,3Гц, С6-Н 2-F-Pyr), 12,93 (ушир.с, 1Н, обмінюваний, NH). Бензил-{4-[2-бензилсульфаніл-5-(4фтор феніл)-3Н-імідазол-4-іл]піридин-2-іл}амін (26с) З використанням загального способу С вказану в заголовку сполуку одержували з 26b (0,2г; 0,53ммоль) і бензиламіну (0,60г; 5,6ммоль) після проведення реакції протягом 6 годин при 180°С і розділення колонковою хроматографією (SiO2 60, СН2СI2/е тилацетат 1+1). Т. пл. 185°С. ІЧ (ATR): 3407 (NH), 3025, 2855, 2713, 1599, 1550, 1489, 1356, 1220 (C-F), 1155, 840, 814, 693 см -1. 1 H-ЯМР (CD3OD): d (мл.) 4,21 (с, 2Н, NCH2), 4,38 (с, 2Н, SCH2), 6,52-6,55 (м, 2Н, С3-/С5-Н 2аміно-Pyr), 7,03-7,38 (м, 9Н, Ph і 4-F-Ph), 7,83 (д, 1Н, 5,7 Гц, С6-Н 2-аміно-Pyr). (RS)-{4-[2-Бeнзилcyльфaнiл-5-(4-фтopфeнiл)3H-iмiдaзoл-4-iл]пipидин-2-iл}-(1-фенілетил)амін (26d) З використанням загального способу С вказану в заголовку сполуку одержували з 26b (0,2г; 0,53ммоль) і (RS-)-1-фенілетиламіну (0,65г; 5,4ммоль) після проведення реакції протягом 15 годин при 150°С і розділення колонковою хроматографією (SiO2 60, СН2СI2/етилацетат 1+1). Т. пл. 145°С. ІЧ (ATR): 3028, 1606, 1546,1494, 1450, 1221 (CF), 1157, 837, 813, 697 см -1. 49 80718 50 ІЧ (ATR): 3049, 1592, 1505, 1374, 1224 (C-F), H-ЯМР (CD3OD): d (1,44 (д, 3Н, 6,8Гц, СН3), 1086, 1030 (S=O), 1014, 989, 839, 816,781 см -1 (C4,22 (с, 2Н, СН2), 6,44-6,54 (м, 2Н, С3-/С5-Н 2аміно-Pyr), 7,04-7,35 (м, 9Н, Ph і 4-F-Ph), 7,80 (д, Cl). 1 1Н, 5,4Гц, С6-Н 2-аміно-Pyr). H-ЯМР (ДМСО-d 6): d (м.ч.) 2,71 (с, 3Н, СН3), {4-[2-Бензилсульфаніл-5-(4-фторфеніл)-3Н4,48 (с, 2Н, СН2), 7,25-8,24 (м, 10Н, 2-Cl-Pyr, 4імідазол-4-іл]піридин-2-іл}-(4-метоксибензил)амін MeS(0)-Ph і 4-F-Ph), 8,26 (д, 1Н, 5,3Гц, С6-Н 2-С1(26е) Pyr), 12,94 (ушир.с, 1Н, обмінюваний, NH), З використанням загального способу С 2-Фтор-4-[5-(4-фторфеніл)-2-(4вказану в заголовку сполуку одержували з 26а метансульфінілбензилсульфаніл)-3Н-імідазол-4(0,2г; 0,5ммоль) і 4-метоксибензиламіну (2,0г; іл]піридин (27b) 14,6ммоль) після проведення реакції протягом 22 З використанням загального способу А годин при кипінні зі зворотним холодильником і вказану в заголовку сполуку одержували з 24b розділення колонковою хроматографією (АI2 О3, (4,2г; 14,5ммоль) і 3 (4,1г; 22ммоль) після СН2СI2/етилацетат 1+1). Т. пл. 196-200°С. проведення реакції протягом 2 годин і розділення ІЧ (ATR): 1605, 1574, 1507, 1245, 1225 (C-F), колонковою хроматографією (1. Аl2О3, 843, 814, 698 см -1. СН2Сl2/етилацетет 1+1; 2. SiO2 60, СН2Сl2/EtOH 1 9+1). Т. пл. 150°С. H-ЯМР (ДМСО-d 6): d (м.ч.) 4,29 (с, 2Н, ізомери ІЧ (ATR): 3061, 1610, 1506, 1408, 1227 (C-F), «А» + «В», NCH2), 4,35 (с, 2Н, «А» + «В», SCH2), 1030 (S=O), 1016, 995, 978, 882, 839, 815 см -1. 6,43-6,47 (м, 1Н «А» + 2Н «В», С5-Н «А» і С3-/С5-Н 1 «В», 2-аміно-Pyr), 6,65 (с, 1Н «А», С3-Н2-аміноH-ЯМР (ДМСО-d 6): d (м.ч.) 2,71 (с, 3Н, СН3), Pyr), 6,80-6,84 (м, 2Н «А» + «В», 4-MeO-Ph), 7,144,49 (с, 2Н, СН2), 7,10 (с, 1Н, С3-H2-F-Pyr), 7,307,51 (м, 11Н «А» + «В», 4-MeO-Ph, Ph і 4-F-Ph), 7,37 (м, 3Н, С5-Н 2-F-Pyr і 4-F-Ph), 7,47-7,67 (м, 6Н, 7,79 (д, 1Н «В», 5,4Гц, С6-Н, 2-аміно-Pyr), 7,91 (д, 4-F-Ph i 4-MeS(O)-Ph), 8,11 (д, 1Н, 4,8Гц, C6-H 2-Fб 1Н, «А», 5,4Гц, С -Н, 2-аміно-Pyr), 12,67 (ушир.с, Pyr), 12,95 (ушир.с, 1Н, обмінюваний, NH). 1Н, обмінюваний, імідазол-NH), аміно-NH не Бензил-{4-[5-(4-фторФеніл)-2-(4видний. метансульфінілбензилсульфаніл)-3Н-імідазол-44-[2-Бензилсульфаніл-5-(4-фторфеніл)-3Ніл]піридин-2-іл}амін (27с) імідазол-4-іл]-2-метоксипіридин (26f) З використанням загального способу С Суспензію 25а (0,1г; 0,25ммоль) в вказану в заголовку сполуку одержували з 27b метанольному розчині NaOCH3 (30%, 2мл) (0,3г; 0,68ммоль) і бензиламіну (0,75г; 7,0ммоль) розбавляли метанолом (5мл) і перемішували при після проведення реакції протягом 7 годин при кипінні зі зворотним холодильником протягом 13 170°С і розділення колонковою хроматографією годин. Реакційну суміш розбавляли Н2О і водний (SiO2 60, СН2Сl2/EtOH 19+1). Т. пл. 149°С. розчин екстрагували (СН2Сl2) (3х). Об'єднаний ІЧ (ATR): 3238, 3064, 1600, 1558, 1514, 1495, органічний екстракт промивали насиченим 1227 (C-F), 1034 (S=O), 1006, 982, 839,814 см -1. 1 розчином NaCl, сушили над Na2SO4 і H-ЯМР (CD3OD): d (м.ч.) 2,70 (с, 3Н, СН3), 4,21 концентрували. Маслянистий залишок очищали (с, 2Н, NCH2), 4,32 (с, 2Н, SCH2), 6,51-6,55 (м, 2Н, колонковою хроматографією (SiO2 60, С3-/С5-Н 2-аміно-Pyr), 7,03-7,42 (м, 13Н, Ph, 4СН2Сl2/етилацетат 1+1). MeS(O)-Ph і 4-F-Ph), 7,82 (д, 1Н, 5,5Гц, С6-Н 21 H-ЯМР (CDCl3): d (м.ч.) 3,91 (с, 3Н, ОСН3), аміно-Pyr). 4,29 (с, 2Н, СН2), 6,91-6,95 (м, 1Н, 2-МеО-Pyr), (RS)-{4-[5-(4-фторфеніл)-2-(47,02-7,11 (м, 2Н, 4-F-Ph), 7,27-7,38 (м, 7Н, Ph і 4-Fметансульфінілбензилсульфаніл)-3Н-імідазол-4Ph), 8,05 (д, 1Н, 5,4Гц, С6-Н 2-МеО-Pyr), NH не іл]піридин-2-іл}-(1-фенілетил)амін (27d) видний. З використанням загального способу С Приклад 27 вказану в заголовку сполуку одержували з 27b 2-Хлор-4-[5-(4-фторфеніл)-2-(4(0,3г; 0,68ммоль) і (RS)-1-фенілетиламіну (0,85г; метансульфінілбензилсульфаніл)-3Н-імідазол-47,0ммоль) після проведення реакції протягом 10 іл]піридин (27а) годин при 170°С і розділення колонковою NaH (55-65%; 0,1г; приблизно 2ммоль) хроматографією (SiO2 60, CH2Cl2/Et.OH 9+1). Т. пл. вводили в розчин 24а (0,31г; 1,0ммоль) в 193°С. абсолютному ТГФ (15мл). Первинну суміш ІЧ (ATR): 2967, 1606, 1547, 1502, 1221 (C-F), перемішували при кімнатній температурі протягом 1085, 1031 (S=O), 1014, 838, 814, 670 см -1. 1 5 хвилин і додавали 4H-ЯМР (CD3OD): d (м.ч.) 1,45 (д, 3Н, 6,8Гц, метилсульфінілбензилхлорид (3, 0,19г; 1,0ммоль). СН3), 2,67 (с, 3Н, S(O)CH3), 4,28 (с, 2Н, СН2), 4,62Реакційну суміш перемішували при кімнатній 4,73 (м, 1Н, метин-Н), 6,42-6,53 (м, 2Н, С3-/С5-Н 2температурі протягом 2 годин. Жовто-коричневий аміно-Pyr), 7,09-7,44 (м, 9Н, Ph і 4-F-Ph), 8,21 (д, розчин розбавляли Н2О і нейтралізували 1Н, 5,0Гц, С6-Н 2-F-Pyr). лимонною кислотою 10%-ної концентрації. ТГФ Сполуки, одержані способом С, представлені видаляли, і водний розчин екстрагували нижче в таблиці 3 (однак сполука №31 була етилацетатом (2х). Об'єднаний органічний одержана способом D). екстракт промивали насиченим розчином NaCl (2x), сушили над Na2SO4 і концентрували. Твердий залишок очищали колонковою хроматографією (SiO2 60, СН2Сl2/EtOH 9,5+0,5). Т. пл. 179°С. 1 51 80718 Приклад 37а Циклогексил-{4-[5-(4-фторфеніл)-2метилсульфаніл-1Н-імідазол-4-іл]піридин-2-іл}амін (37а) 2-Фтор-4-[5-(4-фторфеніл)-2-метилсульфаніл1Н-імідазол-4-іл]піридин (1,2г, 4ммоль), який відважували в одногорлу колбу місткістю 25мл, заздалегідь продуту аргоном, суспендували в циклогексиламіні (3,97г, 0,04моль), вводили захисну атмосферу аргону і потім нагрівали при кипінні аміну зі зворотним холодильником на масляній бані при температурі 160°С протягом 48 годин. Коричневу суспензію залишали охолоджуватись до кімнатної температури. Потім додавали 30мл розчину цитрату Na (10%-ний розчин лимонної кислоти, рН 5, з концентрованим NaOH) і суміш перемішували протягом 10 хвилин і екстрагували двічі 30мл етилацетату. Об'єднані органічні фази знову екстрагували двічі у кожному разі 30мл розчину цитрату Na (10%-ний розчин лимонної кислоти, рН 5, з концентрованим NaOH), потім 30мл розчину НаНСО3 і екстрагували один раз насиченим розчином NaCl. Органічні фази сушили над Na2SO4 і концентрували з використанням роторного випарника, залишок кристалізували з 10мл. Перекристалізацію проводили з суміші ізопропанол/вода (приблизно 5мл ІРrOН нагрівають і залишають охолоджуватись і повільно додають приблизно 5мл дистильованої води). Вихід: 0,76г (49,7%), чистота (за ВЕРХ) 96,6%. Таким способом одержують сполуки формули І, представлені нижче в таблиці 4. 52 Сполуки, представлені нижче в таблиці 5, були одержані з використанням вищезгаданого способу. 53 80718 54 55 80718 56 57 80718 58 59 80718 60
ДивитисяДодаткова інформація
Назва патенту англійською2-thio-substituted imidazole derivatives and their use in pharmaceutics
Автори англійськоюLaufer Stefan, Striegel, Hans-Gunter, Albrecht Wolfgang
Назва патенту російською2-тиозамещеные производные имидазола и их применение в фармацевтике
Автори російськоюЛауфер Стефан, Альбрехт Вольфганг
МПК / Мітки
МПК: A61P 19/06, A61P 19/02, C07D 413/14, A61P 37/00, A61K 31/444, A61P 1/02, C07D 401/04, A61P 1/04, A61P 29/00, C07D 405/14, A61K 31/5377, A61P 37/06, A61P 17/06, A61P 37/08, A61P 25/04, C07D 417/14, A61P 25/00, A61P 11/00, C07D 409/14, A61P 37/02, A61P 9/04, A61P 25/08, A61P 31/18, C07D 453/00, A61K 31/4439, C07D 493/04, A61K 31/4709, A61K 31/496, A61P 19/10, A61P 1/16, A61P 9/00, C07D 401/14, A61P 17/14, A61P 35/00, A61P 25/28, A61P 9/10, A61P 3/10
Мітки: застосування, 2-тіозаміщені, похідні, фармацевтиці, імідазолу
Код посилання
<a href="https://ua.patents.su/30-80718-2-tiozamishheni-pokhidni-imidazolu-ta-kh-zastosuvannya-u-farmacevtici.html" target="_blank" rel="follow" title="База патентів України">2-тіозаміщені похідні імідазолу та їх застосування у фармацевтиці</a>
Попередній патент: Електромеханічний регулятор напруги системи збудження синхронного генератора
Наступний патент: Зв’язуюче для шляхового покриття (варіанти) та спосіб його одержання
Випадковий патент: Засіб для передпосівної обробки насіння ярового ячменю і гороху