Спосіб лікування або запобігання розладів центральної нервової системи похідними 1-ар(алк)-4-піперидиноімідазолін-2-ону, фармацевтична композиція
Номер патенту: 87982
Опубліковано: 10.09.2009
Автори: Дост Ріта, Рунфельдт Кріс, Рабе Хольгер, Лянген Барбара, Людденс Хартмут
Формула / Реферат
1. Спосіб лікування або запобігання розладу центральної нервової системи, який являє собою афективний розлад чи афективний епізод або тривожний розлад чи тривожний епізод, шляхом введення пацієнту, який цього потребує, ефективної кількості щонайменше одного 1-ар(алк)ілімідазолін-2-ону формули (І)
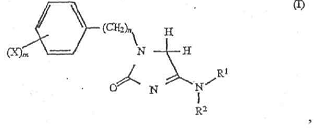
де X - водень, С1-4-алкіл, С1-4-алкоксильна група, трифторметил або галогеновий залишок, R1 і R2, незалежно один від одного є С1-4-алкільним, С3-10-циклоалкільним або С3-10-гетероалкільним залишком, або R1 і R2 спільно є С2-6-алкіленовим залишком, в якому група -СН2 факультативно замінена киснем, азотом або сіркою, n - 0 або 1 і m - 0 або ціле число від 1 до 5,
вибраного з 1-(4-метоксифеніл)-4-піперидиноімідазолін-2-ону та 1-(4-хлорфеніл)-4-піперидиноімідазолін-2-ону.
2. Спосіб за п. 1, який відрізняється тим, що вводять ефективну кількість 1-(4-хлорфеніл)-4-піперидиноімідазолін-2-ону.
3. Спосіб за п. 1 або п. 2, який відрізняється тим, що згадану сполуку вводять парентеральним або пероральним шляхом.
4. Спосіб за будь-яким із пп. 1-3, який відрізняється тим, що згадану сполуку вводять у кількості 1-100 мг на кг маси тіла хворого.
5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що розладом центральної нервової системи є афективний розлад або афективний епізод.
6. Спосіб за п. 5, який відрізняється тим, що афективним розладом або афективним епізодом є клінічна депресія, тяжкий депресивний розлад або епізод, епізоди маніакального, змінного та гіпоманіакального настрою, депресивні епізоди з атиповими, кататонічними або меланхолічними проявами, депресивні епізоди з передменструальним дисфорійним розладом, який виникає у післяпологовий період, легкий депресивний розлад, посттравматичний стресовий розлад, обсесивно-компульсивний розлад і розлади харчування.
7. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що розладом центральної нервової системи є тривожний розлад або тривожний епізод.
8. Спосіб за п. 7, який відрізняється тим, що тривожним розладом або епізодом є хронічний тривожний розлад, панічний розлад, агорафобія, специфічна фобія, соціальна фобія та генералізований тривожний розлад.
9. Фармацевтична композиція для лікування або запобігання розладу центральної нервової системи, який являє собою афективний розлад чи афективний епізод або тривожний розлад чи тривожнии епізод, яка містить ефективну кількість щонайменше одного 1-ар(алк)ілімідазолін-2-ону формули (І)

де X - водень, С1-4-алкіл, С1-4-алкоксильна група, трифторметил або галогеновий залишок, R1 і R2, незалежно один від одного є С1-4-алкільним, С3-10-циклоалкільним або С3-10-гетероалкільним залишком, або R1 і R2 спільно є С2-6-алкіленовим залишком, в якому група -СН2 факультативно замінена киснем, азотом або сіркою, n - 0 або 1 і m - 0 або ціле число від 1 до 5,
вибраного з 1-(4-метоксифеніл)-4-піперидиноімідазолін-2-ону та 1-(4-хлорфеніл)-4-піперидиноімідазолін-2-ону.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що сполукою формули (І) є 1-(4-хлорфеніл)-4-піперидиноімідазолін-2-он.
11. Фармацевтична композиція за будь-яким із пп. 9, 10, яка відрізняється тим, що згадана композиція додатково містить наповнювачі або допоміжні речовини.
12. Фармацевтична композиція за будь-яким із пп. 9-11 для парентерального або перорального введення.
13. Фармацевтична композиція за п. 9, яка відрізняється тим, що згадана композиція містить 1-100 мг на кг маси тіла хворого сполуки формули (І).
14. Фармацевтична композиція за будь-яким із пп. 9-13, де розладом центральної нервової системи є афективний розлад або афективний епізод.
15. Фармацевтична композиція за п. 14, де афективним розладом або афективним епізодом є клінічна депресія, тяжкий депресивний розлад або епізод, епізоди маніакального, змінного та гіпоманіакального настрою, депресивні епізоди з атиповими, кататонічними або меланхолічними проявами, депресивні епізоди з передменструальним дисфорійним розладом, який виникає у післяпологовий період, легкий депресивний розлад, посттравматичний стресовий розлад, обсесивно-компульсивний розлад і розлади харчування.
16. Фармацевтична композиція за будь-яким із пп. 9-13, де розладом центральної нервової системи є тривожний розлад або тривожний епізод.
17. Фармацевтична композиція за п. 16, де тривожним розладом або епізодом є хронічний тривожний розлад, панічний розлад, агорафобія, специфічна фобія, соціальна фобія та генералізований тривожний розлад.
Текст
1. Спосіб лікування або запобігання розладу центральної нервової системи, який являє собою афективний розлад чи афективний епізод або тривожний розлад чи тривожний епізод, шляхом введення пацієнту, який цього потребує, ефективної кількості щонайменше одного 1ар(алк)ілімідазолін-2-ону формули (І) 2 (19) 1 3 цифічна фобія, соціальна фобія та генералізований тривожний розлад. 9. Фармацевтична композиція для лікування або запобігання розладу центральної нервової системи, який являє собою афективний розлад чи афективний епізод або тривожний розлад чи тривожний епізод, яка містить ефективну кількість щонайменше одного 1-ар(алк)ілімідазолін-2-ону формули (І) де X - водень, С1-4-алкіл, С1-4-алкоксильна група, трифторметил або галогеновий залишок, R1 і R2, незалежно один від одного є С1-4-алкільним, С3-10циклоалкільним або С3-10-гетероалкільним залишком, або R1 і R2 спільно є С2-6-алкіленовим залишком, в якому група -СН2 факультативно замінена киснем, азотом або сіркою, n - 0 або 1 і m - 0 або ціле число від 1 до 5, вибраного з 1-(4-метоксифеніл)-4піперидиноімідазолін-2-ону та 1-(4-хлорфеніл)-4піперидиноімідазолін-2-ону. 10. Фармацевтична композиція за п.9, яка відрізняється тим, що сполукою формули (І) є 1-(4хлорфеніл)-4-піперидиноімідазолін-2-он. Цей винахід має відношення до застосування 1-ар(алк)ілімідазолін-2-онів, що містять двозаміщений радикал аміну у 4 положенні, для лікування або запобігання розладів центральної нервової системи, у тому числі психотичних розладів і, зокрема, шизофренії, депресії, тривоги, дистонії, і до застосування цих та інших агоністичних речовин, які являють собою субтипово-селективні ліганди рецепторів бензодіазепінів, що містять субодиницю субодиницю альфа 3. Розлади центральної нервової системи є тяжкими психічними розладами, які надзвичайно погіршують повсякденне життя. Наприклад, шизофренія, на яку страждає приблизно 1% населення світу (Капуано (Capuano) та інші, 2002), найчастіше розпочинається до тридцятирічного віку, що означає лікування впродовж усього життя (Бенес (Benes), 1993). Психоз, зокрема шизофренія, має гетерогенну симптоматичну картину (American Psychiatric Association, 1994). Симптоми можуть розподілятись на дві частини. У разі шизофренії, домінуючими на гострій стадії є галюцинації (сенсорне сприйняття за відсутності зовнішнього стимулу) і марення (хибні, нав'язливі та незвичні ідеї), наприклад, манія переслідування. Хворий є надзвичайно збудженим і втрачає контакт із реальністю. Ці симптоми називають позитивними (Девідсон (Davidson), Ніл (Neale), 1988; Бейлер (Bailer) та інші, 1999). Після того як стадія збудження посла 87982 4 11. Фармацевтична композиція за будь-яким із пп.9, 10, яка відрізняється тим, що згадана композиція додатково містить наповнювачі або допоміжні речовини. 12. Фармацевтична композиція за будь-яким із пп.9-11 для парентерального або перорального введення. 13. Фармацевтична композиція за п.9, яка відрізняється тим, що згадана композиція містить 1-100 мг на кг маси тіла хворого сполуки формули (І). 14. Фармацевтична композиція за будь-яким із пп.9-13, де розладом центральної нервової системи є афективний розлад або афективний епізод. 15. Фармацевтична композиція за п.14, де афективним розладом або афективним епізодом є клінічна депресія, тяжкий депресивний розлад або епізод, епізоди маніакального, змінного та гіпоманіакального настрою, депресивні епізоди з атиповими, кататонічними або меланхолічними проявами, депресивні епізоди з передменструальним дисфорійним розладом, який виникає у післяпологовий період, легкий депресивний розлад, посттравматичний стресовий розлад, обсесивнокомпульсивний розлад і розлади харчування. 16. Фармацевтична композиція за будь-яким із пп.9-13, де розладом центральної нервової системи є тривожний розлад або тривожний епізод. 17. Фармацевтична композиція за п.16, де тривожним розладом або епізодом є хронічний тривожний розлад, панічний розлад, агорафобія, специфічна фобія, соціальна фобія та генералізований тривожний розлад. блюється, стають очевидними так звані негативні симптоми. Ці симптоми включають порушення пізнавальної здатності, зниження активності центральної нервової системи, розлад пам'яті і розуміння мови, швидкості мовлення, рухової функції, робочої пам'яті, а також байдужість і апатичність. Хворі знаходяться у стані невпевненості та тривоги (Девідсон (Davidson), Ніл (Neale), 1988; Бейлер (Bailer) та інші, 1999). Незважаючи на доступність декількох антипсихотичних лікарських засобів, сучасна терапія психозів не є задовільною. Класичні антипсихотичні засоби з високою спорідненістю до рецептора допаміну D2, викликають тяжкі рухові розлади і мають седативні побічні ефекти (Найберг (Nyberg) та інші, 2002). Найвідомішим прототипом класичних антипсихотичних засобів, який все ще залишається лікарським засобом першого ряду, є галоперидол (Капуано (Capuano) та інші, 2002). Через те, що цей препарат має негативні побічні ефекти і може послаблювати гострі позитивні, але не негативні симптоми шизофренії, він не надає хворому можливості повернення до повсякденного життя. Цей факт обумовив розробку нових, так званих атипових, антипсихотичних препаратів. Вони демонструють знижену спорідненість до рецептора допаміну D2 і більш розмаїтий профіль рецепторної спорідненості, зосереджуючись на рецепторі серотоніну субтипу 5-НТ2 (Сейва (Sawa), 5 Снайдер (Snyder), 2002). Зміна профілю рецепторної спорідненості цих лікарських засобів зменшила прояв побічного ефекту у вигляді рухових розладів, однак призвела до зсуву побічних ефектів до таких проблем, як надзвичайно швидкий приріст маси тіла, порушення у статевій сфері, порушення пізнавальних функцій і втрата почуття задоволення. Клозапін (clozapine), який відіграє роль базового лікарського засобу, що поліпшує як позитивні, так і негативні симптоми шизофренії і є позбавленим побічних ефектів у вигляді рухових розладів, викликає агранулоцитоз, що є головним, потенційно летальним, побічним ефектом цього лікарського засобу (Капуано (Capuano) та інші, 2002). Передусім, однак, все ще залишається велика кількість випадків, які не виліковуються (Лінденмайєр (Lindenmayer) та інші, 2002). Ні причина шизофренії, ні механізм дії антипсихотичних лікарських засобів, зокрема, атипових антипсихотичних лікарських засобів, повністю не встановлені. Існує, як видається, полігенний тип успадкування, який, окрім того, керується негенетичними факторами (Прасад (Prasad) та інші, 2002). Все більш зростаючий обсяг епідеміологічних, генетичних та клінічних нейробіологічних даних вказує на те, що у патофізіології шизофренії вирішальну роль відіграють аномалії розвитку головного мозку (Арнольд (Arnold), 1999). Головна гіпотеза щодо шизофренії базується на порушенні функціонування допамінергічної системи. Так, гострі психотичні симптоми можуть стимулюватись допамінергічними лікарськими засобами (Капуано (Capuano) та інші, 2002) і, як описувалось вище, класичні антипсихотичні лікарські засоби, наприклад, галоперидол (haloperidol), мають високу спорідненість до рецептора допаміну D2 (Найберг (Nyberg), 2002). Спосіб дії атипових антипсихотичних засобів вказує, однак, на існування додаткових нейромедіаторних систем, залучених до розвитку шизофренії. Клозапін, базовий антипсихотичний лікарський засіб, і єдиний, що поліпшує позитивні і негативні симптоми шизофренії, не виявляє високої спорідненості до рецепторів допаміну D2 (Герлах (Gerlaeh), 2002). Наприклад, іншим нейромедіатором, залученим до патофізіології шизофренії, є серотонін (Сейва (Sawa), Снайдер (Snyder), 2002). До розвитку шизофренії залученою видається також глутаматергічна нейромедіаторна система. Так, антагоністи NMDA (N-метил-D-аспартат), наприклад, фенциклідин (phencyclidine) і кетамін (ketamine), можуть стимулювати симптоми шизофренії у людей і гризунів (Абі-Сааб (Abi-Saab) та інші, 1998; Лахті (Lahti) та інші, 2001). Перевага модельних тварин, що застосовувались для імітації психозу на основі антагоністів NMDA, у протилежність допамінергічним моделям, полягає у тому, що вони не тільки імітують збуджену та імпульсивну поведінку позитивної фази шизофренії, але також і негативні симптоми шизофренії, наприклад, порушення пізнавальної здатності (АбіСааб (Abi-Saab) та інші, 1998; Йєнтш (Jentsch), Рот (Roth), 1999). Завдяки цьому, ця модель може застосовуватись для ідентифікації нових лікарських засобів з антипсихотичним потенціалом. 87982 6 Незважаючи на те, що причина більшості розладів центральної нервової системи є ще далекою від розуміння, було встановлено, однак, що важливу роль у багатьох розладах центральної нервової системи відіграє нейромедіатор серотонін (5НТ). Хоча складні емоційні стани, наприклад, депресивний та тривожний стани, не можуть бути зведені виключно до дисбалансу, що викликається одним нейромедіатором, підтверджується, однак, що однією з головних причин розвитку депресії та тривоги є розлади нейромедіаторної системи 5-НТ (Греф (Graeff) та інші, 1996). Так, незалежно від різноманітних клінічних форм депресії, а саме тяжкого депресивного розладу та епізодів, епізодів маніакального, змінного та гіпоманіакального настрою, депресивних епізодів з атиповими, кататонічними або меланхолічними проявами, депресивних епізодів з передменструальним дисфорійним розладом, який виникає у післяпологовий період, легкого депресивного розладу, посттравматичного і гострого стресового розладу, хворі у стані депресії демонструють значне зниження рівнів 5-НТ у цереброспінальній рідині і додаткові зміни у центральній системі 5-НТ (Оуенс (Owens) Немероф (Nemeroff), 1994). Незважаючи на те, що першопричинний механізм депресії є, безсумнівно, більш складним, аніж просте зниження рівнів 5-НТ або ослаблення функціонування цієї системи (Дельгадо (Delgado), Морено (Moreno), 1999), участь серотонінергічної системи у депресії найбільш наглядно демонструється терапевтичною ефективністю лікарських засобів, що підвищують позаклітинну концентрацію 5-НТ у головному мозку, наприклад, селективних інгібіторів повторного поглинання серотоніну (SSRI). Так, SSRI, наприклад, флуоксетин (fluoxetine) або циталопрам (citalopram), є, як описують, ефективними при лікуванні депресії різних підгруп, у тому числі тяжкого депресивного розладу, обсесивнокомпульсивного розладу і розладів харчування (Стоке (Stokes), Гольц (Holtz), 1997). Важливо звернути увагу на те, що селективні інгібітори повторного поглинання серотоніну розглядались як значне досягнення у лікуванні розладів центральної нервової системи, порівняно з неселективними інгібіторами поглинання моноаміну, які одночасно різною мірою підвищують рівні серотоніну, допаміну і норадреналіну і, відповідно до цього, демонструють більшу кількість побічних ефектів. На додаток до цього, довготривале підвищення рівнів позаклітинної концентрації 5-НТ у головному мозку за допомогою, наприклад, селективних інгібіторів повторного поглинання серотоніну, може послаблювати тривогу у тварин і людей (Джоунз (Jones) та інші, 2002; Стоке (Stokes), Гольц (Holtz), 1997). Так, флуоксетин, селективний інгібітор повторного поглинання серотоніну, що застосовується для лікування різних тривожних розладів (Натт (Nutt) та інші, 1999), демонструє додатковий ефект модуляції підвищених рівнів 5НТ у разі панічного розладу, агорафобії, специфічної фобії, соціальної фобії та генералізованого тривожного розладу. Стає зрозумілим, що фармакологічний ефект опосередковується підвищеними рівнями нейромедіаторів, наслідком чого є підви 7 щена активація відповідного рецептора, а не специфічним блокуванням медіатору поглинання. Однак пізня поява ознак анксіолітичного і антидепресивного ефекту сполук, що підвищують рівень 5-НТ у головному мозку, наприклад, селективних інгібіторів повторного поглинання серотоніну, є обмежувальним фактором терапевтичної корисності цих лікарських засобів (Натт (Nutt) та інші, 1999). Людина, що знаходиться у напруженому емоційному стані на межі скоєння самогубства, не може очікувати впродовж трьох тижнів, доки проявиться антидепресивний, антипсихотичний та/або анксіолітичний ефект цього лікарського засобу. У протилежність до SSRI, бензодіазепіни демонструють швидку появу ознак своєї анксіолітичної активності (Коста (Costa), Гідотті (Guidotti), 1996). Діапазон їх терапевтичного застосування обмежується, однак, відносно коротким періодом часу, оскільки можливість їх постійного застосування обмежується розвитком толерантності до дії бензодіазепінів і ризиком виникнення звикання до надмірного вживання лікарських засобів (Коста (Costa), Гідотті (Guidotti), 1996). Таким чином, лікарський засіб, що об'єднує обидва механізми, а саме швидку появу ознак активності бензодіазепінів і ефективність тривалого застосування SSRI, виявився б великим досягненням при лікування тривожних розладів, а також депресії. Іншим варіантом розладу центральної нервової системи є дистонія. Дистонія являє собою руховий розлад, основу якого становить порушення функції центральної нервової системи щодо регулювання рухової активності; раніше цей розлад був відомим також під назвою "психовегетативний синдром". Цей розлад характеризується мимовільними, повторними рухами і аномальними положеннями тіла, частково у поєднанні з болісними м'язовими судомами (Грін (Green), 1992; Фрідман (Friedman), Стандерт (Standaert), 2001; Гаманн (Hamann), Ріхтер (Richter), 2002). Симптоми, у залежності від підтипу дистонії, коливаються від вогнищевих до генералізованих дистонічних нападів. Існують також прогресуючі форми, що розпочинаються вогнищевими нападами у дитинстві. Уражатись можуть люди будь-якого віку. У Германії знаходиться приблизно 80000 людей, що страждають на дистонічні напади (DDGeV, 2002). На основі розподілу симптомів, дистонія може класифікуватись на декілька підтипів: вогнищеві дистонії, багатовогнищеві або сегментні дистонії, торсіонні дистонії, півкульні, генералізовані або пізні дистонії. До вогнищевих дистоній належать цервікальна дистонія (кривошия), блефароспазм (мимовільне скорочення повік), апендикулярна дистонія (судоми кінцівок, наприклад, писальна спазма), оромандибулярна дистонія і спастична дисфонія (спазма голосових зв'язок) (DDGeV, 2002; Фрідман (Friedman), Стандерт (Standaert), 2001). На сучасному етапі, за винятком декількох рідкісних форм, лікування дистонії зосереджується на симптоматичному лікуванні. Вогнищеві дистонії можуть доволі успішно лікуватись ботулотоксином (Хсюнгг.І. (Hsiung G.Y.) та інші, 2002). Ботулоток 87982 8 син, який вводять локально до ураженої ділянки, викликає кількатижневе розслаблення м'язів. Лікування слід проводити регулярно. Слабким місцем цього лікування є те, що у деяких хворих розвивається стійкість до токсину унаслідок появи антитіл проти нього, і токсин не може застосовуватись у разі ураження великих ділянок тіла (Дресслер (Dressier) та інші, 2002; Хсюнг (Hsiung) та інші 2002). Системна фармакотерапія сегментних і генералізованих дистоній є незадовільною. Вона залучає застосування антихолінергічних лікарських засобів і баклофену (baclofen), пресинаптично діючого агоніста ГАМКв, який, за повідомленнями, благотворно впливає на симптоми дистонії (Фан (Fahn), 1987; Грін (Green), 1992; Равідкі (Rawicki), 1999). Ефект антиконвульсивних лікарських засобів у разі дистонії є суперечливим: фенобарбітал (phenobarbital) і ламотригін (lamotrigine), як видається, мають продистонічний ефект, у той час як габапентин (gabapentin), як гадають, є антидистонічним (Ріхнер (Richner), Льошер (Loscher), 1999; Ріхнер (Richner), Льошер (Loscher), 2000; Сіп (Siep) та інші, 2002). Хірургічне лікування (глибока стимуляція блідої кулі головного мозку) у разі тяжкої дистонії все ще знаходиться на найранішій стадії розвитку та удосконалення, і успішно застосовується лише при певних типах дистонії. У більшості випадків необхідною є додаткова, системна фармакотерапія (Крек (Krack), Веркей (Vercueil), 2001; Веркей (Vercueil) та інші, 2002; Клейн (Klein), Озеліус (Ozelius), 2002). Механізм дистонії повністю не вивчено. Існує багато свідчень про порушення функціонування базальних ядер (Гернерт (Gernert) та інші, 2002; Герреро (Herrero) та інші, 2002). Гадають, що порушується функціонування механізму, що координує інформацію соматосенсорних аферентних нервів і пропускає сигнали до опорно-рухового апарату (Герреро (Herrero) та інші, 2002). Дистонія може спричинюватись травмою головного мозку або інсультом, однак приблизно 80% генералізованих дистоній є ідіопатичними і, як видається, успадковуються з різним ступенем прояву (Полз (Pauls), Корчін (Korczyn), 1990). На цей час на генетичній основі розрізняють 13 різних форм дистонії (дистонія типів 1-13) (Клейн (Klein), Озеліус (Ozelius), 2002). Генна мутація ідентифікована для трьох рідких підтипів генералізованих дистоній, наприклад, для типу, що реагує на L-ДОФА (Тьягараян (Thyagarajan), 2001). Хом'яки, як генетична модель пароксизмальної дистонії, є однією з декількох чітко визначених тваринних моделей дистонії (Хамман (Hamann), Ріхтер (Richter), 2002). Тривожні розлади є широко розповсюдженими, і їх кількість зростає у всьому світі. Бензодіазепіни все ще вважаються найефективнішими лікарськими засобами для лікування тривожних розладів і демонструють швидку появу ознак анксіолітичної активності. Ці препарати, однак, демонструють також небажані побічні ефекти, наприклад, атаксію, седативний ефект, розслаблення скелетних м'язів, амнезію, що викликається взає 9 модією етанолу та барбітурату. Серйозними проблемами є також розвиток толерантності до терапевтичних ефектів цих лікарських засобів та потенціал розвитку токсикоманії (Коста (Costa), Гідотті (Guidotti), 1996; Атток (Atack), 2003). Як згадувалось вище, класом лікарських засобів, які застосовуються для лікування тривожного розладу є селективні інгібітори повторного поглинання серотоніну (SSRI). Ці лікарські засоби є добре відомими як антидепресанти і не викликають суттєвих побічних ефектів бензодіазепінів, наприклад, толерантності або токсикоманії, однак обмежувальним фактором їх терапевтичної корисності є пізня поява ознак їхнього анксіолітичного і антидепресивного ефекту (Натт (Nutt) та інші, 1999). Окрім того, на їх терапевтичне застосування впливає приріст маси тіла і порушення статевих функцій, що примушує хворих припиняти лікування (Перна (Реrnа) та інші, 2001). Об'єднання позитивних ефектів обох лікарських засобів, лігандів рецептора бензодіазепінів і селективних інгібіторів повторного поглинання серотоніну, могло б послужити матрицею для ідеального антифобійного седативного засобу. На завершення, все ще існує сильна потреба у антифобійному седативному засобі. Однією зі спроб ослаблення цих головних побічних ефектів лікарських речовин, що зв'язуються із сайтом розпізнавання бензодіазепінів на рецепторі ГАМКA, зокрема, седативного ефекту, була б розробка лікарських засобів із високою селективністю щодо певних субтипів рецептора ГАМКA (Коста (Costa), Гідотті (Guidotti), 1996). Фармакологічні та генетичні дослідження, проведеш впродовж останніх років, дозволили виявити різні aсубодиниці рецепторів, що несуть відповідальність за різні поведінкові симптоми, індуковані бензодіазепінами (Атток (Atack), 2003). Так, за описом, рецептори, що містять субодиниці альфа 1, опосередковують седативний та антиконвульсивний ефект бензодіазепінів (Коста (Costa), Гідотті (Guidotti), 1996; Крестані (Crestani) та інші, 2000; Дубінскі (Dubinsky) та інші, 2002). Рецептори ГАМКA, що містять субодиниці альфа 5, повинні відігравати роль у амнезії, що індукується бензодіазепінами, у той час як рецептори, що містять субодиниці альфа 2 і альфа 3, за результатами спостереження, несуть відповідальність за анксіолітичну активність сполук цього класу (Коста (Costa), Гідотті (Guidotti), 1996; Лоу (Low) та інші, 2000; Дубінскі (Dubinsky) та інші, 2002). Однак ефекти бензодіазепінів, специфічні для субтипів, ще не є повністю зрозумілими, і зараз точиться суперечливе обговорення ролі різних субодиниць, яке додатково ускладнюється повідомленням про існування, окрім різних альфа-субодиниць, різних бета-, гамма-субодиниць, а також додаткових субодиниць, які додають свій внесок до різнорідності. Деякі дані вказують на те, що седативний ефект бензодіазепінів, наприклад, опосередковується не виключно рецепторним субтипом, що містить субодиницю альфа 1, але і додатковими механізмами, і що субодиниці альфа-1 відіграють переважну роль лише при атаксії (Платт (Platt) та інші, 2002). Таубер (Tauber) та інші (2003) встановили, що 87982 10 втрата випрямного рефлексу унаслідок одночасного введення діазепаму і етанолу (у поєднанні з втратою рецепторної активності), у мишей, мутантних по субодиниці альфа 2, не спостерігається, але втрата рухової активності (ознака седативного ефекту), спричинена введенням обох сполук, спостерігалась у мишей, мутантних по субодиницям альфа 1, альфа 2, альфа 3 і альфа 5. Відсутність знань щодо функціонування різних субтипів рецептора бензодіазепінів, які гетерогенно експресуються у головному мозку, спричинюється, головним чином, відсутністю лігандів із високою селективністю щодо різних субтипів. Однак, виходячи з вищезгаданих даних, одержаних на основі генетично модифікованих мишей з поставленими під сумнів альфа-субодиницями, нездатними до подальшого опосередковування ефекту бензодіазепінів, декілька фірм розпочали науково-дослідні програми, спрямовані на розробку лігандів рецептора бензодіазепінів, селективних щодо субодиниць альфа 2 і альфа 3, зі зниженою активністю відносно субодиниці альфа 1 (Лоу (Low), 2000; Грібел (Griebel), 2001). Описано декілька сполук цього типу, однак ступінь субтипової селективності видається доволі обмеженим. Функціональна селективність забезпечується різним ступенем часткового агонізму відносно окремих рецепторів. Було показано, наприклад, що сполука SL651498 демонструє приблизно 40-50% часткову агоністичну активність відносно рецепторів, що містять субодиниці альфа 1 і альфа 5, з одночасною 100% частковою агоністичною активністю відносно рецепторів, що містять субодиницю альфа 2, і 70% активністю відносно рецепторів, що містять субодиницю альфа 3. Наслідком цього дійсно може бути функціональна субтипова селективність, однак лише для фармакологічних ефектів, що потребують високого ступеню активації рецепторів. У разі ефектів, що потребують активації нижчої за 50%, такі сполуки будуть діяти подібно неселективним агоністам, як видно на Фіг.2 у роботі Грібел (Griebel) та інші (2001). Все ще триває обговорення того, який ступінь активації рецептора є необхідним для якого ефекту, але було встановлено, що навіть часткові неселективні агоністи, наприклад, імідазеніл (imidazenil), демонструють у хворих седативний ефект (Атток (Atack), 2003). Залишається, таким чином, сумнівним, чи забезпечить стратегія функціонального часткового агонізму гадану селективність з виключенням субодиниці альфа 1. Незважаючи на цей факт, інші дослідники вдаються до такого самого підходу (Доусон (Dawson), 1998; Маккернан (McKeman), 1998). NS2710 і нерозкрита нова сполука, що піддається клінічній розробці, які були одержані унаслідок досліджень і програми розробки фірми Merck (Adis Data Information, 2003; Гудейкр (Goodacre) та інші, 2002; Чемберс (Chambers) та інші, 2001) ще не продемонстрували очікуваного клінічного профілю і виявились седативними і не позбавленими потенціалу звикання (Атток (Atack), 2003). Підсумовуючі ці результати, до сього часу не було досягнуто суттєвого прогресу у розробці нових лігандів рецептора бензодіазепінів, зокрема, з високою субтиповою селективністю. На додаток до цього, 11 знання щодо ролі різних субодиниць у фізіології та патофізіології захворювань все ще залишаються дуже обмеженими, і, знову ж таки, унаслідок відсутності селективних сполук. У той час як визначення ролі субодиниць альфа 1 і альфа 2 було ціллю щонайменше деяких досліджень, ще менше відомо відносно субодиниці альфа 3, яка являє собою субодиницю з достатньо вибірковим розподілом у головному мозку. До цього часу немає доступних лігандів із будь-якою селективністю щодо субодиниці альфа 3. Усі вищезгадані лікарські засоби розроблювались для того, щоб вони мали, і вони таки мають, у кращому разі деяку, селективність щодо субодиниці альфа 2 у комбінації із субодиницею альфа 3, з виключенням, до певної міри, субодиниці альфа 1. Існує усього декілька досліджень відносно рецептора, що містить субодиницю альфа 3. У імуногістохімічному дослідженні субодиниця альфа 3 описується як така, що у великій кількості експресується у холінергічних нейронах смугастого тіла, перегородки, смуги білої речовини, що з'єднує різні частини мозку, і у допамінергічних нейронах щільної частини чорної речовини головного мозку, у той час як ці клітини експресують лише незначну кількість субодиниць альфа 2 (Родрігес-Пальарес (Rodriguez-Pallares) та інші, 2001). Видається, що субодиниці альфа 3 на допамінергічних нейронах щільної частини чорної речовини супроводжуються, головним чином, субодиницями альфа 4 (субодиниця альфа 4 є нечутливою до бензодіазепінів), у той час як мРНК субодиниць альфа 2 виявлено не було (Гайон (Guyon) та інші, 1999). Норадренергічні нейрони locus coeruleus, за описом, є імунореактивними відносно субодиниць альфа 3 і альфа 2. Усі ці ділянки головного мозку були імунонегативними відносно субодиниць альфа 1 (Родрігес-Пальарес (Rodriguez-Pallares) та інші, 2001). Подібним чином, серотонінергічні нейрони на лінії зрощення демонструють високий рівень мічення субодиниць альфа 3, у той час як там спостерігається лише декілька нейронів, що експресують субодиницю альфа 2 (Родрігес-Пальарес (Rodriguez-Pallares) та інші, 2001). На додаток до цього, Гао (Gao) та інші (1993) встановили, що переважна більшість серотонінергічних нейронів лінії зрощення демонструє сильну імунореактивність відносно субодиниці альфа 3, але вони не мають забарвлення субодиниці альфа 1, у той час як у ГАМКергічних нейронах лінії зрощення присутні обидві субодиниці. Усі ці дослідження, однак, являли собою дослідження з міченням, і вони не дають можливості одержання скільки-небудь чіткої фармакологічної картини, опосередкованої субодиницею альфа 3. У разі місцевого введення мусцимолу (muscimol), агоніста ГАМКА, і бікукулліну (bicuculline), антагоніста ГАМКA, у дорсальній і медіальній частині лінії зрощення, за допомогою мікродіалізу виявили вплив на позаклітинні рівні 5-НТ (місцево і у прилеглому ядрі) (Тао (Тао). Ауербах (Auerbach), 2000). Це вказує на те, що рецептори ГАМКА, що містять субодиницю альфа 3, можуть 87982 12 бути залученими до серотонінергічної передачі нервових імпульсів. Виходячи з вищенаведеного, стає зрозумілим, що сучасні способи і можливості лікування розладів центральної нервової системи, у тому числі психотичних розладів, депресії, тривожних розладів і рухових розладів, наприклад, дистонії, є недостатніми, і вони принаймні частково демонструють тяжкі побічні ефекти. Таким чином, мета цього винаходу полягала у наданні додаткових можливостей лікування або запобігання таких розладів центральної нервової системи у ссавців і, зокрема, у наданні способів лікування для застосування на людях. За першим аспектом цього винаходу, ця мета була досягнута способом лікування або запобігання розладів центральної нервової системи, у тому числі, психотичних розладів, депресії, тривожних розладів і рухових розладів та/або психотичних симптомів, пов'язаних з іншими психічними розладами, шляхом введення ефективної кількості щонайменше одного 1-ар(алк)ілімідазолін-2-ону формули (І) (I) де X - водень, С1-4-алкіл, С1-4-алкоксильна група, трифторметил або галогеновий залишок, R1 і R2, незалежно один від одного, є С1-4-алкільним, С3-10-циклоалкільним або С3-10-гетероалкільним залишком, або R1 і R2 разом є С2-6-алкіленовим залишком, де група -СН2 факультативно заміщена киснем, азотом або сіркою, n - 0 або 1, m - 0 або ціле число від 1 до 5, хворому, який цього потребує. За цим винаходом, з подивом було встановлено, що сполуки формули І є високоефективними щодо лікування наведених нижче розладів центральної нервової системи: 1. Психози і психотичні епізоди: Різні типи шизофренії (наприклад, параноїдна, гебефренічна, кататонічна недиференційована або резидуальна) і біполярні афективні розлади, наприклад, біполярна депресія і постпсихотичні депресивні розлади шизофренії. Психотичні епізоди, що спостерігаються у разі шизофреноподібних розладів, шизоафективні розлади, маревні розлади, психотичні розлади, обумовлені дією певних речовин (наприклад, алкоголю, амфетаміну, гашишу, кокаїну, галюциногенів, лікарських засобів для інгаляції (летких препаратів), опіоїдів або фенциклідину); зміни особистості (наприклад, пограничні зміни особистості), імпульсивні розлади, наприклад, неадекватна агресивність; біполярні розлади, гіперактивність з дефіцитом уваги (AD/HD), зловживання і залежність від певних речовин (наприклад, хронічний алкоголізм, залежність від амфетаміну, кокаїну або опіатів). 2. Афективні розлади і афективні епізоди Клінічна депресія, тяжкий депресивний розлад і епізоди, епізоди маніакального, змінного та гіпо 13 маніакального настрою, депресивні епізоди з атиповими, кататонічними або меланхолічними проявами, депресивні епізоди з передменструальним дисфорійним розладом, який виникає у післяпологовий період, легкий депресивний розлад, посттравматичний стресовий розлад, обсесивнокомпульсивний розлад і розлади харчування (порушення поведінки харчування). 3. Тривожні розлади і тривожні епізоди Хронічний тривожний розлад, панічний розлад, агорафобія, специфічна фобія, соціальна фобія та генералізованийтривожний розлад. 4. Рухові розлади, пов'язані, головним чином, із порушенням функціонування базальних ядер Різні підтипи дистонії, наприклад, вогнищеві дистонії, багатовогнищеві або сегментні дистонії, торсіонна дистонія, півкульні, генералізовані або пізні дистонії (індуковані психофармакологічними лікарськими засобами). До вогнищевих дистоній належать цервікальна дистонія (кривошия), блефароспазм (мимовільне скорочення повік), апендикулярна дистонія (судоми кінцівок, наприклад, писальна спазма), оромандибулярна дистонія, спастична дисфонія (спазма голосових зв'язок) і пароксизмальна дистонія. Вперше сполуки формули (І) були описані у WO 97/09314 як речовини, придатні для лікування епілептичних розладів. Зараз із подивом встановлено, що ці речовини можуть також застосовуватись для ефективного лікування або попередження розладів центральної нервової системи, наприклад, вищезгаданих розладів, однак без обмеження ними. Згадані сполуки можуть застосовуватись для лікування ссавців і, зокрема, для лікування людей. Кількість груп -СН2 у сполуках, що застосовуються за цим винаходом, дорівнює 0 (1арилімідазолін-2-они) або 1 (1-аралкілімідазолін-2они). Прикладами сполук формули (І) є: 1-феніл-4-морфоліноімідазолін-2-он, 1-(4-метокси)-4-піперидиноімідазолін-2-он, 1-(4-хлорфеніл)-4-морфоліноімідазолін-2-он, 1-(4-хлорфеніл)-4-піперидиноімідазолін-2-он, 1-(4-хлорфеніл)-4-диметиламіноімідазолін-2он, 1-(4-бромфеніл)-4-морфоліноімідазолін-2-он, 1-(3-хлорфеніл)-4-морфоліноімідазолін-2-он, 1-(4-хлорфеніл)-4-гексаметиленімідазолін-2он, 1-(4-метилфеніл)-4-морфоліноімідазолін-2-он, 1-(4-хлорфеніл)-4(циклогексилметиламіно)імідазолін-2-он, 1-(4-фторфеніл)-4-морфоліноімідазолін-2-он, 1-бензил-4-морфоліноімідазолін-2-он. Речовини, що застосовуються за способом за цим винаходом, можна одержати способом, опис якого наведено у патенті США №5,869,481. Сполукою для застосування як лікарський засіб за цим винаходом, якій віддають особливу перевагу, є 1-(4-хлорфеніл)-4-піперидиноімідазолін2-он (ELB139; номенклатура IB: 1-(4-хлорфеніл)-4піперидин-1-іл-2,5-дигідро-1H-імідазолін-2-он). Введення щонайменше однієї сполуки формули (І) і, зокрема, 1-(4-хлорфеніл)-4піперидиноімідазолін-2-ону, може здійснюватись 87982 14 звичайним шляхом введення психоактивних лікарських засобів. Згадані сполуки, за варіантом, якому віддають перевагу, вводять у формі фармакологічної композиції у кількості 1-100мг на кг маси тіла хворого на добу. У разі вибору інгаляційного або інтраназального шляху введення, кількість для введення, якій віддають перевагу, становить 0,05-5мг на кг маси тіла хворого. Для застосування у рамках лікування шизофренії та інших психотичних розладів, більшу перевагу віддають введенню 2-70мг на кг маси тіла хворого, і особливу перевагу віддають введенню 5-50мг на кг маси тіла хворого, у той час як у рамках лікування дистонії більшу перевагу віддають введенню 1-20мг на кг маси тілахворого і особливу перевагу віддають введенню 5-15мг на кг маси тіла хворого. За варіантом, якому віддають перевагу, сполуки вводять пероральним шляхом або шляхом ін'єкції у формі відповідної парентеральної композиції, шляхом інгаляції, інтраназальним шляхом або у формі супозиторію. На додаток до цього, згадані сполуки, за варіантом, якому віддають перевагу, застосовують у комбінації зі звичайними фармацевтичними носіями, наповнювачами або допоміжними речовинами. Форми застосування у рамках цього винаходу не є критичними доти, доки гарантується достатня абсорбіція активного інгредієнта. На додаток до цього, згадані сполуки вводять як єдиний лікувальний засіб для описаних хвороб і стадій хвороб або у комбінації з іншими сполуками, придатними для лікування згаданих хвороб або стадій хвороб. Комбінація може являти собою одночасне введення із застосуванням окремих шляхів введення для кожного лікарського засобу або у формі встановленої комбінації у вигляді суміші зі звичайними фармацевтичними наповнювачами або допоміжними речовинами. Форми застосування комбінацій у рамках цього винаходу не є критичними доти, доки гарантується достатня абсорбція активного інгредієнта. Наведені нижче приклади застосування 1ар(алк)ілімідазолін-2-онів за цим винаходом ясно показують, що способи за цим винаходом є надзвичайно ефективними у разі лікування психотичних захворювань, практично без спостереження побічних ефектів. Сполуки, застосовані за цим винаходом, дуже добре переносяться і можуть легко вводитись до складу композицій для терапевтичного або профілактичного застосування. Додатковим об'єктом цього винаходу є, таким чином, фармацевтична композиція для лікування або профілактики розладів центральної нервової системи, що містить ефективну кількість щонайменше одного 1-ар(алк)ілімідазолін-2-ону формули (І) (I) 15 де X - водень, С1-4-алкіл, С1-4-алкоксильна група, трифторметил або галогеновий залишок, R1 і R2, незалежно один від одного, є С1-4-алкільним, С3-10-циклоалкільним або С3-10-гетероалкільним залишком, або R1 і R2 разом є С2-6-алкіленовим залишком, де група -СН2 факультативно заміщена киснем, азотом або сіркою, n - 0 або 1, m - 0 або ціле число від 1 до 5, у хворого, який цього потребує. За варіантом, якому віддають найбільшу перевагу, фармацевтична композиція містить 1-(4хлорфеніл)-4-піперидиноімідазолін-2-он (ELB139) як активний агент. Фармацевтична композиція за цим винаходом додатково може містити придатні наповнювачі, допоміжні речовини або заповнювачі та/або речовини, що є необхідними або корисними для одержання відповідної форми застосування. Фармацевтична композиція за цим винаходом містить активний(-і) інгредієнт(-и), за варіантом, якому віддають перевагу, у кількості 1-100мг/кг маси тіла хворого, і призначена для введення per os або парентеральним шляхом (наприклад, внутрішньовенно, внутрішньом'язово або підшкірно). За варіантом, якому віддають більшу перевагу, композиція містить активний інгредієнт у кількості 25-70мг на кг маси тіла або 5-15мг на кг маси тіла відповідно, у залежності від можливого застосування. За додатковим аспектом цього винаходу, ціль було досягнуто шляхом надання способу лікування або запобігання хвороб центральної нервової системи, у тому числі психотичних розладів, рухових розладів та/або психотичних симптомів, пов'язаних з іншими психічними розладами і, зокрема, лікування тривожних розладів. Згаданий спосіб включає введення ефективної кількості щонайменше однієї речовини, яка являє собою субтиповоселективний агоніст рецепторів бензодіазепінів, що містять субодиницю альфа 3, яка, однак, не є активною, тобто вона не виявляє значного позитивного ГАМК-підсилювального впливу на рецептори, що містять субодиницю альфа 2 та/або альфа 4 рецептора ГАМК, незалежно від того, зв'язується вона з цим рецептором або ні. Можна очікувати, що ліганди рецепторів бензодіазепінів, селективні щодо субадиниці альфа 3 згаданих рецепторів, можуть бути ефективними для лікування вищезгаданих захворювань центральної нервової системи. За цим винаходом, селективність визначається як щонайменше 20-кратна різниця у концентрації, необхідній для викликання 50% максимальної ГАМК-потенціювальної реакції, як показано у наведеному у цьому описі розділу прикладів і способів, тобто щонайменше 20-кратна різниця у ЕС50. Селективність може також визначатись як щонайменше 20-кратна різниця у зв'язувальній спорідненості (спорідненість, щонайменше у 20 разів вища спорідненості, визначеної за допомогою стандартних експериментальних методик визначення спорідненості), якщо спорідненість переводити у функціональний агоністичний вплив на відповідний субтип рецептора. Особливу перевагу віддають сполукам, що є субтипово-селективними відносно 87982 16 рецепторів, що несуть субодиницю альфа 3 рецептора ГАМК. Перевагу віддають також сполукам, селективним щодо субтипу альфа 3, які повністю позбавлені активності (які не виявляють значного позитивного ГАМК-посилювального ефекту) відносно рецепторів, що несуть субодиницю альфа 2 або альфа 4 рецептора ГАМК, незалежно від того, зв'язуються вони з цим рецептором або ні. Особливу перевагу віддають також таким сполукам, якщо вони демонструють вищезгадані особливості і, на додаток до цього, діють як часткові агоністи рецепторів ГАМК, що несуть субодиницю альфа 3 і, на додаток до цього, діють як агоністи з низькою спорідненістю або часткові агоністи (із щонайменше 20-кратною різницею спорідненості), знову ж таки, з відданням особливої переваги частковим агоністам із низькою спорідненістю до субодиниці альфа 1 та/або альфа 5. Сполуки 1ар(алк)ілімідазолін-2-ону Формули І, що визначені вище, є сполуками, що демонструють необхідну селективність. Прикладом сполуки, що задовольняє критеріям селективності, як визначено вище, якій віддають особливу перевагу, є 1-(4хлорфеніл)-4-піперидиноімідазолін-2-он (ELB139). Несподівано встановили, що сполука ELB139 та інші речовини, що входять до обсягу цього винаходу, діють як високорівневі субтиповоселективні агоністи рецептора бензодіазепінів на рецептори, що несуть субодиницю альфа 3. Природа впливу на ці рецептори є частково агоністичною, що вказує на те, що ці сполуки і, зокрема, сполука ELB139, діють як субтипово-селективні часткові агоністи рецепторів, що несуть субодиницю альфа 3. Згадані сполуки і, зокрема, сполука ELB139, були також активними по відношенню до рецепторів, що несуть субодиницю альфа 1 або альфа 5, однак із концентраціями, що більше ніж у 20 разів перевищували концентрацію для субодиниці альфа 3. На додаток до цього, несподівано встановили, що згадані сполуки зовсім не проявляли активності відносно рецепторів, що містили субодиниці альфа 2. Подібно іншим бензодіазепінам, сполука ELB139 також не проявляла активності відносно рецепторів, що несли субодиницю альфа 4. Таким чином, сполука ELB139 діє як субтипово-селективна сполука, що активує рецептори, що містять субодиницю альфа 3 і (з більш ніж у 20 разів слабкішою активністю) рецептори, що містять субодиниці альфа 1 і альфа 5, із виключенням рецепторів, що містять субодиниці альфа 2 і альфа 4. На усіх рецепторах, що демонструють чутливість до сполуки ELB139, ця сполука викликає менш сильне потенціювання ГАМКіндукованого імпульсу, порівняно з діазепамом, що свідчить про частково агоністичну властивість. У цьому відношенні, висновок про частково агоністичну активність робили у разі, якщо максимальна потенціація ГАМК-індукованого ефекту була нижчою при найбільшій випробуваній концентрації, порівняно з максимальним ефектом, індукованим діазепамом, як позитивною еталонною сполукою, при супрамаксимальній концентрації від 1мкМ до 10мкМ. Відносний частковий агонізм був у межах 50-70%. Унаслідок субтипової селективності згаданих сполук і, зокрема, з причини того, що сполу 17 ка ELB139 є селективною щодо субодиниці альфа 3, згадані сполуки можуть застосовуватись для визначення ролі субодиниць альфа З відносно фізіології і фармакології. Встановили, що сполука ELB139 викликає підвищення рівнів серотоніну у головному мозку пацюків, однак механізм цього ефекту спочатку залишився нез'ясованим. Для додаткового з'ясування цього ефекту перевірили, чи не був він пов'язаним із дією переносників серотоніну, тобто з механізмом лікарських засобів, що обмежують функціонування цього переносника і, таким чином, обумовлюють підвищення рівнів серотоніну (селективні інгібітори повторного поглинання серотоніну, SSRI) або із зараз відомою селективною взаємодією з рецептором бензодіазепінів, що містить субодиницю альфа 3. Сполуки за цим винаходом і, зокрема, сполука ELB139, не виявляли впливу на поглинання серотоніну синаптосомним препаратом. З іншого боку, вплив сполуки ELB139 на рівні позаклітинного серотоніну міг бути повністю блокованим і навіть зверненим шляхом введення специфічного блокатора рецептора бензодіазепінів, флумазенілу (flumazenil), який блокує взаємодію бензодіазепінів з усіма чутливими до бензодіазепінів рецепторами, у тому числі з рецептором, що містить субодиницю альфа 3. Унаслідок субтипової селективності, ці дані чітко, і несподівано, вказують на те, що вплив сполуки ELB139 на серотонінергічну систему опосередковується рецептором бензодіазепінів, що містять субодиницю альфа 3. Діазепам, за повідомленнями, не має впливу на рівні серотоніну у разі введення у подібних експериментах, що вказує на те, що цей вплив можуть виявляти лише субтиповоселективні сполуки. Таким чином, виходячи з цих даних, зараз дійшли висновку, що субодиниця альфа З є унікальною і новою мішенню для захворювань, що викликають ослаблене функціонування серотонінергічної системи, або для захворювань, у разі яких бажаним є посилене функціонування серотонінергічної системи, наприклад, при афективних розладах, у тому числі при депресивному і тривожному розладах. За другим варіантом підходу, перевірили, чи психофармакологічні поведінкові ефекти сполуки ELB139, що були нетиповими для бензодіазепінів, могли бути змінені на протилежні введенням флумазенілу. Антидепресивний ефект може легко пов'язуватись із підвищенням рівнів серотоніну у головному мозку. Усі лікарські засоби, що підвищують рівень серотоніну, виявляють антидепресивні ефекти, у тому числі лікарські засоби, подібні флуоксетину (SSRI). Оскільки підвищення рівня серотоніну може запобігатись введенням флумазенілу, антипсихотичний ефект вибрали як найпридатніший для оцінки ролі субодиниці альфа 3 у психофармакологічному профілі сполуки ELB139. Відомо, що бензодіазепіни, позбавлені селективності щодо субодиниці альфа 3, не виявляють антипсихотичних ефектів. У разі введення флумазенілу у комбінації зі сполукою ELB139, антипсихотичний ефект сполуки ELB139 неочікувано антагонізувався. Ці дані вказують на те, що субодиниця альфа 3 є ідеальною мішенню не тільки для захворювань, що залучають серотонінергі 87982 18 чну систему, як описувалось вище, але також і для інших захворювань центральної нервової системи, наприклад, психозу. На додаток до цього, ці дані вказують на те, що сполука ELB139 та інші речовини, що є селективними щодо рецепторів, що містять субодиницю альфа 3, є активними анксіолітиками, антидистонічними і антиконвульсивними засобами. Цей широкий спектр активності контрастує з субтиповою селективністю і обговорюваним зв'язком інших субодиниць, окрім субодиниці альфа 3, з різними захворюваннями. Наприклад, антиконвульсивна активність до цього часу співвідносилась, головним чином, із субодиницею альфа 1, однак сполука ELB139 діє як дуже активний анксіолітик, незважаючи на низьку спорідненість до субодиниці альфа 1. Подібним чином, субодиниця альфа 2 розглядалась як головна для анксіолітичних ефектів із лише додатковим внеском субодиниці альфа 3 для тривожних розладів. Однак сполука ELB139 зовсім позбавлена активності відносно субодиниць альфа 2, оскільки є селективною щодо субодиниці альфа 3. Ці дані додатково вказують на те, що субодиниця альфа 3 і рецептор бензодіазепінів на субодиницях альфа 3 є ідеальною мішенню для лікування цих захворювань, у тому числі тривоги і епілепсії. Таким чином, підбиваючи підсумок, набір даних, тобто ефекти in vivo на моделях психозу, депресії, дистонії, епілепсії і тривоги, а також вплив на рівні серотоніну, що свідчить про антидепресивну активність, у поєднанні з субтиповоселективною активністю, відкриває можливість очікування того, що усі ліганди рецепторів бензодіазепінів, що є селективними щодо субодиниці альфа 3 рецепторів бензодіазепінів, можуть бути активними при вищезгаданих захворюваннях центральної нервової системи. Таким чином, іншим об'єктом цього винаходу є фармацевтична композиція, що містить ліганд рецептора бензодіазепінів, селективний щодо субодиниці альфа 3 рецепторів бензодіазепінів. Такі речовини з високою селективністю щодо субодиниці альфа 3 можуть легко виявлятись за допомогою добре відомих і описаних систем скринінгу. Такі системи можуть включати аналізи зв'язування рецептора, як перший крок, однак із застосуванням аналізів зв'язування, які повинні ґрунтуватись на мембранних фракціях, що містять відповідні субодиниці рецептора ГАМК. Такі препарати можна одержати з клітинних ліній, що експресують і складають, після стабільної або тимчасової трансфекції, функціональний рецепторний комплекс ГАМК, що включає субодиниці альфа, що піддаються дослідженню, тобто альфа 1, альфа 2, альфа 3, альфа 4 або альфа 5, у комбінації з однією субодиницею бета (за варіантом, якому віддають перевагу, субодиницею бета 2 і однією субодиницею гамма, за варіантом, якому віддають перевагу, субодиницею гамма 2). Інше джерело субтипів рецепторів ГАМК можна одержати із систем експресії, що експресують рекомбінантні білки різних субодиниць. Такими системами експресії можуть бути бактерії, дріжджі або клітиниеукаріоти. Завдяки застосуванню таких аналізів зв'язування, можуть легко ідентифікуватись сполу 19 ки з високою спорідненістю до субодиниці альфа 3 і високою селективністю щодо інших рецепторів ГАМК, що містять субодиниці альфа 1, альфа 2, альфа 4 або альфа 5. Радіоактивним лігандом може бути 3(Н)-флунітразепам або інші добре описані радіоактивні ліганди, позбавлені селективності щодо індивідуальних субодиниць ГАМК. Оскільки ліганди рецептора бензодіазепінів можуть діяти як агоністи, нейтральні ліганди (антагоністи) і зворотні агоністи, для ідентифікації агоністів, а також часткових агоністів, необхідним є функціональний аналіз. Такими аналізами можуть бути модифіковані аналізи зв'язування із застосуванням зв'язування 3(Н)-мусцимолу, як контролю, оскільки агоністи, антагоністи і зворотні агоністи на характеристики зв'язування мусцимолу впливають по-різному. Основою різних функціональних аналізів, які можуть застосовуватись для ідентифікації притаманної активності лігандів рецепторів бензодіазепінів, є електрофізіологічні методи із застосуванням або ооцитів Xenopus як систем експресії, або трансфікованих клітинних ліній, наприклад, клітин СНО (яєчник китайського хом'ячка), трансфікованих відповідними субодиницями альфа, бета і гамма, як описано повсюди. І, знову ж таки, основою іншого функціонального аналізу можуть бути трансфіковані клітинні лінії, піддані дії ГАМК і сполуки, яку піддають випробуванню, однак із застосуванням мембранного потенціалу як контролю рецепторної взаємодії. Результатом такого постадійного варіанту відбору є сполука, що має високу селективність щодо субодиниці альфа 3, і яка може діяти як повний або частковий агоніст субодиниці альфа 3. Така сполука-ліганд рецептора може також діяти як частковий агоніст із щонайменше у 20 разів нижчою спорідненістю до рецептора ГАМК, що містить субодиниці альфа 1 і 5, порівняно з рецептором ГАМК, що містить субодиницю альфа 3. За варіантом, якому віддають перевагу, така фармацевтична композиція містить 1-ар(алк)ілімідазолін2-он Формули І, як визначено вище, що демонструє необхідну селективність. За варіантом, якому віддають перевагу, така фармацевтична композиція містить сполуку 1-(4-хлорфеніл)-4піперидиноімідазолін-2-он (ELB139). Окрім того, можливо і подеколи рекомендовано, щоб фармацевтична композиція містила додаткові наповнювачі або допоміжні речовини і згадана композиція могла бути придатною для парентерального або для перорального введення. Подібно описаному вище, встановили, що ефективною дозою активної сполуки є доза 1-100мг на кг маси тіла хворого. Додаткові дози, що містяться у фармацевтичній композиції, яким віддають перевагу, становлять 270мг на кг маси тіла або 5-50мг на кг маси тіла для лікування шизофренії та інших психотичних захворювань, і 1-20мг на кг або 5-15мг на кг маси тіла для лікування дистонії. Такі фармацевтичні композиції є придатними для лікування розладів центральної нервової системи і, за варіантом, якому віддають перевагу, для лікування психозу, депресії, дистонії, епілепсії і тривоги, як докладніше описано вище. 87982 20 Такі сполуки або композиції, що включають сполуку ELB139, виявляють також селективні позитивні впливи на розлади центральної нервової системи, які зараз не можуть лікуватись доступними лігандами рецепторів бензодіазепінів, тобто депресію, психоз, дистонію і споріднені захворювання ЦНС, з особливою увагою до захворювань, які можуть лікуватись сполуками, що виявляють вплив на рівні серотоніну у головному мозку, у тому числі депресії. Такі сполуки також виявляють позитивний ефект у разі захворювань, що зараз можуть лікуватись лігандами рецепторів бензодіазепінів, однак із кращим профілем побічних дій, зі зниженням амнезійного, седативного, снодійного, індукуючого звикання, міорелаксантного і ЦНСдепресійного ефекту лігандів рецепторів бензодіазепінів і послабленням розвитку толерантності. До таких захворювань належать тривожні розлади, епілепсія, розлади сну та інші захворювання, що реагують на лікування бензодіазепінами. Винахід додатково пояснюється наведеними нижче прикладами і фігурами. На фігурах зображено: Фіг.1: активність, загальна подолана відстань, стереотипне обнюхування, інші стереотипії і атаксія, стимульовані 0,2мг/кг сполуки МK-801, яка була введена внутрішньоочеревинно пацюкамсамицям за 10хв. до проведення тесту. Галоперидол (внутрішньоочеревинно) і сполука Е131-00139 (перорально) були введені за 1год. до проведення тесту. *статистична значущість порівняно з контролем, р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of treating or preventing central nervous system disorders with compounds having selectivity for the alpha 3 subunit of the benzodiazepine receptor
Автори англійськоюLangen Barbara, Rundfeldt Chris, Dost Rita, Lueddens Hartmund, Rabe Holger
Назва патенту російськоюСпособ лечения или предотвращения расстройств центральной нервной системы производными 1-ар(алк)-4-пиперидиноимидазолин-2-она, фармацевтическая композиция
Автори російськоюЛянген Барбара, Рунфельдт Крис, Дост Рита, Людденс Хартмут, Рабе Хольгер
МПК / Мітки
МПК: A61P 25/18, A61K 31/4166, A61P 25/22, A61P 25/24, A61K 31/5377, A61K 31/454
Мітки: центральної, спосіб, системі, розладів, похідними, композиція, запобігання, нервової, 1-ар(алк)-4-піперидиноімідазолін-2-ону, лікування, фармацевтична
Код посилання
<a href="https://ua.patents.su/30-87982-sposib-likuvannya-abo-zapobigannya-rozladiv-centralno-nervovo-sistemi-pokhidnimi-1-aralk-4-piperidinoimidazolin-2-onu-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування або запобігання розладів центральної нервової системи похідними 1-ар(алк)-4-піперидиноімідазолін-2-ону, фармацевтична композиція</a>
Попередній патент: Комбіноване застосування ектеїнасцидину-743 і протипухлинних сполук, що містять платину
Наступний патент: Похідні блокатора рецептора ангіотензину ii
Випадковий патент: Спосіб профілактики первинної плацентарної недостатності












