Виділений поліпептид, що зв’язується з il-18 (il-18bp) (варіанти), виділена молекула нуклеїнової кислоти, що його кодує (варіанти), антитіло, що зв’язується з даним поліпептидом, спосіб очищення il-18bp та комп
Номер патенту: 75862
Опубліковано: 15.06.2006
Автори: Рубінштейн Менахем, Новік Даніела, Дінарелло Чарльз, Кім Соо Хіун
Формула / Реферат
1. Виділений поліпептид, що включає амінокислотну послідовність, вибрану з групи, що складається з
(a) амінокислотної послідовності, вибраної з групи, що складається з АА1-АА192 SEQ ID NO: 2, АА29-АА192 SEQ ID NO: 2, AA1-AA197 SEQ ID NO: 6 і AA29-AA197 SEQ ID NO: 6,
(b) мутеїну будь-якої послідовності, вказаної в підпункті (а), де ідентичність амінокислотної послідовності вказаного мутеїну і принаймні однієї послідовності, вказаної в підпункті (а), складає щонайменше 70%;
де поліпептид, охарактеризований у підпункті (а) або (b), зв'язується з IL-18.
2. Поліпептид за п. 1, де будь-які зміни амінокислотної послідовності мутеїну, охарактеризованого в підпункті (b), являють собою заміни консервативних амінокислот в амінокислотних послідовностях, охарактеризованих у підпункті (а).
3. Поліпептид за п. 1, де амінокислотна послідовність містить АА1-АА192 SEQ ID NO: 2 або АА29-АА192 SEQ ID NO: 2.
4. Поліпептид за п. 1, де поліпептид глікозильований в одному або декількох положеннях.
5. Поліпептид за п. 1, де поліпептид неглікозильований.
6. Поліпептид за п. 1, де поліпептид додатково містить принаймні один радикал, приєднаний до однієї або декількох функціональних груп, що є одним або декількома бічними ланцюгами амінокислотних залишків N- або С-кінцевих груп.
7. Поліпептид за п. 1, де поліпептид зазнав циклічної перестановки.
8. Поліпептид за п. 1, де поліпептид являє собою невірусний білок.
9. Поліпептид за п. 1, де поліпептид являє собою людський білок.
10. Поліпептид за п. 1, де поліпептид являє собою злитий білок.
11. Поліпептид за п. 10, де поліпептид злитий з Ig.
12. Поліпептид за п. 1 або 11, де поліпептид є розчинним.
13. Поліпептид за п. 1, де поліпептид є пегільованим.
14. Поліпептид за п. 6, де вказаний принаймні один радикал являє собою поліетиленгліколевий радикал.
15. Виділений поліпептид, що містить у собі амінокислотну послідовність АА1-192 SEQ ID N0: 2 або АА29-АА192 SEQ ID NO: 2 або їхні варіанти, що містять консервативні амінокислотні заміни, і зв'язується з IL-18.
16. Виділений поліпептид, що містить у собі амінокислотну послідовність АА1-197 SEQ ID N0: 6 або АА29-АА197 SEQ ID NO: 6 або їхні варіанти, що містять консервативні амінокислотні заміни, і зв'язується з IL-8.
17. Виділений поліпептид, що включає амінокислотну послідовність АА29-40 SEQ ID NO: 10 або АА1-АА40 SEQ ID NO: 10, де поліпептид зв'язується з IL-18 і модулює або блокує біологічну активність IL-18.
18. Поліпептид за п. 17, де поліпептид містить Ig-домен.
19. Очищений IL-18-зв'язуючий білок (IL-18BP), де білок характеризується наступним:
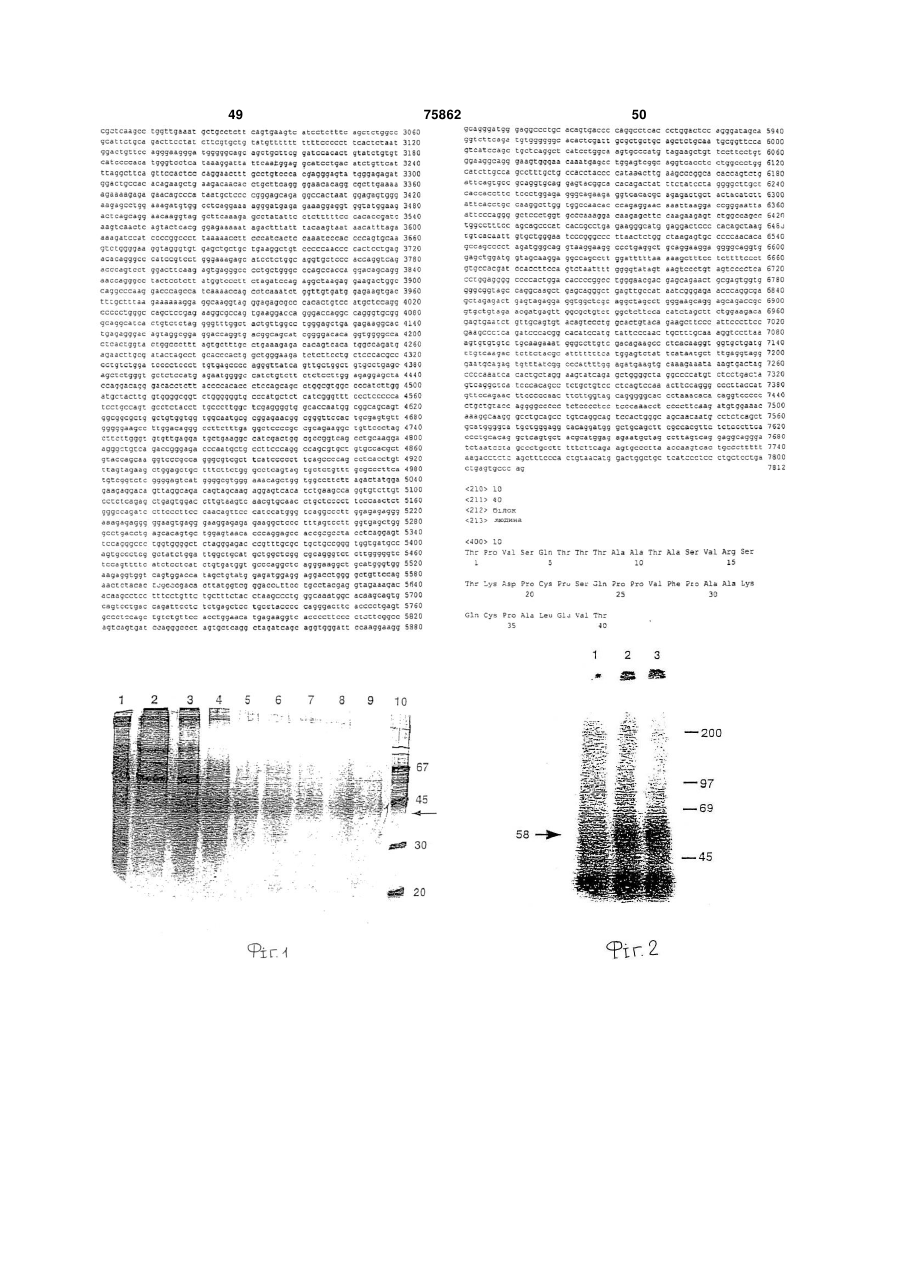
(a) молекулярна маса білка складає приблизно 40 кДа за даними SDS-PAGE у вихідній глікозильованій формі;
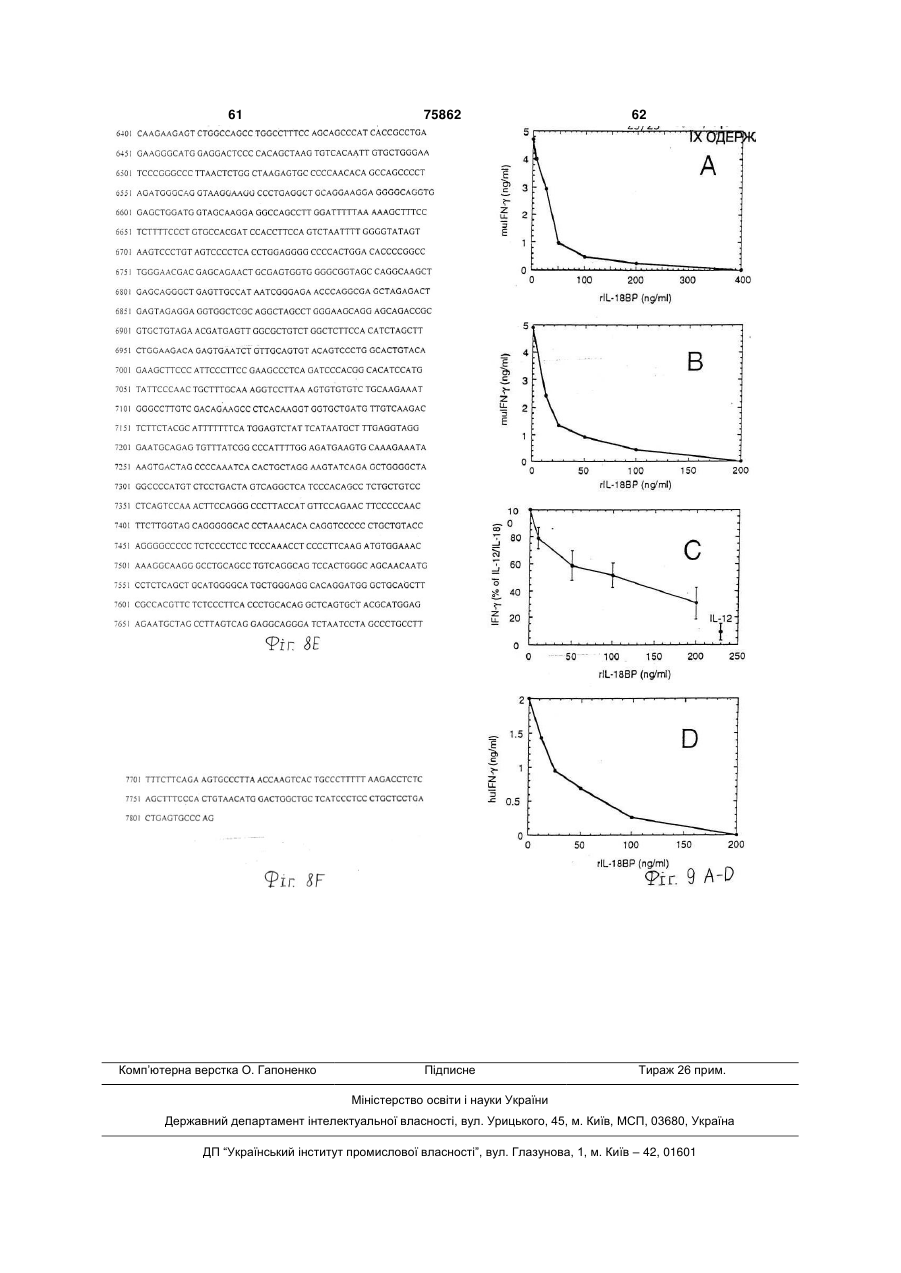
(b) білок зв'язується з IL-18 і модулює або блокує активність IL-18; і
(c) білок містить N-кінцеву послідовність, що включає амінокислотну послідовність АА29-40 SEQ ID NO: 10 або АА1-АА40 SEQ ID NO: 10 або їхні варіанти, що містять консервативні амінокислотні заміни.
20. Активний фрагмент білка IL-18BP за п. 1 або 19, де активний фрагмент зв'язується з IL-18 і модулює або блокує активність IL-18.
21. Виділений поліпептид IL-18BP, що має N-кінцеву послідовність, що включає амінокислотну послідовність АА29-40 SEQ ID NO: 10 або АА1-АА40 SEQ ID NO: 10 або їхні варіанти, що містять консервативні амінокислотні заміни, і Ig-домен, де поліпептид зв'язується з IL-18 і модулює або блокує активність IL-18.
22. Суміш будь-яких поліпептидів, охарактеризованих у пп. 1, 15-17, 19 і 20.
23. Виділена молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує поліпептид, що містить амінокислотну послідовність, вибрану з групи, що складається з амінокислотної послідовності, вибраної з групи, що складається з АА1-АА192 SEQ ID NO: 2, АА29-АА192 SEQ ID NO: 2 і АА29-АА197 SEQ ID NO: 6.
24. Виділена молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, вибрану з групи, що складається з
(а) нуклеотидної послідовності SEQ ID NO: 1, що кодує АА1-АА192 SEQ ID NO: 2 або АА29-АА192 SEQ ID NO: 2;
(b) нуклеотидної послідовності SEQ ID NO: 5, що кодує АА1-АА197 SEQ ID NO: 6 або АА29-АА197 SEQ ID NO: 6;
(с) нуклеотидної послідовності, комплемент якої зв'язується в умовах високої жорсткості з будь-якою з нуклеотидних послідовностей, охарактеризованих у підпунктах (а) або (b), і яка кодує амінокислотну послідовність, вибрану з групи, що складається з АА1-АА192 SEQ ID NO: 2, АА29-АА192 SEQ ID NO: 2, АА1-АА197 SEQ ID NO: 6 і АА29-АА197 SEQ ID NO:6.
25. Виділена молекула нуклеїнової кислоти, що містить нуклеотидну послідовність SEQ ID NO: 9 або нуклеотидну послідовність, комплемент якої зв'язується з нею в умовах високої жорсткості.
26. Виділена молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, вибрану з групи, що складається з SEQ ID NO: 1 і 3, або область SEQ ID NO: 1 або 3, що кодує зрілий білок.
27. Спосіб визначення, виділення або ампліфікації нуклеотидної послідовності, що кодує IL-18BP, що включає застосування нуклеїнових кислот, охарактеризованих у будь-якому з пп. 23-26, як праймера або зонда.
28. Вектор, що містить молекулу нуклеїнової кислоти, охарактеризованої у будь-якому з пп. 23-26.
29. Вектор за п. 28, що додатково містить промотор, оперативно зв'язаний із вказаною молекулою нуклеїнової кислоти.
30. Клітина, генетично модифікована для продукування поліпептиду, охарактеризованого в будь-якому із пп. 1-21.
31. Клітина за п. 30, де клітина генетично модифікована вектором, охарактеризованим у п. 28.
32. Клітина за п. 30, де клітина є еукаріотичною.
33. Клітина за п. 30, де клітина є прокаріотичною.
34. Клітина за п. 32, де клітина є клітиною ссавця.
35. Спосіб одержання поліпептиду, охарактеризованого в будь-якому із пп. 1-21, що включає культивування клітини, охарактеризованої в будь-якому із пп. 30-34, в умовах, що забезпечують експресію вказаного поліпептиду.
36. Антитіло, що імуноспецифічно зв'язується з поліпептидом, охарактеризованим у будь-якому із пп. 1-21.
37. Антитіло за п. 36, де антитіло являє собою моноклональне антитіло.
38. Антитіло за п. 37, де антитіло являє собою гуманізоване антитіло.
39. Спосіб визначення IL-18BP у зразку, що передбачає взаємодію вказаного зразка з антитілом, охарактеризованим у п. 36, і подальше визначення наявності зв'язаного антитіла.
40. Спосіб очищення поліпептиду IL-18BP, що передбачає взаємодію зразка IL-18BP з антитілом проти IL-18BP, охарактеризованим у п. 36, видалення білка, що не зв'язався, зі зразка з наступною елюцією IL-18BP, що зв'язався.
41. Спосіб виділення або очищення IL-18BP, охарактеризованого в будь-якому із пп. 1-21, що включає
(a) пропускання зразка через хроматографічну колонку, з якою зв'язується IL-18;
(b) промивання колонки для видалення білка, що не зв'язався, зі зразка, і
(c) елюцію IL-18BP, який зв'язався.
42. Спосіб виділення або очищення IL-18BP, охарактеризованого в будь-якому із пп. 1-21, що включає взаємодію зразка із субстратом, з яким зв'язаний IL-18, видалення білка, що не зв'язався, зі зразка з наступною елюцією IL-18BP, який зв'язався.
43. Спосіб одержання похідного IL-18BP, що включає одержання ДНК-конструкта, що кодує поліпептид, охарактеризований у будь-якому із пп. 1, 15-17 і 19-21, лігованого з нуклеїновою кислотою, що кодує другий поліпептид, де при експресії вказаний ДНК-конструкт кодує злитий білок, що містить поліпептид, охарактеризований у будь-якому із пп. 1, 15-17 і 19-21, злитий із другим поліпептидом.
44. Спосіб за п. 43, де вказаним другим поліпептидом є Ig.
45. Спосіб одержання похідного IL-18BP, що включає хімічну модифікацію поліпептиду, охарактеризованого в будь-якому із пп. 1 і 15-17, із включенням принаймні одного модифікуючого радикала.
46. Спосіб за п. 45, де модифікуючий радикал являє собою поліетиленгліколевий радикал.
47. Композиція, що містить поліпептид, охарактеризований в будь-якому із пп. 1-21, або суміш поліпептидів за п. 22 і фармацевтично прийнятний носій.
48. Композиція, що містить нуклеїнову кислоту, охарактеризовану в будь-якому із пп. 23-26, і фармацевтично прийнятний носій.
49. Композиція, що містить антитіло, охарактеризоване в будь-якому із пп. 36-38, і фармацевтично прийнятний носій.
50. Набір, що містить в одній або декількох пляшечках фармацевтичну композицію, охарактеризовану в п. 47.
51. Набір, що містить в одній або декількох пляшечках фармацевтичну композицію, охарактеризовану в п. 48.
52. Набір, що містить в одній або декількох пляшечках фармацевтичну композицію, охарактеризовану в п. 49.
53. Виділена молекула нуклеїнової кислоти, що включає нуклеотидну послідовність, яка кодує поліпептид, що містить амінокислотну послідовність, вибрану з групи, що складається з
(a) амінокислотної послідовності, вибраної з групи, що складається з АА1-АА192 SEQ ID NO: 2, АА29-АА192 SEQ ID NO: 2, AA1-AA197 SEQ ID NO: 6, AA29-AA197 SEQ ID NO: 6;
(b) мутеїну будь-якої послідовності, вказаної в підпункті (а), де амінокислотна послідовність вказаного мутеїну має принаймні 70%-у ідентичністю принаймні з одною послідовністю, вказаною в підпункті (а);
де вказана молекула нуклеїнової кислоти кодує поліпептид, що зв'язується з IL-18.
54. Виділена молекула нуклеїнової кислоти, що включає нуклеотидну послідовність, вибрану з групи, що складається з
(a) нуклеотидної послідовності SEQ ID NO: 1, що кодує АА1-АА192 SEQ ID NO: 2 або АА29-АА192 SEQ ID NO: 2;
(b) нуклеотидної послідовності SEQ ID NO: 5, що кодує AA1-AA197 SEQ ID NO: 6 або AA29-AA197 SEQ ID NO: 6;
(c) нуклеотидної послідовності, комплемент якої зв'язується в умовах високої жорсткості з кожною з нуклеотидних послідовностей, охарактеризованих у підпунктах (а)-(b);
де вказана нуклеїнова кислота кодує поліпептид, що зв'язується з IL-18.
55. Рекомбінантна молекула ДНК, що включає молекулу нуклеїнової кислоти, охарактеризовану в п. 53 або 54, ліговану з другою нуклеїновою кислотою, що кодує другий поліпептид, де при експресії вказана рекомбінантна молекула ДНК кодує злитий білок, що містить поліпептид, охарактеризований у будь-якому з пп. 1, 15-17 і 19-21, злитий з другим поліпептидом.
Текст
1. Виділений поліпептид, що включає амінокислотну послідовність, вибрану з групи, що складається з (a) амінокислотної послідовності, вибраної з групи, що складається з АА1-АА192 SEQ ID NO: 2, АА29АА192 SEQ ID NO: 2, AA1-AA197 SEQ ID NO: 6 і AA29-AA197 SEQ ID NO: 6, (b) мутеїну будь-якої послідовності, вказаної в підпункті (а), де ідентичність амінокислотної послідовності вказаного мутеїну і принаймні однієї послідовності, вказаної в підпункті (а), складає щонайменше 70%; де поліпептид, охарактеризований у підпункті (а) або (b), зв'язується з IL-18. 2. Поліпептид за п. 1, де будь-які зміни амінокислотної послідовності мутеїну, охарактеризованого в підпункті (b), являють собою заміни консервативних амінокислот в амінокислотних послідовностях, охарактеризованих у підпункті (а). UA (21) 2000031437 (22) 13.08.1998 (24) 15.06.2006 (86) PCT/IL98/00379, 13.08.1998 (31) 121554 (32) 14.08.1997 (33) IL (31) 121639 (32) 27.08.1997 (33) IL (31) 121860 (32) 29.09.1997 (33) IL (31) 122134 (32) 06.11.1997 (33) IL (31) 125463 (32) 22.07.1998 (33) IL (46) 15.06.2006, Бюл. № 6, 2006 р. (72) Новік Даніела , IL, Дінарелло Чарльз , US, Рубінштейн Менахем , IL, Кім Соо Хіун, KR (73) ЙЄДА РІСЕРЧ ЕНД ДІВЕЛОПМЕНТ КО. ЛТД, IL (56) EMBL Database entry 0 00923, accession number 0 00923, Merozite Surface Protein 1 (fragment), 01.07.97, XP002087999. EMBL Database entry 0 00919, accession number 0 00919, Merozite Surface Protein 1 (fragment), 01.07.97, XP002088000. EMBL Database entry HSZZ16951, accession number AA311795, Adams M.D. et al., EST182531 Jurkat T-cells VI Homo sapiens cDNA 5' end similar tp Hypothetical protein C9, 18.04.97, XP002088001. EMBL Database entry HSA10059, accession number AA010059, Hillier L. et al., ze16a02. s1 Soares fetal heart NbHH19W Homo sapiens cDNA clone, 02.08.96, XP002088002. EMBL Database entry HZZ03012, accession number g1950205, Adams M.D. et al., EST182531 Jurkat T 2 (19) 1 3 75862 4 3. Поліпептид за п. 1, де амінокислотна послідовполіпептид зв'язується з IL-18 і модулює або блоність містить АА1-АА192 SEQ ID NO: 2 або АА29кує активність IL-18. АА192 SEQ ID NO: 2. 22. Суміш будь-яких поліпептидів, охарактеризо4. Поліпептид за п. 1, де поліпептид глікозильоваваних у пп. 1, 15-17, 19 і 20. ний в одному або декількох положеннях. 23. Виділена молекула нуклеїнової кислоти, що 5. Поліпептид за п. 1, де поліпептид неглікозильомістить нуклеотидну послідовність, яка кодує поліваний. пептид, що містить амінокислотну послідовність, 6. Поліпептид за п. 1, де поліпептид додатково вибрану з групи, що складається з амінокислотної містить принаймні один радикал, приєднаний до послідовності, вибраної з групи, що складається з однієї або декількох функціональних груп, що є АА1-АА192 SEQ ID NO: 2, АА29-АА192 SEQ ID NO: одним або декількома бічними ланцюгами аміно2 і АА29-АА197 SEQ ID NO: 6. кислотних залишків N- або С-кінцевих груп. 24. Виділена молекула нуклеїнової кислоти, що 7. Поліпептид за п. 1, де поліпептид зазнав циклічмістить нуклеотидну послідовність, вибрану з груної перестановки. пи, що складається з 8. Поліпептид за п. 1, де поліпептид являє собою (а) нуклеотидної послідовності SEQ ID NO: 1, що невірусний білок. кодує АА1-АА192 SEQ ID NO: 2 або АА29-АА192 9. Поліпептид за п. 1, де поліпептид являє собою SEQ ID NO: 2; людський білок. (b) нуклеотидної послідовності SEQ ID NO: 5, що 10. Поліпептид за п. 1, де поліпептид являє собою кодує АА1-АА197 SEQ ID NO: 6 або АА29-АА197 злитий білок. SEQ ID NO: 6; 11. Поліпептид за п. 10, де поліпептид злитий з Ig. (с) нуклеотидної послідовності, комплемент якої 12. Поліпептид за п. 1 або 11, де поліпептид є роззв'язується в умовах високої жорсткості з будьчинним. якою з нуклеотидних послідовностей, охарактери13. Поліпептид за п. 1, де поліпептид є пегільовазованих у підпунктах (а) або (b), і яка кодує аміноним. кислотну послідовність, вибрану з групи, що скла14. Поліпептид за п. 6, де вказаний принаймні дається з АА1-АА192 SEQ ID NO: 2, АА29-АА192 один радикал являє собою поліетиленгліколевий SEQ ID NO: 2, АА1-АА197 SEQ ID NO: 6 і АА29радикал. АА197 SEQ ID NO:6. 15. Виділений поліпептид, що містить у собі аміно25. Виділена молекула нуклеїнової кислоти, що кислотну послідовність АА1-192 SEQ ID N0: 2 або містить нуклеотидну послідовність SEQ ID NO: 9 АА29-АА192 SEQ ID NO: 2 або їхні варіанти, що або нуклеотидну послідовність, комплемент якої містять консервативні амінокислотні заміни, і зв'язв'язується з нею в умовах високої жорсткості. зується з IL-18. 26. Виділена молекула нуклеїнової кислоти, що 16. Виділений поліпептид, що містить у собі аміномістить нуклеотидну послідовність, вибрану з грукислотну послідовність АА1-197 SEQ ID N0: 6 або пи, що складається з SEQ ID NO: 1 і 3, або обАА29-АА197 SEQ ID NO: 6 або їхні варіанти, що ласть SEQ ID NO: 1 або 3, що кодує зрілий білок. містять консервативні амінокислотні заміни, і зв'я27. Спосіб визначення, виділення або ампліфікації зується з IL-8. нуклеотидної послідовності, що кодує IL-18BP, що 17. Виділений поліпептид, що включає амінокисвключає застосування нуклеїнових кислот, охараклотну послідовність АА29-40 SEQ ID NO: 10 або теризованих у будь-якому з пп. 23-26, як праймера АА1-АА40 SEQ ID NO: 10, де поліпептид зв'язуєтьабо зонда. ся з IL-18 і модулює або блокує біологічну актив28. Вектор, що містить молекулу нуклеїнової кисність IL-18. лоти, охарактеризованої у будь-якому з пп. 23-26. 18. Поліпептид за п. 17, де поліпептид містить Ig29. Вектор за п. 28, що додатково містить промодомен. тор, оперативно зв'язаний із вказаною молекулою 19. Очищений IL-18-зв'язуючий білок (IL-18BP), де нуклеїнової кислоти. білок характеризується наступним: 30. Клітина, генетично модифікована для продуку(a) молекулярна маса білка складає приблизно 40 вання поліпептиду, охарактеризованого в будькДа за даними SDS-PAGE у вихідній глікозильоваякому із пп. 1-21. ній формі; 31. Клітина за п. 30, де клітина генетично модифі(b) білок зв'язується з IL-18 і модулює або блокує кована вектором, охарактеризованим у п. 28. активність IL-18; і 32. Клітина за п. 30, де клітина є еукаріотичною. (c) білок містить N-кінцеву послідовність, що вклю33. Клітина за п. 30, де клітина є прокаріотичною. чає амінокислотну послідовність АА29-40 SEQ ID 34. Клітина за п. 32, де клітина є клітиною ссавця. NO: 10 або АА1-АА40 SEQ ID NO: 10 або їхні варі35. Спосіб одержання поліпептиду, охарактеризоанти, що містять консервативні амінокислотні заваного в будь-якому із пп. 1-21, що включає кульміни. тивування клітини, охарактеризованої в будь20. Активний фрагмент білка IL-18BP за п. 1 або якому із пп. 30-34, в умовах, що забезпечують екс19, де активний фрагмент зв'язується з IL-18 і мопресію вказаного поліпептиду. дулює або блокує активність IL-18. 36. Антитіло, що імуноспецифічно зв'язується з 21. Виділений поліпептид IL-18BP, що має Nполіпептидом, охарактеризованим у будь-якому із кінцеву послідовність, що включає амінокислотну пп. 1-21. послідовність АА29-40 SEQ ID NO: 10 або АА137. Антитіло за п. 36, де антитіло являє собою моАА40 SEQ ID NO: 10 або їхні варіанти, що містять ноклональне антитіло. консервативні амінокислотні заміни, і Ig-домен, де 38. Антитіло за п. 37, де антитіло являє собою гуманізоване антитіло. 5 75862 6 39. Спосіб визначення IL-18BP у зразку, що перед50. Набір, що містить в одній або декількох плябачає взаємодію вказаного зразка з антитілом, шечках фармацевтичну композицію, охарактериохарактеризованим у п. 36, і подальше визначення зовану в п. 47. наявності зв'язаного антитіла. 51. Набір, що містить в одній або декількох пля40. Спосіб очищення поліпептиду IL-18BP, що пешечках фармацевтичну композицію, охарактериредбачає взаємодію зразка IL-18BP з антитілом зовану в п. 48. проти IL-18BP, охарактеризованим у п. 36, вида52. Набір, що містить в одній або декількох плялення білка, що не зв'язався, зі зразка з наступною шечках фармацевтичну композицію, охарактериелюцією IL-18BP, що зв'язався. зовану в п. 49. 41. Спосіб виділення або очищення IL-18BP, оха53. Виділена молекула нуклеїнової кислоти, що рактеризованого в будь-якому із пп. 1-21, що включає нуклеотидну послідовність, яка кодує повключає ліпептид, що містить амінокислотну послідовність, (a) пропускання зразка через хроматографічну вибрану з групи, що складається з колонку, з якою зв'язується IL-18; (a) амінокислотної послідовності, вибраної з групи, (b) промивання колонки для видалення білка, що що складається з АА1-АА192 SEQ ID NO: 2, АА29не зв'язався, зі зразка, і АА192 SEQ ID NO: 2, AA1-AA197 SEQ ID NO: 6, (c) елюцію IL-18BP, який зв'язався. AA29-AA197 SEQ ID NO: 6; 42. Спосіб виділення або очищення IL-18BP, оха(b) мутеїну будь-якої послідовності, вказаної в підрактеризованого в будь-якому із пп. 1-21, що пункті (а), де амінокислотна послідовність вказановключає взаємодію зразка із субстратом, з яким го мутеїну має принаймні 70%-у ідентичністю призв'язаний IL-18, видалення білка, що не зв'язався, наймні з одною послідовністю, вказаною в зі зразка з наступною елюцією IL-18BP, який зв'япідпункті (а); зався. де вказана молекула нуклеїнової кислоти кодує 43. Спосіб одержання похідного IL-18BP, що вклюполіпептид, що зв'язується з IL-18. чає одержання ДНК-конструкта, що кодує поліпеп54. Виділена молекула нуклеїнової кислоти, що тид, охарактеризований у будь-якому із пп. 1, 15включає нуклеотидну послідовність, вибрану з 17 і 19-21, лігованого з нуклеїновою кислотою, що групи, що складається з кодує другий поліпептид, де при експресії вказа(a) нуклеотидної послідовності SEQ ID NO: 1, що ний ДНК-конструкт кодує злитий білок, що містить кодує АА1-АА192 SEQ ID NO: 2 або АА29-АА192 поліпептид, охарактеризований у будь-якому із пп. SEQ ID NO: 2; 1, 15-17 і 19-21, злитий із другим поліпептидом. (b) нуклеотидної послідовності SEQ ID NO: 5, що 44. Спосіб за п. 43, де вказаним другим поліпептикодує AA1-AA197 SEQ ID NO: 6 або AA29-AA197 дом є Ig. SEQ ID NO: 6; 45. Спосіб одержання похідного IL-18BP, що вклю(c) нуклеотидної послідовності, комплемент якої чає хімічну модифікацію поліпептиду, охарактеризв'язується в умовах високої жорсткості з кожною з зованого в будь-якому із пп. 1 і 15-17, із включеннуклеотидних послідовностей, охарактеризованих ням принаймні одного модифікуючого радикала. у підпунктах (а)-(b); 46. Спосіб за п. 45, де модифікуючий радикал явде вказана нуклеїнова кислота кодує поліпептид, ляє собою поліетиленгліколевий радикал. що зв'язується з IL-18. 47. Композиція, що містить поліпептид, охаракте55. Рекомбінантна молекула ДНК, що включає ризований в будь-якому із пп. 1-21, або суміш помолекулу нуклеїнової кислоти, охарактеризовану в ліпептидів за п. 22 і фармацевтично прийнятний п. 53 або 54, ліговану з другою нуклеїновою кислоносій. тою, що кодує другий поліпептид, де при експресії 48. Композиція, що містить нуклеїнову кислоту, вказана рекомбінантна молекула ДНК кодує злиохарактеризовану в будь-якому із пп. 23-26, і фартий білок, що містить поліпептид, охарактеризовамацевтично прийнятний носій. ний у будь-якому з пп. 1, 15-17 і 19-21, злитий з 49. Композиція, що містить антитіло, охарактеридругим поліпептидом. зоване в будь-якому із пп. 36-38, і фармацевтично прийнятний носій. Даний винахід стосується інтерлейкін-18зв'язувального білка (IL-18), надалі IL-18BP, що здатний зв'язувати IL-18. Зокрема, цей винахід стосується розчинного IL-18BP, одержуваного з біологічних рідин, розчинних IL-BP, які одержують в результаті експресії відповідних ДНК-векторів в клітинах-хазяїнах, кодованих вірусом гомологів IL18BP, що їх одержують шляхом експресії відповідних ДНК-векторів в клітинах-хазяїнах, векторів, які експресують різні IL-BP, векторів, що є застосовними для експресії IL-18BP у людей та інших ссавців, антитіл проти IL-18BP, терапевтичного засто сування зазначених IL-18BP шляхом модулювання і/або блокування активності IL-18, терапевтичного застосування зазначених експресуючих векторів для модулювання і/або блокування активності IL18 та застосування антитіл. В 1989 році було описано індуковану ендотоксином сироваткову активну речовину, що стимулює вироблення інтерферону-гамма (IFN- ), виділену з клітин селезінки миші (27). Ця сироваткова активна речовина діє не як безпосередній індуктор IFN- , а скоріше як ко-стимулятор разом з IL-2 або мітогенами. Спроба виділити активну речовину з 7 75862 8 сироватки мишей, попередньо оброблених ендостимулятор для FAS-ліганд-опосередкованої цитотоксином, дозволила виявити, по-видимому, гомотоксичності клонів натуральних-кілерів миші (37). генний білок масою 50-55кДа (26). Оскільки інші В результаті клонування IL-18 з пошкоджених цитокіни здатні діяти як ко-стимулятори продукції тканин і вивчення експресії гена IL-18, виявлено тісний зв'язок цього цитокіну з аутоімунним захвоIFN- , неможливість нейтралізації сироваткової рюванням. У неогрядних діабетичних (NOD) миактивної речовини нейтралізуючими антитілами шей спонтанно розвивається аутоімунний інсуліт і проти IL-1, IL-4, IL-5, IL-6 або TNF дозволяє припуцукровий діабет, які посилюють і синхронізують стити, що вона є відмінним фактором. У 1995р. ті однократною ін'єкцією циклофосфаміду. За допож самі дослідники показали, що індукований ендомогою полімеразної ланцюгової реакції (PCR) із токсином ко-стимулятор продукції IFN- наявний в зворотною транскриптазою виявляють мРНК IL-18 екстрактах печінки мишей, попередньо оброблев підшлунковій залозі мишей-NOD на ранніх стадіних P. acnes (31). В цій моделі, популяція макроях інсуліту. Після обробки циклофосфамідом швифагів печінки (клітини Купфера) збільшується, і дко збільшується вміст мРНК IL-18 і це передує для цих мишей стає летальною низька доза бакзростанню мРНК IFN-γ і далі розвитку цукрового теріального ліпополісахариду (LPS), яка не є ледіабету. Цікаво, що ці кінетичні параметри подібні тальною для необроблених мишей. Фактор, надо кінетики мРНК IL-12-p40, що веде в результаті званий IFN- -індукуючим фактором (IGIF), пізніше до тісної кореляції з вмістом окремих мРНК. Клопозначений як інтерлейкін-18 (IL-18), виділили в нування кДНК IL-18 з РНК підшлункової залози з гомогенному стані з 1200 грам печінки мишей, обподальшим секвенуванням дозволило виявити роблених P. acnes. Вироджені олігонуклеотиди, ідентичність з послідовністю IL-18, клонованою з одержані з амінокислотних послідовностей очищекупферових клітин і in vivo з попередньо активованого IL-18, застосовували для клонування кДНК ILних макрофагів. Макрофаги мишей-NOD відпові18 миші (31). IL-18 являє собою білок масою 18дають на циклофосфамід експресією гена IL-18, 19кДа з 157 амінокислот, що не має жодної явної тоді як макрофаги паралельно оброблених мишей гомології з будь-яким пептидом з баз даних. МесеBalb/c не реагують. Тому, експресія IL-18 регулюнджерні РНК IL-18 та інтерлейкіну-12 (IL-12) легко ється аномально у аутоімунних мишей-NOD та виявити в клітинах Купфера і активованих макротісно асоційована з розвитком цукрового діабету фагах. Рекомбінантний IL-18 стимулює вироблен(32). ня IFN- більш потужно, ніж IL-12, по-видимому, за IL-18 відіграє істотну роль в імунорегуляції або допомогою окремого механізму (31). Подібно індузапаленні шляхом збільшення функціональної кованій ендотоксином сироватковій активній речоактивності Fas-ліганду на Th-1 клітинах (10). IL-18 вині сироватки, IL-18 сам по собі не індукує IFN- , а також експресується в корі надниркової залози і діє, головним чином, як ко-стимулятор з мітогенатому є секретованим нейроімуномодулятором, що ми або IL-2. IL-18 посилює проліферацію Т-клітин, відіграє важливу роль в настройці імунної системи по-видимому, за допомогою IL-2-залежного мехапісля впливу стресу (9). нізму, і збільшує in vitro продукцію цитокінів-Th-1 In vivo, IL-18 утворюється в результаті розщета у випадку сумісної дії з IL-12 виявляє синергізм, плення рго-IL-18 і, як виявилося, його ендогенна збільшуючи продукцію IFN- (24). активність пояснює продукцію IFN- в випадках Було показано, що нейтралізуючі антитіла летальності, опосередкованої Р. acnes та LPS. проти IL-18 миші відвертають летальну дію низьВнаслідок його активності, блокування біологічної ких доз LPS на мишей, попередньо оброблених P. активності IL-18 при захворюванні людини є тераacnes. Інші дослідники повідомляли про значення певтичною стратегією при численних хворобах. IFN- як медіатора летальної дії LPS у попередньо Цього досягають використанням розчинних рецепоброблених мишей. Наприклад, нейтралізуючі торів або блокуючих антитіл до зв'язаного з клітиaнти-IFN- - антитіла запобігали розвитку у мишей ною рецептора IL-18. генералізованої реакції Шварцмана (16), а обробБілки, що зв'язують цитокіни, (розчинні рецеплені галактозаміном миші з дефіцитом IFN- тори цитокінів) відповідають позаклітинним лирецептора, виявляються резистентними до загиганд-зв'язувальним доменам відповідних їм рецебелі, викликаної LPS (7) . Отже, не є несподіваним, пторів клітинної поверхні цитокінів. Їх одержують що нейтралізуючі антитіла проти IL-18 миші захиабо шляхом альтернативного сплайсинга передщають мишей, попередньо оброблених P. acnes, мРНК, притаманної рецептору клітинної поверхні, від летальної дії LPS (31). До того ж обробка антиабо шляхом протеолітичного розщеплення рецептіла проти мишачого IL-18 відвертає тяжку печінтора клітинної поверхні. Такі розчинні рецептори кову цитотоксичність у мишей, які вижили. були описані раніше, включаючи зокрема розчинні Після того, як клонували мишачу форму, в рецептори IL-6 і IFN- (30), TNF (11, 12), IL-1 та IL-4 1996 році описали послідовність кДНК IL-18 люди(21), IFN- / (28,29) та інші. Один цитокінзв'язувани (38). Рекомбінантний IL-18 людини виявляє льний білок, названий остеопротегерин (OPG, таактивність нативного IL-18 (38). Рекомбінантний ILкож відомий як фактор, що інгібує остеокласти 18 людини не виявляє безпосередньої індукуючої OCIF)/член TNFR/Fas сімейства, є першим прикIFN- активності в Т-клітинах людини, а діє як коладом розчинного рецептора, який існує лише як стимулятор продукції IFN- і інших цитокінів Тсекретований білок (1, 34, 39). хелперів-1 (Th-1) (38). Нині, IL-18 розглядають гоДаний винахід стосується IL-18-зв'язувальних ловним чином як ко-стимулятор продукції цитокінів білків, (IL-18BP) та кодованих вірусами гомологів Th-1 (IFN- , IL-2 і колонієстимулюючого фактора IL-18BP (надалі, вірусні IL-18BP), та рекомбінантгранулоцитів-макрофагів) (20), а також як коних білків, мутеїнів, функціональних похідних, ак 9 75862 10 тивних фрагментів і їх перетворених через цикліLPS (10мкг/мл) разом з зростаючими концентрацізування похідних, здатних зв'язувати IL-18. Винаями IL-18BP людини. хід також стосується способу виділення IL-18BP з (D) Спленоцити миші інкубують (24 години) з рідин організму людини, і способу одержання їх за Соn А (конканаваліном А) (мкг/мл) разом з зростадопомогою рекомбінантних методик. Винахід таючими концентраціями IL-18BP людини. кож стосується векторів, що експресують IL-18BP, (Ε) KG-1 клітини людини стимулюють TNFпідхожих для експресії IL-18BP у людей та інших (20нг/мл) і huIL-18 (людини) (25нг/мл), доданих або ссавців. Окремі IL-18BP, кодовані вірусами гомосамих, або після попереднього змішування (1 гологи IL-18BP, гібридні білки, мутеїни, функціональдина, 37°С) з IL-18BP сечі. ні похідні, активні фрагменти та їх перетворені На Фігурі 4 подано послідовність кДНК ILчерез циклізування похідні відповідно до цього 18BPa людини і білка. Сигнальний пептид підкресвинаходу можуть застосовуватись для модулюлено. вання і/або блокування активності IL-18. На Фігурі 5 подано послідовність кДНК ILТакож забезпечені репліковувані експресуючі 18BPb людини і білка. Сигнальний пептид підкресвектори, що містять послідовності ДНК, підхожі лено. для експресії різних IL-18BP в клітинах-хазяїнах, На Фігурі 6 подано послідовність кДНК ILтрансформованих ними, і білки та поліпептиди, що 18BPC людини і білка. Сигнальний пептид підкрепродукуються шляхом експресії такими хазяїнами. слено. Крім того, винахід стосується фармацевтичних На Фігурі 7 подано послідовність кДНК ILкомпозицій, які складаються з прийнятних носіїв і 18BPd людини і білка. Сигнальний пептид підкресIL-18BP, або вірусних IL-18BP чи векторів, що екслено. пресують їх у людей та інших ссавців, для лікуванНа Фігурі 8 зображено послідовність гена ILня захворювань або станів, при яких необхідне 18BP людини. Визначають послідовність геномномодулювання або блокування активності IL-18. го клону (7,1т.п.н.) людини і порівнюють з послідоДалі винахід стосується антитіл проти IL-18BP вностями різних клонів кДНК, виділених з 3 кДНК і вірусних IL-18BP, підхожих для їх афінної очистки бібліотек. Спільний стартовий кодон трансляції та імуноаналізу. являє собою нуклеотиди 683-685. NuMAl ген локаФігура 1 зображує SDS-PAGE (електрофорез в лізується на негативному ланцюзі від нуклеотиду поліакриламідному гелі в присутності додецилсу3578 до кінця. льфату натрію) IL-18-зв'язувального білка, очищеФігура 9 показує вплив рекомбінантного ILного за афінною методикою. Неочищені білки сечі 18BP на активність IL-18 людини і миші. (500л сечі здорових людей, сконцентрованої ультНis6-мічений IL-18BPa короткочасно експресурафільтруванням) наносять на колонку з IL-18ють в клітинах COS7 і очищають. агарозою. Колонку промивали, а зв'язані білки (A) IL-18 людини (5нг/мл) попередньо змішуелюювали при рН 2,2. Елюйовані фракції нейтрають з або Нis6-міченим-ІL-18ВРа, або RPMI та долізовували і аліквоти аналізували за допомогою дають до клітин селезінки миші разом з LPS SDS-PAGE (10% акриламід) в невідновлювальних (1мкг/мл). Продукцію IFN- вимірюють через 24 умовах і при забарвленні сріблом. Доріжки являгодини. ють собою: 1: неочищені білки сечі (1,5мкг нано(B) IL-18 миші (10нг/мл) попередньо змішують сять на гель); 2-9: елюати 1-8, відповідно, з колонабо з Нis6-міченим-IL-18ВРа, або з RPMI і додають ки з IL-18-агарозою; 10: маркери молекулярних до клітин селезінки миші разом з LPS (1мкг/мл). мас в кДа, подані праворуч. Стрілка вказує зону, Продукцію IFN- вимірюють через 24 години. яка відповідає IL-18BP. (C) IL-18 людини (25нг/мл) попередньо змішуФігура 2 зображує авторадіограму SDS-PAGE ють або з COS7-IL-18BPa, або з RPMI і додають до (7,5% акриламід) комплексів, які складаються з РВМС (мононуклеарні клітини периферійної крові) 125 I-IL-18 (уявна молекулярна маса 19кДа), попелюдини в присутності IL-12 (10нг/мл). речно-зв'язаного з такими препаратами розчинно(D) IL-18 людини (25нг/мл) попередньо змішуго IL-18-зв'язувального білка: Доріжка 1: Промиють або з COS7-IL-18BPa, або з RPMI і додають до вання з IL-18-афінноі колонки. Доріжка 2: Елюція 2 KG-1 клітин людини в присутності TNF- (20нг/мл). з IL-18-афінной колонки. Доріжка 3: Елюція 3 з ILДаний винахід стосується різних IL-18BP та ві18-афінной колонки. Праворуч вказані маркери русних IL-18BPs, які зв'язують IL-18. Такі IL-18BP молекулярних мас (в кДа). Стрілка вказує поперемодулюють і/або блокують біологічні активності ILчно-зшитий продукт (58кДа). 18. Термін "IL-18BP і вірусні IL-18B" включає в сеФігура 3 зображує інгібування індукованої ILбе зрілий білок (без сигнальної послідовності), 18 продукції IFN- за допомогою BL-18BP білок, що містить сигнальну послідовність, мутеїни (A) Спленоцити миші стимулюють (24 години, IL-18BP і вірусних IL-18BP, похідні IL-18BP і вірус37°С) зазначеними поєднаннями LPS (1мкг/мл) і них IL-18BP та усічені форми IL-18BP і вірусних ILIL-18 людини (5нг/мл), доданими або безпосеред18BP та їх солі. ньо, або після попереднього змішування (1 година, Далі винахід стосується ДНК, що кодують різні 37°С) з IL-18BP сечі. Рівень muIFN- (миші) в кульIL-18BP, вірусні IL-18BP, мутенни, рекомбінантні турі визначають через 24 години. білки, функціональні похідні, активні фракції та їх (B) Спленоцити миші інкубують (24 години) з суміші. Зазначена ДНК являє собою геномну ДНК, LPS (1мкг/мл) разом з IL-18 миші (10нг/мл), попекДНК, синтетичну ДНК, продукт PCR або їх поєдредньо змішаний (1 година, 37°С) із зростаючими нання. Ці ДНК вставляють в репліковувані носії концентраціями IL-18BP людини. експресії для експресії різних IL-18BP та вірусних (C) Спленоцити миші інкубують (24 години) з IL-18BP в клітинах-хазяїнах згідно з цим винахо 11 75862 12 дом. ДНК здатні гібридизуватись з зазначеними лідовності білка. Аналогічно, аліквоти елюйованоДНК за жорстких умов, а кодування білків або пого білка піддають прямому аналізу первинної струліпептидів, що зв'язують IL-18, також включають ктурикороткого фрагменту послідовності білка. В до цього винаходу. обох випадках, одержані дві поліпептидні послідоОдна така ДНК кодує IL-18BP, який включає вності. Головна послідовність і мінорна послідовамінокислотну послідовність SEQ ID NO: 10, і місність, остання відповідає фрагменту дефенсину тить термінуючий кодон на її 3'-кінці. людини (номер доступу р11398), починаючи з аміЕкспресуючі вектори, підхожі для експресії різнокислоти 65. Віднімання відомої послідовності них IL-18ВР або вірусних IL-18BP у людей або індефенсину дає таку послідовність: ших ссавців, тобто для генної терапії, являють собою вірусні вектори або інші типи векторів, в які включають ген IL-18BP або кДНК IL-18BP чи ДНК, що кодує IL-18BP у спосіб, який дозволяє здійснити ефективну експресію IL-18BP або вірусного ILде x являє собою ще невизначені амінокисло18BP у людей та інших ссавців. Даний винахід ти. також включає молекули ДНК, які гібридизуються з Щоб одержати більш довгу і більш точну посзазначеними ДНК за жорстких умов і кодують білки лідовність і щоб ідентифікувати можливі залишки і поліпептиди, що зв'язують IL-18. цистеїну, аліквоти елюйованої фракції відновлюВиділення IL-18BP проводять згідно з даним ють ДТТ (дитіотрейтолом) за денатуруючих умов, винаходом, наприклад, шляхом пропускання рідин проводять реакцію з 4-вінілпіридинон, знесолюють організму людини таких як сеча або сироватка за допомогою мікро-ультрафільтраційного причерез хроматографічну колонку, до якої приєднастрою (Ultrafree, cutoff 10000Lf, Millipore) і провоний IL-18, і подальшої елюції IL-18BP. дять аналіз первинної структури короткого фрагРізні IL-18BP і вірусні IL-18BP одержують за менту послідовності білка. Після циклу №1 допомогою рекомбінантних методик, тобто шлясеквенування, проводять реакцію залишкового хом експресування IL-18BP в відповідному хазяїні, білка з о-фталевим альдегідом, щоб блокувати всі слідом за оперативним приєднанням промоторів, N-концеві поліпептиди окрім Pro, а потім продовенхансерів експресії, регуляторних послідовностей жують секвенування. У цей спосіб одержано таку тощо, прийнятних для даного використовуваного одноланцюжкову білкову послідовність: хазяїна, що, наприклад, передбачає експресію в правильній орієнтації. Різні IL-18BP і вірусні IL-18BP, та вектори для експресування EL-18BP у людей та інших ссавців застосовують для лікування і полегшення станів, в які втягнутий IL-18 або які викликані надлишком екзогенно введеного або ендогенно утвореного IL18. Такими станами є, наприклад аутоімунні заОдержана послідовність значно відрізняється хворювання, цукровий діабет І типу, ревматоїдний від послідовності будь-якого іншого відомого білка, артрит, відторгнення трансплантата, запальне що встановлено дослідженням баз даних за струкзахворювання кишечнику, сепсис, розсіяний склетурою білка. Однак дослідження бази даних The роз, ішемічна хвороба серця (включаючи серцевий Institute of Genomic Research (TOGR) напад), ішемічне ураження мозку, хронічний гепа(HTTP://www.ncbi.nlm.nih.gov) за допомогою tblastn тит, псоріаз, хронічний панкреатит, гострий панпрограми дослідження дало файл кДНК, позначекреатит і таке інше. ний ТНС12801, відкрита рамка зчитування (128 Відповідно до цього винаходу, IL-18BP видікодонів) якої, коли транслюється, містить послідоляють з сечі здорової людини за допомогою однієї вність високо гомологічну N-кінцевій послідовності хроматографічної стадії. Препарат неочищеної IL-18BP. Таким чином представляють гомологію: сечі людини, сконцентрованої з 500л сечі здорових людей, наносять на колонку, що містить IL-18 людини, зв'язаний з агарозою. Колонку промивають, а зв'язаний білок елююють при низькому значенні рН. Елюйовані фракції нейтралізують, а аліквоти (Верхня послідовність (1-40) є послідовністю аналізують за допомогою SDS-PAGE (електрофоIL-18BP, виділеною згідно з винаходом; нижню рез в поліакриламідному гелі в присутності додепослідовність (51-100) одержано трансляцією цилсульфату натрію) (10% акриламіду) за невідкДНК файлу ТНС123801 TIGR). новлювальних умов і при забарвленні сріблом. Послідовність кДНК, ідентифікована як ТНС Зокрема, в елюйованих фракціях виявлена білко12801, є, однак, тільки EST (експресована tag посва зона 40кДа (Фіг.1). лідовність), тобто випадково вибраним клоном Білок ~40кДа, одержаний на першій стадії, кДНК. Ніколи не досліджували, чи містить EST ідентифікують як IL-18-зв'язувальний білок, за його відкриту рамку зчитування, або чи експресується здатністю, зокрема, поперечно зв'язувати 125I-IL-18 білок з гена, який відповідає EST, або з самого (Фіг.2). До того ж, білок ~40кДа характеризують, EST, не ідентифікували будь-коли будь-яку функаналізуючи N-кінцеву послідовність білка. Аліквоти цію білка, що кодується ТНС12801. Взагалі немає з елюйованого білка піддають SDS-PAGE, електінформації про те, що ТНС123801 містить відкриту роблотингу на PVDF-мембрані та проводять анарамку зчитування, що кодує IL-18BP. ліз первинної структури короткого фрагменту посАфінно-очищений IL-18BP сечі зберігає здат 13 75862 14 ність зв'язувати його мічений ліганд (125I-IL-18) , і них клітин, периферійної крові) та з селезінки люпісля ковалентного поперечного зв'язування утводини. Різні незалежні клони кДНК відповідають рює комплекс з молекулярною масою 58кДа. Мочотирьом варіантам сплайсинга IL-18BP (SEQ ID лекулярна маса комплексу відповідає співвідноNO: 1, 3, 5 і 7) . Всі варіанти сплайсинга кодують шенню 1:1 IL-18BP ~40кДа та IL-18 19кДа (Фіг.2). передбачувані розчинні секретовані білки. НайАфінно-очищений IL-18BP блокує біологічну більш багатий варіант (IL-18BPa) має відкриту раактивність IL-18 людини, так само як і миші. Таким мку зчитування з 192 кодонів, яка кодує сигнальчином, коли IL-18BP додають до IL-18 або людини, ний пептид, що раніше згадується як "лідерабо миші, він блокує здатність IL-18 викликати послідовність" з 28 амінокислотних залишків, за продукцію інтерферона-гамма, якщо додають раяким йде зрілий передбачуваний IL-18BPa, перші зом з ліпополісахаридом (LPS) до культур клітин 40 залишків якого ідеально відповідають Nселезінки миші (Фіг.3). кінцевій білковій послідовності IL-18BP сечі (SEQ З метою даного опису вираз "біологічна активID NO: 2). Положення залишків цистеїну дозволяє ність IL-18" стосується принаймні однієї з поданих припустити, що цей поліпептид належить до супенижче біологічних властивостей: рсімейства імуноглобулінів (Іg). Цікаво, що кожен з чотирьох залишків Gln в зрілому IL-18BPa є ділян(і) індукція IFN- , головним чином, в якості кокою можливого N-глікозилування. Три інші варіанстимулятора з мітогенами, IL-1, IL-12, TNF- , LPS ти IL-18BP наявні в меншій кількості, ніж IL-18BPa. в різних типах клітин таких як мононуклеарні клітиВони включають в себе більш коротку 1т.п.н. кДНК ни периферійної крові людини, лінія KG-1 клітин IL-18BPb, що кодує сигнальний пептид з 28 амінолюдини і Т-клітини, кислотних залишків з подальшим зрілим білком з (іі) збільшення проліферації Т-клітин, 85 амінокислотних залишків (SEQ ID NO: 4). Третій (ііі) збільшення утворення цитокіну ТН-1 in варіант, IL-18BPC, являє собою кДНК 2,3т.п.н., що vitro, головним чином в якості ко-стимулятора, кодує сигнальний пептид з 28 амінокислотних за(iv) синергізм з IL-12 щодо збільшення продулишків з подальшим зрілим IL-18BP з 169 амінокикування IFN- , дія ко-стимулятора щодо продукції слотних залишків (SEQ ID NO: 6). Четвертий варіIFN- та інших цитокінів Т-хелперів-1, ант, IL-18BPd, кодує сигнальний пептид з 28 (ν) ко-стимулююча дія відносно FAS-лігандамінокислотних залишків з подальшим зрілим ILопосередкованої цитотоксичності клонів натураль18BP з 1 амінокислотних залишків (SEQ ID NO: 8). них-кілерів миші, Для подальшого дослідження можливого існу(vi) індукція активації NF-kB в KG-1 клітинах вання додаткових варіантів сплайсинга IL-18BP, людини, ймовірно шляхом індукування утворення проводять скринінг геномної бібліотеки людини гомодимеру 50 NF-kB і гетеродимеру р65/р50 NFзондом, який відповідає повній довжині кДНК ILkB, 18BP. П'ять геномних клонів, що відрізняються за (vii) індукція IL-8. довжиною, ідентифіковані в цій бібліотеці. ПровоВживаний в описі вираз "зв'язування з IL-18" дять аналіз послідовності ДНК цих клонів з викоозначає здатність IL-18BP зв'язувати IL-18, що ристанням зовнішнього і внутрішнього праймерів. доводять, наприклад шляхом зв'язування IL-18BP Всього з цих клонів зібрана послідовність 7,8т.п.н. з міченим IL-18 при афінній очистці, як описують в (SEQ ID NO: 9). Не ідентифікують ніякого екзона, Прикладі 2 опису. що кодує трансмембранний (ТМ) рецептор з посВживаний в описі вираз "модулювання активлідовністю 7,8т.п.н. Всі варіанти, розподілені в ності IL-18" означає здатність IL-18BP змінювати звичайному ініціюючому сайті трансляції, кодують будь-яку активність IL-18, а не блокування, напритой самий сигнальний пептид з 28 амінокислотних клад часткове інгібування, підсилення і таке інше. залишків і розчинні зрілі білки, які відрізняються за Вживаний в описі вираз "блокування активносвеличиною та С-кінцевими послідовностями. ІLті IL-18" стосується активності IL-18BP, що блокує 18ВР-локус містить додатковий ген, що кодує білок принаймні одну з наведених вище біологічних ак1 ядерного мітотичного апарату (NUMA1), який тивностей IL-18. Активність IL-18ВР, що блокує ILзнаходиться на мінус ланцюга. Ці дані локалізують 18, є прикладом здатності IL-18BP блокувати асоген IL-18BP в хромосомі llq 13 (36). ційовану з IL-18 експресію IFN- в спленоцитах Дослідження гомології проводять на повній бімиші. Як буде показане більш докладно нижче, лковій послідовності IL-18BPa і GenPept базі даних модулювання або блокування активності IL-18BP (HTTP://www.ncbi.nlm.nih.gov), використовуючи частково зумовлене тим, що IL-18ВР інгібує виклиSmith Watermann-алгоритм. Виявлено, що гомолокану IL-18 активацію NF-kB. До того ж, IL-18ВР ги IL-18BP експресуються в деяких покс-вірусах у блокує принаймні одну з таких активностей IL-18, а вигляді секретованих білків з раніше невідомою саме індукцію IFN- в клітинах людини і миші, індуфункцією. Раніше повідомляли, що віруси кодують кцію IL-8 і активацію NF-kB. різні рецептори цитокінів і що такі кодовані вірусаДНК-зонд для скринінга кДНК бібліотек одерми молекули служать в якості пасток-рецепторів, жують шляхом PCR з зворотною транскриптазою що інгібує імунні відповіді шляхом нейтралізації їх зі специфічними смисловим і антисмисловим відповідного цитокіну (розглядають Spriggs, MK, праймерами і РНК з Т-клітин людини Jurkat з 1994, Сшт, Opin. Immunol., 6, 526-529). Тому винапраймерами з TIGR послідовності. Одержаний хід далі стосується кодованих вірусами гомологів продукт PCR підтверджують аналізом послідовно32 IL-18BP, які також є блокаторами або модулятості ДНК. Продукт PCR мітять [Р] і використовують рами біологічної активності IL-18. Приклади кодов якості зонда для скринінга чотирьох кДНК бібліованих вірусами гомологів IL-18BP подані в Табтек людини, одержаних з моноцитів периферійної лиці 1. крові, з лінії Т-клітин Jurkat, з РВМС (мононуклеар 15 75862 16 Згідно з даним винаходом, кодований вірусом біологічно активний IL-18BP. гомолог експресують в прокаріотичному або еукаДалі даний винахід стосується мутеїнів і фраріотичному хазяїні. Вживаний в описі вираз "кодогментів IL-18ВР та вірусних IL-18BP, і рекомбінанваний вірусом гомолог IL-18BP" означає схожість тних білків, які складаються з IL-18BP дикого типу принаймні 50% в послідовності з принаймні 70 та вірусних IL-18BP або їх мутеїнів або фрагменамінокислотних залишків. Більш прийнятно, схотів, злитих з іншим поліпептидом або білком і які жість становить принаймні 50%, принаймні 60%, характеризуються здатністю зв'язувати IL-18 або принаймні 70%, принаймні 80% або ще більш прийого гомологи. йнятно принаймні 90% схожості в послідовності з Вживаний в описі термін "мутеїни" стосується 100 амінокислотних залишків. аналогів IL-18BP або аналогів вірусного IL-18BP, в яких один чи більше амінокислотних залишків наТаблиця 1 тивного IL-18BP або вірусного IL-18BP заміщають різними амінокислотними залишками або вилучаКодовані вірусами білки, які ють, або один чи більше амінокислотних залишків виявляють високу гомологію з IL-18BP людини приєднують до послідовності нативного IL-18BP або вірусного IL-18BP без значної зміни здатності одержаних продуктів зв'язувати IL-18 порівняно з Послідовність Тип вірусу IL-18BP дикого типу або вірусним IL-18BP. Ці мутеGen Pept їни одержують шляхом відомого синтезу і/або меU60315 Вірус Molluscum MCU60315_54 тодами сайт-спрямованого мутагенезу, або будьcontagiosum якого іншого відомого методу, прийнятного для U60315 Вірус Molluscum MCU60315_53 цього. contagiosum Більш прийнятно будь-який такий мутеїн має SWPHLSB_12 L22013 Вірус віспи свині послідовність амінокислот, яка суттєво повторює CV41KBPL_14 Вірус (віспо)вакцини послідовність IL-18BP, яка суттєво повторює посVVCGAA 5 Вірус натуральної віспи лідовність вірусного IL-18BP, таку, щоб мати по Вірус ектомелії (вірус віспи миU01161_3 174 суті однакову активність з IL-18BP. Однією актившей) ністю є його здатність зв'язувати IL-18. Оскільки VVU18340_6 Вірус натуральної віспи мутеїн характеризується значною IL-18VVU18338_7 Вірус натуральної віспи зв'язувальною активністю, його використовують VVU18337_7 Вірус натуральної віспи для очистки IL-18, як наприклад шляхом афінної VARCG_7 173 Основний вірус натуральної віспи хроматографії, і таким чином вважають, що він MCU60315_51 Вірус Molluscum contagiosum має активність, подібну до активності IL-18BP. Так, Новий вірус, асоційований з гепачи має будь-який даний мутеїн по суті таку ж актиHNABV_1 титом не-А, не-В вність як IL-18BP можна визначити за допомогою рутинних експериментів, в яких такий мутеїн підIL-18BPa експресують в клітини COS7 мавпи. дають, наприклад простому конкурентному сендЗ цією метою кДНК IL-18BPa включають в експревіч-аналізу, щоб виявити чи зв'язує він або ні відсуючий вектор pEF-BOS ссавців. Касету, що кодує повідно мічений IL-18, і таким як радіоімуноаналіз (His)6-послідовність, приєднують до 3'-кінця ORF та EUSA (твердофазний імуноферментний аналіз). IL-18BP в рамці, щоб полегшити очистку рекомбіВ більш прийнятному втіленні будь-який такий нантного білка. Клітини COS7 короткочасно транмутеїн має принаймні 40% ідентичності або гомосфікують експресуючим вектором, а безсироватлогії з послідовністю або IL-18BP, або кодованого кове середовище цих клітин (150мл) концентрують вірусом гомолога IL-18BP. Ще більш прийнятно, і очищають шляхом метал-хелатуючої хроматогвін має принаймні 50%, принаймні 60%, принаймні рафії. IL-18BPa рухається у вигляді однієї смуги 7 0%, принаймні 80% або найбільш прийнятно, при SDS-PAGE з забарвленням сріблом при відпринаймні 90% ідентичності або гомології з нею. новлювальних та невідновлювальних умовах і має Мутеїни поліпептидів IL-18BP або мутеїни вітаку ж уявну молекулярну масу, як маса IL-18BP русних IL-18ВР, застосовні згідно з даним винахосечі. Аналіз білкової послідовності цього препарадом, або нуклеїнова кислота, що їх кодує, включату виявляє таку ж N-кінцеву послідовність як посють в себе певний набір істотно відповідних лідовність IL-18BP сечі. Аналіз IL-18BPa за допопослідовностей, як пептиди заміщення або полінумогою імуноблотинга з антитілами, одержаними клеотиди, які рутинно одержують за допомогою проти IL-18BP сечі, виявляє зону з такою ж молеодного з звичайних способів на даному рівні технікулярною масою як маса білка сечі. Крім того, вики без зайвих експериментів на основі інструкцій і користовуючи імунопреципітацію з подальшими порадника, наведених в описі. Докладний опис SDS-PAGE і авторадіографією, встановлюють, що хімії і структури білка див. [Schulz G. Ε. et al., IL-ISBPa витісняє 125I-IL-18ВР сечі з сполуки з анPrinciples of Protein Structure, Spring-Verlag, New титілом. Тому IL-18BPa структурно відповідає ILYork, 1978; і Creighton, Т. Е., Proteins: Structure and 18BP, виділеному з сечі. Molecular Properties, W. H. Freeman & Co., San Були проведені дослідження здатності сирого і Francisco, 1983], які цитують в описі. Для ознайомочищеного IL-18BPa інгібувати біологічну активлення з замінами в нуклеотидній послідовності, ність IL-18. IL-18BPa інгібує активність IL-18 людинаприклад такими як кодонні переваги, див. ни і миші в спленоцитах миші, РВМС і лінії KG-1 [Ausubel et al., supra, at A,1.1-А.1.24, і Sambrook et клітин людини (Фіг.9). Ці результати підтверджуal., supra, в Додатках С і D]. ють справжність кДНК IL-18BPa, як кДНК, що кодує Більш прийнятними замінами щодо мутеїнів 17 75862 18 відповідно до цього винаходу є заміни, відомі як консервативні. Консервативні заміни поліпептидів Таблиця II або білків IL-18BP або вірусних IL-18BP включають в себе синонімічні амінокислоти, групи яких харакЩе більш прийнятні теризуються достатньо схожими фізико-хімічними групи синонімічних амінокислот властивостями, що при заміщеннях між членами групи зберігається біологічна функція молекули, Амінокислота Синонімічна група [Grantham, Science, Vol. 185, pp.862-864 (1974)]. Ser Ser Ясно, що вставки і делеції амінокислот в зазначеArg His, Lys, Arg них послідовностях можна здійснювати без зміни Leu Leu, lle, Phe, Met їх функції, особливо якщо вставки та делеції втяPro Ala, Pro гують лише кілька амінокислот, наприклад менше Thr Thr тридцяти, і більш прийнятно менше десяти, і не Ala Pro, Ala вилучають або заміщають амінокислоти, які є істоVal Val, Met, lle тними для функціональної конформації, наприклад Gly Gly залишки цистеїну, [Anfinsen, "Principles That lle lle, Met, Phe, Val, Leu Govern The Folding of Protein Chains"; Science, Vol. Phe Met, Tyr, lle, Leu, Phe 181, pp.22-20 (1973)]. Білки і мутеїни, утворені за Tyr Phe, Tyr допомогою таких делецій і/або вставок, входять до Cys Cys, Ser компетенції даного винаходу. His His, GIn, Arg Однак залишки цистеїну, які не є істотними для біологічної функції, заміщають на інші залишGIn Glu, GIn, His ки, наприклад, щоб уникнути утворення небажаних Asn Asp, Asn внутрішньомолекулярних і міжмолекулярних дисуLys Lys, Arg льфідних містків, які викликають зниження активAsp Asp, Asn ності IL-18BP. Glu Glu, GIn Більш прийнятні синонімічні амінокислотні груMet Met, Phe, lle, Val, Leu пи подані в Таблиці l. Ще більш прийнятно, синоTrp Trp німічні амінокислотні групи являють собою групи, наведені в Таблиці II; і найбільш прийнятно синоТаблиця III німічні амінокислотні групи являють собою групи, названі в Таблиці III. Найбільш прийнятні групи синонімічних амінокислот Таблиця l Більш прийнятні групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly lle Phe Tyr Cys His GIn Asn Lys Asp Glu Met Trp Синонімічна група Ser, Thr, Gly, Asn Arg, GIn, Lys, Glu, His lIe, Phe, Tyr, Met, Val, Leu Gly, Ala, Thr, Pro Pro, Ser, Ala, Gly, His, GIn, Thr Gly, Thr, Pro, Ala Met, Tyr, Phe, lle, Leu, Val Ala, Thr, Pro, Ser, Gly Met, Tyr, Phe, Val, Leu, lle Trp, Met, Tyr, lle, Val, Leu, Phe Trp, Met, Phe, lle, Val, Leu, Tyr Ser, Thr, Cys Glu, Lys, GIn, Thr, Arg, His Glu, Lys, Asn, His, Thr, Arg, GIn GIn, Asp, Ser, Asn Glu, GIn, His, Arg, Lys Glu, Asn, Asp Asp, Lys, Asn, GIn, His, Arg, Glu Phe, lle, Val, Leu, Met Trp Амінокислота Ser Arg Leu Pro Thr Ala Val Gly lle Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp Синонімічна група Ser Arg Leu, lle, Met Pro Thr Ala Val Gly lle, Met, Leu Phe Tyr Cys, Ser His Gln Asn Lys Asp Glu Met, lle, Leu Met Приклади здійснення амінокислотних замін в білках, що використовують для одержання мутеїнів поліпептидів або білків IL-18BP, або мутеїнів вірусних IL-18BP, для застосування в даному винаході, включають будь-які відомі стадії способів таких як наведені в патентах США RE 33653, 4959314, 4588585 і 4737462 Mark et al.; 5116943 Koths et al., 4965195 Namen et al.; 4879111 Chong 19 75862 20 et al.; і 5017691 Lee et al; і білки з заміщеним лізиможуть бути злиті з іншим білком або поліпептином представляють в патентах США №4904584 дом тощо, наприклад імуноглобуліном або його (Shaw et al.). фрагментом. Він також може бути злитий з поліеВ іншому більш прийнятному напрямку даного тиленгліколем (PEG) для пролонгування часу цирвинаходу мутеїн IL-18BP або вірусного IL-18BP куляції. має амінокислотну послідовність, яка по суті відТермін "солі", що використовується в описі, повідає послідовності IL-18BP або вірусного ILстосується як солей карбоксильних груп, так і со18BP. Термін "по суті відповідає" призначено для лей приєднання кислот аміногруп IL-18BP, віруснорозглядуваних білків з мінорними змінами в посліго IL-18BP, мутеїнів або їх рекомбінантних білків. довності природного білка, які не порушують осноСолі карбоксильної групи, утворені у способі, вівні характеристики природних білків, особливо, що домі у цій галузі, включають неорганічні солі; настосується їх здатності зв'язувати IL-18. Вважають, приклад солі натрію, кальцію, амонію, заліза або що тип змін, які звичайно відносять до "по суті відцинку тощо, та солі, утворені з органічними осноповідають", є такими змінами, що відбуваються в вами, наприклад амінами, такими як триетиламін, результаті узвичаєних методів мутагенезу ДНК, які аргінін або лізин, піперидин, новокаїн і подібні. кодують ці білки, що приводять в результаті до Солі приєднання кислот включають, наприклад нечисленних мінорних модифікацій, і скринінгу солі мінеральних кислот такі як, наприклад хлоринеобхідної активності у описаний вище спосіб. стоводнева кислота або фосфорна кислота, і солі Окрім зв'язування IL-18 мутеїни також модулюють органічних кислот такі як, наприклад оцтова кислоі/або блокують активність IL-18. та або щавлева кислота. Звичайно, будь-які такі Відповідно до цього винаходу, мутеїни вклюсолі повинні мати активність, подібну до IL-18ВР. чають в себе білки, що кодуються нуклеїновою Термін "функціональні похідні", що вживається кислотою такою як ДНК або РНК, які гібридизуютьв описі, означає похідні IL-18BP або вірусного ILся з ДНК або РНК, які кодують IL-18BP або коду18BP та їх мутеїнів і рекомбінантних білків, які ють вірусний IL-18BP відповідно до цього винаходу одержують, наприклад з функціональних груп, ісза жорстких умов. Винахід також включає в себе нуючих у вигляді бокових ланцюгів на залишках таку нуклеїнову кислоту, що також може застосоабо N- або С-кінцевих групах, згідно з методиками, вуватись в якості зонда при ідентифікації і очистці відомими в даній галузі, та їх включають у винахід, необхідної нуклеїнової кислоти. Крім того, така оскільки вони залишаються фармацевтично принуклеїнова кислота є основним кандидатом для йнятними, тобто вони не руйнують активність білвизначення, чи кодує вона поліпептид, що зберігає ка, яка по суті подібна до активності IL-18BP або функціональну активність IL-18BP даного винаховірусного IL-18BP, і не надають токсичних властиду. Термін "жорсткі умови" стосується гібридизації і востей композиціям, що їх містять. Ці похідні умов подальшого промивання, що є звичайними включають в себе, наприклад бокові ланцюги пона даному рівні техніки і узвичаєно називаються ліетиленгліколю, які маскують антигенні ділянки та "жорсткими". Див. [Ausubel et al., Current Protocols подовжують перебування IL-18BP або вірусного ILin Molecular Biology, supra, Interscience, N. Y., 6.3 і 18BP в біологічних рідинах. Інші похідні включають 6.4 (1987, 1992), та Sambrook et al., supra]. Без аліфатичні ефіри карбоксильних груп, аміди каробмеження приклади жорстких умов включають в боксильних груп шляхом реакції з аміаком або з себе умови промивання 12-20° нижче від розрахопервинними чи вторинними амінами, N-ацильні ваної температури гібриду при дослідженні в, напохідні вільних аміногруп залишків амінокислот, приклад 2 х SSC і 0,5% додецилсульфаті натрію утворених з ацильними компонентами (наприклад, протягом 5 хвилин, 2 х SSC і 0,1,% SDS протягом алканоїльними або карбоциклічними ароїльними 15 хвилин; 0,1 х SSC 0,5% SDS при 37°С протягом групами), або О-ацильні похідні вільних гідрокси30-60 хвилин, а потім 0,1 х SSC і 0,5% SDS при льних груп (наприклад, груп залишків серину і тре68°С протягом 30-60 хвилин. Фахівці у цій галузі оніну), сформованих з ацильними компонентами. розуміють, що жорсткі умови також залежать від В якості "активних фракцій" IL-18BP або вірусдовжини послідовності ДНК, олігонуклеотидних ного IL-18ВР, мутеїнів або рекомбінантних білків в зондів (як, наприклад, 10-40 основ) або змішаних даному винаході розглядають будь-який фрагмент олігонуклеотидних зондів. Якщо застосовують або попередники поліпептидного ланцюга білкової змішані зонди, більш прийнятно використовують молекули одних або разом з асоційованими молехлорид тетраметиламонію (ТМАС) замість SSC. кулами або зв'язаними з ними залишками, наприДив. Ausubel, вище. клад залишками цукру або фосфату, або агрегаДалі винахід стосується нуклеїнових кислот, тами білкової молекули, або самими залишками які кодують IL-18BP відповідно до цього винаходу, цукру за умови, що названа фракція по суті зберіале які відрізняються за послідовністю кодону внагає здатність зв'язувати IL-18. слідок виродженості генетичного коду. Винахід Термін "перетворені через циклізування похідтакож стосується таких ДНК, які, можливо, не гібні", що використовується в описі, стосується лінійридизуються за жорстких умов з послідовностями ної молекули, кінці якої з'єднують разом або безДНК, наведеними на Фігурах 4 до 7, але, проте, посередньо, або через лінкер, щоб утворити кодують IL-18BP відповідно до цього винаходу. кільцеву молекулу, а потім кільцеву молекулу розТермін "гібридний білок" стосується поліпепкривають в іншій ділянці, щоб утворити нову лінійтиду, що містить IL-18BP або вірусний IL-18BP, ну молекулу з кінцями, що відрізняються від кінців або їх мутеїни, злиті з іншим білком, який, напривихідної молекули. Перетворення через циклізуклад має тривалий час циркуляції в рідинах оргавання включає ті молекули, структура яких еквіванізму. Таким чином, IL-18BP або вірусний IL-18BP лентна молекулі, яку циклізують, а потім відкрива 21 75862 22 ють. Так, перетворена циклізуванням молекула ні хазяїни включають штам 294 Е. соІі К12 (АТСС синтезується de novo як лінійна молекула, і ніколи 31446), Е. coli X1776 (АТСС 3157), Е. соІі W3110 не проходить через стадію утворення кільця і ста(F¯, лямбда¯, фототрофні (АТСС 27325). За таких дію розкриття. Одержання перетворених через умов білок не глікозилується. Прокаріотичний хациклізування похідних описують в міжнародній зяїн повинен бути сумісним з репліконом і контрозаявці WО 95/27732. льними послідовностями в експресуючій плазміді. Різні рекомбінантні клітини такі як прокаріотиОднак оскільки природні IL-18BP є глікозилочні клітини, наприклад, Е. соІі, або еукаріотичні ваними білками, еукаріотичні хазяїни є більш приклітини, такі як дріжджі або клітини комах, продуйнятними порівняно з прокаріотичними. Більш кують IL-18BP або вірусні IL-18BP. Способи консприйнятні еукаріотичні хазяїни являють собою клітруювання підхожих векторів, що несуть ДНК, які тини ссавців, наприклад людини, мавпи, миші і кодують IL-18BP, та прийнятні для трансформуклітини яєчників китайського хом'яка (СНО), осківання (наприклад, Е. соІі, клітини ссавців та клітильки вони забезпечують пост-трансляційні модини дріжджів) або інфікування клітин комах для тофікації білковим молекулам, які включають правиго, щоб продукувати рекомбінантні IL-18BP або льну укладку, правильне утворення дисульфідних вірусний IL-18BP, добре відомі у цій галузі. Див. зв'язків, а також глікозилування в правильних сайнаприклад, [Ausubel et al., eds. "Current Protocols, тах. Клітини дріжджів і клітини комах також вико1993; та Sambrook et al., eds. "Molecular Cloning: A нують пост-трансляційні модифікації пептидів, Laboratory Manual", 2nd ed., Cold Spring Harbor включаючи високоманозне глікозилування. Press, 1989]. Існує ряд технологій рекомбінантних ДНК, які Для експресії IL-18BP білків або вірусних ILутилізують послідовності сильних промоторів та 18BP, ДНК, що кодують IL-18BP або вірусний ILвисоке число копій плазмід, котрі використовують 18BP, їх фрагменти, мутеїни або рекомбінантні для продукції потрібних білків у клітинах дріжджів і білки, і оперативно приєднані регуляторні фактори клітинах комах. Клітини дріжджів і комах розпізнатранскрипції і трансляції, включають у вектори, що ють лідерні послідовності на клонованих генних здатні інтегрувати необхідні генні послідовності в продуктах ссавців і вибирають зрілий IL-18BP. Пісхромосоми клітини-хазяїна. Щоб вибрати клітини, ля введення вектора, клітини-хазяїни вирощують які стабільно інтегрують введену в їх хромосоми на селективному середовищі, яке вибирають для ДНК, використовують один чи більше маркерів, що вирощування клітин, що містять вектор. Експресія передбачаються відбір клітин-хазяїв, що містять клонованої генної послідовності(ей) приводить до експресуючий вектор. Маркер забезпечує протопродукції IL-18BP, вірусного IL-18BP, рекомбінанттрофію ауксотрофному хазяїну, біоцидну резистених білків або їх мутеїнів чи фрагментів. Зазначені нтність, наприклад до антибіотиків, або резистентспособи клонування, виділення клону, ідентифіканість до важких металів, таких як мідь і подібні. ції, характеристики і секвенування описують більш Селектований ген-маркер або безпосередньо зв'ядокладно далі в Прикладах. зують з ДНК послідовності гена, щоб експресуваЕкспресовані білки потім виділяють і очищати, або вводять в ту саму клітину шляхом коють за допомогою будь-яких узвичаєних методик, трансфекції. Додаткові елементи також необхідні включаючи екстракцію, осадження, хроматоградля оптимального синтезу мРНК одноланцюжковофію, електрофорез чи подібне, або за допомогою го зв'язувального білка. Ці елементи включають афінної хроматографії, використовуючи, наприфактори сплайсинга, а також промотори транскриклад анти-IL-18BP моноклональні антитіла, імобіпції, енхансери і сигнали термінації. лізовані на гелевому матриксі, приміщеному в коНазвану молекулу ДНК, щоб ввести в клітини лонку. Неочищені препарати, що містять названий вибору, більш прийнятно включають в плазмідний рекомбінантний IL-18BP, пропускають через колоабо вірусний вектор, здатний до автономної реплінку, де IL-18BP зв'язується на колонці специфічкації в реципієнті-хазяїні. Більш прийнятні прокаріними антитілами, тоді як домішки проходять. Після отичні плазміди є похідними pBR322. Більш припромивання, білок елююють з гелю за умов, які йнятні еукаріотичні вектори включають в себе BPV звичайно застосовуються з цією метою, тобто при (вірус папіломи великої рогатої худоби). Вірус вісвисокому або низькому рН, наприклад рН 11 повакцини, SV40, 2-мікронний кільцевий вірус, або рН 2. тощо та їх похідні. Такі плазміди і вектори добре Крім того, винахід стосується векторів, які ковідомі у цій галузі (2-5, 22). Якщо вектор або послірисні для експресії IL-18BP або вірусного IL-18BP, довність ДНК, що містить конструкцію, одержують або їх похідних у ссавців, а точніше у людей. Векдля експресії, експресуючий вектор вводять у відтори для короткочасної і довгочасної експресії повідну клітину-хазяїна за допомогою будь-якого з генів у ссавців добре відомі по літературі. Дослічисленних прийнятних способів, таких як трансдження показують, що доставка гена до, наприформація, трансфекція, ліпофекція, кон'югування, клад, скелетного м'язу, гладкого м'язу судин і печіпротопластне злиття, електропорація, осадження нки приводить в результаті до системних рівнів фосфатом кальцію, пряма мікроін'єкція тощо. терапевтичних білків. Скелетний м'яз є зручною Використовувані в цьому винаході клітинимішенню через її велику масу, кровопостачання і хазяїни є або прокаріотичними, або еукаріотичнидоступність. Однак успішно використовують і інші ми. Більш прийнятні прокаріотичні хазяїни вклюмішені і, зокрема кістовомозкові попередники імучають в себе бактерії такі як Е. соІі, Bacillus, нних клітин. Зараз доступні вектори для експресії Streptomyces, Pseudonomas, Salmonella, Serratia білків, наприклад в м'язі, включають плазмідну тощо. Найбільш прийнятні прокаріотичні хазяїни ДНК, ліпосоми, кон'югати білок-ДНК і вектори, на являють собою Е-соІі. Особливо цікаві бактеріальоснові аденовірусу, аденоасоційованого вірусу і 23 75862 24 вірусу герпесу. З них вектори на основі аденоасоних композицій, які містять фармацевтично прийнційованого вірусу (AAV) виявляються найбільш ятний носій і, наприклад вірусний вектор, такий як ефективними щодо тривалості і рівнів експресії будь-який один з названих вірусних векторів на гена і у відношенні безпеки [Kessel, P. D. 1996, основі AAV або інший вектор, які експресують ILProc. Natl. Acad. Sci. USA 93, 14082-14087]. 18ВР або вірусний IL-18BP чи їх мутеїни, фрагмеСпособи конструювання вектора на основі нти або їх рекомбінанті білки і є прийнятними для AAV докладно описують [Snyder et al., 1996, введення людям та іншим ссавцям з метою досягCurrent Protocols in Human Genetics, Chapters нення експресії in vivo IL-18BP або вірусного IL12,1.1-12.1.17, John Wiley & Sons] і цитують в цьо18BP або їх мутеїнів чи фрагментів або рекомбіму патенті. Коротко, плазміду psub201, що містить нантних білків винаходу, тобто для застосування в геном AAV дикого типу розрізають ферментом генній терапії. рестрикції Xba I та зшивають з конструкцією, яка Фармацевтичні композиції винаходу готують складається з ефективного еукаріотичного промодля введення змішуванням IL-18BP або вірусного тору, наприклад цитомегаловірусного промотору, IL-18BP або їх похідних, або векторів, їх експресуKozak погодженої послідовності, послідовності ючих, з фізіологічними прийнятними носіями і/або ДНК, що кодує IL-18BP або вірусний IL-18BP, або стабілізаторами і/або наповнювачами, та готують їх мутеїни, або рекомбінантні білки, чи їх фрагменв дозованій формі, наприклад ліофілізацією в доти, відповідної 3' нетрансльованої області і сигназованих ампулах. Спосіб введення являє собою лу поліаденілування, наприклад сигналу поліадебудь-який з прийнятих способів введення для понілування вірусу мавпи 40. Одержану дібних агентів і залежить від стану, який лікують, рекомбінантну плазміду ко-трансфікують з хелпер наприклад внутрішньовенно, внутрішньом'язово, AAV-плазмідою, наприклад pAAV/Ad, в клітини підшкірно, шляхом локальної ін'єкції або місцевої ссавців, наприклад Т2 93 клітини. Потім культури аплікації, або безперервно шляхом вливань і так інфікують аденовірусом в якості хелпер-вірусу, а далі. Кількість активної сполуки, яку вводять, закультуральні супернатанти збирають через 48-60 лежить від способу введення, захворювання, що годин. Супернатанти фракціонують осадженням лікують, і стану пацієнта. Для локальної ін'єкції, сульфатом амонію, очищають в градієнті щільності наприклад вимагається більш низька кількість білCsCl, діалізують, а потім нагрівають при 56°С, щоб ка на вагу тіла, ніж при внутрішньовенному влизнищити будь-який аденовірус, в той час як одерванні. жаний рекомбінантний AAV, здатний експресувати Відповідно, IL-18BP або вірусні IL-18BP, або IL-18BP або вірусний IL-18BP, або їх мутеїни або вектори, які експресують їх in vivo, показані для рекомбінантні білки, залишається стабільним на лікування аутоімунних захворювань, діабету І типу, цій стадії. ревматоїдного артриту, відторгнення трансплантаДосі не встановлено фізіологічну роль розчинта, запального захворювання кишечнику, сепсису, них рецепторів цитокінів. Розчинні рецептори зв'ярозсіяного склерозу, ішемічної хвороби серця, зують свої специфічні ліганди і в більшості випадвключаючи гострий серцевий напад, ішемічного ків інгібують їх біологічну активність, як показано ураження мозку, хронічного гепатиту, псоріазу, на системі TNF (фактор некрозу пухлини) (11, 12). хронічного і гострого панкреатиту та подібних заВ дуже нечисленних випадках, наприклад IL-6, хворювань, при яких є аберантна експресія IL-18, розчинний рецептор збільшує біологічну активщо веде до надлишку IL-18, або у випадках ускланість. Показано, що рекомбінантний розчинний днень, зумовлених екзогенно введеним IL-18. рецептор TNF, також відомий як ТВР (TNFВинахід також включає антитіла проти IL-18BP зв'язувальний білок), запобігає септичному шоку або вірусного IL-18BP, а також проти їх мутеїнів, на моделях тварин, тоді як виявлено, що розчинні рекомбінантних білків, солей, функціональних поформи рецептора IL-1 справляють повне інгібухідних і активних фракцій. Термін "антитіло" ознавання розвитку in vivo алогенної реактивності у чає включення поліклональних антитіл, монокломишей-реципієнтів алотрансплантату. нальних антитіл (МАТ), химерних антитіл, Аналогічно виявлено, що IL-18BP і вірусний ILангіідіотипових (анти-Id) антитіл до антитіл, які 18BP даного винаходу використовують в якості мітять в розчинній або зв'язаній формі, і гуманізомодуляторів активності IL-18, наприклад при діавані антитіла, а також їх фрагменти, забезпечені беті типу І, сепсисі, аутоімунних захворюваннях, за допомогою будь-яких відомих методів, таких як, при відторгненні трансплантату, ревматоїдному але не обмежених ними, ферментативне розщепартриті, запальному захворюванні кишечнику, сеплення, пептидний синтез або рекомбінантні техносисі, хронічному гепатиті, псоріазі, хронічному гелогії. патиті та гострому гепатиті. Таким чином, їх можна Поліклональні антитіла являють собою гетерозастосовувати, наприклад при будь-якому захвогенні популяції молекул антитіл, одержаних з сирюванні, при якому ендогенна продукція або екзороватки тварин, імунізованих антигеном. Моноклогенне введення IL-18 викликають захворювання нальні антитіла містять по суті гомогенну або погіршення стану пацієнта. популяцію антитіл, специфічних до антигенів, до Крім того, даний винахід стосується фармацеяких популяція містить в основному однакові епівтичних композицій, які містять фармакологічно топ-зв'язувальні ділянки. МАТ одержують у спосоприйнятний носій та IL-18ВР або вірусний IL-18BP би, відомі фахівцям у цій галузі. Див. наприклад, винаходу, або їх активні мутеїни, рекомбінантні [Kohler and Milstein, Nature 256:495-497 (1975); білки і їх солі, функціональні похідні або їх активні Патент США №4376110; Ausubel et al., eds., supra, фракції. Harlow and Lane, Antibodies: A Laboratory Manual, Далі даний винахід стосується фармацевтичCold Spring Harbor Laboratory (1988); і Colligan et 25 75862 26 al., eds., Current Protocols in Immunology, Greene ності. Publishing Assoc. and Wiley Interscience, N. Y., Відповідно, МАТ одержані проти IL-18BP і спо(1992, 1993)], вміст яких наводять в повному обсяріднених білків даного винаходу, використовують, зі шляхом цитування. Такі антитіла можуть налещоб індукувати анти-М-антитіла у відповідних тважати до будь-якого класу імуноглобулінів, включарин таких як BALB/c миші. Клітини селезінки від ючи IgG, IgM, IgE, IgA, GILD і будь-яких їх таких імунізованих мишей застосовують для одепідкласів. Гібридому, що продукує МАТ даного ржання анти-Id гібридом, що секретують анти-Id винаходу, культивують in vitro, in situ або in vivo. МАТ. До того ж, анти-Id МАТ зв'язують з носієм Продукція високих титрів MAT in vivo або in situ таким гемоціанін лімфи слимака (KLH) і застосоробить це зараз більш прийнятним способом одевують для імунізації додаткових BALB/c мишей. ржання. Сироватка від цих мишей містить анти-анти-Id анХимерні антитіла являють собою молекули, рітитіла, які мають зв'язувальні властивості вихіднозні частини яких одержують від різних видів тваго МАТ специфічного відносно епітопу IL-18BP або рин, такі як молекули, що мають варіабельну обепітопів вірусного IL-18BP. ласть, одержану від МАТ миші, і констатну область Анти-Id МАТ, таким чином, мають власні ідіоімуноглобуліну людини. Химерні антитіла використипові епітопи або "ідіотопи" структурно подібні до товують головним чином для відновлення імунооцінюваного епітопу, такому як IL-18BP або вірусгенності при застосуванні і для збільшення виходу ний IL-18BP. при продукції, наприклад, коли МАТ миші мають Термін "гуманізоване антитіло" означає вклюбільш високий вихід з гібридом, але більш висока чення, наприклад антитіл, які одержують маніпуімуногенність у людей, так що застосовують химелюванням з антитілами миші за допомогою спосорні МАТ людина-миша. Химерні антитіла і способи бів генетичної інженерії для того, щоб вони їх одержання відомі у цій галузі. [Cabilly et al., Proc. виявилися більш сумісними з організмом людини. Natl. Acad. Sci. USA 81: 3273-3277 (1984); Morrison Такі гуманізовані антитіла характеризуються зниet al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 женою імуногенністю і покращеною фармакокіне(1984); Boulianne et al., Nature 312: 643-646 (1984); тикою у людей. Їх одержують за допомогою техноCabilly et al., Заявка на Європейський Патент логій, відомих у цій галузі, таких як описують, 125023 (опублікована 14 листопада, 1984); наприклад для гуманізованих анти-TNF антитіл в Neuberger et al., Nature 314: 268-270 (1985); [Molecular Immunology, Vol. 30, Ν 16, 1443-1453, Taniguchi et al., Заявка на Європейський Патент 1993]. 171496 (опублікована 19 лютого, 1985); Morrison et Термін "антитіло" також означає включення al., Заявка на Європейський Патент 173494 (опубобох інтактних молекул, а також їх фрагментів талікована 5 березня, 1986); Neuberger et al., РСТ ких як, наприклад Fab і F(ab')2, що зв'язують антиміжнародна Заявка WO 8601533, (опублікована 13 ген. Фрагменти Fab і F(ab')2, без фрагмента Fc березня, 1986); Kudo et al., Заявка на Європейсьінтактного антитіла, швидше вилучаються з циркукий Патент 184187 (опублікована 11 червня, 1986); ляції і характеризуються меншим неспецифічним Morrison et al., Заявка на Європейський Патент тканинним зв'язуванням, ніж інтактне антитіло 173494 (опублікована 5 березня, 1986); Sahagan et [Wahl et al., J. Nucl. Med. 24: 316-325 (1983)]. Слід al., J. Immunil. 137: 1066-1074 (1986); Robinson et оцінити, що Fab і F(ab')2 та інші фрагменти антиal., Міжнародна Заявка WO 9702671 (опублікована тіл, корисні в даному винаході, використовують 7 травня 1987); Lie et al., Proc. Natl. Acad. Sci. USA для визначення і кількісної оцінки IL-18BP або ві84: 3439-3443 (1987); Sun et al., Proc. Natl. Acad. русного IL-18BP, згідно з способами, наведеними в Sci. USA 84: 214-218 (1987); Better et al., Science описі для інтактних молекул антитіл. Такі фрагме240: 1041-1043 (1988); і Harlow & Lane, Antibodies: нти звичайно одержують шляхом протеолітичного A Laboratory Manual, supra]. Ці посилання вводять розщеплення, використовуючи ферменти такі як в опис в повному обсязі шляхом цитування. папаїн (для одержання фрагментів Fab) або пепАнтиідіотипове (анти-Id) антитіло є антитілом, син (для одержання фрагментів F(ab')2). що розпізнає унікальні детермінанти, звичайно Як зазначено, антитіло є "здатним зв'язувати" асоційовані з ангиген-зв'язувальним сайтом антимолекулу, якщо воно здатне специфічно взаємодітіла. Id-антитіло одержують імунізацією тварини яти з молекулою, щоб внаслідок цього зв'язати того ж виду і генетичного типу (наприклад, лінія молекулу з антитілом. Термін "епітоп" означає, що мишей) в якості джерела МАТ з МАТ, до якого анчастина будь-якої молекули здатна бути зв'язаною ти-Id одержаний. Імунізована тварина розпізнає і антитілом, яка також розпізнається таким антитівідповідає на ідіотипові детермінанти імунізуючого лом. Епітопи або "антигенні детермінанти" звичайантитіла шляхом продукування антитіл до цих ідіоно складаються з хімічно активних поверхневих типових детермінантів (анти-Id-антитіло). Див., груп молекул таких як амінокислоти або бокові наприклад, Патент США №4699880, який наводять ланцюги цукрів, і мають особливі характеристики в описі шляхом цитування. тривимірної структури, а також певні характерисАнти-Іd-антитіло також використовують в якостики заряду. ті "імуногену", щоб викликати імунну відповідь у ще "Антиген" являє собою молекулу або частину іншої тварини, що продукує так зване анти-анти-ldмолекули, здатну бути зв'язаною антитілом, яке антитіло. Анти-анти-Id є ідентичним за епітопом до додатково індукує тварину до продукції антитіла, вихідного МАТ, що індукує анти-Id. Таким чином, здатного зв'язувати епітоп такого антигену. Антишляхом використання антитіл до ідіотипових деген може мати один чи більше епітопів. Зазначена ремінантів МАТ можливо ідентифікувати інші клоспецифічна реакція призначена, щоб вказати, що ни, які експресують антитіла ідентичної специфічантиген взаємодіє у високо вибірний спосіб з йому 27 75862 28 відповідним антитілом і не взаємодіє з множиною зв'язувати антиген або антитіло. Так, конфігурація інших антитіл, які викликаються іншими антигепідкладки або носія є сферичною як шарик, або нами. циліндричною як внутрішня поверхня дослідної Антитіла, включаючи фрагменти антитіл, корипробірки, або як зовнішня поверхня стрижня. Альсні в даному винаході, використовують для кількістернативно, поверхня є плоскою як аркуш, тестного і якісного визначення IL-18BP або вірусного смужка тощо. Більш прийнятні підкладки і носії IL-18BP або споріднених білків у зразку або для включають гранули полістиролу. Фахівцям в цій визначення присутності в клітинах, що експресугалузі відомі численні інші носії для зв'язування ють такі білки даного винаходу. Це здійснюють антитіла або антигену, або вони зможуть встаноімунофлуоресцентними методами, що застосують вити те ж саме шляхом звичайного експериментуфлуоресцентно мічені антитіла (див. нижче), в вання. поєднанні з світловою мікроскопією, проточною Зв'язувальну активність даної партії антитіл цитометрією і флуориметричним визначенням. відповідно до цього винаходу визначають згідно з Антитіла (або їх фрагменти), корисні в даному добре відомими способами. Фахівці у цій галузі винаході, застосовують гістологічно для імунофвстановлюють ефективні і оптимальні умови дослуоресцентної та імуноелектронної мікроскопії, лідження для кожного визначення шляхом звичайдля визначення in situ IL-18BP або вірусного ILного експериментування. 18BP або споріднених білків даного винаходу. ВиІнші стадії, такі як промивання, перемішуванзначення in situ включає взяття гістологічного зраня, струшування, фільтрування і таке інше додазка у пацієнта і забезпечення такого зразка мічеють до дослідження, коли необхідно в певній ситуним антитілом даного винаходу. Більш прийнятно ації. антитілом забезпечують нанесенням або приєдОдним з способів, у який відповідно до цього нанням міченого антитіла (або фрагменту) до біовинаходу антитіло ефективно мітять, є зв'язування логічного зразка. Застосування такого способу антитіла з ферментом і застосування в імуноферзробило можливим визначення не тільки присутментному аналізі (ЕІА). Цей фермент, в свою черності IL-18BP або вірусного IL-18BP або споріднегу, при експозиції з відповідним субстратом, взаєних білків, але також визначення його розподілу в модіє з субстратом з утворенням хімічного досліджуваній тканині. Застосовуючи спосіб данокомпонента, який визначають, наприклад за допого винаходу кожен з фахівців у цій галузі швидко могою спектрофотометричного, флуориметричнопомітить, що будь-який з великої різноманітності го або візуального способів. Ферменти, які викоригістологічних методів (таких як процедури забарвстовують для ефективного мічення антитіл, лення) можна модифікувати для проведення подівключають, але не обмежуються, малатдегідрогебного визначення in situ. назу, стафілококову нуклеазу, дельта-5-стероїдТакий аналіз для IL-18BP або вірусного ILізомеразу, алкогольдегідрогеназу, альфа18BP або споріднених білків даного винаходу звигліцерофосфатдегідрогеназу, триозофосфатизочайно включає в себе інкубацію біологічного зразмеразу, пероксидазу хрону, лужну фосфатазу, ка такого як біологічна рідина, екстракт тканини, аспарагіназу, піранозооксидазу, бетасвіжоодержані клітини такі як лімфоцити або лейгалактозидазу, рибонуклеазу, уреазу, каталазу, коцити або клітини, які інкубують в культурі тканиглюкозо-6-фосфат-дегідрогеназу, глюкоамілазу і ни, в присутності ефективно міченого антитіла, ацетилхолінеестеразу. Визначення здійснюють здатного ідентифікувати IL-18BP або споріднені колориметричними методами, в яких застосовують білки, і визначення антитіла за допомогою будьхромогенний субстрат для ферменту. Визначення якої з ряду технологій, добре відомих у цій галузі. також проводять шляхом візуального порівняння Біологічний зразок обробляють твердофазною міри ензиматичної реакції субстрату порівняно з підкладкою або носієм таким як нітроцелюлоза аналогічно приготованими стандартами. або твердою підкладкою або носієм, які імобілізуВизначення виконують, використовуючи будьють клітини, клітинні частинки або розчинні білки. який з цілого ряду інших імунологічних аналізів. Підкладку або носій потім промивають відповідним Наприклад, радіоактивним міченням антитіл або буфером з подальшою обробкою ефективно мічефрагментів антитіл, визначають IL-18BP або віруним антитілом відповідно до цього винаходу. Твесний IL-18BP шляхом застосування радіоімунного рдофазну підкладку або носій потім промивають аналізу (RIA). Гарний опис RIA є в [Laboratory буфером другий раз, щоб вилучити незв'язані анTechniques and Biochemistry in Molecular Bioloqy, титіла. Кількість зв'язаної мітки на твердій підклаby Work, T. S. et al., North Holland Publishing дці або носії визначають узвичаєними методами. Company, NY (1978) з особливим посиланням на Терміни "твердофазна підкладка", "твердофаглаву, що має назву "An Introduction to зний носій", "тверда підкладка", "твердий носій", Radioimmuno Assay and Related Techniques" by "підкладка" або "носій" означають будь-яку підклаChard, Т.], введену до опису цитуванням. Радіоакдку або носій, здатні зв'язувати антиген або антитивний ізотоп визначають за допомогою таких затіла. Добре відомі підкладки або носії включають собів як застосування гамма-лічильника або сцинскло, полістирол, поліпропілен, поліетилен, дектиляційного лічильника або шляхом стран, найлон амілази, природні і модифіковані авторадіографії. целюлози, поліакриламіди, габро і магнетид. Для Відповідно до цього винаходу антитіло мітять цілей даного винаходу, носій може бути розчинним флуоресцентною сполукою. Коли флуоресцентно деякою мірою або нерозчинним. Матеріал підкладмічене антитіло піддають дії світла, належної довки має будь-яку можливу структурну конфігурацію жини хвилі, його присутність визначають за флуотакої довжини, що сполучена молекула здатна ресценцією. Звичайно найбільш використовувани 29 75862 30 ми сполуками для флуоресцентного мічення є себе одну стадію інкубації, коли антитіло, зв'язане флуоресцеїн ізотіоціанат, родамін, фікоеритрин, з твердою підкладкою або носієм, і мічене антитіло фікоціанін, алофікоціанін, о-фталевий альдегід та - обидва додають до тестованого зразка водночас. флуорескамін. По завершенні інкубації, тверду підкладку і носій Антитіла також ефективно мітять, використопромивають для вилучення залишку рідкого зразка вуючи метали, що емітують флуоресценцію, такі і міченого антитіла, не включеного до комплексу. як 152Еu або інші з серії лантанидів. Ці метали приПрисутність міченого антитіла, асоційованого з єднують до антитіла, використовуючи такі металтвердою підкладкою або носієм, визначають за хелатуючі групи як діетилентриамінпентаоцтова допомогою узвичаєного "прямого" сендвіч-аналізу. кислота (ЕТРА). У "зворотному" аналізі використовують ступінАнтитіло ефективно мітять зв'язуванням його з часте додання спочатку розчину міченого антитіла біотином. Біотиніловане антитіло потім визначадо рідкого зразка, за яким йде додання неміченого ють за допомогою авідину або стрептавідину, приантитіла, зв'язаного з твердою підкладкою або єднаних до флуоресцентної сполуки або ферменносієм, після відповідного періоду інкубації. Після ту, такому як пероксидаза, або до радіоактивного другої інкубації тверду фазу промивають узвичаєізотопу і подібних. ним способом для вилучення залишку досліджуТакож антитіло ефективно мітять, приєднуючи ваного зразка розчину міченого антитіла, що не його до хемілюмінесцентної сполуки. Присутність прореагувало. Визначення міченого антитіла, зв'яхемілюмінесцентноміченого антитіла потім визназаного з твердою підкладкою або носієм, здійснючають, детектуючи люмінесценцію, що виникає в ють як у випадку "одночасного" і "прямого" анаході хімічної реакції. Прикладами особливо корислізів. них люмінесцентно мічених сполук є лумінол, ізоДаний винахід також передбачає молекули лумінол, тероматичний ефір акридину, імідазол, ДНК, які кодують будь-які з білків даного винаходу, сіль акридину і ефір щавлевої кислоти. що описані вище, репліковувані носії експресії, що Подібним чином, біолюмінесцентну сполуку містять будь-які такі молекули ДНК, клітинивикористовують для мічення антитіла даного вихазяїни, трансформовані будь-яким таким експренаходу. Біолюмінесценція являє собою вид хемісуючим носієм, включаючи прокаріотичні і еукаріолюмінесценції, виявленої в біологічних системах, в тичні клітини-хазяїни, більш прийнятно клітини яких каталітичний білок збільшує ефективність СНО. Винахід також включає в себе спосіб для хемілюмінесцентної реакції. Присутність біолюміпродукції експресуючих векторів, що кодують несцентного білка визначають за наявністю люмібудь-який з білків даного винаходу, з метою їх екснесценції. Для мічення важливими біолюмінесценпресії у людей та інших ссавців. тними сполуками є люциферин, люцифераза і У винахід також включають спосіб одержання екворин. будь-якого з білків даного винаходу шляхом кульМолекулу антитіла даного винаходу адаптують тивування трансформованої клітини відповідно до для застосування в кількісному імуноаналізі, також цього винаходу і повернення білка, кодованого відомому як "два-сайти" або "сендвіч-аналіз". В молекулою ДНК, і експресуючого носія в таку тратиповому кількісному імуноаналізі велика кількість нсформовану клітину-хазяїна. немічених антитіл (або фрагменту антитіла) зв'яОкрім використання IL-18BP або вірусного ILзують з твердою підкладкою або носієм і додають 18BP для модулювання активності IL-18, їх також ефективно мічені розчинні антитіла, щоб зробити застосовують для очистки самого IL-18. З цією можливим виявлення і/або кількісний аналіз потметою IL-18BP або вірусний IL-18BP зв'язують з рійного комплексу, утвореного між твердофазним афінною колонкою і пропускають неочищений ILантитілом, антигеном і міченим антитілом. 18. Потім IL-18 витягають з колонки шляхом, наТиповий і більш прийнятний кількісний імуноаприклад елюції при низькому рН. наліз включає "прямий" аналіз, в якому антитіло, Далі винахід ілюструють наведеними нижче зв'язане з твердою фазою, спочатку контактує з необмежувальними прикладами: тестованим зразком, щоб витягти антиген з зразка Приклад 1 шляхом утворення подвійного комплексу твердоВиділення білка, що зв'язує IL-18 фазне антитіло-антиген. Після відповідного періоIL-18 Е. соlі (2,5мг, Peprotech, NJ) приєднують ду інкубації тверду підкладку або носій промивадо Affigel-10 (0,5мл, BioRad), згідно з інструкціями ють для вилучення залишків рідкого зразка, виробника, і упаковують в колонку. Неочищений включаючи антиген, що не прореагував, якщо це білок сечі (сконцентрованої в 1000 разів, 500мл) взагалі вимагається, а потім здійснюють контакт з наносять на колонку при низькій швидкості розчином, що містить невідому кількість мічених 0,25мл/хвилину. Колонку промивають 250мл 0,5Μ антитіл (що функціонує як "репортерна група"). NaCl в фосфатному буферному розчині (PBS). Після другого періоду інкубації, протягом якого Зв'язані білки потім елююють 25мМ лимонної кисмічене антитіло утворює комплекс з антигеном, лоти рН 2,2 і бензамідином (1мМ), негайно нейтзв'язаним з твердою підкладкою або носієм за доралізують 1Μ Nа2СО3. Збирають фракції по 1мл. помогою неміченого антитіла, тверду підкладку Фракції аналізують за допомогою SDS-PAGE і заабо носій промивають другий раз для вилучення барвлення сріблом. Білок, що зв'язує IL-18, елююмічених антитіл, що не прореагували. ється в фракціях 2-8 у вигляді білка 40000 Дальтон В іншому типі імуноаналізу - "сендвіч-аналізі", (Фіг.1). В зоні 40кДа, що відповідає IL-18BP, при який успішно проводять з антигеном даного виназабарвленні сріблом виявляється чіткий жовтий ходу, використовують так звані "одночасний" і колір. Аналізують різні фракції шляхом поперечно"зворотний" аналіз. "Одночасний" аналіз включає в го зв'язування з 125I-IL-18, SDS-PAGE і авторадіо 31 75862 32 графії, як описують в Прикладі 2. Білок, що зв'язує блокувати всі N-кінцеві поліпептиди інші, ніж Pro. У IL-18, виявляють в фракціях 2-8, елюйованих з цей спосіб одержують лише основну послідовколонки з IL-18-агарозою (Фіг.2). ність, як таке: Приклад 2 Поперечне зв'язування афінно-очищеного IL18BP 3 міченим IL-18 Зразки (40мкл) IL-18BP після першої стадії очистки інкубують (70 хвилин при 4°С) з 125I-IL-18 (5000000 cpm - кількість імпульсів на хвилину). Дисукцинімідил суберат (DSS), розчинений в диВ циклах 6, 7, 8 і 11 одержують низький рівень метилсульфоксиді (Ме2SО, 20мМ) , додають до сигналу Thr. Через цей низький рівень його розгзалишкової концентрації 2мМ і суміш залишають лядають більш обережно, щоб не позначити даний протягом 20 хвилин при 4°С. Реакцію зупиняють амінокислотний залишок в названих циклах. доданням 1 трис-НСI, рН 7,5, і 1Μ NaCl до залишОдержана послідовність значно відрізняється кової концентрації 100мМ. Додають зразок буфевід послідовності будь-якого іншого відомого білка, ру, що містить дитіотрейтол (DTT, 25мМ кінцева) і що встановлено дослідженням баз даних за струксуміші аналізують в SDS-PAGE (7,5% акриламід) з турою білка. Однак дослідження бази даних TIGR подальшою авторадіографією (Фіг.2). за допомогою tbiastn програми дослідження забезОсобливу зону з молекулярною масою 58кДа, печило файл кДНК, позначений ТНС12801, відкрияка ймовірно містить білок ~40кДа поперечнота рамка зчитування (218 кодон) якого, коли тран125 зв'язаний з I-IL-18 ~20кДа, виявляють в фракціслюється, містить послідовність високо ях, елюйованих з IL-18- афінної колонки (Доріжки 2 гомологічну N-кінцевій послідовності IL-18ВР. Цим і 3), але не в промивній рідині з колонки (Доріжка подана гомологія: 1), що містить всі інші неочищені білки сечі. Приклад 3 Аналіз послідовності білка Елюйовані фракції з афінної колонки Прикладу 1 поділяють за допомогою SDS-PAGE (10% акри(Верхня послідовність (1-40) являє собою посламід) за невідновлювальних умов, електроблотилідовність IL-18ВР, виділеного згідно з винаходом; нгу на PVDF мембрані (Pro-Blot, Applied нижня послідовність (51-100) одержана трансляціBiosystems, USA). Мембрану забарвлюють кумасі єю кДНК з файлу ТНС123801 TIGR). блакитним, вирізають зону ~40кДа і проводять Гадана білкова послідовність, одержана трананаліз білкової послідовності за допомогою мікрослюванням файлу ТНС12801, викликає сумніви секвенатора Precise (Applied Biosystems, USA.). щодо залишків 2 і 4 IL-18ВР. Вона підтверджує Одержано таку основну послідовність: ідентичність амінокислотних залишків 6, 7 і 8 IL18BP як Thr і, по-видимому, підходить також для залишку 11. Приклад 4 IL-18BP є глікопротеїном Аліквоту (0,3мл) елюйованих фракцій Прикладе x являє собою ще не встановлені амінокисду 1 очищають далі гель-хроматографією на кололоти. Крім того, одержано мінорну послідовність: нці Superose 12 (1 30см, Pharmacia, Sweden). Колонку попередньо врівноважують і елююють фосфатним буферним розчином і азидом натрію (0,02%) при швидкості потоку 0,5мл/хвилину і збирають фракції по 1мл. Білок, що зв'язує IL-18, Через цю подвійну послідовність неможливо елююється в фракціях 20-25 як білок ~40000 Дальодержати дані відносно більш довгої послідовностон, що встановлюють методом SDS-PAGE і забаті. Мінорну послідовність ідентифікують як фрагрвленням сріблом. Зразок, що містить білок мент дефенсину людини (№ доступу р11398), по~40000 Дальтон (фракція 23, 50мкл, 50нг білка) чинаючи з 65 амінокислоти дефенсину. Основну взаємодіє з N-глікозидазою F (PNG-ase F, BioRad) послідовність не зв'язують з жодним відомим білзгідно з інструкцією. Коротко, аліквоту денатуруком, грунтуючись на дослідженнях всіх доступних ють кип'ятінням в присутності 5% SDS протягом 10 баз даних в NCBI і TIGR за допомогою blastp і хвилин, 10 07 буферу (2,5мкл), 10% NP-40 tbiastn програм дослідження. (2,5мкл) і PNGase F (1мкл), 1 година при 37°С. Для того, щоб одержати більш довгу і більш Зразок аналізують методом SDS-PAGE (10% акточну послідовність і для того, щоб ідентифікувати риламід) за невідновлювальних умов і порівнюють передбачувані залишки цистеїну, іншу аліквоту з негідролізованим IL-18BP з такої ж фракції з фракції, елюйованої з колонки IL-18-агарози, відSuperose 12. Показано, що зона 40кДа IL-18BP новлюють DTT в 6Μ гуанідині НСl, проводять реазникає з фракції, обробленої PNGase. Виявляють кцію з 4-вінілпіридином, знесолюють за допомогою нові зони, які відповідають 30кДа (навіть вище зомікроультрафільтраційного пристрою (Ultrafree, ни PNGase) і 20кДа. Зникнення зони 40кДа вказує, cutoff 10000 Daltons, Millipore) і проводять визнащо ця зона є N-глікозилованим білком. чення первинної структури короткого фрагменту Приклад 5 молекули білка. Після циклу №1 секвенування, Блокування біологічної активності IL-18 за дофільтер взаємодіє з о-фталевим альдегідом, щоб помогою IL-18BP 33 75862 34 Здатність IL-18BP, виділеного з сечі, блокувахвилини) і елонгації (70°С, 1 хвилина). Одержані ти активність IL-18 визначають шляхом вимірюпродукти PCR поділяють методом електрофорезу в агарозному гелі (1%), елююють і клонують з вання індукованої IL-18 продукції IFN- в мононукpGEM-Teasy ТА вектором клонування (Promega). леарних клітинах. IL-18 індукує IFN- , якщо ДНК з індивідуальних клонів секвенують з Т7 і SP6 додають разом або з низькими концентраціями праймерами. LPS, IL-12, IL-2, або з іншими стимуляторами. АкОдержаний фрагмент 477 пар основ мітять 32Ρ тивність IL-18 тестують в спленоцитах миші, в мошляхом рендом-праймування. Цей зонд викориснонуклеарних клітинах периферійної крові (РВМС) товують для скринінга різних кДНК людини і генолюдини і в лінії KG-1 клітин людини. Клітини селемних бібліотек. Подвійні нітроцелюлозні фільтри зінки одержують від здорових мишей, промивають, піддають гібридизації з зондом при 60°С в буфері, суспендують в середовищі RPMI 1640, доповнещо містить 6 x SSC, 10х розчин Денхардта, 0,1% ному 10% фетальною бичачою сироваткою при SDS і 100мкг/мл ДНК сперми лосося. Фільтри про5 10б клітин/мл. 1,0мл культури стимулюють LPS мивають і витримують протягом ночі при -80°С на (або 0,5 або 1мкг/мл) разом з рекомбінантним ILплівці Kodak XAR. Подвійні позитивні клони очи18 людини або миші (або 0,5 або 5нг/мл). IL-18щають з колоній. Плазміди вирізаються з лямбдазв'язувальний білок людини (0/5 або 50нг/мл) дорСЕУ9 клонів і плазміди самолігуються. кДНК з дають до рекомбінантного IL-18 перед доданням інших бібліотек виділяють згідно з інструкціями до клітин селезінки. Після культивування протягом авторів. Автоматизований аналіз послідовності 24 годин, клітини селезінки піддають трьом циклам ДНК з виділених клонів проводять на секвенаторах заморожування (-70°С) і танення (кімнатна темпемоделей 373А і 377 (Applied Biosystems), викорисратура), клітинний дебріс вилучають центрифугутовуючи смисловий і антисмисловий праймери. ванням, а супернатант аналізують щодо IFN- , Використовують стандартні протоколи для цих використовуючи ELISA-набори для IFN- миші процедур копіювання (33). (Endogen). Як показують на Фіг.3А, IL-18ВР блокує Проведено скринінг таких бібліотек: бібліотека активність huIL-18 (людини) в спленоцитах миші у кДНК моноцитів людини, сконструйована в лямбдоза-залежний спосіб. На відміну від цього, викода-рСЕУ9 векторі клонування (15), люб'язно надаристовуваний в якості контролю розчинний рецепна Т. Мікі бібліотека кДНК юркатних лейкозних Ттор інтерферона- / не справляє ніякої дії. Аналоклітин людини, бібліотека кДНК лейкоцитів перигічно, IL-18Bp людини інгібує активність ферійної крові людини, всі від Clontech (Palo рекомбінантного IL-18 миші, дозволяючи припусAlto90%, є поріІнша кДНК IL-18BPb 1т.п.н. кодує зрілий білок з внянною з концентрацією самого IL-18, дозволяю85 амінокислотних залишків (SEQ ID NO: 4). Третій чи припустити високу спорідненість взаємодії між варіант, IL-18ВРс, представляється 2,3т.п.н. кДНК, цими двома білками. що кодує зрілий IL-18ВР з 169 амінокислотних заПриклад 6 лишків (SEQ ID NO: 6). Четвертий варіант, BLВиділення клонів кДНК, що кодують IL-18BP 18BPd, кодує зрілий IL-18BP з 133 амінокислотних Тотальна РНК з юркатних Т-клітин (CRL 8163, залишків (SEQ ID NO: 8). Внутрішньоекзонний American Type Culture Collection) зворотносплайсинг відбувається у двох сайтах вздовж протранскрибована з Superscript Rnase Η зворотною мРНК. Ці явища і додатковий 5' екзон в IL-18BPa транскриптазою (Gibco-BRL) і довільними праймеприводять до 3 різних 5' UTRs в різних клонах рами (Promega, Madison WI). Потім одержані фракДНК. Тому цілком можливо, що різні варіанти ILгменти кДНК ампліфікують шляхом PCR, викорис18BP утворюються у відповідь на певні сигнали товуючи Tag-ДНК полімеразу (Sigma) і праймери, регулювання транскрипції. що відповідають нуклеотидам 24-44 (смисловий) і Досі не виявлено жодної кДНК, що кодує ре500-481 (зворотний) клону ТНС12801 TIGR. Ампцептор з трансмембранним доменом. ліфікацію проводять в 30 циклах відпалу (55°С, 2 Приклад 7 35 75862 36 Конструкція експресуючого вектора ссавців, Результати різних біодосліджень, а також анапродукція реком-бінантного IL-18BP і оцінка біололіз зміни рухливості (Приклад 8) показують, що гічних активностей рекомбінантного IL-18BP інгібування активності IL-18 є властивістю, притаКодуючу область кДНК IL-18BPa ампліфікують манною клонованому IL-18BP, а не властивістю шляхом PCR з смисловим праймером супутніх домішок в IL-18BP сечі, таких як фрагмент дефенсину, що ко-елююється. Приклад 8 Аналіз зміни електрофоретичної рухливості та зворотним праймером: Вивчають вплив сечового і рекомбінантного IL18BP на індуковану IL-18 активацію NF-kB в KG-1 клітинах людини. KG-1 клітини людини (4 106 в Продукти PCR вирізають за допомогою Хbа 1 1мл RMPI) стимулюють або huIL-18 (людини) та клонують в сайті Xba I pEF-BOS експресуючого (10нг/мл), або huIL-18, попередньо змішаним з ILвектора (25), щоб одержати pEF-BOS-IL-18BPa. 18ВР (20 хвилин, кімнатна температура). Після 20 Конструкції підтверджують секвенуванням ДНК. хвилин при 37°С, клітини три рази промивають Серії 6 107 COS7 клітин в 1,4мл TD-буферу, охолодженим льодом PBS і негайно заморожують що містить плазмідну ДНК pEF-BOS-IL-18BPa в рідкому азоті. Клітинні осади повторно суспен(10мкг) і ДЕАЕ-декстран (120мкг), інкубують протядують в трикратному пакувальному колонковому гом 30 хвилин при кімнатній температурі, як опиоб'ємі буферу А (20мМ трис рН 7,6, 0,4Μ NaCI, сують (35). Клітини потім промивають ДМЕМ-10% 0,2мМ EDTA, гліцерин (20% за об'ємом), 1,5мМ фетальна бичача сироватка, культивують протяМgСl2, 2мМ дититрейтол (DDT), 0,4мМ PMSF, 1мМ гом 4 годин в ДМЕМ-10, промивають та інкубують Na3VO4 2мкг/мл кожного з лейпептину, пепстагіну і протягом 3-5 днів в безсироватковому середовищі апротиніну). Клітинний дебріс вилучають центриДМЕМ. Культуральне середовище збирають, конфугуванням (15000 x g, 15 хвилин), аліквоти супецентрують в 6 разів ультрафільтруванням (10 kD рнатанту заморожують в рідкому азоті і зберігають cutoff) і виділяють IL-18BP-HiS6 на колонці Talon при -80 °С. Концентрацію білка визначають за ме(Clontech) з імідазолом в якості елюенту згідно з тодом Бредфорда (Bio-Rad), використовуючи биінструкцією авторів. чачий сироватковий альбумін в якості стандарту. Імунологічну перехресну реактивність сечовоДволанцюжковий олігонуклеотид, який відповідає го і COS7-експресованого IL-18BP оцінюють так: елементу, що зв'язує NF-kB (10пмол, Promega) , IL-18BP сечі (5мкг) мітять 125І у спосіб з хлорамімітять [32P]dCTP (300Ки/ммол) і Τ4 полінуклеотидном Т. Супернатанти COS7 клітин (250мкл) змішукіназою (New England Biolabs). Вільні нуклеотиди ють (1 година, кімнатна температура) з антитілами вилучають центрифугуванням з нанесенням предо IL-18BP сечі, розбавляють 1:1000 в забуферепарату на спін-колонку. Екстракти (10мкг білка) ному фосфатом розчині (PBS), 0,05% твіні 20 і клітин, оброблені IL-18 або IL-18+IL-18BP, інкубу0,5% бичачому сироватковому альбуміні (Wash ють (15 хвилин, кімнатна температура) з міченим Buffer). Потім додають IL-18BP сечі (106 імпульсів зондом (3 104 імпульсів на хвилину) разом з полі на хвилину) і через 1 годину додають білок-GdI.dC (500нг, Pharmacia) і денатурованою ДНК sepharose (20мкл). Суміш суспендують (1,5 години, сперми лосося (100нг, Sigma) в 20мкл буферу, що 4°С), потім гранули ізолюють і промивають 3х містить HEPES (рН 7,5, 10мМ), 60мМ КСl, 1мМ Wash Buffer і раз в PBS. Гранули елююють буфеМgСl2, 2мМ EDTA, 1мМ DTT і гліцерин (5% за ром для зразка, поділяють методом SDS-PAGE об'ємом). Потім суміші наносять на 5% неденату(10% акриламід) у відновлювальних умовах з поруючі поліакриламідні гелі. Електрофорез проводальшою авторадіографією. дять при 185Вт в 0,5 x ТВЕ (40мМ трис НСl, 45мМ IL-18BPa рухається у вигляді однієї зони на борної кислоти і 2,5мМ EDTA). Гелі висушують під SDS-PAGE з забарвленням сріблом за відновлювакуумом і проводять авторадіографію всю ніч при вальних і невідновлювальних умов та має таку ж -80°С. Виявлено, що IL-18 індукує утворення гомоуявну молекулярну масу, як маса IL-18BP сечі (дадимеру р50 NF-kB і гетеродимеру р65/р50 NF-kB. ні не наведено). При аналізі послідовності білка Сечовий, а також рекомбінантний IL-18BP інгібує цього препарату виявляють таку ж N-кінцеву посактивацію NF-kB, викликану IL-18, що встановлюлідовність як послідовність IL-18BP сечі, вказуючи, ють за аналізом зміни електрофоретичної рухлищо останній не деградується на N-кінці. вості з екстрактами KG-1 клітин, що зв'язують раІмуноблотинговий аналіз IL-18BP з антитілами, діоактивний олігонуклеотид, який відповідає одержаними проти IL-18BP сечі, виявляє зону з погодженій послідовності NF-kB. такою ж молекулярною масою як маса білка сечі. Приклад 9 Крім того, використовуючи імунопреципітацію з Експресія IL-18BP в Ε. coli, клітинах дріжджів і подальшими SDS-PAGE і авторадіографією, покакомах зують, що IL-19BPa здатний витісняти 125I-IL-18BP IL-18BP також продукується іншими рекомбісечі з комплексу з антитілами. Тому, IL-18BPa нантними клітинами, такими як прокаріотичні кліструктурно відповідає IL-18ВР сечі. тини, наприклад Е. coli, або іншими еукаріотичниДосліджують здатність неочищеного і очищеми клітинами, такими як клітини дріжджів і комах. ного IL-18BPa інгібувати біологічну активність ILЄ добре відомі способи для конструювання відпо18. IL-18BPa інгібує у доза-залежний спосіб індукувідних векторів, що несуть ДНК, які кодують будьвальну IFN- активність IL-18 людини і миші в який IL-18ВР, і придатні для трансформування Е. спленоцитах миші, РВМС та в лінії KG-1 клітин coli і клітин дріжджів, або інфікування клітин комах людини (Фіг.9). для того, щоб продукувати рекомбінантний IL 37 75862 38 18BP. Для експресії в клітинах дріжджів, ДНК, що шляхом PCR з відповідно сконструйованими кодує IL-18BP (Приклад 6) вирізають і вставляють праймерами. Аналогічно розщепляють мутантний в експресуючі вектори, підхожі для трансфекції pRKCD42Fcl, щоб утворити великий фрагмент, що клітин дріжджів. Для експресії в клітинах комах, містить плазміду і послідовності IgGl. Потім два ДНК, що кодує IL-18BP, вставляють в бакуловірус, фрагменти лігують з утворенням нової плазміди, а клітини комах інфікують названим вище рекомбіяка кодує поліпептидний попередник, що складанантним бакуловірусом. Для експресії в Е. coli, ється з IL-18BP і приблизно 227 С-кінцевих аміноДНК, що кодує IL-18BP, піддають сайтспрямовакислот IgGl (область петлі і СН2 та СН3 домени). ному мутагенезу з відповідними олігонуклеотидаДНК, що кодує рекомбінантні білки, виділяють з ми для того, щоб ATG кодон ініціації вставити саплазміди шляхом рестрикції відповідними фермеме до першого кодона зрілого IL-18BP. нтами рестрикції, а потім вводять в ефективні проАльтернативно, таку ДНК одержують шляхом PCR каріотичні і еукаріотичні експресуючі вектори. з відповідними смисловим і антисмисловим прайПриклад 12 мерами. Одержані ДНК-конструкції потім вводять в Одержання хімічно модифікованих IL-18BP прокаріотичні експресуючі вектори, відповідно скоДля збільшення періоду напів-життя IL-18BP в нструйовані з використанням технологій, добре плазмі, одержують IL-18BP, які хімічно модифікувідомих на даному рівні техніки (23). ють поліетиленгліколем (PEG). Модифікацію здійПриклад 10 снюють поперечним зшиванням PEG з залишком Конструкція експресуючого вектора, асоційоцистеїну молекули IL-18BP. Конструюють мутантні ваного з аденовірусом, для експресії IL-18BPa in IL-18ВР, що містять додатковий залишок цистеїну vivo на амінокінцях, в ділянках глікозилування та на Функціональний ген, що кодує IL-18BPa, конскарбоксильних кінцях кожного IL-18BP. Мутагенез труюють на основі плазмідної pcDNA3 (Invitrogen, здійснюють методом PCR, використовуючи олігоSan Diego CA). кДНК IL-18BP з Kozak-погодженою нуклеотиди, що містять потрібну мутацію. Ці мутапослідовністю на 5' кінці зшивають в сайті Xba нтні білки експресують у звичайний спосіб, добре pcDNA3 у спосіб, що руйнує сайт рестрикції. Нові відомий в цій галузі. Проводять pegylation цих білXba 1 сайти вставляють шляхом сайтків і визначають активність. спрямованого мутагенезу до неоміцинової касети Приклад 13 (основа 2151 вихідної послідовності pcDNA3) і пісОдержання поліклональних антитіл до IL-18BP ля сигналу поаденілування SV40 (основа 3372 Кроликам спочатку вводять підшкірно 5мкг чивихідної послідовності pcDNA3). Цю конструкцію стого препарату IL-18BP сечі, емульгованого в вирізають шляхом Xbal і одержаний 4,7т.п.н. мініповний ад'ювант Фрейнда. Через три тижні їм зноген вставляють в Xbal-сайт плазмідної psub201, як ву вводять підшкірно 5мкг препарату IL-18BP в описують [Snyder et al., 1996, Current Protocols in неповному ад'юванті Фрейнда. Дві додаткові ін'єкHuman Genetics, Chapters 12.1.1-12.1.17, John ції IL-18BP, розчиненого в PBS, проводять з 10Wiley & Sons]. Одержану рекомбінантну плазміду денними інтервалами. У кроликів забирають кров ко-трансфікують з хелпер AAV плазмідою pAAV/Ad через 10 днів після останньої імунізації. Зростання в Т293 клітини людини. Культури потім інфікують рівня антитіл визначають за допомогою радіоімуаденовірусом в якості хелпер-вірусу і клітини збиноаналізу. 125І-мічений IL-18BP (166000 імпульсів рають після 48-60 годин інкубації. Клітини піддана хвилину) змішують з різними розведеннями ють 3 циклам заморожування-танення, клітинний (1:50, 1:500, 1:5000 і 1:50000) сироватки кролика. дебріс вилучають центрифугуванням, а супернаСуспензію гранул білок-G-агарози (20мкл, тант насичують суфатом амонію 33% насичення. Pharmacia) додають в загальному об'ємі 200мкл. Потім суміш центрифугують, a rAAV осаджують з Суміш залишають протягом 1 години при кімнатній супернатанту сульфатом амонію при 50% наситемпературі, потім гранули промивають 3 рази і чення. Далі вірус очищають за допомогою CsCl, рахують зв'язану радіоактивність. Антисироватку діалізують і нарешті нагрівають протягом 15 хвикролика до лептину людини використовують в яколин при 56°С, щоб знищити будь-який вірус. сті негативного контролю. Титр IL-18BP- антисироПриклад 11 ватки виявляється між 1:500 і 1:5000, у той час як Конструкція рекомбінатних білків злиття ILнегативний контроль менший від 1:50. 18BP Приклад 14 Одержання білків, що містять IL-18BP, злитих Одержання моноклональних антитіл до ILз константною областю важкого ланцюга IgG2, 18BP проводять так: ДНК IL-18BP піддають сайтспрямоСамицям Balb/C мишей (у віці 3 місяців) ввованному мутагенезу з відповідними олігонуклеотидять спочатку 2мкг очищеного IL-18BP в емульсії дами для того, щоб ввести унікальний сайт рестповного ад'юванту Фрейнда, а через три тижні пірикції безпосередньо перед і після кодуючих дшкірно в неповному ад'юванті Фрейнда. Три допослідовностей. Плазміду, що несе константну даткові ін'єкції роблять з 10-денними інтервалами область важкого ланцюга IgG2, наприклад підшкірно в PBS. Кінцеві бустер-ін'єкції здійснюють pRKC042Fcl (6), піддають подібному сайтспрямовнутрішньочеревно за 4 і 3 дні до злиття мишам, ванному мутагенезу, щоб ввести той самий унікаякі показують найвищий тирт зв'язування, що вильний сайт рестрикції у спосіб, що допускає трансзначають шляхом IRIA (див. нижче). Злиття проляцію в фазі злитого білка. Фрагмент dsDNA, що водять, використовуючи NSO/1 лінію клітин меласкладається з 5'нетранслованих послідовностей і номи і лімфоцити, одержані як з селезінки, так і з кодує IL-18BP, одержують шляхом розщеплення в лімфатичних вузлів тварин, в якості клітин, що унікальних сайтах рестрикції або, альтернативно, зливаються. Злиті клітини розподіляють в багато 39 75862 40 лункові планшети для мікрокультури і гібридоми розбавляють блокуючим розчином і додають в селектують в ДМЕМ, доповненим HAT і 15% сиролунки (100мкл/лунку) протягом 4 годин при 37°С. ваткою коня. Гібридоми, котрі, як виявлено, продуПотім планшети 3 рази промивають PBS, що міскують антитіла до IL-18BP, субклонують за метотить твін 20 (0,05%) з подальшим доданням антидом лімітуючих розведень і вводять Balb/C мишам, ІL-18ВР сироватки кролика (1:1000, 100мкл/лунку) яким введений пристан для утворення асциту. для подальшої інкубації протягом ночі при 4°С. Ізотипи антитіл визначають, використовуючи коПланшети промивають 3 рази і додають кон'югат мерційно доступний EUSA-набір (Amersham, UK). пероксидази хріну з антитілами кози до антитіл Скринінг гібридом, що продукують анти-ІLкролика (HRP, Jackson Labs, 1:10000, 18ВР моноклональні антитіла, проводять так: Гіб100мкл/лунку) протягом 2 годин при кімнатній темридомні супернатанти тестують щодо присутності пературі. Планшети промивають 4 рази, а забарванти-ІL-18ВР антитіл за допомогою інвертного лення проявляють з використанням ABTS (2,2'твердофазного радіоімуноаналізу (IRIA). ELISAазино-біс(3-етилбензтіа-золін-6-сульфокислоти, планшети (Dynatech Laboratories, Alexandria, VA) Sigma) з Н2О2 в якості субстрату. Планшети зчипокривають Talon-очищеним IL-18BPa-His6 тують за допомогою автоматичного апарату для (10мкг/мл, 100мкл/лунку). Після інкубації протягом зчитування планшетів. ночі при 4°С, планшети промивають двічі PBS, що Приклад 17 містять BSA (бичачий сироватковий альбумін) Неглікозилований IL-18BP людини біологічно (0,5%) і твін-20 (0,05%) та блокують промивальним активний розчином протягом принаймні 2 годин при 37°С. Досліджують здатність очищеного рекомбінанДодають гібридомні культуральні супернатанти тного IL-18BPa інгібувати біологічну активність IL(100мкл/лунку) і планшети інкубують протягом 4 18. IL-18BPa інгібує у доза-залежний спосіб індугодин при 37°С. Планшети промивають 3 рази, та куючу IFN- активність IL-18 людини і миші в спледодають кон'югат пероксидази хріну з антитілами ноцитах миші, РВМС та лінії KG-1 клітин людини кози до антитіл миші (HRP, Jackson Labs, 1:10000, (Фіг.9). 100мкл/лунку) протягом 2 годин при кімнатній темОчищений IL-18BPa, що має His6 tag на С-кінці пературі. Планшети промивають 4 рази, а забарв(1,5мкг, 50мкл) приводять до рН 7,5 та змішують з лення проявляють шляхом ABTS (2,2-азино-біс(3N-глікозидазою F (3мкл, 500000 U/мл PNGase F, етилбензтіазолін-6-сульфокислота, Sigma) з Н2О2 New England Biolabs). Суміш інкубують протягом в якості субстрату. Планшети зчитують за допомо24 годин при 37° за невідновлювальних умов. Алігою автоматичного ELISA-планшет-рідера. Зразки, квоти з зразка і з негідролізованного IL-18BP-His6 що дають OD, яке принаймні в 5 раз вище, ніж аналізують шляхом SDS-PAGE за невідновлювавеличина негативного контролю, вважають позильних умов з подальшим імуноблотингом з антитітивними. лами до IL-18BP. Виявляють, що зона 40кДа ILПриклад 15 18BP-His6 зникає в PNGase- обробленої фракції, і Афінна хроматографія IL-18BP з моноклонавиявляють нову зону 20кДа. Молекулярна маса льними антитілами продукту і специфічність PNGase F вказують, що Антитіла проти IL-18BP використовують для IL-18BP-H1S6 є повністю деглікозилованим. очистки IL-18ВР за допомогою афінної хроматогPNGase-оброблені фракції, негідролізований рафії. Секретовану гібридомою асцитну рідину, що IL-18BP-His6 і контрольний зразок, що містить містить моноклональні антитіла, очищають осаPNGase в буфері, нарізно адсорбують на Talonдженням суфатом амонію при 50% насичення з гранулах, промивають фосфатним буфером та подальшим екстенсивним діалізом проти PBS. елююють імідазолом (100мМ). Елюйовані фракції Приблизно 10мг імуноглобулінів зв'язують з 1мл піддають біоаналізу, використовуючи IL-18 людини Affigel 10 (Bio Rad USA), як рекомендує виробник. (20нг/мл), LPS (2мкг/мл) та спеноцити миші. Ре250мл білків сечі людини (еквівалентних 250л зультати наведені у таблиці нижче: неочищеної сечі) наносять на 0,5мл колонку з анти-ІL-18ВР-антитілами при 4°С при швидкості поЗразок IFN- (нг/мл) току 0,25мл/хвилину. Колонку промивають PBS, аж Контроль 7,5 доки не перестане визначатися білок в промивній Негідролізований IL-18BP-His6 0 рідині. IL-18BP елююють 25мМ буфером лимонної Оброблений PNGase IL-18BP-His6 0 кислоти, рН 2,2, (8 1 колонка, об'єм фракцій) і негайно нейтралізують 1Μ Nа2СО3. Подальшу очистЗроблено висновок, що деглікозилований ILку цього препарату здійснюють за допомогою гель18BP біологічно активний як модулятор активності фільтрації. IL-18. Приклад 16 Наведений вище опис окремих напрямків виELISA-тест (метод твердофазного імуноферявляє основну суть винаходу так, що інші, застоментного аналізу) совуючи сучасні знання, легко модифікують і/або Титраційні мікропланшети (Dynatech or пристосують для різних застосувань такі конкретні Maxisorb, by Nunc) покривають анти-ІL-18ВР мононапрямки без відступу від основних уявлень і тому клональними антитілами (безсироватковий гібритакі пристосування і модифікації повинні бути та домний супернатант або імуноглобуліни асцитної призначені для включення до значень та галузі рідини) протягом ночі при 4°С. Планшети промиеквівалентів описаних напрямків. Зрозуміло, що вають PBS, що містить BSA (0,5% та твін 20 фразеологія і термінологія служать для опису, а не (0,05%) та блокують тим самим розчином протяобмеження. гом принаймні 2 годин при 37°С. Тестовані зразки 41 75862 42 References factor on the activation of Thl but not Th2 cells and 1. Anderson, D.M., et al., A homologue of the TNF exerts its effect independently of IL-12. J. Immunol. receptor and its Ugand enhance T-cell growth and 158:1541-1550. dendritic-cell function. Nature, 1997. 390(6656): 21. Maliszewski, C. R., T. A. Sato, T. Vanden Bos, S. p.175-179. Waugh, S. K. Dower, J. Slack, M. P. Beckmann, and 2. Bollon, D. P., et al. (1980) J. Clin. Hematol. Oncol. K. H. Grabs-tein. 1990. Cytokine receptors and В cell 10:39-48. functions. I. Recombinant soluble receptors 3. Botstein, D., et al. (1982) Miami Wint. Symp. specifically inhibit IL-1- and IL-4-induced В cell 19:265-274. activities in vitro. J. Immunol. 144:3028-3033. 4. Broach, J. R., in "The Molecular Biology of the 22. Maniatis, Т., in "Cell Biology: A Comprehensive Yeast Saccharomyces: Life Cycle and Inheritance", Treatise, Vol.3: Gene Expression", Academic Press, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, pp.563-608 (1980). NY, pp.445-470 (1981). 23. Maniatis et. al., Molecular Cloning: A Laboratory 5. Broach, J. R., (1982) Cell 28:203-2-04. Manual, Cold Spring Harbor Laboratory, New York, 6. Byrn R. A. et al., 1990, Nature (London) 344:6671982. 670. 24. Micallef, M. J., T. Ohtsuki, K. Kohno, F. Tanabe, 7. Car, B. D., V. M. Eng, B. Schnyder, L. Ozmen, S. S. Ushio, M. Namba, T. Tanimoto, K. Torigoe, M. Huang, P. Gallay, D. Heumann, M. Aguet, and B. Fujii, M. Ikeda, S. Fukuda, and M. Kurimoto. 1996. Ryffel. 1994. Interferon gamma receptor deficient Interferon-gamma-inducing factor enhances Τ helper mice are resistant to endotoxic shock. J. Exp. Med. 1 cytokine production by stimulated human Τ cells: 179:1437-44 issn: 0022-1007. synergism with interleukin-12 for interferon-gamma 8. Chater, K. F. et al., in "Sixth International production. Eur-J-Iimunol 26:1647-51 issn: 0014Symposium on Actinomycetales Biology", Akademiai 2980. Kaido, Budapest, Hungary (1986), pp.45-54. 25. Mizushima, S. and Nagata, S. (1990) pEF-BOS, a 9. Conti, В., J. W. Jahng, С Tinti, J. H. Son, and Т. Н. powerful mammalian expression vector. Nucleic Acid Joh. 1997. Induction of interferon-gamma inducing Res. 18:5322-532 8. factor in the adrenal cortex. J. Biol. Chem. 272:203526. Nakamura, K., H. Okamura, K. Nagata, T. 2037. Komatsu, and T. Tamura. 1993. Purification of a 10. Dao, Т., К. Ohashi, Т. Kayano, Μ. Kurimoto, and factor which provides a costimulatory signal for H. Okamura. 1996. Interferon-gamma-inducing factor, gamma interferon production. Infect-Immun 61:64-70 a novel cytokine, enhances Fas ligand-mediated issn: 0019-9567. cytotoxicity of murine Τ helper 1 cells. Cell-Immunol. 27. Nakamura, K., H. Okamura, M. Wada, K. Nagata, 173:230-5 issn: 0008-8749. and T. Tamura. 1989. Endotoxin-induced serum 11. Engelmann, H., D. Aderka, M. Rubinstein, D. factor that stimulates gamma interferon production. Rotman, and D. Walhsch. 198 9. A tumor necrosis Infect-Immun 57:590-5 issn: 0019-9567. factor-binding protein purified to homogeneity from 28. Novick, D., B. Cohen, and M. Rubinstein. 1994. human urine protects cells from tumor necrosis factor The Human Interferon alpha/beta Receptor toxicity. J. Biol. Chem. 264:11974-11980. Characterization and Molecular Cloning. Cell 12. Engelmann, H., D. Novick, and D. Wallach. 1990. 77:391-400. Two tumor necrosis factor-binding proteins purified 29. Novick, D., B. Cohen, and M. "Rubinstein. 1992. from human urine. Evidence for immunological crossSoluble Interferon-alpha Receptor Molecules Are reactivity with cell surface tumor necrosis factor Present in Body Fluids. FEBS Lett 314:445-448. receptors. J. Biol. Chem. 265: 1531-1536. 30. Novick, D., H. Engelmann, D. Wallach, and M. 13. Fantuzzi, G., et al., IL-18 regulation of IFN-g Rubinstein. 1989. Soluble cytokine receptors are production and cell proliferation as revealed in present in normal human urine. J. Exp. Med. interleukin-lb converting enzyme-deficient mice. 170:1409-1414. Blood, 1998. 91: p.2118-2125. 31. Okamura, Η., Η. Tsutsui, T. Komatsu, M. 14. Gryczan, Т., "The Molecular Biology of the Yutsudo, A. Hakura, T. Tanimoto, K. Torigoe, T. Bacilli", Academic Press, NY (1982), pp.307-329. Okura, Y. Nukada, K. Hattori, K. Akita, M. Namba, F. 15. Gutkind, J.S. et al., A novel c-fgr exon utilized in Tanabe, K. Konishi, S. Fukuda, and M. Kurimoto. Epstein-Barr virus-infected В lymphcytes but not in 1995. Cloning of a new cytokine that induces IFNmormal monocytes. Molec. Cell. Biol., 1991. 11: gamma production by Τ cells. Nature 378:8 8-91. p.1500-1507. 32. Rothe, H., N. A. Jenkins, N. G. Copeland, and H. 16. Heremans, H., J. Van Damme, C. Dillen, R. Kolb. 1997. Active stage of autoimmune diabetes is Dijkmans, and A. Billiau. 1990. Interferon gamma, a associated with the expression of a novel cytokine, mediator of lethal lipopolysaccharide-induced IGIF, which is located near Idd2. J-Clin-Inves.t Shwartzman-like shock reactions in mice. J. Exp. 99:469-74 issn: 0021-9738. Med. 171:1853-69 issn: 0022-1007. 33. Sambrook, J., E.F. Fritsch, and M. Т., Molecular 17. Izaki, K. (1978) Jpn. J. Bacterial. 33:729-742. Cloning: A laboratory manual. 2nd ed. ed. 1989, Cold 18. John, J. F., et al. (1986) Rev. Infect. Dis. Spring Ear-box, New York: Cold Spring Harbor 8:693-704. Laboratory. 19. Kendall, K.J. et al. (1987) J: Bacterial. 169:417734. Simonet, W.S., et al., Osteoprotegerin: a novel 4183. secreted protein involved in the regulation of bone 20. Kohno, K., J. Kataoka, T. Ohtsuki, Y. Suemoto, I. density. Cell, 1997. 89(2): p.309-319. Okamoto, M. Usui, M. Ikeda, and M. Kurimoto. 1997. 35. Sompayrac, L.H. and K.L. Danna, Efficient IFN-gamma-inducing factor (IGIF) is a costimulatory infection of monkey cells with DNA of simian virus 40. 43 75862 44 Proc. Nat'l. Acad. Sci. USA, 1981. 78: p. 7575-7578. of the cDNA for human IFN-gamma-inducing factor, 36. Sparks, C.A., et al., Assignment of the nuclear expression in Escherichia coli, and studies on the mitotic apparatus protein NuMA gene to human biologic activities of the protein. J. Immunol. chromosome Ilql3. Genomics, 1993.17: p.222-224. 156:4274-4279.34. Okayama, H. and Berg, P. (1983) 37. Tsutsui, H., K. Nakanishi, K. Matsui, K. Higashino, A cDNA cloning vector that permits expression H. Okamura, Y. Miyazawa, and K. Kaneda. 1996. ofcDNA inserts in mammalian cells. Моl. Cell. Biol. IFN-gamna-inducing factor up-regulates Fas ligand3:280-289. mediatedcytotoxic activity of murine natural killer cell 39. Yasuda, H., et al., Identity of osteoclastogenesis clones. J. Immunol. 157:3967-73 issn: 0022-1767. inhibitory factor (OCIF) and osteoprotegerin (OPG): a 38. Ushio, S., M. Namba, T. Okura, K. Hattori, Y. mechanism by which OPG/OCIF inhibits Nukada, K. Akita, F. Tanabe, K. Konishi, M. Micallef, osteoclastogenesis in vitro. Endocrinology, 1998. 139: M. Fujii, K. Torigoe, T. Tanimoto, S. Fukuda, M. p.1329-1337. Ikeda, H. Okamura, and M. Kurimoto. 1996. Cloning 45 75862 46 47 75862 48 49 75862 50 51 75862 52 53 75862 54 55 75862 56 57 75862 58 59 75862 60
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated polypeptide binding il-18 (il-18bp) (variants), isolated molecule of nucleic acid coding it (variants), antibody, binding this polypeptide, a method for purification of il-18bp and a composition containing it
Автори англійськоюNovick Daniela, Dinarello Charles, Rubinstein Menachem
Назва патенту російськоюВыделенный полипептид, который связывается с il-18 (il-18bp) (варианты), выделенная молекула нуклеиновой кислоты, которая его кодирует (варианты), антитело, которое связывается с указанным полипептидом, способ очистки il-18bp и композиция, которая его содержит
Автори російськоюНовик Даниэла, Динарелло Чарльз, Рубинштейн Менахем
МПК / Мітки
МПК: C07K 16/24, A61K 39/395, C07K 14/54, A61K 38/20, A61K 38/17
Мітки: поліпептидом, кислоти, нуклеїнової, кодує, варіанти, молекула, виділена, антитіло, виділений, очищення, il-18, il-18bp, спосіб, зв'язується, поліпептид, комп, даним
Код посилання
<a href="https://ua.patents.su/31-75862-vidilenijj-polipeptid-shho-zvyazuehtsya-z-il-18-il-18bp-varianti-vidilena-molekula-nuklenovo-kisloti-shho-jjogo-kodueh-varianti-antitilo-shho-zvyazuehtsya-z-danim-polipeptidom-spos.html" target="_blank" rel="follow" title="База патентів України">Виділений поліпептид, що зв’язується з il-18 (il-18bp) (варіанти), виділена молекула нуклеїнової кислоти, що його кодує (варіанти), антитіло, що зв’язується з даним поліпептидом, спосіб очищення il-18bp та комп</a>
Попередній патент: Спосіб регенерації сплавів в ударних хвилях
Наступний патент: Послідовний декодер вітербі (варіанти) і спосіб послідовного декодування по вітербі
Випадковий патент: Спосіб лікування деструктивного туберкульозу легень