Антибіотик 107891, його фактори а1 і а2, фармацевтично прийнятні солі і композиція та їх застосування
Номер патенту: 87548
Опубліковано: 27.07.2009
Автори: Паренті Франко, Кандіані Джанпаоло, Гасталдо Лучано, Лаззаріні Амеріга, Лосі Даніеле, Чічілято Ісмаела, Селва Енріко, Марінеллі Флавіа
Формула / Реферат
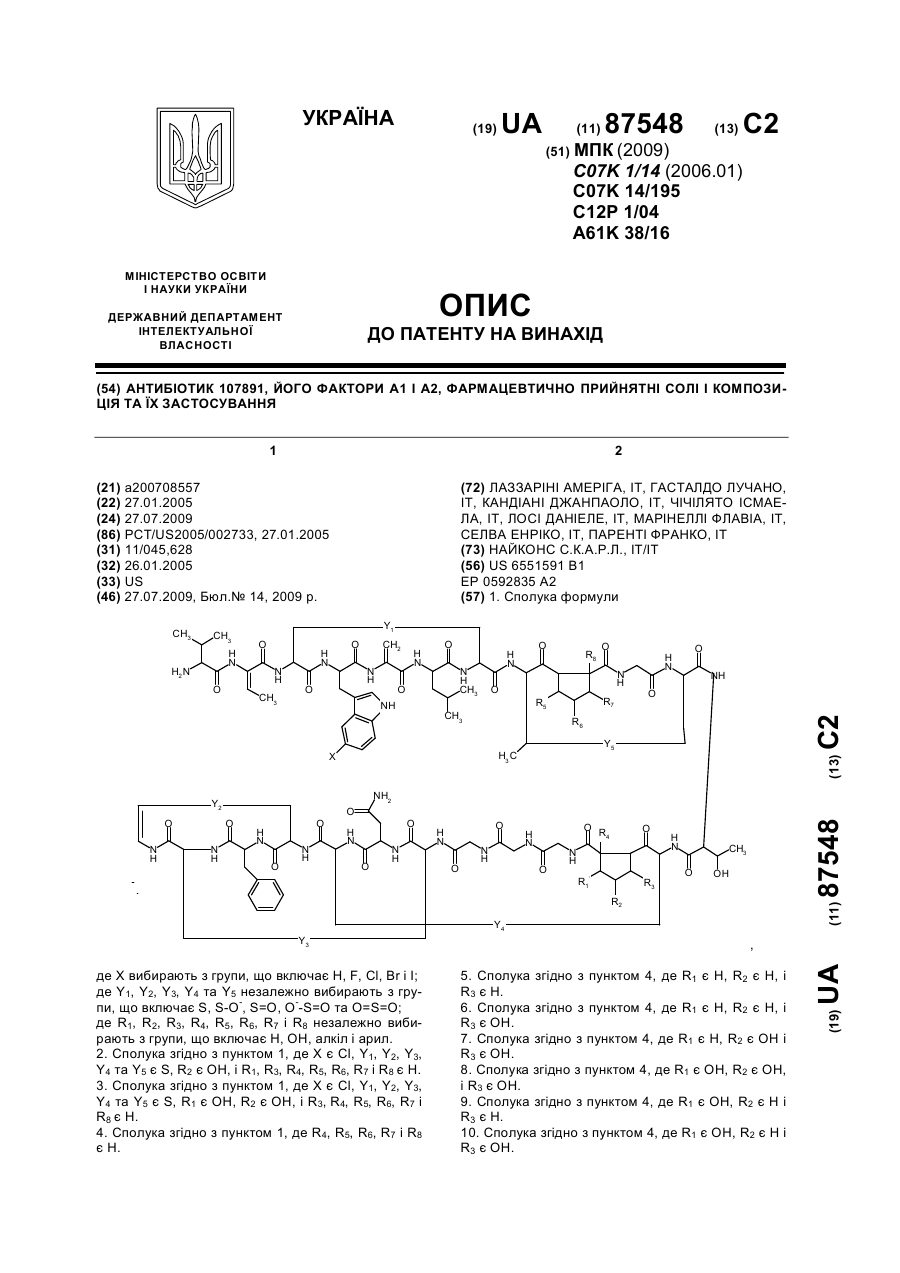
1. Сполука формули
 ,
,
де Х вибирають з групи, що включає Н, F, Сl, Вr і І;
де Y1, Y2, Y3, Y4 та Y5 незалежно вибирають з групи, що включає S, S-O-, S=O, O--S=O та O=S=O;
де R1, R2, R3, R4, R5, R6, R7 і R8 незалежно вибирають з групи, що включає Н, ОН, алкіл і арил.
2. Сполука згідно з пунктом 1, де Х є Сl, Y1, Y2, Y3, Y4 та Y5 є S, R2 є ОН, і R1, R3, R4, R5, R6, R7 і R8 є Н.
3. Сполука згідно з пунктом 1, де Х є Сl, Y1, Y2, Y3, Y4 та Y5 є S, R1 є ОН, R2 є ОН, і R3, R4, R5, R6, R7 і R8 є Н.
4. Сполука згідно з пунктом 1, де R4, R5, R6, R7 і R8 є Н.
5. Сполука згідно з пунктом 4, де R1 є Н, R2 є Н, і R3 є Н.
6. Сполука згідно з пунктом 4, де R1 є Н, R2 є Н, і R3 є ОН.
7. Сполука згідно з пунктом 4, де R1 є Н, R2 є ОН і R3 є ОН.
8. Сполука згідно з пунктом 4, де R1 є ОН, R2 є ОН, і R3 є ОН.
9. Сполука згідно з пунктом 4, де R1 є ОН, R2 є Н і R3 є Н.
10. Сполука згідно з пунктом 4, де R1 є ОН, R2 є Н і R3 є ОН.
11. Сполука згідно з пунктом 1, де Y1 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y2, Y3, Y4 та Y5 є S.
12. Сполука згідно з пунктом 1, де Y2 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y3, Y4 та Y5 є S.
13. Сполука згідно з пунктом 1, де Y3 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y2, Y4 та Y5 є S.
14. Сполука згідно з пунктом 1, де Y4 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y2, Y3 та Y5 є S.
15. Сполука згідно з пунктом 1, де Y5 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y2, Y3 та Y4 є S.
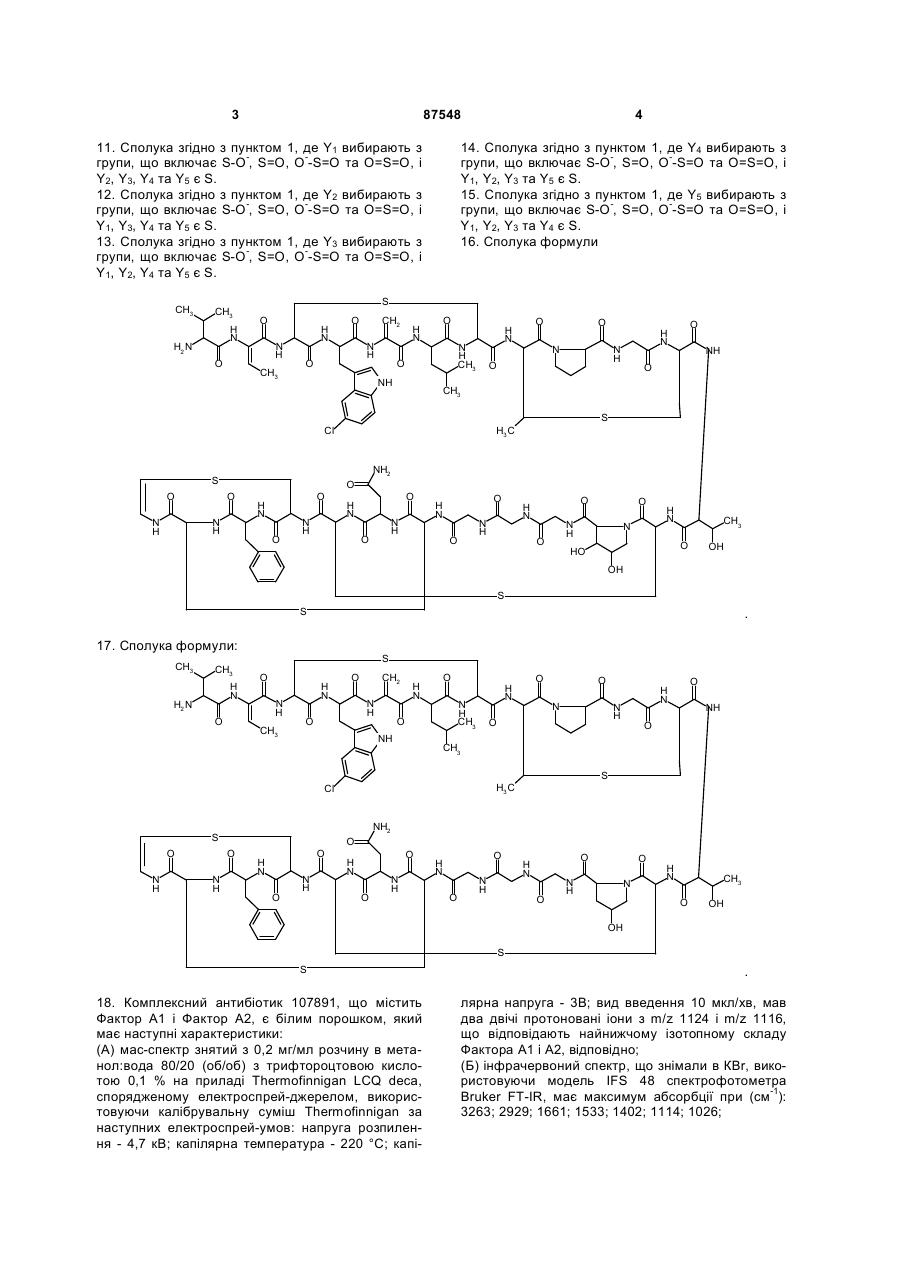
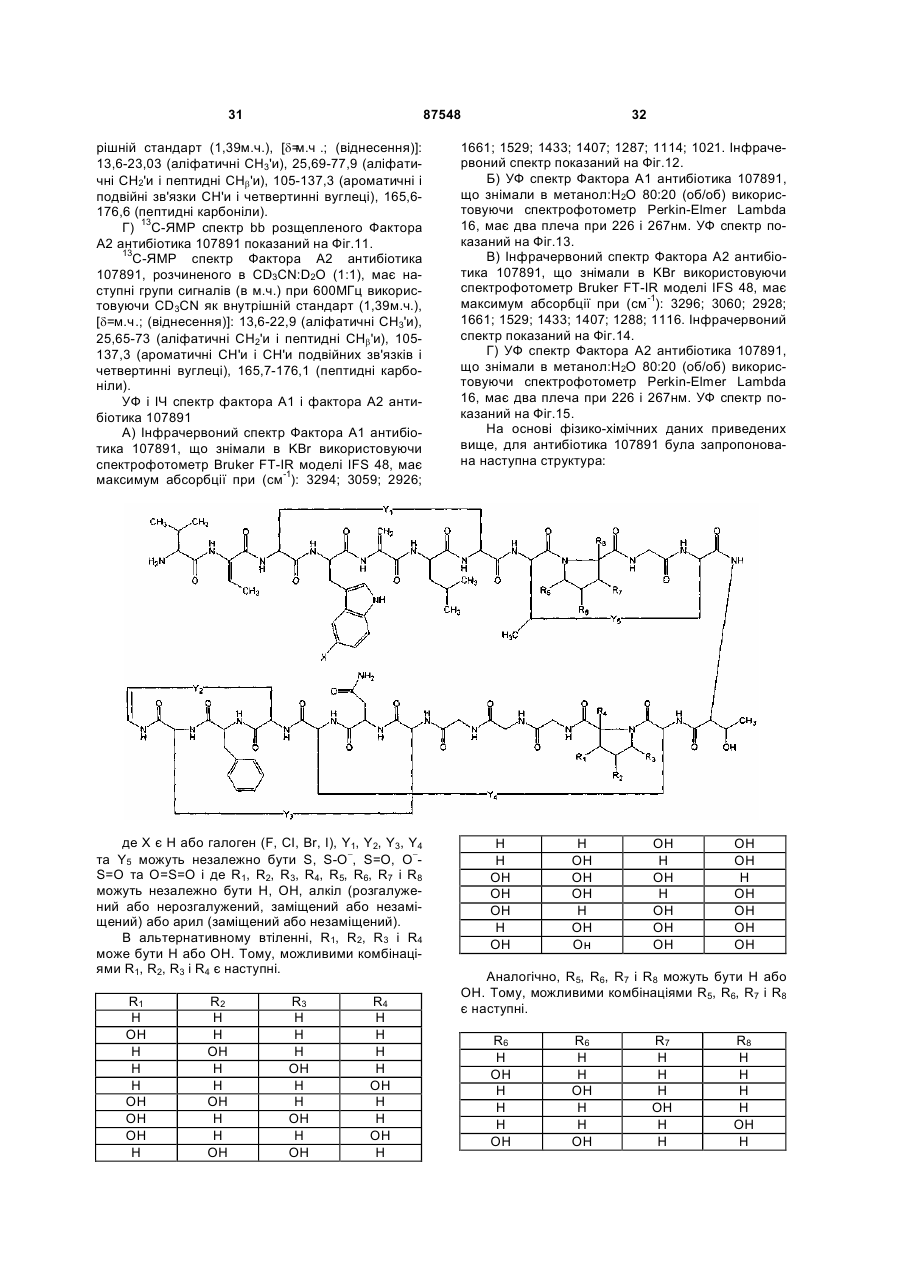
16. Сполука формули
 .
.
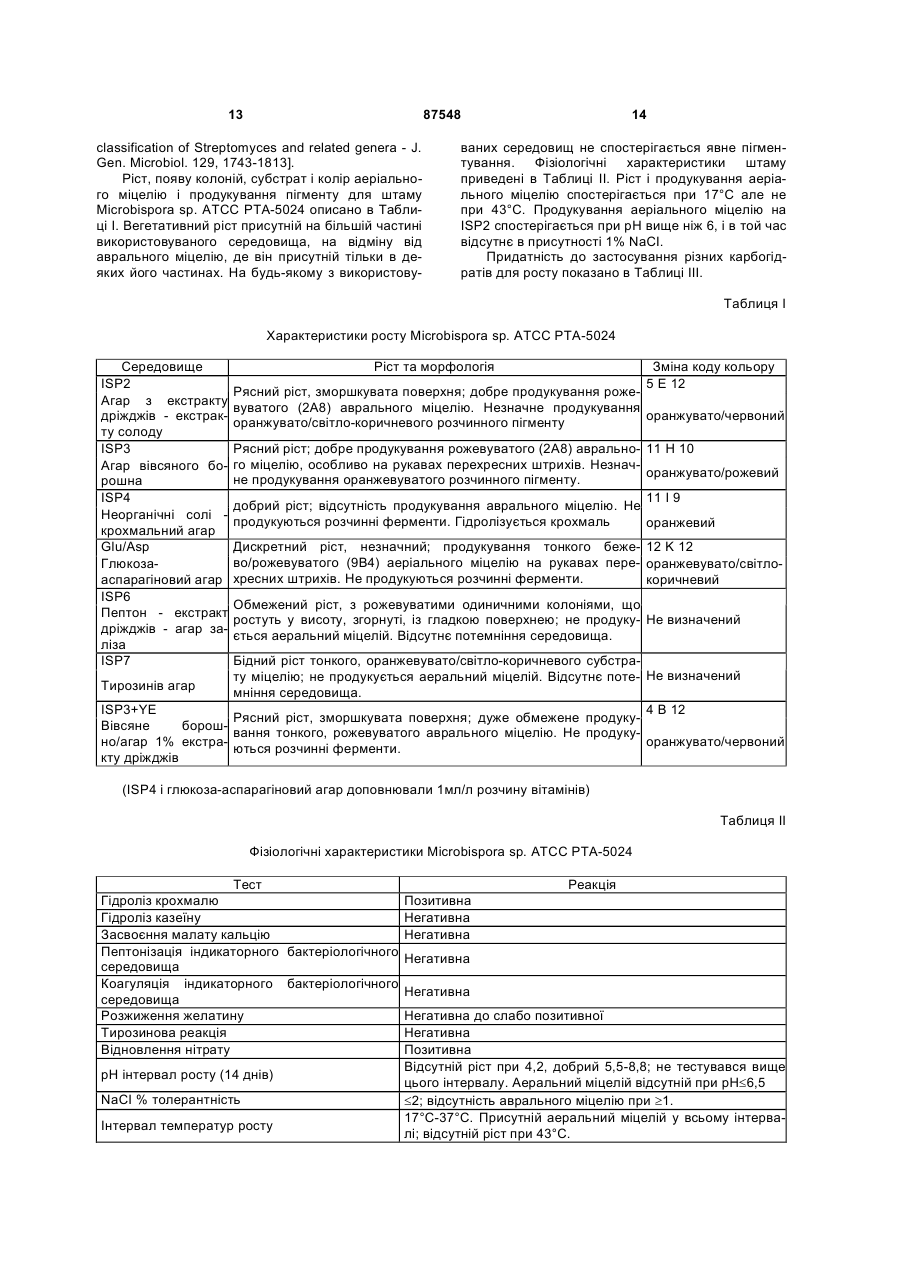
17. Сполука формули:
 .
.
18. Комплексний антибіотик 107891, що містить Фактор А1 і Фактор А2, є білим порошком, який має наступні характеристики:
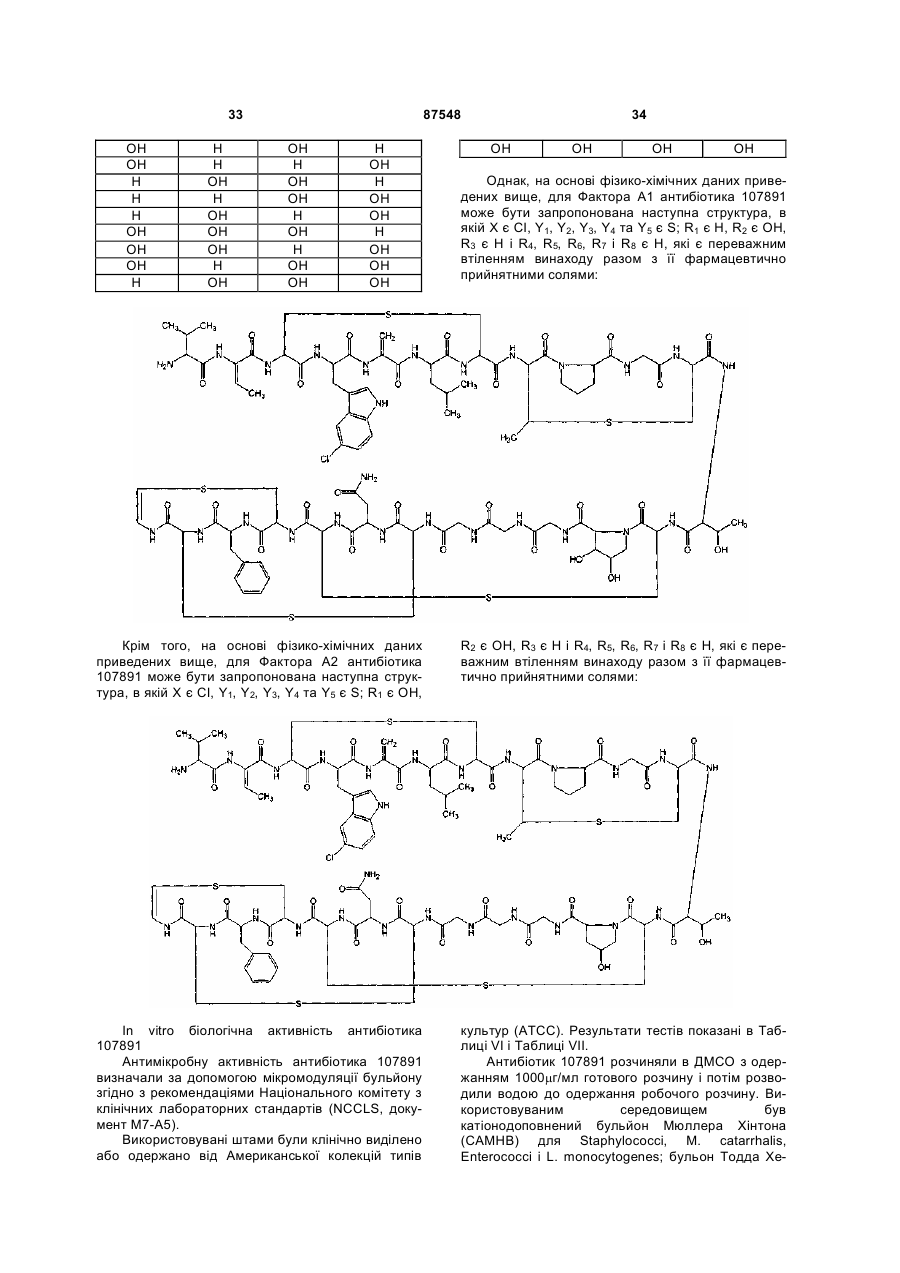
(A) мас-спектр знятий з 0,2 мг/мл розчину в метанол:вода 80/20 (об/об) з трифтороцтовою кислотою 0,1 % на приладі Thermofinnigan LCQ deca, спорядженому електроспрей-джерелом, використовуючи калібрувальну суміш Thermofinnigan за наступних електроспрей-умов: напруга розпилення - 4,7 кВ; капілярна температура - 220 °С; капілярна напруга - 3В; вид введення 10 мкл/хв, мав два двічі протоновані іони з m/z 1124 і m/z 1116, що відповідають найнижчому ізотопному складу Фактора А1 і А2, відповідно;
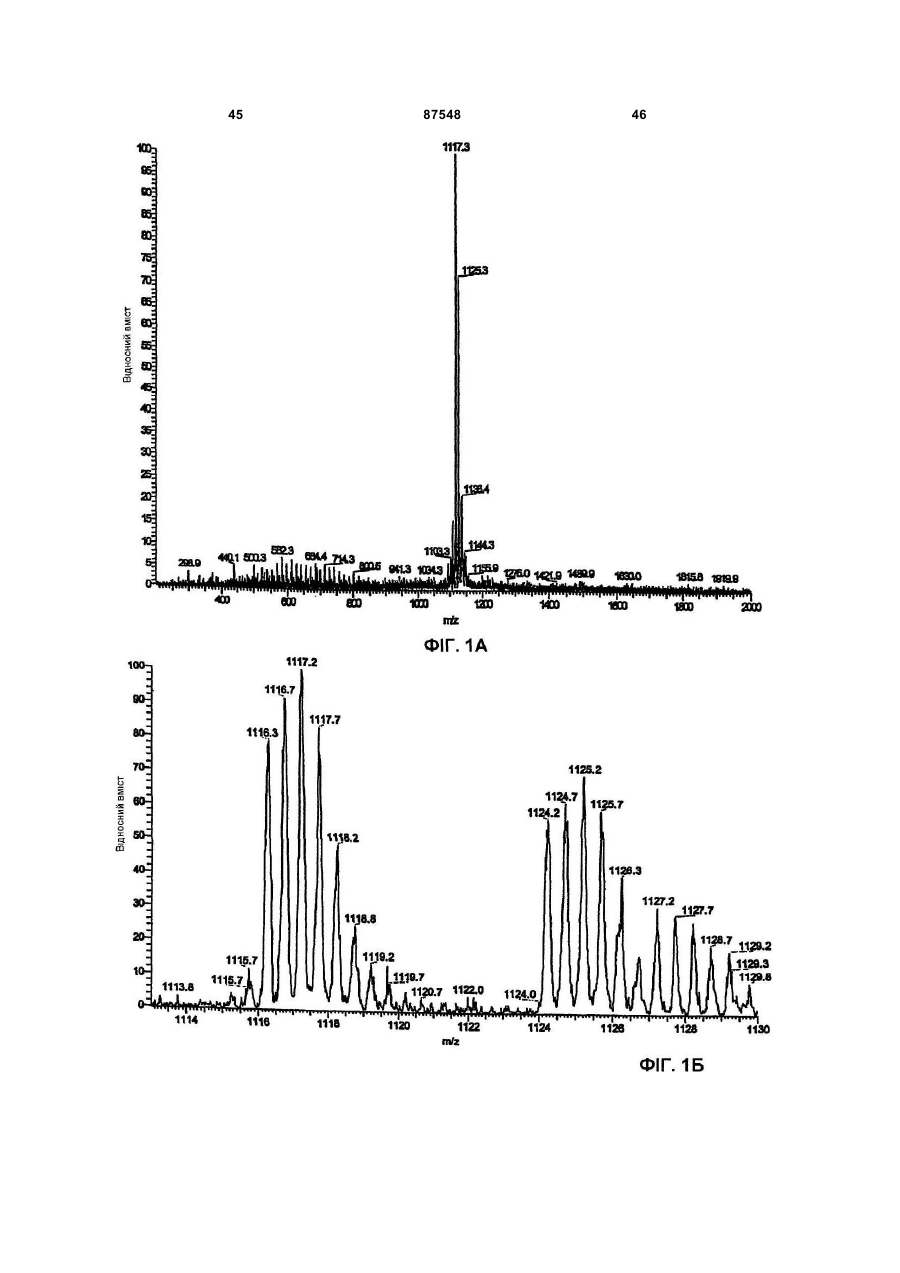
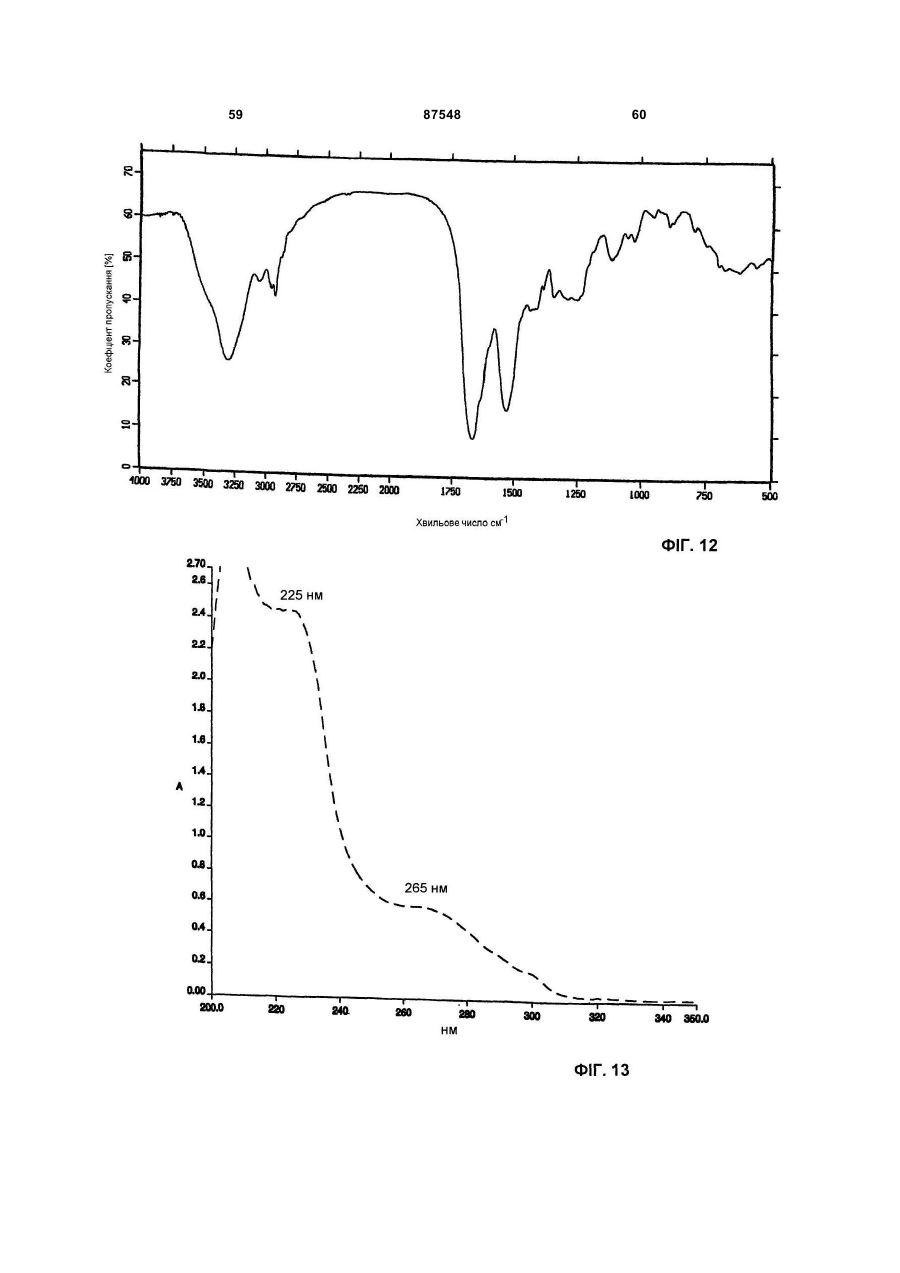
(Б) інфрачервоний спектр, що знімали в КВr, використовуючи модель IFS 48 спектрофотометра Bruker FT-IR, має максимум абсорбції при (см-1): 3263; 2929; 1661; 1533; 1402; 1114; 1026;
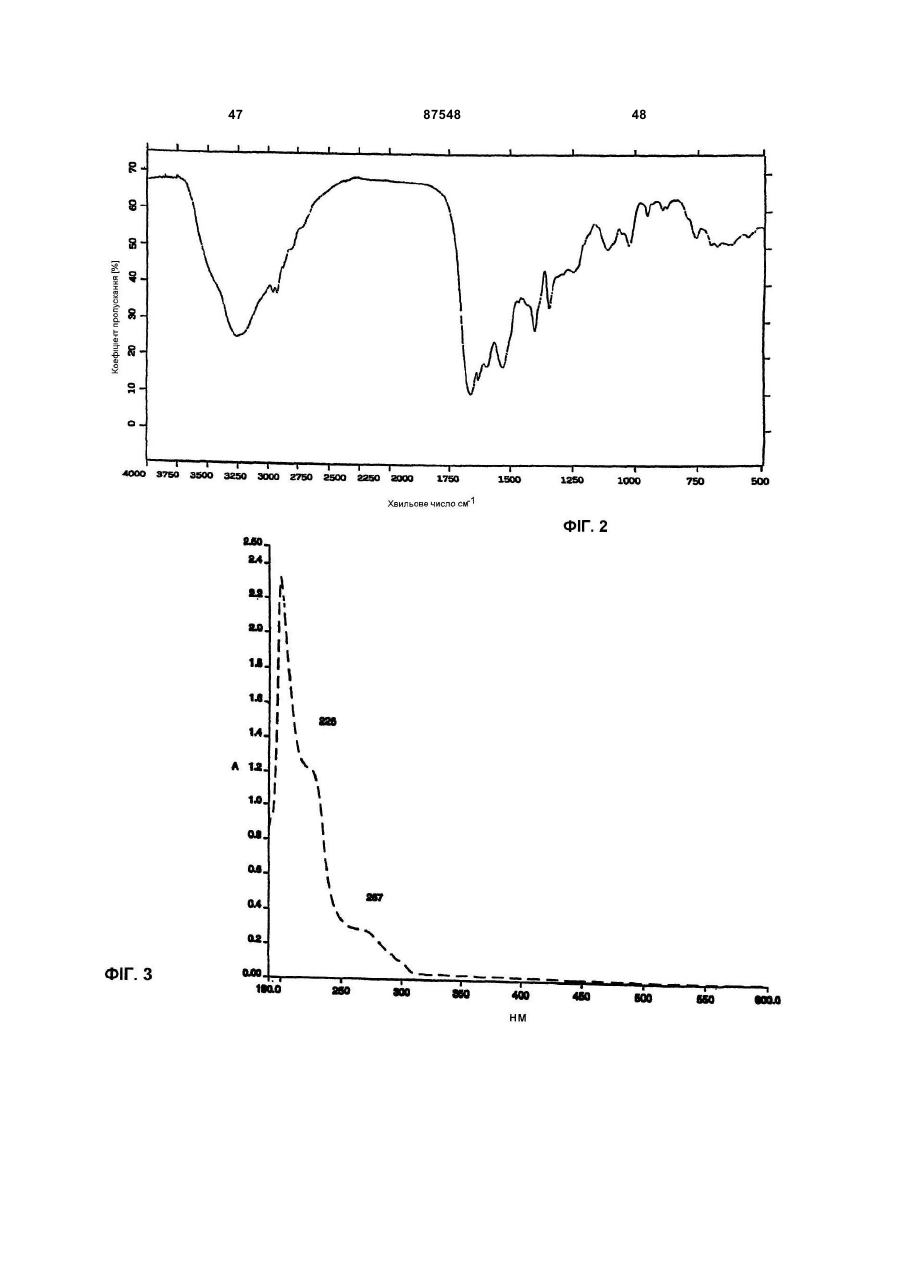
(B) УФ спектр, що знімали в метанол:Н2O 80:20 (об/об), використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267 нм;
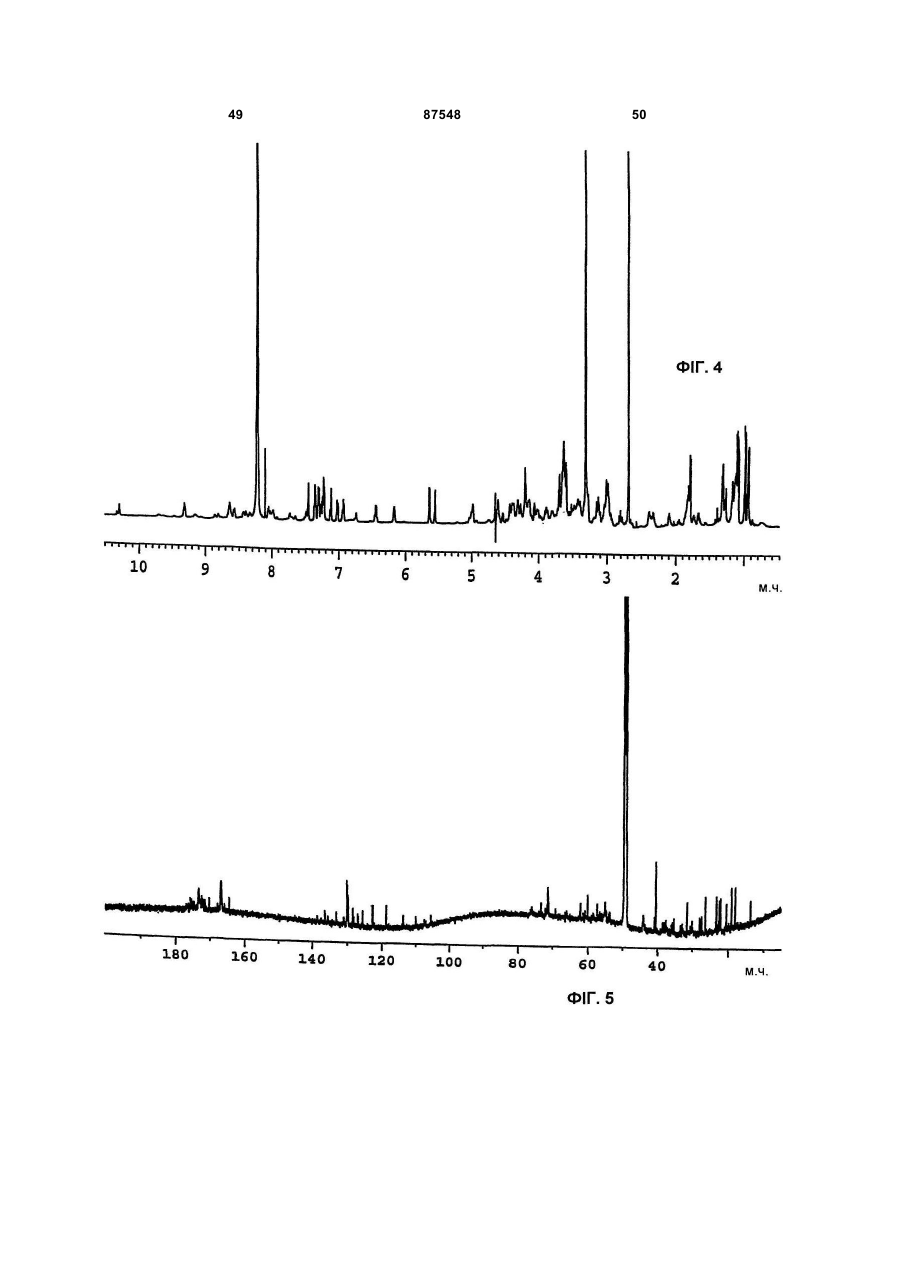
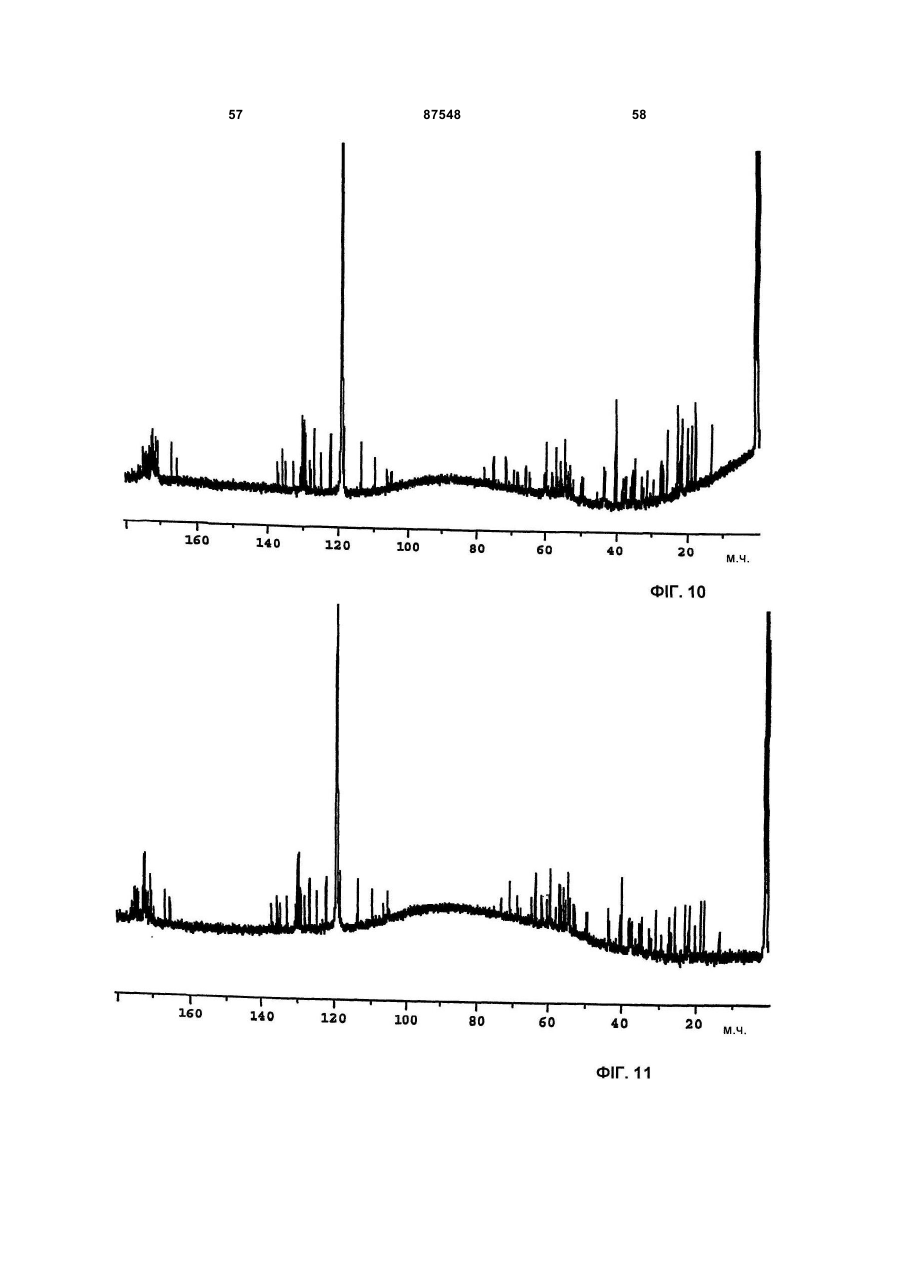
(Г) 1H-ЯМР спектр, що знімали при 600 МГц в суміші метанол-d4:Н2О (рН 4,3 НСl) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600, використовуючи водопригнічену послідовність і як внутрішній стандарт - залишковий сигнал метанол-d4 при 3,31 м. ч., має наступні сигнали [δ=м. ч. мультиплетність; (віднесення)]: 0,93 д (СН3), 0,98 д (СН3), 1,07 т (перекривається СН3'и), 1,18 т (перекривається СН3'и), 1,26 с (СН3), 1,30 т (перекривається СН3'и), 1,62-1,74 м (СН2), 1,78 д (СН3), 1,80 д (СН3), 2,03 м (CH2), 2,24 м (СН), 2,36 м (СН2), 2,72-3,8 м (пептидні альфа СН'и), 3,8-5,2 м (пептидні альфа СН'и), 5,53-6,08 с (СН2), 5,62 д (СН подвійного зв'язка), 6,42 м (СН), 6,92 д (СН подвійного зв'язка), 7,0-7,55 м (ароматичні СН'и), 7,62-10,4 д і м (ароматичні і пептидні NН'и);
(Д) 13С-ЯМР спектр, що знімали в суміші метанол-d4:Н2О (рН 4,3 НСl) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600, використовуючи як внутрішній стандарт залишковий сигнал метанол-d4 при 49,15 м. ч., має наступні сигнали [δ=м. ч.; (віднесення)]: 13,6-23,2 (аліфатичні СН3'и), 26,16-73 (аліфатичні СН2'и і пептидні альфа СН'и), 105-136 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 164,3-176,3 (пептидні карбоніли);
(Е) кислотний гідролізат в 6N НСl, (105°С, 24 г) має наступні амінокислоти, разом з іншими неідентифікованими піками, після модифікування 6-амінохіноліл-N-гідроксисукцинімідилкарбаматом: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (продукт гідролізу аспарагіну), фенілаланін і лейцин;
Є) кислотний гідролізат в 4N метансульфоновій кислоті, що містить 0,2 % (в/о) 3-(2-аміноетил)індолу, як каталізатор (115°С, 16 г), містить 5-хлортриптофан; і
Ж) детектується група, що іонізується основою, при кислото/основному титруванні 0,01 N гідроксидом калію в 2-метоксiетанолі (MCS):H2O 12:3 (об/об), що містить молярний надлишок 0,01 N хлорводневої кислоти.
19. Фактор А1 антибіотика 107891 є білим порошком, що має наступні характеристики:
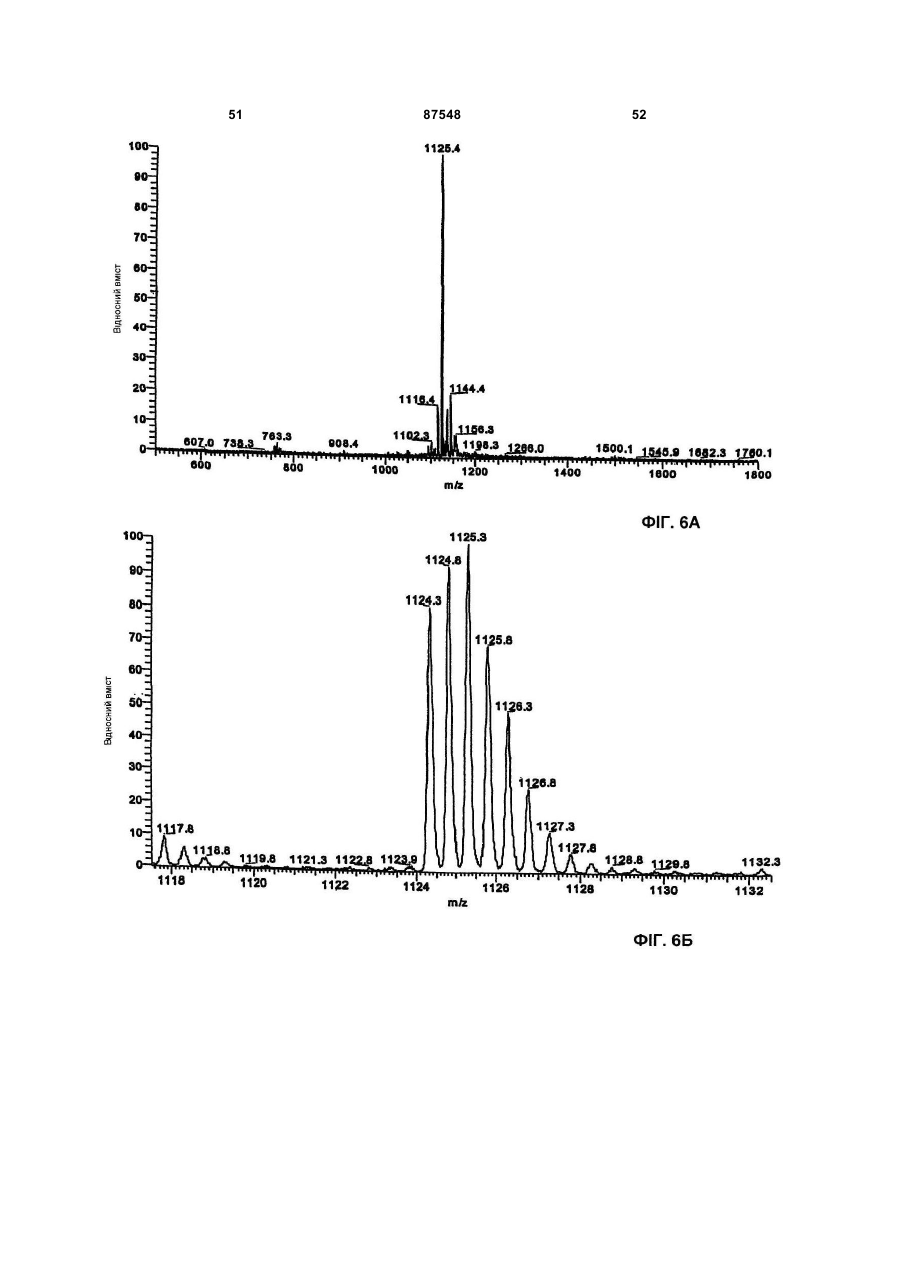
A) двічі протонований іон при m/z 1124, що відповідає найнижчому ізотопному складу в мас-спектрі, знятому з 0,1 мг/мл розчину в ацетонітрил:вода 50:50 (об/об) з оцтовою кислотою 0,5 % на приладі Thermofinnigan LCQ deca, спорядженому електроспрей-джерелом, використовуючи калібрувальну суміш Thermofinnigan за наступних електроспрей-умов: напруга розпилення - 4,7 кВ; капілярна температура - 250°С; капілярна напруга - 8В; вид введення 10 мкл/хв;
Б) точна маса антибіотика, що визначали, використовуючи спектрометр Bruker Daltonics APEX II, 4.7 Tesla, споряджений електроспрей-джерелом, відповідає молекулярній вазі 2246,71±0,06, розрахованій моноізотопній масі з [М+2Н]2+ при m/z 1124,36124 (точність 30 м. ч.);
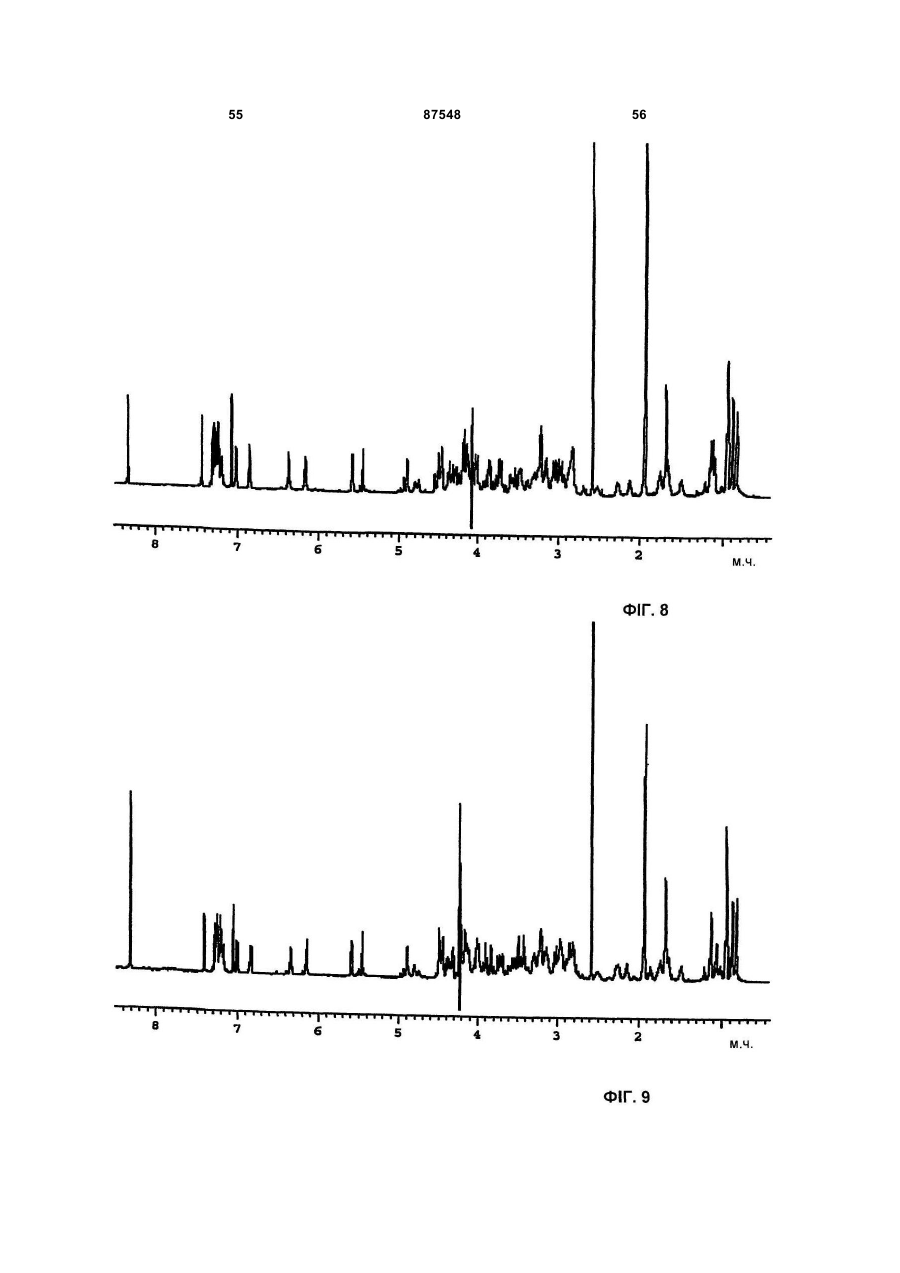
B) коли розчинити в CD3CN і D2O (1:1), 1H ЯМР спектр має наступні групи сигналів (в м. ч.) при 600 МГц, використовуючи СD3СN як внутрішній стандарт (1,94 м. ч.), [δ=м. ч., мультиплетність; (віднесення)] : 0,84 д (СН3), 0,89 д (СН3), 0,94 т (перекривається СН3'и), 1,1 д (СН3), 1,13 д (СН3), 1,15 т (перекривається СН3'и), 149 м (CH2), 1,69 д (СН3), 1,75 м (СН2), 2,11 м (СН), 2,26 м (СН), 2,5 м (СН2), 2,68-3,8 м (пептидні СНβ'и), 3,8-5,0 м (пептидні СНα'и), 5,45-6,17 с (CH2), 5,58 д (СН подвійного зв'язка), 6,36 м (СН), 6,86 д (СН подвійного зв'язка), 7,0-7,45 м (ароматичних СН'и);
Г) коли розчинити в CD3CN:D2O (1:1), 13С ЯМР спектр має наступні сигнали (в м. ч.) при 600 МГц використовуючи СD3СN як внутрішній стандарт (1,39 м. ч.), [δ=м. ч.; (віднесення)]: 13,6-23,03 (аліфатичні СН3'и), 25,69-77,9 (аліфатичні СН2'и і пептидні СНα'и), 105-137,3 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 165,6-176,6 (пептидні карбоніли);
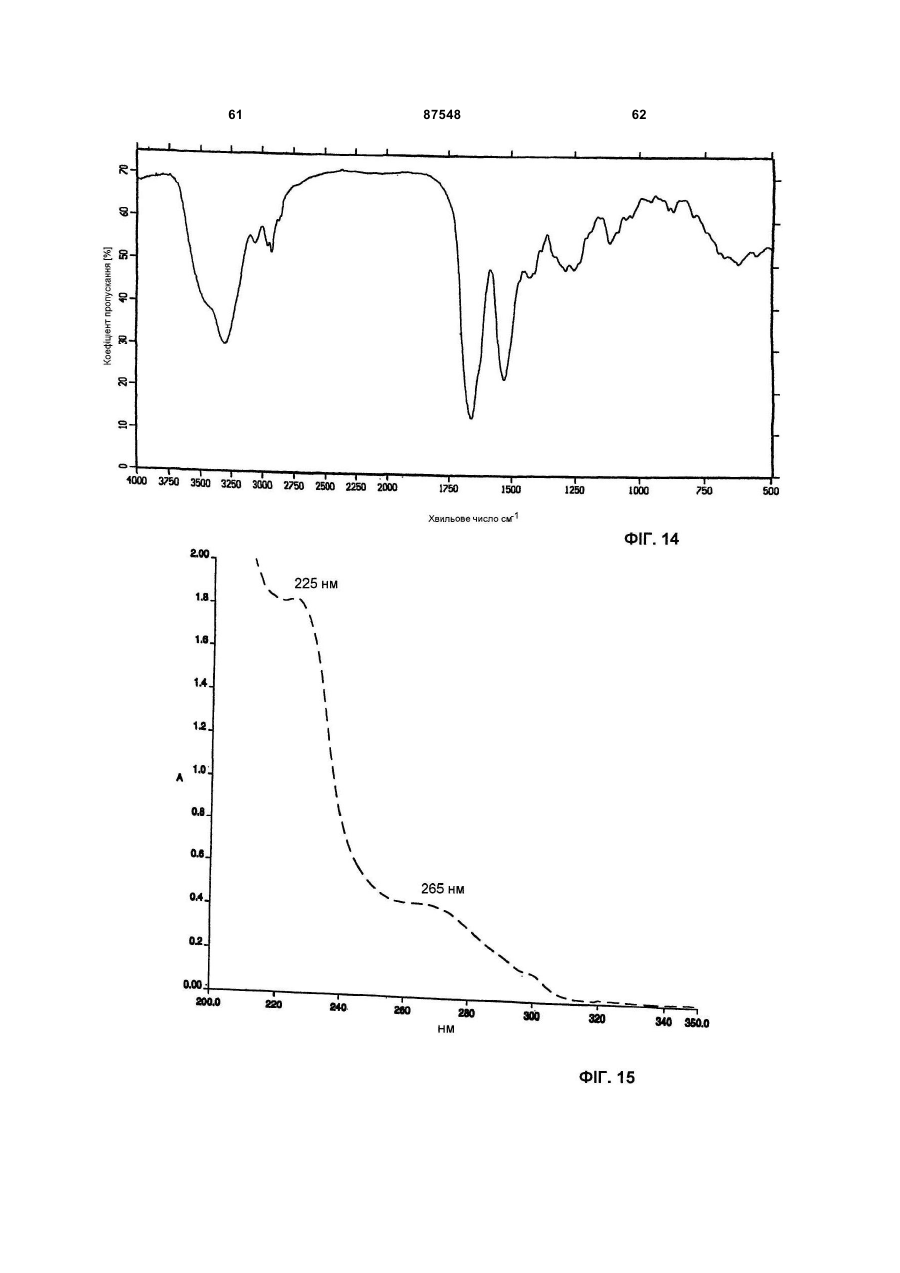
Д) інфрачервоний спектр, що знімали в КВr, використовуючи модель IFS 48 спектрофотометра Bruker FT-IR, має максимум абсорбції при (см-1): 3294; 2926; 1661; 1529; 1433; 1407; 1287; 1114; 1021;
Е) УФ спектр, що знімали в метанол:Н2O (у співвідношенні 80:20), використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267 нм;
Є) кислотний гідролізат в 6N НСl, (105°С, 24 г) має наступні амінокислоти, разом з іншими неідентифікованими піками, після модифікування 6-амінохіноліл-N-гідроксисукцинімідилкарбаматом: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (продукт гідролізу аспарагіну), фенілаланін і лейцин; і
Ж) кислотний гідролізат в 4N метансульфоновій кислоті, що містить 0,2 % (в/о) 3-(2-аміноетил)індолу, як каталізатор (115°С, 16 г), містить 5-хлортриптофан.
20. Фактор А2 антибіотика 107891 є білим порошком, що має наступні характеристики:
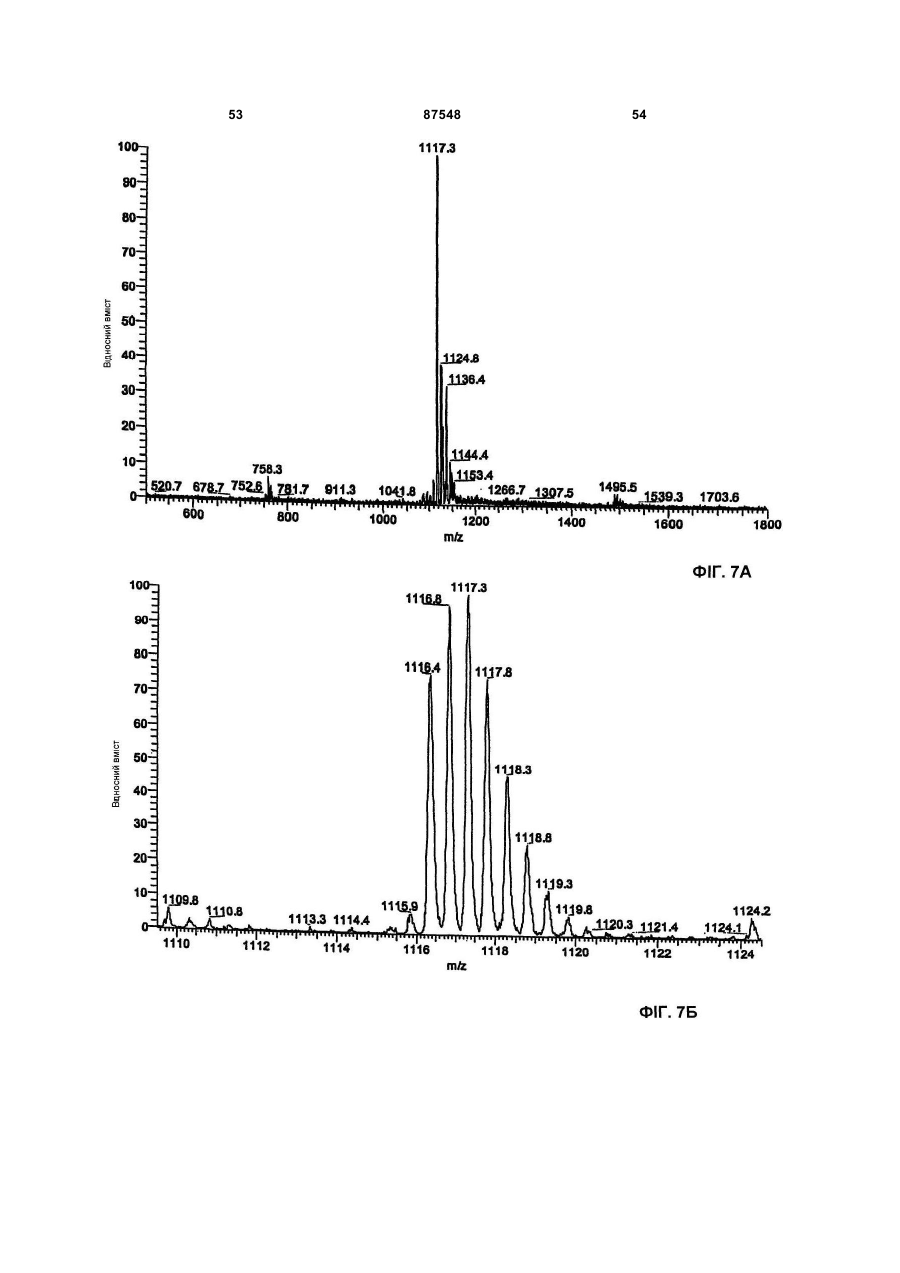
A) двічі протонований іон при m/z 1116, що відповідає найнижчому ізотопному складу в мас-спектрі, знятому з 0,1 мг/мл розчину в ацетонітрил:вода 50:50 (об/об) з оцтовою кислотою 0,5 % на приладі Thermofinnigan LCQ deca, спорядженому електроспрей-джерелом, використовуючи калібрувальну суміш Thermofinnigan за наступних електроспрей-умов: напруга розпилення - 4,7 кВ; капілярна температура - 250°С; капілярна напруга - 8В; вид введення 10 мкл/хв;
Б) точна маса антибіотика, що визначали використовуючи спектрометр Bruker Daltonics APEX II, 4.7 Tesla, споряджений електроспрей-джерелом, відповідає молекулярній вазі 2230,71±0,06, розрахованій моноізотопній масі з [M+2H]2+ при m/z 1116,36260 (точність 30 м. ч.);
B) коли розчинити в СD3СN і D2O (1:1), 1H ЯМР спектр має наступні групи сигналів (в м. ч.) при 600 МГц, використовуючи СD3СN як внутрішній стандарт (1,94 м. ч.), [δ=м. ч., мультиплетність; (віднесення)]: 0,84 д (СН3), 0,88 д (СН3), 0,94 в (СН3), 1,06 д (СН3), 1,14 д (СН3), 1,48 м (CH2), 1,65-1,75 м (СН2), 1,67 в (СН3), 2,15 м (СН), 2,25 м (СН), 2,5 м (СН2), 2,77-3,8 м (пептидні СНβ'и), 3,8-4,9 м (пептидні СНα'и), 5,45-6,14 с (CH2), 5,59 д (СН подвійного зв'язка), 6,34 м (СН), 6,84 д (СН подвійного зв'язка), 7,0-7,42 м (ароматичних СН'и);
Г) коли розчинити в СD3СN:D2О (1:1), 13С ЯМР спектр має наступні сигнали (в м. ч.) при 600 МГц, використовуючи СD3СN як внутрішній стандарт (1,39 м. ч.), [δ=м. ч.; (віднесення)]: 13,6-22,9 (аліфатичні СН3'и), 25,65-73 (аліфатичні СН2'и і пептидні СНα'и), 105-137,3 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 165,7-176,1 (пептидні карбоніли);
Д) інфрачервоний спектр, що знімали в КВr, використовуючи модель IFS 48 спектрофотометра Bruker FT-IR, має максимум абсорбції при (см-1): 3296; 3060; 2928; 1661; 1529; 1433; 1407; 1288; 1116;
Е) УФ спектр, що знімали в метанол:Н2O (у співвідношенні 80:20), використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267 нм;
Є) кислотний гідролізат в 6N НСl, (105°С, 24 г) має наступні амінокислоти, разом з іншими неідентифікованими піками, після модифікування 6-амінохіноліл-N-гідроксисукцинімідилкарбаматом: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (продукт гідролізу аспарагіну), фенілаланін і лейцин; і
Ж) кислотний гідролізат в 4N метансульфоновій кислоті, що містить 0,2 % (в/о) 3-(2-аміноетил)індолу, як каталізатор (115°С, 16 г), містить 5-хлортриптофан.
21. Спосіб одержання антибіотика 107891 і його Факторів А1 і А2 і їх солей з кислотами, що включає стадії:
культивування Microbispora sp. АТСС РТА-5024 або його варіанта або мутанта, що зберігає здатність продукувати згаданий антибіотик, за аеробних умов, у водному поживному середовищі, яке містить засвоюване джерело вуглецю, азоту і неорганічних солей;
виділення одержаного антибіотика з міцелію і/або фільтрування ферментаційного бульйону; і
очищення виділеного антибіотика 107891.
22. Спосіб згідно з пунктом 21, де штам Microbispora sp. АТСС РТА-5024 або його варіант або мутант, що продукує антибіотик 107891, попередньо культивують.
23. Спосіб згідно з пунктом 21, де виділення антибіотика 107891 проводять фільтруванням ферментаційного бульйону і антибіотик виділяють з фільтрованого ферментаційного бульйону згідно з методикою, яку вибирають з групи, що включає екстрагування розчинником, що не змішується з водою, осадження додаванням осаджувача або шляхом зміни рН розчину, абсорбційну хроматографію, розподільну хроматографію, розподільну хроматографію з оберненою фазою, іонообмінну хроматографію, молекулопоглинальну хроматографію і комбінацію двох або декількох згаданих методик.
24. Спосіб згідно з пунктом 21, де виділення антибіотика 107891 проводять шляхом виділення міцелію з надосадкової рідини ферментаційного бульйону і міцелій, екстрагують розчинником, що змішується з водою, в якому, після видалення збідненого міцелію, одержують розчин, що змішується з водою, який містить неочищений антибіотик, який можна піддати або окремо, або разом з фільтрованим ферментаційним бульйоном виділенню антибіотика 107891 за допомогою методики, яку вибирають з групи, що включає екстрагування розчинником, осадження додаванням осаджувача або шляхом зміни рН розчину, абсорбційну хроматографію, розподільну хроматографію, розподільну хроматографію з оберненою фазою, іонообмінну хроматографію, молекулопоглинальну хроматографію і комбінацію двох або декількох згаданих методик.
25. Спосіб згідно з пунктом 24, де концентрацію розчинника, що змішується з водою, в екстракті міцелію зменшують перед виділенням з нього антибіотика.
26. Спосіб згідно з пунктом 23, де фільтрований ферментаційний бульйон піддають контактуванню з абсорбційною смолою і згадану смолуелююють полярним розчинником, що змішується з водою, або його сумішшю з водою, одержуючи розчин, що містить неочищений антибіотик 107981.
27. Спосіб згідно з пунктом 26, де абсорбційну смолу вибирають з групи, що включає полістирольну, змішану полістирол-дивінілбензольну і поліамідну смолу.
28. Спосіб згідно з пунктом 24, де міцелій екстрагують С1-С3 спиртом і екстракт міцелію піддають контактуванню з абсорбційною смолою і елююють її полярним розчинником, що змішується з водою, або його сумішшю з водою, одержуючи розчин, що містить неочищений антибіотик 107891.
29. Спосіб згідно з пунктом 23, де розчини, що містять неочищений антибіотик 107891, об'єднують і піддають подальшому очищенню згаданого антибіотика 107891.
30. Спосіб згідно з пунктом 26, де розчин, що містить, неочищений антибіотик 107981, концентрують і потім ліофілізують одержуючи неочищений антибіотик 107891, як твердий продукт.
31. Спосіб згідно з пунктом 26, де абсорбційні смоли, що містять абсорбований антибіотик, об'єднують і їх суміш елююють полярним розчинником, що змішується з водою, або його сумішшю з водою.
32. Спосіб згідно з пунктом 21, де антибіотик 107981 очищають за допомогою хроматографії, переважно, за допомогою препаративної ВЕРХ або хроматографії середнього тиску.
33. Спосіб згідно з пунктом 21, де Фактор А1 і Фактор А2 виділяють за допомогою препаративної ВЕРХ з очищеного антибіотика 107891.
34. Фармацевтична композиція, що містить антибіотик, який вибирають з антибіотика 107891, Фактора А1 антибіотика 107891, Фактора А2 антибіотика 107891 і суміші згаданих Факторів в будь-якому співвідношенні або його фармацевтично прийнятної солі з кислотою.
35. Фармацевтична композиція згідно з пунктом 34, що також містить фармацевтично прийнятний носій.
36. Антибіотик 107891, його Фактор А1, його Фактор А2 або суміш згаданих Факторів в будь-якому співвідношенні або його фармацевтично прийнятна сіль з кислотою, для застосування як медикаменту.
37. Застосування антибіотика 107891, його Фактора А1, його Фактора А2 або суміші згаданих Факторів в будь-якому співвідношенні або його фармацевтично прийнятної солі з кислотою, для виготовлення медикаменту для лікування або профілактики бактеріальної інфекції.
38. Застосування антибіотика 107891, його Фактора А1, його Фактора А2 або суміші згаданих Факторів в будь-якому співвідношенні або його фармацевтично прийнятної солі з кислотою, як промотора росту тварини.
39. Біологічно чиста культура штаму Microbispora sp. АТСС РТА-5024 або його варіанта або мутанта, що зберігає здатність продукувати антибіотик 107891, коли культивуються при зануренні за аеробних умов в присутності засвоюваного джерела вуглецю, азоту і неорганічних солей.
Текст
1. Сполука формули 3 87548 11. Сполука згідно з пунктом 1, де Y1 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y2, Y3, Y4 та Y5 є S. 12. Сполука згідно з пунктом 1, де Y2 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y3, Y4 та Y5 є S. 13. Сполука згідно з пунктом 1, де Y3 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y2, Y4 та Y5 є S. CH3 CH3 H N H2 N O 4 14. Сполука згідно з пунктом 1, де Y4 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y2, Y3 та Y5 є S. 15. Сполука згідно з пунктом 1, де Y5 вибирають з групи, що включає S-O-, S=O, O--S=O та O=S=O, і Y1, Y2, Y3 та Y4 є S. 16. Сполука формули S O N H CH3 H N O CH2 N H O O H N N H CH3 O NH O H N O N N H O O H N NH O CH3 S H3 C Cl NH2 S O O O N H N H O H N O N H O H N N H O O H N N H O O H N O N H O N H N CH3 O HO OH OH S . S 17. Сполука формули: CH3 CH3 H N H2 N O S O N H CH3 H N O CH2 N H O O H N N H CH3 O NH O H N O N N H O O H N NH O CH3 S H3 C Cl NH2 S O N H O O N H O H N O N H O H N O N H O H N O N H O H N O O N H N H N CH3 O OH OH S S 18. Комплексний антибіотик 107891, що містить Фактор А1 і Фактор А2, є білим порошком, який має наступні характеристики: (A) мас-спектр знятий з 0,2 мг/мл розчину в метанол:вода 80/20 (об/об) з трифтороцтовою кислотою 0,1 % на приладі Thermofinnigan LCQ deca, спорядженому електроспрей-джерелом, використовуючи калібрувальну суміш Thermofinnigan за наступних електроспрей-умов: напруга розпилення - 4,7 кВ; капілярна температура - 220 °С; капі . лярна напруга - 3В; вид введення 10 мкл/хв, мав два двічі протоновані іони з m/z 1124 і m/z 1116, що відповідають найнижчому ізотопному складу Фактора А1 і А2, відповідно; (Б) інфрачервоний спектр, що знімали в КВr, використовуючи модель IFS 48 спектрофотометра Bruker FT-IR, має максимум абсорбції при (см-1): 3263; 2929; 1661; 1533; 1402; 1114; 1026; 5 (B) УФ спектр, що знімали в метанол:Н2O 80:20 (об/об), використовуючи спектрофотометр PerkinElmer Lambda 16, має два плеча при 226 і 267 нм; (Г) 1H-ЯМР спектр, що знімали при 600 МГц в суміші метанол-d4:Н2О (рН 4,3 НСl) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600, використовуючи водопригнічену послідовність і як внутрішній стандарт - залишковий сигнал метанол-d4 при 3,31 м. ч., має наступні сигнали [δ=м . ч. мультиплетність; (віднесення)]: 0,93 д (СН3), 0,98 д (СН3), 1,07 т (перекривається СН3'и), 1,18 т (перекривається СН3'и), 1,26 с (СН3), 1,30 т (перекривається СН3'и), 1,62-1,74 м (СН2), 1,78 д (СН3), 1,80 д (СН3), 2,03 м (CH2), 2,24 м (СН), 2,36 м (СН2), 2,72-3,8 м (пептидні альфа СН'и), 3,8-5,2 м (пептидні альфа СН'и), 5,53-6,08 с (СН2), 5,62 д (СН подвійного зв'язка), 6,42 м (СН), 6,92 д (СН подвійного зв'язка), 7,0-7,55 м (ароматичні СН'и), 7,62-10,4 д і м (ароматичні і пептидні NН'и); (Д) 13С-ЯМР спектр, що знімали в суміші метанолd4:Н2О (рН 4,3 НСl) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600, використовуючи як внутрішній стандарт залишковий сигнал метанол-d4 при 49,15 м. ч., має наступні сигнали [δ=м. ч.; (віднесення)]: 13,6-23,2 (аліфатичні СН3'и), 26,16-73 (аліфатичні СН2'и і пептидні альфа СН'и), 105-136 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 164,3-176,3 (пептидні карбоніли); (Е) кислотний гідролізат в 6N НСl, (105°С, 24 г) має наступні амінокислоти, разом з іншими неідентифікованими піками, після модифікування 6амінохіноліл-N-гідроксисукцинімідилкарбаматом: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (продукт гідролізу аспарагіну), фенілаланін і лейцин; Є) кислотний гідролізат в 4N метансульфоновій кислоті, що містить 0,2 % (в/о) 3-(2аміноетил)індолу, як каталізатор (115°С, 16 г), містить 5-хлортриптофан; і Ж) детектується група, що іонізується основою, при кислото/основному титруванні 0,01 N гідроксидом калію в 2-метоксiетанолі (MCS):H2O 12:3 (об/об), що містить молярний надлишок 0,01 N хлорводневої кислоти. 19. Фактор А1 антибіотика 107891 є білим порошком, що має наступні характеристики: A) двічі протонований іон при m/z 1124, що відповідає найнижчому ізотопному складу в мас-спектрі, знятому з 0,1 мг/мл розчину в ацетонітрил:вода 50:50 (об/об) з оцтовою кислотою 0,5 % на приладі Thermofinnigan LCQ deca, спорядженому електроспрей-джерелом, використовуючи калібрувальну суміш Thermofinnigan за наступних електроспрейумов: напруга розпилення - 4,7 кВ; капілярна температура - 250°С; капілярна напруга - 8В; вид введення 10 мкл/хв; Б) точна маса антибіотика, що визначали, використовуючи спектрометр Bruker Daltonics APEX II, 4.7 Tesla, споряджений електроспрей-джерелом, відповідає молекулярній вазі 2246,71±0,06, розрахованій моноізотопній масі з [М+2Н]2+ при m/z 1124,36124 (точність 30 м. ч.); B) коли розчинити в CD3CN і D2O (1:1), 1H ЯМР спектр має наступні групи сигналів (в м. ч.) при 600 МГц, використовуючи СD3СN як внутрішній стан 87548 6 дарт (1,94 м. ч.), [δ=м. ч., мультиплетність; (віднесення)] : 0,84 д (СН3), 0,89 д (СН3), 0,94 т (перекривається СН3'и), 1,1 д (СН3), 1,13 д (СН3), 1,15 т (перекривається СН3'и), 149 м (CH2), 1,69 д (СН3), 1,75 м (СН2), 2,11 м (СН), 2,26 м (СН), 2,5 м (СН2), 2,68-3,8 м (пептидні СНβ'и), 3,8-5,0 м (пептидні СНα'и), 5,45-6,17 с (CH2), 5,58 д (СН подвійного зв'язка), 6,36 м (СН), 6,86 д (СН подвійного зв'язка), 7,0-7,45 м (ароматичних СН'и); Г) коли розчинити в CD3CN:D2O (1:1), 13С ЯМР спектр має наступні сигнали (в м. ч.) при 600 МГц використовуючи СD3СN як внутрішній стандарт (1,39 м. ч.), [δ=м. ч.; (віднесення)]: 13,6-23,03 (аліфатичні СН3'и), 25,69-77,9 (аліфатичні СН2'и і пептидні СНα'и), 105-137,3 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 165,6176,6 (пептидні карбоніли); Д) інфрачервоний спектр, що знімали в КВr, використовуючи модель IFS 48 спектрофотометра Bruker FT-IR, має максимум абсорбції при (см-1): 3294; 2926; 1661; 1529; 1433; 1407; 1287; 1114; 1021; Е) УФ спектр, що знімали в метанол:Н2O (у співвідношенні 80:20), використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267 нм; Є) кислотний гідролізат в 6N НСl, (105°С, 24 г) має наступні амінокислоти, разом з іншими неідентифікованими піками, після модифікування 6амінохіноліл-N-гідроксисукцинімідилкарбаматом: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (продукт гідролізу аспарагіну), фенілаланін і лейцин; і Ж) кислотний гідролізат в 4N метансульфоновій кислоті, що містить 0,2 % (в/о) 3-(2аміноетил)індолу, як каталізатор (115°С, 16 г), містить 5-хлортриптофан. 20. Фактор А2 антибіотика 107891 є білим порошком, що має наступні характеристики: A) двічі протонований іон при m/z 1116, що відповідає найнижчому ізотопному складу в мас-спектрі, знятому з 0,1 мг/мл розчину в ацетонітрил:вода 50:50 (об/об) з оцтовою кислотою 0,5 % на приладі Thermofinnigan LCQ deca, спорядженому електроспрей-джерелом, використовуючи калібрувальну суміш Thermofinnigan за наступних електроспрейумов: напруга розпилення - 4,7 кВ; капілярна температура - 250°С; капілярна напруга - 8В; вид введення 10 мкл/хв; Б) точна маса антибіотика, що визначали використовуючи спектрометр Bruker Daltonics APEX II, 4.7 Tesla, споряджений електроспрей-джерелом, відповідає молекулярній вазі 2230,71±0,06, розрахованій моноізотопній масі з [M+2H]2+ при m/z 1116,36260 (точність 30 м. ч.); B) коли розчинити в СD3СN і D2O (1:1), 1H ЯМР спектр має наступні групи сигналів (в м. ч.) при 600 МГц, використовуючи СD3СN як внутрішній стандарт (1,94 м. ч.), [δ=м. ч., мультиплетність; (віднесення)]: 0,84 д (СН3), 0,88 д (СН3), 0,94 в (СН3), 1,06 д (СН3), 1,14 д (СН3), 1,48 м (CH2), 1,65-1,75 м (СН2), 1,67 в (СН3), 2,15 м (СН), 2,25 м (СН), 2,5 м (СН2), 2,77-3,8 м (пептидні СНβ'и), 3,8-4,9 м (пептидні СНα'и), 5,45-6,14 с (CH2), 5,59 д (СН подвій 7 ного зв'язка), 6,34 м (СН), 6,84 д (СН подвійного зв'язка), 7,0-7,42 м (ароматичних СН'и); Г) коли розчинити в СD3СN:D2О (1:1), 13С ЯМР спектр має наступні сигнали (в м. ч.) при 600 МГц, використовуючи СD3СN як внутрішній стандарт (1,39 м. ч.), [δ=м . ч.; (віднесення)]: 13,6-22,9 (аліфатичні СН3'и), 25,65-73 (аліфатичні СН2'и і пептидні СНα'и), 105-137,3 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 165,7-176,1 (пептидні карбоніли); Д) інфрачервоний спектр, що знімали в КВr, використовуючи модель IFS 48 спектрофотометра Bruker FT-IR, має максимум абсорбції при (см-1): 3296; 3060; 2928; 1661; 1529; 1433; 1407; 1288; 1116; Е) УФ спектр, що знімали в метанол:Н2O (у співвідношенні 80:20), використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267 нм; Є) кислотний гідролізат в 6N НСl, (105°С, 24 г) має наступні амінокислоти, разом з іншими неідентифікованими піками, після модифікування 6амінохіноліл-N-гідроксисукцинімідилкарбаматом: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (продукт гідролізу аспарагіну), фенілаланін і лейцин; і Ж) кислотний гідролізат в 4N метансульфоновій кислоті, що містить 0,2 % (в/о) 3-(2аміноетил)індолу, як каталізатор (115°С, 16 г), містить 5-хлортриптофан. 21. Спосіб одержання антибіотика 107891 і його Факторів А1 і А2 і їх солей з кислотами, що включає стадії: культивування Microbispora sp. АТСС РТА-5024 або його варіанта або мутанта, що зберігає здатність продукувати згаданий антибіотик, за аеробних умов, у водному поживному середовищі, яке містить засвоюване джерело вуглецю, азоту і неорганічних солей; виділення одержаного антибіотика з міцелію і/або фільтрування ферментаційного бульйону; і очищення виділеного антибіотика 107891. 22. Спосіб згідно з пунктом 21, де штам Microbispora sp. АТСС РТА-5024 або його варіант або мутант, що продукує антибіотик 107891, попередньо культивують. 23. Спосіб згідно з пунктом 21, де виділення антибіотика 107891 проводять фільтруванням ферментаційного бульйону і антибіотик виділяють з фільтрованого ферментаційного бульйону згідно з методикою, яку вибирають з групи, що включає екстрагування розчинником, що не змішується з водою, осадження додаванням осаджувача або шляхом зміни рН розчину, абсорбційну хроматографію, розподільну хроматографію, розподільну хроматографію з оберненою фазою, іонообмінну хроматографію, молекулопоглинальну хроматографію і комбінацію двох або декількох згаданих методик. 24. Спосіб згідно з пунктом 21, де виділення антибіотика 107891 проводять шляхом виділення міцелію з надосадкової рідини ферментаційного бульйону і міцелій, екстрагують розчинником, що змішується з водою, в якому, після видалення збідненого міцелію, одержують розчин, що змішуєть 87548 8 ся з водою, який містить неочищений антибіотик, який можна піддати або окремо, або разом з фільтрованим ферментаційним бульйоном виділенню антибіотика 107891 за допомогою методики, яку вибирають з групи, що включає екстрагування розчинником, осадження додаванням осаджувача або шляхом зміни рН розчину, абсорбційну хроматографію, розподільну хроматографію, розподільну хроматографію з оберненою фазою, іонообмінну хроматографію, молекулопоглинальну хроматографію і комбінацію двох або декількох згаданих методик. 25. Спосіб згідно з пунктом 24, де концентрацію розчинника, що змішується з водою, в екстракті міцелію зменшують перед виділенням з нього антибіотика. 26. Спосіб згідно з пунктом 23, де фільтрований ферментаційний бульйон піддають контактуванню з абсорбційною смолою і згадану смолу елююють полярним розчинником, що змішується з водою, або його сумішшю з водою, одержуючи розчин, що містить неочищений антибіотик 107981. 27. Спосіб згідно з пунктом 26, де абсорбційну смолу вибирають з групи, що включає полістирольну, змішану полістирол-дивінілбензольну і поліамідну смолу. 28. Спосіб згідно з пунктом 24, де міцелій екстрагують С1-С3 спиртом і екстракт міцелію піддають контактуванню з абсорбційною смолою і елююють її полярним розчинником, що змішується з водою, або його сумішшю з водою, одержуючи розчин, що містить неочищений антибіотик 107891. 29. Спосіб згідно з пунктом 23, де розчини, що містять неочищений антибіотик 107891, об'єднують і піддають подальшому очищенню згаданого антибіотика 107891. 30. Спосіб згідно з пунктом 26, де розчин, що містить, неочищений антибіотик 107981, концентрують і потім ліофілізують одержуючи неочищений антибіотик 107891, як твердий продукт. 31. Спосіб згідно з пунктом 26, де абсорбційні смоли, що містять абсорбований антибіотик, об'єднують і їх суміш елююють полярним розчинником, що змішується з водою, або його сумішшю з водою. 32. Спосіб згідно з пунктом 21, де антибіотик 107981 очищають за допомогою хроматографії, переважно, за допомогою препаративної ВЕРХ або хроматографії середнього тиску. 33. Спосіб згідно з пунктом 21, де Фактор А1 і Фактор А2 виділяють за допомогою препаративної ВЕРХ з очищеного антибіотика 107891. 34. Фармацевтична композиція, що містить антибіотик, який вибирають з антибіотика 107891, Фактора А1 антибіотика 107891, Фактора А2 антибіотика 107891 і суміші згаданих Факторів в будьякому співвідношенні або його фармацевтично прийнятної солі з кислотою. 35. Фармацевтична композиція згідно з пунктом 34, що також містить фармацевтично прийнятний носій. 36. Антибіотик 107891, його Фактор А1, його Фактор А2 або суміш згаданих Факторів в будь-якому співвідношенні або його фармацевтично прийнят 9 87548 10 на сіль з кислотою, для застосування як медикаменту. 37. Застосування антибіотика 107891, його Фактора А1, його Фактора А2 або суміші згаданих Факторів в будь-якому співвідношенні або його фармацевтично прийнятної солі з кислотою, для виготовлення медикаменту для лікування або профілактики бактеріальної інфекції. 38. Застосування антибіотика 107891, його Фактора А1, його Фактора А2 або суміші згаданих Фак торів в будь-якому співвідношенні або його фармацевтично прийнятної солі з кислотою, як промотора росту тварини. 39. Біологічно чиста культура штаму Microbispora sp. АТСС РТА-5024 або його варіанта або мутанта, що зберігає здатність продукувати антибіотик 107891, коли культивуються при зануренні за аеробних умов в присутності засвоюваного джерела вуглецю, азоту і неорганічних солей. Ця заявка є міжнародноподаною на основі заявки US з сер. № [номер патентного повіреного 892,280-500], що подана 26 січня 2005, яка є частковим продовженням заявки US з сер. №11/035,296, що подана 12 січня 2005, яка є частковим продовженням заявки US з сер. №10/521,336, що подана 11 січня 2005, яка є §371 національно поданою РСТ/ЕР2004/007658, 12 липня 2004, пріоритет якої заявлений в ЕР завці №03016306,7, що подана 18 липня 2003, всі з яких спеціально включені сюди як посилання у всій своїй повноті. Представлений винахід стосується антибіотика мікробного походження, довільно названого антибіотик 107891, який є комплексом, що включає Фактори А1 і А2, його фармацевтично прийнятних солей, його фармацевтичних композицій і його застосування як антибактеріального агенту. Іншим об'єктом представленого винаходу є спосіб одержання антибіотика107891, який влючає культивування Microbispora sp. 107891 (тут далі згадується як Microbispora sp. АТСС РТА5024) або його варіанта або мутанта, що зберігає здатність продукувати згаданий антибіотик, виділення антибіотика винаходу з міцелію і/або з ферментаційного бульйону, виділення чистої речовини хроматографічними засобами і розділення Факторів А1 і А2. Антибіотик 107891 є новим антимікробним агентом з пептидною структурою, що містить лантіонін і метиллантіонін як складові. Це є типовою характеристикою лантибіотиків і, зокрема, підгрупи, що спочатку діє на біосинтез стінок клітин. Лантибіотики є пептидами, які містять тіоетер амінокислоти лантіоніну також як і деякі інші модифіковані амінокислоти [Н. G. Sahl and G. Bierbaum, (1998) "Lantibiotics: biosynthesis and biological activities of uniquely modified peptides from gram-позитивний bacteria", Ann. Rev. Microbiol. 52:41-79]. Основні відомі лантибіотики мають антибактеріальну активність, хоча є повідомлення про активність по відношенню до різних фармакологічних цілей. Антибактеріальні лантибіотики можна грубо розділити на дві групи виходячи з їх структур: лантибіотики типу-Α є типово подовженими амфіфільними пептидами, в той час як лантибіотики типу-В є компактними і глобулярними [О. McAuliffe, R. P. Ross and C. Hill, (2001): "Lantibiotics: structure, biosynthesis and mode of action". FEMC Microb. Rev. 25: 285-308]. Нізин є типовим представником лантибіотика типу А, в якому актагардин (гардиміцин) і мерсацидин на лежить до підкласу лантибіотика типу В. І нізинові і мерсацидинові лантибіотики взаємодіють з мембрано-зв'язаним пептидоглікановими попередниками ліпіду II, хоча два класи відрізняються по дії, вони продукуються в процесі бактерілаьної проліферації. Нізинові лантибіотики в основному вбивають бактерію шляхом порушення проникності мембрани [Н. Brotz, Μ. Josten, I. Wiedemann, U. Schneider, F. Gotz, G. Bierbaum and H. G. Sahl, (1998): "Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics", Mol. Microbiol. 30:317-27], де мерсацидинові лантибіотики в основному вбивають бактеріальну клітину шляхом інгібування біосинтезу стінок клітини [Н. Brotz, G. Bierbaum, К. Leopold, P. Ε. Reynolds and H. G. Sahl, (1998): "The lantibiotics mersacidin inhibits peptidoglycan synthesis by targeting lipid II", Antimicrob Agents Chemother. 42:154-60]. Два антибіотики, що продукуються штамом NRRLL 30420 Microbispora corallina, ідентифіковані як MF-BA-1768a1 і ΜΡ-ΒΑ-1768b1, відповідно, описуються в патенті US №6,551,591 В1. В описаному вище патенті розкриті фізико-хімічні дані (наприклад, мас-спектроскопічні дані, молекулярна вага, вміст амінокислот) і порівняння часу утримувань РХ-МС експериментальних аналізів чітко показала, що комплексний антибіотик 107891, також як і його компоненти Фактор А1 і Фактор А2 є хімічно відмінними від антибіотиків MF-BA 1768a1 і MF-BA1768b 1. ЕР 0592835А2 описує протипухлинні антибіотики BU-4803TA1, А2, В, C1, C2 і D. Антибіотики BU4803TA1 А2 і В виділяють з ферментаційного бульйону Microbispora ATCC 55327 (АА 9966), в той час як антибіотики BU4803TC1, С2 і D є продуктами трансформації антибіотика BU 4803TA1, А2 і В, відповідно, коли ці продукти зберігаються в диметилсульфоксиді. Фізико-хімічні дані розкриті в ЕР 0592835 А для приведених вище антибіотиків (наприклад, вигляд, абсорбція УФ, молекулярна вага, протипухлинна активність, чітко показують, що вони є хімічними речовинами відмінними від комплексного антибіотика 107891 і його факторів А1 і А2. Штам і ферментування Microbispora sp. 107891 виділили і депонували 27 лютого 2003 у American Type Culture Collection (ATCC), 10801 University Blvd, Manassas Va., 20110-2209 U.S.A., у відповідності із Будапештським договором. Штаму було присвоєно інвентарний номер РТА-5024. 11 Одержання антибіотика 107891 проводять шляхом культивування штаму Microbispora sp здатного його продукувати, тобто Microbispora sp. ATCC РТА-5024 або його варіанту або мутанту, що зберігає здатність продукувати згаданий антибіотик; виділення одержаного антибіотика з цільного культурального бульйону і/або з відокремленого міцелію і/або з фільтрованого ферментаційного бульйону; і очищення виділеного антибіотика хроматографічними засобами. В будь-якому випадку, переважно одержання антибіотика 107891 проводять в аеробних умовах у водному поживному середовищі, що містить легкозасвоювані джерела вуглецю, азоту і неорганічних солей. Може бути використана більшість поживних середовищ, що зазвичай використовується у галузі ферментування, однак деякі середовища є переважними. Переважним джерелом вуглецю є цукроза, фруктоза, глюкоза, ксилоза і їм подібні. Переважними джерелами азоту є соєве борошно, пептон, екстракт м'яса, екстракт дріжджів, триптон, амінокислоти, гідролізований казеїн і їм подібні. Серед неорганічних солей, які можуть бути включені в культуральне середовище, присутні звичайні тверді солі здатні забезпечувати іони натрію, калію, заліза, цинку, кобальту, магнію, кальцію, амонію, хлориду, карбонату, сульфату, фосфату, нітрату і їм подібні іони. Переважно, штам, що продукує антибіотик 107891 попередньо культивують у ферментаційній пробірці або в колбі для струшування, тоді культуру використовують для інокуляції в банковий ферментатор для одержання основних кількостей речовин. Середовищем, що використовується, для попереднього культивування може бути тим же самим як і те що використовується для об'ємних ферментацій, але також може бути використане і інше середовище. Штам, що продукує антибіотик 107891, може вирощуватись при температурах від 17°С до 37°С, оптимальними температурами є температура приблизно 28-30°С. Під час ферментації, утворення антибіотика 107891 можна контролювати за допомогою біодослідження на сприйнятливих мікроорганізмах і/або використовуючи ВЕРХ аналізи. Максимум продукування антибіотика 107891 зазвичай спостерігається після від 90 години до 200 години ферментування. Антибіотик 107891 одержують культивуванням Microbispora sp. ATCC РТА-5024 або його варіанта або мутанта здатного продукувати антибіотик 107891, і знаходиться в культуральному бульйоні і/або в міцелії. В цьому описі і пунктах формули термін "антибіотик 107891", якщо не вказано інше, означає комплексний антибіотик 107891, що включає Фактори А1 i Α2. Морфологічні характеристики Microbispora sp. АТСС РТА-5024 Microbispora sp. АТСС РТА-5024 добре росте на різних стандартних твердих середовищах. Мікроскопічні вимірювання проводили використовуючи ріст культури на гумінова кислота-агар із слідами солі (склад в г/л: гумінова кислота 0,5, FeSO4*7H2O 0,001, MnСІ2*4Н2О 0,001, ZnSO4*7H2O 87548 12 0,001, NiSO4*6H2O 0,001, MOPS 2, агар 20) доповненому 1мл/л розчину вітамінів (гідрохлорид тимідину 25мг/л, пантотенат кальцію 250мг/л, нікотинова кислота 250мг/л, біотин 0,5мг/л, рибофлавін 1,25г/л, ціанокобаламін 6,25мг/л, парамінобензойна кислота 25мг/л, фолієва кислота 500мг/л, гідрохлорид піридоксалю 500мг/л). В рідкій культурі (V6 середовище, склад в г/л: декстроза 22, екстракт м'яса 5, екстракт дріжджів 5, казеїн 3, NaCI 1,5) не спостерігалась фрагментація міцелію після 6 днів росту при 28°С. Мікроскопічне дослідження на гумінова кислота-агар із слідами солі (після 21 днів інкубування при 28°С) показало ветвління нефрагментованого субстрату міцелію і моноподіальне ветвління аеріального міцелію; також спостерігалась наявність багатьох довгих прямих і незначно розгалужених аеральних гіфів. Характеристичні продольні пари спор ростуть короткими спорофорами, що латерально виникають з відгалужень або безпосередньо з основного аерального гіфу. Спори є кульоподібними i нерухливими. Спорангій-подібні тіла або інші частинки структур не спостерігаються. Культуральні характеристики Microbispora sp. АТСС РТА-5024 Microbispora sp. АТСС РТА-5024 вирощували протягом шести днів в AF/MC рідкому середовищі (дивіться Приклад 1) при 28°С і 200об/хв, тоді переносили (5% інокулювання) до нового AF/MC рідкого середовища і вирощування продовжували ще 6 днів і потім інокулювали (7% інокулювання) в 100мл V6 рідке середовище (дивіться Приклад 1). Після вирощування 6 днів при 28°С і 200об/хв, збирали міцелій центрифугуванням і три рази промивали стерильним розчином саліну, потім розводили одержуючи придатний розчин для інокулювання. Аліквотами суспензії штрихували перехресними штрихами різні середовища рекомендовані Shirling and Gottlieb [Ε. Β. Shirling and D. Gottlieb, (1966): "Method for Characterization of Streptomyces species", Int. J. Syst. Bacteriol. 16: 313-340, і середовище рекомендоване S. A. Waksman (1961): "The Actinomycetes", The Williams and Wilkins Co., Baltimore. Vol. 2 :328-334]. Придатність для використання різних карбогідратів як джерела вуглецю і енергії визначали використовуючи середовище ISP4 без крохмалю, доповнене 1мл/л розчину вітаміну описаного вище як основного середовища; кожне джерело вуглецю додавали в кінцевій концентрації 1% (в/о). NaCI толерантність, рН інтервал росту також як і здатність до росту при різних температурах визначали на ISP2 середовищі. Всі середовища інкубували при 28°С протягом трьох тижнів; описи стосуються 21 дня якщо не вказано інше. Колір оцінювали при звичайному денному освітленні використовуючи Атлас кольорів Maerz and Paul [A. Maerz and Μ. R. Paul, 1950 - A Dictionary of Colour, 2nd edition. McGraw-Hill Book Co. Inc., New York]. Здатність відновлювати нітрати у нітрити оцінювали на вологому Нітратному середовищі за методикою описаною Williams et al. [S. Т. Williams, M. Goodfellow, G. Alderson, Ε. Μ. Η. Wellington, P. H. A. Sneath & Μ. J. Sackin, 1983-Numerical 13 87548 classification of Streptomyces and related genera - J. Gen. Microbiol. 129, 1743-1813]. Ріст, появу колоній, субстрат і колір аеріального міцелію і продукування пігменту для штаму Microbispora sp. АТСС РТА-5024 описано в Таблиці І. Вегетативний ріст присутній на більшій частині використовуваного середовища, на відміну від аврального міцелію, де він присутній тільки в деяких його частинах. На будь-якому з використову 14 ваних середовищ не спостерігається явне пігментування. Фізіологічні характеристики штаму приведені в Таблиці II. Ріст і продукування аеріального міцелію спостерігається при 17°С але не при 43°С. Продукування аеріального міцелію на ISP2 спостерігається при рН вище ніж 6, і в той час відсутнє в присутності 1% NaCI. Придатність до застосування різних карбогідратів для росту показано в Таблиці III. Таблиця І Характеристики росту Microbispora sp. АТСС РТА-5024 Середовище ISP2 Агар з екстракту дріжджів - екстракту солоду ISP3 Агар вівсяного борошна ISP4 Неорганічні солі крохмальний агар Glu/Asp Глюкозааспарагіновий агар ISP6 Пептон - екстракт дріжджів - агар заліза ISP7 Ріст та морфологія Зміна коду кольору 5 Ε 12 Рясний ріст, зморшкувата поверхня; добре продукування рожевуватого (2А8) аврального міцелію. Незначне продукування оранжувато/червоний оранжувато/світло-коричневого розчинного пігменту Рясний ріст; добре продукування рожевуватого (2А8) аврально- 11 Η 10 го міцелію, особливо на рукавах перехресних штрихів. Незначоранжувато/рожевий не продукування оранжевуватого розчинного пігменту. 11 I 9 добрий ріст; відсутність продукування аврального міцелію. Не продукуються розчинні ферменти. Гідролізується крохмаль оранжевий Дискретний ріст, незначний; продукування тонкого беже- 12 K 12 во/рожевуватого (9В4) аеріального міцелію на рукавах пере- оранжевувато/світлохресних штрихів. Не продукуються розчинні ферменти. коричневий Обмежений ріст, з рожевуватими одиничними колоніями, що ростуть у висоту, згорнуті, із гладкою поверхнею; не продуку- Не визначений ється аеральний міцелій. Відсутнє потемніння середовища. Бідний ріст тонкого, оранжевувато/світло-коричневого субстрату міцелію; не продукується аеральний міцелій. Відсутнє поте- Не визначений Тирозинів агар мніння середовища. ISP3+YE 4 В 12 Рясний ріст, зморшкувата поверхня; дуже обмежене продукуВівсяне борошвання тонкого, рожевуватого аврального міцелію. Не продукуно/агар 1% екстраоранжувато/червоний ються розчинні ферменти. кту дріжджів (ISP4 і глюкоза-аспарагіновий агар доповнювали 1мл/л розчину вітамінів) Таблиця II Фізіологічні характеристики Microbispora sp. АТСС РТА-5024 Тест Реакція Гідроліз крохмалю Позитивна Гідроліз казеїну Негативна Засвоєння малату кальцію Негативна Пептонізація індикаторного бактеріологічного Негативна середовища Коагуляція індикаторного бактеріологічного Негативна середовища Розжиження желатину Негативна до слабо позитивної Тирозинова реакція Негативна Відновлення нітрату Позитивна Відсутній ріст при 4,2, добрий 5,5-8,8; не тестувався вище рН інтервал росту (14 днів) цього інтервалу. Аеральний міцелій відсутній при рН£6,5 NaCI % толерантність £2; відсутність аврального міцелію при ³1. 17°С-37°С. Присутній аеральний міцелій у всьому інтерваІнтервал температур росту лі; відсутній ріст при 43°С. 15 87548 Таблиця III Поглинання джерела вуглецю Microbispora sp. АТСС РТА-5024 Джерело вуглецю Арабіноза Целюлоза Фруктоза Інозит Маніт Рафіноза Рамоза Цукроза Ксилоза Глюкоза Гліцерин Без цукру Ріст (14 днів) ++ ++ +/+++ +++ +++ ++ ++ +++ значний ріст; ++ добрий ріст; + посередній ріст; +/- обмежений ріст, - відсутність росту; аеральний міцелій завжди відсутній. Хемотаксономічні характеристики Microbispora sp. АТСС РТА-5024 Microbispora sp. АТСС РТА-5024 вирощували в GYM середовищі (глюкоза 4г/л; екстракт дріжджів 4г/л; екстракт солоду 10г/л) при 28°С на роторному шейкері і міцелій збирали, двічі промивали стерильною дистильованою водою і потім ліофілізували. Проводили аналіз амінокислот згідно із способом Станек і Роберте [J. L. Staneck and G. D. Roberts, (1974): "Simplified approach to identification of aerobic actinomycetes by thin-layer chromatography", Appl. Microbiol. 28: 226-231]. Менахінони і полярні ліпіди екстрагували за наступною методикою Міннікін та ін. [D. Е. Minnikin, A. G. O'Donnell, Μ. Goodfellow., G. Alderson, Μ. Athalye, A. Schaal and J. H. Parlett, (1984): "An integrated procedure of isoprenoid quinones and polar lipids", J. Microbiol. Meth. 2: 233-241]. Аналізували полярні ліпіди використовуючи тонкошарову хроматографію [D. Е. Minnikin, V. Patel, L. Alshamaony, and Μ. Goodfellow, (1977): "Polar lipid composition in the classification of Nocardia and related bacteria", Int. J. Syst. Bacteriol. 27.104-117], менахінони за допомогою ВЕРХ [R. M. Kroppenstedt, (1982): "Separation of bacterial menaquinones by HPLC using reverse phase RP18 and a silver loaded ion exchanger as stationary phase", J. Liquid. Chromat. 5:2359-2367; R. M. Kroppenstedt, (1985): "Fatty acid and menaquinone analysis of actinomycetes and related organisms", in: Chemical Methods in Bacterial Systematics. No20 SAB Technical Series pp. 173199, M. Goodfellow and D. E. Minnikin eds, Academic Press, London] і метилові естери жирних кислот за допомогою газо-рідинної хроматографії, відповідно [L Τ Miller, (1982): "A single derivatization method for bacterial fatty acid methyl esters including hydroxy acids", J. Clin. Microbiol. 16: 584-586; M. Sasser, (1990): "Identification of bacteria by gas chromatography of cellular fatty acids", USFCC News Letters 20:1-6]. Присутність міколових кислот пере 16 віряли за методом Міннікін та ін. [D. Е. Minnikin, L. Alshamaony, and M. Goodfellow, (1975): "Differentiation of Mycobacterium, Nocardia and related taxa by thin layer chromatographic analysis of whole organism methanolyzates", J. Gen Microbiol. 88: 200-204]. Клітинні гідролізати штаму Microbispora sp. ATCC PTA-5024 містять мезо-діамінопімелінову кислоту як діамінокислоту пептидоглікану. Домінуючими менахінонами є МK-9(ІІІ, Vlll-H4), MK-9(H2) і МK-9(Н0). Полярність ліпідної компоненти характеризується присутністю фосфатидилетаноламіну, метилфосфатидилетаноламіну, фосфатидилгліцерину, дифосфатидил-гліцерину, фосфатидилінозиту, фосфатидил-інозитманозидів і Nацетилглюкозаміну, що містить фосфоліпід, тобто фосфоліпід типу IV згідно до Лешевальє та ін. [Н. A. Lechevalier, С. De Brieve and Μ. P. Lechevalier, (1977): "Chemotaxonomy of aerobic actinomycetes: phospholipid composition", Biochem. Syst. Ecol. 5: 246-260]. Основними компонентами жирної кислоти є антеізо 15:0, ізо 16:0, н-16:0, антеізо 17:0, і 10метил-гептадеканова (10-Ме-17:0), тобто 3с згідно Кроппенстедта [R. М. Kroppenstedt, (1985): "Fatty acid and menaquinone analysis of actinomycetes and related organisms", in: Chemical Methods in Bacterial Systematics. No20 SAB Technical Series pp. 173199. M. Goodfellow and D. E. Minnikin eds, Academic Press, London]. Міколова кислота не детектувалась. Визначення 16S рДНК послідовності Microbispora sp. ATCC PTA-5024 Часткову послідовність 16 рРНК гену (16S рДНК), тобто 1443 нуклеотиди, що відповідає 95% повній рРНК, штаму Microbispora sp. ATCC PTA5024, визначали за наступною опублікованою методикою [P. Mazza, P. Monciardini, L. Cavaletti, Μ. Sosio and S. Donadio, (2003): "Diversity of Actinoplanes and related genera isolated from an Italian soil", Microbial Ecol. 5:362-372]. Вона розкрита в SEQ ID NO 1. Цю послідовність порівнювали з послідовністю штаму Microbispora corallina NRRL 30420 (MF-BA1768), як повідомлялось в патенті US №6,551,591 В1. Дві послідовності співставляли і встановлювали відмінність в 31 з 1456 співставлених положень, що відповідало загальній розбіжності послідовності 2,13%. Будь-які два штами, що різняться менше ніж на 97,5% ідентичності послідовності зазвичай належить до різних видів [Stackebrandt, Ε. і Embley, Μ. Τ. (2000) "Diversity of Uncultered Microorganisms in the Environment". In: Nonculturable Microorganisms in the Environment, R. R. Colwell і D. J Grimes (eds). ASM, Press, Washington D.C., pp. 57-75]. Тому 2% рівень розбіжності послідовності є доволі високим [RossellMora, R., and Amann, R. (2001). "The Species Concept for Prokaryotes". FEMC Microbiol. Rev. 25. 39-67] і вказує на те, що Microbispora sp. ATCC PTA-5024 і Microbispora corallina NRRL 30420 (MFBA-1768) є різними штамами. Ідентичність штаму Microbispora sp. АТСС РТА-5024 17 Штам, що продукує антибіотик 107891, відноситься до виду Microbispora, родини Streptosporangiaceae оскільки має наступні хемотаксономічні і морфологічні характеристики: - присутність мезо-діамінопімелінової кислоти в стінках клітини; - значні кількості МK-9(ІІІ, Vlll-H4) і фосфоліпіду типу IV згідно з Лешевальє та ін. [Н. A. Lechevalier, С. De Brieve and Μ. P. Lechevalier, (1977): "Chemotaxonomy of aerobic actinomycetes: phospholipid composition", Biochem. Syst. Ecol. 5: 246-260]; - жирна кислота профілю 3с sensu Кроппенстедт [R. M. Kroppenstedt, (1992) "The genus Nocardiopsis", in: The Prokariotes, Vol II, pp. 11391156, A. Balows, H. Truper, M. Dworkin, W. Harder and K. H. Schleifer eds; New York, Springer-Verlag]; - відсутність міколових кислот; - утворення характеристичних продольних пар спор на кінцях коротких спорофорів, що латерально відгалужуються від аеріального гіфу. Нерухливі спори. - часткова послідовність 16 рРНК гену (16S рДНК), тобто 1443 нуклеотиди, що відповідає 95% повної рРНК, показаній в SEQ ID NO.1, що має >97% ідентичності 16S рДНК послідовності з описаних видів Microbispora. Як і у випадку інших мікроорганізмів, характеристики штаму, що продукує антибіотик 107891, зазнають змін. Наприклад, штучні варіанти і мутанти штаму можна одержати шляхом обробки різними відомими мутагенами, такими як УФ випромінювання і хімікати, такі як азотиста кислота, Nметил-N'-нітро-N-нітрозогуанідин і багато інших. Всі природні і штучні варіанти і мутанти штаму Microbispora sp. АТСС РТА-5024 здатного продукувати антибіотик 107891 розглядаються як еквівалентні до нього для цілей цього винаходу і тому знаходяться в межах рамок винаходу. Екстрагування і очищення антибіотика 107891 Як згадано вище, антибіотик 107891 майже однаково розподілений в міцелії і в фільтрованій фракції ферментаційного бульйону. Віджатий бульйон можна одержати відокремленням міцелію від надосадкової рідини ферментаційного бульйону і міцелій можна екстрагувати розчинником, що змішується з водою, одержуючи розчин, що містить 107891 антибіотик, після видалення збідненого міцелію. Цей міцелійний екстракт можна потім обробити окремо або у поєднанні з надосадковою рідиною згідно з методиками описаними тут далі для фракції надосадкової рідини. Коли розчинник, що змішується з водою, може втручатися у виділення антибіотика з екстракту міцелію, розчинник, що змішується з водою, може видалятись перегонкою або може розводитись водою до концентрації, що не впливає. Термін "розчинник, що змішується з водою," як використовується в цій заявці, має значення на даний момент відоме в цій галузі для цього терміну і стосується розчинників, що за використовуваних умов, змішуються з водою в достатньо широкому інтервалі концентрацій. Прикладами органічних розчинників, що змішуються з водою, які можуть бути використані при екстракції сполук 87548 18 винаходу є: нижчі спирти, наприклад (С1-С3) спирти, такі як метанол, етанол і пропанол; феніл (С1С3) спирти, такі як бензиловий спирт; нижчі кетони, наприклад (С3-С4) кетони, такі як ацетон і етилметилкетон; циклічні етери, такі як діоксан і тетрагідрофуран; гліколі і їх продукти часткового етерифікування, такі як етиленгліколь, пропіленгліколь і монометиловий етер етиленгліколю, нижчі аміди, такі як диметилформамід і діетилфоримамід; оцтова кислота, диметилсульфоксид і ацетонітрил. Виділення сполуки з надосадкової рідини ферментаційного бульйону продукуючих організмів проводять згідно з відомими методиками, що включають екстрагування розчинниками, осадження додаючи нерозчинники або зміна рН розчину, шляхом розподільчої хроматографії, розподільчої хроматографії з оберненою фазою, іонобмінної хроматографії, хроматографії молекулярного виключення і їм подібні або комбінацією двох або більше згаданих методик. Процедура виділення сполук винаходу з фільтрованого ферментаційного бульйону включає екстрагування антибіотика 107891 органічним розчинником, що незмішується з водою, з наступним осадженням з концентрованого екстракту, можливо з додаванням осаджуючого агенту. Також в цьому випадку, термін "розчинник, що незмішується з водою" як використовується в цій заявці, має значення на даний момент відоме в цій галузі для цього терміну і стосується розчинників, що за використовуваних умов, слабо змішуються або практично не змішуються з водою в достатньо широкому інтервалі концентрацій, придатний для плануємого застосування. Прикладами органічних розчинників, що не змішуються з водою, які можуть бути використані при екстракції сполук винаходу з ферментаційного бульйону є: спирти з, принаймні, чотирма атомами вуглецю, які можуть бути лінійними, розгалуженими або циклічними, такими як н-бутанол, 1-пентанол, 2пентанол, 3-пентанол, 1-гексанол, 2-гексанол, 3гексанол, 3,3-диметил-1-бутанол, 4-метил-1пентанол, 3-метил-1-пентанол, 2,2-диметил-3пентанол, 2,4-диметил-3-пентанол, 4,4-диметил-2пентанол, 5-метил-2-гексанол, 1-гептанол, 2гептанол, 5-метил-1-гексанол, 2-етил-1-гексанол, 2-метил-3-гексанол, 1-октанол, 2-октанол, циклопентанол, 2-циклопентилетанол, 3-циклопентил-1пропанол, циклогексанол, циклогептанол, циклооктанол, 2,3-диметил-циклогексанол, 4етилциклогексанол, циклооктилметанол, 6-метил5-гептен-2-ол, 1-нонанол, 2-нонанол, 1-деканол, 2деканол і 3-деканол; кетони з принаймні п'ятьма атомами вуглецю, такі як метилізопропілкетон, метилізобуилкетон, метил-н-амілкетон, метилізоамілкетон і їх суміші. Як відомо в цій галузі, продукт екстракції з фільтрованого ферментаційного бульйону можна покращити шляхом доведення рН до прийнятного значення і/або шляхом додавання певної органічної солі, що утворює іонну пару з антибіотиком, який є розчинним в екстракційному розчиннику. Як відомо в цій галузі, розділення фаз можна покращити шляхом насичення водної фази сіллю. 19 Коли, після екстракції, органічну фазу, що містить значні кількості води, відновлюють, і це можна без проблем здійснити шляхом азеотропної відгонки від неї води. Загалом, це потребує додавання розчинника здатного утворювати мінімальні азеотропні суміші з водою, з наступним додаванням осаджуючого агенту для осадження бажаного продукту, якщо необхідно. Типовими прикладами органічних розчинників здатних утворювати мінімальні азеотропні суміші з водою є: н-бутанол, бензол, толуол, бутиловий етер, тетрахлорид вуглецю, хлороформ, циклогексан, 2,5диметилфуран, гексан і м-ксилен; переважним розчинником є н-бутанол. Прикладами осаджувальних агентів є петролейний ефір, нижчі алкілові етери, такі як етиловий етер, пропіловий етер і бутиловий етер, і нижчі алкілові кетони, такі як ацетон. Згідно з переважною методикою виділення антибіотика 107891, фільтрований ферментаційний бульйон може контактувати з адсорбційною матрицею з наступним елююванням полярним розчинником, що змішується з водою, або його сумішшю, концентруванням до маслянистого залишку при пониженому тиску і осадження осаджувальним агентом типу вже згаданого вище. Прикладами адсорбційних матриць, що можуть бути легко використані при виділенні сполук винаходу, є полістирол або змішані полістиролдівінілбензольні смоли (наприклад М112 або S112, Dow Chemical Co.; AmberliteÒ XAD2 або XAD4, Rohm & Haas; Diaion HP 20, Mitsubishi), акрилові смоли (наприклад XAD7 або XAD8, Rohm & Haas), поліаміди, такі як полікапролактами, найлони і поперечно зшиті полівінілпіролідони (наприклад Poliamide-CC 6, Poliamide-SC 6, Poliamide-CC 6.6, Poliamide-CC 6AC і Poliamide-SC 6AC, MachereyNagel & Co., Germany; Pa. 400, M. Woelm AG, Germany); і полівінілпіролідонові смоли PVP-CL, (Aldrich Chemie GmbH & Co., KG, Germany) і поперечно-зшиті мембрани з контрольованим розміром пор (наприклад SephadexÒ LH-20, Pharmacia Fine Chemicals, AB). Переважно, використовуються полістиролові смоли, особливо переважною є смола Diaion HP 20. У випадку полістиролових смол, полістиролдивінілбензольних смол, поліамідних смол або акрилових смол, переважним елюентом є розчинник, що змішується з водою, або його водні суміші. Водні суміш можуть містити буфери із прийнятним значенням рН. Також в цьому випадку, термін "розчинник, що змішується з водою", як використовується в цьому описі і пунктах формули винаходу, має значення на даний момент відоме в цій галузі для цього терміну, як описано вище. Наступні методики виділення і очищення антибіотика можуть бути проведені на об'єднаних екстрактах з бульйону надосадкової рідини і з міцелію. Наприклад, коли частина антибіотика, що міститься у фільтрованому ферментаційному бульйоні або надосадковій рідині, виділяють шляхом абсорбування на абсорбційній смолі і частину антибіотика, що міститься в міцелії, екстрагують з нього використовуючи розчинник, що змішується з 87548 20 водою, з наступним адсорбуванням на абсорбційні смолі, елюювальні фракції з кожної з двох стадій абсорбції можна об'єднати, необов'язково після концентрування, і потім ще обробити як єдине ціле. Альтернативно, коли використовувані дві порції абсорбційної смоли для окремих стадій розділення є такими ж самими і мають ті ж самі функціональні характеристики, вони можуть бути об'єднані разом і суміш можна піддати спільному елююванню, наприклад, розчинником, що змішується з водою, або його сумішшю з водою. В будь-якому випадку, використовують будьяку методику адаптовану для виділення неочищеного антибіотика 107981, з наступною стадією очищення суміші неочищених матеріалів одержаних після комбінування продуктів виділених з окремих стадій екстракції. Очищення неочищеного антибіотика 107891 можна проводити за будь-якою методикою відомою в цій галузі методикою, але переважно проводять за допомогою хроматографічних засобів. Прикладами цих хроматографічних методик є такі, що описані стосовно стадії виділення і включають також хроматографію на стаціонарних фазах, таких як силікагель, оксид алюмінію, активований силікат магнію та їм подібні або хроматографію з оберненою фазою на силанізованому силікагелі, що має різні функціоналізовані похідні і елююють розчинниками, що змішуються з водою, або водною сумішшю розчинників, що змішуються з водою, видів згаданих вище. Наприклад, препаративну ВЕРХ хроматографію можна проводити використовуючи RP-8 або RP-18 як стаціонарну фазу і суміш буфер HCOONH4:CH3CN як елюювальну систему. Активні фракції, що виділяють на стадії очищення, об'єднують разом, концентрують у вакуумі, осаджують додаючи осаджувальний агент згаданого вище виду і сушать або ліофілізують за один або декілька циклів. У випадку продукту, що містить залишкові кількості форміату амонію або інших буферувальних солей, їх можна видалити шляхом абсорбування антибіотика 107891 на екстракційні колонці з твердою фазою, наприклад, на смолі колонки з оберненою фазою, такою як SPE Superclean LCP18 Supelco (Bellefonte Pa., USA) з наступним промиванням дистильованою водою і елююванням прийнятною сумішшю водного розчинника, наприклад, етанол:вода. Антибіотик потім виділяють шляхом видалення елюювальних розчинників. Відповідно, одержують суху рецептуру очищеного комплексного антибіотика 107891 як білий порошок. Як зазвичай в цій галузі, стадії одержання також як і виділення, і очищення можна контролювати за допомогою різних аналітичних методик включаючи дослідження проти сприйнятливих мікроорганізмів, а аналітичний контроль використовуючи ВЕРХ або ВЕРХ поєднану з масспектрометрією. Переважну аналітичну ВЕРХ проводять на пристрої Waters (Waters Chromathography, Milford, Mass.) спорядженому колонкою Waters Simmetry 21 shield RP8, 5m (250´4,6мм), що елююють потоком із швидкістю 1мл/хв і при температурі 50°С. Елюювання проводять за багатоступневою програмою: Час=0 (30% фаза В); Час=8хв (30% Фаза В); Час=28хв (40% фази В). Фазою А був ацетонітрил· 100мМ буфер форміату амонію (рН: 5,0) 5:95 (об/об) i Фазою В був ацетонітрил. УФ детектор був на 282нм. Витік з колонки розділяли у співвідношенні 5:95 і основну частину (приб. 950mл/хв) подавали на фотодіодну матрицю детектора. Частину що залишилась 50mл/хв подавали до ЕСІ інтерфейсу іонної пастки мас-спектрометра Finnigan LCQ (Thermoquest, Finnigan MAT, San Jose CA). Mac-спектрометричний аналіз проводили за наступних умов: Умови введення зразка: Газ носій (N2) 60псі; Допоміжний газ (N2) 5псі; Капілярний нагрівач 250°С; Параметри напруги вводу зразка: Полярність і позитивна, і негативна; Напруга іонного розпилення +/-5кВ; Капілярна напруга +/-19В, Умови сканування: максимальний час іону 200мс; Час іону 5мс; Повне мікросканування 3; Сегмент протягом 30хв, сканування позитивні (150-2000 m/z) і негативні (150-2000 m/z). За цих аналітичних ВЕРХ умов Фактори А1 і А2 антибіотика 107891 мають час утримування 13,2хв і 13,9хв, відповідно. За цієї ж самої ВЕРХ системи Фактор А2 Рамопланіну [L. Gastaldo, R. Ciabatti, F. Assi, E. Restelli, J. К. Kettenrinr, L. F. Zerilli, G Roman, M. Denaro and B. Cavalleri, (1992): "Isolation, structure determination and biological activity of A-16686 Factors Α'1, A'2 і A'3 glycolipodepsipeptide antibiotics", J. Ind. Microbiol. 11: 13-18] елююється з часом утримування 7,5хв. Фактори А1 та А2 антибіотика 107891 можна виділити з очищеного зразка комплексного антибіотика 107891 за допомогою препаративної ВЕРХ. Фактор А1 відокремлювали і очищали на колонці Symmetry Prep. C18 з очищеним комплексним антибіотиком 107891 розчиненим в ДМСО: мурашина кислота 95:5 (об/об) використовуючи 25 хвилинне елюювання лінійним градієнтом від 30% до 45% фази В при швидкості потоку 3,5мл. Фазою В був ацетонітрил. Фазою А був 25мМ буфер форміату амонію рН 4,5: ацетонітрил 95:5 (об/об). Елюювальні фракції, що містять чистий Фактор А1 антибіотика 107891 об'єднували і концентрували у вакуумі. Залишковий розчин ліофілізували одержуючи чистий Фактор А1 як білий порошок. Фактор А2 відокремлювали і очищали ізократичним елююванням на колонці Symmetry Prep. C18 з очищеним комплексним антибіотиком 107891 розчиненим в суміші оцтова кислота ацетонітрил: 100мМ буфер форміату амонію (рН 4) 50:120:80 (об/об). Ізократичне елюювання проводили із швидкістю потоку 7мл суміші 100мМ буфер форміату амонію рН 4:ацетонітрил у співвідношенні 82,5:17,5 (об/об). Елюювальні фракції, що містять 87548 22 чистий Фактор А2 антибіотика 107891 об'єднували і концентрували у вакуумі. Залишковий розчин ліофілізували одержуючи чистий Фактор А2 як білий порошок. Оскільки антибіотик 107891 і його фактори А1 і А2, як показало кислото/основне титрування в 2метоксиетанолі (MCS):H2O 12:3 (об/об), містять основну групу, вони здатні утворювати солі з придатними кислотами згідно із звичайними методиками і вони також можуть існувати у вигляді вільноосновної форми. Антибіотик 107891 і його фактори А1 і А2, коли одержуються у вільноосновній формі, можуть бути перетворені з використанням кислоти у відповідні солі, які включають нетоксичні фармацевтично прийнятні солі. Придатними солями є такі солі, що утворюються при стандартній реакції і з органічними, і неорганічними кислотами, такими як, наприклад, хлорводнева, бромводнева, сірчана, фосфорна, оцтова, трифтороцтова, трихлороцтова, бурштинова, лимонна, аскорбінова, молочна, малеїнова, фумарова, пальмітинова, холінова, памоїнова, слизева, глутамова, камфорова, глутарова, гліколева, фталева, винна, лауринова, стеаринова, саліцилова, метансульфонова, бензолсульфонова, сорбінова, пікринова, бензойна, циннамова і їм подібні кислоти. Адитивні солі антибіотика 107891 і його факторів А1 і А2 з кислотами можна одержати згідно із звичайними методиками, що зазвичай використовуються. Як приклад, антибіотик 107891, або його Фактор А1, або його Фактор А2, у вільноосновній формі, розчиняють у мінімальній кількості придатного розчинниками, типово нижчого спирту, або суміші нижчий спирт/вода, і до одержаного розчину поступово додають стехіометричну кількість придатно вибраної кислоти і одержану сіль осаджують додаючи нерозчинник. Адитивну сіль, яка утворилась, виділяють фільтруванням або упарюванням розчинників. Альтернативно, ці солі можна одержати в, по суті, безводній формі шляхом ліофілізації; в цьому випадку сіль антибіотика 107891, або його Фактор А1, або його Фактор А2 з леткою кислотою розчиняють в придатній кількості нелеткої кислоти. Розчин потім фільтрують видаляючи будь-які нерозчинні речовини і ліофілізують за один або декілька циклів. Певну адитивну сіль можна одержати з розчину іншої солі антибіотика 107891, або його Фактора А1, або його Фактора А2, коли бажана сіль осаджується при додаванні прийнятного аніону. Перетворення несольових сполук винаходу у відповідні адитивні солі і зворотний процес, тобто перетворення адитивної солі сполуки винаходу у несольову форму знаходиться в межах знань середнього спеціаліста в цій галузі і охоплюється представленим винаходом. Утворення солей антибіотика 107891 і його факторів А1 і А2 може бути корисним з декількох причин, включаючи розділення, очищення згаданого антибіотика 107891 i його факторів А1 і А2 і їх застосування як терапевтичних агентів або промоторів росту тварин. Для терапевтичних цілей, зазвичай використовують фармацевтично прийнятні солі. 23 Термін "фармацевтично прийнятні солі" означає тут нетоксичні солі, які можна використати в терапії теплокровних тварин. Комплексний антибіотик 107981, його фактори А1 і А2 і суміш згаданих Факторів в будь-якій пропорції можна вводити, як такі або в суміші з фармацевтично прийнятними носіями і також можна вводити у поєднанні з іншими антимікробними агентами, такими як пеніциліни, цефалоспорини, аміноглікозиди і глікопептиди. Спільна терапія, таким чином включає послідовне, одночасне і окреме введення активної сполуки, за умови, що терапевтична дія агенту введеного першим не зникає повністю, коли вводиться наступний. Сполуки винаходу або їх фармацевтично прийнятні адитивні солі можуть бути сформульовані у формі придатній для парентерального, перорального або місцевого введення Для внутрішньовенного ведення при лікуванні будь-якої інфекції викликаної мікроорганізмом чутливим до антибіотику, використовується парентеральна рецептура, наприклад, у воді з прийнятним солюбілізувальним агентом, таким як поліпропіленгліколь або диметилацетамід, і поверхнево-активним агентом (наприклад, поліоксиетиленсорбіту моноолеат або поліетоксильована касторова олія) або циклодекстринами або фосфоліпідами, на основі рецептур в стерильній воді для ін'єктування. Рецептури для ін'єктування також можна одержати з прийнятним циклодекстрином. Комплексний антибіотик 107981, його фактори А1 і А2 і суміш згаданих Факторів в будь-якій пропорції також може бути використана в придатній фармацевтичній формі, такі як капсула, таблетка або водна суспензія для перорального введення або використовуючи звичайні креми або желе для місцевого застосування. Окрім їх застосування як медикаментів при лікуванні людей i в ветеринарії, сполуки винаходу також можуть бути використані як промотори росту тварин. З цією ціллю, сполуку винаходу вводять перорально в придатній їжі. Обережне концентрування використовують тоді, коли необхідно одержати активний агент в кількості, що ефективно промотує ріст, коли споживаються нормальні кількості їжі. Додавання активної сполуки винаходу до їжі тварин переважно проводять шляхом одержання прийнятної суміші їжі, що містить активну сполуку в ефективній кількості і включення суміші в повний раціон. Альтернативно, проміжний концентрат або харчові добавки, що містять активний інгредієнт можна примішати до їжі. Шляхи одержання і введення таких харчових сумішей і повного раціону описуються в книгах [таких як "Applied Animal Nutrition", W.H. Freedman i CO., S. Francisco, U.S Α., 1969 або "Livestock Feeds and Feeding" 0 і В books, Corvallis, Ore., U.S.A., 1977]. Фізико-хімічні характеристики антибіотика 107891 A) Мас-спектрометрія: В МС експериментах на приладі Thermofinnigan LCQ deca спорядженого електроспрейджерелом, використовуючи калібрувальну суміш Thermofinnigan, антибіотик 107891 дає два 87548 24 двічипротонованих іонів з m/z=1124 і з m/z 1116, що відповідають найнижчому ізотопному складу комплексу Факторів А1 і А2, відповідно. Електроспрей умови були наступними: Напруга розпилення: 4,7кВ; Капілярна температура: 220°С; Капілярна напруга: 3В; Вид введення 10mл/хв. Спектр знімали з 0,2мг/мл розчину в метанол/вода 80/20 (об/об) з трифтороцтовою кислотою 0,1% і він показаний на Фіг.1А (повносканований низькороздільний спектр) і 1В (масштабний високороздільний спектр) Б) Інфрачервоний спектр антибіотика 107891 знімали в KBr використовуючи спектрометр Bruker FT-IR моделі IFS 48, що проявляє максимум абсорбції при (см-1): 3263; 2929; 1661; 1533; 1402; 1114; 1026. інфрачервоний спектр показаний на Фіг.2. Смуги поглинання при 1631, 1596 і 1346 відповідають залишковим кількостям форміату амонію. B) УФ спектр антибіотика 107891, знімали в метанол/Н2O (у співвідношенні 80:20) використовуючи спектрометр Perkin-Elmer Lambda 16, що має два плеча при 226 і 267нм УФ спектр показаний на Фіг.3. Г) 1Н-ЯМР спектр знімали в суміші метанолd4:Н2o (рН 4,3 HCI) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600 використовуючи водопригнічену послідовність. Як внутрішній стандарт використовується залишковий сигнал метанолі при 3,31м.ч.. 1 Н-ЯМР спектр антибіотика 107891 показаний на Фіг.4. 1 Н ЯМР спектр антибіотика 107891 розчиненого в метанол-d4:Н2О (0,01N НСІ) 40:10 (об/об) має наступні групи сигналів (в м.ч.) при 600МГц використовуючи MeOH-d4 як внутрішній стандарт (3,31м.ч.), [d=м.ч ., мультиплетність; (віднесення)]: 0,93 д (СН3), 0,98 д (СН3), 1,07 т (перекривається СН3'и), 1,18 т (перекривається СН3'и), 1,26 с (СН3), 1,30 т (перекривається СН3'и), 1,62-1,74 м (СН2), 1,78 д (СН3), 1,80 д (СН3), 2,03 м (СН2), 2,24 м (СН), 2,36 м (СН2), 2,72-3,8 м (пептидні альфа СН'и), 3,8-5,2 м (пептидні альфа СН'и), 5,53-6,08 с (СН2), 5,62 д (СН подвійного зв'язка), 6,42 м (СН), 6,92 д (СН подвійного зв'язка), 7,0-7,55 м (ароматичні СН'и), 7,62-10,4 д і м (ароматичні і пептидні ΝΗ'и) Д) 13С-ЯМР спектр знімали в суміші метанолd4:Н2О (рН 4,3 НСІ) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600 використовуючи як внутрішній стандарт залишковий сигнал метанол-d4 при 49,15м.ч. 13С-ЯМР спектр bb розщепленого антибіотика 107891 показаний на Фіг.5. 13 С ЯМР спектр антибіотика 107891 розчиненого в метанолі:Н2О (0,01N НСІ) 40:10 (об/об) має наступні групи сигналів (в м.ч.) при 600МГц використовуючи MeOH-d4 як внутрішній стандарт (49,15м.ч.), [d=м.ч.; (віднесення)]: 13,6-23,2 (аліфатичні СН3'и), 26,16-73 (аліфатичні СН2'и і пептидні альфа СН'и), 105-136 (ароматичні і подвійні зв'язки СН'и і четвертинні вуглеці), 164,3-176,3 (пептидні карбоніли). Е) Комплексний антибіотик 107891 розчинений в 2-метоксиетанолі (MCS):H2O 12:3 (об/об) містить молярний надлишок 0,01Μ хлорводневої кислоти. Розчин потім піддавали титруванню розчином 25 87548 0,01N гідроксиду калію. Одержана крива титрування показала присутність однієї основної групи, що іонізується. Амінокислотний склад композиції антибіотика 107891 і його факторів А1 і А2 А) Визначення "кислотостійкості" амінокислот в комплексному антибіотику 107891 Антибіотик 107891 піддавали повному кислотному гідролізу (НСІ 6Ν, 105°С, 24г) і ідентифікували амінокислотні компоненти антибіотика стійкі до кислоти. Кислотонестабільні амінокислоти не детектуються при цьому підході. Гідролізат досліджували за допомогою НРРХ-МС і ГХ-МС аналізу, після придатного модифікування, у порівнянні із сумішшю стандартних амінокислот модифікованих подібним чином Для ВЕРХ аналізу гідролізовані зразки обробляли 6-амінохіноліл-Nгідроксисукцинімідилкарбамат (набором реагенту AccQ-TagÔ Fluor), для ГХ аналізу використовуючи суміш 3N НСІ в безводному метанолі і трифтороцтовому ангідриді. Кількісний ВЕРХ аналіз проводили на рідиннохроматографічній системі з одночасним DAD і МС детектуванням. ВЕРХ спосіб мав наступні умови: Колонка: AccQ-TagÔ (Waters C18 NovoPak 4mм 3,9´150мм) Температура колонки: 37°С Потік: 1мл/хв. Фаза А: ацетат амонію 140мМ рН 5 (оцтова кислота) Фаза В: вода:ацетонітрил 60:40 (об/об) Програма елюювання Час (хв) %В 0 5 5 5 30 80 35 95 40 95 41 5 УФ детектування: 254нм МС умови були наступними: Спектрометр: Finnigan LCQ Deca споряджений стандартним джерелом електророзпилення. Капілярна температура. 250°С. Напруга джерела: 4,70кВ Струм джерела: 80mΑ Капілярна напруга: - 15В Кількісний ГХ аналіз проводили на газовому хроматографі спорядженому МС-ЕІ детектуванням. ГХ проводили за наступних умов: Колонка: J & W Scientific DB-5,30м´0,254мм ВД´0,25mΜ FT Газ носій: гелій Спосіб ін'єктування: без розділення Температура ін'єктора: 200°С. Температура автоматичної лінії: 300°С. Температурна програма: від 50°С до 100°С при 2,5°С/хв (10хв), від 100°С до 250°С при 10°С/хв (15хв), 15хв при 250°С. Об'єм ін'єктування: 1mл МС умови були наступними: Спектрометр: Finnigan TSQ700 Спосіб іонізації: електронний удар Прикладена напруга: Струм розжарювання: 400мА Вторинно-електронний примножувач: 1400В 26 Електронна енергія: 70еВ Спосіб позитивного іону Умови сканування: Інтервал сканування: 40-650аом Час сканування: 1сек В РХ/МС і ГХ/МС хроматограми одержували на гідролізаті антибіотика 107891, наступні амінокислоти ідентифікували поряд з іншими неідентифікованими піками: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (ЯМР дослідження показали, що вона є продуктом трансформації аспарагіну, який утворює аспарагінову кислоту при гідролізі), фенілаланін і лейцин. Фактори А1 і А2 антибіотика 107891 піддавали повному кислотному гідролізу за тих же самих умов (модифікування і НРРХ-МС), що були показані для комплексу. ГХ-МС аналіз проводили на пристрої Thermo Finnigan Trace ГХ-МС спорядженому ін'єктором PTV. ГХ проводили за наступних умов: Колонка: Restek RTX-5MC, 15м´0,25мм ВД´0,25mм FT Газ носій: гелій Температура обладнання: 250°С. Температурна програма: 1,5хв при 50°С, від 50°С до 100°С при 20°С/хв, 1хв при 100°С, від 100°С до 135°С при 20°С/хв, 1хв при 135°С, від 135°С до 250° при 20°С/хв, 1хв при 250°С. Об'єм ін'єктування: 1mл Ін'єктор: без розділення, базова температура 50°С, температура переходу 280°С, швидкість переходу 14,5°С/хв МС умови були наступними: Спосіб іонізації: електронний удар Прикладена напруга: Струм розжарювання: 149mΑ Вторинно-електронний примножувач: 200В Електронна енергія: 70еВ Спосіб позитивного іону Умови сканування: Інтервал сканування: 33-500аом Час сканування: 0,6сек В гідролізаті Фактора А1 антибіотика 107891, ВЕРХ/МС і ГХ/МС хроматограми показали присутність наступних амінокислот поряд з іншими неідентифікованими піками: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (ЯМР дослідження показали, що вона є продуктом трансформації аспарагіну, який утворює аспарагінову кислоту при гідролізі), фенілаланін і лейцин. Проведення описаної вище процедури на Факторі А2 показало присутність наступних амінокислот поряд з іншими неідентифікованими піками: лантіонін, метиллантіонін, гліцин, пролін, валін, аспарагінова кислота (ЯМР дослідження показали, що вона є продуктом трансформації аспарагіну, який утворює аспарагінову кислоту при гідролізі), фенілаланін і лейцин. Б) Визначення 5-хлортриптофану в комплексному антибіотику 107891 і в його Факторі А1 і Факторі А2. Повний гідроліз очищеного комплексу 107891 і його окремих Факторів А1 і А2 проводили згідно із способом описаним Simpson R J, Neuberger M R, Liu Τ Υ, "Complete Aminoacid Analysis of Proteins 27 from a Single Hydrolysate". Journal Biol. Chem (United States), Apr. 10, 1976, 251 (7), 1936-40. Ця методика гідролізу попереджає деградацію амінокислот нестабільних до дії мінеральних кислот і таким чином дозволяє визначити ці амінокислоти, включаючи триптофан, в гідролізаті пептиду. Стандартний зразок 5-хлор-DL-триптофану одержували від Biosynt AG, Staad, Switzerland і його структуру підтверджували ЯМР аналізом; DLтриптофан одержували від Merck KGaA, Darmstadt, Germany. Фактор А1 (1,5мг) суспендували в 0,6мл 4N метансульфонової кислоти, що містить 0,2% (ваг/об) 3-(2-аміноетил)індолу, як каталізатор гідролізу. Гідроліз проводили при 115°С протягом 16 годин. Гідролізат нейтралізували 5N NaOH і розводили еквівалентною кількістю води. 100mл цього розчину аналізували за допомогою РХ-МС. Розділення проводили на колонці Symmetry С18 (5mм) 4,6´250мм (Waters Co. Milford Mass., USA) спорядженій преколонкою Symmetry C18 (5mм) 3,9´20мм. Елюювання проводили при швидкості потоку 1мл/хв з 25хв лінійним градієнтом від 0% до 50% фази В Фазою А був 25мМ HCOONH4 буфер рН 4,5:CH3CN 95:5 (об/об) і Фазою В був CH3CN. УФ детектування проводили при 280нм. ВЕРХ устаткування сполучали з іонною пасткою масспектрометра Finnigan LCQ (Thermoquest, Finnigan MAT, San Jos, Calif., USA). 50mл/хв потоки з колонки відводили до електроспрей іонізації (ЕСІ) масспектрометра LCQ МС аналіз проводили за наступних умов: ввід зразка, газ носій (Ν2) 60псі; капілярний нагрівач 210°С; полярність напруги вводу зразка: і позитивна, і негативна; іонна напруга розпилення +/-4,5кВ, капілярна напруга +/-21В; умови сканування: максимальний час іону 50мс; повний мікро: сканування 3. Стандарти триптофану і 5-хлортриптофану елюювали з часом утримування 8,1 хвилин і 11,5 хвилин, що відповідає М+Н+ із m/z 205 і 239, відповідно. В гідролізаті Фактора А1 антибіотика 107891 присутній пік на 11,5 хвилині із m/z 238,97, що вказує на присутність 5-хлор-триптофану. Стандарт триптофану детектували використовуючи хроматографічну систему з межею детектування 0,3mг/мл. Це значення є нижчим, ніж значення, яке виявляється в присутності згаданої амінокислоти в зразку антибіотику, що тестується. Детектували відсутність триптофану вище згаданої межі в хроматограмі гідролізату Фактора А1 антибіотика 107891. Ідентичні результати були одержані з РХ-МС аналізу гідролізату Фактора А2 і гідролізату очищеного зразка комплексного антибіотика 107891. Mac-спектрометрія фактора А1 і фактора А2 антибіотика 107891 Фактор А1 антибіотика 107891 дає двічі протонований іон з m/z=1124 i Фактор А2 з m/z 1116, що відповідає найнижчому ізотопному складу в МС експериментах на приладі Thermofmnigan LCQ deca спорядженому джерелом електророзпилення, використовуючи калібраційну суміш Thermofinnigan. Умови електророзпилення були наступними: Напруга розпилення: 4,7кВ; Капілярна температура: 250°С; Капілярна напруга: 8В; Вид 87548 28 введення 10mл/хв. Спектр знімали з 0,1мг/мл розчину в ацетонітрилвода 50:50 (об/об) з оцтовою кислотою 0,5% і він показаний на Фіг.6А (повносканований низькороздільний спектр) і 6В (масштабний високороздільний спектр) і на Фіг.7А (повносканований низькороздільний спектр) і В (масштабний високороздільний спектр). Точну масу Фактора А1 і Фактора А2 антибіотика визначали використовуючи спектрометр Bruker Daltonics APEX II, 4.7 Tesla споряджений джерелом електророзпилення. На базі цих даних, Фактор А1 має молекулярну вагу 2246,71±0,06, розраховану моноізотопну масу з [М+2Н]2+ з m/z 1124,36124 (точність 30м.ч.), визначену за допомогою високороздільної ЕСІ-МСФП. Фактор А2 має молекулярну вагу 2230,71±0,06, розраховану моноізотопну масу з [М+2Н]2+ з m/z 1116,36260 (точність 30м.ч.), визначену за допомогою високороздільної ЕСІ-МСФП. Порівняння фактора А1і фактора А2 антибіотика 107891 з антибіотиками MF-BA-1768a1 i MFBA-1768b1 A) Microbispora corallina NNRL 30420 (MF-BA1768), описаний в патенті US №6,551,591 В1, одержували з NNRL колекції. В дослідницьких експериментах, штам М. corallina NNRL 30420 (MF-BA1768) ферментували в колбі Ерленмейєра за умов описаних в патенті US №6,551,591 В1. Зібраний матеріал екстрагували розведеним метанолом. Після центрифугування міцелію, надосадкову рідину переносили на НР20 полістирольну абсорбційну смолу, елюювали сумішшю метанол:вода 70:30, яку упарювали до маленького об'єму і потім ліофілізували. В хроматограмі присутні два піки 1091 і 1108 [М+2Н]2+ сигналів, що відповідають [М+2Н]2+ показаним в патенті US №6,551,581 В1 для MF-BA1768b 1 і MF-BA-1768a1, відповідно. Згаданий вище екстракт збагачували Факторами А1 і А2 антибіотика 107891 і суміш аналізували за допомогою РХМС. Піки антибіотиків MF-BA-1768b 1 і MF-BA1768a1 і Факторів А1 і А2 антибіотику 107891 встановлювали по певному часу утримування і певним [М+2Н]2+ МС фрагментам. Б) В наступному експерименті, в 30л ферментаційному танку ферментували Microbispora sp. штаму NRRL 30420 (MF-BA-1768) і збирали матеріали згідно з описом патенту US №6,551,591 В1. Після послідовних стадій очищення на полістироловій смолі НР20 і поліамідній смолі СС 6 0,10,3мм (Macherey-Nagel), одержували дві окремі речовини в чистій формі використовуючи препаративну ВЕРХ на часточках розміру m10 колонки С18 Phenomenex (Torrance Calif., USA) Luna (250´12,2мм), яку елюювали із швидкістю потоку 27мл/хв з наступною багатостадійною програмою: Час=0хв (32% фази В); Час=8хв (32% фази В); Час=20хв (36% фази В); Час=32хв (90% Фаза В). Фазою А була мурашина кислота 0,05% (об/об) у воді, Фазою В був CH3CN. Ці речовини показали антибактеріальну активність проти стафілококів і ентерококів, як показано в Таблиці IV. В РХ-МС експериментах дві речовини показали [М+2Н]++ сигнали двічі протонованих іонів, що відповідають антибіотику MF-BA-1768a1 i 29 MF-BA-1768b1, як 87548 описано в патенті US 30 №6,551,591 В1. Таблиця IV MIC (mг/мл) Штам 1400 Staphylococcus aureus кл.ізол. Met r 568 Enterococcus faecium кл.ізол. 569 Enterococcus faecium кл.ізол. Van A 559 Enterococcus faecalis кл.ізол. 560 Enterococcus faecalis кл.ізол. Van A MF-BA1768a1 0,13 4 4 4 4 Експериментальні умови антимікробних тестів були такими ж самими, як ті що використовуються для тестів показаних в Таблиці VI, нижче. РХ-МС аналізи виділених антибіотиків MF-BA1768a1 і MF-BA-1768b 1 проводили на колонці Symmetry С18 (5mм) 4,6´250мм (Waters Co. Milford Mass., USA) спорядженій преколонкою Symmetry C18 (5mм) 3,9´20мм (обидві витримували у печі при температурі 50°С). Елюювання проводили при швидкості потоку 1мл/хв з наступною багатостадійною програмою елюювання: Час=0хв (30% Фази В); Час=8хв (30% Фази В); Час=20хв (45% Фази В); Час=24хв (90% Фази В) і Час=28хв (90% Фази В). Фазою А був 25мМ HCOONH4 буфер рН 4,5:CH3CN 95:5 (об/об) і фазою В був CH3CN. ВЕРХ устаткування сполучали з іонною пасткою мас-спектрометра Finnigan LCQ (Thermoquest, Finnigan MAT, San Jose, Calif., USA). 100mл/хв потоки з колонки відводили до елеткроспрей іонізації (ЕСІ) мас-спектрометра LCQ. MC аналіз проводили за наступних умов: ввід зразка: потік газу носія (N2) 25псі; потік допоміжного газу 5псі; капілярний нагрівач 210°С; полярність напруги вводу зразка: і позитивна, і негативна; іонна напруга розпилення +/-4,5кВ; капілярна напруга +/-12В; умови сканування: максимальний час іону 50мс; повний мікро: сканування 3. Індивідуальні антибіотики MF-BA-1768a1 і MFBA-1768b1 і Фактори А1 і А2 антибіотика 107891 аналізували індивідуально і в суміші. Результати зводили в наступну Таблицю V. Таблиця V MF-BA-1768b1 Антибіотик 107891 А1 Антибіотик 107891 А2 MF-BA-1768a1 Час утримування (хв) [М+2Н]2+ 12,86 1091 16,3 1124 16,81 1116 18,1 1108 В такій же самій хроматографічній системі Фактор А2 рамопланіну [L. Gastaldo, R. Ciabatti, F. Assi, E. Restelli, J. К. Kettenring, L. F. Zerilli, G. Roman, M. Denaro and B. Cavalleri, (1992): "Isolation, structure determination and biological activity of A-16686 Factors Α'1, A'2 і A'3 glycolipodepsipeptide antibiotics", J. Ind. Microbiol. 11:13-18] елюювали з часом утримування 11,00хв. MF-BA1768b 1 0,5 16 8 8 8 107891 A1 107891 A2 0,13 1 1 1 0,5 0,13 2 2 2 1 107891 комплекс 0,13 2 2 1 0,5 ЯМР спектроскопія факторів А1 і факторів А2 антибіотика 107891 1 Н-ЯМР спектр Фактора А1 і Фактора А2 антибіотика 107891 знімали в суміші CD3CN:D2O (1:1) при 298K на спектрометрі Bruker AMX 600 використовуючи водопригнічену послідовність. Як внутрішній стандарт розглядали залишковий сигнал ацетонітрил-d3 з 1,94м.ч.. A) 1Н-ЯМР спектр Фактора А1 антибіотика 107891 показаний на Фіг.8. 1 Н-ЯМР спектр Фактора А1 антибіотика 107891, розчиненого в CD3CN:D2O (1:1), має наступні групи сигналів (в м.ч.) при 600МГц використовуючи CD3CN як внутрішній стандарт (1,94м.ч.), [dм.ч ., мультиплетність; (віднесення)]: 0,84 д = (СН3), 0,89 д (СН3), 0,94 т (перекривається СН3'и), 1,1 д (СН3), 1,13 д (СН3), 1,15 т (перекривається СН3'и), 149 м (СН2), 1,69 д (СН3), 1,75 м (СН2), 2,11 м (СН), 2,26 м (СН), 2,5 м (СН2), 2,68-3,8 м (пептидні СНb 'и), 3,8-5,0 м (пептидні СНa'и), 5,45-6,17 с (СН2), 5,58 д (СН подвійного зв'язку), 6,36 м (СН), 6,86 д (СН подвійного зв'язку), 7,0-7,45 м (ароматичні СН'и). Сигнал диметилсульфоксиду присутній при 2,58м.ч. і сигнал форміату також присутній при 8,33м.ч., як домішки. Б) 1Н ЯМР спектр bb розщепленого Фактора А2 антибіотика 107891 показаний на Фіг.9. 1 Н ЯМР спектр Фактора А2 антибіотика 107891, розчиненого в CD3CN:D2O (1:1), має наступні групи сигналів (в м.ч.) при 600МГц використовуючи CD3CN як внутрішній стандарт (1,94 м.ч.), [dм.ч ., мультиплетність; (віднесення)]: 0,84 д = (СН3), 0,88 д (СН3), 0,94 д (СН3), 1,06 д (СН3), 1,14 д (СН3), 148 м (СН2), 1,65-1,75 м (СН2), 1,67 д (СН3), 2,15 м (СН), 2,25 м (СН), 2,5 м (СН2), 2,773,8 м (пептидні СНb 'и), 3,8-4,9 м (пептидні СНb 'и), 5,45-6,14 с (СН2), 5,59 д (СН подвійного зв'язку), 6,34 м (СН), 6,84 д (СН подвійного зв'язку), 7,07,42 м (ароматичні СН'и). Сигнал диметилсульфоксиду присутній при 2,58м.ч. і сигнал форміату також присутній при 8,32м.ч., як домішки. 13 С-ЯМР спектр Фактора А1 і Фактора А2 антибіотика 107891 знімали в суміші CD3CN:D2O (1:1) при 298K спектрометрі Bruker AMX 600 використовуючи як внутрішній стандарт залишковий сигнал ацетонітрилу-d3 при 1,39м.ч.. B) 13С-ЯМР спектр Фактора А1 антибіотика 107891 показаний на Фіг.10. 13С ЯМР спектр Фактора А1 антибіотика 107891, розчиненого в CD3CN:D2O (1:1), має наступні групи сигналів (в м.ч.) при 600МГц використовуючи CD3CN як внут 31 87548 рішній стандарт (1,39м.ч.), [d=м.ч .; (віднесення)]: 13,6-23,03 (аліфатичні СН3'и), 25,69-77,9 (аліфатичні СН2'и і пептидні СНb 'и), 105-137,3 (ароматичні і подвійні зв'язки СН'и і четвертинні вуглеці), 165,6176,6 (пептидні карбоніли). Г) 13С-ЯМР спектр bb розщепленого Фактора А2 антибіотика 107891 показаний на Фіг.11. 13 С-ЯМР спектр Фактора А2 антибіотика 107891, розчиненого в CD3CN:D2O (1:1), має наступні групи сигналів (в м.ч.) при 600МГц використовуючи CD3CN як внутрішній стандарт (1,39м.ч.), [d=м.ч.; (віднесення)]: 13,6-22,9 (аліфатичні СН3'и), 25,65-73 (аліфатичні СН2'и і пептидні СНb 'и), 105137,3 (ароматичні СН'и і СН'и подвійних зв'язків і четвертинні вуглеці), 165,7-176,1 (пептидні карбоніли). УФ i ІЧ спектр фактора А1 i фактора А2 антибіотика 107891 A) Інфрачервоний спектр Фактора А1 антибіотика 107891, що знімали в KBr використовуючи спектрофотометр Bruker FT-IR моделі IFS 48, має максимум абсорбції при (см-1): 3294; 3059; 2926; де X є Η або галоген (F, СІ, Br, І), Υ1, Υ2, Υ3, Υ4 та Υ5 можуть незалежно бути S, S-O-, S=O, O-S=O та O=S=O і де R1, R2, R3, R4, R5, R6, R7 і R8 можуть незалежно бути Н, ОН, алкіл (розгалужений або нерозгалужений, заміщений або незаміщений) або арил (заміщений або незаміщений). В альтернативному втіленні, R1, R2, R3 і R4 може бути Η або ОН. Тому, можливими комбінаціями R1, R2, R3 і R4 є наступні. R1 H ОН H H H ОН ОН ОН H R2 H H ОН H H ОН H H ОН R3 H H H ОН H H ОН H ОН R4 H H H H ОН H H ОН H 32 1661; 1529; 1433; 1407; 1287; 1114; 1021. Інфрачервоний спектр показаний на Фіг.12. Б) УФ спектр Фактора А1 антибіотика 107891, що знімали в метанол:Н2О 80:20 (об/об) використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267нм. УФ спектр показаний на Фіг.13. B) Інфрачервоний спектр Фактора А2 антибіотика 107891, що знімали в KBr використовуючи спектрофотометр Bruker FT-IR моделі IFS 48, має максимум абсорбції при (см-1): 3296; 3060; 2928; 1661; 1529; 1433; 1407; 1288; 1116. Інфрачервоний спектр показаний на Фіг.14. Г) УФ спектр Фактора А2 антибіотика 107891, що знімали в метанол:Н2О 80:20 (об/об) використовуючи спектрофотометр Perkin-Elmer Lambda 16, має два плеча при 226 і 267нм. УФ спектр показаний на Фіг.15. На основі фізико-хімічних даних приведених вище, для антибіотика 107891 була запропонована наступна структура: H H ОН ОН ОН H ОН H ОН ОН ОН H ОН Он ОН H ОН H ОН ОН ОН ОН ОН H ОН ОН ОН ОН Аналогічно, R5, R6, R7 і R8 можуть бути Н або ОН. Тому, можливими комбінаціями R5, R6, R7 і R8 є наступні. R6 H ОН H H H ОН R6 H H ОН H H ОН R7 H H H ОН H H R8 H H H H ОН H 33 ОН ОН H H H ОН ОН ОН H H H ОН H ОН ОН ОН H ОН 87548 ОН H ОН ОН H ОН H ОН ОН H ОН H ОН ОН H ОН ОН ОН 34 ОН ОН ОН ОН Однак, на основі фізико-хімічних даних приведених вище, для Фактора А1 антибіотика 107891 може бути запропонована наступна структура, в якій X є СІ, Y1, Y2, Y3, Υ4 та Υ5 є S; R1 є Η, R2 є OH, R3 є Н і R4, R5, R6, R7 і R8 є Н, які є переважним втіленням винаходу разом з її фармацевтично прийнятними солями: Крім того, на основі фізико-хімічних даних приведених вище, для Фактора А2 антибіотика 107891 може бути запропонована наступна структура, в якій X є СІ, Υ1, Υ2, Υ3, Υ4 та Υ5 є S; R1 є OH, R2 є OH, R3 є Η i R4, R5, R6, R7 і R8 є Н, які є переважним втіленням винаходу разом з її фармацевтично прийнятними солями: In vitro біологічна активність антибіотика 107891 Антимікробну активність антибіотика 107891 визначали за допомогою мікромодуляції бульйону згідно з рекомендаціями Національного комітету з клінічних лабораторних стандартів (NCCLS, документ М7-А5). Використовувані штами були клінічно виділено або одержано від Американської колекцій типів культур (АТСС). Результати тестів показані в Таблиці VI і Таблиці VII. Антибіотик 107891 розчиняли в ДМСО з одержанням 1000mг/мл готового розчину і потім розводили водою до одержання робочого розчину. Використовуваним середовищем був катіонодоповнений бульйон Мюллера Хінтона (САМНВ) для Staphylococci, M. catarrhalis, Enterococci і L. monocytogenes; бульон Тодда Хе 35 87548 вітта (ТНВ) для Streptococci; GC середовище+1% Ізовіталекс+1% хаемін для Neisseria spp.; подова настоянка мозку+1% С доповнена для Н. influenzae; бульйон Lactobacillus для Lactobacilli; Middlebrook 7H9 збагачений Middlebrook OADC для Μ. smegmatis; RPMI 1640 середовище для С. albicans. Бульйон Вілкінса Чалгрена+оксираза (1:25 об/об) для Clostridia; бульйон Бруцелла, що містить цистеїн (0,5г/л), для Propionibacteria. Інокула для бактерій складала 105 CFU/мл. С. albicans інокулювали 1´104CFU/мл. Всі тести проводили в присутності 0,02% сироватки альбуміну теляти (CAT). Культури інкубували при 35°С на повітрі, за винятком штамів Clostridia i Propioniobacteria, яким необхідна анаеробна атмосфера. Через 18-24 години проводили візуальну оцінку і визначали МІС. МІС означає найнижчу концентрацію антибіотика при якій не спостерігається ріст. Таблиця VI Протимікробна активність антибіотика 107891 MIC (mг/мл) 107891 119 Staph. aureus Smith ATCC19636 £0,13 4061 Staph. aureus LIM1 £0,13 3798 Staph. aureus клін. ізолят VISA 2 1400 Staph. aureus клін. ізолят Met-R £0,13 613 Staph. aureus клін. ізолят Met-R £0,13 3797 Staph. aureus клін. ізолят VISA Me 2 4064 Staph. aureus LIM2 CHSA Met-R 0,5 1729 Staph. haemolyticus Met-R 8 1730 Met-S 2 147 Staph. epidermidis ATCC12228 £0,13 1139 4 44 Strept. pneumoniae Pen-S £0,13 2868 Peo-I £0,13 49 Strept. pyogenes £0,13 559 Ent. faecalis Van-S 1 560 Ent. faecalis Van-A 0,5 А533 Ent. faecalis Van-A 1 568 Ent. faecium Van-S 2 569 Ent. faecium Van-A 1 В518 Ent. faecium Van-A 2 А6345 Ent. faecium Van-A Lnz-R 4 3754 Mycobacterium smegmatis 32 134 Listeria garviae £0,13 148 Listeria delbruechii ATCC47927 4 1450 Listeria monocytogenes 0,125 833 Haemophilus influenzae 32 Haemophilus influenzae ATCC 920 32 19418 3924 Moraxella catharralis 1 16 Moraxella catharralis ATCC8176 0,25 1613 Neisseria meningitidis ATCC 13090 0,5 997 Neisseria ganorhaee 0,25 47 Escherichia coli >128 145 Candida albicans >128 Мікроорганізм 36 Таблиця VII Протимікробна активність антибіотика 107891 проти анаеробних бактерій Мікроорганізм АТСС 27520 Propionibacterium limphophilum АТСС 25564 Propionibacterium granulasium АТСС 14157 Propionibacterium proptonicus P9 Propionibacterium acnes 1329 Propionibacterium acnes ATCC 25746 Propionibacterium acnes ATCC 6919 Propionibacterium acnes ATCC 6922 Propionibacterium acnes ATCC 1348 Propionibacterium acnes 4018 Clostridium difficile 4025 Clostridium difficile 4022 Clostridium difficile 4032 Clostridium perfringens 4043 Clostridium butyricum 4009 Clostridium beiferinchii 4052 Clostridium septicum 60601 Peptostreptococcus anaerobius MIC (mг/мл) Антибіотик 107891 0,015 0,03 4 0,125 0,5 0,015 0,125 £0,0039 0,25 £0,125 £0,125 £0,125 £0,125 £0,125 £0,125 £0,125 >128 Антибіотик 107891 проявляє добру антибактеріальну активність проти Грам-позитивних бактерій. МІС інтервал проти Staphylococcus spp., включаючи метицилінстійкі штами (MRSA) і штами стійкі до глюкопептидних інтермедіатів (GISA), становить=0,13-4mг/мл і проти нещодавно виділених Enterococcus spp., включаючи ванкоміцинстійкий (VRE), становить 0,5-4mг/мл. Проти Streptococcus spp. МІС становить £0,13mг/мл. Антибіотик 107891 також активний проти анаеробних Грам-позитивних штамів; МІС є £0,13mг/мл проти Clostridia і £0,004-4mг/мл проти Propionibacteria. Протимікробні активності були показані проти штамів L monocytogenes (MIC 0,125mг/мл) і Lactobacilli (МІС інтервал £0,134mг/мл). Деякі Грам-негативні бактерії є чутливими до антибіотика 107891, МІС є 1-0,25mг/мл проти М. catharralis, 0,5-0,25mг/мл проти Neisseria spp. і 32mг/мл проти Н. influenzae Антибіотик 107891 не активний проти тестованих штамів Е. coli і С albicans. В експериментах залежності смертності від часу антибіотик 107891 проявляє бактерицидну активність проти штаму S. aureus GISA і Ε. faecalis VanA; протягом 24 годин при МІС значенні бактерицидної концентрації в бульйоні Мюллера Хінтона. S. aureus може викликати життя-загрожуючі інфекції і MRSA має особливе клінічне значення оскільки він стійкий до всіх пеніцилінів і цефалоспоринів а також багатьох інших антибіотиків; крім того, він легко поширюється від пацієнта до паціє 37 нта викликаючи спалахи інфекції із значними наслідками для здоров'я [W. Witte, (1999): "Antibiotic resistance in Gram-positive bacteria: epidemiological aspects", Journal of Antimicrobial Chemotherapy 44:1-9]. Центри по контролю за захворюваністю (CDC) Національної системи спостереження за внутрішньолікарняними інфекціями (NNIS) повідомляють, що стійкість до метициліну серед S. aureus в госпіталях США збільшилась з 2,4% в 1975 до 29% в 1991, із вищим ступенем стійкості при інтенсивних заходах [L. Archibald, L. Philips, D. Monnet, J. Ε. Jr Me Gowan, F. Tenover, R. Gaynes, (1997): "Antimicrobial resistance in isolates from inpatients і outpatients in the United States: increasing importance of the intensive care unit", Clinic Infect. Dis. 24: 211-5]. Внутрішньолікарняні стафілококальні інфекції пов'язують із значною захворюваністю і смертністю, що подовжує час одужання і збільшує вартість госпіталізації. Основні штами MRSA є стійкими до деяких найбільш часто використовуваних протимікробних агентів, включаючи досить популярні макролідні, аміноглікозидні і b-лактамні антибіотики, включаючи нещодавно отримані цефалоспорини. Ванкоміцинстійкі патогени, що зустрічаються в лікарнях, які відповідають за інфекції (такі як ендокардити, менінгіти і септицимія) викликають підвищену терапевтичну увагу [Y. Cetinkaya, P. Falk і С. G. Mayhall, (2000): "Vancomycin-resistant enterococci", Clin. Microbiol. Rev. 13: 686-707; L. B. Rice, (2001): "Emergence of vancomycin-resistant enterococci", Emerg. Infec. Dis. 7:183-7]. S. pneumoniae і Μ. catarrhalis розглядають як важливі патогени для людей. Вони зазвичай викликають інфекції респіраторного тракту, особливо середній отит у дітей і інфекції нижньої частини респіраторного тракту в людей похилого віку. М. catarrhalis і S. pneumoniae донедавна розглядались як звичайні патогени респіраторного тракта [Μ. С. Enright and Η. McKenzy, (1997): "Moraxella (Branhamella) catarrhalis. Clinical and molecular aspect of a rediscovered pathogen", J. Med. Microbiol. 46:360-71]. Clostridia відповідає за різні захворювання: газова гангрена і залежні інфекції ран, правець, ботулізм, антибіотик-викликана діарея (CDAD) і псевдомембранний коліт. Більшість з цих мікроорганізмів продукують екзотоксини, що відіграють важливу роль патогенезі захворювань. С. difficile є каузативним агентом, що відповідає за 25% випадків CDAD і фактично за всі випадки псевдомембранного коліту. В останні роки мали місце випадки повторного інфікування С. difficile у пацієнтів з ванкоміцин-стійкою ентерококальною інфекцією або колонізацією [J. G. Bartlett, (1992): "Antibiotic associated diarrhea", Clinic. Infect. Dis. 15: 573-581]. In vitro біологічна активність факторів A1 i A2 антибіотика 107891 В Таблиці VIII показана протимікробна активність окремих Факторів А1 і А2 антибіотика 107891. МІС визначали за методом розведення мікробульйону, як описано вище. 87548 38 Таблиця VIII MIC (mг/мл) Фактор Фактор А1 А2 819 Staph.aureus Met-S £0,03 £0,03 1524 Staph.aureus Met-R £0,03 £0,03 2235 Staph.aureus Met-R 0,06 0,06 3894 Staph.epidermidis Met-R 0,06 £0,03 3881 Staph.epidermidis Met-R 0,06 £0,03 602 Staph.haemolyticus Met-R 0,25 0,25 3919 Strept.pneumoniae Pen-R £0,0015 £0,0015 3915 Strept.pneumoniae Pen-S £0,0015 £0,0015 4323 Ent.faecalis VanA £0,03 £0,03 J1 Ent.faecalis VanA 1 1 4341 Ent.faecalis VanB 0,5 0,5 4397 Ent.faecalis VanB 1 1 4341 Ent.faecalis VanB 2 2 6349 Ent.faecium Van A LNZ-R 2 2 4 Ent.faecium Van A 1 1 3 Ent.faecium Van A 0,5 0,5 D561 Ent.faecium Van A 2 2 А8 Ent.faecium Man A 0,5 0,5 4339 Ent.faecium VanD 0,25 0,25 4174 Ent.gallinarum 1 1 997 Neisseria gonorrhaee 0,5 0,25 1613 Neisseria meningitidis 0,25 0,25 1016 Propionibacterium. acnes 0,06 £0,03 Мікроорганізм In vivo біологічна активність антибіотика 107891 В експериментах використовували самиць ICR мишей (Harlan Italia SpA - S. Pietro al Natisone, Italy) вагою 23-25г з гострою летальною інфекцією в імунокомпетентних або нейтропенічних мишей. Нейтропенію викликали двома інтраперітонеальними введеннями циклофосфаміду, 200 і 100мг/кг, за чотири дні і один день, відповідно, перед інфікуванням мишей. Інфекцію викликали інтраперітонеальним інокулюванням імунокомпетентних мишей (8 тварин/доза/група лікування) бактеріальної суспензії або клітинного ізоляту метицилінстійкого стафілококу (Staph. aureus SA3817), або стандартного метицилінчутливого штаму (Staph. aureus Smith ATCC19636), або шляхом інокулювання нейтропенічним мишам клінічного ізоляту глікопептидстійкого ентерококу (Ent. faecalis А533). Бактеріальний препарат (приб. 106клітин/мишу) одержували суспендуванням в 0,5мл 5% бактеріологічного муцину (Difco). Оброблених тварин умертвляли протягом 24-72г після інфікування. Лікування антибіотиком починали через 10-15хв після введення бактеріального агенту. Антибіотик 107891 вводили внутрішньовенно або підшкірно у вигляді різних водних рецептур. Розраховували 50% ефективну дозу (ED50) і 95% межу достовірності за методом Спіармана-Карбера [D. J. Finney, (1952): "The Spearman-Karber method", in: Statistical methods in biological assay, pp. 524-530, Charles Griffin & Co, Ltd., London] з відсотка тварин, що вижили на 7 день. Результати показані в наступній Таблиці IX. 39 87548 Антибіотик 107891 є нетоксичним до максимально тестованої дози 200мг/кг. Таблиця IX ED50 антибіотика 107891 при гострих летальних інфекціях у мишей Рецептура Штам А MCSA А VanA В С MRSA VanA Шлях вв пш вв пш пш вв пш ED50 95% межа домг/кг стовірності 2,1 1,7-2,7 2,1 1,7-2,7 3,2 2,7-3,9 11,1 9,2-13,5 4,2 3,5-5,1 3,7 2,8-4,9 12,7 10,7-15,0 Рецептури: А: 10% (об/об) ДМСО, 10% (в/об) Бета гідрокси-пропілциклодекстрин (Sigma), 80% (об/об) 5% (в/об) глюкози в Н2О В: 10% (об/об) ДМСО, 40% (об/об) ПЕГ 400 в 0,1Μ водного СН3СООН С: 50% (об/об) ПЕГ 400 в Н2О Штами: I. MCSA: Staph. aureus Smith 819 АТСС19636 II. MRSA: Staph. aureus 3817, клінічно виділений III. VanA: Ent. faecalis A533, клінічно виділений, у нейтропенічних мишей Фіг.1А (повносканований низькороздільний спектр) і 1Б (масштабний високороздільний спектр) представляють масспектри антибіотика 107891, що має двічіпротонований іон з m/z 1124 і m/z 1116. Фіг.2 представляє спектр ІЧ абсорбції антибіотика 107891 диспергованого в KBr. Фіг.3 представляє УФ спектр антибіотика 107891 розчиненого в метанол:Н2O. Фіг.4 представляє 1Н-ЯМР спектр знятий в суміші метанол-d4:Н2O (рН 4,3 НСІ) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600 використовуючи послідовність пригнічення води. Фіг.5 представляє 13С-ЯМР спектр знятий в суміші метанол-d4:Н2O (рН 4,3 НСІ) 40:10 (об/об) при 40°С на спектрометрі Bruker AMX 600. Фіг.6А (повносканований низькороздільний спектр) і 6Б (масштабний високороздільний спектр) представляють мас-спектри Фактор А1 антибіотика 107891, що має двічіпротоновані іони [М+2Н]2+ з m/z 1124. Фіг.7А (повносканований низькороздільний спектр) і 7Б (масштабний високороздільний спектр) представляють мас-спектри Фактор А2 антибіотика 107891, що має двічіпротоновані іони [М+2Н]2+ з m/z 1116. Фіг.8 представляє 1Н-ЯМР спектр Фактора А1 антибіотика 107891 знятий в суміші CD3CN:D2O (1:1) при 298К на спектрометрі Bruker AMX 600 використовуючи послідовність пригнічення води. Фіг.9 представляє 1Н-ЯМР спектр Фактора А2 антибіотика 107891 знятий в суміші CD3CN:D2O (1:1) при 298К на спектрометрі Bruker AMX 600 використовуючи послідовність пригнічення води. 40 Фіг.10 представляє 13С-ЯМР спектр Фактора А1 антибіотика 107891 знятий в суміші CD3CN:D2O (1:1) при 298К на спектрометрі Bruker AMX 600. Фіг.11 представляє 13С-ЯМР спектр Фактора А2 антибіотика 107891 знятий в суміші CD3CN:D2O (1:1) при 298К на спектрометрі Bruker AMX 600. Фіг.12 представляє спектр ІЧ абсорбції Фактора А1 антибіотика 107891 диспергованого в KBr. Фіг.13 представляє УФ спектр антибіотика Фактора А1 107891 розчиненого в метанол:Н2О. Фіг.14 представляє спектр ІЧ абсорбції Фактора А2 антибіотика 107891 диспергованого в KBr. Фіг.15 представляє УФ спектр антибіотика Фактора А2 107891 розчиненого в метанол: Н2О. Приклади Приклад 1: Спосіб ферментування Microbispora sp. АТСС РТА-5024 Штам Microbispora sp. АТСС РТА-5024 витримували на скошених агарах з вівсяного борошна 23 тижні при 28°С. Мікробний вміст одного скосу зішкрібали 5мл стерильної води і інокулювали в 500мл колби Ерленмейєра, що містять 100мл затравного середовища (AF/MC), яке включає (г/л): декстроза 20, екстракт дріжджів 2, соєве борошно 8, NaCI 1 і карбонат кальцію 4. Середовище одержували у дистильованій воді і рН доводили до 7,3 і потім стерилізували при 121°С 20 хвилин. Інокулювальні колби вирощували при 28°С, на роторному збовтувачi при 200об/хв. Через 4-6 днів, 5% цієї культури інокулювали в другий ряд колб, що містить те ж саме ферментаційне середовище. Через 72 годин інкубування, 200мл переносили в 4л біореактор, що містить 3л того ж самого вегетативного середовища. Ферментування проводили при 30°С при перемішуванні 700об/хв і аерації 0,5 оох. Через 72 години, культуру (1,5л) переносили в 20л біореактор, що містить 15л того ж самого вегетативного середовища. Ферментування проводили протягом 48 годин при 30°С, при перемішуванні 500об/хв і аерації 0,5 оох і потім переносили до продуційного танку. Продукування антибіотика 107891 проводили в 300л біореакторі, що містить 200л продуційного середовища М8, який містить (г/л): крохмаль 20, глюкоза 10, екстракт дріжджів 2, гідролізований казеїн 4, екстракт м'яса 2 і карбонат кальцію 3. Середовище одержували в деіонізованій воді і рН доводили до 7,2 i потім стерилізували при 121°С 25хв. Після охолодження у ферментатор інокулювали приблизно 14л (7%) прекультури Біореактор працював при 29°С, при перемішуванні 180об/хв і аерації 0,5 оох з тиском в голові 0,36бар. Біореактор розвантажували після 98 годин ферментування. Продукування антибіотика 107891 контролювали за допомогою ВЕРХ. Як описано раніше, після екстрагування цільного культурального бульйону тим же самим об'ємом метанолу. Екстрагування проводили при кімнатній температурі при перемішуванні протягом однієї години. Приклад 2: Альтернативний спосіб ферментування Microbispora sp. АТСС РТА-5024 Microbispora sp. АТСС РТА-5024 інокулювали в 500мл колби Ерленмейєра, що містять 100мл се 41 редовища для вирощування (G1), яке містить г/л: глюкоза 10, мальтоза 10, соєва олія 10, соєве борошно 8, екстракт дріжджів 2 і карбонат кальцію 4. Середовище одержували у деіонізованій воді і стерилізували при 120°С´20хв. без коригування рН. Інокульовані колби інкубували 120-168 години при 28°С, при перемішуванні 200об/хв доки не спостерігався добрий ріст. Колби потім використовували для інокулювання (3%) 4л біореактора, що містить 3л затравного середовища AF/MC, яке одержували як описано в Прикладі 1. Після 120 годин ферментування при 30°С, перемішуванні 700об/хв і аерації 0,5 oox, 1,5л культури переносили до 20л біореактора, що містить 15л того ж самого вегетативного середовища. Ферментування проводили 96 годин при 30°С, перемішуванні при 600об/хв і аерації 0,5 оох, і потім переносили до продукційного танку. Одержання антибіотика проводили в 300л біореакторі, що містить 200л продуційного середовища (V6), яке включає (г/л): декстроза 20, екстракт дріжджів 5, екстракт м'яса 5, гідролізований казеїн 3, пептон 5 і NaCI 1,5 Середовище одержували у деіонізованій воді з рН доведеним до 7,5 NaOH і стерилізували при 121°С 20хв. В біореактор інокулювали 14л затравочної культури (7%) і проводили ферментування при 29°С, перемішуванні при 180об/хв, при аерації 100л стандартного повітря на хвилину (0,5 оох). Утворення антибіотика 107891 контролювали за допомогою ВЕРХ як описано раніше. Продукт ферментування збирали після 160 годин. Приклад 3: Виділення антибіотика 107891 Ферментаційний бульйон описаний в Прикладі 1 фільтрували використовуючи тангенціальну фільтрувальну систему (розмір пор мембрани 0,1mм, Koch Carbo-Cor, Koch Wilmington, USA) одержуючи 170л надосадкової рідини і 30л концентрованого міцелію. Комплексний антибіотик 107891 знаходився і у фільтраті (А) і у міцелії (Б). (А) Фільтрований бульйон перемішували протягом ночі при кімнатній температурі в присутності полістиролової смоли Diaion НР-20 (4л). Смолу виділяли, промивали 10л метанол:вода 4:6 (об/об) і елюювали порціями спочатку 10л метанол:вода 9:1 (об/об) і потім 10л метанол:бутанол:вода: 9:1:1 (об/об). Об'єднані елюйовані фракції, що містять антибіотик 107891 концентрували до малого об'єму на роторному випаровувачi і потім ліофілізували, одержуючи 32г неочищеного матеріалу. Цей неочищений матеріал розчиняли в н-бутанолі (1л) і потім екстрагували три рази послідовно 800мл води. Органічний шар концентрували при пониженому тиску одержуючи масляний залишок, який розчиняли в метанолі. Після додавання петролейного ефіру, одержували в осаді 5г неочищеного антибіотика. (Б) Після додавання 25л метанолу, ретентатну частину, що містить міцелій перемішували протягом 1 години і фільтрували одержуючи 45л екстракту міцелію. Цей розчин розводили водою (20л) і перемішували протягом ночі при кімнатній температурі з полістироловою смолою Diaion НР-20 (1л). Виділяли смолу, промивали її 2л метанол:вода 40:60 (об/об) і елюювали партіями послідовно 3л 87548 42 метанол:вода 85:15 (об/об) і потім 2л метанол:вода 90:10 (об/об). Елюювані фракції аналізували на присутність антибіотика 107891 використовуючи дифузію на агарі на Staphylococcus aureus і використовуючи аналітичну ВЕРХ, як описано раніше. Елюювані фракції, що містять антибіотик 107891 об'єднували, концентрували при пониженому тиску і ліофілізували, одержуючи 8,1 грам неочищеного антибіотика 107891. Приклад 4: Альтернативне виділення антибіотика 107891 рН зібраного з 200л ферментаційного танку бульйону описаного в прикладі 2 доводили до 6,8 і бульйон фільтрували використовуючи тангенціальне фільтрування (мембрану з розміром пор 0,1m, Koch Carbo-Cor). Перміат (180л) перемішували порцями протягом ночі при кімнатній температурі 2л смоли Diaion HP20 (Mitsubishi Chemical) і смолу збирали. Додавали метанол (25л) до частини ретентату в устаткування для тангенціального фільтрування (приблизно 20л), що містить концентрований міцелій. Цю суспензію перемішували протягом 1 години і потім фільтрували використовуючи мікрофільтрувальну систему для залишкового об'єму ретентату приблизно 20л. Додавали ще метанол (25л) і описаний вище процес повторювали загалом 5 разів. Об'єднані метанольні екстракти (приблизно 125л) розводили 160л демінералізованої води і перемішували порціями протягом ночі при кімнатній температурі з 3л смоли Diaion HP 20. Смолу збирали і об'єднували із смолою Diaion HP 20, що використовувалась для екстрагування бульйону перміату згідно із способом описаним вище. Об'єднану смолу промивали у хроматографічній колонці 20л вода:метанол 6:4 (об/об). Антибіотик 107891 елюювали 23л метанол:50мМ буфер форміату амонію рН 3,5:н-бутанол 9:1:1 (об/об). Цей елюат концентрували у вакуумі до кінцевого об'єму 3л. Концентрований розчин завантажували з рН 4,5 на колонку з 2,5л поліаміду СС 6 0,1-0,3мм (Macherey-Nagel) кондиціоновану вода:метанол 7:3 (об/об) Колонку промивали вода:метанол 7:3 (об/об) і потім 25мМ буфером форміату амонію рН 3,5: метанол 7:3 (об/об). Антибіотик елюювали вода:метанол 3:7 (об/об) і потім 1:9 (об/об). Елюювання завершували 25мМ буфером форміату амонію рН 2,8: метанол у співвідношенні 1:9 (об/об). Елюати, що містять антибіотик 107891, об'єднували і концентрували у вакуумі до кінцевого об'єму 1л. рН концентрованого розчину доводили з 4 до 5,7 використовуючи 7Μ гідроксид амонію і потім суміш центрифугували для збирання осаду. Цю тверду речовину суспендували у воді і ліофілізували, одержуючи 6,96г рецептури антибіотика 107891. Приклад 5: Очищення антибіотика 107891 Неочищений антибіотик 107891 (3,6г), одержували як описано в Прикладі 3, очищали використовуючи хроматографію середнього тиску на 100г оберненої фази С8 (ЕС) розмір часточок 40-70mм, розмір пор 60А, 1ST (International Sorbent Technology, Mid-Glamorgan, UK) використовуючи систему хроматографії середнього тиску Bchi B 43 680 (Bchi laboratoriums-technik AG, Flawil Switzerland), споряджений формувачем градієнту В-687, збирачем фракцій В-684, скляною колонкою В-685 70´460мм. Смолу попередньо промивали сумішшю фаза А фаза В 8:2 (об/об) і потім елюювали 25мл/хв 60хв з лінійним градієнтом від 20% до 60% фази В на 60хв. Фазою А був ацетонітрил: 20мМ буфер форміату амонію (рН 6,6) 10:90 (об/об); і фазою В був ацетонітрил: 20мМ буфер форміату амонію (рН: 6,6)90:10 (об/об). Фракції, що містять антибіотик 107891 об'єднували, концентрували у вакуумі і двічі ліофілізували з водою, одержуючи 430мг очищеного антибіотика 107891. Приклад 6: Очищення антибіотика 107891 за допомогою препаративної ВЕРХ Антибіотик 107891 надалі очищали за допомогою препаративної ВЕРХ на Hibar напакованій лічросорб RP8 (розмір часточок 7mм) колонка RT 25025мм, Merck, використовуючи 25 хвилинне елюювання лінійним градієнтом від 30% до 45% фази В, із швидкістю потоку 30мл/хв. Фазою А був 25мМ буфер форміату амонію рН 4,5:ацетонітрил 95:5 (об/об) і Фазою В був ацетонітрил. Зразок антибіотика 107891 з прикладу 5 (300мг) розчиняли в 1,5мл 350 ДМСО:мурашина кислота 95:5 (об/об) і 300mл піддавали хроматографічному аналізу. Антибіотик 107891 типово елююється на 15-16 хвилинах. Елюювальні фракції 5 хроматографічних прогонів, що містять антибіотик 107891, об'єднували і концентрували у вакуумі. Залишковий розчин послідовно ліофілізували з води три рази, одержуючи 31мг антибіотика 107891 як білий порошок. Приклад 7: Виділення і очищення окремих Факторів А1 і А2 антибіотика 107891 Фактори А1 і А2 відокремлювали і очищали від комплексного антибіотика 107891 Прикладу 5 за 87548 44 допомогою препаративної ВЕРХ на колонці Symmetry Prep C18 (розмір часточок 7mм) 7,8´300мм Waters (Mildfold USA) використовуючи дві різні програми елюювання. A) Фактор А1 очищали 25 хвилинним елююванням лінійним градієнтом від 30% до 45% фази В, із швидкістю потоку 3,5мл. Фазою А був 25мМ буфер форміату амонію рН 4,5:ацетонітрил 95:5 (об/об) і Фазою В був ацетонітрил. Очищений комплексний антибіотик 107891 (15мг) розчиняли в 350mл ДМСО:мурашина кислота 95:5 (об/об) і піддавали хроматографуванню. Фактори А1 і А2 типово елюються на 11-13 хвилинах. Елюйовані фракції потім аналізували за допомогою ВЕРХ за аналітичних умов описаних вище. Фракції 14 хроматографічних пропускань, що містять Фактор А1 антибіотика 107891, об'єднували і концентрували у вакуумі. Залишковий розчин ліофілізували з води послідовно три рази, одержуючи 15мг чистого Фактора А1, як білий порошок. B) Фактор А2 очищали ізократичним елююванням із швидкістю потоку 7мл 100мМ буфером форміату амонію рН 4:ацетонітрил 82,5:17,5 (об/об). Очищений комплексний антибіотик 107891 (5мг) розчиняли в 250mл суміш оцтова кислота:ацетонітрил:100мМ буфер форміату амонію рН 4 50:120:80 (об/об) і піддавали хроматографуванню. Фактори А1 і А2 типово елюються на 9-10 хвилинах. Елюйовані фракції потім аналізували за допомогою ВЕРХ за аналітичних умов описаних вище. Фракції 20 хроматографічних пропускань, що містять Фактор А2 антибіотика 107891, об'єднували і концентрували у вакуумі. Залишковий розчин ліофілізували з води послідовно два рази, одержуючи 8мг чистого Фактора А2, як білий порошок. 45 87548 46 47 87548 48 49 87548 50 51 87548 52 53 87548 54 55 87548 56 57 87548 58 59 87548 60
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibiotic 107891, its factors a1 and a2, pharmaceutically acceptable salts and compositions, and use thereof
Автори англійськоюLazzarini Ameriga, Gastaldo Luciano, Candiani Gianpaolo, Ciciliato Ismaela, Losi Daniele, Marinelli Flavia, Selva Enrico, Parenti Franco
Назва патенту російськоюАнтибиотик 107891, его факторы а1 и а2, фармацевтически приемлемые соли и композиция и их применение
Автори російськоюЛаззарини Америга, Гасталдо Лучано, Кандиани Джанпаоло, Чичилято Исмаэла, Лоси Даниэле, Маринелли Флавиа, Селва Энрико, Паренти Франко
МПК / Мітки
МПК: A61K 38/16, C07K 14/195, C12P 1/04, C07K 1/14
Мітки: прийнятні, 107891, фактори, антибіотик, солі, композиція, застосування, фармацевтично
Код посилання
<a href="https://ua.patents.su/32-87548-antibiotik-107891-jjogo-faktori-a1-i-a2-farmacevtichno-prijjnyatni-soli-i-kompoziciya-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антибіотик 107891, його фактори а1 і а2, фармацевтично прийнятні солі і композиція та їх застосування</a>