Похідні сечовини і їх терапевтичне застосування при лікуванні, серед іншого, захворювань дихальних шляхів
Формула / Реферат
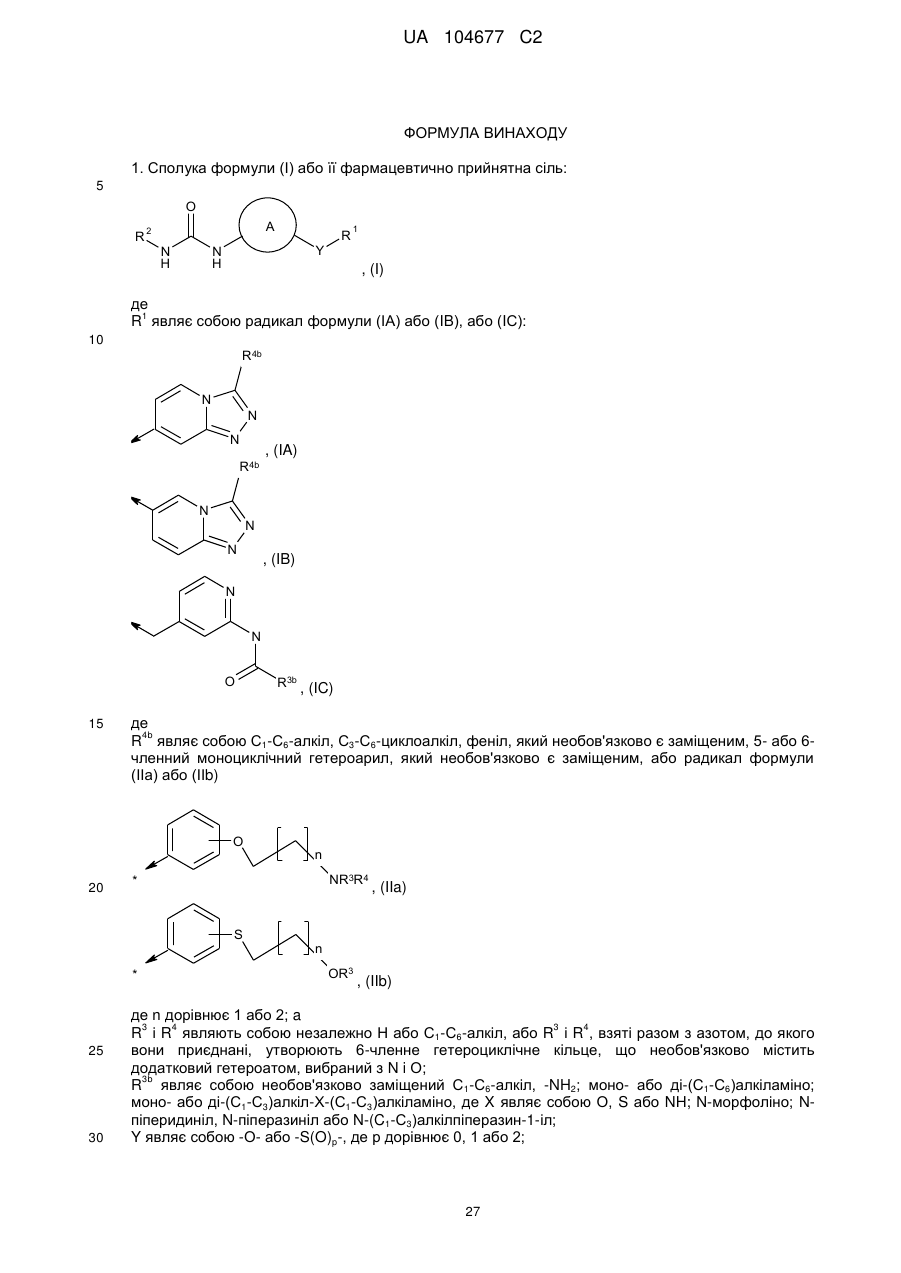
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
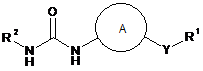 , (I)
, (I)
де
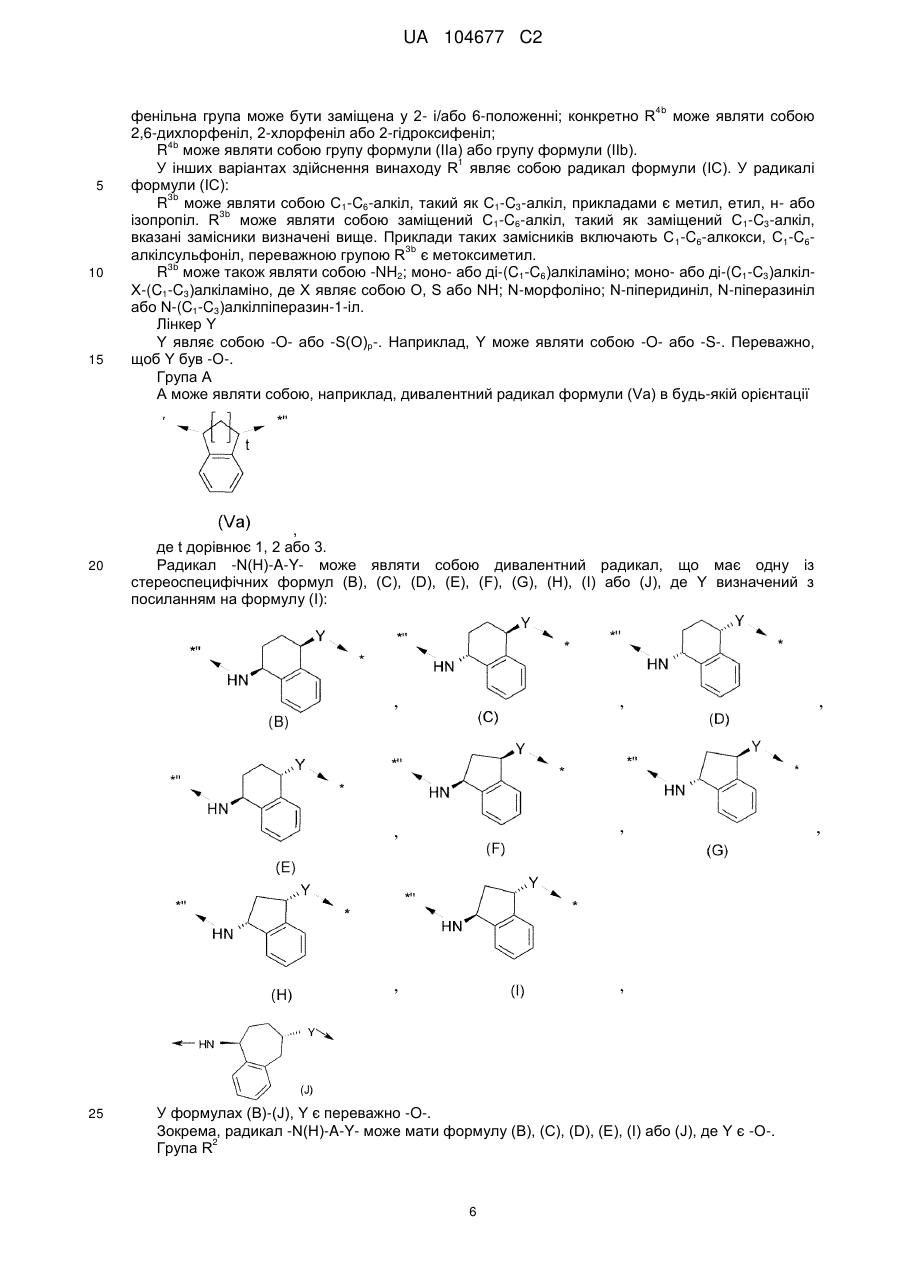
R1 являє собою радикал формули (ІА) або (IB), або (IС):
 , (IA)
, (IA)
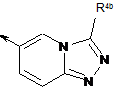 , (IB)
, (IB)
 , (IC)
, (IC)
де
R4b являє собою С1-С6-алкіл, С3-С6-циклоалкіл, феніл, який необов'язково є заміщеним, 5- або 6-членний моноциклічний гетероарил, який необов'язково є заміщеним, або радикал формули (ІІа) або (ІІb)
 , (IIa)
, (IIa)
 , (IIb)
, (IIb)
де n дорівнює 1 або 2; a
R3 і R4 являють собою незалежно Н або С1-С6-алкіл, або R3 і R4, взяті разом з азотом, до якого вони приєднані, утворюють 6-членне гетероциклічне кільце, що необов'язково містить додатковий гетероатом, вибраний з N i О;
R3b являє собою необов'язково заміщений С1-С6-алкіл, -NH2; моно- або ді-(С1-С6)алкіламіно; моно- або ді-(С1-С3)алкіл-Х-(С1-С3)алкіламіно, де X являє собою О, S або NH; N-морфоліно; N-піперидиніл, N-піперазиніл або N-(C1-С3)алкілпіперазин-1-іл;
Y являє собою -О- або -S(O)p-, де р дорівнює 0, 1 або 2;
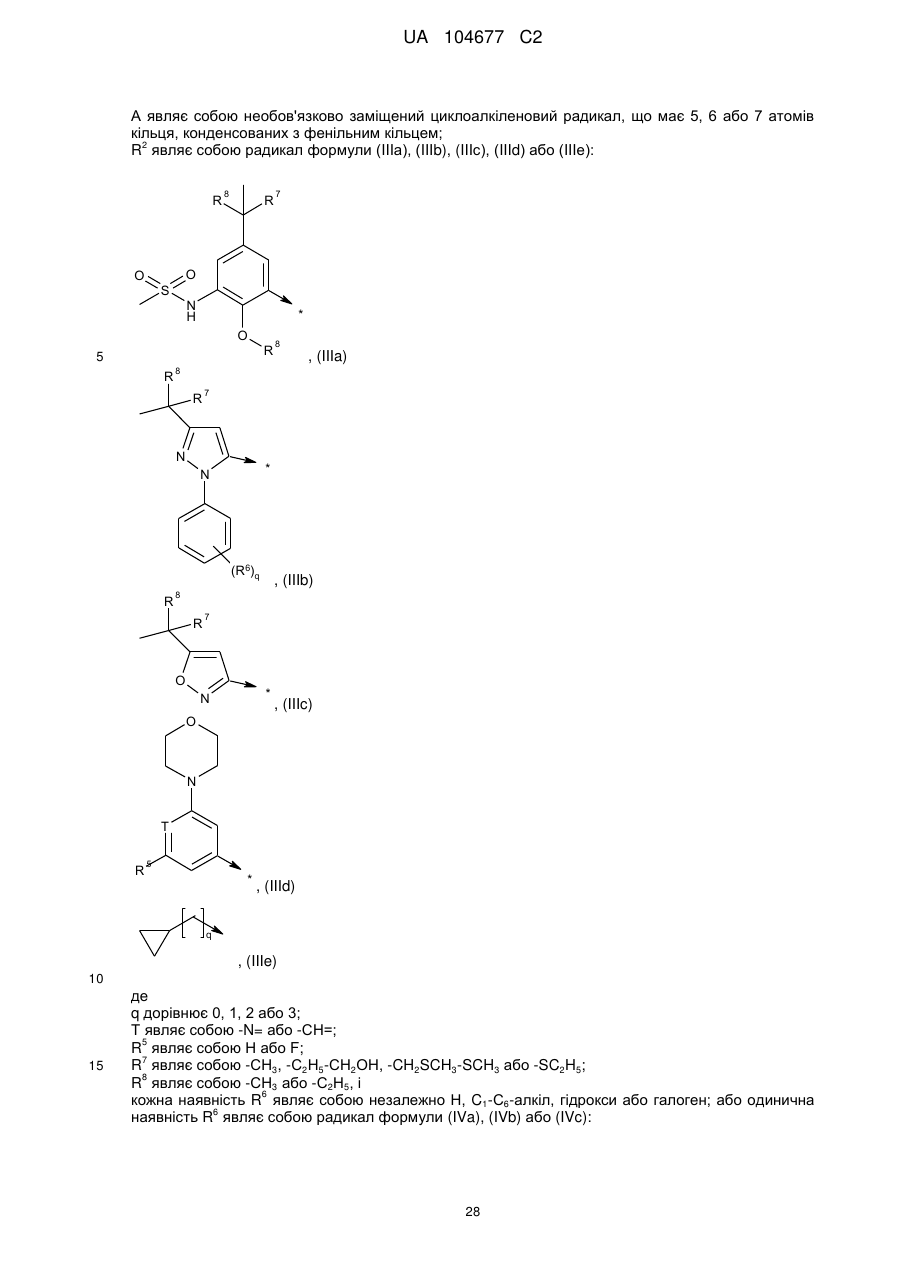
А являє собою необов'язково заміщений циклоалкіленовий радикал, що має 5, 6 або 7 атомів кільця, конденсованих з фенільним кільцем;
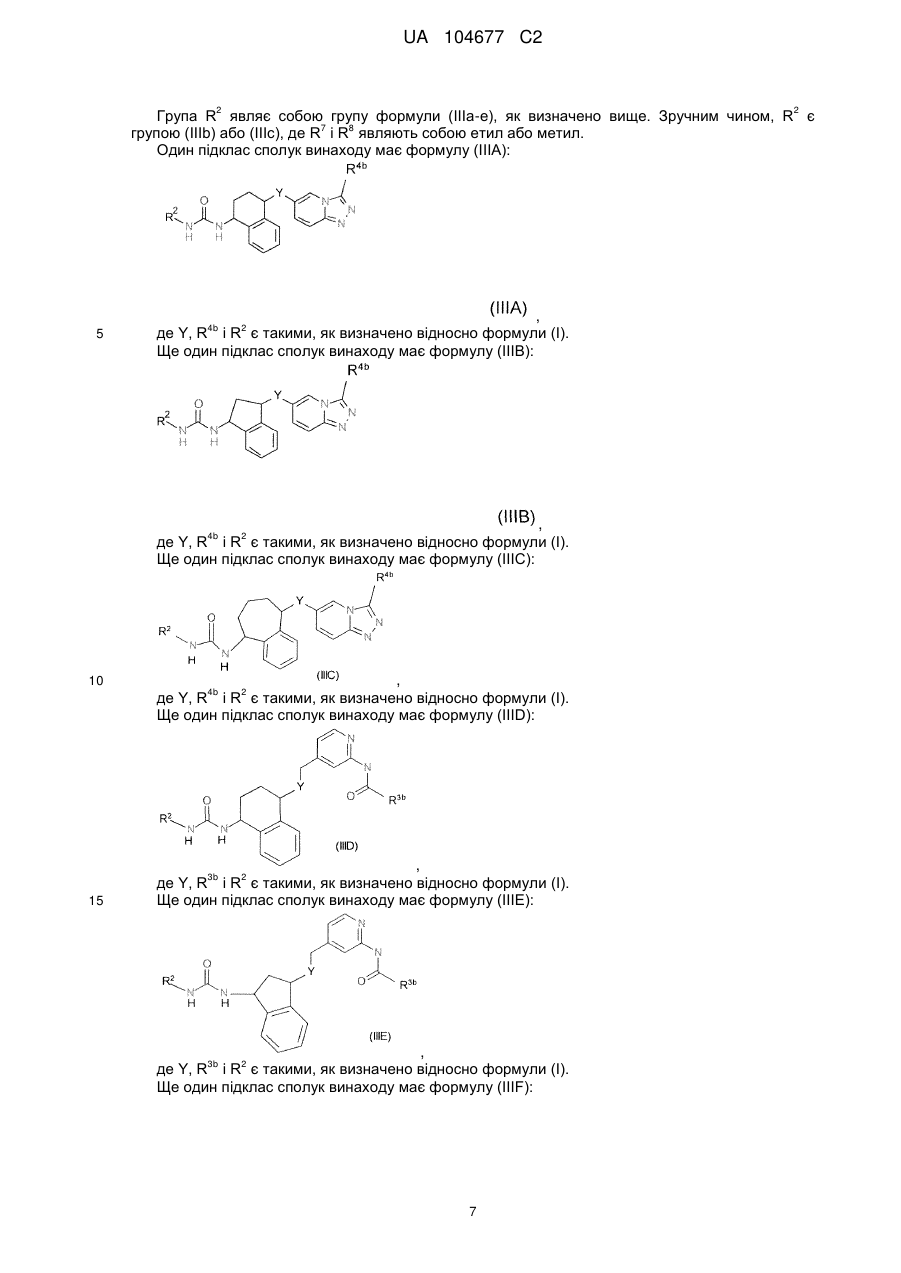
R2 являє собою радикал формули (IIIа), (IIIb), (IIIс), (IIId) або (IIIе):
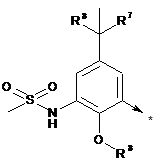 , (IIIa)
, (IIIa)
 , (IIIb)
, (IIIb)
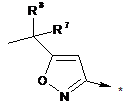 , (IIIc)
, (IIIc)
 , (IIId)
, (IIId)
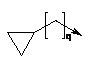 , (IIIe)
, (IIIe)
де
q дорівнює 0, 1, 2 або 3;
Т являє собою -N= або -СН=;
R5 являє собою Н або F;
R7 являє собою -СН3, -С2Н5-СН2ОН, -CH2SCH3-SCH3 або -SC2H5;
R8 являє собою -СН3 або -С2Н5, і
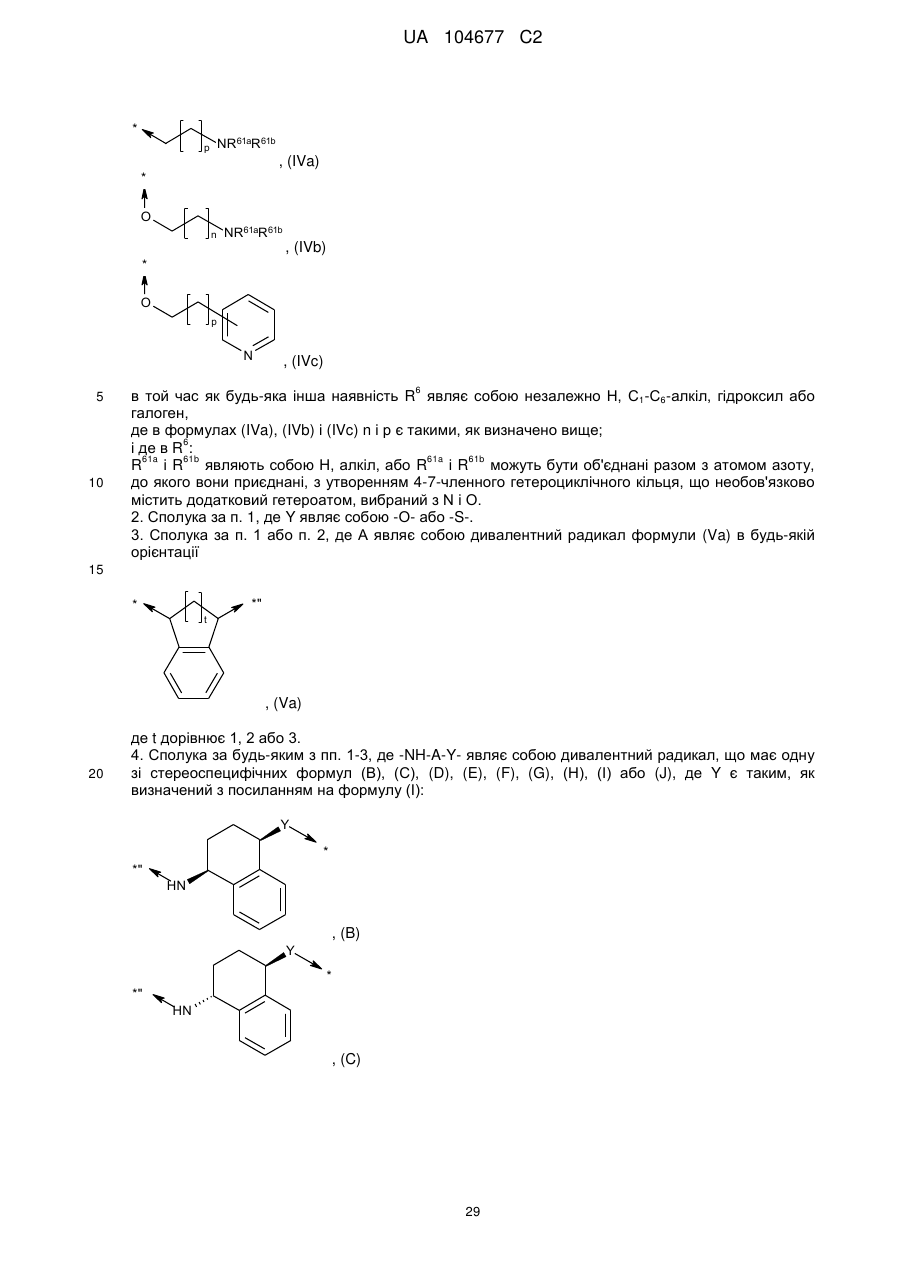
кожна наявність R6 являє собою незалежно Н, C1-С6-алкіл, гідрокси або галоген; або одинична наявність R6 являє собою радикал формули (IVa), (IVb) або (IVc):
 , (IVa)
, (IVa)
 , (IVb)
, (IVb)
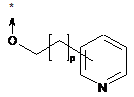 , (IVc)
, (IVc)
в той час як будь-яка інша наявність R6 являє собою незалежно Н, С1-С6-алкіл, гідроксил або галоген,
де в формулах (IVa), (IVb) і (IVc) n і р є такими, як визначено вище;
і де в R6:
R61a і R61b являють собою Н, алкіл, або R61a і R61b можуть бути об'єднані разом з атомом азоту, до якого вони приєднані, з утворенням 4-7-членного гетероциклічного кільця, що необов'язково містить додатковий гетероатом, вибраний з N і О.
2. Сполука за п. 1, де Y являє собою -О- або -S-.
3. Сполука за п. 1 або п. 2, де А являє собою дивалентний радикал формули (Va) в будь-якій орієнтації
 , (Va)
, (Va)
де t дорівнює 1, 2 або 3.
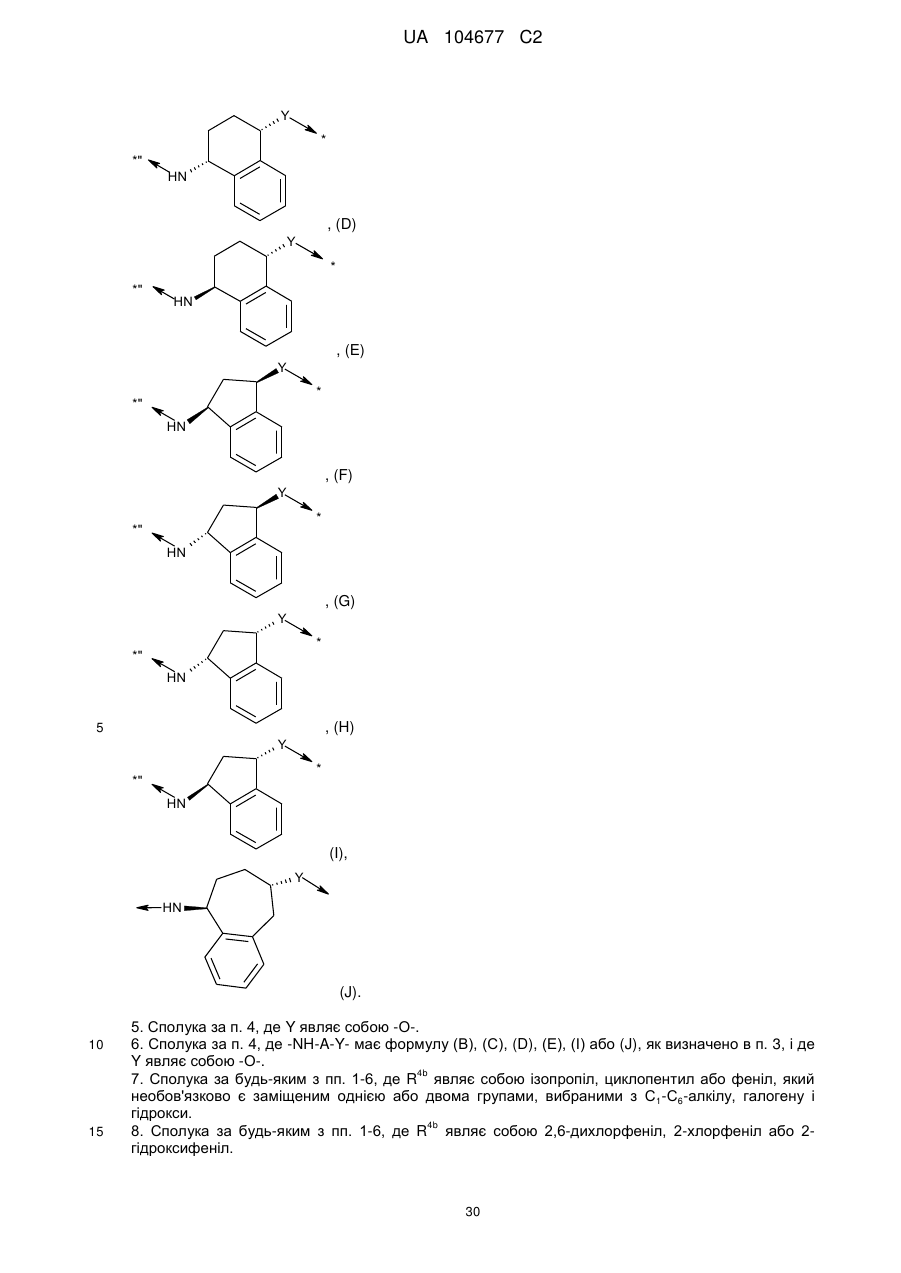
4. Сполука за будь-яким з пп. 1-3, де -NH-A-Y- являє собою дивалентний радикал, що має одну зі стереоспецифічних формул (В), (С), (D), (E), (F), (G), (Н), (І) або (J), де Y є таким, як визначений з посиланням на формулу (І):
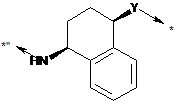 , (B)
, (B)
 , (C)
, (C)
 , (D)
, (D)
 , (E)
, (E)
 , (F)
, (F)
 , (G)
, (G)
 , (H)
, (H)
 (I),
(I),
 , (J).
, (J).
5. Сполука за п. 4, де Y являє собою -О-.
6. Сполука за п. 4, де -NH-A-Y- має формулу (В), (С), (D), (Е), (І) або (J), як визначено в п. 3, і де Y являє собою -О-.
7. Сполука за будь-яким з пп. 1-6, де R4b являє собою ізопропіл, циклопентил або феніл, який необов'язково є заміщеним однією або двома групами, вибраними з С1-С6-алкілу, галогену і гідрокси.
8. Сполука за будь-яким з пп. 1-6, де R4b являє собою 2,6-дихлорфеніл, 2-хлорфеніл або 2-гідроксифеніл.
9. Сполука за будь-яким з пп. 1-6, де R3b являє собою метоксиметил.
10. Сполука за будь-яким з попередніх пунктів, де R2 являє собою групу (IIIb) або (IIIс), де R7 і R8 являють собою незалежно етил або метил.
11. Сполука за будь-яким з пп. 1-9, де R2 являє собою групу (IIIb1) або (IIIb2).
12. Фармацевтична композиція, яка містить сполуку за будь-яким з попередніх пунктів, разом з одним або декількома фармацевтично прийнятними носіями.
13. Композиція за п. 12, яка є пристосованою для інгаляції для легеневого введення.
14. Сполука за будь-яким з пп. 1-11 для застосування при лікуванні захворювання або стану, який має позитивний результат від інгібування активності МАР-кінази р38.
15. Сполука для застосування за п. 14, де захворювання або стан є хронічним обструктивним захворюванням легень і являє собою гострий респіраторний дистрес-синдром у дорослих (ARDS), загострення гіперреактивності дихальних шляхів, що є наслідком іншої лікарської терапії, або захворювання дихальних шляхів, яке є асоційованим з легеневою гіпертензією.
Текст
Реферат: Сполуки формули (І) являють собою інгібітори МАРК р38, застосовні як протизапальні 1 засоби при лікуванні, серед інших, захворювань дихальних шляхів, де R являє собою радикал формули (ІА) або (IB), або (IС); Y являє собою -О- або -S(O)р-, де р дорівнює 0, 1 або 2; А являє собою необов'язково заміщений циклоалкіленовий радикал, що має 5, 6 або 7 атомів кільця, 2 3b 4b конденсованих з фенільним кільцем; і R , R і R є такими, як визначено в формулі винаходу. O R A 2 N H N H Y R 1 (I) UA 104677 C2 (12) UA 104677 C2 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується сполук і композицій, які є інгібіторами MAPK p38, застосовних як протизапальні засоби при лікуванні, серед іншого, захворювань дихальних шляхів. Попередній рівень техніки Мітогенактивовані протеїнкінази (MAPK) складають сімейство пролін-направлених серин/треонінових кіназ, які активують їх субстрати за допомогою подвійного фосфорилування. Існують чотири відомих людських ізоформи МАР-кінази р38, p38, p38, p38 і p38. Кінази р38, які також відомі як цитокінпригнічувальні, зв'язуючі протизапальні засоби білки (CSBP), активовані стресом протеїнкінази (SAPK) і RK, є відповідальними за фосфорилування (Stein et al. Ann. Rep. Med Chem., 1996, 31, 289-298) і активацію транскрипційних факторів (таких як ATF2, MAX, CHOP і C/ERPb), а також інших кіназ (таких як MAPKAP-K2/3 або MK2/3), і самі активуються за допомогою фізичного і хімічного стресу (наприклад, УФ, осмотичного стресу), прозапальними цитокінами і бактеріальним ліпополісахаридом (LPS) (Herlaar Е. & Brown Z. Molecular Medicine Today, 1999, 5, 439-447). Було показано, що продукти фосфорилування p38 опосередковують вироблення запальних цитокінів, які включають фактор некрозу пухлин альфа (TNF-) і інтерлейкін-1 (IL-1), і циклооксигеназу-2 (COX-2). Також відомо, що IL-1 і TNF- стимулюють вироблення інших прозапальних цитокінів, таких як IL-6 і IL-8. IL-1 і TNF- є біологічними речовинами, продукованими різноманітними клітинами, такими як моноцити або макрофаги. Було продемонстровано, що IL-1 опосередковує різноманітні біологічні активності, які, як вважають, є важливими при імунорегуляції і інших фізіологічних станах, таких як запалення (наприклад, Dinarello et al. Rev. Infect. Disease, 1984, 6, 51). Надмірне або нерегульоване вироблення TNF (особливо, TNF-) залучене в опосередковування або загострення ряду захворювань, і вважають, що TNF може викликати або сприяти ефектам запалення загалом. IL-8 являє собою хемотаксичний фактор, продукований деякими типами клітин, що включають моноядерні клітини, фібробласти, ендотеліальні клітини і кератиноцити. Його вироблення з ендотеліальних клітин індукується IL1, TNF або ліпополісахаридом (LPS). IL-8 стимулює ряд функцій in vitro. Було показано, що він має хемоатрактантні властивості для нейтрофілів, Т-лімфоцитів і базофілів. Збільшення вироблення IL-8 також є відповідальним за хемотаксис нейтрофілів в запальну ділянку in vivo. Очікується, що інгібування сигнальної трансдукції через p38, який на доповнення до IL-1, TNF і IL-8, описаних вище, також необхідний для синтезу і/або дії деяких додаткових прозапальних білків (наприклад, IL-6, GM-CSF, COX-2, колагенази і стромелізину), є високоефективним механізмом для регуляції надмірної і деструктивної активації імунної системи. Це очікування основане на високих і різноманітних протизапальних активностях, описаних для інгібіторів кінази р38 (Badger et al. J. Pharm. Exp. Thera., 1996, 279, 1453-1461; Griswold et al. Pharmacol. Comm., 1996, 7, 323-229). Зокрема, інгібітори кінази р38 були описані як потенційні засоби для лікування ревматоїдного артриту. На доповнення до зв'язку між активацією p38 і хронічним запаленням і артритом, є дані, що вказують на роль p38 в патогенезі захворювань дихальних шляхів, зокрема COPD і астмі. Стресові фактори (що включають тютюновий дим, інфекції або продукти окислення) можуть викликати запалення всередині легеневого оточення. Було показано, що інгібітори p38 інгібують індуковані LPS і овальбуміном в повітряних шляхах TNF-, IL-1, IL-6, IL-4, IL-5 і IL-13 (Haddad et al. Br. J. Pharmacol., 2001, 132 (8), 1715-1724; Underwood et al. Am. J. Physiol. Lung Cell. Mol. 2000, 279, 895-902; Duan et al. 2005, Am. J. Respir. Crit. Care Med., 171, 571-578; Escott et al. Br. J. Pharmacol., 2000, 131, 173176; Underwood et al. J. Pharmacol. Exp. Ther. 2000, 293, 281-288). Крім того, вони значно інгібують нейтрофілію і вивільнення MMP-9 у тваринних моделей з LPS, озоном або сигаретним димом. Існує також значний обсяг доклінічних даних, що вказують на сприятливі ефекти інгібування кінази р38, які можуть стосуватися легень (Lee et al. Immunopharmacology, 2000, 47, 185-200). Таким чином, терапевтичне інгібування активації p38 може бути важливим при регуляції запалення дихальних шляхів. Роль шляху p38 MAPK при різноманітних захворюваннях була розглянута в огляді Chopra P. et al. (Expert Opinion on Investigational Drugs, 2008, 17(10), 1411-1425). Вважають, що сполуки даного винаходу можуть застосовуватися для лікування p38-опосередкованих захворювань, таких як: астма, хронічне або гостре звуження бронхів, бронхіт, гостре пошкодження легені і бронхоектаз, гіпертензія легеневої артерії, туберкульоз, рак легені, загальне запалення (наприклад, запальне захворювання кишечнику), артрит, нейрозапалення, біль, пропасниця, фіброзні захворювання, легеневі розлади і захворювання (наприклад, гіпероксичне альвеолярне пошкодження), серцево-судинні захворювання, постішемічне реперфузійне пошкодження і гостра серцева недостатність, кардіоміопатія, інсульт, ішемія, реперфузійне пошкодження, ниркове реперфузійне пошкодження, набряк мозку, нейротравма і мозкова 1 UA 104677 C2 5 10 15 20 25 30 35 40 травма, нейродегенеративні розлади, розлади центральної нервової системи, захворювання печінки і нефрит, шлунково-кишкові стани, виразкові захворювання, хвороба Крона, очні захворювання, офтальмологічні стани, глаукома, гостре пошкодження тканини ока і очні травми, діабет, діабетична нефропатія, стани, що стосуються шкіри, міалгії внаслідок інфекції, грипу, ендотоксичного шоку, синдром токсичного шоку, аутоімунне захворювання, відторгнення трансплантата, кістковорезорбційні захворювання, розсіяний склероз, псоріаз, екзема, порушення жіночої репродуктивної системи, патологічні (але незлоякісні) стани, такі як гемангіоми, ангіофіброма носоглотки, і аваскулярний некроз кісток, доброякісні і злоякісні пухлини/неоплазія, що включають рак, лейкемію, лімфому, системний червоний вовчак (SLE), ангіогенез, включаючи неоплазію, кровотечу, коагуляцію, радіаційне пошкодження і/або метастази. Хронічне вивільнення активного TNF може викликати кахексію і анорексію, і TNF може бути летальним. TNF також бере участь при інфекційних захворюваннях. Вони включають, наприклад, малярію, мікобактеріальну інфекцію і менінгіт. Вони також включають вірусні інфекції, такі як ВІЛ, вірус грипу і вірус герпесу, включаючи вірус простого герпесу типу 1 (HSV-1), вірус простого герпесу типу 2 (HSV-2), цитомегаловірус (CMV), вірус вітряної віспи (VZV), вірус Епштейна-Барра, вірус герпесу людини 6 (HHV-6), вірус герпесу людини 7 (HHV7), вірус герпесу людини 8 (HHV-8), псевдосказ і ринотрахеїт, серед інших. Відомі інгібітори кінази р38 розглянуті в огляді Hanson G. J. (Expert Opinions on Therapeutic Patents, 1997, 7, 729-733); Hynes J. et al. (Current Topics in Medicinal Chemistry, 2005, 5, 967-985); Dominguez C. et al. (Expert Opinions on Therapeutics Patents, 2005, 15, 801-816); і Pettus L. H. & Wurtz R. P. (Current Topics in Medicinal Chemistry, 2008, 8, 1452-1467). Інгібітори кінази р38, що містять триазолопіридиновий мотив, є відомими в даній галузі, наприклад, див. WO 07/091152, WO 04/072072, WO 06/018727. Короткий опис винаходу Сполуки даного винаходу є інгібіторами мітогенактивованої протеїнкінази p38 ("p38 MAPK", "кінази р38" або "p38"), включаючи кіназу p38, і є інгібіторами вироблення цитокінів і хемокінів, включаючи вироблення TNF- і IL-8. Вони мають ряд терапевтичних застосувань, при лікуванні запальних захворювань, конкретно алергічних і неалергічних захворювань дихальних шляхів, більш конкретно обструктивних або запальних захворювань дихальних шляхів, таких як хронічна обструктивна хвороба легень ("COPD") і астма. Вони, отже, є особливо придатними для легеневої доставки за допомогою інгаляції через ніс або рот. Докладний опис винаходу Відповідно до винаходу надана сполука формули (I) або її фармацевтично прийнятна сіль: , де 1 R являє собою радикал формули (IA) або (IB), або (IC): , , , де 4b R являє собою C1-C6-алкіл, C3-C6-циклоалкіл, феніл, який необов'язково є заміщеним, 5або 6-членний моноциклічний гетероарил, який необов'язково є заміщеним, або радикал формули (IIa) або (IIb) , , 3 45 4 3 4 де n дорівнює 1 або 2; а R і R являють собою незалежно Н або C1-C6-алкіл, або R і R , взяті разом з азотом, до якого вони приєднані, утворюють 6-членне гетероциклічне кільце, яке необов'язково містить додатковий гетероатом, вибраний з N і О; 2 UA 104677 C2 3b 5 R являє собою необов'язково заміщений C 1-C6-алкіл, -NH2; моно- або ді-(C1-C6)алкіламіно; моно- або ді-(C1-C3)алкіл-Х-(C1-C3)алкіламіно, де X являє собою О, S або NH; N-морфоліно; Nпіперидиніл, N-піперазиніл або N-(C1-C3)алкілпіперазин-1-іл; Y являє собою -O- або -S(О)p-, де р дорівнює 0, 1 або 2; А являє собою необов'язково заміщений циклоалкіленовий радикал, що має 5, 6 або 7 атомів кільця, конденсованих з фенільним кільцем; 2 R являє собою радикал формули (IIIa), (IIIb), (IIIc), (IIId) або (IIIe): , , 10 15 , де q дорівнює 0, 1, 2 або 3; Т являє собою -N= або -CH=; 5 R являє собою Н або F; 7 R являє собою -CH3, -C2H5-CH2OH, -CH2SCH3-SCH3 або -SC2H5; 8 R являє собою -CH3 або -C2H5, і 6 кожна наявність R являє собою незалежно Н, C1-C6-алкіл, гідрокси або галоген; або 6 одинична наявність R являє собою радикал формули (IVa), (IVb) або (IVc) , , 6 20 25 30 35 40 , , в той час як будь-яка інша наявність R являє собою незалежно Н, C1-C6алкіл, гідроксил або галоген, де в формулах (IVa), (IVb) і (IVc) n і р є такими, як визначено вище; 6 і де в R : 61а 61b 61a 61b R і R являють собою Н, алкіл, або R і R можуть бути об'єднані разом з атомом азоту, до якого вони приєднані, з утворенням 4-7-членного гетероциклічного кільця, що необов'язково містить додатковий гетероатом, вибраний з N і О, такого як кільце піперидину, піперазину або морфоліну. У ще одному аспекті, винахід включає фармацевтичні композиції, які містять сполуку винаходу, разом з одним або декількома фармацевтично прийнятними носіями і/або ексципієнтами. Особливо переважними є композиції, пристосовані для інгаляції для легеневого введення. У ще одному аспекті, винахід включає застосування сполуки винаходу для лікування захворювань або станів, яке має позитивний результат від інгібування активності МАР-кінази р38. Лікування обструктивних або запальних захворювань дихальних шляхів є переважним застосуванням. Всі форми обструктивних або запальних захворювань дихальних шляхів є потенційно виліковними із застосуванням сполук даного винаходу, зокрема обструктивне або запальне захворювання дихальних шляхів, яке є захворюванням, вибраним з групи, що складається з хронічної еозинофільної пневмонії, астми, COPD, COPD, що включає, хронічний бронхіт, емфізему легень або задишку, асоційовану або не асоційовану з COPD, COPD, яка характеризується необоротною, прогресуючою обструкцією дихальних шляхів, гострого респіраторного дистрес-синдрому у дорослих (ARDS), загострення гіперреактивності дихальних шляхів, що є наслідком іншої лікарської терапії, і захворювання дихальних шляхів, яке є 3 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 55 асоційованим з легеневою гіпертензією, хронічними запальними захворюваннями, що включають кістозний фіброз, бронхоектаз і фіброз легень (ідіопатичний). Ефективність дії передбачають, коли інгібітори кінази р38 вводять або місцево в легеню (наприклад, за допомогою інгаляції і інтраназальної доставки), або за допомогою системних шляхів (наприклад, пероральної, внутрішньовенної і підшкірної доставки). Термінологія Як використовують тут, термін "(Ca-Cb)алкіл", де а і b є цілими числами, стосується прямоланцюжкового або розгалуженого алкільного радикала, що має від а до b вуглецевих атомів. Таким чином, коли а дорівнює 1 і b дорівнює 6, наприклад, термін включає метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил і н-гексил. Як використовують тут, термін "карбоциклічний" стосується моно-, бі- або трициклічного радикала, що має до 16 атомів кільця, всі з яких являють собою вуглець, і включає арил і циклоалкіл. Як використовують тут, термін "циклоалкіл" стосується моноциклічного насиченого карбоциклічного радикала, що має від 3-8 атомів вуглецю і включає, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Термін "дивалентний циклоалкіленовий радикал" стосується циклоалкільного радикала, що має дві ненасичених валентності, такого як 1,3-циклопентилен, 1,4-циклогексилен і 1,4циклогептилен, таким чином: , , . Як використовують тут, необмежувальний термін "арил" стосується моно- або біциклічного карбоциклічного ароматичного радикала і включає радикали, що мають два моноциклічних карбоциклічних ароматичних кільця, які є безпосередньо зв'язаними ковалентним зв'язком. Ілюстративними прикладами таких радикалів є феніл, біфеніл і нафтил. Як використовують тут, необмежувальний термін "гетероарил" стосується моно- або біциклічного ароматичного радикала, що містить один або декілька гетероатомів, вибраних з S, N і О, і включає радикали, що мають два таких моноциклічних кільця або одне таке моноциклічне кільце і одне моноциклічне арильне кільце, які є безпосередньо зв'язаними ковалентним зв'язком. Ілюстративними прикладами таких радикалів є тієніл, бензотієніл, фурил, бензофурил, піроліл, імідазоліл, бензімідазоліл, тіазоліл, бензотіазоліл, ізотіазоліл, бензізотіазоліл, піразоліл, оксазоліл, бензоксазоліл, ізоксазоліл, бензізоксазоліл, ізотіазоліл, триазоліл, бензотриазоліл, тіадіазоліл, оксадіазоліл, піридиніл, піридазиніл, піримідиніл, піразиніл, триазиніл, індоліл і індазоліл. Як використовують тут, необмежувальний термін "гетероцикліл" або "гетероциклічний" включає "гетероарил", як визначено вище, і в його неароматичному значенні стосується моно-, бі- або трициклічного неароматичного радикала, що містить один або декілька гетероатомів, вибраних з S, N і О, і груп, що складаються з моноциклічного неароматичного радикала, що містить один або декілька таких гетероатомів, який є ковалентно зв'язаним з ще одним таким радикалом або з моноциклічним карбоциклічним радикалом. Ілюстративними прикладами таких радикалів є групи піроліл, фураніл, тієніл, піперидиніл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, піразоліл, піридиніл, піролідиніл, піримідиніл, морфолініл, піперазиніл, індоліл, морфолініл, бензофураніл, піраніл, ізоксазоліл, бензімідазоліл, метилендіоксифеніл, етилендіоксифеніл, малеімідо і сукцинімідо. Якщо не встановлено іншим чином в контексті, в якому це наявне, термін "заміщений" в застосуванні до будь-якого арильного або гетероарильного фрагмента в даному документі означає заміщений щонайменше одним замісником, наприклад, вибраним з (C 1-C6)алкілу, (C1C6)фторалкілу, (C1-C6)алкокси (включаючи метилендіокси- і етилендіоксизаміщення біля суміжних атомів вуглецю ароматичного кільця), (C1-C6)фторалкокси, (C1-C6)алкоксі(C1-C6)алкілу, бензилоксі(C1-C6)алкілу, (C1-C6)алкоксі(C1-C6)алкокси, бензилоксі(C1-C6)алкокси, гідрокси, гідроксі(C1-C6)алкілу, гідроксі(C1-C6)алкокси, гідроксі(C1-C6)алкілтіо, меркапто, меркапто(C1C6)алкілу, (C1-C6)алкілтіо, циклопропілу, галогену (включаючи фтор і хлор), О-бензилу, нітро, A A A A нітрилу (ціано), -COOH, тетразолілу, -COOR , -COR , -SО2R , -CONH2, -SО2NH2, -CONHR , A A B A B A A B A A B SО2NHR , -CONR R , -SО2NR R , -NH2, -NHR , -NR R , -OCONH2, -OCONHR , -OCONR R , A A B A A B A A NHCOR , -NHCOOR , -NR COOR , -NHSО2OR , -NR SО2OR , -NHCONH2, -NR CONH2, В A B A B A A B A B NHCONHR , -NR CONHR , -NHCONR R або -NR CONR R , де R і R являють собою A B незалежно (C1-C4)алкільну групу, або R і R , коли вони приєднані до одного і того ж азоту, можуть утворювати, разом з цим азотом, циклічну аміногрупу, таку як морфолінільну, 4 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 55 піперидинільну або піперазинільну групу. "Необов'язковий замісник" може являти собою одну із заміщувальних груп, охоплюваних наведеним вище описом. Сполуки винаходу можуть існувати в одній або декількох геометричних, оптичних, енантіомерних, діастереомерних і таутомерних формах, що включають, але не обмежені лише ними, цис- і транс-форми, Е- і Z-форми, R-, S- і мезоформи, кетоформи і енольні форми. Якщо не зазначається інакше, посилання на конкретну сполуку включає всі такі ізомерні форми, включаючи їх рацемічні і інші суміші. Там, де потрібно, такі ізомери можуть бути виділені з їх сумішей за допомогою застосування або адаптації відомих способів (наприклад, хроматографічних методів і методів перекристалізації). За необхідності, такі ізомери можуть бути одержані із застосуванням адаптації відомих способів (наприклад, асиметричного синтезу). Як використовують тут, термін "сіль" включає основно-адитивні, кислотно-адитивні і амонієві солі. Як коротко указано вище, сполуки винаходу, які є кислотними, можуть утворювати солі, що включають фармацевтично прийнятні солі, з основами, такими як гідроксиди лужних металів, наприклад гідроксиди натрію і калію; гідроксиди лужноземельних металів, наприклад гідроксиди кальцію, барію і магнію; з органічними основами наприклад N-метил-D-глюкаміном, холіном, трис(гідроксиметил)амінометаном, L-аргініном, L-лізином, N-етилпіперидином, дибензиламіном і т. п. Ті сполуки винаходу, які є основними, можуть утворювати солі, що включають фармацевтично прийнятні солі з неорганічними кислотами, наприклад з галогенводневими кислотами, такими як хлористоводнева або бромистоводнева кислота, сірчана кислота, азотна кислота або фосфорна кислота і т. п., і з органічними кислотами, наприклад з оцтовою, трифтороцтовою, винною, янтарною, фумаровою, малеїновою, яблучною, саліциловою, лимонною, метансульфоновою, п-толуолсульфоновою, бензойною, бензолсульфоновою, глутаміновою, молочною і мигдалевою кислотами і т. п. Ті сполуки формули (I), які мають основний азот, можуть також утворювати четвертинні амонієві солі з фармацевтично прийнятним протиіоном, таким як амоній, хлорид, бромід, ацетат, форміат, п-толуолсульфонат, сукцинат, гемісукцинат, нафталінбіссульфонат, метансульфонат, трифторацетат, ксинафоат і т. п. Як огляд по солях, див. Handbook of Pharmaceutical Salts; Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Очікується, що сполуки винаходу можуть бути одержані у формі гідратів і сольватів. Будьяке посилання в даному документі, включаючи формулу винаходу, на "сполуки, яких стосується винахід" або "сполуки винаходу", або "дані сполуки" і т. п. включає посилання на солі, гідрати і сольвати таких сполук. Термін 'сольват' застосовують тут для опису молекулярного комплексу, що містить сполуку винаходу і стехіометричну кількість однієї або декількох фармацевтично прийнятних молекул розчинника, наприклад етанолу. Термін 'гідрат' використовують, коли вказаним розчинником є вода. Індивідуальні сполуки винаходу можуть існувати в декількох поліморфних формах і можуть бути одержані в різних кристалічних формах. Сполуки можуть також вводитися у формі їх проліків. Таким чином, деякі похідні сполук, які можуть бути активними самі по собі або можуть самі мати невелику фармакологічну активність або не мати її, можуть при введенні в або на організм перетворюватися в сполуки винаходу, що мають бажану активність, наприклад, за допомогою гідролітичного розщеплення. Такі похідні згадуються як проліки. Додаткову інформацію по застосуванню проліків можна знайти в Prodrugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (Т. Higuchi and V.J. Stella); і Bioreversible Carriers in Drug Design, Pergamon Press, 1987 (ed. E. B. Roche, American Pharmaceutical Association; C.S. Larsen and J. Ostergaard, Design and application of prodrugs, in Textbook of Drug Design and Discovery, 3rd Edition, 2002, Taylor and Francis). Проліки відповідно до винаходу можуть, наприклад, бути одержані за допомогою заміни відповідної функціональності, присутньої в сполуках формули (I), на певні фрагменти, відомі кваліфікованим фахівцям в даній галузі як 'профрагменти', як описано, наприклад, в Design of Prodrugs by H. Bundgaard (Elsevier, 1985). Такі приклади можуть являти собою проліки карбоксильної групи (такі як -CO-О-CH2-О-CO-tBu, як застосовують в проліках півампіцилін для ампіциліну), амід (-CO-NH-CH2-NAlk2) або амідин (-C(=N-О-CH3)-NH2). Варіанти здійснення винаходу 1 У деяких варіантах здійснення винаходу R являє собою радикал формули (IA) або (IB). З цих радикалів, радикал формули (IB) є на даний час переважним. У радикалах (IA) або (IB): 4b R може являти собою C1-C6-алкіл, такий як ізопропільна група; 4b R може являти собою C3-C6-циклоалкіл, такий як циклопентил; 4b R може являти собою феніл; більш конкретно фенільна група є заміщеною однією або двома групами, вибраними з C1-C6-алкілу, галогену (наприклад, хлору) або гідрокси; наприклад 5 UA 104677 C2 4b 5 10 15 20 фенільна група може бути заміщена у 2- і/або 6-положенні; конкретно R може являти собою 2,6-дихлорфеніл, 2-хлорфеніл або 2-гідроксифеніл; 4b R може являти собою групу формули (IIa) або групу формули (IIb). 1 У інших варіантах здійснення винаходу R являє собою радикал формули (IC). У радикалі формули (IC): 3b R може являти собою C1-C6-алкіл, такий як C1-C3-алкіл, прикладами є метил, етил, н- або 3b ізопропіл. R може являти собою заміщений C 1-C6-алкіл, такий як заміщений C1-C3-алкіл, вказані замісники визначені вище. Приклади таких замісників включають C 1-C6-алкокси, C1-C63b алкілсульфоніл, переважною групою R є метоксиметил. 3b R може також являти собою -NH2; моно- або ді-(C1-C6)алкіламіно; моно- або ді-(C1-C3)алкілХ-(C1-C3)алкіламіно, де X являє собою О, S або NH; N-морфоліно; N-піперидиніл, N-піперазиніл або N-(C1-C3)алкілпіперазин-1-іл. Лінкер Y Y являє собою -O- або -S(О)р-. Наприклад, Y може являти собою -O- або -S-. Переважно, щоб Y був -О-. Група А А може являти собою, наприклад, дивалентний радикал формули (Va) в будь-якій орієнтації , де t дорівнює 1, 2 або 3. Радикал -N(Н)-A-Y- може являти собою дивалентний радикал, що має одну із стереоспецифічних формул (В), (С), (D), (Е), (F), (G), (Н), (I) або (J), де Y визначений з посиланням на формулу (I): , , , , , , 25 , , У формулах (В)-(J), Y є переважно -O-. Зокрема, радикал -N(Н)-A-Y- може мати формулу (В), (С), (D), (Е), (I) або (J), де Y є -О-. 2 Група R 6 UA 104677 C2 2 2 Група R являє собою групу формули (IIIa-e), як визначено вище. Зручним чином, R є 7 8 групою (IIIb) або (IIIc), де R і R являють собою етил або метил. Один підклас сполук винаходу має формулу (IIIA): 5 , 4b 2 де Y, R і R є такими, як визначено відносно формули (I). Ще один підклас сполук винаходу має формулу (IIIB): , 4b 2 де Y, R і R є такими, як визначено відносно формули (I). Ще один підклас сполук винаходу має формулу (IIIC): 10 15 , 4b 2 де Y, R і R є такими, як визначено відносно формули (I). Ще один підклас сполук винаходу має формулу (IIID): , 3b 2 де Y, R і R є такими, як визначено відносно формули (I). Ще один підклас сполук винаходу має формулу (IIIE): , 3b 2 де Y, R і R є такими, як визначено відносно формули (I). Ще один підклас сполук винаходу має формулу (IIIF): 7 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 , 3b 2 де Y, R і R є такими, як визначено відносно формули (I). Застосовність Як указано вище, сполуки винаходу являють собою інгібітори p38 MAPK і, таким чином, застосовні для лікування захворювань або станів, яке має позитивний результат від інгібування ферменту p38. Такі захворювання і стани відомі з літератури і деякі з них були вказані вище. Однак, сполуки мають загальне застосування як протизапальні засоби, особливо для застосування при лікуванні респіраторного захворювання. Конкретно, сполуки можуть застосовуватися при лікуванні хронічної обструктивної хвороби легень (COPD), хронічного бронхіту, фіброзу легень, пневмонії, гострого респіраторного дистрес-синдрому (ARDS), емфіземи легень або емфіземи, індукованої курінням, спадкової (неалергічної астми і екзогенної (алергічної) астми, м'якої астми, помірної астми, важкої астми, астми, стійкої до стероїдів, нейтрофільної астми, бронхітної астми, астми, індукованої навантаженням, професійної астми і індукованої астми після бактеріальної інфекції, кістозного фіброзу, фіброзу легень і бронхоектазу. Композиції Як указано вище, сполуки, яких стосується винахід, являють собою інгібітори кінази р38 і є застосовними при лікуванні деяких захворювань, наприклад запальних захворювань дихальних шляхів. Приклади таких захворювань наведені вище і включають астму, риніт, алергічний синдром дихальних шляхів, бронхіт і хронічну обструктивну хворобу легень. Буде зрозуміло, що конкретний рівень дози для будь-якого конкретного пацієнта буде залежати від різноманітних факторів, що включають активність конкретної використовуваної сполуки, вік, масу тіла, загальний стан здоров'я, стать, дієту, час введення, шлях введення, швидкість виведення, комбінацію лікарського засобу і тяжкість конкретного захворювання, що піддається лікуванню. Оптимальні дозові рівні і частота дозування будуть визначатися клінічними випробуваннями, як необхідно в галузі фармацевтики. Загалом, інтервал добової дози для перорального введення буде знаходитися в межах інтервалу від приблизно 0,001 мг до приблизно 100 мг на кг маси тіла людини, часто від 0,01 мг до приблизно 50 мг на кг, наприклад від 0,1 до 10 мг на кг, в однократній або розділених дозах. Як правило, інтервал добової дози для інгаляційного введення буде знаходитися в межах інтервалу від приблизно 0,1 мкг до приблизно 1 мг на кг маси тіла людини, переважно 0,1 мкг до 50 мкг на кг, в однократній або розділених дозах. З іншого боку, може бути необхідно застосовувати дозування поза цими межами в деяких випадках. Для мети винаходу, інгаляційне введення є переважним. Сполуки, яких стосується винахід, можуть бути одержані для введення за допомогою будьякого шляху відповідно до їх фармакокінетичних властивостей. Композиції, що вводяться перорально, можуть знаходитися у формі таблеток, капсул, порошків, гранул, пастилок, рідких або гелеподібних препаратів, таких як пероральні, місцеві або стерильні парентеральні розчини або суспензії. Таблетки і капсули для перорального введення можуть бути представлені у формі однократної дози і можуть містити загальноприйняті ексципієнти, такі як зв'язуючі, наприклад сироп, акація, желатин, сорбітол, трагакант або полівінілпіролідон; наповнювачі, наприклад лактозу, цукор, кукурудзяний крохмаль, фосфат кальцію, сорбітол або гліцин; таблетувальне мастило, наприклад стеарат магнію, тальк, поліетиленгліколь або оксид кремнію; розпушувачі, наприклад картопляний крохмаль, або прийнятні зволожувачі, такі як лаурилсульфат натрію. Таблетки можуть бути покриті згідно із способами, добре відомими в звичайній фармацевтичній практиці. Пероральні рідкі препарати можуть знаходитися у формі, наприклад, водних або масляних суспензій, розчинів, емульсій, сиропів або еліксирів або можуть бути представлені у вигляді сухого продукту для відновлення з водою або іншим придатним середовищем перед застосуванням. Такі рідкі препарати можуть містити загальноприйняті добавки, такі як суспендуючі агенти, наприклад сорбітол, сироп, метилцелюлоза, сироп глюкози, желатин, гідровані харчові жири; емульгуючі агенти, наприклад лецитин, сорбітанмоноолеат або акація; неводні наповнювачі (які можуть включати харчові масла), наприклад мигдалева олія, фракціонована кокосова олія, масляні складні ефіри, такі як з гліцерином, пропіленгліколем або етиловим спиртом; консерванти, наприклад метил- або 8 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 пропіл-п-гідроксибензоат або сорбінова кислота, і за бажанням загальноприйняті ароматизуючі або забарвлюючі агенти. Для місцевого нанесення на шкіру, лікарський засіб може бути введений в крем, лосьйон або мазь. Кремові або мазеві готові лікарські форми, які можуть застосовуватися для лікарського засобу, є загальноприйнятими готовими формами, добре відомими в даній галузі, наприклад, як описано в стандартних керівництвах по фармацевтиці, таких як Британська фармакопея. Активний інгредієнт може також вводитися парентерально в стерильному середовищі. Залежно від використовуваних основи і концентрації, лікарський засіб може або бути суспендований або розчинений в середовищі. Переважним чином, допоміжні лікарські речовини, такі як місцевий анестетик, консервант і буферні речовини, можуть розчинятися в основі. Однак, для лікування запального захворювання дихальних шляхів, сполуки винаходу можуть також бути складені для інгаляції, наприклад, як назальний спрей або сухий порошок, або аерозольні інгалятори. Для доставки за допомогою інгаляції, активна сполука знаходиться переважно у формі мікрочастинок. Вони можуть бути одержані різноманітними методами, що включають розпилювальне сушіння, ліофілізацію і мікронізацію. Генерація аерозолю може здійснюватися з використанням, наприклад, струминних розпилювачів під тиском або ультразвукових розпилювачів, переважно, з використанням пропелентних дозованих аерозолів або безпропелентного введення мікронізованих активних сполук з, наприклад, інгаляційних капсул або інших систем доставки "сухого порошку". За допомогою прикладу, композиція винаходу може бути одержана у вигляді суспензії для доставки з небулайзера або у вигляді аерозолю в рідкому пропеленті, наприклад, для застосування в інгаляторі відміряних доз з розпиленням стисненим повітрям (PMDI). Пропеленти, придатні для застосування в PMDI, відомі кваліфікованому фахівцю і включають CFC-12, HFA-134a, HFA-227, HCFC-22 (CCl2F2) і HFA-152 (CH4F2 і ізобутан). У переважному варіанті здійснення винаходу, композиція винаходу знаходиться у формі сухого порошку, з використанням для доставки інгалятора сухого порошку (DPI). Відомі багато які типи DPI. Мікрочастинки для доставки за допомогою введення можуть бути складені з ексципієнтами, які сприяють доставці і вивільненню. Наприклад, в готовій лікарській формі сухого порошку, мікрочастинки можуть бути складені з великими частинками носія, які сприяють потоку з DPI в легені. Відомі придатні частинки носія і вони включають частинки лактози; вони можуть мати середньомасовий аеродинамічний діаметр, більший, ніж 90 мкм. У випадку готової лікарської форми на основі аерозолю, приклад являє собою: сполука винаходу 24 мг/балон, лецитин, NF рідк. конц. 1,2 мг/балон, трихлорфторметан, NF 4,025 г/балон, дихлордифторметан, 12,15 NF г/балон. Активні сполуки можуть бути дозовані, як описано, залежно від застосовуваної інгаляторної системи. На доповнення до активних сполук, форми для введення можуть додатково містити ексципієнти, такі як, наприклад, пропеленти (наприклад, Frigen у випадку дозованих аерозолів), поверхнево-активні речовини, емульгатори, стабілізатори, консерванти, ароматизатори, наповнювачі (наприклад, лактоза у випадку порошкових інгаляторів) або, якщо доцільно, додаткові активні сполуки. Для цілей інгаляції доступне велике число систем, за допомогою яких аерозолі з оптимальним розміром частинок можуть генеруватися і вводитися, з використанням інгаляційного методу, який є придатним для пацієнта. На доповнення до застосування адапторів (спейсерів, розширювачів) і грушоподібних контейнерів (наприклад, Nebulator®, Volumatic®), і автоматизованих пристроїв, що випускають розпилюваний спрей (Autohaler®), для дозованих аерозолів, зокрема у випадку порошкових інгаляторів, доступний ряд технічних рішень (наприклад, Diskhaler®, Rotadisk®, Turbohaler® або інгалятори, наприклад, як описано в EP-A-0505321). Додатково, сполуки винаходу можуть бути доставлені в багатокамерні пристрої, таким чином, забезпечуючи доставку комбінаційних агентів. Комбінації 9 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 55 Інші сполуки можуть комбінуватися із сполуками, яких стосується винахід, для профілактики і лікування запальних захворювань, особливо респіраторних захворювань. Таким чином, даний винахід також стосується фармацевтичних композицій, що містять терапевтично ефективну кількість сполуки винаходу і один або декілька інших терапевтичних засобів. Придатні терапевтичні засоби для комбінованої терапії сполуками винаходу включають, але не обмежені лише ними: (1) кортикостероїди, такі як флутиказону пропіонат, флутиказону фуроат, мометазону фуроат, беклометазону дипропіонат, циклезонід, будезонід, GSK 685698, GSK 870086, QAE 397, QMF 149, TPI-1020; (2) агоністи 2-адренорецепторів, такі як сальбутамол, альбутерол, тербуталін, фенотерол, і агоністи 2-адренорецепторів пролонгованої дії, такі як салметерол, індакатерол, формотерол (включаючи формотеролу фумарат), арформотерол, кармотерол, GSK 642444, GSK 159797, GSK 159802, GSK 597501, GSK 678007, AZD3199; (3) комбіновані продукти кортикостероїд/2-агоніст пролонгованої дії, такі як салметерол/флутиказону пропіонат (Адваїр/Серетид), формотерол/будезонід (Симбікорт), формотерол/флутиказону пропіонат (Флутиформ), формотерол/циклезонід, формотерол/мометазону фуроат, індакатерол/мометазону фуроат, Індакатерол/QAE 397, GSK 159797/GSK 685698, GSK 159802/GSK 685698, GSK 642444/GSK 685698, GSK 159797/GSK 870086, GSK 159802/GSK 870086, GSK 642444/GSK 870086, арформотерол/циклезонід; (4) антихолінергічні засоби, наприклад антагоністи мускаринового-3 (M3) рецептора, такі як іпратропію бромід, тіотропію бромід, Аклідиній (LAS-34273), NVA-237, GSK 233705, Даротропій, GSK 573719, GSK 961081, QAT 370, QAX 028; (5) M3-антихолінергічні/2-адренорецепторні агоністи з подвійною фармакологічною дією, такі як GSK 961081; (6) модулятори лейкотриєнів, наприклад антагоністи лейкотриєнів, такі як монтелукаст, зафірлукаст або пранлукаст, або інгібітори біосинтезу лейкотриєнів, такі як Зилейтон або BAY-1005, або антагоністи LTB4, такі як Амелубант, або інгібітори FLAP, такі як GSK 2190914, AM-103; (7) інгібітори фосфодіестерази-IV (PDE-IV) (пероральні або інгальовні), такі як рофлуміласт, циломіласт, Оглеміласт, ONO-6126, Тетоміласт, Тофіміласт, UK 500,001, GSK 256066; (8) антигістамінні засоби, наприклад селективні антагоністи рецептора гістаміну-1 (H1), такі як фексофенадин, цитиризин, лоратидин або астемізол, або подвійні антагоністи H1/H3 рецептора, такі як GSK 835726, GSK 1004723; (9) протикашлеві засоби, такі як кодеїн або декстраморфан; (10) муколітичний засіб, наприклад Nацетилцистеїн або фудостеїн; (11) відхаркувальний засіб/мукокінетичний модулятор, наприклад амброксол, гіпертонічні розчини (наприклад, фізіологічний розчин або маніт) або поверхневоактивний засіб; (12) пептидний муколітичний засіб, наприклад рекомбінантна людська дезоксирибонуклеаза I (дорназа-альфа і rhДНаза) або геліцидин; (13) антибіотики, наприклад азитроміцин, тобраміцин і азтреонам; (14) неселективні інгібітори COX-1/COX-2, такі як ібупрофен або кетопрофен; (15) інгібітори COX-2, такі як целекоксиб і рофекоксиб; (16) антагоністи VLA-4, такі, як описані в WO 97/03094 і WO 97/02289; (17) інгібітори TACE і інгібітори TNF-, наприклад моноклональні антитіла анти-TNF, такі як Remicade і CDP-870, і імуноглобулінові молекули рецептора TNF, такі як Enbrel; (18) інгібітори матриксної металопротеази, наприклад MMP-12; (19) інгібітори еластази людських нейтрофілів, такі як ONO-6818 або описані в WO 2005/026124, WO 2003/053930 і WO 06/082412; (20) антагоністи A2b, такі, як описані в WO 2002/42298; (21) модулятори функції хемокінового рецептора, наприклад антагоністи CCR3 і CCR8; (22) сполуки, які модулюють дію інших простаноїдних рецепторів, наприклад антагоніст тромбоксану A2; антагоністи DP1, такі як MK-0524, антагоністи CRTH2, такі як ODC9101 і AZD1981, і змішані антагоністи DP1/CRTH2, такі як AMG 009; (23) агоністи PPAR, що включають агоністи PPAR-альфа (такі як фенофібрат), агоністи PPARдельта, агоністи PPAR-гамма, такі як Піоглітазон, Розиглітазон і Балаглітазон; (24) метилксантини, такі як теофілін або амінофілін, і комбінації метилксантин/кортикостероїд, такі як теофілін/будезонід, теофілін/флутиказону пропіонат, теофілін/циклезонід, теофілін/мометазону фуроат і теофілін/беклометазону дипропіонат; (25) агоністи A2a, такі, як описані в EP 1052264 і EP 1241176; (26) антагоністи CXCR2 або IL-8, такі як SCH 527123 або GSK 656933; (27) модулятори сигнального шляху IL-R, такі як кінерет і ACZ 885; (28) антагоністи MCP-1, такі як ABN-912. Способи синтезу Сполуки винаходу можуть бути одержані за допомогою рутинної адаптації способів, описаних тут в Прикладах. Наприклад, сполуки винаходу можуть бути одержані відповідно до шляхів, ілюстрованих на Схемі 1. 10 UA 104677 C2 Схема 1 Сполуки загальної формули (a) можуть бути одержані із сполук загальної формули (d): 5 10 15 за допомогою реакції із сполукою загальної формули (b): , b 2 де R є таким, як визначено для R в загальній формулі (I), у придатному розчиннику, такому як диметилсульфоксид, 1,4-діоксан або ацетонітрил, в присутності основи, такої як діізопропілетиламін, в інтервалі температур переважно між кімнатною температурою і 100°С. Сполуки загальної формули (b) можуть бути одержані з амінів загальної формули (с) відповідно до відомих літературних методик (наприклад, WO 2006009741, EP 1609789). c Сполуки загальної формули (е), де R являє собою водень, можуть бути одержані із сполук загальної формули (е): , c де R може бути придатною захисною групою, за допомогою видалення захисту, згідно із способами, відомими кваліфікованим фахівцям в даній галузі. Сполуки загальної формули (е) можуть бути одержані із сполук загальної формули (f): за допомогою реакції із сполукою загальної формули (g): 11 UA 104677 C2 5 10 15 20 25 30 35 . Використовуючи трет-бутоксид калію і 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)-піримідинон, у придатному розчиннику, такому як толуол, 1,4-діоксан або ацетонітрил, в інтервалі температур переважно між кімнатною температурою і 100°С. c Сполуки загальної формули (g), де R являє собою водень, можуть бути одержані із сполук загальної формули (h) або (i), як описано в WO 2008/043019, . c Сполуки загальної формули (h), де R являє собою амід, переважно трифторацетамід, можуть бути одержані із сполук загальної формули (j), як описано в WO 2008/043019, використовуючи RuCl[S,S-Tsdpen(п-цимол)]. Буде зрозумілим, що сполуки формули (j) можуть бути гомохіральними, як ілюстровано для (j) вище, або бути протилежними енантіомерами або рацемічними . Фахівці в даній галузі зможуть зрозуміти, що може бути одержана будь-яка комбінація стереоцентрів, як показано в (g), з використанням N-((R)-4-оксо-1,2,3,4-тетрагідронафталін-1іл)-ацетаміду або N-((S)-4-оксо-1,2,3,4-тетрагідронафталін-1-іл)-ацетаміду, використовуючи RuCl[R,R-Tsdpen(п-цимол)] або RuCl[S,S-Tsdpen(п-цимол)]. Сполука (g) зображена без певних стереоцентрів, але будь-яка комбінація може взаємодіяти, як проілюстровано на Схемі 1. Сполуки загальної формули (f) можуть бути одержані із сполук загальної формули (k): з використанням придатного окислювача, такого як хлорамін Т, тетраацетат свинцю або діацетат фенілйоду(III), у придатному розчиннику, такому як дихлорметан або етанол, в інтервалі температур переважно між кімнатною температурою і 100°С. Сполуки загальної формули (k) можуть бути одержані із сполук загальної формули (m): за допомогою реакції з альдегідом загальної формули (l): RaCHO, (l) у придатному розчиннику, такому як етанол або тетрагідрофуран, в інтервалі температур переважно між кімнатною температурою і 80°С. Альтернативно, сполуки формули (f) можуть бути одержані із сполук формули (n): з використанням придатного дегідратуючого засобу, такого як реагент Берджесса, трифенілфосфін і гексахлоретан, оксихлорид фосфору, оцтова кислота або умови Міцунобу (діетилазодикарбоксилат/трифенілфосфін/триметилсилілазид), за відсутності або в присутності придатного розчинника, такого як тетрагідрофуран, толуол або NMP, в інтервалі температур переважно між кімнатною температурою і 120°С. Сполуки формули (n) можуть бути одержані із сполук формули (m): 12 UA 104677 C2 5 10 15 20 25 30 35 40 45 50 за допомогою реакції із сполукою загальної формули (о): a R CО2H, (o) з використанням придатного ацилюючого/дегідратуючого агента, такого як трифенілфосфін/трихлорацетонітрил, в присутності основи, такої як діізопропілетиламін, у придатному розчиннику, такому як дихлорметан або ацетонітрил, в інтервалі температур переважно між кімнатною температурою і 150°С. Загальні експериментальні подробиці Скорочення, застосовувані в експериментальному розділі: водн. = водний; ДХМ = дихлорметан; DIPEA = діізопропілетиламін; ДМФА = N,N-диметилформамід; ДМСО = диметилсульфоксид; EDC = 1-етил-3-(3'-диметиламінопропіл)карбодіімід; EtOAc = етилацетат; EtOH = етанол; Et2О = діетиловий ефір; ФКХ = флеш-колонкова хроматографія; год. = година; HATU = гексафторфосфат 2-(7-аза-1H-бензотриазол-1-іл)-1,1,3,3-тетраметилуронію; HOBt = 1гідроксибензотриазол; ВЕРХ = високоефективна рідинна хроматографія; РХМС = рідинна хроматографія-мас-спектрометрія; MeCN = ацетонітрил; MeOH = метанол; хв. = хвилини; ЯМР = ядерний магнітний резонанс; КТ = кімнатна температура; Rt = час утримування; нас. = насичений; SCX-2 = сильна катіонообмінна хроматографія; TFA = трифтороцтова кислота; ТГФ = тетрагідрофуран; H2О = вода; IMS = промисловий метилований спирт; Et3N = триетиламін; EtNiPr2 = діізопропілетиламін. Номенклатуру структурам надавали, використовуючи програмне забезпечення Autonom 2000 Name від MDL Inc. Стереохімічні представлення сполук основані на порівняннях з даними, наведеними в WO 2008/043019 для ключових проміжних сполук. Всі реакції здійснювали в атмосфері азоту, якщо не встановлено інакше. Спектри ЯМР одержували на спектрометрі Varian Unity Inova 400 з потрійним резонансним зондом зворотного детектування з розміром 5 мм, працюючим при 400 МГц, або на спектрометрі Bruker Avance DRX 400 з потрійним резонансним зондом TXI зворотного детектування з розміром 5 мм, працюючим при 400 МГц, або на спектрометрі Bruker Avance DPX 300 із стандартним зондом подвійної частоти з розміром 5 мм, працюючим при 300 мГц. Зсуви наведені в м.ч. відносно тетраметилсилану. Віднесення спектрів ЯМР проводили, використовуючи програмне забезпечення DataChord Spectrum Analyst Version 4.0.b21. Там, де продукти очищали за допомогою флеш-колонкової хроматографії, 'флеш оксид кремнію' стосується силікагелю для хроматографії, від 0,035 до 0,070 мм (від 220 до 440 меш) (наприклад, Fluka силікагель 60), і застосовуваного тиску азоту до 10 psi для прискореного елюювання з колонки або застосування системи очищення CombiFlash® Companion або застосування системи очищення Biotage SP1. Всі розчинники і промислові реагенти використовували в тому вигляді, як їх одержували. Сполуки, очищені за допомогою препаративної ВЕРХ, очищали, використовуючи C18оберненофазову колонку (100 × 22,5 мм вн. діам. колонка Genesis з розміром частинок 7 мкм), або колонку Phenyl-Hexyl (250 × 21,2 мм вн. діам. колонка Gemini з розміром частинок 5 мкм), УФ-детектування при 230 або 254 нм, швидкість потоку 5-20 мл/хв.), елюювання з градієнтами від 100-0 до 0-100% вода/ацетонітрил (що містять 0,1% TFA або 0,1% мурашиної кислоти) або вода/MeOH (що містять 0,1% TFA або 0,1% мурашиної кислоти). Фракції, що містять необхідний продукт (ідентифікований за допомогою аналізу РХМС), відбирали, органічну фракцію видаляли упарюванням, і водну фракцію, що залишилася, ліофілізували, з одержанням кінцевого продукту. Продукти, очищені за допомогою препаративної ВЕРХ, виділяли у вигляді форміатних або трифторацетатних солей, якщо не зазначено інакше. Застосовувані системи рідинної хроматографії-мас-спектроскопії (РХМС) і ВЕРХ являють собою: Спосіб 1 Waters Platform РХ-квадрупольний мас-спектрометр з C18-оберненофазовою колонкою (30 × 4,6 мм Phenomenex Luna розмір частинок 3 мкм). Градієнтне елюювання з А: вода + 0,1% мурашиної кислоти; В: метанол + 0,1% мурашиної кислоти: Градієнт - Час 0,00 0,50 4,50 5,50 6,00 швидкість потоку мл/хв. 2,0 2,0 2,0 2,0 2,0 13 %А 95 95 5 5 95 %В 5 5 95 95 5 UA 104677 C2 5 Детектування - МС, ELS, УФ (200 мкл спліт в МС з проточним детектором HP1100 DAD). МСспосіб іонізації - електророзпилення (позитивні і негативні іони). Спосіб 2 Waters ZMD квадрупольний мас-спектрометр з C18-оберненофазовою колонкою (30 × 4,6 мм Phenomenex Luna розмір частинок 3 мкм). Градієнтне елюювання з А: вода + 0,1% мурашиної кислоти; В: метанол + 0,1% мурашиної кислоти: Градієнт - Час 0,00 0,50 4,50 5,50 6,00 10 швидкість потоку мл/хв. 2,0 2,0 2,0 2,0 2,0 %А 95 95 5 5 95 %В 5 5 95 95 5 Детектування - МС, ELS, УФ (200 мкл спліт в МС з проточним детектором Waters 996 DAD). МС-спосіб іонізації - електророзпилення (позитивні і негативні іони). Спосіб 3 Waters ZMD квадрупольний мас-спектрометр з C18-оберненофазовою колонкою (30 × 4,6 мм Phenomenex Luna розмір частинок 3 мкм). Градієнтне елюювання з А: вода + 0,1% мурашиної кислоти; В: ацетонітрил + 0,1% мурашиної кислоти: 15 Градієнт - Час 0,00 0,50 4,50 5,50 6,00 20 30 %А 95 95 5 5 95 %В 5 5 95 95 5 Детектування - MS, ELS, УФ (200 мкл спліт в МС з проточним детектором HP1100 DAD). МСспосіб іонізації - електророзпилення (позитивні і негативні іони). Спосіб 4 Waters ZMD квадрупольний мас-спектрометр з Higgins Clipeus 5 мікрон C18 100 × 3,0 мм, встановлений при 40°С. Градієнтне елюювання з А: вода + 0,1% мурашиної кислоти; В: MeOH + 0,1% мурашиної кислоти: Градієнт - Час 0,00 1,00 13,00 20,00 22,00 25 швидкість потоку мл/хв. 2,0 2,0 2,0 2,0 2,0 швидкість потоку мл/хв. 1,0 1,0 1,0 1,0 1,0 %А 85 85 5 5 85 %В 15 15 85 85 15 Детектування - МС, УФ PDA. МС-спосіб іонізації - електророзпилення (позитивні і негативні іони). Спосіб 5 Waters ZMD квадрупольний мас-спектрометр з Acquity BEH C18 1,7 мкм 100 × 2,1 мм, Acquity BEH Shield RP18 1,7 мкм 100 × 2,1 мм або Acquity HSST3 1,8 мкм 100 × 2,1 мм, встановленими при 40°С. Градієнтне елюювання з А: вода + 0,1% мурашиної кислоти; В: CH 3CN + 0,1% мурашиної кислоти: Градієнт - Час 0,00 0,40 6,00 6,80 7,00 8,00 швидкість потоку мл/хв. 0,4 0,4 0,4 0,4 0,4 0,4 14 %А 95 95 5 5 95 95 %В 5 5 95 95 5 5 UA 104677 C2 5 10 Детектування - МС, УФ PDA. МС-спосіб іонізації - електророзпилення (позитивні і негативні іони). Спосіб 6 Phenomenex Gemini C18-оберненофазова колонка (250 × 21,20 мм з розміром частинок 5 мкм). Градієнтне елюювання з А: вода + 0,1% мурашиної кислоти; В: CH 3CN + 0,1% мурашиної кислоти - 10% А/90% В до 98% А/2% В протягом 20 хв - швидкість потоку 18 мл/хв. Детектування - проточний УФ-детектор, встановлений при довжині хвилі 254 нм. Приклад 1 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-цис-1,2,3,4-тетрагідронафталін-1-іл]-сечовина а) (+/-) цис-4-азидо-1,2,3,4-тетрагідронафталін-1-ол 15 20 25 30 35 40 Розчин 1-тетралону (2,92 г, 20 ммоль), N-бромсукциніміду (3,56 г, 20 ммоль) і азодибутиронітрилу (80 мг) в тетрахлориді вуглецю (80 мл) кип'ятили із зворотним холодильником протягом 1,25 год., потім упарювали у вакуумі. Одержане в результаті масло розчиняли в ДМФА (8 мл), обробляли азидом натрію (2,6 г, 40 ммоль) і перемішували при КТ протягом 2 год. Реакційну суміш розподіляли між Et2О (200 мл) і H2О (50 мл). Одержаний в результаті органічний шар сушили (MgSO4), відфільтровували і упарювали у вакуумі. Одержане в результаті масло розчиняли в EtOH (100 мл), охолоджували до 0°С під аргоном і обробляли боргідридом натрію (0,76 г, 20 ммоль). Реакційну суміш перемішували при КТ протягом 1 год., концентрували у вакуумі до приблизно 50 мл і розподіляли між H2О і Et2О. Водний шар екстрагували ДХМ (100 мл) і EtOAc (100 мл) і об'єднані органічні шари сушили (MgSO 4), відфільтровували, концентрували у вакуумі і очищали за допомогою ФКХ, з використанням 030% циклогексан/діетиловий ефір з одержанням сполуки заголовка при Rf 0,2 у вигляді темно1 червоного масла (1,5 г, 40%). H-ЯМР (300 МГц, CDCl3): 7,57-7,52 (1H, м), 7,43-7,28 (3H, м), 4,814,72 (1H, м), 4,55-4,49 (1H, м), 2,13-1,99 (3H, м), 1,79 (1H, м). b) (+/-) цис-4-аміно-1,2,3,4-тетрагідронафталін-1-ол Розчин сполуки стадії а) Прикладу 1 (1,086 г, 5,7 ммоль) і трифенілфосфіну (1,81 г, 6,84 ммоль) в ТГФ (20 мл) і H2О (4 мл) перемішували при КТ в атмосфері азоту протягом 6,5 год. Реакційну суміш розбавляли Et2О і екстрагували 0,4M розчином HCl. Водний шар підлуговували 10N розчином гідроксиду натрію і екстрагували ДХМ. Об'єднані органічні шари сушили (MgSO 4), відфільтровували, концентрували у вакуумі і очищали за допомогою ФКХ з використанням 020% ДХМ/2M NH3 в MeOH з одержанням сполуки заголовка (0,55 г, 59%). РХМС (спосіб 1): Rt + 0,41, 1,50 хв., m/z 164 [MH ]. c) N’-(5-фторпіридин-2-іл)-гідразид ізомасляної кислоти Розчин 5-фтор-2-гідразинілпіридин (0,59 г, 4,65 ммоль), ізомасляної кислоти (528 мг, 6 ммоль) і гідрату HOBt (153 мг, 1 ммоль) в ДХМ (10 мл) обробляли EDC (1,15 г, 6 ммоль). Реакційну суміш перемішували при КТ протягом 40 хв., виливали в насичений водний розчин бікарбонату натрію (40 мл), екстрагували чотирма частинами ДХМ, сушили (Na 2SО4), упарювали і очищали за допомогою ФКХ з використанням 10-30% EtOAc/ДХМ з одержанням + сполуки заголовка (0,42 г, 46%). РХМС (спосіб 2): Rt 2,46 хв., m/z 198 [MH ]. 15 UA 104677 C2 d) 6-фтор-3-ізопропіл-[1,2,4]триазоло[4,3-a]піридин 5 10 15 20 25 30 35 40 Розчин сполуки стадії с) Прикладу 1 (0,41 г, 2,08 ммоль), трифенілфосфіну (763 мг, 2,91 ммоль) і триетиламіну (0,87 мл, 6,24 ммоль) в ТГФ (5 мл) при 0°С обробляли 1,2гексахлоретаном (690 мг, 2,91 ммоль). Реакційну суміш перемішували при 0°С протягом 40 хв., потім при КТ протягом 20 хв., гасили водою, екстрагували двічі EtOAc, сушили (Na2SO4), упарювали і очищали двічі за допомогою ФКХ (циклогексан/EtOAc 1/0 до 1/1) з одержанням сполуки заголовка (274 мг, забрудненої 20% PPh3O, 58%) у вигляді білої твердої речовини. + РХМС (спосіб 1): Rt 2,58 хв., m/z 180 [MH ]. e) (+/-) 4-(3-ізопропіл-[1,2,4]триазоло[4,3-a]піридин-6-ілокси)-цис-1,2,3,4-тетрагідронафталін1-іламін Розчин сполуки стадії b) Прикладу 1 (367 мг, 2,05 ммоль) і трет-бутоксиду калію (255 мг, 2,25 ммоль) в толуолі (1 мл) і 1,3-диметил-3,4,5,6-тетрагідро-2(1H)-піримідиноні (0,5 мл) додавали до сполуки стадії d) Прикладу 1 (334 мг, 2,05 моль). Реакційну суміш перемішували, в той час як температура зростала від 50°С до 80°С протягом 20 хв. Реакційну суміш охолоджували, гасили водою і екстрагували 10% лимонною кислотою. Водну фазу промивали CH2Cl2, підлуговували KOH до pH=10 і екстрагували CH2Cl2, Об'єднані органічні шари сушили (MgSO 4), концентрували і очищали за допомогою ФКХ (0-9% MeOH/NH3-CH2Cl2) з одержанням сполуки заголовка у вигляді коричневої камеді, яка отверджувалася при стоянні (400 мг, 60%). РХМС (спосіб 3): Rt + 1 2,45 хв., m/z 323 [MН ]. H-ЯМР (400 МГц, CDCl3): 1,43-1,55 (6H, м), 1,85-2,15 (3H, м), 2,30-2,45 (1H, м), 3,27 (1H, кв., J=6,85), 3,97-4,04 (1H, м), 5,24 (1H, т, J=4,7), 5,29 (1H, с), 7,07-7,14 (1H, м), 7,22-7,50 (5H, м), 7,56-7,62 (1H, м), 7,65-7,71 (1H, м). f) (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-цис-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Розчин сполуки стадії е) Прикладу 1 (87 мг, 0,27 ммоль) в діоксані (2 мл) з EtNiPr2 (49 мкл, 0,3 ммоль) і 2,2,2-трихлоретил-3-трет-бутил-1-п-толіл-1H-піразол-5-ілкарбаматом (109 мг, 0,27 ммоль) нагрівали при 70°С протягом 20 год. Реакційній суміші давали охолодитися, розподіляли між H2O-EtOAc, органічну фазу сушили (Na2SO4) і концентрували у вакуумі. Залишок очищали за допомогою ФКХ (0-6% 9:1 MeOH/0,88 NH3-CH2Cl2) і суспендували в MeOH з одержанням сполуки заголовка у вигляді безбарвної твердої речовини (57 мг). РХМС (спосіб 4): Rt 12,03 хв., + 1 m/z 578 [MH ]. H-ЯМР (400 МГц, CDCl3): 7,59 (1H, д, J=9,8), 7,42 (1H, д, J=1,9), 7,39 (2H, д, J=8,2), 7,32-7,24 (4H, м), 7,20 (2H, д, J=8,1), 7,03 (1H, дд, J=9,8, 1,9), 6,52 (1H, шир.с), 6,28 (1H, с), 5,47 (1H, д, J=8,7), 5,19 (1H, т, J=3,9), 5,09 (1H, тд, J=8,9, 5,2), 3,29-3,18 (1H, м), 2,35 (3H, с), 2,25 (1H, м), 2,13-2,03 (2H, м), 1,93 (1H, м), 1,47 (3H, д, J=6,9), 1,44 (3H, д, J=6,9), 1,32 (9H, с). Приклад 2 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[4-(3-ізопропіл[1,2,4]-триазоло[4,3a]піридин-6-ілокси)-транс-1,2,3,4-тетрагідронафталін-1-іл]-сечовина a) (+/-) транс-4-азидо-1,2,3,4-тетрагідронафталін-1-ол 16 UA 104677 C2 5 10 15 20 Сполуку заголовка одержували із сполуки стадії а) Прикладу 1 за допомогою ФКХ (циклогексан/діетиловий ефір 100/0 до 70/30) при Rf 0,1 у вигляді темно-червоного масла (0,4 г). 1 H-ЯМР (300 МГц, CDCl3): 7,57-7,52 (1H, м), 7,43-7,28 (3H, м), 4,81-4,72 (1H, м), 4,55-4,49 (1H, м), 2,13-1,99 (3H, м), 1,79 (1H, м). b) (+/-) транс-4-аміно-1,2,3,4-тетрагідронафталін-1-ол Розчин сполуки стадії b) Прикладу 2 (0,3 г, 1,59 ммоль) і трифенілфосфіну (0,5 г, 1,9 ммоль) в ТГФ (10 мл) і H2O (4 мл) перемішували при КТ в атмосфері азоту протягом 6,5 год. Реакційну суміш розбавляли Et2O і екстрагували 0,5M розчину HCl. Водний шар підлуговували розчином K2CO3 і екстрагували ДХМ. Об'єднані органічні шари сушили (MgSО 4), відфільтровували, концентрували у вакуумі і очищали за допомогою ФКХ (ДХМ/MeOH, що містить NH 3 9/1) з + одержанням сполуки заголовка (1,13 мг). РХМС (спосіб 1): Rt 0,41, 1,50 хв., m/z 164 [MH ]. с) (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[4-(3-ізопропіл[1,2,4]триазоло[4,3a]піридин-6-ілокси)-транс-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Сполука заголовка була одержана аналогічно стадіям е) і f) Прикладу 1, виходячи з продукту + 1 стадії b) Прикладу 2. РХМС (спосіб 4): Rt 12,01 хв., m/z 578 [MH ]. H-ЯМР (400 МГц, CDCl3): 7,59 (1H, д, J=9,2), 7,43 (1H, д, J=1,5), 7,35 (2H, д, J=8,1), 7,32-7,25 (4H, м), 7,19 (2H, д, J=8,4), 7,09 (1H, дд, J=9,8, 1,8), 6,49 (1H, шир.с), 6,25 (1H, с), 5,38 (1H, д, J=8,3), 5,23 (1H, т, J=5,0), 5,16 (1H, кв., J=6,3), 3,23 (1H, м), 2,40-2,30 (4H, м), 2,19-2,06 (2H, м), 1,85-1,75 (1H, м), 1,46 (3H, д, J=6,9), 1,43 (3H, д, J=6,9), 1,31 (9H, с). Сполуки наступних прикладів були одержані аналогічно Прикладу 1. Приклад № 3 4 ЯМР (400 МГц) Структура (CDCl3): 1,31 (9H, с), 1,80-1,93 (1H, м), 1,94-2,09 (2H, м), 2,172,28 (1H, м), 2,36 (3H, с), 4,995,09 (1H, м), 5,10-5,18 (2H, м), 6,18 (1H, с), 6,24 (1H, с), 7,11 (1H, дд, J=2,0, 8,0), 7,17-7,31 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)(6H, м), 7,34-7,40 (3H, м), 7,443-{4-[3-(2-хлорфеніл)-[1,2,4]триазоло[4,37,61 (3H, м), 7,67 (1H, дд, 1,6, а]піридин-6-ілокси]-цис-1,2,3,47,6), 7,72-7,76 (1H, м) тетрагідронафталін-1-іл}-сечовина (d6-DMSO): 1,26 (9Н, с), 1,752,10 (4Н, м), 2,35 (3Н, с), 4,734,81 (1Н, м), 5,48-5,53 (1Н, м), 6,31 (1Н, м), 7,05 (1Н, д, J=8,0), 7,19-7,38 (9Н, м), 7,67-7,78 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)- (3Н, м), 7,89 (1Н, д, J=12,0), 3-{4-[3-(2,6-дихлорфеніл)-[1,2,4]триазоло-[4,3- 7,96 (1Н, с), 8,03 (1Н, с) а]піридин-6-ілокси]-цис-1,2,3,4тетрагідронафталін-1-іл}-сечовина 17 РХМС (Спосіб 5) Rt 5,22 хв. m/z 646 + [MH ] (Спосіб 5) Rt 5,30 хв. m/z 680 + [MH ] UA 104677 C2 Приклад № ЯМР (400 МГц) Структура 5 (+/-) 1-{4-[3-(2-бензилоксифеніл)[1,2,4]триазоло[4,3-а]піридин-6-ілокси]цис-1,2,3,4-тетрагідронафталін-1-іл}-3-(5-третбутил-2-п-толіл-2H-піразол-3-іл)-сечовина 6 (+/-) 1-(5-трет-бутил)-ізоксазол-3-іл)-(3-[4-(3ізопропіл-[1,2,4]триазоло[4,3-а]піридин-6ілокси]-цис-1,2,3,4-тетрагідро-нафталін-1-іл]сечовина РХМС (d4-MeOH): 1,32 (9Н, с), 1,661,98 (4Н, м), 2,40 (3Н, с), 4,734,84 (1Н, м), 5,13 (1Н, т, J=4,7), 5,19 (2Н, с), 6,35 (1Н, с), 7,047,40 (18Н, м), 7,60-7,68 (3Н, м), 7,73 (1Н, д, J=9,5) (Спосіб 4) Rt 12,5 хв. m/z 717 + [MH ] (d6-DMSO): 1,28 (9Н, с), 1,38 (6Н, т, J=7,2), 1,85-2,22 (4Н, м), 3,57 (кв., 1Н, J=6,6), 4,87-4,95 (1Н, м), 5,55 (1Н, т, J=4,17), 6,40 (1Н, с), 7,02 (1Н, д, J=9,0), 7,22 (1Н, дд, J=10, 2,4), 7,277,45 (4Н, м), 7,69 (1Н, д, J=10,0), 8,21-8,24 (1Н, м), 9,32 (1Н, с) (Спосіб 5) Rt 4,35 хв. m/z 488 + [MH ] Приклад 7 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-{4-[3-(2-гідроксифеніл)-[1,2,4]триазоло[4,3a]піридин-6-ілокси]-цис-1,2,3,4-тетрагідронафталін-1-іл}-сечовина 5 10 15 20 25 Розчин сполуки Прикладу 5 (50 мг, 69,6 ммоль) в IMS (5 мл) перемішували з гідроксидом паладію (20 мг) в атмосфері водню протягом 24 год. Реакційну суміш відфільтровували через Hyflo, концентрували у вакуумі і очищали з використанням препаративної ВЕРХ за способом 6. Фракції, що містять продукт, ліофілізували з одержанням сполуки заголовка у вигляді брудно+ 1 білої твердої речовини. РХМС (Спосіб 5): Rt 4,87 хв., m/z 627 [MH ]. H-ЯМР (400 МГц, d4MeOH): 1,31 (9H, с), 1,86-2,33 (4H, м), 2,39 (3H, с), 4,85-4,91 (1H, м), 5,33 (1H, т, J=4,1), 6,34 (1H, с), 7,02-7,08 (2H, м), 7,19-7,36 (12H, м), 7,42-7,48 (1H, м), 7,58 (1H, дд, J=2,7, 8,3), 7,69-7,75 (2H, м). Приклад 8 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1R,4R)-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Сполуку заголовка одержували з використанням (1R,4R)-4-аміно-1,2,3,4-тетрагідронафталін1-олу (WO 2008/043019) аналогічно стадіям е) і f) Прикладу 1. РХМС (Спосіб 5): Rt 4,71 хв., m/z + 1 578 [MH ]. H-ЯМР (400 МГц, d6-DMSO): 1,26 (9H, с), 1,35-1,41 (6H, м), 1,69-1,80 (1H, м), 1,972,07 (1H, м), 2,08-2,19 (2H, м), 2,35 (3H, с), 3,56 (1H, кв., J=6,95), 4,86-4,93 (1H, м), 5,53-5,59 (1H, м), 6,32 (1H, с), 7,01 (1H, д, J=8,34), 7,20-7,43 (9H, м), 7,68 (1H, д, J=10,4), 7,96 (1H, с), 8,19-8,22 (1H, м). Приклад 9 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1R,4S)-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина 18 UA 104677 C2 a) 2,2,2-трифтор-N-((1R,4S)-4-гідрокси-1,2,3,4-тетрагідронафталін-1-іл)-ацетамід 5 10 15 20 25 30 Сполуку заголовка одержували, як описано для 2,2,2-трифтор-N-((1R,4R)-4-гідрокси-1,2,3,4тетрагідронафталін-1-іл)ацетаміду в WO 2008/043019, використовуючи RuCl[(S,S)1 Tsdpen(цимол)]. H-ЯМР (400 МГц, d6-DMSO): 1,61-1,82 (2H, м), 2,04-2,16 (2H, м), 4,56-4,64 (1H, м), 5,03-5,13 (1H, м), 5,28 (1H, д, J=7,5), 7,06 (1H, д, J=7,5), 7,21-7,32 (2H, м), 7,49 (1H, д, J=7,5), 9,79 (1H, д, J=8,5). b) (1S,4R)-4-аміно-1,2,3,4-тетрагідронафталін-1-ол Сполуку заголовка одержували, використовуючи сполуку стадії а) Прикладу 9, як описано в 1 WO 2008/043019. H-ЯМР (400 МГц, d6-DMSO): 1,80-1,93 (4H, м), 3,98-4,02 (1H, м), 4,50-4,55 (1H, м), 7,21-7,28 (2H, м), 7,39-7,47 (2H, м). c) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1R,4S)-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Сполуку заголовка одержували, використовуючи (1S,4R)-4-аміно-1,2,3,4тетрагідронафталін-1-ол (Приклад 9, стадія b)), аналогічно Прикладу 1, стадіям е) і f). РХМС + 1 (Спосіб 5): Rt 4,84 хв., m/z 578 [MН ]. H-ЯМР (400 МГц, d6-DMSO): 1,27 (9H, с), 1,35-1,40 (6H, м), 1,80-1,98 (2H, м), 2,02-2,13 (2H, м), 2,36 (3H, с), 3,56 (1H, кв., J=7,2), 4,78-4,86 (1H, м), 5,53 (1H, т, J=5,2), 5,75 (1H, с), 6,32 (1H, с), 7,09 (1H, д, J=8,3), 7,16 (1H, дд, J=9,7, 2,0), 7,25-7,41 (7H, м), 7,68 (1H, д, J=9,7), 8,03 (1H, с), 8,19-8,22 (1H, м). Приклад 10 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1S,4R)-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Сполуку заголовка одержували, використовуючи (1R,4S)-4-аміно-1,2,3,4тетрагідронафталін-1-ол, аналогічно Прикладу 1, стадіям е) і f). РХМС (Спосіб 5): Rt 4,85 хв., + 1 m/z 578 [MH ]. H-ЯМР (400 МГц, CDCl3): 1,32 (9H, с), 1,42-1,49 (6H, м), 1,86-1,98 (1H, м), 2,012,13 (2H, м), 2,21-2,30 (1H, м), 3,35 (3H, с), 3,24 (1H, кв., J=6,8), 5,04-5,13 (1H, м), 5,17-5,21 (1H, м), 5,45 (1H, д, J=8,6), 6,27 (1H, с), 6,53 (1H, с), 7,04 (1H, дд, J=9,7, 2,1), 7,20 (1H, д, J=8,0), 7,237,44 (8H, м), 7,59 (1H, д, J=9,9). Приклад 11 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1S,4S)-4-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина 19 UA 104677 C2 5 10 15 20 25 30 Сполуку заголовка одержували, використовуючи (1S,4S)-4-аміно-1,2,3,4-тетрагідронафталін+ 1 1-ол, аналогічно Прикладу 1, стадіям е) і f). РХМС (Спосіб 5): Rt 4,74 хв., m/z 578 [MH ]. H-ЯМР (400 МГц, CDCl3): 1,30 (9H, с), 1,40-1,48 (6H, м), 1,70-1,87 (4H, м), 2,07-2,19 (2H, м), 2,33 (3H, с), 3,23 (1H, кв., J=5,2), 5,11-5,19 (1H, м), 5,20-5,27 (1H, м), 5,46 (1H, д, J=7,8), 6,25 (1H, с), 6,58 (1H, с), 7,10 (1H, д, J=9,5), 7,17 (1H, д, J=8,2), 7,23-7,37 (4H, м), 7,44 (1H, с), 7,58 (1H, д, J=9,5). Приклад 12 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1R,3R)-3-(3ізопропіл[1,2,4]триазоло[4,3a]піридин-6-ілоксі)-індан-1-іл]-сечовина (R)-3-аміноіндан-1-он (EP 1316542A1) одержували з (R)-(N-ацетил)--аланіну, як описано в EP 1316542A1, Bioorg. Med. Chem. Lett, 2008, 18, 4224-4227; і Chem. Lett., 2002, (3), 266. (1R,3R)-3-аміноіндан-1-ол одержували з (R)-3-аміноіндан-1-ону, використовуючи методики, описані в WO 2008/043019. Сполуку заголовка одержували, використовуючи (1R,3R)-3аміноіндан-1-ол, аналогічно Прикладу 1, стадіям е) і f). РХМС (Спосіб 5): Rt 4,61 хв., m/z 564 + 1 [MН ]. H-ЯМР (400 МГц, CDCl3): 1,31 (9H, с), 1,42-1,48 (6H, м), 2,14-2,25 (1H, м), 2,34 (3H, с), 2,82 (1H, дд, J=3,2, 15,3), 3,23 (1H, кв., J=6,4) 5,56-5,71 (3H, м), 6,27 (1H, с), 6,62 (1H, с), 7,05 (1H, д, J=9,7), 7,15-7,22 (2H, м), 7,23-7,45 (7H, м), 7,56 (1H, д, 10,5). Приклад 13 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1S,3S)-3-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілоксі)-індан-1-іл]-сечовина Сполуку заголовка одержували, використовуючи (1S,3S)-3-аміноіндан-1-ол, аналогічно + 1 Прикладу 12. РХМС (Спосіб 5): Rt 4,61 хв., m/z 564 [MН ]. H-ЯМР (400 МГц, CDCl3): 1,31 (9H, с), 1,42-1,48 (6H, м), 2,14-2,25 (1H, м), 2,34 (3H, с), 2,82 (1H, дд, J=3,2, 15,3), 3,23 (1H, кв., J=6,4) 5,56-5,71 (3H, м), 6,27 (1H, с), 6,62 (1H, с), 7,05 (1H, д, J=9,7), 7,15-7,22 (2H, м), 7,23-7,45 (7H, м), 7,56 (1H, д, 10,5). Приклад 14 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1R,3S)-3-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілоксі)-індан-1-іл]-сечовина 20 UA 104677 C2 5 10 15 20 25 30 Сполуку заголовка одержували, використовуючи (1S,3R)-3-аміноіндан-1-ол, аналогічно + 1 Прикладу 12. РХМС (Спосіб 5): Rt 4,68 хв., m/z 564 [MH ]. H-ЯМР (400 МГц, CDCl3): 1,29 (9H, с), 1,36-1,45 (6H, м), 1,92-2,00 (1H, м), 2,26 (3H, с), 3,03-3,14 (1H, м), 3,24 (1H, кв., J=6,8), 5,33-5,45 (1H, м), 5,49-5,46 (1H, м), 5,94-6,01 (1H, м), 6,25 (1H, с), 6,90 (1H, шир. с), 6,96-7,01 (1H, м), 7,09 (2H, д, J=7,8), 7,25-7,42 (7H, м), 7,51 (1H, д, J=9,3). Приклад 15 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1S,3R)-3-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілоксі)-індан-1-іл]-сечовина Сполуку заголовка одержували, використовуючи (1R,3S)-3-аміноіндан-1-ол, аналогічно + 1 Прикладу 12. РХМС (Спосіб 5): Rt 4,68 хв., m/z 564 [MH ]. H-ЯМР (400 МГц, CDCl3): 1,29 (9H, с), 1,36-1,45 (6H, м), 1,92-2,00 (1H, м), 2,26 (3H, с), 3,03-3,14 (1H, м), 3,24 (1H, кв., J=6,8), 5,33-5,45 (1H, м), 5,49-5,46 (1H, м), 5,94-6,01 (1H, м), 6,25 (1H, с), 6,90 (1H, шир. с), 6,96-7,01 (1H, м), 7,09 (2H, д, J=7,8), 7,25-7,42 (7H, м), 7,51 (1H, д, J=9,3). Приклад 16 1-(5-трет-бутилізоксазол-3-іл)-3-[(1S,4S)-4-(3-ізопропіл-[1,2,4]триазоло[4,3-а]піридин-6ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Сполука заголовка була одержана аналогічно Прикладу 1, стадіям е) і f), виходячи з продукту стадії b) Прикладу 2 і 2,2,2-трихлоретилового складного ефіру (5-трет-бутилізоксазол+ 1 3-іл)-карбамінової кислоти (WO 2006091671). РХМС (Спосіб 5): Rt 4,36 хв., m/z 489 [MH ]. HЯМР (400 МГц, d4-MeOH): 1,27 (9H, с), 1,39 (6H, т, J=6,65), 1,81-1,82 (1H, м), 2,06 (1H, м), 2,19 (2H, м), 3,53-3,62 (1H, м), 4,99 (1H, с), 5,63 (1H, с), 6,38 (1H, с), 6,96 (1H, д, J=8,22), 7,23 (1H, дд, J=9,86 і 2,09), 7,34-7,35 (3H, м), 7,43 (1H, д, J=7,45), 7,69 (1H, дд, J=9,85 і 0,79), 8,24 (1H, д, J=2,02), 9,24 (1H, с). Приклад 17 N-(5-трет-бутил-3-{3-[(1S,4S)-4-(3-ізопропіл-[1,2,4]триазоло[4,3-a]піридин-6-ілокси)-1,2,3,4тетрагідронафталін-1-іл]-уреїдо}-2-метоксифеніл)-метансульфонамід Сполука заголовка була одержана аналогічно Прикладу 1, стадіям е) і f), виходячи з продукту стадії b) Прикладу 2 і 2,2,2-трихлоретилового складного ефіру (5-трет-бутил-3метансульфоніламіно-2-метоксифеніл)-карбамінової кислоти. РХМС (Спосіб 5): Rt 4,31 хв., m/z 21 UA 104677 C2 + 5 1 621 [MH ]. H-ЯМР (400 МГц, d4-MeOH): 1,31 (9H, с), 1,47 (6H, дд, J=12,55 і 6,88), 1,92-1,93 (1H, м), 2,29-2,31 (3H, м), 3,03 (3H, с), 3,50-3,59 (1H, м), 3,75 (3H, с), 5,12 (1H, м), 5,58 (1H, м), 7,16 (1H, д, J=2,30), 7,33-7,34 (4H, м), 7,45 (1H, д, J=7,68), 7,66 (1H, дд, J=9,90 і 0,81), 8,00 (1H, д, J=2,31), 8,05 (1H, д, J=1,98). Приклад 18 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[9-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-цис-6,7,8,9-тетрагідро-5H-бензоциклогептен-5-іл]-сечовина а) (+/-) цис-9-аміно-6,7,8,9-тетрагідро-5H-бензоциклогептен-5-ол 10 15 20 25 Сполука заголовка була одержана аналогічно Прикладу 1, стадіям а) і b), використовуючи 9азидо-6,7,8,9-тетрагідробензоциклогептен-5-он. Діастереоізомери розділяли за допомогою ФКХ, і регіоізомери ідентифікували після аналізу NOE(SY). РХМС (Спосіб 3): Rt 1,44 хв., m/z 178 + 1 [MH ]. H-ЯМР (400 МГц, CDCl3): 1,69-1,70 (3H, м), 2,06-2,07 (1H, м), 2,18-2,19 (1H, м), 2,49-2,51 (1H, м), 4,26 (1H, дд, J=5,97 і 1,56), 4,68 (1H, д, J=6,36), 7,15-7,22 (3H, м), 7,29 (1H, д, J=7,19). b) (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[9-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-цис-6,7,8,9-тетрагідро-5H-бензоциклогептен-5-іл]-сечовина Сполука заголовка була одержана аналогічно Прикладу 1, стадіям е) і f), виходячи з + 1 продукту стадії а) Прикладу 18. РХМС (Спосіб 5): Rt 4,84 хв., m/z 592 [MH ]. H-ЯМР (400 МГц, d6-DMSO): 1,24 (12H, м), 1,34 (3H, д, J=6,82), 1,4-2,2 (6H, м), 2,36 (3H, с), 3,43 (1H, м), 5,03-5,08 (1H, м), 5,71 (1H, м), 6,26 (1H, с), 7,11 (1H, м), 7,21-7,39 (8H, м), 7,44-7,48 (1H, м), 7,67 (1H, д, J=9,83), 7,91 (1H, с), 8,34 (1H, шир. с). Приклад 19 (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[9-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-транс-6,7,8,9-тетрагідро-5H-бензоциклогептен-5-іл]-сечовина a) (+/-) транс-9-аміно-6,7,8,9-тетрагідро-5H-бензоциклогептен-5-ол 30 35 40 Сполука заголовка була одержана аналогічно Прикладу 1, стадіям а) і b), використовуючи 9азидо-6,7,8,9-тетрагідробензоциклогептен-5-он. Діастереоізомери розділяли за допомогою ФКХ, і регіоізомери ідентифікували після аналізу NOE(SY). РХМС (Спосіб 3): Rt 0,81 хв., m/z 178 + 1 [MH ]. H-ЯМР (400 МГц, CDCl3): 1,57-2,14 (6H, м), 4,51 (1H, м), 5,12 (1H, м), 7,21-7,22 (2H, м), 7,36 (2H, м). b) (+/-) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[9-(3-ізопропіл-[1,2,4]триазоло[4,3a]піридин-6-ілокси)-транс-6,7,8,9-тетрагідро-5H-бензоциклогептен-5-іл]-сечовина Сполука заголовка була одержана аналогічно Прикладу 1, стадіям е) і f), виходячи із сполуки + 1 стадії а) Прикладу 19. РХМС (Спосіб 5): Rt 4,87 хв., m/z 592 [MН ]. H-ЯМР (400 МГц, d6-DMSO): 1,11 (3H, д, J=6,82), 1,17 (3H, д, J=6,84), 1,21 (9H, с), 1,69-1,71 (4H, м), 2,24 (2H, м), 2,33 (3H, с), 3,31 (1H, м), 5,47 (2H, м), 6,24 (1H, с), 7,02-7,03 (1H, м), 7,09-7,24 (4H, м), 7,30-7,32 (5H, м), 7,59 (1H, д, J=9,87), 7,98 (1H, с), 8,18 (1H, с). 22 UA 104677 C2 Приклад 20 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-((1S,4S)-4-{3-[2-(2-гідроксіетилсульфаніл)феніл]-[1,2,4]триазоло[4,3-a]піридин-6-ілокси}-1,2,3,4-тетрагідронафталін-1-іл)-сечовина 5 10 15 20 25 30 a) a]піридин 6-фтор-3-{2-[2-(тетрагідропіран-2-ілоксі)-етилсульфаніл]-феніл}-[1,2,4]триазоло[4,3 Розчин 2-[2-(6-фтор-[1,2,4]триазоло[4,3-a]піридин-3-іл)-фенілсульфаніл]-етанолу (400 мг, 1,38 ммоль), 4-метилбензолсульфонової кислоти (65 мг, 0,345 ммоль) і 3,4-дигідро-2H-пірану (251 мкл, 2,76 ммоль) в ДХМ (5 мл) перемішували при КТ в атмосфері азоту протягом 36 год. Реакційну суміш розбавляли ДХМ і екстрагували насиченим розчином NaHCО 3. Органічний шар сушили над MgSО4, відфільтровували і концентрували у вакуумі. Залишок очищали за допомогою ФКХ, використовуючи MeOH в ДХМ (від 0 до 5%), з одержанням сполуки заголовка у + 1 вигляді блідо-жовтого масла (381 мг, 74%). РХМС (Спосіб 3): Rt 3,10 хв., m/z 374 [MН ]. H-ЯМР (400 МГц, CDCl3): 1,49 (6H, м), 3,01-3,02 (2H, м), 3,42-3,59 (2H, м), 3,80-3,80 (2H, м), 4,52 (1H, м), 7,34-7,35 (2H, м), 7,55-7,55 (2H, м), 7,67-7,68 (2H, м), 7,90 (1H, дд, J=9,97 і 4,82). b) (1S,4S)-4-(3-{2-[2-(тетрагідропіран-2-ілоксі)-етилсульфаніл]-феніл}-1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іламін Розчин сполуки стадії а) Прикладу 20 (381 мг, 1,02 ммоль), стадії b) Прикладу 2 (183 мг, 1,12 ммоль), трет-бутоксиду калію (125 мг, 1,12 ммоль) і DMPU (492 мкл, 4,08 ммоль) нагрівали при 50°С протягом 2 год., потім при 80°С протягом 1,5 год. Реакційну суміш охолоджували до КТ і розподіляли між H2О-EtOAc. Органічний шар сушили над MgSO4, відфільтровували і концентрували у вакуумі. Залишок очищали за допомогою ФКХ, використовуючи 2M NH 3-MeOH в ДХМ (від 0 до 50%), з одержанням сполуки заголовка (146 мг, 28%). РХМС (Спосіб 3): Rt 2,29 + хв., m/z 517 [MH ]. c) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1S,4S)-4-(3-{2-[2-(тетрагідропіран-2-ілоксі)етилсульфаніл]-феніл}-[1,2,4]триазоло[4,3-a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]сечовина Розчин сполуки стадії b) Прикладу 20 (60 мг, 0,11 ммоль), DIPEA (26 мкл 0,15 ммоль) і 2,2,2трихлоретил-3-трет-бутил-1-п-толіл-1H-піразол-5-ілкарбамату (56 мг, 0,138 ммоль) в діоксані (5 23 UA 104677 C2 5 10 15 20 25 мл) нагрівали при 80°С протягом 20 год. Реакційній суміші давали охолодитися до КТ, її розподіляли між H2О-ДХМ, органічну фазу сушили (MgSО4) і концентрували у вакуумі. Залишок очищали за допомогою ФКХ, використовуючи MeOH в ДХМ (від 0 до 5%), з одержанням сполуки + заголовка у вигляді жовтої піни (38 мг, 45%). РХМС (Спосіб 3): Rt 4,09 хв., m/z 772 [MH ]. d) 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-((1S,4S)-4-{3-[2-(2-гідроксиметилсульфаніл)феніл]-[1,2,4]триазоло[4,3-a]піридин-6-ілокси}-1,2,3,4-тетрагідронафталін-1-іл)-сечовина Розчин стадії с) Прикладу 20 (38 мг, 0,05 ммоль) і 4-метилбензолсульфонової кислоти (9 мг, 0,05 ммоль) в MeOH (2 мл) перемішували при КТ протягом 3 год., потім при 60°С протягом 5 год. Суміш охолоджували до КТ і концентрували у вакуумі. Залишок очищали за допомогою ФКХ, використовуючи MeOH в ДХМ (від 0 до 10%), з одержанням сполуки заголовка у вигляді + 1 жовтої твердої речовини (15 мг, 44%). РХМС (Спосіб 5): Rt 4,83 хв., m/z 688 [MH ]. H-ЯМР (400 МГц, d6-DMSO): 1,26 (9H, с), 1,69 (1H, м), 2,00-2,11 (3H, м), 2,35 (3H, с), 3,01 (2H, т, J=6,60), 3,50 (2H, т, J=6,60), 4,87 (1H, м), 5,55 (1H, м), 6,32 (1H, с), 6,98 (1H, д, J=8,10), 7,11 (4H, д, J=7,86), 7,31-7,33 (5H, м), 7,47 (4H, м), 7,63-7,71 (1H, м), 7,79 (1H, с), 7,96 (1H, д, J=3,40). Приклад 21 1-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-3-[(1S,4S)-4-(3-третбутил[1,2,4]триазоло[4,3a]піридин-6-ілокси)-1,2,3,4-тетрагідронафталін-1-іл]-сечовина Сполука заголовка була одержана аналогічно Прикладу 2. РХМС (Спосіб 5): Rt 4,86 хв., m/z + 1 592 [MH ]. H-ЯМР (400 МГц, d4-MeOH): 1,29 (9H, с), 1,50 (9H, с), 1,72-1,80 (1H, м), 2,11-2,19 (2H, с), 2,22-2,29 (1H, с), 2,37 (3H, с), 4,99 (1H, т, J=4), 5,46 (1H, т, J=4), 6,32 (1H, с), 7,18-7,34 (10H, м), 7,63-7,65 (1H, м), 7,93 (1H, с). Приклад 22 N-(4-{(1S,4S)-4-[3-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-уреїдо]-1,2,3,4тетрагідронафталін-1-ілоксиметил}-піридин-2-іл)-2-метоксіацетамід a) трет-бутиловий карбамінової кислоти 30 35 складний ефір ((1S,4S)-4-гідрокси-1,2,3,4-тетрагідронафталін-1-іл) Розчин сполуки стадії b) Прикладу 2 (0,47 г, 2,9 ммоль) і ди-трет-бутилдикарбонату (0,7 г, 3,19 ммоль) в ацетонітрилі (10 мл) перемішували при КТ протягом 20 год. Розчинники видаляли у вакуумі, і залишок очищали за допомогою ФКХ, використовуючи EtOAc в циклогексані (від 0 до 1 40%), з одержанням сполуки заголовка у вигляді рожевої твердої речовини (0,56 г, 74%). HЯМР (400 МГц, d6-DMSO): 1,41 (9H, с), 1,62 (2H, м), 1,95-2,14 (2H, м), 4,54 (1H, м), 4,66 (1H, м), 5,18 (1H, д, J=6,29), 7,18-7,19 (3H, м), 7,41-7,43 (1H, м). b) трет-бутиловий складний ефір [(1S,4S)-4-(2-амінопіридин-4-ілметокси)-1,2,3,4тетрагідронафталін-1-іл]-карбамінової кислоти 24 UA 104677 C2 5 10 15 20 25 30 35 40 45 Розчин сполуки стадії а) Прикладу 21 (240 мг, 0,912 ммоль) в ДМФА (5 мл), охолоджували до 0°С, обробляли гідридом натрію (70 мг, 1,82 ммоль) і гідробромідною сіллю 4бромметилпіридин-2-іламіну (249 мг, 0,93 ммоль). Реакційну суміш перемішували при 0°С протягом 1 год., потім давали їй можливість нагрітися до КТ. Розчинник упарювали у вакуумі, і залишок очищали за допомогою ФКХ, використовуючи EtOAc в ДХМ (від 0 до 100%), з одержанням сполуки заголовка у вигляді коричневої камеді (145 мг, 43%). РХМС (Спосіб 3): Rt + 1 2,47 хв., m/z 370 [MH ]. H-ЯМР (400 МГц, d6-DMSO): 1,43 (9H, с), 1,62-1,64 (1H, м), 1,80-1,82 (1H, м), 2,08 (1H, м), 2,16-2,25 (1H, м), 4,46-4,49 (3H, м), 4,72 (1H, м), 5,86 (2H, шир. с), 6,44-6,45 (2H, м), 7,19-7,27 (3H, м), 7,37-7,38 (1H, м), 7,84 (1H, д, J=5,16). c) 4-((1S,4S)-4-аміно-1,2,3,4-тетрагідронафталін-1-ілоксиметил)-піридин-2-іламін Розчин сполуки стадії b) Прикладу 21 (130 мг, 0,35 ммоль) і TFA (1 мл) в ДХМ (5 мл) перемішували при КТ протягом 2 год. і концентрували у вакуумі з одержанням сполуки + заголовка у вигляді оранжевої камеді (68 мг, 72%). РХМС (Спосіб 3): Rt 0,31 хв., m/z 270 [MH ]. d) 1-[(1S,4S)-4-(2-амінопіридин-4-ілметокси)-1,2,3,4-тетрагідронафталін-1-іл]-3-(5-трет-бутил2-п-толіл-2H-піразол-3-іл)-сечовина Сполука заголовка була одержана аналогічно стадії з Прикладу 20, виходячи з продукту + стадії с) Прикладу 21. РХМС (Спосіб 3): Rt 2,64 хв., m/z 525 [MH ]. e) N-(4-{(1S,4S)-4-[3-(5-трет-бутил-2-п-толіл-2H-піразол-3-іл)-уреїдо]-1,2,3,4тетрагідронафталін-1-ілоксиметил}-піридин-2-іл)-2-метоксіацетамід Розчин сполуки стадії d) Прикладу 21 (40 мг, 0,076 ммоль), DIPEA (28 мкл, 0,167 ммоль) і метоксіацетилхлориду (15,2 мкл, 0,16 ммоль) в ДХМ (1 мл) перемішували при КТ протягом 2 год. Реакційну суміш концентрували у вакуумі, і залишок очищали за допомогою ВЕРХ (від 30 до 95% CH3CN в H2O+0,1% мурашиної кислоти) з одержанням сполуки заголовка у вигляді білої + 1 твердої речовини (21 мг, 46%). РХМС (Спосіб 5): Rt 5,05 хв., m/z 597 [MH ]. H-ЯМР (400 МГц, d6-DMSO): 1,26 (9H, с), 1,62-1,68 (1H, м), 2,05-2,07 (3H, м), 2,35 (3H, с), 3,36 (3H, с), 4,05 (2H, с), 4,63-4,64 (3H, м), 4,84 (1H, м), 6,31 (1H, с), 6,96 (1H, д, J=8,33), 7,10 (1H, д, J=5,15), 7,28-7,29 (7H, м), 7,40-7,44 (1H, м), 7,98 (1H, с), 8,11 (1H, с), 8,26 (1H, д, J=5,10), 9,93 (1H, с). Біологічні аналізи Аналіз кінази р38 Людський рекомбінантний фермент p38, експресований в Е. coli і активований за допомогою інкубації з ферментом MKK6 (Calbiochem #559324), використовували як джерело ферментної активності. Аналіз здійснювали у високозв’язувальних, прозорих, плоскодонних 96-ямкових аналітичних планшетах, які покривали рекомбінантною ATF-2 (Biosource #PHF0043). Тестовані сполуки інкубували з кіназою р38 протягом 2 год. перед ініціацією кіназного аналізу за допомогою додавання АТФ для одержання аналітичної концентрації, що дорівнює 250 мкМ. Фосфорилування ATF-2 виявляли і кількісно оцінювали, використовуючи ELISA. Тест складався з послідовної інкубації в присутності анти-фосфо-ATF2, біотинільованих анти-IgG і стрептавідин-HRP. Інкубація з HRP хромогенним субстратом (TMB) приводить до поглинання, яке є пропорційним кількості продукованого фосфорилованого субстрату. Поглинання виявляють, використовуючи пристрій для зчитування багатоямкових планшетів. Сполуки розбавляють в ДМСО перед додаванням до аналітичного буфера, причому кінцева концентрація ДМСО в аналізі становить 1%. IC50 визначають як концентрацію, при якій дана сполука досягає 50% інгібування від контролю. Результати показані в наступній Таблиці: 25 UA 104677 C2 Таблиця 1 Приклад Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 Приклад 13 Приклад 14 Приклад 15 Приклад 16 Приклад 17 Приклад 18 Приклад 19 Приклад 20 Приклад 21 Приклад 22 5 10 15 Інгібування р38 ++++ ++++ ++++ ++++ +++ ++++ ++++ ++ ++ ++++ ++++ ++ ++++ + + ++++ ++++ +++ +++ ++++ НТ ++++ У наведеній вище таблиці, активності зв’язування p38 (значення IC50) вказані таким чином:
ДивитисяДодаткова інформація
Назва патенту англійськоюUrea derivatives and their therapeutic use in the treatment of, inter alia, diseases of the respiratory tract
Автори англійськоюWoo, Chi-kit, van Niel, Monique, Bodil
Автори російськоюВоо Чи-кит, ван Нил Моник Бодил
МПК / Мітки
МПК: C07D 471/04, A61P 29/00, A61K 31/437
Мітки: сечовини, захворювань, застосування, дихальних, похідні, іншого, лікуванні, терапевтичне, шляхів
Код посилання
<a href="https://ua.patents.su/33-104677-pokhidni-sechovini-i-kh-terapevtichne-zastosuvannya-pri-likuvanni-sered-inshogo-zakhvoryuvan-dikhalnikh-shlyakhiv.html" target="_blank" rel="follow" title="База патентів України">Похідні сечовини і їх терапевтичне застосування при лікуванні, серед іншого, захворювань дихальних шляхів</a>
Попередній патент: Дозувальний привід для аерозольної упаковки зі змінними трубками
Наступний патент: Спосіб локального знеміцнення міцних ґрунтів високовольтним електрохімічним вибухом
Випадковий патент: Спосіб підвищення продуктивності сільськогосподарських культур