Похідні карбоксамідину і їх застосування при лікуванні васкулярних захворювань
Номер патенту: 77731
Опубліковано: 15.01.2007
Автори: Єгесне Чакаі Зіта, Денеш Ласло, Батоне Тьорьок Магдольна, Марваньош Еде, Ірьогді Ласло
Формула / Реферат
1. Застосування сполук загальної формули (І), (II) і (III)
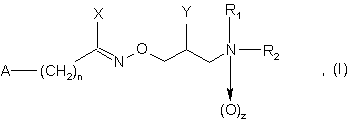
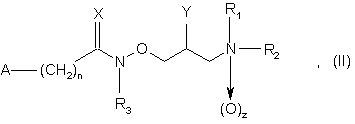
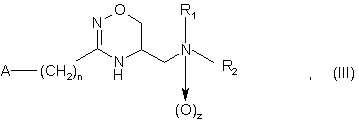
де R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, необов'язково, заміщений фенілом,
або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, де гетероциклічне кільце, необов'язково, заміщене однією або більше гідрокси, оксо або бензильними групами,
А представляє феніл, необов'язково, заміщений однією або більшою кількістю С1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6-членне гетероароматичне кільце, що містить один або більшу кількість гетероатомів, таких як азот, кисень або сірка, що необов'язково має структуру N-оксиду на азоті,
n дорівнює нулю, 1 або 2,
z дорівнює нулю або 1,
в сполуках загальної формули (І) Х представляє атом галогену або –NR4R5 групу, де R4 і R5, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, в сполуках загальної формули (II) Х представляє атом кисню,
R3 представляє атом водню або розгалужений або нерозгалужений С1-6 алкіл,
Y представляє атом водню або гідроксигрупу, атом галогену або С1-22 ацилоксигрупу,
за умови, якщо R4 і R5 є одночасно атомами водню, Y є іншим ніж гідроксигрупа, за умови, що в сполуках загальних формул (І) і (II), де Y є іншим ніж галоген,
а) R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп, і/або
б) А є N-вмісним гетероароматичним кільцем, яке має структуру N-оксиду на азоті, і/або
в) z є 1,
при наступній умові, що якщо Х є галогеном і Y є гідрокси або ацилокси в сполуках загальної формули (І),
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп і за умови для сполук загальної формули (III), що
якщо R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, необов'язково, заміщений фенілом, або разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, тоді А є гетероароматичним кільцем, що містить кисень або сірку або N-вмісним гетероароматичним кільцем, що має структуру N-оксиду на азоті, і
якщо А є фенілом, необов'язково, заміщеним однією або більшою кількістю С1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6-членним N-вмісним гетероароматичним кільцем, тоді R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп, і солей і оптичноактивних форм згаданих вище сполук для одержання фармацевтичних продуктів для застосування в лікуванні і/або попередженні васкулярних захворювань або захворювань пов'язаних з васкулярними розладами.
2. Сполуки загальної формули (І)

в якій
R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, необов'язково, заміщений фенілом, або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, де гетероциклічне кільце, необов'язково, заміщене однією або більше гідрокси, оксо або бензильними групами,
А представляє феніл, необов'язково, заміщений однією або більшою кількістю С1-6 алкільних, С1-6 галоалкільних або нітрогруп або атомами галогену, або 5-6-членне гетероароматичне кільце, що містить один або більшу кількість гетероатомів, таких як азот, кисень або сірка, що необов'язково має структуру N-оксиду на азоті,
n дорівнює нулю, 1 або 2,
z дорівнює нулю або 1,
Х представляє атом галогену або -NR4R5 групу, де R4 і R5, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл,
Y представляє атом водню або гідроксигрупу, атом галогену або С1-22 ацилоксигрупу, за умови, якщо R4 і R5 є одночасно атомами водню, тоді Y є іншим ніж гідроксигрупа,
за умови, що
а) якщо Y представляє атом водню і/або Х представляє –NR4R5 групу, де R4 і R5 мають вказані вище значення,
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп, і/або
А є N-вмісним гетероароматичним кільцем, яке має структуру N-оксиду на азоті, або
б) якщо Х є галогеном і Y є гідрокси або ацилокси,
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне, насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп, і стереоізомери згаданих вище сполук і їх солі.
3. Сполуки загальної формули (II)

в якій
R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, необов'язково, заміщений фенілом, або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, де гетероциклічне кільце, необов'язково, заміщене однією або більше гідрокси, оксо або бензильними групами,
А представляє феніл, необов'язково, заміщений однією або більшою кількістю С1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6-членне гетероароматичне кільце, що містить один або більшу кількість гетероатомів, таких як азот, кисень або сірка, що необов'язково має структуру N-оксиду на азоті,
n дорівнює нулю, 1 або 2,
z дорівнює нулю або 1,
Х представляє атом кисню,
R3 представляє атом водню або розгалужений або нерозгалужений С1-6 алкіл,
Y представляє атом водню або гідроксигрупу, атом галогену або С1-22 ацилоксигрупу, при умові, що Y є іншим ніж галоген,
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп, і/або
А є N-вмісним гетероароматичним кільцем, яке має структуру N-оксиду на азоті,
і стереоізомери згаданих вище сполук і їх солі.
4. Сполуки загальної формули (III)

в якій
R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, необов'язково, заміщений фенілом, або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, де гетероциклічне кільце, необов'язково, заміщене однією або більше гідрокси, оксо або бензильних груп,
А представляє феніл, необов'язково, заміщений однією або більшою кількістю С1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6-членне гетероароматичне кільце, що містить один або більшу кількість гетероатомів, таких як азот, кисень або сірка, що необов'язково має структуру N-оксиду на азоті,
n дорівнює нулю, 1 або 2,
z дорівнює нулю або 1,
за умови, що
якщо R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С1-6 алкіл, необов'язково, заміщений фенілом, або разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, тоді А є гетероароматичним кільцем, що містить кисень або сірку або N-вмісним гетероароматичним кільцем, що має структуру N-оксиду на азоті, і
якщо А є фенілом, необов'язково, заміщеним однією або більшою кількістю С1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6-членним N-вмісним гетероароматичним кільцем, тоді R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп,
і стереоізомери згаданих вище сполук і їх солі.
5. Сполука за п. 3, яка являє собою N-[3-(1-піперидиніл)пропокси]піридин-1-оксид-3-карбоксамідин і його солі.
6. Сполука за п. 2, яка являє собою N-[3-(1-піперидиніл)пропокси]піридин-1-оксид-3-карбоксімідоїлхлорид і його солі.
7. Сполука за п. 3, яка являє собою N-[2-гідрокси-3-(1-піперидиніл)пропокси]-N'-н-бутилпіридин-1-оксид-4-карбоксамідин, його стереоізомери і їх солі.
8. Сполука за п. 2, яка являє собою 2-хлор-N-[3-(4-оксидо-4-морфолініл)пропокси]бензімідоїлхлорид і його солі.
9. Сполука за п. 4, яка являє собою 5,6-дигідро-5-[(1-піперидиніл)метил]-3-(1-оксидо-3-піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і їх солі.
10. Сполука за п. 4, яка являє собою 5,6-дигідро-5-[(4-бензил-1-піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і їх солі.
11. Сполука за п. 4, яка являє собою 5,6-дигідро-5-[(2-оксо-1-піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і їх солі.
12. Сполука за п. 4, яка являє собою 5,6-дигідро-5-[(1-піперидиніл)метил]-3-(1-оксидо-3-піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і їх гідрати і солі.
13. Сполука за п. 4, яка являє собою 5,6-дигідро-5-[(1-оксидо-1-піперидиніл)метил]-3-(1 -оксидо-3-піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і їх солі.
14. Сполука за п. 4, яка являє собою 5,6-дигідро-5-[(4-гідрокси-1-піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і їх солі.
15. Сполука за п. 2, яка являє собою гідрохлорид N-[2-xлop-3-(1-піперидиніл)пропокси]-3-бензімідоїлхлориду, його стереоізомери і їх солі.
16. Сполука за п. 3, яка являє собою N-[2-гідрокси-3-(1-піперидиніл)пропокси]піридин-1-оксид-3-карбоксамід, його стереоізомери і їх солі.
17. Фармацевтична композиція, що містить сполуку загальної формули (І)

як активний інгредієнт, де R1, R2, А, X, Y, n і z є такими, як визначено в пункті 2.
18. Фармацевтична композиція, що містить сполуку загальної формули (ІІ)

як активний інгредієнт, де R1, R2, А, X, Y, n і z є такими, як визначено в пункті 3.
19. Фармацевтична композиція, що містить сполуку загальної формули (III)

як активний інгредієнт, де R1, R2, А, X, Y, n і z є такими, як визначено в пункті 4.
Текст
1. Застосування сполук загальної формули (І), (II) і (III) 3 77731 4 Y представляє атом водню або гідроксигрупу, азоту і/або кисню, де гетероциклічне кільце, атом галогену або С1-22 ацилоксигрупу, необов'язково, заміщене однією або більше за умови, якщо R4 і R5 є одночасно атомами гідрокси, оксо або бензильними групами, водню, Y є іншим ніж гідроксигрупа, за умови, що в А представляє феніл, необов'язково, заміщений сполуках загальних формул (І) і (II), де Y є іншим однією або більшою кількістю С 1-6 алкільних, С1-6 ніж галоген, галоалкільних або нітрогруп або атомами а) R1 і R2 разом з атомом азоту, до якого вони галогену, або 5-6-членне гетероароматичне приєднані, утворюють 5-7-членне насичене кільце, що містить один або більшу кількість гетероциклічне кільце, що необов'язково містить гетероатомів, таких як азот, кисень або сірка, що інший гетероатом азоту і/або кисню, де необов'язково має структур у N-оксиду на азоті, гетероциклічне кільце є заміщеним однією або n дорівнює нулю, 1 або 2, більшою кількістю гідрокси, оксо або бензильних z дорівнює нулю або 1, груп, і/або Х представляє атом галогену або -NR4R5 групу, де б) А є N-вмісним гетероароматичним кільцем, яке R4 і R5, незалежно, представляють атом водню має структур у N-оксиду на азоті, і/або або розгалужений або нерозгалужений С1-6 алкіл, в) z є 1, Y представляє атом водню або гідроксигрупу, при наступній умові, що якщо Х є галогеном і Y є атом галогену або С 1-22 ацилоксигрупу, за умови, гідрокси або ацилокси в сполуках загальної якщо R4 і R5 є одночасно атомами водню, тоді Y є формули (І), іншим ніж гідроксигрупа, R1 і R2 разом з атомом азоту, до якого вони за умови, що приєднані, утворюють 5-7-членне насичене а) якщо Y представляє атом водню і/або Х гетероциклічне кільце, що необов'язково містить представляє –NR4R5 групу, де R4 і R5 мають інший гетероатом азоту і/або кисню, де вказані вище значення, гетероциклічне кільце є заміщеним однією або R1 і R2 разом з атомом азоту, до якого вони більшою кількістю гідрокси, оксо або бензильних приєднані, утворюють 5-7-членне насичене груп і за умови для сполук загальної формули (III), гетероциклічне кільце, що необов'язково містить що інший гетероатом азоту і/або кисню, де якщо R1 і R2, незалежно, представляють атом гетероциклічне кільце є заміщеним однією або водню або розгалужений або нерозгалужений С 1-6 більшою кількістю гідрокси, оксо або бензильних алкіл, необов'язково, заміщений фенілом, або груп, і/або разом з атомом азоту, до якого вони приєднані, А є N-вмісним гетероароматичним кільцем, яке утворюють 5-7-членне насичене гетероциклічне має структур у N-оксиду на азоті, або кільце, що необов'язково містить інші гетероатоми б) якщо Х є галогеном і Y є гідрокси або ацилокси, азоту і/або кисню, тоді А є гетероароматичним R1 і R2 разом з атомом азоту, до якого вони кільцем, що містить кисень або сірку або Nприєднані, утворюють 5-7-членне, насичене вмісним гетероароматичним кільцем, що має гетероциклічне кільце, що необов'язково містить структур у N-оксиду на азоті, і інший гетероатом азоту і/або кисню, де якщо А є фенілом, необов'язково, заміщеним гетероциклічне кільце є заміщеним однією або однією або більшою кількістю С 1-4 алкільних, С1-4 більшою кількістю гідрокси, оксо або бензильних галоалкільних або нітрогруп або атомами груп, і стереоізомери згаданих вище сполук і їх галогену, або 5-6-членним N-вмісним солі. гетероароматичним кільцем, тоді R1 і R2 разом з 3. Сполуки загальної формули (II) R1 Y атомом азоту, до якого вони приєднані, утворюють X 5-7-членне насичене гетероциклічне кільце, що O N R2 , (II) необов'язково містить інший гетероатом азоту N A (CH2)n і/або кисню, де гетероциклічне кільце є заміщеним R3 (O) z однією або більшою кількістю гідрокси, оксо або в якій бензильних груп, і солей і оптичноактивних форм згаданих вище сполук для одержання R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С 1-6 алкіл, фармацевтичних продуктів для застосування в необов'язково, заміщений фенілом, або R1 і R2 лікуванні і/або попередженні васкулярних разом з атомом азоту, до якого вони приєднані, захворювань або захворювань пов'язаних з утворюють 5-7-членне насичене гетероциклічне васкулярними розладами. 2. Сполуки загальної формули (І) кільце, що необов'язково містить інші гетероатоми R1 азоту і/або кисню, де гетероциклічне кільце, Y X необов'язково, заміщене однією або більше O N R2 гідрокси, оксо або бензильними групами, N A (CH 2)n , (I) А представляє феніл, необов'язково, заміщений однією або більшою кількістю С 1-4 алкільних, С1-4 (O)z галоалкільних або нітрогруп або атомами в якій галогену, або 5-6-членне гетероароматичне R1 і R2, незалежно, представляють атом водню кільце, що містить один або більшу кількість або розгалужений або нерозгалужений С 1-6 алкіл, гетероатомів, таких як азот, кисень або сірка, що необов'язково, заміщений фенілом, або R1 і R2 необов'язково має структур у N-оксиду на азоті, разом з атомом азоту, до якого вони приєднані, n дорівнює нулю, 1 або 2, утворюють 5-7-членне насичене гетероциклічне z дорівнює нулю або 1, кільце, що необов'язково містить інші гетероатоми 5 77731 6 Х представляє атом кисню, 5. Сполука за п. 3, яка являє собою N-[3-(1R3 представляє атом водню або розгалужений або піперидиніл)пропокси]піридин-1-оксид-3нерозгалужений С1-6 алкіл, карбоксамідин і його солі. Y представляє атом водню або гідроксигрупу, 6. Сполука за п. 2, яка являє собою N-[3-(1атом галогену або С 1-22 ацилоксигрупу, при умові, піперидиніл)пропокси]піридин-1-оксид-3що Y є іншим ніж галоген, карбоксімідоїлхлорид і його солі. R1 і R2 разом з атомом азоту, до якого вони 7. Сполука за п. 3, яка являє собою N-[2-гідроксиприєднані, утворюють 5-7-членне насичене 3-(1-піперидиніл)пропокси]-N'-н-бутилпіридин-1гетероциклічне кільце, що необов'язково містить оксид-4-карбоксамідин, його стереоізомери і їх інший гетероатом азоту і/або кисню, де солі. гетероциклічне кільце є заміщеним однією або 8. Сполука за п. 2, яка являє собою 2-хлор-N-[3-(4більшою кількістю гідрокси, оксо або бензильних оксидо-4-морфолініл)пропокси]бензімідоїлхлорид і груп, і/або його солі. А є N-вмісним гетероароматичним кільцем, яке 9. Сполука за п. 4, яка являє собою 5,6-дигідро-5має структур у N-оксиду на азоті, [(1-піперидиніл)метил]-3-(1-оксидо-3-піридил)-4Ні стереоізомери згаданих ви ще сполук і їх солі. 1,2,4-оксадіазин, його стереоізомери і їх солі. 4. Сполуки загальної формули (III) 10. Сполука за п. 4, яка являє собою 5,6-дигідро-5R1 O [(4-бензил-1-піперидиніл)метил]-3-(3-піридил)-4НN 1,2,4-оксадіазин, його стереоізомери і їх солі. N 11. Сполука за п. 4, яка являє собою 5,6-дигідро-5N R2 A (CH2)n , (III) H [(2-оксо-1-піперидиніл)метил]-3-(3-піридил)-4Н(O)z 1,2,4-оксадіазин, його стереоізомери і їх солі. 12. Сполука за п. 4, яка являє собою 5,6-дигідро-5в якій [(1-піперидиніл)метил]-3-(1-оксидо-3-піридил)-4НR1 і R2, незалежно, представляють атом водню 1,2,4-оксадіазин, його стереоізомери і їх гідрати і або розгалужений або нерозгалужений С 1-6 алкіл, солі. необов'язково, заміщений фенілом, або R1 і R2 13. Сполука за п. 4, яка являє собою 5,6-дигідро-5разом з атомом азоту, до якого вони приєднані, [(1-оксидо-1-піперидиніл)метил]-3-(1 -оксидо-3утворюють 5-7-членне насичене гетероциклічне піридил)-4Н-1,2,4-оксадіазин, його стереоізомери і кільце, що необов'язково містить інші гетероатоми їх солі. азоту і/або кисню, де гетероциклічне кільце, 14. Сполука за п. 4, яка являє собою 5,6-дигідро-5необов'язково, заміщене однією або більше [(4-гідрокси-1-піперидиніл)метил]-3-(3-піридил)-4Нгідрокси, оксо або бензильних груп, 1,2,4-оксадіазин, його стереоізомери і їх солі. А представляє феніл, необов'язково, заміщений 15. Сполука за п. 2, яка являє собою гідрохлорид однією або більшою кількістю С 1-4 алкільних, С1-4 N-[2-xлop-3-(1-піперидиніл)пропокси]-3галоалкільних або нітрогруп або атомами бензімідоїлхлориду, його стереоізомери і їх солі. галогену, або 5-6-членне гетероароматичне 16. Сполука за п. 3, яка являє собою N-[2-гідроксикільце, що містить один або більшу кількість 3-(1-піперидиніл)пропокси]піридин-1-оксид-3гетероатомів, таких як азот, кисень або сірка, що карбоксамід, його стереоізомери і їх солі. необов'язково має структур у N-оксиду на азоті, 17. Фармацевтична композиція, що містить n дорівнює нулю, 1 або 2, сполуку загальної формули (І) z дорівнює нулю або 1, R1 Y X за умови, що якщо R1 і R2, незалежно, представляють атом O N R2 N водню або розгалужений або нерозгалужений С 1-6 A (CH2)n , (I) алкіл, необов'язково, заміщений фенілом, або (O)z разом з атомом азоту, до якого вони приєднані, як активний інгредієнт, де R1, R2, А, X, Y, n і z є утворюють 5-7-членне насичене гетероциклічне такими, як визначено в пункті 2. кільце, що необов'язково містить інші гетероатоми 18. Фармацевтична композиція, що містить азоту і/або кисню, тоді А є гетероароматичним сполуку загальної формули (ІІ) кільцем, що містить кисень або сірку або NR1 Y X вмісним гетероароматичним кільцем, що має структур у N-оксиду на азоті, і O N R2 N , (II) A (CH2) n якщо А є фенілом, необов'язково, заміщеним однією або більшою кількістю С 1-4 алкільних, С1-4 R3 (O) z галоалкільних або нітрогруп або атомами як активний інгредієнт, де R1, R2, А, X, Y, n і z є галогену, або 5-6-членним N-вмісним такими, як визначено в пункті 3. гетероароматичним кільцем, тоді R1 і R2 разом з 19. Фармацевтична композиція, що містить атомом азоту, до якого вони приєднані, утворюють сполуку загальної формули (III) 5-7-членне насичене гетероциклічне кільце, що O R1 N необов'язково містить інший гетероатом азоту і/або кисню, де гетероциклічне кільце є заміщеним N N R2 A (CH2) n , (III) однією або більшою кількістю гідрокси, оксо або H бензильних груп, (O) z і стереоізомери згаданих ви ще сполук і їх солі. як активний інгредієнт, де R1, R2, А, X, Y, n і z є такими, як визначено в пункті 4. 7 77731 Винахід стосується фармацевтично ефективних похідних гідроксиламіну, які корисні при лікуванні васкулярних захворювань. Винахід стосується застосування сполук загальних формул (І), (II) і (III) R1 і R2, незалежно, представляють атом водню або розгалужений або нерозгалужений С 1-6 алкіл, необов'язково, заміщений фенілом, або R1 і R2 разом з атомом азоту до якого вони приєднані утворюють 5-7 членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азоту і/або кисню, де гетероциклічне кільце, необов'язково, заміщене однією або більше гідрокси, оксо або бензильних груп, А представляє феніл, необов'язково, заміщений однією або більшою кількістю С 1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6 членне гетероароматичне кільце, що містить один або більшу кількість гетероатомів, таких як азот, кисень або сірка, що необов'язково має структуру N-оксиду на азоті, n дорівнює нулю, 1 або 2, z дорівнює нулю або 1, в сполуках загальної формули (І), X представляє атом галогену або -NR4R5 груп у, де R4 і R5, незалежно, представляють атом водню або розгалужений або нерозгалужений С 1-4 алкіл, в сполуках загальної формули (II), X представляє атом кисню, R3 представляє атом водню або розгалужений або нерозгалужений С1-4 алкіл, Υ представляє атом водню або гідроксигрупу, атом галогену або С 1-22 ацилоксигрупу, при умові, якщо R4 і R5 є одночасно атомами водню, Υ є іншим ніж гідроксигрупа, при умові, що в сполуках загальних формул (І) і (II), де Υ є іншим ніж галоген, а) R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7 членне, насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азот і/або кисень, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп і/або б) А є N-вмісним гетероароматичним кільцем, яке має структур у N-оксиду на азоті, і/або в) z є 1, при наступній умові, що якщо X є галогеном і Υ є гідрокси або ацилокси в сполуках загальної формули (І), R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7 членне, насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азот і/або кисень, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп і при умові для сполук загальної формули (111), що якщо R1 і R2, незалежно, представляють атом 8 водню або розгалужений або нерозгалужений С 1-6 алкіл, необов'язково, заміщений фенілом, або разом з атомом азоту, до якого вони приєднані, утворюють 5-7 членне насичене гетероциклічне кільце, що необов'язково містить інші гетероатоми азот і/або кисень, тоді А є гетероароматичним кільцем, що містить кисень або сірку або Nвмісним гетероароматичним кільцем, що має структур у N-оксиду на азоті і якщо А є фенілом, необов'язково, заміщеним однією або більшою кількістю С 1-4 алкільних, С1-4 галоалкільних або нітрогруп або атомами галогену, або 5-6 членним N-вмісним гетероароматичним кільцем, тоді R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7 членне, насичене гетероциклічне кільце, що необов'язково містить інший гетероатом азот і/або кисень, де гетероциклічне кільце є заміщеним однією або більшою кількістю гідрокси, оксо або бензильних груп, і солей і оптичноактивних форм сполук для одержання фармацевтичних продуктів, що використовуються при лікуванні і/або попередженні васкулярних захворювань або захворювань пов'язаних з васкулярними розладами. Сполуки подібної структури відомі з [WO 97/16439]. Ці сполуки збільшують експресію молекулярних шаперонів або активність молекулярного шаперону в клітині, що зазнає фізіологічного стресу. Завдяки цим характеристикам, вони є корисні для лікування захворювання пов'язаних з функціонуванням системи шаперону. Захисна і генеруюча дія, що сполуки подібної будови спричиняють на васкулярні ендотеліальні клітини, відома з [WO 98/06400]. Ці сполуки є в основному корисними для попередження ушкоджень спричинених ішемією і для лікування кардіоваскулярних і цереброваскулярних захворювань. Ми встановили, що коли похідні гідроксиламіну описані в згаданій літературі хімічно модифікувати, переважно, в такий спосіб, щоб вони відповідали загальним формулам (І), (II) і (III) вище, 1) атом галогену вводять в пропіленову груп у амінопропільної групи приєднаної до гідроксиламінової частини як замісник і/або 2) одержують N-оксид на атомах азоту в термінальній групі молекули, тобто на атомі азоту приєднаному до пропіленової групи згаданої вище амінопропільної групи і/або на атомі азоту розташованому в гетероароматичному кільці молекули, потім одержують продукти, що є похідними гідроксиламіну, які мають набагато кращі фармакологічні властивості по відношенню до васкулярних захворювань, ніж відомі сполуки, які як було встановлено є корисні для цих цілей. А саме, діють ці сполуки більш інтенсивно ніж відомі з попереднього рівня техніки сполуки, що 9 77731 10 використовуються для подібних цілей. Тому вони груп, особливо корисні як активні інгредієнти при і стереоізомери згаданих ви ще сполук і їх солі. лікуванні або попередженні васкулярних Нові сполуки є сполуками загальної формули захворювань або захворювань опосередкованих (II), в якій васкулоярними розладами. R1 і R2, незалежно, представляють атом водню Ґрунтуючись на цих спостереженнях, цей або розгалужений або нерозгалужений Сі.6 алкіл, винахід стосується застосування сполук загальних необов'язково, заміщений фенілом, або R1 і R2 формул (І), (II) і (III) - де R1, R2, R3, А, X, Υ, n і z є разом з атомом азоту до якого вони приєднані такими як вказано вище -, і застосування солей і утворюють 5-7 членне насичене гетероциклічне оптичноактивних форм згаданих вище сполук для кільце, що необов'язково містить інші гетероатоми одержання фармацевтичних продуктів для азоту і/або кисню, де гетероциклічне кільце, лікування і/або попередження васкулярних необов'язково, заміщене однією або більше захворювань або захворювань опосередкованих гідрокси, оксо або бензильних груп, васкулярними розладами. А представляє феніл, необов'язково, Значна частина сполук загальних формул (І), заміщений однією або більшою кількістю С 1-4 (II) і (III) є новими сполуками. алкільних, С1-4 галоалкільних або нітрогруп або Нові сполуки є сполуками загальної формули атомами галогену, або 5-6 членне (І), в якій гетероароматичне кільце, що містить один або R1 і R2, незалежно, представляють атом водню більшу кількість гетероатомів, таких як азот, або розгалужений або нерозгапужений С 1-6 алкіл, кисень або сірка, що необов'язково має структуру необов'язково, заміщений фенілом, або R1 і R2 N-оксиду на азоті, разом з атомом азоту до якого вони приєднані n дорівнює нулю, 1 або 2, утворюють 5-7 членне насичене гетероциклічне z дорівнює нулю або 1, кільце, що необов'язково містить інші гетероатоми X представляє атом кисню, азоту і/або кисню, де гетероциклічне кільце, R3 представляє атом водню або розгалужений необов'язково, заміщене однією або більше або нерозгалужений С1-6 алкіл, гідрокси, оксо або бензильних груп, Υ представляє атом водню або гідроксигрупу, А представляє феніл, необов'язково, атом галогену або С 1-22 ацилоксигрупу, при умові, заміщений однією або більшою кількістю С 1-4 що Υ є іншим ніж галоген, алкільних, С1-4 галоалкільних або нітрогруп або R1 і R2 разом з атомом азоту, до якого вони атомами галогену, або 5-6 членне приєднані, утворюють 5-7 членне, насичене гетероароматичне кільце, що містить один або гетероциклічне кільце, що необов'язково містить більшу кількість гетероатомів, таких як азот, інший гетероатом азот і/або кисень, де кисень або сірка, що необов'язково має структуру гетероциклічне кільце є заміщеним однією або N-оксиду на азоті, більшою кількістю гідрокси, оксо або бензильних n дорівнює нулю, 1 або 2, груп і/або z дорівнює нулю або 1, А є N-вмісним гетероароматичним кільцем, X представляє атом галогену або -NR4R5 яке має структур у N-оксиду на азоті, груп у, де R4 і R5, незалежно, представляють атом і стереоізомери згаданих ви ще сполук і їх солі. водню або розгалужений або нерозгалужений С 1-6 Нові сполуки є сполуками загальної формули алкіл, (III), в якій Υ представляє атом водню або гідроксигрупу, R1 і R2, незалежно, представляють атом водню атом галогену або С 1-22 ацилоксигрупу, при умові, або розгалужений або нерозгалужений Сь 6 алкіл, якщо R4 і R5 є одночасно атомами водню, тоді Υ є необов'язково, заміщений фенілом, або R1 і R2 іншим ніж гідроксигрупа, разом з атомом азоту до якого вони приєднані при умові, утворюють 5-7 членне насичене гетероциклічне а) якщо Υ представляє атом водню і/або X кільце, що необов'язково містить інші гетероатоми представляє -NR4RS групу, де R 4 і R5 мають азоту і/або кисню, де гетероциклічне кільце, вказані вище значення, необов'язково, заміщене однією або більше R1 і R2 разом з атомом азоту, до якого вони гідрокси, оксо або бензильних груп, приєднані, утворюють 5-7 членне, насичене А представляє феніл, необов'язково, гетероциклічне кільце, що необов'язково містить заміщений однією або більшою кількістю С 1-4 інший гетероатом азот і/або кисень, де алкільних, С1-4 галоалкільних або нітрогруп або гетероциклічне кільце є заміщеним однією або атомами галогену, або 5-6 членне більшою кількістю гідрокси, оксо або бензильних гетероароматичне кільце, що містить один або груп і/або більшу кількість гетероатомів, таких як азот, А є N-вмісним гетероароматичним кільцем, кисень або сірка, що необов'язково має структуру яке має структур у N-оксиду на азоті, або N-оксиду на азоті, б) якщо X є галогеном і Υ є гідрокси або n дорівнює нулю, 1 або 2, ацилокси, z дорівнює нулю або 1, R1 і R2 разом з атомом азоту, до якого вони при умові, що приєднані, утворюють 5-7 членне, насичене якщо гетероциклічне кільце, що необов'язково містить R1 і R2, незалежно, представляють атом водню інший гетероатом азот і/або кисень, де або розгалужений або нерозгалужений С 1-6 алкіл, гетероциклічне кільце є заміщеним однією або необов'язково, заміщений феніл, або разом з більшою кількістю гідрокси, оксо або бензильних атомом азоту, до якого вони приєднані, утворюють 11 77731 12 5-7 членне насичене гетероциклічне кільце, що (HUVEC) досліджували в системі культури клітин необов'язково містить інші гетероатоми азот і/або (in vitro). Після зливання, HUVEC клітини кисень, тоді А є гетероароматичним кільцем, що пошкоджували згідно з методом Ямамура та ін. містить кисень або сірку або N-вмісним [Yamamura et al, J. Surgical Res. 63, 349-354,1996]. гетероароматичним кільцем, що має структур у NРеєстрували кількість мігруючих клітин оксиду на азоті і використовуючи комп'ютеризований аналіз якщо А є фенілом, необов'язково, заміщеним зображення протягом 24 годин після нанесення однією або більшою кількістю С 1-4 алкільних, С1-4 пошкодження у відсутності і присутності активних галоалкільних або нітрогруп або атомами агентів в концентрації 10-6М. Активний інгредієнт галогену, або 5-6 членним N-вмісним [описаний в публікації №WO 98/06400], під назвою гетероароматичним кільцем, тоді R1 і R2 разом з 5,6-дигідро-5-(1-піперидиніл)-метил-3-(3-піридил)атомом азоту, до якого вони приєднані, утворюють 4Н-1,2,4-оксадіазин, використовували як 5-7 членне, насичене гетероциклічне кільце, що контрольну сполуку. Одержані результати необов'язково містить інший гетероатом азот і/або приведені в Таблиці 1. кисень, де гетероциклічне кільце є заміщеним Таблиця 1 однією або більшою кількістю гідрокси, оксо або бензильних груп, 2 № Сполу ки клітин/мм 24 го дини і стереоізомери згаданих ви ще сполук і їх солі. Контро льна 30 Винахід стосується згаданих вище сполук. 4 45 8 48 Винахід також стосується фармацевтичного 9 52 продукту, що містить як активний інгредієнт 11 51 сполуки загальних формул (І), (II) і (III), або їх 12 60 1 2 3 стереоізомерів, або їх солей, де R , R , R , А, X, Υ, 13 54 n і z є такими як визначено вище. Наступні сполуки є особливо переважними: Далі, ми приводимо результати тесту 1. Ν-[3-(1-піперидиніл)пропокси]піридин-1розслаблення кровоносної судини, що проводять оксид-3-карбоксамідин in vitro на судинах пацюка, а також морфологічні 2. Ν-[3-(1-піперидиніл)пропокси]піридин-1результати грудної аорти. оксид-3-карбоксімідоїлхлорид Щурів Wistar Okamoto віком три місяці з 3. N-[2-пдрокси-3-(1-піперидиніл)пропокси]-N'генетичною гіпертонією (SH) обробляли протягом н-бутилпіридин-1-оксид-4-карбоксамідин одного місяця різними сполуками, що тестуються. 4. N-[3-(1-оксидо-1-піперидиніл)пропокси]-3Після цього проводили функціональні і нітро-бензімідоїлхлориду дигідрат морфологічні тестування. 5. 2-хлор-N-[3-(4-оксидо-4Вазо-релаксуюча дія сполук винаходу на морфолініл)пропокси]бензімідоїлхлорид грудн у аорту SH щурів (in vitro тестування) 6. (R,S)-5,6-дигідро-5-[(1-піперидиніл)метил]-3Тестування проводили за допомогою методу (1-оксидо-3-піридил)-4Н-1,2,4-оксадіазин відомого з літератури [Japan J. Pharmacol., 59,3397. 5,6-дигідро-5-[(4-бензил-1347 (1992) ]. SH щурів анастезіювали Нембуталом піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4(40мг/кг, і.п.), потім грудну аорту видаляли і оксадіазин поміщали в оксигенований (95% О2+5% СО2) 8. (R) або (3)-5,6-дигідро-5-[(2-оксо-1розчин Кребса-Хенселейта. Склад розчину (мМ): піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4NaCI 118, KСІ 4,7, СаСІ2 2,52, MgSO4 1,64, оксадіазин NaHCO3 24,88, KН2РО4 1,18, глюкоза 5,5. 3-мм 9. (+)-5,6-дигідро-5-[(1-піперидиніл)метил]-3-(1кільця аорти суспендували в 20мл органічної бані оксидо-3-піридил)-4Н-1,2,4-оксадіазин при 37°С. Розслаблення спокою було 1г, яке 10. (R) або (3)-5,6-дигідро-5-[(1-оксидо-1підтримували протягом урівноваження. Протягом 1 піперидиніл)метил]-3-(1-оксидо-3-піридил)-4Нгодини врівноваження, середовище змінювали 1,2,4-оксадіазин кожні 20 хвилин. Судини скорочували 10-6Μ 11. 5,6-дигідро-5-[(4-гідрокси-1метоксаміну (приблизно. 80% максимального піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4скорочення). Після досягнення максимального оксадіазин скорочення, ми досліджували одержану 12. Ν-[2-хлор-3-(1-піперидиніл)пропокси]-3вазодилацію як дію ацетилхоліну (Ach) (10 -6-104 бензімідоїлхлориду гідрохлорид М), яка інформували нас про стан ендотелію 13. N-[2-гідрокси-3-(1стінок судин. Силу скорочення вимірювали піперидиніл)пропокси]піридин-1-оксид-3використовуючи ізометричний тензометр (SG-01D, карбоксамід Experimentia Ltd), і реєстрували на ОН-850 Біологічну дію сполук винаходу досліджували поліграфі (Radelkis). В цей час знову, 5,6-дигідроза допомогою наступної методики: 5-(1-піперидиніл)-метил-3-(3-піридил)-4Н-1,2,4Дослідження мігрування рани в культурі оксадіазин, як [описано в WO 98/06400], ендотеліальних клітин використовували як контрольну сполуку. Дію сполук винаходу на пошкоджені моношари Результати цих тестів зведені в Таблиці 2. ендотеліальних клітин пупочної вени людини 13 77731 Таблиця 2 Вазо-релаксу юча дія сполу к в инаходу на гру дну аорту SH щу рів (in v itro тестув ання) Матеріали -6 10 55,1 77,4 82,5 80,3 87,0 79,7 82,3 88,4 SH контрольна n =10 Контро льна n=12; 20мг/кг Сполу ка №4, n=11; 5мг/кг Сполу ка №8, n=11; 20 мг/кг Сполу ка №9, n=10; 5мг/кг Сполу ка №11, n=12; 10мг/кг Сполу ка №12, n=12; 20мг/кг Сполу ка №13, n=10 Д ози (М) -5 10 57,2 80,2 84,9 88,0 87,9 85,1 83,5 90,3 -4 10 72,0 81,7 88,1 89,2 93,2 86,0 80,4 95,2 Як показано в таблиці, ми встановили 30% зменшення розслаблення у випадку необроблених гіпертонічних тварин, що є результатом ушкодження ендотелію індуковане гіпертонією. Сполуки, що тестуються, мають значно кращі релаксаційні властивості, що є результатом покращення функціонування ендотелію, завдяки відносному збільшення факторів ендотеліальнозалежного розслаблення. Морфологічне тестування грудних аорт використовуючи електронний мікроскоп Тестування проводили згідно з методикою відомою з літератури [Br. J. of Pharmacol., 1995; 115,415-420]. 1мм 2 шматочки стінки аорти вирізали з грудної аорти щурів, і потім фіксували 2,5% глутаральдегідом при кімнатній температурі протягом 2 годин. Після цього фіксували 1% тетроксидом осмію протягом 1 години. Після цього, шматочки тканини дегідратували етанолом і вводили в Durcupan ACM. Зразки кількісно оцінювали ґрунтуючись на даних знятих на електронному мікроскопі Hitachi 7100. Результати цього тесту приведені в Таблиці 3. Таблиця 3 Дослідження в пливу сполу к в инаходу на гру дну аорту SH щу рів за допом огою електро нного мікроскопу (мор фо логічне тестув ання) Матеріали Дози SH контроль, фі зіологічний саліну Сполу ка №4, 20мг/кг п. о. Сполу ка №8, 5мг/кг п. о. Сполу ка №9, 5мг/кг п. о. Сполу ка №11, 10мг/кг п. о. Сполу ка №12, 20мг/кг п. о. Сполу ка №13, 20мг/кг п. о. Сту пінь регенера ції розчин 1 5 5 5 4 3 4 Результати морфологічного тесту виражали на шкалі від 1 до 5, в залежності від ступеня з яким лікування різними сполуками, що тестуються, відновлювали індуковані гіпертонією пошкодження ендотелію, це, ступінь спостерігаємо!" регенераційної активності. На шкалі, 1 використовується стосовно випадків коли не спостерігалась регенерація, 2 стосується слабкої, 3 стосується середньої, 4 - доброї, і 5 - сильної регенерації. Коли порівнювати з необробленими контрольними, спостерігалась значна захисна і регенеративна дія після лікування сполуками винаходу. Під час лікування, тонкий свіжеутворений шар закривав пошкоджений 14 ендотелій, який містив клітини з активним ядром і багатою цитоплазмою. Регенерація проявляється дуже ефективно у випадку більшості сполук, що тестувались. Сполуки загальної формули (І), де Υ є атомом галогену одержували шляхом галогенування придатними сполуками, що містять гідроксильну груп у як Υ замісник. Інші сполуки винаходу одержували за допомогою відомих методик приведених [в WO 97/16439 і WO 98/06400]. Способи одержання деяких сполук показані в прикладах. Композиції винаходу можна одержати в твердій або рідкій формах, що зазвичай використовуються при лікуванні людей і в ветеринарній практиці. Для перорального введення використовують таблетки, таблетки з покриттям, драже, гранули, капсули, розчини або сиропи, для ректального введення використовують супозиторії і для парентерального введення використовують ліофілізовані або не ліофілізовані ін'єкційні або інфузійні розчини, що можуть бути одержані за відомими методиками. Пероральні композиції можуть містити наповнювачі, такі як мікрокристалічна целюлоза, крохмаль, лактоза, змащувальні агенти, такі як стеаринова кислота і стеарат магнію, покривні матеріали, такі як цукор, плівкоутворюючі матеріали, такі як гідроксиметилцелюлоза, ароматизатори або підсолоджувачи, такі як метилпарабен або сахарин, і барвники. Допоміжними агентами і супозиторіях можуть бути, наприклад, масло какао і поліетиленгліколь. Композиції для парентерального використання можуть містити салін або, необов'язково, диспергувальні і змочувальні агенти, такі як пропіленгліколь разом з активним інгредієнтом . Доза сполук винаходу залежить від пацієнта і хвороби і змінюється від 0,1 до 200мг/кг/день, переважно від 0,1 до 50мг/кг/день. Для лікування людей, переважною пероральною дозою є 10200мг, у випадку ректального застосування 1-15мг, і у випадку парентерального застосування 2-20мг на день для дорослої особи. Ці дози використовують у одиничній дозованій формі, необов'язково, розподіляють на 2-3 введення, зокрема, у випадку перорального лікування. Винахід розкривається за допомогою наступних прикладів. Приклад 1 N-[3-(1-піперидиніл)пропокси]піридин-1-оксид3-карбоксамщин 1,86г (0,033моль) КОН розчиняли в суміш 10мл етанолу і 75мл метанолу. До розчину додавали 4,59г (0,03моль) нікотинамідоксим-1оксиду. Після перемішування протягом 15хв. додавали розчин 4,85г (0,03моль) 1-хлор-3-(1піперидиніл)пропану в 6мл етанолу. Суміш кип'ятили протягом 12 годин, потім осад відфільтровували, і розчин упарювали. До залишку додавали 30мл 2N розчину карбонату калію, потім екстрагували 3 рази 50мл хлороформу. Органічну фазу промивали 15мл 2N розчину карбонату калію, сушили над безводним сульфатом магнію, фільтрували і упарювали. 15 77731 16 Неочищений продукт розтирали з 40мл Вихід: 0,74г (63%). 1 трет.бутил-метилового етеру. Цю методику Н-ЯМР (CDCI3): 8,62; 8,28; 8,18; 7,58; 4,52; повторювали і продукт одержували в дві стадії 3,1-3,6; 2,2-2,6; 1,3-1. 8. 13 перекристалізували в 1:2 суміші метанолу і С-ЯМР (CDCІ3): 148,2; 135,9; 134,0; 132,7; діетилового етеру. Ви хід: 1,72г (21%) 129,6; 125,0; 122,0; 73,7; 67,0; 65,4; 22,4; 22,1; 20,9. 1 Н-ЯМР (метанол d4): 8,62; 8,36; 7,82; 7,58; Приклад 5 4,22; 2,3-2,6; 1,92; 1,3-1,6. 2-хлор-N-[3-(4-оксидо-413 С-ЯМР (метанол d4): 149,4; 140,9; 138,0; морфолініл)пропокси]бензімідоїлхлорид 134,5; 127,9; 73,3; 57,4; 55,6; 27,4; 26,7; 25,4. Одержували згідно з Прикладом 4, відміна Приклад 2 полягає у використанні як вихідного матеріалу 2N-[3-(1-піперидиніл)пропокси]піридин-1-оксидхлор-N-[3-(43-карбоксімідоїлхлорид морфолініл)пропокси]бензімідоїлхлориду. 1,668г (6,0ммоль) N-[3-(1Вихід: 82%. піперидиніл)пропокси]піридин-1-оксид-3Приклад 6 карбоксамідину розчиняли в 1:1 суміші об. НСІ і (R,S)-5,6-дигідро-5-[(1-піперидиніл)метил]-3-(1води, потім при 0°С по краплям додавали до оксидо-3-піридил)-4Н-1,2,4-оксадіазин розчину 0,57г (8,2ммоль) NaNO2 в 4мл води. а) 18,5г (0,05моль) N-[2-гідрокси-3-(1Суміш перемішували протягом 2 годин при 0°С, піперидиніл)пропокси]-піридин-1-оксид-3потім підлуговували 15мл 20% розчину NaOH. карбоксамідин-гідрохлорид розчиняли в 50мл Потім екстрагували три рази 15мл хлороформу, тіонілхлориду, і реакційну суміш нагрівали із екстракт сушили над безводним сульфатом зворотнім холодильником протягом 1 години. натрію, фільтрували і упарювали. Залишок Потім реакційну суміш упарювали, залишок розтирали з 15мл етеру, фільтрували і сушили. розчиняли в метанолі і розчин обробляли Осад перекристалізували з 6мл ацетону. Вихід: вугіллям, фільтрували і упарювали. Залишок 1,1г (63%). кристалізували з мінімальної кількості етанолу. 1 Н-ЯМР (ДМСО d6): 8,56; 8,20; 7,98; 7,48; 2,4Вихід одержаного гідрохлориду N-[2-хлор-3-(12,6; 1,92; 1,45; 1,3. піперидиніл)пропокси]піридин-1-оксид-313 С-ЯМР (ДМСО d6): 139,6; 136,7; 132,9; 132,3; карбоксамідину становив 68%. 129,5 і 126,5; 73,6; 53,9; 52,9; 24,1; 23,5; 22,0. б) До розчину 16,5г (143,5ммоль) Приклад 3 трет.бутилату калію в 150мл трет, бутанолу N-[2-гідрокси-3-(1-піперидиніл)пропокси]-N'-ндодавали 11,8г (34,1ммоль) проміжного бутил-піридин-1-оксид-4-карбоксамідин гідрохлориду N-[2-хлор-3-(11,18г N-[2-гідрокси-3-(1піперидиніл)пропокси]піридин-1-оксид-3піперидиніл)пропокси]піридин-1-оксид-4карбоксамідину. Реакційну суміш кип'ятили карбоксімідоїлхлориду розчиняли в суміш 18мл нпротягом 5 годин, потім упарювали. До залишку бутиламіну і 10мл 2-метоксиетилового етеру. після упарювання додавали 100мл 5% розчину Реакційну суміш нагрівали із зворотнім NaOH і суміш екстрагували 3 рази 300мл холодильником протягом 24 годин, н-бутиламін етилацетату. Об'єднані екстракти сушили над упарювали з суміші і до залишку додавали 100мл сульфатом натрію, фільтрували і упарювали. 2Μ розчину карбонату калію, потім його Залишок після упарювання розтирали з етером, екстрагували 3 рази 10мл хлороформу. Екстракт фільтрували, промивали етером і сушили. сушили над безводним сульфатом натрію, Вихід: 34%. фільтрували і упарювали. Одержаний матеріал Тпл.: 154-158°С. перекристалізували з етилацетату. Приклад 7 Вихід: 0,85г (64%). 5,6-дигідро-5-[(4-бензил-1-піперидиніл)метил]1 Н-ЯМР (CDCI3): 8,18; 7,36; 5,22; 4,06; 4,04; 3-(3-піридил)-4Н-1,2,4-оксадіазин 2,97; 2,62 і 2,42; 1,2-1,7; 0,86. Одержували згідно Прикладом 6, починали з 13 С-ЯМР (CDCI3) : 153,1; 139,2; 129,2; 125,5; відповідного хлорованого амідину. 76,4; 65,5; 60,8; 54,6; 43,9; 33,3; 25,6; 23,9; 19,6; Вихід: 20%, Тпл.: 178-180°С. 13,6. Приклад 8. Приклад 4 (R) або (S)-5,6-дигідро-5-[(2-оксо-1Дигідрат N-[3-(1-оксидо-1піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4піперидиніл)пропокси]-3-нітробензімідоїлхлориду оксадіазин До розчину 1,0г (3,0ммоль) N-[3-(12,5г (9,6ммоль) (-)-5,6-дигідро-5-(1піперидиніл)пропокси]-3-нітробензімідоїлхлориду в піперидиніл)-метил-3-(3-піридил)-4Н-1,2,45мл хлороформного розчину додавали 0,725г оксадіазину розчиняли в 150мл 1% оцтової (4,2ммоль) м-хлорпербензойної кислоти в 6мл кислоти і до розчину додавали 17,86г хлороформі. Реакційну суміш перемішували (47,99ммоль) дигідрат динатрієвої солі протягом 6 годин при 25 С, потім упарювали. До етилендіамінтетраацтової кислоти і 15,3г залишку додавали 12мл 2Μ розчину карбонату (48ммоль) ацетату ртуті (іі), і реакційну суміш калію і екстрагували 5 разів 20мл хлороформу. кип'ятили протягом 2 годин при перемішуванні. Об'єднані екстракти сушили над сульфатом Потім реакційну суміш фільтрували, фільтрат магнію, фільтрували і упарювали. Продукт упарювали, до залишку додавали 500мл метанолу розчиняли в етанолі; розчин обробляли вугіллям і потім маленькими порціями 17,5г (0,46моль) потім упарювали. Одержаний матеріал розтирали натрій[тетрагідроборат(ІІІ)] при перемішуванні. з етилацетатом, фільтрували і сушили. Після додавання борогідриду його надлишок 17 77731 18 розкладали 1:1 водною хлор водневою кислотою При цій температурі по краплям додавали 20,85г (рН=3), потім рН реакційної суміші доводили до 10 (17,7 мл, 225ммоль) епіхлоргідрин і суміш використовуючи 10% розчин NaOH. Метанол перемішували протягом 3 годин. Суміш потім упарювали з реакційної суміші і потім водну фазу екстрагували 6´50мл етеру, об'єднані органічні екстрагували 3 рази 150мл хлороформу. Об'єднані фази промивали 50мл насиченого водного хлороформні фази промивали спочатку 100мл розчину хлориду натрію, сушили над Na2SO4, води, потім 50мл насиченого водного розчину обробляли вугіллям, фільтрували і упарювали. хлориду натрію, органічну фазу сушили над м=6,08г (21%) сульфатом магнію, фільтрували і упарювали. Одержаний випарюванням залишок Одержане масло (2г) очищали за допомогою переносили в 90мл етеру, прозорий розчин колонкової хроматографії (Kieselgel 60, елюент: декантували з смоли (1,18г) - етерний розчин 1:1 суміш хлороформу і метанолу), і містив 24,8ммоль епоксисполуки - і до цього кристалізували з суміші етилацетату і етеру розчину додавали 5,1г (24,8ммоль) 4(додаючи дуже маленьку кількість етанолу). бензоїлоксипіперидину розчиняли в 20мл Одержували 0,94г (35,7%) чистого матеріалу. ізопропанолу. її перемішували при кімнатній 1 Н-ЯМР: (CDC13): 8,9; 8,6; 7,92; 7,26; 6,68; 3,98; температурі протягом 6 днів, потім 3,96; 3,72-3,6; 3,42-3,22; 2,30; 1,76. відфільтровували маленьку кількість осаду і 13 С-ЯМР (CDCI3): 172,2; 150,8; 150,4; 146,9; маточний розчин упарювали. Об'єднаний 11,7г 133,2; 128,6; 123,3; 65,1; 50,7; 50,5; 50,0; 32,1; 20,9. упарений залишок переносили в 100мл води, Приклад 9. екстрагували 100мл етеру, потім 2´50мл (+)-5,6-дигідро-5-[(1-піперидиніл)метил]-3-(1етилацетату, органічні фази сушили над Na2SO4 і оксидо-3-піридил)-4Н-1,2,4-оксадіазин упарювали. 6,25г (24ммоль) (-)-5,6-дигідро-5-(1м=8,77г (88%) піперидиніл)-метил-3-(3-піридил)-4Н-1,2,4Утворення моногідрохлориду: оксадіазину розчиняли в суміші 40мл води, 6,85мл 8,77г залишку після упарювання розчиняли в (120ммоль) льодяної оцтової кислоти і 1,43мл 44мл ізопропанолу (при легкому нагріванні), потім (24ммоль) об. H2SO4. Розчин нагрівали при 60°С і додавали 3,72мл 6М НСІ/іРА. Розчин доводили до при цій температурі по краплям додавали 12мл кипіння, відокремлювали розчинену смолу. Потім її (75ммоль) 21,5% пероксиду водню і реакційну охолоджували до кімнатної температури, суміш перемішували при цій температурі. Через 10 утворювався осад моногідрохлориду. Його годин до реакційної суміші по краплям додавали кристалізували в холодильнику протягом декількох 6мл 21,5% пероксиду водню. Ще через 20 годин годин, потім відфільтровували і промивали реакційну суміш охолоджували до 0°С і по холодним ІРА. краплям виливали в 60мл 0°С 20% NaOH, потім м=7,19г (75,4%) екстрагували 5 разів 50мл диихлорметану. Тпл.: 115-120°С Об'єднані органічні фази промивали водою, Перекристалізація: 7,19г неочищеного сушили над суль фатом магнію і упарювали. продукту з 150мл гарячого ізопропанолу. Упарений залишок очищали за допомогою колон Кристалізували при охолодженні. очної хроматографії. Придатні фракції розтирали з м=5,87мг (81,5%) 20мл ацетону і витримували в холодильнику Тпл.: 117-120°С протягом ночі. На наступний день продукт 5,87г (13,5ммоль) цього моногідрохлориду фільтрували, промивали холодним ацетоном і суспендували в 60мл дихлоретану, додавали 30мл сушили, потім перекристалізували з етанолтіонілхлориду і кип'ятили протягом 1 години. її етилацетат. потім охолоджували до кімнатної температури, по Вихід: 13,7%. краплям додавали 220мл метанолу, обробляли Тпл.: 165-168°С. вугіллям, фільтрували і упарювали. 7,5г Приклад 10 одержаного залишку після випарювання (R) або (S)-5,6-дигідро-5-[(1-оксидо-1розтирали з 75мл етилацетату і кристалізували піперидиніл)метил]-3-(1-оксидо-3-піридил)-4Нохолодженням. Фільтрували, промивали холодним 1,2,4-оксадіазин етилацетатом, потім вологий осад перемішували з Одержували згідно Прикладом 9, з відміною, 50мл ацетону. Осад відфільтровували і промивали що полягає у відокремленні придатних фракцій ацетоном. колонкової хроматографії. м=5,76г (87%) Вихід: 3,4%. 5,76г (11,75ммоль) цієї "хлорсполуки" 1 Н-ЯМР (D2O): 8,38; 8,26; 7,76; 7,53; 4,6; 4,4; суспендували в 120мл трет, бутанолу, додавали 3,9; 3,55-3,1; 1,95-1,25. 8,12г (72,37ммоль) трет, бутилату калію і кип'ятили 13 С-ЯМР (D2 O): 149,7; 139,9; 136,7; 131,6; протягом 1 години. Осад фільтрували і промивали 129,1; 126,9; 69,2; 65,6; 65,5; 44,3; 20,46; 20,30 і маленькою кількістю метанолу і маточний розчин 20,17. упарювали. Одержані 8,56г залишку після Приклад 11 випарювання переносили в 40мл води, 5,6-дигідро-5-[(4-гідрокси-1екстрагували 2´30мл хлороформу, сушили і піперидиніл)метил]-3-(3-піридил)-4Н-1,2,4упарювали. Залишок (м=1,89г) розтирали з 20мл оксадіазин етилацетату, кристалізували при охолодженні, 20,55г (150ммоль) 3-піридинамідоксиму і 20,1г відфільтровували і промивали ЕeOАс. (360ммоль) гідроксиду калію розчиняли в 95мл м=1,19г води і 28,5мл ДМСО, потім охолоджували до 0°С. Перекристалізували: 1,19мг неочищеного 19 77731 20 продукту з 13мл гарячого ізопропанолу. Приклад 15 Кристалізували при охолодженні. Капсули м=605мг 5,6-дигідро-5-[(1-піперидиніл)-метилТпл.: 170-173°С 3-(3-піридил)-4Н-1,2,4-оксадіазин 20,0мг 1 Н-ЯМР (досліджений зразок: PM-720-cs 5; мікрокристалічна целюлоза 99,0мг розчинник: CDCI3+ДMCO; стандарт: CDCI3; МГц: аморфний силікагель 1,0мг 300) [м.ч.]: 8,8 8,5 7,9 7,3 (м, 4Н, ароматичні Активний інгредієнт змішували з протони); 6,1 (м, 1Н, NH); 4,02 (м, 1Н, ОСН2); 3,74 наповнювачами, суміш гомогенізували і (м, 1Н, СН); 3,62 (м, 1Н, СН-ОН); 3,5 (м, 1Н, ОСН2); наповнювали нею желатинові капсули. Приклад 16 2,9-2,3 (м, 6Н, 3´CH2N); 1,9-1,52 (м, 4Н, 2´СН2); 13 Драже С-ЯМР (досліджений зразок: PM-720-cs 5; Дигідрат N-[3-(1-оксидо-1розчинник: CDCI3+ДMCO; стандарт: CDCI3; МГц: 75,4) [м.ч.]: 150,4 (C=N); 150,9 146,9 133,5 128,6 піперидиніл) пропокси]-3нітробензімідоїлхлориду 123,3 (5С, Руr-атоми вуглецю); 66,6 (ОСН2); 66,4 25,0мг лактоза 82,5мг (СН-ОН); 59,4 (CH2N); 51,8 (CH2N); 50,7 (CH2N); картопляний крохмаль 33,0мг 46,3 (CHN); 33,8 (2C, 2´CH2) полівінілпіролідон 4,0мг Приклад 12 стеарат магнію 0,5мг Гідрохлориду N-[2-хлор-3-(1Активний інгредієнт і полівінілпіролідон піперидиніл)пропокси]-3-бензімідоїлхлорид розчиняли в етанолі. Змішували лактозу і 2,0г гідрохлориду N-[2-гідрокси-3-(1картопляний крохмаль, і суміш рівномірно піперидиніл)пропокси]бензімідоїлхлориду зволожували гранулювальним розчином активного розчиняли в 10мл тіонілхлориду, потім розчин інгредієнту. Після просівання, вологі гранули кип'ятили протягом 2 годин. Відганяли сушили при 50°С і просівали. Додавали стеарат тіонілхлорид; залишок після упарювання магнію і гранули пресували в ядра драже, на які переносили в 50мл метанолу, потім упарювали. потім наносили покриття з цукру і полірували Світло-жовтий залишок після упарювання бджолиним воском. (м=2,48г) розчиняли в 12,5мл етанолу і Приклад 17 кристалізували з 50мл етеру. Відокремлювали Супозиторії осад фільтруванням і промивали суміш 5,6-дигідро-5-[(4-бензил-1етанол/етер. піперидиніл)метил]-3-(3-піридил)-4Нм=1,68г 1,2,4-оксадіазин 4,0мг Тпл.: 154,5-158°С масло какао 3,5г Перекристалізували: розчиняли 320мг в 1мл твердий жир 50 супозиторійна маса 15,0г гарячого МеОН, потім осаджували 3мл етеру. Масло какао і супозиторійну масу нагрівали Осаджений осад відфільтровували і промивали. при 40°С, активний інгредієнт диспергували в м=210мг розплаві, потім масу виливали в супозиторійні Тпл.: 155,5-160°С (кор.) форми. Приклад 13 Приклад 18 N-[2-гідрокси-3-(1Розчин піперидиніл)пропокси]піридин-1-оксид-3Гідрохлорид 5,6-дигідро-5-[(4карбоксамід гідрокси-1-піперидиніл)-метил]-3-(34,0г N-[2-гідрокси-3-(1піридил)-4Н-1,2,4-оксадіазину 500мг піперидиніл)пропокси]піридин-1-оксид-3сорбіт 10г карбоксімідоїлхлориду перемішували в 120мл 0,2N сахарат натрію 0,05г NaOH при 60°С протягом 5 днів. Розчин двічі дистильована вода до 100мл нейтралізували водною хлор водневою кислотою, Приклад 19 упарювали, залишок розтирали з етанолом і Ін'єкція одержаний розчин знову упарювали. Залишок Гідрохлорид Ν-[2-хлор-3-(1кристалізували з ізопропанолу, відфільтровували і піперидиніл)пропокси]-3одержаний 1,0г неочищеного продукту бензімідоїлхлорид 2мг перекристалізували з ізопропанолу, що кипить. фізіологічний розчин саліну, Вихід: 0,8г пірогенвільний, стерильний до 2,0мл Тпл.: 143-147°С Розчином наповнювали 2мл ампули і ампули Приклад 14 запаювали. Таблетки Приклад 20 (+)-5,6-дигідро-5-[(1Інфузійний розчин піперидиніл)метил-3-(3-піридил)-4НІнфузійний розчин з об'ємом 500мл 1,2,4-оксадіазин 20,0мг одержували з наступним складом: кукурудзяний крохмаль 100,0мг Метансуль фонат N-[2-гідрокси-3-(1лактоза 95,0мг піперидиніл)-пропокси]піридин-1тальк 4,5мг оксид-3-карбоксамід 20мг стеарат магнію 0,5мг фізіологічний розчин саліну, до Активну сполуку добре розмелювали, пірогенвільний, стерильний 500,0мл змішували з наповнювачами, суміш гомогенізували і гранулювали. Гранулят пресували в таблетки. 21 Комп’ютерна в ерстка Т. Чепелев а 77731 Підписне 22 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCarboxaniidine derivatives and use thereof in the treatment of vascular diseases
Назва патенту російськоюПроизводные карбоксамидина и их применение при лечении васкулярных заболеваний
МПК / Мітки
МПК: C07D 295/22, A61P 9/00, C07D 295/088, A61K 31/4545, A61K 31/4406, A61K 31/5395, C07D 213/89, A61K 31/5375, C07D 295/08, C07D 413/04, A61K 31/45, C07D 413/14
Мітки: карбоксамідину, васкулярних, похідні, застосування, захворювань, лікуванні
Код посилання
<a href="https://ua.patents.su/11-77731-pokhidni-karboksamidinu-i-kh-zastosuvannya-pri-likuvanni-vaskulyarnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Похідні карбоксамідину і їх застосування при лікуванні васкулярних захворювань</a>
Попередній патент: Заміщені 2-тіо-3,5-диціано-4-феніл-6-амінопіридини та їх використання
Наступний патент: Безконтактна електрична синхронна машина з дисковим ротором
Випадковий патент: Спосіб контролю якості діелектричних речовин












