Ціанопіримідинове похідне
Номер патенту: 105919
Опубліковано: 10.07.2014
Автори: Сінохара Хісасі, Юкі Йохей, Хіно Кейсуке, Ямазакі Хіроюкі, МІТІКАМІ ДАЙСАКУ, Іто Куні, Сато Норіфумі, Такедзі Ясухіро
Формула / Реферат
1. Ціанопіримідинова сполука формули (1):
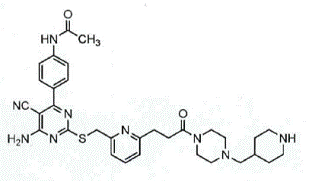 (1)
(1)
або її сіль.
2. N-(4-(6-аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетамід або його сіль.
3. Фармацевтична композиція, що містить сполуку за п. 1 або 2 або її сіль і фармацевтично прийнятний носій.
4. Фармацевтична композиція за п. 3 для лікування або профілактики очного захворювання.
5. Фармацевтична композиція за п. 4 для лікування або профілактики глаукоми.
6. Спосіб лікування очного захворювання, що включає введення ссавцеві або людині, що потребує такого лікування, ефективної кількості сполуки за п. 1 або 2 або її солі.
7. Водний рідкий препарат, що містить фармацевтичну композицію за п. 3.
8. Водний рідкий препарат за п. 7, який додатково містить одну або декілька добавок, вибраних з фармацевтично прийнятного буфера, ізотонічного засобу, консерванту, солюбілізатора і регулятора рН.
9. Водний рідкий препарат за п. 8, де буфер вибирають з бурштинової кислоти, борної кислоти, фосфорної кислоти, амінокислоти і її фармацевтично прийнятної солі.
10. Водний рідкий препарат за п. 9, де буфер являє собою бурштинову кислоту.
11. Водний рідкий препарат за п. 7, де ізотонічний засіб являє собою один або два ізотонічні засоби, вибрані з глюкози, сорбіту, маніту, хлориду натрію, хлориду калію, пропіленгліколю і гліцерину.
12. Водний рідкий препарат за п. 8, де консервант вибирають з хлориду бензалконію, хлориду бензетонію, броміду бензододецинію, глюконату хлоргексидину, метил-пара-оксибензоату, пропіл-пара-оксибензоату, хлорбутанолу і бензилового спирту.
13. Водний рідкий препарат за будь-яким з пп. 7-12, де значення рН становить приблизно від 5,0 до 9,0.
Текст
Реферат: Даний винахід стосується нової ціанопіримідинової сполуки формули (1) і фармацевтичної композиції, які мають безпечний і сильний агоністичний вплив відносно аденозинового А2а рецептора. UA 105919 C2 (12) UA 105919 C2 UA 105919 C2 5 10 15 20 25 30 35 40 45 Галузь техніки, до якої належить винахід Даний винахід стосується нової ціанопіримідинової сполуки і фармацевтичної композиції і складу, що містять дану сполуку. Рівень техніки Аденозин являє собою речовину, яка може виявляти різну фізіологічну активність при зв'язуванні з рецептором на поверхні клітини. Аденозиновий рецептор на поверхні клітини належить до сімейства рецепторів, зв'язаних з G білками, і класифікований на A1, A2a, A2b і A3. Серед них аденозинові А1 і А3 рецептори зв'язані з Gi-білком, і їх активація приводить до зниження внутрішньоклітинного вмісту цАМФ. У доповнення, аденозинові А2а і А2b рецептори зв'язані з Gs-білком, і їх активація приводить до підвищення внутрішньоклітинного вмісту цАМФ. Вказані 4 види підтипів аденозинових рецепторів були клоновані. Вже повідомлялося про дослідження цілого ряду агоністів і антагоністів, які можуть впливати на кожний з вищеперелічених підтипів аденозинових рецепторів. У них повідомлялося, що агоністи аденозинового А2а рецептора не тільки виявляють сильну антигіпертензивну дію і застосовні як згадані вище ліки, такі як гіпотензивний засіб, ліки для лікування/профілактики ішемічної хвороби серця і головного мозку і антиартеріосклеротичний засіб, але також виявляє внутрішньоочну гіпотензивну дію (див. J. Pharmcol. Exp. Ther. 320-326, 273 (1995). У WO 2005/105778 розкриті ціанопіримідинові сполуки, які є агоністами аденозинового А2а рецептора. Однак в WO 2005/105778 не розкриті які-небудь конкретні ціанопіримідинові сполуки подібно до даного винаходу. Розкриття суті винаходу Задача, яка підлягає вирішенню даним винаходом Метою даного винаходу є надання нової сполуки, що має безпечну і сильну агоністичну активність відносно аденозинового А2а рецептора. Засоби вирішення задачі Автори даного винаходу провели широкі дослідження для досягнення згаданої мети, і виявили, що наступні сполуки виявили сильну агоністичну активність відносно аденозинового А2а рецептора, а також чудову безпеку. У доповнення, автори даного винаходу також виявили, що наступні сполуки виявили судинорелаксуючу дію на циліарну артерію ока і нейропротекторну дію на гангліозні клітини сітківки. Даний винахід був оформлений шляхом проведення додаткових досліджень, основаних на вказаних відкриттях. Даний винахід стосується ціанопіримідинової сполуки, представленої в наступному Пункті 1, композиції, що містить сполуку, і складу, використання сполуки, способу лікування або профілактики захворювання і методу отримання сполуки. Пункт 1. Ціанопіримідинова сполука формули (1): , в якій R являє собою атом водню, гідрокси(нижчий алкіл)групу, галоїд(нижчий алкіл)групу або (нижча алкокси)карбоніл(нижчий алкіл)групу, або її сіль. Пункт 2. Ціанопіримідинова сполука за пунктом 1, яку вибирають з групи, яка складається з (1) N-(4-(6-аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1іл)пропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду, (2) N-(4-(6-аміно-5-ціано-2-((6-(3-(4-((1-(2-гідроксіетил)піперидин-4-іл)метил)піперазин-1-іл)3-оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду, (3) N-(4-(6-аміно-5-ціано-2-((6-(3-(4-((1-(3-гідроксипропіл)піперидин-4-іл)метил)піперазин-1іл)-3-оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду, (4) N-(4-(6-аміно-5-ціано-2-((6-(3-(4-((1-(2-фторетил)піперидин-4-іл)метил)піперазин-1-іл)-3оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду, і 1 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 (5) N-(4-(6-аміно-5-ціано-2-((6-(3-(4-((1-(2-метоксикарбонілетил)піперидин-4іл)метил)піперазин-1-іл)-3-оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду, або її солі. Пункт 3. Фармацевтична композиція, що містить сполуку за пунктом 1 або 2 або її солі і фармацевтично прийнятний носій. Пункт 4. Фармацевтична композиція за пунктом 3 для лікування або профілактики очного захворювання. Пункт 5. Фармацевтична композиція за пунктом 4 для лікування або профілактики глаукоми. Пункт 6. Застосування сполуки за пунктом 1 або 2 або її солі як агоніста аденозинового A2a рецептора. Пункт 7. Спосіб лікування очного захворювання, який включає введення ссавцеві або людині, що потребує такого лікування, ефективної кількості сполуки за пунктом 1 або 2 або її солі. Пункт 8. Водний рідкий препарат, що містить фармацевтичну композицію за пунктом 3. Пункт 9. Водний рідкий препарат за пунктом 8, який додатково містить одну або декілька добавок, вибраних з фармацевтично прийнятного буфера, ізотонічного засобу, консерванту, солюбілізатора і регулятора pH. Пункт 10. Водний рідкий препарат за пунктом 9, де буфер вибирають з янтарної кислоти, борної кислоти, фосфорної кислоти, амінокислоти і її фармацевтично прийнятної солі. Пункт 11. Водний рідкий препарат за пунктом 10, де буфер являє собою янтарну кислоту. Пункт 12. Водний рідкий препарат за пунктом 8, де ізотонічний засіб являє собою один або два ізотонічні засоби, вибрані з глюкози, сорбіту, маніту, хлориду натрію, хлориду калію, пропіленгліколю і гліцерину. Пункт 13. Водний рідкий препарат за пунктом 9, де консервант вибирають з хлориду бензалконію, хлориду бензетонію, броміду бензододецинію, глюконату хлоргексидину, метилпара-оксибензоату, пропіл-пара-оксибензоату, хлорбутанолу і бензилового спирту. Пункт 14. Водний рідкий препарат за будь-яким з пунктів 8-13, де значення pH складає приблизно від 5,0 до 9,0. Кожна група, визначена в згаданій вище загальній формулі, конкретно означає наступне. "Атом галогену", що використовується в даному документі, включає атоми фтору, хлору, брому і йоду. "(Нижча алкокси)карбонільна група", що використовується в даному документі, включає алкоксикарбонільну групу, в якій алкокси-фрагмент являє собою нерозгалужену або розгалужену алкоксигрупу, що містить 1-6 атомів вуглецю. Більш детально, вона включає, наприклад, метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл, нбутоксикарбоніл, ізобутоксикарбоніл, трет-бутоксикарбоніл, втор-бутоксикарбоніл, нпентилоксикарбоніл, неопентилоксикарбоніл, н-гексилоксикарбоніл, ізогексилоксикарбоніл, 3метилпентилоксикарбоніл, і тому подібне. "Галоїд(нижчий алкіл)група", що використовується в даному документі, включає нижчу алкільну групу (переважно нерозгалужену або розгалужену алкільну групу, що містить 1-6 атомів вуглецю), заміщену 1-7 атомами галогену, переважно, 1-3 атомами галогену. Більш детально, вона включає, наприклад, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, бромметил, дибромметил, фторметил, 2,2-дифторетил, 2,2,2трифторетил, пентафторетил, 2-фторетил, 2-хлоретил, 3,3,3-трифторпропіл, гептафторпропіл, 2,2,3,3,3-пентафторпропіл, гептафторізопропіл, 3-хлорпропіл, 2-хлорпропіл, 3-бромпропіл, 4,4,4трифторбутил, 4,4,4,3,3-пентафторбутил, 4-хлорбутил, 4-бромбутил, 2-хлорбутил, 5,5,5трифторпентил, 5-хлорпентил, 6,6,6-трифторгексил, 6-хлоргексил, перфторгексил, і тому подібне. "Гірокси(нижчий алкіл)група", що використовується в даному документі, включає згадану вище нижчу алкільну групу (переважно нерозгалужену або розгалужену алкільну групу, що містить 1-6 атомів вуглецю), заміщену 1-5 гідроксигрупами, переважно, 1-3 гідроксигрупами. Більш детально, вона включає, наприклад, гідроксиметил, 2-гідроксіетил, 1-гідроксіетил, 3гідроксипропіл, 2,3-дигідроксипропіл, 4-гідроксибутил, 3,4-дигідроксибутил, 1,1-диметил-2гідроксіетил, 5-гідроксипентил, 6-гідроксигексил, 3,3-диметил-3-гідроксипропіл, 2-метил-3гідроксипропіл, 2,3,4-тригідроксибутил, пергідроксигексил, і тому подібне. "(Нижча алкокси)карбоніл(нижчий алкіл)група", що використовується в даному документі, включає згадану вище нижчу алкільну групу (переважно нерозгалужену або розгалужену алкільну групу, що містить 1-6 атомів вуглецю), що містить 1-3 (переважно 1-2) згадані вище (нижча алкокси)карбонільні групи (переважно нерозгалужені або розгалужені алкоксикарбонільні групи, що містять 1-6 атомів вуглецю). Більш детально, вона включає, 2 UA 105919 C2 5 10 15 20 25 30 наприклад, метоксикарбонілметил, етоксикарбонілметил, 1-метоксикарбонілетил, 2метоксикарбонілетил, 2-етоксикарбонілетил, 1-етоксикарбонілетил, 2-трет-бутоксикарбонілетил, 3-метоксикарбонілпропіл, 3-етоксикарбонілпропіл, 4-етоксикарбонілбутил, 5ізопропоксикарбонілпентил, 6-н-пропоксикарбонілгексил, 1,1-диметил-2-н-бутоксикарбонілетил, 1-метил-1-метоксикарбонілетил, 2-метил-1-метоксикарбонілпропіл, 2-метил-3-третбутоксикарбонілпропіл, 3-метил-1-метоксикарбонілбутил, диетоксикарбонілметил, 1,2діетоксикарбонілетил, 2-н-пентилоксикарбонілетил, н-гексилоксикарбонілметил, і тому подібне. Піримідинові похідні, позначені згаданою вище загальною формулою (1), можуть бути отримані різними способами. Як приклад, похідні можуть бути отримані відповідно до наступних схем 1-4. Схема 1 , де Ra являє собою гідрокси(нижчий алкіл)групу, галоїд(нижчий алкіл)групу або (нижча алкокси)карбоніл(нижчий алкіл)групу; X являє собою атом галогену або групу, яка може брати участь в реакції заміщення подібно атому галогену. Атом галогену, який позначений як X в сполуці формули (2), включає атоми фтору, хлору, брому і йоду. Група, яка може брати участь в реакції заміщення подібно атому галогену, позначена як X, включає, наприклад, відхідну групу, таку як (нижчий алкан)сульфонілоксигрупа і арилсульфонілоксигрупа. "(Нижчий алкан)сульфонілоксигрупа", що використовується в даному документі, включає нерозгалужену або розгалужену алкансульфонілоксигрупу, що містить 1-6 атомів вуглецю; більш детально, вона включає, наприклад, метансульфонілокси, етансульфонілокси, ізопропансульфонілокси, н-пропансульфонілокси, н-бутансульфонілокси, третбутансульфонілокси, н-пентансульфонілокси, н-гексансульфонілокси, і тому подібне. "Арилсульфонілоксигрупа", що використовується в даному документі, включає, наприклад, фенілсульфонілоксигрупу, нафтилсульфонілоксигрупу, і тому подібне. Феніл може містити 1-3 замісники, вибрані з групи, яка складається, наприклад, з нерозгалуженої або розгалуженої алкільної групи, що містить 1-6 атомів вуглецю, нерозгалуженої або розгалуженої алкоксигрупи, що містить 1-6 атомів вуглецю, нітрогрупи і атома галогену. Конкретні приклади 3 UA 105919 C2 5 10 15 20 25 30 35 40 арилсульфонілоксигрупи включають, наприклад, фенілсульфонілокси, 4метилфенілсульфонілокси, 2-метилфенілсульфонілокси, 4-нітрофенілсульфонілокси, 4метоксифенілсульфонілокси, 2-нітрофенілсульфонілокси, 3-хлорфенілсульфонілокси, і тому подібне. Конкретні приклади нафтилсульфонілоксигрупи включають, наприклад, αнафтилсульфонілокси, β-нафтилсульфонілокси, і тому подібне. Сполука формули (1b) може бути отримана шляхом здійснення взаємодії Сполуки (1a) і Сполуки (2). Реакцію, як правило, проводять в традиційному розчиннику, який не позначається негативно на реакції, наприклад, у воді; в спиртовому розчиннику, такому як метанол, етанол, ізопропанол, н-бутанол, трифторетанол і етиленгліколь; в кетоновому розчиннику, такому як ацетон або метилетилкетон; в ефірному розчиннику, такому як тетрагідрофуран, діоксан, діетиловий ефір і диглім; в складноефірному розчиннику, такому як метилацетат або етилацетат; в апротонному полярному розчиннику, такому як ацетонітрил, N, N-диметилформамід і диметилсульфоксид; в галогенвуглеводневому розчиннику, такому як хлористий метилен і хлористий етилен; або в інших органічних розчинниках. Крім того, реакція може проводитися в суміші згаданих вище традиційних розчинників. Згадані вище реакції, як правило, проводять в присутності основи. Основа включає, загалом, неорганічну основу або органічну основу. "Неорганічна основа", що використовується в даному документі, включає, наприклад, лужний метал, такий як натрій і калій; гідрокарбонат лужного металу, такий як гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію; гідроксид лужного металу, такий як гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид цезію; карбонат лужного металу, такий як карбонат літію, карбонат натрію, карбонат калію і карбонат цезію; нижчий алкоксид лужного металу, такий як метоксид натрію і етоксид калію, гідрид лужного металу, такий як гідрид натрію і гідрид калію; і тому подібне. "Органічна основа", яка використовується в даному документі, включає, наприклад, триалкіламін, такий як триметиламін, триетиламін і N-етилдіізопропіламін; піридин; хінолін; піперидин; імідазол; піколін; диметиламінопіридин; диметиланілін; N-метилморфолін; 1,5діазабіцикло[4.3.0]нон-5-ен (DBN); 1,4-діазабіцикло[2.2.2]октан (DABCO); 1,8діазабіцикло[5.4.0]ундец-7-ен (DBU); і тому подібне. Основа може використовуватися як єдиний інгредієнт або в будь-якому поєднанні двох або більше інгредієнтів. Кількість основи, що використовується, як правило, є 0,5-10-кратною в молярному відношенні відносно Сполуки (1a), переважно 0,5-6-кратною в молярному відношенні відносно Сполуки (1a). Якщо основа є рідкою, то вона може також використовуватися як розчинник. За необхідності, описане вище реакційне середовище може містити йодид лужного металу, такий як йодид калію або йодид натрію, як прискорювач реакції. Співвідношення між Сполукою (1a) і Сполукою (2), що використовуються в представленій вище Схемі 1, становить, принаймні, 1 моль, переважно, 1-5 моль, Сполуки (2) на 1 моль Сполуки (1a). Температура реакції не обмежується, і реакція, як правило, може проводитися при охолоджуванні, при кімнатній температурі або при нагріванні. Переважно, представлена вище реакція може проводитися приблизно при кімнатній температурі протягом 1-30 годин. 4 UA 105919 C2 Схема 2 5 10 15 20 25 , де значення R визначена вище. Сполука (1) може бути отримана шляхом здійснення взаємодії Сполуки (3) або її реакційноздатного похідного, в якому активована карбоксильна група, і Сполуки (4) або її реакційноздатного похідного, в якому активована іміногрупа. Переважна реакційноздатна форма карбоксильної групи в Сполуці (3) включає галоїдангідрид, ангідрид кислоти, активний амід, активний складний ефір, і тому подібне. Переважні приклади реакційноздатної форми карбоксильної групи включають хлорангідрид; азид кислоти, змішаний ангідрид захищеної фосфорної кислоти (наприклад, діалкілфосфорна кислота, фенілфосфорна кислота, дифенілфосфорна кислота, дибензилфосфорна кислота і галоїдзаміщена фосфорна кислота), діалкілфосфорної кислоти, сірчастої кислоти, тіосірчаної кислоти, сірчаної кислоти, сульфонової кислоти (наприклад, метансульфонова кислота), аліфатичної кислоти (наприклад, оцтова кислота, пропіонова кислота, масляна кислота, ізомасляна кислота, півалева кислота, валеріанова кислота, ізовалеріанова кислота, 2етилмасляна кислота, трихлороцтова кислота) або ароматичної кислоти (наприклад, бензойна кислота); симетричний ангідрид кислоти; активний амід імідазолу, 4-заміщеного імідазолу, диметилпіразолу, триазолу або тетразолу; активний складний ефір (наприклад, складний ціанометиловий ефір, складний метоксиметиловий ефір, складний диметилімінометиловий ефір, складний вініловий ефір, складний пропаргіловий ефір, складний пара-нітрофеніловий ефір, складний 2,4-динітрофеніловий ефір, складний трихлорфеніловий ефір, складний пентахлорфеніловий ефір, складний мезилфеніловий ефір, і тому подібне) або складний ефір з N-гідроксисполукою (наприклад, N, N-диметилгідроксиламін, 1-гідрокси-2-(1H)-піридон, Nгідроксисукцинімід, N-гідроксифталімід, 1-гідрокси-1H-бензотриазол, і тому подібне). Залежно від типу Сполуки (3), що підлягає використанню, можливий вибір будь-якої загальнодоступної сполуки із вказаних реакційноздатних похідних. У тому випадку, коли в представленій вище реакції Сполуку (3) використовують як вільну кислоту або її сіль, реакцію переважно проводять в присутності конденсуючого агента. Конденсуючий агент включає традиційний і добре відомий агент, наприклад, N, N' 5 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 дихлоргексилкарбодіімід; N-циклогексил-N'-мофоліноетилкарбодіімід; N-циклогексил-N'-(4діетиламіноциклогексил)карбодіімід; N, N'-діетилкарбодіімід; N, N'-діізопропілкарбодіімід; Nетил-N'-(3-диметиламінопропіл)карбодіімід або його гідрохлорид; N, N'-карбонілбіс(2метилімідазол); пентаметиленкетен-N-циклогексилімін; дифенілкетен-N-циклогексилімін; етоксіацетилен, 1-алкокси-1-хлоретилен; триалкілфосфит; етилполіфосфат; ізопропілполіфосфат; оксихлорид фосфору (сульфонілхлорид); трихлорид фосфору; дифенілсульфонілазид; тіонілхлорид; оксалілхлорид; (нижчий алкіл)галоїдформіат (наприклад, етилхлороформіат, ізопропілхлороформіат, і тому подібне); трифенілфосфін, сіль 2-етил-7гідроксибензизоксазолію; внутрішня сіль 2-етил-5-(мета-сульфонфеніл)ізоксазолію гідроксиду; бензотразол-1-ілокситрис(диметиламіно)фосфонію гексафторфосфат; 1-(парахлорбензолсульфонілокси)-6-хлор-1H-бензотриазол; реагент Вільсмайєра, який отримують шляхом здійснення взаємодії N, N-диметилформаміду з тіонілхлоридом, фосгеном, трихлорметилхлороформіатом, оксихлоридом фосфору, і тому подібне. Більш переважно, реакцію проводять в присутності згаданого вище конденсуючого агента в поєднанні з активним естерифікуючим агентом, таким як N-гідроксисукцинімід, N-гідроксифталимід і 1-гідрокси-1Hбензотриазол. Переважне реакційноздатне похідне іміногрупи в Сполуці (4) включає іміногрупу типу основи Шиффа або її таутомер типу енаміну, який отримують шляхом здійснення взаємодії Сполуки (4) і карбонільної сполуки, такої як альдегід або кетон; силільне похідне, яке отримують шляхом здійснення взаємодії Сполуки (4) і силільної сполуки, такої як біс(триметилсиліл)ацетамід, моно(триметилсиліл)ацетамід і біс(триметилсиліл)сечовина; похідне, яке отримують шляхом здійснення взаємодії Сполуки (4) і трихлорид фосфору, фосгену, і тому подібне. Реакцію, як правило, проводять в традиційному розчиннику, який не позначається негативно на реакції, наприклад, у воді; в спиртовому розчиннику, такому як метанол, етанол, ізопропанол, н-бутанол, трифторетанол і етиленгліколь; в кетоновому розчиннику, такому як ацетон або метилетилкетон; в ефірному розчиннику, такому як тетрагідрофуран, діоксан, діетиловий ефір, діізопропіловий ефір і диглім; в сладноефірному розчиннику, такому як метилацетат або етилацетат; в апротонному полярному розчиннику, такому як ацетонітрил, N, Nдиметилформамід і диметилсульфоксид; у вуглеводневому розчиннику, такому як н-пентан, нгексан, н-гептан і циклогексан; в галогенвуглеводневому розчиннику, такому як хлористий метилен і хлористий етилен; або в інших органічних розчинниках. Крім того, реакція може проводитися в суміші згаданих вище традиційних розчинників. Представлена вище реакція може проводитися в присутності основи. Основа включає цілий ряд відомих неорганічних і органічних основ. "Неорганічна основа", що використовується в даному документі, включає, наприклад, лужний метал, такий як натрій і калій; гідрокарбонат лужного металу, такий як гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію; гідроксид лужного металу, такий як гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид цезію; карбонат лужного металу, такий як карбонат літію, карбонат натрію, карбонат калію і карбонат цезію; нижчий алкоксид лужного металу, такий як метоксид натрію і етоксид калію, гідрид лужного металу, такий як гідрид натрію і гідрид калію; і тому подібне. "Органічна основа", що використовується в даному документі, включає, наприклад, триалкіламін, такий як триметиламін, триетиламін і N-етилдіізопропіламін; піридин; хінолін; піперидин; імідазол; піколін; диметиламінопіридин; диметиланілін; N-метилморфолін; 1,5- діазабіцикло[4.3.0]нон-5ен (DBN); 1,4-діазабіцикло[2.2.2]октан (DABCO); 1,8- діазабіцикло[5.4.0]ундец-7-ен (DBU); і тому подібне. Якщо основа є рідкою, то вона може також використовуватися як розчинник. Основа може використовуватися як єдиний інгредієнт або в будь-якому поєднанні двох або більше інгредієнтів. Кількість основи, що використовується, як правило, є 0,1-10-кратною в молярному відношенні відносно Сполуки (3), переважно 0,1-3-кратною в молярному відношенні відносно Сполуки (3). Співвідношення між Сполукою (3) і Сполукою (4), що використовуються в представленій вище Схемі 2, становить, принаймні, 1 моль, переважно 1-5 моль, Сполуки (3) на 1 моль Сполуки (4). Температура реакції не обмежується, і реакція, як правило, може проводитися при охолоджуванні, при кімнатній температурі або при нагріванні. Переважно, представлена вище реакція може проводитися при температурі від кімнатної температури до 100 °C протягом від 30 хвилин до 30 годин, переважно, протягом від 30 хвилин до 5 годин. Сполука (3), використана як вихідна речовина в представленій вище реакції, є добре відомою сполукою, і методика отримання цієї сполуки описана нижче (Схема 4). 6 UA 105919 C2 Схема 3 5 10 , де W являє собою N-захисну групу. Сполука (6) може бути отримана шляхом здійснення взаємодії Сполуки (3) і Сполуки (5) способом, аналогічним представленому на Схемі 2. Крім того, Сполука (1a) може бути отримана шляхом видалення N-захисної групи. N-захисна група, позначена в даному документі. як W, включає, наприклад, (нижча алкокси)карбонільну групу, нижчу алканоїльну групу, арилзаміщену (нижчий алкіл)групу, і тому подібне. "(Нижча алкокси)карбонільна група", що використовується в даному документі, включає нерозгалужену або розгалужену алкоксикарбонільну групу, що містить 1-6 атомів вуглецю, 7 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 наприклад, метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл, бутоксикарбоніл, третбутоксикарбоніл, пентилоксикарбоніл, гексилоксикарбоніл, і тому подібне. "Нижча алканоїльна група", що використовується в даному документі, включає нерозгалужену або розгалужену алканоїльну групу, що містить 1-6 атомів вуглецю, наприклад, форміл, ацетил, пропіоніл, бутирил, ізобутирил, пентаноїл, трет-бутилкарбоніл, гексаноїл, і тому подібне. "Арилзаміщена (нижчий алкіл)група", що використовується в даному документі, включає, наприклад, бензил, 2-фенілетил, 1-фенілетил, 3-фенілпропіл, 4-фенілбутил, 5-фенілпентил, 6фенілгексил, дифенілметил, тритил, і тому подібне, і нерозгалужену або розгалужену алкільну групу, що містить 1-6 атомів вуглецю, яка заміщена 1-3 фенільними групами. Замісник фенільної групи включає, наприклад, нерозгалужену або розгалужену алкільну групу, що містить 1-6 атомів вуглецю, яка може бути необов'язково заміщена 1-3 групами, вибраними з групи, яка складається з атома галогену і гідроксигрупи (наприклад, метил, етил, пропіл, nбутил, втор-бутил, трет-бутил, н-пентил, н-гексил, гідроксиметил, 2-гідроксіетил, 1-гідроксіетил, 3-гідроксипропіл, 2,3-дигідроксипропіл, 4-гідроксибутил, 1,1-диметил-2-гідроксіетил, 5,5,4тригідроксипентил, 5-гідроксипентил, 6-гідроксигексил, 1-гідроксіізопропіл, 2-метил-3гідроксипропіл, трифторметил, трихлорметил, хлорметил, бромметил, фторметил, йодметил, дифторметил, дибромметил, 2-хлоретил,2,2,2-трифторетил, 2,2,2-трихлоретил, 3-хлорпропіл, 2,3-дихлорпропіл, 4,4,4-трихлорбутил, 4-фторбутил, 5-хлорпентил, 3-хлор-2-метилпропіл, 5бромгексил, 5,6-дихлоргексил, 3-гідрокси-2-хлорпропіл, і тому подібне); нерозгалужену або розгалужену алкоксигрупу, що містить 1-6 атомів вуглецю, яка може бути необов'язково заміщена 1-3 групами, вибраними з групи, яка складається з атома галогену і гідроксигрупи (наприклад, метокси, етокси, пропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси, нгексилокси, гідроксиметокси, 2-гідроксіетокси, 1-гідроксіетокси, 3-гідроксипропокси, 2,3дигідроксипропокси, 4-гідроксибутокси, 1,1-диметил-2-гідроксіетокси, 5,5,4тригідроксипентилокси, 5-гідроксипентилокси, 6-гідроксигексилокси, 1-гідроксіізопропокси, 2метил-3-гідроксипропокси, трифторметокси, трихлорметокси, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, дибромметокси, 2-хлоретокси, 2,2,2-трифторетокси, 2,2,2-трихлоретокси, 3-хлорпропокси, 2,3-дихлорпропокси, 4,4,4-трихлорбутокси, 4фторбутокси, 5-хлорпентилокси, 3-хлор-2-метилпропокси, 5-бромгексилокси, 5,6дихлоргексилокси, 3-гідрокси-2-хлорпропокси, і тому подібне); і атом галогену (наприклад, атома фтору, брому, хлору, йоду). У тому випадку, коли на фенільній групі присутні 2 або більше замісників, замісники можуть бути однаковими або різними. Видалення N-захисної групи: W може проводитися традиційним способом, таким як гідроліз і гідрування. Реакцію, як правило, проводять у прийнятному розчиннику, який не позначається негативно на реакції, наприклад, у воді; в спиртовому розчиннику, такому як метанол, етанол, ізопропанол, н-бутанол, трифторетанол і етиленгліколь; в кетоновому розчиннику, такому як ацетон або метилетилкетон; в ефірному розчиннику, такому як тетрагідрофуран, діоксан, діетиловий ефір, диметоксіетан і диглім; в сладноефірному розчиннику, такому як метилацетат або етилацетат; в апротонному полярному розчиннику, такому як ацетонітрил, N, Nдиметилформамід, диметилсульфоксид і N-метилпіролідон; в галогенвуглеводневому розчиннику, такому як хлористий метилен і хлористий етилен; або в інших органічних розчинниках. Крім того, реакція може проводитися в суміші згаданих вище традиційних розчинників. (i) Гідроліз: Гідроліз переважно проводить в присутності основи або кислоти, включаючи льюїсову кислоту. "Основа", що використовується в даному документі, включає традиційні неорганічні і органічні основи. Переважна неорганічна основа включає, наприклад, лужний метал, такий як натрій і калій; лужноземельний метал, такий як магній або кальцій; гідроксид, карбонат або гідрокарбонат лужного або лужноземельного металу. Переважна органічна основа включає, наприклад, триалкіламін, такий як триметиламін і триетиламін; піколін; 1,5діазабіцикло[4.3.0]нон-5-ен; і тому подібне. "Кислота", що використовується в даному документі, включає традиційні неорганічні і органічні кислоти. Переважна органічна кислота включає, наприклад, аліфатичну кислоту, таку як мурашина кислота, оцтова кислота і пропіонова кислота; і тригалоїдзаміщену оцтову кислоту, таку як трихлороцтова кислота і трифтороцтова кислота. Переважна неорганічна кислота включає, наприклад, соляну кислоту, бромистоводневу кислоту, сірчану кислоту, хлороводень, бромоводень, і тому подібне. "Льюїсова кислота", що використовується в даному документі, 8 UA 105919 C2 5 10 15 20 25 30 35 включає, наприклад, бору трифторидетерат, бору трибромід, алюмінію хлорид, заліза (III) хлорид, і тому подібне. У тому випадку, коли як кислоту використовують тригалоїдзаміщену оцтову кислоту або льюїсову кислоту, реакцію переважно проводять в присутності пастки катіонів, такої як анізол або фенол. Кількість основи, що використовується, або кислоти не обмежується, доки кількості достатньо для проведення гідролізу. Температура реакції, як правило, складає від 0 до 120 °C, переважно від кімнатної температури до 100 °C, і більш переважно від кімнатної температури до 80 °C. Тривалість реакції, як правило, складає від 30 хвилин до 24 годин, переважно від 30 хвилин до 12 годин, і більш переважно від 1 до 8 годин. (ii) Гідрування: Використовуване в даному документі "гідрування" може проводитися за допомогою традиційного/відомого способу гідрування. Традиційні способи гідрування включають, наприклад, хімічне відновлення, каталітичне відновлення, і тому подібне. Переважний відновник, що використовується при хімічному відновленні, включає гідрид, такий як йодоводень, сірководень, алюмогідрид літію, боргідрид натрію і ціаноборгідрид натрію; або метал, такий як олово, цинк або залізо; або поєднання металовмісної сполуки (наприклад, хлорид хрому, ацетат хрому, і тому подібне) і органічної або неорганічної кислоти (наприклад, мурашина кислота, оцтова кислота, пропіонова кислота, трифтороцтова кислота, паратолуолсульфонова кислота, соляна кислота, бромистоводнева кислота, і тому подібне). Переважний каталізатор, що використовується при каталітичному відновленні, включає платиновий каталізатор, такий як платинова пластина, губчаста платина, платинова чернь, колоїдна платина, діоксид платини і платиновий дріт; паладієвий каталізатор, такий як губчастий паладій, паладієва чернь, оксид паладію, паладоване вугілля, паладію/барію сульфат, і паладію/барію карбонат; нікелевий каталізатор, такий як порошковий нікель, оксид нікелю і нікель Ренея; кобальтовий каталізатор, такий як порошковий кобальт і кобальт Ренея; залізний каталізатор, такий як порошкове залізо; і тому подібне. Якщо кислота, що використовується при хімічному відновленні, є рідкою, то вона може також використовуватися як розчинник. Кількість відновника або каталізатора, що використовується при каталітичному відновленні, може без обмеження являти собою звичайно використовувану кількість. Температура реакції, як правило, складає від 0 до 120 °C, переважно від кімнатної температури до 100 °C, і більш переважно від кімнатної температури до 80 °C. Тривалість реакції, як правило, складає від 30 хвилин до 24 годин, переважно від 30 хвилин до 10 годин, і більш переважно від 30 хвилин до 4 годин. 9 UA 105919 C2 Схема 4 5 10 15 20 25 30 Сполука (3) може бути отримана шляхом здійснення взаємодії Сполуки (5) і Сполуки (6). Реакцію проводять відповідно до посилання (El-Sharabsy, S.A.; Abdel Gawad, S.M.; Hussain, S.M.; J. Prakt. Chem, 1989, 331(2), 207) або схожим з ним способом. Реакцію, як правило, проводять у прийнятному розчиннику, який не позначається негативно на реакції, наприклад, у воді; в спиртовому розчиннику, такому як метанол, етанол, ізопропанол, н-бутанол, трифторетанол і етиленгліколь; в кетоновому розчиннику, такому як ацетон або метилетилкетон; в ефірному розчиннику, такому як тетрагідрофуран, діоксан, діетиловий ефір, і диглім; в сладноефірному розчиннику, такому як метилацетат або етилацетат; в апротонному полярному розчиннику, такому як ацетонітрил, N, N-диметилформамід і диметилсульфоксид; в галогенвуглеводневому розчиннику, такому як хлористий метилен і хлористий етилен; або в інших органічних розчинниках. Крім того, реакція може проводитися в суміші згаданих вище традиційних розчинників. Представлена вище реакція може проводитися за відсутності каталітичного сполуки або в присутності кислого каталізатора. Як правило, реакцію переважно проводять в присутності основи. Основа включає, загалом, неорганічні і органічні основи. "Неорганічна основа", що використовується в даному документі, включає, наприклад, лужний метал, такий як натрій і калій; гідрокарбонат лужного металу, такий як гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію; гідроксид лужного металу, такий як гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид цезію; карбонат лужного металу, такий як карбонат літію, карбонат натрію, карбонат калію і карбонат цезію; нижчий алкоксид лужного металу, такий як метоксид натрію і етоксид калію, гідрид лужного металу, такий як гідрид натрію і гідрид калію; і тому подібне. "Органічна основа", що використовується в даному документі, включає, наприклад, триалкіламін, такий як триметиламін, триетиламін і N-етилдіізопропіламін; піридин; хінолін; піперидин; імідазол; піколін; диметиламінопіридин; диметиланілін; N-метилморфолін; DBN; DABCO; DBU; і тому подібне. Основа може використовуватися як єдиний інгредієнт або в будь-якому поєднанні з двох або більше інгредієнтів. Кількість основи, що використовується, як правило, є 10-кратною в молярному відношенні відносно Сполуки (5), переважно 3,5-кратною в молярному відношенні відносно Сполуки (5). Якщо основа є рідкою, то вона може також використовуватися як розчинник. 10 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 Співвідношення між Сполукою (6) і Сполукою (5) становить, принаймні, 1 моль Сполуки (5) на 1 моль Сполуки (6), переважно 1-5 моль Сполуки (5) на 1 моль Сполуки (6). Температура реакції не обмежується, і реакція, як правило, може проводитися при охолоджуванні, при кімнатній температурі або при нагріванні. Переважно, представлена вище реакція може проводитися при нагріванні із зворотним холодильником протягом 1-30 годин. Якщо в реакції як проміжний продукт отримується дигідроформа Сполуки (7), то Сполука (7) може бути далі окиснена з отриманням Сполуки (8). Окиснення Сполуки (7) може проводитися способом, традиційним в даній галузі техніки. Переважний окисник включає, наприклад, 2,3-дихлор-5,6-диціано-пара-бензохінон (DDQ), Nбромсукцинімід (NBS), і тому подібне. Реакцію окиснення, як правило, проводять без розбавлення або у прийнятному розчиннику, який не позначається негативно на реакції, наприклад, в спиртовому розчиннику, такому як метанол, етанол, ізопропанол, н-бутанол, трифторетанол і етиленгліколь; в кетоновому розчиннику, такому як ацетон або метилетилкетон; в ефірному розчиннику, такому як тетрагідрофуран, діоксан, діетиловий ефір, і диглім; в сладноефірному розчиннику, такому як метилацетат або етилацетат; в апротонному полярному розчиннику, такому як ацетонітрил, N, N-диметилформамід і диметилсульфоксид; в галогенвуглеводневому розчиннику, такому як хлористий метилен і хлористий етилен; або в інших органічних розчинниках. Крім того, реакція може проводитися в суміші згаданих вище традиційних розчинників. Кількість окисника, що використовується, як правило, складає від каталітичного до молярного надлишку відносно Сполуки (7). Температура реакції не обмежується, і реакція, як правило, може проводитися при охолоджуванні, при кімнатній температурі або при нагріванні. Переважно, представлена вище реакція може проводитися при нагріванні із зворотним холодильником протягом 0,5-75 годин. Сполука (7) в представленій вище Схемі 4 включає ізомер по подвійному зв'язку кільця. Сполука (4), що використовується як вихідна речовина, є відомою доступною сполукою. Вихідна речовина, що використовується в представленій вище схемі, може знаходитися в формі її відповідної солі, і цільові продукти кожної реакції також можуть являти собою відповідні солі. Бажані для кожного процесу сполуки, описані в кожній представленій вище схемі, і сполуки за даним винаходом можуть бути виділені і очищені відповідно до традиційного способу, наприклад, шляхом розділення неочищеного продукту реакції шляхом охолоджування, фільтрації, концентрації, екстракції, і тому подібне, з подальшим очищенням неочищеного продукту шляхом хроматографії, перекристалізації, і тому подібне. Переважна сіль Сполуки (1) являє собою фармацевтично прийнятну сіль і включає, наприклад, сіль з неорганічною основою, таку як сіль металу (наприклад, сіль лужного металу, така як сіль натрію і сіль калію, сіль лужноземельного металу, така як сіль кальцію і сіль магнію), сіль амонію, карбонат лужного металу (наприклад, карбонат літію, карбонат калію, карбонат натрію і карбонат цезію, і тому подібне), гідрокарбонат лужного металу (наприклад, гідрокарбонат літію, гідрокарбонат натрію, гідрокарбонат калію, і тому подібне) і гідроксид лужного металу (наприклад, гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид цезію, і тому подібне); сіль з органічною основою, такою як три(нижчий алкіл)амін (наприклад, триметиламін, триетиламін, N-етилдіізопропіламін, і тому подібне), піридин, хінолін, піперидин, імідазол, піколін, диметиламінопіридин, диметиланілін, N-(нижчий алкіл)морфолін (наприклад, Nметилморфолін, і тому подібне), DBN, DBU і DABCO; сіль неорганічної кислоти, таку як гідрохлорид, гідробромід, гідройодид, сульфат, нітрат, фосфат; і сіль органічної кислоти, таку як форміат, ацетат, пропіонат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, цитрат, тартрат, карбонат, пікрат, метансульфонат, етансульфонат, пара-толуолсульфонат і глутамат. Вихідна речовина, що використовується в представлених вище схемах, може являти собою свою сіль, подібно Сполуці (1), і цільові сполуки кожної реакції також можуть являти собою відповідні солі. Крім того, в кожну загальну формулу включені сольвати вихідних речовин і цільових сполук (наприклад, гідрат, етанолят, і тому подібне). Переважний сольват включає гідрат. Сполуки за даним винаходом формули (1) включають ізомер, такий як геометричний ізомер, стереоізомер і оптичний ізомер. Даний винахід також включає сполуку формули (1), в якій один або декілька з включених в сполуку атомів замінені одним або декількома їх ізотопами. Приклади ізотопу, який може бути 11 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 включений в сполуку за даним винаходом, включає, наприклад, ізотопи атомів водню, вуглецю, 2 3 13 14 15 17 18 18 36 азоту, кисню, сірки, фтору і хлору, і більш детально, H, H, C, C, N, O, O, F, Cl, і тому подібне. Конкретна мічена ізотопом сполука, що містить згаданий(і) вище ізотоп(и) і/або ізотоп(и) іншого(их) атома(ів), наприклад, сполуки, що містить радіоізотоп(и), такий(і) як 3H і 3 14C, застосовна для топографічного аналізу сполуки і/або речовини. Мічення тритієм (тобто, H) 14 або мічення С-14 (тобто, C) сполуки особливо переважне в світлі простоти отримання і виявлення. Крім того, передбачається, що сполука, яка містить важкий(і) ізотоп(и), такий як 2 дейтерій (тобто, H), також привнесе деякі терапевтичні переваги, такі як поліпшення метаболічної стабільності (наприклад, збільшення часу напівжиття in vivo) і зниження дозування. Сполуки за даним винаходом, що містять ізотопний(і) атом(и), як правило, можуть бути отримані за допомогою згаданих вище схем і/або подальших прикладів, з використанням будь-яких доступних мічених ізотопами реагентів. Сполуки за даним винаходом і їх солі мають агоністичну активність відносно аденозинового A2a рецептора, і, таким чином, вони застосовні як агоніст аденозинового A2a рецептора ссавців, включаючи людину. Відповідно, даний винахід також належить до фармацевтичних композицій як лікарський засіб, такий як агоніст аденозинового A2a рецептора. Далі в даному документі фармацевтичну композицію необов'язково називають "фармацевтична композиція за даним винаходом". Фармацевтична композиція за даним винаходом може бути приготована у вигляді звичайної лікарської форми, що містить ефективну кількість, принаймні, однієї сполуки, вибраної з групи, яка складається зі сполук за даним винаходом і їх солей, і деякі фармацевтично прийнятні носії. Фармацевтично прийнятні носії, що використовуються в фармацевтичній композиції за даним винаходом, можуть являти собою тверду речовину, таку як наповнювач, або рідину, таку як розріджувач. Приклади вказаних носіїв включають, наприклад, лактозу, стеарат магнію, крохмаль, тальк, желатин, агар, пектин, аравійську камедь, оливкову олію, кунжутну олію, масло какао, етиленгліколь, очищену воду, і тому подібне. У доповнення, фармацевтична композиція за даним винаходом може бути приготована у вигляді стандартної лікарської форми, прийнятної для введення. Приклади включають тверду і рідку лікарську форму, прийнятну для перорального введення, таку як таблетка, пілюля, капсула, гранула, порошок і рідина, а також лікарську форму для парентерального введення, таку як ін'єкція (внутрішньовенна ін'єкція, внутрішньом'язова ін'єкція, і тому подібне), очні краплі, офтальмічна мазь, супозиторій, засіб, що всмоктується черезшкірно, і тому подібне. Зокрема, переважною фармацевтичною композицією є очні краплі, оскільки вважається, що фармацевтична композиція за даним винаходом може застосовуватися як засіб, що знижує внутрішньоочний тиск, лікарський засіб для лікування глаукоми, і тому подібне, виходячи з її агоністичної активності відносно аденозинового A2a рецептора. Фармацевтична композиція за даним винаходом може бути приготована у вигляді водної рідини і далі застосовуватися як офтальмічна фармацевтична композиція. Наприклад, така водна рідка лікарська форма може бути приготована таким чином. За необхідності, до сполуки за даним винаходом (включаючи її сіль, те ж і далі в даному документі) необов'язково додають одну або декілька добавок, вибраних з фармацевтично прийнятного буфера, ізотонічної речовини, консерванту, солюбілізатора і регулятора pH, і приготовляють бажану водну лікарську форму за допомогою стандартної технології. Буфер, що використовується у водній рідкій лікарській формі, включає, наприклад, неорганічну кислоту, таку як борна кислота і фосфорна кислота; органічну кислоту, таку як амінокислота і янтарна кислота; і фармацевтично прийнятну сіль. Переважним буфером є янтарна кислота, фосфорна кислота і фосфорнокислий натрій. Буфер може застосовуватися як єдиний інгредієнт або в будь-якому поєднанні двох або декількох інгредієнтів. Препарат, в якому як буфер використовують янтарну кислоту або її фармацевтично прийнятну сіль, може запобігти випаданню в осад активного інгредієнта в процесі тривалого зберігання, оскільки сіль активного інгредієнта з янтарною кислотою має високу розчинність. Концентрація буфера у водному рідкому препараті переважно являє собою концентрацію, мінімально необхідну для запобігання зміні pH, наприклад, не більшу ніж 2 % (мас./об.), переважно не більшу ніж 0,6 % (мас./об.), і найбільш переважно не більшу ніж 0,2 % (мас./об.). Регулятор pH, що використовується у водному рідкому препараті, включає, наприклад, соляну кислоту, сірчану кислоту, молочну кислоту, оцтову кислоту, гідроксид калію, гідроксид натрію, гідроксид кальцію, гідроксид магнію, моноетаноламін, триетаноламін, діізопрапаноламін, триізопропаноламін і їх фармацевтично прийнятні солі. Переважний регулятор pH включає соляну кислоту і гідроксид натрію. Регулятор pH може застосовуватися як єдиний інгредієнт або в будь-якій комбінації двох або декількох інгредієнтів. 12 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ізотонічна речовина, що використовується у водному рідкому препараті, застосовується для приготування препарату, ізотонічного відносно сльози. Ізотонічна речовина, що використовується в даному документі, являє собою загальноприйняту для очних крапель речовину, і включає хлорид натрію, хлорид калію, борну кислоту, борат натрію, маніт, гліцерин, пропіленгліколь, поліетиленгліколь, мальтозу, сахарозу, сорбіт, глюкозу, і тому подібне, переважно гліцерин, глюкозу, маніт, пропіленгліколь і сорбіт; найбільш переважно гліцерин. Ізотонічна речовина може застосовуватися як єдиний інгредієнт або в будь-якій комбінації двох або декількох інгредієнтів. Препарат, в якому як ізотонічна речовина застосовується гліцерин, може запобігати осадженню активного інгредієнта або споріднених речовин в процесі тривалого зберігання, оскільки гліцерин не позначається негативно на розчинності активного інгредієнта. Осмотичний тиск водного рідкого препарату, який містить ізотонічну речовину, складає, наприклад, від 170 до 460 мОсм/кг, переважно від 229 до 372 мОсм/кг, і найбільш переважно від 256 до 316 мОсм/кг. Консервант, що використовується в даному документі, включає, наприклад, сіль четвертинного амонію, таку як бензалконій, бензетоній і бензододециній; катіонну сполуку, таку як хлоргексидин; параоксибензоат, такий як метилпараоксибензоат і пропілпараоксибензоат; і спиртову сполуку, таку як хлорбутанол і бензиловий спирт. Переважний консервант включає хлорид бензалконію і бромід бензододецинію, і найбільш переважно хлорид бензалконію і бромід бензододецинію, в якому алкільний ланцюг складається лише з 12 атомів вуглецю. За необхідності, фармацевтична композиція за даним винаходом може містити солюбілізатор. Використовуваний в даному документі солюбілізатор включає, наприклад, полімер, такий як полівінілпіролідон, макрогол (поліетиленгліколь), полівініловий спирт і гідроксипропілметилцелюлоза; поверхнево-активну речовину, таку як полісорбат, поліоксіетилен гідрогенізованої рицинової олії і поліоксіетиленполіоксіпропілен; багатоатомний спирт, такий як пропіленгліколь; органічну кислоту, таку як бензойна кислота і сорбінова кислота; амінокислоту, таку як аспарагінова кислота, гістидин, гліцин і лізин; і похідне ксантину, таке як кофеїн. Переважний солюбілізатор включає полівінілпіролідон, макрогол, полівініловий спирт, бензойну кислоту, сорбінову кислоту і альгінову кислоту; особливо полівінілпіролідон і макрогол. Солюбілізатор може застосовуватися як єдиний інгредієнт або в будь-якій комбінації двох або декількох інгредієнтів. Значення pH водного рідкого препарату, що містить фармацевтичну композицію за даним винаходом, складає приблизно від 4 приблизно до 9, переважно приблизно від 5 приблизно до 8, особливо переважно приблизно від 6 приблизно до 7, і найбільш переважно від 6,3 до 6,9. Тверда лікарська форма за даним винаходом для перорального введення, така як таблетка, порошок і гранула, може бути приготована шляхом змішування сполуки за даним винаходом, принаймні, з одним інертним носієм, таким як лактоза, маніт, глюкоза, гідроксипропілцелюлоза, мікрокристалічна целюлоза, крохмаль, полівінілпіролідон, мета-кремнієва кислота і алюмінат магнію, і складання суміші відповідно до загальноприйнятого способу. До складу препарату також можуть бути включені додаткові прийнятні добавки, наприклад, мастило, таке як стеарат магнію; розпушувач, такий як гліколят целюлози кальцію; стабілізатор, такий як лактоза; солюбілізуюча речовина, така як глутамінова кислота і аспарагінова кислота; і тому подібне. У його склад також можуть бути включені підсолоджувач, віддушка, ароматизатор, консервант, і тому подібне. За необхідності, таблетка і пілюля може бути покрита тонкою цукровою оболонкою і внутрішньошлунково- або кишковорозчинною оболонкою, з використанням сахарози, желатину, гідроксипропілцелюлози і фталату гідроксипропілметилцелюлози. Рідкий лікарський засіб для перорального введення, такий як емульсія, розчин, суспензія, сироп і еліксир, може бути приготовлений шляхом розчинення або диспергування сполуки за даним винаходом в традиційно використовуваному інертному розріджувачі, такому як очищена вода і етанол. Рідкий лікарський засіб також може містити допоміжну речовину, таку як зволожуюча речовина і речовина, яка сприяє суспендуванню, підсолоджувач, віддушка, ароматизатор, консервант, і тому подібне. Форма для парентерального введення, що ін'єктується, включає асептичний водний або неводний розчин, суспензію, емульсію, і тому подібне, і водна форма, що ін'єктується, може бути приготована відповідно до загальноприйнятого способу, наприклад, з використанням як розріджувача дистильованої води для ін'єкцій і сольового розчину. Неводна форма, що ін'єктується, може бути приготована відповідно до загальноприйнятого способу, наприклад, з використанням розріджувача або носія, такого як пропіленгліколь, поліетиленгліколь або рослинна олія, така як оливкова олія; спиртів, таких як етанол; полісорбату 80. Форма, що ін'єктується, може додатково містити допоміжну речовину, таку як консервант, зволожуюча 13 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 речовина, емульгатор, речовина, що сприяє диспергуванню, стабілізатор (наприклад, лактоза) і солюбілізуюча речовина (наприклад, глутамінова кислота і аспарагінова кислота). Форму, що ін'єктується, стерилізують відповідно до загальноприйнятого способу, наприклад, шляхом фільтрації через фільтр для видалення бактерій, додавання протимікробного засобу або опромінення, такого як гамма-випромінювання. У доповнення, форма, що ін'єктується, також може бути приготована у вигляді лікарської форми, що швидко готується, коли приготований асептичний твердий лікарський засіб перед застосуванням розчиняють в асептичній воді або асептичному розчиннику для ін'єкцій. Схема прийому фармацевтичної композиції за даним винаходом в кожному складанні буде визначатися в кожному випадку залежно від стану пацієнта, якому вводять фармацевтичну композицію (суб'єкт введення), віку, статі, і так далі. Загалом, дозування очних крапель, які містять фармацевтичну композицію за даним винаходом, може бути визначена в такій кількості, щоб очні краплі, що містять активну сполуку в концентрації 0,0001-10 % (мас./об.), переважно 0,001-1,0 % (мас./об.), найбільш переважно 0,01-0,3 % (мас./об.), можна було закапувати або використовувати при промиванні тампоном від одного до декількох разів на добу. Кількість очних крапель для одного застосування дорослою людиною становить, як правило, приблизно 0,001-1 мл. У випадку перорального лікарського засобу або форми, що ін'єктується, фармацевтичної композиції за даним винаходом дозування може бути визначене таким чином, що сполука за даним винаходом може бути введена в кількості 0,001-1000 мг на добу для дорослої людини. Добова доза може бути введена однократно, але переважно може бути розділена на декілька прийомів. Вищезазначене дозування являє собою тільки рекомендацію і, отже, воно також може бути збільшено або зменшено. Як згадано вище, є бажаним визначення дозування у випадку кожного використання залежно від різних умов. Відповідно, залежно від умов, зменшене дозування може, проте, показувати задовільний результат. Ефект даного винаходу Як агоніст аденозинового А2а рецептора фармацевтичні композиції і сполуки за даним винаходом можуть мати різну активність, таку як внутрішньоочна гіпотензивна дія, збільшення притоки крові до диска зорового нерва, захист зорового нерва, вазодилатація, коронарна дилатація, зниження кров'яного тиску, інгібування агрегації тромбоцитів, антитромботичний ефект, протизапальний ефект, бронхоектаз і імуносупресія. Тому, фармацевтичні композиції і сполуки за даним винаходом можуть бути адаптовані для лікування очного захворювання, такого як глаукома (наприклад, глаукома з нормальним тиском, глаукома з підвищеним внутрішньоочним тиском, післяопераційна повторна глаукома, і тому подібне), підвищення внутрішньоочного тиску, діабетична ретинопатія, вікова макулярна дегенерація (ВМД), пігментний ретиніт (ПР) і захворювання сітківки, викликані глаукомою; гіпертензії; застійної серцевої недостатності; серцевої недостатності; стенокардії; атеросклерозу; ішемічної хвороби серця; цереброваскулярної ішемії; реперфузійного пошкодження; тромбозу; епілепсії; риніту; синуситу; емфіземи; хронічної обструктивної хвороби легенів (ХОХЛ); бронхіальної астми; бронхіту; респіраторних захворювань; синдрому дихальної недостатності; септичного шоку; пневмосклерозу; гастриту; метастатичного гастриту; неспецифічного виразкового коліту; хвороби Крона; загоєння ран; екземи; шкірної гіперчутливості; дерматиту; псоріазу; хронічного ревматоїдного артриту; цукрового діабету; розсіяного склерозу; аутоімунного захворювання; і тому подібне. У доповнення, фармацевтичні композиції і сполуки за даним винаходом можуть бути використані як діагностичний засіб для інфаркту міокарда. Далі в даному документі, даний винахід проілюстрований Довідковими прикладами для отримання вихідних сполук і Прикладами для отримання сполук і складів за даним винаходом, а також експериментальними фармакологічними тестами, але не повинно тлумачитися як обмежене ними. Спектри ядерного магнітного резонансу (ЯМР) в представлених нижче прикладах вимірювали в наступних умовах. Скорочення визначені таким чином. Прилад: JNM-AL300 (JEOL) Внутрішній стандарт: TMS с: синглет, д: дублет, т: триплет, кв: квартет, квінт: квінтет, секст: секстет Короткий опис креслень На фігурі 1 представлені значення виживаності клітин при додаванні сполуки Прикладу 1 в концентрації 0,25, 0,5 і 1 мМ до клітин епітелію рогівки. На фігурі 2 представлені ефекти сполуки Прикладу 1 на циліарну артерію кроликів. 14 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 На фігурі 3 представлені ефекти сполуки Прикладу 1 на виживаність гангліозних клітин сітківки. Найкращий спосіб здійснення винаходу Довідковий приклад 1 Метил-(Е)-3-(6-гідроксиметилпіридин-2-іл)акрилат 2-Бромпіридин-6-метанол (50,0 г) розчиняли в безводному N, N-диметилформаміді (250 мл). До розчину додавали метилакрилат (47,9 мл), хлорид тетра(н-бутил)амонію (73,9 г), гідрокарбонат натрію (47,7 г) і Молекулярні Сита 3A(1/16) (50,0 г), а потім в атмосфері аргону додавали ацетат паладію (II) (2,98 г). Суміш перемішували при 80 °C протягом 5 годин. Після охолоджування реакційної суміші отриманий осад відфільтровувати, і додавали воду до фільтрату, який екстрагували етилацетатом. Органічний шар промивали сольовим розчином, сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 50,2 г метил-(Е)-3-(6-гідроксиметилпіридин-2-іл)акрилату. Коричневий порошок. 1 H-ЯМР (CDCl3) 7,72 (1Н, т, J=7,5 Гц), 7,68 (1Н, д, J=15,6 Гц), 7,32 (1Н, д, J=7,5 Гц), 7,21 (1Н, д, J=7,5 Гц), 6,97 (1Н, д, J=15,6 Гц), 4,78 (2H, д, J=4,2 Гц), 3,85 (1Н, т, J=4,2 Гц), 3,83 (3H, с). Довідковий приклад 2 Метил-3-(6-гідроксиметилпіридин-2-іл)пропіонат Метил-(Е)-3-(6-гідроксиметилпіридин-2-іл)акрилат (50,2 г) майже розчиняли в ізопропіловому спирті (502 мл). До розчину додавали 5 % паладій на активованому вугіллі (2,51 г), і перемішували суміш при 50 °C в умовах нормального тиску в атмосфері водню протягом 2,5 годин. Після охолоджування реакційної суміші каталізатор відфільтровувати, і концентрували фільтрат в умовах вакууму з отриманням 50,0 г метил-3-(6-гідроксиметилпіридин-2іл)пропіонату. Коричневе масло. 1 H-ЯМР (CDCl3) 7,58 (1Н, т, J=7,5 Гц), 7,09 (1Н, д, J=7,5 Гц), 7,03 (1Н, д, J=7,5 Гц), 4,71 (2H, с), 4,01 (1Н, ушир. c), 3,69 (3H, с), 3,15 (2H, т, J=7,2 Гц), 2,81 (2H, т, J=7,2 Гц). Довідковий приклад 3 Метил-3-(6-метансульфонілоксиметилпіридин-2-іл)пропіонат Метил-3-(6-гідроксиметилпіридин-2-іл)пропіонат (50,0 г) розчиняли в етилацетаті (1000 мл). До розчину додавали триетиламін (53,5 мл), і перемішували суміш на льоду протягом 10 хвилин. До суміші по краплях протягом 10 хвилин додавали метансульфонілхлорид (23,8 мл), і перемішували отриману суміш на льоду протягом 30 хвилин. До реакційної суміші додавали воду, суміш переносили в ділильну лійку, промивали водним насиченим гідрокарбонатом натрію і сольовим розчином, сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 63,0 г метил-3-(6-метансульфонілоксиметилпіридин-2-іл)пропіонату. Коричневе масло. 1 H-ЯМР (CDCl3) 7,63 (1Н, т, J=7,5 Гц), 7,26 (1Н, д, J=7,5 Гц), 7,19 (1Н, д, J=7,5 Гц), 5,28 (2H, с), 3,67 (3H, с), 3,12 (2H, т, J=7,2 Гц), 3,07 (3H, с), 2,79 (2H, т, J=7,2 Гц). Довідковий приклад 4 Метил-3-{6-[4-(4-ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілтіометил]піридин-2іл}пропіонат 4-Ацетамідбензальдегід (1000 г) розчиняли в етанолі (16000 мл). До суміші додавали малононітрил (607 г) і піперидин (40 г), і перемішували отриману суміш при нагріванні із зворотним холодильником протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури, а потім перемішували протягом 30 хвилин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали етанолом (2000 мл) і сушили з отриманням 1049 г N-[4(2,2-диціановініл)феніл]ацетаміду у вигляді жовтого порошку. Метил-3-(6-метансульфонілоксиметилпіридин-2-іл)пропіонат (7,0 г) розчиняли в метанолі (75 мл), а потім додавали тіосечовину (1,85 г). Суміш нагрівали із зворотним холодильником протягом 1,5 годин. Після охолоджування реакційної суміші додавали триетиламін (10,7 мл), і перемішували суміш протягом деякого часу. Послідовно додавали метанол (75 мл), отриманий раніше N-[4-(2,2-диціановініл)феніл]ацетамід (4,33 г), а потім N-бромсукцинімід (3,67 г), і перемішували суміш протягом 1 години. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали метанолом (40 мл), і сушили з отриманням 5,5 г метил-3-{6-[4-(4ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілтіометил]піридин-2-іл}пропіонату. Білий порошок. 1 H-ЯМР (DMSO-d6) 10,23 (1Н, с), 8,20-7,60 (2H, ушир. c), 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,63 (1Н, т, J=7,8 Гц), 7,35 (1Н, д, J=7,8 Гц), 7,15 (1Н, д, J=7,8 Гц), 4,45 (2H, с), 3,57 (3H, с), 2,96 (2H, т, J=7,2 Гц), 2,74 (2H, т, J=7,2 Гц), 2,09 (3H, с). Довідковий приклад 5 15 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 3-{6-[4-(4-Ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілтіометил]піридин-2-іл}пропіонова кислота Метил-3-{6-[4-(4-ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілтіометил]піридин-2іл}пропіонат (5 г) суспендували в ацетонітрилі, що містить 50 % води (150 мл). До суспензії додавали моногідрат гідроксиду літію (1,35 г), і перемішували суміш при кімнатній температурі протягом 1 години. Потім до реакційної суміші поступово додавали розчин лимонної кислоти (4,11 г) у воді (20 мл), і додатково перемішували реакційну суміш при кімнатній температурі протягом 2 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали водою (75 мл), і сушили з отриманням 5 г 3-{6-[4-(4-ацетиламінофеніл)-6-аміно-5ціанопіримідин-2-ілтіометил]піридин-2-іл}пропіонової кислоти. Білий порошок. 1 H-ЯМР (DMSO-d6) 10,25 (1Н, с), 7,84 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,64 (1Н, т, J=7,8 Гц), 7,36 (1Н, д, J=7,8 Гц), 7,16 (1Н, д, J=7,8 Гц), 4,47 (2H, с), 2,95 (2H, т, J=7,2 Гц), 2,65 (2H, т, J=7,2 Гц), 2,09 (3H, с). Довідковий приклад 6 1-трет-Бутоксикарбоніл-4-(піперазин-1-іл)метилпіперидин 1-трет-Бутоксикарбоніл-4-піперидилметанол (10 г) розчиняли в етилацетаті (150 мл). До розчину додавали триетиламін (12,8 мл), і перемішували суміш на льоду протягом деякого часу. До суміші повільно по краплях додавали метансульфонілхлорид (5,4 мл), і перемішували реакційну суміш на льоду протягом 30 хвилин. До реакційної суміші додавали воду, суміш переносили в ділильну лійку, промивали водою (50 мл) і екстрагували етилацетатом (50 мл, двічі). Об'єднаний органічний шар сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Залишок розчиняли в ацетонітрилі (200 мл), і додавали до розчину піперазин (18 г). Суміш перемішували при нагріванні із зворотним холодильником протягом 3 годин. Реакційну суміш концентрували в умовах вакууму, а потім відфільтровувати піперазин, що випав в осад. До фільтрату додавали сольовий розчин (50 мл) і етилацетат (50 мл), і перемішували суміш протягом ночі. Суміш переносили в ділильну лійку, органічний шар розділяли, промивали сольовим розчином (50 мл, двічі) і концентрували в умовах вакууму. До залишку додавали воду (50 мл), і нейтралізували суміш додаванням 1н соляної кислоти при охолоджуванні на льоду. Додавали етилацетат (100 мл), і перемішували суміш протягом деякого часу. Потім суміш переносили в ділильну лійку, і розділяли водний шар. Водний шар сильно підлуговували додаванням 5н гідроксиду натрію при охолоджуванні на льоду. Суміш екстрагували етилацетатом, сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 9,96 г 1-трет-бутоксикарбоніл-4-(піперазин-1-іл)метилпіперидину. Безбарвне масло. 1 H-ЯМР (CDCl3) 4,11-4,05 (2H, м), 2,87 (4H, т, J=4,8 Гц), 2,72-2,64 (2H, м), 2,36 (4H, ушир. с), 2,14 (2H, д, J=6,9 Гц), 1,74-1,65 (3H, м), 1,45 (9H, м), 1,13-0,99 (2H, м). Довідковий приклад 7 4-((4-(3-(6-((4-(4-ацетамідофеніл)-6-аміно-5-ціанопіримідин-2-ілтіо)метил)піридин-2іл)пропаноїл)піперазин-1-іл)метил)-1-трет-бутоксикарбонілпіперидину дигідрохлорид 3-{6-[4-(4-ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілтіометил]піридин-2-іл}пропіонову кислоту (2,16 г) суспендували в ацетоні (44 мл). До суспензії додавали 1-гідрокси-1Hбензотриазол (781 мг), 1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид (1,1 г) і 1-третбутоксикарбоніл-4-(піперазин-1-іл)метилпіперидин (1,5 г) у вказаному порядку, і нагрівали суміш із зворотним холодильником протягом 1 години. Ацетон видаляли в умовах вакууму, потім додавали етилацетат (30 мл) і воду (30 мл), і перемішували суміш протягом 30 хвилин. Суміш переносили в ділильну лійку, промивали насиченим водним гідрокарбонатом натрію і сольовим розчином у вказаному порядку, сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Залишок повністю розчиняли в метанолі (25 мл), потім при охолоджуванні на льоду повільно по краплях додавали конц. соляну кислоту (0,85 мл), і перемішували суміш при кімнатній температурі протягом 1 години. Потім додавали етанол (50 мл), і перемішували суміш при 50 °C протягом 1 години. Після охолоджування реакційної суміші кристалічну речовину, що випала в осад, збирали на фільтрі і сушили з отриманням 2,95 г 4-((4-(3-(6-((4-(4ацетамідофеніл)-6-аміно-5-ціанопіримідин-2-ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1іл)метил)-1- трет-бутоксикарбонілпіперидину дигідрохлориду. Білий порошок. 1 H-ЯМР (DMSO-d6) 10,30 (1Н, с) 10,15 (1Н, ушир. с) 8,00-7,81 (4H, м) 7,72 (2H, д, J=8,7 Гц) 7,65 (1Н, ушир. с) 7,40 (1Н, ушир. с) 4,57 (2H, с) 4,36-4,31 (1Н, м) 4,02-3,89 (3H, м) 3,70-3,30 (8H, м) 3,17-2,73 (8H, м) 2,09 (3H, с) 1,99 (1Н, м) 1,78-1,73 (2H, м) 1,39 (9H, с). Приклад 1 N-(4-(6-Аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду тригідрохлорид 16 UA 105919 C2 5 10 15 20 25 30 35 До 4-((4-(3-(6-((4-(4-ацетамідфеніл)-6-аміно-5-ціанопіримідин-2-ілтіо)метил)піридин-2іл)пропаноїл)піперазин-1-іл)метил)1-трет-бутоксикарбонілпіперидину дигідрохлориду (40 г) додавали 400 мл хлороводню (1 моль/л в етилацетаті), і перемішували суміш при кімнатній температурі протягом 24 годин. Осад збирали на фільтрі і промивали етилацетатом (80 мл). Осад сушили з отриманням білої нечищеної кристалічної речовини. Неочищену кристалічну речовину розчиняли у воді (245 мл) при кімнатній температурі і фільтрували. До фільтрату повільно додавали ацетон (875 мл), і перемішували суміш із затравковим кристалом протягом 6 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали ацетоном (140 мл), а потім сушили з отриманням 29,8 г N-(4-(6-аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4ілметил)піперазин-1-іл)пропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду тригідрохлориду. Білий порошок. 1 H-ЯМР (DMSO-d6) 11,23 (1Н, ушир. с) 10,43 (1Н, с) 9,05 (1Н, ушир. с) 8,93 (1Н, ушир. с) 8,30 (1Н, т, J=7,8 Гц) 7,96 (1Н, д, J=7,8 Гц) 7,81 (2H, д, J=8,7 Гц) 7,78-7,73 (3H, м) 4,77 (2H, с) 4,364,31 (1Н, м) 4,02-3,74 (3H, м) 3,53-3,45 (2H, м) 3,26-3,23 (5H, м) 3,02-2,81 (8H, м) 2,10-1,91 (6H, м) 1,50-1,39 (2H, м). Приклад 2 N-(4-(6-Аміно-5-ціано-2-((6-(3-(4-((1-(2-гідроксіетил)піперидин-4-іл)метил)піперазин-1-іл)-3оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду малеат N-(4-(6-Аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду тригідрохлорид (1,01 г) розчиняли в безводному N, N-диметилформаміді (15 мл). До розчину додавали 2-хлоретанол (186 мкл), триетиламін (0,6 мл), карбонат калію (386 мг) і йодид натрію (300 мг), і перемішували суміш при 50 °C протягом 3 годин. Реакційну суміш концентрували в умовах зниженого тиску, і очищали залишок по методу хроматографії на силікагелі (хлористий метилен:метанол:28 % водний аміак = 100:10:1) з отриманням 220 мг N-(4-(6-аміно-5-ціано-2-((6-(3-(4-((1-(2-гідроксіетил)піперидин-4-іл)метил)піперазин-1-іл)-3-оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду. Сполуки розчиняли в метанолі (5 мл), і додавали малеїнову кислоту (38,8 мг). Суміш перемішували протягом деякого часу. Розчин концентрували в умовах вакууму з отриманням 250 мг N-(4-(6-аміно-5-ціано-2-((6-(3-(4-((1-(2-гідроксіетил)піперидин-4-іл)метил)піперазин-1-іл)3-оксопропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду малеату. Білий порошок. 1 H-ЯМР (DMSO-d6) 10,25 (1Н, с) 7,83 (2H, д, J=8,7 Гц) 7,71 (2H, д, J=8,7 Гц) 7,63 (1Н, т, J=7,5 Гц) 7,35 (1Н, д, J=7,5 Гц) 7,15 (1Н, д, J=7,5 Гц), 6,04 (2H, с) 5,76 (1Н, ушир. с) 4,47-4,35 (4H, м) 3,71 (2H, ушир. с) 3,45-3,32 (9H, м) 3,11 (2H, ушир. с) 2,97-2,87 (4H, м) 2,73-2,69 (2H, м) 2,36-2,19 (3H, м) 2,09 (3H, с) 1,88-1,83 (3H, м) 1,35-1,31 (2H, м). Сполуки подальших прикладів 3-5 отримували відповідно до методики, аналогічної представленій в Прикладі 2. Приклад R Дані ЯМР-спектроскопії Сіль H-ЯМР (DMSO-d6) 11,23 (1Н, ушир. с) 10,43 (1Н, с) 9,05 (1Н, ушир. с) 8,93 (1Н, ушир. с) 8,30 (1Н, т, J=7,8 Гц) 7,96 (1Н, д, J=7,8 Гц) 7,81 (2Н, д, J=8,7 Гц) 7,78-7,73 (3Н, м) 4,77 тригідрохлорид (2Н, с) 4,36-4,31 (1Н, м) 4,02-3,74 (3Н, м) 3,533,45 (2Н, м) 3,26-3,23 (5Н, м) 3,02-2,81 (8Н, м) 2,10-1,91 (6Н, м) 1,50 1,39 (2Н, м). 1 1 Н 17 UA 105919 C2 Приклад 2 3 4 5 5 R Дані ЯМР-спектроскопії Сіль DMSO-d6: 10,25 (1H, с) 7,83 (2H, д, J=8,7 Гц) 7,71 (2H, д, J=8,7 Гц) 7,63 (1H, т, J=7,5 Гц) 7,35 (1H, д, J=7,5 Гц) 7,15 (1H, д, J=7,5 Гц), 6,04 (2H, с) 5,76 (1H, ушир. с) 4,47-4,35 (4H, малеат м) 3,71 (2H, ушир. с) 3,45-3,32 (9H, м) 3,11 (2H, ушир. с) 2,97-2,87 (4H, м) 2,73-2,69 (2H, м) 2,36-2,19 (3H, м) 2,09 (3H, с) 1,88-1,83 (3H, м) 1,35-1,31 (2H, м) DMSO-d6: 10,25 (1H, с) 7,83 (2H, д, J=8,7 Гц) 7,72 (2H, д, J=8,7 Гц) 7,62 (1H, т, J=7,8 Гц) 7,34 (1H, д, J=7,8 Гц) 7,14 (1H, д, J=7,8 Гц), 4,46 (2H, с) 3,44-3,29 (8H, м) 2,94 (2H, т, J=7,5 Гц) 2,87-2,83 (2H, м) 2,73-2,66 (2H, м) 2,34 (2H, ушир. с) 2,20-2,18 (4H, м) 2,09 (3H, с) 2,03 (2H, д, J=7,2 Гц) 1,87 (2H, ушир. с) 1,641,43 (4H, м) 1,09-1,01 (2H, м) CDCl3: 7,99 (2Н, д, J=8,7 Гц) 7,75-7,60 (2Н, м) 7,51 (1Н, т, J=7,5 Гц) 7,27 (1Н, д, J=7,5 Гц) 7,07 (1Н, д, J=7,5 Гц), 5,85 (ушир. с, 2Н) 4,65 (1Н, т, J=5,1 Гц) 4,53-4,42 (1Н, м) 4,49 (2Н, с) 3,59 (1Н, т, J=4,8 Гц) 3,53-3,40 (2Н, м) 3,13 (2Н, т, J=6,9 Гц) 3,00-2,90 (2Н, м) 2,80 (2Н, т, J=6,9 Гц) 2,73 (1Н, т, J=4,8 Гц) 2,63 (1Н, т, J=4,8 Гц) 2,38-2,25 (4Н, м) 2,21 (3Н, с) 2,14 (2Н, д, J=7,5 Гц) 2,10-1,97 (2Н, м) 1,85-1,60 (2Н, м) 1,55-1,40 (1Н, м) 1,35-1,15 (2Н, м) DMSO-d6: 10,25 (1Н, с) 7,84 (2Н, д, J=8,7 Гц) 7,72 (2Н, д, J=8,7 Гц) 7,62 (1Н, т, J=7,8 Гц) 7,34 (1Н, д, J=7,8 Гц) 7,14 (1Н, д, J=7,8 Гц) 4,46 (2Н, с) 3,59 (3Н, с) 3,50-3,25 (4Н, м) 2,982,76 (3Н, м) 2,75-2,50 (3Н, м) 2,50-2,40 (4Н, м) 2,25-2,13 (4Н, м) 2,09 (3Н, с) 2,04 (2Н, д, J=7,2 Гц) 1,68-1,55 (2Н, м) 1,50-1,35 (1Н, м) 1,150,98 (2Н, м) Приклад 6 N-(4-(6-Аміно-5-ціано-2-(6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин-2іл)метилтіо)піримідин-4-іл)феніл)ацет-D3-аміду тригідрохлорид (6-3) 18 UA 105919 C2 5 10 15 20 25 30 35 трет-Бутил-4-(4-(3-(6-(4-(4-ацет-D3-амідофеніл)-6-аміно-5-ціанопіримідин-2ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату дигідрохлорид (6-2) трет-Бутил-4-(4-(3-(6-((4-аміно-6-(4-амінофеніл)-5-ціанопіримідин-2-ілтіо)метил)піридин-2іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилат (6-1) (3,4 г) розчиняли в хлористому метилені (68 мл). До розчину при охолоджуванні на льоду додавали триетиламін (1,4 мл), і перемішували суміш протягом деякого часу. По краплях повільно додавали ацетил-D3-хлорид (532 мкл), і перемішували суміш при кімнатній температурі протягом ночі. Додавали воду, і переносили суміш в ділильну лійку. Водний шар екстрагували хлористим метиленом (двічі), комбінований органічний шар сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Залишок очищали по методу хроматографії на силікагелі (хлористий метилен/метанол=25/1) з отриманням 3,1 г трет-бутил-4-(4-(3-(6-(4-(4-ацет-D3-амідофеніл)-6аміно-5-ціанопіримідин-2-ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1карбоксилату. Сполуку повністю розчиняли в метанолі (20 мл), потім при охолоджуванні на льоду по краплях повільно додавали конц. HCl (1,7 мл), і перемішували суміш при кімнатній температурі протягом 3 годин. Потім додавали етанол (40 мл), і перемішували суміш при 50 °C протягом 1 години. Після охолоджування реакційної суміші кристалічну речовину, що випала в осад, збирали на фільтрі і сушили з отриманням 2,06 г трет-бутил-4-((4-(3-(6-((4-(4-ацет-D3амідофеніл)-6-аміно-5-ціанопіримідин-2-ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1іл)метил)піперидин-1-карбоксилату дигідрохлориду (6-2). Білий порошок. 1 H-ЯМР (DMSO-d6) 10,29 (1Н, с) 10,15 (1Н, ушир. с) 8,00-7,90 (1Н, м) 7,82 (2H, д, J=8,7 Гц) 7,73 (2H, д, J=8,7 Гц) 7,59 (1Н, м) 7,40 (1Н, м) 4,57 (2H, с) 4,36-4,31 (1Н, м) 4,02-3,89 (3H, м) 3,703,30 (8H, м) 3,17-2,73 (8H, м) 1,99 (1Н, м) 1,78-1,73 (2H, м) 1,39 (9H, с). N-(4-(6-аміно-5-ціано-2-(6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин-2іл)метилтіо)піримідин-4-іл)феніл)ацет-D3-аміду тригідрохлорид (6-3) До тертий-бутил-4-(4-(3-(6-(4-(4-ацет-D3-амідофеніл)-6-аміно-5-ціанопіримідин-2ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату дигідрохлориду (6-2) (2,0 г) додавали 20 мл хлороводню (1 моль/л в етилацетаті), і перемішували суміш при кімнатній температурі протягом 41 години. Осад збирали на фільтрі і промивали етилацетатом (4,0 мл). Неочищену кристалічну речовину розчиняли у воді (10 мл) при кімнатній температурі і фільтрували. До фільтрату повільно додавали ацетон (40 мл), і перемішували суміш із затравковим кристалом протягом 2 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали ацетоном (4 мл), а потім сушили з отриманням 1,75 г N-(4-(6-аміно-5-ціано-2-(6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин2-іл)метилтіо)піримідин-4-іл)феніл)ацет-D3-аміду тригідрохлориду (6-3). Білий порошок. 1 H-ЯМР (DMSO-d6) 11,06 (1Н, ушир. с) 10,38 (1Н, с) 8,94-8,81 (2H, м) 8,16 (1Н, т, J=7,8 Гц) 7,83-7,80 (3H, м) 7,75 (2H, д, J=8,7 Гц) 7,64 (1Н, д, J=7,8 Гц) 4,70 (2H, с) 4,36-4,31 (1Н, м) 4,023,74 (3H, м) 3,53-3,45 (2H, м) 3,26-3,23 (5H, м) 3,02-2,81 (8H, м) 2,10-1,91 (3H, м) 1,50-1,39 (2H, м). 40 19 UA 105919 C2 Приклад 7 5 10 15 20 25 30 35 Метил-4-нітробензоат-2,3,5,6-D4 (7-2) 4-Нітробензойну-D4 кислоту (7-1) (5 г) розчиняли в метанолі (100 мл). До розчину додавали конц. соляну кислоту (1,0 мл), і нагрівали суміш із зворотним холодильником протягом 15 годин. Реакційну суміш концентрували в умовах вакууму, а потім додавали до залишку воду. Суміш екстрагували хлористим метиленом. Органічний шар промивали водним гідрокарбонатом натрію, сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 5,3 г метил-4-нітробензоату-2,3,5,6-D4 (7-2). Білий порошок. 1 H-ЯМР (CDCl3) 3,99 (3H, с). 4-Нітробензил-2,3,5,6-D4 спирт (7-3) Метил-4-нітробензоат-2,3,5,6-D4 (7-2) (5,3 г) суспендували в суміші діоксану (53 мл) і води (53 мл). До суспензії додавали боргідрид натрію (9,4 г), і перемішували суміш при кімнатній температурі протягом 6 годин. Після завершення реакції реакційну суміш злегка підкислювали додаванням 5н HCl і переносили в ділильну лійку. Водний шар екстрагували етилацетатом, комбінований органічний шар сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 3,75 г 4-нітробензил-2,3,5,6-D4 спирту (7-3). Жовтий порошок. 1 H-ЯМР (DMSO-d6) 5,53 (1Н, т, J=5,7 Гц) 4,64 (2H, д, J=5,7 Гц). 4-Амінобензил-2,3,5,6-D4 спирт (7-4) 4-Нітробензил-2,3,5,6-D4 спирт (7-3) (3,75 г) розчиняли в суміші етилацетату (37 мл) і диметилформаміду (10 мл). До розчину додавали 5 % паладій на активованому вугіллі (400 мг), і перемішували суміш при атмосферному тиску водню протягом 6 годин. Після завершення реакції каталізатор відфільтровувати, і концентрували фільтрат в умовах вакууму з отриманням 2,65 г 4-амінобензил-2,3,5,6-D4 спирту (7-4). Жовте масло. 1 H-ЯМР (CDCl3) 4,56 (2H, с). 4-Ацетамідобензил-2,3,5,6-D4 ацетат (7-5) 4-Амінобензил-2,3,5,6-D4 спирт (7-4) (2,65 г) розчиняли в етилацетаті (53 мл). До розчину при охолоджуванні на льоду додавали триетиламін (12,9 мл), і перемішували суміш протягом деякого часу. Потім по краплях повільно додавали ацетилхлорид (5,5 мл), і перемішували суміш протягом 1 години. Після завершення реакції до реакційної суміші додавали воду, і переносили суміш в ділильну лійку. Водний шар екстрагували етилацетатом, комбінований органічний шар сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 4,28 г 4-ацетамідобензил-2,3,5,6-D4 ацетату (7-5). Жовте масло. 1 H-ЯМР (DMSO-d6) 4,99 (2H, с) 2,09 (6H, с). N-(4-(Гідроксиметіл)феніл-2,3,5,6-D4)ацетамід (7-6) 4-Ацетамідобензил-2,3,5,6-D4 ацетат (7-5) (4,28 г) розчиняли в метанолі (80 мл). До розчину додавали карбонат калію (2,9 г), і перемішували суміш протягом 1,5 години. Після завершення 20 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакції реакційну суміш фільтрували. Фільтрат концентрували в умовах вакууму з отриманням 3,4 г N-(4-(гідроксиметил)феніл-2,3,5,6-D4)ацетаміду (7-6). Жовте масло. 1 H-ЯМР (DMSO-d6) 10,07 (1Н, с) 4,42 (2H, с) 2,02 (3H, с). N-(4-Формілфеніл-2,3,5,6-D4)ацетамід (7-7) N-(4-(Гідроксиметіл)феніл-2,3,5,6-D4)ацетамід (7-6) (3,4 г) розчиняли в диметилформаміді (68 мл). До розчину додавали діоксид марганцю (17 г), і перемішували суміш при 60 °C протягом 6 годин. Після завершення реакції реакційну суміш фільтрували. До фільтрату додавали воду, і екстрагували суміш етилацетатом. Органічний шар сушили над безводним сульфатом магнію і концентрували в умовах вакууму з отриманням 2,5 г N-(4-формилфеніл-2,3,5,6-D4)ацетаміду (77). Білий порошок. 1 H-ЯМР (CDCl3) 9,93 (1Н, с) 7,50 (1Н, ушир. с) 2,23 (3H, м). N-(4-(2,2-диціановініл)феніл-2,3,5,6-D4)ацетамід (7-8) N-(4-Формілфеніл-2,3,5,6-D4)ацетамід (7-7) (2,5 г) розчиняли в етанолі (50 мл). До розчину додавали малононітрил (1,1 г) і піперидин (2 краплі), і перемішували суміш при кімнатній температурі протягом 8 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали етанолом і сушили з отриманням 2,1 г N-(4-(2,2-диціановініл)феніл-2,3,5,6D4)ацетаміду (7-8). Жовтий порошок. 1 H-ЯМР (DMSO-d6) 10,52 (1Н, с) 8,37 (1Н, с) 2,12 (3H, с). N-(4-(6-аміно-5-ціано-2-меркапто-3,4-дигіропіримідин-4-іл)феніл-2,3,5,6-D4)ацетамід (7-9) До 20 мл етанольного розчини металевого натрію (276 мг) додавали тіосечовину (760 мг), і перемішували суміш при кімнатній температурі протягом 1 години. Потім додавали N-(4-(2,2диціановініл)феніл-2,3,5,6-D4)ацетамід (7-8) (2,1 г), і перемішували суміш при нагріванні із зворотним холодильником протягом 3 годин. Після завершення реакції видаляли етанол в умовах зниженого тиску. Залишок розчиняли в теплій воді і злегка підкисляли додаванням оцтової кислоти. Осад збирали на фільтрі і сушили з отриманням 2,91 г N-(4-(6-аміно-5-ціано-2меркапто-3,4-дигіропіримідин-4-іл)феніл-2,3,5,6-D4)ацетаміду (7-9). Жовтий порошок. 1 H-ЯМР (DMSO-d6) 9,99 (1Н, с) 9,69 (1Н, с) 6,13 (2H, м) 4,93 (1Н, с) 2,07 (3H, с). Метил-3-(6-(4-(4-ацетиламінофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2ілтіометил)піридин-2-іл)пропіонат(7-10) N-(4-(6-Аміно-5-ціано-2-меркапто-3,4-дигідропіримідин-4-іл)феніл-2,3,5,6-D4)ацетамід (7-9) (2,91 г) розчиняли в диметилформаміді (60 мл). До розчину додавали метил-3-(6метансульфонілоксиметилпіридин-2-іл)пропіонат (2,73 г) і карбонат калію (2,76 г), і перемішували суміш при кімнатній температурі протягом ночі. Потім додавали Nбромсукцинімід (1,77 г), і перемішували суміш ще протягом години. Після завершення реакції до реакційної суміші додавали воду, і екстрагували суміш етилацетатом. Органічний шар сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Залишок очищали по методу хроматографії на силікагелі (хлористий метилен/метанол = 20/1) з отриманням 3,52 г метил-3-(6-(4-(4-ацетиламінофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2-ілтіометил)піридин-2іл)пропіонату (7-10). Білий порошок. 1 H-ЯМР (DMSO-d6) 10,26 (1Н, с) 7,63 (1Н, т, J=7,8 Гц) 7,36 (1Н, д, J=7,8 Гц) 7,16 (1Н, д, J=7,8 Гц) 4,46 (2H, с) 3,57 (3H, с) 2,99 (2H, т, J=7,2 Гц) 2,73 (2H, т, J=7,2 Гц) 2,09 (3H, с). 3-(6-(4-(4-ацетиламінофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2-ілтіометил)піридин-2іл)пропіонова кислота (7-11) Метил-3-(6-(4-(4-ацетиламінофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2ілтіометил)піридин-2-іл)пропіонат (7-10) (3,52 г) суспендували в ацетонітрилі, що містить 50 % води (100 мл). До суспензії додавали моногідрат гідроксиду літію (331 мг), і нагрівали суміш із зворотним холодильником протягом 2 годин. Потім до реакційної суміші поступово додавали розчин лимонної кислоти (1,59 г) у воді (10 мл), і перемішували реакційну суміш при 50 °C протягом 1 години. Після охолоджування реакційної суміші кристалічну речовину, що випала в осад, збирали на фільтрі, промивали водою і сушили з отриманням 2,29 г 3-(6-(4-(4ацетиламінофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2-ілтіометил)піридин-2-іл)пропіонової кислоти (7-11). Білий порошок. 1 H-ЯМР (DMSO-d6) 10,25 (1Н, с), 7,64 (1Н, т, J=7,8 Гц), 7,36 (1Н, д, J=7,8 Гц), 7,16 (1Н, д, J=7,8 Гц) 4,46 (2H, с) 2,92 (2H, т, J=7,2 Гц) 2,65 (2H, т, J=7,2 Гц) 2,09 (3H, с). трет-Бутил-4-(4-(3-(6-(4-(4-ацетамідофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату дигідрохлорид (7-12) 3-(6-(4-(4-Ацетиламінофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2-ілтіометил)піридин-2іл)пропіонову кислоту (7-11) (2,29 г) суспендували в ацетоні (46 мл). До суспензії додавали 1гідрокси-1H-бензотриазол (820 мг), 1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид 21 UA 105919 C2 5 10 15 20 25 30 (1,16 г) і трет-бутил-4-піперазин-1-ілметилпіперидин-1-карбоксилат (1,43 г) у вказаному порядку, і нагрівали суміш із зворотним холодильником протягом 1 години. Ацетон видаляли в умовах вакууму, потім додавали етилацетат (23 мл) і воду (23 мл), і перемішували суміш протягом 30 хвилин. Суміш переносили в ділильну лійку. Органічний шар промивали насиченим водним гідрокарбонатом натрію і сольовим розчином у вказаному порядку, сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Після повного розчинення залишку в метанолі (22,5 мл) при охолоджуванні на льоду по краплях повільно додавали конц. HCl (1,43 мл), і перемішували суміш при кімнатній температурі протягом 1 години. Потім додавали етанол (45 мл), і перемішували суміш при 50 °C протягом 1 години. Після охолоджування реакційної суміші кристалічну речовину, що випала в осад, збирали на фільтрі і сушили з отриманням 2,35 г трет-бутил-4-((4-(3-(6-((4-(4-ацетамідофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату дигідрохлориду (7-12). Білий порошок. 1 H-ЯМР (DMSO-d6) 10,30 (1Н, с) 7,95 (1Н, м) 7,65 (1Н, м) 7,45 (1Н, м) 4,59 (2H, с) 4,40-4,31 (1Н, м) 4,10-3,85 (3H, м) 3,70-3,30 (8H, м) 3,17-2,73 (8H, м) 2,09 (3H, с) 1,99 (1Н, м) 1,78-1,74 (2H, м) 1,39 (9H, с). N-(4-(6-аміно-5-ціано-2-(6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин-2іл)метилтіо)піримідин-4-іл)феніл-2,3,5,6-D4)ацетаміду тригідрохлорид (7-13) До трет-бутил-4-(4-(3-(6-(4-(4-ацетамідофеніл-2,3,5,6-D4)-6-аміно-5-ціанопіримідин-2ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату дигідрохлориду (7-12) (2,35 г) додавали 23 мл хлороводню (1 моль/л в етилацетаті), і перемішували суміш при кімнатній температурі протягом 24 годин. Осад збирали на фільтрі і промивали етилацетатом (4,7 мл). Неочищену кристалічну речовину розчиняли у воді (10 мл) при кімнатній температурі і фільтрували. До фільтрату повільно додавали ацетон (40 мл), і перемішували суміш із затравковим кристалом протягом 2 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали ацетоном (4,7 мл), а потім сушили з отриманням 1,93 г N-(4-(6-аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1іл)пропіл)піридин-2-іл)метилтіо)піримідин-4-іл)феніл-2,3,5,6-D4)ацетаміду тригідрохлориду (713). Білий порошок. 1 H-ЯМР (DMSO-d6) 11,04 (1Н, ушир. с) 10,38 (1Н, с) 8,92-8,80 (2H, м) 8,10 (1Н, м) 7,79 (1Н, м) 7,59 (1Н, м) 4,67 (2H, с) 4,37-4,33 (1Н, м) 4,07-4,03 (1Н, м) 3,70-2,82 (17H, м) 2,10-1,98 (6H, м) 1,48-1,37 (2H, м). Далі в даному документі, як довідкові приклади представлені методики для наступних сполук. 35 40 3-(6-(4-аміно-6-(4-амінофеніл)-5-ціанопіримідин-2-ілтіо-метил)піридин-2-іл)пропіонова кислота (8-2) 3-(6-(4-(4-ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілтіометил)піридин-2-іл)пропіонову кислоту (8-1) (230 мг) суспендували в ацетонітрилі (20 мл). До суспензії додавали 5н соляну кислоту (2 мл), і перемішували суміш при 60 °C протягом ночі. Після охолоджування реакційної суміші поступово додавали водну лимонну кислоту для нейтралізації реакційної суміші. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали етанолом і сушили з 22 UA 105919 C2 5 10 15 20 25 30 35 отриманням 150 мг 3-(6-(4-аміно-6-(4-амінофеніл)-5- ціанопіримідин-2-ілтіометил)піридин-2іл)пропіонової кислоти (8-2). Яскраво-жовтий порошок. 1 H-ЯМР (DMSO-d6) 7,83 (2H, д, J=8,7 Гц) 7,74 (1Н, т, J=7,5 Гц) 7,30 (1Н, д, J=7,5 Гц) 7,12 (1Н, д, J=7,5 Гц) 6,61 (2H, д, J=8,7 Гц) 5,90 (2H, ушир. с) 4,44 (2H, с) 2,91 (2H, т, J=7,5 Гц) 2,48 (2H, т, J=7,5 Гц). трет-Бутил-4-(4-(3-(6-((4-аміно-6-(4-амінофеніл)-5-ціанопіримідин-2-ілтіо)метил)піридин-2іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилат (8-3) 3-(6-(4-аміно-6-(4-амінофеніл)-5-ціанопіримідин-2-ілсульфанілметил)піридин-2-іл)пропіонову кислоту (8-2) (2,58 г) суспендували в ацетоні (50 мл). До суспензії додавали 1-гідрокси-1Hбензотриазол (1,28 г), 1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид (1,8 г) і третбутил-4-піперазин-1-ілметилпіперидин-1-карбоксилат (1,8 г) у вказаному порядку, і нагрівали суміш із зворотним холодильником протягом 1 години. Ацетон видаляли в умовах вакууму, потім додавали етилацетат (30 мл) і воду (30 мл), і перемішували суміш протягом 30 хвилин. Суміш переносили в ділильну лійку. Органічний шар промивали насиченим водним гідрокарбонатом натрію і сольовим розчином у вказаному порядку, сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Залишок очищали по методу хроматографії на силікагелі (хлористий метилен/метанол/28 % водний аміак = 100/10/1) з отриманням 3,9 г трет-бутил-4-(4-(3-(6-(4-аміно-6-(4-амінофеніл)-5ціанопіримідин-2ілтіо)метил)піридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату (8-3). Яскраво-жовтий порошок. 1 H-ЯМР (CDCl3) 7,95 (2H, д, J=8,7 Гц) 7,50 (1Н, т, J=7,5 Гц) 7,28 (1Н, д, J=7,5 Гц) 7,08 (1Н, д, J=7,5 Гц) 6,71 (2H, д, J=8,7 Гц) 5,70 (2H, ушир. с) 4,51 (2H, с) 4,16-4,09 (4H, м) 3,59 (2H, т, J=4,8 Гц) 3,45 (2H, т, J=4,8 Гц) 3,13 (2H, т, J=7,5 Гц) 2,80 (2H, т, J=7,5 Гц) 2,75-2,65 (2H, м) 2,34-2,30 (4H, м) 2,13 (2H, д, J=7,2 Гц) 1,72-1,64 (1Н, м) 1,46 (9H, с) 1,07-1,02 (2H, м). 4-Аміно-6-(4-амінофеніл)-2-(6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1іл)пропіл)піридин-2-іл)метилтіо)піримідин-5-карбонітрил тетрагідрохлорид (8-4) До трет-бутил-4-(4-(3-(6-(4-аміно-6-(4-амінофеніл)-5-ціанопіримідин-2-ілтіо)метил)піридин-2іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату (8-3) (3,6 г) додавали 54 мл хлороводню (1 моль/л в етилацетаті), і перемішували суміш при кімнатній температурі протягом 24 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали етилацетатом і сушили з отриманням 4,3 г 4-аміно-6-(4-амінофеніл)-2-(6-(3-оксо-3-(4-(піперидин4-ілметил)піперазин-1-іл)пропіл)піридин-2-іл)метилтіо)піримідин-5-карбонітрилу тетрагідрохлориду (8-4). Яскраво-жовтий порошок. 1 H-ЯМР (DMSO-d6) 11,23 (1Н, ушир. с) 9,05 (1Н, ушир. с) 8,93 (1Н, ушир. с) 8,30 (1Н, т, J=7,5 Гц) 7,79-7,68 (4H, м) 6,92 (2H, д, J=8,7 Гц) 4,77 (2H, с) 4,40-4,31 (8H, м) 3,36-3,18 (4H, м) 3,022,75 (6H, м) 2,21-1,98 (3H, м) 1,52-1,34 (2H, м). Далі в даному документі, як довідкові приклади представлені методики для наступних сполук. 23 UA 105919 C2 5 10 15 20 25 30 35 Метил-3-(6-гідроксиметил-1-оксипіридин-2-іл)пропіонат (9-2) Метил-3-(6-гідроксиметилпіридин-2-іл)пропіонат (9-1) (1,37 г) розчиняли в хлористому метилені (15 мл), повільно додавали розчин мета-хлорпербензойної кислоти (1,46 г) в хлористому метилені, і перемішували суміш протягом 2 годин. Реакційний розчин промивали 10 % водним сульфітом натрію, водним гідрокарбонатом натрію і водою у вказаному порядку. Органічний шар сушили над безводним сульфатом магнію з отриманням 880 мг метил-3-(6гідроксиметил-1-оксипіридин-2-іл)пропіонату (9-2). Білий порошок. 1 H-ЯМР (CDCl3) 7,48-7,29 (1Н, м) 7,25-7,22 (2H, м) 5,01 (1Н, м) 4,80 (2H, с) 3,67 (3H, с) 3,23 (2H, т, J=7,2 Гц) 2,87 (2H, т, J=7,2 Гц). N-(4-(6-аміно-5-ціано-2-меркаптопіримідин-4-іл)феніл)ацетамід (9-4) Тіосечовину (1,52 г) суспендували в етанолі (15 мл), потім додавали карбонат натрію (2,12 г), і перемішували суміш при 60 °C протягом 30 хвилин. Потім додавали N-(4-(2,2диціановініл)феніл)ацетамід (9-3) (4,22 г), і перемішували суміш при нагріванні із зворотним холодильником протягом 5 годин. Після завершення реакції видаляли етанол в умовах зниженого тиску. Залишок розчиняли в теплій воді і злегка підкисляли додаванням оцтової кислоти. Кристалічну речовину, що випала в осад, збирали на фільтрі і сушили з отриманням 1,87 г N-(4-(6-аміно-5-ціано-2-меркаптопіримідин-4-іл)феніл)ацетаміду (9-4). Жовтий порошок. 1 H-ЯМР (DMSO-d6) 10,29 (1Н, с) 7,73 (2H, д, J=8,7 Гц) 7,64 (2H, д, J=8,7 Гц) 2,09 (3H, с). Метил-3-{6-[4-(4-ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілсульфанілметил]-1оксипіридин-2-іл}пропіонат (9-5) Метил-3-(6-гідроксиметил-1-оксипіридин-2-іл)пропіонат (9-4) (880 мг) розчиняли в хлористому метилен (18 мл). До розчину додавали триетиламін (1,15 мл), і перемішували суміш на льоду протягом 10 хвилин. По краплях повільно додавали метансульфонілхлорид (0,48 мл), і перемішували суміш на льоду протягом 30 хвилин. До реакційної суміші додавали воду, і переносили суміш в ділильну лійку. Органічний шар промивали насиченим водним гідрокарбонатом натрію і сольовим розчином. Органічний шар сушили над безводним сульфатом магнію з отриманням метил-3-(6-метансульфонілоксиметил-1-оксипіридин-2іл)пропіонату. Потім сполуки розчиняли в диметилформаміді (10 мл), додавали N-(4-(6-аміно-5ціано-2-меркаптопіримідин-4-іл)феніл)ацетамід (1,14 г) і карбонат калію (1,1 г), і перемішували суміш при кімнатній температурі протягом ночі. Після завершення реакції додавали воду. Осад збирали на фільтрі і сушили з отриманням 580 мг метил-3-(6-(4-(4-ацетиламінофеніл)-6-аміно-5ціанопіримідин-2-ілсульфанілметил)-1-оксипіридин-2-іл)пропіонату (9-5). Білий порошок. 1 H-ЯМР (DMSO-d6) 10,26 (1Н, с) 7,83 (2H, д, J=8,7 Гц) 7,74-7,69 (3H, м) 7,37 (1Н, д, J=7,8 Гц) 7,23 (1Н, т, J=7,8 Гц) 4,50 (2H, с) 3,59 (3H, с) 3,05 (2H, т, J=7,2 Гц) 2,76 (2H, т, J=7,2 Гц) 2,09 (3H, с). 3-{6-[4-(4-Ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілсульфанілметил]-1-оксипіридин2-іл}пропіонова кислота (9-6) 24 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 60 Метил-3-{6-[4-(4-ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілсульфанілметил]-1оксипіридин-2-іл}пропіонат (9-5) (580 мг) суспендували в ацетонітрилі, що містить 50 % води (17 мл). До суспензії додавали моногідрат гідроксиду літію (53 мг), і перемішували суміш при 80 °C протягом 2 годин. Потім додавали лимонну кислоту (253 мг), і перемішували суміш при 50 °C протягом 1 години. Після охолоджування реакційної суміші кристалічну речовину, що випала в осад, збирали на фільтрі, промивали водою і сушили з отриманням 540 мг 3-{6-[4-(4ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілсульфанілметил]-1оксипіридин-2іл}пропіонової кислоти (9-6). Білий порошок. 1 H-ЯМР (DMSO-d6) 10,25 (1Н, с) 7,83 (2H, д, J=8,7 Гц) 7,74-7,68 (3H, м) 7,37 (1Н, д, J=7,8 Гц) 7,23 (1Н, т, J=7,8 Гц) 4,50 (2H, с) 3,02 (2H, т, J=7,2 Гц) 2,67 (2H, т, J=7,2 Гц) 2,09 (3H, с). трет-Бутил-4-(4-(3-(6-(4-(4-ацетамідофеніл)-6-аміно-5-ціанопіримідин-2-ілтіо)метил)-1оксипіридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилат (9-7) 3-{6-[4-(4-Ацетиламінофеніл)-6-аміно-5-ціанопіримідин-2-ілсульфанілметил]-1-оксипіридин2-іл}пропіонову кислоту (9-6) (520 мг) розчиняли в суміші ацетону (10 мл) і диметилформаміду (10 мл). До розчину додавали 1-гідрокси-1H-бензотриазол (224 мг), 1-етил-3-(3диметиламінопропіл)карбодііміду гідрохлорид (318 мг), трет-бутил-4-піперазин-1ілметилпіперидин-1-карбоксилат (315 мг) у вказаному порядку, і нагрівали суміш із зворотним холодильником протягом 2 годин. Ацетон видаляли в умовах вакууму, потім додавали етилацетат і воду, і перемішували суміш протягом 30 хвилин. Суміш переносили в ділильну лійку, органічний шар промивали насиченим водним гідрокарбонатом натрію і сольовим розчином у вказаному порядку, сушили над безводним сульфатом магнію і концентрували в умовах вакууму. Залишок очищали по методу хроматографії на силікагелі (хлористий метилен/метанол = 50/1) з отриманням 470 мг трет-бутил-4-(4-(3-(6-(4-(4-ацетамідофеніл)-6аміно-5-ціанопіримідин-2-ілтіо)метил)-1-оксипіридин-2-іл)пропаноїл)піперазин-1іл)метил)піперидин-1-карбоксилату (9-7). Білий порошок. 1 H-ЯМР (CDCl3) 7,98 (2H, д, J=8,7 Гц) 7,69-7,61 (3H, м) 7,43 (1Н, дд, J=7,8, 1,8 Гц) 7,31 (1Н, дд, J=7,8, 1,8 Гц) 7,09 (1Н, т, J=7,8 Гц) 5,75 (2H, с) 4,65(2H, с) 4,12-4,00 (2H, м) 3,55 (2H, ушир. с) 3,46 (2H, ушир. с) 3,24 (2H, т, J=7,2 Гц) 2,87 (2H, т, J=7,2 Гц) 2,71-2,63 (2H, м) 2,32-2,29 (4H, м) 2,23 (3H, с) 2,11 (2H, д, J=6,9 Гц) 1,71-1,67 (3H, м) 1,46 (9H, с) 1,07-0,97 (2H, м). N-(4-(6-аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)-1оксипіридин-2-іл)метилтіо)піримідин-4-іл)феніл)ацетаміду тригідрохлорид (9-8) До трет-бутил-4-(4-(3-(6-(4-(4-ацетамідофеніл)-6-аміно-5-ціанопіримідин-2-ілтіо)метил)-1оксипіридин-2-іл)пропаноїл)піперазин-1-іл)метил)піперидин-1-карбоксилату (450 мг) додавали 4,5 мл хлороводню (1 моль/л в етилацетаті), і перемішували суміш при кімнатній температурі протягом 24 годин. Осад збирали на фільтрі, промивали етилацетатом і сушили з отриманням білої неочищеної кристалічної речовини. Неочищену кристалічну речовину розчиняли у воді (2,5 мл) при кімнатній температурі і фільтрували. До фільтрату повільно додавали ацетон (10 мл), і перемішували суміш протягом 6 годин. Кристалічну речовину, що випала в осад, збирали на фільтрі, промивали ацетоном, а потім сушили з отриманням 230 мг N-(4-(6-аміно-5-ціано-2-((6(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)-1-оксипіридин-2-іл)метилтіо)піримідин4-іл)феніл)ацетаміду тригідрохлориду. Білий порошок. 1 H-ЯМР (DMS0-d6) 10,65 (1Н, м) 10,33 (1Н, с) 8,80-8,66 (2H, м) 7,82 (2H, д, J=8,7 Гц) 7,757,69 (3H, м) 7,43 (1Н, д, J=7,8 Гц) 7,25 (1Н, т, J=7,8 Гц) 4,50 (2H, с) 4,42-4,38 (1Н, м) 4,18-4,09 (1Н, м) 3,74-3,25 (8H, м) 3,08-3,01 (4H, м) 2,87-2,70 (4H, м) 2,09 (3H, с) 2,08-1,97 (2H, м) 1,47-1,39 (2H, м). Далі в даному документі, представлені декілька прикладів фармацевтичних композицій, що містять сполуки за даним винаходом. Приклад 8 У лабораторний стакан з нержавіючої сталі ємністю 5 л додавали очищену воду (приблизно 4,5 кг). До неї додавали концентрований гліцерин (130 г) як ізотонічний засіб і янтарну кислоту (3,5 г) як буфер, і перемішували суміш для розчинення. Потім до розчину додавали N-(4-(6аміно-5-ціано-2-((6-(3-оксо-3-(4-(піперидин-4-ілметил)піперазин-1-іл)пропіл)піридин-2іл)метилтіо)піримідин-4-іл)феніл)ацетамід (сполука Прикладу 1) (0,5 г), і перемішували суміш для розчинення. До розчину додавали бромід бензододецинію (0,3 г) як консервант, і обережно перемішували суміш. Повне розчинення підтверджували візуально. До розчину поступово додавали 4 % (об./об.) водний гідроксид натрію для коректування значення pH до 6,6. Після коректування pH до розчину додавали очищену воду до загальної маси 5,0 кг, і обережно перемішували розчин. Розчин асептично фільтрували, потім фільтрат асептично вміщували в бутель для очних крапель, і герметично закривали бутель. Приклад 9 25 UA 105919 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтичну композицію Прикладу 9 готували способом, аналогічним описаному в Прикладі 8, з використанням як буфера дигідрофосфату натрію (3,00 г) замість янтарної кислоти. Приклад 10 Фармацевтичну композицію Прикладу 10 готували способом, аналогічним описаному в Прикладі 8, з використанням як ізотонічного засобу глюкози (275 г) замість концентрованого гліцерину. Приклад 11 Фармацевтичну композицію Прикладу 11 готували способом, аналогічним описаному в Прикладі 8, з використанням як ізотонічного засобу маніту (255 г) замість концентрованого гліцерину. Приклад 12 Фармацевтичну композицію Прикладу 12 готували способом, аналогічним описаному в Прикладі 8, з використанням як ізотонічного засобу концентрованого гліцерину (68 г) і пропіленгліколю (50 г) замість концентрованого гліцерину. Приклад 13 Фармацевтичну композицію Прикладу 13 готували способом, аналогічним описаному в Прикладі 8, з використанням як ізотонічного засобу концентрованого гліцерину (105 г) і сорбіту (43 г) замість концентрованого гліцерину. Приклад 14 Фармацевтичну композицію Прикладу 14 готували способом, аналогічним описаному в Прикладі 8, з використанням як ізотонічного засобу пропіленгліколю (50 г), маніту (100 г) і сорбіту (43 г) замість концентрованого гліцерину. Приклад 15 Фармацевтичну композицію Прикладу 15 готували способом, аналогічним описаному в Прикладі 8, з використанням як консерванту бензалконію хлориду (0,5 г) замість бензододецинію броміду. Далі описані приклади фармакологічних тестів з використанням сполук за даним винаходом. Тест 1: цАМФ-генеруюча дія на клітини, що експресує аденозиновий А2а рецептор Тест проводили, як зазначено нижче, з посиланням на методику, розкриту в бібліографічному посиланні (Klotz K. N. et al, Naunyn-Schmiedeberg's Arch. Pharmacol, (1998) 357, 1-9; Shryock J. C. et al, Molecular Pharmacology, (1998) 53, 886-893). Що стосується клітин, які підлягають використанню в тесті, то використали клітини HEK293, які експресують аденозиновий А2а рецептор (людський) (PerkinElmer Life Sciences, код № RBHA2AC). Що стосується поживного середовища, то використали модифіковане по Дульбекко середовище Ігла (DMEM), що містить 10 % FBS (ембріональної бичачої сироватки) і 1 мМ пірувату натрію. 5 Клітини вміщували в 96-ямковий планшет (1×10 /ямка) і вирощували протягом ночі. Після видалення надосадової рідини в кожну ямку додавали 0,1 мл DMEM (без FBS), що містить 20 мМ HEPES, 0,1 мМ IBMX (3-ізобутил-1-метилксантин) і 2 одиниці/мл аденозиндезамінази і інкубували при 37 °C протягом 30 хвилин. Потім в кожну ямку додавали 0,1 мл поживного середовища, що містить тестовані сполуки в ДМСО в заданій концентрації, і інкубували ще протягом 30 хвилин. Після видалення надосадової рідини в ямку додавали цитолітичний розчин для гасіння реакції. Кількість цАМФ в кожній ямці вимірювали з використанням системи для імуноферментного аналізу (EIA) цАМФ (Amersham Biosciences, код № RPN225). Той же аналіз повторювали з використанням CGS-21680 (2-паракарбоксіетил)фенетиламіно-5'-N-етилкарбоксамідоаденозину гідрохлориду (Sigma, код C141) як еталонної сполуки. Кількість цАМФ, що утворюється в еталонному середовищі під дією 1 мкМ еталонної сполуки, приймали за 100 %. Вимірювали кількість цАМФ, що утворюється в кожному тестованому середовищі і на основі результатів для кожної тестованої сполуки в заданій концентрації, розраховували концентрацію, що приводить до продукції 50 % цАМФ, яку визначали як значення EC50. Результати описаного вище тесту, отримані з використанням наступних сполук за даним винаходом, отриманих у вказаних вище прикладах, представлені в наступній Таблиці. Результат 26 UA 105919 C2 Приклад 1 2 3 4 5 5 10 15 20 25 30 35 40 45 50 Агоністична активність відносно A2a (EC50, нМ) 3,3 2,9 1,8 6,1 8,4 Тест 2: Дія сполуки Прикладу 1 на клітини епітелію рогівки Метод Як клітини для тесту використовували клітини епітелію рогівки кролика (KURABO). До клітин епітелію рогівки кролика, поміщених в 96-ямковий планшет, додавали сполуку Прикладу 1, і 2 інкубували зразок протягом 60 хвилин. Потім, зразок опромінювали УФА (3,5 мВт/см ) протягом 70 хвилин з використанням імітатора сонячного випромінювання (SOL500). Після цього, клітини відмивали буфером. Через 24 години оцінювали життєздатність клітин шляхом аналізу поглинання нейтрального червоного. Результат Результат представлений на Фігурі 1. Життєздатність клітин після додавання сполуки Прикладу 1 (0,25, 0,5 і 1 мМ) з подальшим опроміненням імітатором сонячного випромінювання становила 106,3 %, 115,0 % і 100,7 %, відповідно, і таким чином зниження життєздатності клітин зовсім не спостерігалося. Виходячи з представлених вище результатів, очевидно, що даний препарат може бути використаний у високій концентрації навіть поза приміщенням на сонці, оскільки сполука за даним винаходом не виявила який-небудь цитотоксичності навіть при використанні її у високій концентрації, і що препарат за даним винаходом являє собою лікарський засіб, який може безпечно використовуватися. Тест 3: Релаксація судин Порушення кровообігу ока відбувається при глаукомі, пігментному ретиніті, макулярній дегенерації, ішемічній оптичної невропатії, оклюзії артерії сітківки, оклюзії вени сітківки, діабетичній ретинопатії і іридоцикліті. Особливо, порушення кровообігу в диску зорового нерва вважається важливим чинником при глаукомі. Очний кровотік має два циркуляторні системи. Одна являє собою шлях через циліарну артерію, а друга являє собою шлях через центральну артерію сітківки. Циліарна артерія проходить до артерій в судинній оболонці ока, диску зорового нерва і циліарному тілі. З іншого боку, центральна артерія сітківки проходить до артерії в сітківці, і частина центральної артерії сітківки відгалужується до диска зорового нерва. Сполука Прикладу 1 розслабляє циліарну артерію, що як вважається, поліпшує кровообіг ока. Тому вважається, що сполука Прикладу 1 являє собою ефективні ліки для терапії захворювань ока, таких як глаукома, пігментний ретиніт, макулярна дегенерація, ішемічна оптична невропатія, оклюзія артерії сітківки, оклюзія вени сітківки, діабетична ретинопатія і іридоцикліт. Матеріали і методи Кроликів умертвляли шляхом внутрішньовенного введення смертельною дозою пентобарбіталу натрію. Витягували очі і виділяли циліарні артерії. З циліарних артерій вирізали судинні кільця довжиною 2 мм і вміщували в Danish Multi Myograph System 610M (Danish myo technology) при спостеріганні під мікроскопом. Судини врівноважували в насиченому киснем розчині Кребса з 5 % CO2 і 95 % O2 при 37 °C. Для підтвердження пошкодження ендотелію судин досліджували релаксацію циліарної артерії 100 мкМ карбахоліну. Якщо релаксація карбахоліном складала більше 30 %, то судини, ендотелій яких не був пошкоджений, використовували для експериментів. +, Після того, як циліарну артерію звужували розчином Кребса з високим змістом K в камеру вводили сполуку Прикладу 1 в серії розведення від 0,3 мкМ до 300 мкМ. Тиск вимірювали за допомогою Myodaq ver 2.01 (Danish myo technology). Результат Результати представлені в подальшій таблиці і на Фігурі 2. Сполука Прикладу 1 дозозалежно розслабляє циліарну артерію кроликів, а значення EC 50 для неї становила 17,0 мкМ. Таким чином, був зроблений висновок, що сполука Прикладу 1 викликає релаксацію циліарної артерії. 27 UA 105919 C2 Концентрація (мкМ) 0,3 1 3 10 30 100 300 5 10 15 20 25 30 35 Релаксація (%) 2,6±0,5 4,8±1,2 7,9±2,3 35,3±14,4 65,6±9,5 82,4±3,7 90,1±2,4 Тест 4: Нейропротекція При глаукомі, одному з очних захворювань, що веде до сліпоти, вибірково ушкоджуються гангліозні клітини сітківки (RGC). Потім ушкоджується зоровий нерв і в завершення з'являється дефект поля зору. Оклюзія артерії сітківки, оклюзія вени сітківки, діабетична ретинопатія і ішемічна оптична невропатія також є очними захворюваннями, пов'язаними з порушеннями зорового нерва. У доповнення, макулярна дегенерація, пігментний ретиніт і спадкова очна невропатія Лебера є очними захворюваннями, пов'язаними з пошкодженням нервових клітин в сітківці. Сполука Прикладу 1 виявляє нейропротекторні ефекти відносно RGC і, як вважають, є нейропротекторними ліками, які використовують в терапії очних захворювань, таких як оклюзія артерії сітківки, оклюзія вени сітківки, діабетична ретинопатія, ішемічна оптична невропатія, макулярна дегенерація, пігментний ретиніт і спадкова очна невропатія Лебера. Матеріали і методи Даний експеримент проводили відповідно до способу, описаного Otori et al. (Invest Opthalmol Vis Sci. 39: 972-981, 1998). У щурів Long Evans у віці 7 днів витягували очі. З очей виділяли сітківку. Сітківку дисоціювали шляхом інкубації з середовищем Neurobasal, що містить 15 од/мл папаїну, при 37 °C протягом 30 хвилин. Готували суспензію клітин сітківки. Суспензію клітин сітківки інкубували в покритій анти-SIRP антитілами (Chemicon) колбі при кімнатній температурі протягом 30 хвилин. Неприкріплені клітини вміщували в покриту анти-thy1 антитілами (Chemicon) колбу. Клітини інкубували при кімнатній температурі протягом 30 хвилин. На закінчення, прикріплені клітини в колбі промивали середовищем Neurobasal. Після центрифугування при 800 об/хв протягом 5 хвилин готували очищені RGC. Клітини висівали на скляні накривні стекла, які було покриті полі-L-лізином і ламінином. Очищені RGC вирощували в середовищі Neurobasal, що містить добавку B27, 1 мМ глутаміну, 50 нг/мл CNTF, 10 мкМ Forskolin. Культуру клітин підтримували при 37 °C у вологій атмосфері, що містить 5 % CO2 і 95 % повітря. Відразу після висівання клітин додавали BDNF (50 нг/мл) або сполуку Прикладу 1 в кінцевій концентрації 0 нМ (контроль), 3 нМ, 10 нМ або 30 нМ. Виживаність клітин (життєздатність клітин) визначали шляхом підрахунку забарвлених RGC. Через 5 діб після початку вирощування культури RGC забарвлювали 1 мкМ кальцеїном-AM (Molecular probe). Число RGC підраховували з використанням флуоресцентного мікроскопа. Процент виживаності клітин (життєздатність клітин) розраховували, використовуючи вирахуване число в контрольній групі, прийняте за 0 %, і вирахуване число в групі з додаванням BDNF, прийняте за 100 %. Результат Результати представлені в подальшій таблиці і на Фігурі 3. Сполука Прикладу 1 дозозалежно збільшувала виживаність клітин. Цей результат вказує на те, що сполука Прикладу 1 мала нейропротекторні ефекти відносно RGC. 40 Групи Контроль Приклад 1 3 нМ Приклад 1 10 нМ Приклад 1 30 нМ n 8 Виживаність клітин (%) 0,0±6,5 8 10,9±7,0 8 46,5±7,0 8 41,9±, 5 Значення = середнє±стандартна помилка 28
ДивитисяДодаткова інформація
Назва патенту англійськоюA novel cyanopyrimidine derivative
Автори російськоюSato, Norifumi, Yuki, Yohei, Shinohara, Hisashi, Takeji, Yasuhiro, Ito, Kuni, Michikami, Daisaku, Hino, Keisuke, Yamazaki, Hiroyuki
МПК / Мітки
МПК: C07D 401/12, A61K 31/506, A61P 27/06
Мітки: ціанопіримідинове, похідне
Код посилання
<a href="https://ua.patents.su/33-105919-cianopirimidinove-pokhidne.html" target="_blank" rel="follow" title="База патентів України">Ціанопіримідинове похідне</a>
Попередній патент: Гербіцидні композиції, що містять напталам
Наступний патент: Похідні сполук стероїдал[3,2-с]піразолу з глюкокортикоїдною активністю
Випадковий патент: Спосіб спрямованого накопичення популяцій хижих комах












