Антимікробні засоби на основі похідних геміну
Номер патенту: 108480
Опубліковано: 12.05.2015
Автори: Нєбольсін Владімір Євгєньєвіч, Желтухіна Галіна Алєксандровна
Формула / Реферат
1. Застосування сполуки загальної формули (І)
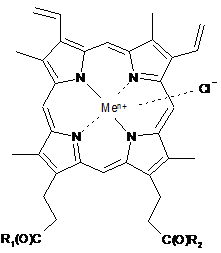 , I
, I
де R1 і R2 однакові або різні, при цьому
або один з R1 і R2 являє собою -ОН, а інший являє собою -ArgArgTrpHisArgLeuLysGlu(OMe)OH, -ArgTrpHisArgLeuLysGlu(OMe)OH, -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp або Phe, або Туr (граміцидин D), -Nd-цикло-(Оrn-Lеu-О-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -ArgOMe, -SerOMe, -bАlаНА, -bAlaHis, -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
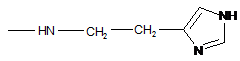 ;
;
Меn+ являє собою Fe2+ або Fe3+;
або її ізомерів або сумішей ізомерів, або їх фармацевтично прийнятних солей, як антимікробного засобу.
2. Застосування за п. 1, де антимікробний засіб являє собою антибактеріальний засіб.
3. Застосування за п. 2, де вказаний антибактеріальний засіб виявляє активність відносно грампозитивних бактерій роду Staphylococcus, Bacillus, Enterococcus і/або Micrococcus.
4. Застосування за п. 3, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus.
5. Застосування за п. 3, де бактерії належать до штаму Staphylococcus aureus 209Р, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569.
6. Застосування за п. 1, де антимікробний засіб являє собою протигрибковий засіб.
7. Застосування за п. 6, де вказаний протигрибковий засіб виявляє активність відносно мікроскопічних грибів роду Candida і/або Criptococcus.
8. Застосування за п. 7, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans.
9. Застосування за п. 6, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465.
10. Застосування за будь-яким з пп. 1-9, де в сполуках загальної формули (І)
або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
 .
.
11. Антимікробний засіб, що являє собою похідне геміну загальної формули (I)
 , I
, I
де R1 і R2 однакові або різні, при цьому
або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Glу-Аlа-(D-Leu)-Аlа-(D-Vаl)-Vаl-(D-Vаl)-Тrp-(D-Lеu)-Х-(D-Lеu)-Тrр-(D-Lеu)-Тrр-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
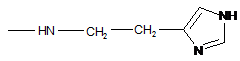 ;
;
Меn+ являє собою Fe2+ або Fe3+;
або його ізомер або суміш ізомерів, або їх фармацевтично прийнятну сіль.
12. Антимікробний засіб за п. 11, який являє собою антибактеріальний засіб.
13. Антимікробний засіб за п. 12, який виявляє активність відносно грампозитивних бактерій роду Staphylococcus, Bacillus, Enterococcus і/або Micrococcus.
14. Антимікробний засіб за п. 13, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus.
15. Антимікробний засіб за п. 13, де бактерії належать до штаму Staphylococcus aureus 209P, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ас-2230, Staphylococcus aureus № 25923 АТСС, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569.
16. Антимікробний засіб за п. 11, який являє собою протигрибковий засіб.
17. Антимікробний засіб за п. 16, який виявляє активність відносно мікроскопічних грибів роду Candida і/або Criptococcus.
18. Антимікробний засіб за п. 17, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans.
19. Антимікробний засіб за п. 17, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465.
20. Антимікробний засіб за будь-яким з пп. 11-19, де в сполуках загальної формули (І)
або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
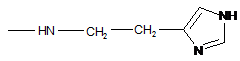 .
.
21. Фармацевтична композиція, яка має антимікробну активність, що включає як активний інгредієнт сполуку формули (І)
 , I
, I
де R1 і R2 однакові або різні, при цьому
один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
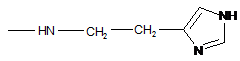 ;
;
Меn+ являє собою Fe2+ або Fe3+;
або її ізомер або суміш ізомерів, або їх фармацевтично прийнятну сіль, в поєднанні з фармацевтично прийнятним носієм або наповнювачем.
22. Фармацевтична композиція за п. 21, яка являє собою антибактеріальний засіб.
23. Фармацевтична композиція за п. 22, яка виявляє активність відносно грампозитивних бактерій роду Staphylococcus, Bacillus, Enterococcus і/або Micrococcus.
24. Фармацевтична композиція за п. 23, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus.
25. Фармацевтична композиція за п. 23, де бактерії належать до штаму Staphylococcus aureus 209P, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569.
26. Фармацевтична композиція за п. 21, яка являє собою протигрибковий засіб.
27. Фармацевтична композиція за п. 26, яка виявляє активність відносно мікроскопічних грибів роду Candida і/або Criptococcus.
28. Фармацевтична композиція за п. 27, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans.
29. Фармацевтична композиція за п. 27, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465.
30. Фармацевтична композиція за будь-яким з пп. 21-29, де в сполуках загальної формули (І)
або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Аlа-(D-Vаl)-Vаl-(D-Vаl)-Тrр-(D-Lеu)-Х-(D-Lеu)-Тrp-(D-Lеu)-Тrр-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe (XV), -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
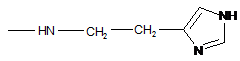 .
.
31. Спосіб лікування і/або профілактики захворювань, викликаних бактеріями або мікроскопічними грибами, що включає введення пацієнту, який потребує цього, засобу за будь-яким з пп. 11-20 або фармацевтичної композиції за будь-яким з пп. 21-30.
32. Спосіб за п. 31, в якому захворювання викликане бактеріями.
33. Спосіб за п. 32, в якому бактерії є грампозитивними бактеріями роду Staphylococcus, Bacillus, Enterococcus або Micrococcus.
34. Спосіб за п. 33, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus.
35. Спосіб за п. 33, де бактерії належать до штаму Staphylococcus aureus 209Р, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569.
36. Спосіб за п. 31, в якому захворювання викликане мікроскопічними грибами.
37. Спосіб за п. 36, де мікроскопічні гриби належать до роду Candida або Criptococcus.
38. Спосіб за п. 37, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans.
39. Спосіб за п. 37, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465.
40. Спосіб за будь-яким з пп. 31-39, де в сполуках загальної формули (І)
або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
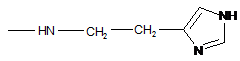 .
.
41. Антисептична і/або дезінфікуюча композиція, що містить сполуку загальної формули (І):
 , І
, І
де R1 і R2 однакові або різні, при цьому
один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
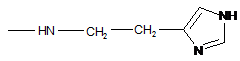 ;
;
Меn+ являє собою Fe2+ або Fe3+;
або її ізомер або суміш ізомерів, або їх фармацевтично прийнятну сіль.
42. Антисептична і/або дезінфікуюча композиція за п. 41, що містить сполуку загальної формули (І), охарактеризовану в п. 10.
43. Похідне геміну загальної формули (І)
 , I
, I
де R1 і R2 однакові або різні, при умові, що обидва R1 і R2 одночасно не являють собою -ОН,
при цьому або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH,
або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА або -Arg-ArgOMe,
де НА являє собою залишок гістаміну
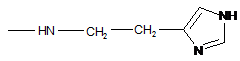 ;
;
Меn+ являє собою Fe2+ або Fe3+,
або його ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль.
44. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Arg-Gly-Asp-OH, або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль.
45. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrр, Phe або Туr (граміцидин D), або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль.
46. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Nd-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль.
47. Сполука за п. 43, де R1=R2=-NHCH2CH2OH, або її фармацевтично прийнятна сіль.
48. Сполука за п. 43, де R1=R2=-GlyOMe, або її фармацевтично прийнятна сіль.
49. Сполука за п. 43, де R1=R2=-NHCH(CH2OH)CH2OH, або її фармацевтично прийнятна сіль.
50. Сполука за п. 43, де R1=R2=-NHCH2CH(OH)CH2OH, або її фармацевтично прийнятна сіль.
51. Сполука за п. 43, де R1=R2=-Glu(ArgOMe)-ArgOMe, або її фармацевтично прийнятна сіль.
52. Сполука за п. 43, де R1=R2=-HA, або її фармацевтично прийнятна сіль.
53. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Arg-Arg-Trp-Trp-Arg-Phe-OH, або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль.
54. Сполука за п. 43, де R1=R2=-Arg-ArgOMe, або її фармацевтично прийнятна сіль.
55. Спосіб отримання сполуки загальної формули (І) за будь-яким з пп. 43-54, що включає взаємодію активованого по карбоксильній/их групі/ах похідного геміну з амінокомпонентом.
56. Спосіб за п. 55, де як активоване похідне геміну використовують 6,7-біс-N-оксисукцинімідний ефір геміну або 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксіімідний ефір геміну, а як розчинник використовують N,N-диметилформамід.
57. Спосіб за п. 55, де для активування по одній з карбоксильних груп геміну використовують ди-трет-бутилпірокарбонат, причому процес проводять в N,N-диметилформаміді в присутності піридину.
Текст
Реферат: Винахід стосується нових антимікробних, в тому числі антибактеріальних і протигрибкових, засобів і композицій на основі похідних геміну загальної формули (І), а також отримання нових похідних геміну. Перевагами антибактеріальних засобів на основі похідних геміну є їх біосумісність, біодеградованість, висока ефективність проти резистентних бактерій і широко поширених і небезпечних для людини мікроскопічних грибів, відсутність токсичності і побічних ефектів. UA 108480 C2 (12) UA 108480 C2 N N Cl Men+ N R1(O)C N C(O)R2 .I UA 108480 C2 5 10 15 20 25 30 35 40 Галузь техніки Винахід стосується галузі біоорганічної хімії і спрямований на розробку нових антимікробних засобів і композицій на основі похідних геміну, а також на отримання нових похідних геміну. Рівень техніки Як відомо, багато небезпечних захворювань людини і тварин викликаються мікроорганізмами, такими як бактерії і мікроскопічні гриби. Бактерії викликають такі захворювання епідемічного характеру, як холера, черевний тиф, паратифи, чума, дифтерія, туляремія, бруцельоз, а також туберкульоз, зараження крові (сепсис), проказа, сифіліс і інш. У тварин бактерії викликають сап, сибірську виразку, туберкульоз і інш. Грибкові захворювання головним чином вражають шкірні покриття і слизові оболонки і являють собою, зокрема, кератомікози, мікроспорію, трихофітію, криптококоз і т. п. Боротьба з мікроорганізмами основується на застосуванні антимікробних засобів, таких як антибактеріальні засоби (в тому числі антибіотики) і протигрибкові засоби. Однак багато відомих засобів мають ряд недоліків, таких як токсичність, чутливість до дії протеолітичних ферментів, гемолітичний ефект, недостатня широта антимікробної дії. Зокрема, у бактерій швидко розвивається резистентність відносно існуючих антимікробних засобів, головним чином антибіотиків. Тому проблема пошуку нових нетоксичних, біосумісних антимікробних засобів, застосування яких не приводило б до резистентності, вельми актуальна. Відомо, що гемін має антимікробну активність відносно золотистого стафілококу [Y. Nitzan, H. Ladan, S. Gozansky, Z. Malik. Characterization of hemin antibacterial action on Staphylococcus aureus //FEMS Microbiol. Lett., 1987, V. 48 (3), р. 401-406]. Однак використання геміну як антибактеріального засобу утруднене внаслідок його нерозчинності у воді, гемолітичної активності, а також короткочасності антибактеріального ефекту. Раніше робилися спроби модифікації геміну шляхом його кон'югації з амінокислотами і пептидами з метою створення біологічно активних похідних. В результаті модифікації карбоксильних груп геміну шляхом отримання відповідних амідів були отримані і досліджені сполуки загальної формули (I), де R1 і R2, однакові або різні, являють собою -ОН або залишок амінокислоти або пептиду, причому R1 і R2 не можуть одночасно означати -ОН. Так, для деяких пептидних похідних геміну загальної формули (I), зокрема, де один з R 1 і R2 являє собою -OH, а інший являє собою -ArgArgTrpHisArgLeuLysGlu(OMe)OH (сполука V) або ArgTrpHisArgLeuLysGlu(OMe)OH (сполука VI), встановлена нуклеазна (нуклеолітична) активність, що виявляється в здатності руйнувати плазмідну ДНК [патент RU № 2250906, 27.04.2005; Желтухіна Г.А., Лобанова Т.Н., Небольсин В.Е., М.О. Галямов, Драніцина С.М., Костанян І.А. // Біоорган. хімія. 2006. Т. 32, №2, С. 198-210]. Окремі амінокислотні і пептидні похідні геміну загальної формули (I), а саме ті, у яких один з R1 і R2 являє собою -OH, а інший являє собою -ArgArgTrpHisArgLeuLysGlu(OMe)OH (сполука V), або R1=R2=-ArgOMe (сполука VII), здатні інгібувати протеїназу ВІЛ і чинити, внаслідок цього, противірусну анти-ВІЛ дію [патент RU № 2238950, 27.10.2004]. Також показано, що деякі похідні геміну загальної формули (I), а саме ті, у яких R 1=R2=SerOMe (сполука VIII), R1=R2=-βAlaHis (сполука X), R1=R2=-ArgOMe (сполука VII), R1=R2=-βAlaHA (сполука IX, HA - залишок гістаміну), або один з R1 і R2 являє собою -OH, а інший являє собою rgArgTrpHisArgLeuLysGlu(OMe)OH (сполука V), або -ArgTrpHisArgLeuLysGlu(OMe)OH (сполука VI), мають противірусну активність [заявка RU 2007125604, 20.01.2009]. 1 UA 108480 C2 5 10 15 20 25 30 35 40 Однак антимікробна, в тому числі антибактеріальна і протигрибкова, активність вказаних вище похідних геміну не відома з рівня техніки. З іншого боку, останнім часом багато уваги приділялося дизайну нових антимікробних агентів на основі антимікробних пептидів (АМП) [A. Giuliani, G. Pirri, S.F. Nicoletto. Antimicrobial peptides: an overview of а promising class of therapeutics//Central European Journal of Biology, 2007, V. 2(1), р. 1 33]. Серед відомих антимікробних пептидів можна назвати лінійний граміцидин D, що являє собою суміш пептидів формули (II): Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)TrpNHCH2CH2OH (II) де X=Trp, Tyr, Phe [W. E. Herrelland D.Heilman. Experimental and Clinical Studies on Gramicidin //J. Clin. Invest., 1941, V.20, 583-591.], і циклічний граміцидин S формули (III): [G. Nagamurthi and S. Rambhav. Gramicidin-S: Structure activity relationship//J. Biosci., 1985, V.7, № 3-4, p.323-329]. Сполука ІІ ефективна проти грампозитивних бактерій [W.E. Herrell and D. Heilman. Experimental and Clinical Studies on Gramicidin //J. Clin. Invest., 1941, V. 20, № 583] і деяких вірусів, зокрема герпесу [US Patent 6001808, 1999]. Сполука ІІI ефективна головним чином проти грампозитивних бактерій в концентраціях 5-15 мкМ [Jingbo Xiao, Bernard Weisblum, and Peter Wipf. Electrostatic versus Steric Effects in Peptidomimicry: Synthesis and Secondary Structure Analysis of Gramicidin S Analogues with (Е)-Alkene Peptide Isosteres //J. Am. Chem. Soc., 2005, 127 (16), pp 5742 5743]. Сполуки ІІ і III використовуються в медичній практиці тільки для зовнішнього застосування. Недоліками цих антимікробних сполук є їх відносно велика довжина і, відповідно, порівняно висока вартість, недостатня широта антибактеріальної, протигрибкової і антивірусної дії, а також побічні ефекти, що проявляються при застосуванні, в основному це гемоліз еритроцитів і алергічні реакції. Відомий також пептид Arg-Gly-Asp (IV), який є фрагментом антимікробних пептидів сімейства цекропінів, багатьох мікробних білків і фібронектину поверхні клітин ссавців [A.J. Kastin. Handbook of biologically active peptides// Elsevier, Academic Press, USA, 2006, p. 576]. Однак до цього часу можливість його застосування як засобу для лікування інфекційних захворювань не була вивчена. Основними перешкодами до застосування АМП в клінічній практиці є їх порівняно висока вартість, чутливість до дії протеолітичних ферментів, а також властивий багатьом АМП гемолітичний ефект. Крім того, в даний час антимікробні пептиди отримують в основному твердофазним методом, що робить ці речовини такими, що надзвичайно дорого коштують, а їх застосування економічно недоцільним. Тому є вельми актуальним пошук коротших аналогів АМП і їх похідних, в тому числі кон'югатів із сполуками інших класів. У зв'язку з тим, що зберігається потреба у вдосконаленні антимікробних засобів відносно зниження їх токсичності, зменшення інших побічних ефектів, а також в підвищенні активності проти резистентних штамів, було запропоновано використати як такі засоби похідні геміну. Суть винаходу Даний винахід стосується застосування похідних геміну загальної формули (I) 2 UA 108480 C2 5 10 15 20 , де R1 і R2 однакові або різні, при умові, що обидва R 1 і R2 одночасно не являють собою -ОН, при цьому або один з R1 і R2 являє собою -OH, а інший являє собою ArgArgTrpHisArgLeuLysGlu(OMe)OH, -ArgTrpHisArgLeuLysGlu(OMe)OH, -Val-Gly-Ala-(D-Leu)-Ala(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp, або Phe, або δ Tyr (граміцидин D), -N -цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -ArgArg-Trp-Trp-Arg-Phe-OH, або R1 і R2 обидва являють собою -ArgOMe, -SerOMe, -βAlaHA, -βAlaHis, -NHCH2CH2OH, GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA або -ArgArgOMe, де HA являє собою залишок гістаміну ; n+ 2+ 3+ Me являє собою Fe або Fe ; або їх ізомерів або сумішей ізомерів, або їх фармацевтично прийнятних солей як антимікробних засобів. Також винахід стосується антимікробного, в тому числі антибактеріального і/або протигрибкового, засобу на основі вищезгаданих сполук формули (I) і відповідних фармацевтичних, антисептичних і/або дезінфікуючих композицій, а також способу лікування і/або профілактики захворювань, викликаних мікроорганізмами. Також винахід стосується нових похідних геміну загальної формули (I) , де R1 і R2 однакові або різні, при умові, що обидва R1 і R2 одночасно не являють собою -ОН, при цьому або один з R1 і R2 являє собою -OH, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp, або Phe, або 3 UA 108480 C2 δ Tyr (граміцидин D), -N -цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -ArgArg-Trp-Trp-Arg-Phe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA або -Arg-ArgOMe, 5 10 15 20 25 30 35 40 45 50 55 де HA являє собою залишок гістаміну ; n+ 2+ 3+ Me являє собою Fe або Fe ; або їх ізомерів або сумішей ізомерів, або їх фармацевтично прийнятних солей, а також способу синтезу цих сполук. Короткий опис фігур креслень На Фіг. 1 зображені графіки, що відображають динаміку виходу карбоксифлуоресцеїну з модельних ліпосом під дією похідних геміну. На Фіг. 2 показана залежність гемолітичної активності (що оцінюється по інтенсивності виходу гемоглобіну з еритроцитів) від концентрації похідних геміну. Докладний опис винаходу Автори даного винаходу несподівано виявили, що сполуки приведеної вище формули (I), що являють собою кон'югати геміну з пептидами, амінокислотами або їх аналогами, є перспективними антимікробними засобами. Перевагами похідних геміну формули (I) є їх біосумісність і біодеградованість, низька токсичність відносно нормальних клітин людини і відсутність гемолітичного ефекту, а також висока антибактеріальна ефективність, в тому числі проти резистентних штамів, в поєднанні з протигрибковою активністю. Без наміру обмеження якою-небудь теорією, автори передбачають, що антимікробна дія сполук формули (I) може бути частково пояснена їх деструктуючою дією відносно ліпідної мембрани, що, як відомо, є одним з основних механізмів антимікробної дії. Дана дія продемонстрована в прикладі 12 і на фіг. 1. Таким чином, були отримані і досліджені наступні нові сполуки формули (I): Сполука (XI): один з R1 і R2 являє собою -OH, а інший являє собою -Arg-Gly-Asp-OH; Сполука (XII): один з R1 і R2 являє собою -OH, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp, Phe або Tyr, (граміцидин D); δ Сполука (XIII): один з R1 і R2 являє собою -OH, а інший являє собою -N -цикло-(Orn-Leu-DPhe-Pro-Val)2 (граміцидин S); Сполука (XIV): R1=R2=-NHCH2CH2OH; Сполука (XV): R1=R2=-GlyOMe; Сполука (XVI): R1=R2=-NHCH(CH2OH)CH2OH; Сполука (XVII): R1=R2=-NHCH2CH(OH)CH2OH; Сполука (XVIII): R1=R2=-Glu(ArgOMe)-ArgOMe; Сполука (XIX): R1=R2=-HA; Сполука (XX): один з R1 і R2 являє собою -OH, а інший являє собою -Arg-Arg-Trp-Trp-ArgPhe-OH; Сполука (XXI): R1=R2=-Arg-ArgOMe; де HA являє собою . Крім нових сполук були досліджені також відомі похідні геміну загальної формули (I), які продемонстрували аналогічні властивості, а саме: Сполука (V): один з R1 і R2 являє собою -OH, а інший являє собою ArgArgTrpHisArgLeuLysGlu(OMe)OH; Сполука (VI): один з R1 і R2 являє собою -OH, а інший являє собою ArgTrpHisArgLeuLysGlu(OMe)OH; Сполука (VII): R1=R2=-ArgOMe; Сполука (VIII): R1=R2=-SerOMe; Сполука (IX): R1=R2=-βAlaHA, де НА - залишок гістаміну; Сполука (X): R1=R2=-βAlaHis; Сполуки (V), (VI) розкриті в патенті RU № 2250906, 27.04.2005 і статті Желтухіна Г.А., Лобанова Т.Н., Небольсин В.Е., М.О. Галямов, Драніцина С.М., Костанян І.А. // Біоорган. хімія. 2006. Т. 32, №2, С. 198-210, сполука (VII) розкрита в патенті RU № 2238950, 27.10.2004, сполуки 4 UA 108480 C2 (VIII), (IX), (X) розкриті в заявці RU 2007125604, 20.01.2009. Однак антимікробна, в тому числі антибактеріальна і протигрибкова, активність цих сполук раніше не була досліджена. Таким чином, даний винахід спрямований на застосування похідних геміну загальної формули (I) 5 10 15 20 25 30 35 40 , де R1 і R2 однакові або різні, при умові, що обидва R 1 і R2 одночасно не являють собою -ОН, при цьому або один з R1 і R2 являє собою -OH, а інший являє собою ArgArgTrpHisArgLeuLysGlu(OMe)OH, -ArgTrpHisArgLeuLysGlu(OMe)OH, -Val-Gly-Ala-(D-Leu)-Ala(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp, або Phe, або δ Tyr (граміцидин D), -N -цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -ArgArg-Trp-Trp-Arg-Phe-OH, або R1 і R2 обидва являють собою -ArgOMe, -SerOMe, -βAlaHA, βAlaHis, -NHCH2CH2OH, GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA або -ArgArgOMe, де HA являє собою залишок гістаміну ; n+ 2+ 3+ Me являє собою Fe або Fe ; або їх ізомерів або сумішей ізомерів, або їх фармацевтично прийнятних солей як антимікробних засобів. Антимікробна активність включає як антибактеріальну, так і протигрибкову активність. Представлені вище сполуки формули (I) виявляють активність проти грампозитивних бактерій, таких як бактерії роду Staphylococcus (наприклад, Staphylococcus aureus), Bacillus (наприклад, Bacillus subtilis), Enterococcus (наприклад, Enterococcus faecalis) і Micrococcus (наприклад, Micrococcus luteus), в тому числі резистентних, тобто тих, що мають стійкість до дії відомих антибактеріальних засобів. Переважно, вказані бактерії належать до штамів Bacillus subtilis BKM В-501, Staphylococcus aureus 209P, Enterococcus faecalis ВКМ В-871 або Micrococcus luteus ВКМ Ac-2230. Ще більш переважно, вказані сполука виявляють антибактеріальну активність проти резистентних штамів Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 KC, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569. Крім того, представлені вище сполуки формули (I) виявляють активність проти мікроскопічних грибів Cryptococcus (зокрема, Cryptococcus neoformans, переважно штаму Cryptococcus neoformans № 3465), а також Candida (зокрема, Candida albicans, переважно штаму Candida albicans № 927). Сполуки формули (I) можуть існувати у вигляді ізомерів, а також у вигляді сумішей ізомерів, які повністю входять в об'єм заявленого винаходу. Наприклад, при модифікації однієї з двох карбоксильних груп геміну може утворюватися суміш (6),(7)-похідних. Всі амінокислоти, що входять до складу похідних геміну, являють собою L-амінокислоти, якщо не вказано інше. Сполуки формули (I) можуть бути використані як у вигляді солей з фармацевтично прийнятними кислотами, наприклад, молочної, винної, лимонної, хлористоводневої і інш., так і у 5 UA 108480 C2 5 10 15 20 25 30 35 40 вигляді солей по карбоксильних групах з іонами лужних і лужноземельних металів, таких як натрій, калій, кальцій, або, наприклад, з фармацевтично прийнятними основами, такими як аміак, етаноламін. Вказані вище сполуки формули (I) і/або їх солі можуть бути використані як активні інгредієнти в фармацевтичних композиціях (наприклад, в твердій, напівтвердій або рідкій формах) в суміші з органічним або неорганічним носієм або наповнювачем. Активний інгредієнт може бути включений в композицію разом з звичайно використовуваними нетоксичними, фармацевтично прийнятними носіями, придатними для виготовлення розчинів, таблеток, пілюль, капсул, супозиторіїв, емульсій, суспензій, спреїв, інгаляторів, крапель, мазей і будь-яких інших лікарських форм. Як носії можуть бути використані вода, глюкоза, лактоза, аравійська камедь, желатин, крохмаль, триксиліт магнію, тальк, кукурудзяний крохмаль, сечовина, поліетиленгліколь і інші носії, придатні для виготовлення твердих, м'яких або рідких препаратів. При цьому, як добавки можуть бути використані стабілізатори, загусників, барвники і віддушки. Сполуки формули I вводять в композицію в кількості, достатній для отримання антимікробного ефекту. При виготовленні разової лікарської форми кількість активного інгредієнта, що використовується в комбінації з носієм, може варіювати залежно від реципієнта, що піддається лікуванню, від конкретного способу введення лікарського засобу. Так, наприклад, при використанні сполук даного винаходу у вигляді розчинів для ін'єкцій вміст діючого начала в них становить 0,001-1 масових %. Як розріджувач речовини можуть бути використані 0,9 % розчин натрію хлориду, дистильована вода, розчин новокаїну для ін'єкцій, розчин Рінгера, розчин глюкози. При використанні сполуки загальної формули (I) у вигляді таблеток і супозиторіїв кількість речовини становить 1,0-100,0 мг на одиничну дозовану форму. Для таблеток і супозиторіїв як фармацевтичний наповнювач використовують будь-яку фармацевтично придатну основу. Оскільки сполуки загальної формули (I) є як водорозчинними, так і ліпофільними, то вони можуть застосовуватися у вигляді водних розчинів, спиртових розчинів, мазей, кремів і т. д. Далі, винахід стосується антимікробного лікарського засобу на основі вказаних вище сполук формули (I), а також способу лікування захворювань, що викликаються вказаними вище бактеріями і/або мікроскопічними грибами, що включає введення потребуючому цього пацієнту вказаної вище сполуки формули (I) або фармацевтичної композиції на її основі. Спосіб призначений для лікування пацієнтів-ссавців, в тому числі людей. Рекомендовані дози сполуки формули (I) становлять 0,01-10 мг/кг. Оскільки сполуки формули (I) мають антибактеріальну і протигрибкову активність, вони можуть також використовуватися як або в складі антисептичних і/або дезінфікуючих засобів. Такі засоби можуть бути виготовлені, наприклад, у вигляді розчинів з використанням різних розчинників, таких як вода і нижчі спирти (наприклад, 1-пропанол або 2-пропанол). Також об'єктом винаходу є нові похідні геміну загальної формули (I) , де R1 і R2 однакові або різні, при умові, що обидва R1 і R2 одночасно не являють собою -ОН, при цьому або один з R1 і R2 являє собою -OH, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp, або Phe, або 6 UA 108480 C2 δ Tyr (граміцидин D), -N -цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -ArgArg-Trp-Trp-Arg-Phe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -HA або -Arg-ArgOMe, 5 10 15 20 25 30 35 40 45 50 55 де HA являє собою залишок гістаміну ; n+ 2+ 3+ Me являє собою Fe або Fe ; або їх ізомери або суміші ізомерів, або їх фармацевтично прийнятні солі. Ще один аспект винаходу стосується способу отримання описаних вище нових сполук формули (I). Сполуки формули (I) отримують шляхом взаємодії активованої по карбоксильній/их групі/ах похідного геміну з амінокомпонентом. Як амінокомпоненти використовують пептиди, амінокислоти (в основному, α-амінокислоти) або їх аналоги, зокрема, Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(DLeu)-Trp-NHCH2CH2OH, де X=Trp, або Phe, або Tyr (граміцидин D), цикло-(Orn-Leu-D-Phe-ProVal)2 (граміцидин S), Arg-Gly-Asp-OH, NH2CH2CH2OH, GlyOMe, NH2CH(CH2OH)CH2OH, NH2CH2CH(OH)CH2OH, Glu(ArgOMe)-ArgOMe, гістамін (HA), Arg-Arg-Trp-Trp-Arg-Phe-OH і ArgArgOMe. Переважно, аміногрупи амінокомпонентів (наприклад, α-аміногрупи амінокислот) ацилюють біс-N-оксисукцинімідним ефіром геміну; або, при отриманні моно-похідних геміну, 6(7)-моно-Nокси-5-норборнен-2,3-дикарбоксіімідним ефіром геміну; або активованим по одній карбоксильній групі похідним геміну, причому як активуючий агент використовують ди-трет-бутилпірокарбонат в присутності піридину. Реакції проводять в DMF протягом 0,5-2 годин, при температурі від -15° до +30 °С. Таким чином, пропонуються нові ефективні антимікробні засоби з антибактеріальною і протигрибковою дією на основі похідних геміну. Їх перевагами є біосумісність, біодеградованість, активність відносно ресистентних штамів бактерій, відсутність токсичності і побічних ефектів. При цьому концентрації, в яких сполуки, що заявляються, виявляють токсичну дію відносно нормальних клітин, вищеїх МІК (мінімальної інгібуючої концентрації) і МБК (мінімальної бактерицидної концентрації) на 2-3 порядки. Отже, сполуки, що заявляються, з великою імовірністю мають широкий спектр антимікробної активності, що робить їх перспективними для застосування як лікарських засобів. Винахід далі ілюструється за допомогою прикладів, які не призначені для обмеження його об'єму. Список скорочень DCC-N,N'-дициклогексилкарбодіімід DMSO - диметилсульфоксид DOPC - діолеоїлфосфатидилхолін GrD - граміцидин D HA - гістамін Hem - залишок геміну MeOH - метиловий спирт MES-2-(N-морфоліно)етансульфокислота MH - середовище Mueller-Hilton OMe- метиловий ефір ONb-N-окси-5-норборнен-2,3-дикарбоксіімідний ефір OtBu - трет-бутиловий ефір Z - карбобензокси-група ДМСО - диметилсульфоксид ДМФА - N,N'-диметилформамід ІЧ - інфрачервона спектроскопія ІР - інгібування росту КФ - карбоксифлуоресцеїн МБК - мінімальна бактерицидна концентрація МІК - мінімальна інгібуюча концентрація МПК - мінімальна переважна концентрація ОФ-ВЕРХ - обернено-фазна високоефективна рідинна хроматографія Тris - тріс-(гідроксиметил)амінометан 7 UA 108480 C2 5 10 15 20 25 30 35 40 45 50 55 60 ТСХ- хроматографія в тонкому шарі ХЛФ - хлороформ ЕА - етилацетат Всі величини, виражені в процентах, стосуються процентів по масі, якщо не указано інакше. Приклади У роботі використовувалися амінокислоти і їх похідні L-ряду фірми "Bachem" (Німеччина), "Reanal" (Угорщина), DOPC (Sigma-Aldrich), карбоксифлуоресцеїн (Fluka, Німеччина), MES (Sigma-Aldrich), Tris (Sigma-Aldrich), граміцидин D (Sigma-Aldrich), граміцидин S (Красфарма, Росія) хлорид калію ч.д.а. (Хіммед, Росія) Всі розчинники безводні, за винятком тих, які використовувалися для екстракції з водних розчинів. Індивідуальність отриманих сполук перевіряли методом ТСХ на пластинах Kieselgel 60 F254 (Merck, Німеччина) в системах: хлороформ - метанол 9:1 (1), хлороформ - метанол 8:2 (2), хлороформ - метанол 5:3 (3), хлороформ - метанол - оцтова кислота 5:3:1 (4), метанол - оцтова кислота - вода 4:1:1 (5), бутанол - оцтова кислота - вода 4:1:1 (6). Хроматограми виявляли хлортолідиновим реактивом, нінгідрином, по світінню в УФ-світлі. Мас-спектри високого розрізнення отримували на час-пролітному мас-спектрометрі "Ultraflex" ("Bruker", Німеччина) методом матриксної лазерно-десорбційної іонізації (TOF MALDI), як матриця використовувалася 2,5-дигідроксибензойна кислота. ІЧ-спектри реєстрували на Фур'є-спектрометрі: "Magna 750" ("Nicolet", США). Електронні спектри знімали на спектрофотометрі "Jasco" модель UV/VS 7800 (Японія). ОФ-ВЕРХ проводили на приладі Gilson 305 (Gilson, Франція). Препаративну ОФ-ВЕРХ проводили на колонці Luna 10µ, обернена фаза C5, розміри 25021,2 мм, (Phenomenex, США) в наступних умовах: Ізократична елюція 0,1 % розчином TFA у воді, швидкість потоку 4 мл/хв. Поглинання реєстрували при довжині хвилі 220 нм (7). Динаміку виходу КФ з ліпосом контролювали на флуориметрі Cary Eclipse (Varian, США). Ліпосоми отримували за допомогою міні-екструдера Avanti (Avanti Polar Lipids, США) Приклад 1 α 6,7-біс-(метиловий ефір N -гліцил)-протогемін (IX) (сполука XV, R1=R2=-GlyOMe) До суспензії 0,030 г (0,236 ммоль) H-GlyOMe•HCl в 1,5 мл DMF додавали 0,033 мл (0,236 ммоль) Et3N і перемішували при кімнатній температурі 3 хв. До отриманого розчину додавали розчин 0,100 г (0,118 ммоль) 6,7-біс-N-оксисукцинімідного ефіру протогеміну IX (I) в 5 мл DMF, і перемішували 2 години при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (1) і (2). Розчин концентрували у вакуумі до 0,5 мл і додавали 6 мл діетилового ефіру. Отриманий залишок розчиняли в ХЛФ, при цьому спостерігалося випадання білих кристалів Et3N•HCl, від яких позбувалися декантацією розчину. Розчинник видаляли у вакуумі. Для введення протиіону Cl залишок розчиняли в 15 мл суміші ХЛФ-МеОН (8:2), два рази струшували з 7,5 мл 0,5 N розчину соляної кислоти і промивали водою до нейтральної реакції. Розчинник видаляли у вакуумі. Речовину очищали на колонці (20×2 см) з силікагелем Kieselgel 60 F254 (Merck, Німеччина), елюювали сумішшю ХЛФ-МеОН (8:2). Фракцію, що містить речовину з Rf 0,71 (2), збирали. Розчинник видаляли у вакуумі. Вихід 0,063 г (67 %), Rf 0,26 (1), -3 0,71 (2). Електронний спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10 ): 400 (115,9), 508 (9,38), 640 -1 : (3,81). ІЧ-Фур'є спектр, ν, см , таблетка KBr 1737 (СО скл. еф.), 1648 (амід I), 1539 (амід II). Масспектр, m/z: [M]+ 758,5. Приклад 2 6,7-біс-гістамініл-протогемін (IX) (сполука XIX, R1=R2=HA) До розчину 0,026 г (0,236 ммоль) гістаміну в 1,5 мл DMF додавали розчин 0,100 г (0,118 ммоль) 6,7-біс-N-оксисукцинімідного ефіру протогеміну IX (I) в 4 мл DMF і перемішували 20 хв. при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (2) і (3). Розчин концентрували у вакуумі до 1 мл і додавали 10 мл діетилового ефіру. Для введення протиіону Cl залишок розчиняли в 4 мл МеОН і додавали 0,093 мл (0,354 ммоль) 3,8 N HCl/MeOH до досягнення рН 4. Розчинник видаляли у вакуумі при температурі 30 °С. Речовину очищали на колонці (31×2 см) з силікагелем Kieselgel 60 F 254 (Merck, Німеччина), елюювали сумішшю ХЛФ-МеОН (5:3). Фракцію, що містить речовину з Rf 0,64 (3), збирали. Розчинник видаляли у вакуумі. Вихід 0,049 г (51 %), Rf 0,25 (2), 0,64 (3). Електронний спектр, -3 -1 λmax, нм, ХЛФ:МеОН (8:2), (ε·10 ): 388 (49,1), 508 (4,18), 640 (1,76). ІЧ-Фур'є спектр, ν, см , таблетка KBr:1644 (амід I), 1543 (амід II). Мас-спектр, m/z: [M]+ 802,3. Приклад 3 α 6,7-біс-[біс-(метиловий ефірN -L-аргініл)-L-глутаміл]-протогемін IX (XVIII, R1=R2=Glu(ArgOMe)-ArgOMe) 8 UA 108480 C2 α 5 10 15 20 25 30 35 40 45 50 55 60 1. Біс-(метиловий ефір N -аргініл)-L-глутамінової кислоти дигідрохлорид До суспензії 0,069 г (0,266 ммоль) Н-ArgOMe•2HCl в 2 мл DMF додавали 0,074 мл (0,531 ммоль) Et3N і перемішували при кімнатній температурі 5 хв. До отриманого розчину додавали 0,077 г (0,133 ммоль) біс-пентафторфенілового ефіру Вос-глутамінової кислоти, отриманого раніше, і перемішували 4 години при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (5). Розчин концентрували у вакуумі до 1 мл і додавали 10 мл діетилового ефіру. Маслоподібний осад відділяли від розчинника декантуванням, залишки розчинника видаляли у вакуумі. Речовину очищали на колонці (23×1 см) з силікагелем Kieselgel 60 F254 (Merck, Німеччина), елюювали сумішшю метанол - оцтова кислота - вода 4:0,5:0,5. Фракцію, що містить речовину з Rf 0,67 (5), збирали. Розчинник видаляли у вакуумі. Вихід 0,073 25 -1 г (77 %), Rf 0,67 (5). [α]D -8,53° (С 0,38; МеОН). ІЧ-Фур'є спектр, ν, см , таблетка KBr: 1735 (СО скл. еф.), 1653 (амід I), 1542, 1558 (амід II). Мас-спектр, m/z: [M]+ 588,31. α До 0,073 г (0,0946 ммоль) біс-(метиловий ефіру N -аргініл)-Boc-L-глутамінової кислоти (V) підливали 6 мл ~3 N HCl/MeOH. Отриману суспензію перемішували 2 години при кімнатній температурі. Контроль процесу здійснювали ТСХ в умовах (6). Після досягнення повної конверсії в аміновільний дипептид розчинник видаляли у вакуумі при 30 °С. Маслоподібний залишок кристалізували під безводним діетиловим ефіром, розчинник відділяли декантацією. α 2. 6,7-біс-[(біс-метиловий ефір N -L-аргініл)-L-глутаміл]-протогемін IX (XVIII) До суспензії отриманого Н-Glu(ArgOMe)2•3HCl в 1,5 мл DMF додавали 0,047 мл (0,335 ммоль) Et3N і перемішували при кімнатній температурі 2 хв. Спостерігали випадання осаду Et3N•HCl. До отриманої суспензії додавали розчин 0,047 г (0,0558 ммоль) 6,7-біс-Nоксисукцинімідного ефіру протогеміну IX (I) в 2 мл DMF і перемішували 22 години при кімнатній температурі. Контроль за протіканням реакції здійснювали ТСХ в умовах (6). Розчин концентрували у вакуумі до 1 мл і додавали 10 мл діетилового ефіру. Для введення протиіона Cl залишок розчиняли в 4 мл МеОН і додавали 3,8 N HCl/MeOH до досягнення рН 4. Розчинник видаляли у вакуумі при температурі 30 °С. Речовину тричі очищали на колонці (13×1 см) з сефадексом LH-20, елюювали МеОН. Фракцію, що містить речовину з Rf 0,07 (6), збирали. Розчинник видаляли у вакуумі. Вихід 0,030 г (34 %). Rf 0,07 (6), Rf(на окисі алюмінію) 0,70 (6). -3 Електронний спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10 ): 400 (92,2), 508 (6,31), 636 (2,39). ІЧ-Фур'є -1 : спектр, ν, см , таблетка KBr 1737 (СО скл. еф.), 1649 (амід I), 1528 (амід II). Мас-спектр, m/z: [M]+ 1554,97. Приклад 4 6,7-біс-N-(2-гідроксиетил)амід протогеміну (IX) (XIV, R1=R2=-NH-CH2-CH2-OH) До розчину 0,050 г (0,0591 ммоль) 6,7-біс-N-оксисукцинімідного ефіру протогеміну IX (I) в 3 мл DMF додавали 0,010 мл (0,118 ммоль) аміноетанолу і перемішували 20 хв. при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (2) і (3). Розчин концентрували у вакуумі до 1 мл і додавали 10 мл діетилового ефіру. Для введення протиіона Cl залишок розчиняли в 3 мл МеОН і додавали 3,8 N HCl/MeOH до досягнення рН 4. Розчинник видаляли у вакуумі при температурі 30 °С. Речовину очищали на колонці (24×1 см) з силікагелем Kieselgel 60 F254 (Merck, Німеччина), елюювали сумішшю ХЛФ-МеОН (5:3). Фракцію, що містить речовину з Rf 0,52 (3), збирали. Розчинник видаляли у вакуумі. Вихід 0,036 г -3 (82,5 %), Rf 0,35 (2), 0,52 (3). Електронний спектр, λ max, нм, ХЛФ:МеОН (8:2), (ε·10 ): 400 (183,0), -1 508 (5,23), 640 (2,08). ІЧ-Фур'є спектр, ν, см , таблетка KBr: 1632 (амід I), 1549 (амід II). Масспектр, m/z: [M]+ 702,5. Приклад 5 6,7-біс-N-(1,3-дигідроксипропан-2-іл)амід протогеміну (IX) (XVI, R1=R2=-HN-CH(CH2OH)CH2OH) До розчину 0,050 г (0,0591 ммоль) 6,7-біс-N-оксисукцинімідного ефіру протогеміну IX (I) в 3 мл DMF додавали розчин 0,012 г (0,118 ммоль) 2-аміно-1,3-пропандіолу в 0,5 мл DMF і перемішували 20 хв. при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (4). Розчин концентрували у вакуумі до 0,5 мл і додавали 6 мл діетилового ефіру. Для введення протиіона Cl залишок розчиняли в 9 мл суміші ХЛФ-МеОН (8:2), один раз струшували з 4 мл 0,06 N розчину соляної кислоти, насиченого NaCl, і промивали водою до нейтральної реакції. Розчинник видаляли у вакуумі. Речовину очищали на колонці (21×2 см) з сефадексом LH-20, елюювали МеОН. Фракцію, що містить речовину з Rf 0,56 (4), збирали. Розчинник видаляли у вакуумі. Вихід 0,018 г (36 %), Rf 0,56 (4). Електронний спектр, -3 -1 λmax, нм, ХЛФ:МеОН (8:2), (ε·10 ): 400 (40,5), 508 (2,68), 640 (1,02). ІЧ-Фур'є спектр, ν, см , таблетка KBr: 1629 (амід I), 1550 (амід II). Мас-спектр, m/z: [M]+ 762,0. Приклад 6 6,7-біс-N-(2,3-дигідроксипропіл)амід протогеміну (IX) (XVII, R1=R2=-HN-H2C-CH(OH)-CH2OH) 9 UA 108480 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину 0,050 г (0,0591 ммоль) 6,7-біс-N-оксисукцинімідного ефіру протогеміну IX (I) в 3 мл DMF додавали 0,009 мл (0,118 ммоль) 3-аміно-1,2-пропандіолу і перемішували 20 хв. при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (3) і (4). Розчин концентрували у вакуумі до 0,5 мл і додавали 6 мл діетилового ефіру. Для введення протиіона Cl залишок розчиняли в 3 мл МеОН і додавали 3,8 N HCl/MeOH до досягнення рН 4. Розчинник видаляли у вакуумі при температурі 30 °С. Речовину очищали на колонці (30×2 см) з силікагелем Kieselgel 60 F254 (Merck, Німеччина), елюювали сумішшю ХЛФ-МеОН:АсОН (5:3:0,5). Фракцію, що містить речовину з Rf 0,69 (4), збирали. Розчинник видаляли у вакуумі. Вихід 0,023 -3 г (46 %), Rf 0,33 (3), 0,69 (4). Електронний спектр, λ max, нм, ХЛФ:МеОН (8:2), (ε·10 ): 396-400 -1 (24,2), 488 (2,14), 600 (1,40). ІЧ-Фур'є спектр, ν, см , таблетка KBr: 1634 (амід I), 1565 (амід II). Мас-спектр, m/z: [M]+ 762,0. Приклад 7 6(7)-моно-(-Val-Gly-Ala-D-Leu-Ala-D-Val-Val-D-Val-Trp-)амід протогеміну (IX) (XII, один з R1 і R2 являє собою -OH, а інший являє собою -Val-Gly-Ala-D-Leu-Ala-D-Val-Val-D-Val-Trp-, де Х = Trp, Tyr, Phe) До розчину 32 мг (0,017 ммоль) граміцидину D в 0,650 мл сухого ДМФА додавали 48 мкл 1 N HCl в метанолі. Реакційну суміш перемішували 72 год. в темряві при кімнатній температурі. Розчинник видаляли у вакуумі при 30С. Вихід 30 мг (98 %). Мас-спектр, m/z: [M]+ 1854,0 До розчину 30 мг (0,016 ммоль) деформілованого граміцидину D в 0,2 мл ДМФА додавали 13,2 мг (0,016 ммоль) 6(7)-моно-N-окси-5-норборнен-2,3-дикарбоксіімідного ефіру геміну і перемішували 1,5 год. при кімнатній температурі. Розчинник видаляли у вакуумі при 30 °С. Залишок розчиняли в хлороформі. Залишок очищали на колонці (30×2 см) з силікагелем Kieselgel 60 F254 (Merck, Німеччина), елюювали сумішшю ХЛФ-МеОН 9:1. Вихід 23,5 мг (59 %). -1 ІЧ-Фур'є спектр, ν, см , таблетка KBr: 1634 (амід I), 1565 (амід II). Rf 0,65 (1). Приклад 8 6(7)-моно-[цикло-(Orn-Leu-D-Phe-Pro-Val)2])амід протогеміну (IX) (XIII, один з R1 і R2 являє α собою -OH, а інший являє собою -N -[цикло-(Orn-Leu-D-Phe-Pro-Val)2]) До розчину 50 мг (0,077 ммоль) геміну в 0,5 мл сухого ДМФА додавали 1 мл піридин і 25,3 мг (0,116 ммоль) ди-трет-бутилпірокарбонату і перемішували 15 хв. при кімнатній температурі. Одночасно до суспензії 93,5 мг (0,077 ммоль) дигідрохлориду граміцидину S в 0,5 мл ДМФА додавали 22 мкл (0,154 ммоль) триетиламіну і перемішували 2 хв. До отриманого змішаного ангідриду геміну додавали розчин аміновільного граміцидину S і перемішували 3 год. Розчинник видаляли у вакуумі при температурі 30 °С. Залишок розчиняли в хлороформі. Залишок очищали на колонці (30×2 см) з силікагелем Kieselgel 60 F 254 (Merck, Німеччина), елюювали сумішшю ХЛФ-МеОН 12:1. Вихід 20 мг (15 %). Мас-спектр, m/z: [M]+ -3 1739,5. Електронний спектр, λmax, нм, хлороформ:метанол (4:1), (ε·10 ): 400 (105), 492 (10,6), 640 (6). Приклад 9 6(7)-моно-(Arg-Gly-Asp)-протогемін (IX) (XI, один з R1 і R2 являє собою -OH, а інший являє собою -Arg-Gly-Asp-OH) До суспензії 20 мг (0,038 ммоль) Arg-Gly-Asp·CH3COOH·CF3COOH в 0,5 мл ДМФА додавали 5 мкл (0,038 ммоль) триетиламіну і перемішували 2 хв. Потім додавали 62 мкл (0,251 ммоль) біс-(О, N-триметилсиліл)ацетаміду і перемішували при кімнатній температурі 30 хв. У отриману суспензію вносили 32 мг (0,038 ммоль) 6,7-біс-N-оксисукцинімідного ефіру протогеміну IX, і реакційну масу перемішували 6 годин. Потім розчинник видаляли у вакуумі, осад розчиняли в метанолі для десилілування карбоксильних груп трипептиду. Цільовий продукт перекристалізовували з метанолу. Вихід 20 мг (54 %). Мас-спектр, m/z: [M]+ 981,3 Приклад 10 α N [6(7)-(Протогемін IX)-іл]- ArgArgTrpTrpArgPhe-OH (XX, один з R1 і R2 являє собою -OH, а інший являє собою -ArgArgTrpTrpArgPhe-OH) а) Твердофазний синтез ArgArgTrpTrpArgPhe-OH (XXI) на 2-хлортритил-хлоридному полімері Визначення ступеня приєднання стартової амінокислоти. До 0,1 г полімеру, що містить 1,43 ммоль активних груп, попередньо набухлого в 5 мл дихлоретану, додавали свіжоприготований розчин 0,044 г (0,1143 ммоль) Fmoc-Phe-OH і 0,040 мл (0,286 ммоль) триетиламіну в 2 мл дихлоретану, перемішували повітрям протягом 25 хв. при 25 °С. Реакцію зупиняли додаванням 2 мл суміші метанол - триетиламін (9:1), перемішували 1 хв. Пептидилполімер відфільтровували, промивали дихлоретаном (2 хв×3), DMF (2 хв×2), ізопропанолом (2 хв×2), DMF (2 хв×2), ізопропанолом (2 хв×2), метанолом (2 хв×1), діетиловим ефіром (2 хв×2), сушили на водострумені, ступінь заміщення смоли визначали спектрофотометрично. До 10 мг 10 UA 108480 C2 5 10 15 20 25 отриманого Fmoc-Phe-полімеру додавали 1 мл 20 % розчину піперидину в DMF і перемішували 20 хв. при 25 °С. Смолу відфільтровували, відбирали алівоту фільтрату і визначали оптичне поглинання розчину N-(9-флуореніметил)піперидину, що утворився, при 289 нм. Ступінь заміщення смоли обчислювали за формулою: с=А289×V×W/5800, де с - вміст активних груп в полімері, A289 - оптична густина розчину відносно контролю, W (мг) - маса взятого полімеру, 5800 - молярний коефіцієнт поглинання N-(9флуоренілметил)піперидину. Вміст Fmoc-Phe в полімері становив 0,3 ммоль/м. До 0,331 г полімеру, що містить 0,099 ммоль Cl, попередньо набухлого в 3,3 мл дихлоретану, додавали свіжоприготований розчин 0,115 г (0,3 ммоль) Fmoc-Phe-OH і 0,034 мл (0,25 ммоль) триетиламіну в 0,6 мл дихлоретану, перемішували протягом 25 хв. при 25 °С. Реакцію зупиняли додаванням 6 мл суміші метанол - триетиламін (9:1), перемішували 1 хв. Пептидилполімер відфільтровували, промивали дихлоретаном (2 хв×3), DMF (2 хв×2), ізопропанолом (2 хв×2), DMF (2 хв×2), ізопропанолом (2 хв×2), метанолом (2 хв×1), діетиловим ефіром (2 хв×2). Об'єм однієї порції промивального розчину 2 мл. Синтетичний цикл включає в себе: 1) 10-хвилинну активацію приєднуваної Fmoc-амінокислоти, (3 екв.), з DIC (3 екв.) і HOBt (3,6 екв.) в 1 мл DMF; 2) деблокування α-аміногруп обробкою 20 % розчином піперидину в DMF (3 мл×3) протягом 30 хв.; 3) промивання пептидилполімеру DMF (1,5 мл×8, по 3 хв.); 4) додаткове промивання пептидилполімеру розчином HOBt (3,6 екв.) в 1,5 мл DMF протягом 3 хв.; 5) конденсацію активованої Fmoc-амінокислоти (3 екв.) з пептидилполімером протягом 24 год.; 6) промивання пептидилполімеру DMF (1,5 мл×2, по 2 хв.); 7) контроль повноти заміщення аміногруп при приєднанні чергової Fmoc-амінокислоти здійснювали за допомогою нінгідринового тесту, при позитивному результаті тесту проводили повтор стадії конденсації. Двократно конденсацію здійснювали при приєднанні наступних амінокислот: Arg2, Trp3, Trp4, Arg5, Arg6. Умови синтезу пептиду H-ArgArgTrpTrpArgPhe-OH № 1 Амінокислота (АК) Fmoc-Arg-OH* Fmoc-Arg-OH* 2 Fmoc-Trp-OH Fmoc-Trp-OH 3 Fmoc-Trp-OH Fmoc-Trp-OH 4 Fmoc-Arg-OH* Fmoc-Arg-OH* Fmoc-Arg-OH* Кількість реагентів 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,127 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,127 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,127 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,127 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 11 Час реакції Нінгідриновий тест конденсації, год. 24 + 2 24 + 3 24 + 3 24 + 5 + 12 _ UA 108480 C2 № 5 Амінокислота (АК) Fmoc-Arg-OH* Fmoc-Arg-OH* Кількість реагентів 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) 0,118 г АК (0,3 ммоль) 0,048 г HOBt (0,36 ммоль) 0,046 мл DIC (0,3 ммоль) Час реакції Нінгідриновий тест конденсації, год. 16 + 16 *Перед реакцією бічну функцію Fmoc-Arg-OH в DMF переводили в гідрохлорид додаванням одного еквівалента 12 N водного розчину HCl. Розчинники відганяли у вакуумі, сушили над NaOH. 5 10 15 20 25 30 35 40 45 Після закінчення синтезу і деблокування α-аміногрупи 0,143 г пептидилполімеру промивали DMF (1 мл×8, по 2 хв.), промивали HOBt (3,6 екв.) в 1 мл DMF. α б) N [6(7)-(Протогемін IX)-іл]-ArgArgTrpTrpArgPhe-OH (XX). До 0,29 г пептидилполімеру (XX) з відщепленим Fmoc-захистом додавали 3 екв. 6(7)-моно-N-окси-5-норборнен-2,3дикарбоксіімідного ефіру протогеміну IX (II) в 4,5 мл DMF, перемішували 5 год. і залишали на 24 год. при кімнатній температурі. Гемінпептидилполімер відділяли, промивали DMF (2 мл 7, по 3 хв.). Нінгідриновий тест негативний. Гемінпептидилполімер промивали DCM (2 мл×2, по 2 хв.), сушили у вакуумі водоструменевого насоса і додавали до нього 4,5 мл суміші TFA-TFE-DCM (1:1:8), перемішували в атмосфері азоту 3 год. Полімер відділяли, промивали сумішшю TFATFE-DCM (1:1:8) (1 мл×4, по 1 хв.). Залишок розтирали з охолодженим безводним діетиловим ефіром (10-12-кратним надлишком по об'єму), осад, що випав, відфільтровували, промивали × 2 ефіром, сушили у вакуумі. Продукт очищали на колонці (150×20 мм) з сефадексом LH-20, елююючи цільову речовину сумішшю метанол - вода (20:1). Вихід 0,027 г (25 %). Rf 0,5 (6). -3 -1 -1 Електронний спектр (метанол), λmax, нм (ε 10 , М см ): 393,4. (65,8), 474,8 (8,7), 578,0 (3,61), 607,2 (3,19). Мас-спектр, m/z: 1605 [M]+ (обчислено 1603,5). Приклад 11 α 6,7-біс-[(Метиловий ефір N -L-аргініл)-L-аргініл]-протогемін IX (XXI, R1=R2=-Arg-ArgOMe) α а) N-оксисукцинімідний ефір N , NG, NG-трибензилоксикарбоніларгініну До розчину 0,410 г (0,709 ммоль) Z3ArgOH в 5 мл ХЛФ (безв.) додавали 0,0816 г (0,709 ммоль) N-оксисукциніміду в 1 мл DMF. Реакційну суміш охолоджували до -10 °С і додавали по краплях протягом 10 хв. 0,146 г (0,709 ммоль) DCC в 5 мл ХЛФ. Реакційну суміш перемішували 2 години при 0 °С, потім 5 годин при кімнатній температурі і залишали на 17 годин при 4-5 °С. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (11). Осад DCU, що випав, відділяли двократним фільтруванням, розчинник видаляли у вакуумі. Залишок кристалізували з етилацетату петролейним ефіром. Твердий осад сушили у вакуумі над безводним CaCl 2. Вихід -1 0,380 г (81 %), Rf 0,68 (11). ІЧ-спектр Фур'є, ν, см , таблетка KBr: 1742 (CO скл. еф.), 1610 (OCONH), 1541 (OCONH), 1262 (ароматика). Мас-спектр, m/z: [M]+ 673,7. Літ. [106]: Т. пл. 85-86. 25 [α]D -9,7° (С 2; діоксан). α б) Метиловий ефір N , NG, NG-трибензилоксикарбоніларгініларгініну До суспензії 0,023 г (0,0890 ммоль) Н-ArgOMe•2HCl в 2 мл DMF додавали 0,024 мл (0,178 ммоль) Et3N і перемішували при кімнатній температурі 5 хв. До отриманого розчину додавали α 0,060 г (0,890 ммоль) N-оксисукцинімідного ефіру N , NG, NG-трибензилоксикарбоніларгініну, отриманого раніше, в суміші 1,5 мл DMF, і перемішували 22 години при кімнатній температурі. Контроль за протіканням реакції здійснювали методом ТСХ в умовах (2). Розчинник концентрували у вакуумі до 1 мл і додавали 10 мл діетилового ефіру. Маслоподібний осад відділяли від розчинника декантуванням, залишки розчинника видаляли у вакуумі. Залишок розчиняли в 15 мл суміші ХЛФ:МеОН (8:2) і промивали водою. Органічний шар видаляли у вакуумі. Речовину очищали колонковою хроматографією на силікагелі Kieselgel 60 F 254 (Merck, Німеччина) (8×3 см), елюювали сумішшю ХЛФ-МеОН (9:1). Фракції, що містять речовину з Rf 0,48 (2), збирали. Розчинник видаляли у вакуумі. Вихід 0,056 г (78 %), Rf 0,48 (2). ІЧ-Фур'є -1 спектр, ν, см , таблетка KBr: 1727 (СО скл. еф.), 1642 (амід I), 1548 (амід II). Мас-спектр, m/z: [M]+ 748. α в) 6,7- біс-[(Метиловий ефір N - L-аргініл)- L-аргініл]-протогемін IX α До 0,054 г (0,0511 ммоль) метилового ефіру N -аргініл-Z3-аргініну підливали 8 мл суміші метанол - оцтова кислота - вода (6:1:1). До розчину додавали паладієвий каталізатор і 12 UA 108480 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідрували при кімнатній температурі 1 год., контролюючи хід реакції ТСХ в системі (2). Після закінчення реакції каталізатор відфільтровували, промивали водою, розчинник видаляли у вакуумі при 40 °С. До суспензії отриманого Н-ArgArgOMe•3CH3COOH в 2 мл DMF додавали 0,0216 мл (0,1542 ммоль) Et3N і перемішували при кімнатній температурі 2 хв. Спостерігали випадання осаду Et3N•HCl. До отриманої суспензії додавали розчин 0,022 г (0,0257 ммоль) 6,7біс-N-оксисукцинімідного ефіру протогеміну IX (I) в 1 мл DMF і перемішували 3,5 години при кімнатній температурі. Контроль за протіканням реакції здійснювали ТСХ в умовах (5). Розчин концентрували у вакуумі до 1 мл і додавали 7 мл діетилового ефіру. Для введення протиіона Cl залишок розчиняли в 15 мл суміші ХЛФ-МеОН (8:2), два рази струшували з 7,5 мл 0,1 N розчину соляної кислоти і промивали водою до нейтральної реакції. Розчинник видаляли у вакуумі. Речовину очищали препаративною ТСХ на силікагелі Kieselgel 60 F 254 (Merck, Німеччина) (11×14 см), елюювали сумішшю МеОН:АсОН:Н2О (4:1:1). Вихід 0,015 г (40 %). Rf 0,1 (5). Електронний -3 спектр, λmax, нм, ХЛФ:МеОН (8:2), (ε·10 ): 400 (79,2), 478 (5,72), 596 (3,41). ІЧ-Фур'є спектр, ν, см 1 , таблетка KBr: 1739 (СО скл. еф.), 1642 (амід I), 1531 (амід II). Мас-спектр, m/z: [M]+ 1270,4. Приклад 12 Дослідження деструктуючої дії похідних геміну загальної формули I відносно ліпідних мембран Для вивчення впливу похідних геміну на проникність ліпідної мембрани була використана методика вимірювання індукованого цими речовинами виходу карбоксифлуоресцеїну (КФ) з навантажених ним ліпосом по методиці, описаній в [Y.N. Antonenko, T.B. Stoilova, S.I. Kovalchuk, et al. Large unselective pore in lipid bilayer membrane formed by positively charged peptides containing а sequence of gramicidin А//FEBS Letters, 2005, V.579, p.5247 5252]. Для приготування ліпосом використали стоковий розчин DOPC в хлороформі з концентрацією 20 мг/мл. Стоковий розчин об'ємом 200 мкл упарювали в струмі азоту, додавали 0,4 мл буферного розчину, що містить 10 мМ Тріс, 10 мМ MES, 100 мМ КСl 100 мМ КФ, струшували 2 хв. і піддавали трьом циклам заморожування-відтавання, струшуючи суміш після кожного циклу. Отриману суміш мультиламелярних ліпосом продавлювали через полікарбонатний фільтр з порами діаметром 0,1 мкм, використовуючи міні-екструдер Avanti (Avanti Polar Lipids, США). КФ, що не включився в ліпосоми, відділяли гель-хроматографією на сефадексі G-50. Сефадекс залишали на ніч у воді для набухання. Колонку об'ємом 20 мл заповнювали набухлим сефадексом, після чого врівноважували 60 мл буферу, що містить 10 мМ Тris, 10 мМ MES, 100 мМ КСl (буфер А). Об'єм суспензії ліпосом, що містять КФ, становив 500 мкл (концентрація ліпіду 0,045 мг/мл). Суспензію вміщували в кювету, об'єм доводили до 2 мл буфером А. до отриманої суспензії ліпосом додавали 10 мкл 10-4 М розчину похідного геміну загальної формули I в ДМСО. Динаміку виходу КФ контролювали флуориметрично. Флуоресценцію карбоксифлуоресцеїну збуджували при довжині хвилі 490 нм, реєстрували при 520 нм (ширина обох щілин 5 нм). Відносну кількість барвника, що вийшов з ліпосом, в конкретний момент часу розраховували за формулою: α = (Ff-F0)/(Fm-F0), де F0 і Ff є рівнем флуоресценції до і після додавання пептиду, відповідно, а F m - значення флуоресценції після повного руйнування ліпосом детергентом Triton X-100, доданим до кінцевої концентрації 2,4 % (по масі). На фіг. 1 представлена динаміка виходу карбоксифлуоресцеїну з ліпосом під дією похідних геміну загальної формули I при співвідношенні ліпід/похідне геміну 10:1 (моль/моль). Приклад 13 Дослідження антибактеріальної активності сполук загальної формули I Для визначення антибактеріальної активності речовин були використані штами Bacillus subtilis ВКМ В-501, Staphylococcus aureus 209P, Enterococcus faecalis ВКМ В-871, Micrococcus luteus ВКМ Ac-2230 (отримані з Всеросійської колекції мікроорганізмів Інституту біохімії і фізіології мікроорганізмів РАН). Основні параметри, які характеризують антибактеріальну активність, - це мінімальна інгібуюча концентрація (МІК) і мінімальна бактерицидна концентрація (МБК). МІК - це найменша концентрація досліджуваної сполуки, повністю інгібуюча розмноження бактерій в рідкому середовищі. МБК - це найменша концентрація, що викликає загибель всіх клітин. МІК оцінювали методом інгібування росту культури в рідкому середовищі з серійним розведенням речовин по модифікованій методиці [Amsterdam, D. 1996. Susceptibility testing of antimicrobials in liquid media, pp.52-111. In Loman, V., ed. Antibiotics in laboratory medicine, 4th ed. Williams and Wilkins, Baltimore]. Бактерії культивували, і тестування проводили в рідкому середовищі МН (середовище Mueller-Hinton: сухий екстракт яловичого бульйону 4 г/л, крохмаль 1,5 г/л, гідролізат казеїну 17,5 г/л; Sigma-Fluka каталожний номер 70192) при 37 °C, 100 % вологості і перемішуванні. Для 13 UA 108480 C2 5 10 15 20 25 30 35 40 45 50 тестування використали культуру (з 4 по 7 пересівання від розморожування) в експонентній фазі росту. Всі досліджувані сполуки, крім граміцидину D, поглинають світло на довжині хвилі 595 нм, що використовується для оцінки зростання бактеріальної культури. Тому при оцінці оптичної густини суспензії бактерій враховували поправку на поглинання кожної сполуки з урахуванням її концентрації в ямці. Інгібування росту (ІР) бактерій розраховували в процентах через 20 годин інкубації клітин з речовинами по оптичній густині (А) хвилі, що вимірюється в кожній ямці на довжині 595 нм, використовуючи формулу: ІРi = [(Aкt-Aк0) - (Ait-Ai0)]100/(Aкt-Aк0) (1), де індекс i означає номер ямки, к - контрольна ямка з бактеріями, в яку досліджувана сполука не вноситься, 0 - вимірювання проводиться відразу ж після внесення досліджуваної речовини в ямку, t - вимірювання через 20 годин після внесення речовини. Для визначення антибактеріальної активності досліджуваних сполук використали наступний експериментальний протокол. Кріопробірку з культурою тестованого штаму (Bacillus subtilis ВКМ В-501, Staphylococcus aureus 209P, Enterococcus faecalis ВКМ В-871, Micrococcus luteus ВКМ Ac2230) в середовищі з 7 % ДМСО, що зберігалася в рідкому азоті, швидко розморожували, 100 мкл суспензії клітин додавали до 1,5 мл свіжого середовища MH. Клітини вирощували протягом доби при температурі 37 °C і перемішуванні на орбітальному шейкері зі швидкістю 150 об./хв. Морфологічні ознаки штаму і відсутність контамінації сторонніми бактеріями перевіряли (а) шляхом посіву на агаризоване (15 г/л агару) середовище МН за формою і кольором колоній, що утворюються, (б) під мікроскопом (Мікмед-2, ЛОМО, Росія) з 40 об'єктивом по характерних морфологічних ознаках клітин. Далі бактерії культивували в 1 мл рідкого середовища МН при температурі 37 °C і перемішуванні. Клітини пересівали кожну добу. Починаючи з 3-го і закінчуючи 6-м пересіванням, культуру клітин використали для постановки тестів. Для постановки тесту 5 мкл бактеріальної суспензії в стаціонарній фазі росту переносили в 1 мл стерильного середовища MH і інкубували до досягнення експонентної фази росту (3-5 год., 37 °C при перемішуванні зі швидкістю 150 об./хв.). Щоб оцінити концентрацію мікроорганізмів, вимірювали оптичну густину (А) отриманої бактеріальної культури на довжині хвилі 595 нм. Вважали, що А=0,2, виміряна від 200 мкл суспензії клітин в 96-ямковому планшеті з 8 урахуванням поглинання середовища, відповідає 4×10 клітин/мл для обох штамів, що використовуються. З урахуванням вимірювання концентрації клітин суспензію розбавляли 4 5 середовищем МН до 5×10 -1×10 клітин/мл і переносили в стерильний 96-ямковий планшет по 100 мкл на ямка. Потім до клітин вносили досліджувану сполуку і робили серійне двократне розведення цих сполук в ямках планшета. Максимальна концентрація речовин в серії становила -4 -6 . 10 М, мінімальна - 1,6×10 М Дослідження антибактеріальної активності виконували в 2 повторах для кожної сполуки, а результат усереднювали. Як контролі використали: 100 мкл бактеріальної культури без додавання яких-небудь речовин (4 ямка); бактеріальну культуру, в яку доданий 1 % ДМСО або вода в об'ємі, як в ямках з максимальною концентрацією тестованих сполук (4 ямка); 100 мкл стерильного середовища MН без бактерій і без досліджуваних речовин для контролю випадкової контамінації в планшеті (4 ямка). Відразу після внесення сполук за допомогою планшетного фотометра "Уніплан" (Пікон, Росія) в кожній ямка вимірювали Аi0, а в контрольній ямці - Ак0 необхідні для розрахунку за формулою (1). Планшет інкубували протягом 20 год. при температурі 37 °С і перемішуванні зі швидкістю 150 об./хв. Потім в кожній ямці вимірювали Аit, а в контрольній ямці - Акt і розраховували інгібування росту бактерій за формулою (1). МІК визначали, як мінімальну концентрацію досліджуваної сполуки, при якій інгібування росту становить 100 %. Для визначення МБК середовище з ямки, де концентрація досліджуваної сполуки дорівнювала МІК, МІК2 і МІК4, переносили на чашки Петрі з агаризованим середовищем МН (15 г/л агару) і рівномірно розтирали по площі чашок стерильними шпателями. Чашки інкубували 2 доби. МБК визначали як найменшу концентрацію досліджуваної сполуки, при якій колонії на чашці Петрі не зростають. Всі тести на антибактеріальну активність повторили з перервою в 2 дні, щоб оцінити мінливість стійкості бактеріальних клітин до дії досліджуваних сполук. 55 14 UA 108480 C2 Таблиця 1 Характеристики антибактеріальної активності сполук загальної формули I відносно грампозитивних бактерій Bacillus subtilis ВКМ В-501 Речовина V VI VII VIII IX XI XII XIV XV XVI XVII XVIII XIX Hem Граміцидин S МІК, мкМ 19±7 38±13 3,1±0,8 6,3±1,6 50±13 12,5±4 38±13 1,6±0,4 12,5±4 >200 >200 1,6±0,41 100±25 13±4 2,5 МБК, мкМ 38±13 75±25 3,1±0,8 9±4 100±25 25±7 38±13 6,3±1,6 25±7 >200 >200 Не досягнута Не досягнута 50±13 5 Таблиця 2 Характеристики антибактеріальної активності сполук загальної формули I відносно грампозитивних бактерій Staphylococcus aureus 209P Речовина V VII VIII IX XI XII XIV XV XVI XVII XVIII XIX Hem Граміцидин S МІК, мкМ 50 50 25 100 12,5 50 1,6 50 >200 >200 6,3 200 100 0,8 15 МБК, мкМ >4002 200 200 400 Не досягнута >502 3,2 50 >200 >200 >502 Не досягнута 200 3,1 UA 108480 C2 Таблиця 3 Характеристики антибактеріальної активності сполук загальної формули I відносно грампозитивних бактерій Enterococcus faecalis ВКМ В-871 Речовина V VII VIII IX XI XII XIV XV XVI XVII XVIII XIX Hem Граміцидин S МІК, мкМ 100 50 12,5 200 100 50 25 100 >200 >200 12,5 200 1000 3,1 МБК, мкМ 400 400 25 >4003 Не досягнута >503 100 Не досягнута >200 >200 >503 Не досягнута >1000 6,3 Таблиця 4 Характеристики антибактеріальної активності сполук загальної формули I відносно грампозитивних бактерій Micrococcus luteus ВКМ Ac-2230 Речовина V VI VII VIII IX XI XII XIV XV XVI XVII XVIII XIX Hem Граміцидин S 5 10 15 МІК, мкМ 3,1 25 1,6 6,3 6,3 50 1,6 0,8 1,6 >200 >200 3,1 25 12,5 0,4 МБК, мкМ 6,3 25 6,3 12,5 25 200 >6,33 1,6 6,5 >200 >200 12,5 25 25 0,8 Пояснення до таблиць 1-4 1 Сполука має бактеріостатичний ефект: вона інгібує розмноження бактерій у вказаній концентрації, але не вбиває їх. 2,3 МБК не досягнута. Приведена максимальна використана концентрація речовини. Таким чином, сполуки VII, VIII і XVIII, пригнічують ріст грампозитивних бактерій S. aureus в концентраціях до 50 мкМ (таблиця 2). Бактерії M. luteus високочутливі до дії даних сполук. Сполуки V, VI, VII, VIII, IX, гемін, GrD і граміцидин S інгібують ріст M. luteus в концентраціях до 30 мкМ. При цьому для сполук V, VII, VIII, GrD і граміцидину S (таблиця 4) МІК досить низька - менша 10 мкМ. Сполуки Н і VI трохи менш активні (МІК = 12,5 і 25 мкМ, відповідно). Всі досліджені сполуки виявили бактерицидну активність відносно M. luteus, причому МБК не перевищує 30 мкМ. Ентерококи E. faecalis в середньому більш стійкі до дії даних сполук, ніж мікрококи M. luteus і стафілококи S. fureus. Найбільш ефективним сполукам відносно Е. faecalis виявилася сполука XVIII: МІК 12,5 мкМ. 16 UA 108480 C2 5 10 15 20 25 30 35 40 Всі досліджені сполуки виявляють активність відносно грампозитивних бактерій В. subtilis. Найбільш активними виявилися речовини VII і XVIII (МІК менша 10 мкМ). Приклад 14 Визначення специфічної активності похідних геміну відносно штамів резистентних бактерій Матеріали і методи Випробовувані препарати - похідні геміну, розчинні у воді (VII, XVIII) і розчинні в ДМСО (VIII, XV, XIV). Як препарат порівняння був взятий ванкоміцин. Кожна речовина випробовувалася в трьох повторах. У роботі використовувалися одноразові стерильні 96-ямкові плоскодонні планшети, чашки Петрі, піпетки, наконечники і пробірки (Пан-Еко, Москва). Поживні середовища: бульйон Мюллера-Хінтон для роботи готували з сухих середовищ (Mueller Hinton broth, Acumedia, Baltimore) і стерилізували автоклавуванням при 121 °С протягом 15 хвилин. Для культивування Staphylococcus aureus використали готове сухе середовище Триптиказо-соєвий агар (Tripticase Soy Agar, BBL). Для культивування Enterococcus faecalis використали готове сухе середовище - Колумбійський агар (Columbia Agar Base, BBL). Середовища стерилізували автоклавуванням при 121 °С протягом 15 хвилин. Досліджувані резистентні бактеріальні штами Грампозитивні: Staphylococcus aureus № 25923 ATCC (American Type Culture Collection); Staphylococcus aureus № 100 KC; Staphylococcus epidermidis № 533; Enterococcus faecalis № 559; Enterococcus faecium № 569. 5 Бактеріальний інокулюм був постійний і становив 510 КУО/мл. Отримані результати представлені в таблицях (Мср). Постановка експерименту Для водорозчинних сполук з 2 по 8 ямки вносили розчинник (вода) по 15 мкл, потім в 1 ямка 3 вносили 30 мкл стокового розчину досліджуваної сполуки у воді з концентрацією 110 М, і 3 послідовним двократним розведенням доводили його концентрацію до 0,007110 М. З кожної 5 ямки відбирали по 10 мкл і додавали по 190 мкл бактеріальної культури (10 КУО). Для розчинних в ДМСО сполук з 2 по 8 ямки вносили розчинник (ДМСО) по 10 мкл, потім в 1 ямка вносили 20 мкл стокового розчину досліджуваної сполуки, що досліджується у воді з 3 концентрацією 510 М і послідовним двократним розведенням доводили його концентрацію до 3 0,03910 М. З кожної ямка відбирали по 2 мкл і додавали по 198 мкл бактеріальних культури 5 (10 КУО). Як контроль включали ямки, що не містять тестованих препаратів (контроль зростання культури). Крім того ставився контроль чистоти поживних середовищ і розчинників. Планшети інкубували в термостаті при 36 °С протягом 24 годин. Оцінку зростання культур проводили візуально, порівнюючи зростання мікроорганізмів в присутності тест-сполук, що вивчаються, із зростанням культури без них. За МПК - мінімальну переважну концентрацію приймали останнє розведення випробуваних препаратів з пригніченням росту бактеріальної культури. Отримані результати представлені в таблицях. 45 Таблиця 5 -5 Визначення МІК похідних геміну відносно Гр+ штамів (×10 М) Похідні геміну St.aureus 25923 II VII VIII XIV XV XVIII XXI Hem 1,0 2,5. 0,260 0,521 2,5 0,078 5,0 >1,0 St.aureus 100 KC >1,0 5,0 0,625 >5,0 >5,0 0,156 5,0 >1,0 St.epiderm 533 Ent.faecalis 559 Ent.faecium 569 >1,0 2,5 0,521 0,521 2,5. 0,078 5,0 >1,0 17 0,42 2,5 0,312 0,625 >5,0. 0,078 5,0 >1,0 0,33 >5,0 >5,0. >5,0 >5,0 0,625 >5,0 >1,0 UA 108480 C2 Таблиця 6 Визначення МІК ванкоміцину відносно Гр+ і Гр- штамів (мкг/мл) Бактеріальні штами Staphylococcus aureus № 25923 ATCC Staphylococcus aureus № 100 KC Staphylococcus epidermidis № 533 Enterococcus faecalis № 559 Enterococcus faecium № 569 5 10 15 20 25 30 35 40 45 50 Ванкоміцин 1,0 1,0 1,0 1,0 >32,0 Таким чином, похідні геміну загальної формули I активні в різній мірі відносно Гр+ штамів резистентних бактерій. Приклад 15 Методика визначення гемолітичної активності сполук загальної формули I Для дослідження гемолітичної активності використовували свіжу капілярну кров людини. Ефективність гемолізу визначали за виходом гемоглобіну з еритроцитів в середовищі RPMI1640 (без фенолового червоного, з додаванням 10 % фетальної телячої сироватки і 20 мМ L7 глутаміну) при початковій щільності еритроцитів (1,00,1)×10 клітин/мл через 3 години інкубації з агентом (37 °С, 5 % СО2, 100 % вологість, перемішування на орбітальному шейкері). Як характеристику гемолітичної активність використовували частку гемоглобіну, що вийшов з еритроцитів у зовнішнє середовище. Еритроцити, тіні і проміжні форми, що містять гемоглобін, що не вийшов, відділяли центрифугуванням. Гемоглобін визначали по поглинанню супернатанту на довжині хвилі 414 нм (поблизу максимуму смуги Смітті гема). Оскільки всі досліджувані сполуки, крім GrD, поглинають світло на даній довжині хвилі, при розрахунку частки гемоглобіну, що вийшов враховували поправку на поглинання кожної сполуки з урахуванням її концентрації. Вихід гемоглобіну (ВГ) розраховували в процентах по оптичній густині (А) на довжині хвилі 414 нм, використовуючи формулу: ВГ = [(Aei-Aeo) - (Ami-Amo)]100/(Aet-Aeo) (2), де індекс е означає супернатант зразка з еритроцитами, i - додану концентрацію сполуки, о супернатант зразка без додавання досліджуваних сполук, m - розчин без еритроцитів, t супернатант зразка з 100 % лізованими еритроцитами. Частка гемоглобіну, що вийшов, дорівнює частці лізованих еритроцитів при умові, що лізис відбувається повністю, тобто при лізисі з еритроцита вийде весь гемоглобін, що міститься в ньому. Дослідження гемолітичної активності виконували в 2 повторах для кожної сполуки, а результат усереднювали. Для визначення гемолітичної активності сполук використовували наступний експериментальний протокол. Кров (100 мкл) відбирали з пальця здорового донора в пробірку, що містить 0,9 мл середовища RPMI-1640 (без фенолового червоного) і гепарин (10 од./мл). Клітини осаджували центрифугуванням протягом 5 хв. при 200×g і переносили в 10 мл середовища RPMI-1640 (без фенолового червоного, з додаванням 10 % фетальної телячої сироватки і 20 мМ L-глутаміну, далі - повне середовище). Щільність еритроцитів в суспензії визначали підрахунком в камері Горяєва за допомогою мікроскопа "Мікмед-2" (ЛОМО, Росія) і 7 розбавляли повним середовищем до (20,2)×10 клітин/мл. Методом послідовного розведення з кроком в 2 рази готували серії розчинів сполук в повному середовищі (максимальна концентрація 200 мкМ, мінімальна - 1,6 мкМ, об'єм 75 мкл). До приготованих розчинів швидко додавали 75 мкл суспензії еритроцитів зі щільністю 7 (20,2)×10 клітин/мл. 7 Для негативних контролів до 75 мкл суспензії еритроцитів з щільністю (20,2)×10 клітин/мл додавали: а) 75 мкл повного середовища (4 зразка); б) 60 мкл повного середовища і 15 мкл води (4 зразка); або в) 73,5 мкл повного середовища і 1,5 мкл ДМСО (4 зразка). Для визначення 100 %-ного виходу гемоглобіну (позитивний контроль, 4 зразка) еритроцити з 75 мкл суспензії осаджували центрифугуванням (5 хв. при 200×g), осад ресуспендували в деіонізованій воді (50 мкл), після повного лізису об'єм проби доводили повним середовищем до 150 мкл.) Всі зразки (крім позитивного контролю) інкубували протягом 3 год. при температурі 37 °С, 5 % СО2, 100 % вологості і перемішуванні зі швидкістю 150 об./хв. Потім всі зразки центрифугували протягом 5 хв. при 2700×g. У ямку 96-ямкового планшета переносили по 130 мкл супернатанту з кожного зразка. Після чого за допомогою фотометричного аналізатора "Уніплан" (Пікон, Росія) вимірювали оптичну густину в ямках планшета на довжині хвилі 414 нм. Вихід гемоглобіну розраховували за формулою (2). На фіг. 2 представлена гемолітична 18 UA 108480 C2 5 10 15 20 25 30 35 40 45 50 активність похідних геміну і сполук порівняння - граміцидину S, граміцидину D і геміну. Дані представлені у вигляді середнього по 2-х повторах стандартне відхилення. Фіг. 2. Сполука XII, не виявляє гемолітичну активність аж до 100 мкМ. Речовини V, VI, VIII, IX, XVIII мають низьку гемолітичну активність (фіг. 2), причому ефективність гемолізу всіх синтезованих сполук значно нижча, ніж у геміну, і вельми низка навіть при максимальній концентрації сполук (100 мкМ). Приклад 16 Дослідження цитотоксичної активності сполук загальної формули (I) відносно лейкоцитів людини Сумарну фракцію лейкоцитів виділяли з крові людини методом вільної седиментації, для чого використовували свіжовідібрану венозну кров здорового донора. Кров (10 мл) з добавкою 10 од./мл гепарину витримували протягом 2,5 год. при температурі 15-18 °С в темряві. Відбирали світлий верхній шар рідини (4 мл) над стовпом осідаючих еритроцитів, тричі відмивали збалансованим сольовим розчином Хенкса і ресуспендували в середовищі RPMI-1640 (з додаванням 8 % ембріональної бичачої сироватки, 2 мМ L-глутаміну і 10 мМ HEPES, далі - повне середовище). Концентрацію лейкоцитів і еритроцитів в суспензії визначали підрахунком в камері Горяєва, 6 після чого суспензію доводили повним середовищем до концентрації лейкоцитів (1,00,1)×10 клітин/мл. При цьому концентрація еритроцитів в суспензії клітин крові, що використовується для вимірювань, не перевищувала 30 % від концентрації лейкоцитів. Для визначення цитотоксичності досліджуваних сполук для лейкоцитів людини суспензію клітин переносили в ямки стерильних 96-ямкових планшетів, методом послідовного розведення з кроком в 2 рази вносили досліджувані речовини (діапазон тестованих концентрацій: 3,2-100 мкМ для сполук GrD і граміцидину S 8-500 мкМ для сполуки XIII; 8-1000 мкМ для сполук V, VI, VII, VIII, IX, X, XI, XIV, XV, XIX і Hem) і акуратно перемішували. Експеримент виконували в двох паралельних повторах. Як контролі використовували клітини, до яких додавали еквівалентну кількість розчинника, в якій були приготовані досліджувані речовини: воду для сполук VII і X; водний розчин ДМСО для сполук V, VI, VIII, IX; ДМСО для GrD, граміцидин S, Hem, XI, XIII, XIV, XV, XIX. Додатковий контроль - суспензія лейкоцитів без всяких добавок. Клітини інкубували із досліджуваними сполуками 3 год. (37 °С, 5 % СО2, 100 % вологість). Загибель лейкоцитів оцінювали за допомогою флуоресцентної мікроскопії. Для виявлення мертвих і живих клітин використовували фарбування йодистим пропідієм (проникає тільки в ядра мертвих клітин) і Hoechst 33342 (забарвлює всі ядра). Клітини інкубували в планшетах 15 хв. одночасно з йодистим пропідієм і Hoechst 33342 (37 °С, 5 % СО2), а потім планшети поміщували під мікроскоп для аналізу. Частку загиблих клітин визначали по флуоресцентних зображеннях клітин в синій (Hoechst 33342) і червоній (йодистий пропідій) областях спектра, отриманих за допомогою флуоресцентного мікроскопа Axio Observer (Zeiss, Німеччина) з 10 об'єктивом ("Plan-Neofluar" 10/0,3). Використовували наступнінабори флуоресцентних фільтрів. Для йодистого пропідію: смуговий фільтр на збудження 530-585 нм; бар'єрне дихроїчне дзеркало 600 нм, довгохвильовий бар'єрний аналізуючий фільтр 615 нм. Для Hoechst 33342: смуговий фільтр на збудження 359-372 нм; бар'єрне дихроїчне дзеркало 395 нм, довгохвильовий бар'єрний аналізуючий фільтр 397 нм. За допомогою цифрової фотокамера реєстрували три типи зображень клітин: а) в білому світлі, що проходить; б) флуоресцентне зображення в синій області спектра з ультрафіолетовим збудженням; в) флуоресцентне зображення в червоній області спектра із збудженням зеленим світлом. Фотографували не менше 4 полів зору на ямку в різних її областях. Результат аналізу усереднювали по 1000-1500 клітин для кожної концентрації досліджуваних сполук. 19 UA 108480 C2 Таблиця 7 Цитотоксична активність сполук загальної формули (I) відносно лейкоцитів людини Речовина Hem V VI VII VIII IX X XI XIII XIV XV XIX Фонові значення загибелі лейкоцитів без добавок при додаванні води при додаванні 10 % ДМСО при додаванні 100 % ДМСО 5 10 15 20 25 30 35 Загибель лейкоцитів в присутності речовини в концентрації 1 мМ 40±2 5,8±0,3 10,5±0,5 8,0±0,8 6,1±0,3 3,1±0,3 4,9±0,3 8,6±0,4 14±2 17,5±0,7 13±1 13±1 4,5±0,7 4,2±0,7 4,9±0,4 8,1±0,7 Сполуки V, VII, VIII, IX і X в концентрації до 1 мМ не викликають загибель лейкоцитів з крові людини. При цьому невеликий токсичний ефект розчинів граміцидину S, XI, в ДМСО повністю зумовлений токсичною дією розчинника (ДМСО). Для сполук VI, XIII, XIV, XV і XIX виявлений слабкий токсичний ефект, який виявляється при концентраціях, близьких до 1 мМ, для сполук XIV, XV і XIX, при концентраціях більше 125 мкМ для сполук VI і XIII. Сполука порівняння - гемін має істотно вищу токсичність відносно лейкоцитів в порівнянні із сполуками, що заявляються (40 % проти 3-17 %, таблиця 7). Отримані результати свідчать про перспективність речовин, що заявляються, для створення на їх основі нетоксичних, біосумісних антимікробних агентів, в тому числі для профілактики і лікування захворювань, викликаних різними грампозитивними бактеріями, в тому числі резистентними. Приклад 17 Дослідження протигрибкової активності сполук загальної формули (I) Об'єктом впливу були клітини музейного штаму Cryptococcus neoformans № 3465, а також клітини музейного штаму Candida albicans №927, вирощених на глюкозо-пептон-дріжджовому середовищі при 32 °С протягом 1 діб. Як сполука порівняння використовувалися антимікотики пімафуцин, амфотерицин, флуконазол. Експеримент проводили в круглодонних 96-ямкових планшетах фірми "Ленмедполімер" в двох повторностях. У перший стовпець (0) вносили 10 мкл стокового розчину водорозчинних -2 -3 препаратів з концентрацією 10 -10 моль/л, у другий також 10 мкл плюс 10 мкл розчинника, що відповідає даній сполуці, суспендували і переносили 10 мкл в наступну комірку, і т. д. до 8 комірки ряду. Стокові розчини водонерозчинних сполук загальної формули I (V, VIII, XII, XIII, XIV, гемін) готували в ДМСО, розбавляли ДМСО і середовищем. Концентрація ДМСО в реакційній комірці складала ≤ 5 %. Потім в кожну комірку вносили 190 мкл суспензії клітин культури Cr. neoformans в 3 синтетичному поживному середовищі (кінцева концентрація клітин приблизно 10 КУО/мл), що містить рН-індикатор бромкрезоловий синій (рН середовища 5,5, колір індикатора - блакитний). При пониженні pH до 4,5 колір індикатора в середовищі змінюється на жовтий, що є ознакою зростання клітин гриба. Синтетичне середовище складалося з наступних компонентів: солі, амінокислоти, мікроелементи, вітаміни, антибіотик і глюкоза (всього 30 компонентів) [Yarrow D. Methods for the isolation, maintenance and identification of yeasts //In: The Yeasts, А Taxonomic Study.- 1998.- Elsevier.- Ed. by Kurtsman C.Р., Fell J.W.- P.77-100]. Після внесення суспензії клітин Cr. neoformans планшет протягом 1 години інкубували при 32 °С з перемішуванням, потім переносили в стаціонарний термостат і інкубували 2 і 5 діб при 27 °С. Після внесення суспензії 20 UA 108480 C2 клітин С. albicans планшети інкубували протягом 1 години при 32 °С з перемішуванням, потім переносили в стаціонарний термостат і інкубували 1 і 4 діб при 27 °С. Результати приведені в таблиці 8 і 9. Таблиця 8 Ріст культури Cryptococcus neoformans в присутності сполук загальної формули I Препарати 1 2 3 4 5 6 7 8 9 Граміцидин S Hem V VII VIII XVIII Контроль Амфотерицин B Флуконазол Ріст тест-культури при різних разведеннях препаратів на 2 добу 0 :2 :4 :8 : 16 : 32 : 64 : 128 5,00*10-5М + + + ± ± ± ± ± ± + + ± ± ± ± ± ± ± + ± + + + + + + ± ± ± + + + + + + + + + + + + + + + + + -** ±** ± ± + + + + + (-) – відсутність росту, індикатор блакитний; (±) - слабкий ріст, індикатор жовтий, але осад клітин, що виросли, у вигляді розмитої плями; (+) - сильний ріст, індикатор жовтий, осад клітин у вигляді густої компактної плями; * на 2 добу блакитний колір до 6 комірки, але з невеликим осадом на дні; на 5 добу жовтий; ** концентрація препаратів в 0 комірці складає 5,00*10-4 М. 5 Таблиця 9 Ріст культури Candida albicans в присутності сполук загальної формули I Препарати Граміцидин S Hem V VII VIII XII XIII XIV XV XVIII XX Контроль Пімафуцин 10 15 Ріст тест-культури при різних розведеннях препаратів 0 :2 :4 :8 : 16 : 32 -4 1*10 М + + ± + + + + + ± ± ± ± ± + + + + + ± ± ± + + + ± ± ± + + + ± ± + + + + ± + + + + + ± + + + + + ± ± ± ± ± ± ± ± ± + + + + + + + : 64 + + ± + + + + + + ± ± + + Контрольні посіви з комірок, проведені через 1-4 доби впливу сполуками загальної формули -5 I, показали практично фунгіцидний ефект сполука XVIII в концентрації близько 5·10 М. Крім того, сполука XII виявилася ефективною проти одного із збудників крипотокозу Cryptococcus humicolus з МПК 12,5 мкМ. Таким чином, сполуки загальної формули I виявляють фунгістатичний і/або фунгіцидний -4 ефекти, величина яких залежить від будови і виявляється в інтервалі концентрацій від 10 до -6 10 М. Приклад 18 Приклади лікарських форм А. Желатинові капсули 21 UA 108480 C2 5 10 15 20 25 30 35 Склад порошку, що вводиться в капсулу: Сполука, що відповідає 1-50 мг загальній формулі (I) Оксид магнію 50 мг Крохмаль 100-200 мг Вказані вище інгредієнти змішують, і суміш вводять в тверді желатинові капсули в кількості 151-285 мг. Б. Таблетована форма Таблетовану форму отримують, використовуючи приведені нижче інгредієнти: Сполука, що відповідає 1-50 мг загальній формулі (I) Крохмаль картопляний 100 мг Полівінілпіролідон 10 мг Магнію стеарат 2 мг Лактоза 48-82 мг Аеросил 5 мг Компоненти змішують і пресують для утворення таблеток вагою 200 мг кожна. В. Аерозольна форма Склад аерозольної суміші, розрахованої на 10 прийомів: Сполука, що відповідає 10-100 мг загальній формулі (I) Магнію сульфату 150 мг Лактоза 110-140 мг Сполуку змішують з наповнювачами і вміщують в спеціальний пристрій для розпилення. Г. Супозиторії Як супозиторна основа можуть бути використані: основи, не розчинні у воді - масло какао; основи, що розчиняються у воді або змішуються з водою - желатино-гліцеринові або поліетиленоксидні; комбіновані основи - мильно-гліцеринові. Приклад складу супозиторію: Сполука, що відповідає загальній формулі (I) - 1-50 мг, Масло какао - кількість, необхідна для отримання супозиторію При необхідності можливе виготовлення ректальних, вагінальних і уретральних супозиторіїв з відповідними наповнювачами. Д. Мазі Як мазеві основи можуть бути використані: вуглеводневі мазеві основи - вазелін білий і жовтий (Vaselinum album, Vaselinum flavum), вазелінове масло (Oleum Vaselini), мазь біла і рідка (Unguentum album, Unguentum flavum), а як добавки для надання більш щільної консистенції - твердий парафін і віск; абсорбтивні мазеві основи - гідрофільний вазелін (Vaselinum hydrophylicum), ланолін (Lanolinum), кольдкрем (Unguentum leniens); мазеві основи, що змиваються водою - гідрофільна мазь (Unguentum hydrophylum); водорозчинні мазеві основи - поліетиленгліколева мазь (Unguentum Glycolis Polyaethyleni), бентонітові основи і інші. Приклад складу мазі: Сполука, що відповідає 0,01-0,1 г загальній формулі (I) Вазелін 10 г Мазі виготовляють по відповідній технології. Е. Розчин для ін'єкцій Як розчинник при приготуванні розчину для ін'єкцій можуть бути використані 0,9 % розчин натрію хлориду, дистильована вода, розчин новокаїну. Форма випуску - ампули, флакони, шприц-тюбики. Склад розчину для ін'єкцій: Сполука, що відповідає 1-50 мг загальній формулі (I) Вода дистильована 1-2 мл Можливо виготовлення різних лікарських форм для ін'єкцій - стерильних розчинів, стерильних порошків і таблеток. 22 UA 108480 C2 Приклади композицій для дезінфікуючих і антисептичних засобів А. Сполука, що відповідає 0,001-1 % загальній формулі (I) 1 - пропанол 30-40 % 2 - пропанол 10-70 % вода дистильована 10-60 % Б. Сполука, що відповідає загальній формулі (I) Четвертинна амонієва основа (або їх суміш) Вода дистильована 0,001-1 % 2-10 % до 100 % В. Сполука, що відповідає загальній формулі I Диметилсульфоксид (DMSO) або поліетиленгліколь (PEG) М.М. 200-12000 вода дистильована Г. Сполука, що відповідає загальній формулі I Суміш спиртів, DMSO, PEG, ПАР в різних сполученнях і співвідношеннях вода дистильована 0,001-1 % 1-20 % 1-20 % до 100 % 0,001-1 % 1-80 % до 100 % 5 10 Д. Сполука, що відповідає 0,001-1 % загальній формулі I вода дистильована до 100 % Таким чином, похідні геміну загальної формули (I) мають антибактеріальну і протигрибкову активність, в тому числі відносно патогенного для людини S. aureus і його резистентних штамів. Крім того, практично всі заявлені похідні геміну в різній мірі мають здатність збільшувати проникність модельних ліпідних мембран, що, як відомо з літературних даних, являє собою важливу частину механізму антимікробної (антибактеріальної, протигрибкової) дії антимікробних агентів. Ефективність сполук, які відповідають загальній формулі I, підтверджує їх придатність для промислового застосування в складі дезінфікуючих, антисептичних і терапевтичних засобів з протигрибковою і антибактеріальною дією. ФОРМУЛА ВИНАХОДУ 15 1. Застосування сполуки загальної формули (І) N N Cl Men+ N R1(O)C N C(O)R2 ,I де R1 і R2 однакові або різні, при цьому 23 UA 108480 C2 5 або один з R1 і R2 являє собою -ОН, а інший являє собою -ArgArgTrpHisArgLeuLysGlu(OMe)OH, ArgTrpHisArgLeuLysGlu(OMe)OH, -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(DLeu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp або Phe, або Туr (граміцидин D), -N-цикло-(ОrnLеu-О-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-Arg-Phe-OH, або R1 і R2 обидва являють собою -ArgOMe, -SerOMe, -АlаНА, -AlaHis, -NHCH2CH2OH, GlyOMe, -NHCH(CH2OH)CH2OH, -NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -ArgArgOMe, де НА являє собою залишок гістаміну NH HN CH2 CH2 N 10 15 20 25 30 35 ; Ме являє собою Fe або Fe ; або її ізомерів або сумішей ізомерів, або їх фармацевтично прийнятних солей, як антимікробного засобу. 2. Застосування за п. 1, де антимікробний засіб являє собою антибактеріальний засіб. 3. Застосування за п. 2, де вказаний антибактеріальний засіб виявляє активність відносно грампозитивних бактерій роду Staphylococcus, Bacillus, Enterococcus і/або Micrococcus. 4. Застосування за п. 3, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus. 5. Застосування за п. 3, де бактерії належать до штаму Staphylococcus aureus 209Р, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569. 6. Застосування за п. 1, де антимікробний засіб являє собою протигрибковий засіб. 7. Застосування за п. 6, де вказаний протигрибковий засіб виявляє активність відносно мікроскопічних грибів роду Candida і/або Criptococcus. 8. Застосування за п. 7, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans. 9. Застосування за п. 6, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465. 10. Застосування за будь-яким з пп. 1-9, де в сполуках загальної формули (І) або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(DVal)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну n+ 2+ 3+ NH HN CH2 CH2 N . 11. Антимікробний засіб, що являє собою похідне геміну загальної формули (I) 24 UA 108480 C2 N N Cl Men+ N N R1(O)C 5 C(O)R2 ,I де R1 і R2 однакові або різні, при цьому або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Glу-Аlа-(D-Leu)-Аlа-(D-Vаl)-Vаl-(DVаl)-Тrp-(D-Lеu)-Х-(D-Lеu)-Тrр-(D-Lеu)-Тrр-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну NH HN 10 15 20 25 30 35 CH2 CH2 N ; Ме являє собою Fe або Fe ; або його ізомер або суміш ізомерів, або їх фармацевтично прийнятну сіль. 12. Антимікробний засіб за п. 11, який являє собою антибактеріальний засіб. 13. Антимікробний засіб за п. 12, який виявляє активність відносно грампозитивних бактерій роду Staphylococcus, Bacillus, Enterococcus і/або Micrococcus. 14. Антимікробний засіб за п. 13, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus. 15. Антимікробний засіб за п. 13, де бактерії належать до штаму Staphylococcus aureus 209P, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ас-2230, Staphylococcus aureus № 25923 АТСС, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569. 16. Антимікробний засіб за п. 11, який являє собою протигрибковий засіб. 17. Антимікробний засіб за п. 16, який виявляє активність відносно мікроскопічних грибів роду Candida і/або Criptococcus. 18. Антимікробний засіб за п. 17, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans. 19. Антимікробний засіб за п. 17, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465. 20. Антимікробний засіб за будь-яким з пп. 11-19, де в сполуках загальної формули (І) або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(DVal)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну n+ 2+ 3+ NH HN CH2 CH2 N . 25 UA 108480 C2 21. Фармацевтична композиція, яка має антимікробну активність, що включає як активний інгредієнт сполуку формули (І) N N Cl Men+ N N R1(O)C 5 10 C(O)R2 ,I де R1 і R2 однакові або різні, при цьому один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp або Phe, або Туr (граміцидин D), N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну NH HN CH2 CH2 N ; Ме являє собою Fe або Fe ; або її ізомер або суміш ізомерів, або їх фармацевтично прийнятну сіль, в поєднанні з фармацевтично прийнятним носієм або наповнювачем. 22. Фармацевтична композиція за п. 21, яка являє собою антибактеріальний засіб. 23. Фармацевтична композиція за п. 22, яка виявляє активність відносно грампозитивних бактерій роду Staphylococcus, Bacillus, Enterococcus і/або Micrococcus. 24. Фармацевтична композиція за п. 23, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus. 25. Фармацевтична композиція за п. 23, де бактерії належать до штаму Staphylococcus aureus 209P, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569. 26. Фармацевтична композиція за п. 21, яка являє собою протигрибковий засіб. 27. Фармацевтична композиція за п. 26, яка виявляє активність відносно мікроскопічних грибів роду Candida і/або Criptococcus. 28. Фармацевтична композиція за п. 27, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans. 29. Фармацевтична композиція за п. 27, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465. 30. Фармацевтична композиція за будь-яким з пп. 21-29, де в сполуках загальної формули (І) або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Аlа-(D-Vаl)-Vаl-(DVаl)-Тrр-(D-Lеu)-Х-(D-Lеu)-Тrp-(D-Lеu)-Тrр-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe (XV), -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну n+ 15 20 25 30 35 2+ 3+ 26 UA 108480 C2 NH HN CH2 CH2 N 5 10 15 20 25 . 31. Спосіб лікування і/або профілактики захворювань, викликаних бактеріями або мікроскопічними грибами, що включає введення пацієнту, який потребує цього, засобу за будьяким з пп. 11-20 або фармацевтичної композиції за будь-яким з пп. 21-30. 32. Спосіб за п. 31, в якому захворювання викликане бактеріями. 33. Спосіб за п. 32, в якому бактерії є грампозитивними бактеріями роду Staphylococcus, Bacillus, Enterococcus або Micrococcus. 34. Спосіб за п. 33, де бактерії вибирають з видів Staphylococcus aureus, Enterococcus faecalis i Micrococcus luteus. 35. Спосіб за п. 33, де бактерії належать до штаму Staphylococcus aureus 209Р, Enterococcus faecalis ВКМ B-871, Micrococcus luteus ВКМ Ac-2230, Staphylococcus aureus № 25923 ATCC, Staphylococcus aureus № 100 КС, Staphylococcus epidermidis № 533, Enterococcus faecalis № 559 або Enterococcus faecium № 569. 36. Спосіб за п. 31, в якому захворювання викликане мікроскопічними грибами. 37. Спосіб за п. 36, де мікроскопічні гриби належать до роду Candida або Criptococcus. 38. Спосіб за п. 37, де мікроскопічні гриби являють собою Cryptococcus neoformans або Candida albicans. 39. Спосіб за п. 37, де мікроскопічні гриби належать до штаму Candida albicans № 927 або Cryptococcus neoformans № 3465. 40. Спосіб за будь-яким з пп. 31-39, де в сполуках загальної формули (І) або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(DVal)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну NH HN CH2 CH2 N . 41. Антисептична і/або дезінфікуюча композиція, що містить сполуку загальної формули (І): N N Cl Men+ N 30 35 R1(O)C N C(O)R2 ,І де R1 і R2 однакові або різні, при цьому один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(D-Val)-Val-(D-Val)Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де X=Trp або Phe, або Туr (граміцидин D), N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -Arg-Arg-Trp-Trp-ArgPhe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe, -НА або -Arg-ArgOMe, 27 UA 108480 C2 де НА являє собою залишок гістаміну NH HN CH2 CH2 N ; Ме являє собою Fe або Fe ; або її ізомер або суміш ізомерів, або їх фармацевтично прийнятну сіль. 42. Антисептична і/або дезінфікуюча композиція за п. 41, що містить сполуку загальної формули (І), охарактеризовану в п. 10. 43. Похідне геміну загальної формули (І) n+ 5 2+ 3+ N N Cl Men+ N N R1(O)C 10 15 C(O)R2 ,I де R1 і R2 однакові або різні, при умові, що обидва R1 і R2 одночасно не являють собою -ОН, при цьому або один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(D-Leu)-Ala-(DVal)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrp або Phe, або Туr (граміцидин D), -N-цикло-(Orn-Leu-D-Phe-Pro-Val)2 (граміцидин S), -Arg-Gly-Asp-OH або -ArgArg-Trp-Trp-Arg-Phe-OH, або R1 і R2 обидва являють собою -NHCH2CH2OH, -GlyOMe, -NHCH(CH2OH)CH2OH, NHCH2CH(OH)CH2OH, -Glu(ArgOMe)-ArgOMe (XVIII), -НА або -Arg-ArgOMe, де НА являє собою залишок гістаміну NH HN CH2 CH2 N ; Ме являє собою Fe або Fe , або його ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль. 44. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Arg-Gly-Asp-OH, або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль. 45. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Val-Gly-Ala-(DLeu)-Ala-(D-Val)-Val-(D-Val)-Trp-(D-Leu)-X-(D-Leu)-Trp-(D-Leu)-Trp-NHCH2CH2OH, де Х=Тrр, Phe або Туr (граміцидин D), або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль. 46. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -N-цикло-(OrnLeu-D-Phe-Pro-Val)2 (граміцидин S), або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль. 47. Сполука за п. 43, де R1=R2=-NHCH2CH2OH, або її фармацевтично прийнятна сіль. 48. Сполука за п. 43, де R1=R2=-GlyOMe, або її фармацевтично прийнятна сіль. 49. Сполука за п. 43, де R1=R2=-NHCH(CH2OH)CH2OH, або її фармацевтично прийнятна сіль. 50. Сполука за п. 43, де R1=R2=-NHCH2CH(OH)CH2OH, або її фармацевтично прийнятна сіль. 51. Сполука за п. 43, де R1=R2=-Glu(ArgOMe)-ArgOMe, або її фармацевтично прийнятна сіль. 52. Сполука за п. 43, де R1=R2=-HA, або її фармацевтично прийнятна сіль. 53. Сполука за п. 43, де один з R1 і R2 являє собою -ОН, а інший являє собою -Arg-Arg-Trp-TrpArg-Phe-OH, або її ізомер або суміш ізомерів, або їх фармацевтично прийнятна сіль. 54. Сполука за п. 43, де R1=R2=-Arg-ArgOMe, або її фармацевтично прийнятна сіль. 55. Спосіб отримання сполуки загальної формули (І) за будь-яким з пп. 43-54, що включає взаємодію активованого по карбоксильній/их групі/ах похідного геміну з амінокомпонентом. n+ 20 25 30 35 2+ 3+ 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntimicrobial agents based on hemin derivatives
Автори англійськоюNebolsin, Vladimir Yevhenievich, Zheltukhina, Galina Aleksandrovna
Автори російськоюНебольсин Владимир Евгеньевич, Желтухина Галина Александровна
МПК / Мітки
МПК: C07K 14/805, C07F 15/02, A61K 38/42, C07D 487/22, A61P 31/04, A61P 31/10
Мітки: засоби, геміну, основі, похідних, антимікробні
Код посилання
<a href="https://ua.patents.su/33-108480-antimikrobni-zasobi-na-osnovi-pokhidnikh-geminu.html" target="_blank" rel="follow" title="База патентів України">Антимікробні засоби на основі похідних геміну</a>
Попередній патент: Склади у вигляді везикул для лікування запальних дерматозів
Наступний патент: Упаковка для бездимного тютюну та спосіб її виготовлення
Випадковий патент: Заклепка