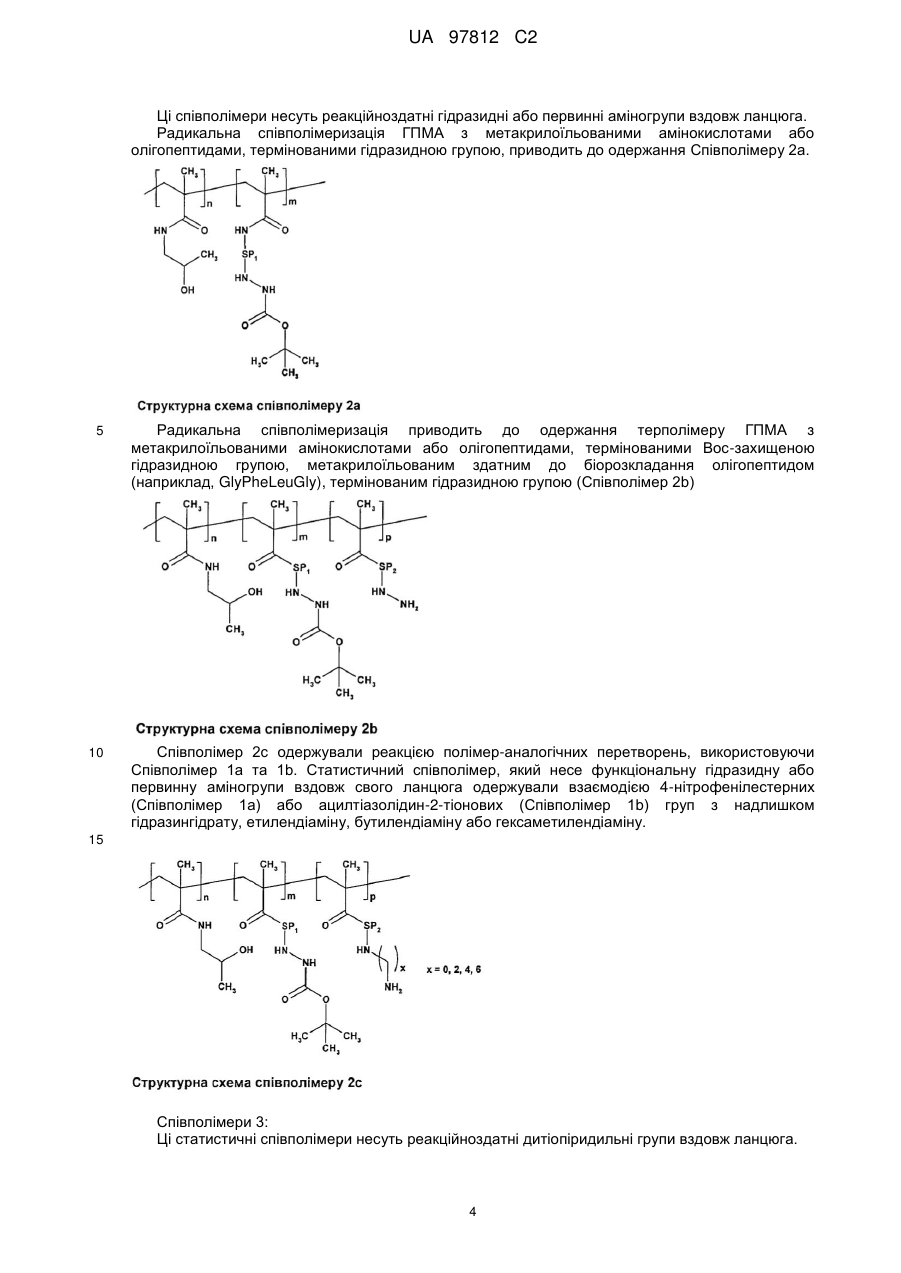
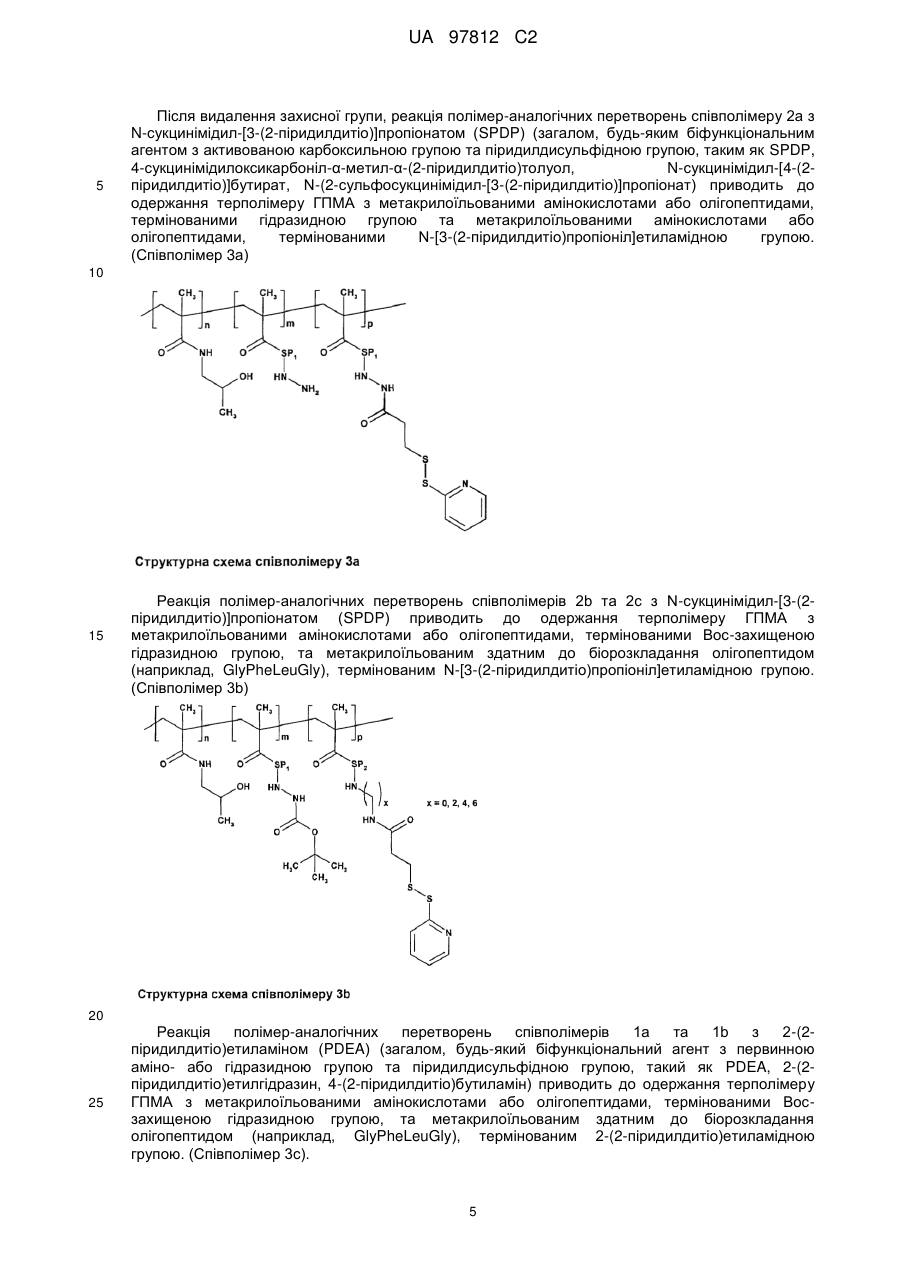
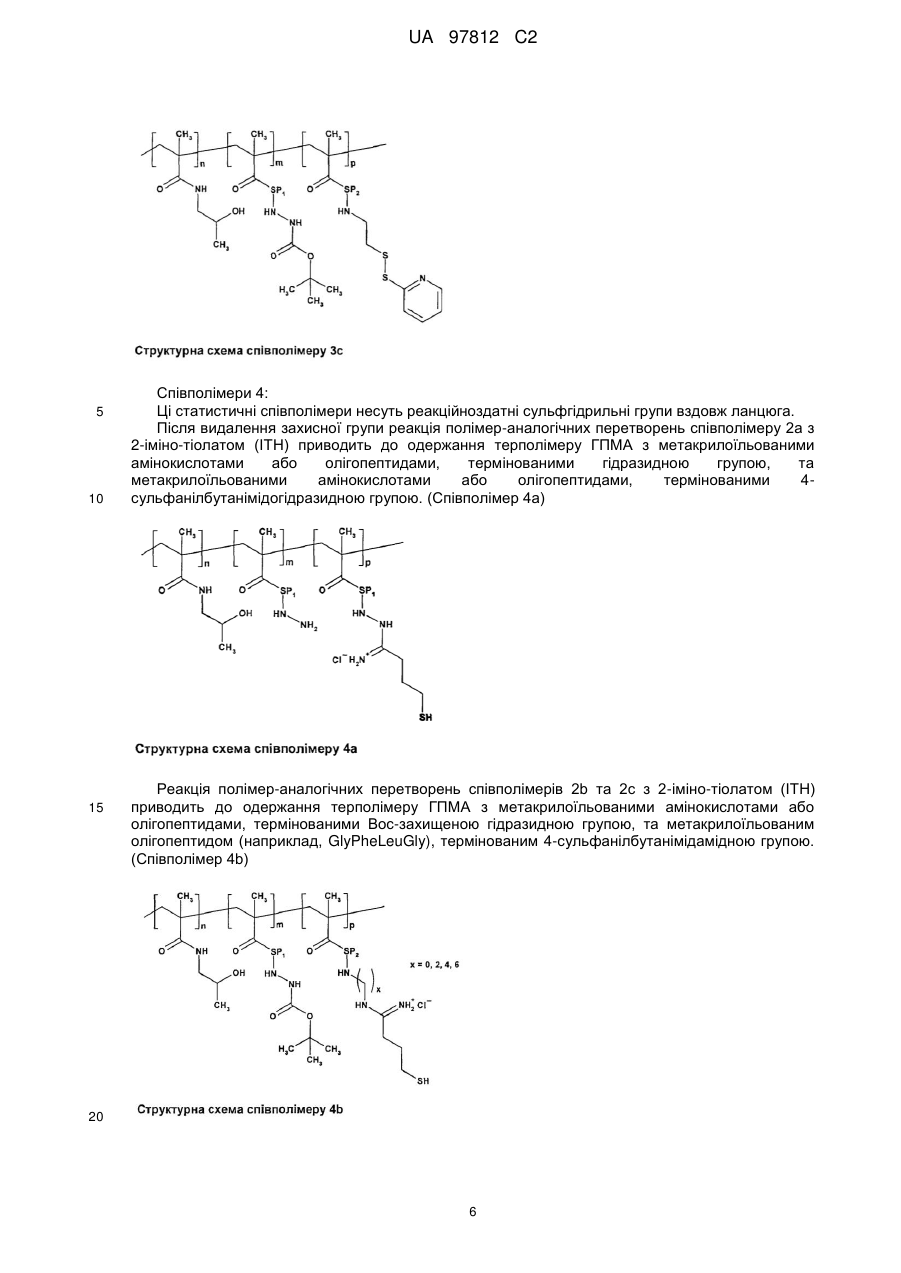
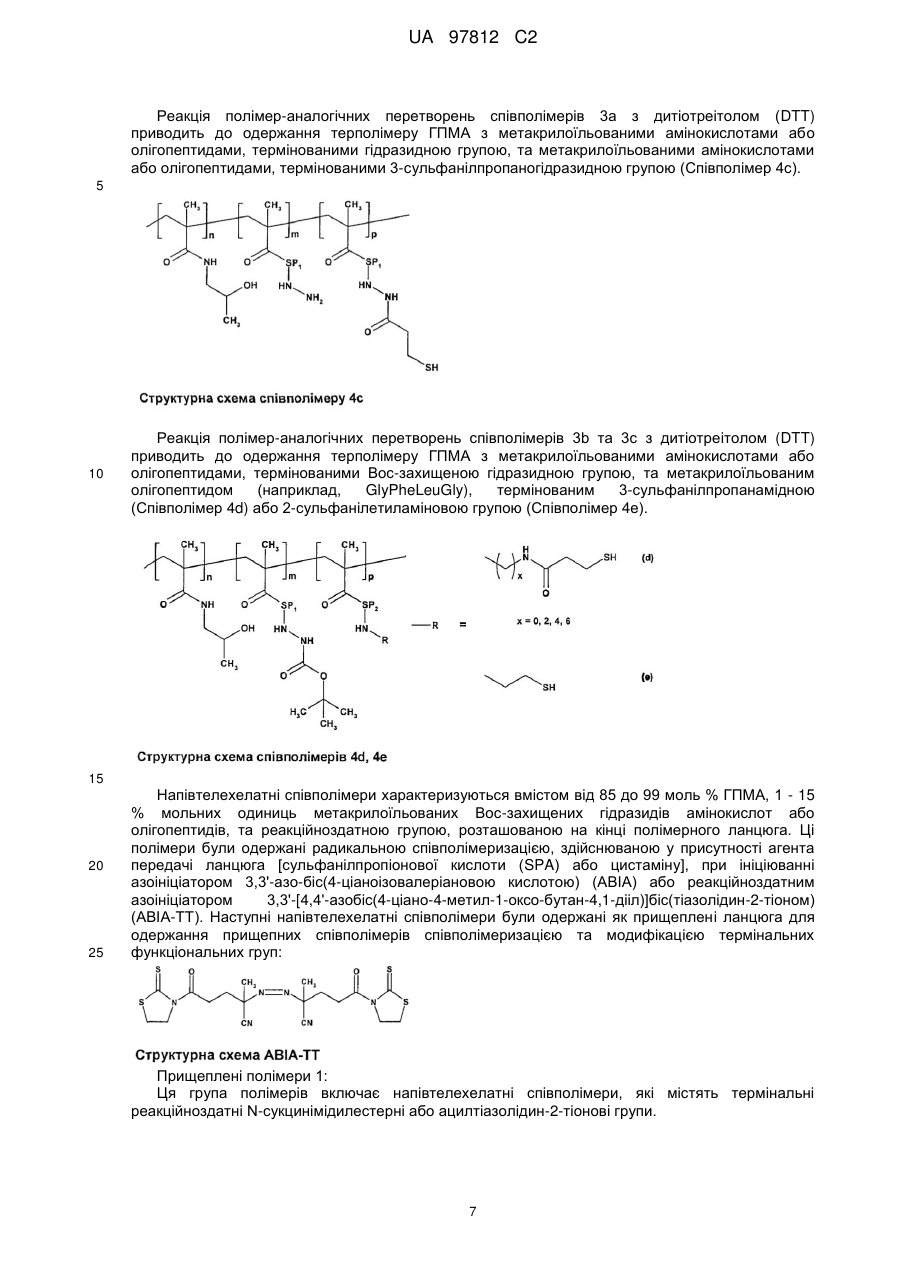
Прищепні макромолекулярні кон’югати доксорубіцину з протипухлинною активністю та спосіб їх одержання
Номер патенту: 97812
Опубліковано: 26.03.2012
Автори: Хітіл Петр, Етріх Томас, Рігова Бланка, Мркван Томаш, Ульбріх Карел
Формула / Реферат
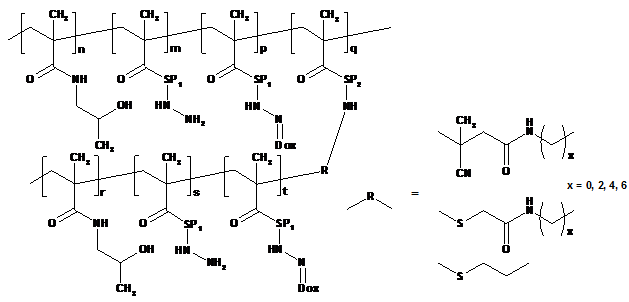
1. Полімерний лікарський засіб, в якому канцеростатик, зв'язаний за допомогою спейсерів, які містять гідролітично розщеплювані гідразонові зв'язки, зв'язаний з водорозчинним полімерним носієм, одержаним на основі співполімеру N-(2-гідроксипропіл)метакриламіду, який відрізняється тим, що структура полімерного лікарського засобу складається з головного ланцюга N-(2-гідроксипропіл)метакриламіду, який несе канцеростатик, та іншого ланцюга N-(2-гідроксипропіл)метакриламіду – прищепленого ланцюга, який також може нести канцеростатик, при цьому молекулярна вага головного ланцюга та прищеплених ланцюгів вибрана такою, що і головний ланцюг до зв'язування з прищепленими ланцюгами, і окремі прищеплені ланцюги здатні видалятись з організму після розкладання, в той час як загальна молекулярна вага прищепного полімеру перевищує ексклюзійну межу організму, де згаданий полімерний лікарський засіб має структуру, що вибирають з наступних структур 1а, 1b, 1с, 1d, 2, 3a, 3b, 4a, 4b, 4c та 5:
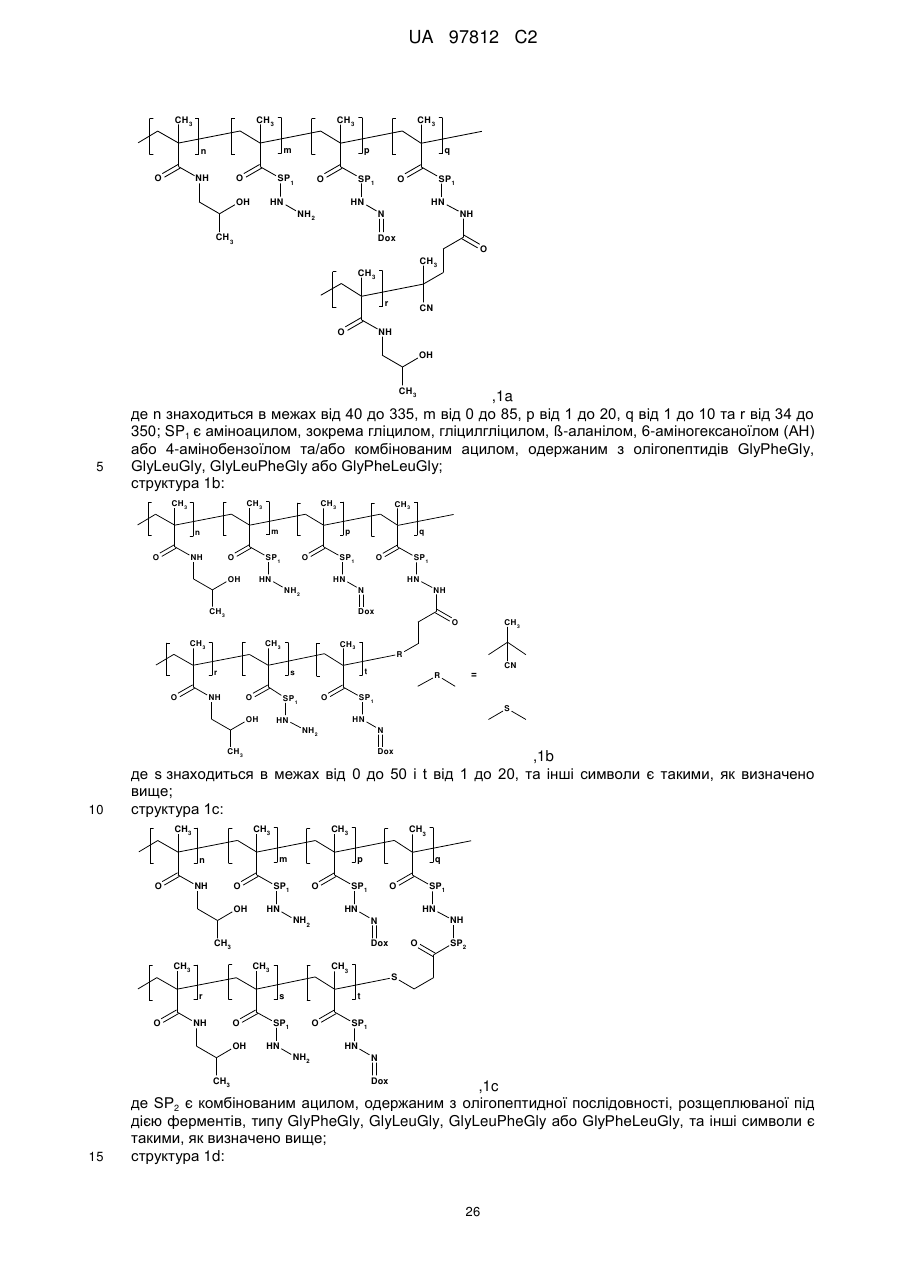
структура 1а:
 ,
,
1a
де n знаходиться в межах від 40 до 335, m від 0 до 85, p від 1 до 20, q від 1 до 10 та r від 34 до 350; SP1 є аміноацилом, зокрема гліцилом, гліцилгліцилом, ß-аланілом, 6-аміногексаноїлом (AH) або 4-амінобензоїлом та/або комбінованим ацилом, одержаним з олігопептидів GlyPheGly, GlyLeuGly, GlyLeuPheGly або GlyPheLeuGly;
структура 1b:
 ,
,
1b
де s знаходиться в межах від 0 до 50 і t від 1 до 20, та інші символи є такими, як визначено вище;
структура 1c:
 ,
,
1c
де SP2 є комбінованим ацилом, одержаним з олігопептидної послідовності, розщеплюваної під дією ферментів, типу GlyPheGly, GlyLeuGly, GlyLeuPheGly або GlyPheLeuGly, та інші символи є такими, як визначено вище;
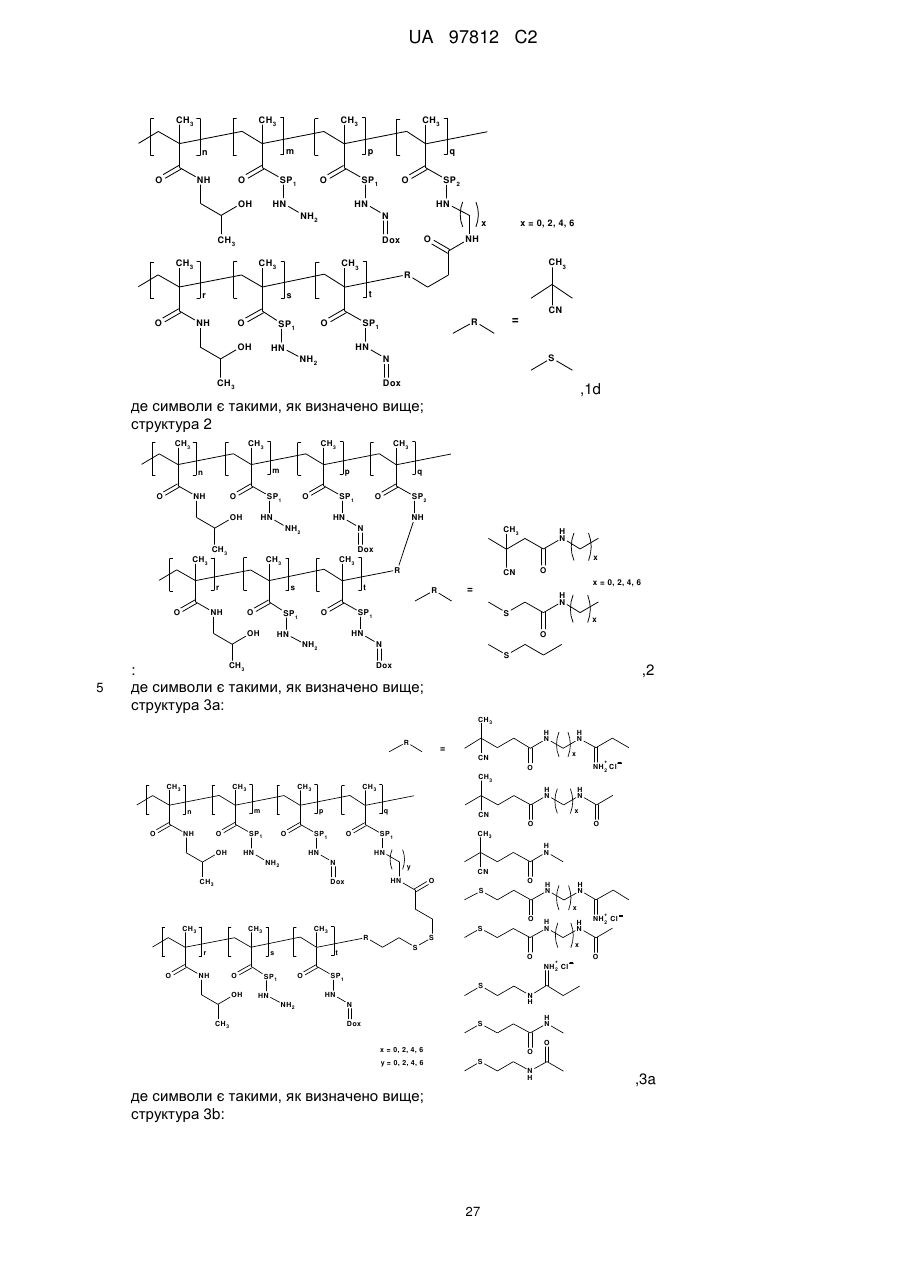
структура 1d:
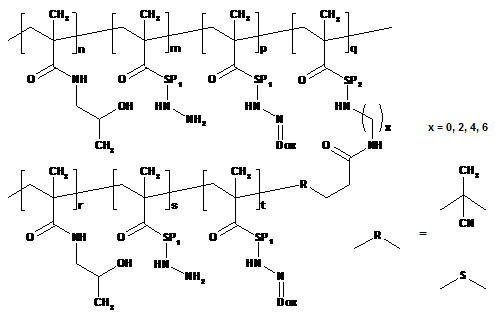 ,
,
1d
де символи є такими, як визначено вище;
структура 2:
 ,
,
2
де символи є такими, як визначено вище;
структура 3a:
 ,
,
3a
де символи є такими, як визначено вище;
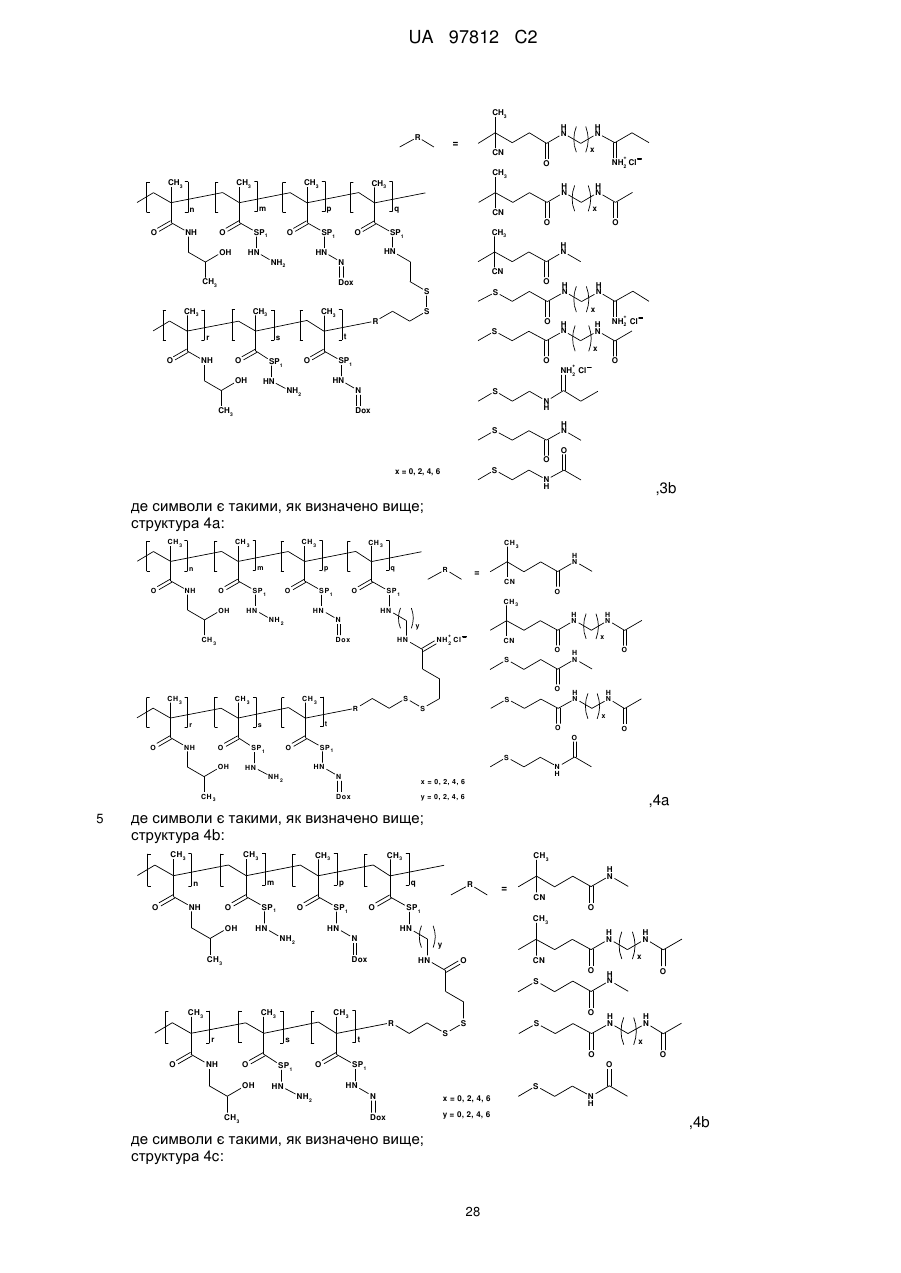
структура 3b:
 ,
,
3b
де символи є такими, як визначено вище;
структура 4a:
 ,
,
4a
де символи є такими, як визначено вище;
структура 4b:
 ,
,
4b
де символи є такими, як визначено вище;
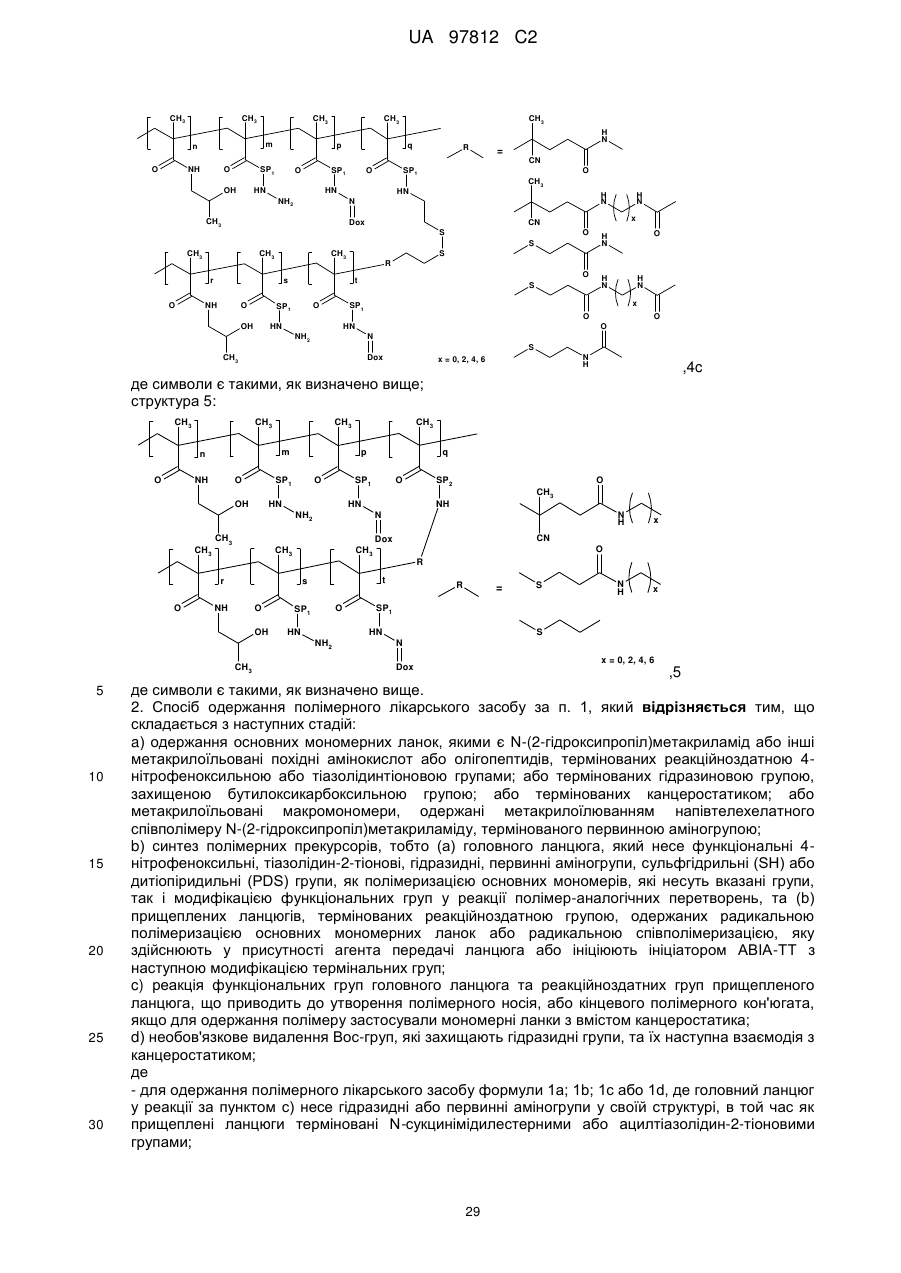
структура 4c:
 ,
,
4c
де символи є такими, як визначено вище;
структура 5:
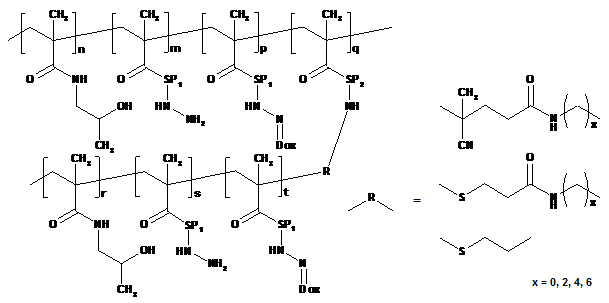 ,
,
5
де символи є такими, як визначено вище.
2. Спосіб одержання полімерного лікарського засобу за п. 1, який відрізняється тим, що складається з наступних стадій:
a) одержання основних мономерних ланок, якими є N-(2-гідроксипропіл)метакриламід або інші метакрилоїльовані похідні амінокислот або олігопептидів, термінованих реакційноздатною 4-нітрофеноксильною або тіазолідинтіоновою групами; або термінованих гідразиновою групою, захищеною бутилоксикарбоксильною групою; або термінованих канцеростатиком; або метакрилоїльовані макромономери, одержані метакрилоїлюванням напівтелехелатного співполімеру N-(2-гідроксипропіл)метакриламіду, термінованого первинною аміногрупою;
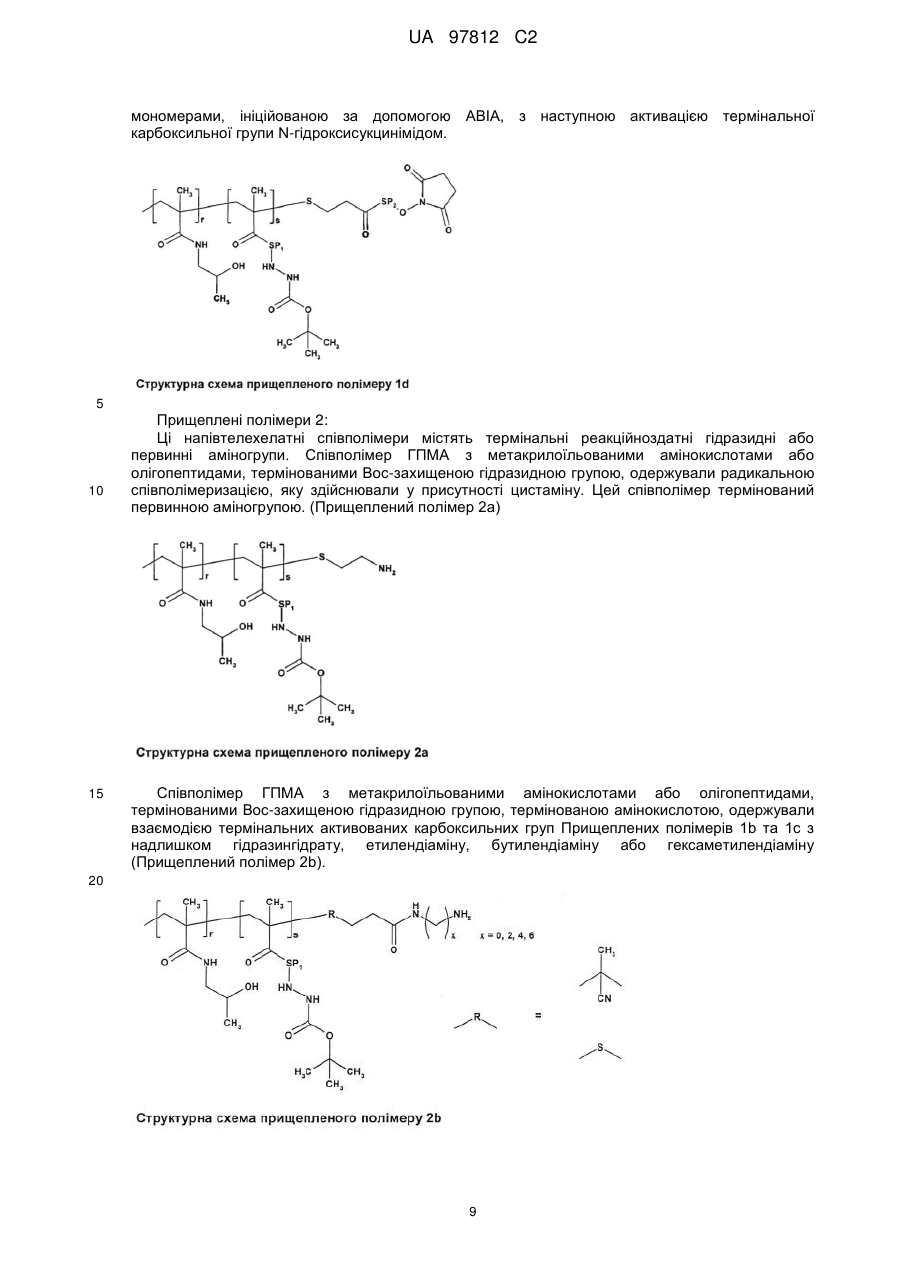
b) синтез полімерних прекурсорів, тобто (a) головного ланцюга, який несе функціональні 4-нітрофеноксильні, тіазолідин-2-тіонові, гідразидні, первинні аміногрупи, сульфгідрильні (SH) або дитіопіридильні (PDS) групи, як полімеризацією основних мономерів, які несуть вказані групи, так і модифікацією функціональних груп у реакції полімер-аналогічних перетворень, та (b) прищеплених ланцюгів, термінованих реакційноздатною групою, одержаних радикальною полімеризацією основних мономерних ланок або радикальною співполімеризацією, яку здійснюють у присутності агента передачі ланцюга або ініціюють ініціатором ABIA-TT з наступною модифікацією термінальних груп;
c) реакція функціональних груп головного ланцюга та реакційноздатних груп прищепленого ланцюга, що приводить до утворення полімерного носія, або кінцевого полімерного кон'югата, якщо для одержання полімеру застосували мономерні ланки з вмістом канцеростатика;
d) необов'язкове видалення Boc-груп, які захищають гідразидні групи, та їх наступна взаємодія з канцеростатиком;
де
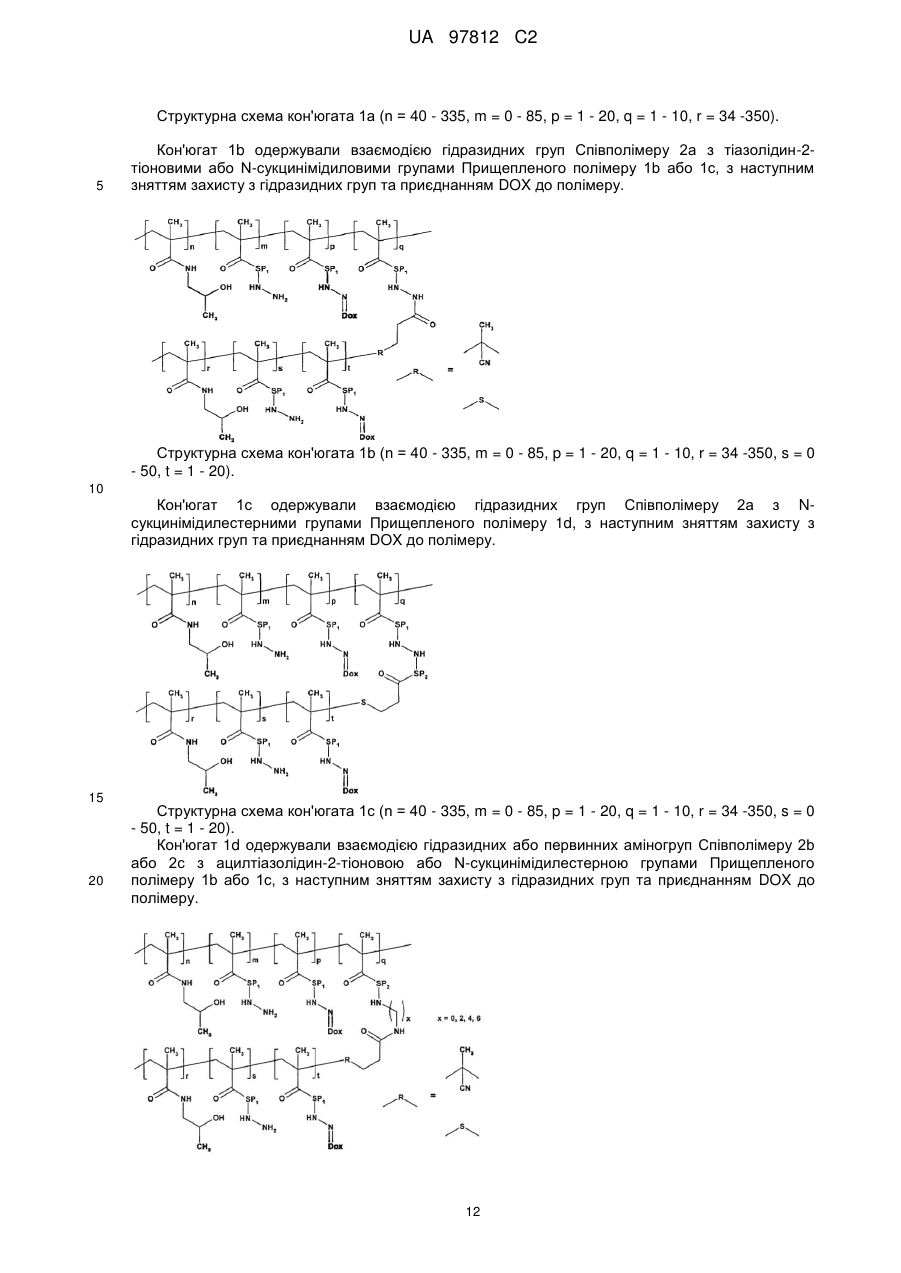
- для одержання полімерного лікарського засобу формули 1a; 1b; 1c або 1d, де головний ланцюг у реакції за пунктом с) несе гідразидні або первинні аміногрупи у своїй структурі, в той час як прищеплені ланцюги терміновані N-сукцинімідилестерними або ацилтіазолідин-2-тіоновими групами;
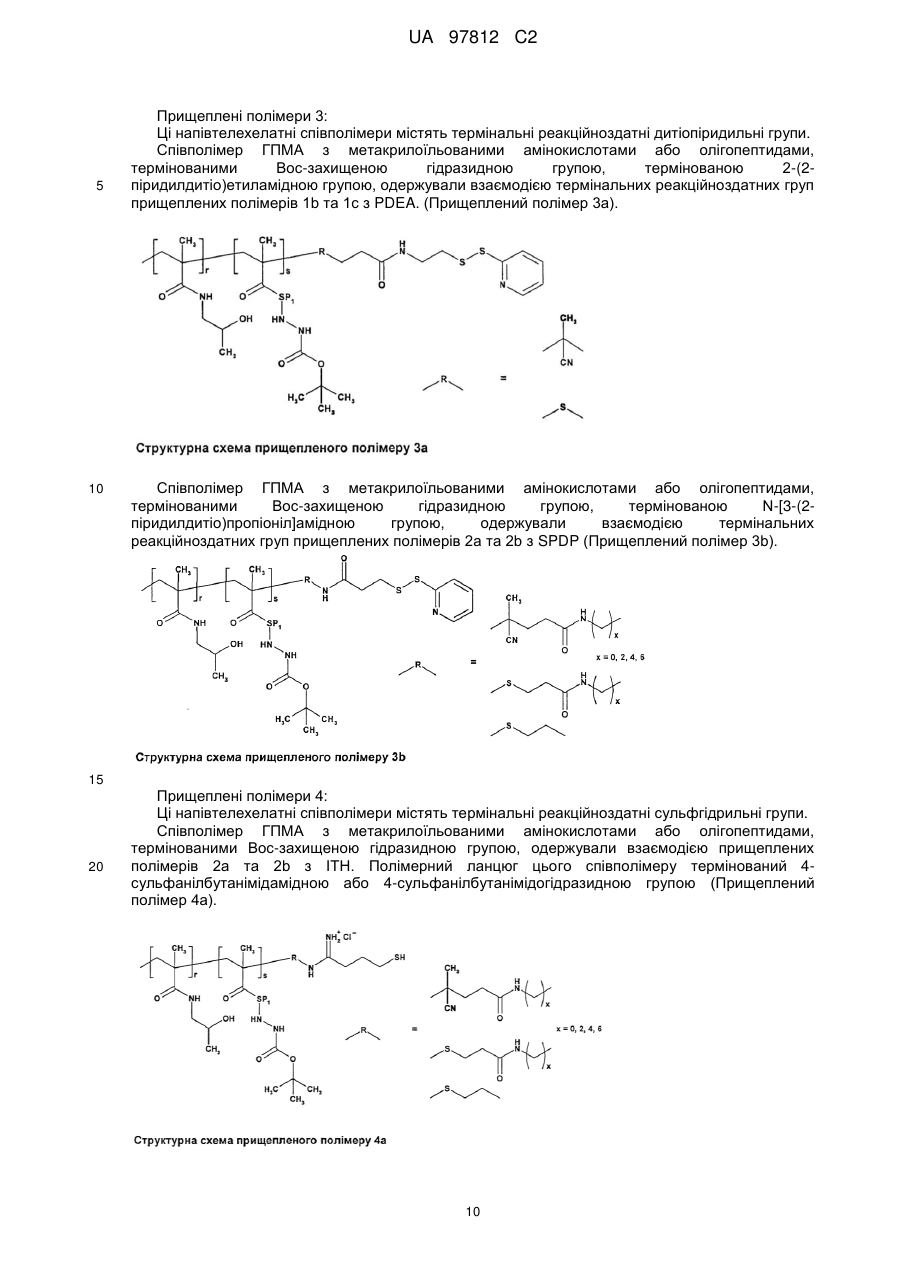
- для одержання полімерного лікарського засобу формули 3a або 3b, де головний ланцюг у реакції за пунктом с) несе реакційноздатні дитіопіридильні групи у своїй структурі, в той час як прищеплені ланцюги терміновані сульфгідрильною групою;
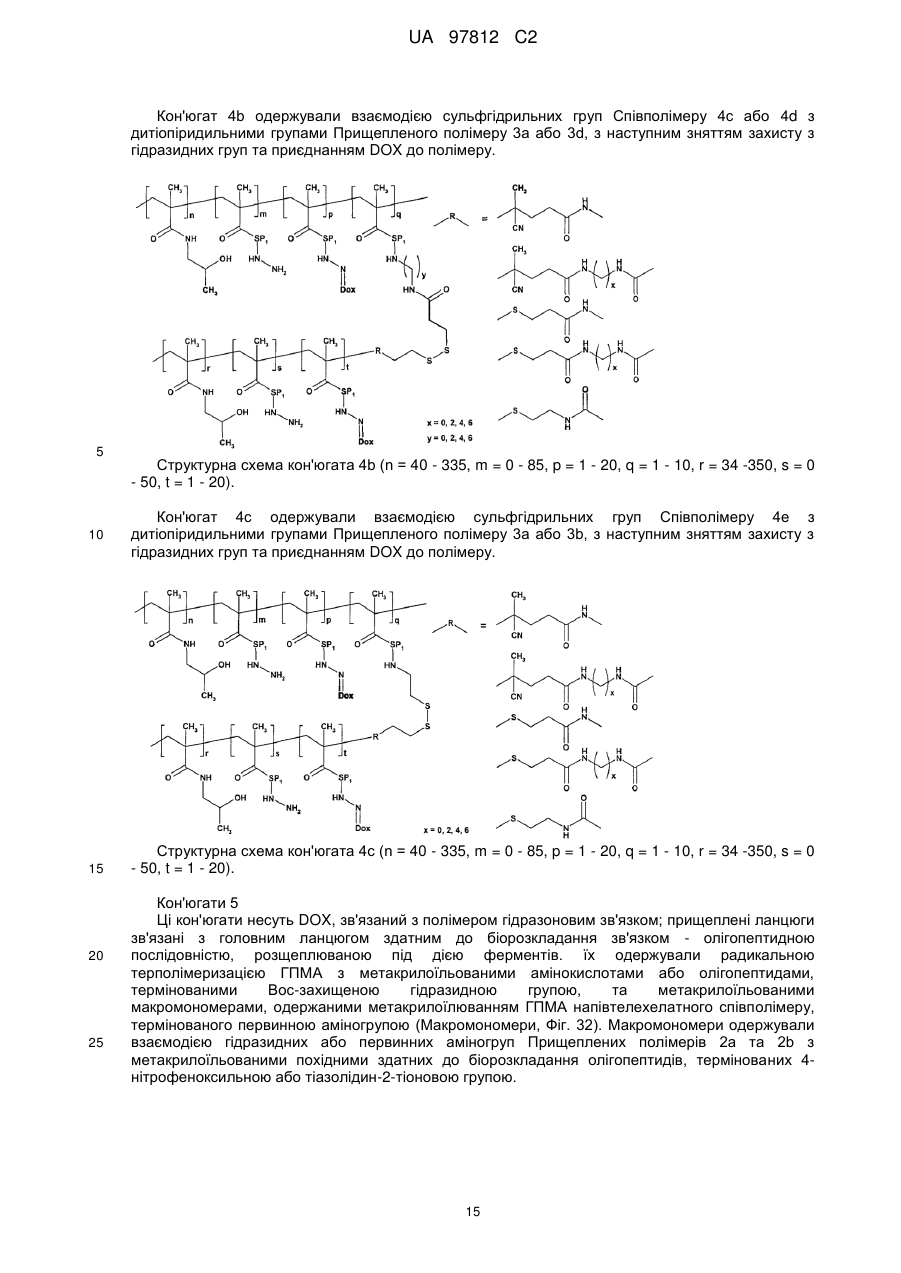
- для одержання полімерного лікарського засобу формули 4a; 4b або 4c, де головний ланцюг у реакції за пунктом с) несе сульфгідрильні групи у своїй структурі, в той час як прищеплені ланцюги терміновані дитіопіридильною групою;
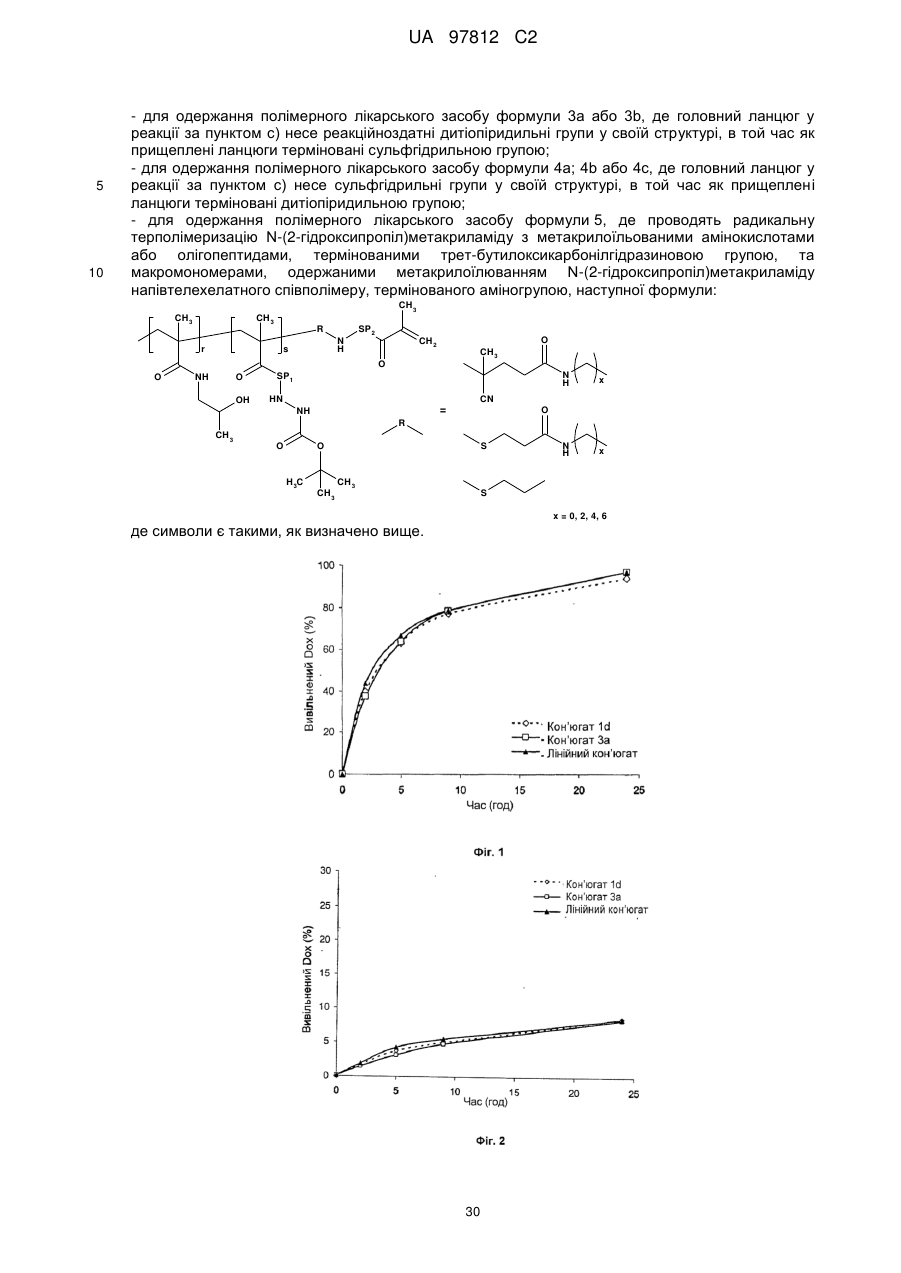
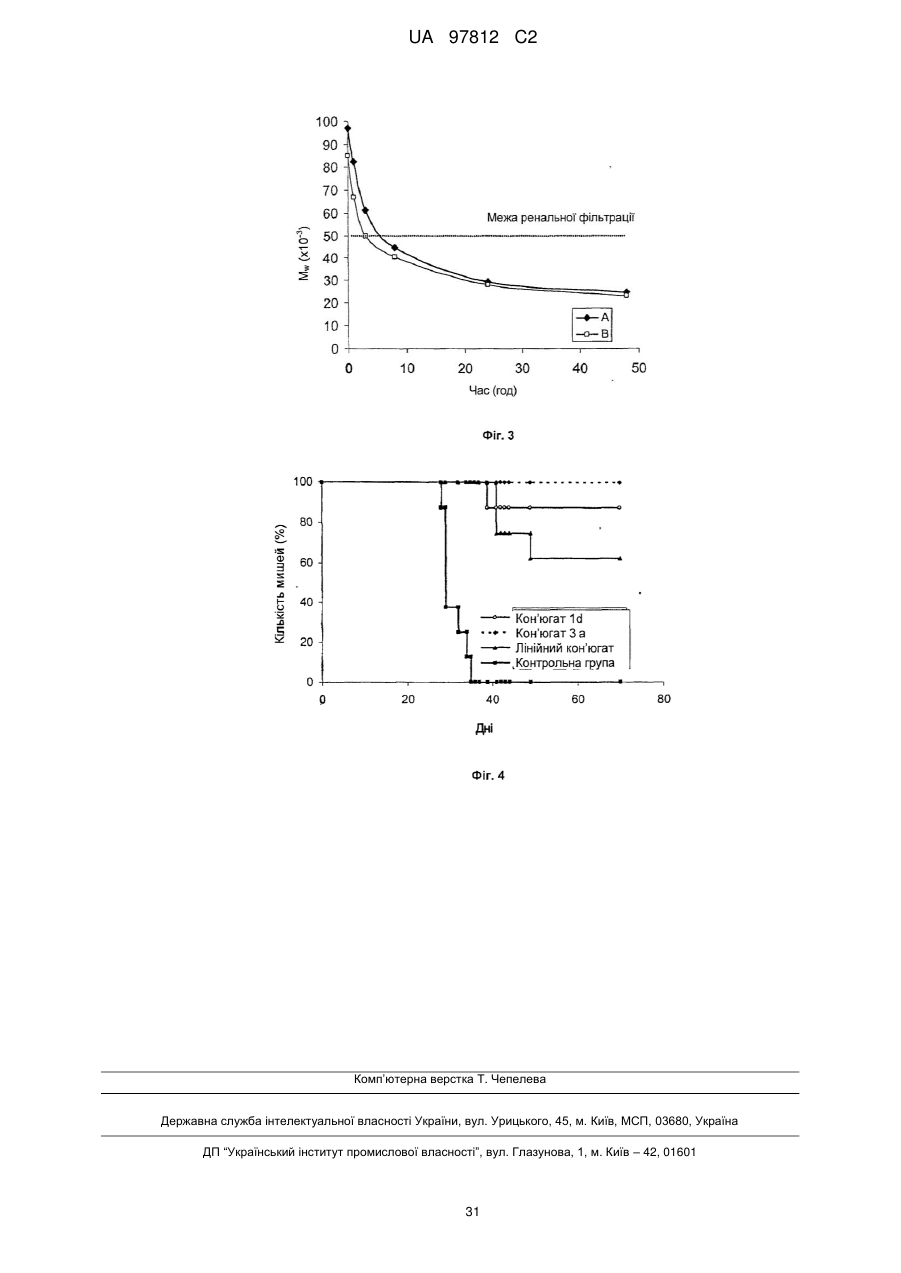
- для одержання полімерного лікарського засобу формули 5, де проводять радикальну терполімеризацію N-(2-гідроксипропіл)метакриламіду з метакрилоїльованими амінокислотами або олігопептидами, термінованими трет-бутилоксикарбонілгідразиновою групою, та макромономерами, одержаними метакрилоїлюванням N-(2-гідроксипропіл)метакриламіду напівтелехелатного співполімеру, термінованого аміногрупою, наступної формули:

де символи є такими, як визначено вище.
Текст
Реферат: Полімерний лікарський засіб, в якому канцеростатик, зв'язаний за допомогою спейсерів, які містять гідролітично розщеплювані гідразонові зв'язки, зв'язаний з водорозчинним полімерним носієм, одержаним на основі співполімеру N-(2-гідроксипропіл)метакриламіду, при цьому структура полімерного лікарського засобу складається з головного ланцюга N-(2гідроксипропіл)метакриламіду, який несе канцеростатик, та іншого ланцюга N-(2гідроксипропіл)метакриламіду - прищепленого ланцюга, який також може нести канцеростатик, при цьому вказані прищеплені ланцюги зв'язані з головним ланцюгом зв'язком, який стабільний в організмі, та/або зв'язком, розщеплюваним в організмі, зокрема олігопептидним спейсером, вибраним з таких, як GlyLeuGly, GlyPheGly, GlyPheLeuGly та GlyLeuPheGly, та спосіб його одержання. UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується макромолекулярних водорозчинних полімерних носіїв канцеростатиків, які забезпечують направлений транспорт цитостатиків, зокрема, доксорубіцину (DOX), у солідні пухлини, та забезпечує видалення полімеру з організму. Вплив кон'югата полімерного носія та канцеростатичного лікарського засобу зосереджується на таргетній терапії пухлинних хвороб у медицині людини. Останні напрямки розвитку лікарських засобів зосереджені на таких формах лікарських засобів, які роблять можливою таргетну терапію біологічно-активної речовини, переважно у місці необхідного терапевтичного впливу. Лікарські засоби направленого впливу головним чином застосовують у таких галузях, в яких побічні ефекти активного компоненту можуть потенційно призвести до пошкодження будь-яких здорових частин організму. Ця небезпека особливо актуальна для цитостатичної терапії. Полімерні речовини, зокрема, водорозчинні полімери, застосовані як носії лікарського засобу, надають важливу можливість вирішення проблеми. Приєднання цитостатика до водорозчинного полімеру через хімічний зв'язок дозволяє суттєво підвищити розчинність нерозчинних або слабо розчинних лікарських засобів, значно зменшуючи їх токсичність. Висока молекулярна вага полімерів захищає лікарський засіб від швидкого видалення з організму внаслідок клубочкової фільтрації, сприяючи тривалій циркуляції у крові, а також більшій біологічній ефективності лікарського засобу. Крім того, макромолекулярні речовини, зокрема, синтетичні полімери, можуть накопичуватись у солідних пухлинах завдяки ефекту EPR (enhanced permeability and retention- підвищена проникність та утримання) [Maeda 2000, 2001]. Якщо канцеростатик зв'язаний з макромолекулярним носієм, цей факт може бути застосований для його направленого накопичення у пухлині. Було винайдено багато систем, які базуються на цьому принципі. Полімерні міцели є одними з них. Вони представляють систему носія, яка структурно відрізняється від розчинних полімерів, винайдених для досягнення тумор-специфічного транспорту цитостатиків до солідних пухлин, вони також використовують переваги ефекту EPR щільних пухлин для підвищення накопичення макромолекулярного лікарського засобу у пухлині, але їх зазвичай одержують перегрупуванням амфіфільних диблок-співполімерів у макромолекулярні міцельні утворення, створюючи колоїдні розчини. У міцелах лікарська речовина зазвичай зв'язана з міцельною гідрофобною серцевиною фізичним (гідрофобні взаємодії, іонні зв'язки) або ковалентним зв'язками [Kataoka 2001, Yokoyama 1999, Bae 2003, Yoo 2002, Bronich 1999]. Якщо лікарська речовина має бути вивільненою з міцели, хімічний зв'язок має бути розірваним та, у той же час, гідрофобні взаємодії у серцевині міцели дезінтегровані. Це особливо справедливо для гідрофобних лікарських речовин. З іншого боку, у розчинних системах, які накопичуються у солідних пухлинах, макромолекули розчиняються у водному середовищі на молекулярному рівні та молекула зазвичай приймає форму статистичного клубка. Лікарська речовина потім взаємодіє з гідрофільним полімером та для вивільнення їй не потрібно долати бар'єр гідрофобних взаємодій. Були одержані та досліджені полімерні кон'югати канцеростатиків з розчинними полімерами, в яких лікарська речовина з протираковим ефектом була зв'язана з полімером нерозщеплюваним ковалентним зв'язком, гідролітично нестабільним іонним зв'язком або ковалентним зв'язком, схильним до ферментного або простого хімічного гідролізу. Такі системи здатні вивільнювати канцеростатик з носія у його активній формі або у пухлині, або, більш конкретно, безпосередньо у пухлинній клітині. Важливу групу таких лікарських речовин складають полімерні лікарські речовини на основі співполімерів N-(2гідроксипропіл)метакриламіду (ГПМА), кількість якого інтенсивно спрямовується на пухлини через упорядковану структуру, приєднану до полімеру (антитіла, гормони) [Duncan 1985, Rihova 2000, Kopecek 2001, 2000]. Однак, їх синтез є досить складним. Джерела надають багато інформації про одержання та дослідження властивостей полімерів, які несуть канцеростатик, приєднаний до полімеру зв'язком, який піддається гідролізу у водному середовищі. [Kratz 1999]. Суттєву роль серед них також відіграють співполімери ГПМА, які несуть канцеростатик доксорубіцин, зв'язаний з полімерним ланцюгом гідролітично-розщеплюваним гідразоновим зв'язком [Etrych 2002, Ulbrich 2004a, Ulbrich 2004b, Ulbrich - patents]. Цей зв'язок є відносно стабільним в середовищі кровотоку (під час транспортування в організмі) та гідролітичнонестабільним у злегка кислому середовищі живої клітини. Швидкість гідролізу цього зв'язка регулює швидкість вивільнення лікарської речовини та, таким чином, концентрацію активної речовини у місці необхідного ефекту. Дослідження як in vitro так і in vivo на мишах виявили, що ці полімерні канцеростатики показують істотно кращий протираковий ефект проти багатьох ліній пухлин у порівнянні з вільною лікарською речовиною, та у багатьох випадках їх застосування приводить до загального одужання піддослідних тварин навіть при терапевтичному способі введення [Rihova 2001, Etrych 2001]. Основною проблемою, яка пов'язана із застосуванням співполімерів ГПМА, є їх нерозщеплюваний вуглецевий ланцюг; внаслідок чого область 1 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекулярної ваги, яку можна застосувати для одержання полімерного носія, є обмеженою молекулярною вагою, що менша, ніж 40,000 - 50,000, тобто нижче виключної границі організму. Полімери з вищою молекулярною вагою не можуть ефективно та достатньо виділятись з організму та їх застосування буде призводити до їх надмірного накопичення в організмі. Для досягнення продуктивного ефекту EPR, тобто значного накопичення у пухлинах, необхідно застосовувати полімери, включаючи співполімери ГПМА, з молекулярною вагою значно вищою виключної границі (Seymour 1995, Noguchi 1998). Таким чином, доцільно, щоб молекулярна вага полімерного носія була досить високою але, у той же час, гарантувала розкладання полімеру після вивільнення активного компоненту на фрагменти, які можуть бути видалені з організму за допомогою, наприклад, клубочкової фільтрації. Даний винахід пропонує та показує ефективність макромолекулярного полімерного лікарського засобу з визначеною та здатною до біорозкладання структурою носія, яка передбачає транспортування цитостатика у пухлину, а також наступне видалення полімерного носія з організму. Суть полімерного лікарського засобу відповідно до даного винаходу полягає в тому, що канцеростатик доксорубіцину, приєднаний до полімерних ланцюгів за допомогою спейсерів, які містять рН-чутливі гідролітично-розщеплювані гідразонові зв'язки, зв'язаний з водорозчинним полімерним носієм, одержаним на основі співполімеру ГПМА. Такі спейсери можуть бути утворені окремими амінокислотами, олігопептидами або будь-якими іншими структурами, які дозволяють їх термінування гідразидною групою. Структура полімерної лікарської речовини вибирається такою, щоб вона складалась з головного полімерного ланцюга, утвореного співполімером ГПМА, який несе доксорубіцин, зв'язаний гідразоновим зв'язком через спейсер, до якого прищеплені інші ланцюги гомополімеру або співполімеру ГПМА, які також несуть доксорубіцин, зв'язаний гідразоновим зв'язком. Лікарський засіб згідно з даним винаходом відрізняється тим, що полімерні прищеплені ланцюги приєднані до головного ланцюга або зв'язком, стабільним в організмі, або зв'язками, які розщеплюванні в організмі, переважно зв'язками, розщеплюваними у наміченій пухлинній клітині, наприклад, олігопептидною послідовністю, розщеплюваною під дією ферментів або відновлювально-розщеплювальним дисульфідним зв'язком. Молекулярна вага головного ланцюга вибрана нижче виключної границі організму, переважно в межах від 10,000 до 50,000 г/моль; молекулярна вага полімерних прищеплених ланцюгів в межах від 5,000 до 50,000 г/моль. Олігопептидні послідовності, розщеплювані під дією ферментів, переважно містять GlyLeuGly, GlyPheGly, GlyPheLeuGly або GlyLeuPheGly олігопептидні послідовності, відновлювально-розщеплювальні зв'язки містять дисульфідні структури різного складу. Молекулярна вага полімерних прищеплених ланцюгів та головного ланцюга вибрана такою, що і головний ланцюг окремо до зв'язування з прищепленими ланцюгами, і окремі прищеплені ланцюги здатні видалятись з організму, переважно шляхом клубочкової фільтрації. Молекулярна вага прищепного полімеру є настільки високою, що вона перевищує виключну границю організму та гарантує тривалий час циркуляції та достатній ефект EPR, а також поглинання тканиною солідних пухлин. Молекулярну вагу нових прищепних кон'югатів доксорубіцину можна регулювати не тільки молекулярною вагою основного полімеру та прищеплених ланцюгів, але також і співвідношенням кількості прищеплених ланцюгів на один головний ланцюг. Молекулярна вага такого прищепного полімеру переважно знаходиться в межах від 50,000 до 400,000 г/моль; вміст доксорубіцину як у головному ланцюзі, так і у прищеплених ланцюгах знаходиться в межах від 1 до 25 ваг. % (0,3 до 8 моль %). Полімерний лікарський засіб відповідно до даного винаходу спочатку має вводитись внутрішньовенно (ін'єкція або інфузія), але він також може вводитись внутрішньопухлинно або інтраперитонеально. Полімер з хімічно зв'язаним цитостатиком є стабільним під час циркуляції у кровотоці; гідразоновий зв'язок між доксорубіцином та полімером є відносно стабільним за фізіологічних умов кровотоку (рН 7,4). Після екстравазації та поглинання у солідних пухлинах завдяки ефекту EPR, молекулярно-розчинений кон'югат проникає до кожної клітини пухлини шляхом піноцитозу та в результаті зменшення рН із зовнішнього рН 7,4 до внутрішньоклітинного рН 5 - 6, гідразоновий зв'язок має бути гідролізований та цитостатик вивільнений у клітинімішені, що має активувати її цитотоксичний ефект. У злегка кислому відновлювальному середовищі клітини (в джерелах наводяться концентрації глутатіону у цитоплазмі живих клітин в межах від 1 до 5 ммоль) має відбутись регульоване гідролізом вивільнення лікарської речовини та відновлення дисульфідних зв'язків, а також розкладання макромолекулярного прищепного полімеру на первинні полімерні фрагменти, здатні видалятися з організму. Подібне розкладання носія має відбутись у носії, який містить прищеплені ланцюги, зв'язані олігопептидною послідовністю, розщеплюваною під дією ферментів. Це розкладання полімерного скелета має бути викликане дією лізосомних клітинних ферментів. Об'єктивність механізму дії полімерного 2 UA 97812 C2 5 10 15 20 25 30 35 40 45 лікарського засобу згідно з даним винаходом, як пропонується вище, демонструється шляхом експериментів, включаючи модельоване вивільнення доксорубіцину з полімерного ланцюга, а також експерименти на розкладання полімеру, які здійснювались у фізіологічному середовищі, що моделює стан у живій клітині. Результати таких досліджень, включаючи тести на протипухлинну активність, подані у частині з прикладами даної заявки. Синтез та структури полімерних кон'югатів Полімерні кон'югати згідно з даним винаходом синтезували у декілька стадій; детальна кінцева структура кон'югата значно залежить від вибраного шляху синтезу. На першій стадії синтезу синтезували основні мономери: ГПМА, метакрилоїльовані похідні амінокислот та олігопептидів, термінованих 4-нітрофеноксильною (ONp) або тіазолідин-2тіоновою (ТТ) групою, метакрилоїльовані похідні амінокислот та олігопептидів, термінованих гідразидною (NHNH2) групою, або термінованих гідразидною групою, захищеною третбутилоксикарбонільною групою (Вос), або термінованих доксорубіцином, зв'язаним гідразоновим зв'язком, та метакрилоїльовані макромономери, одержані шляхом метакрилоїлюваня ГПМА напівтелехелатного співполімеру, термінованого первинною аміногрупою (NH2). На другій стадії синтезували полімерні прекурсори, тобто статистичні співполімери ГПМА, які слугують головним ланцюгом, та напівтелехелатні полімери з термінальними реакційноздатними групами, які слугують для прищеплення головного полімерного ланцюга. Головний полімерний ланцюг по своїй довжині несе функціональні групи, такі як 4нітрофеноксильна, тіазолідин-2-тіонова групи, гідразидні групи, первинні аміногрупи, сульфгідрильні (SH) групи або дитіопіридильні (PDS) групи, може бути одержаний як радикальною співполімеризацією вищевказаних функціональних мономерів з ГПМА, так і реакцією полімер-аналогічних перетворень основного співполімеру, який несе функціональні групи. Основний співполімер є співполімером ГПМА та метакрилоїльованих гідразидів амінокислот або олігопептидів, які, по суті, містять 70 - 98 моль % ГПМА та 2 - 30 моль % одиниць з функціональними групами. В нижчеподаних структурних схемах введено два скорочення для спейсерів у бічних ланцюгах співполімеру: і) SP1-аміноацил у метакрилоїл(аміноацил)гідразидах та метакрилоїл(аміноацил)амінах, наприклад, гліцил, гліцилгліцил, β-аланіл, 6аміногексаноїл (АН), 4-амінобензоїл або комбінований ацил, одержаний з олігопептидів, таких як GlyPheGly, GlyLeuGly, GlyLeuPheGly або GlyPheLeuGly; іі) SP2-комбінований ацил у метакрилоїл(аміноацил)гідразидах та метакрилоїл(аміноацил)амінах, одержаний з олігопептидної послідовності, розщеплюваної під дією ферментів, яка переважно містить олігопептидні послідовності GlyLeuGly, GlyPheGly, GlyPheLeuGly або GlyLeuPheGly. Наступні статистичні співполімери з мономерними ланками, як описано вище, можна одержати співполімеризацією або реакціями полімер-аналогічних перетворень: Співполімери 1: Ці співполімери несуть реакційноздатні 4-нітрофеноксильні або ацилтіазолідин-2-тіонові групи вздовж ланцюга. Радикальна співполімеризація приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, та метакрилоїльованим здатним до біорозкладання олігопептидом (наприклад, GlyPheLeuGly), термінованим 4-нітрофеноксильною (Співполімер 1а) або тіазолідин-2-тіоновою групами (Співполімер 1b). Співполімери 2: 3 UA 97812 C2 Ці співполімери несуть реакційноздатні гідразидні або первинні аміногрупи вздовж ланцюга. Радикальна співполімеризація ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими гідразидною групою, приводить до одержання Співполімеру 2а. 5 Радикальна співполімеризація приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, метакрилоїльованим здатним до біорозкладання олігопептидом (наприклад, GlyPheLeuGly), термінованим гідразидною групою (Співполімер 2b) 10 Співполімер 2с одержували реакцією полімер-аналогічних перетворень, використовуючи Співполімер 1а та 1b. Статистичний співполімер, який несе функціональну гідразидну або первинну аміногрупи вздовж свого ланцюга одержували взаємодією 4-нітрофенілестерних (Співполімер 1а) або ацилтіазолідин-2-тіонових (Співполімер 1b) груп з надлишком гідразингідрату, етилендіаміну, бутилендіаміну або гексаметилендіаміну. 15 Співполімери 3: Ці статистичні співполімери несуть реакційноздатні дитіопіридильні групи вздовж ланцюга. 4 UA 97812 C2 5 Після видалення захисної групи, реакція полімер-аналогічних перетворень співполімеру 2а з N-сукцинімідил-[3-(2-піридилдитіо)]пропіонатом (SPDP) (загалом, будь-яким біфункціональним агентом з активованою карбоксильною групою та піридилдисульфідною групою, таким як SPDP, 4-сукцинімідилоксикарбоніл-α-метил-α-(2-піридилдитіо)толуол, N-сукцинімідил-[4-(2піридилдитіо)]бутират, N-(2-сульфосукцинімідил-[3-(2-піридилдитіо)]пропіонат) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими гідразидною групою та метакрилоїльованими амінокислотами або олігопептидами, термінованими N-[3-(2-піридилдитіо)пропіоніл]етиламідною групою. (Співполімер 3а) 10 15 Реакція полімер-аналогічних перетворень співполімерів 2b та 2с з N-сукцинімідил-[3-(2піридилдитіо)]пропіонатом (SPDP) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, та метакрилоїльованим здатним до біорозкладання олігопептидом (наприклад, GlyPheLeuGly), термінованим N-[3-(2-піридилдитіо)пропіоніл]етиламідною групою. (Співполімер 3b) 20 25 Реакція полімер-аналогічних перетворень співполімерів 1а та 1b з 2-(2піридилдитіо)етиламіном (PDEA) (загалом, будь-який біфункціональний агент з первинною аміно- або гідразидною групою та піридилдисульфідною групою, такий як PDEA, 2-(2піридилдитіо)етилгідразин, 4-(2-піридилдитіо)бутиламін) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Восзахищеною гідразидною групою, та метакрилоїльованим здатним до біорозкладання олігопептидом (наприклад, GlyPheLeuGly), термінованим 2-(2-піридилдитіо)етиламідною групою. (Співполімер 3с). 5 UA 97812 C2 5 10 15 Співполімери 4: Ці статистичні співполімери несуть реакційноздатні сульфгідрильні групи вздовж ланцюга. Після видалення захисної групи реакція полімер-аналогічних перетворень співполімеру 2а з 2-іміно-тіолатом (ІТН) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими гідразидною групою, та метакрилоїльованими амінокислотами або олігопептидами, термінованими 4сульфанілбутанімідогідразидною групою. (Співполімер 4а) Реакція полімер-аналогічних перетворень співполімерів 2b та 2с з 2-іміно-тіолатом (ІТН) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, та метакрилоїльованим олігопептидом (наприклад, GlyPheLeuGly), термінованим 4-сульфанілбутанімідамідною групою. (Співполімер 4b) 20 6 UA 97812 C2 Реакція полімер-аналогічних перетворень співполімерів 3a з дитіотреітолом (DTT) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими гідразидною групою, та метакрилоїльованими амінокислотами або олігопептидами, термінованими 3-сульфанілпропаногідразидною групою (Співполімер 4с). 5 10 Реакція полімер-аналогічних перетворень співполімерів 3b та 3с з дитіотреітолом (DTT) приводить до одержання терполімеру ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, та метакрилоїльованим олігопептидом (наприклад, GlyPheLeuGly), термінованим 3-сульфанілпропанамідною (Співполімер 4d) або 2-сульфанілетиламіновою групою (Співполімер 4е). 15 20 25 Напівтелехелатні співполімери характеризуються вмістом від 85 до 99 моль % ГПМА, 1 - 15 % мольних одиниць метакрилоїльованих Вос-захищених гідразидів амінокислот або олігопептидів, та реакційноздатною групою, розташованою на кінці полімерного ланцюга. Ці полімери були одержані радикальною співполімеризацією, здійснюваною у присутності агента передачі ланцюга [сульфанілпропіонової кислоти (SPA) або цистаміну], при ініціюванні азоініціатором 3,3'-азо-біс(4-ціаноізовалеріановою кислотою) (ΑΒΙΑ) або реакційноздатним азоініціатором 3,3'-[4,4'-азобіс(4-ціано-4-метил-1-оксо-бутан-4,1-дііл)]біс(тіазолідин-2-тіоном) (АВІА-ТТ). Наступні напівтелехелатні співполімери були одержані як прищеплені ланцюга для одержання прищепних співполімерів співполімеризацією та модифікацією термінальних функціональних груп: Прищеплені полімери 1: Ця група полімерів включає напівтелехелатні співполімери, які містять термінальні реакційноздатні N-сукцинімідилестерні або ацилтіазолідин-2-тіонові групи. 7 UA 97812 C2 Радикальна полімеризація ГПМА, ініційована АВІА-ТТ ініціатором, приводить до одержання гомополімеру ГПМА з термінальною реакційноздатною ацилтіазолідин-2-тіоновою групою (Прищеплений полімер 1а). 5 10 15 Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, одержували радикальною полімеризацією ГПМА, яку здійснювали у присутності агента передачі ланцюга SPA. Співполімер термінований N-сукцинімідилестерною групою. (Прищеплений полімер 1b). Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою та термінальною ацилтіазолідин-2-тіоновою групою, одержували радикальною співполімеризацією відповідних мономерів при ініціюванні за допомогою АВІА-ТТ. Співполімер з термінальною N-сукцинімідилестерною групою одержували аналогічно при ініціюванні за допомогою ΑΒΙΑ та з наступною активацією термінальної карбоксильної групи N-гідроксисукцинімідом (Прищеплений полімер 1с). 20 25 Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, та з термінальним Ν-сукцинімідилестером здатного до біорозкладання олігопептиду (наприклад, GlyPhe LeuGly-OSu), як правило SP2, (Прищеплений полімер 1d) одержували радикальною співполімеризацією ГПМА з відповідними 8 UA 97812 C2 мономерами, ініційованою за допомогою ΑΒΙΑ, з наступною активацією термінальної карбоксильної групи N-гідроксисукцинімідом. 5 10 15 Прищеплені полімери 2: Ці напівтелехелатні співполімери містять термінальні реакційноздатні гідразидні або первинні аміногрупи. Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, одержували радикальною співполімеризацією, яку здійснювали у присутності цистаміну. Цей співполімер термінований первинною аміногрупою. (Прищеплений полімер 2а) Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, термінованою амінокислотою, одержували взаємодією термінальних активованих карбоксильних груп Прищеплених полімерів 1b та 1с з надлишком гідразингідрату, етилендіаміну, бутилендіаміну або гексаметилендіаміну (Прищеплений полімер 2b). 20 9 UA 97812 C2 5 10 Прищеплені полімери 3: Ці напівтелехелатні співполімери містять термінальні реакційноздатні дитіопіридильні групи. Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, термінованою 2-(2піридилдитіо)етиламідною групою, одержували взаємодією термінальних реакційноздатних груп прищеплених полімерів 1b та 1с з PDEA. (Прищеплений полімер 3a). Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, термінованою N-[3-(2піридилдитіо)пропіоніл]амідною групою, одержували взаємодією термінальних реакційноздатних груп прищеплених полімерів 2а та 2b з SPDP (Прищеплений полімер 3b). 15 20 Прищеплені полімери 4: Ці напівтелехелатні співполімери містять термінальні реакційноздатні сульфгідрильні групи. Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, одержували взаємодією прищеплених полімерів 2а та 2b з ІТН. Полімерний ланцюг цього співполімеру термінований 4сульфанілбутанімідамідною або 4-сульфанілбутанімідогідразидною групою (Прищеплений полімер 4а). 10 UA 97812 C2 5 10 15 20 25 30 Співполімер ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, одержували взаємодією прищеплених полімерів 3a та 3b з DTT. Ланцюг цього співполімеру термінований 3сульфанілпропаногідразидною, 3-сульфанілпропанамідною або 2-сульфанілетиламіновою групами (Прищеплений полімер 4b). Полімерний носій та полімерний кон'югат. Полімерний носій є прищепним макромолекулярним полімером без лікарської речовини, зв'язаної з ним, одержаний реакцією прищеплення напівтелехелатного співполімеру до основного співполімеру, як показано у розділі з прикладами. Для реакцій переважно застосовують вищевказані співполімери, гідразидна група яких захищена Вос-групою (трет-бутилоксикарбонільною групою). На останній стадії синтезу кон'югата захисну групу видаляють з гідразидної групи та кон'югат зв'язується з доксорубіцином гідразоновим зв'язком реакцією у метанолі з використанням як каталізатора оцтової кислоти. Кінцеву полімерну лікарську речовину (кон'югат) очищували осадженням та, при необхідності, колоночною хроматографією, як показано у розділі з прикладами. Об'єкт даного патенту включає полімерні кон'югати доксорубіцину, детальні структури якого показані у розділі схем, та синтез якого описаний у розділі з прикладами. Стосовно типів груп, які реагують в основних полімерах та напівтелехелатних прищеплених полімерах, полімерні кон'югати додатково поділяються на 5 основних груп. Були одержані наступні кон'югати: Кон'югати 1 Ці кон'югати несуть DOX, зв'язаний з полімером гідразоновим зв'язком; прищеплені ланцюги зв'язані з головним ланцюгом нездатним до розкладання зв'язком. Для одержання цих полімерних кон'югатів були застосовані співполімери, які несуть гідразидні або первинні аміногрупи вздовж свого головного ланцюга, та напівтелехелатні співполімери з термінальною N-сукцинімідилестерною або ацилтіазолідин-2-тіоновою групами. Кон'югат 1а був одержаний взаємодією гідразидних груп Співполімеру 2а з ацилтіазолідин-2тіоновими групами Прищепленого полімеру 1а, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. 11 UA 97812 C2 Структурна схема кон'югата 1а (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350). 5 Кон'югат 1b одержували взаємодією гідразидних груп Співполімеру 2а з тіазолідин-2тіоновими або N-сукцинімідиловими групами Прищепленого полімеру 1b або 1с, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. Структурна схема кон'югата 1b (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 - 50, t = 1 - 20). 10 Кон'югат 1с одержували взаємодією гідразидних груп Співполімеру 2а з Nсукцинімідилестерними групами Прищепленого полімеру 1d, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. 15 20 Структурна схема кон'югата 1с (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 - 50, t = 1 - 20). Кон'югат 1d одержували взаємодією гідразидних або первинних аміногруп Співполімеру 2b або 2с з ацилтіазолідин-2-тіоновою або N-сукцинімідилестерною групами Прищепленого полімеру 1b або 1с, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. 12 UA 97812 C2 Структурна схема кон'югата 1d (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 - 50, t = 1 - 20). 5 10 15 20 25 Кон'югати 2 Ці кон'югати несуть DOX, зв'язаний з полімером гідразоновим зв'язком; прищеплені ланцюги зв'язані з головним ланцюгом здатним до біорозкладання зв'язком - олігопептидною послідовністю, розщеплюваною під дією ферментів. Для одержання цих полімерних кон'югатів були застосовані співполімери, які несуть 4-нітрофеноксильні або тіазолідин-2-тіонові групи вздовж свого головного ланцюга, та напівтелехелатні співполімери з термінальними гідразидними або первинними аміногрупами. Кон'югат 2 одержували взаємодією ацилтіазолідин-2-тіонової або 4-нітрофенілестерної груп Співполімеру 1а або 1b з гідразидними або первинними аміногрупами Прищепленого полімеру 2а або 2b, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. Структурна схема кон'югата 2 (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 - 350, s = 0 - 50, t = 1 - 20). Кон'югати 3 Ці кон'югати несуть DOX, зв'язаний з полімером гідразоновим зв'язком; прищеплені ланцюги зв'язані з головним ланцюгом здатним до біорозкладання зв'язком - дисульфідними містками, відновлювально-розщеплюваними в цитоплазмі цільової клітини. Для одержання цих полімерних кон'югатів були застосовані співполімери, які несуть реакційноздатні дитіопіридильні групи вздовж свого головного ланцюга, та напівтелехелатні співполімери з термінальними сульфгідрильними групами. Кон'югат 3a одержували взаємодією дитіопіридильних груп Співполімеру 3a або 3b з сульфгідрильними групами Прищепленого полімеру 4а або 4b, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. 13 UA 97812 C2 5 Структурна схема кон'югата 3 (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 50, t = 1 - 20). Кон'югат 3b одержували взаємодією дитіопіридильних груп Співполімеру 3с з сульфгідрильними групами Прищепленого полімеру 4а або 4b, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. Структурна схема кон'югата 3b (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 - 50, t = 1 - 20). 10 15 20 Кон'югати 4 Ці кон'югати несуть DOX, зв'язаний з полімером гідразоновим зв'язком; прищеплені ланцюги зв'язані з головним ланцюгом здатним до біорозкладання зв'язком - дисульфідними містками, відновлювально-розщеплюваними в цитоплазмі цільової клітини. Для одержання цих полімерних кон'югатів були застосовані співполімери, які несуть сульфгідрильні групи вздовж свого головного ланцюга, та напівтелехелатні співполімери з термінальними реакційноздатними дитіопіридильними групами. Кон'югат 4а одержували взаємодією сульфгідрильних груп Співполімеру 4а або 4b з дитіопіридильними групами Прищепленого полімеру 3a або 3b, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. Структурна схема кон'югата 4а (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 - 350, s = 0-50, t = 1 -20). 25 14 UA 97812 C2 Кон'югат 4b одержували взаємодією сульфгідрильних груп Співполімеру 4с або 4d з дитіопіридильними групами Прищепленого полімеру 3a або 3d, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. 5 10 15 20 25 Структурна схема кон'югата 4b (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 - 50, t = 1 - 20). Кон'югат 4с одержували взаємодією сульфгідрильних груп Співполімеру 4е з дитіопіридильними групами Прищепленого полімеру 3a або 3b, з наступним зняттям захисту з гідразидних груп та приєднанням DOX до полімеру. Структурна схема кон'югата 4с (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 - 50, t = 1 - 20). Кон'югати 5 Ці кон'югати несуть DOX, зв'язаний з полімером гідразоновим зв'язком; прищеплені ланцюги зв'язані з головним ланцюгом здатним до біорозкладання зв'язком - олігопептидною послідовністю, розщеплюваною під дією ферментів. їх одержували радикальною терполімеризацією ГПМА з метакрилоїльованими амінокислотами або олігопептидами, термінованими Вос-захищеною гідразидною групою, та метакрилоїльованими макромономерами, одержаними метакрилоїлюванням ГПМА напівтелехелатного співполімеру, термінованого первинною аміногрупою (Макромономери, Фіг. 32). Макромономери одержували взаємодією гідразидних або первинних аміногруп Прищеплених полімерів 2а та 2b з метакрилоїльованими похідними здатних до біорозкладання олігопептидів, термінованих 4нітрофеноксильною або тіазолідин-2-тіоновою групою. 15 UA 97812 C2 Структурна схема макромономерів (r = 34 - 350, s = 1 - 70). 5 10 15 20 25 30 Структурна схема кон'югата 5 (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 - 10, r = 34 -350, s = 0 50, t = 1 - 20). Фіг. 1 показує графік швидкості вивільнення DOX з прищепних полімерних кон'югатів та лінійного полімерного кон'югата у буфері з рН 5 (модель внутрішньоклітинного середовища). Фіг. 2 показує графік швидкості вивільнення DOX з прищепних полімерних кон'югатів та лінійного полімерного кон'югата у буфері з рН 7,4 (модель кровотоку). Фіг. 3 показує часову залежність молекулярної ваги полімерних кон'югатів під час їх розкладаня - А) розкладання Кон'югата 1d, застосовуючи лізосомальний фермент катепсин В -7 [с(катепсин В) = 5-10 моль/л]; В) розкладання Кон'югата 3a, застосовуючи глутатіон -3 [с(глутатіон) = 3-10 моль/л]. Фіг. 4 показує графік виживаності мишей В/6, інокульованих мишиною лімфомою EL 4, яку лікували прищепними кон'югатами DOX шляхом внутрішньовенного введення однієї дози 15 мг/кг еквівалента DOX при терапевтичному способі введення лікарського засобу. Приклади методів синтезу проміжних продуктів та кон'югатів згідно з винаходом Приклад 1: Синтез мономерів та ініціатора АВІА-ТТ 3,3'-[4,4'-Азобіс(4-ціано-4-метил-1-оксо-бутан-4,1-дііл)]біс(тіазолідин-2-тіон) (АВІА-ТТ) одержували раніше описаним способом [Subr 2006] ГПМА одержували раніше описаним способом [Ulbrich a kol. 2000]. Елементний аналіз: розраховано: 58,8 % С, 9,16 % Н, 9,79 % N; отримано: 58,98 % С, 9,18 % Н, 9,82 % N. Продукт був хроматографічно чистим. 6-(Метакрилоїламіно)гексаноїл-N'-(трет-бутилоксикарбоніл)гідразин (MA-AH-NHNH-Вос) одержували раніше описаним способом [Ulbrich 2004a] 6-(Метакрилоїламіно)гексаноїл гідразин (N'-(6-гідразино-6-оксогексил)-2-метилакриламід) (MA-AH-NHNH2) одержували раніше описаним способом [Ulbrich patents, Etrych patent]. MA-GFLG-TT або MA-GFLG-ONp 4-Нітрофенілестер N-метакрилоїлгліцил-DL-фенілаланіллейцилгліцину (MA-GFLG-ONp) одержували раніше описаним способом [Rejmanova 1977] Тіазолідин-2-тіон N-метакрилоїлгліцил-DL-фенілаланіллейцилгліцину (MA-GFLG-TT) одержували раніше описаним способом [Subr patent] 6-(Метакрилоїламіно)гексаноїлгідразин-Доксорубіцин (MA-AH-NHN=DOX) 16 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 60 6-(Метакрилоїламіно)гексаноїлгідразин (40 мг, 0,188 ммоль) розчинили у 6 мл метанолу при кімнатній температурі. Розчин вилили у реакційну посудину, в яку помістили доксорубіцин.НСІ (115 мг, 0,198 ммоль) та суспензію енергійно перемішали. До суспензії додали 310 мкл оцтової кислоти та реакційну суміш перемішували при кімнатній температурі протягом 24 годин. За реакційним процесом слідкували за допомогою ТШХ - на пластинках Silicagel 60 F254 (метанол:хлороформ:оцтова кислота 2:8:1, Rf(DOX) = 0,75, Rf(MA-AH-NHN=DOX)= 0,9). Потім до гомогенної реакційної суміші додали 100 мг співполімеру 1 (для зв'язування залишкового вільного DOX) та реакційну суміш перемішували при кімнатній температурі протягом ще 4 годин. Продукт очистили від полімерних та низькомолекулярних домішок за допомогою гельхроматографії на колонці (30 cm × 3 cm), наповненій Sephadex LH-20 у метанолі. Фільтрат концентрували до 2 мл та продукт осадили у 30 мл діетилового етеру. Продукт відсмоктали, промили невеликою кількістю діетилового етеру та висушили у вакуумі до досягнення постійної ваги. Вихід становив 110 мг продукту (79 %) з температурою плавлення від 172 до 175 С. ТШХ (метанол:хлороформ:оцтова кислота 2:8:1): одна пляма з Rf = 0,9. MALDI-TOF MS: 762 (M+Na). Полі(ГПМА-спів-МА-АН-NНNН-Вос)-GLFG-МА метакрилоїльований макромономер одержували взаємодією термінальних гідразидних або первинних аміногруп напівтелехелатних співполімерів (Прищеплені полімери 2а та 2b) з 4-нітрофеноксильними або тіазолідин-2тіоновими групами метакрилоїльованих похідних здатних до біорозкладання олігопептидів. 200 мг Прищепленого співполімеру 2а (0,0125 ммоль груп NH2) розчинили у 2 мл метанолу та додали розчин 7,7 мг MA-GFLG-TT (0,0137 моль, 110% по відношенню до груп NH2) у 1 мл метанолу при кімнатній температурі та інтенсивному перемішуванні. Через 2 години реакційну суміш очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex LH-20 у метанолі при детекції по індексу рефракції. Полімерну фракцію виділили, концентрували до 3 мл у вакуумному ротаційному випарнику, та макромономер виділили шляхом осадження з 30 мл етилацетату. Продукт сушили до досягнення постійної ваги. Приклад 2: Синтез полімерного прекурсора - Співполімер 1b - співполімер ГПМА з MAGFLG-TT Полі(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-GFLG-ТТ) співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА, MA-AH-NHNH-Вос та MA-GFLG-TT у ДМСО при 60 °С. 465 мг (3,25 ммоль) ГПМА, 44,5 мг (0,14 ммоль) MA-AH-NHNH-Boc, 100 мг (0,18 ммоль) MAGFLG-TT (12,5 ваг. % мономерів) та 98,3 мг (0,60 ммоль) АБІН (2 ваг. %) розчинили у 3,8 мл ДМСО. Ампулу з розчином полімеризаційної суміші барботували азотом протягом 10 хвилин, потім помістили у нагрітий до 60 °С термостат на 6 годин. Потім реакційну суміш осадили у 80 мл суміші ацетону : діетилового етеру 3 : 1 та центрифугували. Полімер осадили з метанолу у таку ж суміш, відфільтрували через пористий скляний фільтр S4 та висушили до досягнення постійної ваги. Приклад 3: Синтез полімерного прекурсора - Співполімер 2а - співполімер ГПМА з MA-AHNHNH2 Полi(ГПМА-спiв-МА-АН-NНNН2) співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-AH-NHNH2 у метанолі при 60 °С у відповідності з раніше описаним способом [Etrych patent]. Приклад 4: Синтез полімерного прекурсора - Співполімер 2с – співполімер полі(ГПMA-співMA-AH-NHNH-Boc-спів-MA-GFLG-NH2) Полі(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-GFLG-NН2) співполімер одержували реакцією полімер-аналогічних перетворень полі(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-GFLG-ТТ) співполімеру з надлишком етилендіаміну (EDA). 410 мг полі(ГПМА-спів-МА-АН-NНNH-Вос-спів-МА-GFLG-ТТ) полімеру (0,10 ммоль груп ТТ) розчинили у 6 мл меанолу. 70 мкл EDA (1,05 ммоль) додали до енергійно перемішуваного жовтуватого розчину. Через 30 хвилин знебарвлений розчин осадили у 120 мл суміші ацетону : діетилового етеру 3:1, знову осадили з метанолу у таку ж суміш та відфільтрували. Полімер висушили до досягнення постійної ваги. Приклад 5: Синтез полімерного прекурсора - Співполімер 3a – співполімер полі(ГПМА-співMA-AH-NHNH2-спів-MA-AH-PDS) Полі(ГПМА-спів-МА-АН-NНNН2-спів-МА-АН-РDS) співполімер одержували реакцією полімераналогічних перетворень полі(ΓΠΜΑ-спів-ΜΑ-ΑΗ-ΝΗΝΗ2) співполімеру з біфункціональним агентом SPDP. 400 мг полі(ΓΠΜΑ-мпів-ΜΑ-ΑΗ-ΝΗΝΗ2) полімеру (0,17 ммоль груп ΝΗΝΗ2) розчинили у 7 мл метанолу та до енергійно перемішуваного розчину додали розчин 30 мг SPDP (0,094 ммоль) у 1 17 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 60 мл метанолу. Через 2 години реакційну суміш розбавили до 15 мл метанолом та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex LH-20 у метанолі при детекції по індексу рефракції. Полімерну фракцію виділили, концентрували до 8 мл у вакуумному ротаційному випарнику та співполімер виділили шляхом осадження з 100 мл етилацетату. Полімер висушили до досягнення постійної ваги. Приклад 6: Синтез полімерного прекурсора - Співполімер 3с - співполімер полі(ГПМА-спів-MA-AH-NHNH-Boc-спів-MA-AH-PDS) полі(ГПМА-спів-MA-AH-NHNH-Boc-спів-MA-AH-PDS) співполімер одержували реакцією полімер-аналогічних перетворень полі(ГПМА-спів-MA-AH-NHNH-Boc-спів-МА-АН-ТТ) співполімеру з біфункціональним агентом PDEA. 20 мг PDEA.HCI (0,089 ммоль) розчинили у 1 мл ДМСО та додали 14,5 мкл діізопропілетиламіну (0,089 ммоль) при інтенсивному перемішуванні. Через 5 хвилин до цього розчину при інтенсивному перемішуванні та кімнатній температурі додали розчин 300 мг полі(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-АН-ТТ) полімеру (0,073 ммоль груп ТТ) у 4 мл ДМСО. Через 2 години реакційну суміш розбавили до 15 мл метанолом та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex LH-20 у метанолі при детекції по індексу рефракції. Полімерну фракцію виділили, концентрували до 6 мл у вакуумному ротаційному випарнику та співполімер виділили шляхом осадження у 80 мл суміші ацетону : діетилового етеру 1:3 Продукт висушили до досягнення постійної ваги. Приклад 7: Синтез полімерного прекурсора - Співполімер 4b – співполімер полі(ГПМА-співMA-AH-NHNH-Boc-спів-MA-GFLG-SH) Полі(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-GFLG-SН) співполімер одержували реакцією полімер-аналогічних перетворень полi(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-GFLG-NH2) співполімеру з ІТН у фосфатному буфері. 350 мг полі(ГПMA-спів-MA-AH-NHNH-Boc-спів-MA-GFLG-NH2) співполімеру (0,11 ммоль груп NH2) розчинили у 7 мл фосфатного буферу (0,05 Μ фосфатного буферу з 0,1 Μ NaCI, pH 7,4). 80 мг ІТН (0,58 ммоль) розчинили у 1 мл дистильованої води та цей розчин додали до розчину співполімеру при інтенсивному перемішуванні та кімнатній температурі. Через 30 хвилин реакційну суміш розбавили до 20 мл дистильованою водою та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. Приклад 8: Синтез полімерного прекурсора - Співполімер 4с – співполімер полі(ГПМА-співМА-АН-NНNН2-спів-МА-АН-SН) Полi(ГПМА-спів-МА-АН-NНNН2-спів-МА-АН-SН) співполімер одержували відновленням PDS груп полі(ГПМА-спів-МА-АН-NHNH2-спів-МА-АН-РDS) співполімеру за допомогою DTT у дистильованій воді. 300 мг полі(ГПМА-спів-MA-AH-NHNH2-спів-MA-AH-PDS) співполімеру (0,075 ммоль груп PDS) розчинили у 5 мл дистильованої води. 40 мг DTT (0,26 ммоль) розчинили у 1 мл дистильованої води та цей розчин додали до розчину співполімеру при інтенсивному перемішуванні та кімнатній температурі. Через 20 хвилин реакційну суміш розбавили до 15 мл дистильованою водою та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. Приклад 9: Синтезнапівтелехелатного полімерного прекурсора - Прищеплений полімер 1b співполімер полі(ГПМА-спів-МА-АН-NНNН-Вос)-ТТ Полі(ГПМА-спів-МА-АН-NНNН-Вос)-ТТ напівтелехелатний співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-AH-NHNH-Boc уДМСО при 60 °С та ініціюванні ініціатором АВІА-ТТ. 367 мг (2,57 ммоль) ГПМА, 70 мг (0,224 ммоль) MA-AH-NHNH-Boc (14 ваг. % мономерів) розчинили у 2,7 мл ДМСО та розчин помістили в полімеризаційну ампулу, у якій було попередньо відважено 140 мг (0,290 ммоль) АВІА-ТТ (4 ваг. %). Розчин у ампулі продували азотом протягом 15 хвилин, ампулу герметизували та помістили у термостат, нагрітий до 60 °С. Ініціатор розчинився через 3 хвилини при 60 °С. Через 6 годин реакційну суміш осадили у 80 мл суміші ацетону : діетилового етеру 2:1. Полімер розчинили у 4 мл метанолу та знову осадили у 60 мл такої ж суміші для осадження. Осаджений співполімер відфільтрували через пористий скляний фільтр S4 та висушили до досягнення постійної ваги. Приклад 10: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 1с - співполімер полi(ГПМА-спів-МА-АН-NНNН-Вос)-OSu 18 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 Полi(ГПМА-спів-МА-АН-NНNН-Вос)-ОSu напівтелехелатний співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-AH-NHNH-Boc у етанолі при 50 °С та ініціюванні ініціатором ΑΒΙΑ, з наступною активацією термінальних карбоксильних груп до N-сукцинімідилестеру. 3,33 г (23,2 ммоль) ГПМА, 674 мг (2,16 ммоль) MA-AH-NHNH-Boc (12 ваг. % мономерів) та 600 мг (2,14 ммоль) ΑΒΙΑ (1,8 ваг. %) розчинили у 35 мл етанолу. Розчин помістили у полімеризаційну ампулу та продували азотом впродовж 15 хвилин. Потім ампулу герметизували та помістили у термостат, нагрітий до 50 °С. Через 21 годину рекційну суміш осадили у 700 мл ацетону та центрифугували. Співполімер знову осадили з метанолу у таку ж осаджувальну речовину, відфільтрували через пористий скляний фільтр S4 та висушили до досягнення постійної ваги. На другій стадії 400 мг полімеру (0,027 ммоль СООН) розчинили у 1,75 мл DMF. 27,5 мг дициклогексилкарбодііміду (DCC) (0,133 ммоль) та 15,4 мг Nгідроксисукциніміду (0,133 ммоль) розчинили у 0,2 мл DMF та додали до перемішаного розчину співполімеру, охолодженого до 4 °С (сумішшю води та льоду). Реакційну суміш перемішували впродовж 1,5 години при 4°С та впродовж 2 годин при кімнатній температурі. Полімер осадили у 50 мл ацетону та відфільтрували через пористий скляний фільтр S4. Після висушування до досягнення постійної ваги зразок зберігали в атмосфері аргону при-18 °С. Приклад 11: Синтез напівтелехелатного полімерного прекурсора (синтез з агентом передачі ланцюга SPA) - Прищеплений полімер 1с - співполімер полі(ГПМА-спів-MA-AH-NHNH-Boc)-OSu полі(ГПМА-спів-MA-AH-NHNH-Boc)-OSu напівтелехелатний співполімер одержували радикальною співполімеризацією ГПМА та MA-AH-NHNH-Boc з осадженням у ацетоні при 50 °С у присутності ініціатора АБІН та SPA, як агента передачі ланцюга. На другій стадії термінальні карбоксильні групи були перетворені реакцією з DCC та N-гідроксисукцинімідом на Nсукцинімідилестер. 438 мг (3,07 ммоль) ГПМА, 76 мг (0,36 ммоль) MA-AH-NHNH-Boc, 4,6 мг (0,028 ммоль) АБІН та 6 мг (0,057 ммоль) SPA розчинили у 3,86 мл ацетону та розчин помістили у полімеризаційну ампулу. Розчин у ампулі продували азотом впродовж 10 хвилин, потім ампулу герметизували та помістили у термостат, нагрітий до 50 °С на 19 годин. Відокремлений полімер відфільтрували, розчинили у 2 мл метанолу та фракціонували на колонці, наповненій Sephadex LH-60, застосовуючи метанол як елюент. Коли олігомерна фракція була відокремлена, полімерний розчин концентрували під вакуумом та осадили у 10-кратному надлишку суміші ацетону та діетилового етеру (1:1). Полімер відфільтрували через пористий скляний фільтр S4 та висушили до досягнення постійної ваги. На другій стадії 340 мг полімеру (0,028 ммоль СООН) розчинили у 1,6 мл DMF. 28,5 мг дициклогексилкарбодііміду (DCC) (0,138 ммоль) та 15,9 мг Nгідроксисукциніміду (0,138 ммоль) розчинили у 0,2 мл DMF та додали до перемішаного розчину співполімеру, охолодженого до 4 °С. Реакційну суміш перемішували впродовж 3,5 годин при 4 °С та протягом 3 годин при кімнатній температурі. Полімер виділили осадженням у 50 мл ацетону та відфільтрували через пористий скляний фільтр S4. Після висушування до досягнення постійної ваги зразок зберігали в атмосфері аргону при -18 °С. Приклад 12: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 1d - співполімер полi(ГПМА-спів-МА-АН-NНNН-Вос)-GFLG-OSu Полі(ГПМА-спів-МА-АН-NНNН-Вос)-GFLG-OSu напівтелехелатний співполімер одержували синтезом в дві стадії. На першій стадії N-сукцинімідилестер полі(ГПМА-спів-МА-AH-NHNH-Boc)OSu співполімеру взаємодіяв з аміногрупою олігопептиду GFLG. На другій стадії термінальні карбоксильні групи одержаного полі(ГПМА-спів-MA-AH-NHNH-Boc)-GFLG-СООН співполімеру перетворили на N-сукцинімідилестер реакцією з DCC та N-гідроксисукцинімідом. 300 мг полі(ГПМА-спів-МА-АН-NНNН-Вос)-ОSu співполімеру (0,025 ммоль груп OSu) розчинили у 2 мл of DMF. Потім до розчину додали розчин 14 мг олігопептиду GFLG (0,036 ммоль) у 0,2 мл DMF. Реакційну суміш перемішували впродовж 3,5 годин при кімнатній температурі. Полімер виділили осадженням у 40 мл ацетону та відфільтрували через пористий скляний фільтр S4. Після висушування до досягнення постійної ваги зразок зберігали в атмосфері аргону при -18 °С. На другій стадії 320 мг полімеру (0,027 ммоль СООН) розчинили у 1,6 мл DMF. 28,5 мг дициклогексилкарбодііміду (DCC) (0,138 ммоль) та 15,9 мг Nгідроксисукциніміду (0,138 ммоль) розчинили у 0,2 мл DMF та додали до перемішаного розчину співполімеру, охолодженого до 4°С. Реакційну суміш перемішували впродовж 4 годин при 4°С та впродовж 3 годин при кімнатній температурі. Полімер виділили осадженням у 50 мл ацетону та відфільтрували через пористий скляний фільтр S4. Після висушування до досягнення постійної ваги зразок зберігали в атмосфері аргону при -18 °С. 19 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 13: Синтез напівтелехелатного полімерного прекурсора (синтез з агентом передачі ланцюга цистаміном) - Прищеплений полімер 2а – співполімер полі(ГПMA-спів-MA-AH-NHNHBoc)-NH2 Полі(ГПМА-спів-МА-АН-NНNН-Вос)-NН2 напівтелехелатний співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-AH-NHNH-Boc у метанолі при 50 °С у присутності ініціатора АБІН та цистаміну як агента передачі ланцюга. 385 мг (2,69 ммоль) ГПМА, 76 мг (0,36 ммоль) MA-AH-NHNH-Boc, 1,55 мг (0,0095 ммоль) АБІН та 2,8 мг (0,036 ммоль) цистаміну розчинили у 4 мл метанолу та розчин помістили в полімеризаційну ампулу. Розчин у ампулі продували азотом впродовж 10 хвилин, потім ампулу герметизували та помістили у термостат, нагрітий до 50 °С на 24 години. Полімер виділили осадженням у 60 мл суміші ацетону та діетилового етеру (2:1). Співполімер відфільтрували через пористий скляний фільтр S4 та знову осадили з метанолу (3 мл) у 40 мл такої ж суміші для осадження. Полімер відфільтрували через пористий скляний фільтр S4 та висушили до досягнення постійної ваги. Приклад 14: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 2b - співполімер полі(ГПМА-спів-MA-AH-NHNH-Boc)-NH2 Пoлi(ГПMA-cпiв-MA-AH-NHNH-Boc)-NH2 напівтелехелатний співполімер одержували реакцією полімер-аналогічних перетворень полі(ГПМА-спів-MA-AH-NHNH-Boc)-TT співполімеру з етилендіаміном у метанолі. 450 мг пoлi(ГПMA-cпiв-MA-AH-NHNH-Boc)-TT полімеру (0,041 ммоль груп ТТ) розчинили у 6 мл метанолу. 30 мкл EDA (0,45 ммоль) додали до енергійно перемішуваного жовтуватого розчину. Через 30 хвилин знебарвлений розчин осадили у 120 мл суміші ацетону : діетилового етеру 3:1, знову осадили з метанолу у таку ж суміш та відфільтрували. Полімер сушили до досягнення постійної ваги. Приклад 15: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 3a - співполімер пoлi(ГПMA-cпiв-MA-AH-NHNH-Boc)-PDS полі(ГПМА-спів-MA-AH-NHNH-Boc)-PDS напівтелехелатний співполімер одержували реакцією полімер-аналогічних перетворень пoлi(ГПMA-cпiв-MA-AH-NHNH-Boc)-TT співполімеру з біфункціональним агентом PDEA у ДМСО. 10 мг PDEA.HCI (0,045 ммоль) розчинили у 0,5 мл ДМСО та додали 7,3 мкл діізопропілетиламіну (0,045 ммоль) при інтенсивному перемішуванні. Через 5 хвилин до цього розчину при інтенсивному перемішуванні та кімнатній температурі додали розчин 400 мг полі(ГПМА-спів-MA-AH-NHNH-Boc)-TT співполімеру (0,036 ммоль груп ТТ) у 5 мл ДМСО. Через 2 години реакційну суміш розбавили до 15 мл метанолом та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex LH-20 у метанолі (при детекції по індексу рефракції). Полімерну фракцію виділили, концентрували до 6 мл у вакуумному ротаційному випарнику та співполімер виділили шляхом осадження з 80 мл суміші ацетону : діетилового етеру 3:1. Продукт висушили до досягнення постійної ваги. Приклад 16: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 3b - співполімер полi(ГПМА-спів-МА-АН-NНNН-Вос)-РDS полі(ГПМА-спів-MA-AH-NHNH-Boc)-PDS напівтелехелатний співполімер одержували реакцією полімер-аналогічних перетворень полі(ГПМА-спів-MA-AH-NHNH-Boc)-NH2 співполімеру з біфункціональним агентом SPDP у метанолі. 300 мг полі(ГПМА-спів-МА-АН-NНNН-Вос)-NН2 полімеру (0,025 ммоль груп ΝΗΝΗ2) розчинили у 4 мл метанолу та розчин 11 мг SPDP (0,035 ммоль) у 1 мл додали до інтенсивно переміщуваного розчину. Через 2 години реакційну суміш розбавили метанолом до 15 мл та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex LH-20 у метанолі при детекції по індексу рефракції. Полімерну фракцію виділили, концентрували до 8 мл у вакуумному ротаційному випарнику та співполімер виділили шляхом осадження у 100 мл етилацетату. Продукт висушили до досягнення постійної ваги. Приклад 17: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 4а - співполімер полі(ГПМА-спів-МА-АН-NНNН-Вос)-SН Полі(ГПМА-спів-МА-АН-NНNН-Вос)-SН напівтелехелатний співполімер одержували реакцією полімер-аналогічних перетворень (ΓΠΜΑ-спів-ΜΑ-ΑΗ-ΝΗΝΗ-Βοс)-ΝΗ2 співполімеру з ІТН у фосфатному буфері. 250 мг полі(ГПМА-спів-МА-АН-NНNН-Вос)-NH2 (0,021 ммоль груп ΝΗ2) співполімеру розчинили у 5 мл фосфатного буфера (0,05 Μ фосфатного буфера з 0,1 Μ NaCI, pH 7,4). 16 мг ІТН (0,116 ммоль) розчинили у 0,5 мл дистильованої води та цей розчин додали до розчину 20 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 60 співполімеру при інтенсивному перемішуванні та кімнатній температурі. Через 25 хвилин реакційну суміш розбавили до 15 мл дистильованою водою та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. Приклад 18: Синтез напівтелехелатного полімерного прекурсора - Прищеплений полімер 4b - співполімер полi(ГПМА-спів-МА-АН-NНNН-Вос)-SН Полі(ГПМА-спів-МА-АН-NНNН-Вос)-SН напівтелехелатний співполімер одержували відновленням PDS груп полі(ГПМА-спів-МА-АН-NНNН-Вос)-РDS співполімеру за допомогою DTT у дистильованій воді. 300 мг полі(ГПМА-спів-МА-АН-NНNН2)-РDS співполімеру (0,022 ммоль груп PDS) розчинили у 5 мл дистильованої води. 20 мг DTT (0,13 ммоль) розчинили у 1 мл дистильованої води та цей розчин додали до розчину співполімеру при інтенсивному перемішуванні та кімнатній температурі. Через 20 хвилин реакційну суміш розбавили до 15мл дистильованою водою та співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. Приклад 19: Синтез полімерного кон'югата - Кон'югат 1d – співполімер полi(ΓΠΜΑ-спів-ΜΑΑΗ-ΝΗΝΗ2-ΜΑ-ΑΗ-ΝΗΝ=DΟΦ-спів-ΜΑ-GFLG-ΝΗ-)-графт-[(GFLG)-полi(ГПМА-спів-МА-АНNНNН2-спів-МА-АН-NНN=DОХ)] Полi(ГПМА-спів-МА-АН-NНNН2-спів-МА-АН-NНN=DОХ-спів-МА-GFLG-NН-)-графт-[(GFLG)полі(ГПМА-спів-MA-AH-NHNH2-спів-MA-AH-NHN=DOX)] полімерний кон'югат одержували взаємодією аміногруп полі(ГПMA-спів-MA-AH-NHNH-Boc-спів-MA-GFLG-NH2) співполімеру ТТ групами полі(ΓΠΜΑ-спів-MΑ-ΑΗ-ΝΗΝΗ-Βοο)-ΤΤ співполімеру, з наступним захистом гідразидних груп трифтороцтовою кислотою (TFA) та зв'язуванням DOX у метанолі, каталізованим оцтовою кислотою. 180 мг полi(ΓΠΜΑ-спів-ΜΑ-ΑΗ-ΝΗΝΗ-Βοc)-ΤΤ (0,015 ммоль ТТ) розчинили у 3 мл ДМСО та додали при кімнатній температурі до перемішаного розчину 70 мг полі(ГПМА-спів-MA-AHNHNH-Boc-спів-MA-GFLG-NH2) (0,017 ммоль NH2) в 2 мл ДМСО. Через 2,5 години взаємодії при кімнатній температурі розчин осадили у 50 мл суміші етилацетату : діетилового етеру 3 : 1 та відфільтрували через пористий скляний фільтр S4. Прищепний співполімер розчинили у 4 мл метанолу, знову осадили у суміші етилацетату : діетилового етеру, відфільтрували та висушили до досягнення постійної ваги. Коли видалили захисні Вос групи, 220 мг прищепного співполімеру розчинили у 6 мл суміші TFA : триізопропілсілану : води 95 : 2,5 : 2,5. Через 15 хвилин суміш неодноразово випаровували з метанолом (у 5-кратному надлишку) у вакуумному випарнику, застосовуючи вакуум, що створюється водоструминним насосом, доки не утворились кристали. Продукт розчинили у воді та рН водного розчину підвищили до рН = 7-8. Співполімер очистили від низькомолекулярних домішок за допомогою гель-хроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. При зв'язуванні DOX з прищепним співполімером, 200 мг співполімеру розчинили у 2 мл метанолу та розчин налили у термо-регульований елемент, де містилось 20 мг DOX.HCI (0,034 ммоль). Негомогенну суспензію перемішували у темноті при 25 °С та через 1 хвилину додали 100 мкл оцтової кислоти. Суспензія поступово розчинилась та через 23 години проходження реакції полімерний продукт очистили від низькомолекулярних домішок та будь-яких залишків вільної лікарської речовини за допомогою гель-хроматографії на колонці, наповненій Sephadex LH-20 у метанолі. Полімерну фракцію виділили, концентрували до 3 мл у вакуумному ротаційному випарнику та співполімер виділили осадженням у 30 мл етилацетату. Продукт висушили до досягнення постійної ваги. Приклад 20: Синтез полімерного кон'югата - Кон'югат 2 - співполімер полі(ГПМА-спів-МА-АНNНNН2-спів-МА-АН-NНN=DОХ-спів-МА-GFLG-NН-)-графт-[(GFLG)-полi(ГПМА-спів-MA-AHNHNH2-MA-AH-NHN=DOX)] Полі(ΓΠΜΑ-спів-ΜΑ-ΑΗ-ΝΗΝΗ2-спів-ΜΑ-ΑΗ-ΝΗΝ=DΟΦ-спів-ΜΑ-GFLG-ΝΗ-)-графт-[(GFLG)полі(ГПМА-спів-MA-AH-NHNH2-MA-AH-NHN=DOX)] полімерний кон'югат одержували взаємодією ONp груп полі(ГПМА-спів-MA-AH-NHNH-Boc-спів-MA-GFLG-ONp) співполімеру з гідразидними групами полі(ГПМА-спів-МА-АН-NНNН-Вос)-NНNН2 співполімеру, з наступним захистом гідразидних груп трифтороцтовою кислотою(ТFА) та зв'язуванням DOX у метанолі, каталізованим оцтовою кислотою. 250 мг полi(ГПМА-спів-МА-АН-NНNН-Вос)-NНNН2 (0,019 ммоль ТТ) розчинили у 4 мл ДМСО та додали при кімнатній температурі до перемішаного розчину 90 мг полі(ГПМА-спів-MA-AH 21 UA 97812 C2 5 10 15 20 25 30 35 40 45 50 55 NHNH-Boc-спів-MA-GFLG-ONp) (0,021 ммоль NH2) у 2,5 мл ДМСО. Через 3 години взаємодії при кімнатній температурі розчин осадили у 50 мл суміші ацетону : діетилового етеру 3 : 1 та відфільтрували через пористий скляний фільтр S4. Прищепний співполімер розчинили у 5 мл метанолу, знову осадили у суміші етилацетату : діетилового етеру, відфільтрували та висушили до досягнення постійної ваги. Видалення захисних Вос груп, а також зв'язування лікарської речовини з прищепним співполімером, здійснювали аналогічно, які в Прикладі 19. Приклад 21: Синтез полімерного кон'югата - Кон'югат 3a – співполімер полі(ΓΠΜΑ-спів-ΜΑΑΗ-ΝΗΝΗ2-спів-ΜΑ-ΑΗ-ΝΗΝ=DΟΦ-спів-ΜΑ-ΑΗ-SS-)-графт-[(SS)-полi(ГПМА-спів-МА-АН-NНNН2МА-АН-NНN=DОХ)] Полi(ГПМА-спів-МА-АН-NНNН2-спів-МА-АН-NНN=DОХ-спів-МА-АН-SS-)-графт-[(SS)полі(ГПМА-спів-MA-AH-NHNH2-MA-AH-NHN=DOX)] полімерний кон'югат одержували взаємодією PDS груп полi(ГПМА-спів-МА-АН-NНNН2-спів-МА-АН-РDS) співполімеру з сульфгідрильними групами полі(ГПМА-спів-МА-АН-NНNН-Вос)-SН співполімеру, з наступним захистом гідразидних груп трифтороцтовою кислотою(TFА) та зв'язуванням DOX у метанолі, каталізованим оцтовою кислотою. 330 мг полi(ГПМА-спів-МА-АН-NНNН-Вос)-SН (0,021 ммоль груп SH) розчинили у 7 мл фосфатного буфера (0,05 Μ фосфатного буфера з 0,1 Μ NaCI, 0,01 Μ етилендіамінтетраоцтової кислоти (EDTA), рН 7,4) та додали при кімнатній температурі до перемішаного розчину 108 мг полі(ГПМА-спів-MA-AH-NHNH2-спів-MA-AH-PDS) (0,025 ммоль груп PDS) у 2,5 мл такого ж буфера. Через 3 години взаємодії при кімнатній температурі прищепний співполімер очистили від низькомолекулярних домішок за допомогою гельхроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. Видалення захисних Вос груп, а також зв'язування лікарської речовини з прищепним співполімером, здійснювали аналогічно, які в Прикладі 19. Приклад 22: Синтез полімерного кон'югата - Кон'югат 3a - співполімер полi(ΓΠΜΑ-спів-ΜΑΑΗ-ΝΗΝΗ2-спів-ΜΑ-ΑΗ-ΝΗΝ=DОХ-спів-ΜΑ-ΑΗ-SS-)-графт-[(SS)-полі(ГПMA-спів-MA-AH-NHNH2MA-AH-NHN=DOX)] Полі(ΓΠΜΑ-спів-ΜΑ-ΑΗ-ΝΗΝΗ2-спів-ΜΑ-ΑΗ-ΝΗΝ=DОХ-спів-MΑ-ΑΗ-SS-)-графт-[(SS)полі(ГПМА-спів-МА-АН-NНNН2-МА-АН-NНN=DОХ)] полімерний кон'югат одержували взаємодією SH груп полі(ГПМА-спів-МА-АН-NНNH-Вос-спів-МА-АН-SН) з PDS групами полі(ГПМА-спів-МААН-NНNН-Вос)-РDS співполімеру, з наступним захистом гідразидних груп трифтороцтовою кислотою(TFА) та зв'язуванням DOX у метанолі, каталізованим оцтовою кислотою. 280 мг полі(ГПМА-спів-MA-AH-NHNH-Boc)-PDS (0,019 ммоль груп PDS) розчинили у 6 мл фосфатного буфера (0,05 Μ фосфатного буфера з 0,1 Μ NaCI, 0,01 Μ етилендіамінтетраоцтової кислоти (EDTA), рН 7,4) та додали при кімнатній температурі до перемішаного розчину 95 мг полi(ГПМА-спів-МА-АН-NНNН-Вос-спів-МА-АН-SН) (0,024 ммоль груп SH) у 2,5 мл такого ж буфера. Через 3 години взаємодії при кімнатній температурі прищепний співполімер очистили від низькомолекулярних домішок за допомогою гельхроматографії на колонці, наповненій Sephadex G-25 у дистильованій воді при детекції по індексу рефракції. Полімерну фракцію виділили та ліофілізували у ліофілізаторі Lyovac GT-2. Видалення захисних Воc груп, а також зв'язування лікарської речовини з прищепним співполімером, здійснювали аналогічно, як і в Прикладі 19. Приклад 23: Синтез полімерного кон'югата - Кон'югат 5 - співполімер полі(ГПМА-спів-МА-АНNНNН2-спів-МА-АН-NНN=DОХ-спів-МА-GFLG-NН-)-графт-[(GFLG)-полi(ГПМА-спів-MA-AHNHNH2-MA-AH-NHN=DOX)] Полi(ГПМА-спів-МА-АН-NНNН2-спів-МА-АН-NНN=DОХ-спів-МА-GFLG-NН-)-графт-[(GFLG)полі(ГПMA-спів-MA-AH-NHNH2-MA-AH-NHN=DOX)] полімерний кон'югат одержували радикальною співполімеризацією в розчині сполук ГПМА, MA-AH-NHNH2 та полі(ГПМА-спів-MAAH-NHNH-Boc)-GLFG-MA у метанолі при 60 °С. 465 мг (3,25 ммоль) ГПМА, 44,5 мг (0,20 ммоль) MA-AH-NHNH2, 950 мг (0,076 ммоль) полі(ГПМА-спів-MA-AH-NHNH-Boc)-GLFG-MA та 98,3 мг (0,60 ммоль) АБІН розчинили у 9 мл метанолу. Ампулу з розчином полімеризаційної суміші продували азотом протягом 10 хвилин, потім герметизували та помістили у термостат, нагрітий до 60 °С на 24 години. Реакційну суміш потім осадили у 100 мл суміші ацетону : діетилового етеру 3 : 1 та центрифугували. Полімер знову осадили з метанолу у таку ж суміш, відфільтрували через пористий скляний фільтр S4 та висушили до досягнення постійної ваги. Видалення захисних Вос груп, а також зв'язування лікарської речовини з прищепним співполімером, здійснювали аналогічно, як і в Прикладі 19. Приклад 24: Вивільнення доксорубіцину з прищепних полімерних кон'югатів 22 UA 97812 C2 5 10 15 20 25 30 35 40 Було виміряно кількість доксорубіцину, вивільненого з прищепних полімерних кон'югатів після їх інкубування у фосфатному буфері з рН 5,0 (0,1 Μ фосфатного буфера, який містить 0,05 Μ NaCI), що моделює внутрішньоклітинне середовище, та у фосфатному буфері з рН 7,4, що моделює середовище кровотоку. Кількість вивільненого DOX в інкубаційному розчині визначили за допомогою ВЕРХ (Shimadzu). В попередньо визначених інтервалах відібрали 50 мкл інкубаційного розчину та проаналізували на колонці TSKGel G 300хІ, ізократичний потік 0,5 мл/хв рухомої фази включав суміш метанолу:ацетатного буфера рН 6,5 (80 : 20 об. %). Кількість DOX розрахували з площі піків вільного та зв'язаного DOX (UV-VIS визначення при 488 нм). Після інкубування кон'югатів (концентрації 5 мг/мл) у фізіологічному середовищі при 36 °С (фосфатний буфер, рН 7,4), вивільнилась лише невелика кількість лікарської речовини (до 8 %/24 години) (Фігура 33); і навпаки, швидкість вивільнення DOX з прищепних полімерних кон'югатів, та, таким чином, швидкість активації цитотоксичної лікарської речовини, є досить високою у злегка кислому середовищі при рН 5,0 (Фігура 35). Швидкості вивільнення лікарських речовин при рН 7,4 та рН 5 з прищепних полімерних кон'югатів є повністю порівняними з тими, які визначені для гідразонових кон'югатів, одержаних лише з лінійних співполімерів [Etrych patent]. Приклад 25: Розкладання прищепних полімерних кон'югатів глутатіоном або катепсином В на продукти розкладу, здатні видалятись з організму Дослідження на розкладання здійснювали у фосфатному буфері (0,1 Μ фосфатного буфера, який містить 0,05 Μ NaCI, pH 6) у присутності катепсину В або глутатіону у ролі агентів розкладання, тобто у середовищі, яке моделює внутрішньоклітинне середовище (цитоплазму, ендосому та вторинну лізосому). Прищепні полімерні кон'югати розчинили у фосфатному буфері у концентрації 50 мг/мл та безпосередньо перед тим, як розчин помістили у термостат (37° С), маточний розчин катепсину В або глутатіону додали до розчинів так, що кінцева -7 -3 концентрація цих агентів в інкубаційному середовищі складала 5-10 моль/л та 3-10 моль/л для катепсину та глутатіону відповідно. В попередньо визначених інтервалах відібрали аліквотні частини (200 мкл) з інкубаційних розчинів. Зразки знесолили на колонці PD-10 та ліофілізували. Молекулярну вагу продуктів розкладу виміряли із застосуванням рідинного хроматографа Shimadzu SIL-HT, обладнаним диференційним рефрактометром (Shimadzu RID-10A) та багатокутовим детектором дисперсії світла (DAWN EOS, Wyatt Technology, USA). Аналіз здійснювали на колонці Superose™6 (300 × 10 мм) (Amersham Bioscience). Як рухому фазу застосували 0,3 Μ ацетатного буфера (CH3COONa/CH3COOH; pH = 6,5; 0,5 г/л NaN3) з витратою 0,5 мл/хв. Молекулярну вагу та полідисперсність співполімеру розрахували із застосуванням програмного забезпечення Astra. (Wyatt Technology, USA). Кон'югати, які містять GlyPheLeuGly послідовності, розщеплювані під дією ферментів (Кон'югат 1d), розклались протягом 24 годин за допомогою катепсину В до продуктів розкладу, молекулярна вага яких була нижча межі ренальної фільтрації (Фіг. 37). У розчині, який містив -3 глутатіон (3-10 моль/л), виявилось швидке розкладання прищепних кон'югатів, які містять дисульфідні містки. Ці прищепні кон'югати розклались через 24 години на полімерні продукти розкладу з молекулярною вагою, яка нижча межі ренальної фільтрації (~25,000 г/моль). Приклад 26. Приклад біологічної активності in vitro прищепних кон'югатів доксорубіцину під час інкубування з клітинами різних ліній пухлин Таблиця 1 Цитотоксичність прищепних полімерів порівняно з Гідразоном Зразок Структура: No.: В-578 Р-Acap-Dox (Гідразон) В-624 В-599 В-613 EL4
ДивитисяДодаткова інформація
Назва патенту англійськоюA polymeric drug, in which a cancerostatic connected via spacers containing hydrolytically cleavable hydrazone bonds
Автори англійськоюEtrych Tomas, Chytil, Petr, Ulbrich Karel, Mrkvan, Tomas, Rihova Blanka
Назва патенту російськоюПрививочные макромолекулярные конъюгаты доксорубицина с противоопухолевой активностью и способ их получения
Автори російськоюЭтрих Томас, Хитил Петр, Ульбрих Карел, Мркван Томаш, Ригова Бланка
МПК / Мітки
МПК: A61P 35/00, A61K 31/78, A61K 47/48, A61K 31/704
Мітки: одержання, активністю, доксорубіцину, кон'югати, спосіб, прищепні, протипухлинною, макромолекулярні
Код посилання
<a href="https://ua.patents.su/33-97812-prishhepni-makromolekulyarni-konyugati-doksorubicinu-z-protipukhlinnoyu-aktivnistyu-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Прищепні макромолекулярні кон’югати доксорубіцину з протипухлинною активністю та спосіб їх одержання</a>
Попередній патент: Спосіб моделювання заготовок великогабаритних деталей
Наступний патент: Фумаратна сіль (альфа s, бета r)-6-бром-альфа-[2-(диметиламіно)етил]-2-метоксі-альфа-1-нафталеніл-бета-феніл-3-хінолінетанолу
Випадковий патент: Пристрій для спалювання газоподібного й/або твердого пилоподібного палива