Поліпептид ace2
Номер патенту: 106869
Опубліковано: 27.10.2014
Автори: Пеболл Бернгард, Вейк Роберт, Шустер Манфред, Штраннер Штефан, Янзек-Гавлат Евелін, Ваґнер Беттіна, Лойбнер Ганс
Формула / Реферат
1. Рекомбінантний, глікозилований, розчинний людський димерний поліпептид АСЕ2, де димер АСЕ2 включає дві мономерні одиниці АСЕ2, які є зв’язаними за допомогою нековалентного зв’язку, причому поліпептидний ланцюг АСЕ2 складається з амінокислот 18-740 послідовності SЕQ ІD NО: 1 або включає послідовність SЕQ ІD NО: 1 або їх ферментативно активні фрагменти.
2. Рекомбінантний поліпептид АСЕ2 за п. 1, що є присутнім у формі гомодимеру.
3. Рекомбінантний поліпептид АСЕ2 за п. 1 або пунктом 2, де димер містить два іони цинку.
4. Рекомбінантний поліпептид АСЕ2 за будь-яким зпп. 1-3, де АСЕ2 поліпептид не має трансмембранних доменів.
5. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-4, який відрізняється тим, що є глікозилованим, де глікольні групи мономера поліпептиду АСЕ2 містять сумарно принаймні 14 залишків сіалової кислоти.
6. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-5, який відрізняється тим, що він є глікозилованим у принаймні 80% з можливих сайтів N-глікозилування та має частку цукру більше ніж 10 % (мас. % відносно цілої молекули АСЕ2), переважно більше ніж 15 %, особливо переважно більше ніж 20 %.
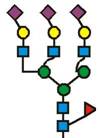
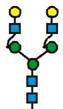
7. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-6, який відрізняється тим, що принаймні 70 % глікозилованих сайтів N-глікозилування мають структуру, незалежно один від одного, вибрану з формул 1-8:
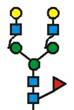
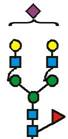
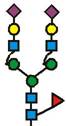
(формула 1),
(формула 2),
(формула 3),
(формула 4),
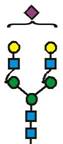
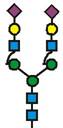
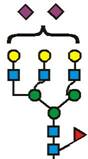
(формула 5),
(формула 6),
(формула 7),
(формула 8),
де:

8. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-7, який відрізняється тим, що усі можливі сайти N-глікозилування є глікозилованими.
9. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-8, який відрізняється тим, що одна мономерна одиниця димеру АСЕ2 має молекулярну масу принаймні 90 кДа, переважно принаймні 92 кДа, особливо переважно принаймні 94 кДа, особливо переважно принаймні 96 кДа, ще більш переважно принаймні 98 кДа та найбільш переважно принаймні 101 кДа.
10. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-9, який відрізняється тим, що серин, який відповідає Sеr740 SЕQ ІD NО: 1, є О-глікозилованим.
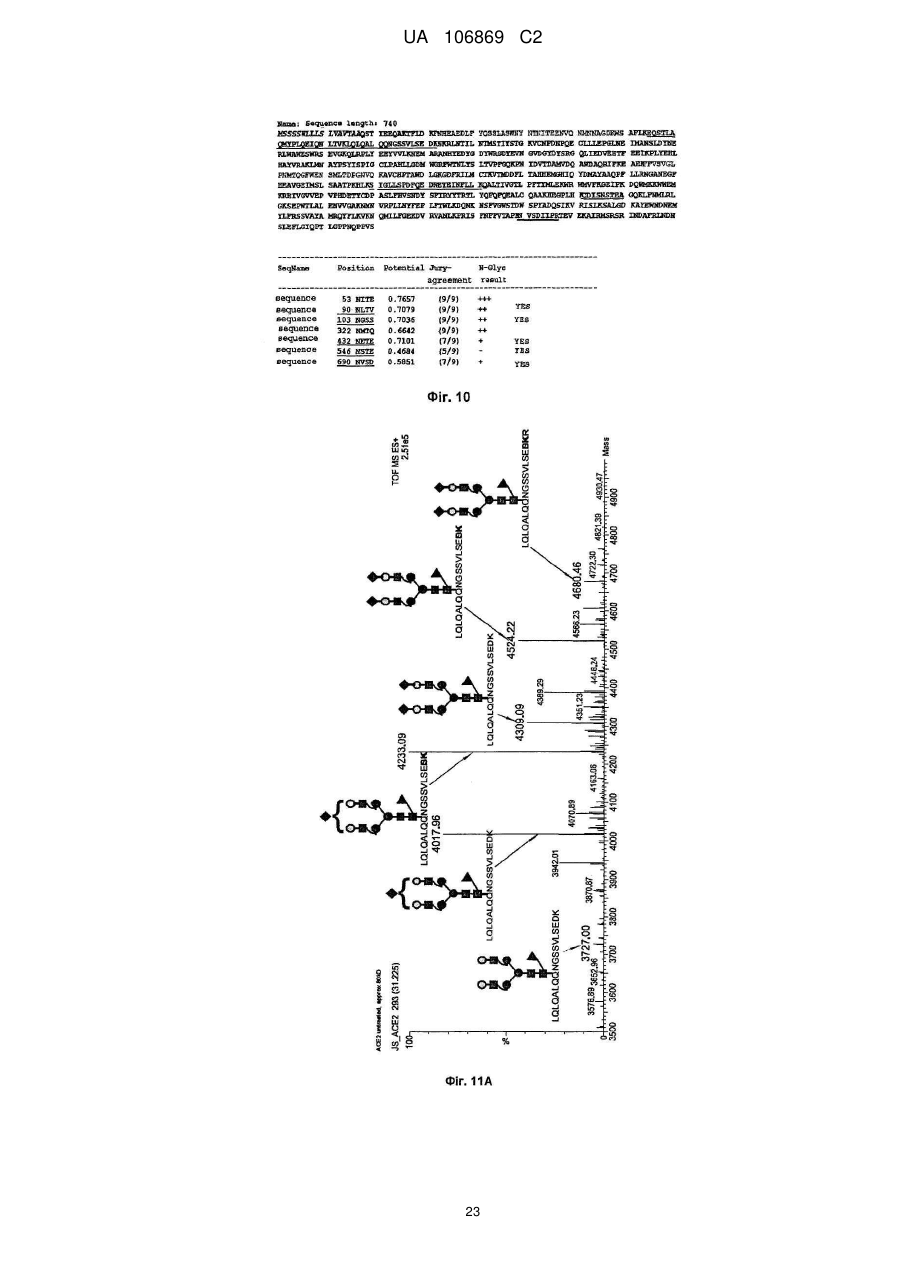
11. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-10, який відрізняється тим, що принаймні 70 %, переважно принаймні 80 %, особливо принаймні 90 %, найбільш переважно 100 % глікозилованих сайтів N-глікозилування містять сіалові кислоти, та переважно сайти N-глікозилування, що відповідають Аsn53, Аsn90, Аsn103, Аsn322, Аsn432, Аsn546, Аsn690 SЕQ ІD NО: 1, є сіалізованими.
12. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-11, який відрізняється тим, що принаймні 30 %, переважно принаймні 40 %, особливо принаймні 55 %, найбільш переважно принаймні 70 % глікозилованих сайтів N-глікозилування містять принаймні дві сіалові кислоти.
13. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-12, який відрізняється тим, що один аспарагін, вибраний з групи, яка відповідає Asn53, Asn90, Asn103, Asn322, Asn432, Asn546 та Asn690 SЕQ ІD NО: 1, є N-глікозилованим, переважно за допомогою глікану зі структурою у відповідності із формулою 1, 2, 3, 4, 5, 6, 7 або 8, як визначено у п. 7.
14. Препарат, що містить рекомбінантні, глікозиловані, розчинні людські димерні поліпептиди АСЕ2 за будь-яким з пп. 1-13, який відрізняється тим, що фракція АСЕ2 поліпептидів з молекулярною вагою менше 119 кДа, як визначено за допомогою гель-електрфорезу, складає менше 20%.
15. Препарат за п. 14, який відрізняється тим, що фракція АСЕ2 поліпептидів з трансмембранними доменами складає менше ніж 20 %, переважно менше ніж 10 %, особливо переважно менше ніж 5 %, найбільш переважно менше ніж 1 % та, зокрема, 0 %.
16. Препарат за п. 14 або за п. 15, який відрізняється тим, що фракція АСЕ2 мультимерів складає менше ніж 20 %.
17. Препарат за п. 16, який відрізняється тим, що фракція АСЕ2 мультимерів складає менше ніж 5%, найбільш переважно менше ніж 1%.
18. Препарат за будь-яким з пп. 14-17, який відрізняється тим, що частка АСЕ2 димерів молекул АСЕ2 складає принаймні 70%, переважно принаймні 80%, особливо переважно принаймні 90%, дуже переважно принаймні 95% та найбільш переважно принаймні 99%.
19. Препарат за будь-яким з пп. 14-18, який відрізняється тим, що фракція АСЕ2 поліпептидів з N-глікозилованим аспарагіном, вибраним з групи, яка відповідає Asn53, Asn90, Asn103, Asn322, Asn432, Asn546 та Asn690 SЕQ ІD NО: 1, складає більше 60%, переважно більше 70%, особливо переважно більше 80%, дуже переважно більше 90%, найбільш переважно 99%, зокрема 100%, та переважно з гліканом, який має структуру у відповідності з формулою 1, 2, 3, 4, 5, 6, 7 або 8, як визначено у п. 7.
20. Препарат за будь-яким з пп. 14-19, який відрізняється тим, що фракція АСЕ2 поліпептидів з N-глікозилованим серином, що відповідає Ser740 послідовності SEQ ID NO: 1, складає більше 60%, переважно більше 70%, особливо переважно більше 80%, дуже переважно більше 90%, найбільш переважно 99%, зокрема 100%.
21. Препарат за будь-яким з пп. 14-20, який відрізняється тим, що частка АСЕ2 мономерів складає менше 20%, переважно менше 10%, переважно менше 5%, найбільш переважно менше 1% присутніх молекул АСЕ2.
22. Рекомбінантний, глікозилований, розчинний людський димерний поліпептид АСЕ2 або препарат за будь-яким з пунктів 1-21 з каталітичною активністю ссаt принаймні 4 с-1, переважно принаймні 5 с-1, особливо переважно принаймні 6 с-1, більш переважно принаймні 7 с-1, найбільш переважно принаймні 7,6 с-1 стосовно перетворення Аng ІІ (ангіотензин ІІ) у Аng 1-7 (ангіотензин 1-7).
23. Лікарський засіб, який включає рекомбінантний, димерний поліпептид АСЕ2, як визначено у будь-якому з пунктів 1-13 або 22, або препарат, як визначено у будь-якому з пунктів 14-22.
Текст
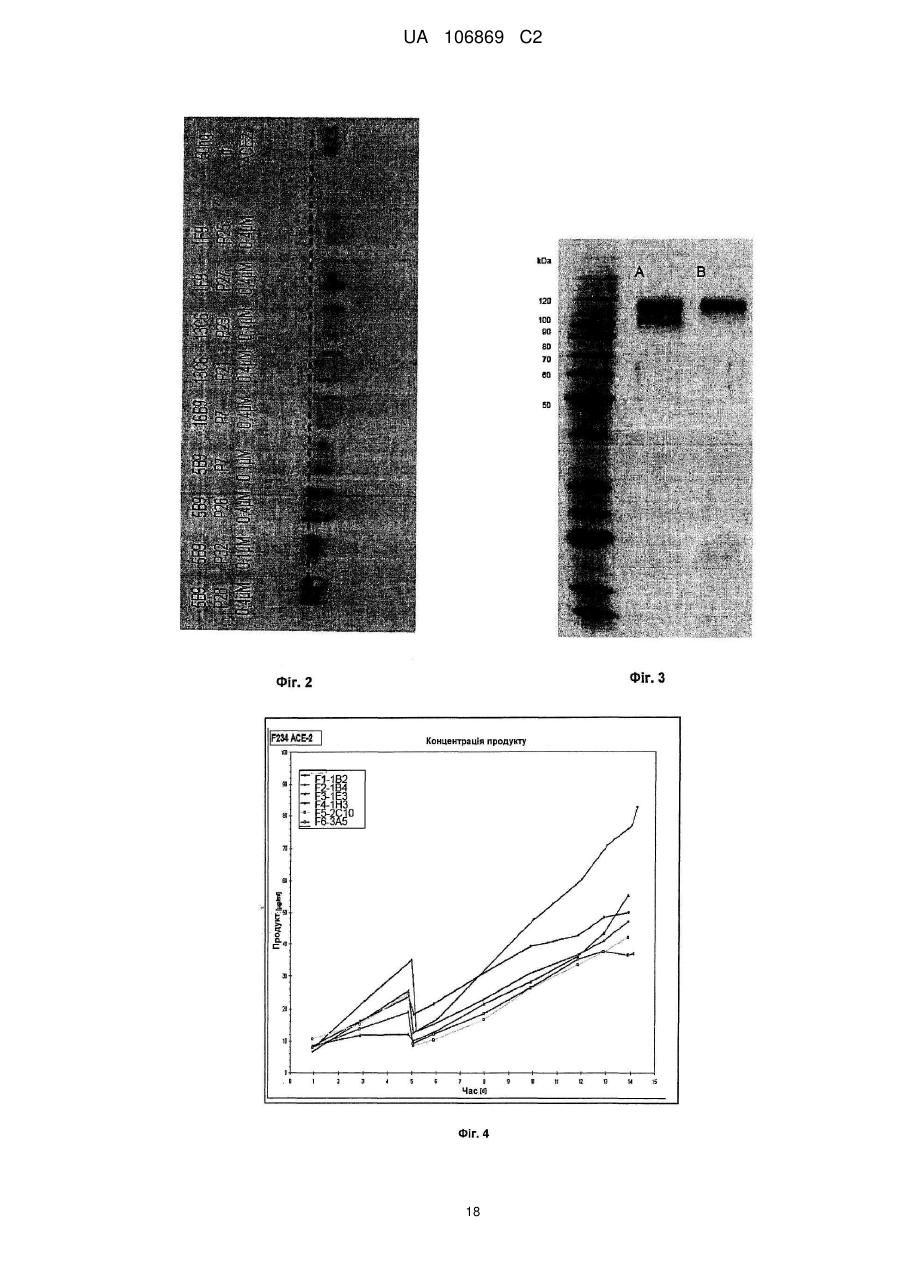
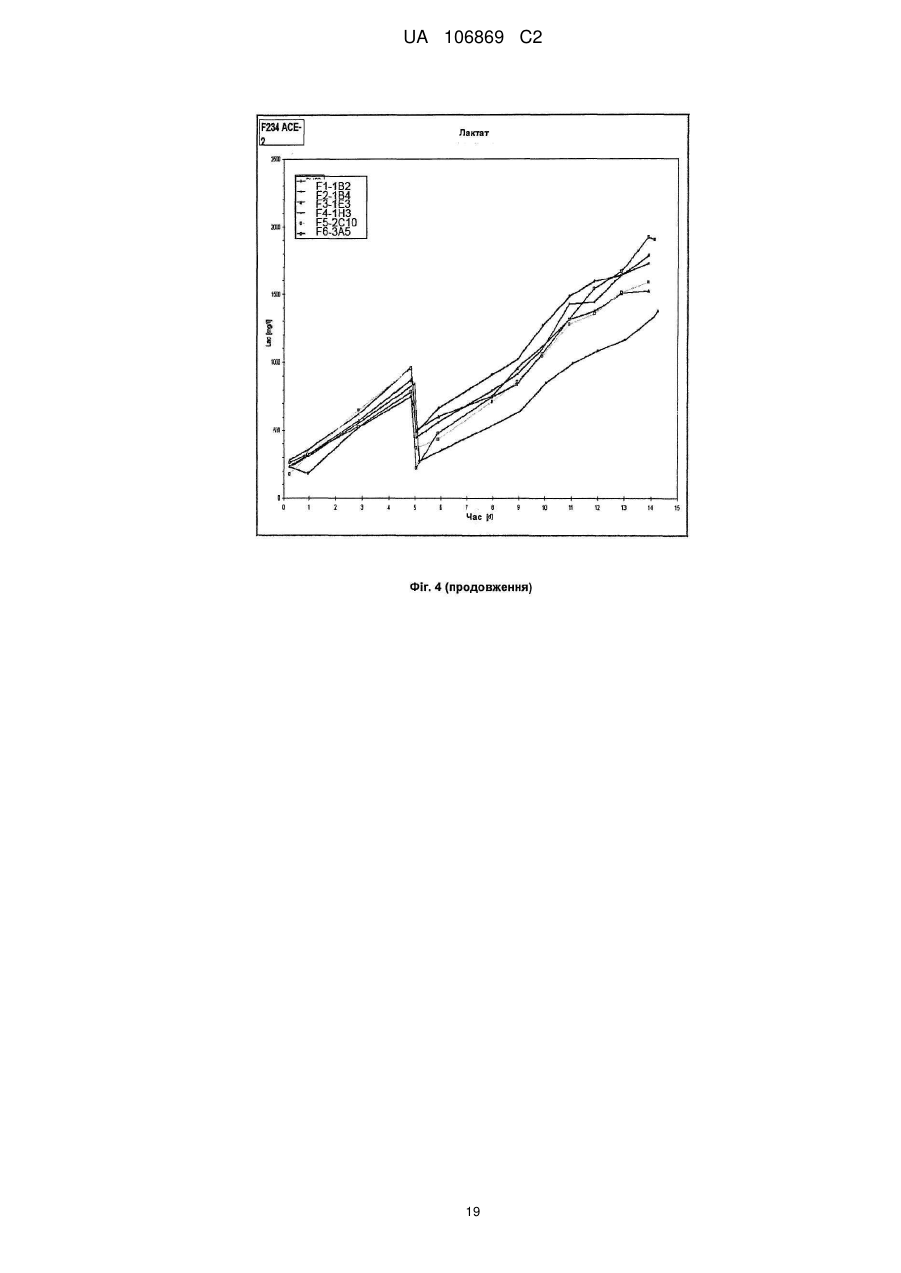
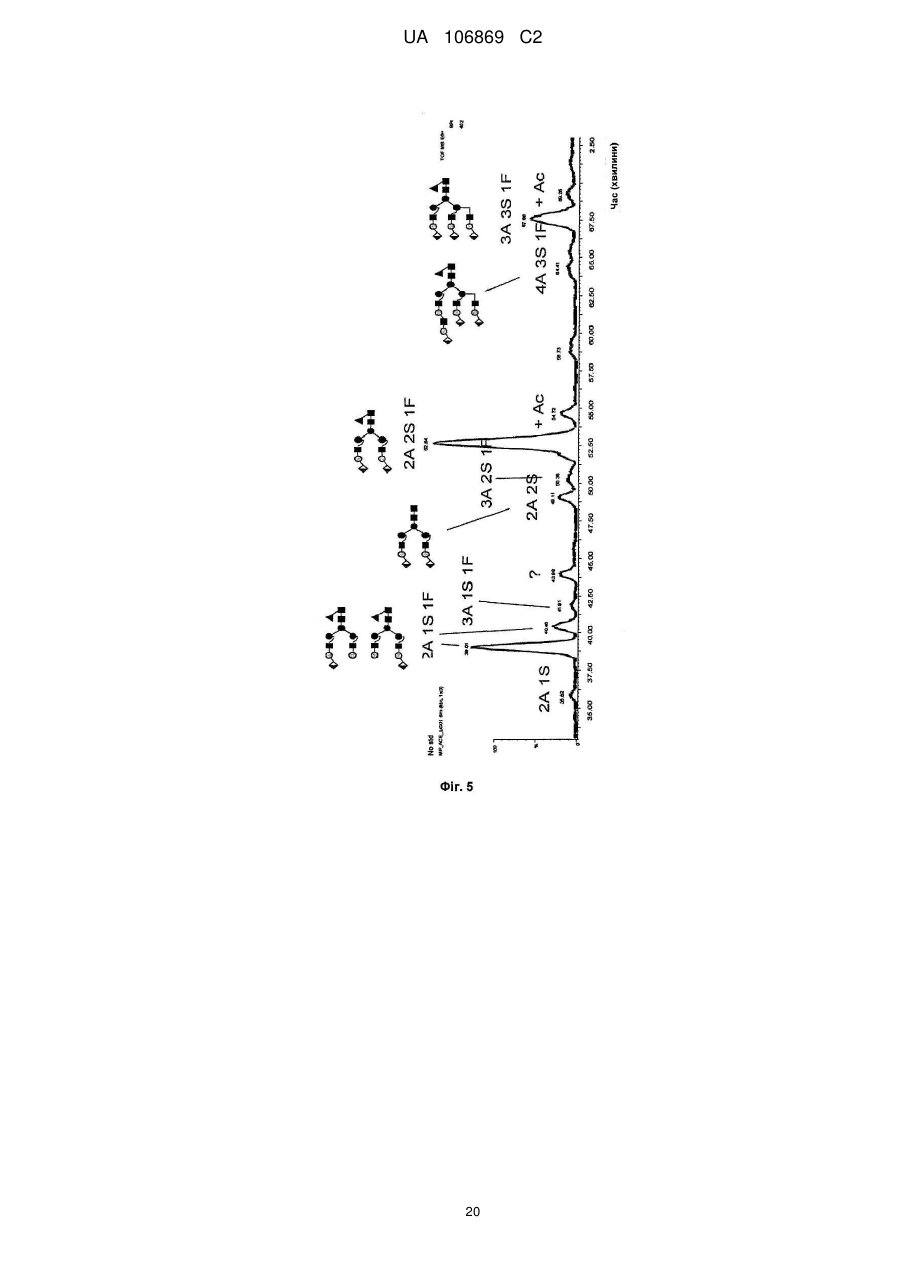
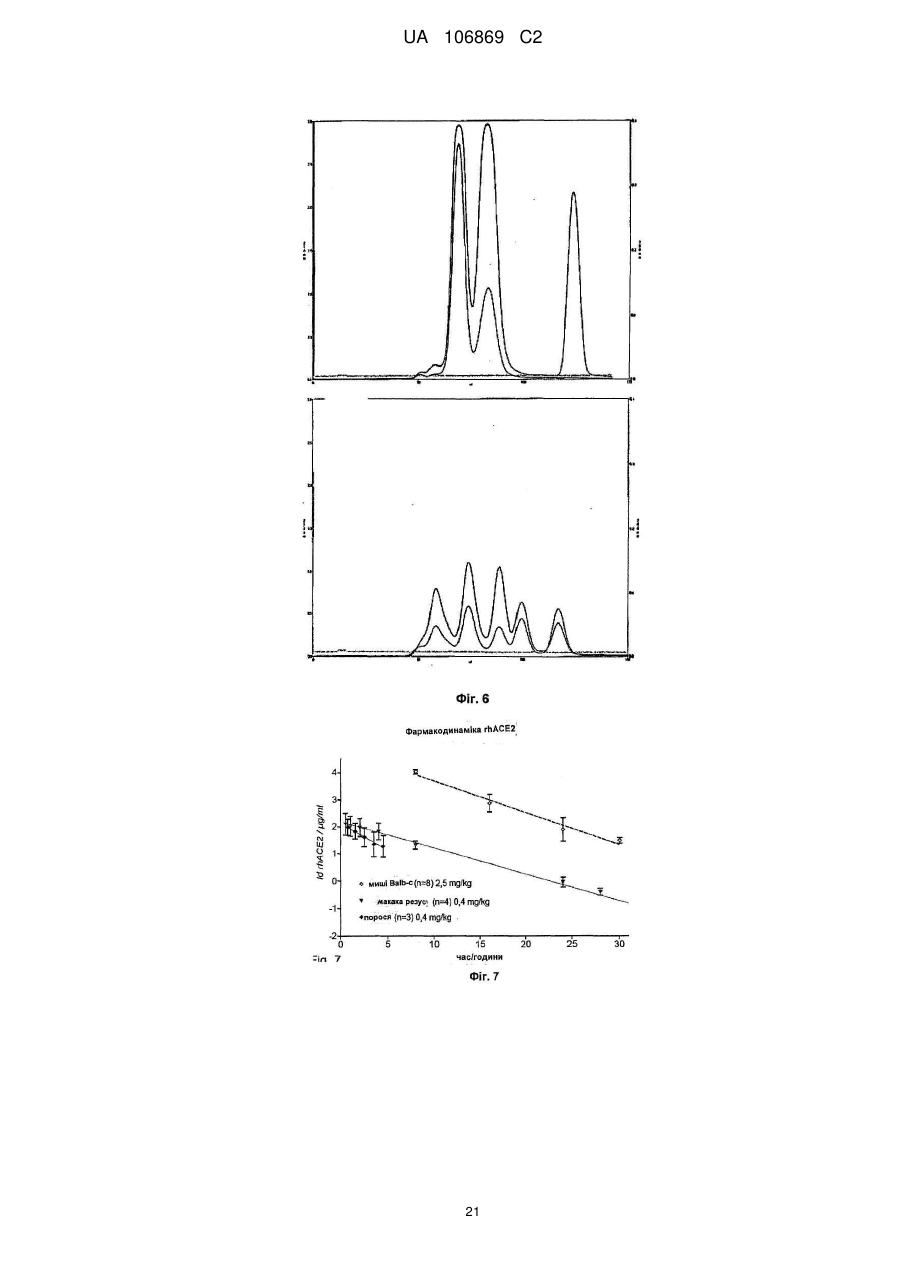
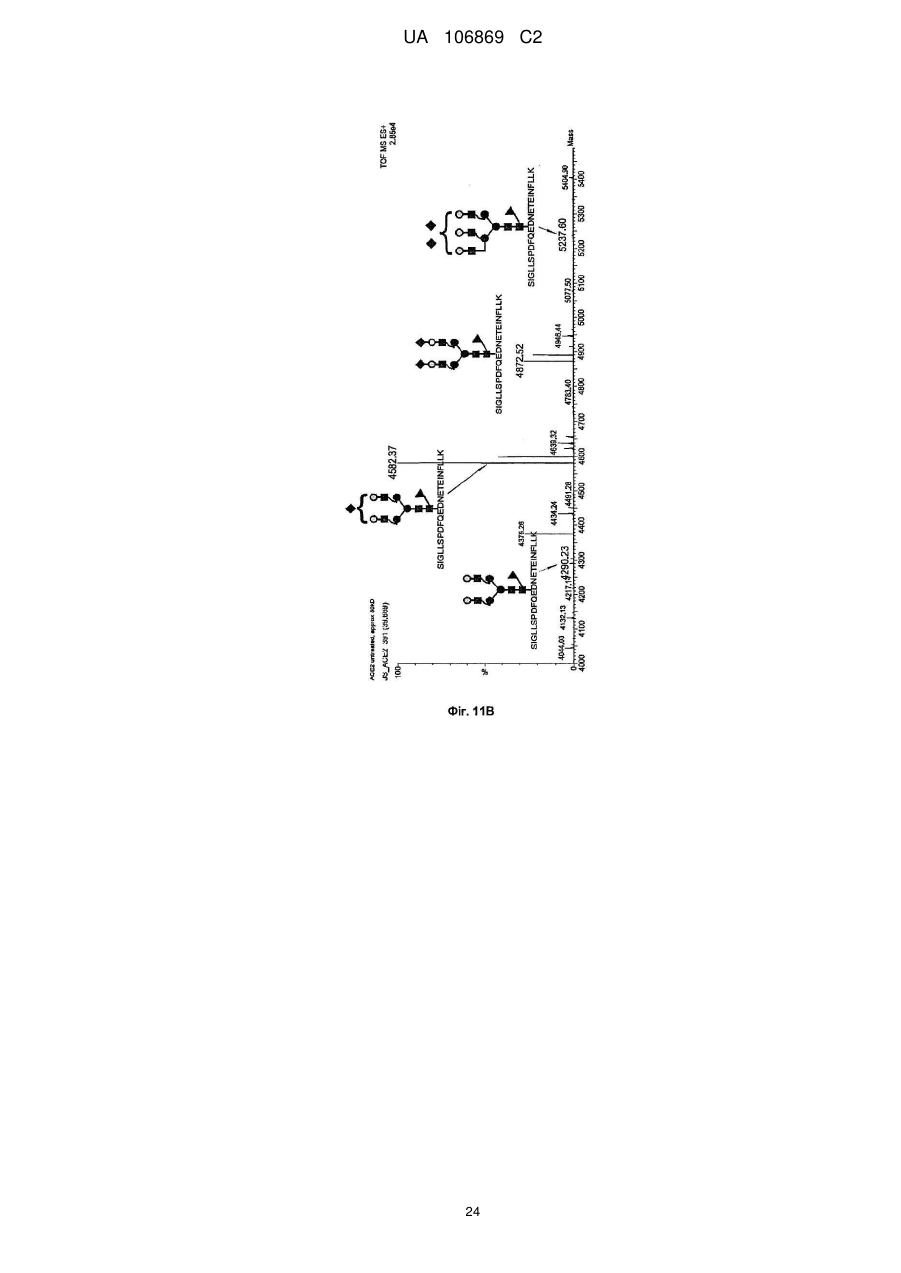
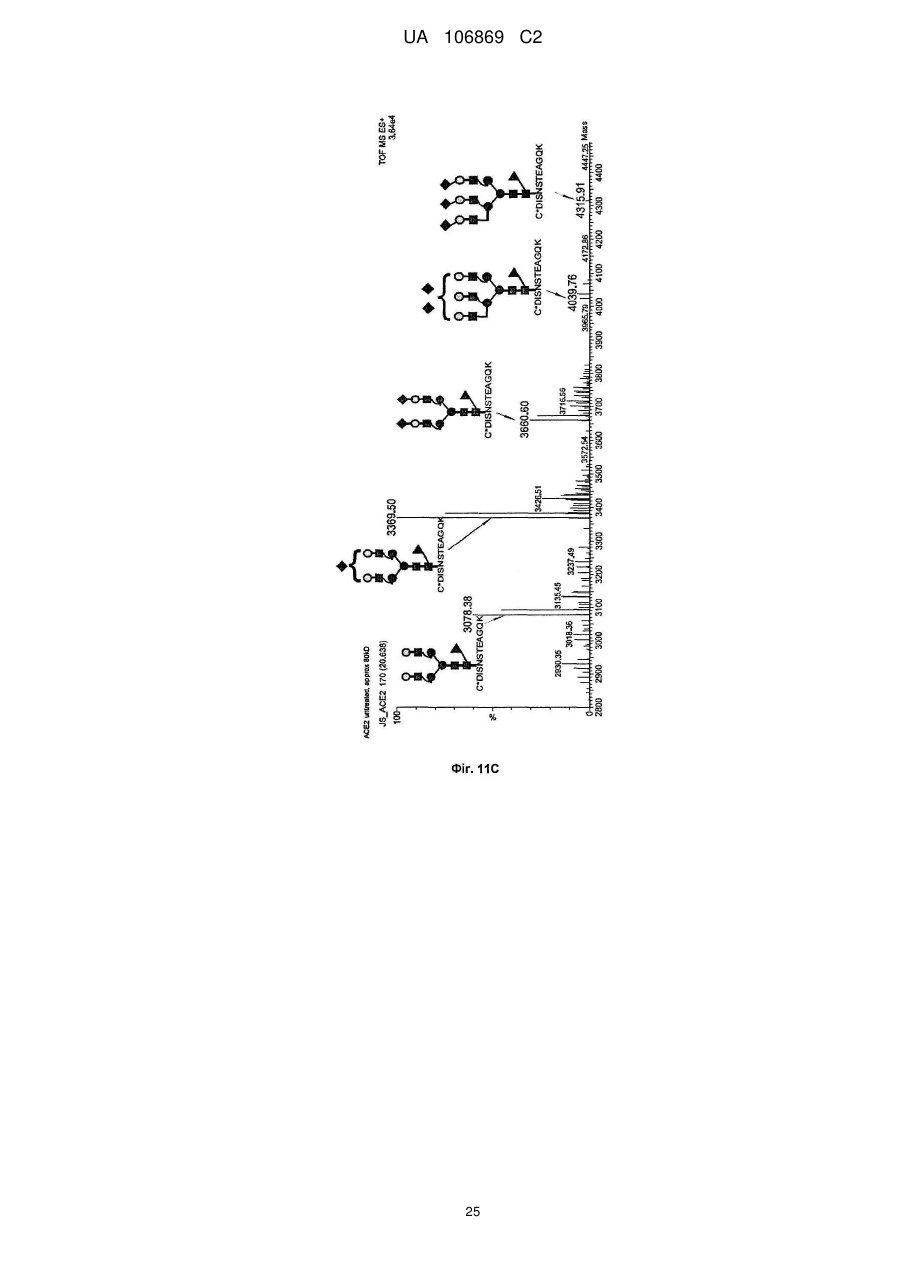
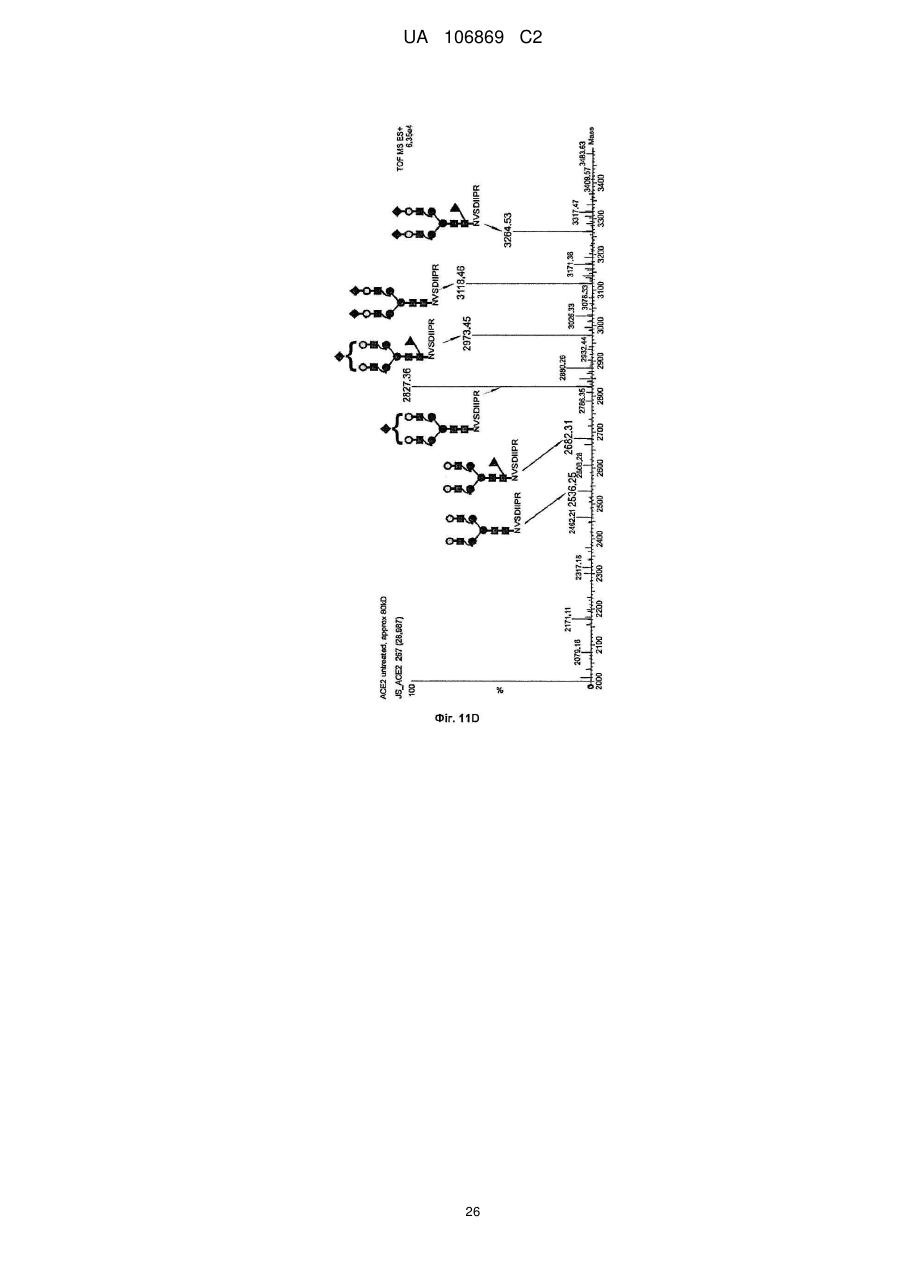
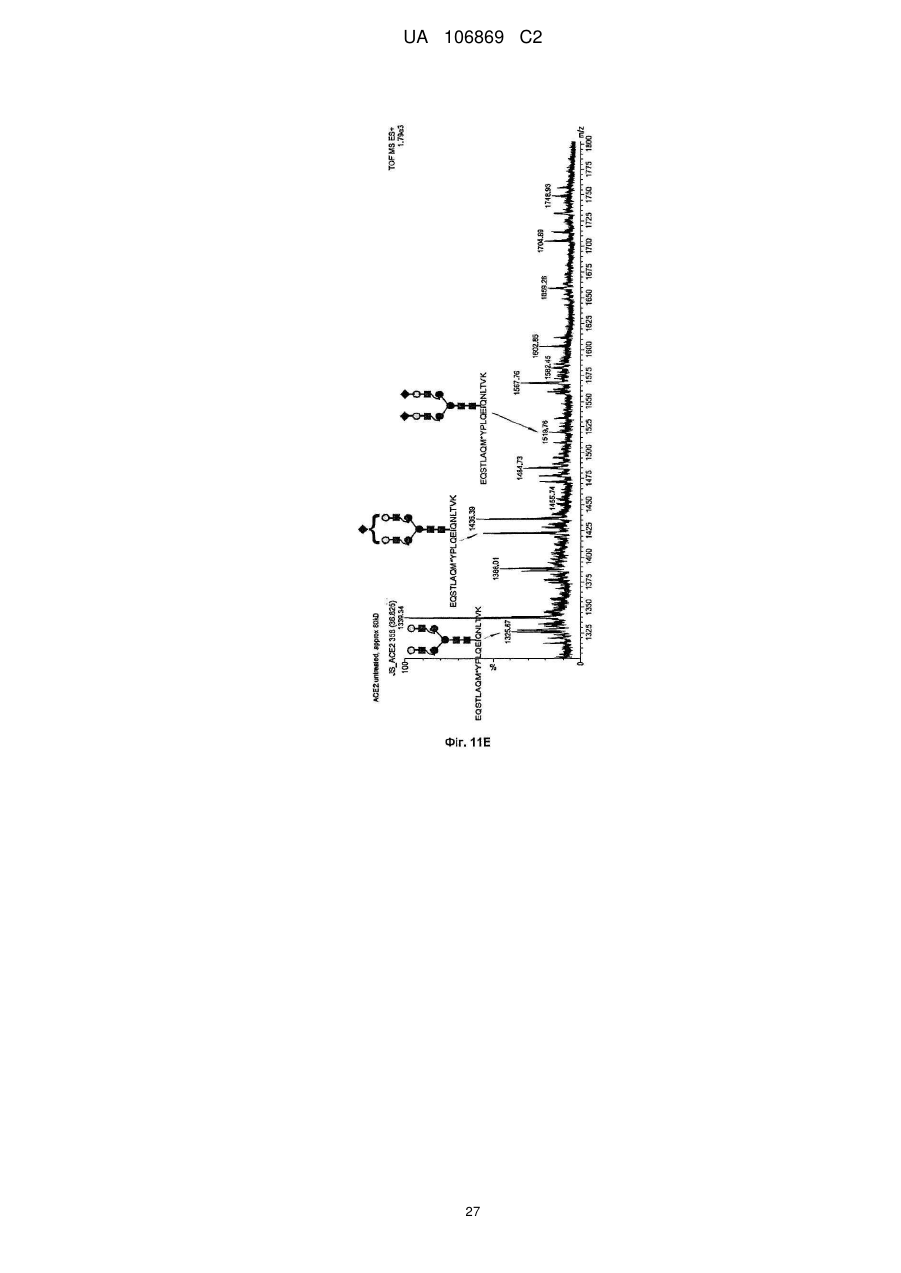
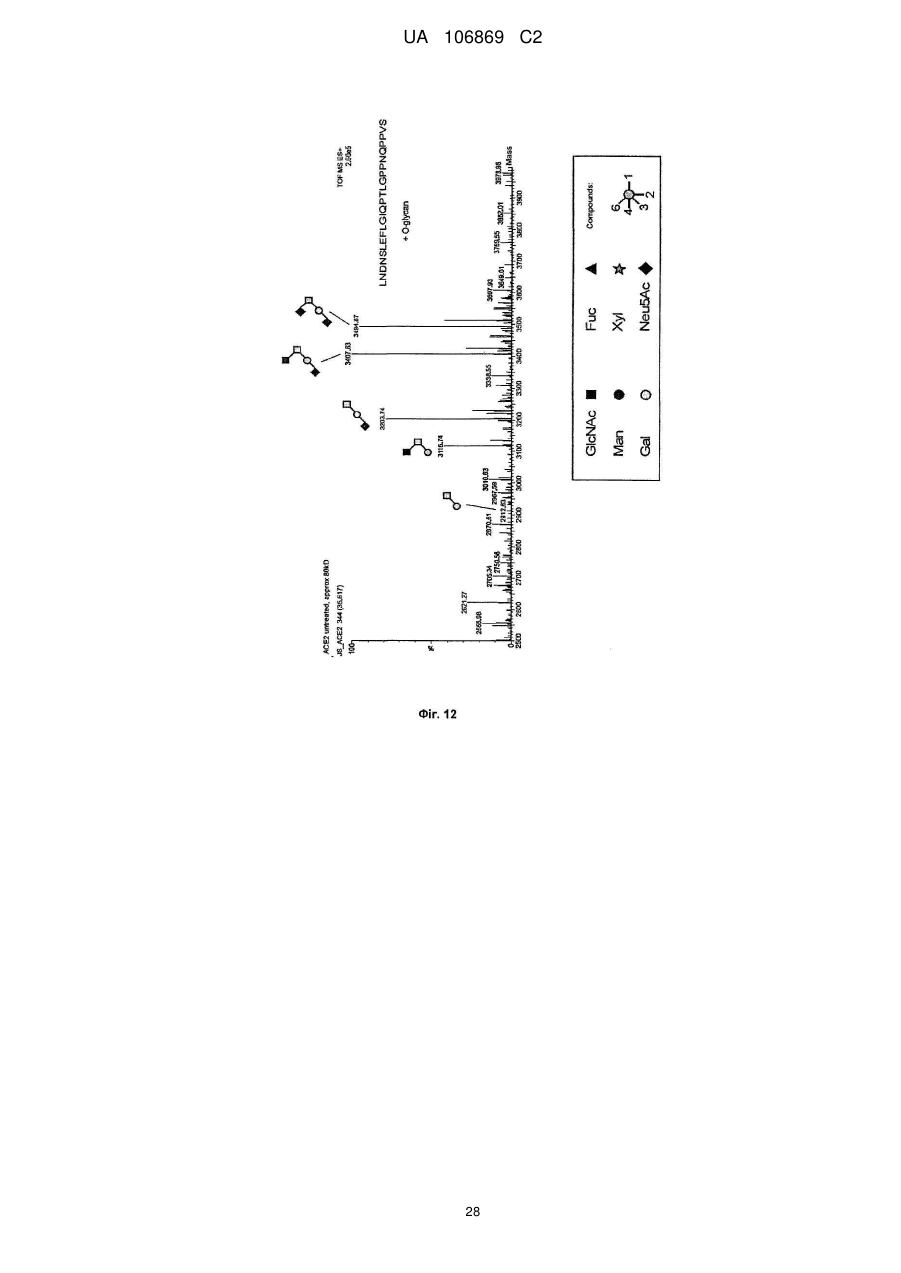
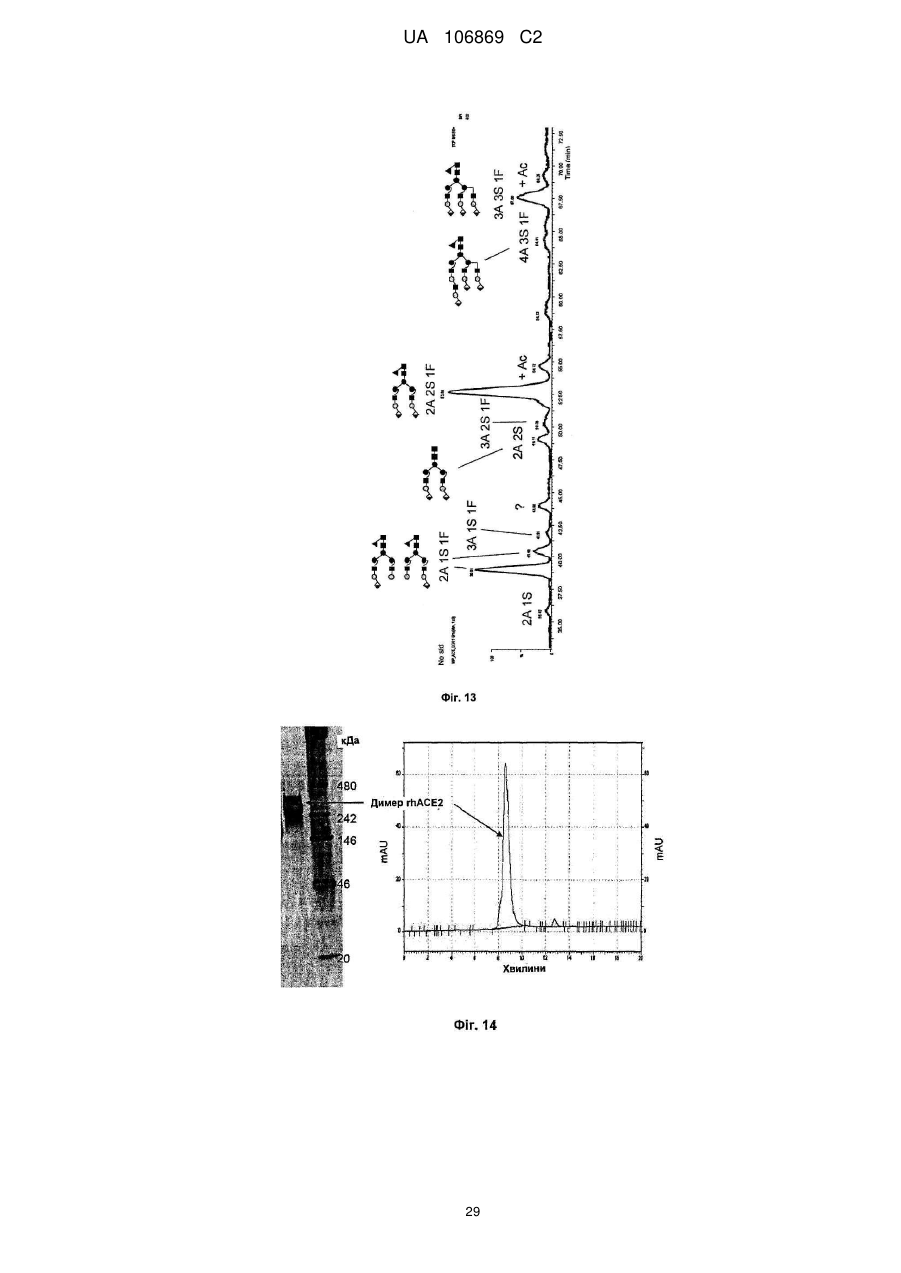
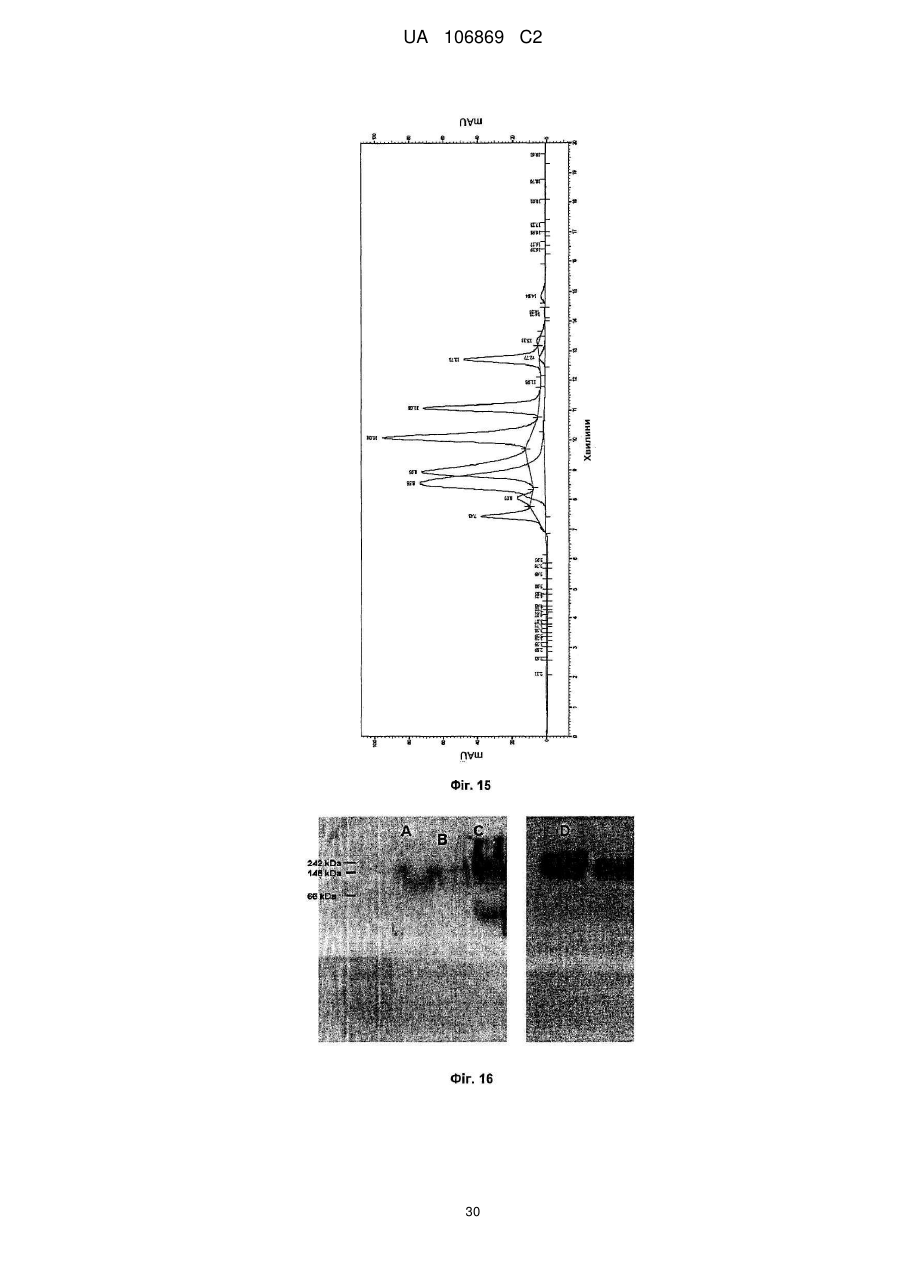
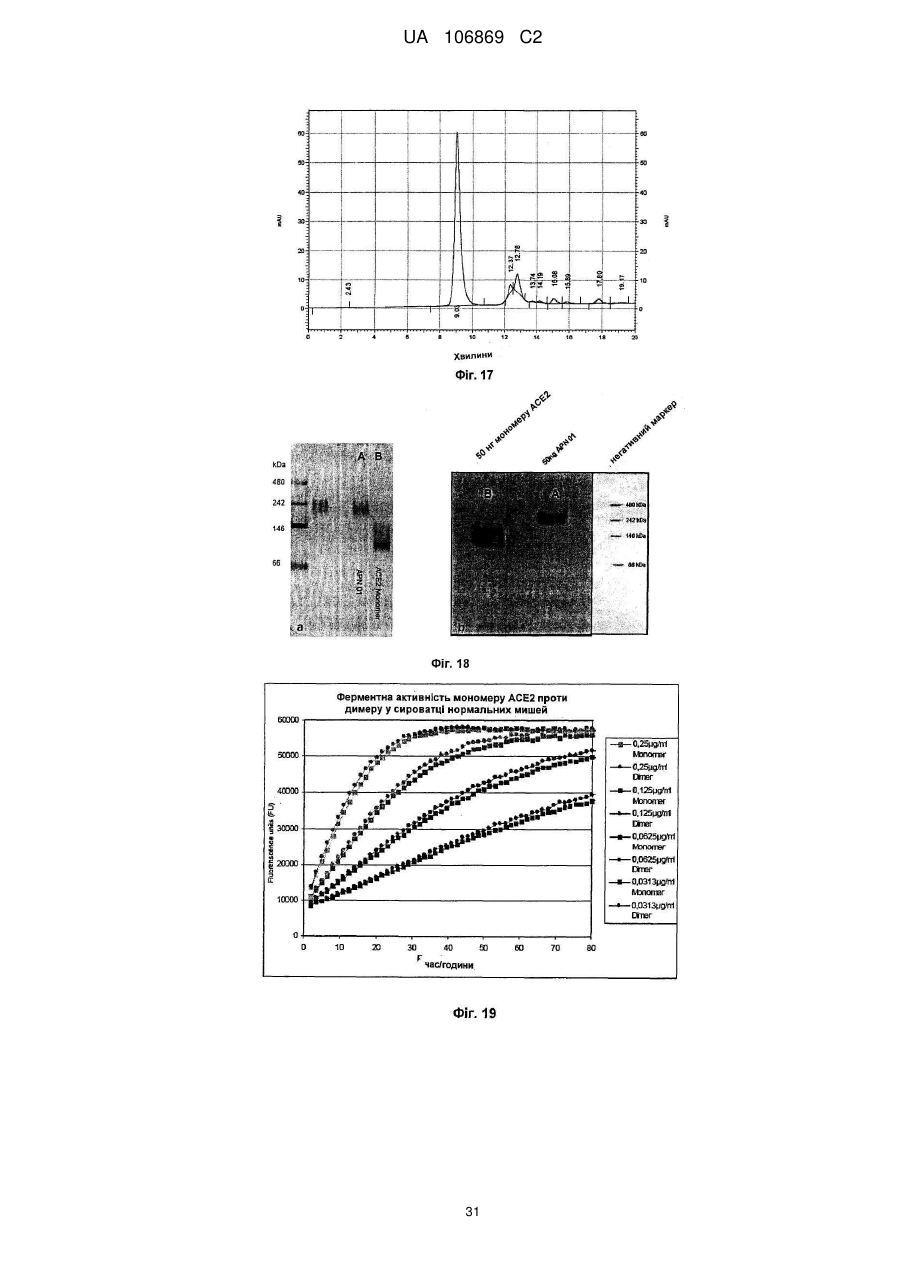
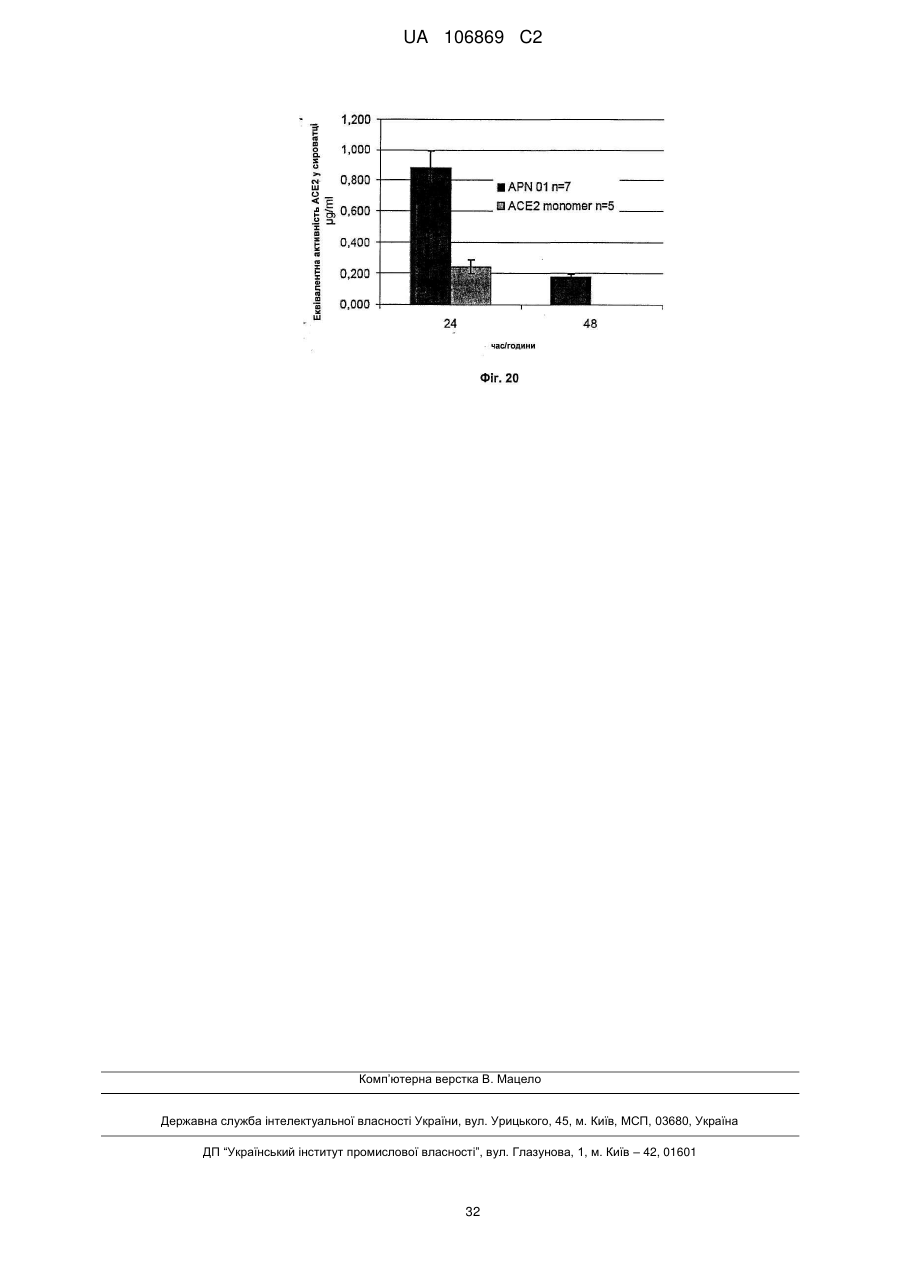
Реферат: Винахід належить до вироблення рекомбінантного, глікозилованого, розчинного людського димерного поліпептиду АСЕ2, де димер АСЕ2 включає дві мономерні одиниці АСЕ2, зв'язані за допомогою нековалентного зв'язку, причому поліпептидний ланцюг АСЕ2 включає послідовність SЕQ ІD NО: 1 або її ферментативно активні фрагменти. Димер використовують для вироблення фармацевтичних продуктів з подовженим періодом напівперетворення. UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується вироблення рекомбінантного білку. Фермент перетворення ангіотензину (АСЕ2) є ключовим ферментом у системі ренінангіотензин. Він є закріпленим на мембрані як карбоксипептидаза, та експресованим як рецептор перед усім у клітинах легень, нирок та серця, але також на ендотеліальних клітинах, та розщеплює різні пептидні субстрати. Відомими представниками субстратів є ангіотензин ІІ (Аng ІІ), що розщеплюється до ангіотензину 1-7 (Аng 1-7), ангіотензин І, що розщеплюється до ангіотензину 1-9, та також апелін та брадикінін. Аng ІІ та Аng 1-7 є антагоністами системи ренінангіотензин. Контролюванням пептидного співвідношення, АСЕ2 відповідає за регулювання щільності судин та за ендотеліальну проникність, таким чином впливаючи на гомеостаз організму. Експресія АСЕ2 є зитокін-контрольованою, серед іншого, та є зменшеною при різних запальних хворобах, що згодом призводить до патологічного збагачення Аng ІІ, одного з найбільш важливих субстратів для АСЕ2. АСЕ2 застосовують для лікування АRDS або АLІ, двох форм гострої хвороби легень, що є асоційованою з даун-регульованою експресією АСЕ2 у легенях. Ця терапія застосовує рекомбінантний розчинний АСЕ2 людини, що застосовують системно, він є дуже швидко доступним до організму для зменшення підвищеної концентрації Аng ІІ та тому вироблення Аng 1-7. Це компенсує негативну дію збільшеної концентрації Аng ІІ. У цьому випадку може бути бажаним мати доступний продукт, що має придатний фармакологічний профіль: відповідно, придатну речовину можна охарактеризувати гарним розподілом в організмі, фармакологічно корисним періодом напівперетворення, а також низькою імуногенністю. Зокрема, продукт повинен бути ферментно активним, мати гарну розчинність та також бути стабільним у розчині та бути відтворюваним та економічним і вироблятися з високою чистотою. Тірnіs еt аl (J Віоl Сhеm 275, (43) (2000): 33238-43) описує виділення АСЕ2 (позначений як АСЕН) та виділення його кДНК. Виробленням у клітинах СНО глікозилований білковий мономер було вироблено із молекулярною масою 120 кДа. Після деглікозилування, маса білку була 85 кДа. Dоnоghuе (Сіrс Rеs 87, (5) (2000): 1-9) описує експресію розчинного АСЕ2 у клітинах СНО; він не був повністю глікозилованим та був охарактеризованим молекулярною масою приблизно 90 кДа. Крім того, цей документ стосується порівнянь послідовностей різних послідовностей АСЕ2 та анти-АСЕ2 антитіла. WО 2004/023270 А2 описує кристалізацію АСЕ2 після експресії мономерів АСЕ2 у клітинах комах Sf9. Молекулярна маса білку була 89,6 кДа після аналізу мас-спектрометрією. Терапевтична дія ефективної фермент-заміщувальної терапії потребує способу вироблення, що може виробляти економічно та відтворювано дуже чистий фармакологічно ефективний продукт. Розчинна екстрацелюлярна фракція АСЕ2 містить ділянки 7 N-глікозилування. Неглікозилований АСЕ2 має низьку розчинність, тенденцію проти агрегації, є більш імуногенним та має скорочений період напівперетворення. На додаток, він має менший гідродинамічний діаметр, що перед усім має шкідливий вплив на очистку. Тому, одна мета заявленого винаходу є забезпечення дуже активного АСЕ2 з гарним іn vіvо періодом напівперетворення. Цієї мети досягають як заявлено у формулі винаходу. Заявлений винахід стосується рекомбінантного поліпептиду АСЕ2, що є присутнім як димер. Переважно, рекомбінантний поліпептид АСЕ2 є глікозилованим, де глікозил-групи мономеру поліпептиду АСЕ2 є загалом з принаймні 10, 11, 12, 13, 14, 15 або принаймні 16 залишків сіалової кислоти, переважно принаймні 14 залишків сіалової кислоти, де поліпептид АСЕ2 є димером. Заявлений винахід також стосується мономеру АСЕ2 із глікозилуваннями, молекулярними масами, визначеними тут. Димер є переважно гомо-димером; зокрема, його мономерні ланки мають ідентичну послідовність та глікозилування. Загалом, мономерні ланки димеру є нековалентно зв'язаними. Мономер може бути отриманим безпосередньо з димеру або денатурацією. Усі кращі глікозилування, описані тут, є застосовними для димеру та мономеру, у тому числі одного або обох мономерів димерного комплексу. Особливо краще, димер містить два іони цинку. Термін "залишки сіалової кислоти" означає залишки типу N-ацетилнейрамінової кислоти (Nеu5Ас) зокрема, особливо N- або О-глікозилування. В основному, стабільність терапевтичного засобу є дуже важливим критерієм, беручи до уваги його період напівперетворення та тому його ефективність. Рекомбінантний АСЕ2 людини ідентифіковано зараз виключно як мономер та описано як такий у літературі стосовно його функціональності, кристалічної структури та також його взаємодії з високо специфічним інгібітором. Тому, наприклад, Тоwlеr еt аl (J Віоl Сhеm 279(17), 2004: 17996-18007), з посиланням на Vісkеrs еt аl (J Віоl Сhеm 277 (17), 2002: 14838-14843), описують експресію АСЕ2 у клітинах 1 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 комах Sf9, котрий отримували як мономер після очищення хроматографією з виключенням за розміром як кінцевим етапом очистки. Молекулярна маса мономеру була 89,6 кДа. Комерційно доступний АСЕ2 (від R&D Sуstеms, саtаlоguе numbеr 933-ZN, bаtсh numbеr FІU035071) є також у мономерній формі та є виробленим, застосовуючи спосіб, описаний у Тірnіs еt аl (2000, вище), з тою різницею, що системою експресії є клітини NS0 замість СНО. Мономери були описані, вони мають молекулярну масу 120 кДа у відновлювальних та невідновлювальних умовах. Згідно із Dоnоghuе еt аl (Сіrс Rеs 87, 2000: е1-е9), мономери АСЕ2 були експресованими у клітинах СНО, вони після секретування мали молекулярну масу 90 кДа. Усі документи, описані тут, уведені як посилання. Для стабілізації терапевтичного засобу згідно з винаходом розроблено спосіб згідно з винаходом, котрий виключно виробляє стабільні димери АСЕ2, та котрий дає вигоду від вироблення та фармакологічних переваг у порівнянні з мономерами АСЕ2. Димеризація має такі переваги: - кращу розчинність та біозасвоюваність у фізіологічних розчинах: димер має високу розчинність та довший іn vіvо період напівперетворення та придатність; - не утворюються агрегати: димер АСЕ2 утворює стабільні комплекси без додавання подальших молекул АСЕ2 до димеру; - зменшену атаку протеаз: внаслідок особливої фракції білку та тому найбільш ймовірно, Стермінальна частина є спрямованою до внутрішньої частини димеру, цей С-термінальний кінець не є деградованим; - збільшений період напівперетворення: нижча імуногенність, краща розчинність та зменшена схильність до протеолітичного розкладання збільшує період напівперетворення білку; - простіша очистка білку: гідродинамічний діаметр димеру АСЕ2 є вищим, ніж очікувано за його структурою та певним сольватним кожухом. Тому, димери АСЕ2 можна легко відділити від звичайних забруднень від експресії білку, наприклад, альбуміну сироватки (67 кДа), застосуванням колонок розділення за розміром. Переважно, рекомбінантний поліпептид АСЕ2 є глікозилованим принаймні на 80 % можливих ділянок N-глікозилування та має частку цукру більше, ніж 10 % (мас % загального АСЕ2) або 11 %, 12 %, 13 %, 14 %, переважно більше, ніж 15 % або 16 %, 17 %, 18 %, 19 %, зокрема, більше, ніж 20 % або 21 %, 22 %, 23 %, 24 % або 25 %. Розроблено спосіб вироблення, що відтворювано виробляє дуже чистий та ферментно активний, високо комплексований глікозилований АСЕ2. Продукт охарактеризовано високою часткою цукру (> 20 мас. %) та складними, високо розгалуженими, частково негативно зарядженими структурами цукру. Вони позитивно впливають на розчинність, біозасвоюваність, ферментну активність, а також фармакологічні властивості продукту. Селекцією придатного констракту експресії, придатного хазяїна експресії, оптимізованої стратегії селекції, застосовуючи середовище, що є пристосованим для метаболізму клітин, а також ретельним проведенням аналізу та селекції клонів вироблено лінію клітин, котра секретує бажаний продукт. АСЕ2 вже експресовано у клітинах комах Sf9 та клітинах мишей NS0. Матеріал було перед усім застосовувано у дослідженнях іn vіtrо. Також є результати відносно перехідної експресії АСЕ2 у клітинах СНО. Зараз не вироблено ліній клітин із відповідною високою продуктивністю. Крім того, не проведено відповідної селекції клонів відносно властивостей продукту, зокрема, стосовно N-глікозилування. Розчинність білку не тільки визначають за його амінокислотною послідовністю, але також за його згортанням, а також посттрансліційними модифікаціями. Заряджені структури цукру є головними чинниками збільшення розчинності білку та мають головний вплив на його фармакологічний профіль. Тому, для ЕРО показано, що присутність складної розгалуженої глікоструктури має позитивну дію на період напівперетворення цього білку. У принципі, різні системи експресії можна обговорювати стосовно експресії рекомбінантного АСЕ2; клітини прокаріотичного хазяїна не тестовано далі, внаслідок втрати ділянок процессингу N-глікозилування. Переважно, принаймні 70 % глікозилованих ділянок N-глікозилування мають структуру, незалежно від кожної іншої вибрану з формул 1 – 8: 2 UA 106869 C2 (формула 1) (формула 2) (формула 3) (формула 4) (формула 5) (формула 6) (формула 7) (формула 8) де: 5 10 15 20 25 30 Переважно, усі з можливих ділянок N-глікозилування є глікозилованими. Переважно, принаймні 80 %, переважно принаймні 90 %, зокрема, 100 % глікозилованих ділянок N-глікозилування мають структуру з формул 1-8. Переважно, одна мономерна одиниця димеру АСЕ2 має молекулярну масу принаймні 90 кДа, переважно принаймні 92 кДа, особливо краще принаймні 94 кДа, зокрема, принаймні 96 кДа, та краще принаймні 98 кДа, найкраще принаймні 100 кДа, 100,5 кДа, 101 кДа, 101,5 кДа або принаймні 102 кДа. Абсолютну молекулярну масу – тобто пептиду без гідратного кожуха – можна визначати за генетичною картою пептиду. Більш високо глікозиловані форми можуть також мати молекулярну масу принаймні 103 кДа, 104 кДа, 105 кДа, 106 кДа, 107 кДа або принаймні 108 кДа. Визначення молекулярних мас, на котрі впливають такі фактори, як гідратний кожух, як-то хроматографія або гель-електрофорез у водних системах – можуть також давати вищі результати. У наступному втіленні, мономерна одиниця димеру АСЕ2 має спостережувану молекулярну масу принаймні 101 кДа або принаймні 102 кДа, переважно принаймні 105 кДа, особливо краще принаймні 109 кДа, зокрема, принаймні 113 кДа, та краще принаймні 117 кДа, та найкраще принаймні 119 кДа, як визначено гель-електрофорезом. В інших втіленнях молекулярна маса мономеру (спостережувана або абсолютна) є максимум 102 кДа, 103 кДа, 104 кДа, 108 кДа, 110 кДа, 112 кДа, 116 кДа, 120 кДа, 125 кДа, 130 кДа, 135 кДа або 140 кДа. Вищі молекулярні маси є можливими за допомогою модифікації АСЕ2, наприклад, ПЕГілуванням. Переважно, мономер (що не утворює димер) має молекулярну масу принаймні 82 кДа, переважно принаймні 86 кДа, особливо краще принаймні 90 кДа, зокрема, принаймні 94 кДа, краще принаймні 98 кДа, та найкраще принаймні 101 кДа або максимум 102 кДа, 103 кДа, 104 кДа, 108 кДа, 110 кДа або максимум 112 кДа. Ці молекулярні маси можна визначати, наприклад, застосовуючи генетичну карту пептиду. Переважно, поліпептид АСЕ2 не має трансмембранних доменіві. Тому, він є розчинним АСЕ2. Особливо кращі втілення тому охоплюють розчинні поліпептиди АСЕ2, поліпептидні ланцюги яких складаються з амінокислот 18-740 або їх ферментно активних фрагментів. Наступний поліпептид складається з амінокислот 18-615 від SЕQ ІD NО: 1. 3 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хоча АСЕ2 людини (SЕQ ІD NО: 1) є кращим для більшості терапевтичних застосувань, АСЕ2 від інших ссавців, наприклад, мишей, щурів, хом'яків, свиней приматів або великої рогатої худоби, можна також застосовувати. АСЕ2 є універсальним ферментом в усіх ссавцях з субстратом Аng ІІ, що є ідентичним у різних видах. Звідси, у принципі його можна також застосовувати у чужинних організмах. Тому, білок згідно з винаходом можна застосовувати не беручи до уваги від походження АСЕ2, наприклад, від людей, мишей, щурів, хом'яків, свиней приматів або великої рогатої худоби. Однак, у кращих втіленнях походження АСЕ2 та організм, що лікують, є однаковими. Переважно, серин (або С-термінальна амінокислота) поліпептиду АСЕ2, відповідний Sеr740 SЕQ ІD NО: 1 (наприклад, С-термінальний кінець) є О-глікозилованим. Переважно, принаймні 70 %, переважно принаймні 80 %, зокрема, принаймні 90 %, та найбільш переважно 100 % глікозилованих ділянок N-глікозилування мають сіалову кислоту; переважно, ділянки N-глікозилування, відповідні Аsn53, Аsn90, Аsn103, Аsn322, Аsn432, Аsn546, Аsn690 SЕQ ІD NО: 1 є сіалізованими. У певних втіленнях аспарагін, відповідний Аsn53 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Аsn90 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Аsn103 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Аsn322 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Аsn432 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Аsn546 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Аsn690 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. У певних втіленнях аспарагін, відповідний Sеr740 SЕQ ІD NО: 1 є моно-, бі-, три- або тетрасіалізованим. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є моно-, бі-, три- або тетра-сіалізованими. Переважно, принаймні 30 %, переважно принаймні 40 %, зокрема, принаймні 55 % та найкраще принаймні 70 % глікозилованих ділянок N-глікозилування мають принаймні дві сіалові кислоти. Переважно, в одному препараті АСЕ2 принаймні 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 % або 100 % вказаних амінокислот є тому сіалізованими. Переважно, аспарагін, відповідний Аsn53 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, аспарагін, відповідний Аsn90 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, аспарагін, відповідний Аsn103 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, аспарагін, відповідний Аsn322 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, аспарагін, відповідний Аsn432 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, аспарагін, відповідний Аsn546 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, аспарагін, відповідний Аsn690 SЕQ ІD NО: 1 є N-глікозилованим, переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. У наступному аспекті, заявлений винахід стосується отримання рекомбінантних поліпептидів АСЕ2, що містять поліпептид як визначено тут, (мономери або димери АСЕ2 або мономерні одиниці димерів), де частина поліпептидів АСЕ2 із спостережуваною молекулярною масою, що можна визначати гель-електрофорезом менше, ніж 100 кДа або менше, ніж 101 кДа, переважно 4 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 менше, ніж 104 кДа, краще менше, ніж 108 кДа, зокрема, менше, ніж 112 кДа, особливо краще менше, ніж 117 кДа, найкраще менше, ніж 119 кДа, є менше, ніж 20 %, переважно менше, ніж 10 %, особливо краще менше, ніж 5 %, найкраще менше, ніж 1 %, особливо 0 %, та будь-яка їх комбінація. Наприклад, поліпептиди АСЕ2 менше, ніж 100 кД можуть бути присутніми у кількості 0 % та поліпептиди АСЕ2 менше, ніж 100 кДа можуть бути присутніми у кількості менше, ніж 20 %. Фракція є з усіма формами АСЕ2 та їх, наприклад, визначають, застосовуючи нативний гель-електрофорез. Так само, молекулярною масою може бути абсолютна молекулярна маса, котру можна визначати за генетичною картою пептиду. Тому, фракція поліпептидів АСЕ2 з молекулярною масою менше, ніж 86 кДа, або менше, ніж 89 кДа, переважно менше, ніж 92 кДа, краще менше, ніж 94 кДа, зокрема, менше, ніж 97 кДа, особливо краще менше, ніж 100 кДа, та найкраще менше, ніж 101 кДа, є менше, ніж 20 %, переважно менше, ніж 10 %, особливо краще менше, ніж 5 %, найкраще менше, ніж 1 %, особливо 0 %, та будь-якою їх комбінацією. Наприклад, поліпептиди АСЕ2 менше, ніж 86 кД можуть бути у кількості 0 %; а поліпептиди АСЕ2 менше, ніж 97 кДа можуть бути у кількості менше, ніж 20 %. Переважно, фракція поліпептидів АСЕ2 з трансмембранними доменами є менше, ніж 20 %, переважно менше, ніж 10 %, особливо краще менше, ніж 5 %, найкраще менше, ніж 1 %, особливо 0 %. Переважно, фракція полімерів АСЕ2 є менше, ніж 20 %, переважно менше, ніж 10 %, особливо краще менше, ніж 5 %, найкраще менше, ніж 1 %, особливо 0 %. Термін "АСЕ2полімери" означає комплекси з 3 або більше поліпептидів АСЕ2. На додаток, у препараті димерів АСЕ2, фракція мономерів АСЕ2 є переважно менше, ніж 20 %, переважно менше, ніж 10 %, особливо краще менше, ніж 5 %, найкраще менше, ніж 1 %, особливо 0 %. На додаток, у препараті мономеру АСЕ2, фракція димерів АСЕ2 є переважно менше, ніж 20 %, переважно менше, ніж 10 %, особливо краще менше, ніж 5 %, найкраще менше, ніж 1 %, особливо 0 %. Переважно, фракція димерів АСЕ2 у молекулах АСЕ2 є принаймні 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 % або принаймні 99 %. У наступному втіленні, у комбінації або незалежно, фракція мономерів АСЕ2 у молекулах АСЕ2 може бути принаймні 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 % або принаймні 99 %. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn53 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn90 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn103 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn322 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn432 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn546 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з N-глікозилованим аспарагіном, відповідним Аsn690 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %, та переважно з гліканом, що має структуру формули 1, 2, 3, 4, 5, 6, 7 або 8. Переважно, фракція поліпептидів АСЕ2 з О-глікозилованим аспарагіном, відповідним Sеr740 SЕQ ІD NО: 1, є більше, ніж 60 %, переважно більше, ніж 70 %, особливо краще більше, ніж 80 %, краще більше, ніж 90 %, найкраще більше, ніж 99 %, та особливо 100 %. 5 UA 106869 C2 -1 5 10 15 20 25 30 35 40 45 50 55 60 Переважно, каталітична активність поліпептиду або препарату АСЕ2, ссаt, є принаймні 4 с , -1 -1 -1 переважно принаймні 5 с , особливо краще принаймні 6 с , краще принаймні 7 с , та найкраще -1 принаймні 7,6 с відносно перетворення Аng 1-7 (ангіотензин 1-7). Аng 1-7 утворюється з Аng ІІ (ангіотензин ІІ) за допомогою АСЕ2. Перетворення можна тестувати просто, як описано у приклади. Це перетворення або каталітичну активність АСЕ2 можна також отримувати з даних інших досліджень. Активність можна, наприклад, вимірювати як описано у WО-2008/046125 А. У наступному аспекті, заявлений винахід стосується способу вироблення рекомбінантних поліпептидів АСЕ2 або препарату рекомбінантних АСЕ2, що має етапи уведення полінуклеотиду, що клонує АСЕ2, переважно полінуклеотиду, що клонує АСЕ2 з нетрансмембранним доменом, в клітини еукаріотів, що експресують поліпептид АСЕ2 та збирання експресованого АСЕ2, зокрема, у димерній формі. Клітини можна тоді вибирати для вироблення поліпептиду АСЕ2 згідно з винаходом, як тут описано, зокрема, з високою молекулярною масою. Переважно, полінуклеотид, що клонує АСЕ2, запропоновано на векторі. Переважно, експресію АСЕ2 вибирають з маркером, переважно DНFR. Переважно, маркер є на векторі. Переважно, вектор має ІRЕS для експресованої мРНК АСЕ2 (або кодує її). Переважно, клітинами еукаріотів є клітини СНО. Заявлений винахід також стосується рекомбінантного поліпептиду АСЕ2 або препарату рекомбінантного поліпептиду АСЕ2, доступного за допомогою такого способу. У наступному аспекті, винахід стосується стабільної лінії клітин (або клітин) еукаріотів, що має трансфектований полінуклеотид, що клонує АСЕ2, переважно лінії клітин СНО (або клітин), що експресують АСЕ2, зокрема, як визначено вище. Лінію клітин можна вибирати стосовно бажаних властивостей, представлених вище, наприклад, вироблення димерів з мономерних одиниць з молекулярною масою принаймні 102 кДа. Клітини переважно мають продуктивність АСЕ2 принаймні 10 пг/клітину/добу, переважно принаймні 15 пг/клітину/добу, особливо краще принаймні 20 пг/клітину/добу. 2+ Експресія АСЕ2 переважно відбувається у присутності достатньої кількості іонів Zn . 2+ Переважно застосовують принаймні 0,5 мікромолярний, зокрема, до 5 мікромолярного Zn ; 2+ зокрема, ферментацію можна проводити, застосовуючи 2,5-3,5 мікромолярний Zn . 2+ Концентрація Zn у живильному середовищі для експресованих клітини, наприклад, може бути принаймні 0,5 мкМ, 0,75 мкМ, 1,0 мкМ, 1,25 мкМ, 1,5 мкМ, 1,75 мкМ, 2,0 мкМ, 2,25 мкМ або принаймні 2,5 мкМ або 3,0 мкМ. Наступні етапи лікування переважно також проводять у 2+ присутності іонів Zn . У наступному аспекті, заявлений винахід стосується медичних або фармацевтичних препаратів АСЕ2 згідно з винаходом, зокрема, для лікування або попередження високого кров'яного тиску, серцевої недостатності, як-то застійної, гострої або хронічної серцевої недостатності, інфаркту міокарду або артеросклерозу, ниркової недостатності, полікистозної хвороби нирок, РКD, або хвороби легень, як-то хронічна обструктивна хвороба легень, пневмонія, астма, хронічний бронхіт, емфізема, кистозний фіброз, інтерстиціальна хвороба легень, гіпертонія легень, емболія легень, саркоїдоз легень, туберкульоз, набряк легень, АLІ, АRDS або рак легень. Загальне лікування АСЕ2 є описаним у WО 2004/000367 А, наприклад; АСЕ2 винаходу є також придатним у цьому випадку. Згідно з винаходом, можуть бути запропонованими фармацевтична композиція або лікарський засіб, що містить білок АСЕ2. Такі композиції можуть бути фармацевтично прийнятними солями, з додатковими буферами, компонентами тонічності або фармацевтично прийнятними носіями. Фармацевтичний носій потрібен для поліпшення сумісності композиції та кращої розчинності, а також кращої біозасвоюваності активних інгредієнтів. Прикладами є емульгатори, загусники, редокс-компоненти, крохмалі, спиртові розчини, поліетиленгліколь та ліпіди. Селекція придатного фармацевтичного носія є високо залежною від шляху застосування. Для перорального застосування, де рідкі або тверді носії можна застосовувати; для ін'єкцій, рідкі кінцеві композиції є потрібними. Переважно, композиція АСЕ2 згідно з винаходом містить буфери або засоби тонічності речовини. Буфером можна доводити рН лікарського засобу до фізіологічних умови та крім того, можна зменшувати варіації рН. Прикладом є фосфатний буфер. Засобами тонічності можна доводити осмолярність, вони можуть містити іонні речовини, як-то неорганічні солі, наприклад, NаСl або КСl, або неіонні речовини, як-то гліцерин або вуглеводи. Переважно, композицію або лікарський засіб для застосування згідно з винаходом виготовляють відповідним чином для системного, місцевого, перорального або інтраназального застосування або як інгаляційний препарат. Ці форми для застосування композиції заявленого 6 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу дозволяють неускладнене поглинання. Коли композиція АСЕ2 є для перорального застосування, це переважно запропоновано у композиції, що є стійкою до шлункової кислоти або є інккапсульованою. Для перорального застосування, тверді або рідкі медичні препарати можна давати безпосередньо або розчиненими або розбавленими, наприклад. Лікарський засіб для застосування згідно з винаходом є переважно виробленим для внутрішньовенного, інтраартеріального, внутрішньом'язового, інтраваскулярного, інтраперитонеального або підшкірного застосування. Ін'єкції або переливання, наприклад, є придатними для цього. Застосування безпосередньо у кровообіг має перевагу тим, що активний інгредієнт лікарського засобу можна розподіляти по всьому тілу та цільова тканин швидко досягається. Заявлений винахід ілюстровано, застосовуючи необмежувальні фігури та приклади. Фігури: Фіг. 1: Експресія АСЕ2 та селекція касет; Фіг. 2: АСЕ2-специфічне Вестерн-блотування історії вироблення клону; Фіг. 3: SDS-РАGЕ-аналіз мономеру АСЕ2; Фіг. 4: Селекція клонів; Фіг. 5: Аналіз РХ-МС глікозилування; Фіг. 6: Препаративне розділення за розміром АСЕ2; Фіг. 7: Фармакокінетика АСЕ2 у 3 видах; Фіг. 8: Криві калібрування для визначення Аng 1-7 та Аng ІІ. Пептиди відділяли у діапазоні встановлених концентрацій, застосовуючи ЗФ-ВЕРХ на колонках Wаtеrs С18 µВоndараk ЗФ, 2,1 d 300 мм, 10 мкм, 125 Å; Фіг. 9: МС/МС-спектр N-термінального пептиду. Зауваження: Q та К мають однакову масу; Фіг. 10: Послідовність АСЕ2 та прогнозоване N-глікозилування; Фіг. 11: Детальний спектр для сайту глікозилування 103 (А), сайту 432 (В), сайту 546 (С), сайту 690 (D), сайту 90 (Е); Фіг. 12: Спектр С-термінально О-глікозилованого пептиду. Структурне розподілення треба класифікувати як умовне; Фіг. 13: РХ-МС виділені глікани; Фіг. 14: Визначення димерної структури АСЕ2, застосовуючи нативний РАGЕ (ліворуч, смуги білку візуалізували, застосовуючи проявлення сріблом) та SЕС (праворуч, розділення на колонці Zоrbах G-450 у присутності 220 мМ Nа-фосфат при рН 7,0 у 10 % ацетонітрилі, хроматограму реєстрували при 214 нм); Фіг. 15: Хроматограма хроматографії за виключенням за розміром димеру АСЕ2 (час утримування 8,55 хвилин, 8,93 хвилин). Стандарти: тироглобулін (670 кДа, 7,43 хвилин), гаммаглобулін (158 кДа), овальбумін (43 кДа, 10,08 хвилин), міоглобулін (17 кДа, 11,08 хвилин), вітамін В-12 (1,3 кДа, 12,71 хвилин); Фіг. 16: АСЕ2-специфічне Вестерн-блотування екстрактів клітин від кори (А), мозку (В) та експресйного клону димеру АСЕ2 (С). D показує чистий димер АСЕ2; Фіг. 17: Аналітична SЕС-ВЕРХ-хроматограма мономеру АСЕ2. Умови перебігу: колонка: Zоrbах GF250, буфер: 220 мМ Nа2Н-РО4+10 % СН3СN, рН 8,0 при 1 мл/хвилин; Фіг. 18: РАGЕ-аналіз димерів АСЕ2 (А) та мономерів АСЕ2 (В); білки виявляли, застосовуючи проявлення сріблом (а) та АСЕ2-специфічне Вестерн-блотування (b); Фіг. 19: Визначення ферментної активності мономерів АСЕ2 у порівнянні з димерами АСЕ2. Сталу початкову концентрацію флуоресцентно-міченого субстрату кумарин-АРК-DNР та чотири різних концентрації ферменту застосовували та відповідні криві флуоресценції порівнювали; Фіг. 20: Активність АСЕ2 у сироватці вимірювали через 24 та 48 години після застосування димеру АСЕ2 (2,5 мг/кг, сині колонки) або мономеру АСЕ2н (2,5 мг/кг, сірі колонки). ПРИКЛАДИ Приклад 1: Експресія високо глікозилованого димеру АСЕ Послідовності розчинних фракцій АСЕ2 людини (SЕQ ІD NО: 1) клонували у вектор експресії, у котрий вже додано ампліфікований маркер DНFR-селекції, для посиленої експресії гена АСЕ2. До цього кінця, між генами, що клонують АСЕ2 та dfhr, вставляли ослаблений ІRЕS, котрий давав бі- цистронну транскрипцію АСЕ2 та DНFR на тій же мРНК. Експресія АСЕ2 та касети селекції є показаною у Фіг. 1. Тоді як обидва білки експресуються під контролем того ж промотеру, експресія АСЕ2 може бути навмисно посиленою за допомогою селекції DНFR, застосовуючи антагоніст МТХ. Ця стратегія може виробляти особливо стабільні експресійні лінії клітин, що дають високий вихід продукту зі сталою якістю. Це також означає, що помірні титри продукту можна також отримати у лініях клітин, котрі можуть можливо бути менш придатними для рекомбінантної експресії певного цільового білку. 7 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей вектор було трансфектовано у клітини СНО-dhfr та ряд копій гена АСЕ2 ампліфікували під безперервно зростаючим тиском МТХ. Кілька циклів селекції та субклонування застосовували для селекції найкращих продуктів з оптимізованими властивостями, застосовуючи інтрацелюлярний FАСS-аналіз та білково-хімічний, а також ферментний аналіз: зокрема, для селекції найбільш придатних клонів, специфічної ферментної активності, котру вимірювали з 3 різними субстратами, гомогенності продукту, клітинної продуктивності, та також комплексності цукру були узятими до уваги. Фіг. 2 показує дані Вестерн-блотування послідовних залишків культур індивідуальних клонів, котрі застосовували для запровадження лінії клітин для вироблення. Властивості продуктів індивідуальних клонів відрізняються тим, що частка цукру у продукті експресії збільшується справа ліворуч, як показано суттєвим збільшенням маси. Це отримували специфічною селекцією високо глікозилованих клонів. Зрештою, один клон (клон 5В9), що мав продукт експресії із найвищою молекулярною масою, застосовували для запровадження ліні клітин для вироблення (184). Було визначено 6 клонів, що ферментно експресували високо активний та складний Nглікозилований АСЕ2. Тоді як розчинний АСЕ2 має молекулярну масу 83 кДа, вибирали клони, котрі були у межах до 120 кДа у денатурувальному SDS-РАGЕ, як визначено за їх структурою цукру. Фіг. 3 показує АСЕ2 (прохід В) вироблений заявленим способом вироблення у порівнянні з стандартним АСЕ2, виробленим у NS0 (прохід А). Тоді як поліпептид АСЕ2 згідно з винаходом – аналізований тут як мономер – є гомогенним та високо глікозилованим, а тому виявляється одиничною смугою при приблизно 120 кДа, смуги для порівняльного матеріалу є від 83 кДа до 120 кДа, вказуючи на високо гетерогенне глікозилування. Попередні клони тоді переносили на безбілкове середовище для росту (Роlуmun). Це комерційно доступне середовище є хімічно визначеним, безсироваточним, без тваринних білків та оптимізованим для рекомбінантної експресії глікопротеїнів у СНО. Ферментацію проводили і 2+ 2,5 – 3,5 мкМ Zn . Усі 6 клонів тримали у культурі та тестували на придатність до вироблення. Зокрема, реєстрували швидкості росту та визначали кількості продукту та метаболітів (Фіг. 4). Крім того, продукти експресії та клони строго аналізували. Усі клони експресували високо активний АСЕ2 та мали продуктивності 20-30 пг/клітину/добу. Крім того, аналізували структури цукру та їх гетерогенність. Зрештою, вибирали клон 1В4. Протягом процесу вироблення, він виявив гомогенну структуру цукру. Усі 7 ділянок N-глікозилування обробляли; вони мали принаймні бі-, але іноді навіть три-розгалужене складне глікозилування з кінцевими сіаловими кислотами. Банк клітин було вироблено та тестовано на основі цього клону, та були створеними спосіб очистки GМР-класу та крім того спосіб вироблення GМР-класу. SЕQ ІD NО: 1 (послідовність білку АСЕ2; аутогенна сигнальна послідовність (підкреслено) розщеплюється клітиною хазяїна для видалення): МSSSSWLLLSLVАVТАА QSТІЕЕQАКТFLDКFNНЕАЕDLFYQSSLАSWNYNТNІТЕЕNVQNМNNАGDКWSАFLКЕQSТLАQМ YРLQЕІQNLТVКLQLQАLQQNGSSVLSЕDКSКRLNТІLNТМSТІYSТGКVСNРDNРQЕСLLLЕРGLNЕІ МАNSLDYNЕRLWАWЕSWRSЕVGКQLRРLYЕЕYVVLКNЕМАRАNНYЕDYGDYWRGDYЕVNGVDGY DYSRGQLІЕDVЕНТFЕЕІКРLYЕНLНАYVRАКLМNАYРSYІSРІGСLРАНLLGDМWGRFWТNLYSLТVР FGQКРNІDVТDАМVDQАWDАQRІFКЕАЕКFFVSVGLРNМТQGFWЕNSМLТDРGNVQКАVСНРТАW DLGКGDFRІLМСТКVТМDDFLТАННЕМGНІQYDМАYААQРFLLRNGАNЕGFНЕАVGЕІМSLSААТРК НLКSІGLLSРDFQЕDNЕТЕІNFLLКQАLТІVGТLРFТYМLЕКWRWМVFКGЕІРКDQWМККWWЕМКRЕІ VGVVЕРVРНDЕТYСDРАSLFНVSNDYSFІRYYТRТLYQFQFQЕАLСQААКНЕGРLНКСDІSNSТЕАG QКLFNМLRLGКSЕРWТLАLЕNVVGАКNМNVRРLLNYFЕРLFТWLКDQNКNSFVGWSТDWSРYАDQS ІКVRІSLКSАLGDКАYЕWNDNЕМYLFRSSVАYАМRQYFLКVКNQМІLFGЕЕDVRVАNLКРRІSFNFFVТ АРКNVSDІІРRТЕVЕКАІRМSRSRІNDАFRLNDNSLЕFLGІQРТLGРРNQРРVS Димеризація АСЕ2 спрямовує усі одиниці гідрофобного білку у внутрішню частину комплексу, внаслідок чого заряджені залишки, як-то N-зв'язані ланцюги цукру, виступають назовні та сольватують структуру у фізіологічному середовищі. Вказану димеризацію 2+ експресією повністю N-глікозилованого АСЕ2 спостерігали у присутності Zn . У цьому випадку димерний комплекс, що складається з 2 ідентичних субодиниць, що були електростатично зв'язаними та також довше не розділялися у фізіологічних розчинах. Це призводить до секретування глікопротеїну кожного разу із 14 високо зарядженими структурами сіалової кислоти на кожну молекулу АСЕ2, а також 28 структурами сіалової кислоти у димері. Два іони 2+ Zn є кожного разу уведеними у комплекс та стабілізують його структуру. Високий заряд ланцюгів цукру сольватує молекулу у фізіологічних розчинах та витискує асоційовані заряджені домени білку назовні. Спосіб вироблення створено так, щоб тільки димери АСЕ2 були у кінцевому продукті. 8 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 Це є можливим внаслідок того, що на створених АСЕ2 є присутніми достатні кількості іонів 2+ 2+ Zn (переважно застосовують 1,5 – 5 мікромолярний Zn ; зокрема, ферментацію можна 2+ 2+ проводити при 2,5 – 3,5 мкМ Zn ); наступні етапи обробки проводять у присутності іонів Zn . Очистку проводять, застосовуючи аніонообмін, осадження амонію сульфатом, НІС-етап, катіонообмін, а тоді наступний аніонообмін високого розділення. Усі середовища у процесі були буферованими фосфатом та містили натрію хлорид. Кінцевим буфером є фізіологічний розчин гліцину для ін'єкцій. Приклад 2: Властивості продуктів Комплексований високоглікозилований мономер АСЕ2 або мономерні одиниці димеру мають набагато вищу молекулярну масу, ніж вказана амінокислотою послідовністю внаслідок ковалентно зв'язаних структур цукру. Тому, генетична карта пептиду дає молекулярну масу 102 кДа, тоді як генетична карта неглікозилованого АСЕ2 тільки 83 кДа. Частка цукру є відповідно 23 % та є суттєвою стосовно властивостей описаних нижче продуктів. Внаслідок сильного гідратування, мономерна одиниця виявляється у SDS-РАGЕ при 120 кДа (Фіг. 3) відносно внутрішнього стандарту. Природний зв'язаний з мембранами АСЕ2 не експресується, тільки розчинна фракція АСЕ2. Внаслідок відсутнього мембранного домену, він є повністю глікозилованим. Внаслідок того, що комплекс є високо сіалізованим та тому високо негативно зарядженим структурами цукру, АСЕ2 має набагато більшу розчинність у порівнянні з неглікозилованим або неповністю глікозилованим АСЕ2. Тому, фізіологічні буферовані композиції білку оf до 15 мг/мл можна легко виготовляти. Крім того, продукт є стабільним у розчині та при довготерміновому зберіганні, він не втрачає активність та не розкладається або агрегується, на частини від стабільної димеризації. Деглікозилований АСЕ2 осаджується навіть у діапазоні низької концентрації. Це можна показати в експерименті препаративного деглікозилування, застосовуючи РNGаsеF. Теоретичний індекс стабільності, розрахований для АСЕ2, є 41,2 та класифікує білок як нестабільний; структури цукру не є обговореними для цього розрахунку. Однак, тоді як композиції залишаються стабільними протягом місяців, це є чітко внаслідок високої частки цукру. Краща сольватація АСЕ2 також означає, що ця композиція складається виключно з димерів АСЕ2 (або після штучного розділення до мономеру, виключно мономерів), тоді як неглікозилований АСЕ2 має тенденцію утворювати полімери та агрегати. Оскільки велика фракція цукрових залишків збільшує гідродинамічний діаметр, сольватаційний кожух препарату АСЕ2 збільшується по суті. Цю ситуацію можна використати для препаративної очистки АСЕ2 за допомогою колонки для розділення за розміром; тут білок, котрий є присутнім виключно як димер, має спостережувану молекулярну масу 250 кДа у порівнянні з розрахованими 83 кДа. Хроматограма препаративної очистки АСЕ2 є показаною у Фіг. 6. АСЕ2 (перша схема) елюється з часом утримування 69 хвилин. Це відповідає спостережуваній молекулярній масі між масою тироглобуліну (перша схема, 58 хвилин, 670 кДа) та гамма-глобуліну (перша схема, 74 хвилин, 158 кДа). У цій області високої молекулярної маси, практично нема забруднень у залишках культур, та таким чином дуже чистий продукт можна відділити у дуже простому етапі розділення. Приклад 3: Фармакологічні властивості продуктів Препарат АСЕ2 винаходу є у фізіологічних буферах як стабільний, дуже чистий та концентрований розчин білку та його можна зберігати та застосовувати без подальшої стабілізації. Фосфатний буфер може, наприклад, бути застосовуваним. АСЕ2 є стабільним як мономер або димер у розчині, а внаслідок високої частки цукру не агрегується. Крім того, препарат АСЕ2 має повну ферментну активність. Внаслідок його розчинності, АСЕ2 можна застосовувати внутрішньовенно як болюс. З тої ж причини біозасвоюваність є гарантованою негайно після застосування. Внаслідок високої, високо розгалуженої та складної частки цукру АСЕ2 розкладається тільки повільно. Це призводить до довгого періоду напівперетворення принаймні 10,5 годин, що виміряли у різних видах, зокрема, у макак-резус. Фіг. 7 показує періоди напівперетворення, виміряні для АСЕ2, застосовуваного внутрішньовенно. Високий вміст сіалової кислоти також означає, що не нейтралізування імунної реакції є встановленим проти АСЕ2. Це може не тільки призводити до зворотних результатів стосовно застосування екзогенного АСЕ2, але також може нейтралізувати аутологічний АСЕ2, присутній у клітинах. Композиція АСЕ2, описана з усіма асоційованими властивостями продуктів тому забезпечує ефективну терапію rhАСЕ2. Приклад 4: Визначення специфічної активності АСЕ2 9 UA 106869 C2 5 10 Специфічну активність препаратів АСЕ2 визначали вимірюванням перетворення Аng ІІ (АsрАrg-Vаl-Туr-Іlе-Ніs-Рrо-Рhе). Усі виміри проводили у потроєнні у 100 мкл аліквотах. Ферментну реакцію починали додаванням 250 нг/мл АСЕ2 до 80 мкМ розчину Аng ІІ у 50 мМ МЕS, 300 мМ NаСl, 10 мкМ ZnСl2 та 0,01 % Вrіj-30 при рН 6,5. Зразки були обережно змішаними та їх інкубували при 37 °C протягом 18 хвилин. Ферментну реакцію припиняли додаванням 100 мМ ЕДТА. Для аналізу розчини розділяли, застосовуючи ЗФ-ВЕРХ (Wаtеrs С18 µВоndараk, 2,1 (300 мм, 10 мкм, 125 Å), застосовуючи лінійний градієнт 10 % до 60 % СН3СN у 0,08 % Н3РО4 протягом 20 хвилин при швидкості потоку 1 мл/хвилин. Крім того, обидва піки Аng ІІ та Аng 1-7 визначали у хроматограмі та інтегрували. Концентрації пептиду визначали, застосовуючи прийнятні криві калібрування, показані у Фіг. 8. Крім того, визначали ферментне перетворення та специфічну активність ферменту. Активність продукту АСЕ2 визначали як описано вище. Таблиця 1 показує результати інтегрування піку, а також обчислені ферментні дані. Таблиця 1: Ферментні дані та умови реакції. Середнє значення потроєних визначень є показаним Ферментна реактивність Площа поверхні піку mАU.хвилин Аng ІІ 17149890 Аng 1-7 4720141 Перетворення мкмоль.хвилин -1 Час реакції -1 хвилин нг.мл 25 30 35 40 45 Ссаt с -1 Специфічна активність -1 -1 мкмоль.мг .хвилин 62,1 18 250 8,0±0,3 4,7±0,2 23,1 18 250 8,8±0,2 5,2±0,1 15 20 Конц. АСЕ2 -1 Препарат АСЕ2 мав каталітичну активність, ссаt, 8,0±0,3 с , відносно перетворення Аng ІІ, -1 та 8,8±0,2 с відносно перетворення Аng 1-7. Обидва значення були у гарній згоді та були набагато вищими, ніж дані від Vісkеrs еt аl (J Віоl Сhеm 277, (17) (2002): 14838-43), про -1 каталітичну активність АСЕ2 3,5 с . Реакційні умови були ідентичними. Причиною 240 % вищої активності для нашого препарату повинна бути посттрансляційна модифікація та у цьому випадку перед усім N-глікозилування, що було набагато менш специфічним у матеріалі, застосовуваному Vісkеrs. Цей матеріал був експресованим у клітинах комах та справді мав ту ж амінокислотну послідовність, але був глікозилованим набагато менше та з меншим ступенем розгалуження. Крім того, визначали комерційно доступний препарат АСЕ2 від R&D Sуstеms (саt -1 № 933-ZN), що також мав набагато нижчу активність, ссаt, 2,0±0,1 с . Суттєвою властивістю препарату винаходу є особливо висока ферментна активність, котра була перед усім отриманою посттрансліційними модифікаціями. По-перше, трипсинові пептиди були виробленими, застосовуючи SDS-РАGЕ та Sалкілування та аналізованими, застосовуючи РХ-ІЕР-МС (та МС-МС). N-термінальний пептид та кілька внутрішніх пептидів були знайденими. П'ять з семи потенційних N-глікозилованих ділянок були знайденими у глікозилованій формі структур з гліканом, котрі головним чином містили дірозгалужені глікани фукози та різні кількості сіалової кислоти. С-термінальний пептид виявлено як О-глікозилований. По-друге, вільні, зменшені N-глікани аналізували, застосовуючи карбон-РХ-ІЕР-МС. Для дірозгалуженого, ді-сіалізованого глікану з фукозою, було показано, що фукоза була зв'язаною з α1,6-ядром, а сіалова кислота була α2,3-зв'язаною. На додаток до моно- або ді-сіалізованих, дірозгалужених гліканів було знайдено значну кількість три-розгалуженого олігосахариду. Груба оцінка маси виробленого глікозилованого АСЕ2 101-102 кДа, тобто відповідає приблизно 17 % вуглеводу. Протеолітичне розкладання hВСhЕ, розділеного, застосовуючи SDS-РАGЕ. Приклад 5: Глікопротеомічний аналіз рекомбінантного АСЕ2 Зразок очищеного, СНО-експресованого АСЕ2 аналізували двома способами: Аліквоти АСЕ2, піддані дії SDS-РАGЕ, обезбарвлювали, карбамідометилували, розкладали трипсином та екстрагували на шматках гелю як описано. Екстракти сушили у концентраторі Sрееd Vас та відтворювали водою, що містить 0,1 % мурашиної кислоти перед наступним аналізом РХ-МС. Для аналізу олігосахариду пептид розкладали РNGазою F та глікани очищали, застосовуючи патрони С18 SРЕ. МС-аналіз трипсинових пептидів та гліколь-пептидів 10 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 Мас-спектрометричний аналіз проводили на приладі Q-ТОF Ultіmа Glоbаl (Wаtеrs Місrоmаss) зі стандартним блоком електророзпилення, системою Сар-РХ (Wаtеrs Місrоmаss) та 10отвірним модулем обміну розчиннику (Rhеоdуnе) як описано Коlаrісh 2006. Зразки спочатку уводили на попередню колонку Аquаsіl С18 (30 мкм 0,32 мм, Тhеrmо Еlесtrоn), застосовуючи воду як розчинник. Аналітичну колонку Віоbаsіс С18 (100 мкм 0,18 мм, Тhеrmо Еlесtrоn) утримували перед обміном розчиннику на 5 % ацетонітрил та тоді лінійний градієнт 5 % – 50 % ацетонітрилу застосовували при швидкості потоку 2 мкл/хвилин. Усі середовища елювання містили 0,1 % мурашиної кислоти. Зразки аналізували за допомогою МС, а також за допомогою МС-МС. Аналіз даних проводили, застосовуючи програму МаssLуnх 4,0 SР4 (Wаtеrs Місrоmаss). Аналіз вільних N-гліканів від АСЕ2 Борогідридом відновлені глікани відділяли на колонці з пористим графітом та досліджували, застосовуючи мас-спектрометрію. Приклад 6: Аналіз глікозилування Молекулярну масу, позицію усіх ділянок глікозилування, а також структуру зв'язаного цукру для послідовності білку АСЕ2 визначали тут. Зразок аналізували, застосовуючи трипсинове розкладання, S-алкілування та РХ-ІЕР-МС. - Визначена маса білку глікозилованого продукту була 102 кДа, де частка цукру була 23 % загальної маси; - N-термінальний кінець та присутність усіх внутрішніх пептидів послідовності визначали тут (дивись інформацію про послідовність); - усі 7 постульованих ділянок N-глікозилування (позиції 53, 90, 103, 322, 432, 546 та 690) дійсно містили ді-розгалужені, складні фукозиловані структури цукру з вмістом сіалової кислоти (Фіг. 13); - с-термінальний пептид був О-глікозилованим. Структуру цих залишків цукру визначали за допомогою карбон- РХ-ІЕР-МС після розщеплення та відновлення. Кожна та усі ді-розгалужені структури містили дві α2,3-зв'язані сіалові кислоти та одну α1,6-зв'язану фукозу. Малу кількості три-розгалужених структур було також знайдено (Фіг. 11). Стратегія застосовуваної селекції мала на увазі, що отримували повністю глікозилований продукт експресії з вмістом сіалової кислоти. Спосіб: Отримання зразку АСЕ2 відділяли, застосовуючи SDS-РАGЕ, обезбарвлювали, алкілували та розкладали, застосовуючи трипсин (Коlаrісh еt аl, Рrоtеоmісs 6 (2006): 3369-3380). Гель-екстракти сушили та розчиняли у 0,1 % мурашиної кислоти перед аналізом РХ-МС. Для аналізу цукру пептид розкладали РNGазою-F та очищали на колонках С18 SРЕ. МС-аналіз Усі мас-спектроскопічні аналізи проводили, застосовуючи прилад Q-ТОF Ultіmа Glоbаl (Wаtеrs Місrоmаss) зі стандартним блоком електророзпиленнята системою Сар-РХ (Wаtеrs Місrоmаss) (Коlаrісh, 2006). Зразки концентрували на попередній колонці Аquаsіl С18 (30 мкм0,32 мм, Тhеrmо Еlесtrоn) у воді. Застосовуваною колонкою для розділення була колонка С18 (100 мкм0,18 мм, Тhеrmо Еlесtrоn), застосовуючи ацетонітрил градієнт. Зразки були досліджували способом МС та МСМС. Аналіз вільних N-гліканів Глікани, відновлені, застосовуючи борогідрид, були охарактеризованими на колонці з пористим графітом. Приклад 7: Димеризація rhАСЕ2 АСЕ2, вироблений згідно з прикладом 1, отримували як димер та аналізували у цьому прикладі як такий без відокремлення димерів. Нативне лікування означає, що димер залишався незайманим, на відміну до аналізу денатурації (Фіг. 3). Термін "димеризація АСЕ2" означає, що усі гідрофобні одиниці білку є спрямованими до внутрішньої частини комплексу, внаслідок чого заряджені залишки, як-то N-зв'язані ланцюги цукру, виступають назовні та сольватують структуру у фізіологічному середовищі, що є також зарядженим. Ця димеризація за допомогою 2+ експресії повністю N-глікозилованого АСЕ2 установлювали у присутності Zn . Димерний комплекс у цьому випадку складається з двох ідентичних субодиниць, котрі є зв'язаними разом електростатично та також не розділяються у фізіологічних розчинах. Це дорівнює секретуванню глікопротеїну кожного разу з 14 високо зарядженими структурами сіалової кислоти на кожній 2+ молекулі АСЕ2, а також 28 структурами сіалової кислоти у димері. Кожна має два атоми Zn у комплексі, що стабілізує структуру. Високий заряд на ланцюгу цукру сольватує молекулу у 11 UA 106869 C2 5 10 15 20 25 30 35 40 45 50 55 60 фізіологічних розчинах та виштовхує асоційовані заряджені домени білку назовні. Спосіб вироблення створено так, щоб виключно димери АСЕ2 були присутніми у кінцевому продукті. Це є можливим внаслідок того, що на створених АСЕ2 є присутніми достатні кількості іонів 2+ 2+ Zn (переважно застосовують 1,5 – 5 мікромолярний Zn ; зокрема, ферментацію можна 2+ проводити при 2,5 – 3,5 мкМ Zn ); тоді наступні етапи обробки проводять у присутності іонів 2+ Zn . У фігурах 14 та 15, димеризацію комплексу АСЕ2 визначають, застосовуючи різні способи. У нативному гель-електрофорезі на поліакриламіді, після проявлення сріблом білок виявляли як одиничну смугу з розміром приблизно 250 кДа. Хроматографія за виключенням за розміром на колонці Zоrbах G-450 у присутності 10 % ацетонітрилу у 220 мМ Nа-фосфатному буфері при рН 7,0 також дає одиничний пік для продукту при часі утримування, відповідному молекулярній масі приблизно 250 кДа. Треба зауважити, що у обох випадках, визначали виключно димеризований білок. Не спостерігали жодної мономерної структури чи агрегатів високої молекулярної маси. Приклад 8: димери АСЕ2 – відмінності від зв'язаного з мембраною АСЕ2 АСЕ2 експресується як трансмембраний білок в усіх вищих видах, перед усім у клітинах легень, нирок, печінки та серця, як суттєвий фермент у системі ренін-ангіотензин. Зв'язаний з мембраною АСЕ2 оточується у природі у мембрани ліпідним подвійним шаром з іншими мембранними білками, котрі стабілізують АСЕ2 в активній конформації та також захищають екстрацелюлярні домени АСЕ2 від протеолітичного розкладання. Для посилення фармакологічних властивостей розчинного АСЕ2 та особливо активності та стабільності розчинного білку, вибирали стратегію експресії та вироблення, що дає виключно стабільні димерні структури АСЕ2. Це є перед усім С-термінальним доменом білку та його посттрансліційною модифікацією, що по суті відповідає за димеризацію. Для підкреслення особливості димерної структури АСЕ2, структуру зв'язаного з мембраною АСЕ2 аналізували, застосовуючи нативну РАGЕ та АСЕ2-специфічне Вестерн-блотування (Фіг. 16). Сліди А та В показують екстракти клітин (кори та мозку) та слід С показує екстракт клітин клону для вироблення димерів АСЕ2, виробленого згідно з прикладом 1. Зв'язаний з мембраною продукт тут має набагато нижчу молекулярну масу у порівнянні з продуктом експресії прикладу 1 (С та D), хоча перший складається тільки з екстрацелюлярної частини. Це свідчить, що зв'язаний з мембраною АСЕ2 є мономером. З іншого боку, продукт експресії складається з димерів, котрі дають продукт із фармакологічними перевагами. У сліді D аналізують очищений кінцевий продукт. Він має тільки одиничну смугу з молекулярною масою приблизно 240 кДа. Приклад 9: Поліпшені фармакологічні властивості димерів АСЕ2 АРN 01 позначає композицію фізіологічного білку АСЕ2, що складається виключно з димерних структур АСЕ2. Два мономери АСЕ2 у цьому випадку утворюють нековалентно зв'язані комплекси. Молекулярні біологічні констракти, експресію лінії клітин, спосіб ферментації, очистку та буфер для зберігання та застосування вибирають або складають так, щоб кінцевий продукт містив виключно стабільні димери АСЕ2. Димер не агрегується до більших комплексів і не дисоціює у фізіологічних умовах на мономери. Y Фіг. 15 (аналітична SЕС-ВЕРХ-хроматограма: АРN 01 порівнювали зі стандартом для розділення за розміром (ВіоRАD GF-стандарт, синя крива). Умови перебігу: колонка: Zоrbах GF250, буфер: 220 мМ Nа2НРО4+10 % СН3СN, рН 8,0 при 1 мл/хвилин). АРN 01 елювався у формі одиничного піку через 8,6 хвилин, цей час утримування є між часом тироглобуліну (680 кДа, час утримування 7,4 хвилин) та гамма глобуліном корів (158 кДа, час утримування 8,9 хвилин). Розрахована молекулярна мас цього комплексу є приблизно 214 кДа. Це приблизно відповідає очікуваній молекулярній масі двох АСЕ2 одиниць, кожна по 102 кДа. Для порівняння, мономери АСЕ2 у клітинах СНО були виробленими як реперний матеріал, котрий також аналізували, застосовуючи SЕС-ВЕРХ. Його хроматограма показана у Фіг. 17. Мономерна форма елюється з часом утримування 9,0 хвилин, що відповідає молекулярній масі приблизно 110 кДа. Обидва продукти також порівнювали, застосовуючи РАGЕ (дивись Фіг. 18а). Тоді як АРN 01 (А) мав смугу білку з молекулярною масою приблизно 240 кДа, мономерна форма (В) виявлялася при приблизно 100 кДа. АСЕ2-специфічне Вестерн-блотування встановило ідентичність обох продуктів, як можна бачити у Фіг. 18b. Обидва продукти виявили ідентичну специфічну активність ферменту, що вимірювали, застосовуючи тест на активність, застосовуючи флуоресцентно мічений субстрат. Як можна бачити у Фіг. 19, криві для тої ж концентрації ферменту мономерної та димерної форм накладаються одна на одну. Для порівнювання фармакологічних властивостей обох продуктів, обидва препарати були застосовуваними до мишей В1-6 мишей інтраперитонеально як болюсні ін'єкції по 2,5 мг/кг та активність ферменту АСЕ2 у зразках сироватки вимірювали через 24 та 48 годин (дивись Фіг. 12 UA 106869 C2 5 10 20). Концентрацію білку доводили так, щоб кожна тварина отримувала 100 мкл фізіологічного розчину білку. Кожного разу 7 тварин обробляли АРN 01 (димер АСЕ2) та 5 тварин мономером АСЕ2. Тоді як перед застосуванням АСЕ2, активність АСЕ2 не можна було виміряти у будьякому зі зразків сироватки, після застосування системну активність АСЕ2 вимірювали в усіх випадках. Як раз через 24 годин після застосування, обидві групи значно відрізнялися (t тест, р < 0,001): тоді як тварини, котрих лікували димером АСЕ2, мали активність, відповідну концентрації АСЕ2 0,9 мкг/мл, активність, відповідна концентрація 0,2 мкг/мл була знайдена тільки в одної тварини у групі, котра отримувала мономерний АСЕ2. Через 48 годин, у групі, котра отримала гомодимер АСЕ2, було ще 0,2 мкг/мл активності, тоді як у групі, що отримала мономер, не можна було визначити більше системної активності АСЕ2. Ці дані показують, що димерна форма АСЕ2 має дуже значні фармакологічні переваги. 13 UA 106869 C2 14 UA 106869 C2 ФОРМУЛА ВИНАХОДУ 5 10 1. Рекомбінантний, глікозилований, розчинний людський димерний поліпептид АСЕ2, де димер АСЕ2 включає дві мономерні одиниці АСЕ2, які є зв’язаними за допомогою нековалентного зв’язку, причому поліпептидний ланцюг АСЕ2 складається з амінокислот 18-740 послідовності SЕQ ІD NО: 1 або включає послідовність SЕQ ІD NО: 1 або їх ферментативно активні фрагменти. 2. Рекомбінантний поліпептид АСЕ2 за п. 1, що є присутнім у формі гомодимеру. 3. Рекомбінантний поліпептид АСЕ2 за п. 1 або пунктом 2, де димер містить два іони цинку. 15 UA 106869 C2 5 10 4. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-3, де АСЕ2 поліпептид не має трансмембранних доменів. 5. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-4, який відрізняється тим, що є глікозилованим, де глікольні групи мономера поліпептиду АСЕ2 містять сумарно принаймні 14 залишків сіалової кислоти. 6. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-5, який відрізняється тим, що він є глікозилованим у принаймні 80 % з можливих сайтів N-глікозилування та має частку цукру більше ніж 10 % (мас. % відносно цілої молекули АСЕ2), переважно більше ніж 15 %, особливо переважно більше ніж 20 %. 7. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-6, який відрізняється тим, що принаймні 70 % глікозилованих сайтів N-глікозилування мають структуру, незалежно один від одного, вибрану з формул 1-8: (формула 1), (формула 2), (формула 3), (формула 4), (формула 5), (формула 6), (формула 7), (формула 8), де: . 15 20 25 30 8. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-7, який відрізняється тим, що усі можливі сайти N-глікозилування є глікозилованими. 9. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-8, який відрізняється тим, що одна мономерна одиниця димеру АСЕ2 має молекулярну масу принаймні 90 кДа, переважно принаймні 92 кДа, особливо переважно принаймні 94 кДа, особливо переважно принаймні 96 кДа, ще більш переважно принаймні 98 кДа та найбільш переважно принаймні 101 кДа. 10. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-9, який відрізняється тим, що серин, який відповідає Sеr740 SЕQ ІD NО: 1, є О-глікозилованим. 11. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-10, який відрізняється тим, що принаймні 70 %, переважно принаймні 80 %, особливо принаймні 90 %, найбільш переважно 100 % глікозилованих сайтів N-глікозилування містять сіалові кислоти, та переважно сайти Nглікозилування, що відповідають Аsn53, Аsn90, Аsn103, Аsn322, Аsn432, Аsn546, Аsn690 SЕQ ІD NО: 1, є сіалізованими. 12. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-11, який відрізняється тим, що принаймні 30 %, переважно принаймні 40 %, особливо принаймні 55 %, найбільш переважно принаймні 70 % глікозилованих сайтів N-глікозилування містять принаймні дві сіалові кислоти. 13. Рекомбінантний поліпептид АСЕ2 за будь-яким з пп. 1-12, який відрізняється тим, що один аспарагін, вибраний з групи, яка відповідає Asn53, Asn90, Asn103, Asn322, Asn432, Asn546 та 16 UA 106869 C2 5 10 15 20 25 30 35 Asn690 SЕQ ІD NО: 1, є N-глікозилованим, переважно за допомогою глікану зі структурою у відповідності із формулою 1, 2, 3, 4, 5, 6, 7 або 8, як визначено у п. 7. 14. Препарат, що містить рекомбінантні, глікозиловані, розчинні людські димерні поліпептиди АСЕ2 за будь-яким з пп. 1-13, який відрізняється тим, що фракція АСЕ2 поліпептидів з молекулярною вагою менше 119 кДа, як визначено за допомогою гель-електрфорезу, складає менше 20 %. 15. Препарат за п. 14, який відрізняється тим, що фракція АСЕ2 поліпептидів з трансмембранними доменами складає менше ніж 20 %, переважно менше ніж 10 %, особливо переважно менше ніж 5 %, найбільш переважно менше ніж 1 % та, зокрема, 0 %. 16. Препарат за п. 14 або за п. 15, який відрізняється тим, що фракція АСЕ2 мультимерів складає менше ніж 20 %. 17. Препарат за п. 16, який відрізняється тим, що фракція АСЕ2 мультимерів складає менше ніж 5 %, найбільш переважно менше ніж 1 %. 18. Препарат за будь-яким з пп. 14-17, який відрізняється тим, що частка АСЕ2 димерів молекул АСЕ2 складає принаймні 70 %, переважно принаймні 80 %, особливо переважно принаймні 90 %, дуже переважно принаймні 95 % та найбільш переважно принаймні 99 %. 19. Препарат за будь-яким з пп. 14-18, який відрізняється тим, що фракція АСЕ2 поліпептидів з N-глікозилованим аспарагіном, вибраним з групи, яка відповідає Asn53, Asn90, Asn103, Asn322, Asn432, Asn546 та Asn690 SЕQ ІD NО: 1, складає більше 60 %, переважно більше 70 %, особливо переважно більше 80 %, дуже переважно більше 90 %, найбільш переважно 99 %, зокрема 100 %, та переважно з гліканом, який має структуру у відповідності з формулою 1, 2, 3, 4, 5, 6, 7 або 8, як визначено у п. 7. 20. Препарат за будь-яким з пп. 14-19, який відрізняється тим, що фракція АСЕ2 поліпептидів з N-глікозилованим серином, що відповідає Ser740 послідовності SEQ ID NO: 1, складає більше 60 %, переважно більше 70 %, особливо переважно більше 80 %, дуже переважно більше 90 %, найбільш переважно 99 %, зокрема 100 %. 21. Препарат за будь-яким з пп. 14-20, який відрізняється тим, що частка АСЕ2 мономерів складає менше 20 %, переважно менше 10 %, переважно менше 5 %, найбільш переважно менше 1 % присутніх молекул АСЕ2. 22. Рекомбінантний, глікозилований, розчинний людський димерний поліпептид АСЕ2 або -1 препарат за будь-яким з пунктів 1-21 з каталітичною активністю ссаt принаймні 4 с , переважно -1 -1 -1 принаймні 5 с , особливо переважно принаймні 6 с , більш переважно принаймні 7 с , -1 найбільш переважно принаймні 7,6 с стосовно перетворення Аng ІІ (ангіотензин ІІ) у Аng 1-7 (ангіотензин 1-7). 23. Лікарський засіб, який включає рекомбінантний, димерний поліпептид АСЕ2, як визначено у будь-якому з пунктів 1-13 або 22, або препарат, як визначено у будь-якому з пунктів 14-22. 17 UA 106869 C2 18 UA 106869 C2 19 UA 106869 C2 20 UA 106869 C2 21 UA 106869 C2 22 UA 106869 C2 23 UA 106869 C2 24 UA 106869 C2 25 UA 106869 C2 26 UA 106869 C2 27 UA 106869 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAce2 polypeptide
Автори російськоюSchuster, Manfred, Loibner, Hans, Janzek-Hawlat, Evelyne, Peball, Bernhard, Stranner, Stefan, Wagner, Bettina, Weik, Robert
МПК / Мітки
МПК: C12N 9/64, A61K 38/48
Мітки: поліпептид
Код посилання
<a href="https://ua.patents.su/34-106869-polipeptid-ace2.html" target="_blank" rel="follow" title="База патентів України">Поліпептид ace2</a>
Попередній патент: Уніфікована телекомунікаційна система диспетчерського контролю та автоматизованого керування гірничими машинами та технологічними комплексами
Наступний патент: Антитіла, специфічні для протофібрилярної форми бета-амілоїдного білка
Випадковий патент: Накриття вантажу, що перевозиться