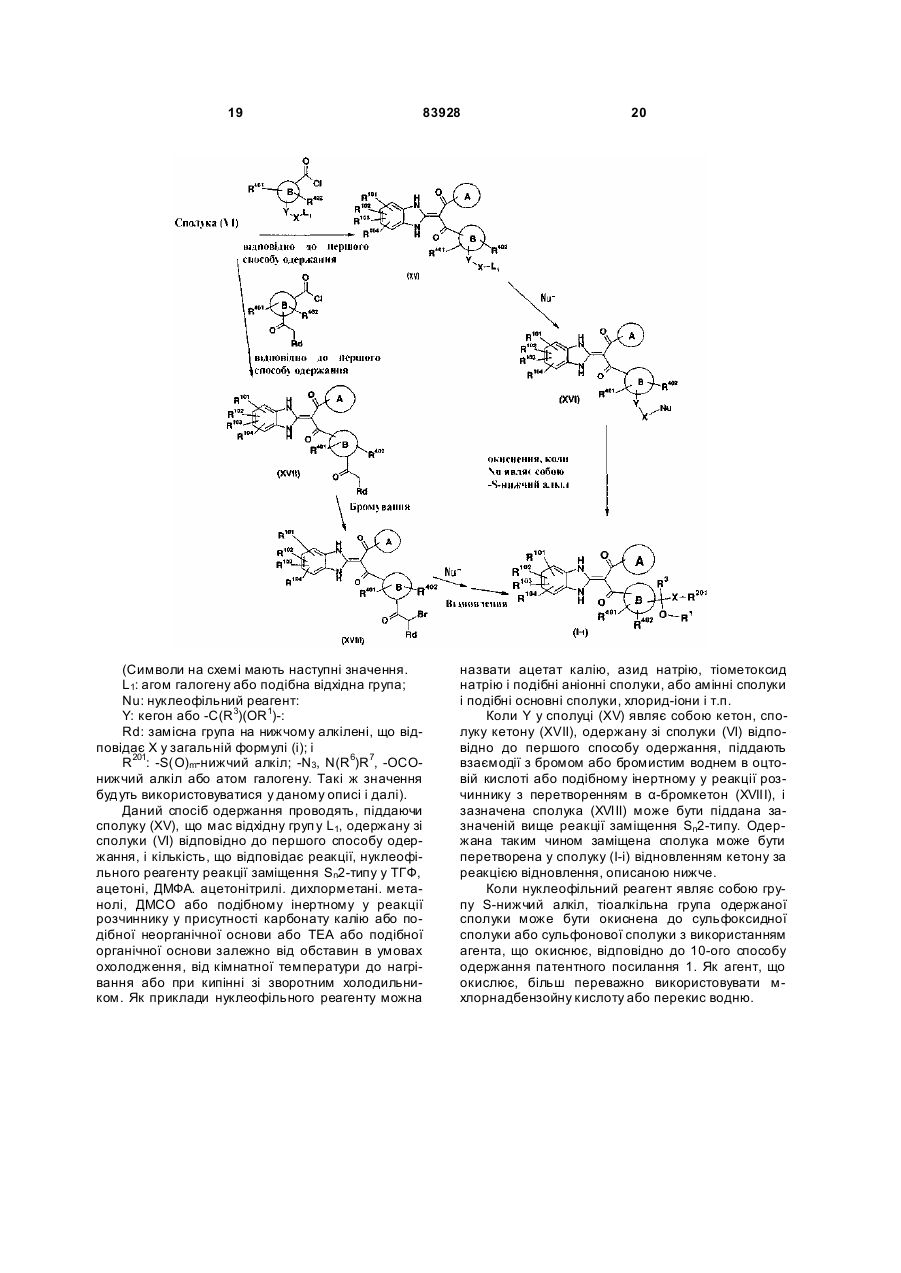
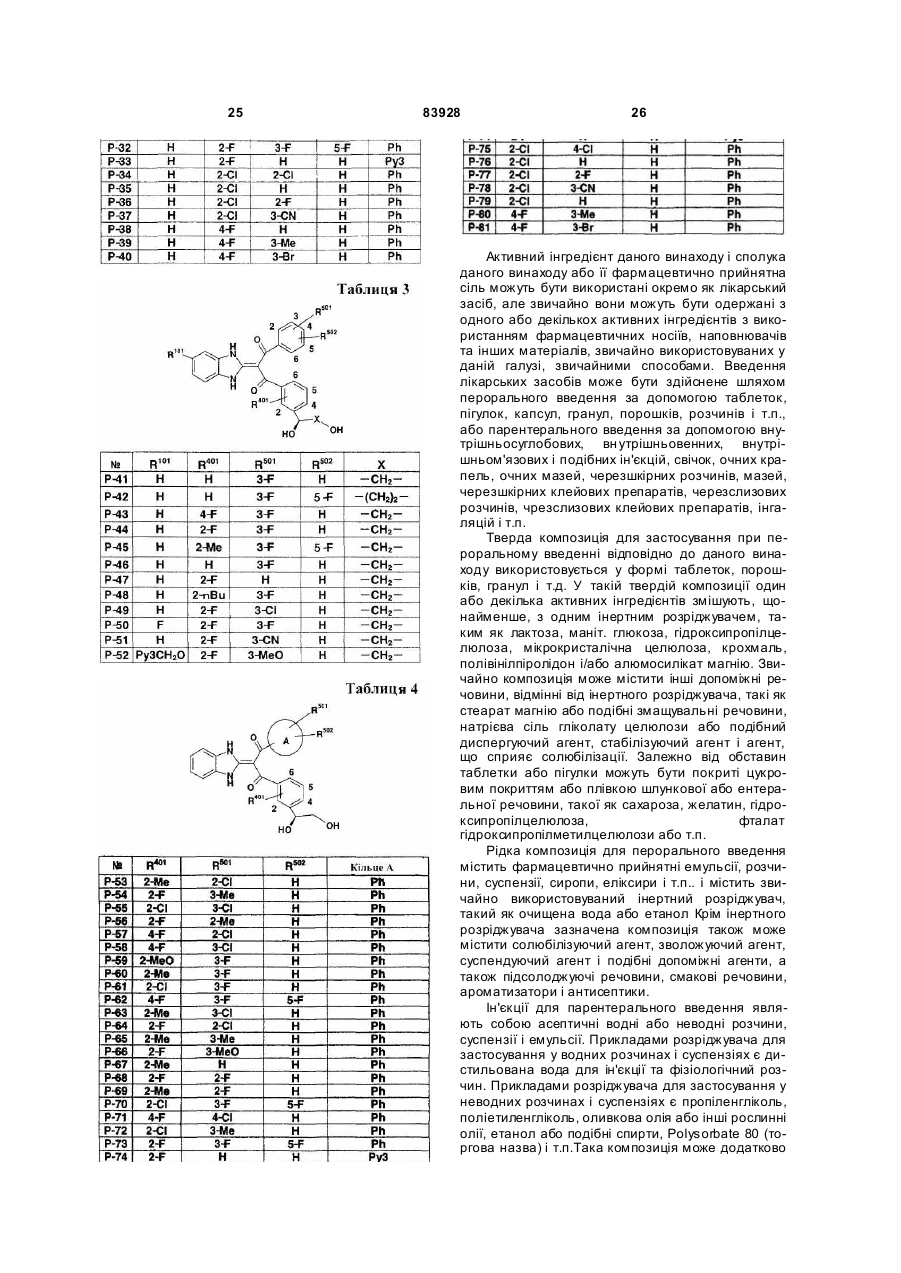
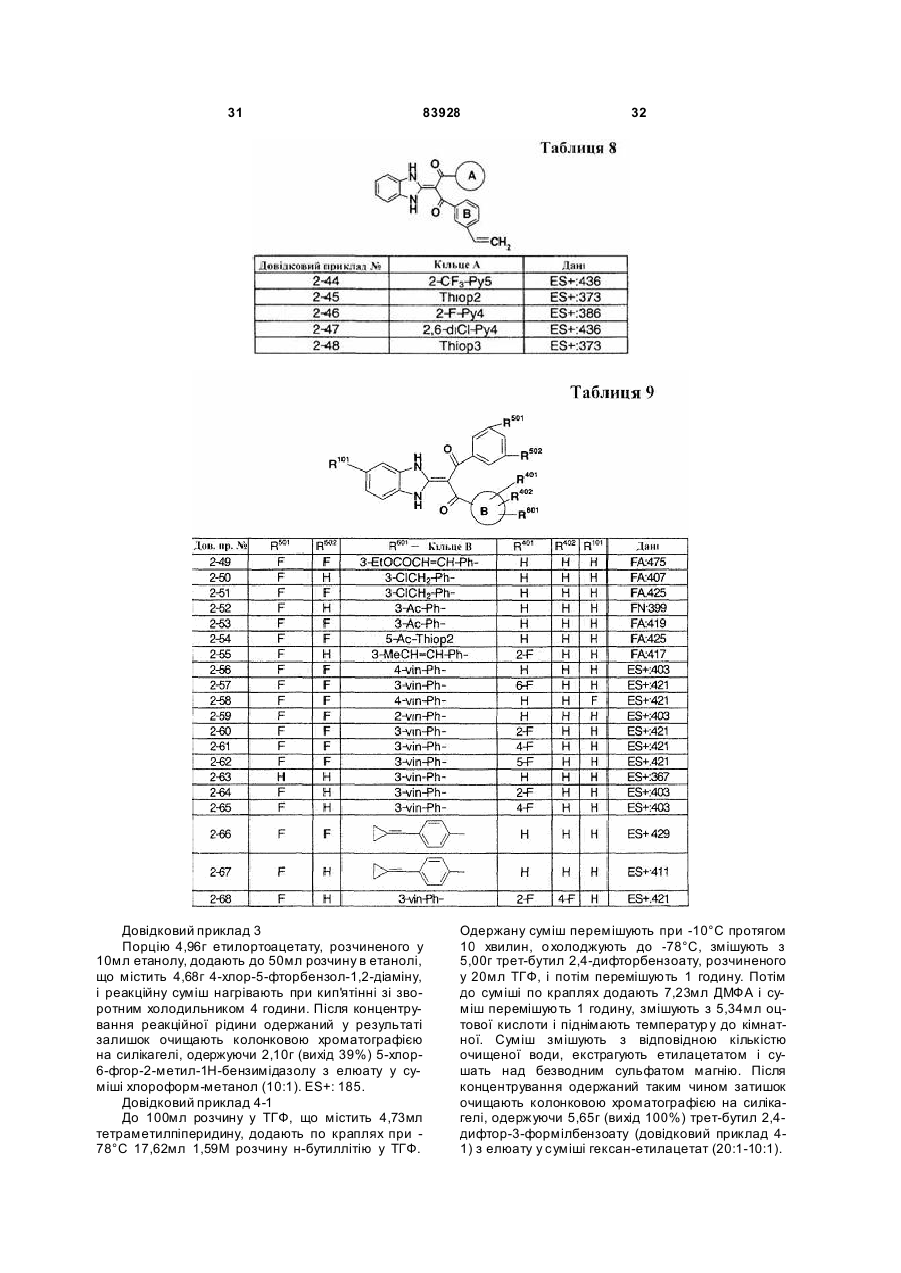
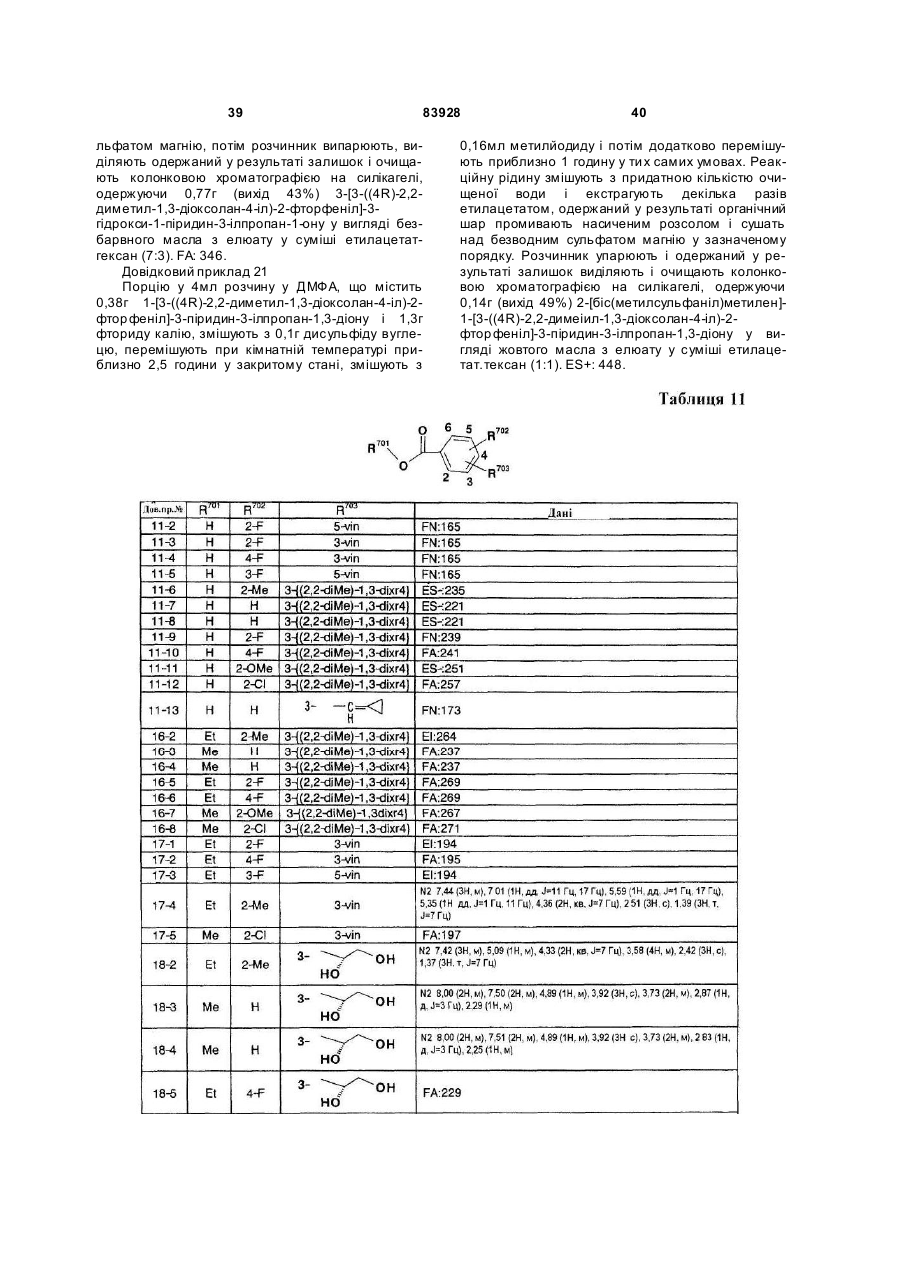
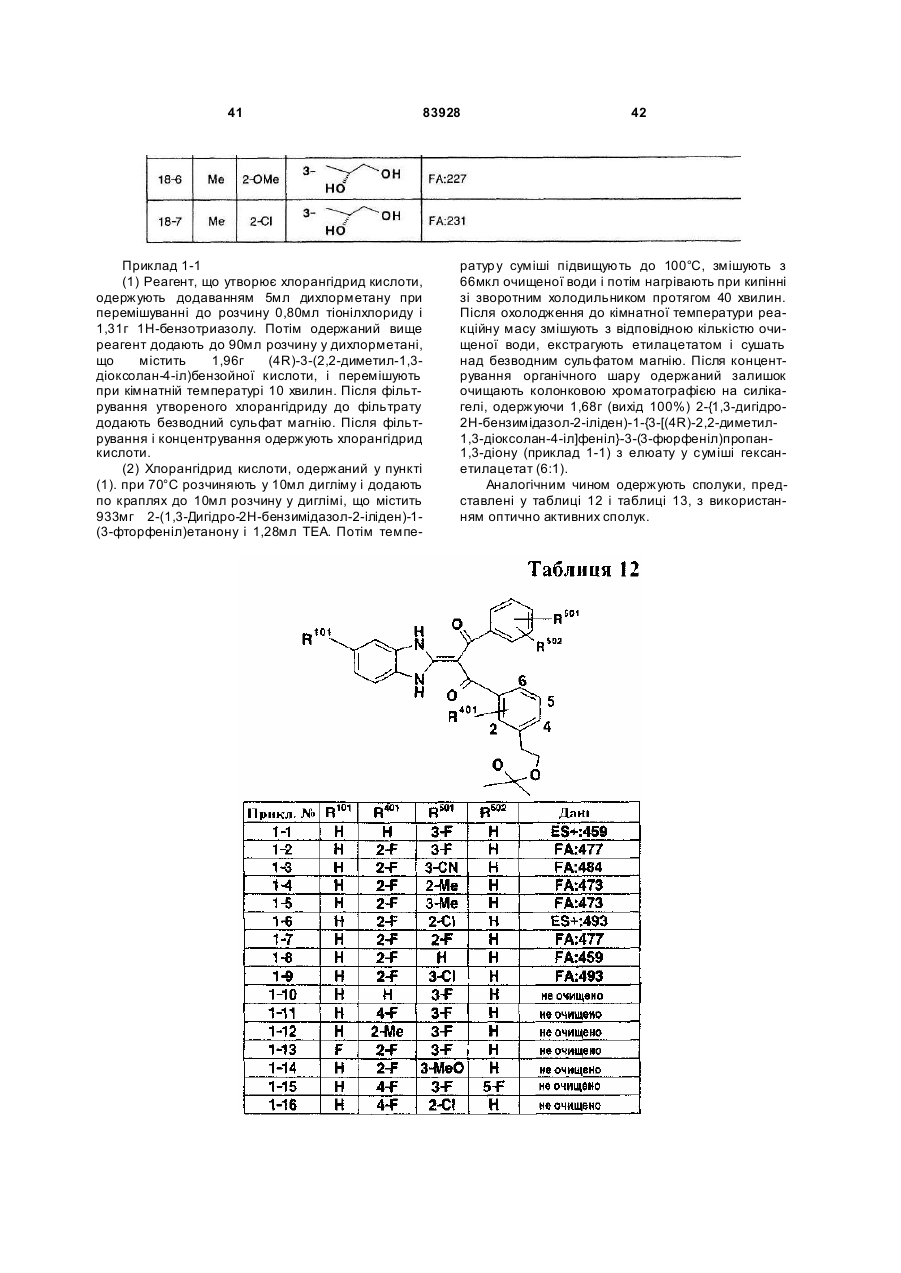
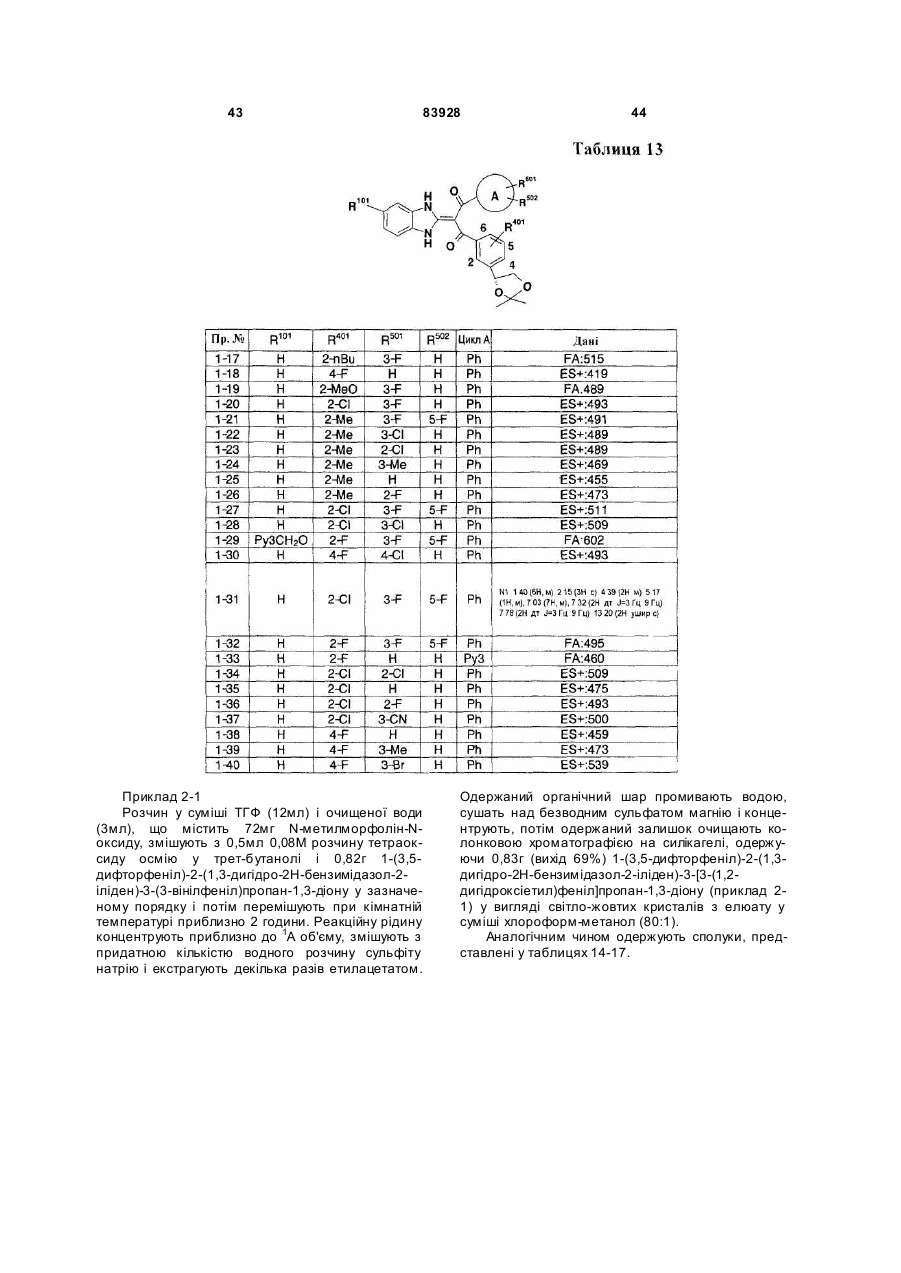
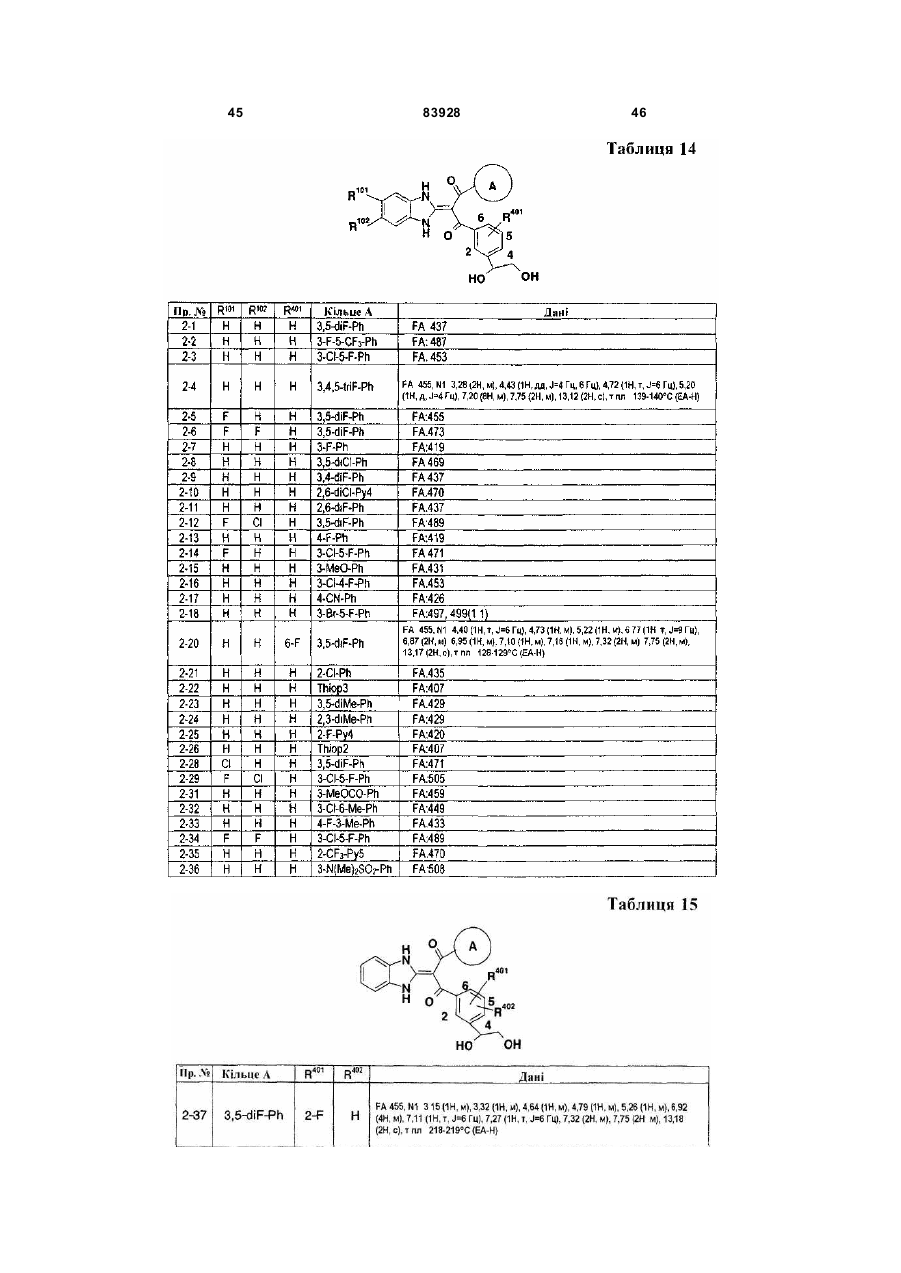
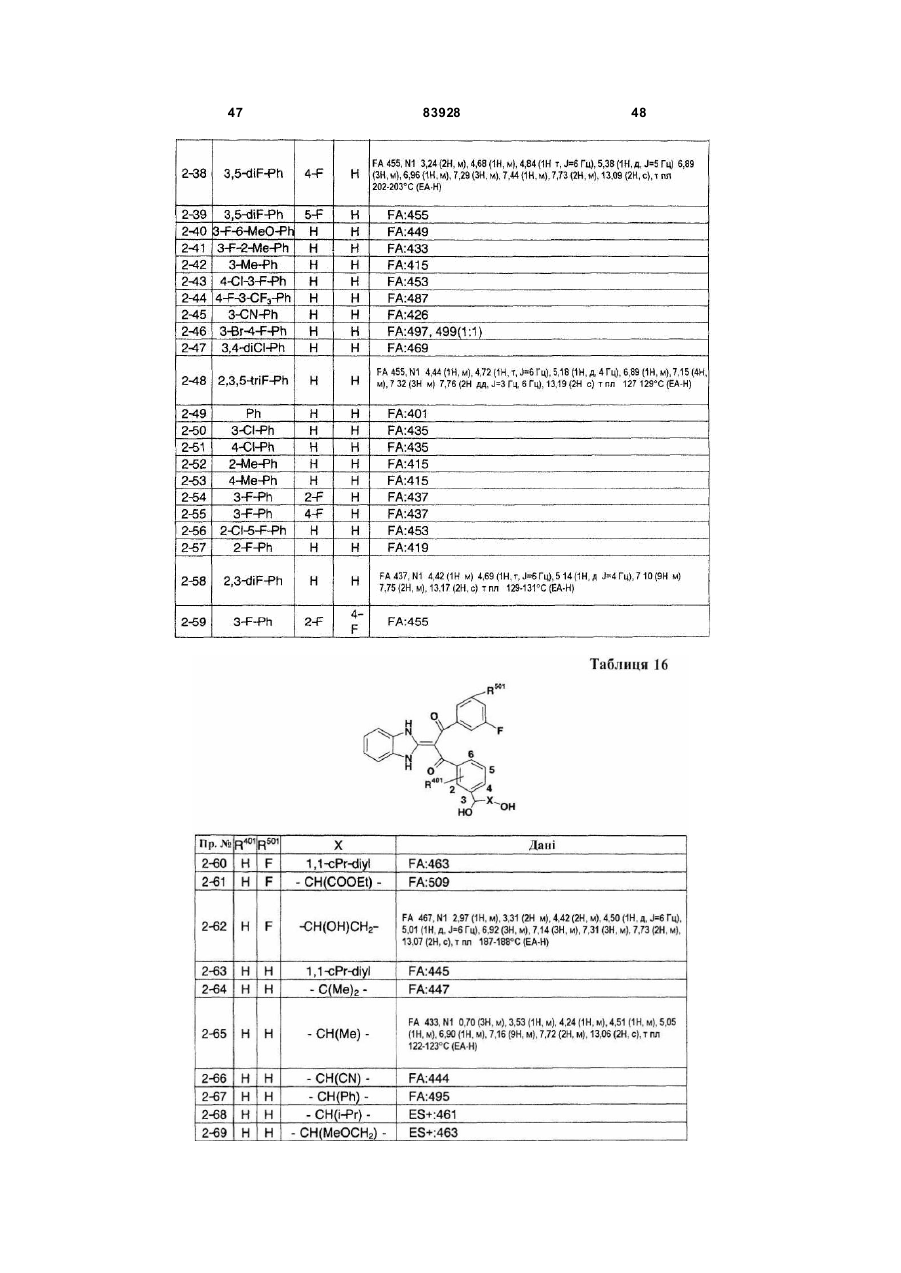
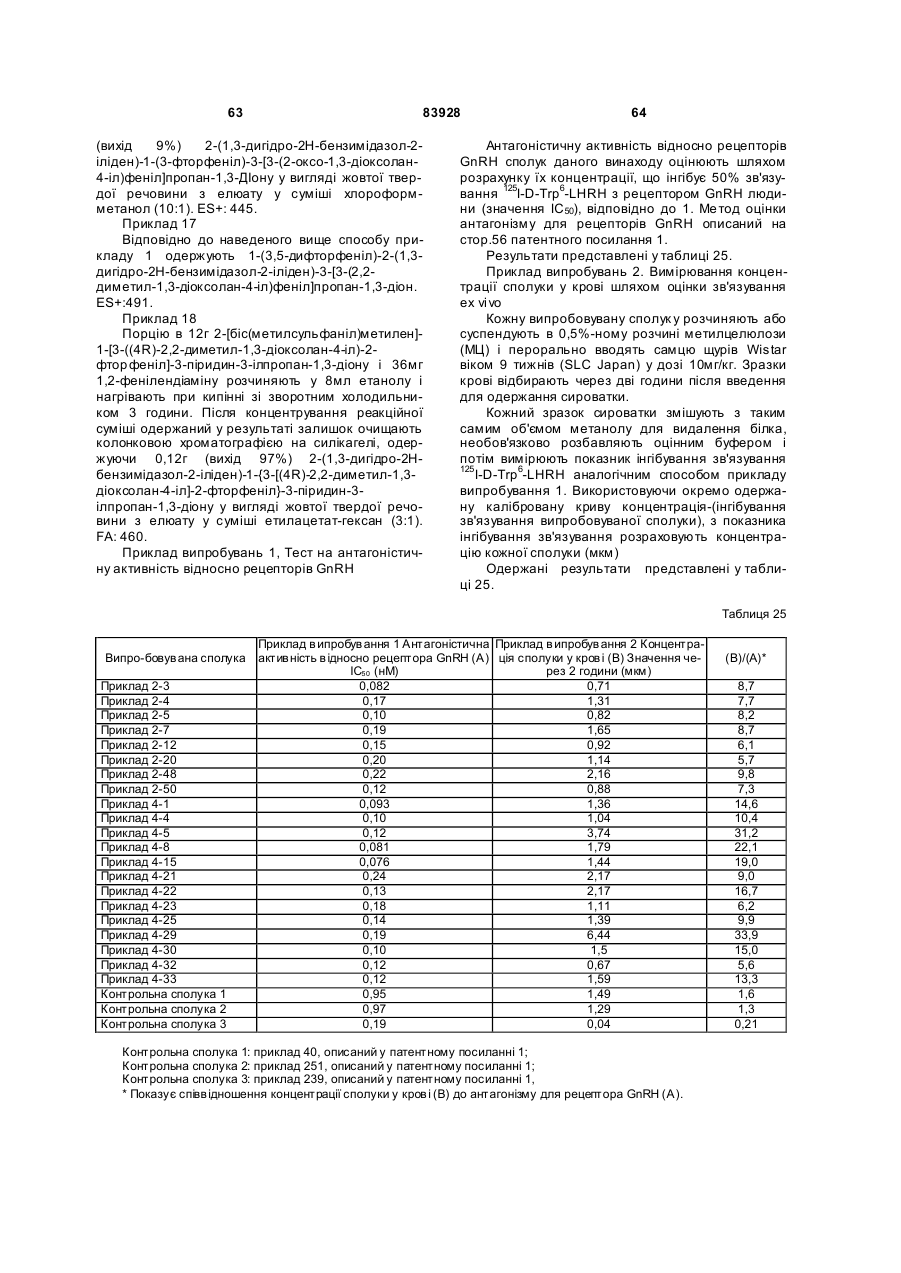
Похідне пропан-1,3-діону або його сіль
Номер патенту: 83928
Опубліковано: 26.08.2008
Автори: Мацумото Сунітіро, Обіцу Казуйосі, Хірано Масаакі, Охнукі Кей, Кінояма Ісао, Кусаяма Тосіюкі, Кавамінамі Ейдзі
Формула / Реферат
1. Похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятна сіль,
 , (I)
, (I)
де символи у формулі означають наступне:
кільце А: бензол, що може бути заміщений, піридин, що може бути заміщений, або тіофенове кільце;
кільце В: бензольне або тіофенове кільце;
R1: Н або -СО-нижчий алкіл;
R2: Н, -О-R5, -N(R6)R7, -N3, -S(O)m-нижчий алкіл, -S(O)m-N(R6)R7, атом галогену, піридил або імідазоліл, які можуть бути заміщені;
R5: Н, нижчий алкіл, -СО-нижчий алкіл, що може бути заміщений, або -СО-O-нижчий алкіл, що може бути заміщений;
R6 і R7: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, нижчий алкіл або -СО-нижчий алкіл, за умови, що R1 і R2 разом можуть утворювати діоксолан, що може бути заміщений;
m: 0, 1 або 2;
R3: Н або нижчий алкіл;
R401 і R402: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену, ОН, -O-нижчий алкіл або нижчий алкіл;
X: зв'язок, нижчий алкілен, що може бути заміщений, або циклоалкандіїл;
R101, R102, R103 і R104: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену, ОН або -O-нижчий алкіл, що може бути заміщений (арилом або гетероарилом).
2. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п. 1, де кільце А являє собою бензольне кільце, що може бути заміщене атомом галогену або нижчим алкілом, кільце В являє собою бензольне кільце, R1 являє собою Н, R2 являє собою ОН, R3 являє собою Н і Х являє собою нижчий алкілен, що може бути заміщений.
3. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п. 2, де Х являє собою метилен, що може бути заміщений.
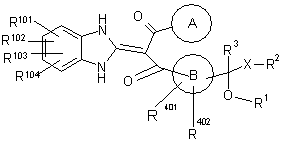
4. Похідне пропан-1,3-діону, представлене загальною формулою (Іа), або його фармацевтично прийнятна сіль,
 , (Ia)
, (Ia)
де символи у формулі мають наступні значення:
R801, R802 і R803: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою атом водню, атом галогену або нижчий алкіл, і
R403 і R404: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену або нижчий алкіл; і
R101, R102, R103 і R104: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену, ОН або -O-нижчий алкіл, що може бути заміщений (арилом або гетероарилом).
5. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п. 4, які являють собою щонайменше одну сполуку, вибрану з групи, що включає:
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-[3-(1,2-дигідроксіетил)феніл]-3-(3,4,5-трифторфеніл)пропан-1,3-діон;
1-{2-бутил-3-[(1R)-1,2-дигідроксіетил]феніл}-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)пропан-1,3-діон;
1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-[5-(1,2-дигідроксіетил)-2-фторфеніл]пропан-1,3-діон;
1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-{3-[(1R)-1,2-дигідроксіетил]-2-метилфеніл}пропан-1,3-діон;
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)-1,2-дигідроксіетил]-2-метилфеніл}-3-(2-фторфеніл)пропан-1,3-діон;
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-[3-(1,2-дигідроксіетил)феніл]-3-(2,3,5-трифторфеніл)пропан-1,3-діон;
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)-1,2-дигідроксіетил]-2-метилфеніл}-3-(3-метилфеніл)пропан-1,3-діон;
1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)пропан-1,3-діон;
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)-1,2-дигідроксіетил]феніл}-3-(3-фторфеніл)пропан-1,3-діон;
1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-[3-(1,2-дигідроксіетил)-2-фторфеніл]пропан-1,3-діон;
1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-[3-(1,2-дигідроксіетил)-4-фторфеніл]пропан-1,3-діон;
1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)пропан-1,3-діон;
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)-1,2-дигідроксіетил]-2-фторфеніл}-3-(3-фторфеніл)пропан-1,3-діон;
1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-3-(3-хлорфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)пропан-1,3-діон.
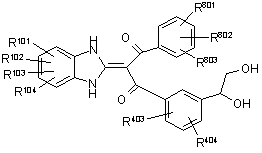
6. Похідне пропан-1,3-діону, представлене загальною формулою (Іb), або його фармацевтично прийнятна сіль,
 , (Іb)
, (Іb)
де символи у формулі означають наступне:
R8 і R9: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, нижчий алкіл, нижчий алкеніл або -O-нижчий алкіл;
R801, R802 i R803: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою атом водню, атом галогену або нижчий алкіл, і
R403 i R404: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену або нижчий алкіл; і
R101, R102, R103 і R104: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену, ОН або -O-нижчий алкіл, що може бути заміщений (арилом або гетероарилом).
7. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п. 6, де R801, R802 і R803 можуть бути однаковими або відрізняються один від одного і кожний являє собою Н або атом галогену.
8. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п. 7, які являють собою щонайменше одну сполуку, вибрану з групи, що включає:
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-(3-фторфеніл)-3-[3-(2-метокси-1,3-діоксолан-4-іл)феніл]пропан-1,3-діон;
2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-(3-фторфеніл)-3-[3-(2-метокси-2-метил-1,3-діоксолан-4-іл)феніл]пропан-1,3-діон,
або їх фармацевтично прийнятну сіль.
9. Фармацевтична композиція, що містить як активний інгредієнт похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятну сіль за п. 1 і фармацевтично прийнятний носій.
10. Фармацевтична композиція за п. 9, що являє собою антагоніст рецептора GnRH.
11. Фармацевтична композиція за п. 10, що являє собою антагоніст рецептора GnRH, для лікування раку простати, раку грудей, ендометріозу, маткової лейоміоми і доброякісної гіпертрофії передміхурової залози.
Текст
1. Похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятна сіль, C2 2 (19) 1 3 83928 3. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п.2, де Х являє собою метилен, що може бути заміщений. 4. Похідне пропан-1,3-діону, представлене загальною формулою (Іа), або його фармацевтично прийнятна сіль, R801 R101 R102 R 103 R104 H N N H О R802 R803 О OH OH 4 1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)1,2-дигідроксіетил]-2-фторфеніл}-3-(3фтор феніл)пропан-1,3-діон; 1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-3-(3хлорфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)пропан-1,3-діон. 6. Похідне пропан-1,3-діону, представлене загальною формулою (Іb), або його фармацевтично прийнятна сіль, R 801 R403 R404 , (Ia) де символи у формулі мають наступні значення: R801, R802 і R803: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою атом водню, атом галогену або нижчий алкіл, і R403 і R404: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену або нижчий алкіл; і R101, R102, R103 і R104 : можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену, ОН або -O-нижчий алкіл, що може бути заміщений (арилом або гетероарилом). 5. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п.4, які являють собою щонайменше одну сполуку, вибрану з групи, що включає: 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-[3-(1,2дигідроксіетил)феніл]-3-(3,4,5трифторфеніл)пропан-1,3-діон; 1-{2-бутил-3-[(1R)-1,2-дигідроксіетил]феніл}-2-(1,3дигідро-2Н-бензімідазол-2-іліден)-3-(3фтор феніл)пропан-1,3-діон; 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-[5-(1,2-дигідроксіетил)-2фтор феніл]пропан-1,3-діон; 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-{3-[(1R)-1,2дигідроксіетил]-2-метилфеніл}пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)1,2-дигідроксіетил]-2-метилфеніл}-3-(2фтор феніл)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-[3-(1,2дигідроксіетил)феніл]-3-(2,3,5трифторфеніл)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)1,2-дигідроксіетил]-2-метилфеніл}-3-(3метилфеніл)пропан-1,3-діон; 1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-2-(1,3дигідро-2Н-бензімідазол-2-іліден)-3-(3фтор феніл)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-{3-[(1R)1,2-дигідроксіетил]феніл}-3-(3-фторфеніл)пропан1,3-діон; 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-[3-(1,2-дигідроксіетил)-2фтор феніл]пропан-1,3-діон; 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-[3-(1,2-дигідроксіетил)-4фтор феніл]пропан-1,3-діон; R 101 R 102 R 103 R 104 H N N H О R 802 R 803 О R 403 O R O R404 R 9 8 , (Іb) де символи у формулі означають наступне: R8 і R9: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, нижчий алкіл, нижчий алкеніл або -O-нижчий алкіл; R801, R802 i R803: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою атом водню, атом галогену або нижчий алкіл, і R403 i R404: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену або нижчий алкіл; і R101, R102, R103 і R104 : можуть бути однаковими або відрізняються один від одного і кожний з них являє собою Н, атом галогену, ОН або -O-нижчий алкіл, що може бути заміщений (арилом або гетероарилом). 7. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п.6, де R801, R802 і R803 можуть бути однаковими або відрізняються один від одного і кожний являє собою Н або атом галогену. 8. Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п.7, які являють собою щонайменше одну сполуку, вибрану з групи, що включає: 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-(3фтор феніл)-3-[3-(2-метокси-1,3-діоксолан-4іл)феніл]пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-1-(3фтор феніл)-3-[3-(2-метокси-2-метил-1,3-діоксолан4-іл)феніл]пропан-1,3-діон, або їх фармацевтично прийнятну сіль. 9. Фармацевтична композиція, що містить як активний інгредієнт похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятну сіль за п.1 і фармацевтично прийнятний носій. 10. Фармацевтична композиція за п.9, що являє собою антагоніст рецептора GnRH. 11. Фармацевтична композиція за п.10, що являє собою антагоніст рецептора GnRH, для лікування раку простати, раку гр удей, ендометріозу, маткової лейоміоми і доброякісної гіпертрофії передміхурової залози. 5 83928 Даний винахід стосується нового похідного пропан-1,3-діону, яке корисне як лікарський засіб, зокрема як терапевтичний агент для захворювань, що залежать від статевих гормонів. Відомо, що гормон гіпоталамуса або гормон гіпофіза пов'язаний з механізмом, що контролює виділення периферичних гормонів. У загальному випадку секреція гормонів передньої частки гіпофіза контролюється за допомогою гормону, що прискорює секрецію, або гормону, що інгібує секрецію, які виділяються з його дальнього центрального гіпоталамуса, або за допомогою периферичного гормону, який виділяється з органа-мішені відповідного гормону. Гормон, що вивільняє гонадотропін, (який позначається далі як GnRH, і GnRH також називають фактором, що вивільняє лютеїнізуючий гормон, LHRH) відомий як гормон, що контролює секрецію статевих гормонів при найбільш високому положенні і контролює секрецію гормонів передньої частки гіпофіза лютеїнізуючого гормону (що далі позначається як LH) і фолікулостимулюючого гормону (що далі позначається FSH), а також статевих гормонів у ста тевих залозах, за допомогою рецептора, який є присутнім у передній частці гіпофіза (що далі називається рецептором GnRH) (Hormone To Rinsho (Hormone and Clinics), спеціальний номер джерела, 46, 46-57 (1998)). Оскільки антагоністи, специфічні і селективні для такого рецептора GnRH, регулюють дію GnRH і контролюють секрецію підпорядкованих LH і FSH. а також статевих гормонів, вони розглядаються як профілактичні або терапевтичні агенти для захворювань, що залежать від статевих гормонів (див. наведений вище Hormone and Clinics, спеціальний номер джерела (1998)). На сьогоднішній день як антагоністи рецептора GnRH на ринку представлені пептидні сполуки цетрорелікс (непатентне посилання 1) і абарелікс (непатентне посилання 2). Альтернативно, як непептидні сполуки, що володіють антагонізмом відносно рецепторів GnRH, у наш час клінічні випробування проходять похідне тіенопіримідину TAK-013 (непатентне посилання 3) і похідне урацилу NBI-42902 (непатентне посилання 4). Крім того, у патентному посиланні 1 розкрито, що похідне пропан-1,3-ДІону володіє антагоністичною дією відносно рецептора GnRH. (У формулі А і В можуть бути однаковими або відрізняються один від одного і кожний являє собою арил, що може бути заміщений, або гетероарил, що може бути заміщений. Докладніше див. наведений вище офіційний друкований орган). Незважаючи на те, що сполука, яка містить 1гідроксіалкільну групу як замісну групу у кільці А або у кільці В, включена в об'єм типового концеп 6 туального похідного пропан-1,3-діону, що містить груп у d як замісну груп у у кільцях, у патентному посиланні 1 відсутній ілюстративний опис для зазначеної сполуки [[Непатентне посилання 1] Proc. Natl. Acad. ScL USA, 85, 1637-1641, 1988. [Непатентне посилання 2] J. Urol., 167, 16701674, 2002 [Непатетне посилання 3] J. Clin. Endocnnol. Metab . 88, 1697-1704, 2003. [Непатентне посилання 4] J. Med. Chem., 2005, 48, 1169-1178. [Патенте посилання 1] International Pibhcation WO 02/02533]. Проблеми, які вирішує даний винахід Метою даного винаходу є розробка лікарського засобу, що виявляє прекрасну антагоністичну дію відносно рецептора GnRH у живому організмі, особливо розробка нової сполуки, яка корисна як терапевтичний агент при раку простати, доброякісній передміхуровій гіпертрофії і т.д. Способи вирішення проблеми Авторами досліджені похідні пропан-1,3-діону. і у результаті підтверджено, що сполука, яка містить бензольне або тіофенове кільце, заміщене групою, що є похідною 1-гідроксіалкілу, у структурі пропан-1,3-діону, що містить 2-(1,3-дигідро-2Нбензимідазол-2-іліден), несподівано виявляє чудову доступність при пероральному введенні, на додаток до прекрасної антагоністичної дії відносно рецепторів GnRH, за рахунок чого реалізується даний винахід. Тобто, винахід стосується похідного пропан1,3-діону, представленого загальною формулою (І), або його солі. Винахід також стосується лікарського засобу, особливо антагоніста рецептора GnRH, в якому зазначене похідне використовується як активний інгредієнт. [Символи у формулі означають наступне: кільце А: бензол, що може бути заміщений, піридин, що може бути заміщений, або тіофенове кільце; кільце В: бензольне або тіофенове кільце; R1: H або -СО-нижчий алкіл: R2: H, -O-R 5, -N(R6)R7, -N 3, -S(O)m-нижчий алкіл, -S(O)m-N(R6)R7, атом галогену, піридил або імідазоліл, які можуть бути заміщені; R5: H, нижчий алкіл, -СО-нижчий алкіл, що може бути заміщений, або -CO-O-нижчий алкіл, що може бути заміщений; R6 і R7: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою H, нижчий алкіл або -СО-нижчий алкіл, за умови, що R1 і R2 разом можуть утворювати діоксолан, що може бути заміщений: m: 0, 1 або 2; 7 83928 R3, H або нижчий алкіл: R401 і R402 : можуть бути однаковими або відрізняються один від одного і кожний з них являє собою H, атом галогену. OH, -О-нижчий алкіл або нижчий алкіл; X: зв'язок, нижчий алкілен, що може бути заміщений, або циклоалкандіїл: R101, R102, R103 і R104 : можуть бути однаковими або відрізняються один від одного і кожний з них являє собою H, атом галогену, OH або -O-нижчий алкіл, що може бути заміщений (арилом або гетероарилом). Такі ж значення будуть використовуватися у даному описі і далі]. Крім того, даний винахід являє собою фармацевтичну композицію, що містить як активний інгредієнт пропан-1,3-діонову сполуку, представлену наведеною вище загальною формулою (І), або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій, переважно фармацевтичну композицію, що є антагоністом рецептора GnRH; і більш переважно фармацевтичну композицію, де антагоніст рецептора GnRH являє собою агент для лікування пов'язаних з GnRH захворювань, таких як рак простати, рак грудей, ендометріоз, маткова лейоміома і доброякісна гіпертрофія передміхурової залози. Більш того, даний винахід пропонує спосіб лікування пацієнта, який страждає від пов'язаних з GnRH захворювань, що включає введення пацієнту ефективної кількості пропан-1,3-діонової сполуки, представленої наведеною вище формулою (І), або її фармацевтично прийнятної солі, переважно спосіб лікування пов'язаних з GnRH захворювань, де пов'язані з GnRH захворювання являють собою рак простати, рак грудей, ендометріоз, маткову лейоміому і доброякісну гіпертрофію передміхурової залози. Крім того, даний винахід включає застосування пропан-1,3-діонової сполуки для одержання антагоніста рецептора GnRH, що містить як активний інгредієнт пропан-1,3-діонову сполуку, представлену наведеною вище загальною формулою (І), або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій. Оскільки сполука даного винаходу має прекрасну доступність при пероральному введенні, на додаток до сильного антагонізму відносно GnRH рецепторів, можна очікувати, що ця сполука буде здійснювати сильний лікарський вплив у живому організмі і що вона буде корисна при лікуванні захворювань, які залежать від статевих гормонів, особливо GnRH-пов'язаних захворювань, таких як рак простати, рак грудей, ендометріоз і маткова лейоміома [C. Huddins & CV. Hogdes. Cancer Res.. 1, 293-297 (1941); L. Bokser et al., Proc. Natl. Acad. Sci, USA, 87. 7100-7104 (1990)], доброякісна гіпертрофія передміхурової залози [J. CHn. Endocrinol. Metab.. 83, 3826-3931, 1998] і т.д. Крім того, оскільки сполука даного винаходу володіє прекрасрюю метаболічною стабільністю в організмі людини і має незначні властивості лікарської взаємодії, зазначена сполука має більш бажані властивості як лікарський засіб, що використовується у випадку перерахованих вище захворювань. 8 Найбільш переважний спосіб здійснення винаходу Переважні варіанти здійснення винаходу представлені нижче. (1) Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль, де у загальній формулі (І) кільце А являє собою бензольне кільце, що може бути заміщене атомом галогену або нижчим алкілом, кільце В являє собою бензольне кільце, R1 являє собою H, R2 являє собою OH, R3 являє собою H, і X являє собою нижчий алкілен, що може бути заміщений. (2) Похідне пропан-1,3-діону формули (І) або його фармацевтично прийнятна сіль, де X являє собою метилен, що може бути заміщений. (3) Похідне пропан-1,3-діону. представлене загальною формулою (Ia), або його фармацевтично прийнятна сіль: (символи у формулі мають наступні значення. R801, R802 і R803: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою атом галогену або нижчий алкіл, і R403 і R404 : можуть бути однаковими або відрізняються один від одного і кожний з них являє собою H, атом галогену або нижчий алкіл; такі ж значення будуть використовуватися у даному описі і далі). (4) Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль за п.4, які являють собою, щонайменше, одну сполуку, вибрану з гр упи, що включає: 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-[3(1,2-дигідроксіетил)феніл]-3-(3,4,5трифторфеніл)пропан-1,3-діон; 1-(2-бутил-3-[(1R)-1,2-дигідроксіетил]феніл}-2(1,3-дигідро-2Н-бензимідазол-2-іліден)-3-(3фтор феніл)пропан-1,3-діон; 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-[5-(1,2-дигідроксіетил)-2фтор феніл]пропан-1,3-діон; 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-{3-[(1R)-1,2дигідроксіетил]-2-метилфеніл}пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-{3[(1R)-1,2-дигідроксіетил]-2-метилфеніл}-3-(2фтор феніл)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-[3(1,2-дигідроксіетил)феніл]-3-(2,3,5трифторфеніл)пропан-1,3-діон; 2-(1,3-Дигідро-2Н-бензимідазол-2-іліден)-1-{3[(1R)-1,2-дигідроксіетил]-2-метилфеніл}-3-(3метилфеніл)пропан-1,3-діон; 1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-2(1,3-дигідро-2Н-бензимідазол-2-іліден)-3-(3фтор феніл)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-{3[(1R)-1,2-дигідроксіетил]феніл}-3-(3фтор феніл)пропан-1,3-діон; 9 83928 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-[3-(1,2-дигідроксіетил)-2фтор феніл]пропан-1,3-діон; 1-(3,5-дифторфепіл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-[3-(1,2-дигідроксіетил)-4фтор феніл]пропан-1,3-діон; 1-{2-хлор-3-[(1R)-1,2-дигідроксіе гил]феніл}-3(3,5-дифторфеніл)-2-(1,3-диі ідро-2Нбензимідазол-2-іліден)пропан-1,3-діон; 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-{3[(1R)-1,2-дигідроксіетил]-2-фторфеніл}-3-(3фтор феніл)пропан-1,3-діон; 1-{2-хлор-3-[(1R)-1,2-дигідроксіетил]феніл}-3(3-хлорфеніл)-2-(1,3-дигідро-2Н-бензимідазол-2іліден)пропан-1,3-діон. (5) Похідне пропан-1,3-діону, представлене загальною формулою (Ib), або його фармацевтично прийнятна сіль: (символи у формулі означають наступне: R8 і R9: можуть бути однаковими або відрізняються один від одного і кожний з них являє собою H, нижчий алкіл, нижчий алкеніл або -О-нижчий алкіл: такі ж значення будуть використовуватися у даному описі і далі). (6) Похідне пропан-1,3-діону загальної формули (Ib) або його фармацевтично прийнятна сіль, де R801, R 802 і R803 можуть бути однаковими або відрізняються один від одного і кожний являє собою H або атом галогену. (7) Похідне пропан-1,3-діону або його фармацевтично прийнятна сіль, що являє собою, щонайменше, одну сполуку, вибрану з групи, що включає: 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-(3фтор феніл)-3-[3-(2-метокси-1,3-діоксолан-4іл)феніл]пропан-1,3-діон: 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-(3фтор феніл)-3-[3-(2-метокси-2-метил-1,3-діоксолан4-іл)феніл]пропан-1,3-діон, або його фармацевтично прийнятну сіль. Як приклад «атома галогену» можна назвати атоми фтору, хлору, брому або йоду. «Нижчий алкіл» являє собою лінійний або розгалужений насичений С 1-6алкіл, переважно метил, етил, ізопропіл. гексил або т.п. «Нижчий алкілен» являє собою лінійний або розгалужений насичений С 1-6алкілен, переважно метилен, етилен, ізопропілен або т.п. 10 «Бензол, що може бути заміщений» або «піридин, що може бути заміщений» являють собою бензольне кільце або піридинове кільце, які можуть бути заміщені 1-3 замісними групами, де замісні групи являють собою атом галогену. CN, нижчий алкіл, що може бути заміщений галогеном, О-нижчий алкіл, -СО-О-нижчий алкіл або аміногрупу, переважно атом галогену або нижчий алкіл, що може бути заміщений атомом галогену. «Імідазоліл, що може бути заміщений» являє собою імідазоліл, що може бути заміщений 1 або 2 замісними групами, і як замісна група переважним с нижчий алкіл. «Діоксолан, що може бути заміщений» являє собою діоксолан, що може бути заміщений 1 або 2 замісними групами, і як замісна група переважними є нижчий алкіл, нижчий алкеніл, -О-нижчий алкіл або морфоліно-нижчий алкіл. «Нижчий алкіл, що може бути заміщений» являє собою нижчий алкіл, що може бути заміщений 1 або 2 замісними групами, і як замісна група переваленими є аміногрупа або моно- або ди(нижчий алкіл)аміногрупа. «Нижчий алкілен, що може бути заміщений» являє собою алкілен, що може бути заміщений 1 або 2 замісними групами, і прикладами переважних замісних груп можуть бути OH, COOH, -СО-Онижчий алкіл, атом галогену. CN, феніл, -O-нижчий алкіл, -О-СО-нижчий алкіл, аміногрупа, моно- або ди(нижчий алкіл)аміногрупа, -CO-NH2, -СО-моноабо ди(нижчий алкіл)аміногрупа і циклоалкіл. «Циклоалкіл» означає С3-6-моноциклічну насичену вуглеводневу кільцеву груп у і переважно являє собою циклопропіл, циклобутил, циклопентил або циклогексил. «Циклоалкандіїл» означає двовалентну гр упу, похідну С 3-6-моноциклічного насиченого вуглеводневого кільця, і переважно являє собою циклопропандіїл, циклобутандіїл, циклопентандіїл, циклогександіїл або т.п.. з яких особливо переважний циклопропандіїл. Визначення «доступність» означає властивість, при якій перорально введений агент абсорбується травним трактом, виявляє ефект початкового проходження через печінку і потім надходить у кров. Сполука, в якій гідроксильна група замінена групою, що утворює проліки. іакож стосується сполуки даного винаходу. Прикладами групи, що утворює проліки, є гр упи, описані у публікації [Prog. Med., 5, 2157-2161 (1985) і "Iyakuhin no Kaihatsu (Development of Medicaments)" vol.7 (Hirokawa Shoten. 1990) Bunshi Sekkei (Molecular Desing). pp.163-198]. У сполуках даного винаходу присутні іаутомери. їх можна описати, наприклад, наступним чином. 11 83928 Окремі форми зазначених ізомерів або їх суміші також входять у даний винахід. Крім того, сполуки даного винаходу можуть мати асиметричний атом або аксіальну асиметрію, що залежать від типу групи-замісника. тому можуть бути одержані ізомери на основі асиметричного атома або т.п.Суміші зазначених оптичних ізомерів і їх окремі форми також включені у даний винахід. Крім того, сполуки, в яких сполуки даного винаходу мічені радіоактивними ізотопами, також входять у винахід. Також сполука, в якій геометрична ізомерія, пов'язана з подвійним зв'язком у положенні 2 пропану, як показано нижче, може піддаватися взаємним перетворенням через таутомерію, показану вище, є присутньою серед сполук даного винаходу. Приклад представлений нижче. Крім того, сполука даного винаходу іноді утворює кислотно-адитивну сіль або. залежно від типу групи-замісника, сіль з основою, і така сіль входить в об'єм даного винаходу за умови, що вона с фармацевтично прийнятною сіллю. Ілюстративними прикладами солі є кислотно-адитивна сіль з хлористоводневою кислотою, бромистоводневою кислотою, йодистоводневою кислотою, сірчаною кислотою, азотною кислотою, фосфорною кислотою і подібними неорганічними кислотами, або з мурашиною кислотою, оцтовою кислотою, пропіоновою кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, фумаровою кислотою, малеїновою кислотою, молочною кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, птолуолсульфоновою кислотою, аспарагіновою кислотою, глутамовою кислотою і подібними органічними кислотами, солі з натрієм, калієм, магнієм, 12 кальцієм, алюмінієм і подібними неорганічними основами, або з метиламіном, етиламіном, етаноламіном. лізином, орнітином і подібними органічними основами, амонійна сіль і т.д. Різні гідрати і сольвати і речовини, що виявляють поліморфізм, сполуки даного винаходу і її фармацевтично прийнятної солі також входять у даний винахід. Способи одержання Сполука даного винаходу і її фармацевтично прийнятна сіль можуть бути одержані з використанням різних загальновідомих способів синтезу, виходячи з характеристик її основного ядра або типу замісних гр уп. У деяких випадках, в залежності від типу функціональної групи з погляду методик одержання, ефективно заміняти зазначену функціональну групу придатною захисною групою (групою, що легко перетворюється у зазначену функціональну групу) на стадії від вихідних до проміжних сполук. Прикладами такої функціональної групи є аміногрупа, гідроксильна група, карбоксильна група і т.п., і захисні групи, описані у ["Protective groups in Organic Synthesis (3-rd Edition)" (Ed. Greene and Wuts. JOHN WILEY & SONS. 1991)], і подібні групи, можуть бути наведені як захисні групи, які необов'язково можуть бути вибрані з врахуванням реакційних умов. За допомогою таких способів розглянуті сполуки можуть бути одержані шляхом проведення реакції після введення зазначеної захисної групи, і потім зняттям захисної групи, як того вимагають обставини. Конкретні способи одержання сполуки даного винаходу описані нижче. Однак способи одержання даного винаходу не обмежені прикладами, представленими нижче. Використовувані у даному описі скорочення мають наступні значення: ДМФА - N,N-димегилформамід; ДМСО - диметилсульфоксид; ТГФ - тетрагідрофуран; Тоl - толуол; ДХЕ - 1,2-дихлоретан; TEA - триетиламін; 13 83928 Диглім - диметиловий ефір діетиленгліколю; LiTMP - 2,2,6,6-тетраметилпіперидат літію; LDA - діізопропіламід літію; (Символи на реакційній схемі мають наступні значення R: нижчий алкіл; R401, R402 , R101 , R102, R103 і R104 необов'язково можуть бути захищені захисною групою. Такі ж значення будуть використовуватися у даному описі і далі.) Даний спосіб одержання являє собою спосіб одержання сполуки (І) даного винаходу. Способом, що базується на способі одержання 4, описаному у патентному посиланні 1, з 1,2-діамінобензольної сполуки (II) одержують 2-метилімідазольну сполуку (III); зазначену сполуку (III) піддають взаємодії з ацильною сполукою (IV). і одержану у результаті реакційну суміш обробляють при кімнатній температурі при нагріванні у присутності морфоліну або подібної органічної основи в інертному для реакції розчиннику, одержуючи таким чином імідазольну сполуку (VI). Зазначена ацильна сполука (IV) може бути одержана, наприклад, шляхом хлорування відповідної карбонової кислоти тіонілхлоридом. хлорангідридом щавлевої кислоти або подібним хлорувальним агентом, у дихлорметані або подібному розчиннику, інертному у реакції, при кімнатній температурі або при нагріванні у присутності або за відсутності ДМФА або подібного каталіза 14 WSCHCl гідрохлорид диметиламінопропіл)-1-етилкарбодиіміду; OHBt - 1-гідроксибензотриазол; CDI - 1,1'-карбонілдіімідазол. 3-(3 тора. Тіонілхлорид або т.п.можуть бути безпосередньо використані як розчинник. Одержану у результаті реакційну суміш можна очистити азеотропною обробкою з толуолом або подібним розчинником, і додаткове очищення можна проводити або не проводити. Крім того, проміжна сполука (V) і т.п.може бути виділена або її можна не виділяти. Далі, проміжну сполуку (VllIa) і подібну сполуку одержують, піддаючи імідазольну сполуку (VI) і ацильну сполуку (VII) реакції ацилювання у диглімі або подібному інертному у реакції розчиннику у присутності або за відсутності TEA або аналогічної основи при температурі від кімнатної температури до нагрівання: і потім сполуку (І) даного винаходу одержують додаванням карбонової кислоти (VIIa) у кількості, що відповідає реакції із зазначеною сполукою (VIIIa). або кількості води, що відповідає реакції, і нагріванням суміші. Ацильна сполука (VII) може бути одержана способом, аналогічно до способу одержання сполуки (IV). Крім того, проміжні сполуки (VIIIa) і аналогічні сполуки можуть бути виділені або їх можна не виділяти. Другий спосіб одержання 15 83928 16 Наведений спосіб одержання являє собою спосіб особливо придатний для одержання сполук (Ia) і (Іа-і) даного винаходу. За даним способом оптично активні сполуки даного винаходу можуть бути одержані селективно при використанні як вихідних сполук оптично активних сполук (VIId) і (VIIe). Стадія 1: Зазначена стадія являє собою загальновідомий спосіб, що стосується захисту 1,2або 1,3-дигідрокси-сполуки. Залежно від умов реакції необов'язково можуть бути вибрані захисні групи, описані у ["Protective groups in Organic Synthesis (3-rd Edition)" (Ed. Greene and Wuts, JOHN WILEY & SONS, 1991)], і подібні групи. У цьому випадку, коли оптично активні 1,2дигідрокси-сполуки (VIId) і (VIIe) використовуються як вихідні речовини замість сполуки (VIIb), зазначені сполуки (VIId) і (VIIe) можуть бути одержані відомим способом відповідно до наведеної нижче реакції. (1). Дана стадія являє собою спосіб, загальновідомий як реакція сполучення за Стале [наприклад. J.K. StiIIe a t al., J. Org. Chem., 52, 422-424, 1987]. Більш конкретно, реакцію проводять, піддаючи галогенарильну сполуку або арилтрифталагну сполуку, переважно бромарильну сполуку (XI) або йодарильну сполуку, взаємодії з такою, що відповідає реакції, кількістю трибутил(вініл)олова або подібного оловоорганічного реагенту у толуолі або подібному інертному у реакції розчиннику при температурі від кімнатної температури до нагрівання, у присутності трис(дибензиліденацетон)дипаладію або подібного паладіевого каталізатора і три(третбутил)фосфіну або подібної фосфінової сполуки, також переважно в атмосфері аргону. (2) Дана стадія являє собою загальновідомий спосіб асиметричного дигідроксилювання олефінової сполуки (XII). Наприклад, реакцію проводять способом, описаним ["Sharpless K.В., et al., Chem. Rev., 94, 1994, 2483-2547"]. наприклад, шляхом окиснення олефінової сполуки за допомогою ADmix (Aldrich, USA) у змішаному розчиннику (третбутанол)-вода або подібному інертному у реакції розчинник). Реакцію проводять при температурі від охолодження льодом до нагрівання, переважно від 0°C до кімнатної температури. Оптично активні 1,2-дигідрокси-сполуки (VIId) і (VIIe), що мають бажану абсолютну конфігурацію, можуть бути відповідно одержані при використанні реагентів ADmix-альфа і AD-mix-бета. Див. наведену нижче схему хімічної реакції. Стадія 2: Дана стадія являє собою загальновідому реакцію гідролізу, яку здійснюють шляхом проведення реакції у ТГФ, метанолі або подібному інертному у реакції розчиннику у присутності гідроксиду натрію або подібної органічної основи, переважно при кімнатній температурі. Стадія 3: Дану стадію проводять загальновідомим способом [K.G. Akamanchi et al., Synlett, 1999, 11, 1763-1785]. Наприклад, реагент, що утворює хлорангідрид кислоти, одержують з тіонілхлориду і 1Н-бензотриазолу у ди хлорметані або подібному інертному у реакції розчиннику; і ациль 17 83928 18 ну сполуку (X) одержують, піддаючи зазначений реагент взаємодії з відповідною карбоновою кислотою (IX), розчиненою у дихлорметані або подібному інертному у реакції розчиннику, при охолодженні льодом, при кімнатній температурі або при нагріванні. Одержана у результаті сполука (X) може бути очищена азеотропною обробкою з толуолом або подібним розчинником, і додаткове очищення можна проводити або не проводити. Стадія 4: Дану стадію проводять відповідно до першого способу одержання. Стадія 5: Дана стадія являє собою спосіб одержання дигідрокси-сполуки (Іа-і) шляхом проведення загальновідомої реакції зняття захисту з захищеної ацетонідом сполуки (Ib-i) 1,2- або 1,3дигідрокси-сполуки. Зазначений спосіб може бути проведений в умовах реакції і тд.. описаних у ["Protective groups in Organic Synthesis (3-rd Edition)". Ed. Greene and Wuts. (JOHN WILEY & SONS, 1991)]. Крім того, коли вінільна група олефінової сполуки (XII) розташована в ортоположенні до атома фтор у, як у випадку етилового ефіру З-вініл-2фторбензойної кислоти, або розташована в ортоположенні до замісної групи, що володіє здатністю до розщеплення, вінільна група зазначеної сполуки також може бути введена за допомогою металарильної сполуки. Наприклад, така сполука також може бути синтезована шляхом одержання металарильної сполуки обробкою етилового ефіру 2фторбензойної кислоти LiTMP, LDA або подібною металорганічною основою у ТГФ або подібному інертному у реакції розчиннику при низькій температурі, переважно при -78°C, з подальшим одержанням етилового ефіру З-форміл-2фторбензойної кислоти, піддаючи зазначену сполуку взаємодії зі сполукою, що використовується як джерело ДМФА або подібної формільної групи, при низькій температурі, переважно при -780C, і потім перетворенням формільної групи у вінільну груп у загальновідомою реакцією Віттига. Більш конкретно, реакцію Віттига проводять взаємодією альдегідної сполуки і кількості реагенту, що відповідає реакції, фосфонієвої солі, у ТГФ або подібному інертному у реакції розчиннику у присутності гідриду натрію, алкіллітію, трет-бутоксиду калію або подібної основи, переважно при температурі від охолодження льодом до кімнатної температури, і також переважно в атмосфері аргону. Третій спосіб одержання (У реакційній схемі замісники Ra і Rb можуть бути однаковими або відрізняються один від одного і кожний являє собою H або нижчий алкіл. CH2NMe2, CH2OMe, CN, Ph, CO2Et CF3 або циклоалкіл, або Ra і Rb разом можуть утворювати циклоалкіл, і Rc являє собою H або нижчий алкіл. Такі ж визначення будуть використовуватися у даному описі і далі). Імідазольна сполука (XIV), одержана зі сполуки (VI). одержаної у першому способі одержання, і ацильної сполуки (ХНІ), відповідно до першого способу одержання, може бути перетворена у сполуку (Іа-іі) загальновідомим способом дигідроксилювання олефінової сполуки [ed. J. March, "AD VANCED ORGANIC CHEMISTR Y" (JOHN WILEY & SONS, 1992)]. Більш переважно, зазначену реакцію проводять окисненням олефінової сполуки тетраоксидом осмію у суміші ТГФ-вода або подібному інертному у реакції розчиннику у присутності N-метилморфолін-N-оксиду або подібного спів-окисника. Реакцію проводять при температурі від охолодження льодом до нагрівання, переважно при кімнатній температурі. Сполука (Іа-іі) як 1,2-гідрокси-сполука може бути перетворена у кеталь (Іb-іі) або складний ортоефір загальновідомим способом з використанням сполуки, еквівалентної кетону, або ортоефірної сполуки. Таку реакцію можна розглядати як захисну реакцію 1,2-дигідрокси-сполуки, і вона може бути проведена з використанням умов реакцій і т.п., описаних у наведеній вище ["Protective groups in Organic Synthesis (3-rd Edition)"]. Четвертий спосіб одержання 19 83928 (Символи на схемі мають наступні значення. L1: агом галогену або подібна відхідна група; Nu: нуклеофільний реагент: Y: кегон або -C(R3)(OR1)-: Rd: замісна група на нижчому алкілені, що відповідає X у загальній формулі (і); і R201: -S(O)m-нижчий алкіл; -N3, N(R6)R7, -ОСОнижчий алкіл або атом галогену. Такі ж значення будуть використовуватися у даному описі і далі). Даний спосіб одержання проводять, піддаючи сполуку (XV), що мас відхідну груп у L1, одержану зі сполуки (VI) відповідно до першого способу одержання, і кількість, що відповідає реакції, нуклеофільного реагенту реакції заміщення Sn2-типу у ТГФ, ацетоні, ДМФА. ацетонітрилі. дихлорметані. метанолі, ДМСО або подібному інертному у реакції розчиннику у присутності карбонату калію або подібної неорганічної основи або TEA або подібної органічної основи залежно від обставин в умовах охолодження, від кімнатної температури до нагрівання або при кипінні зі зворотним холодильником. Як приклади нуклеофільного реагенту можна 20 назвати ацетат калію, азид натрію, тіометоксид натрію і подібні аніонні сполуки, або амінні сполуки і подібні основні сполуки, хлорид-іони і т.п. Коли Y у сполуці (XV) являє собою кетон, сполуку кетону (XVII), одержану зі сполуки (VI) відповідно до першого способу одержання, піддають взаємодії з бромом або бромистим воднем в оцтовій кислоті або подібному інертному у реакції розчиннику з перетворенням в α-бромкетон (XVIII), і зазначена сполука (XVIII) може бути піддана зазначеній вище реакції заміщення Sn2-типy. Одержана таким чином заміщена сполука може бути перетворена у сполуку (І-і) відновленням кетону за реакцією відновлення, описаною нижче. Коли нуклеофільний реагент являє собою групу S-нижчий алкіл, тіоалкільна група одержаної сполуки може бути окиснена до сульфоксидної сполуки або сульфонової сполуки з використанням агента, що окиснює, відповідно до 10-ого способу одержання патентного посилання 1. Як агент, що окислює, більш переважно використовувати мхлорнадбензойну кислоту або перекис водню. 21 83928 22 П'ятий спосіб одержання (У реакційній схемі X2 являє собою атом галогену, і кільце D означає піридин або імідазол, які можуть бути заміщені.) Даний спосіб одержання являє собою спосіб, в якому гідрокси-сполуку (І-іі) одержують, піддаючи кількість, що відповідає реакції, альдегідної сполуки (XIX) взаємодії з літійорганічною сполукою (XXI). одержаною з азотвмісної галогенарильної сполуки (XX) з використанням н-буіиллітію або подібної органічної основи у ТГФ або подібному інертному у реакції розчиннику при температурі від -78°C до кімнатної температури. Шостий спосіб одержання Даний спосіб одержання проводять, піддаючи дитіоацеталь (XXII) і діамінну сполуку (XXIII) реакції конденсації в EtOH або подібному інертному у реакції розчиннику при температурі від кімнатної температури до нагрівання, переважно нагрівання в умовах кип'ятіння зі зворотним холодильником. (У реакційній схемі R111 і R112 являють собою нижчий алкіл, або R111 і R112 разом утворюють цикл, і замісна група у кільці В може бути захи щена відповідною захисною групою). Крім того, сполука даного винаходу і її фармацевтично прийнятні солі можуть бути одержані шляхом використання наведених далі загальновідомих способів перетворення замісної групи, враховуючи типи замісної групи. 1. Реакція відновлення Відновлення кетогрупи до гідроксильної групи, відновлення азидогрупи в аміногрупу, відновлення ненасиченої алкільної групи до насиченої алкільної групи і аналогічні реакції можуть бути проведені відповідно до 4 способу одержання патентного посилання 1. Прикладами більш придатних способів є спосіб, в якому використовують боргідрид натрію, боргідрид літію, діізобутилалюмінійгідрид, літійалюмінійгідрид або подібний відновлювальний агент, і спосіб, в якому каталітичне відновлення проводять з використанням паладію (Pd). платини (Pt), нікелю (Ni) або т.п.в атмосфері водню або форміату амонію або подібного донора водню. 2. Реакція анулювання гідроксильної групи або аміногрупи Реакцію ацилювання гідроксильної групи або аміногрупи проводять, піддаючи гідрокси-сполуку або аміно-сполуку взаємодії з кількістю, що відповідає реакції, хлорангідриду кислоти або ангідриду кислоти у дихлорметані. ДХЕ, піридині, ТГФ, толуолі або подібному інертному у реакції розчиннику у присутності або за відсутності диметиламінопіридину або т.п.при температурі від кімнатної температури до нагрівання. Альтернативно, реакція також може бути проведена, піддаючи взаємодії гідрокси-сполуку і кількість, що відповідає реакції, карбонової кислоти у ДМФА або подібному інертному у реакції розчиннику у присутності або за відсутності WSCHCl, OHBt, CDI або подібного конденсуючого агента, диметиламінопіридину або подібного прискорювача реакції і TEA або подібної органічної основи, в умовах від кімнатної температури до нагрівання. Коли присутні дві або декілька гідроксильних груп, реакція може бути проведена селективно по бажаному положенню шляхом необов'язкового використання захисної групи. Дигідрокси-сполука також може бути перетворена у сполуку циклічної вугільної кислоти (циклічний карбонат) шля хом використання CDI або т.п У випадку сполуки, що має дві або декілька гідрокси 23 83928 льних груп і аміногруп, можуть бути ациловані всі такі групи або частина зазначених груп. 3. Реакція гідролізу Реакція гідролізу складноефірної сполуки до гідрокси-сполуки і карбонової кислоти може бути проведена відповідно до 8-ого способу одержання патентного посилання 1. Як більш переважний спосіб реакцію проводять у ТГФ з використанням гідроксиду натрію, гідроксиду калію або подібної основи. 4. Перетворення 1,2-дигідрокси-сполуки в альдегід Реакцію перетворення 1,2-дигідрокси-сполуки в альдегід проводять окиснювальним розщепленням 1,2-дигідроксіетильної групи у ТГФ, воді, метанолі або подібному інертному у реакції розчиннику з використанням перйоднуватої кислоти або її солі, тетраацетату свинцю або подібного окиснювального агента. Одержана таким чином альдегідна сполука може бути перетворена в аміносполуку у ди хлорметані або подібному інертному у реакції розчиннику відповідно до 5-ого способу одержання патентного посилання 1. Сполуки даного винаходу можуть бути виділені і очищені як вільні сполуки, їх фармацевтично прийнятні солі, гідрати, сольвати або поліморфні речовини. Фармацевтично прийнятна сіль сполуки (І) даного винаходу може бути також одержана, піддаючи сполуку звичайній реакції солеутворення. Виділення і очищення проводять шляхом використання звичайних хімічних методик, таких як екстракція, фракційна кристалізація, різні типи фракційної хроматографії і т.д. Різні ізомери можуть бути розділені за рахунок вибору відповідних вихідних сполук або за рахунок використання розходження фізико-хімічних властивостей між ізомерами. Наприклад, оптичний ізомер може бути перетворений у стереохімічно чистий ізомер шляхом вибору відповідної вихідної сполуки або методом поділу рацемічних сполук (наприклад, методом, в якому сполуки перетворюють у діастереоізомерні солі за допомогою звичайної оптично активної основи або кислоти, і потім проводять оптичний поділ; або способом, при якому сполуки фракціонують з використанням хіральної колонки або т.п.). На додаток до сполук прикладів, які описані нижче, сполуки з наведених нижче таблиць можуть бути одержані аналогічним чином, як і у способах одержання даного винаходу. У цьому контексті в описі використовують наступні скорочення. FA: FAB-MS (М+Н)+; FN; FAB-MS (M-H)-; FABMS - величина, виміряна за допомогою масспектрометрії з іонізацією бомбардуванням швидкими атомами; ES+ являє собою ESI+; ES- являє собою ESI-; EI; EI-MS; EI-MS - величина, виміряна за допомогою мас-спектромегрії при іонізації бомбардуванням атомами; N1: характеристичний пік 5м.ч. спектра ЯМР (ДМСО-d 6, вн утрішній стандарт TMC); N2: характеристичний пік 5м.ч. спектра ЯМР (CDCl3, внутрішній стандарт TMC): уш.с: уширений синглет: т. пл.: температура плавлення; (круглі дужки) вказують на розчинник для перекристаліза 24 ції; EA-Г означає етилацетат-гексан, EA-ЕФ-Е означає етилацетат-ефір-гексан і EtOH означає етанол для перекристалізації: [α]D: кут обертання при 25°С (с: концентрація (г розчиненої речовини/100см 3) MeOH: розчинник для вимірювання); CN або NC: ціаногрупа; vin: вініл; Ph: феніл; Me: метил; diMe: диметил; Et: етил; іРr: ізопропіл; сРr: циклопропіл; сВu: циклобутил; нВu: бутил; сНех: циклогексил; Ac: ацетил; diCl: дихлор; diF: дифтор: triF: трифтор; diOH: дигідрокси; Py: піридин; Ру3: піридин-3-іл: Ру4: піридин-4-іл; Ру5: піридин-5-іл; dixr4: діоксолан-4-іл; Thiop- тіофен; Thiop2 тіофен2-іл; Тhіор3: тіофен-3-іл; Pheny: фенілен; yl: іл; diyl: діїл; охаl: оксалат; Довідк.пр.: Довідковий приклад; Довідк.пр. №: Довідковий приклад №; Пp.: Приклад; Пр. №: Приклад №; Дані: Фізико-хімічні властивості. 25 83928 26 Активний інгредієнт даного винаходу і сполука даного винаходу або її фармацевтично прийнятна сіль можуть бути використані окремо як лікарський засіб, але звичайно вони можуть бути одержані з одного або декількох активних інгредієнтів з використанням фармацевтичних носіїв, наповнювачів та інших матеріалів, звичайно використовуваних у даній галузі, звичайними способами. Введення лікарських засобів може бути здійснене шляхом перорального введення за допомогою таблеток, пігулок, капсул, гранул, порошків, розчинів і т.п., або парентерального введення за допомогою внутрішньосуглобових, вн утрішньовенних, внутрішньом'язових і подібних ін'єкцій, свічок, очних крапель, очних мазей, черезшкірних розчинів, мазей, черезшкірних клейових препаратів, черезслизових розчинів, чрезслизових клейових препаратів, інгаляцій і т.п. Тверда композиція для застосування при пероральному введенні відповідно до даного винаходу використовується у формі таблеток, порошків, гранул і т.д. У такій твердій композиції один або декілька активних інгредієнтів змішують, щонайменше, з одним інертним розріджувачем, таким як лактоза, маніт. глюкоза, гідроксипропілцелюлоза, мікрокристалічна целюлоза, крохмаль, полівінілпіролідон і/або алюмосилікат магнію. Звичайно композиція може містити інші допоміжні речовини, відмінні від інертного розріджувача, такі як стеарат магнію або подібні змащувальні речовини, натрієва сіль гліколату целюлози або подібний диспергуючий агент, стабілізуючий агент і агент, що сприяє солюбілізації. Залежно від обставин таблетки або пігулки можуть бути покриті цукровим покриттям або плівкою шлункової або ентеральної речовини, такої як сахароза, желатин, гідроксипропілцелюлоза, фталат гідроксипропілметилцелюлози або т.п. Рідка композиція для перорального введення містить фармацевтично прийнятні емульсії, розчини, суспензії, сиропи, еліксири і т.п.. і містить звичайно використовуваний інертний розріджувач, такий як очищена вода або етанол Крім інертного розріджувача зазначена композиція також може містити солюбілізуючий агент, зволожуючий агент, суспендуючий агент і подібні допоміжні агенти, а також підсолоджуючі речовини, смакові речовини, ароматизатори і антисептики. Ін'єкції для парентерального введення являють собою асептичні водні або неводні розчини, суспензії і емульсії. Прикладами розріджувача для застосування у водних розчинах і суспензіях є дистильована вода для ін'єкції та фізіологічний розчин. Прикладами розріджувача для застосування у неводних розчинах і суспензіях є пропіленгліколь, поліетиленгліколь, оливкова олія або інші рослинні олії, етанол або подібні спирти, Polysorbate 80 (торгова назва) і т.п.Така композиція може додатково 27 83928 містити тонізуючий агент, антисептик, зволожуючий агент, емульгуючий агент, диспергуючий агент, стабілізуючий агент або агент, що сприяє солюбілізації. Стерилізація, наприклад, можлива шляхом фільтрування через фільтр, що утримує бактерії, змішування з герміцидом або опромінення. Альтернативно, можуть бути спочатку одержані стерильні тверді композиції з подальшим їх розчиненням у стерильній воді або у стерильному розчиннику для ін'єкцій перед їх застосуванням. Черезслизові препарати, такі як трансназальні препарати, використовують } твердому, рідкому або напіврідкому стані, і вони можуть бути одержані відповідно до відомих способів. Наприклад, звичайні відомі агенти, що регулюють рН, антисептики, загусники і наповнювачі необов'язково додають і перетворюють у твердий, рідкий або напівтвердий стан. Трансназальні препарати вводять з використанням звичайного розпилювача, контейнера для крапель для носа, тюбика, пристрою для вставляння у носову порожнину або т.п. У випадку перорального введення придатна добова доза звичайно становить приблизно від 0,001 до 100мг/кг, переважно від 0,1 до 30мг/кг, більш переважно від 0,1 до 10мг/кг, і цю дозу вводять однією порцією або розділеною на дві-чотири дози. У випадку вн утрішньовенного введення придатна добова доза становить приблизно від 0,0001 до 10мг/кг маси тіла, і цю дозу вводять один раз на день або поділеною на дві або декілька доз. Крім того, черезслизові препарати вводять у дозі приблизно від 0,001 до 100мг/кг маси тіла, один раз на добу або розділеною на дві або декілька доз. Дозу 28 необов'язково вибирають залежно від кожного випадку з врахуванням симптомів, віку, статі і т.д. Приклади Далі винахід описаний докладно за допомогою прикладів. Сполуки даного винаходу не обмежені сполуками, описаними у наведених нижче прикладах. Також у довідкових прикладах представлені способи одержання вихідних сполук. Сполука довідкового прикладу 1-1 є відомою сполукою. Довідковий приклад 1-2 Порцію у 4г 1-метил-1Н-бензимідазолу і 13,9мл TEA розчиняють у 40мл дигліму і порціями додають 17,5г хлорангідриду 2-хлорбензойної кислоти. Реакційну суміш перемішують при 100°C протягом 3 годин. Після охолодження до кімнатної температури реакційну суміш змішують з водою, екстрагують хлороформом, сушать над безводним сульфатом натрію і потім концентрують, одержуючи оранжеву маслянисту речовину. Одержане масло розчиняють у 60мл метанолу, змішують з 7,9мл морфоліну і потім нагрівають при кип'ятінні зі зворотним холодильником протягом 3,5 годин. Реакційну суміш охолоджують до кімнатної температури, змішують з водою і потім перемішують 1 годину. Одержаний у результаті осад відфільтровують, промивають холодною водою і потім сушать, одержуючи 6,1г (вихід 75%) 1-(2-хлорфеніл)2-(1,3-дигідро-2Н-бензимідазол-2-іліден)етанолу (довідковий приклад 1-2) у вигляді світло-жовтих порошкоподібних кристалів. ES+: 271. Сполуки, представлені у таблиці 5 і у таблиці 6, одержані аналогічним способом. 29 83928 Довідковий приклад 2-1 Порцію в 3,8г хлорангідриду щавлевої кислоти поступово по краплях додають до 30мл розчину у метиленхлориді, що містить 1,54г 3-вінілбензойної кислоти і каталітично ефективну кількість ДМФА; одержану суміш перемішують при кімнатній температурі приблизно 2 години, потім у суміш виливають придатну кількість толуолу і упарюють при зниженому тиску, одержуючи хлорангідрид 3вінілбензойної кислоти. Хлорангідрид розчиняють 30 у невеликій кількості дигліму і поступово по краплях додають до 5мл розчину у диглімі, що містить 0,82г 1-(3,5-дифторфеніл)-2-(1,3-дигідро-1Нбензимідазол-2-іліден)етанону, що окремо одержаний заздалегідь, і 1,4мл TEA при нагріванні при 70°C. Після закінчення додавання температуру реакційної суміші підвищують до 100°C, реакційну суміш нагрівають протягом приблизно 25хв., змішують з 0,1мл очищеної води і знову підвищують температуру до 175°С і нагрівають протягом приблизно 25хв. Реакційну суміш змішують з водним розчином бікарбонату натрію, екстрагують декілька разів етилацетатом, сушать безводним сульфатом магнію і концентрують: одержаний наступним чином осад очищають колонковою хроматографією на силікагелі, одержуючи 0,83г (довідковий приклад 2-1) (вихід 68%) 1-(3,5-дифторфеніл)-2(1,3-дигідро-2Н-бензимідазол-2-іліден)-3-(3вінілфеніл)пропан-1,3-діону у вигляді жовтої піни з елюату у суміші етилацетат-гексан (1:3). FA: 403. 31 83928 Довідковий приклад 3 Порцію 4,96г етилортоацетату, розчиненого у 10мл етанолу, додають до 50мл розчину в етанолі, що містить 4,68г 4-хлор-5-фторбензол-1,2-діаміну, і реакційну суміш нагрівають при кип'ятінні зі зворотним холодильником 4 години. Після концентрування реакційної рідини одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 2,10г (вихід 39%) 5-хлор6-фгор-2-метил-1Н-бензимідазолу з елюату у суміші хлороформ-метанол (10:1). ES+: 185. Довідковий приклад 4-1 До 100мл розчину у ТГФ, що містить 4,73мл тетраметилпіперидину, додають по краплях при 78°C 17,62мл 1,59М розчину н-бутиллітію у ТГФ. 32 Одержану суміш перемішують при -10°C протягом 10 хвилин, о холоджують до -78°С, змішують з 5,00г трет-бутил 2,4-дифторбензоату, розчиненого у 20мл ТГФ, і потім перемішують 1 годину. Потім до суміші по краплях додають 7,23мл ДМФА і суміш перемішують 1 годину, змішують з 5,34мл оцтової кислоти і піднімають температур у до кімнатної. Суміш змішують з відповідною кількістю очищеної води, екстрагують етилацетатом і сушать над безводним сульфатом магнію. Після концентрування одержаний таким чином затишок очищають колонковою хроматографією на силікагелі, одержуючи 5,65г (вихід 100%) трет-бутил 2,4дифтор-3-формілбензоату (довідковий приклад 41) з елюату у суміші гексан-етилацетат (20:1-10:1). 33 83928 N2: 1,60 (9Н, с); 7,04 (1H, м); 8,14 (1H, м); 10,38 (1H, с). Сполуки, представлені у довідкових прикладах 4-2 і 4-3, одержані аналогічним чином. Довідковий приклад 4-2: трет-бутил 2-фтор-3формілбензоат. FA: 225, N2: 1,62 (9Н, с). 7,32 (1H, т, J=8Гц). 8,08 (2Н, м). 10,42 (1H, с). Довідковий приклад 4-3: 3-(2,2-диметил-1,3діоксолан-4-іл)-2-фтор-бензальдегід, FA: 225. Довідковий приклад 5-1 До 90мл розчину у ТГФ, що містить 8,13г метилтрифенілфосфоніййодиду. додають по краплях при -78°С 9,50мл 1,59М розчину н-бутиллітію у ТГФ. Одержану суміш перемішують при 0°C протягом 10 хвилин, охолоджують до -78°C і потім змішують з 2,44г трет-бутил 2,4-дифтор-3формілбензоату. розчиненого у 10мл ТГФ. Через 40хв. одержану суміш перемішують при кімнатній температурі 1 годину, змішують з відповідними кількостями насиченого водного розчину хлориду амонію і очищеної води, екстрагують етилацетатом і потім сушать над безводним сульфатом магнію. Після концентрування одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 1,20г (вихід 50%) третбутил 2,4-дифтор-3-вінілбензоату (довідковий приклад 5-1) з елюату у суміші гексан-етилацетат (50:1). ES-: 239. Сполуки наведених нижче довідкових прикладів від 5-2 до 5-5, які представлені у таблиці 10, одержані аналогічним чином. Довідковий приклад 5-2: трет-бутил 2-фтор-3проп-1-ен-1-ілбензоат. EI: 236. Довідковий приклад 5-3: Метил 3(циклопропіліденметил)бензоат. FA: 189. Довідковий приклад 5-4: Метил 2-метокси-3вінілбензоат. FA: 193. Довідковий приклад 5-5: 1-Бром-2-фтор-3вінілбензол. FA: 202. 34 Довідковий приклад 6-1 Порцію в 4,27мл трифтороцтової кислоти додають до 30мл розчину у ди хлорметані, що містить 1,33г трет-бутил 2,4-дифтор-3-вінілбензоату. і перемішують 5 годин. Після випарювання розчинника додають відповідні кількості очищеної води і насиченого водного розчину бікарбонату натрію, і водний шар промивають діетиловим ефіром. Водний шар доводять до рН1 за допомогою 1M водного розчину хлористоводневої кислоти, екстрагують діетиловим ефіром і потім сушать над безводним сульфатом магнію. Після концентрування одержують 964мг (вихід 95%) 2,4-дифтор-3-вінілбензойної кислоти (довідковий приклад 6-1). N2: 7,93 (м, 1H), 6,98 (м. 1H), 6,74 (дд. 1H, 1=12Гц. 18Гц), 6,11 (дд, 1H, J=1Гц, 18Гц), 5.68 (дд, 1H, J=1Гц. 12Гц). 2-фтор-3-проп-1-ен-1-ілбензойну кислоту (довідковий приклад 6-2) одержують аналогічним чином. FN: 179. Довідковий приклад 7-1 До 10мл розчину у ТГФ, що містить 300мг 3-[2(1,3-дигідро-2Н-бензимідазол-2-іліден)-3-(3фтор феніл)-3-оксопропаноїл]бензальдегіду і 69мкл ацетону і перемішують протягом 15 хвилин. Одержану суміш змішують з відповідними кількостями насиченого водного розчину хлориду амонію і очищеної води, екстрагують етилацетатом і сушать над безводним сульфатом магнію. Після концентрування одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 184мг (вихід 53%) 2-(1,3-дигідро2Н-бензимідазол-2-іліден)-1-(3-фторфеніл)-3-[3-(1гідроксі-3-оксобутил)феніл]пропан-1,3-діону (довідковий приклад 7-1) з елюату у суміші гексанетилацетат (2:1-1:2). ES+: 445. Аналогічним чином одержують 1-{3-[2-(1,3дигідро-2Н-бензимідазол-2-іліден)-3-(3фтор феніл)-3-оксопропаноїл]бензоїл}-2гідроксипропілацетат (довідковий приклад 7-2). ES+: 459. Довідковий приклад 8 Порцію в 0,57мл брому поступово по краплях додають до 80мл розчину в оцтовій кислоті, що містить 4,18г 1-(3-ацетилфеніл)-3-(3.5дифторфеніл)-2-(1,3-дигідро-2Н-бензимідазол-2іліден)пропан-1,3-діону. і потім до суміші додають 5мл 25%-ного розчину (бромистий водень)-(оцтова кислота) і перемішують суміш при кімнатній температурі приблизно 1 годину. Розчинник упарюють при зниженому тиску, одержаний наступним чином залишок змішують з відповідною кількістю водного розчину бікарбонату натрію і екстрагують декілька разів етилацетатом, одержаний у результаті органічний шар сушать над безводним сульфатом магнію і концентрують, одержуючи проміжний αбромкетон. Зазначену проміжну сполуку розчиняють у 50мл ДМСО без очищення, змішують з 2,16г ацетату калію і перемішують при кімнатній температурі 4 години. Реакційну рідину змішують з відповідною кількістю насиченого водного розчину хлориду амонію, екстрагують декілька разів етилацетатом, сушать над безводним сульфатом натрію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією 35 83928 на силікагелі, одержуючи 2,62г (вихід 55%) 2-{3-[3(3.5-дифторфеніл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-оксопропаноїл]феніл}-2оксоетилацетат у вигляді зеленувато-жовтої піни з елюату у суміші етилацетат-гексан(1:2). FA: 477. Довідковий приклад 9 Порцію у 25мл розчину у ТГФ, що містить 7,8г тетрабутиламонійфториду і 24г молекулярних сит 4А, перемішують при кімнатній температурі 12 годин в атмосфері аргону. Після охолодження до 0°C до суміші по краплях додають 20мл розчину у ТГФ, що містить 300мг 3-[2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-(3-фторфеніл)-3оксопропаноїл]бензальдегіду і 1,7г дифеніл(2,2,2трифтор-етил)фосфіноксиду. Одержану суміш перемішують при кімнатній температурі 5 годин. Реакційну суміш фільтрують, фільтрат промивають водою, суша ть над безводним сульфатом натрію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 201мг (вихід 57%) 2-(1,3дигідро-2Н-бензимідазол-2-іліден)-1-(3фтор феніл)-3-{3-[(1Z)-3,3,3-трифторпроп-1-ен-1іл]феніл}пропан-1,3-діону у вигляді жовтого порошку з елюату у суміші етилацетат-гексан (1:3). FA: 463. Довідковий приклад 10-1 Порцію у 13,55г діоксиду марганцю додають порціями до 20мл розчину у ди хлорметані, що містить 2,11г 1-(3.5-дифторфеніл)-2-(1,3-дигідро2Н-бензимідазол-2-іліден)-3-[3(гідроксиметил)феніл]пропан-1,3-діону. і перемішують 4,5 години. Після фільтрування через целіт і концентрування одержаний у результаті залишок кристалізують з суміші гексан-етилацетат. одержуючи 1,09г (вихід 52%) 3-[3-(3,5-дифторфеніл)-2(1,3-дигідро-2Н-бензимідазол-2-іліден)-3оксопропаноїл]бензальдегіду (довідковий приклад 10-1). FA: 405. Аналогічним чином одержують 1-[3-(2,2диметил-1,3-діоксолан-4-іл)]-2-(фторфеніл)-3піридин-3-ілпропан-1,3-діон (довідковий приклад 10-2). FA: 344. Довідковий приклад 11-1 Порцію в 5.46г етил 3-(2,2-диметил-1,3діоксолан-4-іл)-2-фторбензоату розчиняють у 100мл ТГФ. охолоджують до 0°C і потім повільно додають 40,8мл 1H водного розчину гідроксиду натрію. Підвищують температур у суміші до кімнатної температури і додатково перемішують 17 годин. Після упарювання ТГФ залишок охолоджують до 0°C і повільно додають оцтову кислоту доти, доки рН не досягне 3-4. Одержану суміш екстрагують діетиловим ефіром, сушать над сульфатом натрію і концентрують, потім гри рази піддають азеотропній обробці з толуолом, одержуючи 4,66г (вихід 95%) 3-(2,2-диметил-1,3-діоксолан-4-іл)-2фторбензойної кислоти (довідковий приклад 11-1). FN: 239. Аналогічним чином одержують сполуку довідкового прикладу 11-2 і довідкового прикладу 11-13, які представлені у таблиці 11. Крім того, сполуки довідкових прикладів (11-6)-(11-12) одержані з використанням відповідних оптично активних сполук. 36 Довідковий приклад 12-1 Після додавання 35мг ацетату калію до 2мл розчину у ДМСО, що містить 100мг 1-[3(хлорметил)феніл]-3-(3,5-дифторфеніл)-2-(1,3дигідро-2Н-бензимідазол-2-іліден)пропан-1,3діону, суміш перемішують при кімнатній температурі приблизно 2 дні. Реакційну рідину змішують з відповідною кількістю насиченого водного розчину хлориду амонію, екстрагують декілька разів етилацетатом, сушать над безводним сульфатом магнію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 90мг жовтої маслянистої речовини з елюату у суміші етилацетат.тексан (1:2). Кристалізацією одержаної речовини з невеликої кількості суміші етилацетат:гексан (1:3) при 0°C одержують 68мг (вихід 64%) 3-[3-(3.5дифторфеніл)-2-(1,3-дигідро-2Н-бензимідазол-2іліден)-3-оксопропаноїл]бензил-ацетату (довідковий приклад 12-1) у вигляді жовтих кристалів. FA: 449. Аналогічним чином одержують 3-[2-(1,3дигідро-2Н-бензимідазол-2-іліден)-3-(3фтор феніл)-3-оксопропаноїл]бензилацетат (довідковий приклад 12-2). FA: 431. Довідковий приклад 13 Порцію у 25мл розчину у ТГФ, що містить 1,2г етил 3-{3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3оксопропаноїл]феніл}акрилату, о холоджують до 78°С у потоці газоподібного аргону, поступово по краплях додають 5.5мл 1,0М розчин у толуолі діізобутилалюмінійгідриду і потім суміш перемішують при 0°C приблизно 2 годин. Суміш знову охолоджують до -78°C і додають по краплях таку ж кількість відновлювального агента, потім температуру суміші поступово підвищують до кімнатної температури і перемішують приблизно 40 хвилин. Реакційну рідину охолоджують до -30°C або нижче, додають невелику кількість метанолу і очищеної води і одержану у результаті нерозчинну речовину відфільтровують і промивають відповідною кількістю етилацетату. Органічний шар, одержаний шляхом розділення шарів фільтрату, промивають водою, сушать над безводним сульфатом магнію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 0,58г (вихід 53%) 1-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензимідазол-2іліден)-3-[3-(3-гідрокси-проп-1-ен-1іл)феніл]пропан-1,3-діону у вигляді жовтої піни з елюату у суміші етилацеіат-гексан(1:1). FA: 433. Довідковий приклад 14 Порцію в 104мг ацетату паладію і 5мл TEA додають один за іншим до 50мл розчину в ацетонітрилі, що містить 7,44г 3-йодбензойної кислоти і 3,9мл етилакрилату, суміш герметично закривають у пробірці і нагрівають при 1000C приблизно 12 годин. Після мимовільного охолодження каталізатор відфільтровують з промиванням відповідними кількостями меіанолу і етилацетату і фільтрат упарюють при зниженому тиску. Одержані у результаті неочищені кристали перекристалізовують з невеликої кількості етанолу, одержуючи 5,82г (вихід 88%) 3-(3-етоксі-3-оксопроп-1-ен-1 37 83928 іл)бензойної кислоти \ вигляді білих кристалів. FA: 221. Довідковий приклад 15-1 Порцію в 1г 4-(3-бромфеніл)-2,2-диметил-1,3діоксану розчиняють у 18мл ТГФ і охолоджують до -78°C, потім протягом 1 години по краплях додають 2,35мл розчину у гексані, що містить 1,57М нбутиллітію. Після закінчення додавання одержану суміш додатково перемішують 30 хвилин. Після додавання надлишкової кількості діоксиду вуглецю при -78°C температуру суміші підвищують до кімнатної температури. Реакційний розчин змішують з водним розчином хлориду амонію і екстрагують 10 разів сумішшю хлороформ-метанол (5:1), органічний шар сушать над сульфатом натрію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі (гексан:етилацетат=1:1), одержуючи 550мг (вихід 63%) 3-(2,2-диметил-1,3-діоксан-4іл)бензойної кислоти (довідковий приклад 15-1). FA: 237. Аналогічним чином одержують 2-бутил-3-(2,2диметил-1,3-діоксан-4-іл)бензойну кислоту (ви хід 5%) (довідковий приклад 15-2) з 4-(3-бром-2фтор феніл)-2,2-диметил-1,3-діоксану. FN: 277. Довідковий приклад 16-1 Порцію в 5,71г етил 3-[(1К)-1,2-дигідроксіетил]2-фторбензоату розчиняють у 30мл 2,2диметоксипропану, змішують з 476мг моногідрату п-толуолсуль фонової кислоти і перемішують при кімнатній температурі 30 хвилин. Одержану суміш змішують з насиченим водним розчином бікарбонату натрію і екстрагують етилацетатом, органічний шар промивають насиченим розсолом, сушать над сульфатом натрію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі (гексан:етилацетат=10:1), одержуючи 5,46г (ви хід 81%) етил 3-[(4R)-2,2-диметил-1,3-діоксолан-4-іл]2-фторбензоату (довідковий приклад 16-1). FA: 269. Аналогічним чином з використанням відповідних оптично активних сполук одержують сполуки довідкового прикладу 16-9 і довідкових прикладів (16-2)-(16-8), представлених у таблиці 11. Довідковий приклад 16-9: (4R)-4-(3-Бром-2фтор феніл)-2,2-диметил-1,3-діоксолан. FA: 276. Довідковий приклад 17-1 Порцію в 12,76г етил 3-бром-2-фторбензоату розчиняють у 50мл толуолу, до розчину один за іншим додають 15,8мл трибутил(вініл)олова, 236мг трис(дибензиліденацетон)дипаладію і 1,25мл три-трет-бутилфосфін у (розчин у гексані. 10% мас), і перемішують при кімнатній температурі 13 годин в атмосфері аргону. Суміш розбавляють 300мл діетилового ефіру, змішують з 25г фториду калію і 5мл очищеної води і перемішують 30 хвилин, нерозчинну речовину відфільтровують з використанням лійки Кіріяма. потім концентрують маточну рідину. Залишок очищають колонковою хроматографією на силікагелі (гексан:етилацетат=40:1). одержуючи 10,3г (ви хід 97%) етил-2-фтор-3-вінілбеизоату (довідковий приклад 17-1). 38 Аналогічним чином одержують сполуки довідкових прикладів (17-2)-(17-5). представлених у таблиці 11. Довідковий приклад 18-1 Порцію в 74,3г AD-mix-β додають до змішаного розчинника з 265мл трет-бутанолу і 265мл очищеної води і розчиняють при кімнатній температурі протягом 30 хвилин. Після охолодження до 0°C розчин змішують з 10,3г етил 2-фтор-3вінілбензоату і перемішують 3,5 години. Реакційну суміш змішують з 79,6г сульфату натрію, перемішують при кімнатній температурі 30хв. і потім екстрагують етилацетатом. Органічний шар промивають насиченим розсолом, сушать над сульфатом натрію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі (гексан:етилацетат=1:2), одержуючи 5,71г (вихід 47%) етил 3-[(1R)-1,2-дигідроксіетил]-2-фторбензоату (довідковий приклад 18-1). FA: 229. Аналогічним чином одержують наступні оптично активні сполуки довідкового прикладу 18-8 і довідкових прикладів (18-2)-(18-7), представлених у таблиці 11. Крім того, аналогічним чином з використанням AD-mix-a одержують похідні (1S)-1-фенілетан-1,2діолу. Довідковий приклад 18-8: (1R)-1-(3-Бром-2фтор феніл)етан-1,2-діол. FA: 236. Довідковий приклад 19 До розчину у ДМФА (30мл), що містить 2,70г 3бром-2-хлорбензойної кислоти, додають один за іншим 1,10мл метилйодиду і 2,38г карбонату калію при кімнатній температурі, потім перемішують 1 годину. Реакційну рідину змішують з водою і потім розбавляють етилацетатом. Після розділення шарів органічний шар промивають водою і насиченим розсолом у зазначеному порядку, сушать над безводним сульфатом натрію і потім концентрують при зниженому тиску. Одержаний у результаті залишок очищають колонковою хроматографією на силікагелі з використанням суміші еіилацетат:нгексан (100:3) як елююючий розчинник, одержуючи 2,26г (вихід 79%) метил 3-бром-2-хлорбензоату. FA: 250. Довідковий приклад 20 У потоці аргону охолоджують приблизно до 70°C розчин у безводному ТГФ, що містить 0,72мл N,N-діізопротламіну, до розчину по краплях додають 3,3мл 1,54М розчину н-бутиллітію у гексані, потім температуру реакційної рідини підвищують приблизно до -15°C. Реакційну рідину знову охолоджують приблизно до -70°C. змішують з 0,54мл 3-ацетилпіридину і потім перемішують при тій самій температурі приблизно 30 хвилин. Потім поступово по краплях додають 5мл розчину у безводному ТГФ, що містить 1,1г 3-((4R)-2,2-диметил1,3-діоксолан-4-іл)-2-фторбензальдегіду. Після перемішування при -70°C протягом приблизно 20 хвилин і подальшого витримування приблизно при -30°C протягом приблизно 3 годин, суміш змішують з відповідною кількістю 0,2М водного розчину хлористоводневої кислоти і декілька разів екстрагують етилацетатом. Органічний шар промивають насиченим розсолом і сушать над безводним су 39 83928 льфатом магнію, потім розчинник випарюють, виділяють одержаний у результаті залишок і очищають колонковою хроматографією на силікагелі, одержуючи 0,77г (вихід 43%) 3-[3-((4R)-2,2диметил-1,3-діоксолан-4-іл)-2-фторфеніл]-3гідрокси-1-піридин-3-ілпропан-1-ону у вигляді безбарвного масла з елюату у суміші етилацетатгексан (7:3). FA: 346. Довідковий приклад 21 Порцію у 4мл розчину у ДМФА, що містить 0,38г 1-[3-((4R)-2,2-диметил-1,3-діоксолан-4-іл)-2фтор феніл]-3-піридин-3-ілпропан-1,3-діону і 1,3г фториду калію, змішують з 0,1г дисульфіду вуглецю, перемішують при кімнатній температурі приблизно 2,5 години у закритому стані, змішують з 40 0,16мл метилйодиду і потім додатково перемішують приблизно 1 годину у ти х самих умовах. Реакційну рідину змішують з придатною кількістю очищеної води і екстрагують декілька разів етилацетатом, одержаний у результаті органічний шар промивають насиченим розсолом і сушать над безводним сульфатом магнію у зазначеному порядку. Розчинник упарюють і одержаний у результаті залишок виділяють і очищають колонковою хроматографією на силікагелі, одержуючи 0,14г (вихід 49%) 2-[біс(метилсульфаніл)метилен]1-[3-((4R)-2,2-димеіил-1,3-діоксолан-4-іл)-2фтор феніл]-3-піридин-3-ілпропан-1,3-діону у вигляді жовтого масла з елюату у суміші етилацетат.тексан (1:1). ES+: 448. 41 83928 Приклад 1-1 (1) Реагент, що утворює хлорангідрид кислоти, одержують додаванням 5мл дихлорметану при перемішуванні до розчину 0,80мл тіонілхлориду і 1,31г 1H-бензотриазолу. Потім одержаний вище реагент додають до 90мл розчину у дихлорметані, що містить 1,96г (4R)-3-(2,2-диметил-1,3діоксолан-4-іл)бензойної кислоти, і перемішують при кімнатній температурі 10 хвилин. Після фільтрування утвореного хлорангідриду до фільтрату додають безводний сульфат магнію. Після фільтрування і концентрування одержують хлорангідрид кислоти. (2) Хлорангідрид кислоти, одержаний у пункті (1). при 70°C розчиняють у 10мл дигліму і додають по краплях до 10мл розчину у диглімі, що містить 933мг 2-(1,3-Дигідро-2Н-бензимідазол-2-іліден)-1(3-фторфеніл)етанону і 1,28мл TEA. Потім темпе 42 ратур у суміші підвищують до 100°C, змішують з 66мкл очищеної води і потім нагрівають при кипінні зі зворотним холодильником протягом 40 хвилин. Після охолодження до кімнатної температури реакційну масу змішують з відповідною кількістю очищеної води, екстрагують етилацетатом і сушать над безводним сульфатом магнію. Після концентрування органічного шару одержаний залишок очищають колонковою хроматографією на силікагелі, одержуючи 1,68г (вихід 100%) 2-{1,3-дигідро2Н-бензимідазол-2-іліден)-1-{3-[(4R)-2,2-диметил1,3-діоксолан-4-іл]феніл}-3-(3-фюрфеніл)пропан1,3-діону (приклад 1-1) з елюату у суміші гексанетилацетат (6:1). Аналогічним чином одержують сполуки, представлені у таблиці 12 і таблиці 13, з використанням оптично активних сполук. 43 83928 Приклад 2-1 Розчин у суміші ТГФ (12мл) і очищеної води (3мл), що містить 72мг N-метилморфолін-Nоксиду, змішують з 0,5мл 0,08М розчину тетраоксиду осмію у трет-бутанолі і 0,82г 1-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензимідазол-2іліден)-3-(3-вінілфеніл)пропан-1,3-діону у зазначеному порядку і потім перемішують при кімнатній температурі приблизно 2 години. Реакційну рідину концентрують приблизно до 1A об'єму, змішують з придатною кількістю водного розчину сульфіту натрію і екстрагують декілька разів етилацетатом. 44 Одержаний органічний шар промивають водою, сушать над безводним сульфатом магнію і концентрують, потім одержаний залишок очищають колонковою хроматографією на силікагелі, одержуючи 0,83г (вихід 69%) 1-(3,5-дифторфеніл)-2-(1,3дигідро-2Н-бензимідазол-2-іліден)-3-[3-(1,2дигідроксіетил)феніл]пропан-1,3-діону (приклад 21) у вигляді світло-жовтих кристалів з елюату у суміші хлороформ-метанол (80:1). Аналогічним чином одержують сполуки, представлені у таблицях 14-17. 45 83928 46 47 83928 48 49 83928 Приклад 3-1 Порцію у 6мл розчину у ТГФ, що містить 0,21г 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1-[3-(1,2дигідроксіетил)феніл]-3-(3-фторфеніл)пропан-1,3діону і 0,3г метилортоацетату, змішують з 63мг птолуолсульфонату піридинію і потім перемішують при кімнатній температурі приблизно 30 хвилин. Після випарювання розчинника залишок змішують з придатною кількістю водного розчину бікарбонату натрію, екстрагують декілька разів етилацета 50 том, сушать над безводним сульфатом магнію і концентрують. Одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 162мг (вихід 68%) 2-(1,3-дигідро2Н-бешимідазол-2-іліден)-1-(3-фторфеніл)-3-[3-(2м етокси-2-метил-1,3-діоксолан-4-іл)феніл]пропан1,3-діону (приклад 3-1) у вигляді світло-жовтої піни з елюату у суміші етилацетат-гексан (1:2). Аналогічним чином одержують сполуки, представлені у таблиці 18. 51 83928 Приклад 4-1 Порцію в 20мл розчину у метанолі, що містить 1,68г 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1{3-[(4R)-2,2-диметил-1,3-діоксолан-4-іл]феніл}-3-(3фтор феніл)пропан-1,3-діону. змішують з 560мг моногідрату п-толуолсульфонової кислоти і перемішують при кімнатній температурі 18 годин. Одержану суміш змішують з придатними кількостями очищеної води і насиченого водного розчину бікарбонату натрію, екстрагують етилацетатом і сушать над безводним сульфатом магнію. Після концентрування одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 640мг (вихід 42%) 2-(1,3-дигідро2Н-бензимідазол-2-іліден)-1-{3-[(1R)-1,2дигідроксіетил]феніл}-3-(3-фторфеніл)пропан-1,3діону (приклад 4-1) з елюату у суміші гексанетилацетат (3:1-1:3). Крім того, сполуку прикладу 4-11 одержують наступним способом. 52 Порцію у 140мг 3-(2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-{3-[(4R)-2,2-диметил-1,3діоксолан-4-іл]-2-фторфеніл}-3оксопропаноїл)бензонітрилу розчиняють у 5мл суміші (оцтова кислота)вода (4:1) і перемішують при 50°C протягом 3 годин. Розчинник упарюють для проведення азеотропної обробки з використанням толуолу. Одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, піноподібну речовину, одержану з елюату у суміші хлороформметанол (10:0-9:1), перекристалізовують з суміші етилацетат-гексан, одержуючи 105мг (вихід 82%) 3-(2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-3-{3[(1R)-1,2-дигідроксіетил]-2-фторфеніл}-3оксопропаноїл)бензонітрилу (приклад 4-11). Аналогічним чином одержують сполуки, представлені у таблицях 19-21, при використанні оптично активних сполук, одержаних з дигідроксисполук, синтезованих з використанням AD-mixбета. 53 83928 54 55 83928 Приклад 5 Розчин у хлороформі, що містить 0,11г 1-(3.5дифторфеніл)-2-(1,3-дигідро-2Н-бензимідазол-2іліден)-3-{3-[1-гідроксі-2(метилсульфаніл)етил]феніл}пропан-1,3-діону. змішують з 0,13г 77%-ної 3хлорфенілнадбензойної кислоти і перемішують при кімнатній температурі приблизно 30 хвилин. 56 Реакційну рідину змішують з придатною кількістю водного розчину бікарбонату натрію, екстрагують декілька разів етилацетатом, сушать над безводним сульфатом натрію і концентрують, одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 85мг (вихід 71%) 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-{3-[1-гідроксі-2 57 83928 58 (метилсульфоніл)етил]феніл}пропан-1,3-діону у вигляді жовтої піни з елюату у суміші хлороформметанол (100:1). ES+: 499. Приклад 6-1 Боргідрид натрію при -10°C змішують з 10мл розчину в етанолі, що містить 184мг 2-(1,3Дигідро-2Н-бензимідазол-2-іліден)-1-(3фтор феніл)-3-[3-(1-гідроксі-3оксобутил)феніл]пропан-1,3-діону, і перемішують 30 хвилин. Одержану суміш змішують з придатною кількістю насиченого водного розчину хлориду амонію і очищеною водою, екстрагують етилацетатом і сушать над сульфатом магнію. Після концентрування одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 110мг (вихід 60%) 2-(1,3-дигідро2Н-бензимідазол-2-іліден)-1-[3-(1,3дигідроксибутил)феніл]-3-(3-фторфеніл)пропан1,3-ДІону (приклад 6-1) з елюату у суміші гексанетилацетат (1:1-1:3). Аналогічним чином одержують сполуки, представлені у таблиці 22. Приклад 7-1 До 5мл розчину у ДМФА, що містить 200мг 2(1,3-дитідро-2Н-бензимідазол-2-іліден)-1-[3-(1,2дигідроксіетил)феніл]-3-(3-фторфеніл)пропан-1,3діону і 53мкл 2-метилпропанової кислоти, додають 88мг моногідрату 1-гідроксибензотриазолу, 110мг WSCHCl і 70мг димегиламінопіридину у зазначеному порядку і суміш перемішують при кімнатній температурі 18 годин. Одержану суміш змішують з придатною кількістю очищеної води, екстрагують етилацетатом і сушать над безводним сульфатом натрію. Після концентрування одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 90мг (вихід 39%) 2-{3-[2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-3-(3фтор феніл)-3-оксопропаноїл]феніл}-2гідроксіетил-2-метилпропаноату (приклад 7-5) з елюату у суміші гексан-етилацетат (2:1-0:1). Аналогічним чином одержують сполуки, представлені у таблиці 23. 59 83928 60 Приклад 8 Порцію в 0,35г 2-(1,3-дигідро-2Нбензимідазол-2-іліден)-1-[3-(1,2дигідроксіетил)феніл]-3-(3-фторфеніл)пропан-1,3діону додають до 10мл розчину у ДМФА, що містить 0,14г гідрохлориду N,N-диметилгліцину, 0,14г HOBt, 0,19г WSCHCl і 0,28мл TEA, потім суміш перемішують при кімнатній температурі приблизно 12 годин. Реакційну рідину змішують з придатною кількістю водного розчину хлориду амонію, екстрагують декілька разів етилацетатом, сушать над безводним сульфатом магнію і концентрують, потім одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 0,3г жовтої піни з елюату у суміші хлороформ-метанол (50:1). Одержану піну розчиняють у 15мл етилацетату, до розчину по краплях додають 0,5мл 4н розчину хлористоводневої кислоти в етилацетаті, суміш перемішують при кімнатній температурі приблизно 15 хвилин, потім одержані кристали відфільтровують і суша ть, одержуючи 0,2г (вихід 44%) гідрохлориду 2-{3-[2-(1,3-дигідро-2Нбензимідазол-2-іліден)-3-(3-фторфеніл)-3оксопропаноїл]феніл}-2гідроксіетил(диметиламіно)ацетату у вигляді білих кристалів. FA: 504. Приклад 9-1 Порцію у 10мл розчину у ТГФ, що містить 104мг 1-[{3-[2-(1,3-дигідро-2Н-бензимідазол-2іліден)-3-(3-фторфеніл)-3оксопропаноїл]феніл}(гідрокси)метил]-2гідроксипропілацетату і 2мл метанольного розчину, змішують з 0,62мл 1,0M гідроксиду натрію і перемішують 30 хвилин. Одержану суміш змішують з придатними кількостями насиченого водного розчину хлориду амонію і очищеної води, екстрагують етилацетатом і сушать над безводним сульфатом магнію. Після концентрування одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 35мг (вихід 37%) 2-(1,3-дигідро-2Н-бензимідазол-2-іліден)-1(3-фторфеніл)-3-[3-(1,2,3тригідроксибутил)феніл]пропан-1,3-діону (приклад 9-1) з елюату у суміші гексан-етилацетат (1:1-1:3). Аналогічним чином одержують сполуки, представлені у таблиці 24 і у прикладах 9-5 і 9-6. Приклад 9-5: 2-(1,3-дигідро-2Н-бензимідазол2-іліден)-1-(3-фторфеніл)-3-[3(гідроксиметил)феніл]пропан-1,3-діон. FA: 389. Приклад 9-6: 1-(3,5-Дифторфеніл)-2-(1,3дигідро-2Н-бензимідазол-2-іліден)-3-[3(гідроксиметил)феніл]пропан-1,3-діон. FA: 407. Приклад 10 При охолодженні льодом 0,54г перйодату натрію додають до 3мл водного розчину суміші ТГФметанол (1:1:1), що містить 0,25г 2-(1,3-дигідро-2Нбензимідазол-2-іліден)-1-{3-[2-(1,2-дигідроксіетил)1,3-діоксолан-4-іл]феніл}-3-(3-фторфеніл)пропан1,3-діону, і перемішують при кімнатній температурі приблизно 30 хвилин. Реакційну рідину змішують з придатною кількістю насиченого розсолу, екстрагують етилацетатом, сушать над безводним сульфатом магнію і потім концентрують, одержуючи формільну проміжну сполуку у вигляді жовтої піни. Одержану піну розчиняють у 5мл метиленхлориду, до розчину додають 60мкл морфоліну і 0,3мл оцтової кислоти у зазначеному порядку і потім при охолодженні льодом додають 0,22г триацетоксинатрійборгідриду. Суміш перемішують при кімнатній температурі приблизно 30 хвилин. Після випарювання розчинника залишок змішують з придатною кількістю бікарбонату натрію, екстра гують декілька разів етилацетатом, сушать над безводним сульфатом магнію і концентрують. Одержаний у результаті залишок очищають колонковою хроматографією на силікагелі, одержуючи 0,16г (вихід 60%) 2-(1,3-дигідро-2Н-бензимідазол2-іліден)-1-(3-фторфеніл)-3-{3-[2-(морфолін-4ілметил)-1,3-діоксолан-4-іл]феніл}пропан-1,3-діону у ви гляді жовтої піни з елюату у етилацетаті. FA: 530. Приклад 11-1 Порцію в 0,33мл 2-бромпіридину розчиняють у 3мл ТГФ, розчин охолоджують до -78°C, змішують з 2,2мл н-бутиллітію і потім перемішують при кімнатній температурі 30 хвилин. Одержаний розчин виливають при -78°С у розчин, приготований розчиненням 3-[2-(1,3-дигідро-2Н-бензимідазол-2іліден)-3-(3-фторфеніл)-3оксопропаноїл]бензальдегіду у 10мл ТГФ. Температур у суміші повільно підвищують до кімнатної температури і змішують з 50мл насиченого водно
ДивитисяДодаткова інформація
Назва патенту англійськоюPropane-1,3-dione derivative or its salt
Автори англійськоюHirano Masaaki, Kawaminami Eiji, Kinoyama Isao, Matsumoto Shunichiro, Ohnuki Kei, Obitsu Kazuyoshi, Kusayama Toshiyuki
Назва патенту російськоюПроизводное пропан-1,3-диона или его соль
Автори російськоюХирано Масааки, Каваминами Эйдзи, Кинояма Исао, Мацумото Сунитиро, Охнуки Кей, Обицу Казуйоси, Кусаяма Тосиюки
МПК / Мітки
МПК: C07D 405/10, A61P 13/08, A61P 35/00, C07D 401/14, A61P 5/08, C07D 409/06, A61K 31/4184, C07D 235/12, C07D 401/12, A61K 31/4439, A61P 43/00, C07D 401/06, A61P 15/00
Мітки: сіль, пропан-1,3-діону, похідне
Код посилання
<a href="https://ua.patents.su/34-83928-pokhidne-propan-13-dionu-abo-jjogo-sil.html" target="_blank" rel="follow" title="База патентів України">Похідне пропан-1,3-діону або його сіль</a>
Попередній патент: Спосіб керування процесом видобування вугілля у шахті та модульно-адаптивна прогностична система для його здійснення
Наступний патент: Спосіб приглушення білого шуму в адитивній суміші з повністю відомим імпульсним сигналом
Випадковий патент: Спосіб реконструкції вікон з дерев'яними рамами